眼部送達のためのポリマー送達処方
本発明は、コントロールリリース挿入物に用いるのに適した流動性のある組成物を提供する。前記組成物は哺乳類の眼部へ投与することができる。前記組成物は、(a) 少なくとも実質的に水媒体(aqueous medium)、水、もしくは体液に溶解しない生分解性の、生体適合性がある、熱可塑性のポリマー、(b) 生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグ、ならびに、(c) 標準温度および圧力で熱可塑性ポリマーが可溶な、生体適合性のある有機液体を含む。本発明は、哺乳類の眼部に流動性のある組成物を投与することを含む医療処置の方法もまた提供する。
【発明の詳細な説明】
【背景技術】
【0001】
眼の疾患および/または怪我の処置は、特定の生物学的薬剤が、効果的な時間の間、治療をしようとする部位にとどまっていることが要求される。涙のような天然の体液は、局所的に塗布された生物学的薬剤成分を速く洗い流す傾向があるので、局部的な眼の治療、もしくは、結膜を全身投与の経路とすることは困難である。
【0002】
眼部挿入物(ocular inserts)を局所的な薬物送達に用いることは30年以上にわたって記述されてきている(例えばNess, US Patent No. 3,416,530 および Cheng, US Patent No. 4,053,580 を参照のこと。)。これらの最初の挿入物(insert)には、体液中に溶解しないか、もしくは生体内分解性でない物質が含まれていた。
【0003】
その他の開示では、ある一定の期間投薬して最終的には摩滅する、眼部送達用挿入物(ocular delivery inserts)が記載されているが、これらのいずれの文献にも適切に生体に接着する可能性を有するものは無い。例えば Whitaker, et al. (US Patent No. 3,963,025) 、 Miyata, et al. (US Patent No. 4,164,559) 、 Cohen, et al. (US Patent No. 4,179,497) 、 Heller, et al. (US Patent No. 4,346,709 および 4,249,431) 、 Darougar, et al. (US Patent No. 6,264,971) 、 Wong, et al. (US Patent No. 6,331,313) 、ならびに Masters (US Patent No. 6,342,250) を参照のこと。
【0004】
点眼薬がとどまっている時間を長くするために、生体接着性ポリマー混合物(bioadhesive polymer mixtures)の流動性を有する溶液についてもまた記述されている( Bowman et al., US Patent No. 6,372,245 および Chiou, US Patent No. 5,283,236 )。しかしながら、これらの溶液では、治癒的効果を早く発現させるための結膜との密着が維持されない。
【0005】
眼は解剖学上、複雑な器官で、生物学的薬剤の局所的送達および全身送達のいずれに対しても独特の難しさと利点を有している。眼の表面上皮組織(surface epithelial tissues)である結膜もしくは角膜は、常に涙でぬれている器官である。涙が通常安定した流量の水分が内眼角(medial canthus)にある鼻の涙道(nasal lacrimal ducts)に流れる。
【0006】
異物に対する眼の最初の反応は涙の量を増やすことであり、これが、異物を流すだけでなく点眼薬中の生物学的薬剤も流して、薬剤を副鼻腔の中へと流す。まぶたの内側の表面もしくは眼瞼結膜(palpebral conjunctiva)は湿っていて、高度に血管化(highly vascularized)した器官である。点眼薬中の大部分の生物学的薬剤は、副鼻腔からのどの後ろに流出するが、生物学的薬剤の一部は血管系に取り込まれ、全身送達され(become systemic)、一部は眼球結膜(bulbar conjunctiva)を通して眼の前眼房(anterior chamber)に浸透する。
【0007】
体循環への輸送が速い一方、点眼薬からの送達効率が低く、局所的に塗付した薬剤が眼の前区(anterior segment)へとすぐに入るので常に潜在的な毒性がある。
【0008】
いくつかの文献は、コントロールリリース挿入物(controlled release implant)として用いるのに適した流動的な組成物、生分解性挿入物および生体内分解性の挿入物として用いるための徐放性送達システム(sustained release delivery systems)を記載している。ここで、流動的な組成物および徐放性送達システムには以下のものが含まれる。(a) 生分解性の、生体適合性のあるポリマー、(b) 生物学的薬剤、および、(c) 生体適合性のある有機液体(organic liquid)。また、ここで結果として得られた挿入物は、生体内原位置で構成され、(a) 生分解性の、生体適合性のあるポリマー、(b) 生物学的薬剤、を含む。例えば、U.S. Patent Numbers 6,565,874、 6,528,080、 RE37,950、 6,461,631、 6,395,293、 6,355,657、 6,261,583、 6,143,314、 5,990,194、 5,945,115、 5,792,469、 5,780,044、 5,759,563、 5,744,153、 5,739,176、 5,736,152、 5,733,950、 5,702,716、 5,681,873、 5,599,552、 5,487,897、 5,340,849、 5,324,519、 5,278,202、 および 5,278,201を参照のこと。これらの参考文献は、組成物が眼部送達(ocular delivery)に適していて、コントロールリリース挿入物に用いるのに適した流動性の組成物などを記載していない。
【0009】
従って、求められているものは、例えば数分でもしくは数時間で供給されるような、様々な時間にわたっての、全身治療もしくは局部的治療の両方のための、眼部(例えば、結膜通過性(transconjunctival)もしくは角膜通過性(transcorneal))送達のための、生物学的薬剤のキャリアーである。
【発明の開示】
【0010】
本発明に係る処方は、他の非経口の徐放性送達システムよりも多数の明確な利点を提供する。例えば、ミクロスフェアは、ハロゲン化した溶媒の使用を含むことがある無菌プロセスを用いて製造する必要がある。その上、薬剤のミクロスフェアの割合はカプセル封入の効率性によって調節される。これは薬物製品の製造過程でのAPIのうちの25〜50%の回復不能な損失が生ずる可能性があるプロセスである。それに比べて、本発明に係る処方は生体適合性のある含有物から構成され、適切な生分解性ポリマーを生体適合性のある溶媒に溶解して調製される。ミクロスフェアと異なり、本発明に係る処方ではγ線照射を含む従来技術を用いて最終的に滅菌することができる。この独創的な製造プロセスと独自開発された製品態様(proprietary product configuration)は、本質的に製造過程での薬物の損失を解消する。さらに本発明に係る処方では、ミクロスフェアで少ない投薬量でも大きな体積を注入するのに比べて、大きい投薬量のAPIを小さな注入体積で送達することができる。一番重要なことには、本発明に係る処方で得られた持続性薬剤(depot)は、感度の良い(sensitive)バイオ医薬品が生体内で分解および酵素による不活性化がおこるのを防ぐ。
【0011】
本発明に係る処方は、他の挿入できないものや貯蔵装置(reservoir devices)に比べて患者に優しい送達基盤(delivery platform)である。本発明に係る処方は、皮下に挿入され、挿入物は所定の期間にわたって薬剤を放出する。典型的には、その挿入物は薬剤が放出されるのと同じ速度で分解されるため、挿入サイトは原則的には次の挿入時には消散する。それに比較して、機械的な挿入物(mechanical implants)は薬剤を使い果たした後には、外科的に取り除いて埋め直すか、もしくは詰め替える必要がある。
【0012】
眼に生物学的薬剤を投与するのに用いるときに、本明細書に記載した流動性組成物を、効果的および適切な量の物質の眼や周囲の器官への刺激もしくは毒性の発生および/または程度を下げるために用いる。このような刺激もしくは毒性は、例えばアセトンもしくはN-メチル-2-ピロリドンのような有機溶媒が比較的大量に存在していることなどによって起こる。
【0013】
本発明は、コントロールリリース挿入物に用いるのに適した流動性のある組成物で、前記組成物が、(a) 少なくとも実質的に水媒体(aqueous medium)、水、もしくは体液に溶解しない生分解性の、生体適合性がある、熱可塑性のポリマー、(b) 生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩(biological agently acceptable salt)、もしくはそれらのプロドラッグ、ならびに、(c) 標準温度および圧力で熱可塑性ポリマーが可溶な、生体適合性のある有機液体を含み、眼からの供給に適している組成物を提供する。
【0014】
本発明は、哺乳類の疾患もしくは異常を処置する方法であって、前記方法がそのような処置を必要とする哺乳類の眼部に、有効量の本発明に係る流動性組成物を投与するステップを含む方法も提供する。
【0015】
本発明は、また、哺乳類の眼部から生物学的薬剤を局所的に送達するための方法であって、本発明に係る流動性組成物を哺乳類の眼部に接触させるステップを含む方法も提供する。
【0016】
本発明は、哺乳類の眼部から生物学的薬剤を全身に送達するための方法であって、本発明に係る流動性組成物を哺乳類の眼部に接触させるステップを含む方法もまた提供する。
【0017】
本発明は、(a) 少なくとも実質的に水媒体、水、もしくは体液に溶解しない生分解性の、生体適合性がある、熱可塑性のポリマー、(b) 生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグ、ならびに、(c) 標準温度および圧力で熱可塑性ポリマーが可溶な、生体適合性のある有機液体を含む挿入物であって、ここで、前記挿入物は哺乳類の眼部に位置し、前記挿入物が固体もしくはゼラチン状の微孔性の基盤(microporous matrix)を有し、前記基盤は被膜(skin)で囲まれた芯(core)であり、前記挿入物が体の組織に囲まれていることを特徴とする挿入物も提供する。
【0018】
本発明は、(a) 少なくとも実質的に水媒体、水、もしくは体液に溶解しない生分解性の、生体適合性がある、熱可塑性のポリマー、ならびに、(b) 生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを含む挿入物であって、ここで、前記挿入物は哺乳類の眼部に位置し、前記挿入物が固体もしくはゼラチン状の微孔性の基盤を有し、前記基盤は被膜で囲まれた芯であり、前記挿入物が体の組織に囲まれていることを特徴とする挿入物も提供する。
【0019】
本発明は生体内の眼部の原位置で挿入物を構成する方法であって、(a) 受療者の眼部に流動性組成物を注入するステップ(ここで、流動性組成物は本発明に係るいずれかの組成物)、および、(b) 生体適合性のある有機液体を固体の生分解性の挿入物を構成するために拡散させるステップを含む方法も提供する。
【0020】
本発明は、眼部の原位置で挿入物を構成するのに適した生物学的薬剤キットであって、(a) 第一の容器は、眼部送達に適した流動性組成物を含み、ここで前記組成物は、(i) 少なくとも実質的に水媒体、水、もしくは体液に溶解しない生分解性の、生体適合性がある、熱可塑性のポリマー、ならびに、(ii) 標準温度および圧力で熱可塑性ポリマーが可溶な、生体適合性のある有機液体を含み、(b) 第二の容器は、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを含むことを特徴とするキットも提供する。
【発明を実施するための最良の形態】
【0021】
本発明はコントロールリリース挿入物に適した流動性組成物の眼部送達に関する。組成物は、(a) 少なくとも実質的に水媒体(aqueous medium)、水、もしくは体液に溶解しない生分解性の、生体適合性がある、熱可塑性のポリマー、(b) 生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩(biological agently acceptable salt)、もしくはそれらのプロドラッグ、ならびに、(c) 標準温度および圧力で熱可塑性ポリマーが可溶な、生体適合性のある有機液体を含む。熱可塑性ポリマーは少なくとも実質上、好ましくは基本的に完全に有機溶媒に可溶で、かつ、少なくとも実質上、好ましくは基本的に完全に水媒体、体液もしくは、水、に溶解しない。有機溶媒は少なくとも、わずかに水に溶解し、好ましくは中程度に水に溶解し、特に好ましくは実質上、水に可溶である。流動性組成物は、体内に注入するのに適した生物学的薬剤であって、生物学的薬剤として許容される固体基盤(solid matrix)、典型的には一つの体内挿入物(body implant)もしくは薬物送達システム(drug delivery system)を形成する。その挿入物は、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを調整された速度で放出する。その放出速度は、速度修正剤(rate-modifying agent)を含有させることにより、速くもしくは遅くすることができる
【0022】
明細書にある実施例("one embodiment"、"an embodiment"、"an example embodiment"、等)の表示は、その記載された実施例が、特別な特徴、構造、もしくは特質を有していることがあることを示すが、全ての実施例が、その特別な特徴、構造、もしくは特質を有している必要はない。その上、これらの語句は同じ実施例を示している必要はない。さらに、特別な特徴、構造、もしくは特質が実施例と関連して記載されているときには、当業者の知識の範囲内において、明記されているかどうかにかかわらず、特別な特徴、構造、もしくは特質が関連している他の実施例を想定することができる。
【0023】
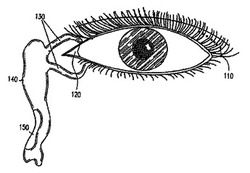
本明細書中では、眼の("ocular")、もしくは、眼部の("ocular region")(550)は眼、周辺の組織、および眼の内部の体液のことに言及している。特に、その語は角膜 (350) もしくは (250)、強膜 (310) もしくは (210)、ぶどう膜 (320)、結膜(330)(例えば、眼球結膜 (220)、眼瞼結膜 (230)、および、瞼板結膜(tarsal conjunctiva) (270))、前眼房(340)、涙嚢、涙管(lacrimal canals)(130)、涙道(110)、内眼角(120)、鼻涙管(150)、ならびに、眼瞼(例えば上眼瞼(240)、および下眼瞼(260))を含む。追加的に、その語は眼の内側の表面(角膜の上にある強膜 (310) もしくは (210))および眼瞼の内側の表面(眼瞼結膜)を含む。
【0024】
本明細書中では、「結膜」("conjunctiva")は、眼瞼の内側の表面、および、強膜 (310) もしくは (210) の前の部分の粘膜である。「眼瞼結膜」("palpebral conjunctiva")は、眼瞼の内側の表面にある粘膜で、厚く、不透明で、高度に血管性(highly vascular)である。「眼球結膜」("bulbar conjunctiva")は、ゆるく結合し、薄く、透明で、強膜 (310) もしくは (210)の眼の前部分の3分の1を覆っている。
【0025】
本明細書では、「角膜」("cornea")は凸状の透明な、眼の前の部分で、最も外側の眼球膜の6分の1を含む。角膜は光を水晶体に透過させる。角膜 (350) もしくは (250)は5つの層(結膜に連続する前角膜上皮、前境界板(ボーマン膜)、角膜固有質(substantial propria)、後境界板(デスメー膜)、および、前眼房の内皮(340)(角皮))を有する繊維状の構造である。角膜は密度が高く、厚さが均一で、血管化しておらず、眼の膜の他の6分の5を構成する、強膜 (310) もしくは (210) を超えてドーム上に突出している。角膜局率の程度は異なる個体によって様々であり、同じ個人であっても年齢によって様々であり、若い間は年をとった後よりも曲率が顕著である。
【0026】
本明細書中で、「眼」("eye")は、頭蓋骨の前部にある骨の眼窩(bony orbit)に含まれ、眼窩脂肪体(orbital fat)中にはめ込まれ、4種類の脳神経(視神経、眼球運動神経、滑車神経、および、外転神経)によって刺激される、視覚についての一対の器官の一つを指す。眼に関連しているものは、特定の付属組織(accessory structure)、例えば筋肉、筋膜、眉、眼瞼、結膜(330)および、涙腺などである。眼球(the bulb of the eye)は、外側の膜と、水晶体レンズ(crystalline lens)によって分けられた内側の二つの腔(cavity)を囲む3つの繊維質の層のうちの1つとによって構成される、ほとんど平行な軸を有する二つの球部分からなっている。水晶体の前の小さい腔は、虹彩によって二つの室に分けられ、いずれの部分も房水(aqueous humor)で満たされている。後ろの腔は、前の腔より大きく、ゼリー状の硝子体(vitreous body)が含まれており、硝子体管(hyaloid canal)で分けられている。眼球の外側の膜は、膜の6分の1を構成する前方の透明な角膜と、膜の6分の5を構成する不透明な強膜からなっている。中程度に血管性の、色素性の膜は、脈絡膜、毛様体、および虹彩で構成される。この内部の神経組織(nervous tissue)の膜が網膜である。光波が水晶体を通過して、網膜中の桿体および錐状体の膜に当たると、視神経から脳に伝達する活動電位が発生する。眼球の横方向の直径と前後方向の直径は、垂直方向の直径よりも少し大きく、通常は女性の眼球は男性の眼球よりも小さい。眼の運動は、上方斜紋筋および下方斜紋筋(the superior and inferior oblique muscles)、上方直筋、下方直筋、内側直筋、および外側直筋(the superior, inferior, medial, and lateral rectus muscles)の6つの筋肉で調節されている。また、眼球は、目、目の玉(bulbus oculi, eyeball)とも呼ばれる。
【0027】
本明細書中では、「目蓋」("eyelid")の語は、睫毛(eyelashes)ならびに、睫毛腺およびマイボーム腺(ciliary and meibomian glands)をふちに有する、目の上の動かすことができる薄い皮膚のひだを指す。それは、粘膜(結膜)で内張りされた、薄いプレート状の繊維質の組織を含む、ゆるく結合した組織からなっている。眼輪筋(orbicularis oculi muscle)および眼球運動神経(oculomotor nerve)は、まぶたの開閉を調節する。上目蓋と下目蓋は、眼瞼の裂溝(palpebral fissure)によって分けられている。また、眼瞼(palpebra)とも呼ばれる。
【0028】
本明細書中では、「眼角」(palpebra)は、眼の隅のことで、目蓋のへりの内側の隅と外側の隅を指す。鼻側眼角(medial canthus)(120)は涙道の開口部を含む小さな空間に通じている。また、眼瞼交連(palpebral commissure)とも呼ばれる。
【0029】
本明細書中では、「粘液」("mucus")は、ムチン、白血球、水、無機塩類、および剥離した細胞を含む、粘性が高く滑りやすい粘膜および腺の分泌物のことを指す。
【0030】
本明細書中では、「鼻腔」("nasal sinus")は、鼻の空洞に続いている繊毛のある粘膜(ciliated mucous membrane)で内張りされた、頭蓋骨のいろいろな骨の中のたくさんの空洞のいずれかひとつを指す。その粘膜は非常に敏感で、刺激されやすく、膨張して腔を遮蔽する原因になることもある。鼻腔には、例えば前頭洞(the frontal sinus)(410)もしくは回転楕円状の腔(the spheroidal sinus)(420)を含む可能性がある。
【0031】
本明細書中では、「涙の」("lacrimal")は、涙(tears)を指す。
【0032】
本明細書中では、「涙道」("lacrimal duct")は、涙が涙腺(the lacrimal lake)からそれぞれの眼の涙嚢へと通る、一対の導管の一つのことを指す。それは、涙小管(lacrimal canaliculus)とも呼ばれる。
【0033】
本明細書中では、「眼瞼結膜」("palpebral conjunctiva")とは、眼瞼の内側の表面、および、強膜 (310) もしくは (210) の前の部分の粘膜である。「眼瞼結膜」は、眼瞼の内側の表面にある粘膜で、厚く、不透明で、高度に血管性(highly vascular)である。「眼球結膜」("bulbar conjunctiva")は、ゆるく結合した、薄く、透明で、強膜 (310) もしくは (210)の眼の前部分の3分の1を覆っている。
【0034】
本明細書中では、「網膜」("retina")は、視神経につながっている10層の敏感な眼の神経組織の膜で、外部の物の映像を受け取って視覚の活動電位(visual impulses)を視神経を通して脳に伝達する。網膜は柔らかく、半透明で、ロドプシンを含んでいる。網膜は外側の色素性の層と9層の網膜(the nine-layered retina proper)からなっている。これらの9つの層は、一番内側から順に、内境界膜(the internal limiting membrane)、神経繊維層(the stratum opticum)、神経細胞層(the ganglion cell layer)、内網状層(the inner plexiform layer)、内顆粒層(the inner nuclear layer)、外網状層(the outer plexiform layer)、外顆粒層(the outer nuclear layer)、外境界層(the external limiting membrane)、および桿状体錐状体層(the layer of rods and cones)である。網膜の外側は脈絡膜につながっており、内側の表面は硝子体につながっている。網膜は、毛様体まで広がっている前方が薄く、焦点が一番あっている後方の表面のちょうど中心の薄い場所を除いて、後方は厚くなっている。光受容体は毛様体の鋸状縁(the jagged ora serrata)の前で終わるが、網膜の膜は毛様体突起(the ciliary processes)および虹彩の後ろまで広がっている。網膜は直射日光にさらされると、曇って不透明になる。ヤコブ膜(Jacob's membrane)、斑点(macula)、乳頭(optic disc)も参照のこと。
【0035】
本明細書中では、「網脈絡膜」("retinochoroid")とは、眼を覆っている網膜および脈絡膜の炎症(inflammation)のことを指す。
【0036】
本明細書中では、「強膜」("sclera")は、眼球の6分の5を覆っている弾性の無い不透明な膜のことを指す。強膜は眼球の大きさと形を維持し、眼球を動かす筋肉につながっている。その後部を視神経が貫通しており、透明な角膜と共に眼球を覆う一番外側の3つの膜を作っている。
【0037】
本明細書では、「洞」("sinus")は、骨の中の空洞、静脈血用の膨張した導管、もしくは化膿した物質を排出することができる膨張した導管のような、空洞もしくは導管を指す。
【0038】
本明細書中では、「眼板腺」("tarsal gland")は数多くの変更された皮脂分泌腺(modified sebaceous gland)のうちのいずれか一つで目蓋の内側の表面にあるものを指す。眼板腺の急性の局部的な細菌感染は、ものもらい(sty)もしくは霰粒腫(chalazion)の原因となることがある。
【0039】
本明細書中では、「涙」("tears")は、涙腺から分泌される、結膜を湿らせるための塩分もしくはアルカリを含んだ水っぽい流体のことを指す。
【0040】
本明細書中では、「ぶどう膜」("uvea")とは、強膜 (310) もしくは (210) の下方の繊維質の膜で、虹彩、毛様体、および、眼の脈絡膜を含む。
【0041】
本明細書中では、「脈管構造」("vasculature")とは、器官もしくは組織中の血管の分布のことを指す。
【0042】
〔生物学的薬剤〕
生物学的薬剤は眼への局所的送達に適するものとすることができる。またあるいは、生物学的薬剤は、眼からの全身送達に適するものとすることができる。
【0043】
生物学的薬剤は、一種類の生物学的薬剤であっても、複数の生物学的薬剤の配合物であっても良い。単独でも配合物としても用いることができる生物学的薬剤の種類には以下のものが含まれる。アドレナリン系薬物、副腎皮質ステロイド、副腎皮質抑制剤(adrenocortical suppressant)、アルコール妨害物質(alcohol deterrent)、アルドステロンアンタゴニスト、アミノ酸、アンモニア解毒剤(detoxicant)、アナボリック、興奮薬、鎮痛薬、アンドロゲン、抗血管新生薬(antiangiogenic)、麻酔の付属物(anesthesia, adjunt to)、麻酔剤、食欲抑制剤、アンタゴニスト、下垂体前葉抑制剤、虫下し、ざ瘡治療剤、抗アドレナリン薬、抗アレルギー薬、抗アメーバ薬、抗アンドロゲン薬、補血薬、狭心症治療薬、恐怖症治療薬、関節炎治療薬、喘息治療薬、アテローム硬化治療薬、抗菌剤、胆石の溶解剤(anticholelithic)、胆石の抗凝固剤(anticholelithogenic)、抗コリン剤、抗凝固剤、抗コクシジウム薬(anticoccidal)、抗けいれん薬、抗うつ薬、糖尿病薬、止痢薬、抗利尿薬、解毒剤、鎮吐薬、抗てんかん薬、抗エストロゲン薬、抗線維溶解薬(antifibronolytic)、抗真菌薬、緑内障治療薬、抗血友病薬、抗出血性薬(antihermorrhagic)、抗ヒスタミン薬、抗高脂血症薬、抗高リポタンパク血症薬(antihyperlipoproteinemic)、血圧降下剤、抗低血圧薬(antihypotensive)、抗感染薬、局所的な抗感染薬(anti- infective, topical)、抗炎症薬、抗角化薬(antikeratinizing agent)、抗マラリア薬、抗菌薬、抗片頭痛薬、抗真菌薬、制吐薬、抗腫瘍薬、抗好中球減少症薬、抗肥満薬(antiobessional agent)、駆虫薬、パーキンソン病治療薬(antiparkinsonian)、ぜん動抑制薬(antiperistaltic)、抗ニューモシスチス薬(antipneumocystic)、抗増殖薬(antiproliferative)、前立腺肥大症治療薬、抗原虫薬、止痒薬、抗精神病薬、抗リウマチ薬、抗住血吸虫薬、抗脂漏性薬、抗分泌薬(antisecretory)、鎮痙薬(antispasmodic)、抗血栓薬、鎮咳薬、抗潰瘍薬(anti-ulcerative)、抗尿石薬、抗ウイルス薬、食欲減退薬、良性前立腺増殖症治療薬、血糖調整剤、骨吸収阻害剤、気管支拡張剤、炭酸脱水酵素阻害薬、心機能抑制薬、心保護剤(cardioprotectant)、強心薬、心臓脈管薬(cardiovascular agent)、利胆薬(choleretic)、コリン作動薬、コリン作動性診断補助薬(cholinergic diagnostic aid)、利尿薬、ドパミン作用薬、外部寄生虫駆除剤(ectoparasiticide)、催吐剤、酵素阻害剤(enxzyme inhibitor)、エストロゲン、フィブリノーゲン分解薬、蛍光剤(flourescent agent)、フリー酸素ラジカルスカベンジャー(free oxygen radical scavenger)、胃運動性作動因子(gastrointestinal motility effector)、グルココルチコイド、性腺刺激原理(gonad-stimulating principle)、養毛刺激剤(hair growth stimulant)、止血薬、ヒスタミンH2受動態アンタゴニスト、ホルモン、低コレステロール血症、血糖降下薬、脂質低下薬、降圧剤、イメージング剤(imaging agent)、免疫化剤(immunizing agent)、免疫調整薬、免疫制御薬、免疫賦活薬(immunostimulant)、免疫抑制薬、陰萎治療薬、阻害剤、角質溶解剤、LNRNアゴニスト、肝臓障害処置薬(liver disorder treatment)、ルテロリジン、記憶補助剤(memory adjuvant)、精神能力賦活剤(mental performance enhancer)、気分調整剤(mood regulator)、粘液溶解物質、粘膜保護剤(mucosal protective agent)、散瞳薬、鼻充血抑制薬、神経筋遮断薬、神経保護剤、NMDAアンタゴニスト、非ホルモン性ステロール誘導体(non-hormonal sterol derivative)、子宮収縮薬、プラスミノーゲン活性化因子、血小板活性化因子アンタゴニスト、血小板凝集阻害薬、脳卒中後の処置薬および頭部外傷後の処置薬(post-stroke and post-head trauma treatment)、増強剤、プロゲスチン、プロスタグランジン、前立腺増殖阻害剤、プロサイロトロピン(prothyrotropin)、向精神薬、放射性医薬品、調整剤、弛緩薬、再分配剤(repartitioning agent)、抗疥癬薬、硬化薬(sclerosing agent)、鎮静薬、催眠鎮静薬(sedative-hypnotic)、選択的アデノシンA1アンタゴニスト(selective adenosine A1 antagonist)、セロトニンアンタゴニスト、セロトニン阻害剤、セロトニン受容体アンタゴニスト、ステロイド、刺激薬、抑制薬、症候性多発性硬化症(symptomatic multiple sclerosis)、協力剤、甲状腺ホルモン、甲状腺ホルモン阻害剤、甲状腺ホルモン様の薬剤(thyromimetic)、精神安定剤、筋萎縮性側索硬化症の処置薬、脳虚血の処置薬、パジェット病の処置薬、不安定狭心症の処置薬、尿酸排泄薬、血管収縮薬、血管拡張薬、傷薬、創傷治癒薬、キサンチンオキシダーゼ阻害剤(zxanthine oxidase inhibitor)。
【0044】
前述の生物学的薬剤の種類の例である具体的な生物学的薬剤は、以下のものを含むが、それらに限定されるわけではない。アセブトロール(Acebutolol)、アセブトロール、アシクロビル(Acyclovir)、アルブテロール(Albuterol)、アルフェンタニル(Alfentanil)、アルモトリプタン(Almotriptan)、アルプラゾラム(Alprazlam)、アミオダロン(Amiodarone)、アンレキサノクス(Amlexanox)、アムホテリシンB(Amphotericin B)、アトルバスタチン(Atorvastatin)、アトロピン(Atropine)、オーラノフィン(Auranofin)、オーロチオグルコース(Aurothioglucose)、ベナゼプリル(Benazepril)、ビカルタミド(Bicalutamide)、ブレチリウム(Bretylium)、ブリフェンタニル(Brifentanil)、ブロモクリプチン(Bromocriptine)、ブプレノルフィン(Buprenorphine)、ブトルファノール(Butorphanol)、ブスピロン(Buspirone)、カルシトニン(Calcitonin)、カンデサルタン(Candesartan)、カーフェンタニル(Carfentanil)、カルベジロール(Carvedilol)、クロルフェニラミン(Chlorpheniramine)、クロロチアジド(Chlorothiazide)、クロルフェンテルミン(Chlorphentermine)、クロルプロマジン(Chlorpromazine)、クリンダマイシン(Clindamycin)、クロニジン(Clonidine)、コデイン(Codeine)、シクロスポリン(Cyclosporine)、デシプラミン(Desipramine)、デスモプレシン(Desmopressin)、デキサメタゾン(Dexamethasone)、ジアゼパム(Diazepam)、ジクロフェナク(Diclofenac)、ジゴキシン(Digoxin)、ジヒドロコデイン(Digydrocodeine)、ドラセトロン(Dolasetron)、ドパミン(Dopamine)、ドキセピン(Doxepin)、ドキシサイクリン(Doxycycline)、ドロナビノール(Dronabinol)、ドロペリドール(Droperidol)、ジクロニン(Dyclonine)、エレトリプタン(Eletriptan)、エナラプリル(Enalapril)、エノキサパリン(Enoxaparin)、エフェドリン(Ephedrine)、エピネフリン(Epinephrine)、エルゴタミン(Ergotamine)、エトミデート(Etomidate)、ファモチジン(Famotidine)、フェロジピン(Felodipine)、フェンタニル(Fentanyl)、フェキソフェナジン(Fexofenadine)、フルコナゾール(Fluconazole)、フルオキセチン(Fluoxetine)、フルフェナジン(Fluphenazine)、フルルビプロフェン(Flurbiprofen)、フルバスタチン(Fluvastatin)、フルボキサミン(Fluvoxamine)、フロバトリプタン(Frovatriptan)、フロセミド(Furosemide)、ガンシクロビル(Ganciclovir)、金チオリンゴ酸ナトリウム(Gold sodium thiomalate)、グラニセトロン(Granisetron)、グリセオフルビン(Griseofulvin)、ハロペリドール(Haloperidol)、B型肝炎ウイルスワクチン(Hepatitis B Virus Vaccine)、ヒドララジン(Hydralazine)、ヒドロモルフォン(Hydromorphone)、インスリン(Insulin)、イプラトロピウム(Ipratropium)、イスラジピン(Isradipine)、二硝酸イソソルビド(Isosorbide Dinitrate)、ケタミン(Ketamine)、ケトロラック(Ketorolac)、ラベタロール(Labetalol)、レボルファノール(Levorphanol)、リシノプリル(Lisinopril)、ロラタジン(Loratadine)、ロラゼパム(Lorazepam)、ロサルタン(Losartan)、ロバスタチン(Lovastatin)、メラトニン(Melatonin)、メチルドパ(Methyldopa)、メチルフェニデート(Methylphenidate)、メトプロロール(Metoprolol)、ミダゾラム(Midazolam)、ミルタザピン(Mirtazapine)、モルヒネ(Morhpine)、ナドロール(Nadolol)、ナルプフィン(Nalbuphine)、ナロキソン(Naloxone)、ナルトレキソン(Naltrexone)、ナラトリプタン(Naratriptan)、ネオスチグミン(Neostgmine)、ニカルジピン(Nicardipine)、ニフェジピン(Nifedipine)、ノルエピネフリン(Norepinephrine)、ノルトリプチリン(Nortriptyline)、オクトレオチド(Octreotide)およびそのアナログ、オランザピン(Olanzapine)、オメプラゾール(Omeprazole)、オンダンセトロン(Ondansetron)、オキシブチニン(Oxybutynin)、オキシコドン(Oxycodone)、オキシモルフォン(Oxymorphone)、オキシトシン(Oxytocin)、フェニレフリン(Phenylephrine)、フェニルプロパノールアミン(Phenylpropanolamine)、フェニトイン(Phenytoin)、ピモジド(Pimozide)、ピオグリタゾン(Pioglitazone)、ピロキシカム(Piroxicam)、プラバスタチン(Pravastatin)、プラゾシン(Prazosin)、プロクロルペラジン(Prochlorperazine)、プロパフェノン(Propafenone)、プロクロルペラジン(Prochlorperazine)、プロピオマジン(Propiomazine)、プロポフォール(Propofol)、プロプラノール(Propranolol)、プソイドエフェドリン(Pseudoephedrine)、ピリドスチグミン(Pyridostigmine)、クエチアピン(Quetiapine)、ラロキシフェン(Raloxifene)、レミフェンタニル(Remifentanil)、rhuFab V2、ロフェコキシブ(Rofecoxib)、レパグリニド(Repaglinide)、リスペリドン(Risperidone)、リザトリプタン(Rizatriptan)、ロピニロール(Ropinirole)、ソマトスタチン(Somatostatin)およびそれらのアナログ、スコポラミン(Scopolamine)、セレギリン(Selegiline)、セルトラリン(Sertraline)、シルデナフィル(Sildenafil)、シンバスタチン(Simvastatin)、シロリムス(Sirolimus)、スピノラクトン(Spironolactone)、スフェンタニル(Sufentanil)、スマトリプタン(Sumatriptan)、タクロリムス(Tacrolimus)、タモキシフェン(Tamoxifen)、テルビナフィン(Terbinafine)、テルブタリン(Terbutaline)、テストステロン(Testosterone)、破傷風トキソイド(Tetanus toxoid)、THCトルテロジン(THC Tolterodine)、トリアムテレン(Triamterene)、トリアゾラム(Triazolam)、トリセタミド(Tricetamide)、バルサルタン(Valsartan)、ベンラファキシン(Venlafaxine)、ベラパミル(Verapamil)、ビスダイン(Visudyne)、ザレプロン(Zaleplon)、ザミナビル(Zanamivir)、ザフィルルカスト(Zafirlukast)、ゾルミトリプタン(Zolmitriptan)、ゾルピデム(Zolpidem)。
【0045】
組成物に含まれる生物学的薬剤の量は、望んでいる処置で投与される投与量によるが、典型的には生物学的薬剤は流動性組成物の重さに対して約0.001%〜約50%であり、より具体的には、流動性組成物の重さに対して約0.005〜約35%存在する。
【0046】
ある実施例において、本発明に係る流動性組成物には、抗片頭痛薬を生物学的薬剤として含めることができる。抗片頭痛薬には、ナラトリプタン、ゾルミトリプタン、リザトリプタン、フロバトリプタン、オクトレアチド(octreatide)、スマトリプタンなど、もしくはその他の「トリプタン」系の生物学的薬剤("triptan" biological agent)を含めることができる。
【0047】
他の実施例において、本発明に係る流動性組成物には、抗血管新生薬(antiangiogenic)を生物学的薬剤として含めることができる。糖尿病性網膜症(diabetic retinopathy)もしくは黄斑変性症(macular degeneration)の受療者を効果的に処置するために、流動性組成物によって網脈絡膜に抗血管新生薬を送達することができる。
【0048】
他の実施例において、本発明に係る流動性組成物には、ぶどう膜炎(uveitis)の受療者を効果的に処置するために、免疫抑制剤を生物学的薬剤として含めることができる。
【0049】
他の実施例において、本発明に係る流動性組成物には、免疫抑制剤もしくは抗炎症薬を生物学的薬剤として含めることができる。流動性組成物により、春季角結膜炎(vernal keratoconjunctivitis)の受療者を効果的に処置するために、免疫抑制剤もしくは抗炎症薬を瞼板結膜(tarsal conjunctiva) (270) に局所送達することができる。
【0050】
他の実施例において、本発明に係る流動性組成物には、創傷治癒薬を生物学的薬剤として含めることができる。流動性組成物は効果的に生物学的薬剤を保持し、角膜の傷に直接接触する可能性がある。
【0051】
他の実施例において、本発明に係る流動性組成物には、抗ウイルス薬、抗生物質(antibiotic agent)、抗真菌剤、もしくはそれらの配合物を含めることができる。流動性組成物により、効果的に感染症(例えば、細菌性、ウイルス性、もしくは真菌性)の処置をすることができると考えられる。
【0052】
他の実施例において、本発明に係る流動性組成物には、抗ウイルス薬を含めることができる。流動性組成物により、角膜 (350) もしくは (250)に抗ウイルス薬を送達し、ヘルペス性の結膜炎もしくは眼瞼炎を患っている受療者を効果的に処置することができると考えられる。
【0053】
本明細書中で、「処置」("treat" もしくは "treating")の語は、(i) 病理学上の症状もしくは関連する兆候が発祥することを防ぐこと(予防など)、(ii) 病理学上の症状もしくは関連する兆候を防ぐこと、もしくは、その進行を止めること、または、(iii) 病理学上の症状もしくは関連する兆候を緩和することを指す。
【0054】
当業者は、「可溶の」("soluble")および「不溶の」("insoluble")という語が、相対的なものであることを理解することができる。例えば、水への溶解度が約1 x 10-45 mg/Lである物質は相対的に水に不溶である。それでもなお、いくらかの水への溶解度(すなわち、別個(discrete)かつ有限の)を有する。この専門用語が不正確(impresice)なために、出願人は「完全に不溶から、全ての比率において完全に可溶の範囲の溶解度」("solubility ranging from completely insoluble in any proportion to completely soluble in all proportions,")、「少なくとも部分的に水溶性」("at least partially water-soluble,")、および「完全に水溶性」("completely water-soluble")という語を、有機溶媒/液体(organic solvent/liquid)を描写するのに使用している。
【0055】
当業者は、有機溶媒/液体の体液への溶解度は、特定の体液や特定の有機溶媒/液体などによって様々である可能性があることもまた、理解することができる。出願人は、有機溶媒/液体の体液への溶解度に対して定義するための一般に受け入れられているパラメータを知らないため、出願人は有機溶媒/液体の水への溶解度を用いて記載をしている。このことで、有機溶媒/液体の水への溶解度についての参考資料が作られていれば、それが有機溶媒/液体が同程度の体液への溶解度を有するとの判断基準を与え、指針になることが、当業者は理解することができる。全ての有機溶媒/液体の水への溶解度が、体液への溶解度と同じではないことが理解されているとはいえ、前述のとおりに指針を与える。
【0056】
「エステル結合」(ester linkage)の語は、-OC(=O)- もしくは -C(=O)O- のことを指す。「チオエステル結合」(thioester linkage)の語は、-SC(=O)- もしくは -C(=O)S- のことを指す。「アミド結合」(amide linkage)の語は、-N(R)C(=O)- もしくは -C(=O)N(R)- のことを指す。「リン酸エステル」(phosphoric acid ester)の語は、-OP(=O)2O-のことを指す。「スルホン酸エステル」(sulphonic acid ester)の語は、-SO2O- もしくは -OSO2- のことを指す。ここで、それぞれのRは、例えば水素、(C1-C20)アルキル、(C3-C6)シクロアルキル、(C3-C6)シクロアルキル(C1-C20)アルキル、アリール、ヘテロアリール、アリール(C1-C20)アルキル、もしくはヘテロアリール(C1-C20)アルキル、のような適切な有機ラジカルである。
【0057】
「アミノ酸」("amino acid,")の語は、天然アミノ酸残基(the residues of the natural amino acids)(例えばAla、Arg、Asn、Asp、Cys、Glu、Gln、Gly、His、Hyl、Hyp、Ile、Leu、Lys、Met、Phe、Pro、Ser、Thr、Trp、Tyr、および Valなど)のD体もしくはL体、さらには、非天然アミノ酸(例えば、ホスホセリン、ホスホトレオニン、ホスホチロシン、ヒドロキシプロリン、γ-カルボキシグルタミン、馬尿酸(hippuric acid)、オクタヒドロキシインドール-2-カルボン酸、スタチン(statine)、1,2,3,4-テトラヒドロイソキノリン-3-カルボン酸、ペニシラミン、オルニチン、シトルリン(citruline)、α-メチル-アラニン、パラ-ベンゾイルフェニルアラニン、フェニルグリシン、プロパルギルグリシン(propargylglycine)、サルコシン(sarcosine)、および、tert-ブチルグリシンなど)も含む。この語はまた、適切なアミノ保護基(例えば、アセチル基もしくはベンジルオキシカルボニル基など)を有する天然アミノ酸および非天然アミノ酸、さらには適切なカルボキシ末端が保護された(例えば、(C1-C6)アルキル、フェニルもしくはベンジルとのエステルまたはアミドとして、あるいはα-メチルベンジルアミドとして)天然アミノ酸および非天然アミノ酸も含む。他の適切なアミノ保護基もしくはカルボキシ保護基は当業者に知られている(例えばGreene, T.W.; Wutz, P.G.M. "Protecting Groups In Organic Synthesis" second edition, 1991, New York, John Wiley & sons, Inc., および、そこでの参考文献を参照のこと)。
【0058】
「ペプチド」("peptide")の語は、2〜35のアミノ酸(例えば先に定義したものなど)もしくはペプチジル残基(peptidyl residues)の配列を指す。配列は、線形であっても環状であっても良い。例えば、環状のペプチドは配列中の2つのシステイン残基の間にジスルフィド架橋(disulfide bridge)をさせることによって調製できるか、もしくは結果として生成することがある。好ましくは、ペプチドには3〜20分子、もしくは5〜15分子のアミノ酸を含む。ペプチド誘導体は、U.S. Patent Numbers 4,612,302、 4,853,371および 4,684,620 に開示されているようにして、あるいは、後述の本明細書の実施例部分に記載したようにして、調製することができる。本明細書に具体的に列挙されたペプチド配列は、アミノ末端が左、カルボキシ末端が右になるように記載されている。
【0059】
「糖類」("saccharide")の語は、任意の糖もしくはその他の炭水化物(carbohydrate)、特に単糖(simple sugar)もしくは炭水化物を指す。糖類は生きている細胞の不可欠な基本的構造であり、生物のエネルギー源である。この語は、分子量が小さい単糖、さらには、分子量の大きな物質も含む。糖類は、糖類の中に含まれている単糖類(monosaccharide)のグループによって分類される。
【0060】
「多糖類」("polysaccharide")の語は、化学的に互いに結合している(すなわちグリコシド結合(glycosidic linkage)をしている)糖の分子が含まれる、炭水化物の一種を指す。この語は、単糖類の連鎖でできている炭水化物である、任意の種類の炭水化物を指す。多糖類は複数の単糖類(単糖)の単位から成る。
【0061】
「脂肪酸」("fatty acid")の語は、脂質分子(lipid molecule)の一部を構成する、脂肪族のモノカルボン酸(aliphatic monocarboxylic acids)の一種であり、脂肪の加水分解によって得られる。この語は、脂肪類、油類、ならびに、動物の細胞膜中でリン脂質(phospholipids)および糖脂質(glycolipids)の一部として、見ることができる任意のいくつもの長鎖脂質カルボン酸(long lipid-carboxylic acid chains)を指す。
【0062】
「ポリアルコール」("polyalcohol")の語は、1以上(例えば2、3、4もしくは5など)のヒドロキシル基を含む炭化水素のことを指す。
【0063】
「炭水化物」("carbohydrate")の語は、生きている細胞の不可欠な基本的構造であり、生物のエネルギー源であるものを指す。この語は、分子量が小さい単糖、さらには、分子量の大きな物質も含む。糖類は、糖類の中に含まれている単糖類(monosaccharide)のグループによって分類される。この語は、ブドウ糖(C6H12O6)のような、可変の数の水素原子および酸素原子と結合した(ただし、水素原子と酸素原子の割合は常に水での割合である)、6原子の炭素原子(もしくは、6の倍数)を含む、糖類(sugars)、デンプン類、およびガム類(gums)を含む化合物のグループを指す。この語は炭素、酸素、および、水素の比が2H:1C:1Oで構成されている化合物もしくは分子のことを指す。炭水化物はスクロースおよびフルクトースのような単糖、またはキチンのような複雑な多糖類のポリマー(complex polysaccharide polymers)である可能性がある。
【0064】
本明細書中で「デンプン」("starch")は、α-(1,4)-D-グルコースのサブユニットおよびα-(1,6)-グルコシド結合の繰り返しで構成される、植物などの中に存在する複雑な多糖類のことを指す。
【0065】
本明細書中で「デキストリン」("dextrin")は、熱、酸、酵素、もしくはそれらの組み合わせによって、デンプンを部分的に分解してできる、中ぐらいの鎖長のグルコースのポリマーのことを指す。
【0066】
本明細書中で「マルトデキストリン」("maltodextrin")もしくは「グルコースポリマー」("glucose polymer")は、D-グルコース単位が主としてα-1,4-結合(α-1,4 bonds)で結合し、DE値(デキストロース当量(dextrose equivalent))が20以下である、甘くない栄養素となる糖類のポリマーを指す。例えば The United States Food and Drug Administration (21 C.F.R. paragraph 184.1444) を参照のこと。マルトデキストリンは部分的に加水分解されたデンプン製品(starch product)である。デンプンの加水分解製品は、乾燥したブドウ糖を基準として計算された還元糖のパーセンテージである、デキストロース当量(DE)として表される、加水分解の程度によって一般的には特徴づけられる。
【0067】
本明細書中で「シクロデキストリン」("cyclodextrins")は、天然のクラスレート(clathrates)で、例えばα-シクロデキストリン、β-シクロデキストリン、およびγ-シクロデキストリンのような、バシラスマセランアミラーゼ(Bacillus macerans amylase)のデンプンへの作用によって得られるものを指す。
【0068】
〔流動性組成物〕
本発明によって、生体適合性がある生分解性の熱可塑性ポリマー、ならびに、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩(biological agently acceptable salt)、もしくはそれらのプロドラッグが、生体適合性のある有機溶媒に溶解もしくは分散されている、流動性組成物が提供される。
【0069】
水媒体(aqueous medium)、体液、もしくは、水に接触させると、その流動性組成物が固形化して挿入物もしくは移植可能物(implantable article)を形成する。本発明に係る流動性組成物から形成された挿入物もしくは移植可能物は、薬剤のコントロールリリース(controlled drug release)に用いることができる。生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグは、流動性組成物が挿入物もしくは移植可能物に変換されると、固形化したポリマー基盤の中に含有される。挿入物が体内に存在するとき、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグは、挿入物の表面での直接溶解(direct dissolution)ならびに、熱可塑性ポリマーの分解および浸食(erosion)によって、ポリマー基盤を通して拡散することにより持続的に放出される。
【0070】
〔ポリマー〕
本発明に従って用いられる生体適合性がある生分解性の熱可塑性ポリマーは、ポリマー鎖(polymer chains)を形成する様々な単量体、もしくは、結合基(linking groups)で互いに結合している単量体単位(monomelic units)から調製することができる。これらには、ポリマー鎖、あるいは、主鎖に、エステル基、アミド基、ウレタン基、無水物、カーボネート基、尿素、エステルアミド基、アセタール基、ケタール基、およびオルトカーボネート基などの結合基、さらには、酵素反応もしくは加水分解反応で加水分解することができる任意の他の有機官能基(すなわち、この加水分解反応で生分解性があるもの)を有するポリマーが含まれる。これらのポリマーは一般に、これらの主鎖結合基(backbone linking groups)を形成する反応基(reactant groups)を含む出発モノマー(starting monomer)の反応によって調製される。例えば、アルコール類とカルボン酸類はエステル結合基を形成する。イソシアネート類とアミン類もしくはアルコール類はそれぞれ、尿素結合基もしくはウレタン結合基を形成する。
【0071】
本発明によると、一部の出発モノマーは少なくとも三官能基を持ち、好ましくは多官能基性(multifunctional)である。この多官能基性によって、結果として得られたポリマー鎖には少なくともいくつかの分岐分子鎖ができる。例えば、エステル結合基をポリマー主鎖に含むポリマーを選択するとき、出発モノマーは通常はヒドロキシカルボン酸類、ヒドロキシカルボン酸類の環状二量体、ヒドロキシカルボン酸類の環状三量体、ジオール類、もしくは、ジカルボン酸類となる。本発明に係るポリマーは、少なくとも多官能基性の出発モノマーを一部含むことによって得られる。さらに、本発明にかかるポリマーはポリマー分子あたり1つ以上の多官能基性単位(multifunctional unit)を含むことがあり、典型的には多くの多官能基性単位が重合反応の化学量論に従って含まれる。好ましくは、本発明にかかるポリマーは、ポリマー分子につき少なくとも一つの多官能基性単位を含む。それぞれのポリマー分子に一つの多機能性単位が含まれると、いわゆる、星型高分子もしくは分岐ポリマー(branched polymer)が形成される。本発明に係る、生分解性の生体適合性がある熱可塑性ポリマーは、線状ポリマー(linear polymer)とすることができる。またあるいは、生分解性の生体適合性がある熱可塑性ポリマーは、分岐ポリマー(branched polymer)とすることができる。
【0072】
例えば、前述のエステル結合基ポリマーには、ジヒドロキシカルボン酸が第一の種類の出発モノマーとして含まれるか、あるいは、トリオールおよび/またはトリカルボン酸が第二の種類の出発モノマーとして含まれる。同様に、トリオール、クァトラオール(quatraol)、ペンタオール、または、ヘキサオール(ソルビトールもしくはグルコースのなど)を第一の種類の出発モノマーとして含めることができる。同様の解釈がポリアミド類についても適用できる。トリアミン、および/または、酸の官能基が3つあるもの(triacid)は、ジアミンおよびジカルボン酸である出発モノマーとともに含まれることがある。アミノジカルボン酸、ジアミノカルボン酸、もしくは、トリアミンは第二の種類の出発モノマーであるアミノ酸と共に含まれることがある。特定の官能基を有する任意の脂肪族出発モノマー、芳香族出発モノマー、もしくはアリールアルキル出発モノマーは、本発明に従って分岐ポリマーを調製するのに用いることができ、ポリマー類およびその分解生成物が生体適合性であるものを提供する。これらの出発モノマーの生体適合規格(biocompatiblity specifications)は当業者にとって既知である。
【0073】
特に、本発明に係る生体適合性がある熱可塑性分岐ポリマーを調製するのに用いられるモノマーから、生体適合性であり生分解性があるポリマー類もしくはコポリマー類が生成される。本発明に係る、生体適合性がある熱可塑性の分岐ポリマーに用いるのに適した、生体適合性であり生分解性があるポリマー類の例には、ポリエステル類、ポリラクチド類(polylactides)、ポリグリコリド類(polyglycolides)、ポリカプロラクトン類(polycaprolactones)、ポリ無水物類(polyanhydrides)、ポリアミド類、ポリウレタン類、ポリエステルアミド類、ポリジオキサノン類(polydioxanones)、ポリアセタール類、ポリケタール類、ポリカーボネート類(polycarbonates)、ポリオルトカーボネート類(polyorthocarbonates)、ポリオルトエステル類(polyorthoesters)、ポリリン酸エステル類、ポリホスファゼン類(polyphosphazenes)、ポリヒドロキシ酪酸塩類(polyhydroxybutyrates)、ポリヒドロキシ吉草酸類(polyhydroxyvalerates)、ポリアルキレンシュウ酸類(polyalkylene oxalates)、ポリアルキレンコハク酸類(polyalkylene succinates)、ポリ(リンゴ酸)(poly(malic acid))、ポリ(アミノ酸類)(poly(amino acids))、および、それらのコポリマー、ターポリマー、またはそれらの結合物(combinations)、あるいはそれらの混合物が含まれる。
【0074】
本発明に係るポリマー組成物には、組成物の生分解性の特徴が望ましくないように妨げられない限り、本発明にかかるポリマーと他の生体適合性のポリマー類とのポリマーブレンド(polymer blends)を含めることができる。本発明に係るポリマーをこのような他のポリマー類と混合することによって、目標とした薬物送達のための望ましい正確な放出特性、もしくは整形外科に適用するなどのための望ましい挿入物構造を作るための望ましい正確な生体分解速度を設計するための自由度が大きくなると考えられる。
【0075】
本発明に係る、生体適合性がある熱可塑性のポリマー類もしくはコポリマー類の好ましいものは、結晶化度(degree of crystallization)が低く、より疎水的なものである。このようなポリマー類およびコポリマー類は、ポリグリコリドやキチンのような水素結合の割合が高い、結晶化度の高いポリマーに比べて、生体適合性のある有機溶媒に溶けやすい。望ましい溶解パラメータ(solubility parameter)を有する好ましい物質は、分岐ポリラクチド類、ポリカプロラクトン類、および、これらに無定形領域(amorphous regions)を増やして溶解度を高めるグリコリドが入ったコポリマー類である。一般に、生体適合性がある生分解性の熱可塑性ポリマーは、50〜60wt%までの固体を生成することができるように、実質的には有機溶媒に可溶である。好ましくは、85〜98wt%までの固体を生成することができるように、本発明に用いられるポリマーは、実質的に有機溶媒に完全に可溶である。また、1mLあたりの水に0.1g未満のポリマーが溶解もしくは分散するように、ポリマー類は少なくとも実質的には水に不溶である。好ましくは、本発明に用いるポリマーは、1mLあたりの水に0.001g未満のポリマーが溶解もしくは分散するように、ポリマー類は少なくとも実質的には水に不溶である。この好ましいレベルでは、水と混和性の溶媒との流動性組成物は、ほとんど直ちに固体のポリマーに変換する。
【0076】
〔溶媒/液体〕
流動性組成物に用いるのに適した液体は、生体適合性があり、水媒体、体液、もしくは水に、少なくとも少し可溶である。有機液体(organic liquid)は、水媒体、体液、もしくは水に、好ましくは少なくとも中程度に可溶であり、さらに好ましくは非常に可溶であり、もっとも好ましくは任意の濃度で溶解する。少なくとも水もしくは体液にわずかに可溶な有機液体は、秒単位から週単位の時間範囲において水をポリマー溶液の中に透過させることができ、ポリマー溶液を凝固、もしくは固化させる原因となる。少し溶解する液体は、ゆっくりと流動性組成物から拡散し、典型的には1日から数週間などの、日単位から週単位で変換させることができる。中程度に溶解する液体は、早く変換させつつも配置されてから成型しやすい組成物として扱うことができるための十分な時間があるように、分単位から日単位で拡散することができる。非常に溶解しやすい有機液体は、ほぼ直ちに変換が起こるように、流動性組成物から秒単位から時間単位で拡散する。有機液体は好ましくは、極性非プロトン性(polar aprotic)もしくは極性プロトン性(polar protic)の有機溶媒である。好ましくは、有機液体は、約30から約1000の範囲の分子量を有する。
【0077】
しかしながら、上記の記載は本発明を限定するものではなく、流動性組成物の固体への変換は、流動性組成物から周囲の水溶媒もしくは体液への有機液体の散逸と、周囲の水溶媒もしくは体液から流動性組成物の中の有機液体への水の注入との結果であると考えられる。この変換の間、流動性組成物中の熱可塑性のポリマーと有機液体の領域での存在割合はポリマーが多い部分と少ない部分があると考えられる。ポリマーが少ない領域は水が注入されることになり、その結果、得られた固体構造が多孔性になると考えられる。
【0078】
流動性組成物を構成するのに用いられることがある生体適合性のある有機液体の例には、外界温度および生理学的温度において液体であるか、あるいは少なくとも流動性である、直鎖、環状、および分枝の、脂肪族有機化合物、芳香族性有機化合物、ならびにアリールアルキル有機化合物であって、アルコール類、ケトン類、エーテル類、アミド類、エステル類、カーボネート類、スルホキシド類、スルホン類、および、生体組織(living tissue)と適合性のある他の任意の官能基の群のような官能基を有するものが含まれる。
【0079】
好ましい生体適合性のある有機液体は少なくともわずかに水もしくは体液に可溶なもので以下のものが含まれる。N-メチル-2-ピロリドン、2-ピロリドン、C1からC15のアルコール類、ジオール類、トリオール類、およびテトラオール類(エタノール、グリセリン、プロピレングリコール、ブタノールなど)、C3からC15のアルキルケトン類(アセトン、ジエチルケトン、およびメチルエチルケトンなど)、C3からC15のエステル類(酢酸メチル、酢酸エチル、乳酸エチルなど)、C1からC15のアミド類(ジメチルホルムアミド、ジメチルアセトアミド、およびカプロラクタム)、C3からC20のエーテル類(テトラヒドロフラン、もしくはソルケタール)、トウィーン、トリアセチン、プロピレンカーボネート、デシルメチルスルホキシド、ジメチルスルホキシド、オレイン酸、および1-ドデシルアザシクロヘプタン-2-オン。他の好ましい有機液体は、ベンジルアルコール、安息香酸ベンジル、ジプロピレングリコール、トリブチリン、オレイン酸エチル、グリセリン、グリコフラル(glycofural)、ミリスチン酸イソプロピル、パルミチン酸イソプロピル、オレイン酸、ポリエチレングリコール、プロピレンカーボネート、およびクエン酸トリエチルである。もっとも好ましい溶媒は、溶媒の溶解度および適合性から、N-メチル-2-ピロリドン、2-ピロリドン、ジメチルスルホキシド、トリアセチン、プロピレンカーボネートである
【0080】
様々な有機液体への生分解性の熱可塑性ポリマーの溶解度は、ポリマーの結晶度、ポリマーの親水性、水素結合、および分子量によって様々である。通常、分子量の小さいポリマーは分子量の大きいポリマーよりも、有機溶媒に早く溶解する。その結果、いろいろな有機液体に溶けているポリマーの濃度はポリマーの種類と分子量によって異なる。さらに、より分子量が大きいポリマーは分子量の小さいものに比べて溶液の粘性が高い傾向がある。
【0081】
一般に、本発明に係る有機液体中のポリマーの濃度は1mlの有機液体あたり約0.01gから飽和溶解度の間の範囲である。典型的には、飽和溶解度は1mlの有機液体あたり80〜95wt%の固体、もしくは溶媒の重さを1mlあたり1gmと仮定すると、4からおおよそ5gmの濃度の範囲である。
【0082】
ゆっくりと凝固する傾向があるポリマーについては、凝固速度(coagulation rate)を速めるのに混合溶媒を使うことができる。要するに、混合溶媒中のある液体成分(liquid component)はポリマーの良溶媒(good solvent)で、混合溶媒のもう一つの液体成分は溶解度が低い溶媒であるか、もしくは非溶剤(non-solvent)である。これらの2つの液体を、ポリマーがまだ可溶であるが生理環境(physiological environment)中での水のような非溶剤の量をわずかに増やすと沈殿するような割合で混合する。必ず溶媒系(solvent system)はポリマーと水の混和性(miscible)でなければならない。このような2成分の溶媒系の例は、N-メチルピロリドンとエタノールの使用である。エタノールをNMP/ポリマー溶液に加えると、その凝固速度が増加する。
【0083】
もし、組成物の有機液体のあるサブグループを用いると、組成物の柔軟性は実質的にその挿入物としての耐用年限の間維持させることができる。このような有機液体は熱可塑性ポリマーの可塑剤(plasticizer)としても作用する可能性があり、その有機液体の水への溶解度が低い場合を除いて、少なくとも部分的には体液中に分散するよりもむしろ残ることがある。このような水への溶解度が低く、可塑特性(plasticizing properties)がある有機液体は、水への溶解度が高い有機液体に加えて、組成物に含まれることがある。後者の場合には、好ましくは、第一の有機液体は体液中に早く分散する。
【0084】
水への溶解度が低い有機液体、すなわち、水中で5重量%未満の水溶液を形成するものも挿入組成物(implant composition)の有機液体として用いることができる。このような有機液体もまた熱可塑性ポリマーの可塑剤として作用する可能性がある。有機液体がこれらの性質を有しているとき、有機液体のサブグループの構成物を「可塑性有機液体」("plasticizer organic liquids")と本明細書中で呼ぶ。挿入されたときに受療者がより快適なものになるように、可塑性有機液体を挿入組成物の柔軟性と成形性に影響させる。さらに、可塑性有機液体は生物学的薬剤の徐放速度(rate of sustained release)に影響するため、挿入組成物に含まれる有機液体の性質によって速度を加速させたり減速させたりできる。水への溶解度が低い有機液体であっても、挿入組成物の有機液体として単に可塑剤能力(plasticizing ability)を用いることもでき、以下のような組み合わせとして用いるのが好ましい。水への溶解度が高い溶媒を挿入組成物で初めに用いる溶媒として選択したときには、水への溶解度が低く可塑剤能力を有する第二の有機液体を用いることによって可塑性に影響させることができる。この場合には、第二の有機液体は有機液体サブグループの構成物で、持続時間の間は少なくとも部分的に挿入組成物の中に残存する。一般に可塑剤として作用する有機液体は固体の熱可塑性基盤中の分子運動を促進する。可塑剤能力により、柔軟性と成型容易性が得られるように、基盤のポリマー分子がお互いに動くことができる。可塑剤能力は、生理活性薬剤が容易に動くことができるようにすることもでき、いくつかの場合においては徐放速度も増大もしくは減少するように影響する。
【0085】
〔水への溶解度が高い溶媒/液体〕
水への溶解度が高い有機液体は、一般に、挿入組成物を挿入した後の柔軟性が問題とならない場合の、挿入組成物に用いることができる。水への溶解度が高い有機液体を用いると、流動性組成物の物理的特徴を有する挿入物が提供され、流動性組成物を直接注入することによって挿入物が作られる。このような挿入物と流動性組成物の先駆物質は、例えば、U.S. Pat. Nos. 4,938,763 および 5,278,201に記載されており、その開示を参照することによって本明細書に含まれる。
【0086】
有用な、水への溶解度が高い有機液体には、例えば以下のものが含まれる。置換複素環化合物(N-メチル-2-ピロリドン(NMP)、および、2-ピロリドンなど)、C2〜C10のアルカン酸(酢酸および乳酸など)、ヒドロキシ酸類(hydroxy acids)のエステル(乳酸メチル、乳酸エチル、クエン酸アルキル、など)、ポリカルボン酸類のモノエステル類(コハク酸モノメチル、クエン酸モノメチルなど)、エーテルアルコール類(ether alcohol)(グリコフロール(glycofurol)、グリセロールフォーマル(glycerol formal)、イソプロピリデングリコール(isopropylidene glycol)、2,2-ジメチル-1,3-ジオキソロン-4-メタノール、など)、ソルケタール、ジアルキルアミド類(ジメチルホルムアミド、ジメチルアセトアミド、ジメチルスルホキシド(DMSO)およびジメチルスルホンなど)、ラクトン類(エプシロン(epsilon)、カプロラクトン、およびブチロラクトンなど)、環状アルキルアミド類(カプロラクタムなど)、ならびにこれらの混合物ならびに配合物。好ましい有機液体には、N-メチル-2-ピロリドン、2-ピロリドン、ジメチルスルホキシド、乳酸エチル、グリコフロール、グリセロールフォーマル、イソプロピリデングリコールが含まれる。
【0087】
〔水への溶解度が低い溶媒/液体〕
前述のとおり、水への溶解度が低い有機液体もまた、挿入組成物に用いることができる。好ましくは、水への溶解度が低い有機液体は挿入物が柔軟性と押し出し可能性(extrudable)を有することが望まれる場合に用いることができる。また、ある状況下では、水への溶解度が低い溶媒を用いることが、生物学的薬剤の徐放速度に影響する。典型的にはこのような状況には、有機液体が挿入物の中に保持されていること、および、有機液体が可塑剤として作用することが含まれる。
【0088】
水への溶解度が低い有機液体の例には以下のものが含まれる。炭酸とアリールアルコール類のエステル類(安息香酸ベンジルなど)、C4〜C10のアルキルアルコール類、C1〜C6アルキルC2〜C6アルカン酸エステル類(C1to C6 alkyl C2 to C6 alkanoates)、炭酸とアルキルアルコール類のエステル(プロピレンカーボネート、エチレンカーボネート、およびジメチルカーボネートなど)、モノカルボン酸類のアルキルエステル類、ジカルボン酸類のアルキルエステル類、およびトリカルボン酸類のアルキルエステル類(酢酸2-エトキシエチル(2-ethyoxyethyl acetate)、酢酸エチル、酢酸メチル、酪酸エチル、マロン酸ジエチル、グルコン酸ジエチル(diethyl glutonate)、クエン酸トリブチル、コハク酸ジエチル、トリブチリン、ミスチリン酸イソプロピル、アジピン酸ジメチル、コハク酸ジメチル、シュウ酸ジメチル、クエン酸ジメチル、クエン酸トリエチル、クエン酸アセチルトリブチル(acetyl tributyl citrate)、グリセリン三酢酸エステル(glyceryl triacetate)など)、アルキルケトン類(メチルエチルケトンなど)、さらには、その他のカルボニル、エーテル、カルボン酸エステル、アミド、ならびにヒドロキシル基を含んでいる有機化合物の液体であって、水にいくらか可溶であるもの。プロピレンカーボネート、酢酸エチル、クエン酸トリエチル、ミスチリン酸イソプロピル、およびグリセリン三酢酸エステルが、それらの生分解性と生物学的薬剤の許容性から、望ましいものである。
【0089】
追加的に、物質を形成する基盤への様々な程度の溶解度が得られる、前述の水への溶解度が高い有機液体と水への溶解度が低い有機液体の混合物は、挿入組成物の硬化速度(hardening rate)を変更するのに用いることができる。例としてはN-メチルピロリドン単独よりも疎水性の溶媒であるN-メチルピロリドンとプロピレンカーボネートの配合物、および、N-メチルピロリドン単独よりも親水性の溶媒であるN-メチルピロリドンとポリエチレングリコールの配合物が含まれる。
【0090】
プロドラッグには、例えば以下のような当業者によく知られているヒドロキシル誘導体類およびアミノ誘導体類も含まれる。親ヒドロキシル化合物と適切なカルボン酸との反応で調製されるエステル類、もしくは親アミノ化合物と適切なカルボン酸との反応で調製されるアミド類。化合物のペンダントヒドロキシル基から誘導された、簡単な脂肪族もしくは芳香族エステル類を、本発明に係るプロドラッグとして用いることができる。ある場合には、(アシルオキシ)アルキルエステル類、もしくは、((アルコキシカルボニル)オキシ)アルキルエステル類などのような2箇所がエステルとなっている種類のプロドラッグ類(double ester type prodrugs)が望ましいことがある。特にプロドラッグとして適しているエステルには、メチルエステル、エチルエステル、プロピルエステル、イソプロピルエステル、n-ブチルエステル、イソブチルエステル、tert-ブチルエステル、およびモノホリノエチルエステル(morpholinoethyl)が含まれる。
【0091】
Hydrolysis in Drug and Prodrug Metabolism: Chemistry, Biochemistry, and Enzymology, by Bernard Testa and Joachim Mayer; Vch Verlagsgesellschaft Mbh (August 2003) は代謝反応ならびに薬剤およびプロドラッグの加水分解にかかわる酵素類についての包括的な総説である。そのテキストには、生体内変化(biotransformation)の重要性が記載され、加水分解酵素類(hydrolytic enzymes)、アミド類の加水分解、およびラクタム類の加水分解の生理学的役割が考察されている。その他の参考文献には例えば以下のものがある。 Biological Approaches to the Controlled Delivery of Drugs (Annals of the New York Academy of Sciences, Vol. 507), R.L. Juliano (editor) (February 1988)、 Design of Biobiological agent Properties through Prodrugs and Analogs, Edward B. Roche (editor), Amer Biological agent Assn (MacK) (June 1977)、 Prodrugs: Topical and Ocular Drug Delivery (Drugs and the Biological agent Sciences, Vol. 53), Kenneth B. Sloan (editor) Marcel Dekker (March 17, 1992)、 Enzyme-Prodrug Strategies for Cancer Therapy, Roger G. Melton (editor), Richard J. Knox (editor), Plenum Press (February 1999)、 Design of Prodrugs, Hans Bundgaard (editor), Elsevier Science (February 1986)、 Textbook of Drug Design and Development, Povl Krogsgaard- Larsen, Hans Bundgaard (editor), Hardwood Academic Pub (May 1991)、 Conversion of Non-Toxic Prodrugs to Active, Anti-Neoplastic Drugs Selectively in Breast Cancer Metastases, Basse, Per H. (September 2000)、 and Marine lipids for produrgs, of compounds and other biological agent applications, M. Masson, T. Loftsson and G. G. Haraldsson, Die Pharmazie, 55 (3), 172-177 (2000)。
【0092】
本発明において用いられるプロドラッグは、溶媒和または生物学的活性な化合物を得るための生理学的条件下で、化学的にもしくは代謝的に切断される任意の適切な官能基を含むことができる。適切な官能基には、カルボン酸エステル類、アミド類、およびチオエステル類などが含まれる。生物学的に活性な化合物の反応性のある官能基によって、対応する官能基の適したリンカー前駆物質(linker precursor)を以下の例えばプロドラッグ中のエステル結合、チオエステル結合、もしくはアミド結合などを示した表から選択することができる。
【0093】
【表1】

【0094】
〔リンカー前駆物質および結合基〕
生物学的活性な化合物(biologically acive compound)は、適切なリンカー前駆物質と結合してプロドラッグを提供する可能性がある。先に示したように、本発明に係る生物学的活性な化合物の反応性の官能基は、典型的にはリンカー前駆物質に存在する必要がある官能基に影響する。リンカー前駆物質の性質は、重大な意味を有するものではなく、許容できるメカニズム上の性質と選択された治癒的適用のための放出速度論を有する本発明に用いられるプロドラッグを提供する。リンカー前駆物質は、典型的には分子量が約25ダルトンから約400ダルトンである二価の有機ラジカルである。さらに好ましくは、リンカー前駆物質の分子量は、約40ダルトンから約200ダルトンである。
【0095】
プロドラッグに存在する結果として得られる結合基は、生物学的に不活性であるか、もしくはそれ自身が生物学的活性を有している。結合基は、プロドラッグの溶解度を変更するため、もしくは、プロドラッグの生体内分布(biodistribution)を変化させるために、プロドラッグの性質(他の分子に付加するなど)を変更させるための、その他の官能基(ヒドロキシル基、メルカプト基、アミン基、カルボン酸類、さらにはその他の官能基など)もまた含む可能性がある。
【0096】
具体的には、結合基は、二価の、分鎖もしくは直鎖の(unbranched)、飽和もしくは不飽和の、炭素数が1〜50の炭化水素鎖である。ここで、1以上の(1、2、3、もしくは4など)の炭素原子は、(-O-)、または、(-NR-、(さらにここで、Rは水素、アルキル基、シクロアルキルアルキル基、もしくは、アリールアルキル基)で任意に置換される。また、アルキル鎖は、アルコシキ基、置換アルコキシ基、シクロアルキル基、置換シクロアルキル基、アルカノイル基、アルカノイルオキシ基、アルコキシカルボニル基、アルキルチオ基、置換アルキルチオ基、ヒドロキシカルボニル基、アジド基、シアノ基、ニトロ基、ハロ基、ヒドロキシ基、オキソ基、カルボニル基、アリール基、置換アリール基、アリールオキシ基、置換アリールオキシ基、ヘテロアリール基、置換ヘテロアリール基、ヘテロアリールオキシ基、置換へテロアリールオキシ基、COOR、もしくはNRR、(ここで、Rは独立に水素、アルキル基、シクロアルキルアルキル基、もしくはアリールアルキル基である可能性がある)の群から選択された1以上の(1、2、3、もしくは4など)置換基の炭素原子で任意に置換される。
【0097】
「アルキル」("alkyl")の語は、好ましくは炭素数が1〜40、さらに好ましくは炭素数が1〜10、さらになお好ましくは炭素数が1〜6の、分鎖もしくは直鎖の(unbranched)炭化水素鎖のモノラジカル(monoradical)を指す。この語の例には、メチル、エチル、n-プロピル、イソプロピル、n-ブチル、イソブチル、sec-ブチル、n-ヘキシル、n-デシル、テトラデシルなどがある。
【0098】
アルキルは任意に1以上の、アルコキシ基、ハロ基、ハロアルキル基、ヒドロキシル基、ヒドロキシアルキル基、アリール基、ヘテロアリール基、複素環基、シクロアルキル基、アルカノイル基、アルコキシカルボニル基、アミノ基、アルキルアミノ基、アシルアミノ基、ニトロ基、トリフルオロメチル基、トリフルオロメトキシ基、カルボキシ基、カルボキシアルキル基、ケト基、チオキソ基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、およびシアノ基で任意に置換される可能性がある。
【0099】
「アルキレン」("alkylene")の語は、好ましくは炭素数が1〜40、さらに好ましくは炭素数が1〜10、さらになお好ましくは炭素数が1〜6の、分鎖もしくは直鎖の(unbranched)炭化水素鎖のジラジカル(diradical)を指す。この語の例には、メチレン、エチレン、n-プロピレン、イソプロピレン、n-ブチレン、イソブチレン、sec-ブチレン、n-ヘキシレン、n-デシレン、テトラデシレンなどがある。
【0100】
アルキレンは任意に1以上の、アルコキシ基、ハロ基、ハロアルキル基、ヒドロキシル基、ヒドロキシアルキル基、アリール基、ヘテロアリール基、複素環基、シクロアルキル基、アルカノイル基、アルコキシカルボニル基、アミノ基、アルキルアミノ基、アシルアミノ基、ニトロ基、トリフルオロメチル基、トリフルオロメトキシ基、カルボキシ基、カルボキシアルキル基、ケト基、チオキソ基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、およびシアノ基で任意に置換される可能性がある。
【0101】
「アルコキシ」("alkoxy")の語は、アルキル-O- の基を指し、ここで、アルキルは本明細書中で定義したものである。好ましいアルコキシ基には、例えば、メトキシ基、エトキシ基、n-プロポキシ基、イソプロポキシ基、n-ブトキシ基、tert-ブトキシ基、sec-ブトキシ基、n-ペントオキシ基、n-ヘキソキシ基(n-hexoxy)、1,2-ジメチルブトキシ基などがある。
【0102】
アルコキシは任意に1以上の、ハロ基、ハロアルキル基、ヒドロキシル基、ヒドロキシアルキル基、アリール基、ヘテロアリール基、複素環基、シクロアルキル基、アルカノイル基、アルコキシカルボニル基、アミノ基、アルキルアミノ基、アシルアミノ基、ニトロ基、トリフルオロメチル基、トリフルオロメトキシ基、カルボキシ基、カルボキシアルキル基、ケト基、チオキソ基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、およびシアノ基で任意に置換される可能性がある。
【0103】
「アリール基」("aryl")の語は、6〜20の炭素原子を有する単環式の(フェニル基など)、もしくは複数の環が縮合した環の(縮合環)、不飽和の芳香族性炭素環であって、少なくとも一つの環が芳香族性(ナフチル基、ジヒドロフェナントレニル基、フルオレニル基、もしくはアントリル基など)であるものである。好ましいアリール基にはフェニル基、ナフチル基などが含まれる。
【0104】
アリール基は任意に1以上の、アルキル基、アルコキシ基、ハロ基、ハロアルキル基、ヒドロキシル基、ヒドロキシアルキル基、ヘテロアリール基、複素環基、シクロアルキル基、アルカノイル基、アルコキシカルボニル基、アミノ基、アルキルアミノ基、アシルアミノ基、ニトロ基、トリフルオロメチル基、トリフルオロメトキシ基、カルボキシ基、カルボキシアルキル基、ケト基、チオキソ基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、およびシアノ基で任意に置換される可能性がある。
【0105】
「シクロアルキル基」("cycloalkyl")の語は、3〜20の炭素原子が一つの環もしくは複数の縮合環となっている環状のアルキル基のことを指す。このようなシクロアルキル基には、一例として、シクロプロピル基、シクロブチル基、シクロペンチル基、シクロオクチル基、などの単環式構造、もしくはアダマンタニル基(adamantanyl)などのような多環式構造が含まれる。
【0106】
シクロアルキル基は、任意に1以上の、アルキル基、アルコキシ基、ハロ基、ハロアルキル基、ヒドロキシル基、ヒドロキシアルキル基、アリール基、ヘテロアリール基、複素環基、アルカノイル基、アルコキシカルボニル基、アミノ基、アルキルアミノ基、アシルアミノ基、ニトロ基、トリフルオロメチル基、トリフルオロメトキシ基、カルボキシ基、カルボキシアルキル基、ケト基、チオキソ基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、およびシアノ基で任意に置換される可能性がある。
【0107】
「ハロ基」("halo")の語は、フルオロ基、クロロ基、ブロモ基、および、ヨード基のことを指す。同様に、「ハロゲン」("halogen")の語は、フッ素、塩素、臭素、およびヨウ素を指す。
【0108】
「ハロアルキル」("Haloalkyl")の語は、本明細書で定義したアルキルが、1〜4の本明細書で定義したハロ基(ここでハロ基は同じものであっても異なるものであっても良い)で置換されたものを指す。ハロアルキル基の例としては、一例として、トリフルオロメチル基、3-フルオロドデシル基、12,12,12-トリフルオロドデシル基、2-ブロモオクチル基、3-ブロモ-6-クロロヘプチル基などがある。
【0109】
「ヘテロアリール基」("heteroaryl")の語は本明細書中で、次のように定義される。1、2、もしくは3の芳香族環を含む、単環式、二環式、もしくは三環式の環状構造であって、少なくとも一つの窒素原子、酸素原子、もしくは硫黄原子が芳香族環の中に含まれているもので、非置換のもの、または例えば1箇所以上、特には1〜3箇所が、ハロ基、アルキル基、ヒドロキシル基、ヒドロキシアルキル基、アルコキシ基、アルコキシアルキル基、ハロアルキル基、ニトロ基、アミノ基、アルキルアミノ基、アシルアミノ基、アルキルチオ基、アルキルスルフィニル基、およびアルキルスルホニル基などの置換基で置換されたものである。ヘテロアリール基の例には以下のものが含まれるが、それらに限定されるわけではない。2H-ピロリル基、3H-インドリル基、4H-キノリジニル基、4nH-カルバゾリル基、アクリジニル基、ベンゾ[b]チエニル基、ベンゾチアゾリル基、D-カルボリニル基(D-carbolinyl)、カルバゾリル基、クロメニル基(chromenyl)、シンナオリニル基(cinnaolinyl)、ジベンゾ[b,d]フラニル基、フラザニル基、フリル基、イミダゾリル基、イミジゾリル基、インダゾリル基、インドリシニル基、インドリル基、イゾベンゾフラニル基、イソインドリル基、イソキノリル基、イソチアゾリル基、イソオキサゾリル基、ナフチリジニル基、ナフト[2,3-b]基、オキサゾリル基、ペリミジニル基(perimidinyl)、フェナントリジニル基(phenanthridinyl)、フェナントロリニル基、フェナサジニル基(phenarsazinyl)、フェナジニル基(phenazinyl)、フェノチアジニル基、フェノキサチニル基(phenoxathiinyl)、フェノキサジニル基、フタラジニル基(phthalazinyl)、プテリジニル基(pteridinyl)、プリニル基、ピラニル基、ピラリジニル基、ピラゾリル基、ピリダジニル基、ピリジル基、ピリミジニル基(pyrimidinyl)、ピリミジニル基(pyrimidinyl)、ピロリル基、キナゾリニル基、キノリル基、キノキサリニル基、チアジアゾリル基(thiadiazolyl)、チアントレニル基(thianthrenyl)、チアゾリル基、チエニル基、チアゾリル基、およびキサンテニル基。ある実施例では「ヘテロアリール基」("heteroaryl")は、炭素原子ならびに、過酸化物でない酸素(non-peroxide oxygen)、硫黄、N(Z) の群から独立に選択された1、2、3、もしくは4原子のヘテロ原子を含む5員または6員の単環式芳香環と定義される。ここで、Zは何もないか、またはH、O、アルキル基、フェニル基、もしくはベンジル基である。他の実施例では、ヘテロアリール基は、8員から10員のオルト位で縮合した二環式複素環(ortho-fused bicyclic heterocycle)と定義され、特に、ベンゼン誘導体または、プロピレンの縮合から得られるもの、もしくは、それに加えてテトラメチレンジラジカルから誘導されたものである。
【0110】
ヘテロアリール基は、任意に1以上の、アルキル基、アルコキシ基、ハロ基、ハロアルキル基、ヒドロキシル基、ヒドロキシアルキル基、アリール基、複素環基、シクロアルキル基、アルカノイル基、アルコキシカルボニル基、アミノ基、アルキルアミノ基、アシルアミノ基、ニトロ基、トリフルオロメチル基、トリフルオロメトキシ基、カルボキシ基、カルボキシアルキル基、ケト基、チオキソ基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、およびシアノ基で任意に置換される可能性がある。
【0111】
「複素環基」("heterocycle")の語は、飽和のもしくは部分的に不飽和の環構造で、酸素、窒素、および硫黄の群から選択された少なくとも一原子のヘテロ原子を含み、アルキル基またはC(=O)ORbで任意に置換されたものを指す。ここで、Rbは酸素もしくはアルキル基である。典型的な複素環基は、一原子以上の、酸素、窒素、および硫黄の群から選択されるヘテロ原子を含む単環式、二環式、もしくは三環式の基である。複素環基は環に結合した (=O) もまた含む可能性がある。複素環基の例としては以下のものが含まれるがそれらに限定されるわけではない。1,3-ジヒドロベンゾフラン、1,3-ジオキソラン(dioxolane)、1,4-ジオキサン、1,4-ジチアン、2H-ピラン、2-ピラゾリン、4H-ピラン、クロマニル基(chromanyl)、イミダゾリジニル基、イミダゾリル基、インドリニル基、イソクロマニル基(isochromanyl)、イソインドリル基、モルホリン、ピペラジニル基、ピペリジン、ピペリジル基、ピラゾリジン、ピラゾリジニル基、ピラゾリニル基、ピロリジン、ピロリン、キヌクリジン、およびチオモルホリン。
【0112】
複素環基は、任意に1以上の、アルキル基、アルコキシ基、ハロ基、ハロアルキル基、ヒドロキシル基、ヒドロキシアルキル基、アリール基、ヘテロアリール基、複素環基、シクロアルキル基、アルカノイル基、アルコキシカルボニル基、アミノ基、アルキルアミノ基、アシルアミノ基、ニトロ基、トリフルオロメチル基、トリフルオロメトキシ基、カルボキシ基、カルボキシアルキル基、ケト基、チオキソ基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、およびシアノ基で任意に置換される可能性がある。
【0113】
窒素を含んだ複素環類およびヘテロアリール類(nitrogen heterocycles and heteroaryls)の例には、ピロール、イミダゾール、ピラゾール、ピリジン、ピラジン、ピリミジン、ピリダジン、インドリジン、イソインドール、インドール、インダゾール、プリン、キノリジン、イソキノリン、キノリン、フタラジン、ナフチルピリジン、キノキサリン(quinoxaline)、キナゾリン、シンノリン(cinnoline)、プテリジン、カルバゾール、カルボリン、フェナントリジン、アクリジン、フェナントロリン、イソチアゾール、フェナジン、イソキサゾール、フェノキサジン、フェノチアジン、イミダゾリジン、イミダゾリン、ピペリジン、ピペラジン、インドリン、モルホリノ基、ピペリジニル基、テトラヒドロフラニル基など、さらには、N-アルキル-窒素を含む複素環類が含まれるが、それらに限定されるわけではない。
【0114】
他の種類の複素環(heterocyclics)は「クラウン化合物」("crown compounds")として知られており、[-(CH2-)aA-](ここで、aは2以上)の構造の1以上の繰り返し単位を有し、それぞれ別の物質での(separate occurrence)Aは、O、N、SもしくはPである可能性がある特殊な種類の複素環化合物のことである。クラウン化合物の例には、一例として、[-(CH2)3-NH-]3、[-((CH2)2-O)4-((CH2)2-NH)2]などが含まれる。典型的には、このようなクラウン化合物は4原子から10原子のヘテロ原子、および、8原子から40原子の炭素原子を有する可能性がある。
【0115】
「アルカノイル基」("alkanoyl")の語は、C(=O)Rを指し、ここでRは先に定義したアルキル基である。
【0116】
「アルキルカルボニル基」("alkoxycarbonyl")の語は、C(=O)ORを指し、ここでRは先に定義したアルキル基である。
【0117】
「アミノ基」("amino")の語は-NH2を指し、「アルキルアミノ基」("alkylamino")の語は-NR2を指す。ここで少なくとも一つのRはアルキル基であり、2つ目のRはアルキル基もしくは水素である。「アシルアミノ基」("acylamino")の語は、RC(=O)Nを指し、ここでRはアルキル基もしくはアリール基である。
【0118】
「ニトロ基」("nitro")の語は-NO2を指す。
【0119】
「トリフルオロメチル基」("trifluoromethyl")の語は -CF3を指す。
【0120】
「トリフルオロメトキシ基」("trifluoromethoxy")の語は-OCF3を指す。
【0121】
「シアノ基」("cyano")の語は-CNを指す。
【0122】
「ヒドロキシル基」("hydroxy")の語は-OHを指す。
【0123】
「置換」("Substituted")は、「置換された」("substituted")という表現を用いて示されている原子に結合している一原子以上の水素が、示された群(indicated groups)の中から選択された基と置き換えられ、その示されている原子の通常の価数を超えていないものとなり、置き換えの結果物が安定な化合物であることを示す。適切な「示された群」(indicated groups)には、例えばアルキル基、アルコキシ基、ハロ基、ハロアルキル基、ヒドロキシル基、ヒドロキシアルキル基、アリール基、ヘテロアリール基、複素環基、シクロアルキル基、アルカノイル基、アルコキシカルボニル基、アミノ基、アルキルアミノ基、アシルアミノ基、ニトロ基、トリフルオロメチル基、トリフルオロメトキシ基、カルボキシ基、カルボキシアルキル基、ケト基、チオキソ基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、およびシアノ基などが含まれる。置換基がケト基(すなわち、=O)もしくはチオキソ基(すなわち、=S)である場合は、2原子の水素が置き換えられている。
【0124】
一つ以上の置換基を含む上記の任意の群に関して、当然ながら、このような置換基が立体的に実現不可能および/または合成的に実現不可能な置換や置換パターン(substitution patterns)でないことが理解できる。さらに、本発明に係る化合物はそれらの化合物の置換によって生じる全ての立体異性体を含んでいる。
【0125】
特に結合基は二価のペプチド、アミノ酸、脂肪酸、糖類、多糖類、ポリアルコール(例えばPEGもしくはPVA)、デンプン、デキストリン、マルトデキストリン、シクロデキストリン、または、炭水化物である可能性がある。例えば、結合基が二価のペプチド、アミノ酸、糖類、多糖類、もしくは、ポリアルコールである可能性がある。
【0126】
ある具体的な本発明に係る実施例では、結合基自体が生物学的活性を有する可能性がある。例えば、結合基は、成長ホルモン放出ホルモン(GHRP)、黄体形成ホルモン放出ホルモン(LHRH)、酢酸ロイプロリド、ソマトスタチン、ボンベシン、ガストリン放出ペプチド(GRP)、カルシトニン、ブラジキニン、ガラニン、メラニン細胞刺激ホルモン(MSH)、成長ホルモン放出因子(GRF)、アミリン、タキキニン、セクレチン、副甲状腺ホルモン(PTH)、エンケファリン、エンドセリン、カルシトニン遺伝子放出ペプチド(calcitonin gene releasing peptide)(CGRP)、ニューロメディン、副甲状腺ホルモン関連タンパク質(PTHrP)、グルカゴン、ニューロテンシン、副腎皮質刺激ホルモン(adrenocorticotrophic hormone)(ACTH)、ペプチドYY(PYY)、グルカゴン放出ペプチド(GLP)、血管作用性小腸ペプチド(VIP)、下垂体アデニル酸シクラーゼ活性化ペプチド(pituitary adenylate cyclase activating peptide)(PACAP)、モチリン、サブスタンスP、ニューロペプチドY(NPY)、TSH、ならびに、それらのアナログおよびフラグメントなどの、二価の生理活性のペプチドである可能性がある。たとえば、U.S. Patent Nos. 6,221,958、 6,113,943、 および 5,863,985を参照のこと。
【0127】
ある具体的な本発明に係る実施例では、結合基は親油性(lipophillic)である可能性がある。本発明についての他の実施例では、結合基は親水性である可能性がある。
【0128】
安定な種類のプロドラッグには以下の構造式(I)の化合物が含まれる。
【0129】
【化1】

【0130】
ここで、
Dは、本明細書で開示した生物学的に活性な化合物のモノラジカルであり、
X1は、カルボン酸エステル結合基(carboxylic ester linkage)、アミド結合基、チオエステル結合基、リン酸エステル結合基、もしくはスルホン酸エステル結合基であって、かつ、
L1は、結合基である。
【0131】
他の安定な種類のプロドラッグには以下の構造式(II)の化合物が含まれる。
【0132】
【化2】

【0133】
ここで、
それぞれのDは独立に、本明細書で開示した生物学的に活性な化合物のモノラジカル、もしくはジラジカルであり、
それぞれのX1は、カルボン酸エステル結合基、アミド結合基、チオエステル結合基、リン酸エステル結合基、もしくはスルホン酸エステル結合基であって、
それぞれのL1は、独立に結合基であり、
X2は、カルボン酸エステル、アミド、チオエステル、リン酸エステル、もしくはスルホン酸エステルであって、かつ、
nは約1から約10000である。
【0134】
先に示したように、適切な種類のプロドラックには、本明細書で開示した生物学的活性な化合物の高分子プロドラッグ(polymeric prodrug)も含まれる。生物学的活性な化合物の反応性がある官能基によって、生物学的活性な化合物の一箇所以上がリンカー前駆物質(linker precursor)を結合するために選択され、これが繰り返されることによって高分子プロドラックが得られる。
【0135】
〔投与量〕
流動性組成物は、液体組成物もしくはゲル状組成物であり、受療者の眼部に注入するのに適している。投与される流動性組成物の量は、典型的には、コントロールリリース挿入物に求められる性質による。例えば、流動性組成物の量は、生物学的薬剤、その代謝産物、もしくはそれらのプロドラッグが、コントロールリリース挿入物から放出される時間の長さに影響しうる。さらに、投与される流動性組成物の量は、典型的には、具体的な用途(例えば、疾病あるいは疾患の性質、および、段階/進行度など)にもよる。さらに、投与される流動性組成物の量は、典型的には、形成するコントロールリリース挿入物の数(すなわち、投与される流動性組成物の数)にもよる。特に、約200種類まで、約100種類まで、約50種類まで、約25種類まで、もしくは約10種類までの流動性組成物を投与することができ、約200個まで、約100個まで、約50個まで、約25個まで、もしくは約10個までのコントロールリリース挿入物がこれらの流動性組成物を投与することによって形成される可能性がある。典型的には投与される流動性組成物の数が増加するに従って、投与される流動性組成物の量が減少する。同様に、投与される流動性組成物の数が減少するに従って、投与される流動性組成物の量が増加する。
【0136】
具体的には、組成物は生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩(biological agently acceptable salt)、もしくはそれらのプロドラッグの一年間送達システム(one year delivery system)を処方するために用いることができる。組成物は生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグの6ヶ月送達システム(six month delivery system)を処方するために用いることもできる。組成物は生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグの3ヶ月送達システム(three month delivery system)を処方するために用いることもできる。組成物は生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグの2ヶ月送達システム(two month delivery system)を処方するために用いることもできる。組成物は生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグの1ヶ月送達システム(one month delivery system)を処方するために用いることもできる。
【0137】
具体的には、約10mLまでの流動性組成物を投与することができる。さらに具体的には、約5mLまで、約1mLまで、もしくは約0.5mLまでの流動性組成物を投与することが可能である。
【0138】
前述のように、複数のコントロールリリース挿入物が形成されたとき(すなわち、複数の流動的組成物が投与されたとき)は、それぞれの投与される流動性組成物は、同じ量の生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを含む可能性がある。またあるいは、複数のコントロールリリース挿入物が形成されたとき(すなわち、複数の流動的組成物が投与されたとき)は、それぞれの投与される流動性組成物は、異なる量の生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを含む可能性がある。それぞれの流動性組成物は任意の適切な量を投与することができる。具体的には、約10mLまで、約5mLまで、約1mLまで、約0.5mLまで、もしくは約0.1mLまでの流動性組成物を投与することが可能である。
【0139】
生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグは、任意の効果的で、適切で、妥当な量を存在させることができる。例えば、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグは、流動的組成物の約70wt.%まで、流動的組成物の約60wt.%まで、流動的組成物の約40wt.%まで、または、流動的組成物の約20wt.%まで、存在させることができる。具体的には、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグは、流動的組成物の約10wt.%まで、流動的組成物の約5wt.%まで、流動的組成物の約1wt.%まで、または、流動的組成物の約0.1wt.%まで、存在させることができる。
【0140】
前述のように、複数のコントロールリリース挿入物が形成されたとき(すなわち、複数の流動的組成物が投与されたとき)は、それぞれの投与される流動性組成物は、同じ量の生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを含む可能性がある。またあるいは、複数のコントロールリリース挿入物が形成されたとき(すなわち、複数の流動的組成物が投与されたとき)は、それぞれの投与される流動性組成物は、異なる量の生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを含む可能性がある。ともかく、それぞれの投与される流動性組成物は独立に、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを、流動的組成物の約10wt.%まで、流動的組成物の約5wt.%まで、流動的組成物の約1wt.%まで、または、流動的組成物の約0.1wt.%まで含む可能性がある。
【0141】
具体的には、流動性組成物は約0.001mL以上の体積とすることができる。さらに、流動性組成物は約20.0mLまでの体積とすることができる。具体的には、流動性組成物の体積は、約0.01mLから10.0mLまで、約0.05mLから1.5mLまで、約0.1mLから1.0mLまで、もしくは、約0.2mLから0.8mLまで、とすることができる。
【0142】
具体的には、流動性組成物は、大体、一日に一回以下の投与用に処方することができる。さらに具体的には、流動性組成物は、およそ一週間に一回以下、およそ一月に一回以下、およそ一年に一回以上、およそ一週間に一回からおよそ一年に一回、もしくは、およそ一月に一回からおよそ一年に一回、投与するために処方することができる。
【0143】
流動性組成物は、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを、適切で効果的で安全で、しかも妥当な投薬量で、哺乳類の組織に効果的に送達する。例えば、流動性組成物で、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを、約0.001ピコグラム/キログラム/日以上、約0.01ピコグラム/キログラム/日以上、約0.1ピコグラム/キログラム/日以上、もしくは約1ピコグラム/キログラム/日以上の投与量で、哺乳類の組織に効果的に送達することができる。あるいはまた、流動性組成物で、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを、約100ミリグラム/キログラム/日まで、約50ミリグラム/キログラム/日まで、約10ミリグラム/キログラム/日まで、もしくは約1ミリグラム/キログラム/日までの投与量で、哺乳類の組織に効果的に送達することができる。
【0144】
さらに具体的には、流動性組成物で、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを、約0.001ピコグラム/キログラム/日から約100ミリグラム/キログラム/日まで、約0.01ピコグラム/キログラム/日から約50ミリグラム/キログラム/日まで、約0.1ピコグラム/キログラム/日から約10ミリグラム/キログラム/日まで、もしくは約1ピコグラム/キログラム/日から約1ミリグラム/キログラム/日までの投与量で、哺乳類の組織に効果的に送達することができる。
【0145】
生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを、任意の適した方法で、コントロールリリース挿入物から放出させることができる。例えば、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを、線形速度式(linear kinetic)もしくは一次速度式(first order kinetic)で、コントロールリリース挿入物から放出させることができる。またあるいは、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを、継続的ゼロ次放出(continuous zero order)で、コントロールリリース挿入物から放出させることができる。さらに、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを、突発的な薬剤放出(drug burst)をほとんど、もしくは、全くさせずに、コントロールリリース挿入物から放出させることができる。
【0146】
生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグの哺乳類の組織への送達は、全身送達および/または局所送達とすることができる。具体的には、投薬量(dosage)は局所的に送達することができる。さらに具体的には、投薬量は、約一年までの期間、局所的に送達することができる。さらに具体的には、投薬量は、約一月までの期間、約一週間までの期間、もしくは、約一日までの期間、局所的に送達することができる。
【0147】
生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグに加えて、本発明に係る流動的組成物、および/または挿入物は、任意に、鎮痛薬、麻酔剤、抗炎症薬、抗片頭痛薬、筋弛緩薬、もしくは鎮静催眠薬(sedative and hypnotic)の少なくとも一つを含む可能性がある。鎮痛薬、麻酔剤、抗炎症薬、胃腸薬、抗片頭痛薬、筋弛緩薬、もしくは鎮静催眠薬を任意の適切な量を含む可能性がある。Physician's Desk Reference, 55th Edition (2001) を参照のこと。
【0148】
適切な鎮痛剤には、例えば、以下のものが含まれる。アセトアミノフェン、フェニルプロパノールアミンHCl、クロロフェニルアミンマレイン酸エステル(chlorpheniramine maleate)、重酒石酸ヒドロコドン(hydrocodone bitartrate)、アセトアミノフェンエリキシル(acetaminophen elixir)、ジフェンヒドラミンHCl、プソイドエフェドリンHCl、デキストロメトルファンHBr、グアイフェネシン、ドキシラミンコハク酸塩(doxylamine succinate)、クロニジン塩酸塩、トラマドール塩酸塩、カルバマゼピン、ヒアルロン酸ナトリウム、リドカイン、ヒラン(hylan)、アルニカ・モンタナ(Arnica Montana)、ラジックス(radix)(マウンテン・アルニカ(mountain arnica))、カレンデュラ・オフィチナリス(Calendula officinalis)(マリゴールド)、ハマメリス(Hamamelis)(マンサク)、ミルフォリウム(Millefolium)(ノコギリソウ)、ベラドンナ(deadly nightshade)、アコニタム・ナペルス(Aconitum napellus)(トリカブト(monkshood))、カモミラ(Chamomilla)(カモミール)、シンフィタム・オフチナーレ(Symphytum officinale)(ヒレハリソウ(comfrey))、ベリスペレニス(Bellis perennis)(デイジー)、エキナセア・アングスティフォリア(Echinacea angustifolia)(ホソババレンギク(narrow-leafed cone flower))、ヒペリカム・ペルフォラタム(Hypericum perforatum)(セイヨウオトギリソウ)、ヘパー・スルフューリス・カルカレウム(Hepar sulphuris calcareum)(硫酸カルシウム)、ブプレノルフィン塩酸塩、ナルブフィン塩酸塩、ペンタゾシン塩酸塩、アセチルサリチル酸、サリチル酸、ナロキソン塩酸塩、口腔粘膜吸収型クエン酸フェンタニル(oral transmucosal fentanyl citrate)、硫酸モルヒネ、ナプシル酸プロポキシフェン(propoxyphene napsylate)、プロポキシフェン塩酸塩、メペリジン塩酸塩、塩酸ヒドロモルホン、フェンタニル経皮系(fentanyl transdermal system)、酒石酸レボルファノール(levorphanol tartrate)、プロメタジンHCl(promethazine HCl)、オキシモルホン塩酸塩(oxymorphone hydrochloride)、酢酸レボメタジル塩酸塩(levomethadyl acetate hydrochloride)、オキシコドンHCl、オキシコドン、リン酸コデイン、イソメテプテン変異型(isometheptene mucate)、ジクロナルフェナゾン、ブタルビタール、ナプロキセンナトリウム、ジクロフェナクナトリウム、ミソプロストール、ジクロフェナクカリウム、セレコキシブ、スリンダク、オキサプロジン、サルサラート、ジフニサル、ナプロキセン、ピロキシカム、インドメタシン、インドメタシンナトリウム三水和物、エトドラク、メロキシカム、イブプロフェン、フェノプロフェンカルシウム、ケトプロフェン、メフェナム酸、ナブメトン、トルメチンナトリウム、ケトロラクトメタミン、トリサリチル酸コリンマグネシウム、およびロフェキシコブ。
【0149】
適切な麻酔薬には、例えば、プロポフォール、ハロタン、デスフルラン、ミダゾラムHCl、エピネフリン、レボビピバカイン、エチドカイン塩酸塩、ロヒバカインHCl、クロロプロカインHCl、ブピバカインHCl、およびリドカインHCl、が含まれる。
【0150】
適切な抗感染薬には、例えば、以下のものが含まれる。トリメトプリム、スルファメトキサゾール、クラリスロマイシン、ガンシクロビルナトリウム、ガンシクロビル、クエン酸ダウノルビシンリポソーム(daunorubicin citrate liposome)、フルコナゾール、ドキソルビシンHClリポソーム(doxorubicin HCl liposome)、ホスカルネットナトリウム、インターフェロン アルファ-2b(interferon alfa-2b)、アトバコン、リファブチン、グルクロン酸トリメトレキセート(trimetrexate glucoronate)、イトラコナゾール、シクロフォビル(ciclofovir)、アジスロマイシン、メシル酸デラビルジン(delavirdine mesylate)、エファビレンツ、ネビラピン、ラミブジン/ジドブジン、ザルシタビン、ジダノシン、スタブジン、硫酸アバカビル、アンプレナビル、硫酸インジナビル、サキナビル、メシル酸サキナビル(saquinavir mesylate)、リトナビル、ネルフィナビル、塩酸クロロキン、メトロニダゾール、塩酸メトロニダゾール、ヨードキノール、アルベンダゾール、プラジカンテル、チアベンダゾール、イベルメクチン、硫酸メベンダゾール(mebendazole sulfate)、硫酸トブラマイシン(tobramycin sulfate)、トブラマイシン、アズトレオナム、セフォテタン二ナトリウム(cefotetan disodium)、セフォテタン、ロラカルベフ、セフォキチン、メロペネム、イミペネムおよびシラスタチン(imipenemand cilastatin)、セファゾリン、セファクロル、セフチブテン、セフチゾキシム、セフォペラゾン、セフロクメアセチル(cefuroxumeaxetil)、セラプロジル、セフタンジジム、セフォタキシムナトリウム、セファドロキシル一水和物、セファレキシン、塩酸セファレキシン、セフロキシム、セファゾリン、セファマンドールナファテ(cefamandole nafate)、塩酸セファピム(cefapime hydrochloride)、セフジニル、セフトリアキソンナトリウム、セフィキシム、セフポドシムプロキセチル、ジリスロマイシン、エリスロマイシン、エチルコハク酸エリスロマイシン、ステアリン酸エリスロマイシン、エリスロマイシン、酢酸スルフィソキサゾール(sulfisoxazole acetyl)、トロレアンドマイシン、アジスロマイシン(azithromycin)、クリンダマイシン(clindamycin)、塩酸クリンダマイシン(clindamycin hydrochloride)、硫酸コリスチンナトリウム(colistimethate sodium)、キヌプリスチン/ダルホプリスチン、塩酸バンコマイシン、アモキシシリン、アモキシシリン/クラブラン酸/カリウム、ペニシリンGベンザチン(penicillin G benzathine)、ペニシリンGプロカイン(penicillin G procaine)、ペニシリンGカリウム(penicillin G potassium)、カルベニシリンインダニルナトリウム(carbenicillin indanyl sodium)、ピペラジリンナトリウム、チカルシリン二ナトリウム、クラブラン酸カリウム、アンピシリンナトリウム/スルバクタムナトリウム、タゾバクタムナトリウム、テトラサイクリンHCl、塩酸デメクロサイクリン、塩酸ドキシサイクリン(doxycycline hyclate)、ミノサイクリンHCl、ドキシサイクリン一水和物、オキシテトラサイクリンHCl、酢酸ヒドロコルチゾン(hydrocortisone acetate)、ドキシサイクリンカルシウム、アンホテリンBリピド(amphotericin B lipid)、フルシトシン、グリセオフルビン、塩酸テルビナフィン(terbinafine hydrochloride)、ケトコナゾール、塩酸クロロキン、リン酸クロロキン、ピリメタミン、塩酸メフロキン、塩酸アトバコンおよび塩酸プログアニル(atovaquone and proguanil hydrochloride)、硫酸ヒドロキシクロロキン、塩酸エタンブトール、アミノサリチル酸、リファペンチン、リファンピン、イソニアジド、ピラジナミド、エチオナミド、インターフェロン アルファ-n3(interferon alfa-n3)、ファムシクロビル、塩酸リマンタジン、ホスカルネットナトリウム、インターフェロン アルファコン-1(interferon alfacon-1)、リバビリン、ザミナビル、塩酸アマンタジン、パリビズマブ、リン酸オセルタミビル、塩酸バラシクロビル、ネルフィナビルメシレート(nelfinavir mesylate)、スタブジン、アシクロビル、アシクロビルナトリウム、リファブチン、グルクロン酸トリメトレキセート(trimetrexate glucuronate)、リネゾリド、モキシフロキサシン、塩酸モキシフロキサシン、シプロフロキサシン、塩酸シプロフロキサシン、オフロキサシン、レボフロキサシン、塩酸ロメフロキサシン、ナリジクス酸、ノルフロキサシン、エノキサシン、ガチフロキサシン、トロバフロキサシンメシレート(trovafloxacin mesylate)、アラトロフロキサシン(alatrofloxacin)、スパルフロキサシン、アズトレオナム、ニトロフラントイン一水和物/マクロ結晶(nitrofurantoin monohydrate/macrocrystals)、塩酸セフェピム、ホスホマイシントロメタミン(fosfomycin tromethamine)、硫酸ネオマイシン-硫酸ポリミキシンB(neomycin sulfate-polymyxin B sulfate)、イミペネム、シラスタチン(cilastatin)、メテナミン、マンデル酸メテナミン(methenamine mandelate)、フェニルサリチル酸、硫酸アトロピン、硫酸ヒヨスチアミン、安息香酸、塩酸オキシテトラサイクリン、スルファメチゾール、塩酸フェナゾピリジン、および、リン酸ナトリウム一水和物(sodium acid phosphate, monohydrate)。
【0151】
適切な同毒療法剤(homeopathic remedies)には、例えば、ツヅラフジ(cocculus indicus)、ドクニンジン(conium maculatum)、龍涎香(ambra grisea)、および、石油などが含まれる。
【0152】
適切な抗片頭痛薬には、例えば、マレイン酸チモロール(timolol maleate)、塩酸プロプラノロール、ジヒドロエルゴタミンメシレート(dihydroergotamine mesylate)、酒石酸エルゴタミン(ergotamine tartrate)、カフェイン、ジバルプロエクスナトリウム、アセトアミノフェン、アセチルサリチル酸、サリチル酸、塩酸ナラトリプタン、コハク酸スマトリプタン、スマトリプタン、安息香酸リザトリプタン(rizatriptan benzoate)、および、ゾルミトリプタンなどが含まれる。
【0153】
適切な筋弛緩剤には、例えば、塩化スクシニルコリン、臭化ベクロニウム、臭化ラパクロニウム、臭化ロクロニウム、ダントレンナトリウム、シクロベンザプリンHCl、クエン酸オルフェナドリン(orphenadrine citrate)、クロルゾルキサゾン、メトカルバモール、アセチルサリチル酸、サリチル酸、メタキサロン(metaxalone)、カリソプロトール、リン酸コデイン、ジアゼパム、および、塩酸チザニジンなどが含まれる。
【0154】
適切な鎮静催眠薬(sedative and hypnotic)には、例えば、メホバルビタール、ペントバルビタール、ロラゼパム、トリアゾラム、エスタゾラム、ジアゼパム、ミダゾラムHCl、酒石酸ゾルピデム(Zolpidem tartrate)、メラトニン、ビタミンB12、葉酸、プロポフォール、メペリジンHCl、プロメタジンHCl、ジフェンヒドラミンHCl、ザレプロン、およびコハク酸ドキシラミン(doxylamine succinate)などが含まれる。
【0155】
〔眼の疾病および疾患〕
本明細書に記載した流動性組成物は、一種類以上の眼の疾病および疾患を処置するために、眼部から局所的に投薬することができる。適切な眼の疾病および疾患には、例えば、以下のものが含まれる。急性帯状潜在性外側網膜症(Acute Zonal Occult Outer Retinopathy)、アディー症候群、加齢黄斑変性症(AMD)、白皮症、一過性黒内症、弱視、無虹彩症、瞳孔不同症、無眼球症、無水晶体症(Aphakia)、動脈閉塞、乱視、基底細胞癌(Basal Cell Carcinoma)、眼瞼炎、網膜動脈分枝閉塞症、網膜静脈分枝閉塞症、眼瞼下垂(Blepharoptosis)、眼瞼痙攣(Blepharospasm)、盲目、白内障、セロハン網膜症(Cellophane Retinopathy)、網膜中心静脈閉塞症、中心性漿液性網脈絡膜症、霰粒腫、化学火傷、脈絡膜血管新生膜(Choroidal Neovascular Membrane)、脈絡膜母斑、コーガンジストロフィー(Cogan's Dystrophy)、色盲、コンピュータ視力症候群(Computer Vision Syndrome)、結膜炎、角膜ジストロフィー(Corneal Dystrophy)、角膜浮腫(Corneal Edema)、角膜潰瘍、嚢胞様黄斑浮腫(Cystoid Macular Edema)、サイトメガロウイルス(Cytomegalovirus)、脈絡網膜炎、コロイデレミア(Choroideremia)、コロボーマ(Coloboma)、涙嚢炎、糖尿病性網膜症、眼瞼下垂(Droopy Eyelids)、ドライアイ、複視、二重睫毛、デュアン眼球後退症候群、眼瞼外反(Ectropion)、眼瞼内反(Entropion)、網膜上膜(Epi-retinal membrane)、上強膜炎、内斜視、落屑症候群、外斜視、眼での出血(Eye Hemorrhage)、眼の腫瘍(Eye Neoplasms)、遠視(Farsightedness)、閃光飛蚊症(Flashes & Floaters)、異物(Foreign Body)、フックスジストロフィー(Fuchs' Dystrophy)、巨細胞性動脈炎(Giant Cell Arteritis)、緑内障、一般的な繊維症(General Fibrosis Syndrome)、脳回転状萎縮、頭痛、単純ヘルペス、帯状ヘルペス、眼圧が高いこと(High Pressure in the Eye)、ヒストプラズマ症(眼部)、遠視(Hyperopia)、全房出血(Hyphema)、半盲(Hemianopsia)、ヘルマンスキー・プドラック症候群(Hermanski-Pudlak Syndrome)、麦粒腫、ホルネル症候群、目蓋が内側に曲がっていること(Inward Turned Eyelid)、虹彩血管新生、虹彩母斑、虹彩炎、円錐角膜、カーンズ・セイアー症候群(Kearns-Sayer Syndrome)、角膜炎、涙器の疾病(Lacrimal Apparatus Diseases)、涙道閉塞、黄斑変性症、黄斑浮腫、黄斑円孔、マクラパッカー(Macular Pucker)、辺縁性の眼瞼炎(Marginal Blepharitis)、近視(Myopia)、小眼球症、近視(Myopia)、眼振、近眼(Nearsightedness)、角膜の血管新生(Neovascularization of the Cornea)、視神経乳頭の血管新生(Neovascularization of the Optic Nerve Head)、脈絡膜母斑(Nevus (Choroidal))、母斑(虹彩)、眼ヒストプラズマ症、眼の酒さ(Ocular Rosacea)、視神経症(Optic Neuritis)、目蓋が外側に曲がっていること(Outward Turned Eyelid)、眼筋麻痺、視神経萎縮、視神経症(Optic Neuropathy)、眼窩蜂巣炎、瞼裂斑(Pinguecula)、ピンクアイ(Pink Eye)、後発白内障、老視(Presbyopia)、翼状片(Pterygium)、下垂症、うっ血乳頭、ピータース奇形(Peter's Anomaly)、再発性角膜びらん、眼の充血(Red Eyes)、網膜裂孔、網膜剥離、網膜色素変性症、未熟児網膜症、水晶体後繊維増殖症(ROP)(Retrolental Fibroplasia)、ルベオーシス(Rubeosis)、網膜静脈閉塞、網膜分離症、強膜症、斜視(Strabismus)、ものもらい(Stye)、結膜下の出血(Subconjunctival Hemorrhage)、盲点(Scotoma)、斜視、側頭動脈炎(Temporal Arteritis)、サイジェソン点状表層角膜炎(Thygeson's Superficial Punctate Keratitis)、トラコーマ、ぶどう膜炎、静脈閉塞、および、硝子体剥離。
【0156】
本明細書に記載した流動性組成物を、一種類以上の眼の疾病および疾患を処置するために、眼部から局所的に投薬するとき、通常は、流動性組成物はそのような眼の疾病および疾患を処置するための既知の一種類以上の生物学的薬剤を含む。このような適切な生物学的薬剤には、例えば、以下のものが含まれる。アセチルコリン遮断薬(acetylcholine blocking agents)(ボトックス精製神経毒錯体(botox purified neurotoxin complex)など)、アドレナリンアゴニスト(アルファガン P(alphagan p)、naphcon-aなど)、抗生物質(polytrim、トブラデクス(tobradex)など)、抗緑内障剤(antiglaucoma agents)(ベチモール(betimol)、ベトプティック s(betoptic s)、コソプト(cosopt)、オキュドース中のチモプティック(timoptic in ocudose)、チモプティック(timoptic)、チモプティック-xe(timoptic-xe)、アゾプト(azopt)、コソプト(cosopt)、ダラナイド(daranide)、トルソプト(trusopt)、ルミガン(lumigan)、トラバタン(travatan)、キサラタン(xalatan)、アルファガン P(alphagan P)、naphcon-A、rev- eyesなど)、抗ヒスタミン剤とマスト細胞安定剤(mast cell stabilizer)との配合物(elesat、パタノール(patanol)、zaditorなど)、抗ヒスタミン剤の配合物(antihistamines & combinations)(naphcon-A、オプティバール(optivar)など)、抗感染症薬(polytrim、トブラデクス(tobradex)、シロキサン(ciloxan)、クイクシン(quixin)、ビガモックス(vigamox)、zymar、ブレファマイド(blephamide)など)、抗炎症剤(アキュラー(acular)、アキュラー ls(acular ls)、アキュラー pf(acular pf)、ボルタレン(voltaren)、ブレファマイド(blephamide)、トブラデクス(tobradex)など)、人工涙液/潤滑剤(artificial tears/lubricants)の配合物(bion tears、ラクリサート(lacrisert)、レスタシス(restasis)、tears naturale forte、tears naturale freeなど)、β-アドレナリン遮断薬(beta adrenergic blocking agent)(ベチモール(betimol)、ベトプティック s(betoptic s)、コソプト(cosopt)、timoptic in ocudose、チモプティック(timoptic)、チモプティック-xe(timoptic-xe)など)、β-アドレナリン遮断薬と炭酸脱水酵素阻害薬(carbonic anhydrase inhibitor)との配合物(cosoptなど)、炭酸脱水酵素阻害薬(アゾプト(azopt)、コソプト(cosopt)、ダラナイド(daranide)、トルソプト(trusopt)など)、うっ血除去薬(decongestants)(アルファガン P(alphagan p)、naphcon-aなど)、緑内障用薬剤(agents for glaucoma)(ベチモール(betimol)、ベトプティック s(betoptic s)、コソプト(cosopt)、 timoptic in ocudose、チモプティック(timoptic)、チモプティック-xe(timoptic-xe)、アゾプト(azopt)、コソプト(cosopt)、ダラナイド(daranide)、トルソプト(trusopt)、ルミガン(lumigan)、トラバタン(travatan)、キサラタン(xalatan)、アルファガン p(alphagan p)、naphcon-a、rev-eyesなど)、潤滑剤(bion tears、ラクリサート(lacrisert)、レスタシス(restasis)、tears naturale forte、tears naturale freeなど)、マスト細胞安定剤(アラマスト(alamast)など)、光線力学的治療用薬剤(photodynamic therapy agent)(ビスダイン(visudyne)など)、プロスタグランジン類(ルミガン(lumigan)、トラバタン(travatan)、キサラタン(xalatan)など)、交感神経模倣薬類の配合物(sympathomimetics & combinations)(アルファガン p(alphagan p)、naphcon-aなど)、血管収縮薬類(アルファガン p(alphagan p)、naphcon-aなど)、ビタミン類の配合物(vitamins & combinations)(catasod-ocuxtra/optigold/macutein, visuteinなど)、抗生物質類の配合物(antibiotics & combinations)(polytrim、トブラデクス(tobradex)など)、キノロン類(シロキサン(ciloxan)、クイクシン(quixin)、vigamox、zymarなど)、スルホンアミド類の配合物(sulfonamides & combinations)(blephamideなど)、縮瞳薬(rev-eyesなど)、非ステロイド系抗炎症薬(アキュラー(acular)、アキュラー ls(acular ls)、アキュラー pf(acular pf)、ボルタレン(voltaren)など)、ステロイド系抗炎症薬(blephamide、トブラデクス(tobradex)など)。
【0157】
本発明に係る流動性組成物、および/または、挿入物には、生体内で挿入物の基盤から生物学的薬剤を放出する速度を調整するための放出速度修正剤(release rate modification agent)、孔形成剤、生分解性の結晶化コントロール薬剤、可塑剤、浸出剤(leaching agents)、浸透促進剤、吸収変化剤、不透明化剤、および着色料のうちの一種類以上をさらに含めることができる。
【0158】
〔放出速度修正剤〕
速度修正剤、可塑剤、および浸出可能薬剤(leachable agents)を、生理活性薬剤の放出速度および基盤の柔軟性を調整するために加えることができる。既知の可塑剤、さらには、ポリマー系内で二次的な非共有結合(secondary pseudobonding)をするのに適した有機化合物は、柔軟性変化剤(pliability modifiers)および浸出剤として許容できる。一般にこれらの薬剤は、モノカルボン酸エステル類、ジカルボン酸エステル類、およびトリカルボン酸エステル類、ジオール類およびポリオール類、ポリエステル類、非イオン性界面活性剤類、脂肪酸類、脂肪酸エステル類、植物油などの油類などである。固体基盤中のこれらの薬剤の濃度は、基盤の全重量に対して最大で60wt%までの範囲とすることができ、好ましくは30wt%までであり、さらに好ましくは15wt%までである。一般に、これらの浸出剤、可塑剤、柔軟性変化剤およびその用途は、U.S. Pat. Nos. 5,702,716 および 5,447,725に記載されており、そこでの開示は、用いられるポリマーが本発明に係る生体適合性があり、生分解性で、熱可塑性ポリマーであるという条件の下で、参照することによって本明細書に含まれる。
【0159】
放出速度修正剤を、挿入物基盤が分解する速度、および/または、生体内で挿入物の基盤から生理活性薬剤を放出する速度を調整するために、流動性組成物に含めることがある。本発明に従って固体基盤中に組み込まれた速度修正剤の性質によって、速度修正剤が徐放速度を速める可能性も、遅らせる可能性もある。速度修正剤として加えるのに適した物質には、クエン酸ジメチル、クエン酸トリエチル、ヘプタン酸エチル(ethyl-heptanoate)、グリセリン、ヘキサンジオール、などが含まれる。
【0160】
生理活性薬剤を挿入物基盤(implant matrix)からコントロールリリースするためもしくは徐放するために、ポリマー溶液には放出速度修正剤が含まれることがある。本発明での開示を限定するものではないが、速度修正剤は、ポリマー挿入物の疎水性を変化させることによって生理活性薬剤が挿入物基盤から放出される速度を変更すると考えられる。
【0161】
放出速度修正剤の使用によって生理活性薬剤の放出を複数の桁の範囲で(例えば、1から10、100)減少させることも増加させることもでき、好ましくは、放出速度修正剤がない場合の固体基盤からの生理活性薬剤の放出と比較して10倍まで変化させる。ポリエチレングリコールのような親水性である放出速度修正剤は、生理活性薬剤の放出を増加させることがある。効果的な量の放出速度修正剤と組み合わせてポリマーの分子量を適切に選択することによって、放出速度、および、挿入物基盤からの生理活性薬剤の放出の範囲は、例えば比較的早いものから比較的遅いものまで様々であることがある。
【0162】
有用な放出速度修正剤には、例えば、水溶性の有機物質、水と混和性の有機物質、もしくは水に不溶な有機物質(すなわち、水と混和しない)が含まれ、水に不溶な物質が好ましい。
【0163】
放出速度修正剤は好ましくは、ポリマー分子との間の二次的な非共有結合(secondary valence bonding)のための相補的な分子として置換する有機化合物が好ましく、ポリマー分子が相互に横切る(slide past)能力と柔軟性を増大させる。このような有機化合物は、好ましくは、二次的な非共有結合(secondary valence bonding)に影響を及ぼすことができるように疎水的部分および親水的部分を含む。好ましくは、放出速度修正剤は、ポリマーの配合物、および、ポリマー溶液を処方するのに用いられた溶媒と適合性がある。さらに好ましくは、放出速度修正剤は、生物学薬剤的に許容される物質(biological agently-acceptable substance)である。
【0164】
有用な放出速度修正剤には、例えば、脂肪酸類、トリグリセリド類、その他の疎水性の化合物、有機溶媒、可塑剤、および、親水性化合物などが含まれる。適切な放出速度修正剤には、例えば、以下のようなものが含まれる。酢酸2-エトキシエチル(2-ethoxyethyl acetate)、酢酸メチル、酢酸エチル、フタル酸ジエチル、フタル酸ジメチル、フタル酸ジブチル、アジピン酸ジメチル、コハク酸ジメチル、シュウ酸ジメチル、クエン酸ジメチル(dimethyl citrate)、クエン酸トリエチル、クエン酸アセチルトリブチルエステル、クエン酸アセチルトリエチルエステル、三酢酸グリセリン、セバシン酸ジ(n-ブチル)(di(n-butyl) sebecate)などのような、モノカルボン酸のエステル、ジカルボン酸のエステル、および、トリカルボン酸のエステル、プロピレングリコール、ポリエチレングリコール、グリセリン、ソルビトール、などのような、ポリヒドロキシルアルコール類、脂肪酸、トリグリセリドのようなグリセリンのトリエステル、エポキシ化大豆油およびエポキシ化したその他の植物油、ゴマ油、大豆油、綿実油、アーモンド油、ヒマワリ油、およびピーナッツ油などの、その他の種子、花、果実、葉、もしくは植物または木の茎から得られる植物油、コレステロールのようなステロール類、(C6-C12)アルカノール類、2-エトキシエタノールなどのようなアルコール類。これらの放出速度修正剤は単独で用いられることもあるし、他のこれらの薬剤と組み合わせて用いられることもある。放出速度修正剤の好ましい配合物には、例えば、グリセリン/プロピレングリコール、ソルビトール/グリセリン、エチレンオキシド/プロピレンオキシド、ブチレングリコール/アジピン酸、などが含まれる。好ましい放出速度修正剤には、クエン酸ジメチル、クエン酸トリエチル、ヘプタン酸エチル、グリセリン、および、ヘキサンジオールが含まれる。
【0165】
ポリマー溶液に含まれる放出速度修正剤の量は、挿入物基盤からの生理活性薬剤の望ましい放出速度によって異なる。好ましくは、ポリマー溶液は約0.5〜15%、好ましくは約5〜10%の放出速度修正剤を含む。
【0166】
〔孔形成剤/添加剤〕
本発明に係る流動性組成物は、移植(implantation)、注入、もしくは、別の全体的または部分的な体内中の設置に用いることができる。組成物の生物学的活性物質の一つと本発明に係るポリマーは、均質の基盤を構成することがあるか、または、生物学的活性物質の一種は何らかの方法でポリマー中に封じ込められることがある。例えば、生物学的活性物質の一種は、まずミクロスフェアの中に封じ込められて、その後、少なくとも一部はミクロスフェア構造を維持したままポリマーと結合する。またあるいは、生物学的活性物質の一つは、本発明に係るポリマーの中で十分に混合することができないことがあり、溶解しているというよりむしろ、ポリマー中に小さな液滴が分散していることがある。いずれの形態も許容されるが、好ましくは、組成物が一様であるかどうかにかかわらず、少なくとも部分的にはポリマーが生分解されることによるエステル結合の加水分解に応じて、生体内で生物学的活性物質の放出速度の調整が維持される。
【0167】
添加剤(Additives)を、基盤の構造および生理活性薬剤の放出速度、もしくは体液への分散速度に影響する固体基盤の孔の大きさを、さらに調整しやすくするために加えることができる。例えば、流動性組成物が水媒体、水もしくは組織内殖(tissue ingrowth)の影響を受けなさ過ぎるときには、孔形成剤を基盤にさらに孔を作るために加えることができる。任意の生体適合性のある水溶性の物質を孔形成剤として用いることができる。このような添加剤は、流動性組成物に可溶である可能性も、単に流動性組成物中に分散している可能性もある。それらは、溶解、拡散、もしくは、分散させることができるため、ポリマー基盤が凝固するとすぐに、孔と微小孔性の導管(cannels)の両方が作られる。流動性組成物中の孔形成添加剤(必要であれば、このような孔形成剤を分散させる粒子)は直接的にポリマー基盤中の孔の大きさと数に影響する。
【0168】
孔形成添加剤は、十分に水および体液と混和性である、任意の生物学的薬剤として許容性のある有機物質もしくは無機物質を含み、構成もしくは構成された基盤から水媒体または体液に消えるか、あるいは、水に可溶な物質へと速く分解する水と混和性の物質である。均一な混合物となるように、孔形成剤が有機溶媒中に混和可能であるかもしくは分散可能であることが好ましい。好ましい孔形成剤には、例えば、スクロースおよびブドウ糖のような糖、塩化ナトリウムおよび炭酸ナトリウムのような塩、ヒドロキシプロピルセルロース、カルボキシメチルセルロース、ポリエチレングリコール、およびポリビニルピロリドンのようなポリマーが含まれる。孔の大きさと範囲は、分子量と流動性組成物中に含まれる孔形成添加物の割合を変化させることによって、広い範囲で変化させることができる。
【0169】
示したように、体液と接触させると溶媒と任意の孔形成添加剤が周囲の組織液(tissue fluids)の中に消える。これが、凝固したポリマー基盤の中に微小孔性の導管(microporous channels)を形成する原因である。オプションとして、孔形成添加剤は基盤から周囲の組織液の中へ有機溶媒よりも遅い速度で消えてもよく、基盤が生分解もしくは生体分解する時間にわたって基盤から放出されてもよい。好ましくは、例えば、組織再生サイト(tissue regeneration site)のバリアーシステム、薬剤もしくは薬を時限放出(timed-release)するなどの、挿入物の特定の目的を効果的に達成するための多孔度(porosity)および孔構造(pore structure)のある基盤が構成されるように、孔形成添加剤は埋め込まれた後の短い時間で凝固した挿入物基盤から消える。
【0170】
ポリマー基盤の多孔度は、ポリマー組成物中の溶媒および/または孔形成剤などの、水に可溶な成分もしくは水と混和する成分の濃度によって様々であることがある。例えば、流動性組成物中の水に可溶な物質の濃度が高いと、多孔度が高いポリマーが生成することがある。組成物中のポリマーに対する孔形成剤の濃度は、基盤中の孔形成、もしくは多孔度の程度を変化させるために、変化させてもよい。一般にはポリマー組成物は約0.01〜1グラムの孔形成剤をポリマー1グラム当たりに含む。
【0171】
挿入物の基盤中に形成される孔の大きさ、もしくは直径は、ポリマー基盤中の孔形成剤の大きさ、および/または、直径によって変更しても良い。例えば、対応する孔形成剤の直径を有する孔を形成させるために、比較的ポリマー混合物に溶けにくい孔形成剤を、粒子の大きさによっては選択的にポリマー組成物に含有させても良い。ポリマー混合物に可溶な孔形成剤を、ポリマー混合物ならびに凝縮したポリマー基盤および固体ポリマー基盤の中の孔形成剤の分散および/または凝集のパターンによって、挿入物基盤の孔の大きさと多孔度を変化させるために用いても良い。
【0172】
孔の直径および挿入物のポリマー基盤中での分布は、例えばポリマー基盤の横断面を走査型電子顕微鏡法で調査することによって、評価されることがある。ポリマー基盤の多孔度は、例えば、特定の重力と圧力の比較をする水銀圧入式ポロシメータ法(mercury intrusion porosimetry)、走査型電子顕微鏡写真(scanning electron microscopy photographs)による計算などの、当該分野において既知の適切な方法によって評価されることがある。追加的に、多孔度はポリマー組成物中に含まれる水に可溶な物質の割合もしくはパーセンテージから計算されることもある。例えば、約30%のポリマーと約70パーセントの溶媒および/またはその他の水溶性の成分を含んでいるポリマー組成物では、約70%の多孔度である挿入物ポリマー基盤が形成される。
【0173】
組成物の生物学的活性物質と本発明にかかるポリマーとは、一様な基盤を形成することがあり、生物学的活性物質は何らかの方法でポリマー中に封入されることもある。例えば、生物学的活性物質は最初にミクロスフェアの中に封入されて、その後少なくとも一部分はミクロスフェア構造を維持したままポリマーと結合する。またあるいは、生物学的活性物質は実質的に本発明に係るポリマーと十分に混合することができないことがあり、溶解しているというよりむしろ、ポリマー中に小さな液滴が分散していることがある。いずれの形態も許容されるが、好ましくは、組成物が一様であるかどうかにかかわらず、少なくとも部分的にはポリマーが生分解されることによるエステル結合の加水分解に応じて、生体内で生物学的活性物質の放出速度の調整が維持される。
【0174】
本発明に係るものは、哺乳類の体内に移植もしくは注入するために設計される。このような物が血管の豊富な組織に移植もしくは挿入されたときに最小限にしか組織を刺激しないということは特に重要である。医療デバイス構造(structural medical device)として、本発明に係るポリマー組成物は、十分に適用するための特殊な化学的性質、物理的性質、および機械的性質を有する物理的構成、および、生体内で毒性の残留物を残さずに分解する組成物を提供する。
【0175】
注入可能なポリマー溶液の中で構成された挿入物は生体内でゆっくりと生分解され、生体組織(natural tissue)が成長でき、挿入物が消滅して置き換わるという効果がある。注入可能な系から形成された挿入物は、その基盤の中に含まれている薬剤を、調整された速度で薬剤が使い果たされるまで放出する。ある薬剤では、ポリマーは薬剤が完全に放出されてしまってから分解する。ペプチド類、もしくは、タンパク質類などの他の薬剤では、拡散しない薬剤(non-diffusing drug)が体液にさらされるところまでポリマーが分解してからだけ、薬剤が完全に放出される。
【0176】
〔生分解性の結晶化コントロール薬剤〕
結晶化コントロール薬剤(crystallization-controlling agent)は任意にポリマー質量(polymer mass)の均一性、すなわち、骨やその他の組織に用いるための成形性、接着性(cohesion)および安定性といった望ましい物理的特性を有する均一なポリマー質量を得るための、実質的にポリマーの結晶部分が均一な分配、に作用させるためにポリマーに配合されることがある。結晶化コントロール薬剤は、例えば、炭酸カルシウム、もしくはリン酸カルシウムなどの無機塩、ポリ(ビニルアルコール) 、デンプンもしくはデキストランなどのポリマー、および、その他の同様の物質などの、分散した固体粒子の形で組成物中に存在することがある。その他の有用な結晶化コントロール薬剤は調合工程(compounding process)の間にポリマーに溶解するものか、それとも、融解されたポリマーに可溶なものがある。これらの物質の例として、パルミチン酸グリセリン、もしくは、乳酸エチルなどの低分子量の有機化合物、ポリ(エチレングリコール) もしくは、ポリ(ラクチド-co-カプロラクトン)などのポリマーおよびその他の同様の物質が含まれる。結晶化コントロール薬剤を含む組成物の処方は、約40〜95wt%、好ましくは約60〜90wt%のポリマーと、約5〜60wt%、好ましくは約10〜40wt%の結晶化コントロール薬剤を含む。
【0177】
本発明に係る組成物に用いるのに適している結晶化コントロール薬剤は、融解された組成物の中でも固体粒子のままであるものと、融解された組成物中に融解もしくは溶解するものとの、2つの種類に分けられることがある。
【0178】
組成物の中でも固体粒子もしくは賦形剤(fillers)として維持される結晶化コントロール薬剤には、無機塩類もしくは有機塩類、およびポリマー類が含まれる。適切な無機塩類には、例えば炭酸カルシウム、ヒドロキシアパタイト、リン酸カルシウム、カルシウムアパタイト、硫酸カルシウム、炭酸水素カルシウム、塩化カルシウム、炭酸ナトリウム、炭酸水素ナトリウム、塩化ナトリウムなどの塩類が含まれる。適切な有機塩類には、例えば、ステアリン酸カルシウム、パルミチン酸カルシウム、ステアリン酸ナトリウム、その他のC10-C50の脂肪酸誘導体の金属塩類、などの塩が含まれる。分散した粒子もしくは賦形剤(fillers)として維持されるものとして組成物の中で用いるのに適しているポリマーには、例えば、多糖類、セルロース誘導体、およびポリ(ビニルアルコール) が含まれる。適切な多糖類には、例えば、デキストラン、マルトデキストリン、トウモロコシ、コムギ、米などに由来するデンプン類、デンプングリコール酸ナトリウム(sodium starch glycolate)などのデンプン誘導体が含まれる。適切なセルロース誘導体には例えば、カルボキシメチルセルロースナトリウム、架橋カルボシキメチルセルロースナトリウム(crosslinked sodium carboxymethyl cellulose)、カルボキシメチルセルロース、ヒドロキシメチルセルロース、などが含まれる。適切なポリ(ビニルアルコール)類には、分子量が約5000〜20000、好ましくは約10000〜15000で、加水分解の割合が約80〜100%であるものである。
【0179】
調合工程中に融解された組成物中に融解もしくは溶解する結晶化コントロール薬剤もまた、本発明に係るポリマー組成物に用いられることがある。これらの組成物は冷却している間にいくらか相分離(phase separation)をしても良いし、相分離しなくても良い。この種類の結晶化コントロール薬剤には低分子量の有機化合物およびポリマーが含まれる。適切な低分子量の有機化合物には、例えば、グリセリン、パルミチン酸(palmitate)、ステアリン酸グリセリンおよびその他の同様のグリセリン誘導体、クエン酸トリエチルおよびその他の同様のクエン酸誘導体、乳酸エチル、およびその他のエステル類、などが含まれる。
【0180】
結晶化コントロール薬剤は、成型可能な硬さおよび/または塗抹可能な硬さになるようにポリマーを軟化させるために効果的な量だけ、組成物中に含まれる。好ましくは、結晶化コントロール薬剤は溶媒ではなく固形の物質である。結晶化コントロール薬剤は、組成物中に単独で含ませても、他の結晶化コントロール薬剤との配合で含ませても良い。好ましい配合物の例には、ポリ(ラクチド-co-カプロラクトン) およびステアリン酸カルシウムなどの薬剤がある。
【0181】
〔浸透促進剤〕
組成物は、浸透促進剤(penetration enhancer)が含まれていない組成物に比べて、身体組織への生物学的薬剤の浸透、および、身体組織を通過する生物学的薬剤の浸透を効果的に促進する浸透促進剤をさらに含むことがある。浸透促進剤は、一般に任意の浸透促進剤であることがあるが、好ましくはオレイン酸、オレイルアルコール(oleyl alcohol)、エトキシジグリコール、ラウロカプラム、アルカンカルボン酸類(alkanecarboxylic acid)、ジメチルスルホキシド、極性脂質類(polar lipids)、もしくは、N-メチル-2-ピロリドンであり、さらに好ましくは、オレイン酸もしくはオレイルアルコールである。浸透促進剤は流動性組成物中に任意の適切な量(例えば、約1wt.%から約10wt.%の間など)を存在させることができる。
【0182】
〔吸収変化剤〕
任意の適切で適当な吸収変化剤(absorption altering agent)を本発明に用いることができる。例えば、吸収変化剤は、プロピレングリコール、グリセリン、尿素、ジエチルセバシン酸ナトリウム(diethyl sebecate sodium)、ラウリル硫酸、ラウリル硫酸ナトリウム、ソルビタンエトキシレート類(sorbitan ethoxylates)、オレイン酸、カルボン酸ピロリドンエステル類(pyrrolidone carboxylate esters)、N-メチルピロリドン、N,N-ジメチル-m-トルマイド(N,N-diethyl-m-tolumide)、ジメチルスルホキシド、アルキルメチルスルホキシド、およびこれらの混合物の群から選択することができる。
【0183】
〔不透明化剤〕
任意の適切で適当な不透明化剤(opacification agent)を本発明に用いることができる。例えば、不透明化剤は、バリウム、ヨウ素、カルシウム、およびこれらの混合物の群から選択することができる。
【0184】
〔着色料〕
着色料(colorant)もまた、多孔性の薄膜が分解する時間に渡って生分解性もしくは生物分解性をモニターすることができるだけの、適切な量だけ液体組成物に加えることができる。適切で適当な着色料は、毒性がなく、刺激性がなく、液体組成物の溶媒と反応しないものである。FDAによって化粧品、食品および医薬品に用いることが承認されている着色料には、黄色201号(D & C Yellow No. 7)、赤色225号(D & C Red No. 17)、赤色202号、赤色204号、および赤色220号(D & C Red No. 7, 9, and 34)、赤色504号(FD & C Red No. 4)、橙色205号(Orange D & C No. 4)、青色2号(FD & C Blue 2)、緑色3号(FD & C Green No. 3)などが含まれる。
【0185】
〔成形性挿入物前駆物質〕
流動性組成物は、U.S. Pat. No. 5,487,897に開示した技術に従って、水もしくは食塩水などの水媒体と接触させることによってか、または、血漿、リンパ液、などの体液と接触させることによって、成形性挿入物前駆物質(moldable implant precursor)とすることができる。U.S. Pat. No. 5,487,897の開示は、'897特許の可塑性ポリマーの規格が本明細書に記載したような生体適合性、生分解性の熱可塑性ポリマーであるときは、参照することによって本明細書に含まれる。
【0186】
つまり、'897特許で開示された技術で、生理活性薬剤を含む流動性組成物、もしくは生物学的薬剤を含まない流動性組成物を、外側の液嚢(outer sac)と流動性含有物の2つの部分からなる構造に変換することができる。この技術は、生物学的薬剤系の量などの限られた量の水媒体について、系の外側の表面だけを固体に変換して流動性含有物を内側に有する液嚢を形成するために適用できる。挿入物前駆物質の流動性含有物の硬さは、水っぽいものから粘度の高いものまでの範囲であることがある。外側の液嚢は、ゲル状から、変化しやすい硬さ、成形可能(moldable)、ワックス状までの範囲であることがある。結果として得られたデバイス、もしくは挿入物前駆物質は、その後、挿入サイトに適用しても良い。挿入に際して、溶媒が挿入物前駆物質から周囲の組織液へと拡散して、固体ポリマー基盤を有する挿入物を形成する。好ましくは、挿入後約0.5〜4時間で、好ましくは挿入後約1〜3時間で、好ましくは挿入後2時間以内で、挿入物前駆物質は生体内原位置で固体基盤へと固化する。従って、体内の挿入サイトに設置したとき、挿入物前駆物質は、いずれは固体の多孔性基盤構造へと凝固する。
【0187】
〔多孔性構造〕
生体内原位置で形成された挿入物、挿入物、挿入可能物(implantable articles)、生分解可能物(biodegradable articles)、および、本発明に係るデバイスなどの固体基盤の多孔性構造(porous structure)は、有機溶媒および熱可塑性ポリマーの性質に影響され、それらの水、水媒体、もしくは体液への溶解度(それぞれの媒体によって異なることがある)によっても、また、添加物(孔形成成分など)の存在によっても影響される。多孔性構造はいくつかのメカニズム、および、それらの組み合わせによって生ずると考えられる。流動性組成物の外の隣接した流体への、溶媒の散逸(dissipation)、放出(disbursement)もしくは拡散がポリマー基盤の孔導管(pore channels)を含む孔を作ることがある。流動性組成物への水媒体、水、もしくは体液の注入(infusion)もまた起こり、それも孔形成の原因の一部である。一般に、多孔性構造は流動性組成物から挿入物、物品などに変換する間に形成されると考えられる。この過程の間では、前述のとおり、流動性組成物中の有機溶媒と熱可塑性ポリマーの分配により熱可塑性ポリマーが多い部分と少ない部分ができると考えられる。この分配の結果、水の浸入と溶媒の散逸の動的相互作用が起こると考えられる。注入には水媒体、水、もしくは体液の流動性組成物中への移動も含まれ、散逸には有機溶媒が流動性組成物の周囲の媒体へと移動することも含まれる。流動性組成物の熱可塑性ポリマーが少ない領域は、溶媒と水の混合物、水媒体、もしくは体液に浸入される。これらの領域がいずれは挿入物、物品などの多孔性網状組織(porous network)になると考えられる。
【0188】
典型的には、固体基盤の巨視的構造には、芯(core)と皮膜(skin)が含まれる。典型的には、芯と被膜が微小孔性であるが、後述するように別の孔形成剤を用いない限り、被膜の孔は芯の孔の大きさに比べて小さい。好ましくは、固体基盤の外側の被膜部分の穴の直径は、内側の芯部分の孔の直径の大きさに比べて著しく小さい。芯の孔は、好ましくは、実質的に一様であり、被膜は典型的には機能上、多孔性の性質の芯と比較すると、多孔性ではないものである。挿入物、物品、デバイスなどの孔の大きさは、約4〜1000ミクロンの範囲で、好ましくは被膜層の孔の大きさは約1〜500ミクロンである。このような基盤の多孔度は、U.S. Pat. No. 5,324,519に開示されており、参照することによって本明細書に含まれる。
【0189】
固体の微小孔性の挿入物、物品、デバイスなどは、固体の体積の割合として計算すると5〜95%の範囲の多孔度を有する。多孔度の進行は少なくとも部分的には、有機溶媒および熱可塑性ポリマーの水への溶解度に支配されている。有機溶媒の水への溶解度が高く、ポリマーの水への溶解度がとても低いか、不溶である場合には、実質的に多孔度が高くなりし、典型的には30〜95%程度になる。有機溶媒の水への溶解度が低く、ポリマーの水への溶解度がとても低いか、不溶である場合には、多孔度は低くなり、典型的には5〜40%程度になる。多孔度の程度は部分的には、流動性組成物が水媒体などに接触したときのポリマー-溶媒の分配によって調整される。多孔度の調節は、本発明によって異なる種類の生分解可能物、挿入物、および、デバイスを作るのに有益である。例えば、強度が物品、挿入物、もしくは、デバイスなどに要求される場合には、多孔度を低くするのが有効であることがある。
【0190】
〔固体生分解可能物〕
生分解可能薬剤送達製品(biodegradable drug delivery products)は水、水媒体、もしくは、体液を固体化の原因として用いている変換方法によって調製することができる。一般に、これらの製品は生体外で固体基盤である。生体外での固体基盤が特殊な形状をしている場合には、前述の成形性挿入物質前駆物質についての方法に従って、流動性組成物を適当な鋳型にいれて変換することができる。前駆物質が形成された後、変換を完了させるために、前駆物質を追加的に水媒体に接触されることができる。またあるいは、流動性組成物を、水媒体を透過させる密閉金型(closed mold)に入れて、金型と組成物を水浴(aqueous bath)に沈めるなどして水媒体と接触させることができる。この場合には、好ましくは、流動性組成物は中間から高い粘度を有するものである。
【0191】
マイクロカプセル類、および、微小粒子類は既知の方法で調製することができる。つまり、マイクロカプセルの調製には、流動性組成物中で生理活性薬剤-キャリアーのミセル(bioactive agent-carrier micelles)のエマルジョン形成することを含む。ここで、キャリアーは、本発明に係る、生体適合性で、生分解性で、分岐した熱可塑性ポリマーの非溶剤(nonsolvent)である。ミセルは濾過され、水媒体中で懸濁させる。ミセルの表面の流動性組成物のコーティングは、その後、固体化して多孔性のマイクロカプセルを形成する。微小粒子も同様の方法で形成される。流動性組成物と生理活性薬剤の混合物を一滴ずつ、スプレー式、ドリップ式、エアロゾル化、もしくは、その他の同様の技術で、流動性組成物の非溶剤(nonsolvent)に加える。望ましい大きさと形の多孔性の微小粒子を調製するために、液滴の大きさと形が調整される。シート、薄膜、および、膜は、流動性組成物を適切な非溶剤に入れることによって調製でき、変換をさせることができる。同様に、スプレーもしくは、エアロゾル化したときに、液滴よりもむしろ糸状のものが生成するように、流動性組成物の粘度を調整することができる。流動性組成物用のフィラメント状骨格(filamentous scaffold)、もしくは、膜を構成するために、これらの糸状物を非溶剤に入れることができる。また、縫合材料もしくはその他の同様の材料も流動性組成物を非溶媒中で成型することによって作ることができる。成型開口部(extrusion orifice)は押し出される生産物の大きさと形を調節する。これらの生体外での固体基盤の生成をするための技術は、 U.S. Pat. Nos. 4,652,441、4,917,893、4,954,298、5,061,492、5,330,767、5,476,663、5,575,987、5,480,656、5,643,607、5,631,020、5,631,021、5,651,990 に記載されており、そこでの開示は、用いられるポリマーが本発明に係る生体適合性があり、生分解性で、熱可塑性ポリマーであるという条件の下で参照することによって本明細書に含まれる。
【0192】
これらの生体外の固体基盤は、それらの既知の機能に応じて用いられる。追加的に、挿入物、および、その他の固体物品は、切開術もしくはトロカール(trocar)のような既知の技術を用いて体内に挿入できる。
【0193】
本発明は挿入物もまた提供する。挿入物は、少なくとも実質的に水媒体、水、もしくは体液に溶解しない生分解性の、生体適合性がある、熱可塑性のポリマー、ならびに、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを含む。挿入物は固体もしくはゼラチン状の微孔性の基盤を有し、ここで、その基盤は被膜(skin)で囲まれた芯(core)である。挿入物は標準温度および圧力で熱可塑性ポリマーが可溶な、生体適合性のある有機液体をさらに含む可能性がある。生体適合性のある有機液体の量は、存在する場合には、組成物の約0wt.%〜約20wt.%などのように、少ないほうが好ましい。さらに、生体適合性のある有機液体の量は、時間と共に減少するのが好ましい。芯は、好ましくは、直径が約1ミクロンから約1000ミクロンの孔を含む。被膜は、好ましくは、芯の孔の直径よりも小さな直径の孔を含む。さらに、その被膜の孔は、好ましくは、被膜が芯と比較して機能的に多孔性でなくなるような大きさである。挿入物は任意の好ましい形、および、好ましい形状とすることができる。例えば、挿入物は固体、半固体(semi-solid)、ワックス状、粘度が高いもの、もしくはゼラチン状の挿入物とすることができる。
【0194】
本明細書中で、「処置」("treat" もしくは "treating")の語は、(i) 病理学上の症状(固形腫瘍など)が発祥することを防ぐこと(予防など)、(ii) 病理学上の症状(固形腫瘍など)を防ぐこと、もしくは、その進行を止めること、または、(iii) 病理学上の症状を緩和すること(固形腫瘍に関連する兆候を緩和するなど)を指す。
【0195】
「代謝産物」("Metabolite")は、本発明にかかる活性親薬剤(active parent drug)、もしくは、その他の処方、または、化合物を哺乳類の被験者に投与したときに、生きている細胞が、本発明にかかる活性親薬剤、もしくは、その他の処方、または、化合物と生体内で相互作用したときの生化学的プロセス結果として生じる物質のことを指す。代謝産物には任意の代謝経路からの生成物、もしくは、中間体を含む。
【0196】
「代謝経路」("Metabolic pathway")は、ある物質が他の物質へと変換される、酵素が介在している反応の順番のことを指し、中間体や細胞機能のためのエネルギーが提供される。代謝経路は、サイクルでない可能性(linear)も、サイクルである可能性(cyclic)もある。
【0197】
「治療上有効量」("Therapeutically effective amount")は、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグの本発明に有用な量、あるいは、例えば、内在する疾病もしくは疾患を処置もしくは予防するため、または、宿主の内在する疾病もしくは疾患に関連する徴候を処置するためなどの、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグの配合物の量のことを意図している。生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグの配合物は、好ましくは、相乗的組み合わせ(synergistic combination)である。相乗作用は、Chou and Talalay, Adv. Enzyme Regul. 22:27-55 (1984) に記載されているように、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグの複数のものを配合物として投与したときの効果が、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを個々の薬剤として単独で投与した場合の効果を足し合わせたものに比べて大きいことである。一般に、相乗作用は、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグの最適濃度以下で最も大きく現れる。相乗効果によって細胞障害性の低下し、活性が増加し、もしくは、配合物を個々の成分と比較したときのある他の種類の有益な効果が増大する可能性がある。
【0198】
本明細書中では、「生物学的薬剤として許容される塩」("biological agently acceptable salts")は、親化合物が修飾されてその酸もしくは塩基の塩を形成しているものを指す。生物学的薬剤として許容される塩の例には、アミン類などの塩基性残基と鉱酸もしくは有機酸の塩、カルボン酸類などの酸性残基とのアルカリの塩もしくは有機塩などが含まれるが、それらに限定されるわけではない。生物学的薬剤として許容される塩には、従来からの毒性の無い塩や、例えば毒性の無い無機酸もしくは有機酸などの、親化合物の四級アンモニウム塩が含まれる。例えば、従来からの毒性の無い塩には、無機酸(塩酸、臭化水素酸、硫酸、スルファミン酸、リン酸、硝酸など)から誘導された塩、有機酸(酢酸、プロピオン酸、コハク酸、グリコール酸、ステアリン酸、乳酸、リンゴ酸、酒石酸、クエン酸、アスコルビン酸、パモン酸、マレイン酸、ヒドロキシマレイン酸、フェニル酢酸、グルタミン酸、安息香酸、サリチル酸、スルファニル酸、2-アセトキシ安息香酸、フマル酸、トルエンスルホン酸、メタンスルホン酸、エタンジスルホン酸、シュウ酸、イセチオン酸、など)から調製された塩などが含まれる。特に、生物学的薬剤として許容される塩は、哺乳類の体内に天然に含まれているこれらの塩も含む可能性がある。
【0199】
本発明に有用な生物学的薬剤として許容される塩は、塩基性部分もしくは酸性部分を有している親化合物から従来の化学技術によって合成することができる。一般にこれらの塩は、これらの塩を生成する遊離の酸もしくは塩基を、化学量論的な量の適切な塩基もしくは酸と、水中または有機溶媒中あるいは二種類の混合物中で反応させることによって調製できる。一般には、エーテル、酢酸エチル、エタノール、イソピロピルアルコール、もしくは、アセトニトリルなどの非水溶媒系が好ましい。適切な塩のリストは、Remington's Biological agent Sciences, 17th ed., Mack Publishing Company, Easton, PA, 1985, p. 1418 の中に見つけることができ、参照によって本明細書に含まれる。
【0200】
本明細書中では「生物学的薬剤として許容される」("biological agently acceptable")の語は、ヒトや動物の組織に接触させるのに用いるのに適していて、過剰な毒性、刺激、アレルギー反応、もしくはその他の問題起こさないか、または、効能/危険の割合が相応の副作用を有すると医学的判断の下で思われる範囲の化合物(化学療法薬など)である。
【0201】
〔生物学的薬剤キット〕
本発明は生物学的薬剤キット(biological agent kits)を提供する。このようなキットは生体内原位置で、体内で生分解性の挿入物を形成させるのに適している。キットには流動性組成物を含む第一の容器を含めることができる。その組成物には、少なくとも実質的に水媒体、水、もしくは体液に溶解しない生分解性の、生体適合性がある、熱可塑性のポリマー、ならびに、標準温度および圧力で熱可塑性ポリマーが可溶な、生体適合性のある有機液体を含めることができる。キットには、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを含む第二の容器も含めることができる。生物学的薬剤キットには、オプションとして、生物学的薬剤キットの組み立て、および/または、使用をするための説明書もしくは解説書(printed indicia)さらに含めることができる。
【0202】
具体的には、第一の容器はシリンジもしくはカテーテルを含む可能性があり、第二の容器は、独立に、シリンジもしくはカテーテルを含む可能性がある。追加的に、第一の容器が注射器を含む可能性があり、第二の容器が注射器を含む可能性があり、両方の注射器が直接互いに結合されたものを形作っている可能性がある。
【0203】
〔具体的な範囲、値および実施例〕
本発明のある具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、ラクチド類、グリコリド類、カプロラクトン類、グリセリド類、無水物類(anhydrides)、アミド類、ウレタン類、エステルアミド類、オルトエステル類、ジオキサノン類、アセタール類、ケタール類、カーボネート類(carbonates)、ホスファゼン類、ヒドロキシ酪酸類(hydroxybutyrates)、ヒドロキシ吉草酸類(hydroxyvalerates)、アルキレンシュウ酸類(alkylene oxalates)、アルキレンコハク酸類(alkylene succinates)、アミノ酸類、および、それらの任意の結合物のグループから選択された単量体単位を含む構造を有する可能性があり、その構造は前記単量体単位を無秩序にもしくはブロック単位で含む。
【0204】
本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、ラクチド単量体単位、カプロラクトン単量体単位、グリコリド単量体単位、もしくはそれらの任意の結合物のポリマーもしくはコポリマーである可能性がある。
【0205】
本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、ポリラクチド類、ポリグリコリド類、ポリカプロラクトン類、ポリジオキサノン類、ポリカーボネート類(polycarbonates)、ポリヒドロキシ酪酸類(polyhydroxybutyrates)、ポリアルキレンシュウ酸類(polyalkyene oxalates)、ポリ無水物類(polyanhydrides)、ポリアミド類、ポリエステルアミド類、ポリウレタン類、ポリアセタール類、ポリケタール類、ポリオルトカーボネート類(polyorthocarbonates)、ポリホスファゼン類(polyphosphazenes)、ポリヒドロキシ吉草酸類(polyhydroxyvalerates)、ポリアルキレンコハク酸類(polyalkylene succinates)、ポリ(リンゴ酸)、ポリ(アミノ酸類)、キチン、キトサン、ポリオルトエステル類(polyorthoesters)、ポリ(メチルビニルエーテル)、ポリエステル類、ポリアルキルグリコール類、それらのコポリマー、それらのブロックコポリマー、それらのターポリマー、それらの結合物(combinations)、およびそれらの混合物のグループから選択されたポリマーを含む可能性がある。
【0206】
本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、少なくとも一つのポリエステルを含む可能性がある。
【0207】
本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、ポリラクチド、ポリグリコリド、ポリカプロラクトン、それらのコポリマー、それらのターポリマー、それらの結合物の少なくとも一つである可能性がある。
【0208】
本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、ポリ(DL-ラクチド-co-グリコリド) である可能性がある。本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、末端にカルボキシ基を有するポリ(DL-ラクチド-co-グリコリド) である可能性がある。本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、末端にカルボキシ基を有さないポリ(DL-ラクチド-co-グリコリド) である可能性がある。本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、末端にカルボキシ基を有する、50/50のポリ(DL-ラクチド-co-グリコリド) である可能性がある。本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、末端にカルボキシ基を有さない、75/25のポリ(DL-ラクチド-co-グリコリド) である可能性がある。
【0209】
本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、最高で前記組成物の約80wt.%まで存在する可能性がある。本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、前記組成物の約10wt.%以上存在する可能性がある。本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、前記組成物の約10wt.%から約80wt.%まで存在する可能性がある。本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、前記組成物の約30wt.%から約50wt.%まで存在する可能性がある。
【0210】
本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーの平均分子量が約15,000以上である可能性がある。本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーの平均分子量が最高で約45,000である可能性がある。本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーの平均分子量が約15,000から約45,000である可能性がある。
【0211】
本発明のある具体的な実施例では、生体適合性のある有機液体の水への溶解度が、いかなる比率でも完全に不溶から、全ての比率において完全に可溶まで変動する可能性がある。本発明の他の具体的な実施例では、生体適合性のある有機液体が、水には完全に不溶であるが体液中には拡散する可能性がある。本発明の他の具体的な実施例では、生体適合性のある有機液体が、少なくとも部分的に水溶性である可能性がある。本発明の他の具体的な実施例では、生体適合性のある有機液体が、完全に水溶性である可能性がある。本発明の他の具体的な実施例では、生体適合性のある有機液体が、水媒体、水、もしくは、体液の中に分散する可能性がある。
【0212】
本発明の他の具体的な実施例では、生体適合性のある有機液体が、極性プロトン性の液体である可能性がある。本発明の他の具体的な実施例では、生体適合性のある有機液体が、極性非プロトン性の液体である可能性がある。
【0213】
本発明の他の具体的な実施例では、生体適合性のある有機液体が、外界温度および生理学的温度において液体であり、アルコール類、ケトン類、エーテル類、アミド類、アミン類、アルキルアミン類、エステル類、カーボネート類、スルホキシド類、スルホン類、およびスルホン酸塩類(sulfonates)の群から選択された官能基を少なくとも一つ含む、環状有機化合物、脂肪族有機化合物、直鎖脂肪族有機化合物、分枝脂肪族有機化合物もしくは芳香族系有機化合物である可能性がある。
【0214】
本発明の他の具体的な実施例では、生体適合性のある有機液体が、置換複素環化合物、炭酸(carbonic acid)とアルキルアルコール類(alkyl alcohols)のエステル類、モノカルボン酸類のアルキルエステル類、モノカルボン酸類のアリールエステル類、モノカルボン酸類のアラルキルエステル類、ジカルボン酸類のアルキルエステル類、ジカルボン酸類のアリールエステル類、ジカルボン酸類のアラルキルエステル類、トリカルボン酸類のアルキルエステル類、トリカルボン酸類のアリールエステル類、トリカルボン酸類のアラルキルエステル類、アルキルケトン類、アリールケトン類、アラルキルケトン類、アルコール類、ポリアルコール類、アルキルアミド類、ジアルキルアミド類、アルキルスルホキシド類、ジアルキルスルホキシド類、アルキルスルホン類、ジアルキルスルホン類、ラクトン類、環状アルキルアミド類、環状アルキルアミン類、芳香族アミド類、芳香族アミン類、それらの混合物、およびそれらの結合物の群から選択される可能性がある。
【0215】
本発明の他の具体的な実施例では、生体適合性のある有機液体が、N-メチル-2-ピロリドン、2-ピロリドン、(C2-C8)脂肪族アルコール、グリセリン、テトラグリコール、グリセロールフォーマル(glycerol formal)、2,2-ジメチル-1,3-ジオキソロン-4-メタノール、酢酸エチル、乳酸エチル、酪酸エチル、マロン酸ジブチル、クエン酸トリブチル、アセチルクエン酸トリ-n-ヘキシルエステル(tri-n-hexyl acetylcitrate)、コハク酸ジエチル、グルタル酸ジエチル、マロン酸ジエチル、クエン酸トリエチル、トリアセチン、トリブチリン、炭酸ジエチル(diethyl carbonate)、プロピレンカーボネート(propylene carbonate)、アセトン、メチルエチルケトン、ジメチルアセトアミド、ジメチルホルムアミド、カプロラクタム、ジメチルスルホキシド、ジメチルスルホン、テトラヒドロフラン、カプロラクタム、N,N-ジエチル-m-トルアミド、1-ドデシルアザシクロヘプタン-2-オン、1,3-ジメチル-3,4,5,6-テトラヒドロ-2-(1H)-ピリミジノン、安息香酸ベンジル、および、それらの結合物の群から選択される可能性がある。
【0216】
本発明の他の具体的な実施例では、生体適合性のある有機液体が、約30から約500の範囲の分子量を有する可能性がある。
【0217】
本発明の他の具体的な実施例では、生体適合性のある有機液体が、N-メチル-2-ピロリドン、2-ピロリドン、N,N-ジメチルホルムアミド、ジメチルスルホキシド、プロピレンカーボネート、カプロラクタム、トリアセチン、および、それらの任意の結合物である可能性がある。本発明の他の具体的な実施例では、生体適合性のある有機液体が、N-メチル-2-ピロリドンである可能性がある。
【0218】
本発明の他の具体的な実施例では、生体適合性の液体が、前記組成物の約40wt.%以上存在する可能性がある。本発明の他の具体的な実施例では、生体適合性の液体が、最高で前記組成物の約80wt.%まで存在する可能性がある。本発明の他の具体的な実施例では、生体適合性の液体が、前記組成物の約50wt.%から約70wt.%まで存在する可能性がある。
【0219】
〔実施例〕
〈 ATRIGEL(登録商標)送達システムを用いた眼部への徐放製剤 〉
[ATRIGEL(登録商標)薬剤送達システムの概論]
QLT社(QLT, Inc.)の子会社であるQLT USA社(QLT USA)は、小さな分子、ペプチド類、およびタンパク質類を徐放するための、液体の生分解性薬剤送達システム(アトリゲル(ATRIGEL(登録商標)))を開発した。この送達システムは、ラクチド/グリコリド・コポリマーなどの生体適合性の溶媒類に溶解する生分解性のポリマー類から構成される。薬剤はこの溶液中に含まれており、得られた混合物を通常のシリンジおよび針を使って皮下に注入する。体液と接触すると、ATRIGEL(登録商標)送達システムは固化し、薬剤を固体基盤内に捕捉する。薬剤はあらかじめ定められた速度で挿入物が生分解するに従って放出される。
【0220】
ATRIGEL(登録商標)送達システムを用いて、アトリックス社(Atrix)は、小さな分子から組み換えバイオ医薬品に至るまでの様々な薬剤を、一週間から6ヶ月に至るまで多様な薬剤送達持続時間で送達した。現在、アトリックス社(Atrix)は、デンタルケア製品(ATRIDOX(登録商標)、ATRISORB(登録商標)、およびATRISORB(登録商標)-D)および、薬学的製品((ELIGARD(登録商標) 7.5 mg、ELIGARD(登録商標) 22.5 mg、 およびELIGARD(登録商標)30 mg)を含む、ATRIGEL(登録商標)送達システムを用いたFDAの承認を受けた多くの商品を市場に出しており、いくつかの商品は臨床試験中である。
【0221】
[ATRIGEL(登録商標)送達システムの利点]
ATRIGEL(登録商標)送達システムは、他の非経口の徐放性送達システムよりも多数の明確な利点を提供する。例えば、ミクロスフェアは、ハロゲン化した溶媒の使用を含むことがある無菌プロセスを用いて製造する必要がある。その上、薬剤のミクロスフェアの割合はカプセル封入の効率性によって調節される。これは薬物製品の製造過程でのAPIのうちの25〜50%の回復不能な損失が生ずる可能性があるプロセスである。それに比べて、ATRIGEL(登録商標)送達システムは生体適合性のある含有物から構成され、適切な生分解性ポリマーを生体適合性のある溶媒に溶解して調製される。ミクロスフェアと異なり、ATRIGEL(登録商標)送達システムではγ線照射を含む従来技術を用いて最終的に滅菌することができる。この独創的な製造プロセスと独自開発された製品態様(proprietary product configuration)は、本質的に製造過程での薬物の損失を解消する。さらにATRIGEL(登録商標)送達システムでは、ミクロスフェアで少ない投薬量でも大きな体積を注入するのに比べて、大きい投薬量のAPIを小さな注入体積で送達することができる。一番重要なことには、ATRIGEL(登録商標)持続性薬剤(depot)は、感度の良い(sensitive)バイオ医薬品が生体内で分解および酵素による不活性化するのを防ぐ。
【0222】
ATRIGEL(登録商標)技術は、他の挿入できないものや貯蔵装置(reservoir devices)に比べて患者に優しい送達基盤(delivery platform)である。ATRIGEL(登録商標)薬剤製品は、皮下に挿入され、挿入物は所定の期間にわたって薬剤を放出する。典型的には、その挿入物は薬剤が放出されるのと同じ速度で分解されるため、挿入サイトは原則的には次の挿入時には消散する。それに比較して、機械的な挿入物(mechanical implants)は薬剤を使い果たした後には、外科的に取り除いて埋めなおすか、もしくは詰め替える必要がある。
【0223】
眼に生物学的薬剤を投与するのに用いるときに、ATRIGEL(登録商標)送達システムを、効果的および適切な量の物質の眼や周囲の器官への刺激の発生および/または程度を下げるために用いる。
【0224】
[実施例1]
{眼内注射の後のATRIGEL(登録商標)送達システムの許容性}
一連の臨床前検査は眼内注射の後のATRIGEL(登録商標)送達システムの許容性を決定するために行われた。これらの検査ではニュージーランドシロウサギ(New Zealand White rabbit)に3つのATRIGEL(登録商標)媒体のうちの一つを注射した。注射は直接眼の中に(硝子体内注射)、結膜の下に(結膜下注射)、もしくは、眼球の後ろの筋肉と神経を覆っている膜を通して(テノン嚢下注射(subtenon injection))行った。ウサギは、局所反応と視力(ocular acuity)について28日間にわたって定期的に観察された。さらに、それぞれのATRIGEL(登録商標)媒体の細胞病理学的影響(cytopathological affect)を評価するために硝子体液が試料採取された。
【0225】
いかなる眼内投与でも予想されるとおり、全てのATRIGEL(登録商標)溶液について軽い結膜充血が見られた。しかしながら、この過渡応答は72時間以内に消えた。眼圧および視力(visual acuity)は、検査中に変化しなかった。硝子体液の細胞病理学的評価についは、投与後3日目、14日目および28日目に行った白血球数(white blood cell count)(WBCs)およびタンパク質レベルは全て正常であった。さらに、投与後のいつにおいても処置されたいずれの目にも、炎症、または、異型細胞、もしくは、感染病原体は見られなかった。
【0226】
これらの結果は、ATRIGEL(登録商標)送達システムが良く許容性を有することを示し、眼内注射の後に、不活性であることも表している。実際、ATRIGEL(登録商標)薬剤製品はある種の薬剤の局所反応を弱めることがある。例えば、その後の検査で、ATRIGEL(登録商標)媒体を既知の眼部刺激物質(塩化ベンゼトニウム)と混合して調製した処方の許容性を、同じ物質の水溶液の許容性と比較した。刺激物質を単独で投与したときの巨視的観察と細胞病理学的評価では、硝子体内注射の一日後に、顕著な結膜の腫脹、重篤な水性紅斑および細胞紅斑(aqueous and cellular flare)、ならびに角膜の透明度のほぼ完全な喪失(almost complete loss of the transparency of the cornea)が見られた。しかしながら、ATRIGEL(登録商標)/刺激物質処方の場合には、同じ投薬期間中、軽い結膜の腫脹、中程度の水性紅斑および細胞紅斑が見られ、角膜は全く透明度が失われなかった。従って、ATRIGEL(登録商標)デポーの徐放性は敏感な眼部組織の刺激物質のレベルを抑え、それによっておそらく局所的有害事象を小さくしたことが示される。
【0227】
結論として、ATRIGEL(登録商標)送達システムは、治癒的薬剤を眼部へ持続性送達するのに適している。
【0228】
[実施例2]
PEG300、mPEG350、PEG400、NMP、トリアセチン、純粋なDMSO(neat DMSO)と同様のDMSO、および、BECの水溶液を含むいくつかのATRIGEL(登録商標)処方が、硝子体内かそれとも結膜下で、三日間にわたってウサギの眼で評価された。いくつかのATRIGEL(登録商標)処方、(特に、PEG300、mPEG350、PEG400、およびNMPを含む処方)は、いずれの投与経路を用いても短期間の眼部挿入物に適していることが見出された。従って、長時間の刺激検査(long-term irritation study)は、PEG300、mPEG350、およびNMPを含むATRIGEL(登録商標)の処方について、両方の投与経路を用いて行った。長時間の刺激検査の結果、予測どおりポリマーの生分解が起こり、これによって刺激が長引くことは無かった。従って、PEG300、mPEG350、およびNMPを含むATRIGEL(登録商標)処方は、硝子体内挿入および結膜下挿入用、さらには後の薬物送達用に許容される媒体であると考えられる。
【0229】
この検査の目的はATRIGEL(登録商標)送達システムの、眼部への徐放性薬物送達媒体としての実現可能性の評価をすることである。臨床的に許容される媒体および挿入技術を確認すること、ならびに、眼の機能の障害もしくは著しい組織反応(tissue reaction)の原因とならない挿入物を形成すること、という本検査の最終目的の下で、ATRIGEL(登録商標)媒体は眼部の様々な部位および眼部周辺の組織に挿入される。この予備調査が成功すれば、その後の企画で眼部への薬物送達評価がなされる。
【0230】
ウサギでの一連の臨床前検査では、一連のATRIGEL(登録商標)媒体について様々な挿入技術と挿入位置が行われた。挿入サイトでの組織反応および眼の様々な構造もまた評価される。挿入サイトには、眼の外側に挿入する結膜下注射、および、強膜(強い外側の膜)を通過する硝子体注射が含まれる。ここで、できれば、強膜に加えた挿入物が硝子体液の喪失を防ぐ栓を形成する。硝子体注射された挿入物は、直接、眼の内部に接触しているので有利であり、そのため最も効果的な薬物送達をする。しかしながら、この投与経路は副作用も著しく強い。
【0231】
これらの挿入技術および挿入位置についての初期検査(initial studies)は、72時間後に犠牲にする少数のウサギに対して行われた。一度、初期検査が完成されると、許容されるATRIGEL(登録商標)処方が確認され、長時間の刺激検査(long-term irritation study)が行われた。すべての検査において、ウサギは詳細に副作用について観察され、必要に応じて安楽死させた。前眼房の特徴を評価するためにスリットランプ観察(Slit lamp observations)を行い、修正したMcDonald-Shadduck評価基準(McDonald-Shadduck scoring system)の数値等級(numerical scale)を用いて点数をつけた。挿入サイトおよび眼の主要な組織(特に網膜)の組織診断、ならびに、硝子体液の細胞病理もまた評価した。細胞病理レポートには、白血球数、タンパク質量(protein count)、および、比重値が含まれる。
【0232】
眼は敏感な組織であるので、ATRIGEL(登録商標)媒体と最も生物適応性の高い溶媒のみを初期検査に用いた。初期に検査した溶媒は、ポリエチレングリコール300(PEG300)、PEG400、ポリエチレングリコールモノメチルエステル350(polyethylene glycol monomethylether 350 、mPEG350)、n-メチルピロリドン(NMP)、ジメチルスルホキシド(DMSO)および、グリセリントリアセテート(glycerol triacetate、トリアセチン)である。さらに、既知の眼部刺激物質である塩化ベンゼトニウム(BEC)を陽性応答(positive response)の評価に用いた。検査を通して50/50ポリ(ラクチド-co-グリコリド)(PLGH)という一種類のポリマーを0.18dL/gの固有粘度で用い、50μLの一定の注入体積とし、25ゲージ5/8インチの針を用いた。
【0233】
{ 4.1. ATRS917 }
ウサギの生体内での初期検査は、2003年6月19日に行われ、硝子体注射経路で6種類のATRIGEL(登録商標)媒体処方について行った。バイクリル(Vicryl)生分解性縫合糸を検査における対照として用いた。ATRIGEL(登録商標)処方は以下の表にあげたとおりである。
【0234】
【表2】

【0235】
PEG400処方は(グループEおよびF)は最も粘度が高く、25ゲージ針では、幾分、注入が難しいが、すべての注入は問題なく順調に行われた。注入後24時間では、眼の処置に伴う刺激は見られず、眼の異常はグループAからDでは見られなかった。グループEおよびFでは、処置された眼の三分の一で目脂が見られたが、他の異常は見られなかった。注入後72時間では、グループA、D、およびEでは何の刺激もしくは眼の異常も見られなかったが、グループB、CおよびFでは、処置された眼の三分の一で軽い水性紅斑もしくは細胞紅斑(mild aqueous or cellular flare)が見られたが、その他の異常はなかった。眼の後部の等級付けを補助するために用いられる、トロピカミド瞳孔拡張薬溶液(tropicamide pupil dilation solution)に関連する薬学的な阻害剤のために、動物の瞳孔反射(pupillary response)が無かった。この結果から、今後の検査同様、瞳孔反射の欠如はATRIGEL(登録商標)挿入物に関連するものではないことが期待できる。
【0236】
眼圧、比重、白血球数、および、タンパク質量は、全て正常レベルで炎症、異常細胞、または感染物質(infectious agents)は、処置をしたいずれの眼にも見られなかった。硝子体注射は、非常に清潔で、眼から針を除いたとき、刺した後の穴はATRIGEL(登録商標)自体で封をされていた。解剖によって、挿入物は内側の表面に付着しており、硝子体液中に浮いているのではないことが分かった。
【0237】
この検査の結果、ATRIGEL(登録商標)PEG処方、および、ATRIGEL(登録商標)mPEG処方が眼に注入されたときの許容性があることが分かった。顕著な、眼/組織の刺激はいずれの試験物でも見られなかった。眼科医だけに関係するが、Biological Test Center(BTC)Labsは固体デポー挿入物の用の注入サイズが、幾分、大きかった。彼らはこの注入体積ではウサギの視界に障害が生じると感じていた。本検査では挿入物の大きさではなく、眼および組織の刺激が主要な関心事であり、我々は注入体積の最適化をしていなかった。この問題はさらに開発が続けられて、解決されるであろう。
【0238】
{ 4.2. ATRS929 }
ウサギの生体内での第二回目の検査は、2003年8月20日に行われた。4種類のATRIGEL(登録商標)媒体処方は硝子体注射経路で、2種類の処方は結膜下注射経路で評価した。7-0バイクリル(Vicryl)生分解性縫合糸を、今回も、検査における対照として用いた。ATRIGEL(登録商標)処方は以下の表にあげたとおりである。
【0239】
【表3】

【0240】
グループAからDは硝子体注射、グループEおよびFは結膜下注射をした。(注:参考までに、グループEおよびFの処方はATRS917でも結膜下注射で評価されている。)BCT Labsによって、全ての注入は問題なく順調に行われた。
【0241】
注入後24時間では、ほとんどの動物が軽度から中度の結膜充血(conjunctival congestion)、および、処置した眼(左目)の腫脹を示した。処置された眼の3つで水性紅斑および細胞紅斑(mild aqueous and cellular flare)が見られた(グループAで2つ、グループCで1つ)。核性白内障(Nuclear cataract)が処置された3つの眼で確認された(グループCで2つ、グループDで1つ)。グループCおよびD では(トリアセチンATRIGEL(登録商標)処方)被験物質が水晶体前部と後部を包み、水晶体核へと移動した。処置された眼の3つおよび1つの対照の眼(グループA)で硝子体腔に、いくつかの散らばった混濁部が観測された。その他の異常は見られなかった。
【0242】
注入後72時間では、一匹の動物だけで(グループA)処置した眼に軽度の結膜充血が見られた。72時間後には水性紅斑もしくは細胞紅斑は見られなかったが、グループCで処置した1つの眼にだけ核性白内障が見られた。グループCの動物の処置した眼の2つで被験物質が眼球の後下部に位置していて、被験物質は円錐形であった。一匹の動物では、小さな1〜2mmの被験物質の断片が視神経頭の乳頭周囲部分へと移動した。処置した眼の1つでは(グループD)軽い脈絡膜/網膜の炎症が見られた。
【0243】
ATRIGEL(登録商標)の初期検査(ATRS917)と同様に、注射は、非常に清潔で、眼から針を除いたとき、刺した後の穴はATRIGEL(登録商標)自体で封をされていた。解剖によって、グループAおよびBの挿入物は内側の表面に付着しており、硝子体液中に浮いているのではないことが分かった。グループCおよびDの挿入物は水晶体に付着していることが見出され、薄いフィルム状の形態であった。グループEおよびFの挿入物は眼の外側の表面に付着していることが見出された。検査された全ての処方で、比重、眼圧、白血球数、および、タンパク質量は、全て正常レベルであった。しかしながら、グループCの一匹の動物では、少ない数の炎症細胞(inflammatory cells)が見つかった。
【0244】
この検査の結果は、トリアセチンが眼部ATRIGEL(登録商標)挿入物に許容できるキャリアー溶媒ではないことを示唆している。しかしながら、最初の生体内検査(ATRS917)で硝子体注射されたPEG300およびPEG400に相当する、すなわち同様の細胞病理および眼部所見がみられた、NMP処方は許容されうる結果を示した。結膜下注射されて眼の外側の表面に付着しているPEG300およびPEG400挿入物で眼/組織の刺激が低いこともまた、ATRIGEL(登録商標)システムを眼部薬物送達デバイスとして利用することに希望を与えさらに柔軟性を加えるものである。
【0245】
{ 4.3. ATRS939 }
ウサギの生体内での第三回目の検査は、2003年9月23日に行われた。4種類のATRIGEL(登録商標)処方は硝子体注射経路で、2種類の処方は結膜下注射経路で評価した。先の2つの生体検査と同様に、7-0バイクリル(Vicryl)生分解性縫合糸を、検査における対照として用いた。ATRIGEL(登録商標)処方は以下の表にあげたとおりである。
【0246】
【表4】

【0247】
グループAからDは硝子体注射、グループEおよびFは結膜下注射をした。(注:参考までに、グループEおよびFの処方はATRS917でも結膜下注射で評価されている。)BCT Labsによって、全ての注入は問題なく順調に行われた。
【0248】
注入後24時間では、グループAとEの一匹の動物が軽度の結膜充血を示した。グループC、DおよびFの全ての動物が少なくとも、角膜周辺部への注入に関連して、少なくとも角膜周辺部の外周の75%にわたる鮮紅色の結膜充血を示した。グループCの結膜腫脹もまた顕著で、グループFのものは軽度であった。さらに、グループCで見られた異常は、角膜の透明性が〜76-100%の表面を含め、ほとんど完全に喪失していたことである。グループCでは、重篤な水性紅斑および細胞紅斑(severe aqueous and cellular flare)が見られた。グループCおよびDでは、虹彩ストローマの軽い腫脹を伴い最少量から中程度注射剤(injection)が虹彩の第三の血管(tertiary vessels)に見られた。さらに、多くの混濁(opacities)、底詳細部(fundus details)の顕著なぼやけが硝子体に観測され、さらには、中程度の脈絡膜/網膜の炎症が見られた。注入後24時間でグループA、B、E、およびFには他の顕著な所見は無かった。
【0249】
注入後72時間では、グループB、EおよびFの全ての動物が予測されていたように瞳孔反射が無い以外には異常な眼部所見が無かった。グループAの一匹の動物が軽度の網膜出血および炎症を示した。グループCおよびDでは、さらに軽度から中度の結膜充血がみられ、グループCについては膿などの分泌(discharge)や腫脹も見られた。グループCでは角膜の透明性の喪失、虹彩の合併症、核性白内障および成熟白内障、ならびに、底詳細部(fundus details)の顕著なぼやけの原因となる混濁(opacities)が見られた。グループCおよびDでは、網膜剥離、出血、および炎症は評価できなかった。
【0250】
グループAからDの硝子体液に対して行った細胞病理学的所見では、グループCおよびDの動物の3分の2で比重とタンパク質量の上昇を示した。顕著な炎症はグループCおよびDの全ての動物とグループAの一匹の動物で見られた。全ての網膜細胞は見かけ上正常であり、異常細胞もしくは感染物質は見られなかった。
【0251】
ATRIGEL(登録商標)の初期検査(ATRS917および939)と同様に、注射は、非常に清潔で、眼から針を除いたとき、刺した後の穴はATRIGEL(登録商標)自体で封をされていた。解剖によって、40%のポリマーを含んでいるグループBでは、25%しかポリマーを含まないグループDよりもずっと大きな挿入物が含まれていた。これは部分的にはポリマーの固化に伴う膨張、さらには、ポリマーの濃度そのものによるもので、ポリマー濃度の高いものからは大きな挿入物が得られると期待される。これらの硝子体内注射されたATRIGEL(登録商標)挿入物は、眼の側面部分(side of the eye)と関連しており、それらが眼に「係留している」("anchored")かどうかは明確ではなかった。グループEおよびFの挿入物は眼の外側に密着しており、丸い形をしている硝子体注射をされたものと比較すると平らなディスク状の形態であった。
【0252】
この検査の結果は、予測どおりBECが顕著な眼部刺激の原因となることを示唆しており、ATRIGEL(登録商標)中のBEC(グループD)が細胞紅斑、結膜の腫脹、膿などの分泌および、うっ血、を弱めたが、硝子体液の事実上の炎症(actual inflammation)は軽減されなかった。NMP処方は全ての一連の被験物質の中で一番炎症が軽く、トリアセチンは顕著な結膜充血の原因となった。DMSO処方および純溶媒は、初期検査と第二の検査(ATRS917および929)で検査された上記の被験物質では炎症を起こさせないことが分かった。
【0253】
{ 5. 28日間のATRIGEL(登録商標)実現可能性検査、ATRS948 }
ウサギの生体内での第四回目の検査は、2003年10月28日に行われた。検査では、3種類のATRIGEL(登録商標)処方について、硝子体注射経路および結膜下注射経路を用い、28日間に渡って評価した。この検査はATRIGEL(登録商標)挿入物の長期間の刺激を評価し、さらには挿入物の分解速度論について調査するためのものである。ATRIGEL(登録商標)処方は以下の表にあげたとおりである。
【0254】
【表5】

【0255】
グループA-B、E-F、およびI-Jには硝子体注射、グループC-D、G-H、およびK-Lには結膜下注射をそれぞれ行った。BCT Labsによって、全ての注入は問題なく順調に行われた。
【0256】
注入後24時間では、グループA、C、D、EおよびKの多くの動物が、軽度の結膜充血を示し、グループC、D、およびEの動物では軽度の結膜腫脹もみられた。さらに、グループDの一匹の動物だけは、大量の目脂を分泌した。水性紅斑(Aqueous flare)がグループAとCの一匹の動物に見られた。虹彩合併症(Iris involvement)はグループAの一匹の動物に見られた。その他の眼部所見に異常は無かった。
【0257】
注入後一週間では、一匹の動物にだけ異常な眼部所見が見られた。これはグループDの一匹の動物で角膜の透明性がわずかに失われたことを含む。眼の基底構造(underlying structures)はまだはっきりと視認できるが角膜全体の1〜25%に、明らかにいくらかの混濁が見られた。この異常所見は動物が眼を引っかいたために起こったもので、ATRIGEL(登録商標)被験物質に起因するものではないことが分かった。
【0258】
注入後2週間目、3週間目、および4週間目の試験期間では、異常所見は見られなかった。しかしながら、グループJの一匹の動物で、わずかに水晶体が前方に押されていた。さらに、グループA-B、E-F、およびI-Jの硝子体液についておこなわれた細胞病理学的所見では、比重、眼圧、白血球数およびタンパク質量は、これらの硝子体注射処方で、全て正常レベルであった。その上、異常細胞、もしくは炎症細胞は見られなかった。
【0259】
選択された眼についての解剖は、ポリマー分解と挿入物の形態を調べるために、14日目と28日目に行われた。14日目に、グループA、EおよびIの挿入物は柔らかくゼリー状で半透明構造となっていた。これらの硝子体注射されたATRIGEL(登録商標)挿入物は眼の側面部分(side of the eye)と関連しており、それらが眼に「係留している」("anchored")かどうかは明確ではなかった。グループC、GおよびKの挿入物は、眼の外側に付着しており、完全な状態(integrity)を示し、分解の徴候を示していた。28日目には、グループBに対応する一つの挿入物だけが見つかり、この挿入物は非常に柔らかく、半透明で、明らかに分解していた。他の挿入物は28日目には発見されず、挿入物がかつて存在した痕跡も無かった。
【0260】
この検査の結果、24時間後の所見は最初の3つの短期間の眼部ATRIGEL(登録商標)評価検査と同様のものであった。これらの所見は、硝子体注射もしくは結膜下注射に対する典型的な反応である、結膜充血にほぼ限られていた。注入後28日には、それまで刺激が長引くことは無く、異常な細胞病理も観測されなかった。解剖によって、14日目に見つけられた挿入物は明らかに分解されていて、28日目の時点で発見されたのは1つの挿入物だけであったことが明らかになった。この結果は、この時間内にポリマーの完全な生分解が予期されるものであり、非常に有望なものである。さらに、28日目に刺激がなくなっていたことは、ATRIGEL(登録商標)の分解生成物は刺激の原因とならず、眼から消えていることが示唆された。
【0261】
{5.2. ATRS1012 }
ウサギの生体内での第五回目の検査は、2004年8月18日に行われた。検査では、3種類のATRIGEL(登録商標)処方について、テノン嚢下注射(the sub-Tenon's route of injection)経路を用い、28日間に渡って評価した。この検査はATRIGEL(登録商標)挿入物の長期間の刺激を評価し、さらには挿入物の分解速度論について調査した。ATRIGEL(登録商標)処方は以下の表にあげたとおりである。
【0262】
【表6】

【0263】
1日目および/または3日目では、36個の眼のうち17個で結膜充血が見られた。結膜充血は、PEG300中の25% 50/50 PLGH 0.18を投与した12個のうち6個の眼、mPEG350中の30% 50/50 PLGH 0.18を投与した12個のうち7個の眼、および、NMP中の45% 50/50 PLGH 0.18を投与した12個のうち4個の眼で見られた。これらの眼のうちの1個で、PEG300中の25% 50/50 PLGH 0.18を投与したものは、1日目に結膜の腫脹も見られた。mPEG350中の30% 50/50 PLGH 0.18を投与した1個の眼では3日目に目脂が見られたが、この眼は検査期間中、結膜充血を示していなかったものであった。NMP中の45% 50/50 PLGH 0.18を投与した2個の眼では、結膜充血部分の近くで角膜の透明性が少し失われていた。この所見は注射をした日のみ(1日目)見られた。
【0264】
1日目、3日目、7日目および/または14日目には、36個の眼のうち、9個で被験物質が漏れ出すか位置が変更していた。被験物質の漏洩および移動は、PEG300中の25% 50/50 PLGH 0.18を投与した12個のうち1個の眼、mPEG350中の30% 50/50 PLGH 0.18を投与した12個のうち3個の眼、および、NMP中の45% 50/50 PLGH 0.18を投与した12個のうち5個の眼で見られた。これらの眼には、被験物質は結膜領域(conjunctival area)、角膜表面、および/または、瞬膜(third eyelid)に存在した。
【0265】
21日目では、2種類のPEG被験物質処方のうちの1種類を投与した残っている全ての眼には、痕跡量の被験物質しか見られなかった。NMP処方を投与した全ての残っている眼において被験物質は明らかに存在し、サイトに渡って通常の血管反応(vascular response)があった。
【0266】
全てのグループの硝子体液についておこなわれた細胞病理学的所見では、比重、眼圧、白血球数およびタンパク質量は、これらの硝子体注射処方で、全て正常レベルであった。その上、異常細胞、もしくは炎症細胞は見られなかった。顧問病理学者(consulting pathologist)の意見では、液細胞診所見(fluid cytology findings)は通常の硝子体液と一致した。
【0267】
3日目、14日目および28日目のポリマー分解と挿入物の形態を調べるために、選択された眼の解剖が行われた。3日目には、挿入物は眼の強膜に付着しており膜状であった。14日目には、挿入物は眼の外側に付着しているのが見られ、完全な状態ではあったが分解の徴候が見られた(柔らかくなった)。28日目には挿入物は見られず、以前に挿入物が存在していた痕跡も見られなかった。
【0268】
本検査の結果は、硝子体経路および結膜下経路からの投与を評価した4種類のATRIGEL(登録商標)の初期評価検査として行われた24時間観察と同様の結果を示した。これらの所見は、硝子体注射、結膜下注射、もしくはテノン嚢下注射に対する典型的な反応である結膜充血にほぼ限られていていた。注入後28日には、それまで刺激が長引くことは無く、異常な細胞病理も観測されなかった。解剖によって、14日目に見つけられた挿入物は予想通りわずかに分解されていて、28日目の時点では挿入物が発見されなかった。28日間刺激が無かったことは、ATRIGEL(登録商標)がテノン嚢で許容され耐容性があることを示唆している。
【0269】
{ 6. 考察 }
最初の3種類の短期間の生体内眼部での実現可能性試験(in-vivo ocular feasibility studies)から、PEG300、mPEG350、PEG400、およびNMPがATRIGEL(登録商標)の硝子体内もしくは結膜下の挿入に適した溶媒であることが示唆された。これらのキャリアー溶媒は、いずれの経路を用いた場合でも3日間の期間にわたって眼および組織への刺激がわずかであった。ATRIGEL(登録商標)のDMSO処方では硝子体内の評価がされた前述の被験物質による刺激は見られず、結膜下でも許容性を示す可能性があるが、DMSOの生体適合性は疑わしい。さらに、トリアセチンは挿入物形成しにくいこと、さらには刺激性があることから、眼部挿入物には適合しないことが見出された。
【0270】
PEG300、mPEG350、およびNMPのATRIGEL(登録商標)処方が3日間にわたる眼部挿入物に適合するという知見から、2種類の長期間刺激検査をこれらのATRIGEL(登録商標)処方で行った。長期間刺激検査の結果、28日間の期間にわたって硝子体内注射、結膜下注射、もしくはテノン嚢下注射された挿入物による刺激は見られなかった。さらに、実験の終了時ではATRIGEL(登録商標)挿入物が存在しないことから、ATRIGEL(登録商標)の分解が予想通りに起こって、眼が分解生成物を補足しなかったことを明らかになった。
【0271】
本検査の結果は、硝子体内注射された挿入物は眼の内側の表面に付随しており硝子体液中に浮いていないことを、さらに示唆している。硝子体注射された眼の解剖から、注入した後の孔はATRIGEL(登録商標)自体で封をされて、残りの挿入物が眼の内側の表面に「係留する」("anchored")原因となる。この「係留」は視力障害の原因となる、挿入物の硝子体液中での移動を制限する。同様に、結膜下注射およびテノン嚢下注射された挿入物は、ATRIGEL(登録商標)挿入物の粘着性によって、眼の外側に付着した。これは、眼の外膜を通しての薬剤の物質移行が、挿入物が眼の表面に接触していることによって増加することを暗示する。結膜下注射経路およびテノン嚢下注射経路での許容性が示されたことによって、必要な長い徐放送達期間にあわせるために注入体積、ポリマー濃度もしくは薬物負荷を増加させることが可能であるので、ATRIGEL(登録商標)送達システムの自由度が広がった。
【0272】
{ 概要 }
眼の中もしくは眼の周囲に注入された後の、ATRIGEL(登録商標)送達システムの許容性を決定するために一連の動物実験が行われた。これらの検査ではウサギにいくつかのATRIGEL(登録商標)溶液のうちの一つを注射した。注射は直接眼の中に(硝子体内注射)、結膜の下に(結膜下注射)、もしくは、眼球の後ろの筋肉と神経を覆っている膜を通して(テノン嚢下注射(subtenon injection))行われた。ウサギは、局所反応と視覚の喪失もしくは障害について28日間にわたって定期的に観察された。さらに、障害を指摘するために、眼の液の分析がされた。
【0273】
いかなる物質を眼の中に注入したときでも予測されるとおり、全てのATRIGEL(登録商標)溶液についてわずかな潮紅(redness)が確認された。しかし、この潮紅(redness)は72時間以内に消えた。眼圧は検査中を通して変化が無かった。さらに重要なのは、視覚の障害が起こらなかったことである。顕微鏡下で眼の液の評価をした結果、白血球数(WBCs)は検査中を通して正常数であった。WBSが正常値であったことは、眼の怪我、感染、および/または炎症が無いことを示す。さらに、化学的分析から、体液中に溶解している物質の量は正常であることが示された。いずれの検査期間中にも、炎症の痕跡や感染物質の発生はいずれの処置された眼についても見られなかった。
【0274】
これらの結果はATRIGEL(登録商標)送達システムが、許容性が高く、眼の中もしくは眼の周囲に注入した後、生物学的に不活性なであることを示している。実際、ATRIGEL(登録商標)製剤は、ある種の薬剤の毒性を弱める。例えば、追加の検査によって、ATRIGEL(登録商標)送達システムと眼部刺激性の化合物を混合して調製した処方を、同じ物質を水に溶解したものと比較した。直接観察で、刺激物質を水に溶解したものは、顕著な腫脹、重篤な潮紅、および、眼からの水様の分泌物が見られた。さらに、目の前半分を覆っている部分(角膜)が透明であったものが白濁した。この角膜の変化によって、部分的もしくは完全に失明した。しかしながら、ATRIGEL(登録商標)送達システムを含んだ刺激物質では、軽度から中程度の腫脹、中程度の潮紅しか見られず、眼を覆っている部分は透明のままであった。この刺激の軽減は、水溶液中の高い濃度の刺激物質に眼が直ちに曝されるのと比較して、ATRIGEL(登録商標)送達システムがゆっくりと長い時間をかけて眼の中に刺激物質を放出することによる。このゆっくりとした放出が刺激物質の毒性を軽減し、回復不能な損傷の可能性を軽減する。
【0275】
結果として、PEG300、mPEG350、およびNMPを含むATRIGEL(登録商標)処方は硝子体内もしくは結膜下の挿入物のための許容されうる媒体である。
【0276】
本明細書で引用した全ての出版物、特許、および出願書類は、個々に参照されて本明細書に含まれるかのように、参照することによって本明細書中に含まれる。本発明は様々な具体的な、好ましい実施例および技術に関して記載している。しかしながら、様々な変形物、修飾物が本発明の範囲から逸脱することなく作られることが理解されるべきである。
【0277】
明確にするために別々の実施例の状況として記載されている、本発明のある特徴は、一つの実施例の中で組み合わせとして見られることがある。様々な本発明の特徴は簡潔にするために一つの実施例の状況として記載されているが、これらの特徴が別々にもしくはサブコンビネーションとして提供されることもある。
【図面の簡単な説明】
【0278】
本発明の実施例は以下の説明および、そのような実施例を説明している添付の図を参照することによってよく理解することができる。図の番号計画(numbering scheme)は、参照番号として与えられている先頭の数字を図の番号と関係させている。参照番号は要素に対しての参照番号と同じで、異なった図であっても同じである。例えば、眼部および涙道(110)などの眼の表面は図1に存在する。しかしながら、参照番号は要素に対して同じであり、異なった図であっても同じである。図には以下のものが含まれる。
【図1】眼部および本発明に有用な眼の表面の説明。
【図2】眼部および本発明に有用な眼の表面の説明。
【図3】眼部および本発明に有用な眼の表面の説明。
【図4】粘膜部分および本発明に有用な粘膜の表面の説明。
【背景技術】
【0001】
眼の疾患および/または怪我の処置は、特定の生物学的薬剤が、効果的な時間の間、治療をしようとする部位にとどまっていることが要求される。涙のような天然の体液は、局所的に塗布された生物学的薬剤成分を速く洗い流す傾向があるので、局部的な眼の治療、もしくは、結膜を全身投与の経路とすることは困難である。
【0002】
眼部挿入物(ocular inserts)を局所的な薬物送達に用いることは30年以上にわたって記述されてきている(例えばNess, US Patent No. 3,416,530 および Cheng, US Patent No. 4,053,580 を参照のこと。)。これらの最初の挿入物(insert)には、体液中に溶解しないか、もしくは生体内分解性でない物質が含まれていた。
【0003】
その他の開示では、ある一定の期間投薬して最終的には摩滅する、眼部送達用挿入物(ocular delivery inserts)が記載されているが、これらのいずれの文献にも適切に生体に接着する可能性を有するものは無い。例えば Whitaker, et al. (US Patent No. 3,963,025) 、 Miyata, et al. (US Patent No. 4,164,559) 、 Cohen, et al. (US Patent No. 4,179,497) 、 Heller, et al. (US Patent No. 4,346,709 および 4,249,431) 、 Darougar, et al. (US Patent No. 6,264,971) 、 Wong, et al. (US Patent No. 6,331,313) 、ならびに Masters (US Patent No. 6,342,250) を参照のこと。
【0004】
点眼薬がとどまっている時間を長くするために、生体接着性ポリマー混合物(bioadhesive polymer mixtures)の流動性を有する溶液についてもまた記述されている( Bowman et al., US Patent No. 6,372,245 および Chiou, US Patent No. 5,283,236 )。しかしながら、これらの溶液では、治癒的効果を早く発現させるための結膜との密着が維持されない。
【0005】
眼は解剖学上、複雑な器官で、生物学的薬剤の局所的送達および全身送達のいずれに対しても独特の難しさと利点を有している。眼の表面上皮組織(surface epithelial tissues)である結膜もしくは角膜は、常に涙でぬれている器官である。涙が通常安定した流量の水分が内眼角(medial canthus)にある鼻の涙道(nasal lacrimal ducts)に流れる。
【0006】
異物に対する眼の最初の反応は涙の量を増やすことであり、これが、異物を流すだけでなく点眼薬中の生物学的薬剤も流して、薬剤を副鼻腔の中へと流す。まぶたの内側の表面もしくは眼瞼結膜(palpebral conjunctiva)は湿っていて、高度に血管化(highly vascularized)した器官である。点眼薬中の大部分の生物学的薬剤は、副鼻腔からのどの後ろに流出するが、生物学的薬剤の一部は血管系に取り込まれ、全身送達され(become systemic)、一部は眼球結膜(bulbar conjunctiva)を通して眼の前眼房(anterior chamber)に浸透する。
【0007】
体循環への輸送が速い一方、点眼薬からの送達効率が低く、局所的に塗付した薬剤が眼の前区(anterior segment)へとすぐに入るので常に潜在的な毒性がある。
【0008】
いくつかの文献は、コントロールリリース挿入物(controlled release implant)として用いるのに適した流動的な組成物、生分解性挿入物および生体内分解性の挿入物として用いるための徐放性送達システム(sustained release delivery systems)を記載している。ここで、流動的な組成物および徐放性送達システムには以下のものが含まれる。(a) 生分解性の、生体適合性のあるポリマー、(b) 生物学的薬剤、および、(c) 生体適合性のある有機液体(organic liquid)。また、ここで結果として得られた挿入物は、生体内原位置で構成され、(a) 生分解性の、生体適合性のあるポリマー、(b) 生物学的薬剤、を含む。例えば、U.S. Patent Numbers 6,565,874、 6,528,080、 RE37,950、 6,461,631、 6,395,293、 6,355,657、 6,261,583、 6,143,314、 5,990,194、 5,945,115、 5,792,469、 5,780,044、 5,759,563、 5,744,153、 5,739,176、 5,736,152、 5,733,950、 5,702,716、 5,681,873、 5,599,552、 5,487,897、 5,340,849、 5,324,519、 5,278,202、 および 5,278,201を参照のこと。これらの参考文献は、組成物が眼部送達(ocular delivery)に適していて、コントロールリリース挿入物に用いるのに適した流動性の組成物などを記載していない。
【0009】
従って、求められているものは、例えば数分でもしくは数時間で供給されるような、様々な時間にわたっての、全身治療もしくは局部的治療の両方のための、眼部(例えば、結膜通過性(transconjunctival)もしくは角膜通過性(transcorneal))送達のための、生物学的薬剤のキャリアーである。
【発明の開示】
【0010】
本発明に係る処方は、他の非経口の徐放性送達システムよりも多数の明確な利点を提供する。例えば、ミクロスフェアは、ハロゲン化した溶媒の使用を含むことがある無菌プロセスを用いて製造する必要がある。その上、薬剤のミクロスフェアの割合はカプセル封入の効率性によって調節される。これは薬物製品の製造過程でのAPIのうちの25〜50%の回復不能な損失が生ずる可能性があるプロセスである。それに比べて、本発明に係る処方は生体適合性のある含有物から構成され、適切な生分解性ポリマーを生体適合性のある溶媒に溶解して調製される。ミクロスフェアと異なり、本発明に係る処方ではγ線照射を含む従来技術を用いて最終的に滅菌することができる。この独創的な製造プロセスと独自開発された製品態様(proprietary product configuration)は、本質的に製造過程での薬物の損失を解消する。さらに本発明に係る処方では、ミクロスフェアで少ない投薬量でも大きな体積を注入するのに比べて、大きい投薬量のAPIを小さな注入体積で送達することができる。一番重要なことには、本発明に係る処方で得られた持続性薬剤(depot)は、感度の良い(sensitive)バイオ医薬品が生体内で分解および酵素による不活性化がおこるのを防ぐ。
【0011】
本発明に係る処方は、他の挿入できないものや貯蔵装置(reservoir devices)に比べて患者に優しい送達基盤(delivery platform)である。本発明に係る処方は、皮下に挿入され、挿入物は所定の期間にわたって薬剤を放出する。典型的には、その挿入物は薬剤が放出されるのと同じ速度で分解されるため、挿入サイトは原則的には次の挿入時には消散する。それに比較して、機械的な挿入物(mechanical implants)は薬剤を使い果たした後には、外科的に取り除いて埋め直すか、もしくは詰め替える必要がある。
【0012】
眼に生物学的薬剤を投与するのに用いるときに、本明細書に記載した流動性組成物を、効果的および適切な量の物質の眼や周囲の器官への刺激もしくは毒性の発生および/または程度を下げるために用いる。このような刺激もしくは毒性は、例えばアセトンもしくはN-メチル-2-ピロリドンのような有機溶媒が比較的大量に存在していることなどによって起こる。
【0013】
本発明は、コントロールリリース挿入物に用いるのに適した流動性のある組成物で、前記組成物が、(a) 少なくとも実質的に水媒体(aqueous medium)、水、もしくは体液に溶解しない生分解性の、生体適合性がある、熱可塑性のポリマー、(b) 生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩(biological agently acceptable salt)、もしくはそれらのプロドラッグ、ならびに、(c) 標準温度および圧力で熱可塑性ポリマーが可溶な、生体適合性のある有機液体を含み、眼からの供給に適している組成物を提供する。
【0014】
本発明は、哺乳類の疾患もしくは異常を処置する方法であって、前記方法がそのような処置を必要とする哺乳類の眼部に、有効量の本発明に係る流動性組成物を投与するステップを含む方法も提供する。
【0015】
本発明は、また、哺乳類の眼部から生物学的薬剤を局所的に送達するための方法であって、本発明に係る流動性組成物を哺乳類の眼部に接触させるステップを含む方法も提供する。
【0016】
本発明は、哺乳類の眼部から生物学的薬剤を全身に送達するための方法であって、本発明に係る流動性組成物を哺乳類の眼部に接触させるステップを含む方法もまた提供する。
【0017】
本発明は、(a) 少なくとも実質的に水媒体、水、もしくは体液に溶解しない生分解性の、生体適合性がある、熱可塑性のポリマー、(b) 生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグ、ならびに、(c) 標準温度および圧力で熱可塑性ポリマーが可溶な、生体適合性のある有機液体を含む挿入物であって、ここで、前記挿入物は哺乳類の眼部に位置し、前記挿入物が固体もしくはゼラチン状の微孔性の基盤(microporous matrix)を有し、前記基盤は被膜(skin)で囲まれた芯(core)であり、前記挿入物が体の組織に囲まれていることを特徴とする挿入物も提供する。
【0018】
本発明は、(a) 少なくとも実質的に水媒体、水、もしくは体液に溶解しない生分解性の、生体適合性がある、熱可塑性のポリマー、ならびに、(b) 生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを含む挿入物であって、ここで、前記挿入物は哺乳類の眼部に位置し、前記挿入物が固体もしくはゼラチン状の微孔性の基盤を有し、前記基盤は被膜で囲まれた芯であり、前記挿入物が体の組織に囲まれていることを特徴とする挿入物も提供する。
【0019】
本発明は生体内の眼部の原位置で挿入物を構成する方法であって、(a) 受療者の眼部に流動性組成物を注入するステップ(ここで、流動性組成物は本発明に係るいずれかの組成物)、および、(b) 生体適合性のある有機液体を固体の生分解性の挿入物を構成するために拡散させるステップを含む方法も提供する。
【0020】
本発明は、眼部の原位置で挿入物を構成するのに適した生物学的薬剤キットであって、(a) 第一の容器は、眼部送達に適した流動性組成物を含み、ここで前記組成物は、(i) 少なくとも実質的に水媒体、水、もしくは体液に溶解しない生分解性の、生体適合性がある、熱可塑性のポリマー、ならびに、(ii) 標準温度および圧力で熱可塑性ポリマーが可溶な、生体適合性のある有機液体を含み、(b) 第二の容器は、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを含むことを特徴とするキットも提供する。
【発明を実施するための最良の形態】
【0021】
本発明はコントロールリリース挿入物に適した流動性組成物の眼部送達に関する。組成物は、(a) 少なくとも実質的に水媒体(aqueous medium)、水、もしくは体液に溶解しない生分解性の、生体適合性がある、熱可塑性のポリマー、(b) 生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩(biological agently acceptable salt)、もしくはそれらのプロドラッグ、ならびに、(c) 標準温度および圧力で熱可塑性ポリマーが可溶な、生体適合性のある有機液体を含む。熱可塑性ポリマーは少なくとも実質上、好ましくは基本的に完全に有機溶媒に可溶で、かつ、少なくとも実質上、好ましくは基本的に完全に水媒体、体液もしくは、水、に溶解しない。有機溶媒は少なくとも、わずかに水に溶解し、好ましくは中程度に水に溶解し、特に好ましくは実質上、水に可溶である。流動性組成物は、体内に注入するのに適した生物学的薬剤であって、生物学的薬剤として許容される固体基盤(solid matrix)、典型的には一つの体内挿入物(body implant)もしくは薬物送達システム(drug delivery system)を形成する。その挿入物は、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを調整された速度で放出する。その放出速度は、速度修正剤(rate-modifying agent)を含有させることにより、速くもしくは遅くすることができる
【0022】
明細書にある実施例("one embodiment"、"an embodiment"、"an example embodiment"、等)の表示は、その記載された実施例が、特別な特徴、構造、もしくは特質を有していることがあることを示すが、全ての実施例が、その特別な特徴、構造、もしくは特質を有している必要はない。その上、これらの語句は同じ実施例を示している必要はない。さらに、特別な特徴、構造、もしくは特質が実施例と関連して記載されているときには、当業者の知識の範囲内において、明記されているかどうかにかかわらず、特別な特徴、構造、もしくは特質が関連している他の実施例を想定することができる。
【0023】
本明細書中では、眼の("ocular")、もしくは、眼部の("ocular region")(550)は眼、周辺の組織、および眼の内部の体液のことに言及している。特に、その語は角膜 (350) もしくは (250)、強膜 (310) もしくは (210)、ぶどう膜 (320)、結膜(330)(例えば、眼球結膜 (220)、眼瞼結膜 (230)、および、瞼板結膜(tarsal conjunctiva) (270))、前眼房(340)、涙嚢、涙管(lacrimal canals)(130)、涙道(110)、内眼角(120)、鼻涙管(150)、ならびに、眼瞼(例えば上眼瞼(240)、および下眼瞼(260))を含む。追加的に、その語は眼の内側の表面(角膜の上にある強膜 (310) もしくは (210))および眼瞼の内側の表面(眼瞼結膜)を含む。
【0024】
本明細書中では、「結膜」("conjunctiva")は、眼瞼の内側の表面、および、強膜 (310) もしくは (210) の前の部分の粘膜である。「眼瞼結膜」("palpebral conjunctiva")は、眼瞼の内側の表面にある粘膜で、厚く、不透明で、高度に血管性(highly vascular)である。「眼球結膜」("bulbar conjunctiva")は、ゆるく結合し、薄く、透明で、強膜 (310) もしくは (210)の眼の前部分の3分の1を覆っている。
【0025】
本明細書では、「角膜」("cornea")は凸状の透明な、眼の前の部分で、最も外側の眼球膜の6分の1を含む。角膜は光を水晶体に透過させる。角膜 (350) もしくは (250)は5つの層(結膜に連続する前角膜上皮、前境界板(ボーマン膜)、角膜固有質(substantial propria)、後境界板(デスメー膜)、および、前眼房の内皮(340)(角皮))を有する繊維状の構造である。角膜は密度が高く、厚さが均一で、血管化しておらず、眼の膜の他の6分の5を構成する、強膜 (310) もしくは (210) を超えてドーム上に突出している。角膜局率の程度は異なる個体によって様々であり、同じ個人であっても年齢によって様々であり、若い間は年をとった後よりも曲率が顕著である。
【0026】
本明細書中で、「眼」("eye")は、頭蓋骨の前部にある骨の眼窩(bony orbit)に含まれ、眼窩脂肪体(orbital fat)中にはめ込まれ、4種類の脳神経(視神経、眼球運動神経、滑車神経、および、外転神経)によって刺激される、視覚についての一対の器官の一つを指す。眼に関連しているものは、特定の付属組織(accessory structure)、例えば筋肉、筋膜、眉、眼瞼、結膜(330)および、涙腺などである。眼球(the bulb of the eye)は、外側の膜と、水晶体レンズ(crystalline lens)によって分けられた内側の二つの腔(cavity)を囲む3つの繊維質の層のうちの1つとによって構成される、ほとんど平行な軸を有する二つの球部分からなっている。水晶体の前の小さい腔は、虹彩によって二つの室に分けられ、いずれの部分も房水(aqueous humor)で満たされている。後ろの腔は、前の腔より大きく、ゼリー状の硝子体(vitreous body)が含まれており、硝子体管(hyaloid canal)で分けられている。眼球の外側の膜は、膜の6分の1を構成する前方の透明な角膜と、膜の6分の5を構成する不透明な強膜からなっている。中程度に血管性の、色素性の膜は、脈絡膜、毛様体、および虹彩で構成される。この内部の神経組織(nervous tissue)の膜が網膜である。光波が水晶体を通過して、網膜中の桿体および錐状体の膜に当たると、視神経から脳に伝達する活動電位が発生する。眼球の横方向の直径と前後方向の直径は、垂直方向の直径よりも少し大きく、通常は女性の眼球は男性の眼球よりも小さい。眼の運動は、上方斜紋筋および下方斜紋筋(the superior and inferior oblique muscles)、上方直筋、下方直筋、内側直筋、および外側直筋(the superior, inferior, medial, and lateral rectus muscles)の6つの筋肉で調節されている。また、眼球は、目、目の玉(bulbus oculi, eyeball)とも呼ばれる。
【0027】
本明細書中では、「目蓋」("eyelid")の語は、睫毛(eyelashes)ならびに、睫毛腺およびマイボーム腺(ciliary and meibomian glands)をふちに有する、目の上の動かすことができる薄い皮膚のひだを指す。それは、粘膜(結膜)で内張りされた、薄いプレート状の繊維質の組織を含む、ゆるく結合した組織からなっている。眼輪筋(orbicularis oculi muscle)および眼球運動神経(oculomotor nerve)は、まぶたの開閉を調節する。上目蓋と下目蓋は、眼瞼の裂溝(palpebral fissure)によって分けられている。また、眼瞼(palpebra)とも呼ばれる。
【0028】
本明細書中では、「眼角」(palpebra)は、眼の隅のことで、目蓋のへりの内側の隅と外側の隅を指す。鼻側眼角(medial canthus)(120)は涙道の開口部を含む小さな空間に通じている。また、眼瞼交連(palpebral commissure)とも呼ばれる。
【0029】
本明細書中では、「粘液」("mucus")は、ムチン、白血球、水、無機塩類、および剥離した細胞を含む、粘性が高く滑りやすい粘膜および腺の分泌物のことを指す。
【0030】
本明細書中では、「鼻腔」("nasal sinus")は、鼻の空洞に続いている繊毛のある粘膜(ciliated mucous membrane)で内張りされた、頭蓋骨のいろいろな骨の中のたくさんの空洞のいずれかひとつを指す。その粘膜は非常に敏感で、刺激されやすく、膨張して腔を遮蔽する原因になることもある。鼻腔には、例えば前頭洞(the frontal sinus)(410)もしくは回転楕円状の腔(the spheroidal sinus)(420)を含む可能性がある。
【0031】
本明細書中では、「涙の」("lacrimal")は、涙(tears)を指す。
【0032】
本明細書中では、「涙道」("lacrimal duct")は、涙が涙腺(the lacrimal lake)からそれぞれの眼の涙嚢へと通る、一対の導管の一つのことを指す。それは、涙小管(lacrimal canaliculus)とも呼ばれる。
【0033】
本明細書中では、「眼瞼結膜」("palpebral conjunctiva")とは、眼瞼の内側の表面、および、強膜 (310) もしくは (210) の前の部分の粘膜である。「眼瞼結膜」は、眼瞼の内側の表面にある粘膜で、厚く、不透明で、高度に血管性(highly vascular)である。「眼球結膜」("bulbar conjunctiva")は、ゆるく結合した、薄く、透明で、強膜 (310) もしくは (210)の眼の前部分の3分の1を覆っている。
【0034】
本明細書中では、「網膜」("retina")は、視神経につながっている10層の敏感な眼の神経組織の膜で、外部の物の映像を受け取って視覚の活動電位(visual impulses)を視神経を通して脳に伝達する。網膜は柔らかく、半透明で、ロドプシンを含んでいる。網膜は外側の色素性の層と9層の網膜(the nine-layered retina proper)からなっている。これらの9つの層は、一番内側から順に、内境界膜(the internal limiting membrane)、神経繊維層(the stratum opticum)、神経細胞層(the ganglion cell layer)、内網状層(the inner plexiform layer)、内顆粒層(the inner nuclear layer)、外網状層(the outer plexiform layer)、外顆粒層(the outer nuclear layer)、外境界層(the external limiting membrane)、および桿状体錐状体層(the layer of rods and cones)である。網膜の外側は脈絡膜につながっており、内側の表面は硝子体につながっている。網膜は、毛様体まで広がっている前方が薄く、焦点が一番あっている後方の表面のちょうど中心の薄い場所を除いて、後方は厚くなっている。光受容体は毛様体の鋸状縁(the jagged ora serrata)の前で終わるが、網膜の膜は毛様体突起(the ciliary processes)および虹彩の後ろまで広がっている。網膜は直射日光にさらされると、曇って不透明になる。ヤコブ膜(Jacob's membrane)、斑点(macula)、乳頭(optic disc)も参照のこと。
【0035】
本明細書中では、「網脈絡膜」("retinochoroid")とは、眼を覆っている網膜および脈絡膜の炎症(inflammation)のことを指す。
【0036】
本明細書中では、「強膜」("sclera")は、眼球の6分の5を覆っている弾性の無い不透明な膜のことを指す。強膜は眼球の大きさと形を維持し、眼球を動かす筋肉につながっている。その後部を視神経が貫通しており、透明な角膜と共に眼球を覆う一番外側の3つの膜を作っている。
【0037】
本明細書では、「洞」("sinus")は、骨の中の空洞、静脈血用の膨張した導管、もしくは化膿した物質を排出することができる膨張した導管のような、空洞もしくは導管を指す。
【0038】
本明細書中では、「眼板腺」("tarsal gland")は数多くの変更された皮脂分泌腺(modified sebaceous gland)のうちのいずれか一つで目蓋の内側の表面にあるものを指す。眼板腺の急性の局部的な細菌感染は、ものもらい(sty)もしくは霰粒腫(chalazion)の原因となることがある。
【0039】
本明細書中では、「涙」("tears")は、涙腺から分泌される、結膜を湿らせるための塩分もしくはアルカリを含んだ水っぽい流体のことを指す。
【0040】
本明細書中では、「ぶどう膜」("uvea")とは、強膜 (310) もしくは (210) の下方の繊維質の膜で、虹彩、毛様体、および、眼の脈絡膜を含む。
【0041】
本明細書中では、「脈管構造」("vasculature")とは、器官もしくは組織中の血管の分布のことを指す。
【0042】
〔生物学的薬剤〕
生物学的薬剤は眼への局所的送達に適するものとすることができる。またあるいは、生物学的薬剤は、眼からの全身送達に適するものとすることができる。
【0043】
生物学的薬剤は、一種類の生物学的薬剤であっても、複数の生物学的薬剤の配合物であっても良い。単独でも配合物としても用いることができる生物学的薬剤の種類には以下のものが含まれる。アドレナリン系薬物、副腎皮質ステロイド、副腎皮質抑制剤(adrenocortical suppressant)、アルコール妨害物質(alcohol deterrent)、アルドステロンアンタゴニスト、アミノ酸、アンモニア解毒剤(detoxicant)、アナボリック、興奮薬、鎮痛薬、アンドロゲン、抗血管新生薬(antiangiogenic)、麻酔の付属物(anesthesia, adjunt to)、麻酔剤、食欲抑制剤、アンタゴニスト、下垂体前葉抑制剤、虫下し、ざ瘡治療剤、抗アドレナリン薬、抗アレルギー薬、抗アメーバ薬、抗アンドロゲン薬、補血薬、狭心症治療薬、恐怖症治療薬、関節炎治療薬、喘息治療薬、アテローム硬化治療薬、抗菌剤、胆石の溶解剤(anticholelithic)、胆石の抗凝固剤(anticholelithogenic)、抗コリン剤、抗凝固剤、抗コクシジウム薬(anticoccidal)、抗けいれん薬、抗うつ薬、糖尿病薬、止痢薬、抗利尿薬、解毒剤、鎮吐薬、抗てんかん薬、抗エストロゲン薬、抗線維溶解薬(antifibronolytic)、抗真菌薬、緑内障治療薬、抗血友病薬、抗出血性薬(antihermorrhagic)、抗ヒスタミン薬、抗高脂血症薬、抗高リポタンパク血症薬(antihyperlipoproteinemic)、血圧降下剤、抗低血圧薬(antihypotensive)、抗感染薬、局所的な抗感染薬(anti- infective, topical)、抗炎症薬、抗角化薬(antikeratinizing agent)、抗マラリア薬、抗菌薬、抗片頭痛薬、抗真菌薬、制吐薬、抗腫瘍薬、抗好中球減少症薬、抗肥満薬(antiobessional agent)、駆虫薬、パーキンソン病治療薬(antiparkinsonian)、ぜん動抑制薬(antiperistaltic)、抗ニューモシスチス薬(antipneumocystic)、抗増殖薬(antiproliferative)、前立腺肥大症治療薬、抗原虫薬、止痒薬、抗精神病薬、抗リウマチ薬、抗住血吸虫薬、抗脂漏性薬、抗分泌薬(antisecretory)、鎮痙薬(antispasmodic)、抗血栓薬、鎮咳薬、抗潰瘍薬(anti-ulcerative)、抗尿石薬、抗ウイルス薬、食欲減退薬、良性前立腺増殖症治療薬、血糖調整剤、骨吸収阻害剤、気管支拡張剤、炭酸脱水酵素阻害薬、心機能抑制薬、心保護剤(cardioprotectant)、強心薬、心臓脈管薬(cardiovascular agent)、利胆薬(choleretic)、コリン作動薬、コリン作動性診断補助薬(cholinergic diagnostic aid)、利尿薬、ドパミン作用薬、外部寄生虫駆除剤(ectoparasiticide)、催吐剤、酵素阻害剤(enxzyme inhibitor)、エストロゲン、フィブリノーゲン分解薬、蛍光剤(flourescent agent)、フリー酸素ラジカルスカベンジャー(free oxygen radical scavenger)、胃運動性作動因子(gastrointestinal motility effector)、グルココルチコイド、性腺刺激原理(gonad-stimulating principle)、養毛刺激剤(hair growth stimulant)、止血薬、ヒスタミンH2受動態アンタゴニスト、ホルモン、低コレステロール血症、血糖降下薬、脂質低下薬、降圧剤、イメージング剤(imaging agent)、免疫化剤(immunizing agent)、免疫調整薬、免疫制御薬、免疫賦活薬(immunostimulant)、免疫抑制薬、陰萎治療薬、阻害剤、角質溶解剤、LNRNアゴニスト、肝臓障害処置薬(liver disorder treatment)、ルテロリジン、記憶補助剤(memory adjuvant)、精神能力賦活剤(mental performance enhancer)、気分調整剤(mood regulator)、粘液溶解物質、粘膜保護剤(mucosal protective agent)、散瞳薬、鼻充血抑制薬、神経筋遮断薬、神経保護剤、NMDAアンタゴニスト、非ホルモン性ステロール誘導体(non-hormonal sterol derivative)、子宮収縮薬、プラスミノーゲン活性化因子、血小板活性化因子アンタゴニスト、血小板凝集阻害薬、脳卒中後の処置薬および頭部外傷後の処置薬(post-stroke and post-head trauma treatment)、増強剤、プロゲスチン、プロスタグランジン、前立腺増殖阻害剤、プロサイロトロピン(prothyrotropin)、向精神薬、放射性医薬品、調整剤、弛緩薬、再分配剤(repartitioning agent)、抗疥癬薬、硬化薬(sclerosing agent)、鎮静薬、催眠鎮静薬(sedative-hypnotic)、選択的アデノシンA1アンタゴニスト(selective adenosine A1 antagonist)、セロトニンアンタゴニスト、セロトニン阻害剤、セロトニン受容体アンタゴニスト、ステロイド、刺激薬、抑制薬、症候性多発性硬化症(symptomatic multiple sclerosis)、協力剤、甲状腺ホルモン、甲状腺ホルモン阻害剤、甲状腺ホルモン様の薬剤(thyromimetic)、精神安定剤、筋萎縮性側索硬化症の処置薬、脳虚血の処置薬、パジェット病の処置薬、不安定狭心症の処置薬、尿酸排泄薬、血管収縮薬、血管拡張薬、傷薬、創傷治癒薬、キサンチンオキシダーゼ阻害剤(zxanthine oxidase inhibitor)。
【0044】
前述の生物学的薬剤の種類の例である具体的な生物学的薬剤は、以下のものを含むが、それらに限定されるわけではない。アセブトロール(Acebutolol)、アセブトロール、アシクロビル(Acyclovir)、アルブテロール(Albuterol)、アルフェンタニル(Alfentanil)、アルモトリプタン(Almotriptan)、アルプラゾラム(Alprazlam)、アミオダロン(Amiodarone)、アンレキサノクス(Amlexanox)、アムホテリシンB(Amphotericin B)、アトルバスタチン(Atorvastatin)、アトロピン(Atropine)、オーラノフィン(Auranofin)、オーロチオグルコース(Aurothioglucose)、ベナゼプリル(Benazepril)、ビカルタミド(Bicalutamide)、ブレチリウム(Bretylium)、ブリフェンタニル(Brifentanil)、ブロモクリプチン(Bromocriptine)、ブプレノルフィン(Buprenorphine)、ブトルファノール(Butorphanol)、ブスピロン(Buspirone)、カルシトニン(Calcitonin)、カンデサルタン(Candesartan)、カーフェンタニル(Carfentanil)、カルベジロール(Carvedilol)、クロルフェニラミン(Chlorpheniramine)、クロロチアジド(Chlorothiazide)、クロルフェンテルミン(Chlorphentermine)、クロルプロマジン(Chlorpromazine)、クリンダマイシン(Clindamycin)、クロニジン(Clonidine)、コデイン(Codeine)、シクロスポリン(Cyclosporine)、デシプラミン(Desipramine)、デスモプレシン(Desmopressin)、デキサメタゾン(Dexamethasone)、ジアゼパム(Diazepam)、ジクロフェナク(Diclofenac)、ジゴキシン(Digoxin)、ジヒドロコデイン(Digydrocodeine)、ドラセトロン(Dolasetron)、ドパミン(Dopamine)、ドキセピン(Doxepin)、ドキシサイクリン(Doxycycline)、ドロナビノール(Dronabinol)、ドロペリドール(Droperidol)、ジクロニン(Dyclonine)、エレトリプタン(Eletriptan)、エナラプリル(Enalapril)、エノキサパリン(Enoxaparin)、エフェドリン(Ephedrine)、エピネフリン(Epinephrine)、エルゴタミン(Ergotamine)、エトミデート(Etomidate)、ファモチジン(Famotidine)、フェロジピン(Felodipine)、フェンタニル(Fentanyl)、フェキソフェナジン(Fexofenadine)、フルコナゾール(Fluconazole)、フルオキセチン(Fluoxetine)、フルフェナジン(Fluphenazine)、フルルビプロフェン(Flurbiprofen)、フルバスタチン(Fluvastatin)、フルボキサミン(Fluvoxamine)、フロバトリプタン(Frovatriptan)、フロセミド(Furosemide)、ガンシクロビル(Ganciclovir)、金チオリンゴ酸ナトリウム(Gold sodium thiomalate)、グラニセトロン(Granisetron)、グリセオフルビン(Griseofulvin)、ハロペリドール(Haloperidol)、B型肝炎ウイルスワクチン(Hepatitis B Virus Vaccine)、ヒドララジン(Hydralazine)、ヒドロモルフォン(Hydromorphone)、インスリン(Insulin)、イプラトロピウム(Ipratropium)、イスラジピン(Isradipine)、二硝酸イソソルビド(Isosorbide Dinitrate)、ケタミン(Ketamine)、ケトロラック(Ketorolac)、ラベタロール(Labetalol)、レボルファノール(Levorphanol)、リシノプリル(Lisinopril)、ロラタジン(Loratadine)、ロラゼパム(Lorazepam)、ロサルタン(Losartan)、ロバスタチン(Lovastatin)、メラトニン(Melatonin)、メチルドパ(Methyldopa)、メチルフェニデート(Methylphenidate)、メトプロロール(Metoprolol)、ミダゾラム(Midazolam)、ミルタザピン(Mirtazapine)、モルヒネ(Morhpine)、ナドロール(Nadolol)、ナルプフィン(Nalbuphine)、ナロキソン(Naloxone)、ナルトレキソン(Naltrexone)、ナラトリプタン(Naratriptan)、ネオスチグミン(Neostgmine)、ニカルジピン(Nicardipine)、ニフェジピン(Nifedipine)、ノルエピネフリン(Norepinephrine)、ノルトリプチリン(Nortriptyline)、オクトレオチド(Octreotide)およびそのアナログ、オランザピン(Olanzapine)、オメプラゾール(Omeprazole)、オンダンセトロン(Ondansetron)、オキシブチニン(Oxybutynin)、オキシコドン(Oxycodone)、オキシモルフォン(Oxymorphone)、オキシトシン(Oxytocin)、フェニレフリン(Phenylephrine)、フェニルプロパノールアミン(Phenylpropanolamine)、フェニトイン(Phenytoin)、ピモジド(Pimozide)、ピオグリタゾン(Pioglitazone)、ピロキシカム(Piroxicam)、プラバスタチン(Pravastatin)、プラゾシン(Prazosin)、プロクロルペラジン(Prochlorperazine)、プロパフェノン(Propafenone)、プロクロルペラジン(Prochlorperazine)、プロピオマジン(Propiomazine)、プロポフォール(Propofol)、プロプラノール(Propranolol)、プソイドエフェドリン(Pseudoephedrine)、ピリドスチグミン(Pyridostigmine)、クエチアピン(Quetiapine)、ラロキシフェン(Raloxifene)、レミフェンタニル(Remifentanil)、rhuFab V2、ロフェコキシブ(Rofecoxib)、レパグリニド(Repaglinide)、リスペリドン(Risperidone)、リザトリプタン(Rizatriptan)、ロピニロール(Ropinirole)、ソマトスタチン(Somatostatin)およびそれらのアナログ、スコポラミン(Scopolamine)、セレギリン(Selegiline)、セルトラリン(Sertraline)、シルデナフィル(Sildenafil)、シンバスタチン(Simvastatin)、シロリムス(Sirolimus)、スピノラクトン(Spironolactone)、スフェンタニル(Sufentanil)、スマトリプタン(Sumatriptan)、タクロリムス(Tacrolimus)、タモキシフェン(Tamoxifen)、テルビナフィン(Terbinafine)、テルブタリン(Terbutaline)、テストステロン(Testosterone)、破傷風トキソイド(Tetanus toxoid)、THCトルテロジン(THC Tolterodine)、トリアムテレン(Triamterene)、トリアゾラム(Triazolam)、トリセタミド(Tricetamide)、バルサルタン(Valsartan)、ベンラファキシン(Venlafaxine)、ベラパミル(Verapamil)、ビスダイン(Visudyne)、ザレプロン(Zaleplon)、ザミナビル(Zanamivir)、ザフィルルカスト(Zafirlukast)、ゾルミトリプタン(Zolmitriptan)、ゾルピデム(Zolpidem)。
【0045】
組成物に含まれる生物学的薬剤の量は、望んでいる処置で投与される投与量によるが、典型的には生物学的薬剤は流動性組成物の重さに対して約0.001%〜約50%であり、より具体的には、流動性組成物の重さに対して約0.005〜約35%存在する。
【0046】
ある実施例において、本発明に係る流動性組成物には、抗片頭痛薬を生物学的薬剤として含めることができる。抗片頭痛薬には、ナラトリプタン、ゾルミトリプタン、リザトリプタン、フロバトリプタン、オクトレアチド(octreatide)、スマトリプタンなど、もしくはその他の「トリプタン」系の生物学的薬剤("triptan" biological agent)を含めることができる。
【0047】
他の実施例において、本発明に係る流動性組成物には、抗血管新生薬(antiangiogenic)を生物学的薬剤として含めることができる。糖尿病性網膜症(diabetic retinopathy)もしくは黄斑変性症(macular degeneration)の受療者を効果的に処置するために、流動性組成物によって網脈絡膜に抗血管新生薬を送達することができる。
【0048】
他の実施例において、本発明に係る流動性組成物には、ぶどう膜炎(uveitis)の受療者を効果的に処置するために、免疫抑制剤を生物学的薬剤として含めることができる。
【0049】
他の実施例において、本発明に係る流動性組成物には、免疫抑制剤もしくは抗炎症薬を生物学的薬剤として含めることができる。流動性組成物により、春季角結膜炎(vernal keratoconjunctivitis)の受療者を効果的に処置するために、免疫抑制剤もしくは抗炎症薬を瞼板結膜(tarsal conjunctiva) (270) に局所送達することができる。
【0050】
他の実施例において、本発明に係る流動性組成物には、創傷治癒薬を生物学的薬剤として含めることができる。流動性組成物は効果的に生物学的薬剤を保持し、角膜の傷に直接接触する可能性がある。
【0051】
他の実施例において、本発明に係る流動性組成物には、抗ウイルス薬、抗生物質(antibiotic agent)、抗真菌剤、もしくはそれらの配合物を含めることができる。流動性組成物により、効果的に感染症(例えば、細菌性、ウイルス性、もしくは真菌性)の処置をすることができると考えられる。
【0052】
他の実施例において、本発明に係る流動性組成物には、抗ウイルス薬を含めることができる。流動性組成物により、角膜 (350) もしくは (250)に抗ウイルス薬を送達し、ヘルペス性の結膜炎もしくは眼瞼炎を患っている受療者を効果的に処置することができると考えられる。
【0053】
本明細書中で、「処置」("treat" もしくは "treating")の語は、(i) 病理学上の症状もしくは関連する兆候が発祥することを防ぐこと(予防など)、(ii) 病理学上の症状もしくは関連する兆候を防ぐこと、もしくは、その進行を止めること、または、(iii) 病理学上の症状もしくは関連する兆候を緩和することを指す。
【0054】
当業者は、「可溶の」("soluble")および「不溶の」("insoluble")という語が、相対的なものであることを理解することができる。例えば、水への溶解度が約1 x 10-45 mg/Lである物質は相対的に水に不溶である。それでもなお、いくらかの水への溶解度(すなわち、別個(discrete)かつ有限の)を有する。この専門用語が不正確(impresice)なために、出願人は「完全に不溶から、全ての比率において完全に可溶の範囲の溶解度」("solubility ranging from completely insoluble in any proportion to completely soluble in all proportions,")、「少なくとも部分的に水溶性」("at least partially water-soluble,")、および「完全に水溶性」("completely water-soluble")という語を、有機溶媒/液体(organic solvent/liquid)を描写するのに使用している。
【0055】
当業者は、有機溶媒/液体の体液への溶解度は、特定の体液や特定の有機溶媒/液体などによって様々である可能性があることもまた、理解することができる。出願人は、有機溶媒/液体の体液への溶解度に対して定義するための一般に受け入れられているパラメータを知らないため、出願人は有機溶媒/液体の水への溶解度を用いて記載をしている。このことで、有機溶媒/液体の水への溶解度についての参考資料が作られていれば、それが有機溶媒/液体が同程度の体液への溶解度を有するとの判断基準を与え、指針になることが、当業者は理解することができる。全ての有機溶媒/液体の水への溶解度が、体液への溶解度と同じではないことが理解されているとはいえ、前述のとおりに指針を与える。
【0056】
「エステル結合」(ester linkage)の語は、-OC(=O)- もしくは -C(=O)O- のことを指す。「チオエステル結合」(thioester linkage)の語は、-SC(=O)- もしくは -C(=O)S- のことを指す。「アミド結合」(amide linkage)の語は、-N(R)C(=O)- もしくは -C(=O)N(R)- のことを指す。「リン酸エステル」(phosphoric acid ester)の語は、-OP(=O)2O-のことを指す。「スルホン酸エステル」(sulphonic acid ester)の語は、-SO2O- もしくは -OSO2- のことを指す。ここで、それぞれのRは、例えば水素、(C1-C20)アルキル、(C3-C6)シクロアルキル、(C3-C6)シクロアルキル(C1-C20)アルキル、アリール、ヘテロアリール、アリール(C1-C20)アルキル、もしくはヘテロアリール(C1-C20)アルキル、のような適切な有機ラジカルである。
【0057】
「アミノ酸」("amino acid,")の語は、天然アミノ酸残基(the residues of the natural amino acids)(例えばAla、Arg、Asn、Asp、Cys、Glu、Gln、Gly、His、Hyl、Hyp、Ile、Leu、Lys、Met、Phe、Pro、Ser、Thr、Trp、Tyr、および Valなど)のD体もしくはL体、さらには、非天然アミノ酸(例えば、ホスホセリン、ホスホトレオニン、ホスホチロシン、ヒドロキシプロリン、γ-カルボキシグルタミン、馬尿酸(hippuric acid)、オクタヒドロキシインドール-2-カルボン酸、スタチン(statine)、1,2,3,4-テトラヒドロイソキノリン-3-カルボン酸、ペニシラミン、オルニチン、シトルリン(citruline)、α-メチル-アラニン、パラ-ベンゾイルフェニルアラニン、フェニルグリシン、プロパルギルグリシン(propargylglycine)、サルコシン(sarcosine)、および、tert-ブチルグリシンなど)も含む。この語はまた、適切なアミノ保護基(例えば、アセチル基もしくはベンジルオキシカルボニル基など)を有する天然アミノ酸および非天然アミノ酸、さらには適切なカルボキシ末端が保護された(例えば、(C1-C6)アルキル、フェニルもしくはベンジルとのエステルまたはアミドとして、あるいはα-メチルベンジルアミドとして)天然アミノ酸および非天然アミノ酸も含む。他の適切なアミノ保護基もしくはカルボキシ保護基は当業者に知られている(例えばGreene, T.W.; Wutz, P.G.M. "Protecting Groups In Organic Synthesis" second edition, 1991, New York, John Wiley & sons, Inc., および、そこでの参考文献を参照のこと)。
【0058】
「ペプチド」("peptide")の語は、2〜35のアミノ酸(例えば先に定義したものなど)もしくはペプチジル残基(peptidyl residues)の配列を指す。配列は、線形であっても環状であっても良い。例えば、環状のペプチドは配列中の2つのシステイン残基の間にジスルフィド架橋(disulfide bridge)をさせることによって調製できるか、もしくは結果として生成することがある。好ましくは、ペプチドには3〜20分子、もしくは5〜15分子のアミノ酸を含む。ペプチド誘導体は、U.S. Patent Numbers 4,612,302、 4,853,371および 4,684,620 に開示されているようにして、あるいは、後述の本明細書の実施例部分に記載したようにして、調製することができる。本明細書に具体的に列挙されたペプチド配列は、アミノ末端が左、カルボキシ末端が右になるように記載されている。
【0059】
「糖類」("saccharide")の語は、任意の糖もしくはその他の炭水化物(carbohydrate)、特に単糖(simple sugar)もしくは炭水化物を指す。糖類は生きている細胞の不可欠な基本的構造であり、生物のエネルギー源である。この語は、分子量が小さい単糖、さらには、分子量の大きな物質も含む。糖類は、糖類の中に含まれている単糖類(monosaccharide)のグループによって分類される。
【0060】
「多糖類」("polysaccharide")の語は、化学的に互いに結合している(すなわちグリコシド結合(glycosidic linkage)をしている)糖の分子が含まれる、炭水化物の一種を指す。この語は、単糖類の連鎖でできている炭水化物である、任意の種類の炭水化物を指す。多糖類は複数の単糖類(単糖)の単位から成る。
【0061】
「脂肪酸」("fatty acid")の語は、脂質分子(lipid molecule)の一部を構成する、脂肪族のモノカルボン酸(aliphatic monocarboxylic acids)の一種であり、脂肪の加水分解によって得られる。この語は、脂肪類、油類、ならびに、動物の細胞膜中でリン脂質(phospholipids)および糖脂質(glycolipids)の一部として、見ることができる任意のいくつもの長鎖脂質カルボン酸(long lipid-carboxylic acid chains)を指す。
【0062】
「ポリアルコール」("polyalcohol")の語は、1以上(例えば2、3、4もしくは5など)のヒドロキシル基を含む炭化水素のことを指す。
【0063】
「炭水化物」("carbohydrate")の語は、生きている細胞の不可欠な基本的構造であり、生物のエネルギー源であるものを指す。この語は、分子量が小さい単糖、さらには、分子量の大きな物質も含む。糖類は、糖類の中に含まれている単糖類(monosaccharide)のグループによって分類される。この語は、ブドウ糖(C6H12O6)のような、可変の数の水素原子および酸素原子と結合した(ただし、水素原子と酸素原子の割合は常に水での割合である)、6原子の炭素原子(もしくは、6の倍数)を含む、糖類(sugars)、デンプン類、およびガム類(gums)を含む化合物のグループを指す。この語は炭素、酸素、および、水素の比が2H:1C:1Oで構成されている化合物もしくは分子のことを指す。炭水化物はスクロースおよびフルクトースのような単糖、またはキチンのような複雑な多糖類のポリマー(complex polysaccharide polymers)である可能性がある。
【0064】
本明細書中で「デンプン」("starch")は、α-(1,4)-D-グルコースのサブユニットおよびα-(1,6)-グルコシド結合の繰り返しで構成される、植物などの中に存在する複雑な多糖類のことを指す。
【0065】
本明細書中で「デキストリン」("dextrin")は、熱、酸、酵素、もしくはそれらの組み合わせによって、デンプンを部分的に分解してできる、中ぐらいの鎖長のグルコースのポリマーのことを指す。
【0066】
本明細書中で「マルトデキストリン」("maltodextrin")もしくは「グルコースポリマー」("glucose polymer")は、D-グルコース単位が主としてα-1,4-結合(α-1,4 bonds)で結合し、DE値(デキストロース当量(dextrose equivalent))が20以下である、甘くない栄養素となる糖類のポリマーを指す。例えば The United States Food and Drug Administration (21 C.F.R. paragraph 184.1444) を参照のこと。マルトデキストリンは部分的に加水分解されたデンプン製品(starch product)である。デンプンの加水分解製品は、乾燥したブドウ糖を基準として計算された還元糖のパーセンテージである、デキストロース当量(DE)として表される、加水分解の程度によって一般的には特徴づけられる。
【0067】
本明細書中で「シクロデキストリン」("cyclodextrins")は、天然のクラスレート(clathrates)で、例えばα-シクロデキストリン、β-シクロデキストリン、およびγ-シクロデキストリンのような、バシラスマセランアミラーゼ(Bacillus macerans amylase)のデンプンへの作用によって得られるものを指す。
【0068】
〔流動性組成物〕
本発明によって、生体適合性がある生分解性の熱可塑性ポリマー、ならびに、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩(biological agently acceptable salt)、もしくはそれらのプロドラッグが、生体適合性のある有機溶媒に溶解もしくは分散されている、流動性組成物が提供される。
【0069】
水媒体(aqueous medium)、体液、もしくは、水に接触させると、その流動性組成物が固形化して挿入物もしくは移植可能物(implantable article)を形成する。本発明に係る流動性組成物から形成された挿入物もしくは移植可能物は、薬剤のコントロールリリース(controlled drug release)に用いることができる。生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグは、流動性組成物が挿入物もしくは移植可能物に変換されると、固形化したポリマー基盤の中に含有される。挿入物が体内に存在するとき、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグは、挿入物の表面での直接溶解(direct dissolution)ならびに、熱可塑性ポリマーの分解および浸食(erosion)によって、ポリマー基盤を通して拡散することにより持続的に放出される。
【0070】
〔ポリマー〕
本発明に従って用いられる生体適合性がある生分解性の熱可塑性ポリマーは、ポリマー鎖(polymer chains)を形成する様々な単量体、もしくは、結合基(linking groups)で互いに結合している単量体単位(monomelic units)から調製することができる。これらには、ポリマー鎖、あるいは、主鎖に、エステル基、アミド基、ウレタン基、無水物、カーボネート基、尿素、エステルアミド基、アセタール基、ケタール基、およびオルトカーボネート基などの結合基、さらには、酵素反応もしくは加水分解反応で加水分解することができる任意の他の有機官能基(すなわち、この加水分解反応で生分解性があるもの)を有するポリマーが含まれる。これらのポリマーは一般に、これらの主鎖結合基(backbone linking groups)を形成する反応基(reactant groups)を含む出発モノマー(starting monomer)の反応によって調製される。例えば、アルコール類とカルボン酸類はエステル結合基を形成する。イソシアネート類とアミン類もしくはアルコール類はそれぞれ、尿素結合基もしくはウレタン結合基を形成する。
【0071】
本発明によると、一部の出発モノマーは少なくとも三官能基を持ち、好ましくは多官能基性(multifunctional)である。この多官能基性によって、結果として得られたポリマー鎖には少なくともいくつかの分岐分子鎖ができる。例えば、エステル結合基をポリマー主鎖に含むポリマーを選択するとき、出発モノマーは通常はヒドロキシカルボン酸類、ヒドロキシカルボン酸類の環状二量体、ヒドロキシカルボン酸類の環状三量体、ジオール類、もしくは、ジカルボン酸類となる。本発明に係るポリマーは、少なくとも多官能基性の出発モノマーを一部含むことによって得られる。さらに、本発明にかかるポリマーはポリマー分子あたり1つ以上の多官能基性単位(multifunctional unit)を含むことがあり、典型的には多くの多官能基性単位が重合反応の化学量論に従って含まれる。好ましくは、本発明にかかるポリマーは、ポリマー分子につき少なくとも一つの多官能基性単位を含む。それぞれのポリマー分子に一つの多機能性単位が含まれると、いわゆる、星型高分子もしくは分岐ポリマー(branched polymer)が形成される。本発明に係る、生分解性の生体適合性がある熱可塑性ポリマーは、線状ポリマー(linear polymer)とすることができる。またあるいは、生分解性の生体適合性がある熱可塑性ポリマーは、分岐ポリマー(branched polymer)とすることができる。
【0072】
例えば、前述のエステル結合基ポリマーには、ジヒドロキシカルボン酸が第一の種類の出発モノマーとして含まれるか、あるいは、トリオールおよび/またはトリカルボン酸が第二の種類の出発モノマーとして含まれる。同様に、トリオール、クァトラオール(quatraol)、ペンタオール、または、ヘキサオール(ソルビトールもしくはグルコースのなど)を第一の種類の出発モノマーとして含めることができる。同様の解釈がポリアミド類についても適用できる。トリアミン、および/または、酸の官能基が3つあるもの(triacid)は、ジアミンおよびジカルボン酸である出発モノマーとともに含まれることがある。アミノジカルボン酸、ジアミノカルボン酸、もしくは、トリアミンは第二の種類の出発モノマーであるアミノ酸と共に含まれることがある。特定の官能基を有する任意の脂肪族出発モノマー、芳香族出発モノマー、もしくはアリールアルキル出発モノマーは、本発明に従って分岐ポリマーを調製するのに用いることができ、ポリマー類およびその分解生成物が生体適合性であるものを提供する。これらの出発モノマーの生体適合規格(biocompatiblity specifications)は当業者にとって既知である。
【0073】
特に、本発明に係る生体適合性がある熱可塑性分岐ポリマーを調製するのに用いられるモノマーから、生体適合性であり生分解性があるポリマー類もしくはコポリマー類が生成される。本発明に係る、生体適合性がある熱可塑性の分岐ポリマーに用いるのに適した、生体適合性であり生分解性があるポリマー類の例には、ポリエステル類、ポリラクチド類(polylactides)、ポリグリコリド類(polyglycolides)、ポリカプロラクトン類(polycaprolactones)、ポリ無水物類(polyanhydrides)、ポリアミド類、ポリウレタン類、ポリエステルアミド類、ポリジオキサノン類(polydioxanones)、ポリアセタール類、ポリケタール類、ポリカーボネート類(polycarbonates)、ポリオルトカーボネート類(polyorthocarbonates)、ポリオルトエステル類(polyorthoesters)、ポリリン酸エステル類、ポリホスファゼン類(polyphosphazenes)、ポリヒドロキシ酪酸塩類(polyhydroxybutyrates)、ポリヒドロキシ吉草酸類(polyhydroxyvalerates)、ポリアルキレンシュウ酸類(polyalkylene oxalates)、ポリアルキレンコハク酸類(polyalkylene succinates)、ポリ(リンゴ酸)(poly(malic acid))、ポリ(アミノ酸類)(poly(amino acids))、および、それらのコポリマー、ターポリマー、またはそれらの結合物(combinations)、あるいはそれらの混合物が含まれる。
【0074】
本発明に係るポリマー組成物には、組成物の生分解性の特徴が望ましくないように妨げられない限り、本発明にかかるポリマーと他の生体適合性のポリマー類とのポリマーブレンド(polymer blends)を含めることができる。本発明に係るポリマーをこのような他のポリマー類と混合することによって、目標とした薬物送達のための望ましい正確な放出特性、もしくは整形外科に適用するなどのための望ましい挿入物構造を作るための望ましい正確な生体分解速度を設計するための自由度が大きくなると考えられる。
【0075】
本発明に係る、生体適合性がある熱可塑性のポリマー類もしくはコポリマー類の好ましいものは、結晶化度(degree of crystallization)が低く、より疎水的なものである。このようなポリマー類およびコポリマー類は、ポリグリコリドやキチンのような水素結合の割合が高い、結晶化度の高いポリマーに比べて、生体適合性のある有機溶媒に溶けやすい。望ましい溶解パラメータ(solubility parameter)を有する好ましい物質は、分岐ポリラクチド類、ポリカプロラクトン類、および、これらに無定形領域(amorphous regions)を増やして溶解度を高めるグリコリドが入ったコポリマー類である。一般に、生体適合性がある生分解性の熱可塑性ポリマーは、50〜60wt%までの固体を生成することができるように、実質的には有機溶媒に可溶である。好ましくは、85〜98wt%までの固体を生成することができるように、本発明に用いられるポリマーは、実質的に有機溶媒に完全に可溶である。また、1mLあたりの水に0.1g未満のポリマーが溶解もしくは分散するように、ポリマー類は少なくとも実質的には水に不溶である。好ましくは、本発明に用いるポリマーは、1mLあたりの水に0.001g未満のポリマーが溶解もしくは分散するように、ポリマー類は少なくとも実質的には水に不溶である。この好ましいレベルでは、水と混和性の溶媒との流動性組成物は、ほとんど直ちに固体のポリマーに変換する。
【0076】
〔溶媒/液体〕
流動性組成物に用いるのに適した液体は、生体適合性があり、水媒体、体液、もしくは水に、少なくとも少し可溶である。有機液体(organic liquid)は、水媒体、体液、もしくは水に、好ましくは少なくとも中程度に可溶であり、さらに好ましくは非常に可溶であり、もっとも好ましくは任意の濃度で溶解する。少なくとも水もしくは体液にわずかに可溶な有機液体は、秒単位から週単位の時間範囲において水をポリマー溶液の中に透過させることができ、ポリマー溶液を凝固、もしくは固化させる原因となる。少し溶解する液体は、ゆっくりと流動性組成物から拡散し、典型的には1日から数週間などの、日単位から週単位で変換させることができる。中程度に溶解する液体は、早く変換させつつも配置されてから成型しやすい組成物として扱うことができるための十分な時間があるように、分単位から日単位で拡散することができる。非常に溶解しやすい有機液体は、ほぼ直ちに変換が起こるように、流動性組成物から秒単位から時間単位で拡散する。有機液体は好ましくは、極性非プロトン性(polar aprotic)もしくは極性プロトン性(polar protic)の有機溶媒である。好ましくは、有機液体は、約30から約1000の範囲の分子量を有する。
【0077】
しかしながら、上記の記載は本発明を限定するものではなく、流動性組成物の固体への変換は、流動性組成物から周囲の水溶媒もしくは体液への有機液体の散逸と、周囲の水溶媒もしくは体液から流動性組成物の中の有機液体への水の注入との結果であると考えられる。この変換の間、流動性組成物中の熱可塑性のポリマーと有機液体の領域での存在割合はポリマーが多い部分と少ない部分があると考えられる。ポリマーが少ない領域は水が注入されることになり、その結果、得られた固体構造が多孔性になると考えられる。
【0078】
流動性組成物を構成するのに用いられることがある生体適合性のある有機液体の例には、外界温度および生理学的温度において液体であるか、あるいは少なくとも流動性である、直鎖、環状、および分枝の、脂肪族有機化合物、芳香族性有機化合物、ならびにアリールアルキル有機化合物であって、アルコール類、ケトン類、エーテル類、アミド類、エステル類、カーボネート類、スルホキシド類、スルホン類、および、生体組織(living tissue)と適合性のある他の任意の官能基の群のような官能基を有するものが含まれる。
【0079】
好ましい生体適合性のある有機液体は少なくともわずかに水もしくは体液に可溶なもので以下のものが含まれる。N-メチル-2-ピロリドン、2-ピロリドン、C1からC15のアルコール類、ジオール類、トリオール類、およびテトラオール類(エタノール、グリセリン、プロピレングリコール、ブタノールなど)、C3からC15のアルキルケトン類(アセトン、ジエチルケトン、およびメチルエチルケトンなど)、C3からC15のエステル類(酢酸メチル、酢酸エチル、乳酸エチルなど)、C1からC15のアミド類(ジメチルホルムアミド、ジメチルアセトアミド、およびカプロラクタム)、C3からC20のエーテル類(テトラヒドロフラン、もしくはソルケタール)、トウィーン、トリアセチン、プロピレンカーボネート、デシルメチルスルホキシド、ジメチルスルホキシド、オレイン酸、および1-ドデシルアザシクロヘプタン-2-オン。他の好ましい有機液体は、ベンジルアルコール、安息香酸ベンジル、ジプロピレングリコール、トリブチリン、オレイン酸エチル、グリセリン、グリコフラル(glycofural)、ミリスチン酸イソプロピル、パルミチン酸イソプロピル、オレイン酸、ポリエチレングリコール、プロピレンカーボネート、およびクエン酸トリエチルである。もっとも好ましい溶媒は、溶媒の溶解度および適合性から、N-メチル-2-ピロリドン、2-ピロリドン、ジメチルスルホキシド、トリアセチン、プロピレンカーボネートである
【0080】
様々な有機液体への生分解性の熱可塑性ポリマーの溶解度は、ポリマーの結晶度、ポリマーの親水性、水素結合、および分子量によって様々である。通常、分子量の小さいポリマーは分子量の大きいポリマーよりも、有機溶媒に早く溶解する。その結果、いろいろな有機液体に溶けているポリマーの濃度はポリマーの種類と分子量によって異なる。さらに、より分子量が大きいポリマーは分子量の小さいものに比べて溶液の粘性が高い傾向がある。
【0081】
一般に、本発明に係る有機液体中のポリマーの濃度は1mlの有機液体あたり約0.01gから飽和溶解度の間の範囲である。典型的には、飽和溶解度は1mlの有機液体あたり80〜95wt%の固体、もしくは溶媒の重さを1mlあたり1gmと仮定すると、4からおおよそ5gmの濃度の範囲である。
【0082】
ゆっくりと凝固する傾向があるポリマーについては、凝固速度(coagulation rate)を速めるのに混合溶媒を使うことができる。要するに、混合溶媒中のある液体成分(liquid component)はポリマーの良溶媒(good solvent)で、混合溶媒のもう一つの液体成分は溶解度が低い溶媒であるか、もしくは非溶剤(non-solvent)である。これらの2つの液体を、ポリマーがまだ可溶であるが生理環境(physiological environment)中での水のような非溶剤の量をわずかに増やすと沈殿するような割合で混合する。必ず溶媒系(solvent system)はポリマーと水の混和性(miscible)でなければならない。このような2成分の溶媒系の例は、N-メチルピロリドンとエタノールの使用である。エタノールをNMP/ポリマー溶液に加えると、その凝固速度が増加する。
【0083】
もし、組成物の有機液体のあるサブグループを用いると、組成物の柔軟性は実質的にその挿入物としての耐用年限の間維持させることができる。このような有機液体は熱可塑性ポリマーの可塑剤(plasticizer)としても作用する可能性があり、その有機液体の水への溶解度が低い場合を除いて、少なくとも部分的には体液中に分散するよりもむしろ残ることがある。このような水への溶解度が低く、可塑特性(plasticizing properties)がある有機液体は、水への溶解度が高い有機液体に加えて、組成物に含まれることがある。後者の場合には、好ましくは、第一の有機液体は体液中に早く分散する。
【0084】
水への溶解度が低い有機液体、すなわち、水中で5重量%未満の水溶液を形成するものも挿入組成物(implant composition)の有機液体として用いることができる。このような有機液体もまた熱可塑性ポリマーの可塑剤として作用する可能性がある。有機液体がこれらの性質を有しているとき、有機液体のサブグループの構成物を「可塑性有機液体」("plasticizer organic liquids")と本明細書中で呼ぶ。挿入されたときに受療者がより快適なものになるように、可塑性有機液体を挿入組成物の柔軟性と成形性に影響させる。さらに、可塑性有機液体は生物学的薬剤の徐放速度(rate of sustained release)に影響するため、挿入組成物に含まれる有機液体の性質によって速度を加速させたり減速させたりできる。水への溶解度が低い有機液体であっても、挿入組成物の有機液体として単に可塑剤能力(plasticizing ability)を用いることもでき、以下のような組み合わせとして用いるのが好ましい。水への溶解度が高い溶媒を挿入組成物で初めに用いる溶媒として選択したときには、水への溶解度が低く可塑剤能力を有する第二の有機液体を用いることによって可塑性に影響させることができる。この場合には、第二の有機液体は有機液体サブグループの構成物で、持続時間の間は少なくとも部分的に挿入組成物の中に残存する。一般に可塑剤として作用する有機液体は固体の熱可塑性基盤中の分子運動を促進する。可塑剤能力により、柔軟性と成型容易性が得られるように、基盤のポリマー分子がお互いに動くことができる。可塑剤能力は、生理活性薬剤が容易に動くことができるようにすることもでき、いくつかの場合においては徐放速度も増大もしくは減少するように影響する。
【0085】
〔水への溶解度が高い溶媒/液体〕
水への溶解度が高い有機液体は、一般に、挿入組成物を挿入した後の柔軟性が問題とならない場合の、挿入組成物に用いることができる。水への溶解度が高い有機液体を用いると、流動性組成物の物理的特徴を有する挿入物が提供され、流動性組成物を直接注入することによって挿入物が作られる。このような挿入物と流動性組成物の先駆物質は、例えば、U.S. Pat. Nos. 4,938,763 および 5,278,201に記載されており、その開示を参照することによって本明細書に含まれる。
【0086】
有用な、水への溶解度が高い有機液体には、例えば以下のものが含まれる。置換複素環化合物(N-メチル-2-ピロリドン(NMP)、および、2-ピロリドンなど)、C2〜C10のアルカン酸(酢酸および乳酸など)、ヒドロキシ酸類(hydroxy acids)のエステル(乳酸メチル、乳酸エチル、クエン酸アルキル、など)、ポリカルボン酸類のモノエステル類(コハク酸モノメチル、クエン酸モノメチルなど)、エーテルアルコール類(ether alcohol)(グリコフロール(glycofurol)、グリセロールフォーマル(glycerol formal)、イソプロピリデングリコール(isopropylidene glycol)、2,2-ジメチル-1,3-ジオキソロン-4-メタノール、など)、ソルケタール、ジアルキルアミド類(ジメチルホルムアミド、ジメチルアセトアミド、ジメチルスルホキシド(DMSO)およびジメチルスルホンなど)、ラクトン類(エプシロン(epsilon)、カプロラクトン、およびブチロラクトンなど)、環状アルキルアミド類(カプロラクタムなど)、ならびにこれらの混合物ならびに配合物。好ましい有機液体には、N-メチル-2-ピロリドン、2-ピロリドン、ジメチルスルホキシド、乳酸エチル、グリコフロール、グリセロールフォーマル、イソプロピリデングリコールが含まれる。
【0087】
〔水への溶解度が低い溶媒/液体〕
前述のとおり、水への溶解度が低い有機液体もまた、挿入組成物に用いることができる。好ましくは、水への溶解度が低い有機液体は挿入物が柔軟性と押し出し可能性(extrudable)を有することが望まれる場合に用いることができる。また、ある状況下では、水への溶解度が低い溶媒を用いることが、生物学的薬剤の徐放速度に影響する。典型的にはこのような状況には、有機液体が挿入物の中に保持されていること、および、有機液体が可塑剤として作用することが含まれる。
【0088】
水への溶解度が低い有機液体の例には以下のものが含まれる。炭酸とアリールアルコール類のエステル類(安息香酸ベンジルなど)、C4〜C10のアルキルアルコール類、C1〜C6アルキルC2〜C6アルカン酸エステル類(C1to C6 alkyl C2 to C6 alkanoates)、炭酸とアルキルアルコール類のエステル(プロピレンカーボネート、エチレンカーボネート、およびジメチルカーボネートなど)、モノカルボン酸類のアルキルエステル類、ジカルボン酸類のアルキルエステル類、およびトリカルボン酸類のアルキルエステル類(酢酸2-エトキシエチル(2-ethyoxyethyl acetate)、酢酸エチル、酢酸メチル、酪酸エチル、マロン酸ジエチル、グルコン酸ジエチル(diethyl glutonate)、クエン酸トリブチル、コハク酸ジエチル、トリブチリン、ミスチリン酸イソプロピル、アジピン酸ジメチル、コハク酸ジメチル、シュウ酸ジメチル、クエン酸ジメチル、クエン酸トリエチル、クエン酸アセチルトリブチル(acetyl tributyl citrate)、グリセリン三酢酸エステル(glyceryl triacetate)など)、アルキルケトン類(メチルエチルケトンなど)、さらには、その他のカルボニル、エーテル、カルボン酸エステル、アミド、ならびにヒドロキシル基を含んでいる有機化合物の液体であって、水にいくらか可溶であるもの。プロピレンカーボネート、酢酸エチル、クエン酸トリエチル、ミスチリン酸イソプロピル、およびグリセリン三酢酸エステルが、それらの生分解性と生物学的薬剤の許容性から、望ましいものである。
【0089】
追加的に、物質を形成する基盤への様々な程度の溶解度が得られる、前述の水への溶解度が高い有機液体と水への溶解度が低い有機液体の混合物は、挿入組成物の硬化速度(hardening rate)を変更するのに用いることができる。例としてはN-メチルピロリドン単独よりも疎水性の溶媒であるN-メチルピロリドンとプロピレンカーボネートの配合物、および、N-メチルピロリドン単独よりも親水性の溶媒であるN-メチルピロリドンとポリエチレングリコールの配合物が含まれる。
【0090】
プロドラッグには、例えば以下のような当業者によく知られているヒドロキシル誘導体類およびアミノ誘導体類も含まれる。親ヒドロキシル化合物と適切なカルボン酸との反応で調製されるエステル類、もしくは親アミノ化合物と適切なカルボン酸との反応で調製されるアミド類。化合物のペンダントヒドロキシル基から誘導された、簡単な脂肪族もしくは芳香族エステル類を、本発明に係るプロドラッグとして用いることができる。ある場合には、(アシルオキシ)アルキルエステル類、もしくは、((アルコキシカルボニル)オキシ)アルキルエステル類などのような2箇所がエステルとなっている種類のプロドラッグ類(double ester type prodrugs)が望ましいことがある。特にプロドラッグとして適しているエステルには、メチルエステル、エチルエステル、プロピルエステル、イソプロピルエステル、n-ブチルエステル、イソブチルエステル、tert-ブチルエステル、およびモノホリノエチルエステル(morpholinoethyl)が含まれる。
【0091】
Hydrolysis in Drug and Prodrug Metabolism: Chemistry, Biochemistry, and Enzymology, by Bernard Testa and Joachim Mayer; Vch Verlagsgesellschaft Mbh (August 2003) は代謝反応ならびに薬剤およびプロドラッグの加水分解にかかわる酵素類についての包括的な総説である。そのテキストには、生体内変化(biotransformation)の重要性が記載され、加水分解酵素類(hydrolytic enzymes)、アミド類の加水分解、およびラクタム類の加水分解の生理学的役割が考察されている。その他の参考文献には例えば以下のものがある。 Biological Approaches to the Controlled Delivery of Drugs (Annals of the New York Academy of Sciences, Vol. 507), R.L. Juliano (editor) (February 1988)、 Design of Biobiological agent Properties through Prodrugs and Analogs, Edward B. Roche (editor), Amer Biological agent Assn (MacK) (June 1977)、 Prodrugs: Topical and Ocular Drug Delivery (Drugs and the Biological agent Sciences, Vol. 53), Kenneth B. Sloan (editor) Marcel Dekker (March 17, 1992)、 Enzyme-Prodrug Strategies for Cancer Therapy, Roger G. Melton (editor), Richard J. Knox (editor), Plenum Press (February 1999)、 Design of Prodrugs, Hans Bundgaard (editor), Elsevier Science (February 1986)、 Textbook of Drug Design and Development, Povl Krogsgaard- Larsen, Hans Bundgaard (editor), Hardwood Academic Pub (May 1991)、 Conversion of Non-Toxic Prodrugs to Active, Anti-Neoplastic Drugs Selectively in Breast Cancer Metastases, Basse, Per H. (September 2000)、 and Marine lipids for produrgs, of compounds and other biological agent applications, M. Masson, T. Loftsson and G. G. Haraldsson, Die Pharmazie, 55 (3), 172-177 (2000)。
【0092】
本発明において用いられるプロドラッグは、溶媒和または生物学的活性な化合物を得るための生理学的条件下で、化学的にもしくは代謝的に切断される任意の適切な官能基を含むことができる。適切な官能基には、カルボン酸エステル類、アミド類、およびチオエステル類などが含まれる。生物学的に活性な化合物の反応性のある官能基によって、対応する官能基の適したリンカー前駆物質(linker precursor)を以下の例えばプロドラッグ中のエステル結合、チオエステル結合、もしくはアミド結合などを示した表から選択することができる。
【0093】
【表1】

【0094】
〔リンカー前駆物質および結合基〕
生物学的活性な化合物(biologically acive compound)は、適切なリンカー前駆物質と結合してプロドラッグを提供する可能性がある。先に示したように、本発明に係る生物学的活性な化合物の反応性の官能基は、典型的にはリンカー前駆物質に存在する必要がある官能基に影響する。リンカー前駆物質の性質は、重大な意味を有するものではなく、許容できるメカニズム上の性質と選択された治癒的適用のための放出速度論を有する本発明に用いられるプロドラッグを提供する。リンカー前駆物質は、典型的には分子量が約25ダルトンから約400ダルトンである二価の有機ラジカルである。さらに好ましくは、リンカー前駆物質の分子量は、約40ダルトンから約200ダルトンである。
【0095】
プロドラッグに存在する結果として得られる結合基は、生物学的に不活性であるか、もしくはそれ自身が生物学的活性を有している。結合基は、プロドラッグの溶解度を変更するため、もしくは、プロドラッグの生体内分布(biodistribution)を変化させるために、プロドラッグの性質(他の分子に付加するなど)を変更させるための、その他の官能基(ヒドロキシル基、メルカプト基、アミン基、カルボン酸類、さらにはその他の官能基など)もまた含む可能性がある。
【0096】
具体的には、結合基は、二価の、分鎖もしくは直鎖の(unbranched)、飽和もしくは不飽和の、炭素数が1〜50の炭化水素鎖である。ここで、1以上の(1、2、3、もしくは4など)の炭素原子は、(-O-)、または、(-NR-、(さらにここで、Rは水素、アルキル基、シクロアルキルアルキル基、もしくは、アリールアルキル基)で任意に置換される。また、アルキル鎖は、アルコシキ基、置換アルコキシ基、シクロアルキル基、置換シクロアルキル基、アルカノイル基、アルカノイルオキシ基、アルコキシカルボニル基、アルキルチオ基、置換アルキルチオ基、ヒドロキシカルボニル基、アジド基、シアノ基、ニトロ基、ハロ基、ヒドロキシ基、オキソ基、カルボニル基、アリール基、置換アリール基、アリールオキシ基、置換アリールオキシ基、ヘテロアリール基、置換ヘテロアリール基、ヘテロアリールオキシ基、置換へテロアリールオキシ基、COOR、もしくはNRR、(ここで、Rは独立に水素、アルキル基、シクロアルキルアルキル基、もしくはアリールアルキル基である可能性がある)の群から選択された1以上の(1、2、3、もしくは4など)置換基の炭素原子で任意に置換される。
【0097】
「アルキル」("alkyl")の語は、好ましくは炭素数が1〜40、さらに好ましくは炭素数が1〜10、さらになお好ましくは炭素数が1〜6の、分鎖もしくは直鎖の(unbranched)炭化水素鎖のモノラジカル(monoradical)を指す。この語の例には、メチル、エチル、n-プロピル、イソプロピル、n-ブチル、イソブチル、sec-ブチル、n-ヘキシル、n-デシル、テトラデシルなどがある。
【0098】
アルキルは任意に1以上の、アルコキシ基、ハロ基、ハロアルキル基、ヒドロキシル基、ヒドロキシアルキル基、アリール基、ヘテロアリール基、複素環基、シクロアルキル基、アルカノイル基、アルコキシカルボニル基、アミノ基、アルキルアミノ基、アシルアミノ基、ニトロ基、トリフルオロメチル基、トリフルオロメトキシ基、カルボキシ基、カルボキシアルキル基、ケト基、チオキソ基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、およびシアノ基で任意に置換される可能性がある。
【0099】
「アルキレン」("alkylene")の語は、好ましくは炭素数が1〜40、さらに好ましくは炭素数が1〜10、さらになお好ましくは炭素数が1〜6の、分鎖もしくは直鎖の(unbranched)炭化水素鎖のジラジカル(diradical)を指す。この語の例には、メチレン、エチレン、n-プロピレン、イソプロピレン、n-ブチレン、イソブチレン、sec-ブチレン、n-ヘキシレン、n-デシレン、テトラデシレンなどがある。
【0100】
アルキレンは任意に1以上の、アルコキシ基、ハロ基、ハロアルキル基、ヒドロキシル基、ヒドロキシアルキル基、アリール基、ヘテロアリール基、複素環基、シクロアルキル基、アルカノイル基、アルコキシカルボニル基、アミノ基、アルキルアミノ基、アシルアミノ基、ニトロ基、トリフルオロメチル基、トリフルオロメトキシ基、カルボキシ基、カルボキシアルキル基、ケト基、チオキソ基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、およびシアノ基で任意に置換される可能性がある。
【0101】
「アルコキシ」("alkoxy")の語は、アルキル-O- の基を指し、ここで、アルキルは本明細書中で定義したものである。好ましいアルコキシ基には、例えば、メトキシ基、エトキシ基、n-プロポキシ基、イソプロポキシ基、n-ブトキシ基、tert-ブトキシ基、sec-ブトキシ基、n-ペントオキシ基、n-ヘキソキシ基(n-hexoxy)、1,2-ジメチルブトキシ基などがある。
【0102】
アルコキシは任意に1以上の、ハロ基、ハロアルキル基、ヒドロキシル基、ヒドロキシアルキル基、アリール基、ヘテロアリール基、複素環基、シクロアルキル基、アルカノイル基、アルコキシカルボニル基、アミノ基、アルキルアミノ基、アシルアミノ基、ニトロ基、トリフルオロメチル基、トリフルオロメトキシ基、カルボキシ基、カルボキシアルキル基、ケト基、チオキソ基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、およびシアノ基で任意に置換される可能性がある。
【0103】
「アリール基」("aryl")の語は、6〜20の炭素原子を有する単環式の(フェニル基など)、もしくは複数の環が縮合した環の(縮合環)、不飽和の芳香族性炭素環であって、少なくとも一つの環が芳香族性(ナフチル基、ジヒドロフェナントレニル基、フルオレニル基、もしくはアントリル基など)であるものである。好ましいアリール基にはフェニル基、ナフチル基などが含まれる。
【0104】
アリール基は任意に1以上の、アルキル基、アルコキシ基、ハロ基、ハロアルキル基、ヒドロキシル基、ヒドロキシアルキル基、ヘテロアリール基、複素環基、シクロアルキル基、アルカノイル基、アルコキシカルボニル基、アミノ基、アルキルアミノ基、アシルアミノ基、ニトロ基、トリフルオロメチル基、トリフルオロメトキシ基、カルボキシ基、カルボキシアルキル基、ケト基、チオキソ基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、およびシアノ基で任意に置換される可能性がある。
【0105】
「シクロアルキル基」("cycloalkyl")の語は、3〜20の炭素原子が一つの環もしくは複数の縮合環となっている環状のアルキル基のことを指す。このようなシクロアルキル基には、一例として、シクロプロピル基、シクロブチル基、シクロペンチル基、シクロオクチル基、などの単環式構造、もしくはアダマンタニル基(adamantanyl)などのような多環式構造が含まれる。
【0106】
シクロアルキル基は、任意に1以上の、アルキル基、アルコキシ基、ハロ基、ハロアルキル基、ヒドロキシル基、ヒドロキシアルキル基、アリール基、ヘテロアリール基、複素環基、アルカノイル基、アルコキシカルボニル基、アミノ基、アルキルアミノ基、アシルアミノ基、ニトロ基、トリフルオロメチル基、トリフルオロメトキシ基、カルボキシ基、カルボキシアルキル基、ケト基、チオキソ基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、およびシアノ基で任意に置換される可能性がある。
【0107】
「ハロ基」("halo")の語は、フルオロ基、クロロ基、ブロモ基、および、ヨード基のことを指す。同様に、「ハロゲン」("halogen")の語は、フッ素、塩素、臭素、およびヨウ素を指す。
【0108】
「ハロアルキル」("Haloalkyl")の語は、本明細書で定義したアルキルが、1〜4の本明細書で定義したハロ基(ここでハロ基は同じものであっても異なるものであっても良い)で置換されたものを指す。ハロアルキル基の例としては、一例として、トリフルオロメチル基、3-フルオロドデシル基、12,12,12-トリフルオロドデシル基、2-ブロモオクチル基、3-ブロモ-6-クロロヘプチル基などがある。
【0109】
「ヘテロアリール基」("heteroaryl")の語は本明細書中で、次のように定義される。1、2、もしくは3の芳香族環を含む、単環式、二環式、もしくは三環式の環状構造であって、少なくとも一つの窒素原子、酸素原子、もしくは硫黄原子が芳香族環の中に含まれているもので、非置換のもの、または例えば1箇所以上、特には1〜3箇所が、ハロ基、アルキル基、ヒドロキシル基、ヒドロキシアルキル基、アルコキシ基、アルコキシアルキル基、ハロアルキル基、ニトロ基、アミノ基、アルキルアミノ基、アシルアミノ基、アルキルチオ基、アルキルスルフィニル基、およびアルキルスルホニル基などの置換基で置換されたものである。ヘテロアリール基の例には以下のものが含まれるが、それらに限定されるわけではない。2H-ピロリル基、3H-インドリル基、4H-キノリジニル基、4nH-カルバゾリル基、アクリジニル基、ベンゾ[b]チエニル基、ベンゾチアゾリル基、D-カルボリニル基(D-carbolinyl)、カルバゾリル基、クロメニル基(chromenyl)、シンナオリニル基(cinnaolinyl)、ジベンゾ[b,d]フラニル基、フラザニル基、フリル基、イミダゾリル基、イミジゾリル基、インダゾリル基、インドリシニル基、インドリル基、イゾベンゾフラニル基、イソインドリル基、イソキノリル基、イソチアゾリル基、イソオキサゾリル基、ナフチリジニル基、ナフト[2,3-b]基、オキサゾリル基、ペリミジニル基(perimidinyl)、フェナントリジニル基(phenanthridinyl)、フェナントロリニル基、フェナサジニル基(phenarsazinyl)、フェナジニル基(phenazinyl)、フェノチアジニル基、フェノキサチニル基(phenoxathiinyl)、フェノキサジニル基、フタラジニル基(phthalazinyl)、プテリジニル基(pteridinyl)、プリニル基、ピラニル基、ピラリジニル基、ピラゾリル基、ピリダジニル基、ピリジル基、ピリミジニル基(pyrimidinyl)、ピリミジニル基(pyrimidinyl)、ピロリル基、キナゾリニル基、キノリル基、キノキサリニル基、チアジアゾリル基(thiadiazolyl)、チアントレニル基(thianthrenyl)、チアゾリル基、チエニル基、チアゾリル基、およびキサンテニル基。ある実施例では「ヘテロアリール基」("heteroaryl")は、炭素原子ならびに、過酸化物でない酸素(non-peroxide oxygen)、硫黄、N(Z) の群から独立に選択された1、2、3、もしくは4原子のヘテロ原子を含む5員または6員の単環式芳香環と定義される。ここで、Zは何もないか、またはH、O、アルキル基、フェニル基、もしくはベンジル基である。他の実施例では、ヘテロアリール基は、8員から10員のオルト位で縮合した二環式複素環(ortho-fused bicyclic heterocycle)と定義され、特に、ベンゼン誘導体または、プロピレンの縮合から得られるもの、もしくは、それに加えてテトラメチレンジラジカルから誘導されたものである。
【0110】
ヘテロアリール基は、任意に1以上の、アルキル基、アルコキシ基、ハロ基、ハロアルキル基、ヒドロキシル基、ヒドロキシアルキル基、アリール基、複素環基、シクロアルキル基、アルカノイル基、アルコキシカルボニル基、アミノ基、アルキルアミノ基、アシルアミノ基、ニトロ基、トリフルオロメチル基、トリフルオロメトキシ基、カルボキシ基、カルボキシアルキル基、ケト基、チオキソ基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、およびシアノ基で任意に置換される可能性がある。
【0111】
「複素環基」("heterocycle")の語は、飽和のもしくは部分的に不飽和の環構造で、酸素、窒素、および硫黄の群から選択された少なくとも一原子のヘテロ原子を含み、アルキル基またはC(=O)ORbで任意に置換されたものを指す。ここで、Rbは酸素もしくはアルキル基である。典型的な複素環基は、一原子以上の、酸素、窒素、および硫黄の群から選択されるヘテロ原子を含む単環式、二環式、もしくは三環式の基である。複素環基は環に結合した (=O) もまた含む可能性がある。複素環基の例としては以下のものが含まれるがそれらに限定されるわけではない。1,3-ジヒドロベンゾフラン、1,3-ジオキソラン(dioxolane)、1,4-ジオキサン、1,4-ジチアン、2H-ピラン、2-ピラゾリン、4H-ピラン、クロマニル基(chromanyl)、イミダゾリジニル基、イミダゾリル基、インドリニル基、イソクロマニル基(isochromanyl)、イソインドリル基、モルホリン、ピペラジニル基、ピペリジン、ピペリジル基、ピラゾリジン、ピラゾリジニル基、ピラゾリニル基、ピロリジン、ピロリン、キヌクリジン、およびチオモルホリン。
【0112】
複素環基は、任意に1以上の、アルキル基、アルコキシ基、ハロ基、ハロアルキル基、ヒドロキシル基、ヒドロキシアルキル基、アリール基、ヘテロアリール基、複素環基、シクロアルキル基、アルカノイル基、アルコキシカルボニル基、アミノ基、アルキルアミノ基、アシルアミノ基、ニトロ基、トリフルオロメチル基、トリフルオロメトキシ基、カルボキシ基、カルボキシアルキル基、ケト基、チオキソ基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、およびシアノ基で任意に置換される可能性がある。
【0113】
窒素を含んだ複素環類およびヘテロアリール類(nitrogen heterocycles and heteroaryls)の例には、ピロール、イミダゾール、ピラゾール、ピリジン、ピラジン、ピリミジン、ピリダジン、インドリジン、イソインドール、インドール、インダゾール、プリン、キノリジン、イソキノリン、キノリン、フタラジン、ナフチルピリジン、キノキサリン(quinoxaline)、キナゾリン、シンノリン(cinnoline)、プテリジン、カルバゾール、カルボリン、フェナントリジン、アクリジン、フェナントロリン、イソチアゾール、フェナジン、イソキサゾール、フェノキサジン、フェノチアジン、イミダゾリジン、イミダゾリン、ピペリジン、ピペラジン、インドリン、モルホリノ基、ピペリジニル基、テトラヒドロフラニル基など、さらには、N-アルキル-窒素を含む複素環類が含まれるが、それらに限定されるわけではない。
【0114】
他の種類の複素環(heterocyclics)は「クラウン化合物」("crown compounds")として知られており、[-(CH2-)aA-](ここで、aは2以上)の構造の1以上の繰り返し単位を有し、それぞれ別の物質での(separate occurrence)Aは、O、N、SもしくはPである可能性がある特殊な種類の複素環化合物のことである。クラウン化合物の例には、一例として、[-(CH2)3-NH-]3、[-((CH2)2-O)4-((CH2)2-NH)2]などが含まれる。典型的には、このようなクラウン化合物は4原子から10原子のヘテロ原子、および、8原子から40原子の炭素原子を有する可能性がある。
【0115】
「アルカノイル基」("alkanoyl")の語は、C(=O)Rを指し、ここでRは先に定義したアルキル基である。
【0116】
「アルキルカルボニル基」("alkoxycarbonyl")の語は、C(=O)ORを指し、ここでRは先に定義したアルキル基である。
【0117】
「アミノ基」("amino")の語は-NH2を指し、「アルキルアミノ基」("alkylamino")の語は-NR2を指す。ここで少なくとも一つのRはアルキル基であり、2つ目のRはアルキル基もしくは水素である。「アシルアミノ基」("acylamino")の語は、RC(=O)Nを指し、ここでRはアルキル基もしくはアリール基である。
【0118】
「ニトロ基」("nitro")の語は-NO2を指す。
【0119】
「トリフルオロメチル基」("trifluoromethyl")の語は -CF3を指す。
【0120】
「トリフルオロメトキシ基」("trifluoromethoxy")の語は-OCF3を指す。
【0121】
「シアノ基」("cyano")の語は-CNを指す。
【0122】
「ヒドロキシル基」("hydroxy")の語は-OHを指す。
【0123】
「置換」("Substituted")は、「置換された」("substituted")という表現を用いて示されている原子に結合している一原子以上の水素が、示された群(indicated groups)の中から選択された基と置き換えられ、その示されている原子の通常の価数を超えていないものとなり、置き換えの結果物が安定な化合物であることを示す。適切な「示された群」(indicated groups)には、例えばアルキル基、アルコキシ基、ハロ基、ハロアルキル基、ヒドロキシル基、ヒドロキシアルキル基、アリール基、ヘテロアリール基、複素環基、シクロアルキル基、アルカノイル基、アルコキシカルボニル基、アミノ基、アルキルアミノ基、アシルアミノ基、ニトロ基、トリフルオロメチル基、トリフルオロメトキシ基、カルボキシ基、カルボキシアルキル基、ケト基、チオキソ基、アルキルチオ基、アルキルスルフィニル基、アルキルスルホニル基、およびシアノ基などが含まれる。置換基がケト基(すなわち、=O)もしくはチオキソ基(すなわち、=S)である場合は、2原子の水素が置き換えられている。
【0124】
一つ以上の置換基を含む上記の任意の群に関して、当然ながら、このような置換基が立体的に実現不可能および/または合成的に実現不可能な置換や置換パターン(substitution patterns)でないことが理解できる。さらに、本発明に係る化合物はそれらの化合物の置換によって生じる全ての立体異性体を含んでいる。
【0125】
特に結合基は二価のペプチド、アミノ酸、脂肪酸、糖類、多糖類、ポリアルコール(例えばPEGもしくはPVA)、デンプン、デキストリン、マルトデキストリン、シクロデキストリン、または、炭水化物である可能性がある。例えば、結合基が二価のペプチド、アミノ酸、糖類、多糖類、もしくは、ポリアルコールである可能性がある。
【0126】
ある具体的な本発明に係る実施例では、結合基自体が生物学的活性を有する可能性がある。例えば、結合基は、成長ホルモン放出ホルモン(GHRP)、黄体形成ホルモン放出ホルモン(LHRH)、酢酸ロイプロリド、ソマトスタチン、ボンベシン、ガストリン放出ペプチド(GRP)、カルシトニン、ブラジキニン、ガラニン、メラニン細胞刺激ホルモン(MSH)、成長ホルモン放出因子(GRF)、アミリン、タキキニン、セクレチン、副甲状腺ホルモン(PTH)、エンケファリン、エンドセリン、カルシトニン遺伝子放出ペプチド(calcitonin gene releasing peptide)(CGRP)、ニューロメディン、副甲状腺ホルモン関連タンパク質(PTHrP)、グルカゴン、ニューロテンシン、副腎皮質刺激ホルモン(adrenocorticotrophic hormone)(ACTH)、ペプチドYY(PYY)、グルカゴン放出ペプチド(GLP)、血管作用性小腸ペプチド(VIP)、下垂体アデニル酸シクラーゼ活性化ペプチド(pituitary adenylate cyclase activating peptide)(PACAP)、モチリン、サブスタンスP、ニューロペプチドY(NPY)、TSH、ならびに、それらのアナログおよびフラグメントなどの、二価の生理活性のペプチドである可能性がある。たとえば、U.S. Patent Nos. 6,221,958、 6,113,943、 および 5,863,985を参照のこと。
【0127】
ある具体的な本発明に係る実施例では、結合基は親油性(lipophillic)である可能性がある。本発明についての他の実施例では、結合基は親水性である可能性がある。
【0128】
安定な種類のプロドラッグには以下の構造式(I)の化合物が含まれる。
【0129】
【化1】

【0130】
ここで、
Dは、本明細書で開示した生物学的に活性な化合物のモノラジカルであり、
X1は、カルボン酸エステル結合基(carboxylic ester linkage)、アミド結合基、チオエステル結合基、リン酸エステル結合基、もしくはスルホン酸エステル結合基であって、かつ、
L1は、結合基である。
【0131】
他の安定な種類のプロドラッグには以下の構造式(II)の化合物が含まれる。
【0132】
【化2】

【0133】
ここで、
それぞれのDは独立に、本明細書で開示した生物学的に活性な化合物のモノラジカル、もしくはジラジカルであり、
それぞれのX1は、カルボン酸エステル結合基、アミド結合基、チオエステル結合基、リン酸エステル結合基、もしくはスルホン酸エステル結合基であって、
それぞれのL1は、独立に結合基であり、
X2は、カルボン酸エステル、アミド、チオエステル、リン酸エステル、もしくはスルホン酸エステルであって、かつ、
nは約1から約10000である。
【0134】
先に示したように、適切な種類のプロドラックには、本明細書で開示した生物学的活性な化合物の高分子プロドラッグ(polymeric prodrug)も含まれる。生物学的活性な化合物の反応性がある官能基によって、生物学的活性な化合物の一箇所以上がリンカー前駆物質(linker precursor)を結合するために選択され、これが繰り返されることによって高分子プロドラックが得られる。
【0135】
〔投与量〕
流動性組成物は、液体組成物もしくはゲル状組成物であり、受療者の眼部に注入するのに適している。投与される流動性組成物の量は、典型的には、コントロールリリース挿入物に求められる性質による。例えば、流動性組成物の量は、生物学的薬剤、その代謝産物、もしくはそれらのプロドラッグが、コントロールリリース挿入物から放出される時間の長さに影響しうる。さらに、投与される流動性組成物の量は、典型的には、具体的な用途(例えば、疾病あるいは疾患の性質、および、段階/進行度など)にもよる。さらに、投与される流動性組成物の量は、典型的には、形成するコントロールリリース挿入物の数(すなわち、投与される流動性組成物の数)にもよる。特に、約200種類まで、約100種類まで、約50種類まで、約25種類まで、もしくは約10種類までの流動性組成物を投与することができ、約200個まで、約100個まで、約50個まで、約25個まで、もしくは約10個までのコントロールリリース挿入物がこれらの流動性組成物を投与することによって形成される可能性がある。典型的には投与される流動性組成物の数が増加するに従って、投与される流動性組成物の量が減少する。同様に、投与される流動性組成物の数が減少するに従って、投与される流動性組成物の量が増加する。
【0136】
具体的には、組成物は生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩(biological agently acceptable salt)、もしくはそれらのプロドラッグの一年間送達システム(one year delivery system)を処方するために用いることができる。組成物は生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグの6ヶ月送達システム(six month delivery system)を処方するために用いることもできる。組成物は生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグの3ヶ月送達システム(three month delivery system)を処方するために用いることもできる。組成物は生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグの2ヶ月送達システム(two month delivery system)を処方するために用いることもできる。組成物は生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグの1ヶ月送達システム(one month delivery system)を処方するために用いることもできる。
【0137】
具体的には、約10mLまでの流動性組成物を投与することができる。さらに具体的には、約5mLまで、約1mLまで、もしくは約0.5mLまでの流動性組成物を投与することが可能である。
【0138】
前述のように、複数のコントロールリリース挿入物が形成されたとき(すなわち、複数の流動的組成物が投与されたとき)は、それぞれの投与される流動性組成物は、同じ量の生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを含む可能性がある。またあるいは、複数のコントロールリリース挿入物が形成されたとき(すなわち、複数の流動的組成物が投与されたとき)は、それぞれの投与される流動性組成物は、異なる量の生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを含む可能性がある。それぞれの流動性組成物は任意の適切な量を投与することができる。具体的には、約10mLまで、約5mLまで、約1mLまで、約0.5mLまで、もしくは約0.1mLまでの流動性組成物を投与することが可能である。
【0139】
生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグは、任意の効果的で、適切で、妥当な量を存在させることができる。例えば、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグは、流動的組成物の約70wt.%まで、流動的組成物の約60wt.%まで、流動的組成物の約40wt.%まで、または、流動的組成物の約20wt.%まで、存在させることができる。具体的には、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグは、流動的組成物の約10wt.%まで、流動的組成物の約5wt.%まで、流動的組成物の約1wt.%まで、または、流動的組成物の約0.1wt.%まで、存在させることができる。
【0140】
前述のように、複数のコントロールリリース挿入物が形成されたとき(すなわち、複数の流動的組成物が投与されたとき)は、それぞれの投与される流動性組成物は、同じ量の生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを含む可能性がある。またあるいは、複数のコントロールリリース挿入物が形成されたとき(すなわち、複数の流動的組成物が投与されたとき)は、それぞれの投与される流動性組成物は、異なる量の生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを含む可能性がある。ともかく、それぞれの投与される流動性組成物は独立に、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを、流動的組成物の約10wt.%まで、流動的組成物の約5wt.%まで、流動的組成物の約1wt.%まで、または、流動的組成物の約0.1wt.%まで含む可能性がある。
【0141】
具体的には、流動性組成物は約0.001mL以上の体積とすることができる。さらに、流動性組成物は約20.0mLまでの体積とすることができる。具体的には、流動性組成物の体積は、約0.01mLから10.0mLまで、約0.05mLから1.5mLまで、約0.1mLから1.0mLまで、もしくは、約0.2mLから0.8mLまで、とすることができる。
【0142】
具体的には、流動性組成物は、大体、一日に一回以下の投与用に処方することができる。さらに具体的には、流動性組成物は、およそ一週間に一回以下、およそ一月に一回以下、およそ一年に一回以上、およそ一週間に一回からおよそ一年に一回、もしくは、およそ一月に一回からおよそ一年に一回、投与するために処方することができる。
【0143】
流動性組成物は、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを、適切で効果的で安全で、しかも妥当な投薬量で、哺乳類の組織に効果的に送達する。例えば、流動性組成物で、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを、約0.001ピコグラム/キログラム/日以上、約0.01ピコグラム/キログラム/日以上、約0.1ピコグラム/キログラム/日以上、もしくは約1ピコグラム/キログラム/日以上の投与量で、哺乳類の組織に効果的に送達することができる。あるいはまた、流動性組成物で、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを、約100ミリグラム/キログラム/日まで、約50ミリグラム/キログラム/日まで、約10ミリグラム/キログラム/日まで、もしくは約1ミリグラム/キログラム/日までの投与量で、哺乳類の組織に効果的に送達することができる。
【0144】
さらに具体的には、流動性組成物で、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを、約0.001ピコグラム/キログラム/日から約100ミリグラム/キログラム/日まで、約0.01ピコグラム/キログラム/日から約50ミリグラム/キログラム/日まで、約0.1ピコグラム/キログラム/日から約10ミリグラム/キログラム/日まで、もしくは約1ピコグラム/キログラム/日から約1ミリグラム/キログラム/日までの投与量で、哺乳類の組織に効果的に送達することができる。
【0145】
生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを、任意の適した方法で、コントロールリリース挿入物から放出させることができる。例えば、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを、線形速度式(linear kinetic)もしくは一次速度式(first order kinetic)で、コントロールリリース挿入物から放出させることができる。またあるいは、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを、継続的ゼロ次放出(continuous zero order)で、コントロールリリース挿入物から放出させることができる。さらに、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを、突発的な薬剤放出(drug burst)をほとんど、もしくは、全くさせずに、コントロールリリース挿入物から放出させることができる。
【0146】
生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグの哺乳類の組織への送達は、全身送達および/または局所送達とすることができる。具体的には、投薬量(dosage)は局所的に送達することができる。さらに具体的には、投薬量は、約一年までの期間、局所的に送達することができる。さらに具体的には、投薬量は、約一月までの期間、約一週間までの期間、もしくは、約一日までの期間、局所的に送達することができる。
【0147】
生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグに加えて、本発明に係る流動的組成物、および/または挿入物は、任意に、鎮痛薬、麻酔剤、抗炎症薬、抗片頭痛薬、筋弛緩薬、もしくは鎮静催眠薬(sedative and hypnotic)の少なくとも一つを含む可能性がある。鎮痛薬、麻酔剤、抗炎症薬、胃腸薬、抗片頭痛薬、筋弛緩薬、もしくは鎮静催眠薬を任意の適切な量を含む可能性がある。Physician's Desk Reference, 55th Edition (2001) を参照のこと。
【0148】
適切な鎮痛剤には、例えば、以下のものが含まれる。アセトアミノフェン、フェニルプロパノールアミンHCl、クロロフェニルアミンマレイン酸エステル(chlorpheniramine maleate)、重酒石酸ヒドロコドン(hydrocodone bitartrate)、アセトアミノフェンエリキシル(acetaminophen elixir)、ジフェンヒドラミンHCl、プソイドエフェドリンHCl、デキストロメトルファンHBr、グアイフェネシン、ドキシラミンコハク酸塩(doxylamine succinate)、クロニジン塩酸塩、トラマドール塩酸塩、カルバマゼピン、ヒアルロン酸ナトリウム、リドカイン、ヒラン(hylan)、アルニカ・モンタナ(Arnica Montana)、ラジックス(radix)(マウンテン・アルニカ(mountain arnica))、カレンデュラ・オフィチナリス(Calendula officinalis)(マリゴールド)、ハマメリス(Hamamelis)(マンサク)、ミルフォリウム(Millefolium)(ノコギリソウ)、ベラドンナ(deadly nightshade)、アコニタム・ナペルス(Aconitum napellus)(トリカブト(monkshood))、カモミラ(Chamomilla)(カモミール)、シンフィタム・オフチナーレ(Symphytum officinale)(ヒレハリソウ(comfrey))、ベリスペレニス(Bellis perennis)(デイジー)、エキナセア・アングスティフォリア(Echinacea angustifolia)(ホソババレンギク(narrow-leafed cone flower))、ヒペリカム・ペルフォラタム(Hypericum perforatum)(セイヨウオトギリソウ)、ヘパー・スルフューリス・カルカレウム(Hepar sulphuris calcareum)(硫酸カルシウム)、ブプレノルフィン塩酸塩、ナルブフィン塩酸塩、ペンタゾシン塩酸塩、アセチルサリチル酸、サリチル酸、ナロキソン塩酸塩、口腔粘膜吸収型クエン酸フェンタニル(oral transmucosal fentanyl citrate)、硫酸モルヒネ、ナプシル酸プロポキシフェン(propoxyphene napsylate)、プロポキシフェン塩酸塩、メペリジン塩酸塩、塩酸ヒドロモルホン、フェンタニル経皮系(fentanyl transdermal system)、酒石酸レボルファノール(levorphanol tartrate)、プロメタジンHCl(promethazine HCl)、オキシモルホン塩酸塩(oxymorphone hydrochloride)、酢酸レボメタジル塩酸塩(levomethadyl acetate hydrochloride)、オキシコドンHCl、オキシコドン、リン酸コデイン、イソメテプテン変異型(isometheptene mucate)、ジクロナルフェナゾン、ブタルビタール、ナプロキセンナトリウム、ジクロフェナクナトリウム、ミソプロストール、ジクロフェナクカリウム、セレコキシブ、スリンダク、オキサプロジン、サルサラート、ジフニサル、ナプロキセン、ピロキシカム、インドメタシン、インドメタシンナトリウム三水和物、エトドラク、メロキシカム、イブプロフェン、フェノプロフェンカルシウム、ケトプロフェン、メフェナム酸、ナブメトン、トルメチンナトリウム、ケトロラクトメタミン、トリサリチル酸コリンマグネシウム、およびロフェキシコブ。
【0149】
適切な麻酔薬には、例えば、プロポフォール、ハロタン、デスフルラン、ミダゾラムHCl、エピネフリン、レボビピバカイン、エチドカイン塩酸塩、ロヒバカインHCl、クロロプロカインHCl、ブピバカインHCl、およびリドカインHCl、が含まれる。
【0150】
適切な抗感染薬には、例えば、以下のものが含まれる。トリメトプリム、スルファメトキサゾール、クラリスロマイシン、ガンシクロビルナトリウム、ガンシクロビル、クエン酸ダウノルビシンリポソーム(daunorubicin citrate liposome)、フルコナゾール、ドキソルビシンHClリポソーム(doxorubicin HCl liposome)、ホスカルネットナトリウム、インターフェロン アルファ-2b(interferon alfa-2b)、アトバコン、リファブチン、グルクロン酸トリメトレキセート(trimetrexate glucoronate)、イトラコナゾール、シクロフォビル(ciclofovir)、アジスロマイシン、メシル酸デラビルジン(delavirdine mesylate)、エファビレンツ、ネビラピン、ラミブジン/ジドブジン、ザルシタビン、ジダノシン、スタブジン、硫酸アバカビル、アンプレナビル、硫酸インジナビル、サキナビル、メシル酸サキナビル(saquinavir mesylate)、リトナビル、ネルフィナビル、塩酸クロロキン、メトロニダゾール、塩酸メトロニダゾール、ヨードキノール、アルベンダゾール、プラジカンテル、チアベンダゾール、イベルメクチン、硫酸メベンダゾール(mebendazole sulfate)、硫酸トブラマイシン(tobramycin sulfate)、トブラマイシン、アズトレオナム、セフォテタン二ナトリウム(cefotetan disodium)、セフォテタン、ロラカルベフ、セフォキチン、メロペネム、イミペネムおよびシラスタチン(imipenemand cilastatin)、セファゾリン、セファクロル、セフチブテン、セフチゾキシム、セフォペラゾン、セフロクメアセチル(cefuroxumeaxetil)、セラプロジル、セフタンジジム、セフォタキシムナトリウム、セファドロキシル一水和物、セファレキシン、塩酸セファレキシン、セフロキシム、セファゾリン、セファマンドールナファテ(cefamandole nafate)、塩酸セファピム(cefapime hydrochloride)、セフジニル、セフトリアキソンナトリウム、セフィキシム、セフポドシムプロキセチル、ジリスロマイシン、エリスロマイシン、エチルコハク酸エリスロマイシン、ステアリン酸エリスロマイシン、エリスロマイシン、酢酸スルフィソキサゾール(sulfisoxazole acetyl)、トロレアンドマイシン、アジスロマイシン(azithromycin)、クリンダマイシン(clindamycin)、塩酸クリンダマイシン(clindamycin hydrochloride)、硫酸コリスチンナトリウム(colistimethate sodium)、キヌプリスチン/ダルホプリスチン、塩酸バンコマイシン、アモキシシリン、アモキシシリン/クラブラン酸/カリウム、ペニシリンGベンザチン(penicillin G benzathine)、ペニシリンGプロカイン(penicillin G procaine)、ペニシリンGカリウム(penicillin G potassium)、カルベニシリンインダニルナトリウム(carbenicillin indanyl sodium)、ピペラジリンナトリウム、チカルシリン二ナトリウム、クラブラン酸カリウム、アンピシリンナトリウム/スルバクタムナトリウム、タゾバクタムナトリウム、テトラサイクリンHCl、塩酸デメクロサイクリン、塩酸ドキシサイクリン(doxycycline hyclate)、ミノサイクリンHCl、ドキシサイクリン一水和物、オキシテトラサイクリンHCl、酢酸ヒドロコルチゾン(hydrocortisone acetate)、ドキシサイクリンカルシウム、アンホテリンBリピド(amphotericin B lipid)、フルシトシン、グリセオフルビン、塩酸テルビナフィン(terbinafine hydrochloride)、ケトコナゾール、塩酸クロロキン、リン酸クロロキン、ピリメタミン、塩酸メフロキン、塩酸アトバコンおよび塩酸プログアニル(atovaquone and proguanil hydrochloride)、硫酸ヒドロキシクロロキン、塩酸エタンブトール、アミノサリチル酸、リファペンチン、リファンピン、イソニアジド、ピラジナミド、エチオナミド、インターフェロン アルファ-n3(interferon alfa-n3)、ファムシクロビル、塩酸リマンタジン、ホスカルネットナトリウム、インターフェロン アルファコン-1(interferon alfacon-1)、リバビリン、ザミナビル、塩酸アマンタジン、パリビズマブ、リン酸オセルタミビル、塩酸バラシクロビル、ネルフィナビルメシレート(nelfinavir mesylate)、スタブジン、アシクロビル、アシクロビルナトリウム、リファブチン、グルクロン酸トリメトレキセート(trimetrexate glucuronate)、リネゾリド、モキシフロキサシン、塩酸モキシフロキサシン、シプロフロキサシン、塩酸シプロフロキサシン、オフロキサシン、レボフロキサシン、塩酸ロメフロキサシン、ナリジクス酸、ノルフロキサシン、エノキサシン、ガチフロキサシン、トロバフロキサシンメシレート(trovafloxacin mesylate)、アラトロフロキサシン(alatrofloxacin)、スパルフロキサシン、アズトレオナム、ニトロフラントイン一水和物/マクロ結晶(nitrofurantoin monohydrate/macrocrystals)、塩酸セフェピム、ホスホマイシントロメタミン(fosfomycin tromethamine)、硫酸ネオマイシン-硫酸ポリミキシンB(neomycin sulfate-polymyxin B sulfate)、イミペネム、シラスタチン(cilastatin)、メテナミン、マンデル酸メテナミン(methenamine mandelate)、フェニルサリチル酸、硫酸アトロピン、硫酸ヒヨスチアミン、安息香酸、塩酸オキシテトラサイクリン、スルファメチゾール、塩酸フェナゾピリジン、および、リン酸ナトリウム一水和物(sodium acid phosphate, monohydrate)。
【0151】
適切な同毒療法剤(homeopathic remedies)には、例えば、ツヅラフジ(cocculus indicus)、ドクニンジン(conium maculatum)、龍涎香(ambra grisea)、および、石油などが含まれる。
【0152】
適切な抗片頭痛薬には、例えば、マレイン酸チモロール(timolol maleate)、塩酸プロプラノロール、ジヒドロエルゴタミンメシレート(dihydroergotamine mesylate)、酒石酸エルゴタミン(ergotamine tartrate)、カフェイン、ジバルプロエクスナトリウム、アセトアミノフェン、アセチルサリチル酸、サリチル酸、塩酸ナラトリプタン、コハク酸スマトリプタン、スマトリプタン、安息香酸リザトリプタン(rizatriptan benzoate)、および、ゾルミトリプタンなどが含まれる。
【0153】
適切な筋弛緩剤には、例えば、塩化スクシニルコリン、臭化ベクロニウム、臭化ラパクロニウム、臭化ロクロニウム、ダントレンナトリウム、シクロベンザプリンHCl、クエン酸オルフェナドリン(orphenadrine citrate)、クロルゾルキサゾン、メトカルバモール、アセチルサリチル酸、サリチル酸、メタキサロン(metaxalone)、カリソプロトール、リン酸コデイン、ジアゼパム、および、塩酸チザニジンなどが含まれる。
【0154】
適切な鎮静催眠薬(sedative and hypnotic)には、例えば、メホバルビタール、ペントバルビタール、ロラゼパム、トリアゾラム、エスタゾラム、ジアゼパム、ミダゾラムHCl、酒石酸ゾルピデム(Zolpidem tartrate)、メラトニン、ビタミンB12、葉酸、プロポフォール、メペリジンHCl、プロメタジンHCl、ジフェンヒドラミンHCl、ザレプロン、およびコハク酸ドキシラミン(doxylamine succinate)などが含まれる。
【0155】
〔眼の疾病および疾患〕
本明細書に記載した流動性組成物は、一種類以上の眼の疾病および疾患を処置するために、眼部から局所的に投薬することができる。適切な眼の疾病および疾患には、例えば、以下のものが含まれる。急性帯状潜在性外側網膜症(Acute Zonal Occult Outer Retinopathy)、アディー症候群、加齢黄斑変性症(AMD)、白皮症、一過性黒内症、弱視、無虹彩症、瞳孔不同症、無眼球症、無水晶体症(Aphakia)、動脈閉塞、乱視、基底細胞癌(Basal Cell Carcinoma)、眼瞼炎、網膜動脈分枝閉塞症、網膜静脈分枝閉塞症、眼瞼下垂(Blepharoptosis)、眼瞼痙攣(Blepharospasm)、盲目、白内障、セロハン網膜症(Cellophane Retinopathy)、網膜中心静脈閉塞症、中心性漿液性網脈絡膜症、霰粒腫、化学火傷、脈絡膜血管新生膜(Choroidal Neovascular Membrane)、脈絡膜母斑、コーガンジストロフィー(Cogan's Dystrophy)、色盲、コンピュータ視力症候群(Computer Vision Syndrome)、結膜炎、角膜ジストロフィー(Corneal Dystrophy)、角膜浮腫(Corneal Edema)、角膜潰瘍、嚢胞様黄斑浮腫(Cystoid Macular Edema)、サイトメガロウイルス(Cytomegalovirus)、脈絡網膜炎、コロイデレミア(Choroideremia)、コロボーマ(Coloboma)、涙嚢炎、糖尿病性網膜症、眼瞼下垂(Droopy Eyelids)、ドライアイ、複視、二重睫毛、デュアン眼球後退症候群、眼瞼外反(Ectropion)、眼瞼内反(Entropion)、網膜上膜(Epi-retinal membrane)、上強膜炎、内斜視、落屑症候群、外斜視、眼での出血(Eye Hemorrhage)、眼の腫瘍(Eye Neoplasms)、遠視(Farsightedness)、閃光飛蚊症(Flashes & Floaters)、異物(Foreign Body)、フックスジストロフィー(Fuchs' Dystrophy)、巨細胞性動脈炎(Giant Cell Arteritis)、緑内障、一般的な繊維症(General Fibrosis Syndrome)、脳回転状萎縮、頭痛、単純ヘルペス、帯状ヘルペス、眼圧が高いこと(High Pressure in the Eye)、ヒストプラズマ症(眼部)、遠視(Hyperopia)、全房出血(Hyphema)、半盲(Hemianopsia)、ヘルマンスキー・プドラック症候群(Hermanski-Pudlak Syndrome)、麦粒腫、ホルネル症候群、目蓋が内側に曲がっていること(Inward Turned Eyelid)、虹彩血管新生、虹彩母斑、虹彩炎、円錐角膜、カーンズ・セイアー症候群(Kearns-Sayer Syndrome)、角膜炎、涙器の疾病(Lacrimal Apparatus Diseases)、涙道閉塞、黄斑変性症、黄斑浮腫、黄斑円孔、マクラパッカー(Macular Pucker)、辺縁性の眼瞼炎(Marginal Blepharitis)、近視(Myopia)、小眼球症、近視(Myopia)、眼振、近眼(Nearsightedness)、角膜の血管新生(Neovascularization of the Cornea)、視神経乳頭の血管新生(Neovascularization of the Optic Nerve Head)、脈絡膜母斑(Nevus (Choroidal))、母斑(虹彩)、眼ヒストプラズマ症、眼の酒さ(Ocular Rosacea)、視神経症(Optic Neuritis)、目蓋が外側に曲がっていること(Outward Turned Eyelid)、眼筋麻痺、視神経萎縮、視神経症(Optic Neuropathy)、眼窩蜂巣炎、瞼裂斑(Pinguecula)、ピンクアイ(Pink Eye)、後発白内障、老視(Presbyopia)、翼状片(Pterygium)、下垂症、うっ血乳頭、ピータース奇形(Peter's Anomaly)、再発性角膜びらん、眼の充血(Red Eyes)、網膜裂孔、網膜剥離、網膜色素変性症、未熟児網膜症、水晶体後繊維増殖症(ROP)(Retrolental Fibroplasia)、ルベオーシス(Rubeosis)、網膜静脈閉塞、網膜分離症、強膜症、斜視(Strabismus)、ものもらい(Stye)、結膜下の出血(Subconjunctival Hemorrhage)、盲点(Scotoma)、斜視、側頭動脈炎(Temporal Arteritis)、サイジェソン点状表層角膜炎(Thygeson's Superficial Punctate Keratitis)、トラコーマ、ぶどう膜炎、静脈閉塞、および、硝子体剥離。
【0156】
本明細書に記載した流動性組成物を、一種類以上の眼の疾病および疾患を処置するために、眼部から局所的に投薬するとき、通常は、流動性組成物はそのような眼の疾病および疾患を処置するための既知の一種類以上の生物学的薬剤を含む。このような適切な生物学的薬剤には、例えば、以下のものが含まれる。アセチルコリン遮断薬(acetylcholine blocking agents)(ボトックス精製神経毒錯体(botox purified neurotoxin complex)など)、アドレナリンアゴニスト(アルファガン P(alphagan p)、naphcon-aなど)、抗生物質(polytrim、トブラデクス(tobradex)など)、抗緑内障剤(antiglaucoma agents)(ベチモール(betimol)、ベトプティック s(betoptic s)、コソプト(cosopt)、オキュドース中のチモプティック(timoptic in ocudose)、チモプティック(timoptic)、チモプティック-xe(timoptic-xe)、アゾプト(azopt)、コソプト(cosopt)、ダラナイド(daranide)、トルソプト(trusopt)、ルミガン(lumigan)、トラバタン(travatan)、キサラタン(xalatan)、アルファガン P(alphagan P)、naphcon-A、rev- eyesなど)、抗ヒスタミン剤とマスト細胞安定剤(mast cell stabilizer)との配合物(elesat、パタノール(patanol)、zaditorなど)、抗ヒスタミン剤の配合物(antihistamines & combinations)(naphcon-A、オプティバール(optivar)など)、抗感染症薬(polytrim、トブラデクス(tobradex)、シロキサン(ciloxan)、クイクシン(quixin)、ビガモックス(vigamox)、zymar、ブレファマイド(blephamide)など)、抗炎症剤(アキュラー(acular)、アキュラー ls(acular ls)、アキュラー pf(acular pf)、ボルタレン(voltaren)、ブレファマイド(blephamide)、トブラデクス(tobradex)など)、人工涙液/潤滑剤(artificial tears/lubricants)の配合物(bion tears、ラクリサート(lacrisert)、レスタシス(restasis)、tears naturale forte、tears naturale freeなど)、β-アドレナリン遮断薬(beta adrenergic blocking agent)(ベチモール(betimol)、ベトプティック s(betoptic s)、コソプト(cosopt)、timoptic in ocudose、チモプティック(timoptic)、チモプティック-xe(timoptic-xe)など)、β-アドレナリン遮断薬と炭酸脱水酵素阻害薬(carbonic anhydrase inhibitor)との配合物(cosoptなど)、炭酸脱水酵素阻害薬(アゾプト(azopt)、コソプト(cosopt)、ダラナイド(daranide)、トルソプト(trusopt)など)、うっ血除去薬(decongestants)(アルファガン P(alphagan p)、naphcon-aなど)、緑内障用薬剤(agents for glaucoma)(ベチモール(betimol)、ベトプティック s(betoptic s)、コソプト(cosopt)、 timoptic in ocudose、チモプティック(timoptic)、チモプティック-xe(timoptic-xe)、アゾプト(azopt)、コソプト(cosopt)、ダラナイド(daranide)、トルソプト(trusopt)、ルミガン(lumigan)、トラバタン(travatan)、キサラタン(xalatan)、アルファガン p(alphagan p)、naphcon-a、rev-eyesなど)、潤滑剤(bion tears、ラクリサート(lacrisert)、レスタシス(restasis)、tears naturale forte、tears naturale freeなど)、マスト細胞安定剤(アラマスト(alamast)など)、光線力学的治療用薬剤(photodynamic therapy agent)(ビスダイン(visudyne)など)、プロスタグランジン類(ルミガン(lumigan)、トラバタン(travatan)、キサラタン(xalatan)など)、交感神経模倣薬類の配合物(sympathomimetics & combinations)(アルファガン p(alphagan p)、naphcon-aなど)、血管収縮薬類(アルファガン p(alphagan p)、naphcon-aなど)、ビタミン類の配合物(vitamins & combinations)(catasod-ocuxtra/optigold/macutein, visuteinなど)、抗生物質類の配合物(antibiotics & combinations)(polytrim、トブラデクス(tobradex)など)、キノロン類(シロキサン(ciloxan)、クイクシン(quixin)、vigamox、zymarなど)、スルホンアミド類の配合物(sulfonamides & combinations)(blephamideなど)、縮瞳薬(rev-eyesなど)、非ステロイド系抗炎症薬(アキュラー(acular)、アキュラー ls(acular ls)、アキュラー pf(acular pf)、ボルタレン(voltaren)など)、ステロイド系抗炎症薬(blephamide、トブラデクス(tobradex)など)。
【0157】
本発明に係る流動性組成物、および/または、挿入物には、生体内で挿入物の基盤から生物学的薬剤を放出する速度を調整するための放出速度修正剤(release rate modification agent)、孔形成剤、生分解性の結晶化コントロール薬剤、可塑剤、浸出剤(leaching agents)、浸透促進剤、吸収変化剤、不透明化剤、および着色料のうちの一種類以上をさらに含めることができる。
【0158】
〔放出速度修正剤〕
速度修正剤、可塑剤、および浸出可能薬剤(leachable agents)を、生理活性薬剤の放出速度および基盤の柔軟性を調整するために加えることができる。既知の可塑剤、さらには、ポリマー系内で二次的な非共有結合(secondary pseudobonding)をするのに適した有機化合物は、柔軟性変化剤(pliability modifiers)および浸出剤として許容できる。一般にこれらの薬剤は、モノカルボン酸エステル類、ジカルボン酸エステル類、およびトリカルボン酸エステル類、ジオール類およびポリオール類、ポリエステル類、非イオン性界面活性剤類、脂肪酸類、脂肪酸エステル類、植物油などの油類などである。固体基盤中のこれらの薬剤の濃度は、基盤の全重量に対して最大で60wt%までの範囲とすることができ、好ましくは30wt%までであり、さらに好ましくは15wt%までである。一般に、これらの浸出剤、可塑剤、柔軟性変化剤およびその用途は、U.S. Pat. Nos. 5,702,716 および 5,447,725に記載されており、そこでの開示は、用いられるポリマーが本発明に係る生体適合性があり、生分解性で、熱可塑性ポリマーであるという条件の下で、参照することによって本明細書に含まれる。
【0159】
放出速度修正剤を、挿入物基盤が分解する速度、および/または、生体内で挿入物の基盤から生理活性薬剤を放出する速度を調整するために、流動性組成物に含めることがある。本発明に従って固体基盤中に組み込まれた速度修正剤の性質によって、速度修正剤が徐放速度を速める可能性も、遅らせる可能性もある。速度修正剤として加えるのに適した物質には、クエン酸ジメチル、クエン酸トリエチル、ヘプタン酸エチル(ethyl-heptanoate)、グリセリン、ヘキサンジオール、などが含まれる。
【0160】
生理活性薬剤を挿入物基盤(implant matrix)からコントロールリリースするためもしくは徐放するために、ポリマー溶液には放出速度修正剤が含まれることがある。本発明での開示を限定するものではないが、速度修正剤は、ポリマー挿入物の疎水性を変化させることによって生理活性薬剤が挿入物基盤から放出される速度を変更すると考えられる。
【0161】
放出速度修正剤の使用によって生理活性薬剤の放出を複数の桁の範囲で(例えば、1から10、100)減少させることも増加させることもでき、好ましくは、放出速度修正剤がない場合の固体基盤からの生理活性薬剤の放出と比較して10倍まで変化させる。ポリエチレングリコールのような親水性である放出速度修正剤は、生理活性薬剤の放出を増加させることがある。効果的な量の放出速度修正剤と組み合わせてポリマーの分子量を適切に選択することによって、放出速度、および、挿入物基盤からの生理活性薬剤の放出の範囲は、例えば比較的早いものから比較的遅いものまで様々であることがある。
【0162】
有用な放出速度修正剤には、例えば、水溶性の有機物質、水と混和性の有機物質、もしくは水に不溶な有機物質(すなわち、水と混和しない)が含まれ、水に不溶な物質が好ましい。
【0163】
放出速度修正剤は好ましくは、ポリマー分子との間の二次的な非共有結合(secondary valence bonding)のための相補的な分子として置換する有機化合物が好ましく、ポリマー分子が相互に横切る(slide past)能力と柔軟性を増大させる。このような有機化合物は、好ましくは、二次的な非共有結合(secondary valence bonding)に影響を及ぼすことができるように疎水的部分および親水的部分を含む。好ましくは、放出速度修正剤は、ポリマーの配合物、および、ポリマー溶液を処方するのに用いられた溶媒と適合性がある。さらに好ましくは、放出速度修正剤は、生物学薬剤的に許容される物質(biological agently-acceptable substance)である。
【0164】
有用な放出速度修正剤には、例えば、脂肪酸類、トリグリセリド類、その他の疎水性の化合物、有機溶媒、可塑剤、および、親水性化合物などが含まれる。適切な放出速度修正剤には、例えば、以下のようなものが含まれる。酢酸2-エトキシエチル(2-ethoxyethyl acetate)、酢酸メチル、酢酸エチル、フタル酸ジエチル、フタル酸ジメチル、フタル酸ジブチル、アジピン酸ジメチル、コハク酸ジメチル、シュウ酸ジメチル、クエン酸ジメチル(dimethyl citrate)、クエン酸トリエチル、クエン酸アセチルトリブチルエステル、クエン酸アセチルトリエチルエステル、三酢酸グリセリン、セバシン酸ジ(n-ブチル)(di(n-butyl) sebecate)などのような、モノカルボン酸のエステル、ジカルボン酸のエステル、および、トリカルボン酸のエステル、プロピレングリコール、ポリエチレングリコール、グリセリン、ソルビトール、などのような、ポリヒドロキシルアルコール類、脂肪酸、トリグリセリドのようなグリセリンのトリエステル、エポキシ化大豆油およびエポキシ化したその他の植物油、ゴマ油、大豆油、綿実油、アーモンド油、ヒマワリ油、およびピーナッツ油などの、その他の種子、花、果実、葉、もしくは植物または木の茎から得られる植物油、コレステロールのようなステロール類、(C6-C12)アルカノール類、2-エトキシエタノールなどのようなアルコール類。これらの放出速度修正剤は単独で用いられることもあるし、他のこれらの薬剤と組み合わせて用いられることもある。放出速度修正剤の好ましい配合物には、例えば、グリセリン/プロピレングリコール、ソルビトール/グリセリン、エチレンオキシド/プロピレンオキシド、ブチレングリコール/アジピン酸、などが含まれる。好ましい放出速度修正剤には、クエン酸ジメチル、クエン酸トリエチル、ヘプタン酸エチル、グリセリン、および、ヘキサンジオールが含まれる。
【0165】
ポリマー溶液に含まれる放出速度修正剤の量は、挿入物基盤からの生理活性薬剤の望ましい放出速度によって異なる。好ましくは、ポリマー溶液は約0.5〜15%、好ましくは約5〜10%の放出速度修正剤を含む。
【0166】
〔孔形成剤/添加剤〕
本発明に係る流動性組成物は、移植(implantation)、注入、もしくは、別の全体的または部分的な体内中の設置に用いることができる。組成物の生物学的活性物質の一つと本発明に係るポリマーは、均質の基盤を構成することがあるか、または、生物学的活性物質の一種は何らかの方法でポリマー中に封じ込められることがある。例えば、生物学的活性物質の一種は、まずミクロスフェアの中に封じ込められて、その後、少なくとも一部はミクロスフェア構造を維持したままポリマーと結合する。またあるいは、生物学的活性物質の一つは、本発明に係るポリマーの中で十分に混合することができないことがあり、溶解しているというよりむしろ、ポリマー中に小さな液滴が分散していることがある。いずれの形態も許容されるが、好ましくは、組成物が一様であるかどうかにかかわらず、少なくとも部分的にはポリマーが生分解されることによるエステル結合の加水分解に応じて、生体内で生物学的活性物質の放出速度の調整が維持される。
【0167】
添加剤(Additives)を、基盤の構造および生理活性薬剤の放出速度、もしくは体液への分散速度に影響する固体基盤の孔の大きさを、さらに調整しやすくするために加えることができる。例えば、流動性組成物が水媒体、水もしくは組織内殖(tissue ingrowth)の影響を受けなさ過ぎるときには、孔形成剤を基盤にさらに孔を作るために加えることができる。任意の生体適合性のある水溶性の物質を孔形成剤として用いることができる。このような添加剤は、流動性組成物に可溶である可能性も、単に流動性組成物中に分散している可能性もある。それらは、溶解、拡散、もしくは、分散させることができるため、ポリマー基盤が凝固するとすぐに、孔と微小孔性の導管(cannels)の両方が作られる。流動性組成物中の孔形成添加剤(必要であれば、このような孔形成剤を分散させる粒子)は直接的にポリマー基盤中の孔の大きさと数に影響する。
【0168】
孔形成添加剤は、十分に水および体液と混和性である、任意の生物学的薬剤として許容性のある有機物質もしくは無機物質を含み、構成もしくは構成された基盤から水媒体または体液に消えるか、あるいは、水に可溶な物質へと速く分解する水と混和性の物質である。均一な混合物となるように、孔形成剤が有機溶媒中に混和可能であるかもしくは分散可能であることが好ましい。好ましい孔形成剤には、例えば、スクロースおよびブドウ糖のような糖、塩化ナトリウムおよび炭酸ナトリウムのような塩、ヒドロキシプロピルセルロース、カルボキシメチルセルロース、ポリエチレングリコール、およびポリビニルピロリドンのようなポリマーが含まれる。孔の大きさと範囲は、分子量と流動性組成物中に含まれる孔形成添加物の割合を変化させることによって、広い範囲で変化させることができる。
【0169】
示したように、体液と接触させると溶媒と任意の孔形成添加剤が周囲の組織液(tissue fluids)の中に消える。これが、凝固したポリマー基盤の中に微小孔性の導管(microporous channels)を形成する原因である。オプションとして、孔形成添加剤は基盤から周囲の組織液の中へ有機溶媒よりも遅い速度で消えてもよく、基盤が生分解もしくは生体分解する時間にわたって基盤から放出されてもよい。好ましくは、例えば、組織再生サイト(tissue regeneration site)のバリアーシステム、薬剤もしくは薬を時限放出(timed-release)するなどの、挿入物の特定の目的を効果的に達成するための多孔度(porosity)および孔構造(pore structure)のある基盤が構成されるように、孔形成添加剤は埋め込まれた後の短い時間で凝固した挿入物基盤から消える。
【0170】
ポリマー基盤の多孔度は、ポリマー組成物中の溶媒および/または孔形成剤などの、水に可溶な成分もしくは水と混和する成分の濃度によって様々であることがある。例えば、流動性組成物中の水に可溶な物質の濃度が高いと、多孔度が高いポリマーが生成することがある。組成物中のポリマーに対する孔形成剤の濃度は、基盤中の孔形成、もしくは多孔度の程度を変化させるために、変化させてもよい。一般にはポリマー組成物は約0.01〜1グラムの孔形成剤をポリマー1グラム当たりに含む。
【0171】
挿入物の基盤中に形成される孔の大きさ、もしくは直径は、ポリマー基盤中の孔形成剤の大きさ、および/または、直径によって変更しても良い。例えば、対応する孔形成剤の直径を有する孔を形成させるために、比較的ポリマー混合物に溶けにくい孔形成剤を、粒子の大きさによっては選択的にポリマー組成物に含有させても良い。ポリマー混合物に可溶な孔形成剤を、ポリマー混合物ならびに凝縮したポリマー基盤および固体ポリマー基盤の中の孔形成剤の分散および/または凝集のパターンによって、挿入物基盤の孔の大きさと多孔度を変化させるために用いても良い。
【0172】
孔の直径および挿入物のポリマー基盤中での分布は、例えばポリマー基盤の横断面を走査型電子顕微鏡法で調査することによって、評価されることがある。ポリマー基盤の多孔度は、例えば、特定の重力と圧力の比較をする水銀圧入式ポロシメータ法(mercury intrusion porosimetry)、走査型電子顕微鏡写真(scanning electron microscopy photographs)による計算などの、当該分野において既知の適切な方法によって評価されることがある。追加的に、多孔度はポリマー組成物中に含まれる水に可溶な物質の割合もしくはパーセンテージから計算されることもある。例えば、約30%のポリマーと約70パーセントの溶媒および/またはその他の水溶性の成分を含んでいるポリマー組成物では、約70%の多孔度である挿入物ポリマー基盤が形成される。
【0173】
組成物の生物学的活性物質と本発明にかかるポリマーとは、一様な基盤を形成することがあり、生物学的活性物質は何らかの方法でポリマー中に封入されることもある。例えば、生物学的活性物質は最初にミクロスフェアの中に封入されて、その後少なくとも一部分はミクロスフェア構造を維持したままポリマーと結合する。またあるいは、生物学的活性物質は実質的に本発明に係るポリマーと十分に混合することができないことがあり、溶解しているというよりむしろ、ポリマー中に小さな液滴が分散していることがある。いずれの形態も許容されるが、好ましくは、組成物が一様であるかどうかにかかわらず、少なくとも部分的にはポリマーが生分解されることによるエステル結合の加水分解に応じて、生体内で生物学的活性物質の放出速度の調整が維持される。
【0174】
本発明に係るものは、哺乳類の体内に移植もしくは注入するために設計される。このような物が血管の豊富な組織に移植もしくは挿入されたときに最小限にしか組織を刺激しないということは特に重要である。医療デバイス構造(structural medical device)として、本発明に係るポリマー組成物は、十分に適用するための特殊な化学的性質、物理的性質、および機械的性質を有する物理的構成、および、生体内で毒性の残留物を残さずに分解する組成物を提供する。
【0175】
注入可能なポリマー溶液の中で構成された挿入物は生体内でゆっくりと生分解され、生体組織(natural tissue)が成長でき、挿入物が消滅して置き換わるという効果がある。注入可能な系から形成された挿入物は、その基盤の中に含まれている薬剤を、調整された速度で薬剤が使い果たされるまで放出する。ある薬剤では、ポリマーは薬剤が完全に放出されてしまってから分解する。ペプチド類、もしくは、タンパク質類などの他の薬剤では、拡散しない薬剤(non-diffusing drug)が体液にさらされるところまでポリマーが分解してからだけ、薬剤が完全に放出される。
【0176】
〔生分解性の結晶化コントロール薬剤〕
結晶化コントロール薬剤(crystallization-controlling agent)は任意にポリマー質量(polymer mass)の均一性、すなわち、骨やその他の組織に用いるための成形性、接着性(cohesion)および安定性といった望ましい物理的特性を有する均一なポリマー質量を得るための、実質的にポリマーの結晶部分が均一な分配、に作用させるためにポリマーに配合されることがある。結晶化コントロール薬剤は、例えば、炭酸カルシウム、もしくはリン酸カルシウムなどの無機塩、ポリ(ビニルアルコール) 、デンプンもしくはデキストランなどのポリマー、および、その他の同様の物質などの、分散した固体粒子の形で組成物中に存在することがある。その他の有用な結晶化コントロール薬剤は調合工程(compounding process)の間にポリマーに溶解するものか、それとも、融解されたポリマーに可溶なものがある。これらの物質の例として、パルミチン酸グリセリン、もしくは、乳酸エチルなどの低分子量の有機化合物、ポリ(エチレングリコール) もしくは、ポリ(ラクチド-co-カプロラクトン)などのポリマーおよびその他の同様の物質が含まれる。結晶化コントロール薬剤を含む組成物の処方は、約40〜95wt%、好ましくは約60〜90wt%のポリマーと、約5〜60wt%、好ましくは約10〜40wt%の結晶化コントロール薬剤を含む。
【0177】
本発明に係る組成物に用いるのに適している結晶化コントロール薬剤は、融解された組成物の中でも固体粒子のままであるものと、融解された組成物中に融解もしくは溶解するものとの、2つの種類に分けられることがある。
【0178】
組成物の中でも固体粒子もしくは賦形剤(fillers)として維持される結晶化コントロール薬剤には、無機塩類もしくは有機塩類、およびポリマー類が含まれる。適切な無機塩類には、例えば炭酸カルシウム、ヒドロキシアパタイト、リン酸カルシウム、カルシウムアパタイト、硫酸カルシウム、炭酸水素カルシウム、塩化カルシウム、炭酸ナトリウム、炭酸水素ナトリウム、塩化ナトリウムなどの塩類が含まれる。適切な有機塩類には、例えば、ステアリン酸カルシウム、パルミチン酸カルシウム、ステアリン酸ナトリウム、その他のC10-C50の脂肪酸誘導体の金属塩類、などの塩が含まれる。分散した粒子もしくは賦形剤(fillers)として維持されるものとして組成物の中で用いるのに適しているポリマーには、例えば、多糖類、セルロース誘導体、およびポリ(ビニルアルコール) が含まれる。適切な多糖類には、例えば、デキストラン、マルトデキストリン、トウモロコシ、コムギ、米などに由来するデンプン類、デンプングリコール酸ナトリウム(sodium starch glycolate)などのデンプン誘導体が含まれる。適切なセルロース誘導体には例えば、カルボキシメチルセルロースナトリウム、架橋カルボシキメチルセルロースナトリウム(crosslinked sodium carboxymethyl cellulose)、カルボキシメチルセルロース、ヒドロキシメチルセルロース、などが含まれる。適切なポリ(ビニルアルコール)類には、分子量が約5000〜20000、好ましくは約10000〜15000で、加水分解の割合が約80〜100%であるものである。
【0179】
調合工程中に融解された組成物中に融解もしくは溶解する結晶化コントロール薬剤もまた、本発明に係るポリマー組成物に用いられることがある。これらの組成物は冷却している間にいくらか相分離(phase separation)をしても良いし、相分離しなくても良い。この種類の結晶化コントロール薬剤には低分子量の有機化合物およびポリマーが含まれる。適切な低分子量の有機化合物には、例えば、グリセリン、パルミチン酸(palmitate)、ステアリン酸グリセリンおよびその他の同様のグリセリン誘導体、クエン酸トリエチルおよびその他の同様のクエン酸誘導体、乳酸エチル、およびその他のエステル類、などが含まれる。
【0180】
結晶化コントロール薬剤は、成型可能な硬さおよび/または塗抹可能な硬さになるようにポリマーを軟化させるために効果的な量だけ、組成物中に含まれる。好ましくは、結晶化コントロール薬剤は溶媒ではなく固形の物質である。結晶化コントロール薬剤は、組成物中に単独で含ませても、他の結晶化コントロール薬剤との配合で含ませても良い。好ましい配合物の例には、ポリ(ラクチド-co-カプロラクトン) およびステアリン酸カルシウムなどの薬剤がある。
【0181】
〔浸透促進剤〕
組成物は、浸透促進剤(penetration enhancer)が含まれていない組成物に比べて、身体組織への生物学的薬剤の浸透、および、身体組織を通過する生物学的薬剤の浸透を効果的に促進する浸透促進剤をさらに含むことがある。浸透促進剤は、一般に任意の浸透促進剤であることがあるが、好ましくはオレイン酸、オレイルアルコール(oleyl alcohol)、エトキシジグリコール、ラウロカプラム、アルカンカルボン酸類(alkanecarboxylic acid)、ジメチルスルホキシド、極性脂質類(polar lipids)、もしくは、N-メチル-2-ピロリドンであり、さらに好ましくは、オレイン酸もしくはオレイルアルコールである。浸透促進剤は流動性組成物中に任意の適切な量(例えば、約1wt.%から約10wt.%の間など)を存在させることができる。
【0182】
〔吸収変化剤〕
任意の適切で適当な吸収変化剤(absorption altering agent)を本発明に用いることができる。例えば、吸収変化剤は、プロピレングリコール、グリセリン、尿素、ジエチルセバシン酸ナトリウム(diethyl sebecate sodium)、ラウリル硫酸、ラウリル硫酸ナトリウム、ソルビタンエトキシレート類(sorbitan ethoxylates)、オレイン酸、カルボン酸ピロリドンエステル類(pyrrolidone carboxylate esters)、N-メチルピロリドン、N,N-ジメチル-m-トルマイド(N,N-diethyl-m-tolumide)、ジメチルスルホキシド、アルキルメチルスルホキシド、およびこれらの混合物の群から選択することができる。
【0183】
〔不透明化剤〕
任意の適切で適当な不透明化剤(opacification agent)を本発明に用いることができる。例えば、不透明化剤は、バリウム、ヨウ素、カルシウム、およびこれらの混合物の群から選択することができる。
【0184】
〔着色料〕
着色料(colorant)もまた、多孔性の薄膜が分解する時間に渡って生分解性もしくは生物分解性をモニターすることができるだけの、適切な量だけ液体組成物に加えることができる。適切で適当な着色料は、毒性がなく、刺激性がなく、液体組成物の溶媒と反応しないものである。FDAによって化粧品、食品および医薬品に用いることが承認されている着色料には、黄色201号(D & C Yellow No. 7)、赤色225号(D & C Red No. 17)、赤色202号、赤色204号、および赤色220号(D & C Red No. 7, 9, and 34)、赤色504号(FD & C Red No. 4)、橙色205号(Orange D & C No. 4)、青色2号(FD & C Blue 2)、緑色3号(FD & C Green No. 3)などが含まれる。
【0185】
〔成形性挿入物前駆物質〕
流動性組成物は、U.S. Pat. No. 5,487,897に開示した技術に従って、水もしくは食塩水などの水媒体と接触させることによってか、または、血漿、リンパ液、などの体液と接触させることによって、成形性挿入物前駆物質(moldable implant precursor)とすることができる。U.S. Pat. No. 5,487,897の開示は、'897特許の可塑性ポリマーの規格が本明細書に記載したような生体適合性、生分解性の熱可塑性ポリマーであるときは、参照することによって本明細書に含まれる。
【0186】
つまり、'897特許で開示された技術で、生理活性薬剤を含む流動性組成物、もしくは生物学的薬剤を含まない流動性組成物を、外側の液嚢(outer sac)と流動性含有物の2つの部分からなる構造に変換することができる。この技術は、生物学的薬剤系の量などの限られた量の水媒体について、系の外側の表面だけを固体に変換して流動性含有物を内側に有する液嚢を形成するために適用できる。挿入物前駆物質の流動性含有物の硬さは、水っぽいものから粘度の高いものまでの範囲であることがある。外側の液嚢は、ゲル状から、変化しやすい硬さ、成形可能(moldable)、ワックス状までの範囲であることがある。結果として得られたデバイス、もしくは挿入物前駆物質は、その後、挿入サイトに適用しても良い。挿入に際して、溶媒が挿入物前駆物質から周囲の組織液へと拡散して、固体ポリマー基盤を有する挿入物を形成する。好ましくは、挿入後約0.5〜4時間で、好ましくは挿入後約1〜3時間で、好ましくは挿入後2時間以内で、挿入物前駆物質は生体内原位置で固体基盤へと固化する。従って、体内の挿入サイトに設置したとき、挿入物前駆物質は、いずれは固体の多孔性基盤構造へと凝固する。
【0187】
〔多孔性構造〕
生体内原位置で形成された挿入物、挿入物、挿入可能物(implantable articles)、生分解可能物(biodegradable articles)、および、本発明に係るデバイスなどの固体基盤の多孔性構造(porous structure)は、有機溶媒および熱可塑性ポリマーの性質に影響され、それらの水、水媒体、もしくは体液への溶解度(それぞれの媒体によって異なることがある)によっても、また、添加物(孔形成成分など)の存在によっても影響される。多孔性構造はいくつかのメカニズム、および、それらの組み合わせによって生ずると考えられる。流動性組成物の外の隣接した流体への、溶媒の散逸(dissipation)、放出(disbursement)もしくは拡散がポリマー基盤の孔導管(pore channels)を含む孔を作ることがある。流動性組成物への水媒体、水、もしくは体液の注入(infusion)もまた起こり、それも孔形成の原因の一部である。一般に、多孔性構造は流動性組成物から挿入物、物品などに変換する間に形成されると考えられる。この過程の間では、前述のとおり、流動性組成物中の有機溶媒と熱可塑性ポリマーの分配により熱可塑性ポリマーが多い部分と少ない部分ができると考えられる。この分配の結果、水の浸入と溶媒の散逸の動的相互作用が起こると考えられる。注入には水媒体、水、もしくは体液の流動性組成物中への移動も含まれ、散逸には有機溶媒が流動性組成物の周囲の媒体へと移動することも含まれる。流動性組成物の熱可塑性ポリマーが少ない領域は、溶媒と水の混合物、水媒体、もしくは体液に浸入される。これらの領域がいずれは挿入物、物品などの多孔性網状組織(porous network)になると考えられる。
【0188】
典型的には、固体基盤の巨視的構造には、芯(core)と皮膜(skin)が含まれる。典型的には、芯と被膜が微小孔性であるが、後述するように別の孔形成剤を用いない限り、被膜の孔は芯の孔の大きさに比べて小さい。好ましくは、固体基盤の外側の被膜部分の穴の直径は、内側の芯部分の孔の直径の大きさに比べて著しく小さい。芯の孔は、好ましくは、実質的に一様であり、被膜は典型的には機能上、多孔性の性質の芯と比較すると、多孔性ではないものである。挿入物、物品、デバイスなどの孔の大きさは、約4〜1000ミクロンの範囲で、好ましくは被膜層の孔の大きさは約1〜500ミクロンである。このような基盤の多孔度は、U.S. Pat. No. 5,324,519に開示されており、参照することによって本明細書に含まれる。
【0189】
固体の微小孔性の挿入物、物品、デバイスなどは、固体の体積の割合として計算すると5〜95%の範囲の多孔度を有する。多孔度の進行は少なくとも部分的には、有機溶媒および熱可塑性ポリマーの水への溶解度に支配されている。有機溶媒の水への溶解度が高く、ポリマーの水への溶解度がとても低いか、不溶である場合には、実質的に多孔度が高くなりし、典型的には30〜95%程度になる。有機溶媒の水への溶解度が低く、ポリマーの水への溶解度がとても低いか、不溶である場合には、多孔度は低くなり、典型的には5〜40%程度になる。多孔度の程度は部分的には、流動性組成物が水媒体などに接触したときのポリマー-溶媒の分配によって調整される。多孔度の調節は、本発明によって異なる種類の生分解可能物、挿入物、および、デバイスを作るのに有益である。例えば、強度が物品、挿入物、もしくは、デバイスなどに要求される場合には、多孔度を低くするのが有効であることがある。
【0190】
〔固体生分解可能物〕
生分解可能薬剤送達製品(biodegradable drug delivery products)は水、水媒体、もしくは、体液を固体化の原因として用いている変換方法によって調製することができる。一般に、これらの製品は生体外で固体基盤である。生体外での固体基盤が特殊な形状をしている場合には、前述の成形性挿入物質前駆物質についての方法に従って、流動性組成物を適当な鋳型にいれて変換することができる。前駆物質が形成された後、変換を完了させるために、前駆物質を追加的に水媒体に接触されることができる。またあるいは、流動性組成物を、水媒体を透過させる密閉金型(closed mold)に入れて、金型と組成物を水浴(aqueous bath)に沈めるなどして水媒体と接触させることができる。この場合には、好ましくは、流動性組成物は中間から高い粘度を有するものである。
【0191】
マイクロカプセル類、および、微小粒子類は既知の方法で調製することができる。つまり、マイクロカプセルの調製には、流動性組成物中で生理活性薬剤-キャリアーのミセル(bioactive agent-carrier micelles)のエマルジョン形成することを含む。ここで、キャリアーは、本発明に係る、生体適合性で、生分解性で、分岐した熱可塑性ポリマーの非溶剤(nonsolvent)である。ミセルは濾過され、水媒体中で懸濁させる。ミセルの表面の流動性組成物のコーティングは、その後、固体化して多孔性のマイクロカプセルを形成する。微小粒子も同様の方法で形成される。流動性組成物と生理活性薬剤の混合物を一滴ずつ、スプレー式、ドリップ式、エアロゾル化、もしくは、その他の同様の技術で、流動性組成物の非溶剤(nonsolvent)に加える。望ましい大きさと形の多孔性の微小粒子を調製するために、液滴の大きさと形が調整される。シート、薄膜、および、膜は、流動性組成物を適切な非溶剤に入れることによって調製でき、変換をさせることができる。同様に、スプレーもしくは、エアロゾル化したときに、液滴よりもむしろ糸状のものが生成するように、流動性組成物の粘度を調整することができる。流動性組成物用のフィラメント状骨格(filamentous scaffold)、もしくは、膜を構成するために、これらの糸状物を非溶剤に入れることができる。また、縫合材料もしくはその他の同様の材料も流動性組成物を非溶媒中で成型することによって作ることができる。成型開口部(extrusion orifice)は押し出される生産物の大きさと形を調節する。これらの生体外での固体基盤の生成をするための技術は、 U.S. Pat. Nos. 4,652,441、4,917,893、4,954,298、5,061,492、5,330,767、5,476,663、5,575,987、5,480,656、5,643,607、5,631,020、5,631,021、5,651,990 に記載されており、そこでの開示は、用いられるポリマーが本発明に係る生体適合性があり、生分解性で、熱可塑性ポリマーであるという条件の下で参照することによって本明細書に含まれる。
【0192】
これらの生体外の固体基盤は、それらの既知の機能に応じて用いられる。追加的に、挿入物、および、その他の固体物品は、切開術もしくはトロカール(trocar)のような既知の技術を用いて体内に挿入できる。
【0193】
本発明は挿入物もまた提供する。挿入物は、少なくとも実質的に水媒体、水、もしくは体液に溶解しない生分解性の、生体適合性がある、熱可塑性のポリマー、ならびに、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを含む。挿入物は固体もしくはゼラチン状の微孔性の基盤を有し、ここで、その基盤は被膜(skin)で囲まれた芯(core)である。挿入物は標準温度および圧力で熱可塑性ポリマーが可溶な、生体適合性のある有機液体をさらに含む可能性がある。生体適合性のある有機液体の量は、存在する場合には、組成物の約0wt.%〜約20wt.%などのように、少ないほうが好ましい。さらに、生体適合性のある有機液体の量は、時間と共に減少するのが好ましい。芯は、好ましくは、直径が約1ミクロンから約1000ミクロンの孔を含む。被膜は、好ましくは、芯の孔の直径よりも小さな直径の孔を含む。さらに、その被膜の孔は、好ましくは、被膜が芯と比較して機能的に多孔性でなくなるような大きさである。挿入物は任意の好ましい形、および、好ましい形状とすることができる。例えば、挿入物は固体、半固体(semi-solid)、ワックス状、粘度が高いもの、もしくはゼラチン状の挿入物とすることができる。
【0194】
本明細書中で、「処置」("treat" もしくは "treating")の語は、(i) 病理学上の症状(固形腫瘍など)が発祥することを防ぐこと(予防など)、(ii) 病理学上の症状(固形腫瘍など)を防ぐこと、もしくは、その進行を止めること、または、(iii) 病理学上の症状を緩和すること(固形腫瘍に関連する兆候を緩和するなど)を指す。
【0195】
「代謝産物」("Metabolite")は、本発明にかかる活性親薬剤(active parent drug)、もしくは、その他の処方、または、化合物を哺乳類の被験者に投与したときに、生きている細胞が、本発明にかかる活性親薬剤、もしくは、その他の処方、または、化合物と生体内で相互作用したときの生化学的プロセス結果として生じる物質のことを指す。代謝産物には任意の代謝経路からの生成物、もしくは、中間体を含む。
【0196】
「代謝経路」("Metabolic pathway")は、ある物質が他の物質へと変換される、酵素が介在している反応の順番のことを指し、中間体や細胞機能のためのエネルギーが提供される。代謝経路は、サイクルでない可能性(linear)も、サイクルである可能性(cyclic)もある。
【0197】
「治療上有効量」("Therapeutically effective amount")は、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグの本発明に有用な量、あるいは、例えば、内在する疾病もしくは疾患を処置もしくは予防するため、または、宿主の内在する疾病もしくは疾患に関連する徴候を処置するためなどの、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグの配合物の量のことを意図している。生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグの配合物は、好ましくは、相乗的組み合わせ(synergistic combination)である。相乗作用は、Chou and Talalay, Adv. Enzyme Regul. 22:27-55 (1984) に記載されているように、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグの複数のものを配合物として投与したときの効果が、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを個々の薬剤として単独で投与した場合の効果を足し合わせたものに比べて大きいことである。一般に、相乗作用は、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグの最適濃度以下で最も大きく現れる。相乗効果によって細胞障害性の低下し、活性が増加し、もしくは、配合物を個々の成分と比較したときのある他の種類の有益な効果が増大する可能性がある。
【0198】
本明細書中では、「生物学的薬剤として許容される塩」("biological agently acceptable salts")は、親化合物が修飾されてその酸もしくは塩基の塩を形成しているものを指す。生物学的薬剤として許容される塩の例には、アミン類などの塩基性残基と鉱酸もしくは有機酸の塩、カルボン酸類などの酸性残基とのアルカリの塩もしくは有機塩などが含まれるが、それらに限定されるわけではない。生物学的薬剤として許容される塩には、従来からの毒性の無い塩や、例えば毒性の無い無機酸もしくは有機酸などの、親化合物の四級アンモニウム塩が含まれる。例えば、従来からの毒性の無い塩には、無機酸(塩酸、臭化水素酸、硫酸、スルファミン酸、リン酸、硝酸など)から誘導された塩、有機酸(酢酸、プロピオン酸、コハク酸、グリコール酸、ステアリン酸、乳酸、リンゴ酸、酒石酸、クエン酸、アスコルビン酸、パモン酸、マレイン酸、ヒドロキシマレイン酸、フェニル酢酸、グルタミン酸、安息香酸、サリチル酸、スルファニル酸、2-アセトキシ安息香酸、フマル酸、トルエンスルホン酸、メタンスルホン酸、エタンジスルホン酸、シュウ酸、イセチオン酸、など)から調製された塩などが含まれる。特に、生物学的薬剤として許容される塩は、哺乳類の体内に天然に含まれているこれらの塩も含む可能性がある。
【0199】
本発明に有用な生物学的薬剤として許容される塩は、塩基性部分もしくは酸性部分を有している親化合物から従来の化学技術によって合成することができる。一般にこれらの塩は、これらの塩を生成する遊離の酸もしくは塩基を、化学量論的な量の適切な塩基もしくは酸と、水中または有機溶媒中あるいは二種類の混合物中で反応させることによって調製できる。一般には、エーテル、酢酸エチル、エタノール、イソピロピルアルコール、もしくは、アセトニトリルなどの非水溶媒系が好ましい。適切な塩のリストは、Remington's Biological agent Sciences, 17th ed., Mack Publishing Company, Easton, PA, 1985, p. 1418 の中に見つけることができ、参照によって本明細書に含まれる。
【0200】
本明細書中では「生物学的薬剤として許容される」("biological agently acceptable")の語は、ヒトや動物の組織に接触させるのに用いるのに適していて、過剰な毒性、刺激、アレルギー反応、もしくはその他の問題起こさないか、または、効能/危険の割合が相応の副作用を有すると医学的判断の下で思われる範囲の化合物(化学療法薬など)である。
【0201】
〔生物学的薬剤キット〕
本発明は生物学的薬剤キット(biological agent kits)を提供する。このようなキットは生体内原位置で、体内で生分解性の挿入物を形成させるのに適している。キットには流動性組成物を含む第一の容器を含めることができる。その組成物には、少なくとも実質的に水媒体、水、もしくは体液に溶解しない生分解性の、生体適合性がある、熱可塑性のポリマー、ならびに、標準温度および圧力で熱可塑性ポリマーが可溶な、生体適合性のある有機液体を含めることができる。キットには、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを含む第二の容器も含めることができる。生物学的薬剤キットには、オプションとして、生物学的薬剤キットの組み立て、および/または、使用をするための説明書もしくは解説書(printed indicia)さらに含めることができる。
【0202】
具体的には、第一の容器はシリンジもしくはカテーテルを含む可能性があり、第二の容器は、独立に、シリンジもしくはカテーテルを含む可能性がある。追加的に、第一の容器が注射器を含む可能性があり、第二の容器が注射器を含む可能性があり、両方の注射器が直接互いに結合されたものを形作っている可能性がある。
【0203】
〔具体的な範囲、値および実施例〕
本発明のある具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、ラクチド類、グリコリド類、カプロラクトン類、グリセリド類、無水物類(anhydrides)、アミド類、ウレタン類、エステルアミド類、オルトエステル類、ジオキサノン類、アセタール類、ケタール類、カーボネート類(carbonates)、ホスファゼン類、ヒドロキシ酪酸類(hydroxybutyrates)、ヒドロキシ吉草酸類(hydroxyvalerates)、アルキレンシュウ酸類(alkylene oxalates)、アルキレンコハク酸類(alkylene succinates)、アミノ酸類、および、それらの任意の結合物のグループから選択された単量体単位を含む構造を有する可能性があり、その構造は前記単量体単位を無秩序にもしくはブロック単位で含む。
【0204】
本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、ラクチド単量体単位、カプロラクトン単量体単位、グリコリド単量体単位、もしくはそれらの任意の結合物のポリマーもしくはコポリマーである可能性がある。
【0205】
本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、ポリラクチド類、ポリグリコリド類、ポリカプロラクトン類、ポリジオキサノン類、ポリカーボネート類(polycarbonates)、ポリヒドロキシ酪酸類(polyhydroxybutyrates)、ポリアルキレンシュウ酸類(polyalkyene oxalates)、ポリ無水物類(polyanhydrides)、ポリアミド類、ポリエステルアミド類、ポリウレタン類、ポリアセタール類、ポリケタール類、ポリオルトカーボネート類(polyorthocarbonates)、ポリホスファゼン類(polyphosphazenes)、ポリヒドロキシ吉草酸類(polyhydroxyvalerates)、ポリアルキレンコハク酸類(polyalkylene succinates)、ポリ(リンゴ酸)、ポリ(アミノ酸類)、キチン、キトサン、ポリオルトエステル類(polyorthoesters)、ポリ(メチルビニルエーテル)、ポリエステル類、ポリアルキルグリコール類、それらのコポリマー、それらのブロックコポリマー、それらのターポリマー、それらの結合物(combinations)、およびそれらの混合物のグループから選択されたポリマーを含む可能性がある。
【0206】
本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、少なくとも一つのポリエステルを含む可能性がある。
【0207】
本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、ポリラクチド、ポリグリコリド、ポリカプロラクトン、それらのコポリマー、それらのターポリマー、それらの結合物の少なくとも一つである可能性がある。
【0208】
本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、ポリ(DL-ラクチド-co-グリコリド) である可能性がある。本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、末端にカルボキシ基を有するポリ(DL-ラクチド-co-グリコリド) である可能性がある。本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、末端にカルボキシ基を有さないポリ(DL-ラクチド-co-グリコリド) である可能性がある。本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、末端にカルボキシ基を有する、50/50のポリ(DL-ラクチド-co-グリコリド) である可能性がある。本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、末端にカルボキシ基を有さない、75/25のポリ(DL-ラクチド-co-グリコリド) である可能性がある。
【0209】
本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、最高で前記組成物の約80wt.%まで存在する可能性がある。本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、前記組成物の約10wt.%以上存在する可能性がある。本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、前記組成物の約10wt.%から約80wt.%まで存在する可能性がある。本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーが、前記組成物の約30wt.%から約50wt.%まで存在する可能性がある。
【0210】
本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーの平均分子量が約15,000以上である可能性がある。本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーの平均分子量が最高で約45,000である可能性がある。本発明の他の具体的な実施例では、生分解性の、生体適合性がある、熱可塑性のポリマーの平均分子量が約15,000から約45,000である可能性がある。
【0211】
本発明のある具体的な実施例では、生体適合性のある有機液体の水への溶解度が、いかなる比率でも完全に不溶から、全ての比率において完全に可溶まで変動する可能性がある。本発明の他の具体的な実施例では、生体適合性のある有機液体が、水には完全に不溶であるが体液中には拡散する可能性がある。本発明の他の具体的な実施例では、生体適合性のある有機液体が、少なくとも部分的に水溶性である可能性がある。本発明の他の具体的な実施例では、生体適合性のある有機液体が、完全に水溶性である可能性がある。本発明の他の具体的な実施例では、生体適合性のある有機液体が、水媒体、水、もしくは、体液の中に分散する可能性がある。
【0212】
本発明の他の具体的な実施例では、生体適合性のある有機液体が、極性プロトン性の液体である可能性がある。本発明の他の具体的な実施例では、生体適合性のある有機液体が、極性非プロトン性の液体である可能性がある。
【0213】
本発明の他の具体的な実施例では、生体適合性のある有機液体が、外界温度および生理学的温度において液体であり、アルコール類、ケトン類、エーテル類、アミド類、アミン類、アルキルアミン類、エステル類、カーボネート類、スルホキシド類、スルホン類、およびスルホン酸塩類(sulfonates)の群から選択された官能基を少なくとも一つ含む、環状有機化合物、脂肪族有機化合物、直鎖脂肪族有機化合物、分枝脂肪族有機化合物もしくは芳香族系有機化合物である可能性がある。
【0214】
本発明の他の具体的な実施例では、生体適合性のある有機液体が、置換複素環化合物、炭酸(carbonic acid)とアルキルアルコール類(alkyl alcohols)のエステル類、モノカルボン酸類のアルキルエステル類、モノカルボン酸類のアリールエステル類、モノカルボン酸類のアラルキルエステル類、ジカルボン酸類のアルキルエステル類、ジカルボン酸類のアリールエステル類、ジカルボン酸類のアラルキルエステル類、トリカルボン酸類のアルキルエステル類、トリカルボン酸類のアリールエステル類、トリカルボン酸類のアラルキルエステル類、アルキルケトン類、アリールケトン類、アラルキルケトン類、アルコール類、ポリアルコール類、アルキルアミド類、ジアルキルアミド類、アルキルスルホキシド類、ジアルキルスルホキシド類、アルキルスルホン類、ジアルキルスルホン類、ラクトン類、環状アルキルアミド類、環状アルキルアミン類、芳香族アミド類、芳香族アミン類、それらの混合物、およびそれらの結合物の群から選択される可能性がある。
【0215】
本発明の他の具体的な実施例では、生体適合性のある有機液体が、N-メチル-2-ピロリドン、2-ピロリドン、(C2-C8)脂肪族アルコール、グリセリン、テトラグリコール、グリセロールフォーマル(glycerol formal)、2,2-ジメチル-1,3-ジオキソロン-4-メタノール、酢酸エチル、乳酸エチル、酪酸エチル、マロン酸ジブチル、クエン酸トリブチル、アセチルクエン酸トリ-n-ヘキシルエステル(tri-n-hexyl acetylcitrate)、コハク酸ジエチル、グルタル酸ジエチル、マロン酸ジエチル、クエン酸トリエチル、トリアセチン、トリブチリン、炭酸ジエチル(diethyl carbonate)、プロピレンカーボネート(propylene carbonate)、アセトン、メチルエチルケトン、ジメチルアセトアミド、ジメチルホルムアミド、カプロラクタム、ジメチルスルホキシド、ジメチルスルホン、テトラヒドロフラン、カプロラクタム、N,N-ジエチル-m-トルアミド、1-ドデシルアザシクロヘプタン-2-オン、1,3-ジメチル-3,4,5,6-テトラヒドロ-2-(1H)-ピリミジノン、安息香酸ベンジル、および、それらの結合物の群から選択される可能性がある。
【0216】
本発明の他の具体的な実施例では、生体適合性のある有機液体が、約30から約500の範囲の分子量を有する可能性がある。
【0217】
本発明の他の具体的な実施例では、生体適合性のある有機液体が、N-メチル-2-ピロリドン、2-ピロリドン、N,N-ジメチルホルムアミド、ジメチルスルホキシド、プロピレンカーボネート、カプロラクタム、トリアセチン、および、それらの任意の結合物である可能性がある。本発明の他の具体的な実施例では、生体適合性のある有機液体が、N-メチル-2-ピロリドンである可能性がある。
【0218】
本発明の他の具体的な実施例では、生体適合性の液体が、前記組成物の約40wt.%以上存在する可能性がある。本発明の他の具体的な実施例では、生体適合性の液体が、最高で前記組成物の約80wt.%まで存在する可能性がある。本発明の他の具体的な実施例では、生体適合性の液体が、前記組成物の約50wt.%から約70wt.%まで存在する可能性がある。
【0219】
〔実施例〕
〈 ATRIGEL(登録商標)送達システムを用いた眼部への徐放製剤 〉
[ATRIGEL(登録商標)薬剤送達システムの概論]
QLT社(QLT, Inc.)の子会社であるQLT USA社(QLT USA)は、小さな分子、ペプチド類、およびタンパク質類を徐放するための、液体の生分解性薬剤送達システム(アトリゲル(ATRIGEL(登録商標)))を開発した。この送達システムは、ラクチド/グリコリド・コポリマーなどの生体適合性の溶媒類に溶解する生分解性のポリマー類から構成される。薬剤はこの溶液中に含まれており、得られた混合物を通常のシリンジおよび針を使って皮下に注入する。体液と接触すると、ATRIGEL(登録商標)送達システムは固化し、薬剤を固体基盤内に捕捉する。薬剤はあらかじめ定められた速度で挿入物が生分解するに従って放出される。
【0220】
ATRIGEL(登録商標)送達システムを用いて、アトリックス社(Atrix)は、小さな分子から組み換えバイオ医薬品に至るまでの様々な薬剤を、一週間から6ヶ月に至るまで多様な薬剤送達持続時間で送達した。現在、アトリックス社(Atrix)は、デンタルケア製品(ATRIDOX(登録商標)、ATRISORB(登録商標)、およびATRISORB(登録商標)-D)および、薬学的製品((ELIGARD(登録商標) 7.5 mg、ELIGARD(登録商標) 22.5 mg、 およびELIGARD(登録商標)30 mg)を含む、ATRIGEL(登録商標)送達システムを用いたFDAの承認を受けた多くの商品を市場に出しており、いくつかの商品は臨床試験中である。
【0221】
[ATRIGEL(登録商標)送達システムの利点]
ATRIGEL(登録商標)送達システムは、他の非経口の徐放性送達システムよりも多数の明確な利点を提供する。例えば、ミクロスフェアは、ハロゲン化した溶媒の使用を含むことがある無菌プロセスを用いて製造する必要がある。その上、薬剤のミクロスフェアの割合はカプセル封入の効率性によって調節される。これは薬物製品の製造過程でのAPIのうちの25〜50%の回復不能な損失が生ずる可能性があるプロセスである。それに比べて、ATRIGEL(登録商標)送達システムは生体適合性のある含有物から構成され、適切な生分解性ポリマーを生体適合性のある溶媒に溶解して調製される。ミクロスフェアと異なり、ATRIGEL(登録商標)送達システムではγ線照射を含む従来技術を用いて最終的に滅菌することができる。この独創的な製造プロセスと独自開発された製品態様(proprietary product configuration)は、本質的に製造過程での薬物の損失を解消する。さらにATRIGEL(登録商標)送達システムでは、ミクロスフェアで少ない投薬量でも大きな体積を注入するのに比べて、大きい投薬量のAPIを小さな注入体積で送達することができる。一番重要なことには、ATRIGEL(登録商標)持続性薬剤(depot)は、感度の良い(sensitive)バイオ医薬品が生体内で分解および酵素による不活性化するのを防ぐ。
【0222】
ATRIGEL(登録商標)技術は、他の挿入できないものや貯蔵装置(reservoir devices)に比べて患者に優しい送達基盤(delivery platform)である。ATRIGEL(登録商標)薬剤製品は、皮下に挿入され、挿入物は所定の期間にわたって薬剤を放出する。典型的には、その挿入物は薬剤が放出されるのと同じ速度で分解されるため、挿入サイトは原則的には次の挿入時には消散する。それに比較して、機械的な挿入物(mechanical implants)は薬剤を使い果たした後には、外科的に取り除いて埋めなおすか、もしくは詰め替える必要がある。
【0223】
眼に生物学的薬剤を投与するのに用いるときに、ATRIGEL(登録商標)送達システムを、効果的および適切な量の物質の眼や周囲の器官への刺激の発生および/または程度を下げるために用いる。
【0224】
[実施例1]
{眼内注射の後のATRIGEL(登録商標)送達システムの許容性}
一連の臨床前検査は眼内注射の後のATRIGEL(登録商標)送達システムの許容性を決定するために行われた。これらの検査ではニュージーランドシロウサギ(New Zealand White rabbit)に3つのATRIGEL(登録商標)媒体のうちの一つを注射した。注射は直接眼の中に(硝子体内注射)、結膜の下に(結膜下注射)、もしくは、眼球の後ろの筋肉と神経を覆っている膜を通して(テノン嚢下注射(subtenon injection))行った。ウサギは、局所反応と視力(ocular acuity)について28日間にわたって定期的に観察された。さらに、それぞれのATRIGEL(登録商標)媒体の細胞病理学的影響(cytopathological affect)を評価するために硝子体液が試料採取された。
【0225】
いかなる眼内投与でも予想されるとおり、全てのATRIGEL(登録商標)溶液について軽い結膜充血が見られた。しかしながら、この過渡応答は72時間以内に消えた。眼圧および視力(visual acuity)は、検査中に変化しなかった。硝子体液の細胞病理学的評価についは、投与後3日目、14日目および28日目に行った白血球数(white blood cell count)(WBCs)およびタンパク質レベルは全て正常であった。さらに、投与後のいつにおいても処置されたいずれの目にも、炎症、または、異型細胞、もしくは、感染病原体は見られなかった。
【0226】
これらの結果は、ATRIGEL(登録商標)送達システムが良く許容性を有することを示し、眼内注射の後に、不活性であることも表している。実際、ATRIGEL(登録商標)薬剤製品はある種の薬剤の局所反応を弱めることがある。例えば、その後の検査で、ATRIGEL(登録商標)媒体を既知の眼部刺激物質(塩化ベンゼトニウム)と混合して調製した処方の許容性を、同じ物質の水溶液の許容性と比較した。刺激物質を単独で投与したときの巨視的観察と細胞病理学的評価では、硝子体内注射の一日後に、顕著な結膜の腫脹、重篤な水性紅斑および細胞紅斑(aqueous and cellular flare)、ならびに角膜の透明度のほぼ完全な喪失(almost complete loss of the transparency of the cornea)が見られた。しかしながら、ATRIGEL(登録商標)/刺激物質処方の場合には、同じ投薬期間中、軽い結膜の腫脹、中程度の水性紅斑および細胞紅斑が見られ、角膜は全く透明度が失われなかった。従って、ATRIGEL(登録商標)デポーの徐放性は敏感な眼部組織の刺激物質のレベルを抑え、それによっておそらく局所的有害事象を小さくしたことが示される。
【0227】
結論として、ATRIGEL(登録商標)送達システムは、治癒的薬剤を眼部へ持続性送達するのに適している。
【0228】
[実施例2]
PEG300、mPEG350、PEG400、NMP、トリアセチン、純粋なDMSO(neat DMSO)と同様のDMSO、および、BECの水溶液を含むいくつかのATRIGEL(登録商標)処方が、硝子体内かそれとも結膜下で、三日間にわたってウサギの眼で評価された。いくつかのATRIGEL(登録商標)処方、(特に、PEG300、mPEG350、PEG400、およびNMPを含む処方)は、いずれの投与経路を用いても短期間の眼部挿入物に適していることが見出された。従って、長時間の刺激検査(long-term irritation study)は、PEG300、mPEG350、およびNMPを含むATRIGEL(登録商標)の処方について、両方の投与経路を用いて行った。長時間の刺激検査の結果、予測どおりポリマーの生分解が起こり、これによって刺激が長引くことは無かった。従って、PEG300、mPEG350、およびNMPを含むATRIGEL(登録商標)処方は、硝子体内挿入および結膜下挿入用、さらには後の薬物送達用に許容される媒体であると考えられる。
【0229】
この検査の目的はATRIGEL(登録商標)送達システムの、眼部への徐放性薬物送達媒体としての実現可能性の評価をすることである。臨床的に許容される媒体および挿入技術を確認すること、ならびに、眼の機能の障害もしくは著しい組織反応(tissue reaction)の原因とならない挿入物を形成すること、という本検査の最終目的の下で、ATRIGEL(登録商標)媒体は眼部の様々な部位および眼部周辺の組織に挿入される。この予備調査が成功すれば、その後の企画で眼部への薬物送達評価がなされる。
【0230】
ウサギでの一連の臨床前検査では、一連のATRIGEL(登録商標)媒体について様々な挿入技術と挿入位置が行われた。挿入サイトでの組織反応および眼の様々な構造もまた評価される。挿入サイトには、眼の外側に挿入する結膜下注射、および、強膜(強い外側の膜)を通過する硝子体注射が含まれる。ここで、できれば、強膜に加えた挿入物が硝子体液の喪失を防ぐ栓を形成する。硝子体注射された挿入物は、直接、眼の内部に接触しているので有利であり、そのため最も効果的な薬物送達をする。しかしながら、この投与経路は副作用も著しく強い。
【0231】
これらの挿入技術および挿入位置についての初期検査(initial studies)は、72時間後に犠牲にする少数のウサギに対して行われた。一度、初期検査が完成されると、許容されるATRIGEL(登録商標)処方が確認され、長時間の刺激検査(long-term irritation study)が行われた。すべての検査において、ウサギは詳細に副作用について観察され、必要に応じて安楽死させた。前眼房の特徴を評価するためにスリットランプ観察(Slit lamp observations)を行い、修正したMcDonald-Shadduck評価基準(McDonald-Shadduck scoring system)の数値等級(numerical scale)を用いて点数をつけた。挿入サイトおよび眼の主要な組織(特に網膜)の組織診断、ならびに、硝子体液の細胞病理もまた評価した。細胞病理レポートには、白血球数、タンパク質量(protein count)、および、比重値が含まれる。
【0232】
眼は敏感な組織であるので、ATRIGEL(登録商標)媒体と最も生物適応性の高い溶媒のみを初期検査に用いた。初期に検査した溶媒は、ポリエチレングリコール300(PEG300)、PEG400、ポリエチレングリコールモノメチルエステル350(polyethylene glycol monomethylether 350 、mPEG350)、n-メチルピロリドン(NMP)、ジメチルスルホキシド(DMSO)および、グリセリントリアセテート(glycerol triacetate、トリアセチン)である。さらに、既知の眼部刺激物質である塩化ベンゼトニウム(BEC)を陽性応答(positive response)の評価に用いた。検査を通して50/50ポリ(ラクチド-co-グリコリド)(PLGH)という一種類のポリマーを0.18dL/gの固有粘度で用い、50μLの一定の注入体積とし、25ゲージ5/8インチの針を用いた。
【0233】
{ 4.1. ATRS917 }
ウサギの生体内での初期検査は、2003年6月19日に行われ、硝子体注射経路で6種類のATRIGEL(登録商標)媒体処方について行った。バイクリル(Vicryl)生分解性縫合糸を検査における対照として用いた。ATRIGEL(登録商標)処方は以下の表にあげたとおりである。
【0234】
【表2】

【0235】
PEG400処方は(グループEおよびF)は最も粘度が高く、25ゲージ針では、幾分、注入が難しいが、すべての注入は問題なく順調に行われた。注入後24時間では、眼の処置に伴う刺激は見られず、眼の異常はグループAからDでは見られなかった。グループEおよびFでは、処置された眼の三分の一で目脂が見られたが、他の異常は見られなかった。注入後72時間では、グループA、D、およびEでは何の刺激もしくは眼の異常も見られなかったが、グループB、CおよびFでは、処置された眼の三分の一で軽い水性紅斑もしくは細胞紅斑(mild aqueous or cellular flare)が見られたが、その他の異常はなかった。眼の後部の等級付けを補助するために用いられる、トロピカミド瞳孔拡張薬溶液(tropicamide pupil dilation solution)に関連する薬学的な阻害剤のために、動物の瞳孔反射(pupillary response)が無かった。この結果から、今後の検査同様、瞳孔反射の欠如はATRIGEL(登録商標)挿入物に関連するものではないことが期待できる。
【0236】
眼圧、比重、白血球数、および、タンパク質量は、全て正常レベルで炎症、異常細胞、または感染物質(infectious agents)は、処置をしたいずれの眼にも見られなかった。硝子体注射は、非常に清潔で、眼から針を除いたとき、刺した後の穴はATRIGEL(登録商標)自体で封をされていた。解剖によって、挿入物は内側の表面に付着しており、硝子体液中に浮いているのではないことが分かった。
【0237】
この検査の結果、ATRIGEL(登録商標)PEG処方、および、ATRIGEL(登録商標)mPEG処方が眼に注入されたときの許容性があることが分かった。顕著な、眼/組織の刺激はいずれの試験物でも見られなかった。眼科医だけに関係するが、Biological Test Center(BTC)Labsは固体デポー挿入物の用の注入サイズが、幾分、大きかった。彼らはこの注入体積ではウサギの視界に障害が生じると感じていた。本検査では挿入物の大きさではなく、眼および組織の刺激が主要な関心事であり、我々は注入体積の最適化をしていなかった。この問題はさらに開発が続けられて、解決されるであろう。
【0238】
{ 4.2. ATRS929 }
ウサギの生体内での第二回目の検査は、2003年8月20日に行われた。4種類のATRIGEL(登録商標)媒体処方は硝子体注射経路で、2種類の処方は結膜下注射経路で評価した。7-0バイクリル(Vicryl)生分解性縫合糸を、今回も、検査における対照として用いた。ATRIGEL(登録商標)処方は以下の表にあげたとおりである。
【0239】
【表3】

【0240】
グループAからDは硝子体注射、グループEおよびFは結膜下注射をした。(注:参考までに、グループEおよびFの処方はATRS917でも結膜下注射で評価されている。)BCT Labsによって、全ての注入は問題なく順調に行われた。
【0241】
注入後24時間では、ほとんどの動物が軽度から中度の結膜充血(conjunctival congestion)、および、処置した眼(左目)の腫脹を示した。処置された眼の3つで水性紅斑および細胞紅斑(mild aqueous and cellular flare)が見られた(グループAで2つ、グループCで1つ)。核性白内障(Nuclear cataract)が処置された3つの眼で確認された(グループCで2つ、グループDで1つ)。グループCおよびD では(トリアセチンATRIGEL(登録商標)処方)被験物質が水晶体前部と後部を包み、水晶体核へと移動した。処置された眼の3つおよび1つの対照の眼(グループA)で硝子体腔に、いくつかの散らばった混濁部が観測された。その他の異常は見られなかった。
【0242】
注入後72時間では、一匹の動物だけで(グループA)処置した眼に軽度の結膜充血が見られた。72時間後には水性紅斑もしくは細胞紅斑は見られなかったが、グループCで処置した1つの眼にだけ核性白内障が見られた。グループCの動物の処置した眼の2つで被験物質が眼球の後下部に位置していて、被験物質は円錐形であった。一匹の動物では、小さな1〜2mmの被験物質の断片が視神経頭の乳頭周囲部分へと移動した。処置した眼の1つでは(グループD)軽い脈絡膜/網膜の炎症が見られた。
【0243】
ATRIGEL(登録商標)の初期検査(ATRS917)と同様に、注射は、非常に清潔で、眼から針を除いたとき、刺した後の穴はATRIGEL(登録商標)自体で封をされていた。解剖によって、グループAおよびBの挿入物は内側の表面に付着しており、硝子体液中に浮いているのではないことが分かった。グループCおよびDの挿入物は水晶体に付着していることが見出され、薄いフィルム状の形態であった。グループEおよびFの挿入物は眼の外側の表面に付着していることが見出された。検査された全ての処方で、比重、眼圧、白血球数、および、タンパク質量は、全て正常レベルであった。しかしながら、グループCの一匹の動物では、少ない数の炎症細胞(inflammatory cells)が見つかった。
【0244】
この検査の結果は、トリアセチンが眼部ATRIGEL(登録商標)挿入物に許容できるキャリアー溶媒ではないことを示唆している。しかしながら、最初の生体内検査(ATRS917)で硝子体注射されたPEG300およびPEG400に相当する、すなわち同様の細胞病理および眼部所見がみられた、NMP処方は許容されうる結果を示した。結膜下注射されて眼の外側の表面に付着しているPEG300およびPEG400挿入物で眼/組織の刺激が低いこともまた、ATRIGEL(登録商標)システムを眼部薬物送達デバイスとして利用することに希望を与えさらに柔軟性を加えるものである。
【0245】
{ 4.3. ATRS939 }
ウサギの生体内での第三回目の検査は、2003年9月23日に行われた。4種類のATRIGEL(登録商標)処方は硝子体注射経路で、2種類の処方は結膜下注射経路で評価した。先の2つの生体検査と同様に、7-0バイクリル(Vicryl)生分解性縫合糸を、検査における対照として用いた。ATRIGEL(登録商標)処方は以下の表にあげたとおりである。
【0246】
【表4】

【0247】
グループAからDは硝子体注射、グループEおよびFは結膜下注射をした。(注:参考までに、グループEおよびFの処方はATRS917でも結膜下注射で評価されている。)BCT Labsによって、全ての注入は問題なく順調に行われた。
【0248】
注入後24時間では、グループAとEの一匹の動物が軽度の結膜充血を示した。グループC、DおよびFの全ての動物が少なくとも、角膜周辺部への注入に関連して、少なくとも角膜周辺部の外周の75%にわたる鮮紅色の結膜充血を示した。グループCの結膜腫脹もまた顕著で、グループFのものは軽度であった。さらに、グループCで見られた異常は、角膜の透明性が〜76-100%の表面を含め、ほとんど完全に喪失していたことである。グループCでは、重篤な水性紅斑および細胞紅斑(severe aqueous and cellular flare)が見られた。グループCおよびDでは、虹彩ストローマの軽い腫脹を伴い最少量から中程度注射剤(injection)が虹彩の第三の血管(tertiary vessels)に見られた。さらに、多くの混濁(opacities)、底詳細部(fundus details)の顕著なぼやけが硝子体に観測され、さらには、中程度の脈絡膜/網膜の炎症が見られた。注入後24時間でグループA、B、E、およびFには他の顕著な所見は無かった。
【0249】
注入後72時間では、グループB、EおよびFの全ての動物が予測されていたように瞳孔反射が無い以外には異常な眼部所見が無かった。グループAの一匹の動物が軽度の網膜出血および炎症を示した。グループCおよびDでは、さらに軽度から中度の結膜充血がみられ、グループCについては膿などの分泌(discharge)や腫脹も見られた。グループCでは角膜の透明性の喪失、虹彩の合併症、核性白内障および成熟白内障、ならびに、底詳細部(fundus details)の顕著なぼやけの原因となる混濁(opacities)が見られた。グループCおよびDでは、網膜剥離、出血、および炎症は評価できなかった。
【0250】
グループAからDの硝子体液に対して行った細胞病理学的所見では、グループCおよびDの動物の3分の2で比重とタンパク質量の上昇を示した。顕著な炎症はグループCおよびDの全ての動物とグループAの一匹の動物で見られた。全ての網膜細胞は見かけ上正常であり、異常細胞もしくは感染物質は見られなかった。
【0251】
ATRIGEL(登録商標)の初期検査(ATRS917および939)と同様に、注射は、非常に清潔で、眼から針を除いたとき、刺した後の穴はATRIGEL(登録商標)自体で封をされていた。解剖によって、40%のポリマーを含んでいるグループBでは、25%しかポリマーを含まないグループDよりもずっと大きな挿入物が含まれていた。これは部分的にはポリマーの固化に伴う膨張、さらには、ポリマーの濃度そのものによるもので、ポリマー濃度の高いものからは大きな挿入物が得られると期待される。これらの硝子体内注射されたATRIGEL(登録商標)挿入物は、眼の側面部分(side of the eye)と関連しており、それらが眼に「係留している」("anchored")かどうかは明確ではなかった。グループEおよびFの挿入物は眼の外側に密着しており、丸い形をしている硝子体注射をされたものと比較すると平らなディスク状の形態であった。
【0252】
この検査の結果は、予測どおりBECが顕著な眼部刺激の原因となることを示唆しており、ATRIGEL(登録商標)中のBEC(グループD)が細胞紅斑、結膜の腫脹、膿などの分泌および、うっ血、を弱めたが、硝子体液の事実上の炎症(actual inflammation)は軽減されなかった。NMP処方は全ての一連の被験物質の中で一番炎症が軽く、トリアセチンは顕著な結膜充血の原因となった。DMSO処方および純溶媒は、初期検査と第二の検査(ATRS917および929)で検査された上記の被験物質では炎症を起こさせないことが分かった。
【0253】
{ 5. 28日間のATRIGEL(登録商標)実現可能性検査、ATRS948 }
ウサギの生体内での第四回目の検査は、2003年10月28日に行われた。検査では、3種類のATRIGEL(登録商標)処方について、硝子体注射経路および結膜下注射経路を用い、28日間に渡って評価した。この検査はATRIGEL(登録商標)挿入物の長期間の刺激を評価し、さらには挿入物の分解速度論について調査するためのものである。ATRIGEL(登録商標)処方は以下の表にあげたとおりである。
【0254】
【表5】

【0255】
グループA-B、E-F、およびI-Jには硝子体注射、グループC-D、G-H、およびK-Lには結膜下注射をそれぞれ行った。BCT Labsによって、全ての注入は問題なく順調に行われた。
【0256】
注入後24時間では、グループA、C、D、EおよびKの多くの動物が、軽度の結膜充血を示し、グループC、D、およびEの動物では軽度の結膜腫脹もみられた。さらに、グループDの一匹の動物だけは、大量の目脂を分泌した。水性紅斑(Aqueous flare)がグループAとCの一匹の動物に見られた。虹彩合併症(Iris involvement)はグループAの一匹の動物に見られた。その他の眼部所見に異常は無かった。
【0257】
注入後一週間では、一匹の動物にだけ異常な眼部所見が見られた。これはグループDの一匹の動物で角膜の透明性がわずかに失われたことを含む。眼の基底構造(underlying structures)はまだはっきりと視認できるが角膜全体の1〜25%に、明らかにいくらかの混濁が見られた。この異常所見は動物が眼を引っかいたために起こったもので、ATRIGEL(登録商標)被験物質に起因するものではないことが分かった。
【0258】
注入後2週間目、3週間目、および4週間目の試験期間では、異常所見は見られなかった。しかしながら、グループJの一匹の動物で、わずかに水晶体が前方に押されていた。さらに、グループA-B、E-F、およびI-Jの硝子体液についておこなわれた細胞病理学的所見では、比重、眼圧、白血球数およびタンパク質量は、これらの硝子体注射処方で、全て正常レベルであった。その上、異常細胞、もしくは炎症細胞は見られなかった。
【0259】
選択された眼についての解剖は、ポリマー分解と挿入物の形態を調べるために、14日目と28日目に行われた。14日目に、グループA、EおよびIの挿入物は柔らかくゼリー状で半透明構造となっていた。これらの硝子体注射されたATRIGEL(登録商標)挿入物は眼の側面部分(side of the eye)と関連しており、それらが眼に「係留している」("anchored")かどうかは明確ではなかった。グループC、GおよびKの挿入物は、眼の外側に付着しており、完全な状態(integrity)を示し、分解の徴候を示していた。28日目には、グループBに対応する一つの挿入物だけが見つかり、この挿入物は非常に柔らかく、半透明で、明らかに分解していた。他の挿入物は28日目には発見されず、挿入物がかつて存在した痕跡も無かった。
【0260】
この検査の結果、24時間後の所見は最初の3つの短期間の眼部ATRIGEL(登録商標)評価検査と同様のものであった。これらの所見は、硝子体注射もしくは結膜下注射に対する典型的な反応である、結膜充血にほぼ限られていた。注入後28日には、それまで刺激が長引くことは無く、異常な細胞病理も観測されなかった。解剖によって、14日目に見つけられた挿入物は明らかに分解されていて、28日目の時点で発見されたのは1つの挿入物だけであったことが明らかになった。この結果は、この時間内にポリマーの完全な生分解が予期されるものであり、非常に有望なものである。さらに、28日目に刺激がなくなっていたことは、ATRIGEL(登録商標)の分解生成物は刺激の原因とならず、眼から消えていることが示唆された。
【0261】
{5.2. ATRS1012 }
ウサギの生体内での第五回目の検査は、2004年8月18日に行われた。検査では、3種類のATRIGEL(登録商標)処方について、テノン嚢下注射(the sub-Tenon's route of injection)経路を用い、28日間に渡って評価した。この検査はATRIGEL(登録商標)挿入物の長期間の刺激を評価し、さらには挿入物の分解速度論について調査した。ATRIGEL(登録商標)処方は以下の表にあげたとおりである。
【0262】
【表6】

【0263】
1日目および/または3日目では、36個の眼のうち17個で結膜充血が見られた。結膜充血は、PEG300中の25% 50/50 PLGH 0.18を投与した12個のうち6個の眼、mPEG350中の30% 50/50 PLGH 0.18を投与した12個のうち7個の眼、および、NMP中の45% 50/50 PLGH 0.18を投与した12個のうち4個の眼で見られた。これらの眼のうちの1個で、PEG300中の25% 50/50 PLGH 0.18を投与したものは、1日目に結膜の腫脹も見られた。mPEG350中の30% 50/50 PLGH 0.18を投与した1個の眼では3日目に目脂が見られたが、この眼は検査期間中、結膜充血を示していなかったものであった。NMP中の45% 50/50 PLGH 0.18を投与した2個の眼では、結膜充血部分の近くで角膜の透明性が少し失われていた。この所見は注射をした日のみ(1日目)見られた。
【0264】
1日目、3日目、7日目および/または14日目には、36個の眼のうち、9個で被験物質が漏れ出すか位置が変更していた。被験物質の漏洩および移動は、PEG300中の25% 50/50 PLGH 0.18を投与した12個のうち1個の眼、mPEG350中の30% 50/50 PLGH 0.18を投与した12個のうち3個の眼、および、NMP中の45% 50/50 PLGH 0.18を投与した12個のうち5個の眼で見られた。これらの眼には、被験物質は結膜領域(conjunctival area)、角膜表面、および/または、瞬膜(third eyelid)に存在した。
【0265】
21日目では、2種類のPEG被験物質処方のうちの1種類を投与した残っている全ての眼には、痕跡量の被験物質しか見られなかった。NMP処方を投与した全ての残っている眼において被験物質は明らかに存在し、サイトに渡って通常の血管反応(vascular response)があった。
【0266】
全てのグループの硝子体液についておこなわれた細胞病理学的所見では、比重、眼圧、白血球数およびタンパク質量は、これらの硝子体注射処方で、全て正常レベルであった。その上、異常細胞、もしくは炎症細胞は見られなかった。顧問病理学者(consulting pathologist)の意見では、液細胞診所見(fluid cytology findings)は通常の硝子体液と一致した。
【0267】
3日目、14日目および28日目のポリマー分解と挿入物の形態を調べるために、選択された眼の解剖が行われた。3日目には、挿入物は眼の強膜に付着しており膜状であった。14日目には、挿入物は眼の外側に付着しているのが見られ、完全な状態ではあったが分解の徴候が見られた(柔らかくなった)。28日目には挿入物は見られず、以前に挿入物が存在していた痕跡も見られなかった。
【0268】
本検査の結果は、硝子体経路および結膜下経路からの投与を評価した4種類のATRIGEL(登録商標)の初期評価検査として行われた24時間観察と同様の結果を示した。これらの所見は、硝子体注射、結膜下注射、もしくはテノン嚢下注射に対する典型的な反応である結膜充血にほぼ限られていていた。注入後28日には、それまで刺激が長引くことは無く、異常な細胞病理も観測されなかった。解剖によって、14日目に見つけられた挿入物は予想通りわずかに分解されていて、28日目の時点では挿入物が発見されなかった。28日間刺激が無かったことは、ATRIGEL(登録商標)がテノン嚢で許容され耐容性があることを示唆している。
【0269】
{ 6. 考察 }
最初の3種類の短期間の生体内眼部での実現可能性試験(in-vivo ocular feasibility studies)から、PEG300、mPEG350、PEG400、およびNMPがATRIGEL(登録商標)の硝子体内もしくは結膜下の挿入に適した溶媒であることが示唆された。これらのキャリアー溶媒は、いずれの経路を用いた場合でも3日間の期間にわたって眼および組織への刺激がわずかであった。ATRIGEL(登録商標)のDMSO処方では硝子体内の評価がされた前述の被験物質による刺激は見られず、結膜下でも許容性を示す可能性があるが、DMSOの生体適合性は疑わしい。さらに、トリアセチンは挿入物形成しにくいこと、さらには刺激性があることから、眼部挿入物には適合しないことが見出された。
【0270】
PEG300、mPEG350、およびNMPのATRIGEL(登録商標)処方が3日間にわたる眼部挿入物に適合するという知見から、2種類の長期間刺激検査をこれらのATRIGEL(登録商標)処方で行った。長期間刺激検査の結果、28日間の期間にわたって硝子体内注射、結膜下注射、もしくはテノン嚢下注射された挿入物による刺激は見られなかった。さらに、実験の終了時ではATRIGEL(登録商標)挿入物が存在しないことから、ATRIGEL(登録商標)の分解が予想通りに起こって、眼が分解生成物を補足しなかったことを明らかになった。
【0271】
本検査の結果は、硝子体内注射された挿入物は眼の内側の表面に付随しており硝子体液中に浮いていないことを、さらに示唆している。硝子体注射された眼の解剖から、注入した後の孔はATRIGEL(登録商標)自体で封をされて、残りの挿入物が眼の内側の表面に「係留する」("anchored")原因となる。この「係留」は視力障害の原因となる、挿入物の硝子体液中での移動を制限する。同様に、結膜下注射およびテノン嚢下注射された挿入物は、ATRIGEL(登録商標)挿入物の粘着性によって、眼の外側に付着した。これは、眼の外膜を通しての薬剤の物質移行が、挿入物が眼の表面に接触していることによって増加することを暗示する。結膜下注射経路およびテノン嚢下注射経路での許容性が示されたことによって、必要な長い徐放送達期間にあわせるために注入体積、ポリマー濃度もしくは薬物負荷を増加させることが可能であるので、ATRIGEL(登録商標)送達システムの自由度が広がった。
【0272】
{ 概要 }
眼の中もしくは眼の周囲に注入された後の、ATRIGEL(登録商標)送達システムの許容性を決定するために一連の動物実験が行われた。これらの検査ではウサギにいくつかのATRIGEL(登録商標)溶液のうちの一つを注射した。注射は直接眼の中に(硝子体内注射)、結膜の下に(結膜下注射)、もしくは、眼球の後ろの筋肉と神経を覆っている膜を通して(テノン嚢下注射(subtenon injection))行われた。ウサギは、局所反応と視覚の喪失もしくは障害について28日間にわたって定期的に観察された。さらに、障害を指摘するために、眼の液の分析がされた。
【0273】
いかなる物質を眼の中に注入したときでも予測されるとおり、全てのATRIGEL(登録商標)溶液についてわずかな潮紅(redness)が確認された。しかし、この潮紅(redness)は72時間以内に消えた。眼圧は検査中を通して変化が無かった。さらに重要なのは、視覚の障害が起こらなかったことである。顕微鏡下で眼の液の評価をした結果、白血球数(WBCs)は検査中を通して正常数であった。WBSが正常値であったことは、眼の怪我、感染、および/または炎症が無いことを示す。さらに、化学的分析から、体液中に溶解している物質の量は正常であることが示された。いずれの検査期間中にも、炎症の痕跡や感染物質の発生はいずれの処置された眼についても見られなかった。
【0274】
これらの結果はATRIGEL(登録商標)送達システムが、許容性が高く、眼の中もしくは眼の周囲に注入した後、生物学的に不活性なであることを示している。実際、ATRIGEL(登録商標)製剤は、ある種の薬剤の毒性を弱める。例えば、追加の検査によって、ATRIGEL(登録商標)送達システムと眼部刺激性の化合物を混合して調製した処方を、同じ物質を水に溶解したものと比較した。直接観察で、刺激物質を水に溶解したものは、顕著な腫脹、重篤な潮紅、および、眼からの水様の分泌物が見られた。さらに、目の前半分を覆っている部分(角膜)が透明であったものが白濁した。この角膜の変化によって、部分的もしくは完全に失明した。しかしながら、ATRIGEL(登録商標)送達システムを含んだ刺激物質では、軽度から中程度の腫脹、中程度の潮紅しか見られず、眼を覆っている部分は透明のままであった。この刺激の軽減は、水溶液中の高い濃度の刺激物質に眼が直ちに曝されるのと比較して、ATRIGEL(登録商標)送達システムがゆっくりと長い時間をかけて眼の中に刺激物質を放出することによる。このゆっくりとした放出が刺激物質の毒性を軽減し、回復不能な損傷の可能性を軽減する。
【0275】
結果として、PEG300、mPEG350、およびNMPを含むATRIGEL(登録商標)処方は硝子体内もしくは結膜下の挿入物のための許容されうる媒体である。
【0276】
本明細書で引用した全ての出版物、特許、および出願書類は、個々に参照されて本明細書に含まれるかのように、参照することによって本明細書中に含まれる。本発明は様々な具体的な、好ましい実施例および技術に関して記載している。しかしながら、様々な変形物、修飾物が本発明の範囲から逸脱することなく作られることが理解されるべきである。
【0277】
明確にするために別々の実施例の状況として記載されている、本発明のある特徴は、一つの実施例の中で組み合わせとして見られることがある。様々な本発明の特徴は簡潔にするために一つの実施例の状況として記載されているが、これらの特徴が別々にもしくはサブコンビネーションとして提供されることもある。
【図面の簡単な説明】
【0278】
本発明の実施例は以下の説明および、そのような実施例を説明している添付の図を参照することによってよく理解することができる。図の番号計画(numbering scheme)は、参照番号として与えられている先頭の数字を図の番号と関係させている。参照番号は要素に対しての参照番号と同じで、異なった図であっても同じである。例えば、眼部および涙道(110)などの眼の表面は図1に存在する。しかしながら、参照番号は要素に対して同じであり、異なった図であっても同じである。図には以下のものが含まれる。
【図1】眼部および本発明に有用な眼の表面の説明。
【図2】眼部および本発明に有用な眼の表面の説明。
【図3】眼部および本発明に有用な眼の表面の説明。
【図4】粘膜部分および本発明に有用な粘膜の表面の説明。
【特許請求の範囲】
【請求項1】
コントロールリリース挿入物に用いるのに適した流動性のある組成物で、前記組成物が
(a) 少なくとも実質的に水媒体、水、もしくは体液に溶解しない生分解性の、生体適合性がある、熱可塑性のポリマー、
(b) 生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグ、ならびに、
(c) 標準温度および圧力で熱可塑性ポリマーが可溶な、生体適合性のある有機液体
を含み、眼部送達に適していることを特徴とする、組成物。
【請求項2】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、線状ポリマーであることを特徴とする、請求項1記載の組成物。
【請求項3】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、分岐ポリマーであることを特徴とする、請求項1記載の組成物。
【請求項4】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、ラクチド類、グリコリド類、カプロラクトン類、グリセリド類、無水物類、アミド類、ウレタン類、エステルアミド類、オルトエステル類、ジオキサノン類、アセタール類、ケタール類、カーボネート類、ホスファゼン類、ヒドロキシ酪酸類、ヒドロキシ吉草酸類、アルキレンシュウ酸類、アルキレンコハク酸類、アミノ酸類、および、それらの任意の結合物、のグループから選択された単量体単位を含む構造を有し、前記構造は前記単量体単位を無秩序にもしくはブロック単位で含むことを特徴とする、請求項1記載の組成物。
【請求項5】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、ラクチド単量体単位、カプロラクトン単量体単位、グリコリド単量体単位、もしくはそれらの任意の結合物のポリマーもしくはコポリマーであることを特徴とする、請求項1記載の組成物。
【請求項6】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、ポリラクチド類、ポリグリコリド類、ポリカプロラクトン類、ポリジオキサノン類、ポリカーボネート類、ポリヒドロキシ酪酸類、ポリアルキレンシュウ酸類、ポリ無水物類、ポリアミド類、ポリエステルアミド類、ポリウレタン類、ポリアセタール類、ポリケタール類、ポリオルトカーボネート類、ポリホスファゼン類、ポリヒドロキシ吉草酸類、ポリアルキレンコハク酸類、ポリ(リンゴ酸)、ポリ(アミノ酸類)、キチン、キトサン、ポリオルトエステル類、ポリ(メチルビニルエーテル)、ポリエステル類、ポリアルキルグリコール類、それらのコポリマー類、それらのブロックコポリマー類、それらのターポリマー類、それらの結合物、およびそれらの混合物のグループから選択されたポリマーを含むことを特徴とする、請求項1記載の組成物。
【請求項7】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、少なくとも一つのポリエステルを含むことを特徴とする、請求項1記載の組成物。
【請求項8】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、ポリラクチド、ポリグリコリド、ポリカプロラクトン、それらのコポリマー、それらのターポリマー、それらの結合物の少なくとも一つであることを特徴とする、請求項1記載の組成物。
【請求項9】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、ポリ(DL-ラクチド-co-グリコリド) であることを特徴とする、請求項1記載の組成物。
【請求項10】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、末端にカルボキシ基を有するポリ(DL-ラクチド-co-グリコリド) であることを特徴とする、請求項1記載の組成物。
【請求項11】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、末端にカルボキシ基を有さないポリ(DL-ラクチド-co-グリコリド) であることを特徴とする、請求項1記載の組成物。
【請求項12】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、末端にカルボキシ基を有する、50/50のポリ(DL-ラクチド-co-グリコリド) であることを特徴とする、請求項1記載の組成物。
【請求項13】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、末端にカルボキシ基を有さない、75/25のポリ(DL-ラクチド-co-グリコリド) であることを特徴とする、請求項1記載の組成物。
【請求項14】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、最高で前記組成物の約80wt.%まで存在することを特徴とする、請求項1記載の組成物。
【請求項15】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、前記組成物の約10wt.%以上存在することを特徴とする、請求項1記載の組成物。
【請求項16】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、前記組成物の約10wt.%から約80wt.%まで存在することを特徴とする、請求項1記載の組成物。
【請求項17】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、前記組成物の約30wt.%から約50wt.%まで存在することを特徴とする、請求項1記載の組成物。
【請求項18】
前記生分解性の、生体適合性がある、熱可塑性のポリマーの平均分子量が約15,000以上であることを特徴とする、請求項1記載の組成物。
【請求項19】
前記生分解性の、生体適合性がある、熱可塑性のポリマーの平均分子量が最高で約45,000までであることを特徴とする、請求項1記載の組成物。
【請求項20】
前記生分解性の、生体適合性がある、熱可塑性のポリマーの平均分子量が約15,000以上から約45,000までであることを特徴とする、請求項1記載の組成物。
【請求項21】
前記生体適合性のある有機液体の水への溶解度が、いかなる比率でも完全に不溶から、全ての比率において完全に可溶まで変動することを特徴とする、請求項1記載の組成物。
【請求項22】
前記生体適合性のある有機液体が、水には完全に不溶であるが体液中には拡散することを特徴とする、請求項1記載の組成物。
【請求項23】
前記生体適合性のある有機液体が、少なくとも部分的に水溶性であることを特徴とする、請求項1記載の組成物。
【請求項24】
前記生体適合性のある有機液体が、完全に水溶性であることを特徴とする、請求項1記載の組成物。
【請求項25】
前記生体適合性のある有機液体が、極性プロトン性の液体であることを特徴とする、請求項1記載の組成物。
【請求項26】
前記生体適合性のある有機液体が、極性非プロトン性の液体であることを特徴とする、請求項1記載の組成物。
【請求項27】
前記生体適合性のある有機液体が、外界温度および生理学的温度において液体であり、アルコール類、ケトン類、エーテル類、アミド類、アミン類、アルキルアミン類、エステル類、カーボネート類、スルホキシド類、スルホン類、およびスルホン酸塩類の群から選択された官能基を少なくとも一つ含む、環状有機化合物、脂肪族有機化合物、直鎖脂肪族有機化合物、分枝脂肪族有機化合物または芳香族有機化合物であることを特徴とする、請求項1記載の組成物。
【請求項28】
前記生体適合性のある有機液体が、置換複素環化合物、炭酸とアルキルアルコール類のエステル類、モノカルボン酸類のアルキルエステル類、モノカルボン酸類のアリールエステル類、モノカルボン酸類のアラルキルエステル類、ジカルボン酸類のアルキルエステル類、ジカルボン酸類のアリールエステル類、ジカルボン酸類のアラルキルエステル類、トリカルボン酸類のアルキルエステル類、トリカルボン酸類のアリールエステル類、トリカルボン酸類のアラルキルエステル類、アルキルケトン類、アリールケトン類、アラルキルケトン類、アルコール類、ポリアルコール類、アルキルアミド類、ジアルキルアミド類、アルキルスルホキシド類、ジアルキルスルホキシド類、アルキルスルホン類、ジアルキルスルホン類、ラクトン類、環状アルキルアミド類、環状アルキルアミン類、芳香族アミド類、芳香族アミン類、それらの混合物、およびそれらの結合物、の群から選択されたことを特徴とする、請求項1記載の組成物。
【請求項29】
前記生体適合性のある有機液体が、N-メチル-2-ピロリドン、2-ピロリドン、(C2-C8)脂肪族アルコール、グリセリン、テトラグリコール、グリセロールフォーマル、2,2-ジメチル-1,3-ジオキソロン-4-メタノール、酢酸エチル、乳酸エチル、酪酸エチル、マロン酸ジブチル、クエン酸トリブチル、アセチルクエン酸トリ-n-ヘキシルエステル、コハク酸ジエチル、グルタル酸ジエチル、マロン酸ジエチル、クエン酸トリエチル、トリアセチン、トリブチリン、炭酸ジエチル、プロピレンカーボネート、アセトン、メチルエチルケトン、ジメチルアセトアミド、ジメチルホルムアミド、カプロラクタム、ジメチルスルホキシド、ジメチルスルホン、テトラヒドロフラン、カプロラクタム、N,N-ジエチル-m-トルアミド、1-ドデシルアザシクロヘプタン-2-オン、1,3-ジメチル-3,4,5,6-テトラヒドロ-2-(1H)-ピリミジノン、安息香酸ベンジル、および、それらの結合物、の群から選択されたことを特徴とする、請求項1記載の組成物。
【請求項30】
前記生体適合性のある有機液体が、約30から約500の範囲の分子量を有することを特徴とする、請求項1記載の組成物。
【請求項31】
前記生体適合性のある有機液体が、N-メチル-2-ピロリドン、2-ピロリドン、N,N-ジメチルホルムアミド、ジメチルスルホキシド、プロピレンカーボネート、カプロラクタム、トリアセチン、および、それらの任意の結合物であることを特徴とする、請求項1記載の組成物。
【請求項32】
前記生体適合性のある有機液体が、N-メチル-2-ピロリドンであることを特徴とする、請求項1記載の組成物。
【請求項33】
前記生体適合性の液体が、前記組成物の約40wt.%以上存在することを特徴とする、請求項1記載の組成物。
【請求項34】
前記生体適合性の液体が、最高で前記組成物の約80wt.%まで存在することを特徴とする、請求項1記載の組成物。
【請求項35】
前記生体適合性の液体が、前記組成物の約50wt.%から約70wt.%まで存在することを特徴とする、請求項1記載の組成物。
【請求項36】
前記生体適合性の液体が、水媒体、水、もしくは体液中に分散可能であることを特徴とする、請求項1記載の組成物。
【請求項37】
前記生物学的薬剤が、アドレナリン系薬物、副腎皮質ステロイド、副腎皮質抑制剤、アルコール妨害物質、アルドステロンアンタゴニスト、アミノ酸、アンモニア解毒剤、アナボリック、興奮薬、鎮痛薬、アンドロゲン、麻酔の付属物(anesthesia, adjunt to)、麻酔剤、食欲抑制剤、アンタゴニスト、下垂体前葉抑制剤、虫下し、ざ瘡治療剤、抗アドレナリン薬、抗アレルギー薬、抗アメーバ薬、抗アンドロゲン薬、補血薬、狭心症治療薬、恐怖症治療薬、関節炎治療薬、喘息治療薬、アテローム硬化治療薬、抗菌剤、胆石の溶解剤、胆石の抗凝固剤、抗コリン剤、抗凝固剤、抗コクシジウム薬、抗けいれん薬、抗うつ薬、糖尿病薬、止痢薬、抗利尿薬、解毒剤、鎮吐薬、抗てんかん薬、抗エストロゲン薬、抗線維溶解薬(antifibronolytic)、抗真菌薬、緑内障治療薬、抗血友病薬、抗出血性薬(antihermorrhagic)、抗ヒスタミン薬、抗高脂血症薬、抗高リポタンパク血症薬、血圧降下剤、抗低血圧薬、抗感染薬、局所的な抗感染薬、抗炎症薬、抗角化薬、抗マラリア薬、抗菌薬、抗片頭痛薬、抗真菌薬、制吐薬、抗腫瘍薬、抗好中球減少症薬、抗肥満薬、駆虫薬、パーキンソン病治療薬、ぜん動抑制薬、抗ニューモシスチス薬、抗増殖薬、前立腺肥大症治療薬、抗原虫薬、止痒薬、抗精神病薬、抗リウマチ薬、抗住血吸虫薬、抗脂漏性薬、抗分泌薬、鎮痙薬、抗血栓薬、鎮咳薬、抗潰瘍薬、抗尿石薬、抗ウイルス薬、食欲減退薬、良性前立腺増殖症治療薬、血糖調整剤、骨吸収阻害剤、気管支拡張剤、炭酸脱水酵素阻害薬、心機能抑制薬、心保護剤、強心薬、心臓脈管薬、利胆薬、コリン作動薬、コリン作動性診断補助薬、利尿薬、ドパミン作用薬、外部寄生虫駆除剤、催吐剤、酵素阻害剤(enxzyme inhibitor)、エストロゲン、フィブリノーゲン分解薬、蛍光剤、フリー酸素ラジカルスカベンジャー、胃運動性作動因子、グルココルチコイド、性腺刺激原理、養毛刺激剤、止血薬、ヒスタミンH2受動態アンタゴニスト、ホルモン、低コレステロール血症、血糖降下薬、脂質低下薬、降圧剤、イメージング剤、免疫化剤、免疫調整薬、免疫制御薬、免疫賦活薬、免疫抑制薬、陰萎治療薬、阻害剤、角質溶解剤、LNRNアゴニスト、肝臓障害処置薬、ルテロリジン、記憶補助剤、精神能力賦活剤、気分調整剤、粘液溶解物質、粘膜保護剤、散瞳薬、鼻充血抑制薬、神経筋遮断薬、神経保護剤、NMDAアンタゴニスト、非ホルモン性ステロール誘導体、子宮収縮薬、プラスミノーゲン活性化因子、血小板活性化因子アンタゴニスト、血小板凝集阻害薬、脳卒中後の処置薬および頭部外傷後の処置薬、増強剤、プロゲスチン、プロスタグランジン、前立腺増殖阻害剤、プロサイロトロピン、向精神薬、放射性医薬品、調整剤、弛緩薬、再分配剤、抗疥癬薬、硬化薬、鎮静薬、催眠鎮静薬、選択的アデノシンA1アンタゴニスト、セロトニンアンタゴニスト、セロトニン阻害剤、セロトニン受容体アンタゴニスト、ステロイド、刺激薬、抑制薬、症候性多発性硬化症、協力剤、甲状腺ホルモン、甲状腺ホルモン阻害剤、甲状腺ホルモン様の薬剤、精神安定剤、筋萎縮性側索硬化症の処置薬、脳虚血の処置薬、パジェット病の処置薬、不安定狭心症の処置薬、尿酸排泄薬、血管収縮薬、血管拡張薬、傷薬、創傷治癒薬、キサンチンオキシダーゼ阻害剤(zxanthine oxidase inhibitor)、および、それらの配合物の群から独立に選択されたことを特徴とする、請求項1記載の組成物。
【請求項38】
前記生物学的薬剤が、アセブトロール、アセブトロール、アシクロビル、アルブテロール、アルフェンタニル、アルモトリプタン、アルプラゾラム、アミオダロン、アンレキサノクス、アムホテリシンB、アトルバスタチン、アトロピン、オーラノフィン、オーロチオグルコース、ベナゼプリル、ビカルタミド、ブレチリウム、ブリフェンタニル、ブロモクリプチン、ブプレノルフィン、ブトルファノール、ブスピロン、カルシトニン、カンデサルタン、カーフェンタニル、カルベジロール、クロルフェニラミン、クロロチアジド、クロルフェンテルミン、クロルプロマジン、クリンダマイシン、クロニジン、コデイン、シクロスポリン、デシプラミン、デスモプレシン、デキサメタゾン、ジアゼパム、ジクロフェナク、ジゴキシン、ジヒドロコデイン(Digydrocodeine)、ドラセトロン、ドパミン、ドキセピン、ドキシサイクリン、ドロナビノール、ドロペリドール、ジクロニン、エレトリプタン、エナラプリル、エノキサパリン、エフェドリン、エピネフリン、エルゴタミン、エトミデート、ファモチジン、フェロジピン、フェンタニル、フェキソフェナジン、フルコナゾール、フルオキセチン、フルフェナジン、フルルビプロフェン、フルバスタチン、フルボキサミン、フロバトリプタン、フロセミド、ガンシクロビル、金チオリンゴ酸ナトリウム、グラニセトロン、グリセオフルビン、ハロペリドール、B型肝炎ウイルスワクチン、ヒドララジン、ヒドロモルフォン、インスリン、イプラトロピウム、イスラジピン、二硝酸イソソルビド、ケタミン、ケトロラック、ラベタロール、レボルファノール、リシノプリル、ロラタジン、ロラゼパム、ロサルタン、ロバスタチン、メラトニン、メチルドパ、メチルフェニデート、メトプロロール、ミダゾラム、ミルタザピン、モルヒネ、ナドロール、ナルプフィン、ナロキソン、ナルトレキソン、ナラトリプタン、ネオスチグミン、ニカルジピン、ニフェジピン、ノルエピネフリン、ノルトリプチリン、オクトレオチド、オランザピン、オメプラゾール、オンダンセトロン、オキシブチニン、オキシコドン、オキシモルフォン、オキシトシン、フェニレフリン、フェニルプロパノールアミン、フェニトイン、ピモジド、ピオグリタゾン、ピロキシカム、プラバスタチン、プラゾシン、プロクロルペラジン、プロパフェノン、プロクロルペラジン、プロピオマジン、プロポフォール、プロプラノール、プソイドエフェドリン、ピリドスチグミン、クエチアピン、ラロキシフェン、レミフェンタニル、ロフェコキシブ、レパグリニド、リスペリドン、リザトリプタン、ロピニロール、スコポラミン、セレギリン、セルトラリン、シルデナフィル、シンバスタチン、シロリムス、スピノラクトン、スフェンタニル、スマトリプタン、タクロリムス、タモキシフェン、テルビナフィン、テルブタリン、テストステロン、破傷風トキソイド、THCトルテロジン、トリアムテレン、トリアゾラム、トリセタミド、バルサルタン、ベンラファキシン、ベラパミル、ザレプロン、ザミナビル、ザフィルルカスト、ゾルミトリプタン、ゾルピデム、および、それらの配合物の群から独立に選択されたことを特徴とする、請求項1記載の組成物。
【請求項39】
前記細胞周期生物学的薬剤(cell-cycle biological agent)、前記スケジュール依存性生物学的薬剤(schedule- dependant biological agent)、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグが、前記組成物の約0.00001wt.%以上存在することを特徴とする、請求項1記載の組成物。
【請求項40】
前記細胞周期生物学的薬剤、前記スケジュール依存性生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグが、最高で前記組成物の約20wt.%まで存在することを特徴とする、請求項1記載の組成物。
【請求項41】
前記細胞周期生物学的薬剤、前記スケジュール依存性生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグが、前記組成物の約0.00001wt.%から約10wt.%まで存在することを特徴とする、請求項1記載の組成物。
【請求項42】
前記流動性組成物中に存在する、前記細胞周期生物学的薬剤、前記スケジュール依存性生物学的薬剤、それらの代謝産物、もしくはそれらのプロドラッグのヒトの最大許容投与量(MTD)が、溶液中に存在する、前記細胞周期生物学的薬剤、前記スケジュール依存性生物学的薬剤、それらの代謝産物、もしくはそれらのプロドラッグのヒトの最大許容投与量(MTD)よりも小さいことを特徴とする、請求項1記載の組成物。
【請求項43】
前記流動性組成物中に存在する、前記細胞周期生物学的薬剤、前記スケジュール依存性生物学的薬剤、それらの代謝産物、もしくはそれらのプロドラッグのヒトの最大許容投与量(MTD)が、溶液中に存在する、前記細胞周期生物学的薬剤、前記スケジュール依存性生物学的薬剤、それらの代謝産物、もしくはそれらのプロドラッグのヒトの最大許容投与量(MTD)よりも少なくとも50%小さいことを特徴とする、請求項1記載の組成物。
【請求項44】
生体内で挿入物の基盤から生物学的薬剤を放出する速度を調整するための放出速度修正剤、
孔形成剤、
生分解性の結晶化コントロール薬剤、
可塑剤、
浸出剤、
浸透促進剤、
吸収変化剤、
不透明化剤、および
着色料、
のうちの少なくとも1つをさらに含むことを特徴とする、請求項1記載の組成物。
【請求項45】
前記放出速度修正剤がモノカルボン酸のエステル、ジカルボン酸のエステル、トリカルボン酸のエステル、ポリヒドロキシルアルコール、脂肪酸、グリセリンのトリエステル、ステロール、アルコール、および、それらの任意の配合物の群から選択されることを特徴とする、請求項44記載の組成物。
【請求項46】
前記放出速度修正剤が、酢酸2-エトキシエチル、酢酸メチル、酢酸エチル、フタル酸ジエチル、フタル酸ジメチル、フタル酸ジブチル、アジピン酸ジメチル、コハク酸ジメチル、シュウ酸ジメチル、クエン酸ジメチル、クエン酸トリエチル、クエン酸アセチルトリブチルエステル、クエン酸アセチルトリエチルエステル、三酢酸グリセリン、セバシン酸ジ(n-ブチル)(di(n-butyl) sebecate)、プロピレングリコール、ポリエチレングリコール、グリセリン、ソルビトール、トリグリセリド、エポキシ化大豆油、コレステロール、(C6-C12)アルカノール、2-エトキシエタノール、および、それらの任意の配合物の群から選択されることを特徴とする、請求項44記載の組成物。
【請求項47】
前記孔形成剤が、糖、塩、水溶性ポリマー、もしくは水溶性有機液体であることを特徴とする、請求項44記載の組成物。
【請求項48】
前記生分解性の結晶化コントロール薬剤が、炭酸カルシウム、ヒドロキシアパタイト、リン酸カルシウム、カルシウムアパタイト、硫酸カルシウム、炭酸水素カルシウム、塩化カルシウム、炭酸ナトリウム、炭酸水素ナトリウム、塩化ナトリウム、ステアリン酸カルシウム、パルミチン酸カルシウム、ステアリン酸ナトリウム、デキストラン、デンプン、カルボキシメチルセルロースナトリウム、カルボキシメチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、架橋したカルボキシメチルセルロースナトリウム、ポリ(ビニルアルコール)、パルミチン酸グリセリン、ステアリン酸グリセリン、クエン酸トリエチル、乳酸エチル、ポリ(エチレングリコール)、ポリ(ビニルピロリドン)、ポリ(ラクチド-co-カプロラクトン)、および、それらの任意の配合物の群から選択されることを特徴とする、請求項44記載の組成物。
【請求項49】
前記修正剤が安息香酸ベンジル、フタル酸エステル類、フタル酸ベンジル類、安息香酸グリコール、トリメリト酸エステル類(trimellitates)、アジピン酸エステル類(adipates)、アゼライン酸エステル類(azelates)、セバシン酸エステル類(sebacates)、脂肪族ならびに芳香族のジカルボン酸類およびトリカルボン酸類のエステル類、有機リン酸エステル類(organic phosphates)、ゴマ油、大豆油、綿実油、アーモンド油、ヒマワリ油、ピーナッツ油、および、それらの任意の配合物の群から選択されることを特徴とする、請求項44記載の組成物。
【請求項50】
前記吸収変化剤がプロピレングリコール、グリセリン、尿素、ジエチルセバシン酸ナトリウム、ラウリル硫酸、ラウリル硫酸ナトリウム、ソルビタンエトキシレート類、オレイン酸、ピロリドンのカルボン酸エステル、N-メチルピロリドン、N,N-ジメチル-m-トルマイド(N,N-diethyl-m-tolumide)、ジメチルスルホキシド、アルキルメチルスルホキシド、および、それらの任意の配合物の群から選択されることを特徴とする、請求項44記載の組成物。
【請求項51】
前記速度修正剤が水に不溶の有機物質であることを特徴とする、請求項44記載の組成物。
【請求項52】
前記の水に不溶の有機物質がモノカルボン酸、ジカルボン酸、もしくはトリカルボン酸のエステルであることを特徴とする、請求項51記載の組成物。
【請求項53】
前記不透明化剤がバリウム、ヨウ素、もしくはカルシウムを含むことを特徴とする、請求項44記載の組成物。
【請求項54】
生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグが、粒子に組み込まれているか、もしくは、コントロールリリース成分に含められていることを特徴とする、請求項1記載の組成物。
【請求項55】
前記コントロールリリース成分粒子が、キャリアー分子と共有結合している、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグの共役物(conjugate)を含むことを特徴とする、請求項54記載の組成物。
【請求項56】
前記コントロールリリース成分粒子が、マイクロカプセル、ナノ微粒子(nanoparticle)、シクロデキストリン、リポソーム、および、ミセルの群から選択された微細構造であることを特徴とする、請求項54記載の組成物。
【請求項57】
前記コントロールリリース成分粒子が、約500ミクロン以下の微細構造であることを特徴とする、請求項54記載の組成物。
【請求項58】
前記コントロールリリース成分粒子が、繊維、フィルム、棒、平円盤、および、柱体の群から選択された微細構造であることを特徴とする、請求項54記載の組成物。
【請求項59】
前記コントロールリリース成分粒子が、少なくとも約500ミクロンの微細構造であることを特徴とする、請求項54記載の組成物。
【請求項60】
微孔性の固体の基盤を構成することができる請求項1記載の組成物であって、
前記基盤は被膜で囲まれた芯であり、
前記芯には直径が約1ミクロンから約1000ミクロンの穴が含まれていることを特徴とする組成物。
【請求項61】
前記被膜が前記芯の孔の直径よりも小さな直径の孔を含んでいるために、前記被膜は前記芯と比較して機能的に多孔性でないことを特徴とする、請求項60記載の組成物。
【請求項62】
体積が約0.001mL以上であることを特徴とする、請求項1記載の組成物。
【請求項63】
体積が約20.0mLまでであることを特徴とする、請求項1記載の組成物。
【請求項64】
体積が約0.01mLから約10.0mLであることを特徴とする、請求項1記載の組成物。
【請求項65】
およそ一週間に一回以下程度の投与のために処方されることを特徴とする、請求項1記載の組成物。
【請求項66】
およそ一年に一回以上程度の投与のために処方されることを特徴とする、請求項1記載の組成物。
【請求項67】
およそ一週間に一回から、一年に一回程度の投与のために処方されることを特徴とする、請求項1記載の組成物。
【請求項68】
生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを、約1ピコグラム/キログラム/日から約1ミリグラム/キログラム/日の投薬量を哺乳類の組織に送達することを特徴とする、請求項1記載の組成物。
【請求項69】
前記送達が全身送達であることを特徴とする、請求項68記載の組成物。
【請求項70】
前記送達が局所的送達であることを特徴とする、請求項68記載の組成物。
【請求項71】
前記投薬量が最長で約1年までの期間にわたって局所的に送達されることを特徴とする、請求項68記載の組成物。
【請求項72】
前記投薬量が最長で約1箇月までの期間にわたって局所的に送達されることを特徴とする、請求項68記載の組成物。
【請求項73】
前記投薬量が最長で約1週間までの期間にわたって局所的に送達されることを特徴とする、請求項68記載の組成物。
【請求項74】
前記投薬量が約1日以上の期間にわたって局所的に送達されることを特徴とする、請求項68記載の組成物。
【請求項75】
第二の生物学的薬剤をさらに含むことを特徴とする、請求項1記載の組成物。
【請求項76】
哺乳類の疾患もしくは異常を処置する方法であって、
前記方法がそのような処置を必要とする哺乳類の眼部に、有効量の請求項1から75までのいずれかに記載の流動性組成物を投与するステップ、
を含むことを特徴とする方法。
【請求項77】
前記哺乳類がヒトであることを特徴とする、請求項76記載の方法。
【請求項78】
前記流動性組成物が前記哺乳類の眼部の複数の場所に投与されることを特徴とする、請求項76記載の方法。
【請求項79】
哺乳類の眼部から生物学的薬剤を局所的に送達するための方法であって、
請求項1から75までのいずれかに記載の流動性組成物を哺乳類の眼部に接触させるステップを含む方法。
【請求項80】
哺乳類の眼部から生物学的薬剤を全身に送達するための方法であって、
請求項1から75までのいずれかに記載の流動性組成物を哺乳類の眼部に接触させるステップを含む方法。
【請求項81】
(a) 少なくとも実質的に水媒体、水、もしくは体液に溶解しない生分解性の、生体適合性がある、熱可塑性のポリマー、
(b) 生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグ、ならびに、
(c) 標準温度および圧力で熱可塑性ポリマーが可溶な、生体適合性のある有機液体
を含むことを特徴とする、挿入物であって、
ここで、前記挿入物は哺乳類の眼部に位置し、前記挿入物が固体もしくはゼラチン状の微孔性の基盤を有し、前記基盤は被膜で囲まれた芯であり、前記挿入物が体の組織に囲まれていることを特徴とする挿入物。
【請求項82】
十分に凝固していることを特徴とする、請求項81記載の挿入物。
【請求項83】
固められていることを特徴とする、請求項81記載の挿入物。
【請求項84】
生体適合性のある有機液体の量が時間の経過と共に減少することを特徴とする、請求項81記載の挿入物。
【請求項85】
前記芯に直径が約1ミクロンから約1000ミクロンの穴が含まれていることを特徴とする、請求項81記載の挿入物。
【請求項86】
前記被膜が前記芯の孔の直径よりも小さな直径の孔を含んでいることを特徴とする、請求項81記載の挿入物。
【請求項87】
前記被膜の孔が、前記被膜が前記芯と比較して機能的に多孔性でないような大きさであることを特徴とする、請求項81記載の挿入物。
【請求項88】
(a) 少なくとも実質的に水媒体、水、もしくは体液に溶解しない生分解性の、生体適合性がある、熱可塑性のポリマー、ならびに、
(b) 生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグ、
を含むことを特徴とし、
ここで、前記挿入物は哺乳類の眼部に位置し、前記挿入物が固体もしくはゼラチン状の微孔性の基盤を有し、前記基盤は被膜で囲まれた芯であり、前記挿入物が体の組織に囲まれている挿入物。
【請求項89】
前記芯に直径が約1ミクロンから約1000ミクロンの穴が含まれていることを特徴とする、請求項88記載の挿入物。
【請求項90】
前記被膜が前記芯の孔の直径よりも小さな直径の孔を含んでいることを特徴とする、請求項88記載の挿入物。
【請求項91】
前記被膜の孔が、前記被膜が前記芯と比較して機能的に多孔性でないような大きさであることを特徴とする、請求項88記載の挿入物。
【請求項92】
生体内の眼部の原位置で挿入物を構成する方法であって、
(a) 受療者の眼部に流動性組成物を注入するステップ(ここで、前記流動性組成物は請求項1から75のいずれかに記載された組成物)、および
(b) 生体適合性のある有機液体を固体の生分解性の挿入物を構成するために拡散させるステップ、
を含むことを特徴とする方法。
【請求項93】
眼部での生体内原位置で生分解性の挿入物を構成するのに適した生物学的薬剤キットであって、
(a) 第一の容器は、眼部送達に適した流動性組成物を含み、
ここで、前記組成物は
(i) 少なくとも実質的に水媒体、水、もしくは体液に溶解しない生分解性の、生体適合性がある、熱可塑性のポリマー、ならびに、
(ii) 標準温度および圧力で熱可塑性ポリマーが可溶な、生体適合性のある有機液体
を含み、
(b) 第二の容器は、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを含む
ことを特徴とするキット。
【請求項94】
前記第一の容器が注射器であることを特徴とする、請求項93記載のキット。
【請求項95】
前記第二の容器が注射器であることを特徴とする、請求項93記載のキット。
【請求項96】
前記第一の容器が注射器であり、前記第二の容器が注射器であり、両方の注射器が直接互いに結合されたものを形作っていることを特徴とする、請求項93記載のキット。
【請求項97】
さらに説明書を含むことを特徴とする、請求項93記載のキット。
【請求項98】
哺乳類の眼部に関する疾患もしくは異常を処置する方法であって、
前記方法がそのような処置を必要とする哺乳類の眼部に、有効量の請求項1から75までのいずれかに記載の流動性組成物を投与するステップ、
を含むことを特徴とする方法。
【請求項99】
前記眼部に関する疾患もしくは異常が黄斑変性症であることを特徴とする、請求項98記載の方法。
【請求項100】
前記眼部に関する疾患もしくは異常が癌であることを特徴とする、請求項98記載の方法。
【請求項101】
哺乳類の眼部に関する疾患もしくは異常を処置するための薬物を製造するための、請求項1から75までのいずれかに記載の流動性組成物の使用。
【請求項102】
前記眼部に関する疾患もしくは異常が黄斑変性症であることを特徴とする請求項101に記載の流動性組成物の使用。
【請求項103】
前記眼部に関する疾患もしくは異常が癌であることを特徴とする、請求項101に記載の流動性組成物の使用。
【請求項1】
コントロールリリース挿入物に用いるのに適した流動性のある組成物で、前記組成物が
(a) 少なくとも実質的に水媒体、水、もしくは体液に溶解しない生分解性の、生体適合性がある、熱可塑性のポリマー、
(b) 生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグ、ならびに、
(c) 標準温度および圧力で熱可塑性ポリマーが可溶な、生体適合性のある有機液体
を含み、眼部送達に適していることを特徴とする、組成物。
【請求項2】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、線状ポリマーであることを特徴とする、請求項1記載の組成物。
【請求項3】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、分岐ポリマーであることを特徴とする、請求項1記載の組成物。
【請求項4】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、ラクチド類、グリコリド類、カプロラクトン類、グリセリド類、無水物類、アミド類、ウレタン類、エステルアミド類、オルトエステル類、ジオキサノン類、アセタール類、ケタール類、カーボネート類、ホスファゼン類、ヒドロキシ酪酸類、ヒドロキシ吉草酸類、アルキレンシュウ酸類、アルキレンコハク酸類、アミノ酸類、および、それらの任意の結合物、のグループから選択された単量体単位を含む構造を有し、前記構造は前記単量体単位を無秩序にもしくはブロック単位で含むことを特徴とする、請求項1記載の組成物。
【請求項5】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、ラクチド単量体単位、カプロラクトン単量体単位、グリコリド単量体単位、もしくはそれらの任意の結合物のポリマーもしくはコポリマーであることを特徴とする、請求項1記載の組成物。
【請求項6】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、ポリラクチド類、ポリグリコリド類、ポリカプロラクトン類、ポリジオキサノン類、ポリカーボネート類、ポリヒドロキシ酪酸類、ポリアルキレンシュウ酸類、ポリ無水物類、ポリアミド類、ポリエステルアミド類、ポリウレタン類、ポリアセタール類、ポリケタール類、ポリオルトカーボネート類、ポリホスファゼン類、ポリヒドロキシ吉草酸類、ポリアルキレンコハク酸類、ポリ(リンゴ酸)、ポリ(アミノ酸類)、キチン、キトサン、ポリオルトエステル類、ポリ(メチルビニルエーテル)、ポリエステル類、ポリアルキルグリコール類、それらのコポリマー類、それらのブロックコポリマー類、それらのターポリマー類、それらの結合物、およびそれらの混合物のグループから選択されたポリマーを含むことを特徴とする、請求項1記載の組成物。
【請求項7】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、少なくとも一つのポリエステルを含むことを特徴とする、請求項1記載の組成物。
【請求項8】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、ポリラクチド、ポリグリコリド、ポリカプロラクトン、それらのコポリマー、それらのターポリマー、それらの結合物の少なくとも一つであることを特徴とする、請求項1記載の組成物。
【請求項9】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、ポリ(DL-ラクチド-co-グリコリド) であることを特徴とする、請求項1記載の組成物。
【請求項10】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、末端にカルボキシ基を有するポリ(DL-ラクチド-co-グリコリド) であることを特徴とする、請求項1記載の組成物。
【請求項11】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、末端にカルボキシ基を有さないポリ(DL-ラクチド-co-グリコリド) であることを特徴とする、請求項1記載の組成物。
【請求項12】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、末端にカルボキシ基を有する、50/50のポリ(DL-ラクチド-co-グリコリド) であることを特徴とする、請求項1記載の組成物。
【請求項13】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、末端にカルボキシ基を有さない、75/25のポリ(DL-ラクチド-co-グリコリド) であることを特徴とする、請求項1記載の組成物。
【請求項14】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、最高で前記組成物の約80wt.%まで存在することを特徴とする、請求項1記載の組成物。
【請求項15】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、前記組成物の約10wt.%以上存在することを特徴とする、請求項1記載の組成物。
【請求項16】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、前記組成物の約10wt.%から約80wt.%まで存在することを特徴とする、請求項1記載の組成物。
【請求項17】
前記生分解性の、生体適合性がある、熱可塑性のポリマーが、前記組成物の約30wt.%から約50wt.%まで存在することを特徴とする、請求項1記載の組成物。
【請求項18】
前記生分解性の、生体適合性がある、熱可塑性のポリマーの平均分子量が約15,000以上であることを特徴とする、請求項1記載の組成物。
【請求項19】
前記生分解性の、生体適合性がある、熱可塑性のポリマーの平均分子量が最高で約45,000までであることを特徴とする、請求項1記載の組成物。
【請求項20】
前記生分解性の、生体適合性がある、熱可塑性のポリマーの平均分子量が約15,000以上から約45,000までであることを特徴とする、請求項1記載の組成物。
【請求項21】
前記生体適合性のある有機液体の水への溶解度が、いかなる比率でも完全に不溶から、全ての比率において完全に可溶まで変動することを特徴とする、請求項1記載の組成物。
【請求項22】
前記生体適合性のある有機液体が、水には完全に不溶であるが体液中には拡散することを特徴とする、請求項1記載の組成物。
【請求項23】
前記生体適合性のある有機液体が、少なくとも部分的に水溶性であることを特徴とする、請求項1記載の組成物。
【請求項24】
前記生体適合性のある有機液体が、完全に水溶性であることを特徴とする、請求項1記載の組成物。
【請求項25】
前記生体適合性のある有機液体が、極性プロトン性の液体であることを特徴とする、請求項1記載の組成物。
【請求項26】
前記生体適合性のある有機液体が、極性非プロトン性の液体であることを特徴とする、請求項1記載の組成物。
【請求項27】
前記生体適合性のある有機液体が、外界温度および生理学的温度において液体であり、アルコール類、ケトン類、エーテル類、アミド類、アミン類、アルキルアミン類、エステル類、カーボネート類、スルホキシド類、スルホン類、およびスルホン酸塩類の群から選択された官能基を少なくとも一つ含む、環状有機化合物、脂肪族有機化合物、直鎖脂肪族有機化合物、分枝脂肪族有機化合物または芳香族有機化合物であることを特徴とする、請求項1記載の組成物。
【請求項28】
前記生体適合性のある有機液体が、置換複素環化合物、炭酸とアルキルアルコール類のエステル類、モノカルボン酸類のアルキルエステル類、モノカルボン酸類のアリールエステル類、モノカルボン酸類のアラルキルエステル類、ジカルボン酸類のアルキルエステル類、ジカルボン酸類のアリールエステル類、ジカルボン酸類のアラルキルエステル類、トリカルボン酸類のアルキルエステル類、トリカルボン酸類のアリールエステル類、トリカルボン酸類のアラルキルエステル類、アルキルケトン類、アリールケトン類、アラルキルケトン類、アルコール類、ポリアルコール類、アルキルアミド類、ジアルキルアミド類、アルキルスルホキシド類、ジアルキルスルホキシド類、アルキルスルホン類、ジアルキルスルホン類、ラクトン類、環状アルキルアミド類、環状アルキルアミン類、芳香族アミド類、芳香族アミン類、それらの混合物、およびそれらの結合物、の群から選択されたことを特徴とする、請求項1記載の組成物。
【請求項29】
前記生体適合性のある有機液体が、N-メチル-2-ピロリドン、2-ピロリドン、(C2-C8)脂肪族アルコール、グリセリン、テトラグリコール、グリセロールフォーマル、2,2-ジメチル-1,3-ジオキソロン-4-メタノール、酢酸エチル、乳酸エチル、酪酸エチル、マロン酸ジブチル、クエン酸トリブチル、アセチルクエン酸トリ-n-ヘキシルエステル、コハク酸ジエチル、グルタル酸ジエチル、マロン酸ジエチル、クエン酸トリエチル、トリアセチン、トリブチリン、炭酸ジエチル、プロピレンカーボネート、アセトン、メチルエチルケトン、ジメチルアセトアミド、ジメチルホルムアミド、カプロラクタム、ジメチルスルホキシド、ジメチルスルホン、テトラヒドロフラン、カプロラクタム、N,N-ジエチル-m-トルアミド、1-ドデシルアザシクロヘプタン-2-オン、1,3-ジメチル-3,4,5,6-テトラヒドロ-2-(1H)-ピリミジノン、安息香酸ベンジル、および、それらの結合物、の群から選択されたことを特徴とする、請求項1記載の組成物。
【請求項30】
前記生体適合性のある有機液体が、約30から約500の範囲の分子量を有することを特徴とする、請求項1記載の組成物。
【請求項31】
前記生体適合性のある有機液体が、N-メチル-2-ピロリドン、2-ピロリドン、N,N-ジメチルホルムアミド、ジメチルスルホキシド、プロピレンカーボネート、カプロラクタム、トリアセチン、および、それらの任意の結合物であることを特徴とする、請求項1記載の組成物。
【請求項32】
前記生体適合性のある有機液体が、N-メチル-2-ピロリドンであることを特徴とする、請求項1記載の組成物。
【請求項33】
前記生体適合性の液体が、前記組成物の約40wt.%以上存在することを特徴とする、請求項1記載の組成物。
【請求項34】
前記生体適合性の液体が、最高で前記組成物の約80wt.%まで存在することを特徴とする、請求項1記載の組成物。
【請求項35】
前記生体適合性の液体が、前記組成物の約50wt.%から約70wt.%まで存在することを特徴とする、請求項1記載の組成物。
【請求項36】
前記生体適合性の液体が、水媒体、水、もしくは体液中に分散可能であることを特徴とする、請求項1記載の組成物。
【請求項37】
前記生物学的薬剤が、アドレナリン系薬物、副腎皮質ステロイド、副腎皮質抑制剤、アルコール妨害物質、アルドステロンアンタゴニスト、アミノ酸、アンモニア解毒剤、アナボリック、興奮薬、鎮痛薬、アンドロゲン、麻酔の付属物(anesthesia, adjunt to)、麻酔剤、食欲抑制剤、アンタゴニスト、下垂体前葉抑制剤、虫下し、ざ瘡治療剤、抗アドレナリン薬、抗アレルギー薬、抗アメーバ薬、抗アンドロゲン薬、補血薬、狭心症治療薬、恐怖症治療薬、関節炎治療薬、喘息治療薬、アテローム硬化治療薬、抗菌剤、胆石の溶解剤、胆石の抗凝固剤、抗コリン剤、抗凝固剤、抗コクシジウム薬、抗けいれん薬、抗うつ薬、糖尿病薬、止痢薬、抗利尿薬、解毒剤、鎮吐薬、抗てんかん薬、抗エストロゲン薬、抗線維溶解薬(antifibronolytic)、抗真菌薬、緑内障治療薬、抗血友病薬、抗出血性薬(antihermorrhagic)、抗ヒスタミン薬、抗高脂血症薬、抗高リポタンパク血症薬、血圧降下剤、抗低血圧薬、抗感染薬、局所的な抗感染薬、抗炎症薬、抗角化薬、抗マラリア薬、抗菌薬、抗片頭痛薬、抗真菌薬、制吐薬、抗腫瘍薬、抗好中球減少症薬、抗肥満薬、駆虫薬、パーキンソン病治療薬、ぜん動抑制薬、抗ニューモシスチス薬、抗増殖薬、前立腺肥大症治療薬、抗原虫薬、止痒薬、抗精神病薬、抗リウマチ薬、抗住血吸虫薬、抗脂漏性薬、抗分泌薬、鎮痙薬、抗血栓薬、鎮咳薬、抗潰瘍薬、抗尿石薬、抗ウイルス薬、食欲減退薬、良性前立腺増殖症治療薬、血糖調整剤、骨吸収阻害剤、気管支拡張剤、炭酸脱水酵素阻害薬、心機能抑制薬、心保護剤、強心薬、心臓脈管薬、利胆薬、コリン作動薬、コリン作動性診断補助薬、利尿薬、ドパミン作用薬、外部寄生虫駆除剤、催吐剤、酵素阻害剤(enxzyme inhibitor)、エストロゲン、フィブリノーゲン分解薬、蛍光剤、フリー酸素ラジカルスカベンジャー、胃運動性作動因子、グルココルチコイド、性腺刺激原理、養毛刺激剤、止血薬、ヒスタミンH2受動態アンタゴニスト、ホルモン、低コレステロール血症、血糖降下薬、脂質低下薬、降圧剤、イメージング剤、免疫化剤、免疫調整薬、免疫制御薬、免疫賦活薬、免疫抑制薬、陰萎治療薬、阻害剤、角質溶解剤、LNRNアゴニスト、肝臓障害処置薬、ルテロリジン、記憶補助剤、精神能力賦活剤、気分調整剤、粘液溶解物質、粘膜保護剤、散瞳薬、鼻充血抑制薬、神経筋遮断薬、神経保護剤、NMDAアンタゴニスト、非ホルモン性ステロール誘導体、子宮収縮薬、プラスミノーゲン活性化因子、血小板活性化因子アンタゴニスト、血小板凝集阻害薬、脳卒中後の処置薬および頭部外傷後の処置薬、増強剤、プロゲスチン、プロスタグランジン、前立腺増殖阻害剤、プロサイロトロピン、向精神薬、放射性医薬品、調整剤、弛緩薬、再分配剤、抗疥癬薬、硬化薬、鎮静薬、催眠鎮静薬、選択的アデノシンA1アンタゴニスト、セロトニンアンタゴニスト、セロトニン阻害剤、セロトニン受容体アンタゴニスト、ステロイド、刺激薬、抑制薬、症候性多発性硬化症、協力剤、甲状腺ホルモン、甲状腺ホルモン阻害剤、甲状腺ホルモン様の薬剤、精神安定剤、筋萎縮性側索硬化症の処置薬、脳虚血の処置薬、パジェット病の処置薬、不安定狭心症の処置薬、尿酸排泄薬、血管収縮薬、血管拡張薬、傷薬、創傷治癒薬、キサンチンオキシダーゼ阻害剤(zxanthine oxidase inhibitor)、および、それらの配合物の群から独立に選択されたことを特徴とする、請求項1記載の組成物。
【請求項38】
前記生物学的薬剤が、アセブトロール、アセブトロール、アシクロビル、アルブテロール、アルフェンタニル、アルモトリプタン、アルプラゾラム、アミオダロン、アンレキサノクス、アムホテリシンB、アトルバスタチン、アトロピン、オーラノフィン、オーロチオグルコース、ベナゼプリル、ビカルタミド、ブレチリウム、ブリフェンタニル、ブロモクリプチン、ブプレノルフィン、ブトルファノール、ブスピロン、カルシトニン、カンデサルタン、カーフェンタニル、カルベジロール、クロルフェニラミン、クロロチアジド、クロルフェンテルミン、クロルプロマジン、クリンダマイシン、クロニジン、コデイン、シクロスポリン、デシプラミン、デスモプレシン、デキサメタゾン、ジアゼパム、ジクロフェナク、ジゴキシン、ジヒドロコデイン(Digydrocodeine)、ドラセトロン、ドパミン、ドキセピン、ドキシサイクリン、ドロナビノール、ドロペリドール、ジクロニン、エレトリプタン、エナラプリル、エノキサパリン、エフェドリン、エピネフリン、エルゴタミン、エトミデート、ファモチジン、フェロジピン、フェンタニル、フェキソフェナジン、フルコナゾール、フルオキセチン、フルフェナジン、フルルビプロフェン、フルバスタチン、フルボキサミン、フロバトリプタン、フロセミド、ガンシクロビル、金チオリンゴ酸ナトリウム、グラニセトロン、グリセオフルビン、ハロペリドール、B型肝炎ウイルスワクチン、ヒドララジン、ヒドロモルフォン、インスリン、イプラトロピウム、イスラジピン、二硝酸イソソルビド、ケタミン、ケトロラック、ラベタロール、レボルファノール、リシノプリル、ロラタジン、ロラゼパム、ロサルタン、ロバスタチン、メラトニン、メチルドパ、メチルフェニデート、メトプロロール、ミダゾラム、ミルタザピン、モルヒネ、ナドロール、ナルプフィン、ナロキソン、ナルトレキソン、ナラトリプタン、ネオスチグミン、ニカルジピン、ニフェジピン、ノルエピネフリン、ノルトリプチリン、オクトレオチド、オランザピン、オメプラゾール、オンダンセトロン、オキシブチニン、オキシコドン、オキシモルフォン、オキシトシン、フェニレフリン、フェニルプロパノールアミン、フェニトイン、ピモジド、ピオグリタゾン、ピロキシカム、プラバスタチン、プラゾシン、プロクロルペラジン、プロパフェノン、プロクロルペラジン、プロピオマジン、プロポフォール、プロプラノール、プソイドエフェドリン、ピリドスチグミン、クエチアピン、ラロキシフェン、レミフェンタニル、ロフェコキシブ、レパグリニド、リスペリドン、リザトリプタン、ロピニロール、スコポラミン、セレギリン、セルトラリン、シルデナフィル、シンバスタチン、シロリムス、スピノラクトン、スフェンタニル、スマトリプタン、タクロリムス、タモキシフェン、テルビナフィン、テルブタリン、テストステロン、破傷風トキソイド、THCトルテロジン、トリアムテレン、トリアゾラム、トリセタミド、バルサルタン、ベンラファキシン、ベラパミル、ザレプロン、ザミナビル、ザフィルルカスト、ゾルミトリプタン、ゾルピデム、および、それらの配合物の群から独立に選択されたことを特徴とする、請求項1記載の組成物。
【請求項39】
前記細胞周期生物学的薬剤(cell-cycle biological agent)、前記スケジュール依存性生物学的薬剤(schedule- dependant biological agent)、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグが、前記組成物の約0.00001wt.%以上存在することを特徴とする、請求項1記載の組成物。
【請求項40】
前記細胞周期生物学的薬剤、前記スケジュール依存性生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグが、最高で前記組成物の約20wt.%まで存在することを特徴とする、請求項1記載の組成物。
【請求項41】
前記細胞周期生物学的薬剤、前記スケジュール依存性生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグが、前記組成物の約0.00001wt.%から約10wt.%まで存在することを特徴とする、請求項1記載の組成物。
【請求項42】
前記流動性組成物中に存在する、前記細胞周期生物学的薬剤、前記スケジュール依存性生物学的薬剤、それらの代謝産物、もしくはそれらのプロドラッグのヒトの最大許容投与量(MTD)が、溶液中に存在する、前記細胞周期生物学的薬剤、前記スケジュール依存性生物学的薬剤、それらの代謝産物、もしくはそれらのプロドラッグのヒトの最大許容投与量(MTD)よりも小さいことを特徴とする、請求項1記載の組成物。
【請求項43】
前記流動性組成物中に存在する、前記細胞周期生物学的薬剤、前記スケジュール依存性生物学的薬剤、それらの代謝産物、もしくはそれらのプロドラッグのヒトの最大許容投与量(MTD)が、溶液中に存在する、前記細胞周期生物学的薬剤、前記スケジュール依存性生物学的薬剤、それらの代謝産物、もしくはそれらのプロドラッグのヒトの最大許容投与量(MTD)よりも少なくとも50%小さいことを特徴とする、請求項1記載の組成物。
【請求項44】
生体内で挿入物の基盤から生物学的薬剤を放出する速度を調整するための放出速度修正剤、
孔形成剤、
生分解性の結晶化コントロール薬剤、
可塑剤、
浸出剤、
浸透促進剤、
吸収変化剤、
不透明化剤、および
着色料、
のうちの少なくとも1つをさらに含むことを特徴とする、請求項1記載の組成物。
【請求項45】
前記放出速度修正剤がモノカルボン酸のエステル、ジカルボン酸のエステル、トリカルボン酸のエステル、ポリヒドロキシルアルコール、脂肪酸、グリセリンのトリエステル、ステロール、アルコール、および、それらの任意の配合物の群から選択されることを特徴とする、請求項44記載の組成物。
【請求項46】
前記放出速度修正剤が、酢酸2-エトキシエチル、酢酸メチル、酢酸エチル、フタル酸ジエチル、フタル酸ジメチル、フタル酸ジブチル、アジピン酸ジメチル、コハク酸ジメチル、シュウ酸ジメチル、クエン酸ジメチル、クエン酸トリエチル、クエン酸アセチルトリブチルエステル、クエン酸アセチルトリエチルエステル、三酢酸グリセリン、セバシン酸ジ(n-ブチル)(di(n-butyl) sebecate)、プロピレングリコール、ポリエチレングリコール、グリセリン、ソルビトール、トリグリセリド、エポキシ化大豆油、コレステロール、(C6-C12)アルカノール、2-エトキシエタノール、および、それらの任意の配合物の群から選択されることを特徴とする、請求項44記載の組成物。
【請求項47】
前記孔形成剤が、糖、塩、水溶性ポリマー、もしくは水溶性有機液体であることを特徴とする、請求項44記載の組成物。
【請求項48】
前記生分解性の結晶化コントロール薬剤が、炭酸カルシウム、ヒドロキシアパタイト、リン酸カルシウム、カルシウムアパタイト、硫酸カルシウム、炭酸水素カルシウム、塩化カルシウム、炭酸ナトリウム、炭酸水素ナトリウム、塩化ナトリウム、ステアリン酸カルシウム、パルミチン酸カルシウム、ステアリン酸ナトリウム、デキストラン、デンプン、カルボキシメチルセルロースナトリウム、カルボキシメチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、架橋したカルボキシメチルセルロースナトリウム、ポリ(ビニルアルコール)、パルミチン酸グリセリン、ステアリン酸グリセリン、クエン酸トリエチル、乳酸エチル、ポリ(エチレングリコール)、ポリ(ビニルピロリドン)、ポリ(ラクチド-co-カプロラクトン)、および、それらの任意の配合物の群から選択されることを特徴とする、請求項44記載の組成物。
【請求項49】
前記修正剤が安息香酸ベンジル、フタル酸エステル類、フタル酸ベンジル類、安息香酸グリコール、トリメリト酸エステル類(trimellitates)、アジピン酸エステル類(adipates)、アゼライン酸エステル類(azelates)、セバシン酸エステル類(sebacates)、脂肪族ならびに芳香族のジカルボン酸類およびトリカルボン酸類のエステル類、有機リン酸エステル類(organic phosphates)、ゴマ油、大豆油、綿実油、アーモンド油、ヒマワリ油、ピーナッツ油、および、それらの任意の配合物の群から選択されることを特徴とする、請求項44記載の組成物。
【請求項50】
前記吸収変化剤がプロピレングリコール、グリセリン、尿素、ジエチルセバシン酸ナトリウム、ラウリル硫酸、ラウリル硫酸ナトリウム、ソルビタンエトキシレート類、オレイン酸、ピロリドンのカルボン酸エステル、N-メチルピロリドン、N,N-ジメチル-m-トルマイド(N,N-diethyl-m-tolumide)、ジメチルスルホキシド、アルキルメチルスルホキシド、および、それらの任意の配合物の群から選択されることを特徴とする、請求項44記載の組成物。
【請求項51】
前記速度修正剤が水に不溶の有機物質であることを特徴とする、請求項44記載の組成物。
【請求項52】
前記の水に不溶の有機物質がモノカルボン酸、ジカルボン酸、もしくはトリカルボン酸のエステルであることを特徴とする、請求項51記載の組成物。
【請求項53】
前記不透明化剤がバリウム、ヨウ素、もしくはカルシウムを含むことを特徴とする、請求項44記載の組成物。
【請求項54】
生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグが、粒子に組み込まれているか、もしくは、コントロールリリース成分に含められていることを特徴とする、請求項1記載の組成物。
【請求項55】
前記コントロールリリース成分粒子が、キャリアー分子と共有結合している、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグの共役物(conjugate)を含むことを特徴とする、請求項54記載の組成物。
【請求項56】
前記コントロールリリース成分粒子が、マイクロカプセル、ナノ微粒子(nanoparticle)、シクロデキストリン、リポソーム、および、ミセルの群から選択された微細構造であることを特徴とする、請求項54記載の組成物。
【請求項57】
前記コントロールリリース成分粒子が、約500ミクロン以下の微細構造であることを特徴とする、請求項54記載の組成物。
【請求項58】
前記コントロールリリース成分粒子が、繊維、フィルム、棒、平円盤、および、柱体の群から選択された微細構造であることを特徴とする、請求項54記載の組成物。
【請求項59】
前記コントロールリリース成分粒子が、少なくとも約500ミクロンの微細構造であることを特徴とする、請求項54記載の組成物。
【請求項60】
微孔性の固体の基盤を構成することができる請求項1記載の組成物であって、
前記基盤は被膜で囲まれた芯であり、
前記芯には直径が約1ミクロンから約1000ミクロンの穴が含まれていることを特徴とする組成物。
【請求項61】
前記被膜が前記芯の孔の直径よりも小さな直径の孔を含んでいるために、前記被膜は前記芯と比較して機能的に多孔性でないことを特徴とする、請求項60記載の組成物。
【請求項62】
体積が約0.001mL以上であることを特徴とする、請求項1記載の組成物。
【請求項63】
体積が約20.0mLまでであることを特徴とする、請求項1記載の組成物。
【請求項64】
体積が約0.01mLから約10.0mLであることを特徴とする、請求項1記載の組成物。
【請求項65】
およそ一週間に一回以下程度の投与のために処方されることを特徴とする、請求項1記載の組成物。
【請求項66】
およそ一年に一回以上程度の投与のために処方されることを特徴とする、請求項1記載の組成物。
【請求項67】
およそ一週間に一回から、一年に一回程度の投与のために処方されることを特徴とする、請求項1記載の組成物。
【請求項68】
生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを、約1ピコグラム/キログラム/日から約1ミリグラム/キログラム/日の投薬量を哺乳類の組織に送達することを特徴とする、請求項1記載の組成物。
【請求項69】
前記送達が全身送達であることを特徴とする、請求項68記載の組成物。
【請求項70】
前記送達が局所的送達であることを特徴とする、請求項68記載の組成物。
【請求項71】
前記投薬量が最長で約1年までの期間にわたって局所的に送達されることを特徴とする、請求項68記載の組成物。
【請求項72】
前記投薬量が最長で約1箇月までの期間にわたって局所的に送達されることを特徴とする、請求項68記載の組成物。
【請求項73】
前記投薬量が最長で約1週間までの期間にわたって局所的に送達されることを特徴とする、請求項68記載の組成物。
【請求項74】
前記投薬量が約1日以上の期間にわたって局所的に送達されることを特徴とする、請求項68記載の組成物。
【請求項75】
第二の生物学的薬剤をさらに含むことを特徴とする、請求項1記載の組成物。
【請求項76】
哺乳類の疾患もしくは異常を処置する方法であって、
前記方法がそのような処置を必要とする哺乳類の眼部に、有効量の請求項1から75までのいずれかに記載の流動性組成物を投与するステップ、
を含むことを特徴とする方法。
【請求項77】
前記哺乳類がヒトであることを特徴とする、請求項76記載の方法。
【請求項78】
前記流動性組成物が前記哺乳類の眼部の複数の場所に投与されることを特徴とする、請求項76記載の方法。
【請求項79】
哺乳類の眼部から生物学的薬剤を局所的に送達するための方法であって、
請求項1から75までのいずれかに記載の流動性組成物を哺乳類の眼部に接触させるステップを含む方法。
【請求項80】
哺乳類の眼部から生物学的薬剤を全身に送達するための方法であって、
請求項1から75までのいずれかに記載の流動性組成物を哺乳類の眼部に接触させるステップを含む方法。
【請求項81】
(a) 少なくとも実質的に水媒体、水、もしくは体液に溶解しない生分解性の、生体適合性がある、熱可塑性のポリマー、
(b) 生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグ、ならびに、
(c) 標準温度および圧力で熱可塑性ポリマーが可溶な、生体適合性のある有機液体
を含むことを特徴とする、挿入物であって、
ここで、前記挿入物は哺乳類の眼部に位置し、前記挿入物が固体もしくはゼラチン状の微孔性の基盤を有し、前記基盤は被膜で囲まれた芯であり、前記挿入物が体の組織に囲まれていることを特徴とする挿入物。
【請求項82】
十分に凝固していることを特徴とする、請求項81記載の挿入物。
【請求項83】
固められていることを特徴とする、請求項81記載の挿入物。
【請求項84】
生体適合性のある有機液体の量が時間の経過と共に減少することを特徴とする、請求項81記載の挿入物。
【請求項85】
前記芯に直径が約1ミクロンから約1000ミクロンの穴が含まれていることを特徴とする、請求項81記載の挿入物。
【請求項86】
前記被膜が前記芯の孔の直径よりも小さな直径の孔を含んでいることを特徴とする、請求項81記載の挿入物。
【請求項87】
前記被膜の孔が、前記被膜が前記芯と比較して機能的に多孔性でないような大きさであることを特徴とする、請求項81記載の挿入物。
【請求項88】
(a) 少なくとも実質的に水媒体、水、もしくは体液に溶解しない生分解性の、生体適合性がある、熱可塑性のポリマー、ならびに、
(b) 生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグ、
を含むことを特徴とし、
ここで、前記挿入物は哺乳類の眼部に位置し、前記挿入物が固体もしくはゼラチン状の微孔性の基盤を有し、前記基盤は被膜で囲まれた芯であり、前記挿入物が体の組織に囲まれている挿入物。
【請求項89】
前記芯に直径が約1ミクロンから約1000ミクロンの穴が含まれていることを特徴とする、請求項88記載の挿入物。
【請求項90】
前記被膜が前記芯の孔の直径よりも小さな直径の孔を含んでいることを特徴とする、請求項88記載の挿入物。
【請求項91】
前記被膜の孔が、前記被膜が前記芯と比較して機能的に多孔性でないような大きさであることを特徴とする、請求項88記載の挿入物。
【請求項92】
生体内の眼部の原位置で挿入物を構成する方法であって、
(a) 受療者の眼部に流動性組成物を注入するステップ(ここで、前記流動性組成物は請求項1から75のいずれかに記載された組成物)、および
(b) 生体適合性のある有機液体を固体の生分解性の挿入物を構成するために拡散させるステップ、
を含むことを特徴とする方法。
【請求項93】
眼部での生体内原位置で生分解性の挿入物を構成するのに適した生物学的薬剤キットであって、
(a) 第一の容器は、眼部送達に適した流動性組成物を含み、
ここで、前記組成物は
(i) 少なくとも実質的に水媒体、水、もしくは体液に溶解しない生分解性の、生体適合性がある、熱可塑性のポリマー、ならびに、
(ii) 標準温度および圧力で熱可塑性ポリマーが可溶な、生体適合性のある有機液体
を含み、
(b) 第二の容器は、生物学的薬剤、それらの代謝産物、それらの生物学的薬剤として許容される塩、もしくはそれらのプロドラッグを含む
ことを特徴とするキット。
【請求項94】
前記第一の容器が注射器であることを特徴とする、請求項93記載のキット。
【請求項95】
前記第二の容器が注射器であることを特徴とする、請求項93記載のキット。
【請求項96】
前記第一の容器が注射器であり、前記第二の容器が注射器であり、両方の注射器が直接互いに結合されたものを形作っていることを特徴とする、請求項93記載のキット。
【請求項97】
さらに説明書を含むことを特徴とする、請求項93記載のキット。
【請求項98】
哺乳類の眼部に関する疾患もしくは異常を処置する方法であって、
前記方法がそのような処置を必要とする哺乳類の眼部に、有効量の請求項1から75までのいずれかに記載の流動性組成物を投与するステップ、
を含むことを特徴とする方法。
【請求項99】
前記眼部に関する疾患もしくは異常が黄斑変性症であることを特徴とする、請求項98記載の方法。
【請求項100】
前記眼部に関する疾患もしくは異常が癌であることを特徴とする、請求項98記載の方法。
【請求項101】
哺乳類の眼部に関する疾患もしくは異常を処置するための薬物を製造するための、請求項1から75までのいずれかに記載の流動性組成物の使用。
【請求項102】
前記眼部に関する疾患もしくは異常が黄斑変性症であることを特徴とする請求項101に記載の流動性組成物の使用。
【請求項103】
前記眼部に関する疾患もしくは異常が癌であることを特徴とする、請求項101に記載の流動性組成物の使用。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公表番号】特表2008−520547(P2008−520547A)
【公表日】平成20年6月19日(2008.6.19)
【国際特許分類】
【出願番号】特願2007−534913(P2007−534913)
【出願日】平成17年10月4日(2005.10.4)
【国際出願番号】PCT/US2005/035865
【国際公開番号】WO2006/041942
【国際公開日】平成18年4月20日(2006.4.20)
【出願人】(505340973)キューエルティー ユーエスエー,インコーポレイテッド. (8)
【Fターム(参考)】
【公表日】平成20年6月19日(2008.6.19)
【国際特許分類】
【出願日】平成17年10月4日(2005.10.4)
【国際出願番号】PCT/US2005/035865
【国際公開番号】WO2006/041942
【国際公開日】平成18年4月20日(2006.4.20)
【出願人】(505340973)キューエルティー ユーエスエー,インコーポレイテッド. (8)
【Fターム(参考)】
[ Back to top ]

