睡眠呼吸障害の呼吸パラメータの非侵襲的監視方法および装置
【課題】睡眠呼吸障害に関連するパラメータを監視する。
【解決手段】空気供給システムが、治療のために患者に提供される加圧型の呼吸可能なガスの供給を生成するように動作することができる制御可能な流れ発生器と、治療期間中の患者努力の尺度を決定し、流れ発生器の動作を制御するための入力用の患者努力の信号を提供するように構成されたパルスオキシメータとを含む。
【解決手段】空気供給システムが、治療のために患者に提供される加圧型の呼吸可能なガスの供給を生成するように動作することができる制御可能な流れ発生器と、治療期間中の患者努力の尺度を決定し、流れ発生器の動作を制御するための入力用の患者努力の信号を提供するように構成されたパルスオキシメータとを含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、睡眠呼吸障害(Sleep Disordered Breathing(SDB))に関連するパラメータの監視に関する。
【0002】
関連出願の相互参照
本出願は、それぞれが参照により本明細書にその全体が組み込まれている、2004年10月6日に出願した米国特許仮出願第60/615961号明細書、および2004年11月22日に出願した米国特許仮出願第60/629612号明細書の優先権を主張するものである。
【背景技術】
【0003】
睡眠呼吸障害(SDB)は従来、閉塞性睡眠時無呼吸(Obstructive Sleep Apnea(OSA))およびチェーン‐ストークス型呼吸(Cheyne-Stokes Respiration(CSR))と識別されていた。現在、たとえば心疾患、卒中および糖尿病などを含めて、やはりSDBと関連していると認識される他の複数の状態がある。これらの状態およびSDBを有する患者は、何らかの形の人工呼吸器による陽圧換気補助を用いてSDBを治療することから恩恵を受けることができる。
【0004】
基本的な経鼻的持続気道内陽圧(Continuous Positive Airway Pressure(CPAP))人工呼吸器は一般に患者を監視しなくてもよいが、患者は、何らかの種類の制御ループの一環として患者を監視する装置を有することから恩恵を受ける。具体的には、圧、流れおよび患者の努力を監視するための装置が知られている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】米国特許第6445942号明細書
【特許文献2】米国特許第6091973号明細書
【特許文献3】米国特許第6363270号明細書
【特許文献4】米国特許第5704345号明細書
【特許文献5】米国特許第6484719号明細書
【特許文献6】国際公開第01/000264号
【発明の概要】
【発明が解決しようとする課題】
【0006】
知られている装置の既存の問題は、閉塞性睡眠時無呼吸(OSA)と中枢性睡眠時無呼吸(central sleep apnea(CSA))とを区別することを含む。OSAは、上気道虚脱を示しており、2段式の装置で使用される加えられるCPAP圧または呼気終末圧(end-expiratory pressure(EEP))の自動滴定アルゴリズムへの入力として使用することができる。CSAは、過剰換気を示すことができ、したがって、患者の換気を自動滴定するアルゴリズムへの入力として使用することができる。明らかに、無呼吸を閉鎖性または開放性として誤って分類すると、これらの滴定アルゴリズムによって、患者の治療にとって最適には至らないパラメータが定められることになる。
【0007】
閉塞性と中枢性の睡眠時無呼吸は、知られている装置では、1cmの最大振幅4Hz振動を治療圧波形に注入し、結果として生じる4Hzの流れを測定することによって区別される。圧波形への流れの位相差は負荷のコンプライアンスを示すものであり、次いで、この負荷コンプライアンスは、上気道が開いているか、それとも閉じているかを推定するために使用される。しかし、この方法は、4Hzが、患者が知覚し得る周波数帯の範囲内に入り易いので、患者にとっては不快である。また、この方法は、上気道狭窄/閉鎖、および同時中枢性睡眠時無呼吸を含むイベントに関する情報を提供しない。
【0008】
閉塞性と中枢性の睡眠時無呼吸は、既知の装置では、心原性の流れを検出することによっても区別される。心原性の流れは、肺が心臓の近くにあることにより、心臓の鼓動時に肺の中で引き起こされる気流である。したがって、OSAの間、心原性の流れは決して生じない。上記の解決策と同様に、CSAとOSAが同時に生じたかどうか判断することはやはり不可能である。
【0009】
知られている装置に関する別の既存の問題は、高い患者呼吸努力を推測することを含む。患者の呼吸努力は、睡眠時無呼吸、閉塞性の肺病、および様々な拘束性疾患を含む、複数の疾病の患者の急性状態を評価するときに臨床医によって使用される重要な指標である。それは、その知られている有用性にもかかわらず、関与する変換器が不便であり、または非実用的であるため、流れ発生器(flow generator)滴定アルゴリズムへの入力としても、記録された臨床パラメータとしても普及していない。
【0010】
努力監視の精度に関する「ゴールドスタンダード」は、患者が飲み込むよう求められる、食道カテーテルである。残念なことに、これは、患者にとって不快で厄介なものであり、臨床外では実用的でない。努力を監視するための患者の胸部および腹部の周りの呼吸バンドが知られている。胸骨上切痕の努力センサもまた、EMG(electromyogram(筋電図))およびECG(electrocardiogram(心電図))センサの使用と同様に知られている。これらの技術はすべて、家庭での使用には適していない。
【0011】
知られている装置に関する別の既存の問題は、心臓の後負荷、血管緊張、心拍変動、交感神経系活動全般および/または中心静脈圧など、血管特有のパラメータを測定し格納することを含む。これらのパラメータは、流れ発生器内でリアルタイムに利用可能であるならば、(a)自動滴定アルゴリズムへの寄与、および(b)医師が長期的傾向を観察し、患者の長期的管理を決定するためのより豊富なデータセットを有することを可能にするための呼吸特有のパラメータを付けた記録のために使用されるであろう。
【0012】
しかし、知られている装置に関するさらに別の既存の問題は、平均マスク圧を制限することを含む。OSAまたは上気道抵抗シンドローム(upper airway resistance syndrome(UARS))を取り除くことを目的とする自動滴定CPAPアルゴリズムは、上気道狭窄を制限するために、呼吸流の解析を使用することができる。一定レベルを超えた圧は、患者によっては、心臓機能に有害なことがある。同様に、より低い圧は、上気道の完全な閉鎖が結果として生じないならば、心臓機能に有益であり得る。呼吸療法(たとえばCPAP圧)が連続的に最適化され得るように、自動滴定の手法に心血管パラメータを含めることは望ましい。こうしたパラメータは、心臓の後負荷、血管緊張、心拍変動、交感神経系活動全般および/または中心静脈圧を、それらが非侵襲的にかつ都合よく取得されることができるならば含んでもよい。
【0013】
ResMed社のAutoSet CSおよびAutoSet CS2装置は、具体的には、心疾患の患者を対象とする。これらの装置は、15cmH2Oの最大平均圧を課すことによって、「過度のCPAP圧」の問題に対処する。
【0014】
知られている別のセンサは、胸骨上切痕の努力センサである。米国特許第6445942号明細書(Berthon-Jones)を参照されたい。無呼吸および呼吸低下を監視するための知られている他の技術は、米国特許第6091973号明細書(Colla他)および米国特許第6363270号明細書(Colla他)に記載されている。関連する別の米国特許は、とりわけ開放性と閉鎖性の気道無呼吸の区別について記載している米国特許第5704345号明細書(Berthon-Jones)である。米国特許第6484719号明細書(Berthon-Jones)は、流れセンサを使用するサーボ人工呼吸器について記載している。これらのすべての特許の内容が、相互参照により本明細書に明示的に組込まれている。
【課題を解決するための手段】
【0015】
本発明の第1の態様によれば、人工呼吸器装置の設定が、パルスオキシメータプレチスモグラフィ(pulse oximeter plethysmography(PPG))から導出されたパラメータに従って調整される。調整される人工呼吸器装置の設定は、呼気圧、補助レベル、立上り時間のうちの1つまたは複数を含み、人工呼吸器波形が調整され得る。パルスオキシメータプレチスモグラフィから導出されるパラメータは、心拍、努力、心臓の後負荷、血管緊張、心拍変動、交感神経系活動全般および中心静脈圧のうちの1つまたは複数を含む。ある形では、人工呼吸器の平均治療圧は、パルスオキシメータプレチスモグラフィから導出されたパラメータに従って調節される。別の形では、人工呼吸器の平均治療圧は、パルスオキシメータプレチスモグラフィが患者の血管系が緊張状態になっていることを示す場合に減少される。
【0016】
本発明の第2の態様によれば、パルスオキシメータプレチスモグラフィが、患者の努力を測定するために使用され、患者努力信号は、患者に提供される陽圧療法を制御する、フィードバックコントローラへの入力として使用される。
【0017】
本発明の第3の態様によれば、パルスオキシメータが、開放性と閉鎖性の気道無呼吸を区別するために、気流信号と共に使用される。
【0018】
本発明の第4の態様によれば、患者の努力の尺度は、パルスオキシメータプレチスモグラフ信号から導出され、この努力尺度は、サーボ人工呼吸器の制御変数として使用される。患者努力の尺度が増加するときは、圧補助は減少され、患者努力の尺度が減少するときは、圧補助は増加される。
【0019】
本発明の別の態様は、閉塞性と中枢性の睡眠時無呼吸を区別し、高い患者呼吸努力を推測し、血管特有のパラメータを測定し格納し、および平均マスク圧を制限する、受動的で非侵襲性の便利な方法に関する。
【0020】
本発明のさらに別の態様は、治療のために患者に提供される加圧型の呼吸可能なガスの供給を生成するように動作することができる制御可能な流れ発生器と、治療期間中の患者努力の尺度を決定し、流れ発生器の操作を制御するための入力用の患者努力信号を供給するように構成されたパルスオキシメータプレチスモグラフとを含む空気供給システム(air delivery system)に関する。
【0021】
本発明のさらに別の態様は、睡眠呼吸障害を治療するための方法に関する。この方法は、治療のために患者に加圧型の呼吸可能なガスの供給を提供すること、治療期間中の患者努力の尺度を決定し、患者努力信号を供給するためにパルスオキシメータプレチスモグラフィを使用すること、および患者努力信号からの入力に基づいて加圧型の呼吸可能ガスの供給を制御することを含む。
【0022】
対象のパラメータ(たとえば心臓の後負荷、血管緊張、心拍変動および/または中心静脈圧)は、パルスオキシメータプレチスモグラフから推定することができる。現在、パルスオキシメータは主として、SpO2(arterial oxygen saturation(動脈血酸素飽和度))および心拍数を監視するために使用されている。一部のパルスオキシメータはプレチスモグラフを表示するが、知られている限りでは、プレチスモグラフ内に存在する情報のいずれも、呼吸または心臓血管療法を自動滴定するための入力として使用されていない。末梢動脈緊張(Peripheral Arterial Tone(PAT))は、具体的には動脈緊張に焦点を当てた、新規のマルチセル指プレチスモグラフィ(multi-cell finger plethysmography)システムである。この技術は、感覚モダリティとして、パルスオキシメトリの代替物であり得る。脈波到達時間(Pulse-transit time(PTT))もまた、自律活動および動脈緊張に関する情報を含む。
【0023】
それぞれの態様は、患者の健康障害、たとえば睡眠呼吸障害、うっ血性心不全、卒中などの診断に関する1つまたは複数のパラメータを非侵襲的に監視し、かつ/または監視されたパラメータおよび/または導出された診断に従って人工呼吸器または他の呼吸療法装置を制御するための方法および/または装置の形で明示することができる。
【0024】
本発明の別の態様は、患者を治療せずに、パルスオキシメータプレチスモグラフィを使用して患者を監視することである。
【0025】
本発明のさらなる態様は、添付の特許請求の範囲に述べられている。
【0026】
本発明の他の態様、特徴および利点は、添付の図面と併せて考慮すれば、以下の詳細な説明から明らかになる。図面は、本開示の一部であり、例示するため本発明の原理を示している。
【図面の簡単な説明】
【0027】
【図1】努力信号に変換されたパルスオキシメータ波形を示す図である。
【図2】本発明の様々な実施形態によるパルスオキシメータ適用範囲を示す図である。
【図3】本発明の一実施形態による療法システムを示す図である。
【図3A】本発明の一実施形態による監視システムの概要図である。
【図4】本発明の一実施形態による、上気道閉塞(吸気流の制限)および自動EEP/自動CPAPのためのアルゴリズムを示す図である。
【図5】本発明の一実施形態による、自動EEP滴定/自動化圧補助滴定のためのアルゴリズムを示す図である。
【図6】本発明の一実施形態による、CPAP/自動CPAP/Comfort(固定の低補助2段式)装置上の心臓病患者の交感神経系(SNS)の上昇または心拍出量の減少を検出するためのアルゴリズムを示す図である。
【図7】本発明の一実施形態による、心臓病患者の自動CPAPのためのアルゴリズムを示す図である。
【図8】本発明の一実施形態による、呼吸数情報に基づいてNPPV療法レート設定を初期化するための手順を示すブロック図である。
【図9】本発明の一実施形態による、心原生の流れの振幅を確実に識別することに基づいてNPPV療法トリガ閾値設定を初期化するための手順を示すブロック図である。
【発明を実施するための形態】
【0028】
添付の図面は、本発明の様々な実施形態の理解を容易にするものである。
【0029】
パルスオキシメータプレチスモグラフィ(単純に「パルスオキシメトリ」または「フォトプレチスモグラム」と呼ばれることがある)は、血液酸素化データを非侵襲的で連続的なやり方で取得する標準の方法である。オキシメータは、ヘモグロビン飽和の値を求めるために、光の2つの波長を使用する。波形は、交流(alternating current(AC))信号を表わす、拍動性動脈血量がもたらす吸収によって作られる。非拍動性血、静脈および毛細管血によってもたらされる吸収、ならびに組織吸収が、直流(direct current(DC))信号によって示される。Hartert他、「Use of Pulse Oximetry to Recognize Severity of Airflow Obstruction in Obstructive Airway Disease, Correlation with Pulsus Paradoxus」、Chest 1999:115:475〜481頁を参照されたい。Hartert他からのパルスオキシメータ信号が、図1に示されている。
【0030】
現在、パルスオキシメータは主として、SpO2および心拍数の監視のために使用されているが、しかし、発明の一実施形態によれば、パルスオキシメータは、呼吸療法装置において患者努力の表示として使用される。呼吸努力は、動脈圧波形において、ピーク間振幅の変動として見られ得る。これは、呼吸周期を通じた心拍出量に対する呼吸胸腔内圧の変動の影響によって引き起こされる。吸気は、低下した収縮期血圧に関連し、血圧に対するこの呼吸の影響は、「奇脈(pulsus paradoxus)」と呼ばれる。
【0031】
この影響は、様々な領域(喘息悪化、閉塞性の肺疾病)において呼吸負荷の尺度として提案されてきており、この尺度では、>10mmHgの変動は高い呼吸努力に関連付けられる。動脈圧を測定するための参照基準(reference standard)は、侵襲性(カテーテル)であり、したがって間接的な方法が望まれる。1つのそのような方法は、脈動到達時間(PTT)であり、この脈動到達時間では、血圧の変動は、心臓から末梢へのパルスの伝播時間として変換される、血管コンプライアンスの変動を引き起こす。別の方法は、感知されている組織層(通常指または耳)の動脈血量に関する、オキシメータプレチスモグラフ波形である。呼吸周期を通じての心拍出量の変化は、動脈圧観察と整合の取れた、プレチスモグラムのピーク間振幅の変動として認識され得る。この心拍出量変動は、呼吸による中心静脈圧の変動と相まって、呼吸と同期の取れたPPG信号のベースライン/オフセットの変化をも引き起こす。PPGで見られる第3の要因が呼吸の影響を受け、すなわち心臓周期も呼吸により、主として呼吸神経系の流出を介していくらか調節され、また呼吸によって引き起こされた動脈圧変動に反応して、それほどにではないが調節される。
【0032】
パルスオキシメータプレチスモグムが組織中の血量により深く関連しているので、拍動要素のベースライン/オフセットの変動は、心拍出量変動より感度の高い、心肺相互作用の指標であり得る(Hartert他、「Use of Pulse Oximetry to Recognize Severity of Airflow Obstruction in Obstructive Airway Disease - Correlation With Pulsus Paradoxus」、Chest 1999、115:475〜481頁)。
【0033】
他の要因(動脈緊張、心仕事量、姿勢変化)もまた、PPGの変動を引き起こすことがあり、したがって、呼吸頻度にわたる変動を解析するための処理が必要であり、それには、流れ発生器から提供される呼吸流の情報にその変動を相関させることがさらに役立ち得る。PPplethの段階的な増加(プレチスモグラフからの奇脈)は、差し迫った上気道(upper airway(UA))虚脱に関連した増加している努力を示していることがある。PPplethの劇的な増加は、UA閉塞を示していることがある。
【0034】
波形は、以下のカテゴリに分類される。
(a)脈動振幅:脈拍のAC振幅は、血管コンプライアンスを最もよく示すものであり、この血管コンプライアンスは、20〜30秒以上にわたって調べられるとき、動脈緊張/交感神経系活動によって大きく影響される。したがって、それは、無呼吸からの覚醒を示すことができ、また多くの日/週にわたっては、SNS(sympathetic nervous system(交感神経系))活動時のOSA/UARSを止めることの長期的利益を示し得る。指は、血管コンプライアンスに対する自律活動の影響を検出するのに最良の場所である。耳のパルスオキシメトリは、自律活動に対する感度は小さくなるが、血管コンプライアンスがより小さい効果を及ぼすことを考慮すると、相対的な血圧変動の推定を提供することができる。
(b)オフセットまたはベースライン:呼吸は、呼吸努力(昇圧反応)に応じて変化する、脈拍のベースラインの相の変動(奇脈)を引き起こす。この影響は、気道抵抗(喘息)および閉塞(閉塞性の肺疾病)を識別するために使用されてきた。従来のプレチスモグラフによる奇脈測定方法の比較(Clark J他、Arch Pediatr Adolesc Med 2004、158:48〜51頁)、および閉塞性気道疾患の気流閉塞の重症度、奇病との相関を認識するためのパルスオキシメトリの使用(Hartert他、Chest 1999、115:475〜481頁、オンラインhttp://www.chestjournal.org/cgi/reprint/115/2/475で入手可能)を参照されたい。
(c)脈拍リズム:特に(それだけに限らないが)ECG作業と組み合わされる場合、不規則な心拍リズムが検出され得る。休止後の脈動振幅の心拍間変動は、不規則なリズムを示し得る。ECGが使用可能であることにより、脈動到達時間の計算、血管緊張の別の指標が可能となり、それによって、覚醒、呼吸努力、または交感神経緊張に関する任意の結論についての感度および特異性を高めることができる。心拍数変動の指数は、交感迷走神経バランス(sympathovagal balance)を推測して、脈拍間隔から計算することができる。HRV(heart-rate variability(心拍数変動))データ中のフラクタル成分は睡眠覚醒状態を識別することができる。
(d)波形:波の形態は、動脈のカテーテル圧信号または圧平眼圧計で見られものと類似の情報を含む。たとえば、切痕の位置および相対的振幅は、末梢循環からの圧力波反射の度合いおよびタイミングを示すことができ、それ自体、血管運動性緊張(vasomotor tone)(SNS)の指標である。静脈拍動は、複数の要因間の相互作用を表す波形においても明らかであり得るが、本発明の場合、過度のCPAP(増加した中心静脈圧)またはうっ血性心不全の改善(減少した中心静脈圧)の影響を示すことができる。プレスチモグラムの一次微分波形(first-derivative)は、領域への動脈流に密接に関連し、波形の二次微分波形は、血管作用および動脈コンプライアンスの指標として提案されてきた。
【0035】
生のPPGから上記パラメータを抽出するための方法、たとえば時間領域または周波数領域信号処理技術、あるいはその両方の要素が存在する。一例は、生のPPGから呼吸信号および動脈緊張情報を抽出するために連続ウェーブレット変換を使用する、国際公開第03/00125号パンフレットおよび国際公開第04/075746号パンフレットで教示された方法である。PPGからのベースライン変動評価の時間領域解析は、Shamir他、British Journal of Anaesthesia 1999、82(2):178〜181頁により要約されている。
【0036】
オキシメータ信号処理の最近の進歩によって、装置の性能は、移動および低い灌流を伴って提示される場合により堅牢であることができる。現代の組込み型のプロセッサは、プレチスモグラフの波形のより精巧な後処理を可能にし、最も高度なオキシメータ技術でさえ、OEMモジュール形式として使用可能である。これらの技術進歩は、療法装置からの情報と組み合わせたプレスチモグラムに存在する基礎となる情報と共に、呼吸装置がサーボ制御療法の一環としてオキシメータを使用することを可能にし得る。
【0037】
プレスチモグラムに存在する情報は、脱飽和として明らかでないかもしれない覚醒を示し得るので、診断のみの研究にとっても有用かもしれない。
【0038】
呼吸の影響は、呼吸のタイミング情報を抽出するために使用されることもできる「呼吸洞性不整脈」と呼ばれる心拍タイミングの変動として認識されることもできる。
【0039】
本発明の一態様は、呼吸療法装置のためのリアルタイム制御アルゴリズムを強化するために、(1)オキシメータプレスチモグラフから導出されたパラメータと、(2)呼吸の流れ情報とを組み合わせることに関する。
【0040】
この構成は、アルゴリズムによって適切な療法が定められることを可能にする、患者の急性状態のより完全でタイムリーな推定を可能にするならば、現在の技術より優れていると判明し得る。またパラメータは、長期的な患者管理のために設定されたより豊富なデータを医師に提供するために、任意選択により流れ発生器内に格納される。これは、睡眠の研究において得られるものに類似した、監視されていない環境で使用される流れ発生器からのデータがそれによって医師に提供されるので、現在の技術より優れている。
【0041】
滴定および長期的な患者管理に役立つプレチスモグラフのパラメータは、上述したすべてのパラメータ(患者努力、血管コンプライアンス、心拍数変動、不整脈検出、静脈拍動およびSpO2)を含む。
【0042】
本発明の一実施形態によれば、パルスオキシメータ信号10は、信号プロセッサ20、たとえば、ローパスフィルタ、ピーク検出、最下点検出または平均化を介して供給される。フィルタは、心拍数を示す信号を取り除き、呼吸数を示す信号を残すように設計される。
【0043】
努力信号は、パルスオキシメータから導出されると、図2に示すように複数のやり方で使用することができ、それについて以下でより詳細に述べる。
(i)開放性-閉塞性の無呼吸の区別。プレチスモグラフにより導出された呼吸努力推定は、無呼吸の発作時に(呼吸流れのデータを使用して)、無呼吸が開放性(非閉塞性)か、それとも閉鎖性(閉塞性)か、自動滴定アルゴリズム論理に役立つかどうか示すために使用することができる。たとえば、低いかまたはゼロの流れの信号は無呼吸を示す。無呼吸が、パルスオキシメータで測定される努力が存在しないときに発生する場合は、無呼吸は「開放性」と見なされる。しかし、努力がある場合は、無呼吸は「閉鎖性」と見なされる。
(ii)高気道抵抗。同様に、オキシメータプレチスモグラフから導出された高い呼吸努力が、減少した呼吸流れ、または流れの制限(流れの波形によって推測される)と組み合わされた期間は、呼気の流れの制限または上気道抵抗によるものならば、かなりの気道抵抗の存在を意味することがある。両方の場合において、高い努力と、測定された低い呼吸の流れの組合せは、加えられるPEEP(positive end expiratory pressure(呼気終末陽圧))を増加させるための指標であり得る。
(iii)呼吸の相対的仕事量:呼吸の流れの制限(呼吸の流れの波形または予想量から判断される)がない場合、持続的な高い呼吸努力は、不適当な圧補助(換気不足)を示し得る。
(iv)(米国特許第6484719号明細書に記載されるような)流れに基づいた位相の尺度と共に使用すること。
(v)ResMed社のAutoSet CPAPアルゴリズムを強化するための努力波形の使用。増加している患者努力は、差し迫った上気道不安定性を示す。増加した患者努力に基づくAutoCPAP滴定は、現在の平滑化ベースのアルゴリズムより、閉塞の予防性が高いものであり得る。
(vi)加えられるPEEPの滴定のため努力情報をResMed社のVPAPまたはAutoCS装置においてアルゴリズムの基礎として使用すること。吸気波形に基づく滴定アルゴリズムは、呼吸周期中に圧を変更する装置の中で使用される場合、課題となることが考えられる。患者努力の変化は、呼吸内の圧変化に依存せず、したがって、これらのタイプの療法に対して堅牢であるはずである。
(vii)患者が過剰換気を受けたことの早期指標として努力波形を使用すること。これは、目標レベルを達成するため人工呼吸器が患者の換気を増大させる、不適切なサーボ換気のあり得る結果かもしれない。この指標は、目標換気を滴定するために使用することができる。
(viii)OSAおよび心不全のある患者のためにResMed社のAUTOSET CPAPアルゴリズムへの入力として静脈拍動を使用すること。静脈拍動の増加は、加えられるCPAP圧をより安全な範囲に制限するために使用することができる。
(ix)ResMed社のCPAPアルゴリズムへの入力として血管コンプライアンスを使用すること。血管コンプライアンスの変化は、患者の覚醒を示し得る。これは、自動的にCPAPレベルを定めるために現在使用されているデータを強化するために使用することができる。
(x)呼吸努力の推定を呼吸装置自体の呼吸相の推定(ResMed社のAutoCS2およびAutoVPAPで使用されるパラメータ)と比較することによって、呼吸装置においてより堅牢な呼吸追跡手法を可能にすることができ、たとえば、それは、漏れ拒絶反応または漏れの推定を向上させ得る。
(xi)睡眠状態-ノンレム睡眠の検出。レム睡眠は、HRVのフラクタル成分の覚醒期間に類似する(http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=12059594; http://ajpheart.physiology.org/cgi/reprint/280/1/H17; http://ajpheart.physiology.org/cgi/reprint/283/1/H434を参照)が、しかし、ノンレム睡眠段階は、覚醒とは著しく異なる。HRVデータは、患者がレム睡眠に達する前にノンレム睡眠を通過するに違いないので、睡眠開始を示すために解析され得る。PPGは本質的に、心臓周期を監視するものであり、この周期情報が平均化されないならば、従来のHRV解析を行なうために使用することができる。HRVから睡眠/覚醒を区別する1つの方法が、Ivanov他、Europhysics Letters 1999、48(5):594〜600頁により教示されている。
【0044】
プレチスモグラフの波形の解析は、恐らく、監視された他の変数と組み合わせて、心臓血管の予後診断不良に独立に関連付けられる、動脈硬化の減少のためCPAPまたはVPAP(Variable Positive Airway Pressure)療法を最適化するのに使用されてもよい。たとえば、
(i)心原性の呼吸流の信号のタイミングをプレチスモグラフパルスのタイミングと組み合わせることによって、脈動到達時間の相対的な変動を、従来のPTT(pulse transmission time(脈波伝播時間))の推定よりも正確に計算することが可能であり得る。心拍タイミング情報のためにECGを使用する従来の方法は、前駆出時間および脈動到達時間の両方を含む。対照的に、心原性の流れは、実際の心室の駆出によって引き起こされる。正確なPTT推定は、プレチスモグラフだけの情報に追加の情報を提供して、動脈緊張/SNS活動、および/または呼吸努力の推定に寄与し、動脈コンプライアンスの最適化を目標とする閉ループ療法を可能にし得る。
(ii)プレチスモグラフ波形の形態は、血管コンプライアンスに直接関連する情報、たとえば最初の収縮期ピークに関するいわゆる「切痕」の位置を提供して、動脈コンプライアンスの最適化を目標とする閉ループ療法を可能にし得る。
【0045】
図3〜7を参照して、
療法アルゴリズムの調整は、
・PEEP/CPAPのレベル
・圧補助のレベル
を含み得ることに留意されたい。
【0046】
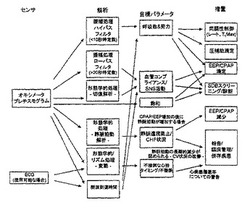
2つのフィードバック(FeedBack)信号F/B 1およびF/B 2に関して、
F/B 1(気流により推測される患者パラメータ)は以下、すなわち
・詳細な換気推定
・吸気流の制限(たとえばUA平滑化指数)
・呼気流の制限(たとえば呼気流波形の形態)
・一回換気量
・漏れ
・心臓のタイミング(心原性の流れから抽出された収縮期駆出の時間)
・呼吸相
のうちのいずれかまたはすべてを含み得ることに留意されたい。
【0047】
F/B 2(PPGから推測された患者パラメータ)は以下、すなわち
・呼吸努力の相対的表示(たとえば高い努力は、PPGの呼吸ベースライン増加の変動、奇脈につながる)
・呼吸数の絶対的表示
・呼吸制御異常または無呼吸タイプを示す呼吸努力のパターンおよび数(呼吸努力の漸増漸減、呼吸パターンからの統計的逸脱)
・呼吸数の表示(たとえばPPG振幅およびタイミングパラメータの変動)
・心臓機能悪化の相対的表示(たとえば心臓の代償不全は、PPGの呼吸ベースライン増加の変動、奇脈をもたらす)
・静脈性うっ血の相対的表示(たとえばPPG-形態解析における静脈拍動の度合い)
・交感神経系活動または動脈コンプライアンスの相対的変動(たとえば、>20〜30秒の時間尺度にわたるPPG脈動振幅の変動、または切痕の位置の変化)
・標準のパルスオキシメトリ(SpO2)
・収縮期脈拍の末梢への到着時(たとえばPPGの収縮期上昇など)
・脈拍数
のうちのいずれかまたはすべてを含み得る。
【0048】
臨床目標は、
・最低換気(たとえば呼吸機能不全、肥満低換気症患者)
・名目換気(たとえばチェーン‐ストークス型呼吸患者)
・最適同調性
・睡眠の質(すべての患者)
・長期的な心臓機能(たとえばCHF(chronic heart failure(慢性心不全))/CSR/高血圧患者)
・心不全の予想/予測(たとえばCHF患者)
・最適な動脈コンプライアンス
・最小CPAP/EEP/PEEP
・最大CPAP/EEP/PEEP
・最小圧補助
・最大圧
・最大平均圧
を含み得る。
【0049】
図3Aは、本発明の一実施形態による監視システムの概要図である。フィードバック信号F/B 1およびF/B 2、ならびに「結合型処理」ボックスに関して、
F/B 1(気流から推測された患者パラメータ)は以下、すなわち
・吸気流の制限(たとえばUA平滑化指数)
・呼気流の制限(たとえば呼気流の波形形態)
・心拍タイミング(心原性の流れから抽出された収縮期駆出の時間)
・呼吸相
・呼吸振幅の時間経過および導出された統計
のうちのいずれかまたはすべてを含み得ることに留意されたい。
【0050】
F/B 2(PPGから推測された患者パラメータ)は以下、すなわち
・呼吸努力の相対的表示(たとえば高い努力は、PPG-の呼吸ベースライン増加の変動、奇脈につながる)
・呼吸数の絶対的表示
・心臓機能の悪化の相対的表示(たとえば心臓の代償不全は、PPGの呼吸ベースライン増加の変動、奇脈をもたらす)
・静脈性うっ血の相対的表示(たとえばPPG形態解析における静脈拍動の度合い)
・交感神経系活動または動脈コンプライアンスの相対的変動(たとえば、>20〜30秒の時間尺度にわたるPPG脈動振幅の変動、または切痕の位置の変化)
・標準のパルスオキシメトリ(SpO2)
・収縮期脈拍の末梢への到着時(たとえばPPGの収縮期上昇など)
・脈拍数
のうちのいずれかまたはすべてを含み得ることに留意されたい。
【0051】
結合型処理(combined processing)は、
・たとえば循環遅延を推測するための呼吸変化(F/B 1)と血液ガス調整(F/B 2)との間の遅延
・心原性の流れの脈拍(F/B 1)と脈拍の末梢への到達(F/B 2)との間の遅延によって示される脈波到達時間(PTT)
を含み得る。
【0052】
臨床監視目標は、
・SDBの評価
・睡眠の質の評価(すべての患者)
・患者管理の付属物としての心臓機能(たとえばCHF/CSR/高血圧患者)の評価
を含み得る。
【0053】
図4〜7は、本発明の様々な実施形態を実施する複数のアルゴリズムを示している。本発明の実施形態は、たとえば患者の呼吸および/または心臓の活動に関する1つまたは複数のパラメータ、たとえばパスルオキシメトリおよび/または気流を、非侵襲的なやり方で監視するための方法および/または装置の形を取り得る。
【0054】
監視される1つまたは複数のパラメータは、診断のため、たとえばデータの記録、報告もしくは警報の作成、または別のやり方で医師に知らせるために使用されてもよい。さらに、または代替案では、監視されるパラメータの値は、ブロワ、人工呼吸器などから患者への加圧型ガスの供給(たとえばタイミング、流圧)を制御するため、たとえば停止し、開始しまたは変化させるために使用されてもよい。
【0055】
図4は、開放性/閉塞性気道無呼吸アルゴリズムを示している。気流信号が分析され、それが正常な範囲内にあるかどうか判断される。そうである場合は、CPAP/EPAP(end-expiratory positive airway pressure(呼吸端陽気道圧))療法がその現在のレベルで維持される。気流信号が正常でない、たとえば無呼吸の表示が低い場合は、努力信号が解析される。努力が高い場合は、閉塞性無呼吸が示されていることがあり、適切な療法は治療圧を増加させることである。
【0056】
図5は、一般的な呼吸機能不全を患う患者のためのアルゴリズムを示している。このアルゴリズムは、圧補助または呼気終末圧(EEP)をいつ変化させるべきかを定義する。
【0057】
図6は、心仕事量を評価するための監視システムの一部であり得るアルゴリズムを示している。心臓病患者は、CPAP療法を受けており、図6のアルゴリズムを用いた追加の監視装置を有してもよい。あるいは、CPAP装置は、パルスオキシメータを組み込んでもよい。2つの信号F/B 1およびF/B 2が解析される。値が、SNS活動の高いレベル、または代償不全(乏しい心仕事量)を示す場合、警告が生成される。警告は、可聴アラームの形であっても、医師に報告するメッセージングシステムの一環であってもよい。
【0058】
図7は、CPAP療法中の心臓病患者のためのアルゴリズムを示している。このアルゴリズムは、図4のアルゴリズムに類似する。しかし、それは、静脈性うっ血がパルスオキシメータを用いて監視される追加のステップを有する。静脈性うっ血が悪化している場合、CPAP圧が増加されないが、前のレベルに戻される。
【0059】
図8は、呼吸数情報に基づいてNPPV(Non-invasive Positive Pressure Ventilation(非侵襲的陽圧換気))療法のレート設定を初期化するための手順を示している。好ましくは、これは、オキシメータプローブ(F/B 2)を付けた後に行なわれるが、換気を始める前に付けることができる。
【0060】
図9は、心原性の流れの振幅をはっきりと識別することに基づいて、NPPV療法のトリガ閾値設定を初期化するための手順を示している。好ましくは、これは、たとえば換気が始められると実施され、したがって、呼吸流の信号が使用可能である。
【0061】
従来のオキシメトリデータ(飽和、心拍数、心拍タイミング情報)と、呼吸タイミングおよび努力情報(PPGの追加処理、および/または鼻または口鼻カニューレデータの追加から推測される)との組合せは、新しい診断の可能性を可能にし得る。たとえば、
・循環遅延(呼吸変化と飽和変化との間の遅延)、恐らくは心不全の重症度または心臓の代償不全の表示である。
・呼気終末の鼻圧変換器によって見られる(鼻孔で見られる)心原性の流れの心拍と、心拍の末梢への到達(オキシメータプレチスモグラムから)との間の遅延を介した真の脈波到達時間(PTT)。PTT測定は、覚醒の指標(交感神経流出およびBP(blood pressure(血圧))の一時的な増加)、および恐らく、より長い期間にわたって見られる場合の平均BP/平均交感神経活性化の指標である。従来PTTは、中心心拍タイミング(心収縮)についてはECG、および末梢心拍タイミングについてはPPGに基づいて計算されている。中心心拍タイミングについて心原性の流れを使用することには、心原性の流れ(cardiogenic flow(CGF))が左心室の電気的な活性化ではなく、機械的駆出(肺から鼻への固定の伝播遅延を伴う)を表し、したがって測定から前駆出期を取り除くという点で、ECGから導出されたPTTに勝る利点があり得る。前駆出期は、ECGから導出されたPTT測定の感度を損なうことがあると知られている。呼吸の周期の一貫した部分(それが最も容易に見られる場合には呼気終末)でCGFを得ることによって、呼吸によって引き起こされるPTTの変動は無視され得る。それは、その両方がPPTを短縮し、またその両方が覚醒に関連している、BP変動または動脈緊張の増加(交感神経の活性化)のいずれかによるPTT変動だけを残し、したがって別の重要なSBD(sleep-breathing disorder(睡眠中呼吸障害))パラメータが提供される。
・生のPPG(奇脈)から呼吸努力情報を抽出することによって、単純な診断システムが、睡眠段階付け以外のSBDスクリーニングに必要なすべての重要な情報、すなわち呼吸パターン、酸素飽和度、覚醒(PTT)または増加したSVR(systemic vascular resistance(全身血管抵抗))、および高い努力の期間(無呼吸の区別、およびRERA(Respiratory Efforts Related Arousals)分類)を提供することができる。このシステムは、導出された信号の相対的重要度に応じて、鼻圧変換器を含んでも、含まなくてもよい。鼻の気流は、呼吸努力と組み合わされて、中枢性と閉塞性の無呼吸の単純明快な区別を可能にするが、信号処理は、PPGからの情報、たとえば脱飽和の時間経過と比較した呼吸努力の時間経過、または呼吸努力の時間経過の統計的解析からの情報を組み合わせることから同じ情報を収集してもよい。
【0062】
本発明の態様がどこで使用され得るかについての他の具体的な例には、以下が含まれる。
(a)呼吸相を追跡し予測し、また人工呼吸器トリガに予測を使用するために、呼吸に関する心臓の変化(たとえば「呼吸の洞性不整脈」)を使用すること。こうした変動は、PPGで都合よく検出され得るが、ECG電極などの他の心臓の監視装置によって検出されることもできる。一般に、心仕事量に課される呼吸の変動は、人工呼吸器トリガとして使用するには生じるのが遅すぎ、すなわち、人工呼吸器は理想的には、早期の吸気、好ましくは患者の初期の吸気努力の100ミリ秒以内に一致する呼吸補助を提供する。人工呼吸器は一般に、トリガとして、吸気の流れまたは気道圧の変動を監視する。重度の閉塞性呼吸器疾患(たとえばCOPD(chronic obstructive pulmonary disease(慢性閉塞性肺疾患))では、呼吸流または圧についての情報は、吸気タイミングの不十分な指標である。こうした障害では、呼吸活動へ代替の「窓」が、優れた結果を提示し得る。呼吸、特に苦労を伴う呼吸は、心拍タイミングおよび心拍出量に影響すると知られている。前の呼吸周期にわたって心仕事量を監視し、心臓についての情報から呼吸相の信号を導出することによって、呼吸信号を抽出する待ち時間が過大(たとえば1息を超える遅延)でないならば、次の吸気努力のタイミングが予測され得ることが提案される。脈拍の中枢-末梢伝播時間は一般に約200ミリ秒(脈波到達時間)であり、せいぜい心臓周期は、呼吸相の低いサンプル数(1息当たり約4〜6拍)の推定を提供するであろう。したがって、呼吸相の予測が0.5息より早く事前に行われ得る可能性は低く、したがって、正確な吸気タイミングを提供することができない。しかし、こうした方法は、COPDなどの病状においてかなりの有用性を依然として提供することができ、この方法では、呼吸の流れを介した人工呼吸器の同期は従来非常に遅延され、また呼吸のタイミングは、通常の呼吸よりも同調されることができる(したがって、予測可能性は潜在的に大きくなる)。
(b)スクリーナ装置内で睡眠開始を、または療法装置内で睡眠構造を推測するために、HRV解析を使用すること。
(c)カスタマイズされたPPG監視を備えた人工呼吸器システム内で、(PPG振幅減少から推測された)心拍出量の劇的な低下を検知し、警報をアサートすること。心拍出量の低下は、臨床的に関連した多くの状況、たとえば血液量減少(Yamakage、Can J Anesth 2005 52(2):207頁)、動的な過膨張/空気トラッピング(Perel、BJA 76(1):168〜169頁)(Conacher、Lancet 1995 346:448頁)を有する患者に過度の正圧を加えることの結果であり得る。
【0063】
患者にとっての利点には、たとえば、より心地よく、使い易いことが含まれる。本発明の態様は、センサを備えず(festoon)に最適な療法を提供し、たとえば指または耳のプローブで十分である。医師にとっての利点には、たとえば管理が容易であることが含まれる。本発明の態様は、単純な適用例、自動化された治療、および長期的な患者管理フィードバックを提供する。他の利点には、それほど高価でなく、療法が向上されることが含まれる。
【0064】
本発明について特定の実施形態を参照して述べたが、これらの実施形態は、本発明の原理の適用例を例示するものにすぎないことを理解されたい。本発明において多数の修正が加えられてもよく、また本発明の思想および範囲から逸脱せずに、他の構成が考案されてもよい。たとえば、必ずしも流れの平坦化を伴わずまたはそれに関連しない、上気道の不安定性、抵抗または閉塞の他の表示があることが当業者には理解されよう。
【0065】
また、上述の様々な実施形態は、他の実施形態と併せて実施されてもよく、たとえば、一実施形態の態様が、さらに他の実施形態を実現するために別の実施形態の態様と組み合わされてもよい。さらに、本発明は、OSAを患う患者への特定の適用例を有するが、他の病気(たとえばうっ血性心不全、糖尿病、病的肥満、卒中、肥満症外科など)を患う患者が、上記教示から利益を得ることができることを理解されたい。さらに、上記教示は、非医学的な適用例において、患者および非患者に同様に適用することができる。
【符号の説明】
【0066】
10 パルスオキシメータ信号
20 信号プロセッサ
【技術分野】
【0001】
本発明は、睡眠呼吸障害(Sleep Disordered Breathing(SDB))に関連するパラメータの監視に関する。
【0002】
関連出願の相互参照
本出願は、それぞれが参照により本明細書にその全体が組み込まれている、2004年10月6日に出願した米国特許仮出願第60/615961号明細書、および2004年11月22日に出願した米国特許仮出願第60/629612号明細書の優先権を主張するものである。
【背景技術】
【0003】
睡眠呼吸障害(SDB)は従来、閉塞性睡眠時無呼吸(Obstructive Sleep Apnea(OSA))およびチェーン‐ストークス型呼吸(Cheyne-Stokes Respiration(CSR))と識別されていた。現在、たとえば心疾患、卒中および糖尿病などを含めて、やはりSDBと関連していると認識される他の複数の状態がある。これらの状態およびSDBを有する患者は、何らかの形の人工呼吸器による陽圧換気補助を用いてSDBを治療することから恩恵を受けることができる。
【0004】
基本的な経鼻的持続気道内陽圧(Continuous Positive Airway Pressure(CPAP))人工呼吸器は一般に患者を監視しなくてもよいが、患者は、何らかの種類の制御ループの一環として患者を監視する装置を有することから恩恵を受ける。具体的には、圧、流れおよび患者の努力を監視するための装置が知られている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】米国特許第6445942号明細書
【特許文献2】米国特許第6091973号明細書
【特許文献3】米国特許第6363270号明細書
【特許文献4】米国特許第5704345号明細書
【特許文献5】米国特許第6484719号明細書
【特許文献6】国際公開第01/000264号
【発明の概要】
【発明が解決しようとする課題】
【0006】
知られている装置の既存の問題は、閉塞性睡眠時無呼吸(OSA)と中枢性睡眠時無呼吸(central sleep apnea(CSA))とを区別することを含む。OSAは、上気道虚脱を示しており、2段式の装置で使用される加えられるCPAP圧または呼気終末圧(end-expiratory pressure(EEP))の自動滴定アルゴリズムへの入力として使用することができる。CSAは、過剰換気を示すことができ、したがって、患者の換気を自動滴定するアルゴリズムへの入力として使用することができる。明らかに、無呼吸を閉鎖性または開放性として誤って分類すると、これらの滴定アルゴリズムによって、患者の治療にとって最適には至らないパラメータが定められることになる。
【0007】
閉塞性と中枢性の睡眠時無呼吸は、知られている装置では、1cmの最大振幅4Hz振動を治療圧波形に注入し、結果として生じる4Hzの流れを測定することによって区別される。圧波形への流れの位相差は負荷のコンプライアンスを示すものであり、次いで、この負荷コンプライアンスは、上気道が開いているか、それとも閉じているかを推定するために使用される。しかし、この方法は、4Hzが、患者が知覚し得る周波数帯の範囲内に入り易いので、患者にとっては不快である。また、この方法は、上気道狭窄/閉鎖、および同時中枢性睡眠時無呼吸を含むイベントに関する情報を提供しない。
【0008】
閉塞性と中枢性の睡眠時無呼吸は、既知の装置では、心原性の流れを検出することによっても区別される。心原性の流れは、肺が心臓の近くにあることにより、心臓の鼓動時に肺の中で引き起こされる気流である。したがって、OSAの間、心原性の流れは決して生じない。上記の解決策と同様に、CSAとOSAが同時に生じたかどうか判断することはやはり不可能である。
【0009】
知られている装置に関する別の既存の問題は、高い患者呼吸努力を推測することを含む。患者の呼吸努力は、睡眠時無呼吸、閉塞性の肺病、および様々な拘束性疾患を含む、複数の疾病の患者の急性状態を評価するときに臨床医によって使用される重要な指標である。それは、その知られている有用性にもかかわらず、関与する変換器が不便であり、または非実用的であるため、流れ発生器(flow generator)滴定アルゴリズムへの入力としても、記録された臨床パラメータとしても普及していない。
【0010】
努力監視の精度に関する「ゴールドスタンダード」は、患者が飲み込むよう求められる、食道カテーテルである。残念なことに、これは、患者にとって不快で厄介なものであり、臨床外では実用的でない。努力を監視するための患者の胸部および腹部の周りの呼吸バンドが知られている。胸骨上切痕の努力センサもまた、EMG(electromyogram(筋電図))およびECG(electrocardiogram(心電図))センサの使用と同様に知られている。これらの技術はすべて、家庭での使用には適していない。
【0011】
知られている装置に関する別の既存の問題は、心臓の後負荷、血管緊張、心拍変動、交感神経系活動全般および/または中心静脈圧など、血管特有のパラメータを測定し格納することを含む。これらのパラメータは、流れ発生器内でリアルタイムに利用可能であるならば、(a)自動滴定アルゴリズムへの寄与、および(b)医師が長期的傾向を観察し、患者の長期的管理を決定するためのより豊富なデータセットを有することを可能にするための呼吸特有のパラメータを付けた記録のために使用されるであろう。
【0012】
しかし、知られている装置に関するさらに別の既存の問題は、平均マスク圧を制限することを含む。OSAまたは上気道抵抗シンドローム(upper airway resistance syndrome(UARS))を取り除くことを目的とする自動滴定CPAPアルゴリズムは、上気道狭窄を制限するために、呼吸流の解析を使用することができる。一定レベルを超えた圧は、患者によっては、心臓機能に有害なことがある。同様に、より低い圧は、上気道の完全な閉鎖が結果として生じないならば、心臓機能に有益であり得る。呼吸療法(たとえばCPAP圧)が連続的に最適化され得るように、自動滴定の手法に心血管パラメータを含めることは望ましい。こうしたパラメータは、心臓の後負荷、血管緊張、心拍変動、交感神経系活動全般および/または中心静脈圧を、それらが非侵襲的にかつ都合よく取得されることができるならば含んでもよい。
【0013】
ResMed社のAutoSet CSおよびAutoSet CS2装置は、具体的には、心疾患の患者を対象とする。これらの装置は、15cmH2Oの最大平均圧を課すことによって、「過度のCPAP圧」の問題に対処する。
【0014】
知られている別のセンサは、胸骨上切痕の努力センサである。米国特許第6445942号明細書(Berthon-Jones)を参照されたい。無呼吸および呼吸低下を監視するための知られている他の技術は、米国特許第6091973号明細書(Colla他)および米国特許第6363270号明細書(Colla他)に記載されている。関連する別の米国特許は、とりわけ開放性と閉鎖性の気道無呼吸の区別について記載している米国特許第5704345号明細書(Berthon-Jones)である。米国特許第6484719号明細書(Berthon-Jones)は、流れセンサを使用するサーボ人工呼吸器について記載している。これらのすべての特許の内容が、相互参照により本明細書に明示的に組込まれている。
【課題を解決するための手段】
【0015】
本発明の第1の態様によれば、人工呼吸器装置の設定が、パルスオキシメータプレチスモグラフィ(pulse oximeter plethysmography(PPG))から導出されたパラメータに従って調整される。調整される人工呼吸器装置の設定は、呼気圧、補助レベル、立上り時間のうちの1つまたは複数を含み、人工呼吸器波形が調整され得る。パルスオキシメータプレチスモグラフィから導出されるパラメータは、心拍、努力、心臓の後負荷、血管緊張、心拍変動、交感神経系活動全般および中心静脈圧のうちの1つまたは複数を含む。ある形では、人工呼吸器の平均治療圧は、パルスオキシメータプレチスモグラフィから導出されたパラメータに従って調節される。別の形では、人工呼吸器の平均治療圧は、パルスオキシメータプレチスモグラフィが患者の血管系が緊張状態になっていることを示す場合に減少される。
【0016】
本発明の第2の態様によれば、パルスオキシメータプレチスモグラフィが、患者の努力を測定するために使用され、患者努力信号は、患者に提供される陽圧療法を制御する、フィードバックコントローラへの入力として使用される。
【0017】
本発明の第3の態様によれば、パルスオキシメータが、開放性と閉鎖性の気道無呼吸を区別するために、気流信号と共に使用される。
【0018】
本発明の第4の態様によれば、患者の努力の尺度は、パルスオキシメータプレチスモグラフ信号から導出され、この努力尺度は、サーボ人工呼吸器の制御変数として使用される。患者努力の尺度が増加するときは、圧補助は減少され、患者努力の尺度が減少するときは、圧補助は増加される。
【0019】
本発明の別の態様は、閉塞性と中枢性の睡眠時無呼吸を区別し、高い患者呼吸努力を推測し、血管特有のパラメータを測定し格納し、および平均マスク圧を制限する、受動的で非侵襲性の便利な方法に関する。
【0020】
本発明のさらに別の態様は、治療のために患者に提供される加圧型の呼吸可能なガスの供給を生成するように動作することができる制御可能な流れ発生器と、治療期間中の患者努力の尺度を決定し、流れ発生器の操作を制御するための入力用の患者努力信号を供給するように構成されたパルスオキシメータプレチスモグラフとを含む空気供給システム(air delivery system)に関する。
【0021】
本発明のさらに別の態様は、睡眠呼吸障害を治療するための方法に関する。この方法は、治療のために患者に加圧型の呼吸可能なガスの供給を提供すること、治療期間中の患者努力の尺度を決定し、患者努力信号を供給するためにパルスオキシメータプレチスモグラフィを使用すること、および患者努力信号からの入力に基づいて加圧型の呼吸可能ガスの供給を制御することを含む。
【0022】
対象のパラメータ(たとえば心臓の後負荷、血管緊張、心拍変動および/または中心静脈圧)は、パルスオキシメータプレチスモグラフから推定することができる。現在、パルスオキシメータは主として、SpO2(arterial oxygen saturation(動脈血酸素飽和度))および心拍数を監視するために使用されている。一部のパルスオキシメータはプレチスモグラフを表示するが、知られている限りでは、プレチスモグラフ内に存在する情報のいずれも、呼吸または心臓血管療法を自動滴定するための入力として使用されていない。末梢動脈緊張(Peripheral Arterial Tone(PAT))は、具体的には動脈緊張に焦点を当てた、新規のマルチセル指プレチスモグラフィ(multi-cell finger plethysmography)システムである。この技術は、感覚モダリティとして、パルスオキシメトリの代替物であり得る。脈波到達時間(Pulse-transit time(PTT))もまた、自律活動および動脈緊張に関する情報を含む。
【0023】
それぞれの態様は、患者の健康障害、たとえば睡眠呼吸障害、うっ血性心不全、卒中などの診断に関する1つまたは複数のパラメータを非侵襲的に監視し、かつ/または監視されたパラメータおよび/または導出された診断に従って人工呼吸器または他の呼吸療法装置を制御するための方法および/または装置の形で明示することができる。
【0024】
本発明の別の態様は、患者を治療せずに、パルスオキシメータプレチスモグラフィを使用して患者を監視することである。
【0025】
本発明のさらなる態様は、添付の特許請求の範囲に述べられている。
【0026】
本発明の他の態様、特徴および利点は、添付の図面と併せて考慮すれば、以下の詳細な説明から明らかになる。図面は、本開示の一部であり、例示するため本発明の原理を示している。
【図面の簡単な説明】
【0027】
【図1】努力信号に変換されたパルスオキシメータ波形を示す図である。
【図2】本発明の様々な実施形態によるパルスオキシメータ適用範囲を示す図である。
【図3】本発明の一実施形態による療法システムを示す図である。
【図3A】本発明の一実施形態による監視システムの概要図である。
【図4】本発明の一実施形態による、上気道閉塞(吸気流の制限)および自動EEP/自動CPAPのためのアルゴリズムを示す図である。
【図5】本発明の一実施形態による、自動EEP滴定/自動化圧補助滴定のためのアルゴリズムを示す図である。
【図6】本発明の一実施形態による、CPAP/自動CPAP/Comfort(固定の低補助2段式)装置上の心臓病患者の交感神経系(SNS)の上昇または心拍出量の減少を検出するためのアルゴリズムを示す図である。
【図7】本発明の一実施形態による、心臓病患者の自動CPAPのためのアルゴリズムを示す図である。
【図8】本発明の一実施形態による、呼吸数情報に基づいてNPPV療法レート設定を初期化するための手順を示すブロック図である。
【図9】本発明の一実施形態による、心原生の流れの振幅を確実に識別することに基づいてNPPV療法トリガ閾値設定を初期化するための手順を示すブロック図である。
【発明を実施するための形態】
【0028】
添付の図面は、本発明の様々な実施形態の理解を容易にするものである。
【0029】
パルスオキシメータプレチスモグラフィ(単純に「パルスオキシメトリ」または「フォトプレチスモグラム」と呼ばれることがある)は、血液酸素化データを非侵襲的で連続的なやり方で取得する標準の方法である。オキシメータは、ヘモグロビン飽和の値を求めるために、光の2つの波長を使用する。波形は、交流(alternating current(AC))信号を表わす、拍動性動脈血量がもたらす吸収によって作られる。非拍動性血、静脈および毛細管血によってもたらされる吸収、ならびに組織吸収が、直流(direct current(DC))信号によって示される。Hartert他、「Use of Pulse Oximetry to Recognize Severity of Airflow Obstruction in Obstructive Airway Disease, Correlation with Pulsus Paradoxus」、Chest 1999:115:475〜481頁を参照されたい。Hartert他からのパルスオキシメータ信号が、図1に示されている。
【0030】
現在、パルスオキシメータは主として、SpO2および心拍数の監視のために使用されているが、しかし、発明の一実施形態によれば、パルスオキシメータは、呼吸療法装置において患者努力の表示として使用される。呼吸努力は、動脈圧波形において、ピーク間振幅の変動として見られ得る。これは、呼吸周期を通じた心拍出量に対する呼吸胸腔内圧の変動の影響によって引き起こされる。吸気は、低下した収縮期血圧に関連し、血圧に対するこの呼吸の影響は、「奇脈(pulsus paradoxus)」と呼ばれる。
【0031】
この影響は、様々な領域(喘息悪化、閉塞性の肺疾病)において呼吸負荷の尺度として提案されてきており、この尺度では、>10mmHgの変動は高い呼吸努力に関連付けられる。動脈圧を測定するための参照基準(reference standard)は、侵襲性(カテーテル)であり、したがって間接的な方法が望まれる。1つのそのような方法は、脈動到達時間(PTT)であり、この脈動到達時間では、血圧の変動は、心臓から末梢へのパルスの伝播時間として変換される、血管コンプライアンスの変動を引き起こす。別の方法は、感知されている組織層(通常指または耳)の動脈血量に関する、オキシメータプレチスモグラフ波形である。呼吸周期を通じての心拍出量の変化は、動脈圧観察と整合の取れた、プレチスモグラムのピーク間振幅の変動として認識され得る。この心拍出量変動は、呼吸による中心静脈圧の変動と相まって、呼吸と同期の取れたPPG信号のベースライン/オフセットの変化をも引き起こす。PPGで見られる第3の要因が呼吸の影響を受け、すなわち心臓周期も呼吸により、主として呼吸神経系の流出を介していくらか調節され、また呼吸によって引き起こされた動脈圧変動に反応して、それほどにではないが調節される。
【0032】
パルスオキシメータプレチスモグムが組織中の血量により深く関連しているので、拍動要素のベースライン/オフセットの変動は、心拍出量変動より感度の高い、心肺相互作用の指標であり得る(Hartert他、「Use of Pulse Oximetry to Recognize Severity of Airflow Obstruction in Obstructive Airway Disease - Correlation With Pulsus Paradoxus」、Chest 1999、115:475〜481頁)。
【0033】
他の要因(動脈緊張、心仕事量、姿勢変化)もまた、PPGの変動を引き起こすことがあり、したがって、呼吸頻度にわたる変動を解析するための処理が必要であり、それには、流れ発生器から提供される呼吸流の情報にその変動を相関させることがさらに役立ち得る。PPplethの段階的な増加(プレチスモグラフからの奇脈)は、差し迫った上気道(upper airway(UA))虚脱に関連した増加している努力を示していることがある。PPplethの劇的な増加は、UA閉塞を示していることがある。
【0034】
波形は、以下のカテゴリに分類される。
(a)脈動振幅:脈拍のAC振幅は、血管コンプライアンスを最もよく示すものであり、この血管コンプライアンスは、20〜30秒以上にわたって調べられるとき、動脈緊張/交感神経系活動によって大きく影響される。したがって、それは、無呼吸からの覚醒を示すことができ、また多くの日/週にわたっては、SNS(sympathetic nervous system(交感神経系))活動時のOSA/UARSを止めることの長期的利益を示し得る。指は、血管コンプライアンスに対する自律活動の影響を検出するのに最良の場所である。耳のパルスオキシメトリは、自律活動に対する感度は小さくなるが、血管コンプライアンスがより小さい効果を及ぼすことを考慮すると、相対的な血圧変動の推定を提供することができる。
(b)オフセットまたはベースライン:呼吸は、呼吸努力(昇圧反応)に応じて変化する、脈拍のベースラインの相の変動(奇脈)を引き起こす。この影響は、気道抵抗(喘息)および閉塞(閉塞性の肺疾病)を識別するために使用されてきた。従来のプレチスモグラフによる奇脈測定方法の比較(Clark J他、Arch Pediatr Adolesc Med 2004、158:48〜51頁)、および閉塞性気道疾患の気流閉塞の重症度、奇病との相関を認識するためのパルスオキシメトリの使用(Hartert他、Chest 1999、115:475〜481頁、オンラインhttp://www.chestjournal.org/cgi/reprint/115/2/475で入手可能)を参照されたい。
(c)脈拍リズム:特に(それだけに限らないが)ECG作業と組み合わされる場合、不規則な心拍リズムが検出され得る。休止後の脈動振幅の心拍間変動は、不規則なリズムを示し得る。ECGが使用可能であることにより、脈動到達時間の計算、血管緊張の別の指標が可能となり、それによって、覚醒、呼吸努力、または交感神経緊張に関する任意の結論についての感度および特異性を高めることができる。心拍数変動の指数は、交感迷走神経バランス(sympathovagal balance)を推測して、脈拍間隔から計算することができる。HRV(heart-rate variability(心拍数変動))データ中のフラクタル成分は睡眠覚醒状態を識別することができる。
(d)波形:波の形態は、動脈のカテーテル圧信号または圧平眼圧計で見られものと類似の情報を含む。たとえば、切痕の位置および相対的振幅は、末梢循環からの圧力波反射の度合いおよびタイミングを示すことができ、それ自体、血管運動性緊張(vasomotor tone)(SNS)の指標である。静脈拍動は、複数の要因間の相互作用を表す波形においても明らかであり得るが、本発明の場合、過度のCPAP(増加した中心静脈圧)またはうっ血性心不全の改善(減少した中心静脈圧)の影響を示すことができる。プレスチモグラムの一次微分波形(first-derivative)は、領域への動脈流に密接に関連し、波形の二次微分波形は、血管作用および動脈コンプライアンスの指標として提案されてきた。
【0035】
生のPPGから上記パラメータを抽出するための方法、たとえば時間領域または周波数領域信号処理技術、あるいはその両方の要素が存在する。一例は、生のPPGから呼吸信号および動脈緊張情報を抽出するために連続ウェーブレット変換を使用する、国際公開第03/00125号パンフレットおよび国際公開第04/075746号パンフレットで教示された方法である。PPGからのベースライン変動評価の時間領域解析は、Shamir他、British Journal of Anaesthesia 1999、82(2):178〜181頁により要約されている。
【0036】
オキシメータ信号処理の最近の進歩によって、装置の性能は、移動および低い灌流を伴って提示される場合により堅牢であることができる。現代の組込み型のプロセッサは、プレチスモグラフの波形のより精巧な後処理を可能にし、最も高度なオキシメータ技術でさえ、OEMモジュール形式として使用可能である。これらの技術進歩は、療法装置からの情報と組み合わせたプレスチモグラムに存在する基礎となる情報と共に、呼吸装置がサーボ制御療法の一環としてオキシメータを使用することを可能にし得る。
【0037】
プレスチモグラムに存在する情報は、脱飽和として明らかでないかもしれない覚醒を示し得るので、診断のみの研究にとっても有用かもしれない。
【0038】
呼吸の影響は、呼吸のタイミング情報を抽出するために使用されることもできる「呼吸洞性不整脈」と呼ばれる心拍タイミングの変動として認識されることもできる。
【0039】
本発明の一態様は、呼吸療法装置のためのリアルタイム制御アルゴリズムを強化するために、(1)オキシメータプレスチモグラフから導出されたパラメータと、(2)呼吸の流れ情報とを組み合わせることに関する。
【0040】
この構成は、アルゴリズムによって適切な療法が定められることを可能にする、患者の急性状態のより完全でタイムリーな推定を可能にするならば、現在の技術より優れていると判明し得る。またパラメータは、長期的な患者管理のために設定されたより豊富なデータを医師に提供するために、任意選択により流れ発生器内に格納される。これは、睡眠の研究において得られるものに類似した、監視されていない環境で使用される流れ発生器からのデータがそれによって医師に提供されるので、現在の技術より優れている。
【0041】
滴定および長期的な患者管理に役立つプレチスモグラフのパラメータは、上述したすべてのパラメータ(患者努力、血管コンプライアンス、心拍数変動、不整脈検出、静脈拍動およびSpO2)を含む。
【0042】
本発明の一実施形態によれば、パルスオキシメータ信号10は、信号プロセッサ20、たとえば、ローパスフィルタ、ピーク検出、最下点検出または平均化を介して供給される。フィルタは、心拍数を示す信号を取り除き、呼吸数を示す信号を残すように設計される。
【0043】
努力信号は、パルスオキシメータから導出されると、図2に示すように複数のやり方で使用することができ、それについて以下でより詳細に述べる。
(i)開放性-閉塞性の無呼吸の区別。プレチスモグラフにより導出された呼吸努力推定は、無呼吸の発作時に(呼吸流れのデータを使用して)、無呼吸が開放性(非閉塞性)か、それとも閉鎖性(閉塞性)か、自動滴定アルゴリズム論理に役立つかどうか示すために使用することができる。たとえば、低いかまたはゼロの流れの信号は無呼吸を示す。無呼吸が、パルスオキシメータで測定される努力が存在しないときに発生する場合は、無呼吸は「開放性」と見なされる。しかし、努力がある場合は、無呼吸は「閉鎖性」と見なされる。
(ii)高気道抵抗。同様に、オキシメータプレチスモグラフから導出された高い呼吸努力が、減少した呼吸流れ、または流れの制限(流れの波形によって推測される)と組み合わされた期間は、呼気の流れの制限または上気道抵抗によるものならば、かなりの気道抵抗の存在を意味することがある。両方の場合において、高い努力と、測定された低い呼吸の流れの組合せは、加えられるPEEP(positive end expiratory pressure(呼気終末陽圧))を増加させるための指標であり得る。
(iii)呼吸の相対的仕事量:呼吸の流れの制限(呼吸の流れの波形または予想量から判断される)がない場合、持続的な高い呼吸努力は、不適当な圧補助(換気不足)を示し得る。
(iv)(米国特許第6484719号明細書に記載されるような)流れに基づいた位相の尺度と共に使用すること。
(v)ResMed社のAutoSet CPAPアルゴリズムを強化するための努力波形の使用。増加している患者努力は、差し迫った上気道不安定性を示す。増加した患者努力に基づくAutoCPAP滴定は、現在の平滑化ベースのアルゴリズムより、閉塞の予防性が高いものであり得る。
(vi)加えられるPEEPの滴定のため努力情報をResMed社のVPAPまたはAutoCS装置においてアルゴリズムの基礎として使用すること。吸気波形に基づく滴定アルゴリズムは、呼吸周期中に圧を変更する装置の中で使用される場合、課題となることが考えられる。患者努力の変化は、呼吸内の圧変化に依存せず、したがって、これらのタイプの療法に対して堅牢であるはずである。
(vii)患者が過剰換気を受けたことの早期指標として努力波形を使用すること。これは、目標レベルを達成するため人工呼吸器が患者の換気を増大させる、不適切なサーボ換気のあり得る結果かもしれない。この指標は、目標換気を滴定するために使用することができる。
(viii)OSAおよび心不全のある患者のためにResMed社のAUTOSET CPAPアルゴリズムへの入力として静脈拍動を使用すること。静脈拍動の増加は、加えられるCPAP圧をより安全な範囲に制限するために使用することができる。
(ix)ResMed社のCPAPアルゴリズムへの入力として血管コンプライアンスを使用すること。血管コンプライアンスの変化は、患者の覚醒を示し得る。これは、自動的にCPAPレベルを定めるために現在使用されているデータを強化するために使用することができる。
(x)呼吸努力の推定を呼吸装置自体の呼吸相の推定(ResMed社のAutoCS2およびAutoVPAPで使用されるパラメータ)と比較することによって、呼吸装置においてより堅牢な呼吸追跡手法を可能にすることができ、たとえば、それは、漏れ拒絶反応または漏れの推定を向上させ得る。
(xi)睡眠状態-ノンレム睡眠の検出。レム睡眠は、HRVのフラクタル成分の覚醒期間に類似する(http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=12059594; http://ajpheart.physiology.org/cgi/reprint/280/1/H17; http://ajpheart.physiology.org/cgi/reprint/283/1/H434を参照)が、しかし、ノンレム睡眠段階は、覚醒とは著しく異なる。HRVデータは、患者がレム睡眠に達する前にノンレム睡眠を通過するに違いないので、睡眠開始を示すために解析され得る。PPGは本質的に、心臓周期を監視するものであり、この周期情報が平均化されないならば、従来のHRV解析を行なうために使用することができる。HRVから睡眠/覚醒を区別する1つの方法が、Ivanov他、Europhysics Letters 1999、48(5):594〜600頁により教示されている。
【0044】
プレチスモグラフの波形の解析は、恐らく、監視された他の変数と組み合わせて、心臓血管の予後診断不良に独立に関連付けられる、動脈硬化の減少のためCPAPまたはVPAP(Variable Positive Airway Pressure)療法を最適化するのに使用されてもよい。たとえば、
(i)心原性の呼吸流の信号のタイミングをプレチスモグラフパルスのタイミングと組み合わせることによって、脈動到達時間の相対的な変動を、従来のPTT(pulse transmission time(脈波伝播時間))の推定よりも正確に計算することが可能であり得る。心拍タイミング情報のためにECGを使用する従来の方法は、前駆出時間および脈動到達時間の両方を含む。対照的に、心原性の流れは、実際の心室の駆出によって引き起こされる。正確なPTT推定は、プレチスモグラフだけの情報に追加の情報を提供して、動脈緊張/SNS活動、および/または呼吸努力の推定に寄与し、動脈コンプライアンスの最適化を目標とする閉ループ療法を可能にし得る。
(ii)プレチスモグラフ波形の形態は、血管コンプライアンスに直接関連する情報、たとえば最初の収縮期ピークに関するいわゆる「切痕」の位置を提供して、動脈コンプライアンスの最適化を目標とする閉ループ療法を可能にし得る。
【0045】
図3〜7を参照して、
療法アルゴリズムの調整は、
・PEEP/CPAPのレベル
・圧補助のレベル
を含み得ることに留意されたい。
【0046】
2つのフィードバック(FeedBack)信号F/B 1およびF/B 2に関して、
F/B 1(気流により推測される患者パラメータ)は以下、すなわち
・詳細な換気推定
・吸気流の制限(たとえばUA平滑化指数)
・呼気流の制限(たとえば呼気流波形の形態)
・一回換気量
・漏れ
・心臓のタイミング(心原性の流れから抽出された収縮期駆出の時間)
・呼吸相
のうちのいずれかまたはすべてを含み得ることに留意されたい。
【0047】
F/B 2(PPGから推測された患者パラメータ)は以下、すなわち
・呼吸努力の相対的表示(たとえば高い努力は、PPGの呼吸ベースライン増加の変動、奇脈につながる)
・呼吸数の絶対的表示
・呼吸制御異常または無呼吸タイプを示す呼吸努力のパターンおよび数(呼吸努力の漸増漸減、呼吸パターンからの統計的逸脱)
・呼吸数の表示(たとえばPPG振幅およびタイミングパラメータの変動)
・心臓機能悪化の相対的表示(たとえば心臓の代償不全は、PPGの呼吸ベースライン増加の変動、奇脈をもたらす)
・静脈性うっ血の相対的表示(たとえばPPG-形態解析における静脈拍動の度合い)
・交感神経系活動または動脈コンプライアンスの相対的変動(たとえば、>20〜30秒の時間尺度にわたるPPG脈動振幅の変動、または切痕の位置の変化)
・標準のパルスオキシメトリ(SpO2)
・収縮期脈拍の末梢への到着時(たとえばPPGの収縮期上昇など)
・脈拍数
のうちのいずれかまたはすべてを含み得る。
【0048】
臨床目標は、
・最低換気(たとえば呼吸機能不全、肥満低換気症患者)
・名目換気(たとえばチェーン‐ストークス型呼吸患者)
・最適同調性
・睡眠の質(すべての患者)
・長期的な心臓機能(たとえばCHF(chronic heart failure(慢性心不全))/CSR/高血圧患者)
・心不全の予想/予測(たとえばCHF患者)
・最適な動脈コンプライアンス
・最小CPAP/EEP/PEEP
・最大CPAP/EEP/PEEP
・最小圧補助
・最大圧
・最大平均圧
を含み得る。
【0049】
図3Aは、本発明の一実施形態による監視システムの概要図である。フィードバック信号F/B 1およびF/B 2、ならびに「結合型処理」ボックスに関して、
F/B 1(気流から推測された患者パラメータ)は以下、すなわち
・吸気流の制限(たとえばUA平滑化指数)
・呼気流の制限(たとえば呼気流の波形形態)
・心拍タイミング(心原性の流れから抽出された収縮期駆出の時間)
・呼吸相
・呼吸振幅の時間経過および導出された統計
のうちのいずれかまたはすべてを含み得ることに留意されたい。
【0050】
F/B 2(PPGから推測された患者パラメータ)は以下、すなわち
・呼吸努力の相対的表示(たとえば高い努力は、PPG-の呼吸ベースライン増加の変動、奇脈につながる)
・呼吸数の絶対的表示
・心臓機能の悪化の相対的表示(たとえば心臓の代償不全は、PPGの呼吸ベースライン増加の変動、奇脈をもたらす)
・静脈性うっ血の相対的表示(たとえばPPG形態解析における静脈拍動の度合い)
・交感神経系活動または動脈コンプライアンスの相対的変動(たとえば、>20〜30秒の時間尺度にわたるPPG脈動振幅の変動、または切痕の位置の変化)
・標準のパルスオキシメトリ(SpO2)
・収縮期脈拍の末梢への到着時(たとえばPPGの収縮期上昇など)
・脈拍数
のうちのいずれかまたはすべてを含み得ることに留意されたい。
【0051】
結合型処理(combined processing)は、
・たとえば循環遅延を推測するための呼吸変化(F/B 1)と血液ガス調整(F/B 2)との間の遅延
・心原性の流れの脈拍(F/B 1)と脈拍の末梢への到達(F/B 2)との間の遅延によって示される脈波到達時間(PTT)
を含み得る。
【0052】
臨床監視目標は、
・SDBの評価
・睡眠の質の評価(すべての患者)
・患者管理の付属物としての心臓機能(たとえばCHF/CSR/高血圧患者)の評価
を含み得る。
【0053】
図4〜7は、本発明の様々な実施形態を実施する複数のアルゴリズムを示している。本発明の実施形態は、たとえば患者の呼吸および/または心臓の活動に関する1つまたは複数のパラメータ、たとえばパスルオキシメトリおよび/または気流を、非侵襲的なやり方で監視するための方法および/または装置の形を取り得る。
【0054】
監視される1つまたは複数のパラメータは、診断のため、たとえばデータの記録、報告もしくは警報の作成、または別のやり方で医師に知らせるために使用されてもよい。さらに、または代替案では、監視されるパラメータの値は、ブロワ、人工呼吸器などから患者への加圧型ガスの供給(たとえばタイミング、流圧)を制御するため、たとえば停止し、開始しまたは変化させるために使用されてもよい。
【0055】
図4は、開放性/閉塞性気道無呼吸アルゴリズムを示している。気流信号が分析され、それが正常な範囲内にあるかどうか判断される。そうである場合は、CPAP/EPAP(end-expiratory positive airway pressure(呼吸端陽気道圧))療法がその現在のレベルで維持される。気流信号が正常でない、たとえば無呼吸の表示が低い場合は、努力信号が解析される。努力が高い場合は、閉塞性無呼吸が示されていることがあり、適切な療法は治療圧を増加させることである。
【0056】
図5は、一般的な呼吸機能不全を患う患者のためのアルゴリズムを示している。このアルゴリズムは、圧補助または呼気終末圧(EEP)をいつ変化させるべきかを定義する。
【0057】
図6は、心仕事量を評価するための監視システムの一部であり得るアルゴリズムを示している。心臓病患者は、CPAP療法を受けており、図6のアルゴリズムを用いた追加の監視装置を有してもよい。あるいは、CPAP装置は、パルスオキシメータを組み込んでもよい。2つの信号F/B 1およびF/B 2が解析される。値が、SNS活動の高いレベル、または代償不全(乏しい心仕事量)を示す場合、警告が生成される。警告は、可聴アラームの形であっても、医師に報告するメッセージングシステムの一環であってもよい。
【0058】
図7は、CPAP療法中の心臓病患者のためのアルゴリズムを示している。このアルゴリズムは、図4のアルゴリズムに類似する。しかし、それは、静脈性うっ血がパルスオキシメータを用いて監視される追加のステップを有する。静脈性うっ血が悪化している場合、CPAP圧が増加されないが、前のレベルに戻される。
【0059】
図8は、呼吸数情報に基づいてNPPV(Non-invasive Positive Pressure Ventilation(非侵襲的陽圧換気))療法のレート設定を初期化するための手順を示している。好ましくは、これは、オキシメータプローブ(F/B 2)を付けた後に行なわれるが、換気を始める前に付けることができる。
【0060】
図9は、心原性の流れの振幅をはっきりと識別することに基づいて、NPPV療法のトリガ閾値設定を初期化するための手順を示している。好ましくは、これは、たとえば換気が始められると実施され、したがって、呼吸流の信号が使用可能である。
【0061】
従来のオキシメトリデータ(飽和、心拍数、心拍タイミング情報)と、呼吸タイミングおよび努力情報(PPGの追加処理、および/または鼻または口鼻カニューレデータの追加から推測される)との組合せは、新しい診断の可能性を可能にし得る。たとえば、
・循環遅延(呼吸変化と飽和変化との間の遅延)、恐らくは心不全の重症度または心臓の代償不全の表示である。
・呼気終末の鼻圧変換器によって見られる(鼻孔で見られる)心原性の流れの心拍と、心拍の末梢への到達(オキシメータプレチスモグラムから)との間の遅延を介した真の脈波到達時間(PTT)。PTT測定は、覚醒の指標(交感神経流出およびBP(blood pressure(血圧))の一時的な増加)、および恐らく、より長い期間にわたって見られる場合の平均BP/平均交感神経活性化の指標である。従来PTTは、中心心拍タイミング(心収縮)についてはECG、および末梢心拍タイミングについてはPPGに基づいて計算されている。中心心拍タイミングについて心原性の流れを使用することには、心原性の流れ(cardiogenic flow(CGF))が左心室の電気的な活性化ではなく、機械的駆出(肺から鼻への固定の伝播遅延を伴う)を表し、したがって測定から前駆出期を取り除くという点で、ECGから導出されたPTTに勝る利点があり得る。前駆出期は、ECGから導出されたPTT測定の感度を損なうことがあると知られている。呼吸の周期の一貫した部分(それが最も容易に見られる場合には呼気終末)でCGFを得ることによって、呼吸によって引き起こされるPTTの変動は無視され得る。それは、その両方がPPTを短縮し、またその両方が覚醒に関連している、BP変動または動脈緊張の増加(交感神経の活性化)のいずれかによるPTT変動だけを残し、したがって別の重要なSBD(sleep-breathing disorder(睡眠中呼吸障害))パラメータが提供される。
・生のPPG(奇脈)から呼吸努力情報を抽出することによって、単純な診断システムが、睡眠段階付け以外のSBDスクリーニングに必要なすべての重要な情報、すなわち呼吸パターン、酸素飽和度、覚醒(PTT)または増加したSVR(systemic vascular resistance(全身血管抵抗))、および高い努力の期間(無呼吸の区別、およびRERA(Respiratory Efforts Related Arousals)分類)を提供することができる。このシステムは、導出された信号の相対的重要度に応じて、鼻圧変換器を含んでも、含まなくてもよい。鼻の気流は、呼吸努力と組み合わされて、中枢性と閉塞性の無呼吸の単純明快な区別を可能にするが、信号処理は、PPGからの情報、たとえば脱飽和の時間経過と比較した呼吸努力の時間経過、または呼吸努力の時間経過の統計的解析からの情報を組み合わせることから同じ情報を収集してもよい。
【0062】
本発明の態様がどこで使用され得るかについての他の具体的な例には、以下が含まれる。
(a)呼吸相を追跡し予測し、また人工呼吸器トリガに予測を使用するために、呼吸に関する心臓の変化(たとえば「呼吸の洞性不整脈」)を使用すること。こうした変動は、PPGで都合よく検出され得るが、ECG電極などの他の心臓の監視装置によって検出されることもできる。一般に、心仕事量に課される呼吸の変動は、人工呼吸器トリガとして使用するには生じるのが遅すぎ、すなわち、人工呼吸器は理想的には、早期の吸気、好ましくは患者の初期の吸気努力の100ミリ秒以内に一致する呼吸補助を提供する。人工呼吸器は一般に、トリガとして、吸気の流れまたは気道圧の変動を監視する。重度の閉塞性呼吸器疾患(たとえばCOPD(chronic obstructive pulmonary disease(慢性閉塞性肺疾患))では、呼吸流または圧についての情報は、吸気タイミングの不十分な指標である。こうした障害では、呼吸活動へ代替の「窓」が、優れた結果を提示し得る。呼吸、特に苦労を伴う呼吸は、心拍タイミングおよび心拍出量に影響すると知られている。前の呼吸周期にわたって心仕事量を監視し、心臓についての情報から呼吸相の信号を導出することによって、呼吸信号を抽出する待ち時間が過大(たとえば1息を超える遅延)でないならば、次の吸気努力のタイミングが予測され得ることが提案される。脈拍の中枢-末梢伝播時間は一般に約200ミリ秒(脈波到達時間)であり、せいぜい心臓周期は、呼吸相の低いサンプル数(1息当たり約4〜6拍)の推定を提供するであろう。したがって、呼吸相の予測が0.5息より早く事前に行われ得る可能性は低く、したがって、正確な吸気タイミングを提供することができない。しかし、こうした方法は、COPDなどの病状においてかなりの有用性を依然として提供することができ、この方法では、呼吸の流れを介した人工呼吸器の同期は従来非常に遅延され、また呼吸のタイミングは、通常の呼吸よりも同調されることができる(したがって、予測可能性は潜在的に大きくなる)。
(b)スクリーナ装置内で睡眠開始を、または療法装置内で睡眠構造を推測するために、HRV解析を使用すること。
(c)カスタマイズされたPPG監視を備えた人工呼吸器システム内で、(PPG振幅減少から推測された)心拍出量の劇的な低下を検知し、警報をアサートすること。心拍出量の低下は、臨床的に関連した多くの状況、たとえば血液量減少(Yamakage、Can J Anesth 2005 52(2):207頁)、動的な過膨張/空気トラッピング(Perel、BJA 76(1):168〜169頁)(Conacher、Lancet 1995 346:448頁)を有する患者に過度の正圧を加えることの結果であり得る。
【0063】
患者にとっての利点には、たとえば、より心地よく、使い易いことが含まれる。本発明の態様は、センサを備えず(festoon)に最適な療法を提供し、たとえば指または耳のプローブで十分である。医師にとっての利点には、たとえば管理が容易であることが含まれる。本発明の態様は、単純な適用例、自動化された治療、および長期的な患者管理フィードバックを提供する。他の利点には、それほど高価でなく、療法が向上されることが含まれる。
【0064】
本発明について特定の実施形態を参照して述べたが、これらの実施形態は、本発明の原理の適用例を例示するものにすぎないことを理解されたい。本発明において多数の修正が加えられてもよく、また本発明の思想および範囲から逸脱せずに、他の構成が考案されてもよい。たとえば、必ずしも流れの平坦化を伴わずまたはそれに関連しない、上気道の不安定性、抵抗または閉塞の他の表示があることが当業者には理解されよう。
【0065】
また、上述の様々な実施形態は、他の実施形態と併せて実施されてもよく、たとえば、一実施形態の態様が、さらに他の実施形態を実現するために別の実施形態の態様と組み合わされてもよい。さらに、本発明は、OSAを患う患者への特定の適用例を有するが、他の病気(たとえばうっ血性心不全、糖尿病、病的肥満、卒中、肥満症外科など)を患う患者が、上記教示から利益を得ることができることを理解されたい。さらに、上記教示は、非医学的な適用例において、患者および非患者に同様に適用することができる。
【符号の説明】
【0066】
10 パルスオキシメータ信号
20 信号プロセッサ
【特許請求の範囲】
【請求項1】
治療のため患者に提供される加圧型の呼吸可能ガスの供給を生成するように動作することができる制御可能な流れ発生器と、
治療期間中の患者努力の尺度を決定し、前記流れ発生器の動作を制御するための入力用の患者努力の信号を提供するように構成されたパルスオキシメータと、
患者の心原性の流れを測定するように構成された気流測定患者インターフェースと、
心原性の呼吸の流れおよび患者努力に少なくとも一部基づいて脈波到達時間を計算するプロセッサと
を含むことを特徴とする空気供給システム。
【請求項2】
前記患者努力の尺度が、パルスオキシメータの信号から導出されることを特徴とする請求項1に記載の空気供給システム。
【請求項3】
前記患者努力の信号が、開放性-閉塞性の無呼吸の区別、高気道抵抗の決定、呼吸の相対的仕事量の決定、流れ発生器のための制御アルゴリズムの強化、過剰換気の決定および睡眠状態の決定のうちの少なくとも1つのために使用されることを特徴とする請求項1から2のいずれか一項に記載の空気供給システム。
【請求項4】
前記患者努力の信号が、気道開放性無呼吸と閉塞性無呼吸を区別するために気流信号と併せて使用されることを特徴とする請求項1から3のいずれか一項に記載の空気供給システム。
【請求項5】
圧補助が前記患者努力の尺度の増加時は減少され、圧補助が前記患者努力の尺度の減少時は増加されることを特徴とする請求項1から4のいずれか一項に記載の空気供給システム。
【請求項6】
睡眠呼吸障害を治療するための方法であって、
治療のため患者に加圧型の呼吸可能ガスの供給を提供するステップと、
パルスオキシメータを使用して治療期間中の患者努力の尺度を決定し、患者努力の信号を提供するステップと、
気流測定患者インターフェースを使用して患者の心原性の流れを測定するステップと、
プロセッサを用いて心原性の呼吸の流れおよび患者努力に少なくとも一部基づいて脈波到達時間を計算するステップと、
前記プロセッサからの入力に基づいて前記加圧型の呼吸可能ガスの供給を制御するステップと
を含むことを特徴とする方法。
【請求項7】
パルスオキシメータの信号から前記患者努力の尺度を導出するステップをさらに含むことを特徴とする請求項6に記載の方法。
【請求項8】
開放性-閉塞性の無呼吸の区別、高気道抵抗の決定、呼吸の相対的仕事量の決定、前記流れ発生器のための制御アルゴリズムの強化、過剰換気の決定および睡眠状態の決定のうちの少なくとも1つのために前記患者努力の信号を使用するステップをさらに含むことを特徴とする請求項6から7のいずれか一項に記載の方法。
【請求項9】
気道開放性無呼吸と閉塞性無呼吸を区別するために前記患者努力の信号を気流信号と併せて使用するステップをさらに含むことを特徴とする請求項6から8のいずれか一項に記載の方法。
【請求項10】
前記患者努力の尺度の増加時は圧補助を減少させ、前記患者努力の尺度の減少時は圧補助を増加させるステップをさらに含むことを特徴とする請求項6から9のいずれか一項に記載の方法。
【請求項11】
パルスオキシメータ信号を導出するように構成されたパルスオキシメータと、
前記パルスオキシメータ信号を受信し、呼吸数を示す患者努力信号を生成するように構成された信号プロセッサと
患者の心原性の流れを測定するように構成された気流測定装置と、
心原性の呼吸の流れおよびパルスオキシメータ信号に少なくとも一部基づいて脈波到達時間における相対的変動を計算するプロセッサと
を含むことを特徴とする呼吸努力監視装置。
【請求項12】
前記患者努力信号が、治療のため患者に提供される加圧型の呼吸可能ガスの供給を生成するよう動作することができる制御可能な流れ生成器の動作を制御するための入力として使用されることを特徴とする請求項11に記載の呼吸努力監視装置。
【請求項13】
睡眠呼吸障害を治療するための方法であって、
パルスオキシメータ信号を導出するステップと、
心原性の流れの信号を導出するステップと、
前記パルスオキシメータ信号および心原性の流れの信号を処理して呼吸数を示す患者努力信号を生成するステップと
を含むことを特徴とする方法。
【請求項14】
前記患者努力信号からの入力に基づいて、治療のための患者への加圧型の呼吸可能ガスの供給を制御するステップをさらに含むことを特徴とする請求項13に記載の方法。
【請求項15】
パルスオキシメータプレチスモグラフィを使用して患者を監視するステップと、
前記パルスオキシメータプレチスモグラフィから患者パラメータを決定するステップと
を含み、
前記患者パラメータは患者努力であることを特徴とする、患者パラメータを監視する方法。
【請求項16】
前記患者パラメータが、前記患者の睡眠中に監視されることを特徴とする請求項15に記載の方法。
【請求項17】
前記患者パラメータが、前記患者が睡眠呼吸障害を患っている程度を示すパラメータであることを特徴とする請求項15に記載の方法。
【請求項18】
前記患者パラメータが、上気道閉塞を示すパラメータであることを特徴とする請求項17に記載の方法。
【請求項19】
健康障害のある患者にCPAP(Continuous Positive Airway Pressure(持続気道内陽圧))人工呼吸器によって正圧療法を提供する方法であって、
パルスオキシメータからの信号を解析して患者努力を決定し、患者努力信号を形成するステップと、
気流測定装置からの患者の測定された心原性の流れを解析するステップと、
心原性の呼吸の流れおよびパルスオキシメータの信号に少なくとも一部基づいて脈波到達時間における相対的変動を計算するステップと、
前記患者への正圧療法を制御する前記人工呼吸器のフィードバックコントローラに前記脈波到達時間における相対的変動を入力するステップと
を含むことを特徴とする方法。
【請求項20】
前記健康障害が、睡眠呼吸障害、うっ血性心不全または卒中であることを特徴とする請求項19に記載の正圧療法を提供する方法。
【請求項21】
前記パルスオキシメータの信号が、心拍数を示す信号を取り除き、呼吸数を示す信号を残すように処理されることを特徴とする請求項19に記載の正圧療法を提供する方法。
【請求項22】
前記処理が、ローパスフィルタ、ピーク検出器、最下点検出器または平均化を使用することを特徴とする請求項21に記載の正圧療法を提供する方法。
【請求項23】
呼吸の流れの制限がない場合、持続的に高い呼吸努力が不十分な圧補助を示すことを特徴とする請求項19に記載の正圧療法を提供する方法。
【請求項24】
VPAPまたはAutoCS装置において前記患者努力の情報が、加えられるPEEP(positive end expiratory pressure(呼気終末陽圧))を滴定するために使用されることを特徴とする請求項19に記載の正圧療法を提供する方法。
【請求項25】
努力波形の尺度が、患者が過剰換気されたことの指標として使用されることを特徴とする請求項19に記載の正圧療法を提供する方法。
【請求項26】
目標換気を滴定するために前記指標を使用するステップをさらに含むことを特徴とする請求項25に記載の正圧療法を提供する方法。
【請求項27】
OSA(Obstructive Sleep Apnea(閉塞性睡眠時無呼吸))および心不全のある患者のためのCPAPアルゴリズムへの入力として、静脈拍動を決定するステップをさらに含むことを特徴とする請求項19に記載の正圧療法を提供する方法。
【請求項28】
静脈拍動の増加に応答して加えられるCPAP圧を制限するステップをさらに含むことを特徴とする請求項19に記載の正圧療法を提供する方法。
【請求項29】
CPAPアルゴリズムへの入力として血管コンプライアンスを決定するステップをさらに含むことを特徴とする請求項19に記載の正圧療法を提供する方法。
【請求項30】
血管コンプライアンスの変化が患者の覚醒を示すことを特徴とする請求項29に記載の正圧療法を提供する方法。
【請求項31】
CPAPレベルを定めるためのデータを強化するステップをさらに含むことを特徴とする請求項30に記載の正圧療法を提供する方法。
【請求項32】
健康障害のある患者にサーボ人工呼吸器によって正圧療法を提供する方法であって、
パルスオキシメータ信号から患者努力の尺度を導出するステップと、
気流測定インターフェースを介して患者の心原性の呼吸の流れを測定するステップと、
前記測定された心原性の呼吸の流れおよび前記導出された患者努力に少なくとも一部基づいて脈波到達時間(PTT)を計算するステップと、
前記患者努力の尺度および/または前記計算されたPTTをサーボ人工呼吸器において制御変数として使用するステップとを含み、
前記患者努力の尺度の増加時は圧補助が減少され、前記患者努力の尺度の減少時は圧補助が増加されることを特徴とする方法。
【請求項33】
前記健康障害が、睡眠呼吸障害、うっ血性心不全または卒中であることを特徴と請求項32に記載の正圧療法を提供する方法。
【請求項1】
治療のため患者に提供される加圧型の呼吸可能ガスの供給を生成するように動作することができる制御可能な流れ発生器と、
治療期間中の患者努力の尺度を決定し、前記流れ発生器の動作を制御するための入力用の患者努力の信号を提供するように構成されたパルスオキシメータと、
患者の心原性の流れを測定するように構成された気流測定患者インターフェースと、
心原性の呼吸の流れおよび患者努力に少なくとも一部基づいて脈波到達時間を計算するプロセッサと
を含むことを特徴とする空気供給システム。
【請求項2】
前記患者努力の尺度が、パルスオキシメータの信号から導出されることを特徴とする請求項1に記載の空気供給システム。
【請求項3】
前記患者努力の信号が、開放性-閉塞性の無呼吸の区別、高気道抵抗の決定、呼吸の相対的仕事量の決定、流れ発生器のための制御アルゴリズムの強化、過剰換気の決定および睡眠状態の決定のうちの少なくとも1つのために使用されることを特徴とする請求項1から2のいずれか一項に記載の空気供給システム。
【請求項4】
前記患者努力の信号が、気道開放性無呼吸と閉塞性無呼吸を区別するために気流信号と併せて使用されることを特徴とする請求項1から3のいずれか一項に記載の空気供給システム。
【請求項5】
圧補助が前記患者努力の尺度の増加時は減少され、圧補助が前記患者努力の尺度の減少時は増加されることを特徴とする請求項1から4のいずれか一項に記載の空気供給システム。
【請求項6】
睡眠呼吸障害を治療するための方法であって、
治療のため患者に加圧型の呼吸可能ガスの供給を提供するステップと、
パルスオキシメータを使用して治療期間中の患者努力の尺度を決定し、患者努力の信号を提供するステップと、
気流測定患者インターフェースを使用して患者の心原性の流れを測定するステップと、
プロセッサを用いて心原性の呼吸の流れおよび患者努力に少なくとも一部基づいて脈波到達時間を計算するステップと、
前記プロセッサからの入力に基づいて前記加圧型の呼吸可能ガスの供給を制御するステップと
を含むことを特徴とする方法。
【請求項7】
パルスオキシメータの信号から前記患者努力の尺度を導出するステップをさらに含むことを特徴とする請求項6に記載の方法。
【請求項8】
開放性-閉塞性の無呼吸の区別、高気道抵抗の決定、呼吸の相対的仕事量の決定、前記流れ発生器のための制御アルゴリズムの強化、過剰換気の決定および睡眠状態の決定のうちの少なくとも1つのために前記患者努力の信号を使用するステップをさらに含むことを特徴とする請求項6から7のいずれか一項に記載の方法。
【請求項9】
気道開放性無呼吸と閉塞性無呼吸を区別するために前記患者努力の信号を気流信号と併せて使用するステップをさらに含むことを特徴とする請求項6から8のいずれか一項に記載の方法。
【請求項10】
前記患者努力の尺度の増加時は圧補助を減少させ、前記患者努力の尺度の減少時は圧補助を増加させるステップをさらに含むことを特徴とする請求項6から9のいずれか一項に記載の方法。
【請求項11】
パルスオキシメータ信号を導出するように構成されたパルスオキシメータと、
前記パルスオキシメータ信号を受信し、呼吸数を示す患者努力信号を生成するように構成された信号プロセッサと
患者の心原性の流れを測定するように構成された気流測定装置と、
心原性の呼吸の流れおよびパルスオキシメータ信号に少なくとも一部基づいて脈波到達時間における相対的変動を計算するプロセッサと
を含むことを特徴とする呼吸努力監視装置。
【請求項12】
前記患者努力信号が、治療のため患者に提供される加圧型の呼吸可能ガスの供給を生成するよう動作することができる制御可能な流れ生成器の動作を制御するための入力として使用されることを特徴とする請求項11に記載の呼吸努力監視装置。
【請求項13】
睡眠呼吸障害を治療するための方法であって、
パルスオキシメータ信号を導出するステップと、
心原性の流れの信号を導出するステップと、
前記パルスオキシメータ信号および心原性の流れの信号を処理して呼吸数を示す患者努力信号を生成するステップと
を含むことを特徴とする方法。
【請求項14】
前記患者努力信号からの入力に基づいて、治療のための患者への加圧型の呼吸可能ガスの供給を制御するステップをさらに含むことを特徴とする請求項13に記載の方法。
【請求項15】
パルスオキシメータプレチスモグラフィを使用して患者を監視するステップと、
前記パルスオキシメータプレチスモグラフィから患者パラメータを決定するステップと
を含み、
前記患者パラメータは患者努力であることを特徴とする、患者パラメータを監視する方法。
【請求項16】
前記患者パラメータが、前記患者の睡眠中に監視されることを特徴とする請求項15に記載の方法。
【請求項17】
前記患者パラメータが、前記患者が睡眠呼吸障害を患っている程度を示すパラメータであることを特徴とする請求項15に記載の方法。
【請求項18】
前記患者パラメータが、上気道閉塞を示すパラメータであることを特徴とする請求項17に記載の方法。
【請求項19】
健康障害のある患者にCPAP(Continuous Positive Airway Pressure(持続気道内陽圧))人工呼吸器によって正圧療法を提供する方法であって、
パルスオキシメータからの信号を解析して患者努力を決定し、患者努力信号を形成するステップと、
気流測定装置からの患者の測定された心原性の流れを解析するステップと、
心原性の呼吸の流れおよびパルスオキシメータの信号に少なくとも一部基づいて脈波到達時間における相対的変動を計算するステップと、
前記患者への正圧療法を制御する前記人工呼吸器のフィードバックコントローラに前記脈波到達時間における相対的変動を入力するステップと
を含むことを特徴とする方法。
【請求項20】
前記健康障害が、睡眠呼吸障害、うっ血性心不全または卒中であることを特徴とする請求項19に記載の正圧療法を提供する方法。
【請求項21】
前記パルスオキシメータの信号が、心拍数を示す信号を取り除き、呼吸数を示す信号を残すように処理されることを特徴とする請求項19に記載の正圧療法を提供する方法。
【請求項22】
前記処理が、ローパスフィルタ、ピーク検出器、最下点検出器または平均化を使用することを特徴とする請求項21に記載の正圧療法を提供する方法。
【請求項23】
呼吸の流れの制限がない場合、持続的に高い呼吸努力が不十分な圧補助を示すことを特徴とする請求項19に記載の正圧療法を提供する方法。
【請求項24】
VPAPまたはAutoCS装置において前記患者努力の情報が、加えられるPEEP(positive end expiratory pressure(呼気終末陽圧))を滴定するために使用されることを特徴とする請求項19に記載の正圧療法を提供する方法。
【請求項25】
努力波形の尺度が、患者が過剰換気されたことの指標として使用されることを特徴とする請求項19に記載の正圧療法を提供する方法。
【請求項26】
目標換気を滴定するために前記指標を使用するステップをさらに含むことを特徴とする請求項25に記載の正圧療法を提供する方法。
【請求項27】
OSA(Obstructive Sleep Apnea(閉塞性睡眠時無呼吸))および心不全のある患者のためのCPAPアルゴリズムへの入力として、静脈拍動を決定するステップをさらに含むことを特徴とする請求項19に記載の正圧療法を提供する方法。
【請求項28】
静脈拍動の増加に応答して加えられるCPAP圧を制限するステップをさらに含むことを特徴とする請求項19に記載の正圧療法を提供する方法。
【請求項29】
CPAPアルゴリズムへの入力として血管コンプライアンスを決定するステップをさらに含むことを特徴とする請求項19に記載の正圧療法を提供する方法。
【請求項30】
血管コンプライアンスの変化が患者の覚醒を示すことを特徴とする請求項29に記載の正圧療法を提供する方法。
【請求項31】
CPAPレベルを定めるためのデータを強化するステップをさらに含むことを特徴とする請求項30に記載の正圧療法を提供する方法。
【請求項32】
健康障害のある患者にサーボ人工呼吸器によって正圧療法を提供する方法であって、
パルスオキシメータ信号から患者努力の尺度を導出するステップと、
気流測定インターフェースを介して患者の心原性の呼吸の流れを測定するステップと、
前記測定された心原性の呼吸の流れおよび前記導出された患者努力に少なくとも一部基づいて脈波到達時間(PTT)を計算するステップと、
前記患者努力の尺度および/または前記計算されたPTTをサーボ人工呼吸器において制御変数として使用するステップとを含み、
前記患者努力の尺度の増加時は圧補助が減少され、前記患者努力の尺度の減少時は圧補助が増加されることを特徴とする方法。
【請求項33】
前記健康障害が、睡眠呼吸障害、うっ血性心不全または卒中であることを特徴と請求項32に記載の正圧療法を提供する方法。
【図1】


【図2】


【図3】


【図3A】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図3A】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2011−131085(P2011−131085A)
【公開日】平成23年7月7日(2011.7.7)
【国際特許分類】
【出願番号】特願2011−81547(P2011−81547)
【出願日】平成23年4月1日(2011.4.1)
【分割の表示】特願2007−534974(P2007−534974)の分割
【原出願日】平成17年10月6日(2005.10.6)
【出願人】(500046450)レスメド・リミテッド (192)
【氏名又は名称原語表記】RESMED LTD
【公開日】平成23年7月7日(2011.7.7)
【国際特許分類】
【出願日】平成23年4月1日(2011.4.1)
【分割の表示】特願2007−534974(P2007−534974)の分割
【原出願日】平成17年10月6日(2005.10.6)
【出願人】(500046450)レスメド・リミテッド (192)
【氏名又は名称原語表記】RESMED LTD
[ Back to top ]

