砒素を含むもののアルカリ処理方法
【課題】非鉄製錬中間産物に含まれる砒素の処理、特に三酸化二砒素形態の砒素の処理において、溶出基準(環境庁告示13号準拠)を満足し、且つ、濾過性に優れ且つ安定なスコロダイトを、再現性良く、煩雑な操作なしに簡便に生成する方法を提供する。
【解決手段】三酸化二砒素を含む非鉄製錬中間産物に水とアルカリを加えスラリーとし、これを加温し、砒素を浸出する浸出工程と、当該浸出液に酸化剤を添加して、3価砒素を5価砒素へ酸化し調整液を得る液調製工程と、当該調整液中の砒素をスコロダイト結晶へ転換する結晶化工程とを、有する三酸化二砒素の処理方法である。
【解決手段】三酸化二砒素を含む非鉄製錬中間産物に水とアルカリを加えスラリーとし、これを加温し、砒素を浸出する浸出工程と、当該浸出液に酸化剤を添加して、3価砒素を5価砒素へ酸化し調整液を得る液調製工程と、当該調整液中の砒素をスコロダイト結晶へ転換する結晶化工程とを、有する三酸化二砒素の処理方法である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、三酸化二砒素(As2O3)と重金属とを含むものから砒素を抽出し、これを安定な砒素化合物であるスコロダイトの結晶とする、三酸化二砒素と重金属とを含むものの処理方法に関する。
【背景技術】
【0002】
砒素を含有する化合物の安定化について、以下の文献が存在する。
特許文献1には、製錬煙灰に含まれる砒素を対象としたスコロダイトの生成方法が記載されている。
【0003】
特許文献2には、硫化砒素の浸出法に関し、硫化砒素を含むスラリーに空気を吹き込みながらアルカリを添加し、pHを5〜8に保持しながら砒素の浸出を行うことが記載されている。
【0004】
非特許文献1は、砒酸鉄、砒酸カルシウム、砒酸マグネシウムの溶解度積について報告している。当該文献によれば、砒酸カルシウムと砒酸マグネシウムとは、アルカリ領域でのみ安定であり、一方、砒酸鉄は中性から酸性領域で安定であり、極少の溶解度がpH3.2で20mg/Lと報告されている。
【0005】
非特許文献2には、砒酸鉄とスコロダイトとの溶解度が開示されている。当該文献によれば、弱酸性領域においてスコロダイトからの砒素の溶解度は、非結質の砒酸鉄のそれより2桁低いことが示され、スコロダイトが安定な砒素化合物であることを開示している。
【0006】
非特許文献3では、硫酸工場排水や製錬排水に含まれる砒素を対象としたスコロダイトの生成方法が記載されている。
【0007】
【特許文献1】特開2005−161123号公報
【特許文献2】特公昭61−24329号公報
【非特許文献1】西村忠久・戸沢一光:東北大学選鉱製錬研究所報告第764号第34巻第1号別刷 1978.June
【非特許文献2】E.Krause and V.A.Ettel,“Solubilities and Stabilities of Ferric Arsenate Compounds”Hydrometallurgy,22,311−337,(1989)
【非特許文献3】Dimitrios Filippou and George P.Demopoulos,“Arsenic Immobilization by Cotrolled Scorodite Precipitation”JOM Dec.,52−55,(1997)
【発明の開示】
【発明が解決しようとする課題】
【0008】
近年、世界的に非鉄製錬を取り巻く鉱石原料確保の環境は、非常に厳しいものがある。特に、銅製錬の分野においては、非鉄メジャーによる寡占化が進み、さらに新興国等の新たな消費大国が出現したことにより、需給が逼迫した状況にある。
当該状況下、各国においては環境分野への規制が強化され、義務化されつつある。本発明者らは、今後は環境と共存できる鉱山・製錬所が当業界を主導していくものと考えた。
【0009】
ここで、非鉄製錬において懸念される公害には、SO2ガスによる大気汚染や、砒素による土壌汚染や排水汚染が挙げられる。特に砒素に関しては、将来的に銅鉱石中の砒素含有量が増えることになることから、今までにも増して万全の対策が必要となる。
従来、国内の臨海非鉄製錬所では、クリーン精鉱を処理原料とすることで問題なく操業を行ってきた。しかし、今後、銅鉱石中の砒素含有量の増加が予想されることから、砒素を製錬中間産物として系外へ抜き出し、何らかの形で安定化し管理保管することが必要となると考えた。
【0010】
ここで、本発明者らは、上述した文献を検討した。
しかし、いずれの特許文献および非特許文献においても、三酸化二砒素や、三酸化二砒素を含む非鉄製錬中間産物から砒素を抽出し、これを安定な砒素化合物とする三酸化二砒素の処理方法については記載がなかった。
【0011】
本発明は、このような状況の下でなされたものであり、その解決しようとする課題は、三酸化二砒素と重金属とを含むものから砒素を抽出し、濾過性に優れ且つ安定なスコロダイトの結晶へと処理する、三酸化二砒素と重金属とを含むものの処理方法を提供することにある。
【課題を解決するための手段】
【0012】
本発明者等は、上記課題を解決すべく鋭意研究を行った。その結果、三酸化二砒素と重金属とを含むものに水とアルカリとを加え、砒素を浸出した浸出液を得る浸出工程を実施し、次に、酸化剤を添加して当該浸出液中の3価砒素を5価砒素へ酸化し、さらに、当該酸化後、当該浸出液中に残留する酸化剤を除去して調製液を得る液調整工程を実施し、さらに、当該調整液中の砒素をスコロダイト結晶へ転換する結晶化工程とを実施することで、砒素を濾過性に優れ且つ安定なスコロダイトとして回収することが可能になるとの全く新規な知見を得た。尚、本発明において重金属とは、砒素を除く重金属のことである。
そして、本発明者等は、3価砒素含有水溶液に、硫化銅、銅イオン、および、銅の5価砒素化合物の3種類の物質を、触媒として共存させた条件下で、当該3価砒素含有水溶液を加温しつつ、ここへ酸化性ガスを吹き込むことで、短時間に3価砒素を5価砒素へ酸化出来る酸化反応を知見した。さらに、本発明者らは、当該酸化反応終期には、3価砒素の99%以上までが5価砒素に酸化されることを確認し、本発明を完成した。
【0013】
即ち、上述の課題を解決するための第1の手段は、
三酸化二砒素(As2O3)と重金属とを含む非鉄製錬中間産物に水とアルカリとを加えてスラリーとし、当該スラリーを加温し、砒素を浸出して浸出液を得る浸出工程と、
当該浸出液に酸化剤を添加して、3価砒素を5価砒素へ酸化し調整液を得る液調製工程と、
当該調整液中の砒素をスコロダイト結晶へ転換する結晶化工程とを、有することを特徴とする三酸化二砒素と重金属とを含むものの処理方法である。
【0014】
第2の手段は、
前記浸出工程が、アルカリとしてNaOHを用い、pH8以上のアルカリ領域で行なわれることを特徴とする第1の手段に記載の三酸化二砒素と重金属とを含むものの処理方法である。
【0015】
第3の手段は、
前記液調整工程が、酸化剤として過酸化水素を用い、さらに前記調整液中に残留する過酸化水素を金属銅と接触させて除去することを特徴とする第1または第2の手段に記載の三酸化二砒素と重金属とを含むものの処理方法である。
【0016】
第4の手段は、
前記結晶化工程が、前記調整液へ第一鉄(Fe2+)塩を添加溶解し、当該第一鉄塩を酸化させることで、前記調整液中の砒素をスコロダイト結晶へ転換するものであることを特徴とする第1から第3の手段のいずれかに記載の三酸化二砒素と重金属とを含むものの処理方法である。
【0017】
第5の手段は、
前記第一鉄塩の酸化の為、前記調整液へ空気又は酸素又はこれら混合ガスを吹き込むことを特徴とする第4の手段に記載の三酸化二砒素と重金属とを含むものの処理方法である。
【0018】
第6の手段は、
前記結晶化工程が、pH1以下の領域で行われること特徴とする第1から第5の手段のいずれかに記載の三酸化二砒素と重金属とを含むものの処理方法である。
【0019】
第7の手段は、
前記結晶化工程が、50℃以上で行われること特徴とする第1から第6の手段のいずれかに記載の三酸化二砒素と重金属とを含むものの処理方法である。
【0020】
第8の手段は、
三酸化二砒素(As2O3)および/または亜砒酸イオンを含み、50℃以上に加温され、pH値が1以上の中性側であり、硫化銅と銅イオンと銅の5価砒素化合物とを含む水溶液へ、
空気および/または酸素を吹き込むことで、当該水溶液中の3価砒素を5価砒素へ酸化することを特徴とする砒素の酸化方法である。
【0021】
第9の手段は、
三酸化二砒素(As2O3)および/または亜砒酸イオンを含み、50℃以上に加温され、pH値が2以上の中性側であり、硫化銅を含む水溶液へ、
空気および/または酸素を吹き込むことで、前記硫化銅の一部を溶解させて銅の5価砒素化合物を生成させながら、当該水溶液中の3価砒素を5価砒素へ酸化することを特徴とする砒素の酸化方法である。
【0022】
第10の手段は、
空気および/または酸素の吹き込み開始時のpH値が2以上であり、吹き込み停止時のpH値が2未満であることを特徴とする第8または第9の手段に記載の砒素の酸化方法である。
【0023】
第11の手段は、
前記水溶液中の3価砒素が5価砒素へ酸化した後、パルプが生成した当該水溶液を濾過して濾過殿物を回収し、当該濾過殿物を前記硫化銅の代替物として用いることを特徴とする第8から第10の手段のいずれかに記載の砒素の酸化方法である。
【0024】
第12の手段は、
前記水溶液中の3価砒素が5価砒素へ酸化した後、パルプが生成した当該水溶液を中和してpH値を3以上とすることで、当該水溶液中の銅イオンを銅の5価砒素化合物として晶出させた後、濾過して濾液と濾過殿物を回収し、当該濾過殿物を硫化銅の代替物として用いることを特徴とする第8から第11の手段のいずれかに記載の砒素の酸化方法である。
【発明の効果】
【0025】
本発明によれば、三酸化二砒素と重金属とを含むものから砒素を抽出し、濾過性に優れ且つ安定なスコロダイトの結晶へと処理することが出来た。
また、第8から第12に記載のいずれかの手段によれば、非鉄製錬所内で容易に調達可能な資材を用いることで、低操業コスト、低設備コストでありながら99%以上の酸化率をもって、3価砒素を5価砒素へ酸化することが可能になった。さらに、本発明によれば、酸化反応終了時の溶液のpH値は1以上、2未満であり、スコロダイト(FeAsO4・2H2O)生成に好適である。従って、当該観点からも低操業コスト、低設備コストに資するものである。
【発明を実施するための最良の形態】
【0026】
上述したように本発明は、三酸化二砒素と重金属とを含むものに水とアルカリとを加え、砒素を浸出した浸出液を得る浸出工程を実施し、次に、酸化剤を添加して当該浸出液中の3価砒素を5価砒素へ酸化し、さらに、当該酸化後、当該浸出液中に残留する酸化剤を除去して調製液を得る液調整工程を実施し、さらに、当該調整液中の砒素をスコロダイト結晶へ転換する結晶化工程とを有する三酸化二砒素と重金属とを含むものの処理方法である。
そして、低操業コスト、低設備コストでありながら99%以上の酸化率をもって、3価砒素を5価砒素に酸化する方法を提供することである。
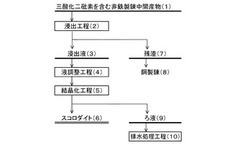
以下、図1に示すフローチャートを参照しながら、1.三酸化二砒素を含む非鉄製錬中間産物、2.浸出工程、3.液調整工程、4.調整液中の砒素をスコロダイト結晶へ転換する結晶化工程、実施例1の順に詳細に説明する。
次に、第2の実施形態として、低操業コスト、低設備コストでありながら99%以上の酸化率をもって、3価砒素を5価砒素へ酸化する方法について、図2に示すフローチャートを参照しながら、1.被処理対象物、2.3価砒素の酸化反応、3.3価砒素の酸化反応開始時のpH値、4.3価砒素の酸化反応終了時のpH値、実施例2〜6、比較例1〜5の順に詳細に説明し、さらに、本発明者らの考える、5.3価砒素の酸化反応モデルについて説明する。
【0027】
1.三酸化二砒素と重金属とを含むもの
本発明に係る三酸化二砒素と重金属とを含むものの具体例として、三酸化二砒素を含む非鉄製錬中間産物がある。そこで、以下、三酸化二砒素を含む非鉄製錬中間産物を、三酸化二砒素と重金属とを含むものの例として、説明する。
三酸化二砒素を含む非鉄製錬中間産物(1)は、非鉄製錬などの産業において、中間物として生成する。尤も、既存の製錬工程で砒素を、三酸化二砒素を含む非鉄製錬中間産物として系外排出している製錬所に限られず、既に、砒素を三酸化二砒素として貯蔵している製錬所にとっても、本処理方法は有効である。
当該砒素として三酸化二砒素と重金属とを含む非鉄製錬中間産物としては、例えば、重金属類を含む焙焼煙灰等が該当する。そして、砒素と重金属とを含む場合は、重金属と砒素とが化合物を生成している場合が多い。従って、本発明で開示する浸出条件で砒素が浸出される場合、抽出される元の砒素の形態は、必ずしも三酸化二砒素に限定されるものではない。尚、本発明において重金属とは、砒素を除く重金属のことである。
【0028】
2.浸出工程
三酸化二砒素を含む非鉄製錬中間産物(1)は、砒素以外に、鉛、カドミニウム等の重金属を含む。この結果、当該中間産物中の砒素の形態は複雑である。この複雑な形態を有する砒素を効率的に浸出するため、本発明者らが研究を行った結果、当該三酸化二砒素を含む非鉄製錬中間産物へ、水とアルカリとを加え、さらに温度をかけて砒素を浸出するという、構成に想到した。具体的には、三酸化二砒素を含む非鉄製錬中間産物(1)へ、必要量の水と、NaOH、KOH、等のアルカリを添加してpH8以上のアルカリ域とし、
浸出を行うのである。一方、pH12を超えると砒素以外の重金属も溶解してくるので、pHは12以下とすることが好ましい。
本発明に係る浸出工程(2)において、当該構成をとることで、三酸化二砒素を含む非鉄製錬中間産物中の、砒素の浸出を促進しながら、他の重金属の溶出を抑制することが実現でき、非鉄製錬中間産物から砒素を効率的に浸出することが可能になった。
生成する残渣(7)は銅製錬(8)工程へ投入すれば良い。
【0029】
次に、当該浸出工程(2)における反応条件について説明する。
(溶解方法・時間)
後工程の結晶化工程(5)において、スコロダイト(6)を効率的に製造するには、高濃度の砒素溶液が求められる。
そこで、当該浸出反応において、三酸化二砒素中の3価砒素を5価砒素に酸化して溶解度を上げ、浸出率を上げることが考えられる。しかし、5価砒素が重金属と反応して砒酸塩を作り、砒素が沈殿してしまうという問題が起こる。
ここで、本発明者らは、三酸化二砒素中から3価砒素の形で浸出を行いながら、アルカリを添加することで、3価砒素の溶解度上げるという画期的な構成に想到した。
【0030】
具体的には、所定量の三酸化二砒素を含む非鉄製錬中間産物と水とアルカリとを調合しpH8以上のアルカリ域のパルプとし、当該パルプを50℃以上で浸出する。アルカリは、苛性ソーダが良い。ナトリウムと三酸化砒素とが反応し、浸出されるためである。
【0031】
三酸化二砒素中から3価砒素の形で浸出を行いながら、アルカリを添加することで、3価砒素の溶解度上がる構成の詳細は不明だが、本発明者らは下記の式1および式2の反応が並行して同時に進行するのではないかと考えている。
As2O3+H2O=2HAsO2・・・・・・・・・・・(式1)
As2O3+NaOH=2NaAsO2+H2O・・・・・(式2)
これは、アルカリの添加量が、式2から算出される量よりも少ない量であっても、3価砒素の溶解度が上がるという、知見による。
当該工程にて、アルカリを過剰に添加すると、後工程の結晶化工程において溶液の粘度が上がり、作業性が低下するという問題点を考慮すると、(式1)および(式2)の並行同時進行により、アルカリ添加量が少なくても良いとの知見は大いに好ましいものである。
さらに、当該構成の優れた点として、当該浸出液(3)の液温を室温程度まで低下させても、三酸化二砒素結晶の析出が見られないことが挙げられる。
【0032】
3.液調整工程
本液調整工程(4)は、浸出液(3)中の3価砒素を5価砒素へと酸化させ、その後、残留する酸化剤を除去する工程である。
浸出液(3)中の砒素の大部分は、3価砒素として溶解している。当該3価砒素を、ほぼ完全に5価砒素へと酸化させる為の酸化剤としては、空気や酸素ガスでは難しい。そこで、過酸化水素(H2O2)の採用に想到した。尚、当該過酸化水素は、30〜35%濃度の汎用的に使われているもので良い。
【0033】
浸出液への過酸化水素の添加は、直接行えば良い。当該過酸化水素の添加による3価砒素の酸化を(式3〜6)に示す。
AsO2−+H2O2=HAsO42−+H+・・・・・・・(式3)
HAsO2+H2O2=HAsO42−+2H+・・・・・・(式4)
HAsO2+H2O2=H2AsO4−+H+・・・・・・(式5)
HAsO2+H2O2=H3AsO4・・・・・・・・・・(式6)
すなわち、酸化反応の進行と共に水素イオンが発生し、浸出液のpHはアルカリ性→中
性→酸性域まで低下する。
これは、後述する結晶化工程における液が、pH1の酸性液であることを考えると、硫酸を使わずとも反応の進行だけでpHを低下させ、結晶化の際における液の酸性域近傍へ到達できる点で好ましい。
【0034】
過酸化水素の添加時間は10分間〜15分間が良い。尤も、添加時間が5分間以上であれば、過酸化水素添加の際の一部分解による気泡の発生を回避出来る。
過酸化水素の添加量は、3価砒素の酸化反応に必要な理論量(1倍当量)程度で良い。もし、3価砒素濃度が不明の場合は、過酸化水素添加後80℃での液電位をAmVとし、過酸化水素添加完了時のpH計の指示値を(pH)としたとき、(式7)を満足していることを目安としても良い。
AmV=−60×(pH)+590・・・・・・・(式7)
(at.80℃)(AmVは、Ag/AgCl電極基準)但し、1.0<pH<3.
0
過酸化水素による3価砒素の酸化は非常に早く、添加中にpHの低下と反応熱による温度の上昇が観察される。しかし、酸化を完全に行うには60分間以上の時間をかける。
【0035】
反応温度は、40℃以上とすることが好ましい。さらに、3価砒素から5価砒素への酸化反応を促進する観点からは、反応温度は高い程好ましい。
尚、既述の通り、過酸化水素添加による3価砒素の5価砒素への酸化反応は発熱反応である。この為、例えば、砒素濃度50g/L程度の溶液を、80℃にて酸化反応させようとした場合、装置からの放熱状況にもよるが、おおよそ液温60℃で過酸化水素の添加を開始すれば、所定量添加終了時の液温は約80℃となっている。
【0036】
次に、該酸化反応後液に残留する酸化剤を除去する工程について説明する。
これは、反応後に残留する酸化剤が、次工程の結晶化工程(5)で添加する第一鉄(Fe2+)の一部を酸化してしまうので、第一鉄イオン濃度を正確に管理するためには、除去することが望ましいからである。
浸出液(3)中に残留する過酸化水素を除去するには、金、銀等の金属のコロイドを添加し、これを分解する方法も考えられる。しかし、ハンドリング性やロスの発生による損失を考えると実操業では不適である。
ここで、本発明者等は、残留する酸化剤(例えば、過酸化水素)を分解するのではなく、消費により除去する構成に想到した。具体的には、被酸化剤(例えば、金属銅)と接触させ、(式8)に示す様に消費により除去する。
Cu0+H2O2+H2SO4=CuSO4+2H2O・・・・・(式8)
反応温度は、反応を完結させるため40℃以上が好ましい。また、反応はpHの上昇を伴うが、pHが一定値を示した時点で終了と判断出来る。
【0037】
4.結晶化工程
結晶化工程(5)は、液調整工程(4)で得られた調整液中の5価砒素を、スコロダイト(6)へと結晶化する工程である。
前記液調整工程(4)を終えて得られる調整液の砒素濃度は、スコロダイト(6)の生産性を考えた場合、20g/L以上、好ましくは30g/L以上の濃厚液であることが好ましい。
まず、当該調整液に対し第一鉄(Fe2+)塩を添加溶解し、室温にて硫酸(H2SO4)を添加しpH1に調整する。ここで、第一鉄塩化合物は種々あるが、設備の耐腐食性の観点および入手の容易性の観点から、硫酸第一鉄が好ましい。
第一鉄塩の添加量は、Fe純分量として被処理砒素総モル量の1倍当量以上、好ましくは1.5倍当量である。
【0038】
第一鉄塩を添加し、pH調整を終えたら、当該調整液を所定の反応温度まで昇温する。ここで反応温度は、50℃以上であればスコロダイト(6)が析出可能である。しかし、スコロダイトの粒径を大きくする観点からは、反応温度が高い程、好ましい。尤も、大気雰囲気下での反応を可能とする観点からは、反応温度を90〜100℃とすることが望ましい。
【0039】
当該調整液が、所定の反応温度に到達したら、空気または酸素またはこれら混合ガスの吹き込みを開始し、強攪拌を行って気液混合状態をつくり、所定の反応温度を保ちながら高温酸化反応を進める。
【0040】
当該高温酸化反応は2〜3時間程度で、下記、(式9)〜(式14)の様に進行すると考えられる。
(反応の前半)
2FeSO4+1/2O2+H2SO4=Fe2(SO4)3+H2O・・・・(式9)
2H3AsO4+Fe2(SO4)3+4H2O=2FeAsO4・2H2O+3H2SO4・・・・(式10)
(全反応式(式9+式10)を、下記、(式11)に示す。)
2H3AsO4+2FeSO4+1/2O2+3H2O=2FeAsO4・2H2O+2H2SO4・・・・(式11)
(As濃度が低下した反応後半)
2FeSO4+1/2O2+H2SO4=Fe2(SO4)3+H2O・・・・(式12)
2/3H3AsO4+1/3Fe2(SO4)3+4/3H2O=2/3FeAsO4・2H2O+H2SO4・・・・(式13)
(全反応式(式12+式13)を、下記、(式14)に示す。)
2/3H3AsO4+2FeSO4+1/2O2+4/3H2O=2/3FeAsO4・2H2O+2/3Fe2(SO4)3・・・・(式14)
【0041】
酸化方法にもよるが、当該高温酸化反応開始後、2時間〜3時間で、pH、砒素濃、Fe濃度が急激に低下する。当該段階において、液の酸化還元電位は95℃で400mV以上(Ag/AgCl電極基準)を示す。そして、含有されている砒素の90%以上がスコ
ロダイト(6)の結晶となる。当該高温酸化反応開始後、3時間以降は、液中に残留する砒素が少量低下するのみで、pHや液電位は殆ど変化しない。尚、当該高温酸化反応を完全に平衡状態で終えるには、好ましくは5時間〜7時間の継続を行う。
【0042】
上述した本発明に係る結晶化工程(5)によれば、反応操作が簡単であり、途中pH調整の必要もなく、含有される砒素を確実にスコロダイト(6)の結晶へ変換可能である。
生成するろ液(9)は、排水処理工程(10)にて処理すればよい。
得られるスコロダイト(6)の結晶は、沈降性、濾過性に優れ、濾過後の付着水分が10%前後と低く、さらに砒素品位が30%にも及ぶので減容化が達成され、かつ、耐溶出性に優れ安定である。従って、砒素を、製錬工程から安定な形として除去し保管可能となる。
【0043】
以下に実施例を示し、本発明をより具体的に説明する。
(実施例1)
<浸出>
As含有品位が74.4%の化学用試薬の三酸化二砒素(As2O3)と、試薬1級グレードのPbO(98%)、ZnO(99%)、CdO(95%)とを、表1に示す配合表により配合し、2リットルビーカー(4枚バッフル付き)に投入した。さらに当該2リ
ットルビーカーへ、純水1,500ccを加えて攪拌しパルプとした。次いで、当該パルプへ、固形NaOHを21g添加溶解し、温度を70℃へ昇温し、浸出を開始した。
浸出時間は、三酸化二砒素は短時間で浸出可能であるが、ここでは共存するPb、Cd、Znの反応も平衡させることを考え180分間とした。
尚、反応終了時のパルプのpHは8.78(at.69.5℃)であった。
得られた浸出液の品位とpHとを表2に示す。
【0044】
【表1】

【表2】

【0045】
<液調整>
得られた浸出液840ccを1Lビーカーに測り取り加熱を開始した。
当該浸出液に含まれる砒素が全て3価砒素と仮定し、当該3価砒素を酸化するに必要な当量の30%に当たる過酸化水素水63gを測り取った。
浸出液の温度が62℃に到達したら、測り取った過酸化水素水の添加を開始し15分間で全量添加した。尚、攪拌は空気を巻き込まない程度の攪拌を行った。
当該反応時の℃−pH−酸化還元電位(mV,Ag/AgCl電極基準)の推移を表3
に示す。
【0046】
【表3】

【0047】
調製液中に残留する過酸化水素水を金属銅を用いて除去する。今回は、試薬1級の銅粉末を用いた。
具体的には、液温が40℃となった時点で、銅粉=1.8gを添加した。当該銅粉添加
直時を反応開始時とし、反応時間経過に伴う℃−pH−酸化還元電位(mV,Ag/Ag
Cl電極基準)の推移を表4に示す。反応は4分間で完了し、調製後液を得た。
尚、調製後液中の砒素濃度は47.5g/L、銅濃度は、49mg/Lであった。
【0048】
【表4】

【0049】
<結晶化>
1)得られた調整後液を純水で希釈し、砒素濃度を45g/Lに調整した。
2)上記800ccを2Lビーカーに移し、95%硫酸を用いpH=1.15へ調整した。
3)添加する第一鉄(Fe2+)量は、Asモル量の1.5倍モル量とし、試薬1級の硫酸第一鉄(FeSO4・7H2O)を各200g測り取り、それぞれ2)の調整液へ溶解し、さらに95%硫酸にて30℃でpH=1.0へ調整した。
4)上記3)を大気圧下で加熱し95℃へ昇温し、次いでビーカー底部よりガラス管を用い酸素ガスを950cc/分で吹き込みを開始し、強攪拌下、気液混合状態で7時間高温酸化反応した。結果を以下の表5に示す。
【0050】
【表5】

【0051】
(第2の実施形態)
本発明者らの検討によると、上述した過酸化水素(H2O2)を用いた酸化方法は、3価砒素の酸化速度が速く、かつ、溶液温度を高温として反応させることにより、ほぼ100%近い3価砒素の酸化が達成される。しかし、過酸化水素は高価な薬剤である。
【0052】
一方、オゾン(O3)を用いた酸化方法は、溶液温度に関係なく、かつ、短時間に、ほぼ100%近い3価砒素の酸化が達成される。しかし、以下の問題がある。
オゾン発生設備自体が高コストである。さらにオゾンの酸化力が強い為、周辺装置の仕様も高度化せざるを得ず、システム全体としては非常な高コストとなる。
オゾンは人体に有害である為、未反応で大気に放出されるオゾンを回収・無害化する付帯設備が必要となる。
オゾンは酸素より水に溶けやすく、反応後液は特異の刺激臭を放つ等の問題がある。当該問題を除くため、後工程において溶存したオゾンを除去する工程が必要となる。
【0053】
一方、粉状金属銅等を触媒として添加する方法では、以下の問題点が明らかとなった。1)被処理液の砒素濃度が低い(例えば、3g/L程度)場合には、砒素の酸化率は100%近い。しかし、被処理液の砒素濃度が高い(例えば、60〜70g/L程度)場合は砒素の酸化率が79%程度に低下する。
2)金属銅(Cu°)が銅イオン(Cu2+)に変化する際に、3価砒素から5価砒素への変化に影響を与える。そして、当該変化の際、3価砒素に対して少なくとも等モル以上の金属銅が必要であるとしている。さらに、難水溶性銅化合物(Cu2O、CuS)においても、金属銅と同様の効果が認められるとしている。この結果、3価砒素化合物である亜砒酸の処理に際して、大量の薬剤(銅源)が必要である。
3)上記2)で説明したように、当該方法では亜砒酸(3価砒素)の処理に際して大量の銅源を使う。この結果、反応後の溶液には数10g/Lの大量の銅イオンが残る。従って、反応後の溶液からの銅の回収工程が必要となり、銅回収コストの負担増を招く。
4)当該反応は、酸性溶液中(例えば、pH値が0、FA(遊離酸)値が130g/L)における反応であるため、反応後の溶液には大量の酸分が残る。従って、反応後の溶液をベースとして5価砒素化合物を生成するためには、大量のアルカリが必要である。これは
、当該方法において、粉状金属銅および/または難水溶性銅化合物を、溶解させる必要があるため、すなわち必然的に酸分が必要とされることから、避けられない問題でもある。
【0054】
以下、本発明を実施するための第2の実施形態について、図2に示すフローチャートを参照しながら、1.被処理対象物、2.3価砒素の酸化反応、3.3価砒素の酸化反応開始時のpH値、4.3価砒素の酸化反応終了時のpH値、実施例2〜6、比較例1〜5の順に詳細に説明し、さらに、本発明者らの考える、5.3価砒素の酸化反応モデルについて説明する。
【0055】
本実施形態によれば、非鉄製錬所内で容易に調達可能な資材を用いることで、低操業コスト、低設備コストでありながら99%以上の酸化率をもって、3価砒素を5価砒素へ酸化することが可能になった。
【0056】
1.被処理対象物
本実施の形態は、高濃度の砒素溶液の作製に最適な処理方法である。
つまり、本実施の形態によれば、溶解度の小さな3価砒素を、溶解度の大きな5価砒素へ容易に酸化可能である。従って、3価砒素源として固体である三酸化二砒素〈1〉を用いることにより、3価砒素が5価砒素へ酸化されるのと並行して当該三酸化二砒素が溶解し、3価砒素が適時供給される形となる。この結果、数10g/Lの高濃度な5価砒素溶液、すなわち濃厚な砒酸溶液の作成が容易となるものである。
【0057】
2.3価砒素の酸化反応
酸化工程〈4〉に係る本実施の形態を導出するにあたり、本発明者らは、銅を砒素の酸化触媒として用い、3価砒素を酸素により酸化する工程に関して検討を行った。
当該検討のいくつかを、以下に記載する。
【0058】
1)酸化触媒として銅イオンのみを使用する(後述の比較例1、比較例2に相当する。)。
2)酸化触媒として硫化銅のみを使用する(後述の比較例3に相当する。)。
3)酸化触媒として硫化銅と銅イオンとの2種を共存させて使用する(後述の比較例4に相当する。)。
4)酸化触媒として硫化銅と銅イオンと銅の5価砒素化合物との3種を共存させて使用する(後述の実施例2〜6に相当する。)。
【0059】
上述の検討の結果、1)〜4)ともに、銅の酸化触媒効果は認められた。しかし、酸化速度、酸化率の観点から4)が、1)〜3)と比較して効果が飛躍的に向上することを知見した。
当該知見に基づき、酸化触媒としては、硫化銅と、銅イオンと、銅の5価砒素化合物(砒酸銅)との3種を共存させて使用することとした。
以下、(a)硫化銅源、(b)銅イオン源、(c)銅の5価砒素化合物(砒酸銅)、および、(d)反応温度、(e)吹き込みガス種と吹き込み量、について詳細に説明する。
【0060】
(a)硫化銅源
硫化銅源〈2〉は、硫化銅固体、硫化銅粉末などを用いることが出来る。尤も、反応性を確保する観点からは、粉状であることが望ましい。また、硫化銅には、大別して、CuSとCu2Sとの形態が存在する(結晶格子中銅の一部が欠損した組成のCu9S5もある。)。本実施形態においては、そのどちらでも効果があり、これらの混合であっても良い。さらに、硫化銅源は、出来るだけ純粋な硫化銅(不純物が極力少なく、純度の高い硫化銅。)であることが好ましい。これは、純度の高い硫化銅を用いることで、As2S3、ZnS、PbS、CdS、等の混入を回避できるからである。
これら、As2S3、ZnS、PbS、CdS、等が混入してくると、以下、(式15〜18)に記載する反応がおこり、3価砒素の酸化反応に必要な銅イオンの供給が妨げられる。
さらに、As2S3、すなわち硫化砒素においては、意識的に銅イオンを添加した場合であっても以下に記載する反応がおこり、最適な銅イオン濃度の維持が難しくなるだけでなく、水素イオン(H+)発生反応が起きる。そして、水素イオン(H+)が発生すると、反応系のpH値が低下してしまい、本発明に係る3価砒素の酸化反応の維持が困難となり、3価砒素の酸化が困難になる。
【0061】
Cu2++1/3As2S3+4/3H2O=CuS+2/3HAsO2+2H+・・・(式15)
Cu2++ZnS=CuS+Zn2+・・・(式16)
Cu2++PbS=CuS+Pb2+・・・(式17)
Cu2++CdS=CuS+Cd2+・・・(式18)
【0062】
ここで、硫化銅源〈2〉として、製錬中間産物として回収される硫化銅を考えた場合、当該回収された硫化銅中には、上述したAs2S3、ZnS、PbS、CdS、等が相当量含まれている。従って、硫化銅源〈2〉として、製錬中間産物として回収される硫化銅をそのまま用いることは好ましくない。もし、用いたい場合には、事前に上述の硫化物を反応分解等により除去し、硫化銅としての純度を上げておけば良い。
【0063】
銅製錬所であれば、以下に記載する方法で、本発明に適した純度の高い硫化銅を簡単に製造可能である。
(1)電気銅を硫酸酸性下(FA(遊離酸)=50〜300g/L)で、加温しつつエアレーションして溶解(Cu=10〜30g/L)させ銅溶液を得る。
(2)得られた銅溶液を、50℃以上でNaSHやH2S等の硫化剤と反応させて硫化銅を回収する。
(3)回収された硫化銅を水洗浄し、付着酸分を取り除く。
この水洗浄後の硫化銅は不純物が少なく、乾燥状態であっても湿潤状態であっても、本発明に適用可能である。
【0064】
(b)銅イオン源
銅イオン源〈3〉は、処理水溶液において銅イオンとなるものを用いれば良い。例えば、硫酸銅は常温にて固体であり、水に溶解して直ぐに銅イオンとなるため好ましい。金属銅、金属銅粉を用いてもよいが、イオン化するまで溶解を待つ必要がある。
【0065】
(c)銅の5価砒素化合物(砒酸銅)
本実施形態に係る銅の5価砒素化合物として砒酸銅がある。砒酸銅の溶解度積は、砒酸鉄(FeAsO4)に匹敵するものであり、弱酸性から中性領域にて容易に形成する5価砒素化合物である。
本実施形態では、3価砒素を含む水溶液に硫化銅を添加し、初期pH値を2以上とし酸化反応を開始する。この為、添加された硫化銅表面では、3価砒素の5価砒素への酸化と、硫化銅の溶解による銅イオンの供給とが並行する為、瞬時に砒酸銅の生成が起きるものと考えられる。また、反応終了時には、溶液が弱酸性領域へ自然移行するものの、この時点では5価砒素および銅イオン共にg/Lオーダーまで濃縮されている。当該濃縮により、砒酸銅の生成能力は、依然低下することがない。
ここで、溶液のpH値が1を割り込む酸性側とならなければ、砒酸銅の形成能力が極端に低下することはない為、pH値の管理を行うことが好ましい。
【0066】
(d)反応温度
砒素の酸化は、溶液温度が高いほうが良好である。具体的には、砒素の酸化を進めるためには50℃以上の温度が求められる。実操業を考慮し、反応槽の材質や反応後の濾過操作を前提とすれば70〜90℃、好ましくは80℃前後に加温〈5〉する。
【0067】
(e)吹き込みガス種と吹き込み量
吹き込みガス〈6〉が、空気であっても3価砒素の酸化反応は可能である。しかし、酸素、または、空気と酸素との混合ガスを吹き込みガス〈6〉とした場合は、溶液中の砒素濃度が低い範囲であっても酸化速度が維持され、吹き込み(ガス)容量も小さくなるため、これに伴うヒートロスも少なくなり反応温度の維持管理が容易になる。そこで、酸化速度、反応温度の維持管理の観点から、吹き込みガス〈6〉は、酸素、または、酸素と空気との混合ガスが好ましい。
【0068】
吹き込みガス〈6〉の単位時間当たりの吹き込み量は、反応槽の気液混合状態により、最適値が変化する。例えば、微細気泡発生装置等を用いれば、酸化効率はさらに向上し、吹き込み量を減らすことが可能となる。
従って、実機操業時には、その気液混合状態や酸素吹き込み方式等を加味して最適値を見出すことが肝要である。
【0069】
3.3価砒素の酸化反応開始時のpH値
本発明に係る3価砒素の酸化反応の基本式は、以下であると考えられる。
As2O3+H2O=2HAsO2・・・・(式19)
三酸化二砒素が水に亜砒酸(3価砒素)として溶解する反応
2HAsO2+O2+2H2O=2H2AsO4−+2H+・・・・(式20)
亜砒酸(3価砒素)が酸化する反応
2HAsO2+O2+2H2O=2H3AsO4・・・・(式21)
亜砒酸(3価砒素)が酸化する反応
【0070】
後述する実施例のように、全砒素溶解時の砒素濃度が40g/L以上の濃厚液の場合は、亜砒酸の溶解度が小さいため三酸化二砒素は全量初期に溶解するのではない。
濃厚砒素液の場合は、亜砒酸が、(式20)、(式21)により溶解度の大きい砒酸へ酸化され、亜砒酸濃度が減少すると並行して、(式19)により亜砒酸が系内へ補給される反応が進行するものと考えられる。つまり、反応初期は、固体の三酸化二砒素が懸濁しながら溶解していくものと考えられる。
【0071】
ここで、亜砒酸の砒酸への酸化は、(式20)、(式21)によるものと考えられる。
当該亜砒酸の砒酸への酸化反応において、初期の30分間で溶液のpH値が2前後へ急激に低下する挙動を示す。当該挙動から、pH2以上の中性側では主に(式20)により酸化が進んでいるものと推定できる。その後の30分間以降では、pH値の低下は緩慢となることから、反応は主に(式21)にて進んでいるものと推定できる。
以上のことから、本発明により3価砒素を効率的に酸化し、且つ、反応終了時のpH値を弱酸性に制御するためには、酸化反応開始時(空気および/または酸素の吹き込み開始時)のpH値を2以上とすれば良いことが理解される。
【0072】
4.3価砒素の酸化反応終了時のpH値
本発明に係る実施の形態において、後述する実施例2〜6の結果が示すように、3価砒素の酸化反応終了時(空気および/または酸素の吹き込み停止時)のpH値は、全て2未満であり、具体的には1.8前後となった。
当該1.8前後のpH値は、5価砒素化合物生成に好ましいpH値である(酸濃度が適正値にある。)。これは、5価砒素化合物である砒酸鉄生成の最適pH域がpH3.5
〜4.5であるため、酸分の中和のため消費される中和剤が少なくて済むからである。
一方、スコロダイト(FeAsO4・2H2O)生成は、pH1前後の5価砒素溶液が元液として用いられるため、少量の逆中和剤(例えば硫酸)添加によりpH調整が可能となるからである。さらに、詳細は後述する実施例6にて説明するが、反応終了時のpH値は、2未満であり1以上であることが好ましい。
【0073】
3価砒素の酸化反応終了時(空気および/または酸素の吹き込み停止時)のpH値が2未満であり、具体的には1.8前後となるのは、上記(式19)〜(式21)により、もたらされるものと考えられる。
まず、(式19)により、三酸化二砒素が水に亜砒酸(3価砒素)として溶解する。尤も、出発原料が固体の三酸化二砒素である場合に限られず、すでに亜砒酸として3価砒素が溶解している水溶液の場合でも同様である(従って、本発明は、一般の排水処理にも適用可能である場合があると考えられる。)。
【0074】
上述の酸化工程〈4〉で得られた産物を、濾過〈7〉において、濾液〈8〉と濾過物〈9〉とに分離する。濾過〈7〉においては、例えば、フィルタープレスの様な、通常の濾過方法を適用できる。上述の酸化工程〈4〉にて、銅の5価砒素化合物が生成されるものの、粘性が高まる等の濾過性の問題がないからである。
【0075】
得られた濾液〈7〉は、上述したように1.8前後のpH値を有する砒酸溶液である。当該1.8前後のpH値は、5価砒素化合物生成に好ましいpH値であることから、濾液〈7〉から、低コスト且つ高生産性をもって5価砒素化合物を生成出来る。
一方、濾過物〈9〉は、硫化銅と、銅の5価砒素化合物との混合物であるので、そのまま酸化触媒として繰り返し使用することが出来る。この繰り返し使用の際、一部溶解した硫化銅に相応する量の硫化銅を、新たに追加添加すれば、触媒効果はさらなる向上が期待出来る。
【0076】
5.3価砒素の酸化反応機構のモデル
本発明に係る硫化銅と、銅イオンと、銅の5価砒素化合物よる3元系触媒は、高い酸化率と酸化速度を兼ね備えたものである。この3元系触媒が発揮する酸化触媒効果は、硫化銅表面での各イオン種の接触がもたらす電池的な反応に起因するものと考えられる。
【0077】
例えば、pH2前後の領域を例として、酸化反応機構のモデルを考える。
まず、3価砒素の酸化を電極反応に置き換えれば、陽極反応は(式22)、陰極反応は(式23)として示される。
As2O3+5H2O=2H3AsO4+4H++4e−・・・・・(式22)
4H++O2+4e−=2H2O・・・・・(式23)
すなわち3価砒素の酸化反応は(式22)にて示す反応が進むが、反応を進めるためには電気的に中性を維持する必要がある。従って、硫化銅表面で進む(式23)で示す陰極反応の進行が、反応性を左右するものと考えられる。このことから、常に活性度の高い硫化銅表面の確保が重要になるものと考えられる。
【0078】
すなわち本反応モデル系では、銅イオンが共存し、且つ、弱酸pH領域の反応であるため、硫化銅表面では(式24)に示す砒酸銅化合物の晶出反応が起きるものと考えられる。
Cu2++H3AsO4+H2O=CuHAsO4・H2O+2H+ ・・・・(式24)
上記(式24)により、硫化銅表面には水素イオン(H+)が補給され、(式25)(式26)に示す反応が並行して進むと考えられる。
CuS+2H++1/2O2=Cu2++S°+H2O ・・・・・(式25)
CuS+H++2O2=Cu2++HSO4− ・・・・・(式26)
【0079】
ここで、硫化銅表面には、砒酸銅化合物が形成されているため、酸素供給が不十分となり、(式25)に示すS°(元素状硫黄)生成反応も進むと考えられる。さらに(式25)(式26)の進行に伴い、局所的にCuイオン濃度が上昇し、且つ、水素イオン(H+)濃度の低下が生じるものと推定される。そして、当該局所においては、(式27)に示す硫化銅の生成反応が、上記(式25)(式26)と並行的に進行するものと考えられる。
Cu2++4/3S°+4/3H2O=CuS+1/3HSO4−+7/3H+・・・
・・(式27)
(式27)は、硫化銅であるCuSの晶出を示すものであり、硫化銅の表面には活性度が高い新生面としてのCuS晶出が確保されることを意味するものである。
【0080】
さらに(式27)で生成する水素イオン(H+)は、(式25)(式26)の示す反応へ供給される他、砒酸銅化合物の溶解反応((式24)の逆反応)でも消費される。この結果、銅イオンの硫化銅表面への補給と、砒酸(H3AsO4)の沖合への拡散とが、進行するものと考えられる。
尚、後述の[比較例5]に示すpH0条件下では、(式24)に示す反応が基本的に進行せず、また、(式27)に示す反応も進み難くなる為、酸化効率が極端に低下するのだと解釈される。
【0081】
(実施例2)
試薬グレードの三酸化二砒素(品位を表6に示す。)、試薬グレードの硫化銅(品位を表7に示す。)を準備した。
上述したように、硫化銅には、大別してCuSとCu2Sとの2形態、さらに、結晶格子中銅の一部が欠損した組成のCu9S5がある。そして、いずれの形態でも使用可能であり、また、いずれかの形態の混合であっても良い。
本実施例に用いた硫化銅のX線回折の結果を、図3に示す。尚、図3において、CuSのピークを△で、Cu2Sのピークを☆で、Cu9S5を◆で示した。当該X線回折の結果から、本実施例に用いた硫化銅はCuSと、Cu2Sと、Cu9S5との混合物と考えられる。
【0082】
【表6】

【表7】

【0083】
反応容器は1リットルビーカーを使用し、攪拌措置は700rpmの2段タービン羽および4枚邪魔板を使用し、ガス吹き込みは、ガラス管を介して前記ビーカー底部より酸素の吹き込みを実施した(強攪拌状態とし、気液混合状態にて酸化した)。
【0084】
三酸化二砒素50gと、硫化銅48gとを反応容器に投入し、純水800ccでリパ
ルプし80℃へ加温した。次いで、撹拌装置を用いて溶液の攪拌を開始し、さらに、当該反応容器の底部に酸素ガスの吹き込みを400cc/分にて開始し、3価砒素の酸化を行った。尚、酸素ガス吹き込み開始直前の溶液のpH値は3.09(at80℃)であった。
【0085】
溶液の攪拌と酸素ガスの吹き込みとを90分間継続し、当該3価砒素の酸化を行った。そして30分間ごとに、溶液の、温度、pH値、酸化還元電位、銅イオン量、3価砒素量、5価砒素量を測定した。当該測定結果を表8に示す。尚、酸化還元電位は、Ag/AgCl電極基準値である。
【0086】
【表8】

【0087】
当該3価砒素の酸化を90分間継続して行った後、溶液を濾過し、沈殿物として回収した触媒を水洗浄し、当該触媒の品位分析とX線回折とを行った。当該反応後の触媒の品位分析結果を表9に、X線回折結果を図4に示した。尚、図4において、CuSのピークを△で、銅の5価砒素化合物のピークを○で示した。
【0088】
【表9】

【0089】
以上、表8、表9、および図4より、本実施例2に係る反応系において、硫化銅と、銅イオンと、銅の5価砒素化合物(砒酸銅)とが共存していることが理解されるものである。
さらに、本実施例2においては、3価砒素の酸化速度、酸化率とも高いことが判明した。特に、酸化率においては酸化反応開始後90分間の時点で、既に99%以上に達していることが認められた。
【0090】
(実施例3)
反応容器に投入する硫化銅の量を半分の24gとした以外は、実施例2と同様の操作を行い、同様の測定を行った。
尚、酸素ガス吹き込み開始直前の溶液のpH値は2.96(at80℃)であった。
30分間ごとに、溶液の、温度、pH値、酸化還元電位、銅イオン量、3価砒素量、5価砒素量を測定した結果を表10に示し、沈殿物として回収した触媒の水洗後の品位分析結果を表11に示す。
【0091】
【表10】

【表11】

【0092】
本実施例3においては、CuS添加量を実施例2の半分とし、当該半減の効果を検討したものである。
その結果、実施例2に較べて、3価砒素の酸化速度は若干劣るが、酸化能力は十分保持され、酸化反応開始後120分間の時点で99%以上の酸化が認められた。実施例2と同様、3価砒素の酸化能力、速度共に、実用化に十分好適と考えられる。
【0093】
(実施例4)
本実施例では、実施例2と同様だが、さらに試薬グレードの硫酸銅(CuSO4・5H2O)16gを反応容器に投入した。当該硫酸銅の投入量は、銅イオンとして5g/Lに相当する量である。本実施例は、反応初期より銅イオン濃度を高めた場合の実施例である。
尚、酸素ガス吹き込み開始直前の溶液のpH値は2.98(at80℃)であった。
30分間ごとに、溶液の、温度、pH値、酸化還元電位、銅イオン量、3価砒素量、5価砒素量を測定した結果を表12に示す。
【0094】
本実施例では、反応終了時の120分時点において酸素ガス吹き込みを停止した。そして、濃度500g/LのNaOH溶液を添加して、溶液をpH=3.5へ中和し、液中に
溶存する銅イオンを5価砒素化合物として晶出させた後、濾過操作を行った。尚、NaOH溶液の添加量は40ccであった。
濾過操作により得られた濾液の全砒素濃度は、29.6g/L、銅濃度は80mg/Lであり、砒酸銅化合物形成に伴う、濃度低下が認められた。
一方、濾過操作により回収された殿物は165g・wetであった。当該殿物のうち5g・wetを採取し、水分測定したところ水分=59.9%であった。また、当該殿物のうち5g・wetを、水洗浄し品位分析を行った。回収された殿物の品位分析結果を表13に示す。
【0095】
【表12】

【表13】

【0096】
本実施例4は、実施例2における反応初期よりCuイオン濃度を高めたものである。
表12の結果から、本実施例においても、高い酸化率にて反応が完結していることが認められた。
一方、本実施例4では、実施例2に比して若干酸化速度が落ちている。従って、反応系内の銅イオン濃度は、必要以上に高く設定する必要がないことが判明した。反応系内の銅イオン濃度は、1〜5g/L程度で十分と判断される。
【0097】
尤も、触媒として、湿式硫化反応で生成された直後の硫化銅を用いる場合、当該硫化銅は難溶性の挙動を取る。そこで、湿式硫化反応で生成された直後の硫化銅を触媒として用いる場合は、反応系内への銅イオンの添加が有効である。
また、本実施例では、中和により添加した銅イオンを、銅の5価砒素化合物として回収している。銅イオンの回収方法は、銅の5価砒素化合物として回収する方法以外にも、元素状硫黄やZnS等の、銅イオンと反応し硫化銅を形成する薬剤を添加する方法によっても良い。
【0098】
(実施例5)
試薬グレード三酸化二砒素50gを準備した。
実施例4で回収した全殿物(実施例4で、測定用サンプルに供した10g・wetは除く。)と、三酸化二砒素50gとを反応容器へ投入し、純水707ccでリパルプし、パルプ中の水分を800ccとした。当該パルプを80℃に加温し、次いで、反応容器の底部に酸素ガスの吹き込みを400cc/分にて開始した。
尚、酸素ガス吹き込み開始直前のpH値は3.03(at79℃)であった。
【0099】
30分間ごとに、溶液の、温度、pH値、酸化還元電位、銅イオン量、3価砒素量、5価砒素量を測定した結果を表14に示す。
【0100】
【表14】

【0101】
90分間反応させた後、酸素吹き込みを停止し、500g/LのNaOH溶液を添加して溶液のpH値を3.0へ中和した後、当該溶液を濾過した。尚、該NaOH溶液の使用量は36ccであった。
得られた濾液の全砒素濃度は44.8g/L、Cu濃度は210mg/Lであり、砒素濃度はほぼ配合値濃度のものが回収されていることが判明した。
一方、得られた殿物は122g・wetであった。得られた殿物のうち5g・wetを採取し水分測定したところ水分=48.9%であった。また、得られた殿物のうち5g・
wetを水洗浄し分析を行った。沈殿物として回収した触媒の品位分析結果を表15に示した。
【0102】
【表15】

【0103】
本実施例5は、実施例2〜6のなかで、最も酸化効率が高く、且つ、酸化速度も速かった。具体的には、反応60分時点で既に95%の酸化が認められ、反応90分時点ではほぼ100%近い99.6%の酸化率を示した。
本実施例5に係る触媒も、硫化銅と、銅イオンと、砒酸銅化合物(銅の5価砒素化合物)との3種共存である。そして、本実施例5に係る触媒は、実施例2、3に比較して、特に砒酸銅化合物(銅の5価砒素化合物)の含有比率が高いものである。当該砒酸銅化合物の高含有比率が、酸化性能向上へ寄与しているものと考えられる。すなわち、当該寄与現象は、「酸化反応のモデル」にて説明したように、砒酸銅化合物の形成・存在が活性なCuSの新生面生成に関与していることを裏付けるものと考えられる。
【0104】
(実施例6)
パルプに濃硫酸を添加することで、酸素吹き込み開始直前のpH値を1.0(at80℃)へ調整した以外は、実施例3と同様の操作を行った。
【0105】
30分間ごとに、溶液の、温度、pH値、酸化還元電位、銅イオン量、3価砒素量、5価砒素量を測定した結果を表16に示す。また、反応後の触媒品位(水洗浄済み)を表17に示した。
【0106】
【表16】

【表17】

【0107】
本実施例6は、添加した硫化銅量は実施例3と同様であるが、酸化開始直前の溶液のpH値を1に調整したものである。
この結果、酸化能力が実施例3に較べて低下し、120分間後の時点で72%の酸化率であった。酸化率100%に到達させるためには、長時間反応させる必要があると考えられるが、酸化能力自体は十分保持している。
【0108】
上述した酸化速度減少の原因は、共存する砒酸銅が大幅に減少した為であると考えられる。さらに、溶液のpH値が1では、硫化銅の溶解量が増える為、未溶解分として回収される硫化銅の量(リサイクル量)が減り、コスト的にも不利となる。
以上のことから、溶液のpH値は2以上として反応を開始し、少なくともpH値1以上で酸化反応を終了することが、反応性確保、CuS回収量確保の観点から好ましいと考えられる。
【0109】
(比較例1)
試薬グレードの三酸化二砒素50gのみを反応容器に投入し、純水800ccでリパルプした以外は、実施例2と同様の操作を行った。
尚、酸素ガス吹き込み開始直前のpH値は2.80(at80℃)であった。
そして30分間ごとに、溶液の、温度、pH値、酸化還元電位、銅イオン量、3価砒素量、5価砒素量を測定した。当該測定結果を表18に示す。
【0110】
【表18】

【0111】
本比較例1では、3価砒素の酸化が殆ど進まないことが判明した。
【0112】
(比較例2)
試薬グレードの三酸化二砒素50gと、試薬グレード硫酸銅(CuSO4・5H2O)16g(Cuイオンとして5g/L)を反応容器に投入し、純水800ccでリパルプした以外は、実施例2と同様の操作を行った。
尚、酸素ガス吹き込み開始直前のpH値は3.33(at80℃)であった。
そして30分間ごとに、溶液の、温度、pH値、酸化還元電位、銅イオン量、3価砒素量、5価砒素量を測定した。当該測定結果を表19に示す。
【0113】
【表19】

【0114】
本比較例2では、比較例1に較べれば酸化の進行が認められるが、その程度は小さい。
【0115】
(比較例3)
試薬グレード三酸化二砒素50gと、試薬グレード硫酸銅(CuSO4・5H2O)32g(銅イオンとして10g/L)を反応装置に投入し、純水800ccでリパルプした以外は、実施例2と同様の操作を行った。
尚、酸素ガス吹き込み開始直前のpH値は3.45(at81℃)であった。
そして30分間ごとに、溶液の、温度、pH値、酸化還元電位、銅イオン量、3価砒素量、5価砒素量を測定した。当該測定結果を表20に示す。
【0116】
【表20】

本比較例3では、溶液中のCuイオン濃度を高くしたことにより、酸化の進行は認められる。しかし、その酸化の進行程度はまだ小さく、さらなる銅イオンの添加補給が必要と考えられ、実用化には不適と考えられる。
【0117】
(比較例4)
試薬グレード三酸化二砒素50gと、試薬グレード硫化銅(CuS)48gと硫黄粉末20gとを反応装置に投入し、純水800ccでリパルプした以外は、実施例2と同様の
操作を行った。
尚、酸素ガス吹き込み開始直前のpH値は2.67(at80℃)であった。
そして30分間ごとに、溶液の、温度、pH値、酸化還元電位、銅イオン量、3価砒素量、5価砒素量を測定した。当該測定結果を表21に示す。
【0118】
【表21】

【0119】
反応終了後に溶液を濾過し、得られた澱物を水洗浄し、品位分析とX線回折を行った。
反応後の触媒品位(水洗浄済み)を表22に、また、X線回折結果を図5に示した。尚、図5において、CuSのピークを△で、硫黄のピークを■で示した。
品位分析において、砒素が0.1%検出されたが、これは未洗浄分の液付着分由来と考えられる。
図5および表22より、本比較例4においては、銅イオンと銅の5価砒素化合物との存在は認められず、硫化銅単味の触媒系であることが理解される。
【0120】
【表22】

本比較例4では、酸化の進行が認められる。従って、比較例2、3で説明したCuイオン単味よりも、硫化銅単味の方が酸化の方が触媒としての能力は高いことが判明した。しかし、実用化の観点からは、その酸化の進行程度はまだ小さく不適と考えられる。
【0121】
(比較例5)
パルプに濃硫酸を添加し、pH値を0(at80℃)に調整した後 酸素吹き込みを開始した以外は、実施例2と同様の操作を行った。
そして30分間ごとに、溶液の、温度、pH値、酸化還元電位、銅イオン量、3価砒素量、5価砒素量を測定した。当該測定結果を表23に示す。
【0122】
【表23】

【0123】
反応終了後に溶液を濾過し、得られた澱物を水洗浄し、品位分析とX線回折を行った。
反応後の触媒品位(水洗浄済み)を表24に、また、X線回折結果を図6に示した。尚、図6において、CuSのピークを△で、三酸化二砒素のピークを□で示した。
【0124】
【表24】

【0125】
本比較例5においては、砒素の酸化が進行せず、反応後触媒にも砒素が10.6%検出
された。また、図6が示す様に、X線回折の結果から三酸化二砒素が確認されることから、酸化反応後においても、三酸化二砒素が未溶解のまま残っているものと理解される。
これは、溶液が硫酸酸性のpH値が0で酸化反応を開始したため、三酸化二砒素の溶解度が低下したこと。さらに、溶液中へ溶出した3価砒素が、溶解度が大きな5価砒素へ酸化されることなく溶液中に残留し、溶液中の3価砒素濃度が低下しないため、三酸化二砒素の一部が未溶解のまま残っているためであると考えられる。
【0126】
本比較例5の結果から、砒素の酸化反応を、砒酸銅が形成できないpH値が0の条件から始めた場合、触媒となる物質は、硫化銅と銅イオンとの2元系となり、酸化能力が激減したものと考えられる。 結局のところ、本特許に係る砒素の酸化反応は、少なくともpH値1以上条件で開始することが好ましいことが判明した。
【図面の簡単な説明】
【0127】
【図1】本発明に係る砒素の処理方法を示すフローチャートである。
【図2】本発明(第2実施形態)の実施形態に係るフローチャートである。
【図3】実施例2に係る硫化銅のX線回折結果である。
【図4】実施例2に係る澱物のX線回折結果である。
【図5】比較例4に係る澱物のX線回折結果である。
【図6】比較例5に係る澱物のX線回折結果である。
【技術分野】
【0001】
本発明は、三酸化二砒素(As2O3)と重金属とを含むものから砒素を抽出し、これを安定な砒素化合物であるスコロダイトの結晶とする、三酸化二砒素と重金属とを含むものの処理方法に関する。
【背景技術】
【0002】
砒素を含有する化合物の安定化について、以下の文献が存在する。
特許文献1には、製錬煙灰に含まれる砒素を対象としたスコロダイトの生成方法が記載されている。
【0003】
特許文献2には、硫化砒素の浸出法に関し、硫化砒素を含むスラリーに空気を吹き込みながらアルカリを添加し、pHを5〜8に保持しながら砒素の浸出を行うことが記載されている。
【0004】
非特許文献1は、砒酸鉄、砒酸カルシウム、砒酸マグネシウムの溶解度積について報告している。当該文献によれば、砒酸カルシウムと砒酸マグネシウムとは、アルカリ領域でのみ安定であり、一方、砒酸鉄は中性から酸性領域で安定であり、極少の溶解度がpH3.2で20mg/Lと報告されている。
【0005】
非特許文献2には、砒酸鉄とスコロダイトとの溶解度が開示されている。当該文献によれば、弱酸性領域においてスコロダイトからの砒素の溶解度は、非結質の砒酸鉄のそれより2桁低いことが示され、スコロダイトが安定な砒素化合物であることを開示している。
【0006】
非特許文献3では、硫酸工場排水や製錬排水に含まれる砒素を対象としたスコロダイトの生成方法が記載されている。
【0007】
【特許文献1】特開2005−161123号公報
【特許文献2】特公昭61−24329号公報
【非特許文献1】西村忠久・戸沢一光:東北大学選鉱製錬研究所報告第764号第34巻第1号別刷 1978.June
【非特許文献2】E.Krause and V.A.Ettel,“Solubilities and Stabilities of Ferric Arsenate Compounds”Hydrometallurgy,22,311−337,(1989)
【非特許文献3】Dimitrios Filippou and George P.Demopoulos,“Arsenic Immobilization by Cotrolled Scorodite Precipitation”JOM Dec.,52−55,(1997)
【発明の開示】
【発明が解決しようとする課題】
【0008】
近年、世界的に非鉄製錬を取り巻く鉱石原料確保の環境は、非常に厳しいものがある。特に、銅製錬の分野においては、非鉄メジャーによる寡占化が進み、さらに新興国等の新たな消費大国が出現したことにより、需給が逼迫した状況にある。
当該状況下、各国においては環境分野への規制が強化され、義務化されつつある。本発明者らは、今後は環境と共存できる鉱山・製錬所が当業界を主導していくものと考えた。
【0009】
ここで、非鉄製錬において懸念される公害には、SO2ガスによる大気汚染や、砒素による土壌汚染や排水汚染が挙げられる。特に砒素に関しては、将来的に銅鉱石中の砒素含有量が増えることになることから、今までにも増して万全の対策が必要となる。
従来、国内の臨海非鉄製錬所では、クリーン精鉱を処理原料とすることで問題なく操業を行ってきた。しかし、今後、銅鉱石中の砒素含有量の増加が予想されることから、砒素を製錬中間産物として系外へ抜き出し、何らかの形で安定化し管理保管することが必要となると考えた。
【0010】
ここで、本発明者らは、上述した文献を検討した。
しかし、いずれの特許文献および非特許文献においても、三酸化二砒素や、三酸化二砒素を含む非鉄製錬中間産物から砒素を抽出し、これを安定な砒素化合物とする三酸化二砒素の処理方法については記載がなかった。
【0011】
本発明は、このような状況の下でなされたものであり、その解決しようとする課題は、三酸化二砒素と重金属とを含むものから砒素を抽出し、濾過性に優れ且つ安定なスコロダイトの結晶へと処理する、三酸化二砒素と重金属とを含むものの処理方法を提供することにある。
【課題を解決するための手段】
【0012】
本発明者等は、上記課題を解決すべく鋭意研究を行った。その結果、三酸化二砒素と重金属とを含むものに水とアルカリとを加え、砒素を浸出した浸出液を得る浸出工程を実施し、次に、酸化剤を添加して当該浸出液中の3価砒素を5価砒素へ酸化し、さらに、当該酸化後、当該浸出液中に残留する酸化剤を除去して調製液を得る液調整工程を実施し、さらに、当該調整液中の砒素をスコロダイト結晶へ転換する結晶化工程とを実施することで、砒素を濾過性に優れ且つ安定なスコロダイトとして回収することが可能になるとの全く新規な知見を得た。尚、本発明において重金属とは、砒素を除く重金属のことである。
そして、本発明者等は、3価砒素含有水溶液に、硫化銅、銅イオン、および、銅の5価砒素化合物の3種類の物質を、触媒として共存させた条件下で、当該3価砒素含有水溶液を加温しつつ、ここへ酸化性ガスを吹き込むことで、短時間に3価砒素を5価砒素へ酸化出来る酸化反応を知見した。さらに、本発明者らは、当該酸化反応終期には、3価砒素の99%以上までが5価砒素に酸化されることを確認し、本発明を完成した。
【0013】
即ち、上述の課題を解決するための第1の手段は、
三酸化二砒素(As2O3)と重金属とを含む非鉄製錬中間産物に水とアルカリとを加えてスラリーとし、当該スラリーを加温し、砒素を浸出して浸出液を得る浸出工程と、
当該浸出液に酸化剤を添加して、3価砒素を5価砒素へ酸化し調整液を得る液調製工程と、
当該調整液中の砒素をスコロダイト結晶へ転換する結晶化工程とを、有することを特徴とする三酸化二砒素と重金属とを含むものの処理方法である。
【0014】
第2の手段は、
前記浸出工程が、アルカリとしてNaOHを用い、pH8以上のアルカリ領域で行なわれることを特徴とする第1の手段に記載の三酸化二砒素と重金属とを含むものの処理方法である。
【0015】
第3の手段は、
前記液調整工程が、酸化剤として過酸化水素を用い、さらに前記調整液中に残留する過酸化水素を金属銅と接触させて除去することを特徴とする第1または第2の手段に記載の三酸化二砒素と重金属とを含むものの処理方法である。
【0016】
第4の手段は、
前記結晶化工程が、前記調整液へ第一鉄(Fe2+)塩を添加溶解し、当該第一鉄塩を酸化させることで、前記調整液中の砒素をスコロダイト結晶へ転換するものであることを特徴とする第1から第3の手段のいずれかに記載の三酸化二砒素と重金属とを含むものの処理方法である。
【0017】
第5の手段は、
前記第一鉄塩の酸化の為、前記調整液へ空気又は酸素又はこれら混合ガスを吹き込むことを特徴とする第4の手段に記載の三酸化二砒素と重金属とを含むものの処理方法である。
【0018】
第6の手段は、
前記結晶化工程が、pH1以下の領域で行われること特徴とする第1から第5の手段のいずれかに記載の三酸化二砒素と重金属とを含むものの処理方法である。
【0019】
第7の手段は、
前記結晶化工程が、50℃以上で行われること特徴とする第1から第6の手段のいずれかに記載の三酸化二砒素と重金属とを含むものの処理方法である。
【0020】
第8の手段は、
三酸化二砒素(As2O3)および/または亜砒酸イオンを含み、50℃以上に加温され、pH値が1以上の中性側であり、硫化銅と銅イオンと銅の5価砒素化合物とを含む水溶液へ、
空気および/または酸素を吹き込むことで、当該水溶液中の3価砒素を5価砒素へ酸化することを特徴とする砒素の酸化方法である。
【0021】
第9の手段は、
三酸化二砒素(As2O3)および/または亜砒酸イオンを含み、50℃以上に加温され、pH値が2以上の中性側であり、硫化銅を含む水溶液へ、
空気および/または酸素を吹き込むことで、前記硫化銅の一部を溶解させて銅の5価砒素化合物を生成させながら、当該水溶液中の3価砒素を5価砒素へ酸化することを特徴とする砒素の酸化方法である。
【0022】
第10の手段は、
空気および/または酸素の吹き込み開始時のpH値が2以上であり、吹き込み停止時のpH値が2未満であることを特徴とする第8または第9の手段に記載の砒素の酸化方法である。
【0023】
第11の手段は、
前記水溶液中の3価砒素が5価砒素へ酸化した後、パルプが生成した当該水溶液を濾過して濾過殿物を回収し、当該濾過殿物を前記硫化銅の代替物として用いることを特徴とする第8から第10の手段のいずれかに記載の砒素の酸化方法である。
【0024】
第12の手段は、
前記水溶液中の3価砒素が5価砒素へ酸化した後、パルプが生成した当該水溶液を中和してpH値を3以上とすることで、当該水溶液中の銅イオンを銅の5価砒素化合物として晶出させた後、濾過して濾液と濾過殿物を回収し、当該濾過殿物を硫化銅の代替物として用いることを特徴とする第8から第11の手段のいずれかに記載の砒素の酸化方法である。
【発明の効果】
【0025】
本発明によれば、三酸化二砒素と重金属とを含むものから砒素を抽出し、濾過性に優れ且つ安定なスコロダイトの結晶へと処理することが出来た。
また、第8から第12に記載のいずれかの手段によれば、非鉄製錬所内で容易に調達可能な資材を用いることで、低操業コスト、低設備コストでありながら99%以上の酸化率をもって、3価砒素を5価砒素へ酸化することが可能になった。さらに、本発明によれば、酸化反応終了時の溶液のpH値は1以上、2未満であり、スコロダイト(FeAsO4・2H2O)生成に好適である。従って、当該観点からも低操業コスト、低設備コストに資するものである。
【発明を実施するための最良の形態】
【0026】
上述したように本発明は、三酸化二砒素と重金属とを含むものに水とアルカリとを加え、砒素を浸出した浸出液を得る浸出工程を実施し、次に、酸化剤を添加して当該浸出液中の3価砒素を5価砒素へ酸化し、さらに、当該酸化後、当該浸出液中に残留する酸化剤を除去して調製液を得る液調整工程を実施し、さらに、当該調整液中の砒素をスコロダイト結晶へ転換する結晶化工程とを有する三酸化二砒素と重金属とを含むものの処理方法である。
そして、低操業コスト、低設備コストでありながら99%以上の酸化率をもって、3価砒素を5価砒素に酸化する方法を提供することである。
以下、図1に示すフローチャートを参照しながら、1.三酸化二砒素を含む非鉄製錬中間産物、2.浸出工程、3.液調整工程、4.調整液中の砒素をスコロダイト結晶へ転換する結晶化工程、実施例1の順に詳細に説明する。
次に、第2の実施形態として、低操業コスト、低設備コストでありながら99%以上の酸化率をもって、3価砒素を5価砒素へ酸化する方法について、図2に示すフローチャートを参照しながら、1.被処理対象物、2.3価砒素の酸化反応、3.3価砒素の酸化反応開始時のpH値、4.3価砒素の酸化反応終了時のpH値、実施例2〜6、比較例1〜5の順に詳細に説明し、さらに、本発明者らの考える、5.3価砒素の酸化反応モデルについて説明する。
【0027】
1.三酸化二砒素と重金属とを含むもの
本発明に係る三酸化二砒素と重金属とを含むものの具体例として、三酸化二砒素を含む非鉄製錬中間産物がある。そこで、以下、三酸化二砒素を含む非鉄製錬中間産物を、三酸化二砒素と重金属とを含むものの例として、説明する。
三酸化二砒素を含む非鉄製錬中間産物(1)は、非鉄製錬などの産業において、中間物として生成する。尤も、既存の製錬工程で砒素を、三酸化二砒素を含む非鉄製錬中間産物として系外排出している製錬所に限られず、既に、砒素を三酸化二砒素として貯蔵している製錬所にとっても、本処理方法は有効である。
当該砒素として三酸化二砒素と重金属とを含む非鉄製錬中間産物としては、例えば、重金属類を含む焙焼煙灰等が該当する。そして、砒素と重金属とを含む場合は、重金属と砒素とが化合物を生成している場合が多い。従って、本発明で開示する浸出条件で砒素が浸出される場合、抽出される元の砒素の形態は、必ずしも三酸化二砒素に限定されるものではない。尚、本発明において重金属とは、砒素を除く重金属のことである。
【0028】
2.浸出工程
三酸化二砒素を含む非鉄製錬中間産物(1)は、砒素以外に、鉛、カドミニウム等の重金属を含む。この結果、当該中間産物中の砒素の形態は複雑である。この複雑な形態を有する砒素を効率的に浸出するため、本発明者らが研究を行った結果、当該三酸化二砒素を含む非鉄製錬中間産物へ、水とアルカリとを加え、さらに温度をかけて砒素を浸出するという、構成に想到した。具体的には、三酸化二砒素を含む非鉄製錬中間産物(1)へ、必要量の水と、NaOH、KOH、等のアルカリを添加してpH8以上のアルカリ域とし、
浸出を行うのである。一方、pH12を超えると砒素以外の重金属も溶解してくるので、pHは12以下とすることが好ましい。
本発明に係る浸出工程(2)において、当該構成をとることで、三酸化二砒素を含む非鉄製錬中間産物中の、砒素の浸出を促進しながら、他の重金属の溶出を抑制することが実現でき、非鉄製錬中間産物から砒素を効率的に浸出することが可能になった。
生成する残渣(7)は銅製錬(8)工程へ投入すれば良い。
【0029】
次に、当該浸出工程(2)における反応条件について説明する。
(溶解方法・時間)
後工程の結晶化工程(5)において、スコロダイト(6)を効率的に製造するには、高濃度の砒素溶液が求められる。
そこで、当該浸出反応において、三酸化二砒素中の3価砒素を5価砒素に酸化して溶解度を上げ、浸出率を上げることが考えられる。しかし、5価砒素が重金属と反応して砒酸塩を作り、砒素が沈殿してしまうという問題が起こる。
ここで、本発明者らは、三酸化二砒素中から3価砒素の形で浸出を行いながら、アルカリを添加することで、3価砒素の溶解度上げるという画期的な構成に想到した。
【0030】
具体的には、所定量の三酸化二砒素を含む非鉄製錬中間産物と水とアルカリとを調合しpH8以上のアルカリ域のパルプとし、当該パルプを50℃以上で浸出する。アルカリは、苛性ソーダが良い。ナトリウムと三酸化砒素とが反応し、浸出されるためである。
【0031】
三酸化二砒素中から3価砒素の形で浸出を行いながら、アルカリを添加することで、3価砒素の溶解度上がる構成の詳細は不明だが、本発明者らは下記の式1および式2の反応が並行して同時に進行するのではないかと考えている。
As2O3+H2O=2HAsO2・・・・・・・・・・・(式1)
As2O3+NaOH=2NaAsO2+H2O・・・・・(式2)
これは、アルカリの添加量が、式2から算出される量よりも少ない量であっても、3価砒素の溶解度が上がるという、知見による。
当該工程にて、アルカリを過剰に添加すると、後工程の結晶化工程において溶液の粘度が上がり、作業性が低下するという問題点を考慮すると、(式1)および(式2)の並行同時進行により、アルカリ添加量が少なくても良いとの知見は大いに好ましいものである。
さらに、当該構成の優れた点として、当該浸出液(3)の液温を室温程度まで低下させても、三酸化二砒素結晶の析出が見られないことが挙げられる。
【0032】
3.液調整工程
本液調整工程(4)は、浸出液(3)中の3価砒素を5価砒素へと酸化させ、その後、残留する酸化剤を除去する工程である。
浸出液(3)中の砒素の大部分は、3価砒素として溶解している。当該3価砒素を、ほぼ完全に5価砒素へと酸化させる為の酸化剤としては、空気や酸素ガスでは難しい。そこで、過酸化水素(H2O2)の採用に想到した。尚、当該過酸化水素は、30〜35%濃度の汎用的に使われているもので良い。
【0033】
浸出液への過酸化水素の添加は、直接行えば良い。当該過酸化水素の添加による3価砒素の酸化を(式3〜6)に示す。
AsO2−+H2O2=HAsO42−+H+・・・・・・・(式3)
HAsO2+H2O2=HAsO42−+2H+・・・・・・(式4)
HAsO2+H2O2=H2AsO4−+H+・・・・・・(式5)
HAsO2+H2O2=H3AsO4・・・・・・・・・・(式6)
すなわち、酸化反応の進行と共に水素イオンが発生し、浸出液のpHはアルカリ性→中
性→酸性域まで低下する。
これは、後述する結晶化工程における液が、pH1の酸性液であることを考えると、硫酸を使わずとも反応の進行だけでpHを低下させ、結晶化の際における液の酸性域近傍へ到達できる点で好ましい。
【0034】
過酸化水素の添加時間は10分間〜15分間が良い。尤も、添加時間が5分間以上であれば、過酸化水素添加の際の一部分解による気泡の発生を回避出来る。
過酸化水素の添加量は、3価砒素の酸化反応に必要な理論量(1倍当量)程度で良い。もし、3価砒素濃度が不明の場合は、過酸化水素添加後80℃での液電位をAmVとし、過酸化水素添加完了時のpH計の指示値を(pH)としたとき、(式7)を満足していることを目安としても良い。
AmV=−60×(pH)+590・・・・・・・(式7)
(at.80℃)(AmVは、Ag/AgCl電極基準)但し、1.0<pH<3.
0
過酸化水素による3価砒素の酸化は非常に早く、添加中にpHの低下と反応熱による温度の上昇が観察される。しかし、酸化を完全に行うには60分間以上の時間をかける。
【0035】
反応温度は、40℃以上とすることが好ましい。さらに、3価砒素から5価砒素への酸化反応を促進する観点からは、反応温度は高い程好ましい。
尚、既述の通り、過酸化水素添加による3価砒素の5価砒素への酸化反応は発熱反応である。この為、例えば、砒素濃度50g/L程度の溶液を、80℃にて酸化反応させようとした場合、装置からの放熱状況にもよるが、おおよそ液温60℃で過酸化水素の添加を開始すれば、所定量添加終了時の液温は約80℃となっている。
【0036】
次に、該酸化反応後液に残留する酸化剤を除去する工程について説明する。
これは、反応後に残留する酸化剤が、次工程の結晶化工程(5)で添加する第一鉄(Fe2+)の一部を酸化してしまうので、第一鉄イオン濃度を正確に管理するためには、除去することが望ましいからである。
浸出液(3)中に残留する過酸化水素を除去するには、金、銀等の金属のコロイドを添加し、これを分解する方法も考えられる。しかし、ハンドリング性やロスの発生による損失を考えると実操業では不適である。
ここで、本発明者等は、残留する酸化剤(例えば、過酸化水素)を分解するのではなく、消費により除去する構成に想到した。具体的には、被酸化剤(例えば、金属銅)と接触させ、(式8)に示す様に消費により除去する。
Cu0+H2O2+H2SO4=CuSO4+2H2O・・・・・(式8)
反応温度は、反応を完結させるため40℃以上が好ましい。また、反応はpHの上昇を伴うが、pHが一定値を示した時点で終了と判断出来る。
【0037】
4.結晶化工程
結晶化工程(5)は、液調整工程(4)で得られた調整液中の5価砒素を、スコロダイト(6)へと結晶化する工程である。
前記液調整工程(4)を終えて得られる調整液の砒素濃度は、スコロダイト(6)の生産性を考えた場合、20g/L以上、好ましくは30g/L以上の濃厚液であることが好ましい。
まず、当該調整液に対し第一鉄(Fe2+)塩を添加溶解し、室温にて硫酸(H2SO4)を添加しpH1に調整する。ここで、第一鉄塩化合物は種々あるが、設備の耐腐食性の観点および入手の容易性の観点から、硫酸第一鉄が好ましい。
第一鉄塩の添加量は、Fe純分量として被処理砒素総モル量の1倍当量以上、好ましくは1.5倍当量である。
【0038】
第一鉄塩を添加し、pH調整を終えたら、当該調整液を所定の反応温度まで昇温する。ここで反応温度は、50℃以上であればスコロダイト(6)が析出可能である。しかし、スコロダイトの粒径を大きくする観点からは、反応温度が高い程、好ましい。尤も、大気雰囲気下での反応を可能とする観点からは、反応温度を90〜100℃とすることが望ましい。
【0039】
当該調整液が、所定の反応温度に到達したら、空気または酸素またはこれら混合ガスの吹き込みを開始し、強攪拌を行って気液混合状態をつくり、所定の反応温度を保ちながら高温酸化反応を進める。
【0040】
当該高温酸化反応は2〜3時間程度で、下記、(式9)〜(式14)の様に進行すると考えられる。
(反応の前半)
2FeSO4+1/2O2+H2SO4=Fe2(SO4)3+H2O・・・・(式9)
2H3AsO4+Fe2(SO4)3+4H2O=2FeAsO4・2H2O+3H2SO4・・・・(式10)
(全反応式(式9+式10)を、下記、(式11)に示す。)
2H3AsO4+2FeSO4+1/2O2+3H2O=2FeAsO4・2H2O+2H2SO4・・・・(式11)
(As濃度が低下した反応後半)
2FeSO4+1/2O2+H2SO4=Fe2(SO4)3+H2O・・・・(式12)
2/3H3AsO4+1/3Fe2(SO4)3+4/3H2O=2/3FeAsO4・2H2O+H2SO4・・・・(式13)
(全反応式(式12+式13)を、下記、(式14)に示す。)
2/3H3AsO4+2FeSO4+1/2O2+4/3H2O=2/3FeAsO4・2H2O+2/3Fe2(SO4)3・・・・(式14)
【0041】
酸化方法にもよるが、当該高温酸化反応開始後、2時間〜3時間で、pH、砒素濃、Fe濃度が急激に低下する。当該段階において、液の酸化還元電位は95℃で400mV以上(Ag/AgCl電極基準)を示す。そして、含有されている砒素の90%以上がスコ
ロダイト(6)の結晶となる。当該高温酸化反応開始後、3時間以降は、液中に残留する砒素が少量低下するのみで、pHや液電位は殆ど変化しない。尚、当該高温酸化反応を完全に平衡状態で終えるには、好ましくは5時間〜7時間の継続を行う。
【0042】
上述した本発明に係る結晶化工程(5)によれば、反応操作が簡単であり、途中pH調整の必要もなく、含有される砒素を確実にスコロダイト(6)の結晶へ変換可能である。
生成するろ液(9)は、排水処理工程(10)にて処理すればよい。
得られるスコロダイト(6)の結晶は、沈降性、濾過性に優れ、濾過後の付着水分が10%前後と低く、さらに砒素品位が30%にも及ぶので減容化が達成され、かつ、耐溶出性に優れ安定である。従って、砒素を、製錬工程から安定な形として除去し保管可能となる。
【0043】
以下に実施例を示し、本発明をより具体的に説明する。
(実施例1)
<浸出>
As含有品位が74.4%の化学用試薬の三酸化二砒素(As2O3)と、試薬1級グレードのPbO(98%)、ZnO(99%)、CdO(95%)とを、表1に示す配合表により配合し、2リットルビーカー(4枚バッフル付き)に投入した。さらに当該2リ
ットルビーカーへ、純水1,500ccを加えて攪拌しパルプとした。次いで、当該パルプへ、固形NaOHを21g添加溶解し、温度を70℃へ昇温し、浸出を開始した。
浸出時間は、三酸化二砒素は短時間で浸出可能であるが、ここでは共存するPb、Cd、Znの反応も平衡させることを考え180分間とした。
尚、反応終了時のパルプのpHは8.78(at.69.5℃)であった。
得られた浸出液の品位とpHとを表2に示す。
【0044】
【表1】

【表2】

【0045】
<液調整>
得られた浸出液840ccを1Lビーカーに測り取り加熱を開始した。
当該浸出液に含まれる砒素が全て3価砒素と仮定し、当該3価砒素を酸化するに必要な当量の30%に当たる過酸化水素水63gを測り取った。
浸出液の温度が62℃に到達したら、測り取った過酸化水素水の添加を開始し15分間で全量添加した。尚、攪拌は空気を巻き込まない程度の攪拌を行った。
当該反応時の℃−pH−酸化還元電位(mV,Ag/AgCl電極基準)の推移を表3
に示す。
【0046】
【表3】

【0047】
調製液中に残留する過酸化水素水を金属銅を用いて除去する。今回は、試薬1級の銅粉末を用いた。
具体的には、液温が40℃となった時点で、銅粉=1.8gを添加した。当該銅粉添加
直時を反応開始時とし、反応時間経過に伴う℃−pH−酸化還元電位(mV,Ag/Ag
Cl電極基準)の推移を表4に示す。反応は4分間で完了し、調製後液を得た。
尚、調製後液中の砒素濃度は47.5g/L、銅濃度は、49mg/Lであった。
【0048】
【表4】

【0049】
<結晶化>
1)得られた調整後液を純水で希釈し、砒素濃度を45g/Lに調整した。
2)上記800ccを2Lビーカーに移し、95%硫酸を用いpH=1.15へ調整した。
3)添加する第一鉄(Fe2+)量は、Asモル量の1.5倍モル量とし、試薬1級の硫酸第一鉄(FeSO4・7H2O)を各200g測り取り、それぞれ2)の調整液へ溶解し、さらに95%硫酸にて30℃でpH=1.0へ調整した。
4)上記3)を大気圧下で加熱し95℃へ昇温し、次いでビーカー底部よりガラス管を用い酸素ガスを950cc/分で吹き込みを開始し、強攪拌下、気液混合状態で7時間高温酸化反応した。結果を以下の表5に示す。
【0050】
【表5】

【0051】
(第2の実施形態)
本発明者らの検討によると、上述した過酸化水素(H2O2)を用いた酸化方法は、3価砒素の酸化速度が速く、かつ、溶液温度を高温として反応させることにより、ほぼ100%近い3価砒素の酸化が達成される。しかし、過酸化水素は高価な薬剤である。
【0052】
一方、オゾン(O3)を用いた酸化方法は、溶液温度に関係なく、かつ、短時間に、ほぼ100%近い3価砒素の酸化が達成される。しかし、以下の問題がある。
オゾン発生設備自体が高コストである。さらにオゾンの酸化力が強い為、周辺装置の仕様も高度化せざるを得ず、システム全体としては非常な高コストとなる。
オゾンは人体に有害である為、未反応で大気に放出されるオゾンを回収・無害化する付帯設備が必要となる。
オゾンは酸素より水に溶けやすく、反応後液は特異の刺激臭を放つ等の問題がある。当該問題を除くため、後工程において溶存したオゾンを除去する工程が必要となる。
【0053】
一方、粉状金属銅等を触媒として添加する方法では、以下の問題点が明らかとなった。1)被処理液の砒素濃度が低い(例えば、3g/L程度)場合には、砒素の酸化率は100%近い。しかし、被処理液の砒素濃度が高い(例えば、60〜70g/L程度)場合は砒素の酸化率が79%程度に低下する。
2)金属銅(Cu°)が銅イオン(Cu2+)に変化する際に、3価砒素から5価砒素への変化に影響を与える。そして、当該変化の際、3価砒素に対して少なくとも等モル以上の金属銅が必要であるとしている。さらに、難水溶性銅化合物(Cu2O、CuS)においても、金属銅と同様の効果が認められるとしている。この結果、3価砒素化合物である亜砒酸の処理に際して、大量の薬剤(銅源)が必要である。
3)上記2)で説明したように、当該方法では亜砒酸(3価砒素)の処理に際して大量の銅源を使う。この結果、反応後の溶液には数10g/Lの大量の銅イオンが残る。従って、反応後の溶液からの銅の回収工程が必要となり、銅回収コストの負担増を招く。
4)当該反応は、酸性溶液中(例えば、pH値が0、FA(遊離酸)値が130g/L)における反応であるため、反応後の溶液には大量の酸分が残る。従って、反応後の溶液をベースとして5価砒素化合物を生成するためには、大量のアルカリが必要である。これは
、当該方法において、粉状金属銅および/または難水溶性銅化合物を、溶解させる必要があるため、すなわち必然的に酸分が必要とされることから、避けられない問題でもある。
【0054】
以下、本発明を実施するための第2の実施形態について、図2に示すフローチャートを参照しながら、1.被処理対象物、2.3価砒素の酸化反応、3.3価砒素の酸化反応開始時のpH値、4.3価砒素の酸化反応終了時のpH値、実施例2〜6、比較例1〜5の順に詳細に説明し、さらに、本発明者らの考える、5.3価砒素の酸化反応モデルについて説明する。
【0055】
本実施形態によれば、非鉄製錬所内で容易に調達可能な資材を用いることで、低操業コスト、低設備コストでありながら99%以上の酸化率をもって、3価砒素を5価砒素へ酸化することが可能になった。
【0056】
1.被処理対象物
本実施の形態は、高濃度の砒素溶液の作製に最適な処理方法である。
つまり、本実施の形態によれば、溶解度の小さな3価砒素を、溶解度の大きな5価砒素へ容易に酸化可能である。従って、3価砒素源として固体である三酸化二砒素〈1〉を用いることにより、3価砒素が5価砒素へ酸化されるのと並行して当該三酸化二砒素が溶解し、3価砒素が適時供給される形となる。この結果、数10g/Lの高濃度な5価砒素溶液、すなわち濃厚な砒酸溶液の作成が容易となるものである。
【0057】
2.3価砒素の酸化反応
酸化工程〈4〉に係る本実施の形態を導出するにあたり、本発明者らは、銅を砒素の酸化触媒として用い、3価砒素を酸素により酸化する工程に関して検討を行った。
当該検討のいくつかを、以下に記載する。
【0058】
1)酸化触媒として銅イオンのみを使用する(後述の比較例1、比較例2に相当する。)。
2)酸化触媒として硫化銅のみを使用する(後述の比較例3に相当する。)。
3)酸化触媒として硫化銅と銅イオンとの2種を共存させて使用する(後述の比較例4に相当する。)。
4)酸化触媒として硫化銅と銅イオンと銅の5価砒素化合物との3種を共存させて使用する(後述の実施例2〜6に相当する。)。
【0059】
上述の検討の結果、1)〜4)ともに、銅の酸化触媒効果は認められた。しかし、酸化速度、酸化率の観点から4)が、1)〜3)と比較して効果が飛躍的に向上することを知見した。
当該知見に基づき、酸化触媒としては、硫化銅と、銅イオンと、銅の5価砒素化合物(砒酸銅)との3種を共存させて使用することとした。
以下、(a)硫化銅源、(b)銅イオン源、(c)銅の5価砒素化合物(砒酸銅)、および、(d)反応温度、(e)吹き込みガス種と吹き込み量、について詳細に説明する。
【0060】
(a)硫化銅源
硫化銅源〈2〉は、硫化銅固体、硫化銅粉末などを用いることが出来る。尤も、反応性を確保する観点からは、粉状であることが望ましい。また、硫化銅には、大別して、CuSとCu2Sとの形態が存在する(結晶格子中銅の一部が欠損した組成のCu9S5もある。)。本実施形態においては、そのどちらでも効果があり、これらの混合であっても良い。さらに、硫化銅源は、出来るだけ純粋な硫化銅(不純物が極力少なく、純度の高い硫化銅。)であることが好ましい。これは、純度の高い硫化銅を用いることで、As2S3、ZnS、PbS、CdS、等の混入を回避できるからである。
これら、As2S3、ZnS、PbS、CdS、等が混入してくると、以下、(式15〜18)に記載する反応がおこり、3価砒素の酸化反応に必要な銅イオンの供給が妨げられる。
さらに、As2S3、すなわち硫化砒素においては、意識的に銅イオンを添加した場合であっても以下に記載する反応がおこり、最適な銅イオン濃度の維持が難しくなるだけでなく、水素イオン(H+)発生反応が起きる。そして、水素イオン(H+)が発生すると、反応系のpH値が低下してしまい、本発明に係る3価砒素の酸化反応の維持が困難となり、3価砒素の酸化が困難になる。
【0061】
Cu2++1/3As2S3+4/3H2O=CuS+2/3HAsO2+2H+・・・(式15)
Cu2++ZnS=CuS+Zn2+・・・(式16)
Cu2++PbS=CuS+Pb2+・・・(式17)
Cu2++CdS=CuS+Cd2+・・・(式18)
【0062】
ここで、硫化銅源〈2〉として、製錬中間産物として回収される硫化銅を考えた場合、当該回収された硫化銅中には、上述したAs2S3、ZnS、PbS、CdS、等が相当量含まれている。従って、硫化銅源〈2〉として、製錬中間産物として回収される硫化銅をそのまま用いることは好ましくない。もし、用いたい場合には、事前に上述の硫化物を反応分解等により除去し、硫化銅としての純度を上げておけば良い。
【0063】
銅製錬所であれば、以下に記載する方法で、本発明に適した純度の高い硫化銅を簡単に製造可能である。
(1)電気銅を硫酸酸性下(FA(遊離酸)=50〜300g/L)で、加温しつつエアレーションして溶解(Cu=10〜30g/L)させ銅溶液を得る。
(2)得られた銅溶液を、50℃以上でNaSHやH2S等の硫化剤と反応させて硫化銅を回収する。
(3)回収された硫化銅を水洗浄し、付着酸分を取り除く。
この水洗浄後の硫化銅は不純物が少なく、乾燥状態であっても湿潤状態であっても、本発明に適用可能である。
【0064】
(b)銅イオン源
銅イオン源〈3〉は、処理水溶液において銅イオンとなるものを用いれば良い。例えば、硫酸銅は常温にて固体であり、水に溶解して直ぐに銅イオンとなるため好ましい。金属銅、金属銅粉を用いてもよいが、イオン化するまで溶解を待つ必要がある。
【0065】
(c)銅の5価砒素化合物(砒酸銅)
本実施形態に係る銅の5価砒素化合物として砒酸銅がある。砒酸銅の溶解度積は、砒酸鉄(FeAsO4)に匹敵するものであり、弱酸性から中性領域にて容易に形成する5価砒素化合物である。
本実施形態では、3価砒素を含む水溶液に硫化銅を添加し、初期pH値を2以上とし酸化反応を開始する。この為、添加された硫化銅表面では、3価砒素の5価砒素への酸化と、硫化銅の溶解による銅イオンの供給とが並行する為、瞬時に砒酸銅の生成が起きるものと考えられる。また、反応終了時には、溶液が弱酸性領域へ自然移行するものの、この時点では5価砒素および銅イオン共にg/Lオーダーまで濃縮されている。当該濃縮により、砒酸銅の生成能力は、依然低下することがない。
ここで、溶液のpH値が1を割り込む酸性側とならなければ、砒酸銅の形成能力が極端に低下することはない為、pH値の管理を行うことが好ましい。
【0066】
(d)反応温度
砒素の酸化は、溶液温度が高いほうが良好である。具体的には、砒素の酸化を進めるためには50℃以上の温度が求められる。実操業を考慮し、反応槽の材質や反応後の濾過操作を前提とすれば70〜90℃、好ましくは80℃前後に加温〈5〉する。
【0067】
(e)吹き込みガス種と吹き込み量
吹き込みガス〈6〉が、空気であっても3価砒素の酸化反応は可能である。しかし、酸素、または、空気と酸素との混合ガスを吹き込みガス〈6〉とした場合は、溶液中の砒素濃度が低い範囲であっても酸化速度が維持され、吹き込み(ガス)容量も小さくなるため、これに伴うヒートロスも少なくなり反応温度の維持管理が容易になる。そこで、酸化速度、反応温度の維持管理の観点から、吹き込みガス〈6〉は、酸素、または、酸素と空気との混合ガスが好ましい。
【0068】
吹き込みガス〈6〉の単位時間当たりの吹き込み量は、反応槽の気液混合状態により、最適値が変化する。例えば、微細気泡発生装置等を用いれば、酸化効率はさらに向上し、吹き込み量を減らすことが可能となる。
従って、実機操業時には、その気液混合状態や酸素吹き込み方式等を加味して最適値を見出すことが肝要である。
【0069】
3.3価砒素の酸化反応開始時のpH値
本発明に係る3価砒素の酸化反応の基本式は、以下であると考えられる。
As2O3+H2O=2HAsO2・・・・(式19)
三酸化二砒素が水に亜砒酸(3価砒素)として溶解する反応
2HAsO2+O2+2H2O=2H2AsO4−+2H+・・・・(式20)
亜砒酸(3価砒素)が酸化する反応
2HAsO2+O2+2H2O=2H3AsO4・・・・(式21)
亜砒酸(3価砒素)が酸化する反応
【0070】
後述する実施例のように、全砒素溶解時の砒素濃度が40g/L以上の濃厚液の場合は、亜砒酸の溶解度が小さいため三酸化二砒素は全量初期に溶解するのではない。
濃厚砒素液の場合は、亜砒酸が、(式20)、(式21)により溶解度の大きい砒酸へ酸化され、亜砒酸濃度が減少すると並行して、(式19)により亜砒酸が系内へ補給される反応が進行するものと考えられる。つまり、反応初期は、固体の三酸化二砒素が懸濁しながら溶解していくものと考えられる。
【0071】
ここで、亜砒酸の砒酸への酸化は、(式20)、(式21)によるものと考えられる。
当該亜砒酸の砒酸への酸化反応において、初期の30分間で溶液のpH値が2前後へ急激に低下する挙動を示す。当該挙動から、pH2以上の中性側では主に(式20)により酸化が進んでいるものと推定できる。その後の30分間以降では、pH値の低下は緩慢となることから、反応は主に(式21)にて進んでいるものと推定できる。
以上のことから、本発明により3価砒素を効率的に酸化し、且つ、反応終了時のpH値を弱酸性に制御するためには、酸化反応開始時(空気および/または酸素の吹き込み開始時)のpH値を2以上とすれば良いことが理解される。
【0072】
4.3価砒素の酸化反応終了時のpH値
本発明に係る実施の形態において、後述する実施例2〜6の結果が示すように、3価砒素の酸化反応終了時(空気および/または酸素の吹き込み停止時)のpH値は、全て2未満であり、具体的には1.8前後となった。
当該1.8前後のpH値は、5価砒素化合物生成に好ましいpH値である(酸濃度が適正値にある。)。これは、5価砒素化合物である砒酸鉄生成の最適pH域がpH3.5
〜4.5であるため、酸分の中和のため消費される中和剤が少なくて済むからである。
一方、スコロダイト(FeAsO4・2H2O)生成は、pH1前後の5価砒素溶液が元液として用いられるため、少量の逆中和剤(例えば硫酸)添加によりpH調整が可能となるからである。さらに、詳細は後述する実施例6にて説明するが、反応終了時のpH値は、2未満であり1以上であることが好ましい。
【0073】
3価砒素の酸化反応終了時(空気および/または酸素の吹き込み停止時)のpH値が2未満であり、具体的には1.8前後となるのは、上記(式19)〜(式21)により、もたらされるものと考えられる。
まず、(式19)により、三酸化二砒素が水に亜砒酸(3価砒素)として溶解する。尤も、出発原料が固体の三酸化二砒素である場合に限られず、すでに亜砒酸として3価砒素が溶解している水溶液の場合でも同様である(従って、本発明は、一般の排水処理にも適用可能である場合があると考えられる。)。
【0074】
上述の酸化工程〈4〉で得られた産物を、濾過〈7〉において、濾液〈8〉と濾過物〈9〉とに分離する。濾過〈7〉においては、例えば、フィルタープレスの様な、通常の濾過方法を適用できる。上述の酸化工程〈4〉にて、銅の5価砒素化合物が生成されるものの、粘性が高まる等の濾過性の問題がないからである。
【0075】
得られた濾液〈7〉は、上述したように1.8前後のpH値を有する砒酸溶液である。当該1.8前後のpH値は、5価砒素化合物生成に好ましいpH値であることから、濾液〈7〉から、低コスト且つ高生産性をもって5価砒素化合物を生成出来る。
一方、濾過物〈9〉は、硫化銅と、銅の5価砒素化合物との混合物であるので、そのまま酸化触媒として繰り返し使用することが出来る。この繰り返し使用の際、一部溶解した硫化銅に相応する量の硫化銅を、新たに追加添加すれば、触媒効果はさらなる向上が期待出来る。
【0076】
5.3価砒素の酸化反応機構のモデル
本発明に係る硫化銅と、銅イオンと、銅の5価砒素化合物よる3元系触媒は、高い酸化率と酸化速度を兼ね備えたものである。この3元系触媒が発揮する酸化触媒効果は、硫化銅表面での各イオン種の接触がもたらす電池的な反応に起因するものと考えられる。
【0077】
例えば、pH2前後の領域を例として、酸化反応機構のモデルを考える。
まず、3価砒素の酸化を電極反応に置き換えれば、陽極反応は(式22)、陰極反応は(式23)として示される。
As2O3+5H2O=2H3AsO4+4H++4e−・・・・・(式22)
4H++O2+4e−=2H2O・・・・・(式23)
すなわち3価砒素の酸化反応は(式22)にて示す反応が進むが、反応を進めるためには電気的に中性を維持する必要がある。従って、硫化銅表面で進む(式23)で示す陰極反応の進行が、反応性を左右するものと考えられる。このことから、常に活性度の高い硫化銅表面の確保が重要になるものと考えられる。
【0078】
すなわち本反応モデル系では、銅イオンが共存し、且つ、弱酸pH領域の反応であるため、硫化銅表面では(式24)に示す砒酸銅化合物の晶出反応が起きるものと考えられる。
Cu2++H3AsO4+H2O=CuHAsO4・H2O+2H+ ・・・・(式24)
上記(式24)により、硫化銅表面には水素イオン(H+)が補給され、(式25)(式26)に示す反応が並行して進むと考えられる。
CuS+2H++1/2O2=Cu2++S°+H2O ・・・・・(式25)
CuS+H++2O2=Cu2++HSO4− ・・・・・(式26)
【0079】
ここで、硫化銅表面には、砒酸銅化合物が形成されているため、酸素供給が不十分となり、(式25)に示すS°(元素状硫黄)生成反応も進むと考えられる。さらに(式25)(式26)の進行に伴い、局所的にCuイオン濃度が上昇し、且つ、水素イオン(H+)濃度の低下が生じるものと推定される。そして、当該局所においては、(式27)に示す硫化銅の生成反応が、上記(式25)(式26)と並行的に進行するものと考えられる。
Cu2++4/3S°+4/3H2O=CuS+1/3HSO4−+7/3H+・・・
・・(式27)
(式27)は、硫化銅であるCuSの晶出を示すものであり、硫化銅の表面には活性度が高い新生面としてのCuS晶出が確保されることを意味するものである。
【0080】
さらに(式27)で生成する水素イオン(H+)は、(式25)(式26)の示す反応へ供給される他、砒酸銅化合物の溶解反応((式24)の逆反応)でも消費される。この結果、銅イオンの硫化銅表面への補給と、砒酸(H3AsO4)の沖合への拡散とが、進行するものと考えられる。
尚、後述の[比較例5]に示すpH0条件下では、(式24)に示す反応が基本的に進行せず、また、(式27)に示す反応も進み難くなる為、酸化効率が極端に低下するのだと解釈される。
【0081】
(実施例2)
試薬グレードの三酸化二砒素(品位を表6に示す。)、試薬グレードの硫化銅(品位を表7に示す。)を準備した。
上述したように、硫化銅には、大別してCuSとCu2Sとの2形態、さらに、結晶格子中銅の一部が欠損した組成のCu9S5がある。そして、いずれの形態でも使用可能であり、また、いずれかの形態の混合であっても良い。
本実施例に用いた硫化銅のX線回折の結果を、図3に示す。尚、図3において、CuSのピークを△で、Cu2Sのピークを☆で、Cu9S5を◆で示した。当該X線回折の結果から、本実施例に用いた硫化銅はCuSと、Cu2Sと、Cu9S5との混合物と考えられる。
【0082】
【表6】

【表7】

【0083】
反応容器は1リットルビーカーを使用し、攪拌措置は700rpmの2段タービン羽および4枚邪魔板を使用し、ガス吹き込みは、ガラス管を介して前記ビーカー底部より酸素の吹き込みを実施した(強攪拌状態とし、気液混合状態にて酸化した)。
【0084】
三酸化二砒素50gと、硫化銅48gとを反応容器に投入し、純水800ccでリパ
ルプし80℃へ加温した。次いで、撹拌装置を用いて溶液の攪拌を開始し、さらに、当該反応容器の底部に酸素ガスの吹き込みを400cc/分にて開始し、3価砒素の酸化を行った。尚、酸素ガス吹き込み開始直前の溶液のpH値は3.09(at80℃)であった。
【0085】
溶液の攪拌と酸素ガスの吹き込みとを90分間継続し、当該3価砒素の酸化を行った。そして30分間ごとに、溶液の、温度、pH値、酸化還元電位、銅イオン量、3価砒素量、5価砒素量を測定した。当該測定結果を表8に示す。尚、酸化還元電位は、Ag/AgCl電極基準値である。
【0086】
【表8】

【0087】
当該3価砒素の酸化を90分間継続して行った後、溶液を濾過し、沈殿物として回収した触媒を水洗浄し、当該触媒の品位分析とX線回折とを行った。当該反応後の触媒の品位分析結果を表9に、X線回折結果を図4に示した。尚、図4において、CuSのピークを△で、銅の5価砒素化合物のピークを○で示した。
【0088】
【表9】

【0089】
以上、表8、表9、および図4より、本実施例2に係る反応系において、硫化銅と、銅イオンと、銅の5価砒素化合物(砒酸銅)とが共存していることが理解されるものである。
さらに、本実施例2においては、3価砒素の酸化速度、酸化率とも高いことが判明した。特に、酸化率においては酸化反応開始後90分間の時点で、既に99%以上に達していることが認められた。
【0090】
(実施例3)
反応容器に投入する硫化銅の量を半分の24gとした以外は、実施例2と同様の操作を行い、同様の測定を行った。
尚、酸素ガス吹き込み開始直前の溶液のpH値は2.96(at80℃)であった。
30分間ごとに、溶液の、温度、pH値、酸化還元電位、銅イオン量、3価砒素量、5価砒素量を測定した結果を表10に示し、沈殿物として回収した触媒の水洗後の品位分析結果を表11に示す。
【0091】
【表10】

【表11】

【0092】
本実施例3においては、CuS添加量を実施例2の半分とし、当該半減の効果を検討したものである。
その結果、実施例2に較べて、3価砒素の酸化速度は若干劣るが、酸化能力は十分保持され、酸化反応開始後120分間の時点で99%以上の酸化が認められた。実施例2と同様、3価砒素の酸化能力、速度共に、実用化に十分好適と考えられる。
【0093】
(実施例4)
本実施例では、実施例2と同様だが、さらに試薬グレードの硫酸銅(CuSO4・5H2O)16gを反応容器に投入した。当該硫酸銅の投入量は、銅イオンとして5g/Lに相当する量である。本実施例は、反応初期より銅イオン濃度を高めた場合の実施例である。
尚、酸素ガス吹き込み開始直前の溶液のpH値は2.98(at80℃)であった。
30分間ごとに、溶液の、温度、pH値、酸化還元電位、銅イオン量、3価砒素量、5価砒素量を測定した結果を表12に示す。
【0094】
本実施例では、反応終了時の120分時点において酸素ガス吹き込みを停止した。そして、濃度500g/LのNaOH溶液を添加して、溶液をpH=3.5へ中和し、液中に
溶存する銅イオンを5価砒素化合物として晶出させた後、濾過操作を行った。尚、NaOH溶液の添加量は40ccであった。
濾過操作により得られた濾液の全砒素濃度は、29.6g/L、銅濃度は80mg/Lであり、砒酸銅化合物形成に伴う、濃度低下が認められた。
一方、濾過操作により回収された殿物は165g・wetであった。当該殿物のうち5g・wetを採取し、水分測定したところ水分=59.9%であった。また、当該殿物のうち5g・wetを、水洗浄し品位分析を行った。回収された殿物の品位分析結果を表13に示す。
【0095】
【表12】

【表13】

【0096】
本実施例4は、実施例2における反応初期よりCuイオン濃度を高めたものである。
表12の結果から、本実施例においても、高い酸化率にて反応が完結していることが認められた。
一方、本実施例4では、実施例2に比して若干酸化速度が落ちている。従って、反応系内の銅イオン濃度は、必要以上に高く設定する必要がないことが判明した。反応系内の銅イオン濃度は、1〜5g/L程度で十分と判断される。
【0097】
尤も、触媒として、湿式硫化反応で生成された直後の硫化銅を用いる場合、当該硫化銅は難溶性の挙動を取る。そこで、湿式硫化反応で生成された直後の硫化銅を触媒として用いる場合は、反応系内への銅イオンの添加が有効である。
また、本実施例では、中和により添加した銅イオンを、銅の5価砒素化合物として回収している。銅イオンの回収方法は、銅の5価砒素化合物として回収する方法以外にも、元素状硫黄やZnS等の、銅イオンと反応し硫化銅を形成する薬剤を添加する方法によっても良い。
【0098】
(実施例5)
試薬グレード三酸化二砒素50gを準備した。
実施例4で回収した全殿物(実施例4で、測定用サンプルに供した10g・wetは除く。)と、三酸化二砒素50gとを反応容器へ投入し、純水707ccでリパルプし、パルプ中の水分を800ccとした。当該パルプを80℃に加温し、次いで、反応容器の底部に酸素ガスの吹き込みを400cc/分にて開始した。
尚、酸素ガス吹き込み開始直前のpH値は3.03(at79℃)であった。
【0099】
30分間ごとに、溶液の、温度、pH値、酸化還元電位、銅イオン量、3価砒素量、5価砒素量を測定した結果を表14に示す。
【0100】
【表14】

【0101】
90分間反応させた後、酸素吹き込みを停止し、500g/LのNaOH溶液を添加して溶液のpH値を3.0へ中和した後、当該溶液を濾過した。尚、該NaOH溶液の使用量は36ccであった。
得られた濾液の全砒素濃度は44.8g/L、Cu濃度は210mg/Lであり、砒素濃度はほぼ配合値濃度のものが回収されていることが判明した。
一方、得られた殿物は122g・wetであった。得られた殿物のうち5g・wetを採取し水分測定したところ水分=48.9%であった。また、得られた殿物のうち5g・
wetを水洗浄し分析を行った。沈殿物として回収した触媒の品位分析結果を表15に示した。
【0102】
【表15】

【0103】
本実施例5は、実施例2〜6のなかで、最も酸化効率が高く、且つ、酸化速度も速かった。具体的には、反応60分時点で既に95%の酸化が認められ、反応90分時点ではほぼ100%近い99.6%の酸化率を示した。
本実施例5に係る触媒も、硫化銅と、銅イオンと、砒酸銅化合物(銅の5価砒素化合物)との3種共存である。そして、本実施例5に係る触媒は、実施例2、3に比較して、特に砒酸銅化合物(銅の5価砒素化合物)の含有比率が高いものである。当該砒酸銅化合物の高含有比率が、酸化性能向上へ寄与しているものと考えられる。すなわち、当該寄与現象は、「酸化反応のモデル」にて説明したように、砒酸銅化合物の形成・存在が活性なCuSの新生面生成に関与していることを裏付けるものと考えられる。
【0104】
(実施例6)
パルプに濃硫酸を添加することで、酸素吹き込み開始直前のpH値を1.0(at80℃)へ調整した以外は、実施例3と同様の操作を行った。
【0105】
30分間ごとに、溶液の、温度、pH値、酸化還元電位、銅イオン量、3価砒素量、5価砒素量を測定した結果を表16に示す。また、反応後の触媒品位(水洗浄済み)を表17に示した。
【0106】
【表16】

【表17】

【0107】
本実施例6は、添加した硫化銅量は実施例3と同様であるが、酸化開始直前の溶液のpH値を1に調整したものである。
この結果、酸化能力が実施例3に較べて低下し、120分間後の時点で72%の酸化率であった。酸化率100%に到達させるためには、長時間反応させる必要があると考えられるが、酸化能力自体は十分保持している。
【0108】
上述した酸化速度減少の原因は、共存する砒酸銅が大幅に減少した為であると考えられる。さらに、溶液のpH値が1では、硫化銅の溶解量が増える為、未溶解分として回収される硫化銅の量(リサイクル量)が減り、コスト的にも不利となる。
以上のことから、溶液のpH値は2以上として反応を開始し、少なくともpH値1以上で酸化反応を終了することが、反応性確保、CuS回収量確保の観点から好ましいと考えられる。
【0109】
(比較例1)
試薬グレードの三酸化二砒素50gのみを反応容器に投入し、純水800ccでリパルプした以外は、実施例2と同様の操作を行った。
尚、酸素ガス吹き込み開始直前のpH値は2.80(at80℃)であった。
そして30分間ごとに、溶液の、温度、pH値、酸化還元電位、銅イオン量、3価砒素量、5価砒素量を測定した。当該測定結果を表18に示す。
【0110】
【表18】

【0111】
本比較例1では、3価砒素の酸化が殆ど進まないことが判明した。
【0112】
(比較例2)
試薬グレードの三酸化二砒素50gと、試薬グレード硫酸銅(CuSO4・5H2O)16g(Cuイオンとして5g/L)を反応容器に投入し、純水800ccでリパルプした以外は、実施例2と同様の操作を行った。
尚、酸素ガス吹き込み開始直前のpH値は3.33(at80℃)であった。
そして30分間ごとに、溶液の、温度、pH値、酸化還元電位、銅イオン量、3価砒素量、5価砒素量を測定した。当該測定結果を表19に示す。
【0113】
【表19】

【0114】
本比較例2では、比較例1に較べれば酸化の進行が認められるが、その程度は小さい。
【0115】
(比較例3)
試薬グレード三酸化二砒素50gと、試薬グレード硫酸銅(CuSO4・5H2O)32g(銅イオンとして10g/L)を反応装置に投入し、純水800ccでリパルプした以外は、実施例2と同様の操作を行った。
尚、酸素ガス吹き込み開始直前のpH値は3.45(at81℃)であった。
そして30分間ごとに、溶液の、温度、pH値、酸化還元電位、銅イオン量、3価砒素量、5価砒素量を測定した。当該測定結果を表20に示す。
【0116】
【表20】

本比較例3では、溶液中のCuイオン濃度を高くしたことにより、酸化の進行は認められる。しかし、その酸化の進行程度はまだ小さく、さらなる銅イオンの添加補給が必要と考えられ、実用化には不適と考えられる。
【0117】
(比較例4)
試薬グレード三酸化二砒素50gと、試薬グレード硫化銅(CuS)48gと硫黄粉末20gとを反応装置に投入し、純水800ccでリパルプした以外は、実施例2と同様の
操作を行った。
尚、酸素ガス吹き込み開始直前のpH値は2.67(at80℃)であった。
そして30分間ごとに、溶液の、温度、pH値、酸化還元電位、銅イオン量、3価砒素量、5価砒素量を測定した。当該測定結果を表21に示す。
【0118】
【表21】

【0119】
反応終了後に溶液を濾過し、得られた澱物を水洗浄し、品位分析とX線回折を行った。
反応後の触媒品位(水洗浄済み)を表22に、また、X線回折結果を図5に示した。尚、図5において、CuSのピークを△で、硫黄のピークを■で示した。
品位分析において、砒素が0.1%検出されたが、これは未洗浄分の液付着分由来と考えられる。
図5および表22より、本比較例4においては、銅イオンと銅の5価砒素化合物との存在は認められず、硫化銅単味の触媒系であることが理解される。
【0120】
【表22】

本比較例4では、酸化の進行が認められる。従って、比較例2、3で説明したCuイオン単味よりも、硫化銅単味の方が酸化の方が触媒としての能力は高いことが判明した。しかし、実用化の観点からは、その酸化の進行程度はまだ小さく不適と考えられる。
【0121】
(比較例5)
パルプに濃硫酸を添加し、pH値を0(at80℃)に調整した後 酸素吹き込みを開始した以外は、実施例2と同様の操作を行った。
そして30分間ごとに、溶液の、温度、pH値、酸化還元電位、銅イオン量、3価砒素量、5価砒素量を測定した。当該測定結果を表23に示す。
【0122】
【表23】

【0123】
反応終了後に溶液を濾過し、得られた澱物を水洗浄し、品位分析とX線回折を行った。
反応後の触媒品位(水洗浄済み)を表24に、また、X線回折結果を図6に示した。尚、図6において、CuSのピークを△で、三酸化二砒素のピークを□で示した。
【0124】
【表24】

【0125】
本比較例5においては、砒素の酸化が進行せず、反応後触媒にも砒素が10.6%検出
された。また、図6が示す様に、X線回折の結果から三酸化二砒素が確認されることから、酸化反応後においても、三酸化二砒素が未溶解のまま残っているものと理解される。
これは、溶液が硫酸酸性のpH値が0で酸化反応を開始したため、三酸化二砒素の溶解度が低下したこと。さらに、溶液中へ溶出した3価砒素が、溶解度が大きな5価砒素へ酸化されることなく溶液中に残留し、溶液中の3価砒素濃度が低下しないため、三酸化二砒素の一部が未溶解のまま残っているためであると考えられる。
【0126】
本比較例5の結果から、砒素の酸化反応を、砒酸銅が形成できないpH値が0の条件から始めた場合、触媒となる物質は、硫化銅と銅イオンとの2元系となり、酸化能力が激減したものと考えられる。 結局のところ、本特許に係る砒素の酸化反応は、少なくともpH値1以上条件で開始することが好ましいことが判明した。
【図面の簡単な説明】
【0127】
【図1】本発明に係る砒素の処理方法を示すフローチャートである。
【図2】本発明(第2実施形態)の実施形態に係るフローチャートである。
【図3】実施例2に係る硫化銅のX線回折結果である。
【図4】実施例2に係る澱物のX線回折結果である。
【図5】比較例4に係る澱物のX線回折結果である。
【図6】比較例5に係る澱物のX線回折結果である。
【特許請求の範囲】
【請求項1】
三酸化二砒素(As2O3)と重金属とを含む非鉄製錬中間産物に水とアルカリとを加えてスラリーとし、当該スラリーを加温し、砒素を浸出して浸出液を得る浸出工程と、
当該浸出液に酸化剤を添加して、3価砒素を5価砒素へ酸化し調整液を得る液調製工程と、
当該調整液中の砒素をスコロダイト結晶へ転換する結晶化工程とを、有することを特徴とする三酸化二砒素と重金属とを含むものの処理方法。
【請求項2】
前記浸出工程が、アルカリとしてNaOHを用い、pH8以上のアルカリ領域で行なわれることを特徴とする請求項1記載の三酸化二砒素と重金属とを含むものの処理方法。
【請求項3】
前記液調整工程が、酸化剤として過酸化水素を用い、さらに前記調整液中に残留する過酸化水素を金属銅と接触させて除去することを特徴とする請求項1または2に記載の三酸化二砒素と重金属とを含むものの処理方法。
【請求項4】
前記結晶化工程が、前記調整液へ第一鉄(Fe2+)塩を添加溶解し、当該第一鉄塩を酸化させることで、前記調整液中の砒素をスコロダイト結晶へ転換するものであることを特徴とする請求項1から3のいずれかに記載の三酸化二砒素と重金属とを含むものの処理方法。
【請求項5】
前記第一鉄塩の酸化の為、前記調整液へ空気又は酸素又はこれら混合ガスを吹き込むことを特徴とする請求項4に記載の三酸化二砒素と重金属とを含むものの処理方法。
【請求項6】
前記結晶化工程が、pH1以下の領域で行われること特徴とする請求項1か5のいずれかに記載の三酸化二砒素と重金属とを含むものの処理方法。
【請求項7】
前記結晶化工程が、50℃以上で行われること特徴とする請求項1から6のいずれかに記載の三酸化二砒素と重金属とを含むものの処理方法。
【請求項8】
三酸化二砒素(As2O3)および/または亜砒酸イオンを含み、50℃以上に加温され、pH値が1以上の中性側であり、硫化銅と銅イオンと銅の5価砒素化合物とを含む水溶液へ、
空気および/または酸素を吹き込むことで、当該水溶液中の3価砒素を5価砒素へ酸化することを特徴とする砒素の酸化方法。
【請求項9】
三酸化二砒素(As2O3)および/または亜砒酸イオンを含み、50℃以上に加温され、pH値が2以上の中性側であり、硫化銅を含む水溶液へ、
空気および/または酸素を吹き込むことで、前記硫化銅の一部を溶解させて銅の5価砒素化合物を生成させながら、当該水溶液中の3価砒素を5価砒素へ酸化することを特徴とする砒素の酸化方法。
【請求項10】
空気および/または酸素の吹き込み開始時のpH値が2以上であり、吹き込み停止時のpH値が2未満であることを特徴とする請求項8または9に記載の砒素の酸化方法。
【請求項11】
前記水溶液中の3価砒素が5価砒素へ酸化した後、パルプが生成した当該水溶液を濾過して濾過殿物を回収し、当該濾過殿物を前記硫化銅の代替物として用いることを特徴とする請求項8から10のいずれかに記載の砒素の酸化方法。
【請求項12】
前記水溶液中の3価砒素が5価砒素へ酸化した後、パルプが生成した当該水溶液を中和
してpH値を3以上とすることで、当該水溶液中の銅イオンを銅の5価砒素化合物として晶出させた後、濾過して濾液と濾過殿物を回収し、当該濾過殿物を硫化銅の代替物として用いることを特徴とする請求項8から11のいずれかに記載の砒素の酸化方法。
【請求項1】
三酸化二砒素(As2O3)と重金属とを含む非鉄製錬中間産物に水とアルカリとを加えてスラリーとし、当該スラリーを加温し、砒素を浸出して浸出液を得る浸出工程と、
当該浸出液に酸化剤を添加して、3価砒素を5価砒素へ酸化し調整液を得る液調製工程と、
当該調整液中の砒素をスコロダイト結晶へ転換する結晶化工程とを、有することを特徴とする三酸化二砒素と重金属とを含むものの処理方法。
【請求項2】
前記浸出工程が、アルカリとしてNaOHを用い、pH8以上のアルカリ領域で行なわれることを特徴とする請求項1記載の三酸化二砒素と重金属とを含むものの処理方法。
【請求項3】
前記液調整工程が、酸化剤として過酸化水素を用い、さらに前記調整液中に残留する過酸化水素を金属銅と接触させて除去することを特徴とする請求項1または2に記載の三酸化二砒素と重金属とを含むものの処理方法。
【請求項4】
前記結晶化工程が、前記調整液へ第一鉄(Fe2+)塩を添加溶解し、当該第一鉄塩を酸化させることで、前記調整液中の砒素をスコロダイト結晶へ転換するものであることを特徴とする請求項1から3のいずれかに記載の三酸化二砒素と重金属とを含むものの処理方法。
【請求項5】
前記第一鉄塩の酸化の為、前記調整液へ空気又は酸素又はこれら混合ガスを吹き込むことを特徴とする請求項4に記載の三酸化二砒素と重金属とを含むものの処理方法。
【請求項6】
前記結晶化工程が、pH1以下の領域で行われること特徴とする請求項1か5のいずれかに記載の三酸化二砒素と重金属とを含むものの処理方法。
【請求項7】
前記結晶化工程が、50℃以上で行われること特徴とする請求項1から6のいずれかに記載の三酸化二砒素と重金属とを含むものの処理方法。
【請求項8】
三酸化二砒素(As2O3)および/または亜砒酸イオンを含み、50℃以上に加温され、pH値が1以上の中性側であり、硫化銅と銅イオンと銅の5価砒素化合物とを含む水溶液へ、
空気および/または酸素を吹き込むことで、当該水溶液中の3価砒素を5価砒素へ酸化することを特徴とする砒素の酸化方法。
【請求項9】
三酸化二砒素(As2O3)および/または亜砒酸イオンを含み、50℃以上に加温され、pH値が2以上の中性側であり、硫化銅を含む水溶液へ、
空気および/または酸素を吹き込むことで、前記硫化銅の一部を溶解させて銅の5価砒素化合物を生成させながら、当該水溶液中の3価砒素を5価砒素へ酸化することを特徴とする砒素の酸化方法。
【請求項10】
空気および/または酸素の吹き込み開始時のpH値が2以上であり、吹き込み停止時のpH値が2未満であることを特徴とする請求項8または9に記載の砒素の酸化方法。
【請求項11】
前記水溶液中の3価砒素が5価砒素へ酸化した後、パルプが生成した当該水溶液を濾過して濾過殿物を回収し、当該濾過殿物を前記硫化銅の代替物として用いることを特徴とする請求項8から10のいずれかに記載の砒素の酸化方法。
【請求項12】
前記水溶液中の3価砒素が5価砒素へ酸化した後、パルプが生成した当該水溶液を中和
してpH値を3以上とすることで、当該水溶液中の銅イオンを銅の5価砒素化合物として晶出させた後、濾過して濾液と濾過殿物を回収し、当該濾過殿物を硫化銅の代替物として用いることを特徴とする請求項8から11のいずれかに記載の砒素の酸化方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2009−242935(P2009−242935A)
【公開日】平成21年10月22日(2009.10.22)
【国際特許分類】
【出願番号】特願2008−180312(P2008−180312)
【出願日】平成20年7月10日(2008.7.10)
【出願人】(306039131)DOWAメタルマイン株式会社 (92)
【Fターム(参考)】
【公開日】平成21年10月22日(2009.10.22)
【国際特許分類】
【出願日】平成20年7月10日(2008.7.10)
【出願人】(306039131)DOWAメタルマイン株式会社 (92)
【Fターム(参考)】
[ Back to top ]

