砒酸鉄粉末
【課題】砒素含有溶液から製造されて砒素の溶出濃度が非常に低い砒酸鉄粉末、特に、砒素の溶出基準である0.3mg/Lよりも非常に低い溶出濃度の砒酸鉄粉末を提供する。
【解決手段】砒酸鉄粉末は、砒酸鉄二水塩の粉末であり、平均粒径が8μm以上、好ましくは10μm以上であり、BET比表面積が2m2/g以下、好ましくは0.5m2/g以下である。また、不純物として含有するカルシウムおよびマグネシウムの量がそれぞれ2質量%以下である。
【解決手段】砒酸鉄粉末は、砒酸鉄二水塩の粉末であり、平均粒径が8μm以上、好ましくは10μm以上であり、BET比表面積が2m2/g以下、好ましくは0.5m2/g以下である。また、不純物として含有するカルシウムおよびマグネシウムの量がそれぞれ2質量%以下である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、砒酸鉄粉末に関し、特に、非鉄製錬の製錬中間物などの砒素以外の各種の元素を含む砒素含有物質を処理して得られる高純度で高濃度の砒素を含む溶液から製造した砒酸鉄粉末に関する。
【背景技術】
【0002】
非鉄製錬において生成される各種の製錬中間物や製錬原料には、有価金属が含まれているが、砒素などの好ましくない元素も含まれている。
【0003】
従来、砒素を含む製錬中間物などから砒素を浸出して分離して回収する方法として、湿式反応により砒素を分離して砒素含有溶液を回収する方法が提案されている(例えば、特許文献1参照)。また、砒酸鉄溶液中に存在する砒素を鉄との安定な結晶性で且つ不溶出性の鉄・砒素化合物として除去して固定する方法が提案されている(例えば、特許文献2参照)。また、砒素含有溶液に鉄(II)溶液および鉄(III)溶液の少なくとも一方を加えて反応させてスコロダイト(Scorodite)(FeAsO4・2H2O)を生成させ、固液分離して銅を含む非鉄金属成分を含有するスコロダイトを回収し、得られた銅を含む非鉄金属成分を含有するスコロダイトに水を加えてリパルプし、スコロダイトに含まれる銅を含む非鉄金属成分を液中に溶かしてスコロダイトから分離する方法が提案されている(例えば、特許文献3参照)。さらに、砒素を含む煙灰から酸溶液により砒素を浸出し、その浸出液に鉄イオンを含む酸性水溶液を混合して非晶質の砒酸鉄(FeAsO4)を沈澱させた後、その混合液を加温して非晶質の砒酸鉄を結晶化し、その混合液をろ過して結晶化された砒酸鉄を除去する方法が提案されている(例えば、特許文献4参照)。また、鉄と砒素の化合物として砒酸鉄などの安定性の評価も報告されている(例えば、非特許文献1参照)。
【0004】
【特許文献1】特公昭61−24329号公報(第1−3頁)
【特許文献2】特開平11−277075号公報(段落番号0013−0014)
【特許文献3】特開2000−219920号公報(段落番号0007)
【特許文献4】特開2005−161123号公報(段落番号0006)
【非特許文献1】東北大学選鉱製錬研究所彙報 第34巻 第1号 別刷(昭和53年6月)、選鉱製錬研究所報告 第764号、「砒酸鉄、砒酸カルシウム、砒酸マグネシウムの溶解度積について(西村忠久、戸沢一光)」
【発明の開示】
【発明が解決しようとする課題】
【0005】
しかし、特許文献1は、砒素含有溶液を回収するまでの方法を提案しているが、その回収された砒素含有溶液を安定な不溶出性の物質まで固定する方法について提案していない。また、特許文献2〜4の方法によって生成される従来の鉄と砒素の化合物や、非特許文献1などに報告されている砒酸鉄のような従来の鉄と砒素の化合物よりもさらに安定な不溶出性の鉄と砒素の化合物を生成することが望まれている。特に、特許文献4の方法では、非晶質の砒酸鉄を沈澱させた後に非晶質の砒酸鉄を結晶化するので、非常に長時間を要するという問題がある。
【0006】
したがって、本発明は、このような従来の問題点に鑑み、砒素含有溶液から製造されて砒素の溶出濃度が非常に低い砒酸鉄粉末を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明者らは、上記課題を解決するために鋭意研究した結果、平均粒径が8μm以上、BET比表面積が2m2/g以下である砒酸鉄粉末が砒素の溶出濃度が非常に低いことを見出し、本発明を完成するに至った。
【0008】
すなわち、本発明による砒酸鉄粉末は、平均粒径が8μm以上、好ましくは10μm以上、BET比表面積が2m2/g以下、好ましくは0.5m2/g以下であることを特徴とする。この砒酸鉄粉末は、砒酸鉄二水塩の粉末であるのが好ましく、不純物として含有するカルシウムおよびマグネシウムの量が、それぞれ2質量%以下であるのが好ましく、0.1質量%以下であるのがさらに好ましい。
【発明の効果】
【0009】
本発明によれば、砒素含有溶液から砒素の溶出濃度が非常に低い砒酸鉄粉末を製造することができる。特に、砒素の溶出基準である0.3mg/Lよりも非常に低い溶出濃度の砒酸鉄粉末を製造することができる。
【発明を実施するための最良の形態】
【0010】
本発明による砒酸鉄粉末の実施の形態は、平均粒径が大きく、小さい粒径の粒子の割合が少なく、比表面積が小さいのが好ましい。平均粒径が大きく、小さい粒径の粒子の割合が少なく、比表面積が小さくて表面が平滑であれば、砒素の溶出濃度が非常に低くなるからである。具体的には、砒酸鉄粉末の平均粒径は、8μm以上であるのが好ましく、10μm以上であるのがさらに好ましい。また、砒酸鉄粉末の粒径5μm以下の粒子の割合は、10%以下であるのが好ましく、5%以下であるのがさらに好ましく、0%であるのが最も好ましい。さらに、砒酸鉄粉末のBET比表面積は、2m2/g以下であるのが好ましく、0.5m2/g以下であるのがさらに好ましい。
【0011】
また、本発明による砒酸鉄粉末の実施の形態は、砒酸鉄二水塩の粉末であるのが好ましく、不純物として含有するカルシウムおよびマグネシウムの量が、それぞれ2質量%以下であるのが好ましく、0.1質量%以下であるのがさらに好ましい。
【0012】
さらに、本発明による砒酸鉄粉末の実施の形態では、運搬効率などを考慮して圧縮密度ができるだけ高いのが好ましく、1トン加圧による圧縮密度が1.9g/cc以上であるのが好ましい。
【0013】
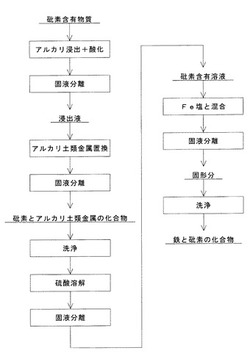
このような砒酸鉄粉末は、例えば、図1に示すような方法によって製造することができる。図1に示す方法では、砒酸鉄粉末は、(1)砒素含有物質をアルカリ溶液に加えてpH10以上、好ましくはpH12以上にして酸化しながらアルカリ浸出した後に固液分離して砒素を含む浸出液を得るアルカリ浸出・酸化工程と、(2)この浸出液にアルカリ土類金属またはその塩を添加した後に固液分離して砒素とアルカリ土類金属の化合物を含む残渣を得るアルカリ土類金属置換工程と、(3)この残渣を洗浄して付着したアルカリ液を除去する洗浄工程と、(4)この洗浄した残渣を硫酸溶液に添加した後に固液分離して高純度で高濃度の砒素含有溶液を得る硫酸溶解工程とを備えた砒素含有溶液の製造方法によって砒素含有溶液を製造し、(5)この砒素含有溶液にFe塩を添加して反応させた後に固液分離し、洗浄して固液分離し、その後、乾燥することによって製造することができる。このようにして得られた砒酸鉄粉末は、結晶粒が粗大であり、砒素の溶出濃度が非常に低く、廃棄、堆積または保管することができる。以下、これらの各工程について説明する。
【0014】
なお、上記の砒素含有溶液の製造方法の原料となる砒素含有物質としては、硫化砒素(As2S3)やFeAsSなどの硫化物のように硫黄と砒素を含む物質を使用することができる。また、亜鉛製錬工程などにより得られる砒化銅(Cu3As)を主成分とする残渣なども使用することができる。この砒化銅を主成分とする残渣には、亜鉛や鉄などの他にインジウムやガリウムなどの有価金属も含まれている。なお、実施の形態の砒素含有物質の処理方法によって処理する砒素含有物質が硫黄を含まない場合には、アルカリ浸出・酸化工程前にNa2SO4塩のような硫酸塩などを添加するか、あるいは、アルカリ浸出・酸化工程後の浸出液に硫酸塩などを添加して、アルカリ土類金属置換工程前の浸出液中にSO4イオンが存在するようにしておく必要がある。また、砒素含有物質は、砒素(As)と硫黄(S)の他に、銅(Cu)、亜鉛(Zn)、鉄(Fe)、インジウム(In)、ガリウム(Ga)、錫(Sn)、アンチモン(Sb)、鉛(Pb)、カドミウム(Cd)、ナトリウム(Na)、カリウム(K)、マグネシウム(Mg)およびカルシウム(Ca)の少なくとも一種を含んでもよい。
【0015】
(1)アルカリ浸出・酸化工程
まず、上記の砒素含有物質を酸化剤とともにアルカリ溶液に添加してpH10以上、好ましくはpH12以上にし、液温50〜100℃に加熱して撹拌しながら反応させることにより、砒素含有物質を酸化しながら浸出する。このアルカリ浸出・酸化工程における反応は、pH10以上、好ましくはpH12以上の強アルカリ性で起こる反応であり、反応速度は非常に速い。
【0016】
このアルカリ浸出によって、Cuを浸出させずにAsを浸出させてCuとAsを分離することができる。また、このアルカリ浸出では、In、Pb、CdおよびMgも浸出されず、Fe、Sn、SbおよびCaもほとんど浸出されない。しかし、Gaはほとんど浸出されるので、この段階では、AsとGaは分離されない。
【0017】
なお、Znは、アルカリ濃度が高いと浸出されるが、アルカリ濃度が低いと浸出されないので、砒素含有物質中のZnの品位、砒素の品位および他の不純物(特にSnとSb)の浸出挙動を勘案してアルカリ濃度を決定すればよい。すなわち、SnやSbの品位が低ければ、残渣中にZnを残しておく方がよいが、SnやSbの品位が高いと、ある程度Znを溶解させた方がよい。
【0018】
アルカリ溶液としてNaOH溶液を使用することができ、その場合、NaOH濃度が50〜300g/Lであるのが好ましい。
【0019】
酸化剤としては、過マンガン酸カリウムなどの固形酸化剤の他、過酸化水素やオゾンなどを使用することができるが、空気や濃度を高めた酸素などを使用してもよく、その場合、液中にガスを吹き込んでバブリングして撹拌することによって酸化反応が容易に進む。
【0020】
アルカリ浸出後に固液分離を行う。この固液分離は、フィルタプレス、遠心分離、デカンタ、ベルトフィルタなどの一般的なろ過のいずれでもよく、ろ過性、脱水性、洗浄性などを勘案してその種類および条件が決定される。
【0021】
一方、固液分離後の固形分は、有価なCuやInなどを含む金属性化合物と、一部酸化された化合物であるので、製錬工程において有効に活用することができる。なお、銅製錬では、自溶炉や反射炉に直接投入してアノードを作成することができる。
【0022】
(2)アルカリ土類金属置換工程
次に、固液分離後の浸出液(主にNaとAsを含む液)にアルカリ土類を添加する。アルカリ浸出後の浸出液にCaOなどのアルカリ土類を添加すると、アルカリ土類金属が砒素と反応してアルカリ土類金属と砒素の化合物を生成するとともに、NaOHのようなアルカリ液を再生する。
【0023】
上記の反応のために過剰のアルカリ土類を添加することによって、再生されたアルカリ液にSO4塩またはイオンを混在させて、アルカリ液へのアルカリ土類金属の混入を防止する。再生されたアルカリ液中にSO4塩がなく、ほぼ純粋なアルカリ液である場合には、過剰にアルカリ土類を添加すると、再生されたアルカリ液中にアルカリ土類金属が溶存してしまう。
【0024】
再生されたアルカリ液中にアルカリ土類金属が存在すると、そのアルカリ液を砒素の浸出に再利用する際に、砒素とアルカリ土類金属が反応して溶解度が低い沈殿物を生成するので、アルカリ浸出工程における浸出率が極端に悪くなる場合がある。一方、過剰のアルカリ土類金属を加えないと、アルカリ液中に砒素が除去されずに残ってしまうため、砒素の回収効率が非常に悪くなる。また、アルカリ液にSO4が混在していると、アルカリ土類としてCaOを使用した場合に、CaOまたはCa(OH)2がその状態で溶解せずに固形分中にとどまる。すなわち、Na+とSO42−の濃度を高くすることによって、Ca2+の溶解度が非常に低く抑制されるため、CaOとして固形分中にとどまる。
【0025】
アルカリ土類の添加量は、砒素とアルカリ土類金属の化合物を生成するための等当量でもよいが、Ca3(AsO4)2に加えてCa(OH)2を生成するように、等当量よりもややアルカリ土類リッチにするのが好ましい。
【0026】
(3)洗浄工程
次に、固形分として得られた砒素とアルカリ土類金属の化合物に付着したアルカリ液を水洗する。この水洗では、固形分中に砒素をとどめておく必要がある。砒素が洗浄排水中に溶出すると、その排水中の砒素を除去するための煩雑な操作が必要になるからである。そのような操作を回避するために、洗浄によってアルカリ液を除去するが砒素を除去しないようにすることが必要である。このような洗浄を可能にするために、上述したようにアルカリ土類を添加する際にアルカリ土類リッチにしてアルカリ性にするのが好ましい。また、アルカリ土類リッチにすると、洗浄によってアルカリ液が洗い流されるだけでなく、アルカリ土類金属が優先的に溶出し、砒素とアルカリ土類金属の化合物はそのまま保持される。なお、アルカリ土類の添加量は、洗浄水の量の増加に伴って多くなるが、Asと反応する量よりも0.5〜1.0質量%程度過剰に、あるいはそれ以上過剰にするのが好ましい。
【0027】
(4)硫酸溶解工程
次に、洗浄後の砒素とアルカリ土類金属の化合物を硫酸溶液に添加して、強く撹拌しながら反応させて、砒素を再溶解させるとともに石膏を生成する。この砒素とアルカリ土類金属の化合物は、アルカリ側では不溶性であるが、pHが4以下ではほぼ全量が溶解するので、鉱酸によってpHを4以下にすれば、ほぼ全量を溶解させることが可能である。しかし、砒素とアルカリ土類金属を分離するためには、硫酸を用いて石膏と砒素含有溶液に分離するのが好ましい。砒素とアルカリ土類金属の化合物を硫酸溶液に添加すると、砒素の溶解と同時に、アルカリ土類と硫酸塩の析出反応が起こる。
【0028】
硫酸溶液の濃度は、100〜500g/Lであるのが好ましく、150〜300g/Lであるのがさらに好ましい。砒素含有溶液中の砒素を高濃度にしたい場合には、硫酸溶液の濃度をより高くする必要があるが、生成する石膏に付着する硫酸溶液の濃度が上昇し、また、溶液の粘度も上昇するので好ましくない。しかし、砒素の未反応を防止する観点では、砒素とアルカリ土類金属の化合物を濃硫酸に添加して、砒素だけでなく石膏も溶解させた後に、水を加えて加水分解により石膏を析出させてもよい。
【0029】
撹拌は強く行うことが好ましい。砒素の溶解反応と石膏の析出反応が同時に起こり、また、ウェットケーキの状態で硫酸溶液に投入するのが好ましく、局部的な中和などを起こし易い系であるので、均一且つ完全に反応させるために、強く撹拌して十分に砒素を硫酸に接触させて高純度で高濃度の砒素含有溶液にする必要があるからである。
【0030】
(5)FeとAsの化合物の生成工程
次に、得られた砒素含有溶液に2価の鉄イオンを加えて、溶液中の鉄に対する砒素のモル比(Fe/As)を1以上にし、酸化剤を加えて撹拌しながら70℃以上に昇温させて反応させた後、固液分離して固形分が得られる。
【0031】
砒素含有溶液中のAs濃度は、不純物として含まれるNaなどが1g/L以下であれば、それほど高くなくてもよいが、As濃度が低いとFeとAsの化合物の析出から成長過程で粒子が粗大化し難くなる傾向があるので、10g/L以上であるのが好ましく、20g/L以上であるのがさらに好ましい。また、砒素含有溶液のpHが2以下であるのが好ましい。
【0032】
2価のFe源としては、可溶性のFeSO4・7H2Oを使用するのが好ましい。溶液中の鉄に対する砒素のモル比(Fe/As)は1以上であるのが好ましく、1.0〜1.5程度であるのがさらに好ましい。
【0033】
酸化剤としては、Fe2+を酸化することができる酸化剤であれば使用することができ、酸素ガスを使用してもよい。また、空気を使用してもよいが、酸化能力が若干低下するので、空気を使用する場合には、Cuなどの触媒を使用して酸化能力を向上させてもよい。
【0034】
反応温度は、50℃以上であればFeとAsの化合物を析出させることができるが、Asの溶出濃度を低下させるためには、70℃以上にするのが好ましく、80〜95℃程度であるのがさらに好ましい。また、オートクレーブなどを用いて100℃以上にしてもよい。なお、反応時間は1〜3時間でよい。
【0035】
このようにして得られた粉末についてX線回折による分析を行ったところ、砒酸鉄二水塩(FeAsO4・2H2O)であった。
【実施例】
【0036】
以下、本発明による砒酸鉄粉末の実施例について詳細に説明する。
【0037】
[実施例1]
まず、出発原料として表1に示す組成の砒素含有物質を用意した。この砒素含有物質400gをNaOH濃度100g/LのNaOH溶液(Na濃度57.5g/L)4Lに入れ、液温90℃に加熱し、2L/分の流量で空気(ガス/液比率=0.5)を吹き込んで、撹拌しながら1時間反応させ、砒素含有物質を酸化しながらアルカリ浸出した。なお、砒素含有物質をNaOH溶液に入れた後のpHは約12であった。
【0038】
【表1】

【0039】
次に、目開き3ミクロンのPTFE(ポリ四フッ化エチレン)からなるメンブランフィルタを用いて、加圧ろ過機によって0.4MPaに加圧して固液分離した。フィルタ上に残った残渣(浸出残渣)の水分は20%であり、質量は600gであった。この浸出残渣は、Cu、Zn、Fe、Inなどを含み、製錬原料として使用される。
【0040】
一方、フィルタを通過したろ液(アルカリ浸出液)に純度95%の工業用生石灰(CaO)を添加して、液温60℃に加熱し、撹拌して1時間反応させ、固形分としてCaとAsの化合物を得るとともに、NaOH液を再生した。この置換反応によって液温は60℃から80℃まで上昇した。なお、工業用生石灰の添加量は、アルカリ浸出の際に加えたNaOH溶液のNaOH濃度との関係からアルカリ浸出液を置換するに足りるCaOと同当量とした。また、CaOを添加すると水(H2O)を消費するので、濃度の上昇を避けるために、アルカリ浸出液が同じ量になるように水を補給して調整した。
【0041】
次に、加圧ろ過機によって固液分離した。得られた残渣(砒素とアルカリ土類金属の塩の固形分)は、20%の水分を含み、158g/Lであった。
【0042】
次に、固液分離後の固形分に付着したアルカリ成分を除去するために、パルプ濃度200g/Lとしてリパルプ洗浄を3回行った。各々のリパルプ洗浄では、液温を60℃として撹拌しながら1時間反応させた。その後、目開き3ミクロンのPTFEからなるメンブランフィルタを用いて、加圧ろ過機によって0.4MPaに加圧して、フィルタ上に残った残渣(洗浄後のカルシウムと砒素を含む固形分)とフィルタを通過したろ液(洗浄后液)に固液分離した。
【0043】
次に、洗浄後の残渣(水分20%を含むカルシウムと砒素の固形分)1912gを200g/Lの硫酸溶液5.59Lに添加してpH1になるようにし、液温を50℃として強く撹拌しながら2時間反応させて残渣を再溶解させた。この置換反応により液温は50℃から80℃に上昇した。
【0044】
その後、目開き3ミクロンのPTFEからなるメンブランフィルタを用いて、加圧ろ過機によって0.4MPaに加圧して、フィルタ上に残った残渣(石膏)とフィルタを通過したろ液(砒素含有溶液)に固液分離した。このようにして得られたろ液について組成分析を行ったところ、表2に示すようにアルカリ土類金属などの不純物が非常に少ない高濃度の砒素を含む溶液であり、pH1.0であった。なお、この溶液中のAsの価数をチオナリド法によって分析したところ、すべて5価であった。
【0045】
【表2】

【0046】
次に、得られた砒素含有溶液486mLと、1級試薬のFeSO4・7H2Oに水を加えてFe濃度が183g/Lになるように調整した溶液214mL(この溶液と砒素含有溶液の合計の液量が700mL)とをチタン製の容量1Lの密閉容器(反応槽)に入れて(As濃度50.13g/L、Fe濃度56.00g/L、Fe/As比=1.5)、容器内の雰囲気を不活性ガス雰囲気として、1段の平パドルを500rpmにして撹拌しながら昇温させた。容器内の温度が100℃以上になった時点で一旦不活性ガスを脱気し、引き続き、最終的な設定温度175℃まで昇温させた。この時点で容器内の圧力は0.8MPaまで上昇した。
【0047】
最終的な設定温度175℃に達したときに容器内に純度99%以上の酸素ガスを吹き込んで、温度と圧力(酸素の分圧を0.2MPa、容器内の全圧を1.0MPaとした)を保持して5時間反応させた。5時間経過後、容器への加温を停止して、約1時間で容器を100℃以下まで冷却し、その後、容器を大気に開放して、容器内の溶液を取り出した。この溶液の温度が70℃になった後、目開き3ミクロンのPTFEからなるメンブランフィルタを用いて、加圧ろ過機によって0.4MPaに加圧して固液分離を行った。
【0048】
次に、固液分離によって得られた固形分のウェット重量を測定し、ウェットベースで100gの固形分に対して水1Lになるように水を加えて、リパルプ洗浄を行なった。このリパルプ洗浄では、液温を30℃として400rpmで1時間撹拌した。この洗浄後、加圧ろ過機を用いて再度固液分離した。
【0049】
この固液分離によって固形分として得られたケーキの重量を測定し、60℃で18時間乾燥した。なお、この乾燥前後の重量を測定することによって水分値を算出した。
【0050】
次に、乾燥した固形物をメノウ乳鉢で軽く解砕して得られた粉体について、組成分析、溶出試験、湿式粒度分布測定、N2ガス吸着法による比表面積測定(BET1点法)、ベックマン式比重測定、1トン加圧による圧縮密度を測定した。組成分析は、一旦水に溶解した後にICPによって行った。湿式粒度分布は、湿式粒度分布測定器(堀場製作所製のLA500)を用いて測定した。N2ガス吸着による比表面積測定は、比表面積測定器(湯浅アイオニクス製のモノソーブ)を用いてBET1点法で行った。また、溶出試験は、環境庁告示13号法に基づいて、固形分100gに対してpH5の水1Lを混合し、溶出試験専用しんとう機で6時間しんとうさせた後、0.45ミクロンのメンブランフィルタを用いて固液分離して得られたろ液(溶出液)中の砒素濃度を分析することによって行った。
【0051】
また、分析結果から、Fe/As比率、発生残渣量(砒素品位と水分値から求めたAs1トン当りの量)、処理すべき液量(処理液の前後のAs濃度から求めたAs1トンを除去する際に必要とされる液量)を計算した。
【0052】
さらに、得られた粉体について、X線回折計を用いて粉末X線回折を行った。この粉末X線回折では、対陰極をCuのKα、波長λ=1.5418オングストローム、管電圧=50kV(一部40kV)、管電流=300mA、走査速度0.01°/sec、走査角度2θ=5°〜85°とし、シンチレーションカウンターを使用した。また、得られた回折像が結晶性であるか否か、低角側を中心としてハローパターンが観察されるか否かによって、非晶質であるか結晶質であるかを判定した。また、走査電子顕微鏡(SEM)によって粒子を観察した。
【0053】
これらの条件および結果を表3〜表5に示す。
【0054】
【表3】

【0055】
【表4】

【0056】
【表5】

【0057】
表5に示すように、得られた粉体のFe/As(モル比)は1.01を示し、X線回折の結果から結晶質の砒酸鉄粉末が得られたことがわかった。また、得られた砒酸鉄粉末からの砒素の溶出濃度は0.03mg/Lであり、基準値(0.3mg/L)より非常に低かった。
【0058】
[実施例2]
実施例1と同様の砒素含有溶液(表2に示す組成の溶液)を用いて、撹拌速度を1000rpm、反応温度(最終的な設定温度)を95℃にした以外は、実施例1と同様の方法によって反応させた後、反応生成物の固液分離によって得られた固形分を実施例1と同様に処理し、得られた粉体について実施例1と同様の測定および計算を行った。その条件および結果を表3〜表5に示す。また、本実施例で得られた粉体の5000倍の走査電子顕微鏡(SEM)写真およびX線回折(XRD)データをそれぞれ図2および図3に示す。
【0059】
表5に示すように、得られた粉体のFe/As(モル比)は1.08を示し、X線回折の結果から結晶質の砒酸鉄二水塩粉末が得られたことがわかった。また、得られた砒酸鉄粉末からの砒素の溶出濃度は0.09mg/Lであり、基準値(0.3mg/L)より非常に低かった。
【0060】
[実施例3]
実施例1と同様の砒素含有溶液(表2に示す組成の溶液)に40g/LのZnを共存させて用いた以外は、実施例1と同様の方法によって反応させた後、反応生成物の固液分離によって得られた固形分を実施例1と同様に処理し、得られた粉体について実施例1と同様の測定および計算を行った。その条件および結果を表3〜表5に示す。
【0061】
表5に示すように、得られた粉体のFe/As(モル比)は0.98を示し、X線回折の結果から結晶質の砒酸鉄二水塩粉末が得られたことがわかった。また、得られた砒酸鉄粉末からの砒素の溶出濃度は0.05mg/Lであり、基準値(0.3mg/L)より非常に低かった。
【0062】
[実施例4]
実施例1と同様の砒素含有溶液(表2に示す組成の溶液)に40g/LのZnを共存させて用いた以外は、実施例2と同様の方法によって反応させた後、反応生成物の固液分離によって得られた固形分を実施例2と同様に処理し、得られた粉体について実施例1と同様の測定および計算を行った。その条件および結果を表3〜表5に示す。
【0063】
表5に示すように、得られた粉体のFe/As(モル比)は1.05を示し、X線回折の結果から結晶質の砒酸鉄二水塩粉末が得られたことがわかった。また、得られた砒酸鉄粉末からの砒素の溶出濃度は0.06mg/Lであり、基準値(0.3mg/L)より非常に低かった。
【0064】
[実施例5]
実施例1と同様の砒素含有溶液(表2に示す組成の溶液)を容量2Lのガラス製の開放容器(反応槽)に入れて、撹拌速度を1000rpm、反応温度(最終的な設定温度)を95℃、反応時間を7時間にした以外は、実施例1と同様の方法によって反応させた後、反応生成物の固液分離によって得られた固形分を実施例1と同様に処理し、得られた粉体について実施例1と同様の測定および計算を行った。その条件および結果を表3〜表5に示す。
【0065】
表5に示すように、得られた粉体のFe/As(モル比)は1.07を示し、X線回折の結果から結晶質の砒酸鉄二水塩粉末が得られたことがわかった。また、得られた砒酸鉄粉末からの砒素の溶出濃度は0.02mg/Lであり、基準値(0.3mg/L)より非常に低かった。
【0066】
[実施例6]
実施例1と同様の砒素含有溶液(表2に示す組成の溶液)を水で希釈して溶液中のAs濃度を30.02g/L、Fe濃度を33.63g/L(Fe/As比=1.5)にした以外は、実施例5と同様の方法によって反応させた後、反応生成物の固液分離によって得られた固形分を実施例1と同様に処理し、得られた粉体について実施例1と同様の測定および計算を行った。その条件および結果を表3〜表5に示す。
【0067】
表5に示すように、得られた粉体のFe/As(モル比)は1.02を示し、X線回折の結果から結晶質の砒酸鉄二水塩粉末が得られたことがわかった。また、得られた砒酸鉄粉末からの砒素の溶出濃度は0.02mg/Lであり、基準値(0.3mg/L)より非常に低かった。
【0068】
[実施例7]
実施例1と同様の砒素含有溶液(表2に示す組成の溶液)を水で希釈して溶液中のAs濃度を20.07g/L、Fe濃度を22.41g/L(Fe/As比=1.5)にした以外は、実施例5と同様の方法によって反応させた後、反応生成物の固液分離によって得られた固形分を実施例1と同様に処理し、得られた粉体について実施例1と同様の測定および計算を行った。その条件および結果を表3〜表5に示す。
【0069】
表5に示すように、得られた粉体のFe/As(モル比)は1.03を示し、X線回折の結果から結晶質の砒酸鉄二水塩粉末が得られたことがわかった。また、得られた砒酸鉄粉末からの砒素の溶出濃度は0.02mg/Lであり、基準値(0.3mg/L)より非常に低かった。
【0070】
[比較例1]
実施例1と同様の砒素含有溶液(表2に示す組成の溶液)の代わりに(500g/Lの砒素を含む)1級試薬の砒素液(5価の砒素液)を希釈して容量5Lの密閉容器(反応槽)に入れ、その溶液中のAs濃度を10.00g/L、Fe濃度を11.18g/L(Fe/As比=1.5)にし、撹拌速度を360rpm、酸素の分圧を0.3MPaにし、固液分離後のリパルプ洗浄を2回行った以外は、実施例1と同様の方法によって反応させた後、反応生成物の固液分離によって得られた固形分を実施例1と同様に処理し、得られた粉体について実施例1と同様の測定および計算を行った。その条件および結果を表3〜表5に示す。
【0071】
表5に示すように、得られた粉体のFe/As(モル比)は1.20を示し、X線回折の結果から結晶質の砒酸鉄二水塩粉末が得られたことがわかった。また、得られた砒酸鉄粉末からの砒素の溶出濃度は0.02mg/Lであった。
【0072】
[比較例2]
1級試薬のFeSO4・7H2Oの代わりにポリ鉄(Fe3+)を使用し、As濃度を47.97g/L、Fe濃度53.77g/L、Fe/As比=1.5)にした以外は、実施例1と同様の方法によって反応させた後、反応生成物の固液分離によって得られた固形分を実施例1と同様に処理し、得られた粉体について実施例1と同様の測定および計算を行った。その条件および結果を表3〜表5に示す。
【0073】
表5に示すように、得られた粉体のFe/As(モル比)は1.04を示し、X線回折の結果から結晶質の砒酸鉄二水塩粉末が得られたことがわかった。また、得られた砒酸鉄粉末からの砒素の溶出濃度は0.48mg/Lであり、基準値(0.3mg/L)より高かった。
【0074】
[比較例3]
実施例1と同様の砒素含有溶液(表2に示す組成の溶液)の代わりに、亜砒酸を溶解してAs濃度47.97g/Lにした溶液を使用した以外は、比較例2と同様の方法によって反応させた後、反応生成物の固液分離によって得られた固形分を実施例1と同様に処理し、得られた粉体について実施例1と同様の測定および計算を行った。その条件および結果を表3〜表5に示す。
【0075】
表5に示すように、得られた粉体のFe/As(モル比)は1.21を示し、X線回折の結果から結晶質の砒酸鉄二水塩粉末が得られたことがわかった。また、得られた砒酸鉄粉末からの砒素の溶出濃度は4.45mg/Lであり、基準値(0.3mg/L)より非常に高かった。
【0076】
[比較例4]
最終的な設定温度(反応温度)を70℃にした以外は、実施例5と同様の方法によって反応させた後、反応生成物の固液分離によって得られた固形分を実施例1と同様に処理し、得られた粉体について実施例1と同様の測定および計算を行った。その条件および結果を表3〜表5に示す。
【0077】
表5に示すように、得られた粉体のFe/As(モル比)は1.06を示し、X線回折の結果から結晶質の砒酸鉄二水塩粉末が得られたことがわかった。また、得られた砒酸鉄粉末からの砒素の溶出濃度は0.32mg/Lであり、基準値(0.3mg/L)より高かった。
【0078】
[比較例5]
最終的な設定温度(反応温度)を50℃にした以外は、実施例5と同様の方法によって反応させた後、反応生成物の固液分離によって得られた固形分を実施例1と同様に処理し、得られた粉体について実施例1と同様の測定および計算を行った。その条件および結果を表3〜表5に示す。
【0079】
表5に示すように、得られた粉体のFe/As(モル比)は0.92を示し、X線回折の結果から非晶質の砒酸鉄二水塩粉末が得られたことがわかった。また、得られた砒酸鉄粉末からの砒素の溶出濃度は319.5mg/Lであり、基準値(0.3mg/L)より非常に高かった。
【0080】
[比較例6]
容量2Lのガラス製の開放容器(反応槽)に入れた溶液中のAs濃度を10.01g/L、Fe濃度を11.21g/L(Fe/As比=1.5)にした以外は、実施例5と同様の方法によって反応させた後、反応生成物の固液分離によって得られた固形分を実施例1と同様に処理し、得られた粉体について実施例1と同様の測定および計算を行った。その条件および結果を表3〜表5に示す。
【0081】
表5に示すように、得られた粉体のFe/As(モル比)は1.03を示し、X線回折の結果から結晶質の砒酸鉄二水塩粉末が得られたことがわかった。また、得られた砒酸鉄粉末からの砒素の溶出濃度は0.01mg/Lであった。
【0082】
これらの結果から、比較例1および比較例3〜6では、実施例1〜7と比べて非常に微細な結晶が生成していることがわかる。また、ポリ鉄を使用した比較例3では、実施例1〜7と比べて、平均粒径が小さく、5μm以下の粒子の割合が多く、BET比表面積が大きくなっているのがわかる。同様にポリ鉄を使用した比較例2では、平均粒径が大きく、5μm以下の粒子の割合が0%であり、BET比表面積が小さくなっているが、SEM像の結果から、緻密な結晶形態でなく、凝集しているため、平均粒径、5μm以下の粒子の割合およびBET比表面積が見掛けの値であることがわかった。これらの結果から、実施例1〜7のように、緻密且つ結晶質で粗い粒子であれば、砒素が溶出し難い安定した結晶であるのがわかる。
【図面の簡単な説明】
【0083】
【図1】本発明による砒酸鉄の実施の形態の製造方法を概略的に示す工程図である。
【図2】実施例2で得られた粉体の走査電子顕微鏡(SEM)写真である。
【図3】実施例2で得られた粉体のX線回折(XRD)データを示す図である。
【技術分野】
【0001】
本発明は、砒酸鉄粉末に関し、特に、非鉄製錬の製錬中間物などの砒素以外の各種の元素を含む砒素含有物質を処理して得られる高純度で高濃度の砒素を含む溶液から製造した砒酸鉄粉末に関する。
【背景技術】
【0002】
非鉄製錬において生成される各種の製錬中間物や製錬原料には、有価金属が含まれているが、砒素などの好ましくない元素も含まれている。
【0003】
従来、砒素を含む製錬中間物などから砒素を浸出して分離して回収する方法として、湿式反応により砒素を分離して砒素含有溶液を回収する方法が提案されている(例えば、特許文献1参照)。また、砒酸鉄溶液中に存在する砒素を鉄との安定な結晶性で且つ不溶出性の鉄・砒素化合物として除去して固定する方法が提案されている(例えば、特許文献2参照)。また、砒素含有溶液に鉄(II)溶液および鉄(III)溶液の少なくとも一方を加えて反応させてスコロダイト(Scorodite)(FeAsO4・2H2O)を生成させ、固液分離して銅を含む非鉄金属成分を含有するスコロダイトを回収し、得られた銅を含む非鉄金属成分を含有するスコロダイトに水を加えてリパルプし、スコロダイトに含まれる銅を含む非鉄金属成分を液中に溶かしてスコロダイトから分離する方法が提案されている(例えば、特許文献3参照)。さらに、砒素を含む煙灰から酸溶液により砒素を浸出し、その浸出液に鉄イオンを含む酸性水溶液を混合して非晶質の砒酸鉄(FeAsO4)を沈澱させた後、その混合液を加温して非晶質の砒酸鉄を結晶化し、その混合液をろ過して結晶化された砒酸鉄を除去する方法が提案されている(例えば、特許文献4参照)。また、鉄と砒素の化合物として砒酸鉄などの安定性の評価も報告されている(例えば、非特許文献1参照)。
【0004】
【特許文献1】特公昭61−24329号公報(第1−3頁)
【特許文献2】特開平11−277075号公報(段落番号0013−0014)
【特許文献3】特開2000−219920号公報(段落番号0007)
【特許文献4】特開2005−161123号公報(段落番号0006)
【非特許文献1】東北大学選鉱製錬研究所彙報 第34巻 第1号 別刷(昭和53年6月)、選鉱製錬研究所報告 第764号、「砒酸鉄、砒酸カルシウム、砒酸マグネシウムの溶解度積について(西村忠久、戸沢一光)」
【発明の開示】
【発明が解決しようとする課題】
【0005】
しかし、特許文献1は、砒素含有溶液を回収するまでの方法を提案しているが、その回収された砒素含有溶液を安定な不溶出性の物質まで固定する方法について提案していない。また、特許文献2〜4の方法によって生成される従来の鉄と砒素の化合物や、非特許文献1などに報告されている砒酸鉄のような従来の鉄と砒素の化合物よりもさらに安定な不溶出性の鉄と砒素の化合物を生成することが望まれている。特に、特許文献4の方法では、非晶質の砒酸鉄を沈澱させた後に非晶質の砒酸鉄を結晶化するので、非常に長時間を要するという問題がある。
【0006】
したがって、本発明は、このような従来の問題点に鑑み、砒素含有溶液から製造されて砒素の溶出濃度が非常に低い砒酸鉄粉末を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明者らは、上記課題を解決するために鋭意研究した結果、平均粒径が8μm以上、BET比表面積が2m2/g以下である砒酸鉄粉末が砒素の溶出濃度が非常に低いことを見出し、本発明を完成するに至った。
【0008】
すなわち、本発明による砒酸鉄粉末は、平均粒径が8μm以上、好ましくは10μm以上、BET比表面積が2m2/g以下、好ましくは0.5m2/g以下であることを特徴とする。この砒酸鉄粉末は、砒酸鉄二水塩の粉末であるのが好ましく、不純物として含有するカルシウムおよびマグネシウムの量が、それぞれ2質量%以下であるのが好ましく、0.1質量%以下であるのがさらに好ましい。
【発明の効果】
【0009】
本発明によれば、砒素含有溶液から砒素の溶出濃度が非常に低い砒酸鉄粉末を製造することができる。特に、砒素の溶出基準である0.3mg/Lよりも非常に低い溶出濃度の砒酸鉄粉末を製造することができる。
【発明を実施するための最良の形態】
【0010】
本発明による砒酸鉄粉末の実施の形態は、平均粒径が大きく、小さい粒径の粒子の割合が少なく、比表面積が小さいのが好ましい。平均粒径が大きく、小さい粒径の粒子の割合が少なく、比表面積が小さくて表面が平滑であれば、砒素の溶出濃度が非常に低くなるからである。具体的には、砒酸鉄粉末の平均粒径は、8μm以上であるのが好ましく、10μm以上であるのがさらに好ましい。また、砒酸鉄粉末の粒径5μm以下の粒子の割合は、10%以下であるのが好ましく、5%以下であるのがさらに好ましく、0%であるのが最も好ましい。さらに、砒酸鉄粉末のBET比表面積は、2m2/g以下であるのが好ましく、0.5m2/g以下であるのがさらに好ましい。
【0011】
また、本発明による砒酸鉄粉末の実施の形態は、砒酸鉄二水塩の粉末であるのが好ましく、不純物として含有するカルシウムおよびマグネシウムの量が、それぞれ2質量%以下であるのが好ましく、0.1質量%以下であるのがさらに好ましい。
【0012】
さらに、本発明による砒酸鉄粉末の実施の形態では、運搬効率などを考慮して圧縮密度ができるだけ高いのが好ましく、1トン加圧による圧縮密度が1.9g/cc以上であるのが好ましい。
【0013】
このような砒酸鉄粉末は、例えば、図1に示すような方法によって製造することができる。図1に示す方法では、砒酸鉄粉末は、(1)砒素含有物質をアルカリ溶液に加えてpH10以上、好ましくはpH12以上にして酸化しながらアルカリ浸出した後に固液分離して砒素を含む浸出液を得るアルカリ浸出・酸化工程と、(2)この浸出液にアルカリ土類金属またはその塩を添加した後に固液分離して砒素とアルカリ土類金属の化合物を含む残渣を得るアルカリ土類金属置換工程と、(3)この残渣を洗浄して付着したアルカリ液を除去する洗浄工程と、(4)この洗浄した残渣を硫酸溶液に添加した後に固液分離して高純度で高濃度の砒素含有溶液を得る硫酸溶解工程とを備えた砒素含有溶液の製造方法によって砒素含有溶液を製造し、(5)この砒素含有溶液にFe塩を添加して反応させた後に固液分離し、洗浄して固液分離し、その後、乾燥することによって製造することができる。このようにして得られた砒酸鉄粉末は、結晶粒が粗大であり、砒素の溶出濃度が非常に低く、廃棄、堆積または保管することができる。以下、これらの各工程について説明する。
【0014】
なお、上記の砒素含有溶液の製造方法の原料となる砒素含有物質としては、硫化砒素(As2S3)やFeAsSなどの硫化物のように硫黄と砒素を含む物質を使用することができる。また、亜鉛製錬工程などにより得られる砒化銅(Cu3As)を主成分とする残渣なども使用することができる。この砒化銅を主成分とする残渣には、亜鉛や鉄などの他にインジウムやガリウムなどの有価金属も含まれている。なお、実施の形態の砒素含有物質の処理方法によって処理する砒素含有物質が硫黄を含まない場合には、アルカリ浸出・酸化工程前にNa2SO4塩のような硫酸塩などを添加するか、あるいは、アルカリ浸出・酸化工程後の浸出液に硫酸塩などを添加して、アルカリ土類金属置換工程前の浸出液中にSO4イオンが存在するようにしておく必要がある。また、砒素含有物質は、砒素(As)と硫黄(S)の他に、銅(Cu)、亜鉛(Zn)、鉄(Fe)、インジウム(In)、ガリウム(Ga)、錫(Sn)、アンチモン(Sb)、鉛(Pb)、カドミウム(Cd)、ナトリウム(Na)、カリウム(K)、マグネシウム(Mg)およびカルシウム(Ca)の少なくとも一種を含んでもよい。
【0015】
(1)アルカリ浸出・酸化工程
まず、上記の砒素含有物質を酸化剤とともにアルカリ溶液に添加してpH10以上、好ましくはpH12以上にし、液温50〜100℃に加熱して撹拌しながら反応させることにより、砒素含有物質を酸化しながら浸出する。このアルカリ浸出・酸化工程における反応は、pH10以上、好ましくはpH12以上の強アルカリ性で起こる反応であり、反応速度は非常に速い。
【0016】
このアルカリ浸出によって、Cuを浸出させずにAsを浸出させてCuとAsを分離することができる。また、このアルカリ浸出では、In、Pb、CdおよびMgも浸出されず、Fe、Sn、SbおよびCaもほとんど浸出されない。しかし、Gaはほとんど浸出されるので、この段階では、AsとGaは分離されない。
【0017】
なお、Znは、アルカリ濃度が高いと浸出されるが、アルカリ濃度が低いと浸出されないので、砒素含有物質中のZnの品位、砒素の品位および他の不純物(特にSnとSb)の浸出挙動を勘案してアルカリ濃度を決定すればよい。すなわち、SnやSbの品位が低ければ、残渣中にZnを残しておく方がよいが、SnやSbの品位が高いと、ある程度Znを溶解させた方がよい。
【0018】
アルカリ溶液としてNaOH溶液を使用することができ、その場合、NaOH濃度が50〜300g/Lであるのが好ましい。
【0019】
酸化剤としては、過マンガン酸カリウムなどの固形酸化剤の他、過酸化水素やオゾンなどを使用することができるが、空気や濃度を高めた酸素などを使用してもよく、その場合、液中にガスを吹き込んでバブリングして撹拌することによって酸化反応が容易に進む。
【0020】
アルカリ浸出後に固液分離を行う。この固液分離は、フィルタプレス、遠心分離、デカンタ、ベルトフィルタなどの一般的なろ過のいずれでもよく、ろ過性、脱水性、洗浄性などを勘案してその種類および条件が決定される。
【0021】
一方、固液分離後の固形分は、有価なCuやInなどを含む金属性化合物と、一部酸化された化合物であるので、製錬工程において有効に活用することができる。なお、銅製錬では、自溶炉や反射炉に直接投入してアノードを作成することができる。
【0022】
(2)アルカリ土類金属置換工程
次に、固液分離後の浸出液(主にNaとAsを含む液)にアルカリ土類を添加する。アルカリ浸出後の浸出液にCaOなどのアルカリ土類を添加すると、アルカリ土類金属が砒素と反応してアルカリ土類金属と砒素の化合物を生成するとともに、NaOHのようなアルカリ液を再生する。
【0023】
上記の反応のために過剰のアルカリ土類を添加することによって、再生されたアルカリ液にSO4塩またはイオンを混在させて、アルカリ液へのアルカリ土類金属の混入を防止する。再生されたアルカリ液中にSO4塩がなく、ほぼ純粋なアルカリ液である場合には、過剰にアルカリ土類を添加すると、再生されたアルカリ液中にアルカリ土類金属が溶存してしまう。
【0024】
再生されたアルカリ液中にアルカリ土類金属が存在すると、そのアルカリ液を砒素の浸出に再利用する際に、砒素とアルカリ土類金属が反応して溶解度が低い沈殿物を生成するので、アルカリ浸出工程における浸出率が極端に悪くなる場合がある。一方、過剰のアルカリ土類金属を加えないと、アルカリ液中に砒素が除去されずに残ってしまうため、砒素の回収効率が非常に悪くなる。また、アルカリ液にSO4が混在していると、アルカリ土類としてCaOを使用した場合に、CaOまたはCa(OH)2がその状態で溶解せずに固形分中にとどまる。すなわち、Na+とSO42−の濃度を高くすることによって、Ca2+の溶解度が非常に低く抑制されるため、CaOとして固形分中にとどまる。
【0025】
アルカリ土類の添加量は、砒素とアルカリ土類金属の化合物を生成するための等当量でもよいが、Ca3(AsO4)2に加えてCa(OH)2を生成するように、等当量よりもややアルカリ土類リッチにするのが好ましい。
【0026】
(3)洗浄工程
次に、固形分として得られた砒素とアルカリ土類金属の化合物に付着したアルカリ液を水洗する。この水洗では、固形分中に砒素をとどめておく必要がある。砒素が洗浄排水中に溶出すると、その排水中の砒素を除去するための煩雑な操作が必要になるからである。そのような操作を回避するために、洗浄によってアルカリ液を除去するが砒素を除去しないようにすることが必要である。このような洗浄を可能にするために、上述したようにアルカリ土類を添加する際にアルカリ土類リッチにしてアルカリ性にするのが好ましい。また、アルカリ土類リッチにすると、洗浄によってアルカリ液が洗い流されるだけでなく、アルカリ土類金属が優先的に溶出し、砒素とアルカリ土類金属の化合物はそのまま保持される。なお、アルカリ土類の添加量は、洗浄水の量の増加に伴って多くなるが、Asと反応する量よりも0.5〜1.0質量%程度過剰に、あるいはそれ以上過剰にするのが好ましい。
【0027】
(4)硫酸溶解工程
次に、洗浄後の砒素とアルカリ土類金属の化合物を硫酸溶液に添加して、強く撹拌しながら反応させて、砒素を再溶解させるとともに石膏を生成する。この砒素とアルカリ土類金属の化合物は、アルカリ側では不溶性であるが、pHが4以下ではほぼ全量が溶解するので、鉱酸によってpHを4以下にすれば、ほぼ全量を溶解させることが可能である。しかし、砒素とアルカリ土類金属を分離するためには、硫酸を用いて石膏と砒素含有溶液に分離するのが好ましい。砒素とアルカリ土類金属の化合物を硫酸溶液に添加すると、砒素の溶解と同時に、アルカリ土類と硫酸塩の析出反応が起こる。
【0028】
硫酸溶液の濃度は、100〜500g/Lであるのが好ましく、150〜300g/Lであるのがさらに好ましい。砒素含有溶液中の砒素を高濃度にしたい場合には、硫酸溶液の濃度をより高くする必要があるが、生成する石膏に付着する硫酸溶液の濃度が上昇し、また、溶液の粘度も上昇するので好ましくない。しかし、砒素の未反応を防止する観点では、砒素とアルカリ土類金属の化合物を濃硫酸に添加して、砒素だけでなく石膏も溶解させた後に、水を加えて加水分解により石膏を析出させてもよい。
【0029】
撹拌は強く行うことが好ましい。砒素の溶解反応と石膏の析出反応が同時に起こり、また、ウェットケーキの状態で硫酸溶液に投入するのが好ましく、局部的な中和などを起こし易い系であるので、均一且つ完全に反応させるために、強く撹拌して十分に砒素を硫酸に接触させて高純度で高濃度の砒素含有溶液にする必要があるからである。
【0030】
(5)FeとAsの化合物の生成工程
次に、得られた砒素含有溶液に2価の鉄イオンを加えて、溶液中の鉄に対する砒素のモル比(Fe/As)を1以上にし、酸化剤を加えて撹拌しながら70℃以上に昇温させて反応させた後、固液分離して固形分が得られる。
【0031】
砒素含有溶液中のAs濃度は、不純物として含まれるNaなどが1g/L以下であれば、それほど高くなくてもよいが、As濃度が低いとFeとAsの化合物の析出から成長過程で粒子が粗大化し難くなる傾向があるので、10g/L以上であるのが好ましく、20g/L以上であるのがさらに好ましい。また、砒素含有溶液のpHが2以下であるのが好ましい。
【0032】
2価のFe源としては、可溶性のFeSO4・7H2Oを使用するのが好ましい。溶液中の鉄に対する砒素のモル比(Fe/As)は1以上であるのが好ましく、1.0〜1.5程度であるのがさらに好ましい。
【0033】
酸化剤としては、Fe2+を酸化することができる酸化剤であれば使用することができ、酸素ガスを使用してもよい。また、空気を使用してもよいが、酸化能力が若干低下するので、空気を使用する場合には、Cuなどの触媒を使用して酸化能力を向上させてもよい。
【0034】
反応温度は、50℃以上であればFeとAsの化合物を析出させることができるが、Asの溶出濃度を低下させるためには、70℃以上にするのが好ましく、80〜95℃程度であるのがさらに好ましい。また、オートクレーブなどを用いて100℃以上にしてもよい。なお、反応時間は1〜3時間でよい。
【0035】
このようにして得られた粉末についてX線回折による分析を行ったところ、砒酸鉄二水塩(FeAsO4・2H2O)であった。
【実施例】
【0036】
以下、本発明による砒酸鉄粉末の実施例について詳細に説明する。
【0037】
[実施例1]
まず、出発原料として表1に示す組成の砒素含有物質を用意した。この砒素含有物質400gをNaOH濃度100g/LのNaOH溶液(Na濃度57.5g/L)4Lに入れ、液温90℃に加熱し、2L/分の流量で空気(ガス/液比率=0.5)を吹き込んで、撹拌しながら1時間反応させ、砒素含有物質を酸化しながらアルカリ浸出した。なお、砒素含有物質をNaOH溶液に入れた後のpHは約12であった。
【0038】
【表1】

【0039】
次に、目開き3ミクロンのPTFE(ポリ四フッ化エチレン)からなるメンブランフィルタを用いて、加圧ろ過機によって0.4MPaに加圧して固液分離した。フィルタ上に残った残渣(浸出残渣)の水分は20%であり、質量は600gであった。この浸出残渣は、Cu、Zn、Fe、Inなどを含み、製錬原料として使用される。
【0040】
一方、フィルタを通過したろ液(アルカリ浸出液)に純度95%の工業用生石灰(CaO)を添加して、液温60℃に加熱し、撹拌して1時間反応させ、固形分としてCaとAsの化合物を得るとともに、NaOH液を再生した。この置換反応によって液温は60℃から80℃まで上昇した。なお、工業用生石灰の添加量は、アルカリ浸出の際に加えたNaOH溶液のNaOH濃度との関係からアルカリ浸出液を置換するに足りるCaOと同当量とした。また、CaOを添加すると水(H2O)を消費するので、濃度の上昇を避けるために、アルカリ浸出液が同じ量になるように水を補給して調整した。
【0041】
次に、加圧ろ過機によって固液分離した。得られた残渣(砒素とアルカリ土類金属の塩の固形分)は、20%の水分を含み、158g/Lであった。
【0042】
次に、固液分離後の固形分に付着したアルカリ成分を除去するために、パルプ濃度200g/Lとしてリパルプ洗浄を3回行った。各々のリパルプ洗浄では、液温を60℃として撹拌しながら1時間反応させた。その後、目開き3ミクロンのPTFEからなるメンブランフィルタを用いて、加圧ろ過機によって0.4MPaに加圧して、フィルタ上に残った残渣(洗浄後のカルシウムと砒素を含む固形分)とフィルタを通過したろ液(洗浄后液)に固液分離した。
【0043】
次に、洗浄後の残渣(水分20%を含むカルシウムと砒素の固形分)1912gを200g/Lの硫酸溶液5.59Lに添加してpH1になるようにし、液温を50℃として強く撹拌しながら2時間反応させて残渣を再溶解させた。この置換反応により液温は50℃から80℃に上昇した。
【0044】
その後、目開き3ミクロンのPTFEからなるメンブランフィルタを用いて、加圧ろ過機によって0.4MPaに加圧して、フィルタ上に残った残渣(石膏)とフィルタを通過したろ液(砒素含有溶液)に固液分離した。このようにして得られたろ液について組成分析を行ったところ、表2に示すようにアルカリ土類金属などの不純物が非常に少ない高濃度の砒素を含む溶液であり、pH1.0であった。なお、この溶液中のAsの価数をチオナリド法によって分析したところ、すべて5価であった。
【0045】
【表2】

【0046】
次に、得られた砒素含有溶液486mLと、1級試薬のFeSO4・7H2Oに水を加えてFe濃度が183g/Lになるように調整した溶液214mL(この溶液と砒素含有溶液の合計の液量が700mL)とをチタン製の容量1Lの密閉容器(反応槽)に入れて(As濃度50.13g/L、Fe濃度56.00g/L、Fe/As比=1.5)、容器内の雰囲気を不活性ガス雰囲気として、1段の平パドルを500rpmにして撹拌しながら昇温させた。容器内の温度が100℃以上になった時点で一旦不活性ガスを脱気し、引き続き、最終的な設定温度175℃まで昇温させた。この時点で容器内の圧力は0.8MPaまで上昇した。
【0047】
最終的な設定温度175℃に達したときに容器内に純度99%以上の酸素ガスを吹き込んで、温度と圧力(酸素の分圧を0.2MPa、容器内の全圧を1.0MPaとした)を保持して5時間反応させた。5時間経過後、容器への加温を停止して、約1時間で容器を100℃以下まで冷却し、その後、容器を大気に開放して、容器内の溶液を取り出した。この溶液の温度が70℃になった後、目開き3ミクロンのPTFEからなるメンブランフィルタを用いて、加圧ろ過機によって0.4MPaに加圧して固液分離を行った。
【0048】
次に、固液分離によって得られた固形分のウェット重量を測定し、ウェットベースで100gの固形分に対して水1Lになるように水を加えて、リパルプ洗浄を行なった。このリパルプ洗浄では、液温を30℃として400rpmで1時間撹拌した。この洗浄後、加圧ろ過機を用いて再度固液分離した。
【0049】
この固液分離によって固形分として得られたケーキの重量を測定し、60℃で18時間乾燥した。なお、この乾燥前後の重量を測定することによって水分値を算出した。
【0050】
次に、乾燥した固形物をメノウ乳鉢で軽く解砕して得られた粉体について、組成分析、溶出試験、湿式粒度分布測定、N2ガス吸着法による比表面積測定(BET1点法)、ベックマン式比重測定、1トン加圧による圧縮密度を測定した。組成分析は、一旦水に溶解した後にICPによって行った。湿式粒度分布は、湿式粒度分布測定器(堀場製作所製のLA500)を用いて測定した。N2ガス吸着による比表面積測定は、比表面積測定器(湯浅アイオニクス製のモノソーブ)を用いてBET1点法で行った。また、溶出試験は、環境庁告示13号法に基づいて、固形分100gに対してpH5の水1Lを混合し、溶出試験専用しんとう機で6時間しんとうさせた後、0.45ミクロンのメンブランフィルタを用いて固液分離して得られたろ液(溶出液)中の砒素濃度を分析することによって行った。
【0051】
また、分析結果から、Fe/As比率、発生残渣量(砒素品位と水分値から求めたAs1トン当りの量)、処理すべき液量(処理液の前後のAs濃度から求めたAs1トンを除去する際に必要とされる液量)を計算した。
【0052】
さらに、得られた粉体について、X線回折計を用いて粉末X線回折を行った。この粉末X線回折では、対陰極をCuのKα、波長λ=1.5418オングストローム、管電圧=50kV(一部40kV)、管電流=300mA、走査速度0.01°/sec、走査角度2θ=5°〜85°とし、シンチレーションカウンターを使用した。また、得られた回折像が結晶性であるか否か、低角側を中心としてハローパターンが観察されるか否かによって、非晶質であるか結晶質であるかを判定した。また、走査電子顕微鏡(SEM)によって粒子を観察した。
【0053】
これらの条件および結果を表3〜表5に示す。
【0054】
【表3】

【0055】
【表4】

【0056】
【表5】

【0057】
表5に示すように、得られた粉体のFe/As(モル比)は1.01を示し、X線回折の結果から結晶質の砒酸鉄粉末が得られたことがわかった。また、得られた砒酸鉄粉末からの砒素の溶出濃度は0.03mg/Lであり、基準値(0.3mg/L)より非常に低かった。
【0058】
[実施例2]
実施例1と同様の砒素含有溶液(表2に示す組成の溶液)を用いて、撹拌速度を1000rpm、反応温度(最終的な設定温度)を95℃にした以外は、実施例1と同様の方法によって反応させた後、反応生成物の固液分離によって得られた固形分を実施例1と同様に処理し、得られた粉体について実施例1と同様の測定および計算を行った。その条件および結果を表3〜表5に示す。また、本実施例で得られた粉体の5000倍の走査電子顕微鏡(SEM)写真およびX線回折(XRD)データをそれぞれ図2および図3に示す。
【0059】
表5に示すように、得られた粉体のFe/As(モル比)は1.08を示し、X線回折の結果から結晶質の砒酸鉄二水塩粉末が得られたことがわかった。また、得られた砒酸鉄粉末からの砒素の溶出濃度は0.09mg/Lであり、基準値(0.3mg/L)より非常に低かった。
【0060】
[実施例3]
実施例1と同様の砒素含有溶液(表2に示す組成の溶液)に40g/LのZnを共存させて用いた以外は、実施例1と同様の方法によって反応させた後、反応生成物の固液分離によって得られた固形分を実施例1と同様に処理し、得られた粉体について実施例1と同様の測定および計算を行った。その条件および結果を表3〜表5に示す。
【0061】
表5に示すように、得られた粉体のFe/As(モル比)は0.98を示し、X線回折の結果から結晶質の砒酸鉄二水塩粉末が得られたことがわかった。また、得られた砒酸鉄粉末からの砒素の溶出濃度は0.05mg/Lであり、基準値(0.3mg/L)より非常に低かった。
【0062】
[実施例4]
実施例1と同様の砒素含有溶液(表2に示す組成の溶液)に40g/LのZnを共存させて用いた以外は、実施例2と同様の方法によって反応させた後、反応生成物の固液分離によって得られた固形分を実施例2と同様に処理し、得られた粉体について実施例1と同様の測定および計算を行った。その条件および結果を表3〜表5に示す。
【0063】
表5に示すように、得られた粉体のFe/As(モル比)は1.05を示し、X線回折の結果から結晶質の砒酸鉄二水塩粉末が得られたことがわかった。また、得られた砒酸鉄粉末からの砒素の溶出濃度は0.06mg/Lであり、基準値(0.3mg/L)より非常に低かった。
【0064】
[実施例5]
実施例1と同様の砒素含有溶液(表2に示す組成の溶液)を容量2Lのガラス製の開放容器(反応槽)に入れて、撹拌速度を1000rpm、反応温度(最終的な設定温度)を95℃、反応時間を7時間にした以外は、実施例1と同様の方法によって反応させた後、反応生成物の固液分離によって得られた固形分を実施例1と同様に処理し、得られた粉体について実施例1と同様の測定および計算を行った。その条件および結果を表3〜表5に示す。
【0065】
表5に示すように、得られた粉体のFe/As(モル比)は1.07を示し、X線回折の結果から結晶質の砒酸鉄二水塩粉末が得られたことがわかった。また、得られた砒酸鉄粉末からの砒素の溶出濃度は0.02mg/Lであり、基準値(0.3mg/L)より非常に低かった。
【0066】
[実施例6]
実施例1と同様の砒素含有溶液(表2に示す組成の溶液)を水で希釈して溶液中のAs濃度を30.02g/L、Fe濃度を33.63g/L(Fe/As比=1.5)にした以外は、実施例5と同様の方法によって反応させた後、反応生成物の固液分離によって得られた固形分を実施例1と同様に処理し、得られた粉体について実施例1と同様の測定および計算を行った。その条件および結果を表3〜表5に示す。
【0067】
表5に示すように、得られた粉体のFe/As(モル比)は1.02を示し、X線回折の結果から結晶質の砒酸鉄二水塩粉末が得られたことがわかった。また、得られた砒酸鉄粉末からの砒素の溶出濃度は0.02mg/Lであり、基準値(0.3mg/L)より非常に低かった。
【0068】
[実施例7]
実施例1と同様の砒素含有溶液(表2に示す組成の溶液)を水で希釈して溶液中のAs濃度を20.07g/L、Fe濃度を22.41g/L(Fe/As比=1.5)にした以外は、実施例5と同様の方法によって反応させた後、反応生成物の固液分離によって得られた固形分を実施例1と同様に処理し、得られた粉体について実施例1と同様の測定および計算を行った。その条件および結果を表3〜表5に示す。
【0069】
表5に示すように、得られた粉体のFe/As(モル比)は1.03を示し、X線回折の結果から結晶質の砒酸鉄二水塩粉末が得られたことがわかった。また、得られた砒酸鉄粉末からの砒素の溶出濃度は0.02mg/Lであり、基準値(0.3mg/L)より非常に低かった。
【0070】
[比較例1]
実施例1と同様の砒素含有溶液(表2に示す組成の溶液)の代わりに(500g/Lの砒素を含む)1級試薬の砒素液(5価の砒素液)を希釈して容量5Lの密閉容器(反応槽)に入れ、その溶液中のAs濃度を10.00g/L、Fe濃度を11.18g/L(Fe/As比=1.5)にし、撹拌速度を360rpm、酸素の分圧を0.3MPaにし、固液分離後のリパルプ洗浄を2回行った以外は、実施例1と同様の方法によって反応させた後、反応生成物の固液分離によって得られた固形分を実施例1と同様に処理し、得られた粉体について実施例1と同様の測定および計算を行った。その条件および結果を表3〜表5に示す。
【0071】
表5に示すように、得られた粉体のFe/As(モル比)は1.20を示し、X線回折の結果から結晶質の砒酸鉄二水塩粉末が得られたことがわかった。また、得られた砒酸鉄粉末からの砒素の溶出濃度は0.02mg/Lであった。
【0072】
[比較例2]
1級試薬のFeSO4・7H2Oの代わりにポリ鉄(Fe3+)を使用し、As濃度を47.97g/L、Fe濃度53.77g/L、Fe/As比=1.5)にした以外は、実施例1と同様の方法によって反応させた後、反応生成物の固液分離によって得られた固形分を実施例1と同様に処理し、得られた粉体について実施例1と同様の測定および計算を行った。その条件および結果を表3〜表5に示す。
【0073】
表5に示すように、得られた粉体のFe/As(モル比)は1.04を示し、X線回折の結果から結晶質の砒酸鉄二水塩粉末が得られたことがわかった。また、得られた砒酸鉄粉末からの砒素の溶出濃度は0.48mg/Lであり、基準値(0.3mg/L)より高かった。
【0074】
[比較例3]
実施例1と同様の砒素含有溶液(表2に示す組成の溶液)の代わりに、亜砒酸を溶解してAs濃度47.97g/Lにした溶液を使用した以外は、比較例2と同様の方法によって反応させた後、反応生成物の固液分離によって得られた固形分を実施例1と同様に処理し、得られた粉体について実施例1と同様の測定および計算を行った。その条件および結果を表3〜表5に示す。
【0075】
表5に示すように、得られた粉体のFe/As(モル比)は1.21を示し、X線回折の結果から結晶質の砒酸鉄二水塩粉末が得られたことがわかった。また、得られた砒酸鉄粉末からの砒素の溶出濃度は4.45mg/Lであり、基準値(0.3mg/L)より非常に高かった。
【0076】
[比較例4]
最終的な設定温度(反応温度)を70℃にした以外は、実施例5と同様の方法によって反応させた後、反応生成物の固液分離によって得られた固形分を実施例1と同様に処理し、得られた粉体について実施例1と同様の測定および計算を行った。その条件および結果を表3〜表5に示す。
【0077】
表5に示すように、得られた粉体のFe/As(モル比)は1.06を示し、X線回折の結果から結晶質の砒酸鉄二水塩粉末が得られたことがわかった。また、得られた砒酸鉄粉末からの砒素の溶出濃度は0.32mg/Lであり、基準値(0.3mg/L)より高かった。
【0078】
[比較例5]
最終的な設定温度(反応温度)を50℃にした以外は、実施例5と同様の方法によって反応させた後、反応生成物の固液分離によって得られた固形分を実施例1と同様に処理し、得られた粉体について実施例1と同様の測定および計算を行った。その条件および結果を表3〜表5に示す。
【0079】
表5に示すように、得られた粉体のFe/As(モル比)は0.92を示し、X線回折の結果から非晶質の砒酸鉄二水塩粉末が得られたことがわかった。また、得られた砒酸鉄粉末からの砒素の溶出濃度は319.5mg/Lであり、基準値(0.3mg/L)より非常に高かった。
【0080】
[比較例6]
容量2Lのガラス製の開放容器(反応槽)に入れた溶液中のAs濃度を10.01g/L、Fe濃度を11.21g/L(Fe/As比=1.5)にした以外は、実施例5と同様の方法によって反応させた後、反応生成物の固液分離によって得られた固形分を実施例1と同様に処理し、得られた粉体について実施例1と同様の測定および計算を行った。その条件および結果を表3〜表5に示す。
【0081】
表5に示すように、得られた粉体のFe/As(モル比)は1.03を示し、X線回折の結果から結晶質の砒酸鉄二水塩粉末が得られたことがわかった。また、得られた砒酸鉄粉末からの砒素の溶出濃度は0.01mg/Lであった。
【0082】
これらの結果から、比較例1および比較例3〜6では、実施例1〜7と比べて非常に微細な結晶が生成していることがわかる。また、ポリ鉄を使用した比較例3では、実施例1〜7と比べて、平均粒径が小さく、5μm以下の粒子の割合が多く、BET比表面積が大きくなっているのがわかる。同様にポリ鉄を使用した比較例2では、平均粒径が大きく、5μm以下の粒子の割合が0%であり、BET比表面積が小さくなっているが、SEM像の結果から、緻密な結晶形態でなく、凝集しているため、平均粒径、5μm以下の粒子の割合およびBET比表面積が見掛けの値であることがわかった。これらの結果から、実施例1〜7のように、緻密且つ結晶質で粗い粒子であれば、砒素が溶出し難い安定した結晶であるのがわかる。
【図面の簡単な説明】
【0083】
【図1】本発明による砒酸鉄の実施の形態の製造方法を概略的に示す工程図である。
【図2】実施例2で得られた粉体の走査電子顕微鏡(SEM)写真である。
【図3】実施例2で得られた粉体のX線回折(XRD)データを示す図である。
【特許請求の範囲】
【請求項1】
平均粒径が8μm以上、BET比表面積が2m2/g以下であることを特徴とする、砒酸鉄粉末。
【請求項2】
前記平均粒径が10μm以上であることを特徴とする、請求項1に記載の砒酸鉄粉末。
【請求項3】
前記BET比表面積が0.5m2/g以下であることを特徴とする、請求項1または2に記載の砒酸鉄粉末。
【請求項4】
前記砒酸鉄粉末が砒酸鉄二水塩の粉末であることを特徴とする、請求項1乃至3のいずれかに記載の砒酸鉄粉末。
【請求項5】
不純物として含有するカルシウムおよびマグネシウムの量がそれぞれ2質量%以下であることを特徴とする、請求項1乃至4のいずれかに記載の砒酸鉄粉末。
【請求項1】
平均粒径が8μm以上、BET比表面積が2m2/g以下であることを特徴とする、砒酸鉄粉末。
【請求項2】
前記平均粒径が10μm以上であることを特徴とする、請求項1に記載の砒酸鉄粉末。
【請求項3】
前記BET比表面積が0.5m2/g以下であることを特徴とする、請求項1または2に記載の砒酸鉄粉末。
【請求項4】
前記砒酸鉄粉末が砒酸鉄二水塩の粉末であることを特徴とする、請求項1乃至3のいずれかに記載の砒酸鉄粉末。
【請求項5】
不純物として含有するカルシウムおよびマグネシウムの量がそれぞれ2質量%以下であることを特徴とする、請求項1乃至4のいずれかに記載の砒酸鉄粉末。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2008−260683(P2008−260683A)
【公開日】平成20年10月30日(2008.10.30)
【国際特許分類】
【出願番号】特願2008−129477(P2008−129477)
【出願日】平成20年5月16日(2008.5.16)
【分割の表示】特願2006−204153(P2006−204153)の分割
【原出願日】平成18年7月27日(2006.7.27)
【出願人】(306039131)DOWAメタルマイン株式会社 (92)
【Fターム(参考)】
【公開日】平成20年10月30日(2008.10.30)
【国際特許分類】
【出願日】平成20年5月16日(2008.5.16)
【分割の表示】特願2006−204153(P2006−204153)の分割
【原出願日】平成18年7月27日(2006.7.27)
【出願人】(306039131)DOWAメタルマイン株式会社 (92)
【Fターム(参考)】
[ Back to top ]

