磁性ナノスケール粒子組成物、及びそれに関連した治療方法
【解決手段】 疾患物質を治療するための温熱療法組成物及びそのような組成物を利用した標的療法が開示されている。これらの組成物は、a)安定単磁区粒子、b)超常磁性粒子の凝集体を有する磁性ナノ粒子、或いはc)安定単磁区血漿及び超常磁性粒子を有する磁性ナノ粒子、を有するものである。これらの組成物はさらに、放射性同位体、潜在的な放射性同位体、化学療法剤も有する。これらの方法は、患者の身体、身体部分、体液或いは組織へバイオプローブ(標的特異的リガンドへ付着したエネルギー感受性物質)を適用する工程と、患者における前記標的を破壊、破裂或いは不活性化するように前記バイオプローブへエネルギーを適用する工程とを有するものである。AMFなどのエネルギー形態はエネルギーを供給するために利用される。開示された方法は、癌、免疫システム、中枢神経システム及び血管システムの疾患、及び病原体媒介性疾患を含む、様々な徴候の治療において有用である。
【発明の詳細な説明】
【技術分野】
【0001】
関連出願の相互参照
本明細書は、2005年11月1日に出願された米国仮出願第60/732,368号(発明の名称「MAGNETIC NANOSCALE PARTICLE COMPOSITIONS,AND THERAPEUTIC METHODS RELATED THERETO(磁性ナノスケール粒子組成物、及びそれに関連した治療方法)」)に対して優先権を主張しており、その内容はこの参照によって本明細書に組み込まれるものである。
【0002】
技術分野
本発明は、磁性ナノ治療組成物及び方法に関するものであり、特に、標的特異的リガンドに付着するエネルギー感受性物質から成る磁性ナノスケール粒子組成物、並びに患者の身体、身体部分、組織或いは体液へのそのような組成物の投与、及び前記標的を破壊或いは不活性化するようにエネルギー源からのエネルギーの投与を有する治療方法に関するものである。
【背景技術】
【0003】
患者における疾患の発症及び一連の治療の成功という結末の間の時間は、多くの場合、受け入れ難いほどに長い。多くの疾患は無症状であり、進行性及びしばしば末期段階へ進行するまで検出を逃れる。加えて、この期間は、正しく診断された治療であっても望ましくない副作用による、患者の著しい精神的及び身体的外傷によって特徴付けられるものである。初期に検出された疾患でも、健康組織の正常機能を破壊する、若しくは他の望んでいない副作用を有する治療によってのみ最も有効的に治療されることとなる。
【0004】
そのような疾患の一つは癌である。かなりの研究努力といくつかの成功に関わらず、癌はいまだ米国の死亡原因の第二位であり、米国癌学会の推定によると年間500,000人以上が癌で亡くなっている。伝統的な治療は侵襲性である及び/若しくは有害な副作用(例えば健康な細胞への毒性など)が付随するものであり、しばしば中程度の成功のみを示す一連の外傷性治療に向かうものである。より良い診断手技及び技術の結果である初期検出は、多くの患者の予後を改善した。しかしながら、多くの患者が耐えなくてはならない苦しみは、一連の治療をよりストレスフルなものにし、患者は診断された治療を遵守し完了することになる。さらに、いくつかの癌は、疾患検出の改善にも関わらず、現在利用可能な治療オプションを拒絶するものもある。未だに医学的挑戦を提起する多くの形態の癌である前立腺癌、乳癌、肺癌及び肝癌によって、毎年たくさんの命が奪われる。結腸直腸癌、卵巣癌、胃癌、白血病、リンパ腫、黒色腫及びそれらの転移も命を脅かすものである。
【0005】
例えば、乳癌に対する従来の治療は、一般的に手術とそれに続く放射線及び/若しくは化学療法を含む。これらの技術はいつも有効的であるものではなく、しかも有効であったとしても、彼らは特定の欠乏に悩まされるものである。手術手順としては、腫瘍のみの除去(乳癌腫瘍摘出術)から乳房の完全除去までが範囲である。初期段階の癌において、乳房の完全除去は癌再発に対する保証を提供するが、外観を損ない、患者に非常に難しい選択を迫るものである。乳癌腫瘍摘出術は外観を損なわないが、癌再発の高いリスクと関連している。放射線療法及び化学療法は辛く、再発に対して完全に有効的であるという訳ではない。
【0006】
病原体ベース疾患の治療も合併症無しではない。全身感染の症状を示している患者はしばしば、最初のステップとして広範囲抗生物質で間違って治療される。侵入した生物体がウイルスであった場合、この一連のアクションは完全に有効ではない。細菌(例えば大腸菌など)が原因の場合、抗生物質治療は問題の細菌だけでなく、食物の適切な消化に必要な腸における良性腸内細菌叢も除去する。従って、この方法で治療された患者は、良性細菌が再増殖するまでしばしば胃腸損傷を経験する。他の例において、抗生物質耐性細菌は抗生物質治療には反応しない。ウイルス疾患に対する治療はしばしば侵入してくるウイルス自体を標的としている。しかしながら、ウイルスが侵入しそのウイルスの更なるコピーを産生するために「ハイジャック」された細胞は生存している。従って、疾患の進行は、停止というより遅延される。
【0007】
これらの理由により、疾患を治療するための改善された代替技術、特に既存の技術と比較して患者に対して低い侵襲性と外傷性を有し、疾患組織、病原体、或いは身体における他の望ましい部位などの標的部位で局所的に有効である技術が提供されることが望まれている。さらに、患者への毒性が最低限で、一回或いは非常に少ない治療セッション(患者のコンプライアンスを最小にする)で実行することができ、優れた操作者技術及び入力を必要とせずに疾患組織を標的とすることができる治療技術を提供することも望ましい。
【0008】
そのような代替技術の一つは免疫療法であり、これは例えば癌を含む多くのヒト疾患を治療するために使用されている急速に広まっているタイプの治療である。FDAは多くの抗体ベース癌治療薬を承認した。抗体、抗体断片及び改変特性(例えば抗原結合親和性、分子構造、特異性、原子価など)を有するペプチドを設計する能力は、治療におけるそれらの使用を増強した。癌免疫療法は、ヒトにおける免疫原性反応を軽減するためのマウス抗体のキメラ化及びヒト化における進歩を利用したものであった。高親和性ヒト抗体はさらに、多くの人免疫グロブリン遺伝子を含むトランスジェニック動物から得られた。さらに、ファージディスプレイ技術、リボソームディスプレイ、及びDNAシャフリングは、標的リガンドとして使用するための高親和性で低免疫原性を有する抗体断片及びペプチドの発見を可能にした。これら進歩の全ては、望ましい抗原結合親和性及び特異性を持ち、最低限の免疫反応を示す免疫療法の設計を可能にする。
【0009】
癌免疫療法の領域は、癌細胞によって(正常細胞と比べて)過剰発現された、或いは癌細胞にのみ発現するマーカーを利用する。そのようなマーカーの同定は進行中であり、リガンド/マーカー組み合わせの選択は、あらゆる免疫療法の成功の鍵を握る。免疫療法は少なくとも3つのクラスに分類される:(1)それ自体が増殖受容体を標的とし、サイトカイン経路を破壊する、若しくは補体或いは抗体依存性細胞毒性を誘導する抗体の展開;(2)毒、放射線核種或いはサイトカインを有する抗体の直接的装備;(3)毒を送達するために使用した免疫リポソームへ抗体を付着させることによる、或いは免疫細胞エフェクター(二特異性抗体)へ抗体を付着させることによる抗体の間接的装備。装備した抗体は治験において強力な腫瘍活性を示したにも関わらず、それらはさらに患者に対して許容できない高レベルの毒性を示した。
【0010】
免疫毒性或いは放射核種(すなわち直接的及び間接的装備)の送達に依存している治療の不利益は、一度患者に投与されたら、これらの薬剤は全時間で活性化されるということであった。これらの治療はしばしば非腫瘍細胞に対してダメージを与え、毒性問題と送達問題を提示する。例えば、癌細胞は一般的に、表面発現抗原(免疫療法によって標的化される)を血流へ流す。免疫複合体は免疫療法剤及びその流された抗原との間に形成され得る。結果として、癌細胞との相互作用よりもこれらの流された抗原との前記抗体の相互作用のせいで、多くの抗体ベース治療は希釈されてしまい、それによって正確な送達用量が減少してしまう。従って、有害な副作用を最低限にし、有効性を改善する「治療応需型」アプローチが好ましい。
【0011】
温熱療法において、約40℃〜約46℃(高温/温熱療法)の範囲における温度は疾患細胞へ不可逆的なダメージを与えることができる。しかしながら、健康な細胞は46.5℃周辺までの温度に曝されても生存することができる。疾患組織における個々の細胞の温度を致死レベルまで上昇させる(細胞性温熱療法)は、優れた治療オプションを提供する。疾患及び身体における他の望ましくない問題に関連した病原体も、局所的な高温に曝すことによって破壊され得る。
【0012】
46℃以上の温度もさらに、即効性温熱切除反応を生じることによって癌及び他の疾患の治療に対して有効である。しかしながら、そのような温度に曝す健康組織を最少量にすることを確実にするために、正確で的確な標的化が必要である。そのようなレベルの標的化の達成に失敗すると、有害な副作用が増加し、その治療の利点が減少してしまう。
【0013】
温熱療法(hyperthermia)は、即効性ネクローシス(一般的に「温熱切除」として言及される)及び/若しくは細胞における熱ショック反応(典型的な温熱療法)を誘導し、その結果細胞内での一連の生化学的変化を介した細胞死を導くため、癌及び他の疾患に対する治療としてかなり有望である。位相同期輪状配列システム(APAS)などのマイクロ波或いは高周波(RF)温熱療法を用いる最先端技術システムは、深部に位置する腫瘍の局所加熱に対するエネルギーを調整しようと試みている。そのような技術は、組織導電率の異種性及び高度に灌流された組織の異種性によって制限される。これは、望ましい領域における投薬に伴う非標的組織における「ホットスポット」現象の未解決問題を導くものである。その結果としては、予想された治療率より低いものであり、望ましい領域へと送達された十分量で正確な熱容量を決定することは本質的に難しいものである。後者の結果によって、再現性及び治療後の予想可能な患者利益を確実にすることが必要な規定臨床プロトコールの開発が排除される。これらの因子の全ては、そのようなシステムでの特異的領域の選択的加熱を非常に困難にする。
【0014】
RF温熱療法を利用した別の戦略は、マイクロ波或いはRFベースアンテナ或いは自己調節型温熱シーズの外科的移植を必要とする。このアプローチは用量決定に関連した問題、及び標的化に関連したいくつかの問題を回避する一方、前記温熱シーズを移植するための侵襲性手順を必要とする。この侵襲性に加えて、このアプローチは原発腫瘍の正確な位置の知識を必要とするので、転移の治療に対するオプションが(もしあったとしても)ごく少ない。従って、前記シーズ移植戦略は未検出の個々の癌細胞、若しくは原発腫瘍部位に全く隣接していない細胞群を標的化することはできない。この戦略の臨床成功は、望ましい腫瘍部位での熱の標的化産生に関連する問題によって阻まれる。
【0015】
適切な溶媒に懸濁された超常磁性粒子(10−9秒ほどの特徴的な緩和時間を有する)(磁性流体として言及される)を用いた腫瘍内での熱産生、及び前記患者の交流磁界(AMF)への曝露によって疾患を治療する戦略が提案されている(米国特許第6,541,039号、Lesniak et al.及び米国特許第6,470,220号、Kraus, et al.を参照のこと)。いくつかのバリエーションが存在する一方、一般的に先行技術に開示された方法は、目的の領域を含む、治療される領域への直接的な磁性流体の導入、及び50kHzと200kHzとの間の周波数を有する磁界を変える低振幅(16kA/m以下)へ患者の大部分を曝すことによって前記粒子を加熱する工程を有するものである。AMFへ患者の大部分を曝す工程は、組織とのAMFの相互作用によって産生された渦電流によって、曝された全領域、さらにはコア身体温度の組織温度を上昇させるということはよく知られている。実は、これは上述のアンテナベース或いは位相同期輪状配列RF装置を用いた一般的な戦略である。従って、この領域内に位置した癌腫瘍は、磁界がなくても温度の上昇に曝される。約40℃〜43℃の範囲までの腫瘍温度上昇はいくつかのケースにおいて報告されている。前記腫瘍に直接的に注入される、腫瘍1グラム当たり約10mg〜100mg粒子という比較的大量な超常磁性粒子を考える場合、そのような腫瘍温度は低いように思われる。これは、熱の大部分が、前記粒子の存在による低程度の熱を有する組織上での直接的なAMF効果(渦電流)の結果であることを示唆するものである。
【0016】
記載されたような磁性流体は非相互作用超常磁性粒子から成り、これは、凝集するためのそれらの粘性が減少しているため好ましいと言われている。前記流体を有する磁性粒子は超常磁性であるので、粘性加熱はその粘性によって溶媒内へエネルギーを蓄積する粒子循環、すなわちブラウン緩和を生じるメカニズムである。先行技術に記載されたように、超常磁性粒子は、ゼロ或いはゼロに近い残留磁気を有し、その結果さらにその磁気モーメントが非相互性である場合に生じる減少した凝集傾向を有するため望ましい。ネール緩和(磁気ヒステレシス)は、AMF期が前記粒子磁気モーメントの特徴的な緩和時間に比べて著しく短く(10−9秒以下)ない限り、この場合除外される。従って、AMFで加熱する磁気ヒステレシスは、AMF周波数が1Ghz以上の場合のみ可能である。記載された磁性(超常磁性)流体の組成物に関する方法、及びそこに開示された一般的なAMF周波数(約100kHz)に対して、ネール緩和を介した加熱の貢献は不可能である。
【発明の開示】
【発明の効果】
【0017】
RF界へ曝された磁性流体を用いた疾患の治療に対する温熱療法は、数十年の間認識されていた。しかしながら、磁性流体温熱療法の主要な問題は、特にその組成物が適用されたRF期より短い特徴的な緩和時間を所有する粒子に限定される場合、致死量の粒子を目的の細胞或いは病原体へ選択的に送達する能力がないことであった。
【0018】
適切に標的化された加熱アプローチが疾患の治療効果を有するという臨床可能性のように、細胞に対する加熱ダメーイの生物学はよく理解されている。このことは、加熱がこれらの治療と組み合わされた場合、或いはこれらの組み合わせである場合、前記細胞の加熱感作に起因する、加熱の細胞毒性効果若しくは放射線或いは化学療法の増強された細胞毒性効果に起因するものである。紫外線、X線、ガンマ、ベータ、アルファ、ニュートロなどのン電離放射線、或いは化学療法との組み合わせで細胞に適用された加熱はしばしば、イオン化エネルギー或いは化学療法用量の付加的組み合わせから予想ものより著しく多く増強された細胞毒性効果を生じる。しばしば細胞は、その用量が熱と組み合わされ、いくつかの組み合わせにおいてサブ致死用量であった場合、化学療法剤或いは電離放射線の別のサブ致死用量に対して高レベルの感受性を示すことがある。そのような併用療法は、加熱或いは電離放射線からのダメージを与える副作用が回避されるため、実証可能な優位な臨床可能性を有している。従って、すなわちバイオプローブにおける適切に標的化された治療の併用形態は、治療様式或いはそれらの併用の非標的化適用よりも著しい利点を有する。
【0019】
上述の観点において、疾患組織、病原体、或いは他の望ましくない問題を治療するための温熱療法組成物に対するニーズが存在し、これは、a)安定単磁区粒子(109秒以上の特徴的な緩和時間);b)超常粒子の凝集から成る磁性ナノ粒子であって、ここにおいて磁気モーメントの相互作用は、患者体内の標的へ適用された磁界の期間に適合した特徴的な緩和時間を有する集合状態を生み出している、磁性ナノ粒子;或いはc)安定単磁区結晶及び超常磁性粒子の凝集から成る磁性ナノ粒子であって、ここにおいて前記安定単磁区及び超常磁性磁気モーメントの相互作用は、10−9秒以上に達する超常磁性特徴的な緩和時間が増加した集合状態を生じる、磁性ナノ粒子、を有するものである。さらに、そのような温熱療法組成物の選択的な送達を含み、安全で有効的で、持続時間が短く、最小限の侵襲性である温熱療法ベース治療方法を有することも望ましい。
【0020】
従って、疾患物質を治療するための温熱療法磁性組成物を提供することが本発明の対象であり、これは、a)安定単磁区粒子(109秒以上の特徴的な緩和時間);b)超常粒子の凝集から成る磁性ナノ粒子であって、ここにおいて磁気モーメントの相互作用は、患者体内の標的へ適用された磁界の期間に適合した特徴的な緩和時間を有する集合状態を生み出している、磁性ナノ粒子;或いはc)安定単磁区結晶及び超常磁性粒子の凝集から成る磁性ナノ粒子であって、ここにおいて前記安定単磁区及び超常磁性磁気モーメントの相互作用は、10−9秒以上に達する超常磁性特徴的な緩和時間が増加した集合状態を生じる、磁性ナノ粒子、を有するものである。
【0021】
疾患物質を治療するための方法を提供することは本発明の別の対象であり、これは、そのような温熱療法組成物の選択的送達を有し、安全で有効的で、持続時間が短く、最小限の侵襲性である。
【0022】
患者に対する磁性物質組成物の投与、及びを例えばネール緩和などの磁気ヒステレシス損失を介して前記磁性物質を誘導的に加熱する改変磁界の適用含む治療方法を提供することは本発明の別の対象であり、この磁性物質組成物は、安定単磁区粒子、若しくは磁気ヒステレシス損失を介した加熱が適切に調節された集合磁性状態の特徴的な緩和時間を有する磁気的に連結した超常磁性粒子の凝集、或いは標的特異的リガンドへ結合した、「磁気的に連結した安定単磁区及び超常磁性粒子の凝集を有するものである。
【0023】
交流磁界の適用前に患者の体内における前記磁性物質組成物の集積の少なくとも1つの位置の検出を有するそのような治療方法を提供することは本発明の別の対象である。
【0024】
前記磁性物質組成物が患者の体外にある場合、前記交流磁界の適用を有するそのような治療方法を提供することは本発明の別の対象である。
【0025】
前記磁性物質を誘導的に加熱し、ネクローシス、アポトーシス或いは疾患物質を非活性化することによる望ましい病理学的効果の誘導を含むそのような治療方法を提供することは本発明の別の対象である。
【0026】
前記ナノ粒子組成物内における温熱療法、放射線、化学療法の利点を組み合わせる組成物及び治療方法を提供することは本発明の別の対象である。
【0027】
磁性物質組成物を投与するための方法を提供することは本発明の更なる別の対象であり、これは腹腔内注入、血管内注入、筋肉内注入、皮下注入、局所的(外用)、吸入、経口摂取、直腸挿入、洗浄、洗浄液、リンス、或いは患者の身体物質への体外投与を介して行われるものである。
【0028】
組織を安全に且つ効果的に、最小限の侵襲性を有し、短い治療期間で治療するための方法を提供することは本発明の更なる対象である。
【0029】
本発明は、疾患物質を治療するための温熱療法磁性組成物に関するものである。1実施形態において、前記組成物は、標的特異的リガンドへ結合した単磁区粒子(109秒以上の特徴的な緩和時間)を有する。別の実施形態において、前記組成物は、超常磁性粒子の凝集を有する磁性ナノ粒子を有するものであり、ここにおいて前記相互作用した磁気モーメントは、患者の体内で標的に適用された磁界の期間に適合した特徴的な緩和時間を有する集合状態を創るものである。別の実施形態において、前記組成物は、安定単磁区結晶及び超常磁性粒子の凝集を有する磁性ナノ粒子を有するものであり、ここにおいて前記安定単磁区及び超常磁性磁気モーメントの相互作用は、10−9秒以上に達する超常磁性特徴的な緩和時間を増加する集合状態を生じるものである。
【0030】
本発明は疾患組織、病原体或いは患者における他の望ましくない問題を治療するための方法に関するものである。1実施形態において、前記治療方法は、患者に対して、標的特異的リガンドに連結した単磁区粒子を有する温熱療法磁性組成物の投与、及び前記磁性物質組成物を誘導的に加熱する交流磁界の適用を有するものである。前記温熱療法磁性組成物はさらに、前記リガンド及び前記磁性粒子を別々に患者に対して投与する工程、及び次に患者の体内で前記リガンド及び前記磁性粒子を組み合わせる工程によって投与されるものである。
【0031】
別の実施形態において、前記治療方法は、患者への、患者の体内で前記磁性組成物の集積の少なくとも1つの位置を検出する温熱療法磁性組成物の投与、及び前記磁性組成物を誘導的に加熱する交流磁界の適用を有するものである。
【0032】
別の実施形態において、前記治療方法は、患者への温熱療法磁性組成物の投与、及びネクローシス、アポトーシス或いは病原体非活性化を生じさせるための、前記磁性組成物への誘導的な加熱によって望ましい病理学的効果を誘導する交流磁界の適用を有するものである。
【0033】
別の実施形態において、前記治療方法は温熱療法磁性組成物の投与を有するものであり、これは腹腔内注入、血管内注入、筋肉内注入、皮下注入、局所的(外用)、吸引、経口摂取、直腸挿入、洗浄、洗浄液、リンス、或いは患者の身体物質への体外投与を介して行われるものである。
【0034】
治療方法に対して開示されたあらゆる実施形態は、患者の一部の身体的特徴のモニタリングを有するものである。
【0035】
治療方法に対して開示されたあらゆる実施形態において、既定標的は、癌、免疫システムの疾患、病原体媒介性疾患、及び毒素、臓器移植に対する反応、ホルモン関連性疾患及び非癌性疾患細胞或いは組織などの望ましくない標的などの疾患に関連するものである。
【0036】
本発明の上述の要約は、それぞれ説明された実施形態或いは本発明の全ての実施を記載することを意図したものではない。以下の図面及び詳細な説明は、これらの実施形態を特に例示するものである。
【発明を実施するための最良の形態】
【0037】
本発明は、付随する図面を参照しながら以下にある本発明の様々な実施形態の詳細な説明を考慮することによってより完全に理解されるであろう。
【0038】
本発明は様々な修飾及び代替形態に適用可能である一方、それについての詳細は、図面において実施例を介して示されており、詳細に記載されているであろう。しかしながら、記載された特定の実施形態に限定することを意図するものではないということは理解されるべきである。一方、添付の請求項によって定義されたような本発明の範囲及び観点の範囲内にある全ての修飾、同等なもの、及び代替物は対象とすることを意図するものである。
【0039】
本発明は、疾患物質を治療するための温熱療法組成物、及びそのような組成物を用いて疾患物質を治療するための方法に関するものである。本発明の組成物及び方法は、癌を含む様々な徴候の治療用に使用される。開示された組成物を用いた治療方法は、バイオプローブを有する治療用磁性組成物の患者への投与、及び標的細胞を殺傷するために前記バイオプローブを十分に加熱するための、前記磁性粒子組成物を含む患者のある領域への交流磁界の適用を有するものである。本発明或いはその観点は、適切な装置或いは器具と併せて使用するのに適している。
【0040】
定義
本明細書で用いられたように、「AMF」(交流磁界の省略)という用語は、約80kHz〜約800kHzの範囲の周波数を有する、特に正弦曲線、三角形、長方形或いは同様な形パターンにおける、その場のベクトルの方向を周期的に変更する磁界を意味している。AMFはさらに、結果生じた磁界ベクトルのAMF成分のみが方向を変化するような静磁界も付け加えられる。前記交流磁界は交流電磁場に付随して生じ、実際には電磁気であることが好ましい。
【0041】
本明細書で用いられたような、「バイオプローブ」という用語は、磁性ナノ粒子コア、コーティング、リンカー、及び前記交流磁界(AMF)に反応して加熱することによって組織を選択的に治療するために使用される標的リガンドを有する標的ナノ粒子を意味している。加えて、前記バイオプローブは適切なエネルギー源に曝された場合放射能を有するようになる放射線源或いは種を有する。イットリウム−90(90Y)は例示的な放射線源である。ホウ素−10(10B)は適切なエネルギー源に曝され放射能を有するようになる場合、放射能を有するようになる例示的な種である。ホウ素−10(10B)は、高ニュートロン吸収横断面を有しており、ニュートロンの捕捉によって放射能を有するようになるため、ニュートロンのビームへ曝された場合、放射能を有するようになる。前記バイオプローブはさらに、化学療法剤も有する。ドキソルビシンは例示的な化学療法剤である。
【0042】
本明細書で用いられたように、「バイオプローブシステム」という用語は、マーカーを介して選択的に同定された標的に特異的なバイオプローブを意味するものである。
【0043】
本明細書で用いられたように、「コーティング」という用語は、患者内における前記バイオプローブのin vivo輸送に影響を与えるように働き、疾患組織及び細胞による取り込みと保持を容易にするのに適切な生態的合成物質を有する、物質、物質の組み合わせ、或いは磁性ナノ粒子の被膜を意味するものである。デキストラン及びポリエチレングリコールの組み合わせは例示的なコーティングである。
【0044】
本明細書で用いられたように、「疾患物質」という用語は、骨髄、肺、血管、神経、結腸、卵巣、乳房及び前立腺癌などのあらゆるタイプの癌;AIDSなどの免疫システムの疾患;細菌、ウイルス、寄生虫或いは真菌などの病原体媒介性疾患(病原体媒介性疾患の例としてはHIV、結核及びマラリアを含む);肥満などのホルモン関連疾患;血管システム疾患;多発性硬化症などの中枢神経系疾患;及び有害な血管新生、再狭窄、アミロイドーシス、毒素、臓器移植に関連した産物による反応、及び他の異常細胞或いは組織増殖などの望ましくない問題に関連した組織或いは細胞を意味するものである。
【0045】
本明細書で用いられたように、「負荷サイクル」という用語は、エネルギー源が1つのオン−オフサイクルにおいてオン及びオフである総時間に対するエネルギー源がオンである時間の割合を意味するものである。
【0046】
本明細書で用いられたように、「エネルギー源」という用語は、前記バイオプローブを有する潜在的な放射線源を活性化する目的で前記バイオプローブへAMF以外の形態のエネルギーを送達することができる装置を意味するものである。
【0047】
本明細書で用いられたように、「徴候」という用語は、疾患などの病状を意味するものである。乳癌は例示的な徴候である。
【0048】
本明細書で用いられたように、「リガンド」という用語は、バイオプローブ及び標的に連結し、生物学的マーカーを標的化し連結する分子或いは化合物を意味するものである。HER−2(上皮増殖因子受容体タンパク質)に特異的なモノクローナル抗体は例示的なリガンドである。
【0049】
本明細書で用いられたような、「リンカー」或いは「リンカー分子」という用語は、リガンド上、若しくは磁性粒子或いはコーティング上特定の機能基を標的化し、これらの任意の2つの間で共有結合を形成する因子を意味するものである。
【0050】
本明細書で用いられたような、「磁性ナノ粒子」という用語は、交流磁界において磁気ヒステレシス損失を介して誘導的に加熱するように適切に調節された集合磁性状態の特徴的な緩和時間、すなわちネール緩和を有する、磁気的に連結した超常磁性粒子の凝集を意味するものである。
【0051】
本明細書で用いられたように、「マーカー」という用語は、前記バイオプローブが特異性を示す抗原或いは他の物質を意味するものである。HER−2タンパク質は例示的なマーカーである。
【0052】
本明細書で用いられたように、「標的」という用語は、疾患細胞、病原体、或いは他の望ましくない問題などの非活性化、破裂、崩壊或いは破壊が望まれているような問題を意味している。マーカーは前記標的に連結する。乳癌細胞は例示的な標的である。
【0053】
標的治療システム
本発明の標的治療システムは、徴候を治療するために少なくとも1つのエネルギー源と連結したバイオプローブシステムの利用に関するものである。
【0054】
バイオプローブシステム
本発明の前記バイオプローブシステムの様々な実施形態は、図1及び図2に説明されている。図1は本発明に従ったバイオプローブ配置を図示したものであり、ここにおいてバイオプローブ100は磁性ナノ粒子110を有している。前記磁性ナノ粒子110はコーティング120を有している。加熱は、前記磁性ナノ粒子がヒステレシスを通じてAMF源へ曝された場合、前記磁性ナノ粒子110に産生されるものである。加えて、前記磁性ナノ粒子は、放射性成分、或いは適切な非AMFエネルギー源に曝された場合放射能を有するようになる適切な同位体を有するものである。
【0055】
磁性ナノ粒子
微磁性粒子の一般的特性:単磁区−安定及び不安定
ナノスケール(1μm以下の直径を有する)磁性物質は、それらの従来型或いは大半の対応物と比較した場合、残留磁気及び飽和保磁力などの多くの増強された特性を有している。粒子サイズの減少に伴って、表面及び界面領域にある粒子を有するわずかな原子が増加する。これは、前記磁性特性に対する前記表面及び界面電子構造の効果の重要性を増加させる。自然発生磁化及び磁気結晶異方性などの物質の本質的な磁性特性は、粒子(結晶)サイズに強く影響される。磁気結晶異方性は単磁区粒子の総異方性に唯一貢献するものである。付加的な貢献としては、静磁気、形、ストレス及び表面異方性が挙げられる。これらの最後は、サイズが減少するにつれて重要性が増加する表面及び粒子境界の詳細な化学性質に密接に関連するものである。
【0056】
総異方性エネルギーは、表面異方性貢献度が増えるので、特定のサイズ範囲内では粒子サイズが減少するにつれて増加する。これらの増強された磁性特性の多くは、ナノスケール磁性物質を様々な適用に特に適するようにするものである。本明細書に記載された本発明に対して、前記増強された磁気結晶異方性は、交流磁界(AMF)に曝された場合、これら物質のヒステレシス損失の増加に貢献する、つまり、より高い特異的吸収率(SAR)或いは加熱を生じる。実は、大半の対応物と比較した場合その表面異方性貢献度が大きくなることによって前記総異方性エネルギーは粒子サイズに伴って増加するため、特定サイズ内のナノスケール磁性物質は、特定のAMF条件下で所定量の物質に対して著しく高いSAR値を生み出すことができる。
【0057】
単一非相互作用粒子
大きな磁性体は、その静磁気エネルギーを最小限にするために磁壁(ブロッホ磁壁)によって分離される、磁区として言及される均一に磁化された領域へ分けられるということは理解される。しかしながら、最小限にされるべき前記エネルギーは、磁壁貢献と同様に静磁気、交換及び異方性成分を含む総エネルギーである。従って、磁性物質内の磁区の数と形を決めるのは、エネルギーの最終バランスである。物質のサイズが小さくなるにつれて、磁区のサイズも小さくなるであろう。加えて、前記磁区の構造は、前記磁壁幅及び構造が変わるにつれて変わるであろう。磁壁形成に関連したエネルギーコストが存在し、従って結果生じる総エネルギーバランスは、磁区の細分を特定の最適な数とサイズまでに限定する。
【0058】
磁壁の形成に起因するエネルギー増加が前記単磁区をより小さい磁区へ分けることによって得られたエネルギー減少よりも大きいため、単磁区構造が存在するサイズ以下の粒子サイズにおける、対応するより低い制限が存在する。多くの磁性物質に対して、容積制限は約2nm〜約800nmの範囲であり、これは自然発生磁化、及び異方性及び交換エネルギーに依存するものである。
【0059】
単磁区のみを有する磁性体、すなわち単磁区粒子に対して、時間及びその環境(温度、外部地場など)に関する前記磁区の磁気モーメントm(磁化の振幅及び配向を定義するベクトル)の挙動は、前記磁性粒子の総異方性エネルギーによって制御される。結晶構造軸に関する前記磁気モーメントの配向は、前記異方性エネルギー及び前記粒子が置かれた物理的環境(過去及び現在)の明確な結果である。本明細書で開示された本発明にとって一般的に興味深い環境変数の中には、時間変動磁場(AMF)及び温度の存在及び性質が含まれている。特に、ヒステレシス損失及びその結果として産生された加熱(SAR)を決定するのは、AMFの存在下に置かれた場合、単磁区粒子におけるmの空間的配向(反転)によって示された反応様式である。
【0060】
交流磁界に曝された場合の、ヒステレシス損失を介して熱を産生する単磁区粒子(結晶)のポテンシャルは、総異方性エネルギーを導く前記粒子内のエネルギーのバランスによって決定される。異方性エネルギーのこの合計は、前記磁気モーメントm(前記粒子の正味の磁気の方向及び振幅両者を表すベクター)の方向における変化に対するエネルギー障壁EBを示す。従って、時間に関するmの安定性は、EBの値を増加する。粒子体積V及びEBは組み合わせて特徴的な緩和時間τ0を定義し、この緩和時間τ0は、十分に強い磁場によって強制的に再配向された後、いくつかの開始値に対するmの方向における自然発生変動或いは緩和に必要な時間である。別の言い方をすると、τ0は、前記粒子の本質的な特性と考えられ、粒子の組成物、容積、形などの様々なパラメーター、及び粒子内の対称性やmに利用できる緩和経路に依存するものである。
【0061】
交流磁界へ曝した時の単磁区粒子のヒステレシス損失を通じて認識された熱の量は、前記粒子の本質的な性質と実験条件の両者の組み合わせの結果である。実験温度は、EBと前記システムで利用可能なエネルギーとの間の相対的差異を決定し、実験緩和時間或いはτを設定するものである。この関係は、数学的に以下のように定義される。
【0062】
【数1】

【0063】
従って、τとのAMFの振動期間(1/ν)の関係は、ヒステレシス損失を通じて産生される熱の量を直接導く重大な実験的に観察可能な量となる。ここで、νとはAMFの振動の周波数である。1/ν>>τの場合、前記モーメントは非ブロック化のように見られ、ヒステレシス損失を示すことなく、すなわち熱を産生することなく、自然発生的にEB及び再配向を不規則に回復する。反対に、1/ν<<τの場合、前記モーメントはブロック化のように見られ、配向における変化に抵抗するものである。十分な振幅のAMFの場合、mはEBを回復せざるを得ず、変化の間熱を放出する。
【0064】
単磁区粒子における異方性エネルギー或いは潜在的なヒステレシス損失は、第一近似において、前記粒子の容量に比例する。従って、大きな単磁区粒子に対して、前記異方性エネルギーは非常に高いので、磁化反転に対する前記エネルギー障壁は物質のキュリー温度以下の任意の温度に対する熱エネルギーによって回復されない。熱エネルギーは、産物kTによって定義され、ここにおいてkはボルツマン定数であり、Tはケルビンにおける温度である。そのような単磁区粒子は、磁気モーメントは変動しないため適切な単磁区を有すると言われており、時間に関する本質的に安定な磁区挙動を示すと言われている。磁化反転は、前記粒子が異方性エネルギーを回復するのに十分な程強い外部磁場に曝された場合、そのような本質的に安定な磁性単磁区において生じ、磁化ベクトル(磁気モーメント)を変化或いは反転させる。前記異方性エネルギーは前記磁気モーメントの回転に対する障壁を示すので、このベクトルにおけるそのような空間的変化は、熱の形態でのエネルギー放出を伴う。放出された熱の量は、第一近似において、前記異方性エネルギーと比例するものである。
【0065】
前記磁場が除去された場合、前記磁気モーメントは特徴的な時間で磁場によって誘導された配向を保持する。磁場が除去された後に生じるそのような磁気モーメントの配向変化に必要な時間は、前記粒子の特徴であり、前記粒子の異方性エネルギー及びkTの両者の結果である緩和時間である。本質的に安定な単磁区粒子の極端な場合において、この時間は109秒以上である。それ故、物質キュリー温度までの全温度に対して、前記異方性エネルギーは磁気スピンシステムの自然発生回転に対する乗り越えられない障壁を示すため、前記磁気モーメントはブロック化のように見える。キュリー(或いはネール)温度は強磁性体から常磁性体状態への移行が生じる温度として定義される。
【0066】
反対に、単磁区形態内で粒子の容量が減少すると異方性エネルギーも減少する。特定の特徴的な粒子サイズ以下では、前記異方性エネルギーはゼロ以上のTの値に対してkTと同程度に低い或いはより低くなる。これは、常磁性体物質における単一スピンと同様に、磁化反転に対する前記エネルギー障壁が回復し、前記粒子の総磁気モーメントが熱的に変動できるということを意味している。この場合において、全体のスピンシステムは自然発生的に回転し、単磁区粒子内のスピンは磁気的に連結したままである。結晶軸に関する前記磁気ベクトルの配向は変動し、本質的に不安定である。これは、バルク材料において観察される常磁性と類似するため、超常磁性である。そのような磁性単磁区粒子は、本質的に不安定な単磁区を有すると言われている、若しくは本質的に超常磁性である。
【0067】
超常磁性粒子を外部磁場に曝すことは、磁場ベクトルの方向に配列された磁気モーメントを生じるが、付随するエネルギーの放出はない。前記異方性エネルギーはゼロ以上の測定可能な実験温度に対してkTより低いため、磁化反転に対する障壁は示さない。磁場が粒子から除去された場合、前記磁気モーメントの配向の自然発生的変動は、外部磁場によって引き起こされたあらゆる誘導を素早く破壊するであろう。本質的な超常磁性粒子の特徴的な緩和時間は非常に短く、特に10−9秒オーダーである。本質的に安定な磁区粒子と対照的に、本質的に超常磁性物質の磁気モーメントは、全実験温度において、及び前記特徴的な緩和時間よりも長い時間の時間依存測定において非ブロック化である。
【0068】
これら2つの極値間で、異方性エネルギーは中間である粒子容量の範囲内にあり、従って磁化反転の時間スケールは、測定の温度及び時間スケールに明確に依存している。従って、所定の粒子容量に対する緩和時間は温度によって定義され、それ故に前記測定時間が前記特徴的な緩和時間より短い場合、磁気モーメントはブロック化であるように見える。この場合において、前記物質は、安定な単磁区と類似の挙動を示し、前記特徴的な緩和時間より短い期間AMFに置かれた場合、熱を産生するであろう。そのような物質は、これらの条件下においてブロック化で明らかに安定な単磁区として定義される。
【0069】
反対に、測定時間、すなわちAMF期間が前記粒子の特徴的な緩和時間を超過する場合、非ブロック化或いは明らかな超常磁性挙動が観察されるであろう。この場合の特徴的な緩和時間が測定時間或いはAMF期間より非常に短いため、磁化再配向及び反転は、異方性エネルギー障壁によるインピーダンスを示さずに不規則に生じ、熱の放出も伴わない。
【0070】
明らかに安定な単磁区或いはブロック化挙動と明らかな超常磁性或いは非ブロック化挙動とを区別するためには温度も非常に重要である。従って、類推して、単磁区を有する特異的容量の粒子の磁気モーメントの特徴的な緩和時間は、実験温度Texpが特徴的な値以下であり、固定期間AMFに曝された場合、ブロック化であるように見える。Texpがこの特徴的な温度以上の値まで増加した場合、前記磁気モーメントは、同じ固定期間アMFに曝された場合、非ブロック化であるように見える。この特徴的な温度は、ブロッキング温度Tbとして定義される。従って、単磁区を有する粒子が固定周波数のAMF内に置かれた場合、前記磁気モーメントの強制振動は、前記粒子温度が前記ブロッキング温度以下である間、熱を放出するであろう。一度前記粒子温度がブロッキング温度を超過すると、前記磁気モーメントは非ブロック化になり、AMFへ更に曝されても熱の放出は停止するであろう。これは、kTによって定義された熱エネルギーが異方性エネルギーを超過し、過度のエネルギーをスピンシステムへ提供し磁気結晶異方性エネルギー障壁を超えるからである。
【0071】
非相互作用粒子のシステム
以上では特異的組成物及び容量の個々の単磁区粒子の挙動を記述した。バイオプローブは、それ自体が1以上の単磁区粒子の凝集である磁性ナノ粒子を有する。更に、前記バイオプローブは、適切で好ましくは非磁性媒体に懸濁された1以上のバイオプローブの懸濁液を有する。従って、前記バイオプローブ懸濁液は、分布の平均に集中している様々なサイズの個々のバイオプローブから成る。言い換えると、各バイオプローブは容量が異なり、更に分布の平均に集中している1以上の単磁区粒子から成る磁性ナノ粒子を有する。
【0072】
緩和時間及び結果生じるヒステレシス損失、及びバイオプローブ懸濁液に適用されたAMFにおいて産生された熱の理論上の記述は、特異的な容量を有する個々の単磁区粒子の挙動、すなわち非相互作用モーメントを有する単分散粒子の集合体の挙動を記載するために必要な記述以上に、更に多くの要因を含む事を必要とするであろう。容量はEBに直接影響を与える単磁区粒子の本質的な特性であるため、様々な容量を有する粒子を有する粒子の集合体に対するτ0及びτの決定は、サイズ分布の知識を必要とする。平均容量が特異的温度及びAMF周波数でmをブロックするのに十分なEBの値に関連する間に、容量及び著しく低いEBの集合体においてかなり大きな粒子の分画が存在する。正味の効果は、平均容量単独の知識から予想されたものより有意に低い測定熱産出を生じる。その逆も示された。粒子の集合体は、EBの値がmをブロックするのに必要な値より低い、すなわち超常磁性を示す場合、平均容量を有する。その結果として、前記システムは特異的な温度で特異的な周波数を有するAMFにおいてヒステレシスを示すと予想されなかった。しかしながら、この集合体は、平均より有意に大きい容量のかなり多数の粒子を含む。前記集合体のこの成分はブロック化であるように見られ、これは、特異的な温度で特異的な周波数を有する実験AMFに曝された場合産生されるヒステレシス及び測定可能な量の熱を生じるものである。特定量の産生された熱は、平均粒子容量のみの知識から予測されたものとはかなり明らかに矛盾するものである。
【0073】
粒子間相互作用は、単磁区粒子の集合体を有するバイオプローブの集合体のヒステレシス挙動を完全に記載するために必要な別の要因である。磁力は、定義によると長期的な力である。つまり、影響範囲は磁性粒子の境界にまで広がる。従って、1以上の単磁区粒子から成る磁性ナノ粒子は、集合状態に由来する異方性エネルギーに体する付加的な貢献、すなわち他の磁区との各磁区mの相互作用貢献のため、各粒子の磁性特性の合計以上の特性を示す。
【0074】
相互作用効果は異方性エネルギーを修飾し、非相互作用の場合、個々の粒子の状態に特徴的な挙動を示す集合状態を産出することが実験的に確立されていた。その結果は明らかに増加したEBであり、これは不均ブロッキングプロセスを生じるということがしばしば観察されていた。従って、超常磁性粒子のクラスタから成る磁性ナノ粒子は、ブロック化であるように見え、適切な実験条件下でヒステレシスを示す。前記ブロッキングプロセスは不均一であるため、ヒステレシス挙動は、凝集体と同程度の容量の単磁区粒子よりもかなり弱い。そのような凝集体は、全ての条件下で厳密ではないので、超常磁性或いは安定な単磁区としては定義されない。さらに、前記凝集体を有する各粒子は、全ての観点において超常磁性であり、ヒステレシスを示すことができない。
【0075】
単磁区粒子の凝集体、すなわち安定体と超常磁性体との組み合わせ、若しくは純粋な超常磁性体から成る磁性ナノ粒子の正確な定義及び完全な特徴付けは、多くの測定技術が特徴付けに必要なため、難しく実用的ではない。実は、これらの測定のいくつかの結果は、決定的ではない或いは矛盾するものである。それにも関わらず、実施測定は、本明細書に記載された本発明の目的に対する明らかな挙動を定義するために存在する。バイオプローブの集合体(ここにおいて各バイオプローブは磁性ナノ粒子の集合体から成り、各磁性ナノ粒子はさらに個々の粒子或いは粒子の凝集体から成る)は、凝集平均異方性エネルギーによって定義され、所定の特異的な温度で特異的なAMFにおける特徴的な緩和時間の平均及び平均挙動を定義する。従って、比較的単純な仕方でそのようなバイオプローブの集合体の磁性特性を定義することが可能である。270K〜380Kの実験温度で、及び約100kHz〜約600kHzの周波数、及び約7.98kA/m〜104kA/mの振幅を有するAMFへ曝すことに基づいて、SARの測定は全体の集合体の明らかな非ブロック化挙動から明らかなブロック化を区別するために使用される。非ブロック化或いは明らかな超常磁性粒子の集合体は、特異的条件下で10W/g以下の粒子を産生するであろう。比較すると、非相互作用の本質的な超常磁性ナノ粒子の集合体は、定義によると正確に0W/gの粒子を産生するであろう。反対に、明らかなブロック化バイオプローブは10W/g〜150W/gの粒子を産生するであろう。さらに、本質的なブロック化或いは安定単磁区粒子の集合体は、いくつかの超常磁性汚染が存在するにも関わらず、ヒステレシス加熱を介して特異的条件下で150W/g以上の粒子を産生するであろう。
【0076】
放射性同位体
特定の癌などの疾患を治療するための放射線及び熱の相乗効果のおかげで、前記バイオプローブが放射性同位体を有する場合、標的温熱療法の有効性は有意に増強される。この方法において、放射線は約20Gy〜約60Gyという典型的な用量で、若しくは好ましくは亜致死用量(20Gy以下)で送達され、温熱療法が開始される或いは完了した後のみ致死となる。放射線の用量レベルは、バイオプローブ組成物における放射性同位体の調節性取り込みによって調節されている。さらに前記放射線用量の調節は、「非標識」バイオプローブとの放射性標識バイオプローブの混合物を有するバイオプローブ懸濁液の使用を介して達成される。疾患の治療に現在使用されている、或いは将来開発されるあらゆる放射性同位体は、本明細書における使用に対して適切であり、標的温熱療法の治療率を増強する。適切な放射性同位体の例としては、これに限定されるものではないが、イオジン−131、コバルト−60、イリジウム−192、イットリウム−90、ストロンチウム−89、サマリウム−153、レニウム−186及びテクネチウム−99mである。
【0077】
潜在的な放射性同位体
特定の同位体は、特定の素粒子、すなわち中性子、プロトンなどに対する、及び特定の形態の電離放射線、すなわちx線に対する高吸収断面を有する不安定核(非放射性)を有する。これらの同位体の核が放射線或いは粒子を吸収する場合、その核は不安定となり、崩壊するにつれて放射する。この現象はすでに認識されており、癌の治療に使用されていた。最も有名な例としては、癌の治療に対するホウ素(ホウ素−10)中性子捕捉療法である。
【0078】
そのような治療は、同位体によって放射される放射線のレベルが主要に対する致死量を産生するのには不十分であるため、広く受け入れられなかった。しかしながら、バイオプローブの成分として、前記同位体の送達は、標的及び2つのエネルギー形態の相乗効果を最大限にする一連の温熱療法でのみ開始されたその放射線である。その結果として、前記放射線は温熱療法と組み合わせて使用した場合より高い細胞毒性となる。
【0079】
高い中性子吸収断面を有する他の同位体は、サマリウム−149、ガドリニウム−157及びガドリニウム−155などの多くのランタニドを含む。サマリウムは特に都合がよい、つまり磁性体であり、前記磁性ナノ粒子結晶構造へのその取り込みは前記ナノ粒子の磁性特性を増強する。
【0080】
化学療法剤
放射性同位体と同様に、化学療法剤を有するバイオプローブは、標的温熱療法と相乗効果的に組み合わせ、治療結果を増強する。本明細書における使用に適した化学療法剤の例としては、これに限定されるものではないが、ドキソルビシン、シスプラチンなどのプラチナ複合体を含む。
【0081】
画像化同位体
本明細書の使用に適した画像化同位体の様々な技術、特にMRI、PET、SPECT及び生体インピーダンスが存在する。
【0082】
フェライトの小さな常磁性或いは超常磁性粒子(酸化鉄Fe3O4或いはfe2O3)は、磁気共鳴映像法(MRI)における常磁性コントラスト媒体として使用され得る。これら薬剤は強いT1解法特性を示し、それらの周囲に対する感受性の違いによって、それらはさらに、コンストラクト媒体含有構造を暗くするためのT2緩和を増強する、強力に変動する磁界も産生する。300ナノメーター以下の非常に小さな粒子もさらに、長時間血管内に残る。前記薬剤も、SPIO's(「small particle iron oxides(小粒子酸化鉄)」或いは「superparamagnetic iron oxides(超常磁性酸化鉄)」)及びUSPIO's(「ultrasmall particle iron oxides(超小型酸化鉄)」或いは「ultrasmall superparamagnetic iron oxides(超小型超常磁性酸化鉄)」)として言及される。本発明の1実施形態において、標的温熱療法及びMRIは組み合わせられる。ガドリニウム標識アンチフィブリンナノ粒子などの不安定プラークを標的としたMRIコントラスト同位体は使用される。一度これらのナノ粒子がプラークによって取り込まれると、AMFはそのプラークを破壊するために使用される。
【0083】
陽電子放射型断層撮影法(PET)は、生きている患者の組織内の陽電子放射型放射性同位元素の濃度を測定するための技術である。幅広い範囲の化合物がPETで使用可能である。これらの陽電子放射型放射性核種は、短い半減期と高い放射性エネルギーを有している。PETで使用される一次陽電子放出型放射線核種は、炭素−11、窒素−13、酸素−15及びフッ素−18を含み、これらはそれぞれ20分、10分、2分及び110分の半減期を有する。これらの化合物は共通して、PETにおけるトレーサー化合物として知られている。
【0084】
単一光子放射型コンピュータ断層撮影法(SPECT)は、テクネチウム−99m及びタリウム−201などの放射線核種と呼ばれる放射性原子から単発で放射されたガンマ線の検出に関するものである。放射性医薬品は、それに付着した放射性核種を有するタンパク質或いは有機物質である。前記タンパク質及び有機分子は、人体内での使用或いは吸収特性に基づいて選択される。SPECTは、診断を助け、癌、脳卒中、肝臓疾患、肺疾患及び多くの他の身体的(機能的)異常を病期分類するために、日常的に使用されている。
【0085】
モリブデン−99、テクネチウム−99m、クロミウム−51、銅−64、ジスプロシウム−165、イッテルビウム−169、インジウム−111、イオジン−125、イオジン−131、イリジウム−192、鉄−59、リン−32、カリウム−42、ロジウム−186、レニウム−188、サマリウム−153、セレニウム−75、ナトリウム−24、ストロンチウム−89、キセノン−127、イットリウム−90或いはその他などの放射性免疫学画像化放射性核種は、特異的抗原標的に結合する抗体(標識化、トレース或いはタギングとしてしばしば言及される)へ結合する。本発明の1実施形態において、放射性免疫学画像化は、前記バイオプローブへ直接放射性核種を連結することによって標的温熱療法と組み合わされる。そのような配置において、前記バイオプローブの取り込み過程は直接的に画像化され得る。
【0086】
生体インピーダンスは、身体がどの程度電流を妨げるかを測定するものである。脂質は高い抵抗率であり、血液は低い抵抗率である。インピーダンスは、例えば2つの電極を用い小さな電流を適用し、別の電極対で結果生じた小さな電圧を測定することによって測定される。電圧がより低くなると、より低い組織インピーダンスは既知電流を与えるようになるであろう。組織は細胞と膜から成り;膜は薄いが高い抵抗性を有し、小さいコンデンサとして電気的に振る舞う。高周波数では、その結果は細胞膜の能力に非依存性となる。しかしながら低周波数では、前記膜は電流を妨げ、その結果は細胞外の液体に依存する。
【0087】
本発明の1実施形態において、1若しくはそれ以上のこれらの画像化技術は、標的療法投与の前、最中或いは後に前記バイオプローブの取り込みを画像化するために使用される。
【0088】
コーティング
コーティング120は、特にコーティング120がポリマー物質である場合、バイオプローブ100の熱特性を増強する。コーティング120はさらに、放射性或いは潜在的な放射性元素も有する。
【0089】
コーティング120に対して適切な物質は、合成及び生物学的ポリマー、コポリマー及びポリマー混合物、及び無機物質を含む。ポリマー物質は、アクリル酸、シロキサン、スチレン、酢酸、アルキレングリコール、アルキレン、酸化アルキレン、パリレン、乳酸及びグリコール酸のポリマーの様々な組み合わせを含む。更に適切なコーティング物質は、ヒドロゲルポリマー、ヒスチジン−コーティングポリマー、及びヒドロゲルポリマーとヒスチジン−コーティングポリマーとの組み合わせを含む。
【0090】
コーティング物質はさらに、多糖、ポリアミノ酸、タンパク質、脂質、グリセロール、及び脂肪酸などの生物学的物質の組み合わせも含む。本明細書において使用するのに適切な他の生物学的物質の例としては、ヘパリン、ヘパリン硫酸、コンドロイチン硫酸、キチン、キトサン、デキストラン、アルギン酸、デンプン、糖質、及びグリコサミノグリカンを含む。本明細書において有用なタンパク質の例としては、細胞外マトリックスタンパク質、プロテオグリカン、糖タンパク質、アルブミン、ペプチド及びゼラチンを含む。これらの物質はさらに、あらゆる適切な合成ポリマー物質と組み合わせでも使用される。
【0091】
無機コーティング物質は、金属、合金、及びセラミックの任意の組み合わせを含む。本明細書における使用に適したセラミック物質の例としては、ヒドロキシアパタイト、炭化ケイ素、カルボン酸、スルホン酸、リン酸、フェライト、ホスホン酸、及び周期表のIV群元素の酸化物を含む。これらの物質は、1若しくはそれ以上の生物学的或いは合成ポリマーも含む合成コーティングを形成する。磁性粒子110が生体適合性である磁性物質から形成される場合、前記粒子自体の表面は生態的合成コーティングとして機能する。
【0092】
前記コーティング物質はさらに、遺伝子導入(形質移入)として知られている過程である、細胞への前記バイオプローブ100の輸送を容易にするようにも働く。遺伝子導入因子として言及されるそのようなコーティング物質は、ベクター、プリオン、ポリアミノ酸、カチオン性リポソーム、両親媒性物質、及び非リポソーム性脂質、或いはそれらの任意の組み合わせを含む。適切なベクターは、プラスミド、ウイルス、ファージ、バイロン、ウイルスコートである。前記バイオプローブコーティングは、有機及び無機物質との遺伝子導入因子の任意の組み合わせの合成物であり、その特定の組み合わせは、疾患物質の特定タイプ、及び患者の身体内の特異的な位置に合わせるものである。
【0093】
マーカー
図2に説明したように、マーカー(抗原)160及び170の選択は、本発明の標的療法にとって重要である。そのことに限定されないが、マーカーの使用と選択は、癌免疫療法において最も一般的なことである。乳癌及びその転移に対して、特異的なマーカー或いはマーカー群は、例えば、MUC型ムチンファミリーのメンバー、上皮成長因子(EGFR)受容体、癌胎児抗原(CEA)、ヒト癌抗原、血管内皮増殖因子(VEGF)抗原、メラノーマ抗原(MAGE)遺伝子、ファミリー抗原、T/Tn抗原、ホルモン受容体、成長因子受容体、クラスタ解析/分化抗原群(cluster designation/differentiation;CD)抗原、腫瘍抑制遺伝子、細胞周期制御因子、癌原遺伝子、癌原遺伝子受容体、増殖マーカー、接着分子、細胞外マトリックスの分解に関するプロテインキナーゼ、悪性形質転換関連因子、アポトーシス関連因子、ヒト癌抗原、糖タンパク質抗原、DF3、4F2、MGFM抗原、乳癌抗原CA15−3、カルポニン、カテプシン、CD31抗原、増殖性細胞核抗原10(PC10)、及びpS2などの細胞表面マーカーから選択される。
【0094】
他の形態の癌及びその転移に対して、特異的マーカー或いはマーカー群は、例えば血管内皮増殖因子受容体(VEGFR)ファミリーのメンバー、癌胎児抗原(CEA)ファミリーのメンバー、抗イディオタイプmABの一種、ガングリオシド擬態の一種、クラスタ解析/分化抗原群抗原のメンバー、上皮増殖因子受容体(EGFR)ファミリーのメンバー、細胞性接着分子の一種、MUC−タイプムチンファミリーのメンバー、癌抗原(CA)のメンバー、マトリックスメタロプロテアーゼの一種、糖タンパク質抗原の一種、メラノーマ関連抗原(MAA)の一種、タンパク質分解酵素、カルモジュリン、腫瘍壊死因子(TNF)受容体ファミリーのメンバー、血管新生マーカーの一種、T細胞認識メラノーマ抗原(MART)、メラノーマ抗原コード化遺伝子(MAGE)のメンバー、前立腺特異抗原(PMSA)、小細胞肺癌抗原(SCLCA)、T/Tn抗原、ホルモン受容体、腫瘍抑制遺伝子抗原、細胞周期調節因子抗原、癌原遺伝子、癌原遺伝子受容体抗原、細胞増殖マーカー、細胞外マトリックスの分解に関連したプロテインキナーゼ、悪性形質転換関連因子、アポトーシス関連因子、ヒト癌抗原の一種などの細胞表面マーカーから選択されるものである。
【0095】
本発明の1実施形態において、バイオプローブは、ムチンファミリーのMUC−1受容体を標的とした1若しくはそれ以上のリガンド130を含む。別の実施形態において、バイオプローブは、HER−1、HER−2、HER−3、及びHER−4などのEGFRファミリーの少なくとも1つを標的にした1若しくはそれ以上のリガンド130を有する。MUC−1(ヒト上皮ムチン、CD277)は、高分子量であり、ほとんどの腺性及び上皮細胞系列によって発現されている膜貫通型ムチン糖タンパク質である。加えて、MUC−1は大きな細胞外ドメインを持っており、これは血流へ流される部分である。MUC−1は、その細胞外ドメインが細胞上の他の分子まで伸びて伸長した強固構造を形成するので、保護的な役割を担っている。MUC−1は、乳癌の80%を含む多くのヒト腺癌において高度に発現しており、悪い予後に関連している。ムチン(MUC−1及びMUC−2)発現は、腫瘍浸潤と関連している。MUC−1及びMUC−2発現は乳房の浸潤性腺癌と関連している。MUC−1はさらに多くの骨髄腫においても高レベルを示す。分化組織/細胞は異なるグリコフォームのMUC−1を産生する。悪性細胞におけるMUC−1の糖鎖付加は、正常細胞と比較してしばしば変化されている。MUC−1は、正常細胞でも見いだされるにも関わらず、本当に腫瘍特異的抗原と考えられており、腫瘍上のその異常な糖鎖付加は標的化の新しいエピトープを形成する。MUC−1の細胞外ドメインは血流へ流される。前記リガンド130は、細胞表面に発現した、流れず残留したMUC−1を標的とする。
【0096】
EGFRファミリーなどの成長因子受容体の過剰発現は、腫瘍を意味し、マクロファージ及び、腫瘍成長を導くことができるTNF(腫瘍壊死因子)などの細胞毒性因子の細胞毒性効果に対する細胞抵抗性が増加したことと関連する。HER−1/neu遺伝子によってコード化されたタンパク質は、170,000ダルトンタンパク質であり、HER−1と言及される。HER−2/neu遺伝子によってコード化されたタンパク質は、185,000ダルトンタンパク質であり、HER−2と言及される。両タンパク質は、細胞内ドメイン、2つのシステインリッチ繰り返しクラスタを含む膜貫通ドメイン、及び細胞内キナーゼドメインを有する。HER−2の細胞外ドメインは、血流へ流される。従って、リガンド130は、細胞の表面に発現した、流されず残留したHER−2を標的とする。
【0097】
卵巣癌及びその転移に対して、特異的マーカー或いはマーカー群は、例えば、ERBB2(HER−2)抗原及びCD64抗原の1つなどの細胞表面マーカーから選択される。卵巣癌及び/若しくは胃癌及びそれらの転移に対して、特異的マーカー或いはマーカー群は、例えば、多型上皮ムチン(PEM)などの細胞表面マーカーから選択される。卵巣癌及びその転移に対して、特異的なマーカー或いはマーカー群は、例えば、癌抗原125(CA125)或いはマトリックスメタロプロテアーゼ2(MMP−2)の一つなどの細胞表面マーカーから選択される。胃癌及びその転移に対して、特異的マーカー或いはマーカー群は、例えばCA19−9抗原及びCA242抗原の一つなどの細胞表面マーカーから選択される。
【0098】
非小細胞肺癌(NSCLC)、結腸直腸癌(CRC)及びそれらの転移に対して、特異的マーカー或いはマーカー群は、例えば、血管内皮増殖因子受容体(VEGFR)、抗原イディオタイプmAB、及び癌胎児抗原(CEA)擬態などの細胞表面マーカーから選択される。小細胞肺癌(SCLC)、悪性メラノーマ、及びそれらの転移の少なくとも1つに対して、特異的マーカー或いはマーカー群は、例えば、抗イディオタイプmAB或いはGD3ガングリオシド擬態などの細胞表面マーカーから選択される。メラノーマ癌及びその転移に対して、特異的マーカー或いはマーカー群は、例えば、メラノーマ関連抗原(MAA)などの細胞表面マーカーから選択される。小細胞肺癌及びその転移に対して、特異的マーカー或いはマーカー群は、例えば、小細胞肺癌抗原(SCLCA)などの細胞表面マーカーから選択される。
【0099】
結腸直腸癌(CRC)及び/若しくは局所的な進行性或いは転移性頭部及び/若しくは頸部癌に対して、特異的マーカー或いはマーカー群は、例えば、上皮成長因子受容体(EGFR)などの細胞表面マーカーから選択される。デューク(Duke's)結腸直腸癌(CRC)及びその転移に対して、特異的マーカー或いはマーカー群は、例えばEp−CAM抗原などの細胞表面マーカーから選択される。
【0100】
非ホジキンリンパ腫(NHL)及びその転移に対して、特異的マーカー或いはマーカー群は、例えばクラスタ解析/分化抗原群(CD)20抗原或いはCD22抗原などの細胞表面マーカーから選択される。B細胞慢性リンパ性白血病及び関連転移に対して、特異的マーカー或いはマーカー群は、例えば、CD52抗原などの細胞表面マーカーから選択される。急性骨髄性白血病及びその転移に対して、特異的マーカー或いはマーカー群は、例えば、CD33抗原などの細胞表面マーカーから選択される。
【0101】
前立腺癌及びその転移に対して、特異的マーカー或いはマーカー群は、例えば、前立腺膜特異的抗原(PMSA)など細胞表面マーカーから選択される。癌性髄膜炎及びその転移に対して、特異的マーカー或いはマーカー群は、例えば、血管内皮細増殖因子受容体(VEGFR)或いは例えばHMFGI(ヒト乳脂肪グロブリン)抗原などの上皮関連糖タンパク質の1つなどの細胞表面マーカーから選択される。
【0102】
肺癌、卵巣癌、結腸癌及びメラノーマ癌、及びそれらの転移に対して、特異的マーカー或いはマーカー群は、例えば、B7−H1タンパク質などの細胞表面マーカーから選択される。結腸癌、乳癌、肺癌、胃癌、子宮頸癌及び子宮癌、及びそれらの転移に対して、特異的マーカー或いはマーカー群は、例えば、TRAIL受容体−1タンパク質、タンパク質の腫瘍壊死因子受容体ファミリーのメンバーなどの細胞表面マーカーから選択される。卵巣癌、膵臓癌、非小細胞肺癌、乳癌、及び頭部及び頸部癌、及びそれらの転移に対して、特異的マーカー或いはマーカー群は、例えば、EGFR(上皮成長因子受容体)などの細胞表面マーカーから選択される。
【0103】
腫瘍血管供給の抗血管新生標的に対して、特異的マーカー或いはマーカー群は、例えば、インテグリンαvβ3、伸長血管の内皮細胞特異的な細胞表面マーカーなどの細胞表面マーカーから選択される。
【0104】
結腸癌及び膀胱癌及びそれらの転移の標的化に対して、特異的マーカー或いはマーカー群は、例えば、RAS、外部環境から核へとシグナルを伝達するシグナル分子などの細胞表面マーカーから選択される。RASの変異型は多くの癌に見いだされる。
【0105】
本発明の1実施形態において、リガンド130は、患者の免疫システムの疾患に関連した、予め決定された標的を標的化する。特定の標的150及び1若しくはそれ以上のリガンド130は、これに限定されるものではないが、ある種の免疫疾患に特異的である。リガンド130は、目的の細胞マーカー或いはマーカー群に親和性を有している。前記マーカー或いはマーカー群160/170は、それらが患者の免疫システムのT細胞或いはB細胞上の生存標的を表すようなものから選択される。リガンド130は、例えば、タンパク質、サイトカイン、ケモカイン、感染性生物、及びそれらと同等のものなどの患者の免疫システムの疾患に関連した標的に親和性を有している。
【0106】
患者の免疫システムの疾患に対して、特異的マーカー或いはマーカー群160/170は、細胞表面マーカーから選択される。標的細胞は、免疫システムのT或いはB細胞である。関節リウマチに対して、特異的マーカー或いはマーカー群は、例えば、CD52抗原の一つ、腫瘍壊死因子(TNF)及びCD25抗原などの細胞表面マーカーから選択される。関節リウマチ及び/若しくは血管炎に対して、特異的マーカー或いはマーカー群は、例えばCD4抗原などの細胞表面マーカーから選択される。血管炎に対して、特異的マーカー或いはマーカー群は、例えば、CD18抗原などの細胞表面マーカーから選択される。多発性硬化症に対して、特異的マーカー或いはマーカー群は、例えば、CD52抗原などの細胞表面マーカーから選択される。
【0107】
別の実施形態において、リガンド130は、病原体媒介性症状に関連した、予め決定された標的150を標的化する。特定の標的150及びリガンド130は、これに限定されるものではないが、あるタイプの病原体媒介性症状に特異的である。病原体は、例えば、細菌、ウイルス、微生物、真菌、及び寄生虫などのあらゆる疾患誘引因子として定義される。リガンド130は、病原体或いは病原体関連問題に親和性を有している。リガンド130は、病原体媒介性症状に関連した細胞マーカー或いはマーカー群に親和性を有している。前記マーカー或いはマーカー群は、それらが感染細胞上の生存標的を表すようなものから選択される。
【0108】
病原体媒介性症状に対して、バイオプローブを利用した治療法に対するリガンド130は、病原体自体を標的にするように選択される。細菌症状に対して、予め決定された標的は、例えば、大腸菌或いは炭疽菌の一つなどの細菌自体である。ウイルス症状に対して、予め決定された標的は、例えばサイトメガロウイルス(CMV)、エプスタイン−バーウイルス(EBV)、B型肝炎ウイルスなどの肝炎ウイルス、HIV、HIV−1或いはHIV−2などのヒト免疫不全ウイルス、ヘルペスウイルス6などのヘルペスウイルスの一つなどのウイルス自体である。寄生虫症状に対して、予め決定された標的は、例えば、クルーズトリパノソーマ、マンソン住血吸虫、日本住血吸虫、或いはブルセイトリパノソーマの一つなどの寄生虫自体である。真菌症状に対して、予め決定された標的は、例えば、コウジカビ、クリプトコッカスネオフォルマンス或いはリゾムコールなどの真菌自体である。
【0109】
病原体媒介性症状に対して、バイオプローブを利用した治療法に対するリガンド130は、細胞に感染した病原体の細胞マーカーを標的とするように選択される。HIVウイルスに対して、予め決定された標的は、HIV感染T細胞の表面に発現したCTLA4である。CTLA4は、HIVが放出される準備ができた時、感染細胞の外表面へ移動する。
【0110】
別の実施形態において、リガンド130は、望ましくない標的物質と関連した、予め決定された標的を標的化する。特定の標的150及びリガンド130は、これに限定されるものではないが、あるタイプの望ましくない標的に特異的である。望ましくない標的とは、望ましくない物質である標的である。望ましくない物質は、疾患或いは望ましくない症状に関連した物質であるが、これは正常状態にも存在する。例えば、前記望ましくない物質は、濃度の上昇を示す、若しくは疾患或いは望ましくない状態において変化されるものである。前記リガンド130は、前記望ましくない標的に対して、或いは前記望ましくない標的に関連した生物分子経路に対して親和性を有する。前記リガンド130は、前記望ましくない標的物質に関連した細胞マーカー或いはマーカー群に親和性を有する。
【0111】
望ましくない標的に対して、予め決定された標的150の選択は、本発明の治療方法において重要である。リガンド130は、疾患或いは望ましくない状態に関連した生物学的問題を標的化するように選択される。動脈硬化に対して、予め決定された標的は例えば、低密度リポタンパク質上のアポリポタンパク質Bである。望ましくない物質は、肥満に関連した脂肪組織或いはセルライト、或いは肥満に対する前駆体である。肥満に対する予め決定されたマーカー或いはマーカー群は、例えば、胃抑制ポリペプチド受容体及びCD36抗原の一つなどの細胞表面マーカーから選択される。別の望ましくない予め決定された標的は、凝集血液である。
【0112】
別の実施形態において、リガンド130は、患者への臓器移植に対する反応に関連した予め決定された標的を標的化するものである。特定の標的150及びリガンド130は、これに限定されるものではないが、ある種の臓器移植に特異的である。リガンド100は、臓器移植に対する反応に関連した生物分子に親和性を有する。前記リガンド130は、臓器移植に対する反応に関連した細胞マーカー或いはマーカー群に親和性を有する。前記マーカー或いはマーカー群は、それらが患者の免疫システムのT細胞或いはB細胞上の生存標的を表すようなものが選択される。
【0113】
臓器移植に対する反応に対して、リガンド130は、移植に対する免疫反応を標的化するように選択される。移植された臓器は、移植前或いは後に処理される。腎臓移植に対して、予め決定されたマーカー或いはマーカー群は、例えば、T細胞受容体(CD3)抗原、或いはCD18抗原などの細胞表面マーカーから選択される。腎臓及び骨髄移植に対して、予め決定されたマーカー或いはマーカー群は、例えば、CD52抗原などの細胞表面マーカーから選択される。肝臓及び骨髄移植に対して、予め決定されたマーカー或いはマーカー群は、例えば、CD154抗原及びCD8抗原の一つなどの細胞表面マーカーから選択される。移植耐性に対して、予め決定されたマーカー或いはマーカー群は、例えばCD4などの細胞表面マーカーから選択される。骨髄に対して、予め決定されたマーカー或いはマーカー群は、例えば、移植片対宿主疾患を避けるために移植前に骨髄からの十分な欠乏に対するT細胞のCD52などの細胞表面マーカーから選択される。異種移植或いは異種移植片に対して、予め決定されたマーカー或いはマーカー群は、例えばガラクトースなどである。ガラクトースは、ブタ臓器上には存在することが知られているが、ヒトでは存在しない。
【0114】
別の実施形態において、リガンド130は、患者における毒素に関連した予め決定された標的を標的化する。毒素は、これに限定されるものではないが、細菌毒素、植物毒素、昆虫毒素、動物毒素、及び人工毒素を含む、生物によって産生されたあらゆる毒として定義される。特定の標的150及びリガンド130は、これに限定されるものではないが、ある種の毒素に特異的である。前記リガンド130は、前記毒素に対する反応に関連した生物分子に親和性を有する。前記リガンド130は、前記毒性に対する反応に関連した細胞マーカー或いはマーカー群に親和性を有する。
【0115】
患者における毒素に対して、リガンド130は前記毒素を標的化するように選択される。細菌毒素表的は、例えば、コレラ毒素、ジフテリア毒素、及びボツリヌス菌毒素の一つである。昆虫毒素は、例えばハチ毒である。動物毒素は、例えばガラガラヘビ(Crotalus durissus terrificus)毒などの例えばヘビ毒である。
【0116】
別の実施形態において、リガンド130は、ホルモン関連疾患に関連した予め決定された標的を標的化する。特定の標的150及びリガンド130は、これに限定されるものではないが、特定のホルモン疾患に特異的である。前記リガンド130は、ホルモン或いはホルモン経路に関連した生物分子に親和性を有する。前記リガンド130は、ホルモン疾患に関連した細胞マーカー或いはマーカー群に親和性を有する。
【0117】
ホルモン関連疾患に対して、リガンド130は、細胞マーカー或いはマーカー群を標的にするように選択される。エストロゲン関連疾患或いは症状に対して、予め決定された標的は、例えばエストロゲン、若しくは例えばエストロゲン受容体などの細胞表面マーカー或いはマーカー群である。ヒト成長ホルモン病に対して、前記予め決定された標的は、例えばヒト成長ホルモンである。
【0118】
別の実施形態において、リガンド130は、非癌性疾患物質と関連した予め決定された標的を標的化する。特定の標的150及びリガンド130は、これに限定されるものではないが、特定の非癌性疾患物質に特異的である。前記リガンド130は、非癌性疾患物質と関連した生物分子に親和性を有する。前記リガンド130は、非癌性疾患物質と関連した細胞マーカー或いはマーカー群に親和性を有する。
【0119】
非癌性疾患物質に対して、前記リガンド130は、例えば、非癌性疾患沈着物及び前駆体沈着物の一つなどの予め決定された標的を標的化するように選択される。アルツハイマー病に対して、予め決定された標的は、例えばアミロイドBタンパク質及びその沈殿物、惜しくはアポリポタンパク質及びその沈殿物である。
【0120】
別の実施形態において、リガンド130は、タンパク質性病原体を標的化する。特定の標的150及びリガンド130は、これに限定されるものではないが、特定のタンパク質性病原体に対して特異的である。前記リガンド130は、タンパク質性病原体、或いはタンパク質性病原体に関連した生物分子に親和性を有する。前記リガンド130は、タンパク質性病原体に関連した細胞マーカー或いはマーカー群に親和性を有する。プリオン病(感染性海綿状脳症としても知られている)に対して、予め決定された標的は、例えばプリオンタンパク質3F4である。
【0121】
リガンド
本発明の1実施形態において、これに限定されるものではないが、抗体などの少なくとも1標的リガンドは、図1に説明されたように、バイオプローブ100の外側部分に配置される。標的リガンド130は、標的150を探し出し付着するものが選択される。
【0122】
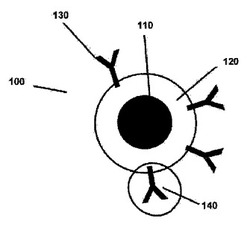
図2は、コーティング120を有するサセプタ110を有するバイオプローブ100が1若しくはそれ以上の標的リガンド130によって標的(細胞など)150へ付着している実施形態を示したものである。リガンド130はさらに、放射性元素或いは潜在的な放射性元素も有する。
【0123】
標的150を有する細胞は、いくつかのタイプのマーカー160及び170を発現している。バイオプローブ100の特異性は、標的150を有する細胞上で、多くの他のマーカー或いは分子160を超えた標的マーカー160へのその付着によって表される。1若しくはそれ以上のバイオプローブ100は、リガンド130を介して前記細胞へ付着する。リガンド130は適応され、バイオプローブ100は、バイオプローブ100が細胞150上に外面的に残存するように設計される。一度細胞150へ結合したら、前記磁性ナノ粒子110は、吸収したエネルギーに反応して加熱する。例えば、前記磁性ナノ粒子110は、AMFに反応してヒステレシス損失を通じて加熱する。その熱は、例えば対流、伝導、放射線或いはこれら熱移動メカニズムの任意の組み合わせを介して、前記細胞150へとコーティング120或いは介在領域を通り抜けるものである。加熱された細胞150は、好ましくは回復不能な障害を引き起こすやり方で障害を受ける。バイオプローブ100が標的150を有する細胞内に取り込まれた場合、バイオプローブ100は、対流、伝導、放射線或いはこれら熱移動メカニズムの任意の組み合わせを介して、内部的に細胞150を加熱する。十分量のエネルギーがバイオプローブ100によって細胞150へ移動された場合、細胞150はネクローシス、アポトーシス、或いは他のメカニズムを介して死ぬ。
【0124】
本明細書での使用に適したリガンドは、これに限定されるものではないが、タンパク質、ペプチド、抗体、抗体断片、糖類、糖鎖、グリカン、サイトカイン、ケモカイン、ヌクレオチド、レクチン、脂質、受容体、ステロイド、神経伝達物質、クラスタ解析/分化抗原群(CD)マーカー、及びインプリントポリマー及びそれらと同等物を含む。好ましいタンパク質リガンドは、例えば細胞表面タンパク質、膜タンパク質、プロテオグリカン、糖タンパク質、ペプチド及びそれらと同等物を含む。好ましいヌクレオチドリガンドは、例えば、完全ヌクレオチド、相補的ヌクレオチド、及びヌクレオチド断片を含む。好ましいリガンドは、例えば、リン脂質、糖脂質及びそれらと同等物を含む。
【0125】
本発明の1実施形態において、リガンド130は、前記磁性粒子110或いは前記コーティング120と共有結合する或いは物理的な相互作用によって結合するものである。前記リガンド130は、前記磁性粒子110の非コーティング部分と共有結合或いは物理的な相互作用によって直接結合される。前記リガンド130は、前記磁性粒子110の非コーティング部分と共有結合或いは物理的な相互作用によって直接結合され、前記コーティング120によって部分的にカバーされる。前記リガンド130は、前記バイオプローブ100のコーティング部分と共有結合或いは物理的な相互作用によって結合される。前記リガンド130は、バイオプローブ100のコーティング部分へ介入される。
【0126】
共有結合は、リンカー分子で達成される。リンク反応において使用される機能基の例としては、アミン、スルフヒドリル、糖鎖、カルボキシル、ヒドロキシル、及びそれらと同等物を含む。リンク因子は、例えば、カルボジイミド、スルフォ−NHSエステルリンカー及びそれらと同等物などのホモニ機能性或いはヘテロニ機能性クロスリンク因子である。前記リンク因子はさらに、グルタルアルデヒドなどのアルデヒドクロスリンク因子でもある。前記リンク因子は、リガンド100が、特に前記リガンド150の活性領域が標的化に利用可能となるような好ましい方向性で、前記磁性粒子110或いは前記コーティング120へ連結するように選択される。物理的相互作用は、例えば、吸収、吸着或いはインターカレーション(介入)などの非共有結合性手段によって前記リンク分子及び前記リガンド100が前記磁性粒子110或いは前記コーティング120へ直接結合することを必要としない。
【0127】
利用される関連徴候に沿って、バイオプローブシステムのいくつかの例示的実施形態を表1に表した。
【0128】
【表1】







【0129】
本発明の方法は、これに限定されるものではないが、骨髄癌、肺癌、血管癌、神経癌、結腸癌、卵巣癌、乳癌及び前立腺癌などのあらゆるタイプの癌、AIDS及び自己免疫症状などの免疫システムの疾患、及びHIV、マラリア及び結核などの病原体媒介性疾患、及び有害血管新生、アミロイドーシス、再狭窄、血管症状、肥満、毒素及び他の異常細胞或いは組織増殖などの望ましくない問題を含む、様々な徴候を治療するために使用される。本明細書に記載されたバイオプローブシステムは、表1に記載した関連徴候以外の他の徴候を治療するために使用される。
【0130】
本発明において使用される標的、マーカー及びリガンドは、これに限定されるものではないが、上述したもの、表1に記載されたもの、さらには米国特許第10/176,959号及び10/200,082号である関連特許出願に開示されたもの(これらはこの参照によって本明細書に組み込まれる)を含む。
【0131】
バイオプローブの投与
治療される望ましい領域へ前記バイオプローブ100を投与する方法及び用量は、これに限定されるものではないが、疾患物質のタイプと位置に依存する。前記バイオプローブ100のサイズ範囲は、滅菌のための精密濾過法を考慮に入れる。投与方法は、例えば、洗浄、スポンジでのすすぎとしての洗浄液、或いは周術期投与技術としての他の外科的布である。投与の他の方法は、血管内注射、静脈内注射、腹腔内注射、皮下注射、及び筋肉内注射を含む。前記バイオプローブ100は、例えば、水、生理食塩水、リンガー液、ブドウ糖、アルブミン溶液及び油などの溶媒における注射可能な形態(懸濁液、乳濁液)で処方される。前記バイオプローブ100はさらに、軟膏或いはローションを介した局所的適用を通じて、パッチを通じて経皮的に、ピル或いはカプセルとして経口的に消化される或いは液体に懸濁される、若しくは坐薬形態において直腸性に挿入することによっても患者へ投与される。バイオプローブ100はさらに、口或いは鼻を介した吸引に適したエアロゾル或いはプレエアロゾル処方で懸濁される。一度患者へ投与されると、標的部位への前記バイオプローブ100の運搬は、前記バイオプローブ100の磁性特性に起因する、適用静的磁場によって補助される。補助運搬は、標的細胞の位置に依存する。前記バイオプローブはさらに、他の方法を利用して患者へ運搬される。例えば、前記バイオプローブ100は、患者に経口的に投与される、或いは直腸性に投与される。
【0132】
エネルギー源
【表2】

【0133】
放射線療法との組み合わせでの標的温熱療法
放射線治療としても言及される放射線療法は、電離放射線を利用した癌及び他の疾患の治療方法である。電離放射線は、それらの遺伝子物質を損傷することによって、治療される領域(「標的組織」)において細胞を障害或いは破壊し、これらの細胞が増殖を続けられないようにするエネルギーを貯蔵している。放射線は癌細胞及び正常細胞両者を損傷するにも関わらず、後者は細胞自身及び機能を適切に修復することができる。放射線療法は、皮膚、舌、咽頭、脳、乳房或いは子宮頸部の癌などの局在化固形腫瘍を治療するために使用される。これはさらに、白血病及びリンパ腫(それぞれ造血細胞及びリンパシステムの癌)を治療するためにも使用され得る。本発明の1実施形態において、放射線療法或いは放射線治療は、本明細書で開示された標的温熱療法と組み合わせで使用される。放射線療法は、標的治療投与の前に少なくとも1回、最中に少なくとも部分的に、或いは後に少なくとも1回、若しくはそれらの組み合わせで適用される。
【0134】
一般的に使用される放射線治療の1タイプは、x線或いはガンマ線に関連する。X線は、癌を治療するために使用される光子放射線の第一形態であった。それらが所有するエネルギー量に依存して、光線は身体の表面或いは深部の癌細胞を破壊するために使用され得る。X線ビームのエネルギーが高くなるにつれて、前記標的組織へのx線の透過は深くなる。直線加速器及びベータートロンは、益々大きなエネルギーのx線を産生する機械である。放射線(x線など)の焦点を癌部位へ合わせるための機械の使用は、外部ビーム放射線療法として言及される。これらのビームは外界から遮断され、特別な遮断は確定した身体領域へこれらのビームを「焦点化」するために使用される。本発明の1実施形態において、外部ビーム放射線療法は、本明細書に開示された標的温熱療法との組み合わせで使用される。標的温熱療法及び放射線療法両者が同時に使用された場合、AMFシステムは前記ビームが入るための分離開口部を有する。或いは、前記ビームは患者の開口部(患者ガントリー)を介して直接入る。術中放射線治療は、大量の外部放射線を手術中に腫瘍及び周辺組織へ直接向ける技術である。
【0135】
ガンマ線は特定の元素(ラジウム、ウラニウム、及びコバルト(60)など)として自然発生的に産生され、それらが分解或いは崩壊する時に放射線を放出する。各元素は、特定の割合で破壊し、ガンマ線及び他の粒子の形態でエネルギーを発する。X線及びガンマ線は一般的に癌細胞に対して同じ効果を有する。
【0136】
別の試験中のアプローチは、粒子線放射線療法である。このタイプの治療は、動きの速い素粒子を使用して局在化癌を治療する。粒子加速器は、この手順に必要な粒子を産生し加速させるために使用される。いくつかの粒子(中性子、パイ中間子及び重イオン)は、組織を通過する経路に沿ってx線或いはガンマ線より大きなエネルギーを貯蔵するため、それらが接触した細胞へより大きな損傷を与える。このタイプの放射線はしばしば、高線エネルギー付与(高LET)放射線として言及される。本発明の1実施形態において、高LET治療は本明細書で開示された標的温熱療法との組み合わせで使用される。
【0137】
癌細胞へ放射線を運搬するための別の技術は、腫瘍或いは体腔へ直接放射線移植片を置くことである。これは、内部放射線療法として言及される(密封小線源治療、間質性照射及び腔内照射は内部放射線療法の一種である)。この治療の間、放射線用量は小さい領域に集中させ、その手順は患者を数日入院させる必要がある。本発明の1実施形態において、内部放射線療法は、本明細書で開示された標的温熱療法との組み合わせで使用される。前記移植片は、渦電流或いはヒステレシス加熱によって標的療法投与の間加熱する物質を有している、若しくはプラスチック、セラミック、ガラス、或いは移植ヒト組織などのAMF照射下でも加熱しない物質を有している。
【0138】
本発明の1実施形態において、放射線標識抗体は、標的温熱療法との組み合わせで癌部位へ直接放射線量を運搬する(放射免疫療法)。図1に説明したように、少なくとも1つの放射性同位体140はバイオプローブ100へ付着させる。そのようなバイオプローブは二重療法バイオプローブとなり得る。一度体内へ注射されたら、前記抗体は活動的に癌細胞を探し出し、放射線の細胞殺傷(細胞毒性)作用によって癌細胞を破壊する。
【0139】
本明細書で使用するのに適した放射性同位体の例としては:
モリブデン−99:テクネチウム−99mを産生するために発生器において「親」として使用され、核医学において最も広範囲に使用される同位体である、
テクネチウム−99m:特に骨格及び心筋を画像化するために使用され、さらには脳、甲状腺、肺(灌流及び換気)、肝臓、脾臓、腎臓、胆嚢、骨髄、唾液腺及び涙腺、心臓血液プール、感染及び多くの専門化医学研究を画像化するために使用される、
クロム−51:赤血球を標識化し、胃腸タンパク質損失を定量化するために使用される、
コバルト−60:外部ビーム放射線療法に使用される、
銅−64:ウィルソン病及びメンケス病などの銅代謝に影響を及ぼす遺伝的疾患を研究するために使用される、
ジスプロシウム−165:関節炎の滑膜切除術治療に対する凝集水酸化物として使用される、
イッテルビウム−169:脳における脳脊髄研究に使用される、
ヨウ素−125:癌密封小線源治療(前立腺及び脳)において使用され、さらには腎臓濾過速度の診断評価のために、及び足の深部静脈血栓症を診断するために使用される。さらに、少量のホルモンの存在を示すための放射免疫アッセイにおいて広く使用される、
ヨウ素−131:甲状腺癌を治療する場合、及びその甲状腺を画像化する場合に広く使用され;さらに異常肝臓機能、腎臓血流及び尿路障害の診断にも使用される、
イリジウム−192:内部放射線療法源として使用するためのワイヤー形態で供給される、
鉄−59:脾臓における鉄代謝を研究するために使用される、
リン−32:真性多血症(過剰な赤血球)の治療において使用される。これはベータ放射体である、
カリウム−42:冠血流における交換可能なカリウムの決定に対して使用される、
レニウム−188(タングステン−188由来):血管形成術バルーンからのベータ照射冠動脈に対して使用される、
サマリウム−153:骨に留まる二次癌の疼痛を軽減するのに非常に効果的である。これはQuadramet(商標)として商業的に利用可能である。さらに、前立腺癌及び乳癌にも非常に効果的である。これはベータ放射体である、
セレニウム−75:消化酵素の産生を研究するためにセレノメチオニンの形態で使用される、
ナトリウム−24:体内の電解質の研究に使用される、
ストロンチウム−89:前立腺癌の疼痛を軽減するのに非常に効果的である。ベータ放射体である、
キセノン−133、キセノン−127:肺性(肺)換気研究に使用される、
イットリウム−90:癌治療に対して、及び大関節における関節炎の治療に対するケイ素コロイドとして使用される。
【0140】
標的温熱療法との組み合わせにおける放射線療法はさらに、単独で、或いは化学療法、手術或いはそれら両者との組み合わせでも使用される。
【0141】
本発明において使用するエネルギー源は、適切な周波数でAMFを産生できる、或いは前記バイオプローブに対して適切な周波数でマイクロ波を産生し、そのエネルギーを加熱に変換できるあらゆる機械を含む。本発明の1実施形態において、エネルギーは、前記バイオプローブへ運搬され、標的細胞(群)及び前記標的細胞(群)の周辺の細胞或いは組織へ熱を伝達する。別の実施形態において、付加的なエネルギー源は、バイオプローブを電離放射線(中性子、アルファ、ベータ、ガンマなど)の源に変換するためにAMF或いはマイクロ波の組み合わせで使用される。図3は、対象の身体或いは身体部分へエネルギーを伝達するエネルギー源を図式的に説明したものである。本明細書で有用ないくつかの例示的なエネルギー形態及びエネルギー源は、表2に記載されている。例えばAMF或いはAMFを有する組み合わせなどの異なる形態のエネルギーは、表2に記載されたもののような様々なメカニズムを用いて作られる。その表はさらに、異なるエネルギー形態及び治療メカニズムに対して妥当である、以下の記載における対応するセクションも記載している。
【0142】
一般的に、図3に説明されたように、操作者270は、例えばケーブル220を介してエネルギー源210へエネルギーを運搬する、例えば制御装置260を介してエネルギー発生装置250を調節する。エネルギー源210は、エネルギーをバイオプローブのサセプタへ伝達し、標的細胞、及び対象230における前記バイオプローブ周辺の細胞或いは組織を加熱する或いは影響を及ぼす。
【0143】
本明細書に記載されたAMFエネルギー源はさらに、例えば、米国特許第10/176,950号及び第10/200,082号である特許出願において開示されたバイオプローブなどの、他のタイプのバイオプローブを加熱するためにも使用されるということは当然のことであろう。さらに、米国特許第10/176,950号及び第10/200,082号である特許出願において開示された前記エネルギー源はさらに本発明のバイオプローブを加熱するためにも使用されるということは当然のことであろう。
【0144】
交流磁場(AMF)加熱
本発明のいくつかの実施形態において、AMFエネルギーはバイオプローブと共に使用され、前記バイオプローブの磁性ナノ粒子においてヒステレシス損失メカニズムを通じて治療加熱を産生する。
【0145】
本発明の1実施形態において、図4に説明されたように、治療システム300は、AMF発生器を有しており、これは例えばキャビネット370内に設置されており、磁気回路330によって対象310内の特異的位置へ導かれるAMFを産生するように設計されている。対象310は、X−Y水平方向及び垂直方向軸に位置付けられたベッド340上に置かれている。位置付けされたベッド340は、ベッドコントローラー350を介して水平及び垂直に位置付けされ得る。AMF発生器は磁気回路330においてAMFを産生し、これは、空隙及び対象310の望ましい治療領域を通過して1磁極面320で磁気回路330から出て、反対側の磁極面320を通じて磁気回路330へ再び入り、回路を完成させるものである。操作者或いは医学技術者は好ましくはコントロールパネル360を介してAMF特徴及びベッド位置を調節しモニタリングする。AMFがRF発生器によって発生された場合、そのAMFの周波数は好ましくは約80kHz〜約800kHzの範囲である。
【0146】
他のアプローチはAMFを発生させるために使用され、集中及び/若しくは均一場を提供する。1実施形態において、磁気ソレノイドコイル410は、ヒト肢或いは小動物など、直径に対する長さの比が大きい組織においてバイオプローブを加熱するのに特に有用である。これは図5に説明されており、ここでは磁気ソレノイドコイル410の横断面を示している。前記コイル410は、輪状で低磁気抵抗磁気物質のドーナッツ型リング420を有しており、これは例えば約150kHzの望ましい周波数で作動する磁気コアに対して特異的に編成される。そのような低磁気抵抗磁気物質の1例としては、Fluxtrol(商標)(Fluxtrol Manufacturing Inc.,Auburn Hills,ミシガン州、米国から商業的に利用可能である)である。
【0147】
低磁気抵抗磁気物質の長さで作られた磁束集束バー400は、ソレノイドコイル410の外径の円周の約25%覆うように位置付けされ、前記リング420からソレノイドコイルの反対端まで伸びている。前記磁束集束バー400は、前記リング420と同じ物質から作られる、或いは異なる物質から作られる。例えば、前記バー400は、Ferrotron(商標)(Fluxtrol Manufacturing Inc.から商業的に利用可能である)から作られる。
【0148】
前記リング420及び集束バー400は、ヒト或いは動物の身体、若しくは身体部分の縮小した横断面を磁場に曝すパターンにおいて磁束430へ向けられている。渦電流加熱は、前記磁束430において曝露組織の横断面の平方に比例するため、曝露断片のサイズを減少することは都合が良い。このアプローチは、減少した渦電流加熱の対象への適用に対して、より高い磁場強度を可能にする。加えて、環状ドーナッツ型リング420及び集束バー400は、ソレノイドコイル400の著しく外側に磁場強度を生じさせる。磁気ソレノイドコイル410は、頭部及び重要な臓器などの対象の非標的部分を保護しながら、AMFを集束させる。
【0149】
本明細書で使用する磁気サセプタは一般的に、エネルギー源によって供給されたAMFエネルギー、及びAMFエネルギーに曝された場合の加熱に感受性を有しており;アーク生体適合性;リガンドが化学的に或いは物理的に付着できる機能基を有する(若しくは有するように修飾され得る)表面を持っている。本発明の1実施形態において、磁気ナノ粒子コアを有するバイオプローブは、生体適合性コーティング物質によって取り囲まれている。コアコーティング物質にはたくさんの可能な組み合わせが存在する。例えば、コーティング物質としての金は、生体適合性でありながら、前記コア物質における酸化などの化学変化を阻止する保護性コーティングを形成するので、特に有用である。さらに、金はAMF加熱に関連した渦電流加熱を増強するための優れた伝導体として働く。
【0150】
保護性コーティングを必要とする磁気サセプタ電流加熱のタイプとしては、鉄、コバルト、他の磁性金属、及びそれらの不安定酸化物を含む。後者の例としては、磁鉄鉱Fe3O4であり、これは更なる酸化を受け磁赤鉄鉱(γ−Fe2O3)を形成し、最終的には/或いは赤鉄鉱(α−Fe2O3)を形成するものである。鉄及びコバルトは例えば、酸化などの化学反応に感受性を有しており、酸化によって著しく変化する磁気特性を有している。保護性コーティングの使用は、前記コア物質がin vivoでヒト及び動物に対して毒性リスクを有しているような実施形態において特に好ましい。従って、金コーティング物質の使用は、コア物質を化学攻撃から保護するために、及び対象をコア物質の毒性効果から保護するために特に好ましい。
【0151】
本発明の1実施形態において、前記金コーティングは、金表面と適切なリガンドとの間に化学結合が形成されるような、チオール化学を介して化学的に修飾される。例えば、有機チオール部位は、前記金へ結合され、その後、少なくとも1つのシラン、カルボキシル、アミン、或いはヒドロキシル基、若しくはそれらの組み合わせを用いて前記有機チオール部位へ前記リガンドが連結する。前記コーティング物質の表面を修飾するための他の化学方法も利用される。
【0152】
別の実施形態において、窒素をドープしたMnクラスタは、磁気サセプタとして使用される。MnN及びMnxNy(x及びyは0でない数字である)などの、これら窒素をドープしたMnクラスタは、強磁性体であり、大きな磁気モーメントを有している。密度汎関数理論に基づいた計算は、小さなMnクラスタの安定性及び磁気特性が窒素の存在下で根本的に変化され得るということを示している。それらの結合エネルギーが実質的に増強されるだけでなく、Mn部位での磁気モーメント間の連結がそのサイズ或いは形に関係なく強磁性体を維持している。
【0153】
別の実施形態において、Nd1−xCaxFeO3は磁気サセプタとして使用される。弱い強磁性の自然発生的磁化は、Ca含量が増加するにつれて、或いは粒子サイズが増加するにつれて減少する。
【0154】
例えば、Co36C64、Bi3Fe5O12、BaFe12O19、NiFe、CoNiFe、Co−Fe3O4、及びFePt−Agの超常磁性粒子の凝集(ここにおいて前記凝集の集合状態は磁気ブロッキングを誘導する)などの他の物質もさらに、本発明のサセプタとして使用される。
【0155】
マイクロ波共振加熱
原子、分子及び結晶は、エネルギー吸収が効率的に達成される共振振動数を有していることはよく知られている。一般的に、共振加熱は、標的物質が比較的低い電源から大量のエネルギーを吸収するため、優れた利点を提供する。従って、身体組織を含む非標的物質(前記標的物質とは共振周波数が異なる)は、同程度では加熱されない。従って、物質は電磁気エネルギースペクトルにおける特定の共振周波数を利用するように選択される。サセプタ物質は、前記物質の内部化学結合が特定の周波数で共振するようなものが選択される。
【0156】
共振加熱はさらに、原子、分子或いは肉眼的長さスケールでの磁気、電気或いは電気双極子構造を有する物質とのマイクロ波エネルギーの相互作用を利用することによって達成され得る。上述された加熱の直接的なモードに加えて、共振加熱は間接的に使用される。本発明の1実施形態において、バイオプローブとして使用する物質は、それらが付着された組織の共振周波数におけるシフトを誘導するであろう、磁気或いは電気特性を有するようなものが選択される。従って、前記バイオプローブに非常に近接した組織の分子は、適切な周波数に変えた適用エネルギー場において好ましく加熱されるであろう。
【0157】
前記エネルギーは、標的細胞、標的組織、全身、体外で(対象の身体の外側で)、或いはそれらの任意の組み合わせで適用され得る。
【0158】
体外治療
本発明の1実施形態において、対象は体外治療を介して治療される。前記バイオプローブは、対象から物質を除去し、前記物質をエネルギー源に曝し、前記物質を体に戻すことによって疾患物質を溶解し、変性させ、損傷するために使用される。前記バイオプローブは、対象の身体或いは身体部分へと導入され、次に抽出された前記物質に沿って前記対象から除去される。前記バイオプローブは、治療後に抽出された物質とは分離される。別の実施形態において、前記バイオプローブは、抽出された物質が対象の身体或いは身体部分の外側にある間に、抽出された物質へ導入される。例えば、抽出された物質が対象の血液である場合、前記バイオプローブは、エネルギー源に曝される前に血管循環システムへ、或いは体外の血液循環へ導入される。
【0159】
最初に血清或いは血漿へ運ばれる前記バイオプローブ/標的複合体が標的である実施形態において、前記血清或いは血漿は他の血液成分からは体外的に分離され、前記標的を破壊する或いは不活性化するようにエネルギー源へ曝され、対象の身体へ血液を戻す前に他の血液成分と再度組み合わされる。前記バイオプローブは、血管循環システム、体外の血液循環、或いは分離後の血清或いは血漿へと導入される。
【0160】
別の実施形態において、前記バイオプローブは、体外の血液循環若しくは血清或いは血漿流が通過する血管或いはカラムに含まれている。前記血管或いはカラムは、前記血液を対象の身体へ戻す前に、前記標的細胞或いは抗原を破壊或いは不活性化するようにエネルギー源へ曝される。
【0161】
体外的に前記バイオプローブへエネルギーを供給する利点は、より高い温度で加熱する及び/若しくは周辺身体組織に対する加熱及び損傷を最小限にする一方、有効性をより素早く増強するように加熱する能力、及び前記エネルギー源からの前記エネルギーへの身体の曝露を軽減する能力を含む。前記バイオプローブが対象の体外の血液循環、身体から抽出された前記血清或いは血漿へ導入される実施形態において、バイオプローブは身体へ直接導入される必要はなく、より高い濃度のバイオプローブは標的に導入され得る。さらに、体外的に治療される前記対象の一部は、治療効果が軽減することなくエネルギーを前記バイオプローブへ提供する一方で、多くの適用可能な方法を用いて外部的に冷却される。加えて、冷却はエネルギーの投与前、及び/若しくは後に行われる。
【0162】
処理されたバイオプローブ及び関連標的は対象の身体へ戻す必要はない。例えば、前記バイオプローブ及び関連標的が対象から抽出された血液に含まれている場合、前記処理されたバイオプローブ及び関連標的は、対象の身体へ血液を戻す前に血液から分離されている。前記バイオプローブが磁気成分を含んでいる実施形態において、前記バイオプローブ及び関連標的を含む体液は、前記バイオプローブ及び関連標的を抽出された身体物質から分離するために、磁場勾配を通過させる。そうすることで、対象の身体へ戻されたサセプタ及び治療された疾患物質の量は減少する。
【0163】
体外治療の別の実施形態において、治癒のために選択された組織は、例えば開腹手術手順の間に、対象の身体から完全に或いは部分的に除去される。前記組織は、身体に連結したまま残る、或いは治療後解剖し再接着され得る。別の実施形態において、前記組織は1ドナー対象の身体或いは身体部分から除去され、治療後レシピエント対象へ移植される。
【0164】
本発明の上記した記載はヒト対象の観点から示されているが、本発明は哺乳類、死体及びそれらと同等物などの他の対象への適用可能であるということは当然である。
【0165】
上述したように、本発明は疾患物質を治療するための温熱療法組成物、及びそのような組成物を利用した標的療法に適用可能である。本発明は、上述した特定の実施形態に限定されると考えられるものではなく、添付された請求項においてかなり正確に明記されたような本発明の全観点をカバーすると理解されるべきである。様々な修飾物、同等な手順、更には本発明が適用可能な多数の構造は、本発明が本明細書のレビューを受ける本分野の当業者には容易に明らかである。請求項はそのような修飾物及び装置をカバーすることを意図している。
【図面の簡単な説明】
【0166】
【図1】図1は、本発明の実施形態に従った、バイオプローブ配置を図式的に説明したものである。
【図2】図2は、本発明の実施形態に従った、疾患細胞表面へ結合した標的特異的バイオプローブを図式的に説明したものである。
【図3】図3は、本発明の実施形態に従った、治療システムを図式的に説明したものである。
【図4】図4は、本発明の実施形態に従った、治療システムを図式的に説明したものである。
【図5】図5は、AMFエネルギー源として用いたソレノイドコイルの横断面を図式的に説明したものである。
【技術分野】
【0001】
関連出願の相互参照
本明細書は、2005年11月1日に出願された米国仮出願第60/732,368号(発明の名称「MAGNETIC NANOSCALE PARTICLE COMPOSITIONS,AND THERAPEUTIC METHODS RELATED THERETO(磁性ナノスケール粒子組成物、及びそれに関連した治療方法)」)に対して優先権を主張しており、その内容はこの参照によって本明細書に組み込まれるものである。
【0002】
技術分野
本発明は、磁性ナノ治療組成物及び方法に関するものであり、特に、標的特異的リガンドに付着するエネルギー感受性物質から成る磁性ナノスケール粒子組成物、並びに患者の身体、身体部分、組織或いは体液へのそのような組成物の投与、及び前記標的を破壊或いは不活性化するようにエネルギー源からのエネルギーの投与を有する治療方法に関するものである。
【背景技術】
【0003】
患者における疾患の発症及び一連の治療の成功という結末の間の時間は、多くの場合、受け入れ難いほどに長い。多くの疾患は無症状であり、進行性及びしばしば末期段階へ進行するまで検出を逃れる。加えて、この期間は、正しく診断された治療であっても望ましくない副作用による、患者の著しい精神的及び身体的外傷によって特徴付けられるものである。初期に検出された疾患でも、健康組織の正常機能を破壊する、若しくは他の望んでいない副作用を有する治療によってのみ最も有効的に治療されることとなる。
【0004】
そのような疾患の一つは癌である。かなりの研究努力といくつかの成功に関わらず、癌はいまだ米国の死亡原因の第二位であり、米国癌学会の推定によると年間500,000人以上が癌で亡くなっている。伝統的な治療は侵襲性である及び/若しくは有害な副作用(例えば健康な細胞への毒性など)が付随するものであり、しばしば中程度の成功のみを示す一連の外傷性治療に向かうものである。より良い診断手技及び技術の結果である初期検出は、多くの患者の予後を改善した。しかしながら、多くの患者が耐えなくてはならない苦しみは、一連の治療をよりストレスフルなものにし、患者は診断された治療を遵守し完了することになる。さらに、いくつかの癌は、疾患検出の改善にも関わらず、現在利用可能な治療オプションを拒絶するものもある。未だに医学的挑戦を提起する多くの形態の癌である前立腺癌、乳癌、肺癌及び肝癌によって、毎年たくさんの命が奪われる。結腸直腸癌、卵巣癌、胃癌、白血病、リンパ腫、黒色腫及びそれらの転移も命を脅かすものである。
【0005】
例えば、乳癌に対する従来の治療は、一般的に手術とそれに続く放射線及び/若しくは化学療法を含む。これらの技術はいつも有効的であるものではなく、しかも有効であったとしても、彼らは特定の欠乏に悩まされるものである。手術手順としては、腫瘍のみの除去(乳癌腫瘍摘出術)から乳房の完全除去までが範囲である。初期段階の癌において、乳房の完全除去は癌再発に対する保証を提供するが、外観を損ない、患者に非常に難しい選択を迫るものである。乳癌腫瘍摘出術は外観を損なわないが、癌再発の高いリスクと関連している。放射線療法及び化学療法は辛く、再発に対して完全に有効的であるという訳ではない。
【0006】
病原体ベース疾患の治療も合併症無しではない。全身感染の症状を示している患者はしばしば、最初のステップとして広範囲抗生物質で間違って治療される。侵入した生物体がウイルスであった場合、この一連のアクションは完全に有効ではない。細菌(例えば大腸菌など)が原因の場合、抗生物質治療は問題の細菌だけでなく、食物の適切な消化に必要な腸における良性腸内細菌叢も除去する。従って、この方法で治療された患者は、良性細菌が再増殖するまでしばしば胃腸損傷を経験する。他の例において、抗生物質耐性細菌は抗生物質治療には反応しない。ウイルス疾患に対する治療はしばしば侵入してくるウイルス自体を標的としている。しかしながら、ウイルスが侵入しそのウイルスの更なるコピーを産生するために「ハイジャック」された細胞は生存している。従って、疾患の進行は、停止というより遅延される。
【0007】
これらの理由により、疾患を治療するための改善された代替技術、特に既存の技術と比較して患者に対して低い侵襲性と外傷性を有し、疾患組織、病原体、或いは身体における他の望ましい部位などの標的部位で局所的に有効である技術が提供されることが望まれている。さらに、患者への毒性が最低限で、一回或いは非常に少ない治療セッション(患者のコンプライアンスを最小にする)で実行することができ、優れた操作者技術及び入力を必要とせずに疾患組織を標的とすることができる治療技術を提供することも望ましい。
【0008】
そのような代替技術の一つは免疫療法であり、これは例えば癌を含む多くのヒト疾患を治療するために使用されている急速に広まっているタイプの治療である。FDAは多くの抗体ベース癌治療薬を承認した。抗体、抗体断片及び改変特性(例えば抗原結合親和性、分子構造、特異性、原子価など)を有するペプチドを設計する能力は、治療におけるそれらの使用を増強した。癌免疫療法は、ヒトにおける免疫原性反応を軽減するためのマウス抗体のキメラ化及びヒト化における進歩を利用したものであった。高親和性ヒト抗体はさらに、多くの人免疫グロブリン遺伝子を含むトランスジェニック動物から得られた。さらに、ファージディスプレイ技術、リボソームディスプレイ、及びDNAシャフリングは、標的リガンドとして使用するための高親和性で低免疫原性を有する抗体断片及びペプチドの発見を可能にした。これら進歩の全ては、望ましい抗原結合親和性及び特異性を持ち、最低限の免疫反応を示す免疫療法の設計を可能にする。
【0009】
癌免疫療法の領域は、癌細胞によって(正常細胞と比べて)過剰発現された、或いは癌細胞にのみ発現するマーカーを利用する。そのようなマーカーの同定は進行中であり、リガンド/マーカー組み合わせの選択は、あらゆる免疫療法の成功の鍵を握る。免疫療法は少なくとも3つのクラスに分類される:(1)それ自体が増殖受容体を標的とし、サイトカイン経路を破壊する、若しくは補体或いは抗体依存性細胞毒性を誘導する抗体の展開;(2)毒、放射線核種或いはサイトカインを有する抗体の直接的装備;(3)毒を送達するために使用した免疫リポソームへ抗体を付着させることによる、或いは免疫細胞エフェクター(二特異性抗体)へ抗体を付着させることによる抗体の間接的装備。装備した抗体は治験において強力な腫瘍活性を示したにも関わらず、それらはさらに患者に対して許容できない高レベルの毒性を示した。
【0010】
免疫毒性或いは放射核種(すなわち直接的及び間接的装備)の送達に依存している治療の不利益は、一度患者に投与されたら、これらの薬剤は全時間で活性化されるということであった。これらの治療はしばしば非腫瘍細胞に対してダメージを与え、毒性問題と送達問題を提示する。例えば、癌細胞は一般的に、表面発現抗原(免疫療法によって標的化される)を血流へ流す。免疫複合体は免疫療法剤及びその流された抗原との間に形成され得る。結果として、癌細胞との相互作用よりもこれらの流された抗原との前記抗体の相互作用のせいで、多くの抗体ベース治療は希釈されてしまい、それによって正確な送達用量が減少してしまう。従って、有害な副作用を最低限にし、有効性を改善する「治療応需型」アプローチが好ましい。
【0011】
温熱療法において、約40℃〜約46℃(高温/温熱療法)の範囲における温度は疾患細胞へ不可逆的なダメージを与えることができる。しかしながら、健康な細胞は46.5℃周辺までの温度に曝されても生存することができる。疾患組織における個々の細胞の温度を致死レベルまで上昇させる(細胞性温熱療法)は、優れた治療オプションを提供する。疾患及び身体における他の望ましくない問題に関連した病原体も、局所的な高温に曝すことによって破壊され得る。
【0012】
46℃以上の温度もさらに、即効性温熱切除反応を生じることによって癌及び他の疾患の治療に対して有効である。しかしながら、そのような温度に曝す健康組織を最少量にすることを確実にするために、正確で的確な標的化が必要である。そのようなレベルの標的化の達成に失敗すると、有害な副作用が増加し、その治療の利点が減少してしまう。
【0013】
温熱療法(hyperthermia)は、即効性ネクローシス(一般的に「温熱切除」として言及される)及び/若しくは細胞における熱ショック反応(典型的な温熱療法)を誘導し、その結果細胞内での一連の生化学的変化を介した細胞死を導くため、癌及び他の疾患に対する治療としてかなり有望である。位相同期輪状配列システム(APAS)などのマイクロ波或いは高周波(RF)温熱療法を用いる最先端技術システムは、深部に位置する腫瘍の局所加熱に対するエネルギーを調整しようと試みている。そのような技術は、組織導電率の異種性及び高度に灌流された組織の異種性によって制限される。これは、望ましい領域における投薬に伴う非標的組織における「ホットスポット」現象の未解決問題を導くものである。その結果としては、予想された治療率より低いものであり、望ましい領域へと送達された十分量で正確な熱容量を決定することは本質的に難しいものである。後者の結果によって、再現性及び治療後の予想可能な患者利益を確実にすることが必要な規定臨床プロトコールの開発が排除される。これらの因子の全ては、そのようなシステムでの特異的領域の選択的加熱を非常に困難にする。
【0014】
RF温熱療法を利用した別の戦略は、マイクロ波或いはRFベースアンテナ或いは自己調節型温熱シーズの外科的移植を必要とする。このアプローチは用量決定に関連した問題、及び標的化に関連したいくつかの問題を回避する一方、前記温熱シーズを移植するための侵襲性手順を必要とする。この侵襲性に加えて、このアプローチは原発腫瘍の正確な位置の知識を必要とするので、転移の治療に対するオプションが(もしあったとしても)ごく少ない。従って、前記シーズ移植戦略は未検出の個々の癌細胞、若しくは原発腫瘍部位に全く隣接していない細胞群を標的化することはできない。この戦略の臨床成功は、望ましい腫瘍部位での熱の標的化産生に関連する問題によって阻まれる。
【0015】
適切な溶媒に懸濁された超常磁性粒子(10−9秒ほどの特徴的な緩和時間を有する)(磁性流体として言及される)を用いた腫瘍内での熱産生、及び前記患者の交流磁界(AMF)への曝露によって疾患を治療する戦略が提案されている(米国特許第6,541,039号、Lesniak et al.及び米国特許第6,470,220号、Kraus, et al.を参照のこと)。いくつかのバリエーションが存在する一方、一般的に先行技術に開示された方法は、目的の領域を含む、治療される領域への直接的な磁性流体の導入、及び50kHzと200kHzとの間の周波数を有する磁界を変える低振幅(16kA/m以下)へ患者の大部分を曝すことによって前記粒子を加熱する工程を有するものである。AMFへ患者の大部分を曝す工程は、組織とのAMFの相互作用によって産生された渦電流によって、曝された全領域、さらにはコア身体温度の組織温度を上昇させるということはよく知られている。実は、これは上述のアンテナベース或いは位相同期輪状配列RF装置を用いた一般的な戦略である。従って、この領域内に位置した癌腫瘍は、磁界がなくても温度の上昇に曝される。約40℃〜43℃の範囲までの腫瘍温度上昇はいくつかのケースにおいて報告されている。前記腫瘍に直接的に注入される、腫瘍1グラム当たり約10mg〜100mg粒子という比較的大量な超常磁性粒子を考える場合、そのような腫瘍温度は低いように思われる。これは、熱の大部分が、前記粒子の存在による低程度の熱を有する組織上での直接的なAMF効果(渦電流)の結果であることを示唆するものである。
【0016】
記載されたような磁性流体は非相互作用超常磁性粒子から成り、これは、凝集するためのそれらの粘性が減少しているため好ましいと言われている。前記流体を有する磁性粒子は超常磁性であるので、粘性加熱はその粘性によって溶媒内へエネルギーを蓄積する粒子循環、すなわちブラウン緩和を生じるメカニズムである。先行技術に記載されたように、超常磁性粒子は、ゼロ或いはゼロに近い残留磁気を有し、その結果さらにその磁気モーメントが非相互性である場合に生じる減少した凝集傾向を有するため望ましい。ネール緩和(磁気ヒステレシス)は、AMF期が前記粒子磁気モーメントの特徴的な緩和時間に比べて著しく短く(10−9秒以下)ない限り、この場合除外される。従って、AMFで加熱する磁気ヒステレシスは、AMF周波数が1Ghz以上の場合のみ可能である。記載された磁性(超常磁性)流体の組成物に関する方法、及びそこに開示された一般的なAMF周波数(約100kHz)に対して、ネール緩和を介した加熱の貢献は不可能である。
【発明の開示】
【発明の効果】
【0017】
RF界へ曝された磁性流体を用いた疾患の治療に対する温熱療法は、数十年の間認識されていた。しかしながら、磁性流体温熱療法の主要な問題は、特にその組成物が適用されたRF期より短い特徴的な緩和時間を所有する粒子に限定される場合、致死量の粒子を目的の細胞或いは病原体へ選択的に送達する能力がないことであった。
【0018】
適切に標的化された加熱アプローチが疾患の治療効果を有するという臨床可能性のように、細胞に対する加熱ダメーイの生物学はよく理解されている。このことは、加熱がこれらの治療と組み合わされた場合、或いはこれらの組み合わせである場合、前記細胞の加熱感作に起因する、加熱の細胞毒性効果若しくは放射線或いは化学療法の増強された細胞毒性効果に起因するものである。紫外線、X線、ガンマ、ベータ、アルファ、ニュートロなどのン電離放射線、或いは化学療法との組み合わせで細胞に適用された加熱はしばしば、イオン化エネルギー或いは化学療法用量の付加的組み合わせから予想ものより著しく多く増強された細胞毒性効果を生じる。しばしば細胞は、その用量が熱と組み合わされ、いくつかの組み合わせにおいてサブ致死用量であった場合、化学療法剤或いは電離放射線の別のサブ致死用量に対して高レベルの感受性を示すことがある。そのような併用療法は、加熱或いは電離放射線からのダメージを与える副作用が回避されるため、実証可能な優位な臨床可能性を有している。従って、すなわちバイオプローブにおける適切に標的化された治療の併用形態は、治療様式或いはそれらの併用の非標的化適用よりも著しい利点を有する。
【0019】
上述の観点において、疾患組織、病原体、或いは他の望ましくない問題を治療するための温熱療法組成物に対するニーズが存在し、これは、a)安定単磁区粒子(109秒以上の特徴的な緩和時間);b)超常粒子の凝集から成る磁性ナノ粒子であって、ここにおいて磁気モーメントの相互作用は、患者体内の標的へ適用された磁界の期間に適合した特徴的な緩和時間を有する集合状態を生み出している、磁性ナノ粒子;或いはc)安定単磁区結晶及び超常磁性粒子の凝集から成る磁性ナノ粒子であって、ここにおいて前記安定単磁区及び超常磁性磁気モーメントの相互作用は、10−9秒以上に達する超常磁性特徴的な緩和時間が増加した集合状態を生じる、磁性ナノ粒子、を有するものである。さらに、そのような温熱療法組成物の選択的な送達を含み、安全で有効的で、持続時間が短く、最小限の侵襲性である温熱療法ベース治療方法を有することも望ましい。
【0020】
従って、疾患物質を治療するための温熱療法磁性組成物を提供することが本発明の対象であり、これは、a)安定単磁区粒子(109秒以上の特徴的な緩和時間);b)超常粒子の凝集から成る磁性ナノ粒子であって、ここにおいて磁気モーメントの相互作用は、患者体内の標的へ適用された磁界の期間に適合した特徴的な緩和時間を有する集合状態を生み出している、磁性ナノ粒子;或いはc)安定単磁区結晶及び超常磁性粒子の凝集から成る磁性ナノ粒子であって、ここにおいて前記安定単磁区及び超常磁性磁気モーメントの相互作用は、10−9秒以上に達する超常磁性特徴的な緩和時間が増加した集合状態を生じる、磁性ナノ粒子、を有するものである。
【0021】
疾患物質を治療するための方法を提供することは本発明の別の対象であり、これは、そのような温熱療法組成物の選択的送達を有し、安全で有効的で、持続時間が短く、最小限の侵襲性である。
【0022】
患者に対する磁性物質組成物の投与、及びを例えばネール緩和などの磁気ヒステレシス損失を介して前記磁性物質を誘導的に加熱する改変磁界の適用含む治療方法を提供することは本発明の別の対象であり、この磁性物質組成物は、安定単磁区粒子、若しくは磁気ヒステレシス損失を介した加熱が適切に調節された集合磁性状態の特徴的な緩和時間を有する磁気的に連結した超常磁性粒子の凝集、或いは標的特異的リガンドへ結合した、「磁気的に連結した安定単磁区及び超常磁性粒子の凝集を有するものである。
【0023】
交流磁界の適用前に患者の体内における前記磁性物質組成物の集積の少なくとも1つの位置の検出を有するそのような治療方法を提供することは本発明の別の対象である。
【0024】
前記磁性物質組成物が患者の体外にある場合、前記交流磁界の適用を有するそのような治療方法を提供することは本発明の別の対象である。
【0025】
前記磁性物質を誘導的に加熱し、ネクローシス、アポトーシス或いは疾患物質を非活性化することによる望ましい病理学的効果の誘導を含むそのような治療方法を提供することは本発明の別の対象である。
【0026】
前記ナノ粒子組成物内における温熱療法、放射線、化学療法の利点を組み合わせる組成物及び治療方法を提供することは本発明の別の対象である。
【0027】
磁性物質組成物を投与するための方法を提供することは本発明の更なる別の対象であり、これは腹腔内注入、血管内注入、筋肉内注入、皮下注入、局所的(外用)、吸入、経口摂取、直腸挿入、洗浄、洗浄液、リンス、或いは患者の身体物質への体外投与を介して行われるものである。
【0028】
組織を安全に且つ効果的に、最小限の侵襲性を有し、短い治療期間で治療するための方法を提供することは本発明の更なる対象である。
【0029】
本発明は、疾患物質を治療するための温熱療法磁性組成物に関するものである。1実施形態において、前記組成物は、標的特異的リガンドへ結合した単磁区粒子(109秒以上の特徴的な緩和時間)を有する。別の実施形態において、前記組成物は、超常磁性粒子の凝集を有する磁性ナノ粒子を有するものであり、ここにおいて前記相互作用した磁気モーメントは、患者の体内で標的に適用された磁界の期間に適合した特徴的な緩和時間を有する集合状態を創るものである。別の実施形態において、前記組成物は、安定単磁区結晶及び超常磁性粒子の凝集を有する磁性ナノ粒子を有するものであり、ここにおいて前記安定単磁区及び超常磁性磁気モーメントの相互作用は、10−9秒以上に達する超常磁性特徴的な緩和時間を増加する集合状態を生じるものである。
【0030】
本発明は疾患組織、病原体或いは患者における他の望ましくない問題を治療するための方法に関するものである。1実施形態において、前記治療方法は、患者に対して、標的特異的リガンドに連結した単磁区粒子を有する温熱療法磁性組成物の投与、及び前記磁性物質組成物を誘導的に加熱する交流磁界の適用を有するものである。前記温熱療法磁性組成物はさらに、前記リガンド及び前記磁性粒子を別々に患者に対して投与する工程、及び次に患者の体内で前記リガンド及び前記磁性粒子を組み合わせる工程によって投与されるものである。
【0031】
別の実施形態において、前記治療方法は、患者への、患者の体内で前記磁性組成物の集積の少なくとも1つの位置を検出する温熱療法磁性組成物の投与、及び前記磁性組成物を誘導的に加熱する交流磁界の適用を有するものである。
【0032】
別の実施形態において、前記治療方法は、患者への温熱療法磁性組成物の投与、及びネクローシス、アポトーシス或いは病原体非活性化を生じさせるための、前記磁性組成物への誘導的な加熱によって望ましい病理学的効果を誘導する交流磁界の適用を有するものである。
【0033】
別の実施形態において、前記治療方法は温熱療法磁性組成物の投与を有するものであり、これは腹腔内注入、血管内注入、筋肉内注入、皮下注入、局所的(外用)、吸引、経口摂取、直腸挿入、洗浄、洗浄液、リンス、或いは患者の身体物質への体外投与を介して行われるものである。
【0034】
治療方法に対して開示されたあらゆる実施形態は、患者の一部の身体的特徴のモニタリングを有するものである。
【0035】
治療方法に対して開示されたあらゆる実施形態において、既定標的は、癌、免疫システムの疾患、病原体媒介性疾患、及び毒素、臓器移植に対する反応、ホルモン関連性疾患及び非癌性疾患細胞或いは組織などの望ましくない標的などの疾患に関連するものである。
【0036】
本発明の上述の要約は、それぞれ説明された実施形態或いは本発明の全ての実施を記載することを意図したものではない。以下の図面及び詳細な説明は、これらの実施形態を特に例示するものである。
【発明を実施するための最良の形態】
【0037】
本発明は、付随する図面を参照しながら以下にある本発明の様々な実施形態の詳細な説明を考慮することによってより完全に理解されるであろう。
【0038】
本発明は様々な修飾及び代替形態に適用可能である一方、それについての詳細は、図面において実施例を介して示されており、詳細に記載されているであろう。しかしながら、記載された特定の実施形態に限定することを意図するものではないということは理解されるべきである。一方、添付の請求項によって定義されたような本発明の範囲及び観点の範囲内にある全ての修飾、同等なもの、及び代替物は対象とすることを意図するものである。
【0039】
本発明は、疾患物質を治療するための温熱療法組成物、及びそのような組成物を用いて疾患物質を治療するための方法に関するものである。本発明の組成物及び方法は、癌を含む様々な徴候の治療用に使用される。開示された組成物を用いた治療方法は、バイオプローブを有する治療用磁性組成物の患者への投与、及び標的細胞を殺傷するために前記バイオプローブを十分に加熱するための、前記磁性粒子組成物を含む患者のある領域への交流磁界の適用を有するものである。本発明或いはその観点は、適切な装置或いは器具と併せて使用するのに適している。
【0040】
定義
本明細書で用いられたように、「AMF」(交流磁界の省略)という用語は、約80kHz〜約800kHzの範囲の周波数を有する、特に正弦曲線、三角形、長方形或いは同様な形パターンにおける、その場のベクトルの方向を周期的に変更する磁界を意味している。AMFはさらに、結果生じた磁界ベクトルのAMF成分のみが方向を変化するような静磁界も付け加えられる。前記交流磁界は交流電磁場に付随して生じ、実際には電磁気であることが好ましい。
【0041】
本明細書で用いられたような、「バイオプローブ」という用語は、磁性ナノ粒子コア、コーティング、リンカー、及び前記交流磁界(AMF)に反応して加熱することによって組織を選択的に治療するために使用される標的リガンドを有する標的ナノ粒子を意味している。加えて、前記バイオプローブは適切なエネルギー源に曝された場合放射能を有するようになる放射線源或いは種を有する。イットリウム−90(90Y)は例示的な放射線源である。ホウ素−10(10B)は適切なエネルギー源に曝され放射能を有するようになる場合、放射能を有するようになる例示的な種である。ホウ素−10(10B)は、高ニュートロン吸収横断面を有しており、ニュートロンの捕捉によって放射能を有するようになるため、ニュートロンのビームへ曝された場合、放射能を有するようになる。前記バイオプローブはさらに、化学療法剤も有する。ドキソルビシンは例示的な化学療法剤である。
【0042】
本明細書で用いられたように、「バイオプローブシステム」という用語は、マーカーを介して選択的に同定された標的に特異的なバイオプローブを意味するものである。
【0043】
本明細書で用いられたように、「コーティング」という用語は、患者内における前記バイオプローブのin vivo輸送に影響を与えるように働き、疾患組織及び細胞による取り込みと保持を容易にするのに適切な生態的合成物質を有する、物質、物質の組み合わせ、或いは磁性ナノ粒子の被膜を意味するものである。デキストラン及びポリエチレングリコールの組み合わせは例示的なコーティングである。
【0044】
本明細書で用いられたように、「疾患物質」という用語は、骨髄、肺、血管、神経、結腸、卵巣、乳房及び前立腺癌などのあらゆるタイプの癌;AIDSなどの免疫システムの疾患;細菌、ウイルス、寄生虫或いは真菌などの病原体媒介性疾患(病原体媒介性疾患の例としてはHIV、結核及びマラリアを含む);肥満などのホルモン関連疾患;血管システム疾患;多発性硬化症などの中枢神経系疾患;及び有害な血管新生、再狭窄、アミロイドーシス、毒素、臓器移植に関連した産物による反応、及び他の異常細胞或いは組織増殖などの望ましくない問題に関連した組織或いは細胞を意味するものである。
【0045】
本明細書で用いられたように、「負荷サイクル」という用語は、エネルギー源が1つのオン−オフサイクルにおいてオン及びオフである総時間に対するエネルギー源がオンである時間の割合を意味するものである。
【0046】
本明細書で用いられたように、「エネルギー源」という用語は、前記バイオプローブを有する潜在的な放射線源を活性化する目的で前記バイオプローブへAMF以外の形態のエネルギーを送達することができる装置を意味するものである。
【0047】
本明細書で用いられたように、「徴候」という用語は、疾患などの病状を意味するものである。乳癌は例示的な徴候である。
【0048】
本明細書で用いられたように、「リガンド」という用語は、バイオプローブ及び標的に連結し、生物学的マーカーを標的化し連結する分子或いは化合物を意味するものである。HER−2(上皮増殖因子受容体タンパク質)に特異的なモノクローナル抗体は例示的なリガンドである。
【0049】
本明細書で用いられたような、「リンカー」或いは「リンカー分子」という用語は、リガンド上、若しくは磁性粒子或いはコーティング上特定の機能基を標的化し、これらの任意の2つの間で共有結合を形成する因子を意味するものである。
【0050】
本明細書で用いられたような、「磁性ナノ粒子」という用語は、交流磁界において磁気ヒステレシス損失を介して誘導的に加熱するように適切に調節された集合磁性状態の特徴的な緩和時間、すなわちネール緩和を有する、磁気的に連結した超常磁性粒子の凝集を意味するものである。
【0051】
本明細書で用いられたように、「マーカー」という用語は、前記バイオプローブが特異性を示す抗原或いは他の物質を意味するものである。HER−2タンパク質は例示的なマーカーである。
【0052】
本明細書で用いられたように、「標的」という用語は、疾患細胞、病原体、或いは他の望ましくない問題などの非活性化、破裂、崩壊或いは破壊が望まれているような問題を意味している。マーカーは前記標的に連結する。乳癌細胞は例示的な標的である。
【0053】
標的治療システム
本発明の標的治療システムは、徴候を治療するために少なくとも1つのエネルギー源と連結したバイオプローブシステムの利用に関するものである。
【0054】
バイオプローブシステム
本発明の前記バイオプローブシステムの様々な実施形態は、図1及び図2に説明されている。図1は本発明に従ったバイオプローブ配置を図示したものであり、ここにおいてバイオプローブ100は磁性ナノ粒子110を有している。前記磁性ナノ粒子110はコーティング120を有している。加熱は、前記磁性ナノ粒子がヒステレシスを通じてAMF源へ曝された場合、前記磁性ナノ粒子110に産生されるものである。加えて、前記磁性ナノ粒子は、放射性成分、或いは適切な非AMFエネルギー源に曝された場合放射能を有するようになる適切な同位体を有するものである。
【0055】
磁性ナノ粒子
微磁性粒子の一般的特性:単磁区−安定及び不安定
ナノスケール(1μm以下の直径を有する)磁性物質は、それらの従来型或いは大半の対応物と比較した場合、残留磁気及び飽和保磁力などの多くの増強された特性を有している。粒子サイズの減少に伴って、表面及び界面領域にある粒子を有するわずかな原子が増加する。これは、前記磁性特性に対する前記表面及び界面電子構造の効果の重要性を増加させる。自然発生磁化及び磁気結晶異方性などの物質の本質的な磁性特性は、粒子(結晶)サイズに強く影響される。磁気結晶異方性は単磁区粒子の総異方性に唯一貢献するものである。付加的な貢献としては、静磁気、形、ストレス及び表面異方性が挙げられる。これらの最後は、サイズが減少するにつれて重要性が増加する表面及び粒子境界の詳細な化学性質に密接に関連するものである。
【0056】
総異方性エネルギーは、表面異方性貢献度が増えるので、特定のサイズ範囲内では粒子サイズが減少するにつれて増加する。これらの増強された磁性特性の多くは、ナノスケール磁性物質を様々な適用に特に適するようにするものである。本明細書に記載された本発明に対して、前記増強された磁気結晶異方性は、交流磁界(AMF)に曝された場合、これら物質のヒステレシス損失の増加に貢献する、つまり、より高い特異的吸収率(SAR)或いは加熱を生じる。実は、大半の対応物と比較した場合その表面異方性貢献度が大きくなることによって前記総異方性エネルギーは粒子サイズに伴って増加するため、特定サイズ内のナノスケール磁性物質は、特定のAMF条件下で所定量の物質に対して著しく高いSAR値を生み出すことができる。
【0057】
単一非相互作用粒子
大きな磁性体は、その静磁気エネルギーを最小限にするために磁壁(ブロッホ磁壁)によって分離される、磁区として言及される均一に磁化された領域へ分けられるということは理解される。しかしながら、最小限にされるべき前記エネルギーは、磁壁貢献と同様に静磁気、交換及び異方性成分を含む総エネルギーである。従って、磁性物質内の磁区の数と形を決めるのは、エネルギーの最終バランスである。物質のサイズが小さくなるにつれて、磁区のサイズも小さくなるであろう。加えて、前記磁区の構造は、前記磁壁幅及び構造が変わるにつれて変わるであろう。磁壁形成に関連したエネルギーコストが存在し、従って結果生じる総エネルギーバランスは、磁区の細分を特定の最適な数とサイズまでに限定する。
【0058】
磁壁の形成に起因するエネルギー増加が前記単磁区をより小さい磁区へ分けることによって得られたエネルギー減少よりも大きいため、単磁区構造が存在するサイズ以下の粒子サイズにおける、対応するより低い制限が存在する。多くの磁性物質に対して、容積制限は約2nm〜約800nmの範囲であり、これは自然発生磁化、及び異方性及び交換エネルギーに依存するものである。
【0059】
単磁区のみを有する磁性体、すなわち単磁区粒子に対して、時間及びその環境(温度、外部地場など)に関する前記磁区の磁気モーメントm(磁化の振幅及び配向を定義するベクトル)の挙動は、前記磁性粒子の総異方性エネルギーによって制御される。結晶構造軸に関する前記磁気モーメントの配向は、前記異方性エネルギー及び前記粒子が置かれた物理的環境(過去及び現在)の明確な結果である。本明細書で開示された本発明にとって一般的に興味深い環境変数の中には、時間変動磁場(AMF)及び温度の存在及び性質が含まれている。特に、ヒステレシス損失及びその結果として産生された加熱(SAR)を決定するのは、AMFの存在下に置かれた場合、単磁区粒子におけるmの空間的配向(反転)によって示された反応様式である。
【0060】
交流磁界に曝された場合の、ヒステレシス損失を介して熱を産生する単磁区粒子(結晶)のポテンシャルは、総異方性エネルギーを導く前記粒子内のエネルギーのバランスによって決定される。異方性エネルギーのこの合計は、前記磁気モーメントm(前記粒子の正味の磁気の方向及び振幅両者を表すベクター)の方向における変化に対するエネルギー障壁EBを示す。従って、時間に関するmの安定性は、EBの値を増加する。粒子体積V及びEBは組み合わせて特徴的な緩和時間τ0を定義し、この緩和時間τ0は、十分に強い磁場によって強制的に再配向された後、いくつかの開始値に対するmの方向における自然発生変動或いは緩和に必要な時間である。別の言い方をすると、τ0は、前記粒子の本質的な特性と考えられ、粒子の組成物、容積、形などの様々なパラメーター、及び粒子内の対称性やmに利用できる緩和経路に依存するものである。
【0061】
交流磁界へ曝した時の単磁区粒子のヒステレシス損失を通じて認識された熱の量は、前記粒子の本質的な性質と実験条件の両者の組み合わせの結果である。実験温度は、EBと前記システムで利用可能なエネルギーとの間の相対的差異を決定し、実験緩和時間或いはτを設定するものである。この関係は、数学的に以下のように定義される。
【0062】
【数1】

【0063】
従って、τとのAMFの振動期間(1/ν)の関係は、ヒステレシス損失を通じて産生される熱の量を直接導く重大な実験的に観察可能な量となる。ここで、νとはAMFの振動の周波数である。1/ν>>τの場合、前記モーメントは非ブロック化のように見られ、ヒステレシス損失を示すことなく、すなわち熱を産生することなく、自然発生的にEB及び再配向を不規則に回復する。反対に、1/ν<<τの場合、前記モーメントはブロック化のように見られ、配向における変化に抵抗するものである。十分な振幅のAMFの場合、mはEBを回復せざるを得ず、変化の間熱を放出する。
【0064】
単磁区粒子における異方性エネルギー或いは潜在的なヒステレシス損失は、第一近似において、前記粒子の容量に比例する。従って、大きな単磁区粒子に対して、前記異方性エネルギーは非常に高いので、磁化反転に対する前記エネルギー障壁は物質のキュリー温度以下の任意の温度に対する熱エネルギーによって回復されない。熱エネルギーは、産物kTによって定義され、ここにおいてkはボルツマン定数であり、Tはケルビンにおける温度である。そのような単磁区粒子は、磁気モーメントは変動しないため適切な単磁区を有すると言われており、時間に関する本質的に安定な磁区挙動を示すと言われている。磁化反転は、前記粒子が異方性エネルギーを回復するのに十分な程強い外部磁場に曝された場合、そのような本質的に安定な磁性単磁区において生じ、磁化ベクトル(磁気モーメント)を変化或いは反転させる。前記異方性エネルギーは前記磁気モーメントの回転に対する障壁を示すので、このベクトルにおけるそのような空間的変化は、熱の形態でのエネルギー放出を伴う。放出された熱の量は、第一近似において、前記異方性エネルギーと比例するものである。
【0065】
前記磁場が除去された場合、前記磁気モーメントは特徴的な時間で磁場によって誘導された配向を保持する。磁場が除去された後に生じるそのような磁気モーメントの配向変化に必要な時間は、前記粒子の特徴であり、前記粒子の異方性エネルギー及びkTの両者の結果である緩和時間である。本質的に安定な単磁区粒子の極端な場合において、この時間は109秒以上である。それ故、物質キュリー温度までの全温度に対して、前記異方性エネルギーは磁気スピンシステムの自然発生回転に対する乗り越えられない障壁を示すため、前記磁気モーメントはブロック化のように見える。キュリー(或いはネール)温度は強磁性体から常磁性体状態への移行が生じる温度として定義される。
【0066】
反対に、単磁区形態内で粒子の容量が減少すると異方性エネルギーも減少する。特定の特徴的な粒子サイズ以下では、前記異方性エネルギーはゼロ以上のTの値に対してkTと同程度に低い或いはより低くなる。これは、常磁性体物質における単一スピンと同様に、磁化反転に対する前記エネルギー障壁が回復し、前記粒子の総磁気モーメントが熱的に変動できるということを意味している。この場合において、全体のスピンシステムは自然発生的に回転し、単磁区粒子内のスピンは磁気的に連結したままである。結晶軸に関する前記磁気ベクトルの配向は変動し、本質的に不安定である。これは、バルク材料において観察される常磁性と類似するため、超常磁性である。そのような磁性単磁区粒子は、本質的に不安定な単磁区を有すると言われている、若しくは本質的に超常磁性である。
【0067】
超常磁性粒子を外部磁場に曝すことは、磁場ベクトルの方向に配列された磁気モーメントを生じるが、付随するエネルギーの放出はない。前記異方性エネルギーはゼロ以上の測定可能な実験温度に対してkTより低いため、磁化反転に対する障壁は示さない。磁場が粒子から除去された場合、前記磁気モーメントの配向の自然発生的変動は、外部磁場によって引き起こされたあらゆる誘導を素早く破壊するであろう。本質的な超常磁性粒子の特徴的な緩和時間は非常に短く、特に10−9秒オーダーである。本質的に安定な磁区粒子と対照的に、本質的に超常磁性物質の磁気モーメントは、全実験温度において、及び前記特徴的な緩和時間よりも長い時間の時間依存測定において非ブロック化である。
【0068】
これら2つの極値間で、異方性エネルギーは中間である粒子容量の範囲内にあり、従って磁化反転の時間スケールは、測定の温度及び時間スケールに明確に依存している。従って、所定の粒子容量に対する緩和時間は温度によって定義され、それ故に前記測定時間が前記特徴的な緩和時間より短い場合、磁気モーメントはブロック化であるように見える。この場合において、前記物質は、安定な単磁区と類似の挙動を示し、前記特徴的な緩和時間より短い期間AMFに置かれた場合、熱を産生するであろう。そのような物質は、これらの条件下においてブロック化で明らかに安定な単磁区として定義される。
【0069】
反対に、測定時間、すなわちAMF期間が前記粒子の特徴的な緩和時間を超過する場合、非ブロック化或いは明らかな超常磁性挙動が観察されるであろう。この場合の特徴的な緩和時間が測定時間或いはAMF期間より非常に短いため、磁化再配向及び反転は、異方性エネルギー障壁によるインピーダンスを示さずに不規則に生じ、熱の放出も伴わない。
【0070】
明らかに安定な単磁区或いはブロック化挙動と明らかな超常磁性或いは非ブロック化挙動とを区別するためには温度も非常に重要である。従って、類推して、単磁区を有する特異的容量の粒子の磁気モーメントの特徴的な緩和時間は、実験温度Texpが特徴的な値以下であり、固定期間AMFに曝された場合、ブロック化であるように見える。Texpがこの特徴的な温度以上の値まで増加した場合、前記磁気モーメントは、同じ固定期間アMFに曝された場合、非ブロック化であるように見える。この特徴的な温度は、ブロッキング温度Tbとして定義される。従って、単磁区を有する粒子が固定周波数のAMF内に置かれた場合、前記磁気モーメントの強制振動は、前記粒子温度が前記ブロッキング温度以下である間、熱を放出するであろう。一度前記粒子温度がブロッキング温度を超過すると、前記磁気モーメントは非ブロック化になり、AMFへ更に曝されても熱の放出は停止するであろう。これは、kTによって定義された熱エネルギーが異方性エネルギーを超過し、過度のエネルギーをスピンシステムへ提供し磁気結晶異方性エネルギー障壁を超えるからである。
【0071】
非相互作用粒子のシステム
以上では特異的組成物及び容量の個々の単磁区粒子の挙動を記述した。バイオプローブは、それ自体が1以上の単磁区粒子の凝集である磁性ナノ粒子を有する。更に、前記バイオプローブは、適切で好ましくは非磁性媒体に懸濁された1以上のバイオプローブの懸濁液を有する。従って、前記バイオプローブ懸濁液は、分布の平均に集中している様々なサイズの個々のバイオプローブから成る。言い換えると、各バイオプローブは容量が異なり、更に分布の平均に集中している1以上の単磁区粒子から成る磁性ナノ粒子を有する。
【0072】
緩和時間及び結果生じるヒステレシス損失、及びバイオプローブ懸濁液に適用されたAMFにおいて産生された熱の理論上の記述は、特異的な容量を有する個々の単磁区粒子の挙動、すなわち非相互作用モーメントを有する単分散粒子の集合体の挙動を記載するために必要な記述以上に、更に多くの要因を含む事を必要とするであろう。容量はEBに直接影響を与える単磁区粒子の本質的な特性であるため、様々な容量を有する粒子を有する粒子の集合体に対するτ0及びτの決定は、サイズ分布の知識を必要とする。平均容量が特異的温度及びAMF周波数でmをブロックするのに十分なEBの値に関連する間に、容量及び著しく低いEBの集合体においてかなり大きな粒子の分画が存在する。正味の効果は、平均容量単独の知識から予想されたものより有意に低い測定熱産出を生じる。その逆も示された。粒子の集合体は、EBの値がmをブロックするのに必要な値より低い、すなわち超常磁性を示す場合、平均容量を有する。その結果として、前記システムは特異的な温度で特異的な周波数を有するAMFにおいてヒステレシスを示すと予想されなかった。しかしながら、この集合体は、平均より有意に大きい容量のかなり多数の粒子を含む。前記集合体のこの成分はブロック化であるように見られ、これは、特異的な温度で特異的な周波数を有する実験AMFに曝された場合産生されるヒステレシス及び測定可能な量の熱を生じるものである。特定量の産生された熱は、平均粒子容量のみの知識から予測されたものとはかなり明らかに矛盾するものである。
【0073】
粒子間相互作用は、単磁区粒子の集合体を有するバイオプローブの集合体のヒステレシス挙動を完全に記載するために必要な別の要因である。磁力は、定義によると長期的な力である。つまり、影響範囲は磁性粒子の境界にまで広がる。従って、1以上の単磁区粒子から成る磁性ナノ粒子は、集合状態に由来する異方性エネルギーに体する付加的な貢献、すなわち他の磁区との各磁区mの相互作用貢献のため、各粒子の磁性特性の合計以上の特性を示す。
【0074】
相互作用効果は異方性エネルギーを修飾し、非相互作用の場合、個々の粒子の状態に特徴的な挙動を示す集合状態を産出することが実験的に確立されていた。その結果は明らかに増加したEBであり、これは不均ブロッキングプロセスを生じるということがしばしば観察されていた。従って、超常磁性粒子のクラスタから成る磁性ナノ粒子は、ブロック化であるように見え、適切な実験条件下でヒステレシスを示す。前記ブロッキングプロセスは不均一であるため、ヒステレシス挙動は、凝集体と同程度の容量の単磁区粒子よりもかなり弱い。そのような凝集体は、全ての条件下で厳密ではないので、超常磁性或いは安定な単磁区としては定義されない。さらに、前記凝集体を有する各粒子は、全ての観点において超常磁性であり、ヒステレシスを示すことができない。
【0075】
単磁区粒子の凝集体、すなわち安定体と超常磁性体との組み合わせ、若しくは純粋な超常磁性体から成る磁性ナノ粒子の正確な定義及び完全な特徴付けは、多くの測定技術が特徴付けに必要なため、難しく実用的ではない。実は、これらの測定のいくつかの結果は、決定的ではない或いは矛盾するものである。それにも関わらず、実施測定は、本明細書に記載された本発明の目的に対する明らかな挙動を定義するために存在する。バイオプローブの集合体(ここにおいて各バイオプローブは磁性ナノ粒子の集合体から成り、各磁性ナノ粒子はさらに個々の粒子或いは粒子の凝集体から成る)は、凝集平均異方性エネルギーによって定義され、所定の特異的な温度で特異的なAMFにおける特徴的な緩和時間の平均及び平均挙動を定義する。従って、比較的単純な仕方でそのようなバイオプローブの集合体の磁性特性を定義することが可能である。270K〜380Kの実験温度で、及び約100kHz〜約600kHzの周波数、及び約7.98kA/m〜104kA/mの振幅を有するAMFへ曝すことに基づいて、SARの測定は全体の集合体の明らかな非ブロック化挙動から明らかなブロック化を区別するために使用される。非ブロック化或いは明らかな超常磁性粒子の集合体は、特異的条件下で10W/g以下の粒子を産生するであろう。比較すると、非相互作用の本質的な超常磁性ナノ粒子の集合体は、定義によると正確に0W/gの粒子を産生するであろう。反対に、明らかなブロック化バイオプローブは10W/g〜150W/gの粒子を産生するであろう。さらに、本質的なブロック化或いは安定単磁区粒子の集合体は、いくつかの超常磁性汚染が存在するにも関わらず、ヒステレシス加熱を介して特異的条件下で150W/g以上の粒子を産生するであろう。
【0076】
放射性同位体
特定の癌などの疾患を治療するための放射線及び熱の相乗効果のおかげで、前記バイオプローブが放射性同位体を有する場合、標的温熱療法の有効性は有意に増強される。この方法において、放射線は約20Gy〜約60Gyという典型的な用量で、若しくは好ましくは亜致死用量(20Gy以下)で送達され、温熱療法が開始される或いは完了した後のみ致死となる。放射線の用量レベルは、バイオプローブ組成物における放射性同位体の調節性取り込みによって調節されている。さらに前記放射線用量の調節は、「非標識」バイオプローブとの放射性標識バイオプローブの混合物を有するバイオプローブ懸濁液の使用を介して達成される。疾患の治療に現在使用されている、或いは将来開発されるあらゆる放射性同位体は、本明細書における使用に対して適切であり、標的温熱療法の治療率を増強する。適切な放射性同位体の例としては、これに限定されるものではないが、イオジン−131、コバルト−60、イリジウム−192、イットリウム−90、ストロンチウム−89、サマリウム−153、レニウム−186及びテクネチウム−99mである。
【0077】
潜在的な放射性同位体
特定の同位体は、特定の素粒子、すなわち中性子、プロトンなどに対する、及び特定の形態の電離放射線、すなわちx線に対する高吸収断面を有する不安定核(非放射性)を有する。これらの同位体の核が放射線或いは粒子を吸収する場合、その核は不安定となり、崩壊するにつれて放射する。この現象はすでに認識されており、癌の治療に使用されていた。最も有名な例としては、癌の治療に対するホウ素(ホウ素−10)中性子捕捉療法である。
【0078】
そのような治療は、同位体によって放射される放射線のレベルが主要に対する致死量を産生するのには不十分であるため、広く受け入れられなかった。しかしながら、バイオプローブの成分として、前記同位体の送達は、標的及び2つのエネルギー形態の相乗効果を最大限にする一連の温熱療法でのみ開始されたその放射線である。その結果として、前記放射線は温熱療法と組み合わせて使用した場合より高い細胞毒性となる。
【0079】
高い中性子吸収断面を有する他の同位体は、サマリウム−149、ガドリニウム−157及びガドリニウム−155などの多くのランタニドを含む。サマリウムは特に都合がよい、つまり磁性体であり、前記磁性ナノ粒子結晶構造へのその取り込みは前記ナノ粒子の磁性特性を増強する。
【0080】
化学療法剤
放射性同位体と同様に、化学療法剤を有するバイオプローブは、標的温熱療法と相乗効果的に組み合わせ、治療結果を増強する。本明細書における使用に適した化学療法剤の例としては、これに限定されるものではないが、ドキソルビシン、シスプラチンなどのプラチナ複合体を含む。
【0081】
画像化同位体
本明細書の使用に適した画像化同位体の様々な技術、特にMRI、PET、SPECT及び生体インピーダンスが存在する。
【0082】
フェライトの小さな常磁性或いは超常磁性粒子(酸化鉄Fe3O4或いはfe2O3)は、磁気共鳴映像法(MRI)における常磁性コントラスト媒体として使用され得る。これら薬剤は強いT1解法特性を示し、それらの周囲に対する感受性の違いによって、それらはさらに、コンストラクト媒体含有構造を暗くするためのT2緩和を増強する、強力に変動する磁界も産生する。300ナノメーター以下の非常に小さな粒子もさらに、長時間血管内に残る。前記薬剤も、SPIO's(「small particle iron oxides(小粒子酸化鉄)」或いは「superparamagnetic iron oxides(超常磁性酸化鉄)」)及びUSPIO's(「ultrasmall particle iron oxides(超小型酸化鉄)」或いは「ultrasmall superparamagnetic iron oxides(超小型超常磁性酸化鉄)」)として言及される。本発明の1実施形態において、標的温熱療法及びMRIは組み合わせられる。ガドリニウム標識アンチフィブリンナノ粒子などの不安定プラークを標的としたMRIコントラスト同位体は使用される。一度これらのナノ粒子がプラークによって取り込まれると、AMFはそのプラークを破壊するために使用される。
【0083】
陽電子放射型断層撮影法(PET)は、生きている患者の組織内の陽電子放射型放射性同位元素の濃度を測定するための技術である。幅広い範囲の化合物がPETで使用可能である。これらの陽電子放射型放射性核種は、短い半減期と高い放射性エネルギーを有している。PETで使用される一次陽電子放出型放射線核種は、炭素−11、窒素−13、酸素−15及びフッ素−18を含み、これらはそれぞれ20分、10分、2分及び110分の半減期を有する。これらの化合物は共通して、PETにおけるトレーサー化合物として知られている。
【0084】
単一光子放射型コンピュータ断層撮影法(SPECT)は、テクネチウム−99m及びタリウム−201などの放射線核種と呼ばれる放射性原子から単発で放射されたガンマ線の検出に関するものである。放射性医薬品は、それに付着した放射性核種を有するタンパク質或いは有機物質である。前記タンパク質及び有機分子は、人体内での使用或いは吸収特性に基づいて選択される。SPECTは、診断を助け、癌、脳卒中、肝臓疾患、肺疾患及び多くの他の身体的(機能的)異常を病期分類するために、日常的に使用されている。
【0085】
モリブデン−99、テクネチウム−99m、クロミウム−51、銅−64、ジスプロシウム−165、イッテルビウム−169、インジウム−111、イオジン−125、イオジン−131、イリジウム−192、鉄−59、リン−32、カリウム−42、ロジウム−186、レニウム−188、サマリウム−153、セレニウム−75、ナトリウム−24、ストロンチウム−89、キセノン−127、イットリウム−90或いはその他などの放射性免疫学画像化放射性核種は、特異的抗原標的に結合する抗体(標識化、トレース或いはタギングとしてしばしば言及される)へ結合する。本発明の1実施形態において、放射性免疫学画像化は、前記バイオプローブへ直接放射性核種を連結することによって標的温熱療法と組み合わされる。そのような配置において、前記バイオプローブの取り込み過程は直接的に画像化され得る。
【0086】
生体インピーダンスは、身体がどの程度電流を妨げるかを測定するものである。脂質は高い抵抗率であり、血液は低い抵抗率である。インピーダンスは、例えば2つの電極を用い小さな電流を適用し、別の電極対で結果生じた小さな電圧を測定することによって測定される。電圧がより低くなると、より低い組織インピーダンスは既知電流を与えるようになるであろう。組織は細胞と膜から成り;膜は薄いが高い抵抗性を有し、小さいコンデンサとして電気的に振る舞う。高周波数では、その結果は細胞膜の能力に非依存性となる。しかしながら低周波数では、前記膜は電流を妨げ、その結果は細胞外の液体に依存する。
【0087】
本発明の1実施形態において、1若しくはそれ以上のこれらの画像化技術は、標的療法投与の前、最中或いは後に前記バイオプローブの取り込みを画像化するために使用される。
【0088】
コーティング
コーティング120は、特にコーティング120がポリマー物質である場合、バイオプローブ100の熱特性を増強する。コーティング120はさらに、放射性或いは潜在的な放射性元素も有する。
【0089】
コーティング120に対して適切な物質は、合成及び生物学的ポリマー、コポリマー及びポリマー混合物、及び無機物質を含む。ポリマー物質は、アクリル酸、シロキサン、スチレン、酢酸、アルキレングリコール、アルキレン、酸化アルキレン、パリレン、乳酸及びグリコール酸のポリマーの様々な組み合わせを含む。更に適切なコーティング物質は、ヒドロゲルポリマー、ヒスチジン−コーティングポリマー、及びヒドロゲルポリマーとヒスチジン−コーティングポリマーとの組み合わせを含む。
【0090】
コーティング物質はさらに、多糖、ポリアミノ酸、タンパク質、脂質、グリセロール、及び脂肪酸などの生物学的物質の組み合わせも含む。本明細書において使用するのに適切な他の生物学的物質の例としては、ヘパリン、ヘパリン硫酸、コンドロイチン硫酸、キチン、キトサン、デキストラン、アルギン酸、デンプン、糖質、及びグリコサミノグリカンを含む。本明細書において有用なタンパク質の例としては、細胞外マトリックスタンパク質、プロテオグリカン、糖タンパク質、アルブミン、ペプチド及びゼラチンを含む。これらの物質はさらに、あらゆる適切な合成ポリマー物質と組み合わせでも使用される。
【0091】
無機コーティング物質は、金属、合金、及びセラミックの任意の組み合わせを含む。本明細書における使用に適したセラミック物質の例としては、ヒドロキシアパタイト、炭化ケイ素、カルボン酸、スルホン酸、リン酸、フェライト、ホスホン酸、及び周期表のIV群元素の酸化物を含む。これらの物質は、1若しくはそれ以上の生物学的或いは合成ポリマーも含む合成コーティングを形成する。磁性粒子110が生体適合性である磁性物質から形成される場合、前記粒子自体の表面は生態的合成コーティングとして機能する。
【0092】
前記コーティング物質はさらに、遺伝子導入(形質移入)として知られている過程である、細胞への前記バイオプローブ100の輸送を容易にするようにも働く。遺伝子導入因子として言及されるそのようなコーティング物質は、ベクター、プリオン、ポリアミノ酸、カチオン性リポソーム、両親媒性物質、及び非リポソーム性脂質、或いはそれらの任意の組み合わせを含む。適切なベクターは、プラスミド、ウイルス、ファージ、バイロン、ウイルスコートである。前記バイオプローブコーティングは、有機及び無機物質との遺伝子導入因子の任意の組み合わせの合成物であり、その特定の組み合わせは、疾患物質の特定タイプ、及び患者の身体内の特異的な位置に合わせるものである。
【0093】
マーカー
図2に説明したように、マーカー(抗原)160及び170の選択は、本発明の標的療法にとって重要である。そのことに限定されないが、マーカーの使用と選択は、癌免疫療法において最も一般的なことである。乳癌及びその転移に対して、特異的なマーカー或いはマーカー群は、例えば、MUC型ムチンファミリーのメンバー、上皮成長因子(EGFR)受容体、癌胎児抗原(CEA)、ヒト癌抗原、血管内皮増殖因子(VEGF)抗原、メラノーマ抗原(MAGE)遺伝子、ファミリー抗原、T/Tn抗原、ホルモン受容体、成長因子受容体、クラスタ解析/分化抗原群(cluster designation/differentiation;CD)抗原、腫瘍抑制遺伝子、細胞周期制御因子、癌原遺伝子、癌原遺伝子受容体、増殖マーカー、接着分子、細胞外マトリックスの分解に関するプロテインキナーゼ、悪性形質転換関連因子、アポトーシス関連因子、ヒト癌抗原、糖タンパク質抗原、DF3、4F2、MGFM抗原、乳癌抗原CA15−3、カルポニン、カテプシン、CD31抗原、増殖性細胞核抗原10(PC10)、及びpS2などの細胞表面マーカーから選択される。
【0094】
他の形態の癌及びその転移に対して、特異的マーカー或いはマーカー群は、例えば血管内皮増殖因子受容体(VEGFR)ファミリーのメンバー、癌胎児抗原(CEA)ファミリーのメンバー、抗イディオタイプmABの一種、ガングリオシド擬態の一種、クラスタ解析/分化抗原群抗原のメンバー、上皮増殖因子受容体(EGFR)ファミリーのメンバー、細胞性接着分子の一種、MUC−タイプムチンファミリーのメンバー、癌抗原(CA)のメンバー、マトリックスメタロプロテアーゼの一種、糖タンパク質抗原の一種、メラノーマ関連抗原(MAA)の一種、タンパク質分解酵素、カルモジュリン、腫瘍壊死因子(TNF)受容体ファミリーのメンバー、血管新生マーカーの一種、T細胞認識メラノーマ抗原(MART)、メラノーマ抗原コード化遺伝子(MAGE)のメンバー、前立腺特異抗原(PMSA)、小細胞肺癌抗原(SCLCA)、T/Tn抗原、ホルモン受容体、腫瘍抑制遺伝子抗原、細胞周期調節因子抗原、癌原遺伝子、癌原遺伝子受容体抗原、細胞増殖マーカー、細胞外マトリックスの分解に関連したプロテインキナーゼ、悪性形質転換関連因子、アポトーシス関連因子、ヒト癌抗原の一種などの細胞表面マーカーから選択されるものである。
【0095】
本発明の1実施形態において、バイオプローブは、ムチンファミリーのMUC−1受容体を標的とした1若しくはそれ以上のリガンド130を含む。別の実施形態において、バイオプローブは、HER−1、HER−2、HER−3、及びHER−4などのEGFRファミリーの少なくとも1つを標的にした1若しくはそれ以上のリガンド130を有する。MUC−1(ヒト上皮ムチン、CD277)は、高分子量であり、ほとんどの腺性及び上皮細胞系列によって発現されている膜貫通型ムチン糖タンパク質である。加えて、MUC−1は大きな細胞外ドメインを持っており、これは血流へ流される部分である。MUC−1は、その細胞外ドメインが細胞上の他の分子まで伸びて伸長した強固構造を形成するので、保護的な役割を担っている。MUC−1は、乳癌の80%を含む多くのヒト腺癌において高度に発現しており、悪い予後に関連している。ムチン(MUC−1及びMUC−2)発現は、腫瘍浸潤と関連している。MUC−1及びMUC−2発現は乳房の浸潤性腺癌と関連している。MUC−1はさらに多くの骨髄腫においても高レベルを示す。分化組織/細胞は異なるグリコフォームのMUC−1を産生する。悪性細胞におけるMUC−1の糖鎖付加は、正常細胞と比較してしばしば変化されている。MUC−1は、正常細胞でも見いだされるにも関わらず、本当に腫瘍特異的抗原と考えられており、腫瘍上のその異常な糖鎖付加は標的化の新しいエピトープを形成する。MUC−1の細胞外ドメインは血流へ流される。前記リガンド130は、細胞表面に発現した、流れず残留したMUC−1を標的とする。
【0096】
EGFRファミリーなどの成長因子受容体の過剰発現は、腫瘍を意味し、マクロファージ及び、腫瘍成長を導くことができるTNF(腫瘍壊死因子)などの細胞毒性因子の細胞毒性効果に対する細胞抵抗性が増加したことと関連する。HER−1/neu遺伝子によってコード化されたタンパク質は、170,000ダルトンタンパク質であり、HER−1と言及される。HER−2/neu遺伝子によってコード化されたタンパク質は、185,000ダルトンタンパク質であり、HER−2と言及される。両タンパク質は、細胞内ドメイン、2つのシステインリッチ繰り返しクラスタを含む膜貫通ドメイン、及び細胞内キナーゼドメインを有する。HER−2の細胞外ドメインは、血流へ流される。従って、リガンド130は、細胞の表面に発現した、流されず残留したHER−2を標的とする。
【0097】
卵巣癌及びその転移に対して、特異的マーカー或いはマーカー群は、例えば、ERBB2(HER−2)抗原及びCD64抗原の1つなどの細胞表面マーカーから選択される。卵巣癌及び/若しくは胃癌及びそれらの転移に対して、特異的マーカー或いはマーカー群は、例えば、多型上皮ムチン(PEM)などの細胞表面マーカーから選択される。卵巣癌及びその転移に対して、特異的なマーカー或いはマーカー群は、例えば、癌抗原125(CA125)或いはマトリックスメタロプロテアーゼ2(MMP−2)の一つなどの細胞表面マーカーから選択される。胃癌及びその転移に対して、特異的マーカー或いはマーカー群は、例えばCA19−9抗原及びCA242抗原の一つなどの細胞表面マーカーから選択される。
【0098】
非小細胞肺癌(NSCLC)、結腸直腸癌(CRC)及びそれらの転移に対して、特異的マーカー或いはマーカー群は、例えば、血管内皮増殖因子受容体(VEGFR)、抗原イディオタイプmAB、及び癌胎児抗原(CEA)擬態などの細胞表面マーカーから選択される。小細胞肺癌(SCLC)、悪性メラノーマ、及びそれらの転移の少なくとも1つに対して、特異的マーカー或いはマーカー群は、例えば、抗イディオタイプmAB或いはGD3ガングリオシド擬態などの細胞表面マーカーから選択される。メラノーマ癌及びその転移に対して、特異的マーカー或いはマーカー群は、例えば、メラノーマ関連抗原(MAA)などの細胞表面マーカーから選択される。小細胞肺癌及びその転移に対して、特異的マーカー或いはマーカー群は、例えば、小細胞肺癌抗原(SCLCA)などの細胞表面マーカーから選択される。
【0099】
結腸直腸癌(CRC)及び/若しくは局所的な進行性或いは転移性頭部及び/若しくは頸部癌に対して、特異的マーカー或いはマーカー群は、例えば、上皮成長因子受容体(EGFR)などの細胞表面マーカーから選択される。デューク(Duke's)結腸直腸癌(CRC)及びその転移に対して、特異的マーカー或いはマーカー群は、例えばEp−CAM抗原などの細胞表面マーカーから選択される。
【0100】
非ホジキンリンパ腫(NHL)及びその転移に対して、特異的マーカー或いはマーカー群は、例えばクラスタ解析/分化抗原群(CD)20抗原或いはCD22抗原などの細胞表面マーカーから選択される。B細胞慢性リンパ性白血病及び関連転移に対して、特異的マーカー或いはマーカー群は、例えば、CD52抗原などの細胞表面マーカーから選択される。急性骨髄性白血病及びその転移に対して、特異的マーカー或いはマーカー群は、例えば、CD33抗原などの細胞表面マーカーから選択される。
【0101】
前立腺癌及びその転移に対して、特異的マーカー或いはマーカー群は、例えば、前立腺膜特異的抗原(PMSA)など細胞表面マーカーから選択される。癌性髄膜炎及びその転移に対して、特異的マーカー或いはマーカー群は、例えば、血管内皮細増殖因子受容体(VEGFR)或いは例えばHMFGI(ヒト乳脂肪グロブリン)抗原などの上皮関連糖タンパク質の1つなどの細胞表面マーカーから選択される。
【0102】
肺癌、卵巣癌、結腸癌及びメラノーマ癌、及びそれらの転移に対して、特異的マーカー或いはマーカー群は、例えば、B7−H1タンパク質などの細胞表面マーカーから選択される。結腸癌、乳癌、肺癌、胃癌、子宮頸癌及び子宮癌、及びそれらの転移に対して、特異的マーカー或いはマーカー群は、例えば、TRAIL受容体−1タンパク質、タンパク質の腫瘍壊死因子受容体ファミリーのメンバーなどの細胞表面マーカーから選択される。卵巣癌、膵臓癌、非小細胞肺癌、乳癌、及び頭部及び頸部癌、及びそれらの転移に対して、特異的マーカー或いはマーカー群は、例えば、EGFR(上皮成長因子受容体)などの細胞表面マーカーから選択される。
【0103】
腫瘍血管供給の抗血管新生標的に対して、特異的マーカー或いはマーカー群は、例えば、インテグリンαvβ3、伸長血管の内皮細胞特異的な細胞表面マーカーなどの細胞表面マーカーから選択される。
【0104】
結腸癌及び膀胱癌及びそれらの転移の標的化に対して、特異的マーカー或いはマーカー群は、例えば、RAS、外部環境から核へとシグナルを伝達するシグナル分子などの細胞表面マーカーから選択される。RASの変異型は多くの癌に見いだされる。
【0105】
本発明の1実施形態において、リガンド130は、患者の免疫システムの疾患に関連した、予め決定された標的を標的化する。特定の標的150及び1若しくはそれ以上のリガンド130は、これに限定されるものではないが、ある種の免疫疾患に特異的である。リガンド130は、目的の細胞マーカー或いはマーカー群に親和性を有している。前記マーカー或いはマーカー群160/170は、それらが患者の免疫システムのT細胞或いはB細胞上の生存標的を表すようなものから選択される。リガンド130は、例えば、タンパク質、サイトカイン、ケモカイン、感染性生物、及びそれらと同等のものなどの患者の免疫システムの疾患に関連した標的に親和性を有している。
【0106】
患者の免疫システムの疾患に対して、特異的マーカー或いはマーカー群160/170は、細胞表面マーカーから選択される。標的細胞は、免疫システムのT或いはB細胞である。関節リウマチに対して、特異的マーカー或いはマーカー群は、例えば、CD52抗原の一つ、腫瘍壊死因子(TNF)及びCD25抗原などの細胞表面マーカーから選択される。関節リウマチ及び/若しくは血管炎に対して、特異的マーカー或いはマーカー群は、例えばCD4抗原などの細胞表面マーカーから選択される。血管炎に対して、特異的マーカー或いはマーカー群は、例えば、CD18抗原などの細胞表面マーカーから選択される。多発性硬化症に対して、特異的マーカー或いはマーカー群は、例えば、CD52抗原などの細胞表面マーカーから選択される。
【0107】
別の実施形態において、リガンド130は、病原体媒介性症状に関連した、予め決定された標的150を標的化する。特定の標的150及びリガンド130は、これに限定されるものではないが、あるタイプの病原体媒介性症状に特異的である。病原体は、例えば、細菌、ウイルス、微生物、真菌、及び寄生虫などのあらゆる疾患誘引因子として定義される。リガンド130は、病原体或いは病原体関連問題に親和性を有している。リガンド130は、病原体媒介性症状に関連した細胞マーカー或いはマーカー群に親和性を有している。前記マーカー或いはマーカー群は、それらが感染細胞上の生存標的を表すようなものから選択される。
【0108】
病原体媒介性症状に対して、バイオプローブを利用した治療法に対するリガンド130は、病原体自体を標的にするように選択される。細菌症状に対して、予め決定された標的は、例えば、大腸菌或いは炭疽菌の一つなどの細菌自体である。ウイルス症状に対して、予め決定された標的は、例えばサイトメガロウイルス(CMV)、エプスタイン−バーウイルス(EBV)、B型肝炎ウイルスなどの肝炎ウイルス、HIV、HIV−1或いはHIV−2などのヒト免疫不全ウイルス、ヘルペスウイルス6などのヘルペスウイルスの一つなどのウイルス自体である。寄生虫症状に対して、予め決定された標的は、例えば、クルーズトリパノソーマ、マンソン住血吸虫、日本住血吸虫、或いはブルセイトリパノソーマの一つなどの寄生虫自体である。真菌症状に対して、予め決定された標的は、例えば、コウジカビ、クリプトコッカスネオフォルマンス或いはリゾムコールなどの真菌自体である。
【0109】
病原体媒介性症状に対して、バイオプローブを利用した治療法に対するリガンド130は、細胞に感染した病原体の細胞マーカーを標的とするように選択される。HIVウイルスに対して、予め決定された標的は、HIV感染T細胞の表面に発現したCTLA4である。CTLA4は、HIVが放出される準備ができた時、感染細胞の外表面へ移動する。
【0110】
別の実施形態において、リガンド130は、望ましくない標的物質と関連した、予め決定された標的を標的化する。特定の標的150及びリガンド130は、これに限定されるものではないが、あるタイプの望ましくない標的に特異的である。望ましくない標的とは、望ましくない物質である標的である。望ましくない物質は、疾患或いは望ましくない症状に関連した物質であるが、これは正常状態にも存在する。例えば、前記望ましくない物質は、濃度の上昇を示す、若しくは疾患或いは望ましくない状態において変化されるものである。前記リガンド130は、前記望ましくない標的に対して、或いは前記望ましくない標的に関連した生物分子経路に対して親和性を有する。前記リガンド130は、前記望ましくない標的物質に関連した細胞マーカー或いはマーカー群に親和性を有する。
【0111】
望ましくない標的に対して、予め決定された標的150の選択は、本発明の治療方法において重要である。リガンド130は、疾患或いは望ましくない状態に関連した生物学的問題を標的化するように選択される。動脈硬化に対して、予め決定された標的は例えば、低密度リポタンパク質上のアポリポタンパク質Bである。望ましくない物質は、肥満に関連した脂肪組織或いはセルライト、或いは肥満に対する前駆体である。肥満に対する予め決定されたマーカー或いはマーカー群は、例えば、胃抑制ポリペプチド受容体及びCD36抗原の一つなどの細胞表面マーカーから選択される。別の望ましくない予め決定された標的は、凝集血液である。
【0112】
別の実施形態において、リガンド130は、患者への臓器移植に対する反応に関連した予め決定された標的を標的化するものである。特定の標的150及びリガンド130は、これに限定されるものではないが、ある種の臓器移植に特異的である。リガンド100は、臓器移植に対する反応に関連した生物分子に親和性を有する。前記リガンド130は、臓器移植に対する反応に関連した細胞マーカー或いはマーカー群に親和性を有する。前記マーカー或いはマーカー群は、それらが患者の免疫システムのT細胞或いはB細胞上の生存標的を表すようなものが選択される。
【0113】
臓器移植に対する反応に対して、リガンド130は、移植に対する免疫反応を標的化するように選択される。移植された臓器は、移植前或いは後に処理される。腎臓移植に対して、予め決定されたマーカー或いはマーカー群は、例えば、T細胞受容体(CD3)抗原、或いはCD18抗原などの細胞表面マーカーから選択される。腎臓及び骨髄移植に対して、予め決定されたマーカー或いはマーカー群は、例えば、CD52抗原などの細胞表面マーカーから選択される。肝臓及び骨髄移植に対して、予め決定されたマーカー或いはマーカー群は、例えば、CD154抗原及びCD8抗原の一つなどの細胞表面マーカーから選択される。移植耐性に対して、予め決定されたマーカー或いはマーカー群は、例えばCD4などの細胞表面マーカーから選択される。骨髄に対して、予め決定されたマーカー或いはマーカー群は、例えば、移植片対宿主疾患を避けるために移植前に骨髄からの十分な欠乏に対するT細胞のCD52などの細胞表面マーカーから選択される。異種移植或いは異種移植片に対して、予め決定されたマーカー或いはマーカー群は、例えばガラクトースなどである。ガラクトースは、ブタ臓器上には存在することが知られているが、ヒトでは存在しない。
【0114】
別の実施形態において、リガンド130は、患者における毒素に関連した予め決定された標的を標的化する。毒素は、これに限定されるものではないが、細菌毒素、植物毒素、昆虫毒素、動物毒素、及び人工毒素を含む、生物によって産生されたあらゆる毒として定義される。特定の標的150及びリガンド130は、これに限定されるものではないが、ある種の毒素に特異的である。前記リガンド130は、前記毒素に対する反応に関連した生物分子に親和性を有する。前記リガンド130は、前記毒性に対する反応に関連した細胞マーカー或いはマーカー群に親和性を有する。
【0115】
患者における毒素に対して、リガンド130は前記毒素を標的化するように選択される。細菌毒素表的は、例えば、コレラ毒素、ジフテリア毒素、及びボツリヌス菌毒素の一つである。昆虫毒素は、例えばハチ毒である。動物毒素は、例えばガラガラヘビ(Crotalus durissus terrificus)毒などの例えばヘビ毒である。
【0116】
別の実施形態において、リガンド130は、ホルモン関連疾患に関連した予め決定された標的を標的化する。特定の標的150及びリガンド130は、これに限定されるものではないが、特定のホルモン疾患に特異的である。前記リガンド130は、ホルモン或いはホルモン経路に関連した生物分子に親和性を有する。前記リガンド130は、ホルモン疾患に関連した細胞マーカー或いはマーカー群に親和性を有する。
【0117】
ホルモン関連疾患に対して、リガンド130は、細胞マーカー或いはマーカー群を標的にするように選択される。エストロゲン関連疾患或いは症状に対して、予め決定された標的は、例えばエストロゲン、若しくは例えばエストロゲン受容体などの細胞表面マーカー或いはマーカー群である。ヒト成長ホルモン病に対して、前記予め決定された標的は、例えばヒト成長ホルモンである。
【0118】
別の実施形態において、リガンド130は、非癌性疾患物質と関連した予め決定された標的を標的化する。特定の標的150及びリガンド130は、これに限定されるものではないが、特定の非癌性疾患物質に特異的である。前記リガンド130は、非癌性疾患物質と関連した生物分子に親和性を有する。前記リガンド130は、非癌性疾患物質と関連した細胞マーカー或いはマーカー群に親和性を有する。
【0119】
非癌性疾患物質に対して、前記リガンド130は、例えば、非癌性疾患沈着物及び前駆体沈着物の一つなどの予め決定された標的を標的化するように選択される。アルツハイマー病に対して、予め決定された標的は、例えばアミロイドBタンパク質及びその沈殿物、惜しくはアポリポタンパク質及びその沈殿物である。
【0120】
別の実施形態において、リガンド130は、タンパク質性病原体を標的化する。特定の標的150及びリガンド130は、これに限定されるものではないが、特定のタンパク質性病原体に対して特異的である。前記リガンド130は、タンパク質性病原体、或いはタンパク質性病原体に関連した生物分子に親和性を有する。前記リガンド130は、タンパク質性病原体に関連した細胞マーカー或いはマーカー群に親和性を有する。プリオン病(感染性海綿状脳症としても知られている)に対して、予め決定された標的は、例えばプリオンタンパク質3F4である。
【0121】
リガンド
本発明の1実施形態において、これに限定されるものではないが、抗体などの少なくとも1標的リガンドは、図1に説明されたように、バイオプローブ100の外側部分に配置される。標的リガンド130は、標的150を探し出し付着するものが選択される。
【0122】
図2は、コーティング120を有するサセプタ110を有するバイオプローブ100が1若しくはそれ以上の標的リガンド130によって標的(細胞など)150へ付着している実施形態を示したものである。リガンド130はさらに、放射性元素或いは潜在的な放射性元素も有する。
【0123】
標的150を有する細胞は、いくつかのタイプのマーカー160及び170を発現している。バイオプローブ100の特異性は、標的150を有する細胞上で、多くの他のマーカー或いは分子160を超えた標的マーカー160へのその付着によって表される。1若しくはそれ以上のバイオプローブ100は、リガンド130を介して前記細胞へ付着する。リガンド130は適応され、バイオプローブ100は、バイオプローブ100が細胞150上に外面的に残存するように設計される。一度細胞150へ結合したら、前記磁性ナノ粒子110は、吸収したエネルギーに反応して加熱する。例えば、前記磁性ナノ粒子110は、AMFに反応してヒステレシス損失を通じて加熱する。その熱は、例えば対流、伝導、放射線或いはこれら熱移動メカニズムの任意の組み合わせを介して、前記細胞150へとコーティング120或いは介在領域を通り抜けるものである。加熱された細胞150は、好ましくは回復不能な障害を引き起こすやり方で障害を受ける。バイオプローブ100が標的150を有する細胞内に取り込まれた場合、バイオプローブ100は、対流、伝導、放射線或いはこれら熱移動メカニズムの任意の組み合わせを介して、内部的に細胞150を加熱する。十分量のエネルギーがバイオプローブ100によって細胞150へ移動された場合、細胞150はネクローシス、アポトーシス、或いは他のメカニズムを介して死ぬ。
【0124】
本明細書での使用に適したリガンドは、これに限定されるものではないが、タンパク質、ペプチド、抗体、抗体断片、糖類、糖鎖、グリカン、サイトカイン、ケモカイン、ヌクレオチド、レクチン、脂質、受容体、ステロイド、神経伝達物質、クラスタ解析/分化抗原群(CD)マーカー、及びインプリントポリマー及びそれらと同等物を含む。好ましいタンパク質リガンドは、例えば細胞表面タンパク質、膜タンパク質、プロテオグリカン、糖タンパク質、ペプチド及びそれらと同等物を含む。好ましいヌクレオチドリガンドは、例えば、完全ヌクレオチド、相補的ヌクレオチド、及びヌクレオチド断片を含む。好ましいリガンドは、例えば、リン脂質、糖脂質及びそれらと同等物を含む。
【0125】
本発明の1実施形態において、リガンド130は、前記磁性粒子110或いは前記コーティング120と共有結合する或いは物理的な相互作用によって結合するものである。前記リガンド130は、前記磁性粒子110の非コーティング部分と共有結合或いは物理的な相互作用によって直接結合される。前記リガンド130は、前記磁性粒子110の非コーティング部分と共有結合或いは物理的な相互作用によって直接結合され、前記コーティング120によって部分的にカバーされる。前記リガンド130は、前記バイオプローブ100のコーティング部分と共有結合或いは物理的な相互作用によって結合される。前記リガンド130は、バイオプローブ100のコーティング部分へ介入される。
【0126】
共有結合は、リンカー分子で達成される。リンク反応において使用される機能基の例としては、アミン、スルフヒドリル、糖鎖、カルボキシル、ヒドロキシル、及びそれらと同等物を含む。リンク因子は、例えば、カルボジイミド、スルフォ−NHSエステルリンカー及びそれらと同等物などのホモニ機能性或いはヘテロニ機能性クロスリンク因子である。前記リンク因子はさらに、グルタルアルデヒドなどのアルデヒドクロスリンク因子でもある。前記リンク因子は、リガンド100が、特に前記リガンド150の活性領域が標的化に利用可能となるような好ましい方向性で、前記磁性粒子110或いは前記コーティング120へ連結するように選択される。物理的相互作用は、例えば、吸収、吸着或いはインターカレーション(介入)などの非共有結合性手段によって前記リンク分子及び前記リガンド100が前記磁性粒子110或いは前記コーティング120へ直接結合することを必要としない。
【0127】
利用される関連徴候に沿って、バイオプローブシステムのいくつかの例示的実施形態を表1に表した。
【0128】
【表1】







【0129】
本発明の方法は、これに限定されるものではないが、骨髄癌、肺癌、血管癌、神経癌、結腸癌、卵巣癌、乳癌及び前立腺癌などのあらゆるタイプの癌、AIDS及び自己免疫症状などの免疫システムの疾患、及びHIV、マラリア及び結核などの病原体媒介性疾患、及び有害血管新生、アミロイドーシス、再狭窄、血管症状、肥満、毒素及び他の異常細胞或いは組織増殖などの望ましくない問題を含む、様々な徴候を治療するために使用される。本明細書に記載されたバイオプローブシステムは、表1に記載した関連徴候以外の他の徴候を治療するために使用される。
【0130】
本発明において使用される標的、マーカー及びリガンドは、これに限定されるものではないが、上述したもの、表1に記載されたもの、さらには米国特許第10/176,959号及び10/200,082号である関連特許出願に開示されたもの(これらはこの参照によって本明細書に組み込まれる)を含む。
【0131】
バイオプローブの投与
治療される望ましい領域へ前記バイオプローブ100を投与する方法及び用量は、これに限定されるものではないが、疾患物質のタイプと位置に依存する。前記バイオプローブ100のサイズ範囲は、滅菌のための精密濾過法を考慮に入れる。投与方法は、例えば、洗浄、スポンジでのすすぎとしての洗浄液、或いは周術期投与技術としての他の外科的布である。投与の他の方法は、血管内注射、静脈内注射、腹腔内注射、皮下注射、及び筋肉内注射を含む。前記バイオプローブ100は、例えば、水、生理食塩水、リンガー液、ブドウ糖、アルブミン溶液及び油などの溶媒における注射可能な形態(懸濁液、乳濁液)で処方される。前記バイオプローブ100はさらに、軟膏或いはローションを介した局所的適用を通じて、パッチを通じて経皮的に、ピル或いはカプセルとして経口的に消化される或いは液体に懸濁される、若しくは坐薬形態において直腸性に挿入することによっても患者へ投与される。バイオプローブ100はさらに、口或いは鼻を介した吸引に適したエアロゾル或いはプレエアロゾル処方で懸濁される。一度患者へ投与されると、標的部位への前記バイオプローブ100の運搬は、前記バイオプローブ100の磁性特性に起因する、適用静的磁場によって補助される。補助運搬は、標的細胞の位置に依存する。前記バイオプローブはさらに、他の方法を利用して患者へ運搬される。例えば、前記バイオプローブ100は、患者に経口的に投与される、或いは直腸性に投与される。
【0132】
エネルギー源
【表2】

【0133】
放射線療法との組み合わせでの標的温熱療法
放射線治療としても言及される放射線療法は、電離放射線を利用した癌及び他の疾患の治療方法である。電離放射線は、それらの遺伝子物質を損傷することによって、治療される領域(「標的組織」)において細胞を障害或いは破壊し、これらの細胞が増殖を続けられないようにするエネルギーを貯蔵している。放射線は癌細胞及び正常細胞両者を損傷するにも関わらず、後者は細胞自身及び機能を適切に修復することができる。放射線療法は、皮膚、舌、咽頭、脳、乳房或いは子宮頸部の癌などの局在化固形腫瘍を治療するために使用される。これはさらに、白血病及びリンパ腫(それぞれ造血細胞及びリンパシステムの癌)を治療するためにも使用され得る。本発明の1実施形態において、放射線療法或いは放射線治療は、本明細書で開示された標的温熱療法と組み合わせで使用される。放射線療法は、標的治療投与の前に少なくとも1回、最中に少なくとも部分的に、或いは後に少なくとも1回、若しくはそれらの組み合わせで適用される。
【0134】
一般的に使用される放射線治療の1タイプは、x線或いはガンマ線に関連する。X線は、癌を治療するために使用される光子放射線の第一形態であった。それらが所有するエネルギー量に依存して、光線は身体の表面或いは深部の癌細胞を破壊するために使用され得る。X線ビームのエネルギーが高くなるにつれて、前記標的組織へのx線の透過は深くなる。直線加速器及びベータートロンは、益々大きなエネルギーのx線を産生する機械である。放射線(x線など)の焦点を癌部位へ合わせるための機械の使用は、外部ビーム放射線療法として言及される。これらのビームは外界から遮断され、特別な遮断は確定した身体領域へこれらのビームを「焦点化」するために使用される。本発明の1実施形態において、外部ビーム放射線療法は、本明細書に開示された標的温熱療法との組み合わせで使用される。標的温熱療法及び放射線療法両者が同時に使用された場合、AMFシステムは前記ビームが入るための分離開口部を有する。或いは、前記ビームは患者の開口部(患者ガントリー)を介して直接入る。術中放射線治療は、大量の外部放射線を手術中に腫瘍及び周辺組織へ直接向ける技術である。
【0135】
ガンマ線は特定の元素(ラジウム、ウラニウム、及びコバルト(60)など)として自然発生的に産生され、それらが分解或いは崩壊する時に放射線を放出する。各元素は、特定の割合で破壊し、ガンマ線及び他の粒子の形態でエネルギーを発する。X線及びガンマ線は一般的に癌細胞に対して同じ効果を有する。
【0136】
別の試験中のアプローチは、粒子線放射線療法である。このタイプの治療は、動きの速い素粒子を使用して局在化癌を治療する。粒子加速器は、この手順に必要な粒子を産生し加速させるために使用される。いくつかの粒子(中性子、パイ中間子及び重イオン)は、組織を通過する経路に沿ってx線或いはガンマ線より大きなエネルギーを貯蔵するため、それらが接触した細胞へより大きな損傷を与える。このタイプの放射線はしばしば、高線エネルギー付与(高LET)放射線として言及される。本発明の1実施形態において、高LET治療は本明細書で開示された標的温熱療法との組み合わせで使用される。
【0137】
癌細胞へ放射線を運搬するための別の技術は、腫瘍或いは体腔へ直接放射線移植片を置くことである。これは、内部放射線療法として言及される(密封小線源治療、間質性照射及び腔内照射は内部放射線療法の一種である)。この治療の間、放射線用量は小さい領域に集中させ、その手順は患者を数日入院させる必要がある。本発明の1実施形態において、内部放射線療法は、本明細書で開示された標的温熱療法との組み合わせで使用される。前記移植片は、渦電流或いはヒステレシス加熱によって標的療法投与の間加熱する物質を有している、若しくはプラスチック、セラミック、ガラス、或いは移植ヒト組織などのAMF照射下でも加熱しない物質を有している。
【0138】
本発明の1実施形態において、放射線標識抗体は、標的温熱療法との組み合わせで癌部位へ直接放射線量を運搬する(放射免疫療法)。図1に説明したように、少なくとも1つの放射性同位体140はバイオプローブ100へ付着させる。そのようなバイオプローブは二重療法バイオプローブとなり得る。一度体内へ注射されたら、前記抗体は活動的に癌細胞を探し出し、放射線の細胞殺傷(細胞毒性)作用によって癌細胞を破壊する。
【0139】
本明細書で使用するのに適した放射性同位体の例としては:
モリブデン−99:テクネチウム−99mを産生するために発生器において「親」として使用され、核医学において最も広範囲に使用される同位体である、
テクネチウム−99m:特に骨格及び心筋を画像化するために使用され、さらには脳、甲状腺、肺(灌流及び換気)、肝臓、脾臓、腎臓、胆嚢、骨髄、唾液腺及び涙腺、心臓血液プール、感染及び多くの専門化医学研究を画像化するために使用される、
クロム−51:赤血球を標識化し、胃腸タンパク質損失を定量化するために使用される、
コバルト−60:外部ビーム放射線療法に使用される、
銅−64:ウィルソン病及びメンケス病などの銅代謝に影響を及ぼす遺伝的疾患を研究するために使用される、
ジスプロシウム−165:関節炎の滑膜切除術治療に対する凝集水酸化物として使用される、
イッテルビウム−169:脳における脳脊髄研究に使用される、
ヨウ素−125:癌密封小線源治療(前立腺及び脳)において使用され、さらには腎臓濾過速度の診断評価のために、及び足の深部静脈血栓症を診断するために使用される。さらに、少量のホルモンの存在を示すための放射免疫アッセイにおいて広く使用される、
ヨウ素−131:甲状腺癌を治療する場合、及びその甲状腺を画像化する場合に広く使用され;さらに異常肝臓機能、腎臓血流及び尿路障害の診断にも使用される、
イリジウム−192:内部放射線療法源として使用するためのワイヤー形態で供給される、
鉄−59:脾臓における鉄代謝を研究するために使用される、
リン−32:真性多血症(過剰な赤血球)の治療において使用される。これはベータ放射体である、
カリウム−42:冠血流における交換可能なカリウムの決定に対して使用される、
レニウム−188(タングステン−188由来):血管形成術バルーンからのベータ照射冠動脈に対して使用される、
サマリウム−153:骨に留まる二次癌の疼痛を軽減するのに非常に効果的である。これはQuadramet(商標)として商業的に利用可能である。さらに、前立腺癌及び乳癌にも非常に効果的である。これはベータ放射体である、
セレニウム−75:消化酵素の産生を研究するためにセレノメチオニンの形態で使用される、
ナトリウム−24:体内の電解質の研究に使用される、
ストロンチウム−89:前立腺癌の疼痛を軽減するのに非常に効果的である。ベータ放射体である、
キセノン−133、キセノン−127:肺性(肺)換気研究に使用される、
イットリウム−90:癌治療に対して、及び大関節における関節炎の治療に対するケイ素コロイドとして使用される。
【0140】
標的温熱療法との組み合わせにおける放射線療法はさらに、単独で、或いは化学療法、手術或いはそれら両者との組み合わせでも使用される。
【0141】
本発明において使用するエネルギー源は、適切な周波数でAMFを産生できる、或いは前記バイオプローブに対して適切な周波数でマイクロ波を産生し、そのエネルギーを加熱に変換できるあらゆる機械を含む。本発明の1実施形態において、エネルギーは、前記バイオプローブへ運搬され、標的細胞(群)及び前記標的細胞(群)の周辺の細胞或いは組織へ熱を伝達する。別の実施形態において、付加的なエネルギー源は、バイオプローブを電離放射線(中性子、アルファ、ベータ、ガンマなど)の源に変換するためにAMF或いはマイクロ波の組み合わせで使用される。図3は、対象の身体或いは身体部分へエネルギーを伝達するエネルギー源を図式的に説明したものである。本明細書で有用ないくつかの例示的なエネルギー形態及びエネルギー源は、表2に記載されている。例えばAMF或いはAMFを有する組み合わせなどの異なる形態のエネルギーは、表2に記載されたもののような様々なメカニズムを用いて作られる。その表はさらに、異なるエネルギー形態及び治療メカニズムに対して妥当である、以下の記載における対応するセクションも記載している。
【0142】
一般的に、図3に説明されたように、操作者270は、例えばケーブル220を介してエネルギー源210へエネルギーを運搬する、例えば制御装置260を介してエネルギー発生装置250を調節する。エネルギー源210は、エネルギーをバイオプローブのサセプタへ伝達し、標的細胞、及び対象230における前記バイオプローブ周辺の細胞或いは組織を加熱する或いは影響を及ぼす。
【0143】
本明細書に記載されたAMFエネルギー源はさらに、例えば、米国特許第10/176,950号及び第10/200,082号である特許出願において開示されたバイオプローブなどの、他のタイプのバイオプローブを加熱するためにも使用されるということは当然のことであろう。さらに、米国特許第10/176,950号及び第10/200,082号である特許出願において開示された前記エネルギー源はさらに本発明のバイオプローブを加熱するためにも使用されるということは当然のことであろう。
【0144】
交流磁場(AMF)加熱
本発明のいくつかの実施形態において、AMFエネルギーはバイオプローブと共に使用され、前記バイオプローブの磁性ナノ粒子においてヒステレシス損失メカニズムを通じて治療加熱を産生する。
【0145】
本発明の1実施形態において、図4に説明されたように、治療システム300は、AMF発生器を有しており、これは例えばキャビネット370内に設置されており、磁気回路330によって対象310内の特異的位置へ導かれるAMFを産生するように設計されている。対象310は、X−Y水平方向及び垂直方向軸に位置付けられたベッド340上に置かれている。位置付けされたベッド340は、ベッドコントローラー350を介して水平及び垂直に位置付けされ得る。AMF発生器は磁気回路330においてAMFを産生し、これは、空隙及び対象310の望ましい治療領域を通過して1磁極面320で磁気回路330から出て、反対側の磁極面320を通じて磁気回路330へ再び入り、回路を完成させるものである。操作者或いは医学技術者は好ましくはコントロールパネル360を介してAMF特徴及びベッド位置を調節しモニタリングする。AMFがRF発生器によって発生された場合、そのAMFの周波数は好ましくは約80kHz〜約800kHzの範囲である。
【0146】
他のアプローチはAMFを発生させるために使用され、集中及び/若しくは均一場を提供する。1実施形態において、磁気ソレノイドコイル410は、ヒト肢或いは小動物など、直径に対する長さの比が大きい組織においてバイオプローブを加熱するのに特に有用である。これは図5に説明されており、ここでは磁気ソレノイドコイル410の横断面を示している。前記コイル410は、輪状で低磁気抵抗磁気物質のドーナッツ型リング420を有しており、これは例えば約150kHzの望ましい周波数で作動する磁気コアに対して特異的に編成される。そのような低磁気抵抗磁気物質の1例としては、Fluxtrol(商標)(Fluxtrol Manufacturing Inc.,Auburn Hills,ミシガン州、米国から商業的に利用可能である)である。
【0147】
低磁気抵抗磁気物質の長さで作られた磁束集束バー400は、ソレノイドコイル410の外径の円周の約25%覆うように位置付けされ、前記リング420からソレノイドコイルの反対端まで伸びている。前記磁束集束バー400は、前記リング420と同じ物質から作られる、或いは異なる物質から作られる。例えば、前記バー400は、Ferrotron(商標)(Fluxtrol Manufacturing Inc.から商業的に利用可能である)から作られる。
【0148】
前記リング420及び集束バー400は、ヒト或いは動物の身体、若しくは身体部分の縮小した横断面を磁場に曝すパターンにおいて磁束430へ向けられている。渦電流加熱は、前記磁束430において曝露組織の横断面の平方に比例するため、曝露断片のサイズを減少することは都合が良い。このアプローチは、減少した渦電流加熱の対象への適用に対して、より高い磁場強度を可能にする。加えて、環状ドーナッツ型リング420及び集束バー400は、ソレノイドコイル400の著しく外側に磁場強度を生じさせる。磁気ソレノイドコイル410は、頭部及び重要な臓器などの対象の非標的部分を保護しながら、AMFを集束させる。
【0149】
本明細書で使用する磁気サセプタは一般的に、エネルギー源によって供給されたAMFエネルギー、及びAMFエネルギーに曝された場合の加熱に感受性を有しており;アーク生体適合性;リガンドが化学的に或いは物理的に付着できる機能基を有する(若しくは有するように修飾され得る)表面を持っている。本発明の1実施形態において、磁気ナノ粒子コアを有するバイオプローブは、生体適合性コーティング物質によって取り囲まれている。コアコーティング物質にはたくさんの可能な組み合わせが存在する。例えば、コーティング物質としての金は、生体適合性でありながら、前記コア物質における酸化などの化学変化を阻止する保護性コーティングを形成するので、特に有用である。さらに、金はAMF加熱に関連した渦電流加熱を増強するための優れた伝導体として働く。
【0150】
保護性コーティングを必要とする磁気サセプタ電流加熱のタイプとしては、鉄、コバルト、他の磁性金属、及びそれらの不安定酸化物を含む。後者の例としては、磁鉄鉱Fe3O4であり、これは更なる酸化を受け磁赤鉄鉱(γ−Fe2O3)を形成し、最終的には/或いは赤鉄鉱(α−Fe2O3)を形成するものである。鉄及びコバルトは例えば、酸化などの化学反応に感受性を有しており、酸化によって著しく変化する磁気特性を有している。保護性コーティングの使用は、前記コア物質がin vivoでヒト及び動物に対して毒性リスクを有しているような実施形態において特に好ましい。従って、金コーティング物質の使用は、コア物質を化学攻撃から保護するために、及び対象をコア物質の毒性効果から保護するために特に好ましい。
【0151】
本発明の1実施形態において、前記金コーティングは、金表面と適切なリガンドとの間に化学結合が形成されるような、チオール化学を介して化学的に修飾される。例えば、有機チオール部位は、前記金へ結合され、その後、少なくとも1つのシラン、カルボキシル、アミン、或いはヒドロキシル基、若しくはそれらの組み合わせを用いて前記有機チオール部位へ前記リガンドが連結する。前記コーティング物質の表面を修飾するための他の化学方法も利用される。
【0152】
別の実施形態において、窒素をドープしたMnクラスタは、磁気サセプタとして使用される。MnN及びMnxNy(x及びyは0でない数字である)などの、これら窒素をドープしたMnクラスタは、強磁性体であり、大きな磁気モーメントを有している。密度汎関数理論に基づいた計算は、小さなMnクラスタの安定性及び磁気特性が窒素の存在下で根本的に変化され得るということを示している。それらの結合エネルギーが実質的に増強されるだけでなく、Mn部位での磁気モーメント間の連結がそのサイズ或いは形に関係なく強磁性体を維持している。
【0153】
別の実施形態において、Nd1−xCaxFeO3は磁気サセプタとして使用される。弱い強磁性の自然発生的磁化は、Ca含量が増加するにつれて、或いは粒子サイズが増加するにつれて減少する。
【0154】
例えば、Co36C64、Bi3Fe5O12、BaFe12O19、NiFe、CoNiFe、Co−Fe3O4、及びFePt−Agの超常磁性粒子の凝集(ここにおいて前記凝集の集合状態は磁気ブロッキングを誘導する)などの他の物質もさらに、本発明のサセプタとして使用される。
【0155】
マイクロ波共振加熱
原子、分子及び結晶は、エネルギー吸収が効率的に達成される共振振動数を有していることはよく知られている。一般的に、共振加熱は、標的物質が比較的低い電源から大量のエネルギーを吸収するため、優れた利点を提供する。従って、身体組織を含む非標的物質(前記標的物質とは共振周波数が異なる)は、同程度では加熱されない。従って、物質は電磁気エネルギースペクトルにおける特定の共振周波数を利用するように選択される。サセプタ物質は、前記物質の内部化学結合が特定の周波数で共振するようなものが選択される。
【0156】
共振加熱はさらに、原子、分子或いは肉眼的長さスケールでの磁気、電気或いは電気双極子構造を有する物質とのマイクロ波エネルギーの相互作用を利用することによって達成され得る。上述された加熱の直接的なモードに加えて、共振加熱は間接的に使用される。本発明の1実施形態において、バイオプローブとして使用する物質は、それらが付着された組織の共振周波数におけるシフトを誘導するであろう、磁気或いは電気特性を有するようなものが選択される。従って、前記バイオプローブに非常に近接した組織の分子は、適切な周波数に変えた適用エネルギー場において好ましく加熱されるであろう。
【0157】
前記エネルギーは、標的細胞、標的組織、全身、体外で(対象の身体の外側で)、或いはそれらの任意の組み合わせで適用され得る。
【0158】
体外治療
本発明の1実施形態において、対象は体外治療を介して治療される。前記バイオプローブは、対象から物質を除去し、前記物質をエネルギー源に曝し、前記物質を体に戻すことによって疾患物質を溶解し、変性させ、損傷するために使用される。前記バイオプローブは、対象の身体或いは身体部分へと導入され、次に抽出された前記物質に沿って前記対象から除去される。前記バイオプローブは、治療後に抽出された物質とは分離される。別の実施形態において、前記バイオプローブは、抽出された物質が対象の身体或いは身体部分の外側にある間に、抽出された物質へ導入される。例えば、抽出された物質が対象の血液である場合、前記バイオプローブは、エネルギー源に曝される前に血管循環システムへ、或いは体外の血液循環へ導入される。
【0159】
最初に血清或いは血漿へ運ばれる前記バイオプローブ/標的複合体が標的である実施形態において、前記血清或いは血漿は他の血液成分からは体外的に分離され、前記標的を破壊する或いは不活性化するようにエネルギー源へ曝され、対象の身体へ血液を戻す前に他の血液成分と再度組み合わされる。前記バイオプローブは、血管循環システム、体外の血液循環、或いは分離後の血清或いは血漿へと導入される。
【0160】
別の実施形態において、前記バイオプローブは、体外の血液循環若しくは血清或いは血漿流が通過する血管或いはカラムに含まれている。前記血管或いはカラムは、前記血液を対象の身体へ戻す前に、前記標的細胞或いは抗原を破壊或いは不活性化するようにエネルギー源へ曝される。
【0161】
体外的に前記バイオプローブへエネルギーを供給する利点は、より高い温度で加熱する及び/若しくは周辺身体組織に対する加熱及び損傷を最小限にする一方、有効性をより素早く増強するように加熱する能力、及び前記エネルギー源からの前記エネルギーへの身体の曝露を軽減する能力を含む。前記バイオプローブが対象の体外の血液循環、身体から抽出された前記血清或いは血漿へ導入される実施形態において、バイオプローブは身体へ直接導入される必要はなく、より高い濃度のバイオプローブは標的に導入され得る。さらに、体外的に治療される前記対象の一部は、治療効果が軽減することなくエネルギーを前記バイオプローブへ提供する一方で、多くの適用可能な方法を用いて外部的に冷却される。加えて、冷却はエネルギーの投与前、及び/若しくは後に行われる。
【0162】
処理されたバイオプローブ及び関連標的は対象の身体へ戻す必要はない。例えば、前記バイオプローブ及び関連標的が対象から抽出された血液に含まれている場合、前記処理されたバイオプローブ及び関連標的は、対象の身体へ血液を戻す前に血液から分離されている。前記バイオプローブが磁気成分を含んでいる実施形態において、前記バイオプローブ及び関連標的を含む体液は、前記バイオプローブ及び関連標的を抽出された身体物質から分離するために、磁場勾配を通過させる。そうすることで、対象の身体へ戻されたサセプタ及び治療された疾患物質の量は減少する。
【0163】
体外治療の別の実施形態において、治癒のために選択された組織は、例えば開腹手術手順の間に、対象の身体から完全に或いは部分的に除去される。前記組織は、身体に連結したまま残る、或いは治療後解剖し再接着され得る。別の実施形態において、前記組織は1ドナー対象の身体或いは身体部分から除去され、治療後レシピエント対象へ移植される。
【0164】
本発明の上記した記載はヒト対象の観点から示されているが、本発明は哺乳類、死体及びそれらと同等物などの他の対象への適用可能であるということは当然である。
【0165】
上述したように、本発明は疾患物質を治療するための温熱療法組成物、及びそのような組成物を利用した標的療法に適用可能である。本発明は、上述した特定の実施形態に限定されると考えられるものではなく、添付された請求項においてかなり正確に明記されたような本発明の全観点をカバーすると理解されるべきである。様々な修飾物、同等な手順、更には本発明が適用可能な多数の構造は、本発明が本明細書のレビューを受ける本分野の当業者には容易に明らかである。請求項はそのような修飾物及び装置をカバーすることを意図している。
【図面の簡単な説明】
【0166】
【図1】図1は、本発明の実施形態に従った、バイオプローブ配置を図式的に説明したものである。
【図2】図2は、本発明の実施形態に従った、疾患細胞表面へ結合した標的特異的バイオプローブを図式的に説明したものである。
【図3】図3は、本発明の実施形態に従った、治療システムを図式的に説明したものである。
【図4】図4は、本発明の実施形態に従った、治療システムを図式的に説明したものである。
【図5】図5は、AMFエネルギー源として用いたソレノイドコイルの横断面を図式的に説明したものである。
【特許請求の範囲】
【請求項1】
磁性組成物であって、
a)周波数約80kHz〜800kHz、振幅約7.98kA/m〜104kA/m、及び温度約270〜380Kの交流磁場に曝された場合に加熱する少なくとも1つの安定単磁区粒子を有する磁性ナノ粒子と、
b)コーティングと
を有する磁性組成物。
【請求項2】
請求項1記載の磁性組成物において、前記コーティングはデキストランを有するものである。
【請求項3】
請求項1記載の磁性組成物であって、この磁性組成物は、さらに、
放射性同位体、潜在的な放射性同位体、化学療法剤、或いはそれらの任意の組み合わせを有するものである。
【請求項4】
請求項3記載の磁性組成物において、前記放射性同位体は、イオジン−131、コバルト−60、イリジウム−192、イットリウム−90、ストロンチウム−89、サマリウム−153、レニウム−186、テクネチウム−99m、或いはそれらの任意の組み合わせである。
【請求項5】
請求項3記載の磁性組成物において、前記潜在的な放射性同位体は、中性子、プロトン、電子、或いは高エネルギー光子に対して高い吸収断面を有する同位体である。
【請求項6】
請求項5記載の磁性組成物において、前記潜在的な放射性同位体は、中性子に対して高い吸収断面を有している同位体であり、ホウ素−10、サマリウム−149、ガドリニウム−157及びガドリニウム−155などのランタニド、或いはそれらの任意の組み合わせの一つである。
【請求項7】
請求項6記載の磁性組成物において、望ましい治療領域は、AMF温熱療法との組み合わせで、中性子、プロトン、電子、或いは高エネルギー光子に曝され、前記潜在的な放射性同位体を活性化するものである。
【請求項8】
請求項3記載の磁性組成物において、前記化学療法剤は、ドキソルビシン、シスプラチン、或いはそれらの任意の組み合わせの一つである。
【請求項9】
磁性組成物であって、
a)i)周波数約80kHz〜800kHz、振幅約7.98kA/m〜104kA/m、及び温度約270〜380Kの交流磁場に曝された場合に明らかに阻害されるような、集合磁気状態を示す超常磁性粒子の凝集体、若しくはii)安定単磁区粒子及び超常磁性粒子の凝集体であって、前記超常磁性粒子の特徴的な緩和時間は増加するような集合磁気状態を示すものであり、この凝集体は、周波数約80kHz〜800kHz、振幅約7.98kA/m〜104kA/m、及び温度約270〜380Kの交流磁場に曝された場合に明らかに阻害されるものである、安定単磁区粒子及び超常磁性粒子の凝集体、のいずれかを有する磁性ナノ粒子と、
b)コーティングと
を有する磁性組成物。
【請求項10】
請求項9記載の磁性組成物において、前記コーティングはデキストランを有するものである。
【請求項11】
請求項10記載の磁性組成物であって、この磁性組成物は、さらに、
放射性同位体、潜在的な放射性同位体、化学療法剤、或いはそれらの任意の組み合わせを有するものである。
【請求項12】
請求項11記載の磁性組成物において、前記放射性同位体は、イオジン−131、コバルト−60、イリジウム−192、イットリウム−90、ストロンチウム−89、サマリウム−153、レニウム−186、テクネチウム−99m、或いはそれらの任意の組み合わせである。
【請求項13】
請求項11記載の磁性組成物において、前記潜在的な放射性同位体は、中性子、プロトン、電子、或いは高エネルギー光子に対して高い吸収断面を有する同位体である。
【請求項14】
請求項13記載の磁性組成物において、前記潜在的な放射性同位体は、中性子に対して高い吸収断面を有している同位体であり、ホウ素−10、サマリウム−149、ガドリニウム−157及びガドリニウム−155などのランタニド、或いはそれらの任意の組み合わせの一つである。
【請求項15】
請求項14記載の磁性組成物において、望ましい治療領域は、AMF温熱療法との組み合わせで、中性子、プロトン、電子、或いは高エネルギー光子に曝され、前記潜在的な放射性同位体を活性化するものである。
【請求項16】
請求項11記載の磁性組成物において、前記化学療法剤は、ドキソルビシン、シスプラチン、或いはそれらの任意の組み合わせの一つである。
【請求項17】
患者を治療する方法であって、
a)患者の少なくとも一部に請求項1記載の磁性組成物を投与する工程と、
b)交流磁場(alternating magnetic field:AMF)を前記磁性組成物に適用する工程であって、前記磁性物質を誘導的に加熱する、前記適用する工程と
を有する方法。
【請求項18】
請求項17記載の方法において、標的は癌、対象の血管システムの疾患、疾患原因病原体、中枢神経システム疾患、或いは非癌性疾患物質と関連するものである。
【請求項19】
請求項18記載の方法において、癌に関連した前記標的は、マーカーを有するものであり、このマーカーは、a)血管内皮細胞増殖因子受容体(vascular endothelial growth factor receptor:VEGFR)ファミリーのメンバー、b)癌胎児抗原(carcinoembryonic antigen:CEA)ファミリーのメンバー、c)非グリコシル化DF3抗原、d)上皮細胞成長因子受容体(epidermal growth factor receptor:EGFR)ファミリーのメンバー、e)細胞性接着分子、f)マトリックスメタロプロテアーゼ、g)糖タンパク質抗原、h)アンジオジェン(angiogen、血管新生促進因子)、i)前立腺特異的膜抗原(prostate specific membrane antigen:PSMA)、j)小細胞肺癌抗原(small cell lung carcinoma antigen:SCLCA)、k)ホルモン受容体、l)腫瘍抑制遺伝子抗原、m)細胞周期調節因子抗原、n)癌原遺伝子抗原、o)癌原遺伝子受容体抗原、p)増殖マーカー、q)悪性形質転換関連因子、r)アポトーシス関連因子、s)ヒト癌抗原、t)インテグリン、u)カリクレイン、v)胎盤成長因子受容体(placental growth factor receptor:PGFR)、w)アデノウイルス細胞表面受容体、x)肝細胞増殖因子受容体(hepatocyte growth factor receptor:HGFR)、y)チロシンキナーゼ、z)サイトケラチン上皮マーカー、aa)増殖細胞核抗原(proliferating cell nuclear antigen:PCNA)、bb)膜関連シアリダーゼ、cc)癌細胞シグナルメディエーター、dd)シクラーゼ−C受容体、ee)トランスフォーミング増殖因子受容体(transforming growth factor receptor:TGFR)、ff)血小板由来増殖因子受容体(platelet derived growth factor receptor:PDGFR)、gg)コバラミン受容体、hh)グリオーマチャネル、ii)脳特異的コンドロイチン硫酸プロテオグリカン、jj)カテニン、kk)MUC型ムチンファミリー受容体のメンバー、ll)クラスタ指定/分化抗原群(cluster designation/differentiation(CD))抗原ファミリーのメンバー、mm)タンパク質抗原、nn)サイトカイン受容体、oo)メソセリン(mesothelin)受容体、或いはpp)a)〜oo)の任意の組み合わせ、である。
【請求項20】
請求項19記載の方法において、前記マーカーに対するリガンドは、a)ポリクローナル抗体、b)モノクローナル抗体、c)キメラ抗体、d)ヒト化抗体、e)ヒト抗体、f)組換え抗体、g)二重特異性抗体、h)抗体断片、i)組換え単鎖抗体断片、或いはj)a)〜i)の任意の組み合わせである。
【請求項21】
請求項19記載の方法において、前記マーカー上皮細胞増殖因子受容体(epidermal growth factor receptor:EGFR)は、HER−1、HER−2、HER−3、HER−4、EGFRvIII、或いはそれらの任意の組み合わせを有するものである。
【請求項22】
請求項20記載の方法において、前記リガンドは、マーカーHER−2に対する抗体、マーカーHER−2に対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項23】
請求項22記載の方法において、前記マーカーHER−2に対する抗体の変異体は、F5scFv、IDM−1(MDX−210)、或いはそれらの任意の組み合わせである。
【請求項24】
請求項20記載の方法において、前記リガンドは、マーカーEGFRvIIIに対する抗体、マーカーEGFRvIIIに対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項25】
請求項24記載の方法において、前記マーカーEGFRvIIIに対する抗体の変異体は、Ua30:2、L8A4、DH8.3、81C6、或いはそれらの任意の組み合わせである。
【請求項26】
請求項19記載の方法において、前記マーカーMUC型ムチンファミリー受容体は、MUC−1、MUC−2、MUC−3、TAG−72、ヒト乳脂肪小球受容体、或いはそれらの任意の組み合わせを有するものである。
【請求項27】
請求項20記載の方法において、前記リガンドは、マーカーMUC−1に対する抗体、マーカーMUC−1に対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項28】
請求項20記載の方法において、前記リガンドは、マーカーTAG−72に対する抗体、マーカーTAG−72に対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項29】
請求項28記載の方法において、前記マーカーTAG−72に対する抗体の変異体は、B72.3である。
【請求項30】
請求項20記載の方法において、前記リガンドは、マーカーCEAに対する抗体、マーカーCEAに対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項31】
請求項30記載の方法において、前記マーカーCEAに対する抗体の変異体は、MFE−23scFvである。
【請求項32】
請求項19記載の方法において、前記マーカークラスタ指定/分化抗原群(cluster designation/differentiation)タンパク質はCD44を有するものであり、CD44は細胞性接着分子として働くものである。
【請求項33】
請求項19記載の方法において、前記マーカーサイトカイン受容体は、インターロイキン(interleukin:IL)ファミリーの少なくとも1つのメンバーを有するものである。
【請求項34】
請求項20記載の方法において、前記リガンドは、マーカーIL13に対する抗体、マーカーIL13に対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項35】
請求項19記載の方法において、前記マーカーマトリックスメタロプロテアーゼは、マトリックスメタロプロテアーゼ9(matrix metalloproteinase 9:MMP9)を有するものである。
【請求項36】
請求項19の方法において、前記マーカー糖タンパク質抗原は、43kD膜関連糖タンパク質抗原、40kD糖タンパク質抗原、或いはそれらの任意の組み合わせを有するものである。
【請求項37】
請求項20記載の方法において、前記リガンドは、マーカー43kD膜関連糖タンパク質に対する抗体、マーカー43kD膜関連糖タンパク質に対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項38】
請求項37記載の方法において、前記マーカー43kD膜関連糖タンパク質に対する抗体の変異体は、323/A3である。
【請求項39】
請求項20記載の方法において、前記リガンドは、40kD糖タンパク質抗原に対する抗体、40kD糖タンパク質抗原に対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項40】
請求項39記載の方法において、前記40kD糖タンパク質抗原に対する抗体の変異体は、NR−LU−10である。
【請求項41】
請求項19記載の方法において、前記マーカーアンジオジェン(angiogen、血管新生促進因子)は、血管内皮増殖因子受容体(VEGFR)、インテグリンαvβ3、ウロキナーゼ型プラスミノーゲンアクチベーター受容体(urokinase type plasminogen activator receptor:uPAR)、プラスミノーゲンアクチベーターインヒビター1(plasminogen activator inhibitor 1:PAI−1)、VEGFR2(KDR/Flk−1)、或いはそれらの任意の組み合わせを有するものである。
【請求項42】
請求項41記載の方法において、前記血管内皮増殖因子受容体(VEGFR)は、FLT1、FLK1、Tie1、Tie2、或いはそれらの任意の組み合わせを有するものである。
【請求項43】
請求項20記載の方法において、前記リガンドは、マーカーインテグリンαvβ3に対する抗体、マーカーインテグリンαvβ3に対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項44】
請求項43記載の方法において、前記マーカーインテグリンαvβ3に対する抗体の変異体は、BerEP4、LM609、2C3、或いはそれらの任意の組み合わせである。
【請求項45】
請求項20記載の方法において、前記リガンドは、マーカー前立腺特異的膜抗原に対する抗体、マーカー前立腺特異的膜抗原に対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項46】
請求項46記載の方法において、前記マーカー前立腺特異的膜抗原に対する抗体の変異体は、MDX−070、7E11−C5.3、或いはそれらの任意の組み合わせである。
【請求項47】
請求項19記載の方法において、前記マーカーアデノウイルス細胞表面受容体は、コクサッキーアデノウイルス細胞表面受容体(coxsackie adenovirus cell surface receptor:CAR)を有するものである。
【請求項48】
請求項19記載の方法において、前記マーカー細胞周期調節因子は、サイクリンA、サイクリンD、サイクリンE、cdc2或いはそれらの任意の組み合わせを有するものである。
【請求項49】
請求項19記載の方法において、前記マーカー癌原遺伝子は、rasを有するものである。
【請求項50】
請求項19記載の方法において、前記マーカーアポトーシス関連因子は、Fas、FasL、或いはそれらの任意の組み合わせを有するものである。
【請求項51】
請求項19記載の方法において、前記マーカータンパク質チロシンキナーゼは、VSrc、C−Src、或いはそれらの任意の組み合わせを有するものである。
【請求項52】
請求項19記載の方法において、前記マーカー癌細胞シグナルメディエーターは、Pl3KC2を有するものである。
【請求項53】
請求項19記載の方法において、前記マーカーシクラーゼ−C受容体は、グアニリルシクラーゼ−C(guanylyl cyclase−C:GC−C)受容体を有するものである。
【請求項54】
請求項19記載の方法において、前記マーカー血小板由来増殖因子受容体(PDGFR)は、PDGFR−アルファ、PDGFR−ベータ、或いはそれらの任意の組み合わせを有するものである。
【請求項55】
請求項19記載の方法において、前記マーカーコバラミン受容体は、メチオニンシンターゼ、L−メチルマロニル−CoAムターゼ、或いはそれらの任意の組み合わせを有するものである。
【請求項56】
請求項19記載の方法において、前記マーカーグリオーマチャネルは、グリオーマ塩素イオンチャネルを有するものである。
【請求項57】
請求項19記載の方法において、前記マーカー脳特異的コンドロイチン硫酸プロテオグリカンは、脳濃縮ヒアルロン酸結合(brain enriched hyaluronan binding:BEHAB)タンパク質受容体を有するものである。
【請求項58】
請求項19記載の方法において、前記マーカーカテニンは、アルファカテニン、ベータカテニン、ガンマカテニン、或いはそれらの任意の組み合わせを有するものである。
【請求項59】
請求項19記載の方法において、前記マーカータンパク質抗原は、p27、p73、或いはそれらの任意の組み合わせを有するものである。
【請求項60】
請求項20記載の方法において、前記リガンドは、マーカーヒト乳脂肪小球受容体(HMFGR)に対する抗体、マーカーHMFGRに対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項61】
請求項60記載の方法において、前記マーカーHMFGRに対する抗体の変異体は、NCL−HMFG1、NCL−HMFG2、或いはそれらの任意の組み合わせである。
【請求項62】
請求項18記載の方法において、患者の血管システムの疾患に関連した前記標的はマーカーを有するものであり、このマーカーは、アポリポタンパク質に関連した抗原、リポタンパク質、血管内皮増殖因子受容体(VEGFR)、塩基性線維芽細胞成長因子受容体(bFGFR)、或いはそれらの任意の組み合わせである。
【請求項63】
請求項62記載の方法において、前記マーカーリポタンパク質は、酸化低密度リポタンパク質(oxidized low density lipoprotein:OxLDL)、マロンジアルデヒド−修飾LDL(malondialdehyde−modified LDL:MDA−LDL)、或いはそれらの任意の組み合わせを有するものである。
【請求項64】
請求項63記載の方法において、前記リガンドは、マーカーOxLDLに対する抗体、マーカーOxLDLに対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項65】
請求項64記載の方法において、前記マーカーOxLDLに対する抗体の変異体は、MDA−2である。
【請求項66】
請求項63記載の方法において、前記リガンドは、マーカーMDA−LDLに対する抗体、マーカーMDA−LDLに対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項67】
請求項66記載の方法において、前記マーカーMDA−LDLに対する抗体の変異体は、IK17である。
【請求項68】
請求項18記載の方法において、疾患原因病原体標的に関する前記標的はウイルスであり、このウイルスは結核に関連するものである。
【請求項69】
請求項68記載の方法において、結核に関連する標的はマーカーを有するものであり、このマーカーはAPAに関連する抗原である。
【請求項70】
請求項18記載の方法において、疾患原因病原体に関する前記標的はウイルスであり、このウイルスはヒト免疫不全ウイルス(human immunodeficiency virus:HIV)に関連するものである。
【請求項71】
請求項70記載の方法において、前記標的はマーカーを有するものであり、このマーカーは、HIV感染細胞に関連するT増殖因子受容体アルファ(T growth factor receptor alpha:TGFR−A)抗原である。
【請求項72】
請求項18記載の方法において、疾患原因病原体標的に関連した前記標的は寄生原虫であり、この寄生原虫はマラリアに関連するものである。
【請求項73】
請求項18記載の方法において、中枢神経システム疾患に関連した前記標的は多発性硬化症であり、前記標的はマーカーを有するものであり、前記マーカーはα4β1−インテグリンのα4−サブユニット(VLA−4)、α4β7−インテグリンのα4−サブユニット、或いはそれらの任意の組み合わせである。
【請求項74】
請求項72記載の方法において、疾患原因病原体に関連した前記標的はマーカーを有するものであり、このマーカーは熱帯熱マラリア原虫上の頂端膜抗原−1(apical membrane antigen−1:AMA−1)である。
【請求項75】
請求項18記載の方法において、非癌性疾患物質に関連した前記標的はマーカーを有するものであり、このマーカーは非癌性疾患沈殿物、非癌性疾患前駆体沈殿物、或いはそれらの任意の組み合わせを有するものである。
【請求項76】
請求項18記載の方法において、非癌性疾患物質に関連した前記標的は、自己免疫関節分解に関連した血管内皮増殖因子受容体である。
【請求項77】
請求項17記載の方法において、前記AMFはパルスである。
【請求項78】
請求項77記載の方法において、前記AMFが「オン」のパルス時間は、約0.1秒〜約1200秒の範囲であり、「オフ」のパルス時間は、約0.1秒〜約1200秒の範囲である。
【請求項79】
請求項17記載の方法において、前記投与する工程は、腹腔内注射、血管内注射、筋肉内注射、皮下注射、局所的(外用)、吸入、経口摂取、直腸挿入、洗浄、周術的な洗浄液或いはリンス、体外、或いはそれらの任意の組み合わせである方法を利用するものである。
【請求項80】
請求項79記載の方法において、前記投与する工程は体外である方法を利用し、対象の少なくとも一部はAMFの体外投与の前に前記対象の身体から抽出されるものであり、この抽出された部分は対象の身体へ戻される、若しくはAMFの投与後にレシピエントの身体へ移植されるものである。
【請求項81】
請求項80記載の方法において、前記対象の抽出された一部はAMFの投与の前、最中、或いは後に冷却されるものである。
【請求項82】
請求項81記載の方法において、前記磁性組成物は、AMFの投与後に磁力を介して前記抽出された一部から除去されるものである。
【請求項83】
患者を治療する方法であって、
a)患者の少なくとも一部に請求項9記載の磁性組成物を投与する工程と、
b)予め決定された標的と組み合わせた前記磁性組成物に交流磁場(alternating magnetic field:AMF)を適用する工程であって、前記磁性物質を誘導的に加熱する、前記適用する工程と
を有する方法。
【請求項84】
請求項83記載の方法において、前記磁性組成物はさらに、放射性同位体、潜在的な放射性同位体、化学療法剤、或いはそれらの任意の組み合わせを有するものである。
【請求項85】
請求項83記載の方法において、前記標的は、癌、対象の血管システムの疾患、疾患原因病原体、多発性硬化症、或いは非癌性疾患物質と関連するものである。
【請求項86】
請求項85記載の方法において、癌に関連する前記標的は、マーカーを有するものであり、このマーカーは、a)血管内皮細胞増殖因子受容体(vascular endothelial growth factor receptor:VEGFR)ファミリーのメンバー、b)癌胎児抗原(carcinoembryonic antigen:CEA)ファミリーのメンバー、c)非グリコシル化DF3抗原、d)上皮細胞成長因子受容体(epidermal growth factor receptor:EGFR)ファミリーのメンバー、e)細胞性接着分子、f)マトリックスメタロプロテアーゼ、g)糖タンパク質抗原、h)アンジオジェン(angiogen、血管新生促進因子)、i)前立腺特異的膜抗原(prostate specific membrane antigen:PSMA)、j)小細胞肺癌抗原(small cell lung carcinoma antigen:SCLCA)、k)ホルモン受容体、l)腫瘍抑制遺伝子抗原、m)細胞周期調節因子抗原、n)癌原遺伝子抗原、o)癌原遺伝子受容体抗原、p)増殖マーカー、q)悪性形質転換関連因子、r)アポトーシス関連因子、s)ヒト癌抗原、t)インテグリン、u)カリクレイン、v)胎盤成長因子受容体(placental growth factor receptor:PGFR)、w)アデノウイルス細胞表面受容体、x)肝細胞増殖因子受容体(hepatocyte growth factor receptor:HGFR)、y)チロシンキナーゼ、z)サイトケラチン上皮マーカー、aa)増殖細胞核抗原(proliferating cell nuclear antigen:PCNA)、bb)膜関連シアリダーゼ、cc)癌細胞シグナルメディエーター、dd)シクラーゼ−C受容体、ee)トランスフォーミング増殖因子受容体(transforming growth factor receptor:TGFR)、ff)血小板由来増殖因子受容体(platelet derived growth factor receptor:PDGFR)、gg)コバラミン受容体、hh)グリオーマチャネル、ii)脳特異的コンドロイチン硫酸プロテオグリカン、jj)カテニン、kk)MUC型ムチンファミリー受容体のメンバー、ll)クラスタ指定/分化抗原群(cluster designation/differentiation(CD))抗原ファミリーのメンバー、mm)タンパク質抗原、nn)サイトカイン受容体、oo)メソセリン(mesothelin)受容体、或いはpp)a)〜oo)の任意の組み合わせ、である。
【請求項87】
請求項86記載の方法において、前記マーカーに対するリガンドは、a)ポリクローナル抗体、b)モノクローナル抗体、c)キメラ抗体、d)ヒト化抗体、e)ヒト抗体、f)組換え抗体、g)二重特異性抗体、h)抗体断片、i)組換え単鎖抗体断片、或いはj)a)〜i)の任意の組み合わせである。
【請求項88】
請求項87記載の方法において、前記リガンドは、マーカーヒト乳脂肪小球受容体(HMFGR)に対する抗体、マーカーHMFGRに対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項89】
請求項88記載の方法において、前記リガンドは、マーカーEGFRvIIIに対する抗体、マーカーEGFRvIIIに対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項90】
請求項88記載の方法において、前記リガンドは、マーカーOxLDLに対する抗体、マーカーOxLDLに対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項91】
請求項88記載の方法において、前記リガンドは、マーカーMDA−LDLに対する抗体、マーカーMDA−LDLに対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項92】
請求項84記載の方法において、前記AMFはパルスである。
【請求項93】
請求項84記載の方法において、前記投与する工程は、腹腔内注射、血管内注射、筋肉内注射、皮下注射、局所的(外用)、吸入、経口摂取、直腸挿入、洗浄、周術的な洗浄液或いはリンス、体外、或いはそれらの任意の組み合わせである方法を利用するものである。
【請求項94】
請求項1記載の磁性組成物において、この組成物は、さらに、リガンドを有するものである。
【請求項95】
請求項17記載の方法において、請求項1記載の磁性組成物は、前記疾患組織に直接投与されるものである。
【請求項96】
請求項17記載の方法において、前記磁性組成物は、さらに、前記患者における予め決定された標的に特異的なリガンドを有するものである。
【請求項97】
請求項83記載の方法において、請求項10記載の磁性組成物は、前記疾患組織に直接投与されるものである。
【請求項98】
請求項83記載の磁性組成物において、前記組成物は、さらに、前記患者における予め決定された標的に特異的なリガンドを有するものである。
【請求項99】
患者を画像化する方法であって、
a)患者の少なくとも一部に請求項9記載の磁性組成物を投与する工程と、
b)前記磁性組成物に磁場を適用し、前記磁性物質を含む前記患者の一部の画像を増強する工程と
を有する方法。
【請求項100】
請求項99記載の方法において、請求項9記載の磁性組成物は、前記標的組織に直接投与されるものである。
【請求項101】
請求項99記載の方法において、前記組成物は、さらに、前記患者における予め決定された標的に特異的なリガンドを有するものである。
【請求項102】
請求項99記載の方法において、前記磁性組成物は、さらに、放射性同位体或いは潜在的な放射性同位体、若しくはそれらの任意の組み合わせを有するものであり、前記標的組織のコントラストを増強するものである。
【請求項103】
請求項9記載の磁性組成物において、前記組成物は、さらに、前記患者における予め決定された標的に特異的なリガンドを有するものである。
【請求項1】
磁性組成物であって、
a)周波数約80kHz〜800kHz、振幅約7.98kA/m〜104kA/m、及び温度約270〜380Kの交流磁場に曝された場合に加熱する少なくとも1つの安定単磁区粒子を有する磁性ナノ粒子と、
b)コーティングと
を有する磁性組成物。
【請求項2】
請求項1記載の磁性組成物において、前記コーティングはデキストランを有するものである。
【請求項3】
請求項1記載の磁性組成物であって、この磁性組成物は、さらに、
放射性同位体、潜在的な放射性同位体、化学療法剤、或いはそれらの任意の組み合わせを有するものである。
【請求項4】
請求項3記載の磁性組成物において、前記放射性同位体は、イオジン−131、コバルト−60、イリジウム−192、イットリウム−90、ストロンチウム−89、サマリウム−153、レニウム−186、テクネチウム−99m、或いはそれらの任意の組み合わせである。
【請求項5】
請求項3記載の磁性組成物において、前記潜在的な放射性同位体は、中性子、プロトン、電子、或いは高エネルギー光子に対して高い吸収断面を有する同位体である。
【請求項6】
請求項5記載の磁性組成物において、前記潜在的な放射性同位体は、中性子に対して高い吸収断面を有している同位体であり、ホウ素−10、サマリウム−149、ガドリニウム−157及びガドリニウム−155などのランタニド、或いはそれらの任意の組み合わせの一つである。
【請求項7】
請求項6記載の磁性組成物において、望ましい治療領域は、AMF温熱療法との組み合わせで、中性子、プロトン、電子、或いは高エネルギー光子に曝され、前記潜在的な放射性同位体を活性化するものである。
【請求項8】
請求項3記載の磁性組成物において、前記化学療法剤は、ドキソルビシン、シスプラチン、或いはそれらの任意の組み合わせの一つである。
【請求項9】
磁性組成物であって、
a)i)周波数約80kHz〜800kHz、振幅約7.98kA/m〜104kA/m、及び温度約270〜380Kの交流磁場に曝された場合に明らかに阻害されるような、集合磁気状態を示す超常磁性粒子の凝集体、若しくはii)安定単磁区粒子及び超常磁性粒子の凝集体であって、前記超常磁性粒子の特徴的な緩和時間は増加するような集合磁気状態を示すものであり、この凝集体は、周波数約80kHz〜800kHz、振幅約7.98kA/m〜104kA/m、及び温度約270〜380Kの交流磁場に曝された場合に明らかに阻害されるものである、安定単磁区粒子及び超常磁性粒子の凝集体、のいずれかを有する磁性ナノ粒子と、
b)コーティングと
を有する磁性組成物。
【請求項10】
請求項9記載の磁性組成物において、前記コーティングはデキストランを有するものである。
【請求項11】
請求項10記載の磁性組成物であって、この磁性組成物は、さらに、
放射性同位体、潜在的な放射性同位体、化学療法剤、或いはそれらの任意の組み合わせを有するものである。
【請求項12】
請求項11記載の磁性組成物において、前記放射性同位体は、イオジン−131、コバルト−60、イリジウム−192、イットリウム−90、ストロンチウム−89、サマリウム−153、レニウム−186、テクネチウム−99m、或いはそれらの任意の組み合わせである。
【請求項13】
請求項11記載の磁性組成物において、前記潜在的な放射性同位体は、中性子、プロトン、電子、或いは高エネルギー光子に対して高い吸収断面を有する同位体である。
【請求項14】
請求項13記載の磁性組成物において、前記潜在的な放射性同位体は、中性子に対して高い吸収断面を有している同位体であり、ホウ素−10、サマリウム−149、ガドリニウム−157及びガドリニウム−155などのランタニド、或いはそれらの任意の組み合わせの一つである。
【請求項15】
請求項14記載の磁性組成物において、望ましい治療領域は、AMF温熱療法との組み合わせで、中性子、プロトン、電子、或いは高エネルギー光子に曝され、前記潜在的な放射性同位体を活性化するものである。
【請求項16】
請求項11記載の磁性組成物において、前記化学療法剤は、ドキソルビシン、シスプラチン、或いはそれらの任意の組み合わせの一つである。
【請求項17】
患者を治療する方法であって、
a)患者の少なくとも一部に請求項1記載の磁性組成物を投与する工程と、
b)交流磁場(alternating magnetic field:AMF)を前記磁性組成物に適用する工程であって、前記磁性物質を誘導的に加熱する、前記適用する工程と
を有する方法。
【請求項18】
請求項17記載の方法において、標的は癌、対象の血管システムの疾患、疾患原因病原体、中枢神経システム疾患、或いは非癌性疾患物質と関連するものである。
【請求項19】
請求項18記載の方法において、癌に関連した前記標的は、マーカーを有するものであり、このマーカーは、a)血管内皮細胞増殖因子受容体(vascular endothelial growth factor receptor:VEGFR)ファミリーのメンバー、b)癌胎児抗原(carcinoembryonic antigen:CEA)ファミリーのメンバー、c)非グリコシル化DF3抗原、d)上皮細胞成長因子受容体(epidermal growth factor receptor:EGFR)ファミリーのメンバー、e)細胞性接着分子、f)マトリックスメタロプロテアーゼ、g)糖タンパク質抗原、h)アンジオジェン(angiogen、血管新生促進因子)、i)前立腺特異的膜抗原(prostate specific membrane antigen:PSMA)、j)小細胞肺癌抗原(small cell lung carcinoma antigen:SCLCA)、k)ホルモン受容体、l)腫瘍抑制遺伝子抗原、m)細胞周期調節因子抗原、n)癌原遺伝子抗原、o)癌原遺伝子受容体抗原、p)増殖マーカー、q)悪性形質転換関連因子、r)アポトーシス関連因子、s)ヒト癌抗原、t)インテグリン、u)カリクレイン、v)胎盤成長因子受容体(placental growth factor receptor:PGFR)、w)アデノウイルス細胞表面受容体、x)肝細胞増殖因子受容体(hepatocyte growth factor receptor:HGFR)、y)チロシンキナーゼ、z)サイトケラチン上皮マーカー、aa)増殖細胞核抗原(proliferating cell nuclear antigen:PCNA)、bb)膜関連シアリダーゼ、cc)癌細胞シグナルメディエーター、dd)シクラーゼ−C受容体、ee)トランスフォーミング増殖因子受容体(transforming growth factor receptor:TGFR)、ff)血小板由来増殖因子受容体(platelet derived growth factor receptor:PDGFR)、gg)コバラミン受容体、hh)グリオーマチャネル、ii)脳特異的コンドロイチン硫酸プロテオグリカン、jj)カテニン、kk)MUC型ムチンファミリー受容体のメンバー、ll)クラスタ指定/分化抗原群(cluster designation/differentiation(CD))抗原ファミリーのメンバー、mm)タンパク質抗原、nn)サイトカイン受容体、oo)メソセリン(mesothelin)受容体、或いはpp)a)〜oo)の任意の組み合わせ、である。
【請求項20】
請求項19記載の方法において、前記マーカーに対するリガンドは、a)ポリクローナル抗体、b)モノクローナル抗体、c)キメラ抗体、d)ヒト化抗体、e)ヒト抗体、f)組換え抗体、g)二重特異性抗体、h)抗体断片、i)組換え単鎖抗体断片、或いはj)a)〜i)の任意の組み合わせである。
【請求項21】
請求項19記載の方法において、前記マーカー上皮細胞増殖因子受容体(epidermal growth factor receptor:EGFR)は、HER−1、HER−2、HER−3、HER−4、EGFRvIII、或いはそれらの任意の組み合わせを有するものである。
【請求項22】
請求項20記載の方法において、前記リガンドは、マーカーHER−2に対する抗体、マーカーHER−2に対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項23】
請求項22記載の方法において、前記マーカーHER−2に対する抗体の変異体は、F5scFv、IDM−1(MDX−210)、或いはそれらの任意の組み合わせである。
【請求項24】
請求項20記載の方法において、前記リガンドは、マーカーEGFRvIIIに対する抗体、マーカーEGFRvIIIに対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項25】
請求項24記載の方法において、前記マーカーEGFRvIIIに対する抗体の変異体は、Ua30:2、L8A4、DH8.3、81C6、或いはそれらの任意の組み合わせである。
【請求項26】
請求項19記載の方法において、前記マーカーMUC型ムチンファミリー受容体は、MUC−1、MUC−2、MUC−3、TAG−72、ヒト乳脂肪小球受容体、或いはそれらの任意の組み合わせを有するものである。
【請求項27】
請求項20記載の方法において、前記リガンドは、マーカーMUC−1に対する抗体、マーカーMUC−1に対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項28】
請求項20記載の方法において、前記リガンドは、マーカーTAG−72に対する抗体、マーカーTAG−72に対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項29】
請求項28記載の方法において、前記マーカーTAG−72に対する抗体の変異体は、B72.3である。
【請求項30】
請求項20記載の方法において、前記リガンドは、マーカーCEAに対する抗体、マーカーCEAに対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項31】
請求項30記載の方法において、前記マーカーCEAに対する抗体の変異体は、MFE−23scFvである。
【請求項32】
請求項19記載の方法において、前記マーカークラスタ指定/分化抗原群(cluster designation/differentiation)タンパク質はCD44を有するものであり、CD44は細胞性接着分子として働くものである。
【請求項33】
請求項19記載の方法において、前記マーカーサイトカイン受容体は、インターロイキン(interleukin:IL)ファミリーの少なくとも1つのメンバーを有するものである。
【請求項34】
請求項20記載の方法において、前記リガンドは、マーカーIL13に対する抗体、マーカーIL13に対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項35】
請求項19記載の方法において、前記マーカーマトリックスメタロプロテアーゼは、マトリックスメタロプロテアーゼ9(matrix metalloproteinase 9:MMP9)を有するものである。
【請求項36】
請求項19の方法において、前記マーカー糖タンパク質抗原は、43kD膜関連糖タンパク質抗原、40kD糖タンパク質抗原、或いはそれらの任意の組み合わせを有するものである。
【請求項37】
請求項20記載の方法において、前記リガンドは、マーカー43kD膜関連糖タンパク質に対する抗体、マーカー43kD膜関連糖タンパク質に対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項38】
請求項37記載の方法において、前記マーカー43kD膜関連糖タンパク質に対する抗体の変異体は、323/A3である。
【請求項39】
請求項20記載の方法において、前記リガンドは、40kD糖タンパク質抗原に対する抗体、40kD糖タンパク質抗原に対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項40】
請求項39記載の方法において、前記40kD糖タンパク質抗原に対する抗体の変異体は、NR−LU−10である。
【請求項41】
請求項19記載の方法において、前記マーカーアンジオジェン(angiogen、血管新生促進因子)は、血管内皮増殖因子受容体(VEGFR)、インテグリンαvβ3、ウロキナーゼ型プラスミノーゲンアクチベーター受容体(urokinase type plasminogen activator receptor:uPAR)、プラスミノーゲンアクチベーターインヒビター1(plasminogen activator inhibitor 1:PAI−1)、VEGFR2(KDR/Flk−1)、或いはそれらの任意の組み合わせを有するものである。
【請求項42】
請求項41記載の方法において、前記血管内皮増殖因子受容体(VEGFR)は、FLT1、FLK1、Tie1、Tie2、或いはそれらの任意の組み合わせを有するものである。
【請求項43】
請求項20記載の方法において、前記リガンドは、マーカーインテグリンαvβ3に対する抗体、マーカーインテグリンαvβ3に対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項44】
請求項43記載の方法において、前記マーカーインテグリンαvβ3に対する抗体の変異体は、BerEP4、LM609、2C3、或いはそれらの任意の組み合わせである。
【請求項45】
請求項20記載の方法において、前記リガンドは、マーカー前立腺特異的膜抗原に対する抗体、マーカー前立腺特異的膜抗原に対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項46】
請求項46記載の方法において、前記マーカー前立腺特異的膜抗原に対する抗体の変異体は、MDX−070、7E11−C5.3、或いはそれらの任意の組み合わせである。
【請求項47】
請求項19記載の方法において、前記マーカーアデノウイルス細胞表面受容体は、コクサッキーアデノウイルス細胞表面受容体(coxsackie adenovirus cell surface receptor:CAR)を有するものである。
【請求項48】
請求項19記載の方法において、前記マーカー細胞周期調節因子は、サイクリンA、サイクリンD、サイクリンE、cdc2或いはそれらの任意の組み合わせを有するものである。
【請求項49】
請求項19記載の方法において、前記マーカー癌原遺伝子は、rasを有するものである。
【請求項50】
請求項19記載の方法において、前記マーカーアポトーシス関連因子は、Fas、FasL、或いはそれらの任意の組み合わせを有するものである。
【請求項51】
請求項19記載の方法において、前記マーカータンパク質チロシンキナーゼは、VSrc、C−Src、或いはそれらの任意の組み合わせを有するものである。
【請求項52】
請求項19記載の方法において、前記マーカー癌細胞シグナルメディエーターは、Pl3KC2を有するものである。
【請求項53】
請求項19記載の方法において、前記マーカーシクラーゼ−C受容体は、グアニリルシクラーゼ−C(guanylyl cyclase−C:GC−C)受容体を有するものである。
【請求項54】
請求項19記載の方法において、前記マーカー血小板由来増殖因子受容体(PDGFR)は、PDGFR−アルファ、PDGFR−ベータ、或いはそれらの任意の組み合わせを有するものである。
【請求項55】
請求項19記載の方法において、前記マーカーコバラミン受容体は、メチオニンシンターゼ、L−メチルマロニル−CoAムターゼ、或いはそれらの任意の組み合わせを有するものである。
【請求項56】
請求項19記載の方法において、前記マーカーグリオーマチャネルは、グリオーマ塩素イオンチャネルを有するものである。
【請求項57】
請求項19記載の方法において、前記マーカー脳特異的コンドロイチン硫酸プロテオグリカンは、脳濃縮ヒアルロン酸結合(brain enriched hyaluronan binding:BEHAB)タンパク質受容体を有するものである。
【請求項58】
請求項19記載の方法において、前記マーカーカテニンは、アルファカテニン、ベータカテニン、ガンマカテニン、或いはそれらの任意の組み合わせを有するものである。
【請求項59】
請求項19記載の方法において、前記マーカータンパク質抗原は、p27、p73、或いはそれらの任意の組み合わせを有するものである。
【請求項60】
請求項20記載の方法において、前記リガンドは、マーカーヒト乳脂肪小球受容体(HMFGR)に対する抗体、マーカーHMFGRに対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項61】
請求項60記載の方法において、前記マーカーHMFGRに対する抗体の変異体は、NCL−HMFG1、NCL−HMFG2、或いはそれらの任意の組み合わせである。
【請求項62】
請求項18記載の方法において、患者の血管システムの疾患に関連した前記標的はマーカーを有するものであり、このマーカーは、アポリポタンパク質に関連した抗原、リポタンパク質、血管内皮増殖因子受容体(VEGFR)、塩基性線維芽細胞成長因子受容体(bFGFR)、或いはそれらの任意の組み合わせである。
【請求項63】
請求項62記載の方法において、前記マーカーリポタンパク質は、酸化低密度リポタンパク質(oxidized low density lipoprotein:OxLDL)、マロンジアルデヒド−修飾LDL(malondialdehyde−modified LDL:MDA−LDL)、或いはそれらの任意の組み合わせを有するものである。
【請求項64】
請求項63記載の方法において、前記リガンドは、マーカーOxLDLに対する抗体、マーカーOxLDLに対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項65】
請求項64記載の方法において、前記マーカーOxLDLに対する抗体の変異体は、MDA−2である。
【請求項66】
請求項63記載の方法において、前記リガンドは、マーカーMDA−LDLに対する抗体、マーカーMDA−LDLに対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項67】
請求項66記載の方法において、前記マーカーMDA−LDLに対する抗体の変異体は、IK17である。
【請求項68】
請求項18記載の方法において、疾患原因病原体標的に関する前記標的はウイルスであり、このウイルスは結核に関連するものである。
【請求項69】
請求項68記載の方法において、結核に関連する標的はマーカーを有するものであり、このマーカーはAPAに関連する抗原である。
【請求項70】
請求項18記載の方法において、疾患原因病原体に関する前記標的はウイルスであり、このウイルスはヒト免疫不全ウイルス(human immunodeficiency virus:HIV)に関連するものである。
【請求項71】
請求項70記載の方法において、前記標的はマーカーを有するものであり、このマーカーは、HIV感染細胞に関連するT増殖因子受容体アルファ(T growth factor receptor alpha:TGFR−A)抗原である。
【請求項72】
請求項18記載の方法において、疾患原因病原体標的に関連した前記標的は寄生原虫であり、この寄生原虫はマラリアに関連するものである。
【請求項73】
請求項18記載の方法において、中枢神経システム疾患に関連した前記標的は多発性硬化症であり、前記標的はマーカーを有するものであり、前記マーカーはα4β1−インテグリンのα4−サブユニット(VLA−4)、α4β7−インテグリンのα4−サブユニット、或いはそれらの任意の組み合わせである。
【請求項74】
請求項72記載の方法において、疾患原因病原体に関連した前記標的はマーカーを有するものであり、このマーカーは熱帯熱マラリア原虫上の頂端膜抗原−1(apical membrane antigen−1:AMA−1)である。
【請求項75】
請求項18記載の方法において、非癌性疾患物質に関連した前記標的はマーカーを有するものであり、このマーカーは非癌性疾患沈殿物、非癌性疾患前駆体沈殿物、或いはそれらの任意の組み合わせを有するものである。
【請求項76】
請求項18記載の方法において、非癌性疾患物質に関連した前記標的は、自己免疫関節分解に関連した血管内皮増殖因子受容体である。
【請求項77】
請求項17記載の方法において、前記AMFはパルスである。
【請求項78】
請求項77記載の方法において、前記AMFが「オン」のパルス時間は、約0.1秒〜約1200秒の範囲であり、「オフ」のパルス時間は、約0.1秒〜約1200秒の範囲である。
【請求項79】
請求項17記載の方法において、前記投与する工程は、腹腔内注射、血管内注射、筋肉内注射、皮下注射、局所的(外用)、吸入、経口摂取、直腸挿入、洗浄、周術的な洗浄液或いはリンス、体外、或いはそれらの任意の組み合わせである方法を利用するものである。
【請求項80】
請求項79記載の方法において、前記投与する工程は体外である方法を利用し、対象の少なくとも一部はAMFの体外投与の前に前記対象の身体から抽出されるものであり、この抽出された部分は対象の身体へ戻される、若しくはAMFの投与後にレシピエントの身体へ移植されるものである。
【請求項81】
請求項80記載の方法において、前記対象の抽出された一部はAMFの投与の前、最中、或いは後に冷却されるものである。
【請求項82】
請求項81記載の方法において、前記磁性組成物は、AMFの投与後に磁力を介して前記抽出された一部から除去されるものである。
【請求項83】
患者を治療する方法であって、
a)患者の少なくとも一部に請求項9記載の磁性組成物を投与する工程と、
b)予め決定された標的と組み合わせた前記磁性組成物に交流磁場(alternating magnetic field:AMF)を適用する工程であって、前記磁性物質を誘導的に加熱する、前記適用する工程と
を有する方法。
【請求項84】
請求項83記載の方法において、前記磁性組成物はさらに、放射性同位体、潜在的な放射性同位体、化学療法剤、或いはそれらの任意の組み合わせを有するものである。
【請求項85】
請求項83記載の方法において、前記標的は、癌、対象の血管システムの疾患、疾患原因病原体、多発性硬化症、或いは非癌性疾患物質と関連するものである。
【請求項86】
請求項85記載の方法において、癌に関連する前記標的は、マーカーを有するものであり、このマーカーは、a)血管内皮細胞増殖因子受容体(vascular endothelial growth factor receptor:VEGFR)ファミリーのメンバー、b)癌胎児抗原(carcinoembryonic antigen:CEA)ファミリーのメンバー、c)非グリコシル化DF3抗原、d)上皮細胞成長因子受容体(epidermal growth factor receptor:EGFR)ファミリーのメンバー、e)細胞性接着分子、f)マトリックスメタロプロテアーゼ、g)糖タンパク質抗原、h)アンジオジェン(angiogen、血管新生促進因子)、i)前立腺特異的膜抗原(prostate specific membrane antigen:PSMA)、j)小細胞肺癌抗原(small cell lung carcinoma antigen:SCLCA)、k)ホルモン受容体、l)腫瘍抑制遺伝子抗原、m)細胞周期調節因子抗原、n)癌原遺伝子抗原、o)癌原遺伝子受容体抗原、p)増殖マーカー、q)悪性形質転換関連因子、r)アポトーシス関連因子、s)ヒト癌抗原、t)インテグリン、u)カリクレイン、v)胎盤成長因子受容体(placental growth factor receptor:PGFR)、w)アデノウイルス細胞表面受容体、x)肝細胞増殖因子受容体(hepatocyte growth factor receptor:HGFR)、y)チロシンキナーゼ、z)サイトケラチン上皮マーカー、aa)増殖細胞核抗原(proliferating cell nuclear antigen:PCNA)、bb)膜関連シアリダーゼ、cc)癌細胞シグナルメディエーター、dd)シクラーゼ−C受容体、ee)トランスフォーミング増殖因子受容体(transforming growth factor receptor:TGFR)、ff)血小板由来増殖因子受容体(platelet derived growth factor receptor:PDGFR)、gg)コバラミン受容体、hh)グリオーマチャネル、ii)脳特異的コンドロイチン硫酸プロテオグリカン、jj)カテニン、kk)MUC型ムチンファミリー受容体のメンバー、ll)クラスタ指定/分化抗原群(cluster designation/differentiation(CD))抗原ファミリーのメンバー、mm)タンパク質抗原、nn)サイトカイン受容体、oo)メソセリン(mesothelin)受容体、或いはpp)a)〜oo)の任意の組み合わせ、である。
【請求項87】
請求項86記載の方法において、前記マーカーに対するリガンドは、a)ポリクローナル抗体、b)モノクローナル抗体、c)キメラ抗体、d)ヒト化抗体、e)ヒト抗体、f)組換え抗体、g)二重特異性抗体、h)抗体断片、i)組換え単鎖抗体断片、或いはj)a)〜i)の任意の組み合わせである。
【請求項88】
請求項87記載の方法において、前記リガンドは、マーカーヒト乳脂肪小球受容体(HMFGR)に対する抗体、マーカーHMFGRに対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項89】
請求項88記載の方法において、前記リガンドは、マーカーEGFRvIIIに対する抗体、マーカーEGFRvIIIに対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項90】
請求項88記載の方法において、前記リガンドは、マーカーOxLDLに対する抗体、マーカーOxLDLに対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項91】
請求項88記載の方法において、前記リガンドは、マーカーMDA−LDLに対する抗体、マーカーMDA−LDLに対する抗体の変異体、或いはそれらの任意の組み合わせである。
【請求項92】
請求項84記載の方法において、前記AMFはパルスである。
【請求項93】
請求項84記載の方法において、前記投与する工程は、腹腔内注射、血管内注射、筋肉内注射、皮下注射、局所的(外用)、吸入、経口摂取、直腸挿入、洗浄、周術的な洗浄液或いはリンス、体外、或いはそれらの任意の組み合わせである方法を利用するものである。
【請求項94】
請求項1記載の磁性組成物において、この組成物は、さらに、リガンドを有するものである。
【請求項95】
請求項17記載の方法において、請求項1記載の磁性組成物は、前記疾患組織に直接投与されるものである。
【請求項96】
請求項17記載の方法において、前記磁性組成物は、さらに、前記患者における予め決定された標的に特異的なリガンドを有するものである。
【請求項97】
請求項83記載の方法において、請求項10記載の磁性組成物は、前記疾患組織に直接投与されるものである。
【請求項98】
請求項83記載の磁性組成物において、前記組成物は、さらに、前記患者における予め決定された標的に特異的なリガンドを有するものである。
【請求項99】
患者を画像化する方法であって、
a)患者の少なくとも一部に請求項9記載の磁性組成物を投与する工程と、
b)前記磁性組成物に磁場を適用し、前記磁性物質を含む前記患者の一部の画像を増強する工程と
を有する方法。
【請求項100】
請求項99記載の方法において、請求項9記載の磁性組成物は、前記標的組織に直接投与されるものである。
【請求項101】
請求項99記載の方法において、前記組成物は、さらに、前記患者における予め決定された標的に特異的なリガンドを有するものである。
【請求項102】
請求項99記載の方法において、前記磁性組成物は、さらに、放射性同位体或いは潜在的な放射性同位体、若しくはそれらの任意の組み合わせを有するものであり、前記標的組織のコントラストを増強するものである。
【請求項103】
請求項9記載の磁性組成物において、前記組成物は、さらに、前記患者における予め決定された標的に特異的なリガンドを有するものである。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公表番号】特表2009−513722(P2009−513722A)
【公表日】平成21年4月2日(2009.4.2)
【国際特許分類】
【出願番号】特願2008−539149(P2008−539149)
【出願日】平成18年11月1日(2006.11.1)
【国際出願番号】PCT/US2006/060419
【国際公開番号】WO2007/079276
【国際公開日】平成19年7月12日(2007.7.12)
【出願人】(503461995)トリトン バイオシステムズ、インク. (5)
【Fターム(参考)】
【公表日】平成21年4月2日(2009.4.2)
【国際特許分類】
【出願日】平成18年11月1日(2006.11.1)
【国際出願番号】PCT/US2006/060419
【国際公開番号】WO2007/079276
【国際公開日】平成19年7月12日(2007.7.12)
【出願人】(503461995)トリトン バイオシステムズ、インク. (5)
【Fターム(参考)】
[ Back to top ]

