磁性ナノ粒子複合体及び当該磁性ナノ粒子複合体による細胞の標識方法
【課題】磁性ナノ粒子をマイナスチャージの蛍光物質と共に、短時間混合させて細胞に添加するだけで、高効率に細胞を磁性、蛍光の両方で標識化することを可能とし、これにより、量子ドットに留まらず、様々な蛍光物質を細胞内に導入できることができる磁性ナノ粒子複合体及び当該磁性ナノ粒子複合体による細胞の標識方法を提供する。
【解決手段】本発明に係る磁性ナノ粒子複合体は、酸化鉄表面を第3級アミンで被覆して表面をプラスに帯電させた磁性ナノ粒子とマイナスに帯電している蛍光物質とを含む。
【解決手段】本発明に係る磁性ナノ粒子複合体は、酸化鉄表面を第3級アミンで被覆して表面をプラスに帯電させた磁性ナノ粒子とマイナスに帯電している蛍光物質とを含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、各種細胞を磁性と蛍光とにより高効率にラベル化することが可能な磁性ナノ粒子複合体及び当該磁性ナノ粒子複合体による標識方法に関する。
【背景技術】
【0002】
近年、診断及びバイオセンサーを含む生物学的適用において、磁気物質はますます重要になってきている。そして、ナノ粒子を利用した生体染色(bio−imaging)、細胞分離(cell separaration)、生体内ドラッグデリバリー(drug delivery)及び遺伝子デリバリー(gene delivery)が、主要研究対象になってきている。特に、発光性量子ドットナノ粒子を利用して細胞内に量子ドット(quantum dot)を取り込み(uptake)、量子ドットから発散される蛍光を外部で測定する研究をはじめ、ナノ粒子を利用したバイオ分野へのアプローチが、数多く研究されている。
【0003】
また、量子ドットをはじめとする大部分のナノ粒子は、カドミウム、亜鉛、コバルトなどの重金属からなり、バイオ分野へ応用するためには、合成されたナノ粒子の表面を生体に適合するように(biocompatible)処理しなければならない。例えば、生体に無毒性を示すシリカやポリエチレングリコール(PEG)のような無機、有機化合物を、合成されたナノ粒子の表面に導入することによって、ナノ粒子の親水性を増加させることができる。このようにして、生体内の循環時間(circulation time)を増加させるなどの研究が急速に進められている。
【0004】
最近、国内外の研究者らは、量子ドットを利用したバイオ分野へのアプローチに対する問題点を解決する研究が盛んに行っている。例えば、国内外の研究者らは、磁気的性質を示すナノ粒子を合成し、当該ナノ粒子にシリカシェルを導入することにより、当該ナノ粒子をバイオ分野に適用させる研究を行っている。
【0005】
また、量子ドットを合成する技術は、非常に複雑で且つ難しい条件を経なければならならず、表面処理過程を通じた全体収率が非常に低いという問題点を有している。最近、量子ドットの表面に特定の癌細胞の結合が可能な抗体を導入させて癌細胞を認識する研究が進められている。しかし、この研究の最大の難点の1つである、量子ドットから発生する光を検出して位置を確認する方法は、生体外(in vitro)研究だけに有効であり、生体内(in vivo)の研究に対しては限界がある。その理由は、量子ドットから発散される光が生体組職を貫いて検出されにくいことにある。
【0006】
このような背景のもと、磁性を有するナノ粒子を生体内に導入し、磁性体が有する磁気的性質を磁気共鳴装置(MRI)のような外部の強い磁場によって検出するなどの有効利用が期待されている。
【0007】
本研究により、磁性ナノ粒子と蛍光物質を結合した材料を設計し合成することにより、ダブルイメージングが可能になることがわかってきた。
【0008】
しかしながら、これを実現するには、磁性粒子と蛍光物質を結合する合成作業が必要であり、その材料の調製に多大な手間と時間がかかるという問題がある。さらに、磁性粒子と蛍光物質を結合させることにより、単色の蛍光で発光させることしか出来ないという問題点もあった。
【0009】
例えば、特許文献1には、蛍光性を有する磁性ナノ粒子、その製造方法及びその用途に関する発明が記載されている。特許文献1の磁性ナノ粒子は、光学的性質及び磁気的性質を同時に有する。そのため、様々なバイオ分野への適用が可能である。また、シリカシェル等の水溶性物質を利用して表面改質することによって、多様な化学官能基をナノ物質に導入することができる。そして、これらの化学官能基を利用して細胞内への浸透力を増加または減少させることができるだけでなく、所望の特定の細胞だけに作用するように選択性を付与することができる。
【0010】
また、例えば、特許文献2には、ナノメートルサイズの蛍光性磁性粒子およびそれらの粒子の作製方法が記載されている。このナノ粒子は、磁性物質と蛍光物質を含むコア粒子を有し、粒子のサイズは約1マイクロメートル未満である。このナノ粒子は無機物の層または有機物の層で覆われて表面修飾され、多くの生物学的アッセイで使用される。
【0011】
しかしながら、特許文献1および特許文献2に係る発明は、磁性粒子と蛍光物質を結合して磁性ナノ粒子複合体を容易に形成し、磁性ナノ粒子複合体によって高効率かつ短時間で細胞を標識することができないという問題点がある。
【先行技術文献】
【特許文献】
【0012】
【特許文献1】特表2009−508105号公報
【特許文献2】特表2007−506934号公報
【発明の概要】
【発明が解決しようとする課題】
【0013】
本発明は、上述の問題に鑑みなされたもので、酸化鉄表面を第3級アミンで被覆することにより、表面をプラスに帯電させた磁性ナノ粒子と、量子ドット等の蛍光物質とを混合することにより、自己組織化により磁性−蛍光ハイブリット材料を高効率に得ることが可能な磁性ナノ粒子複合体及び当該磁性ナノ粒子複合体により細胞を高効率かつ短時間に標識する標識方法を提供することを目的とする。
【課題を解決するための手段】
【0014】
上述の課題を解決するべく鋭意研究した結果、以前、本発明者らは、新規な磁性ナノ粒子(TMADM)の開発に成功した。当該磁性ナノ粒子(TMADM)は、酸化鉄表面を第3級アミンで被覆することにより、表面をプラスに帯電させたものである。当該磁性ナノ粒子(TMADM)は、表面がプラスに帯電しているため、細胞内への導入効率が非常に高い特徴を有している。
【0015】
本発明者らは、今回、この磁性ナノ粒子(TMADM)と、マイナスに帯電している量子ドットとを、たった15分程度混合させるだけで、自己組織化により、磁性−蛍光ハイブリット材料を形成させ、当該磁性−蛍光ハイブリット材料を細胞に添加するだけで、高効率かつ短時間に、細胞を磁性、蛍光の両方で標識化(ダブルイメージング)することを可能とする標識方法を構築した。
【0016】
本発明に係る磁性ナノ粒子複合体は、酸化鉄表面を第3級アミンで被覆して表面をプラスに帯電した磁性ナノ粒子とマイナスに帯電している蛍光物質とを含む。
【0017】
本発明に係る磁性ナノ粒子複合体は、前記蛍光物質が、量子ドットであることが好ましい。
【0018】
本発明に係る磁性ナノ粒子複合体による細胞の標識方法は、酸化鉄表面を第3級アミンで被覆して表面をプラスに帯電した磁性ナノ粒子とマイナスに帯電している蛍光物質とを混合して細胞に添加する方法である。
【0019】
本発明に係る磁性ナノ粒子複合体による細胞の標識方法は、前記蛍光物質が量子ドットであることが好ましい。
【発明の効果】
【0020】
本発明によれば、磁性ナノ粒子をマイナスチャージの蛍光物質と共に、短時間混合させて細胞に添加するだけで、高効率に細胞を磁性、蛍光の両方で標識化することを可能とし、これにより、発光性量子ドットに留まらず、様々な蛍光物質を細胞内に導入することができる。
【図面の簡単な説明】
【0021】
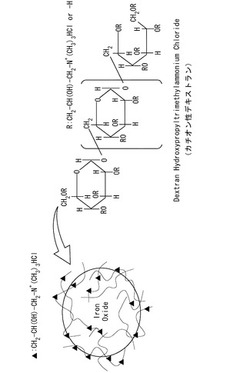
【図1】本発明に係るTMADMの構造図である。
【図2】比較例に係るATDMの構造図である。
【図3】本発明に係る顕微鏡写真及び蛍光顕微鏡写真である。
【図4】本発明に係る蛍光強度比較を示すグラフである。
【発明を実施するための形態】
【0022】
以下、本発明の好適な実施形態につき説明する。
本発明は、酸化鉄表面を第3級アミンで被覆して表面をプラスに帯電させた磁性ナノ粒子(以下、「TMADM」と称する。)とマイナスに帯電している蛍光物質とを含む磁性ナノ粒子複合体である。
【0023】
また、本発明は、酸化鉄表面を第3級アミンで被覆して表面をプラスに帯電させた磁性ナノ粒子とマイナスに帯電している蛍光物質を混合して細胞に添加する、細胞の標識方法である。
これにより、本発明は、当該磁性ナノ粒子複合体(磁性−蛍光ハイブリット材料)を細胞に添加して、細胞を磁性、蛍光の両方で標識化(ダブルイメージング)することができる。
【0024】
以下、磁性ナノ粒子(TMADM)について説明する。
本発明のTMADMを構成する酸化鉄としては、磁性金属酸化物であり、強磁性の粒子が用いられ、好ましくは、保持力が小さく、超常磁性であることが望ましい。
【0025】
具体的な磁性金属酸化物としては、例えば、下記式(1)で表される化合物が挙げられる。
(MIIO)l・M2IIIO3 (1)
(式(1)中、MIIは2価の金属原子を表し、MIIIは3価の金属原子を表し、lは0〜1の範囲内の実数を表す。)
【0026】
上記式(1)において、2価の金属原子MIIとしては、例えば、マグネシウム、カルシウム、マンガン、鉄、ニッケル、コバルト、銅、亜鉛、ストロンチウム、バリウム等が挙げられ、これらは単独で使用することもでき、あるいは2種以上併用することもできる。また、3価の金属原子MIIIとしては、例えば、アルミニウム、鉄、イットリウム、ネオジウム、サマリウム、ユーロピウム、ガドリニウム等が挙げられ、これらはそれぞれ単独で使用するか、あるいは2種以上組み合わせて用いることができる。
【0027】
磁性金属酸化物は、上記式(1)で表される化合物中、好ましくは、MIIIが3価の鉄である磁性金属酸化物、すなわち下記式(2)で示されるフェライトである。
(MIIO)m・Fe2O3 (2)
(式(2)中、MIIは2価の金属原子を表し、mは0〜1の範囲内の実数を表す。)
【0028】
ここで、MIIとしては、上記式(1)において挙げたものと同じ金属原子を挙げることができる。特に、MIIが2価の鉄である場合の上記式(2)の磁性金属酸化物、すなわち下記式(3)で表される磁性酸化鉄が好ましい。
(FeO)n・Fe2O3 (3)
(式(3)中、nは0〜1の範囲内の実数を表す。)
【0029】
なお、上記式(3)において、n=0の場合は、γ−酸化鉄(γ−Fe2O3)であり、また、n=1の場合は、マグネタイト(Fe3O4)である。なお、磁性金属酸化物には、結晶水を有する磁性金属酸化物も包含される。
【0030】
本発明の複合体は保磁力が小さく、超常磁性であることが好ましい。一般に、磁性体の磁化は粒子径の減少に従って減少し、粒子径が10nm以下になるとその傾向が強くなる。また、磁性体の保磁力も、粒子径の減少に伴って減少する。
従って、磁性金属酸化物の粒子径は、好ましくは2〜20nm、さらに好ましくは3〜15nm、さらに好ましくは3〜10nmの範囲内にある。
【0031】
また、本発明の第3級アミンとしては、アミノアルキルエーテル基、アミノシラン基等を有するものが用いられる。本発明の被覆方法としては、アミノアルキルエーテル化多糖を用いることが好ましい。本発明の蛍光物質には、量子ドット(QDs)の他、フルオロセイン(FITC)、ローダミン(TRITC)、PE、Alex Fluor、サイアニン(Cr3、Cy5)、テキサスレッド(Texas Red)等が用いられる。
【0032】
磁性ナノ粒子(TMADM)とマイナスに帯電している蛍光量子ドット(QDs655(−))とを混合する条件について、具体的には、1×104cellsの細胞に対して、磁性ナノ粒子を1〜15μg/Feに調整したものと、量子ドットを8.0nMに調整したものを使用する培地であらかじめ混合して用いることができる。混合時間は15分で十分である。最も高効率であるのは、磁性ナノ粒子3μg/Feの場合である。
【0033】
本発明の細胞の準備において、「ASCs」とは、脂肪組織由来幹細胞であり、脂肪組織に含まれる体性幹細胞のことをいうが、多分化能を維持している限りにおいて、当該体性幹細胞の培養(継代培養を含む)により得られる細胞も、ASCsに該当するものとする。後述の通り、ASCsはSVF画分を構成する細胞として又はSVF画分を用いた培養によって増殖した細胞として、単離された状態に調製される(ASCsの調製法は後述する。)。ここでの「単離された状態」とは、その本来の環境(即ち生体の一部を構成した状態)から取り出された状態、即ち人為的操作によって本来の存在状態と異なる状態で存在していることを意味する。
【0034】
(ASCsの調製法)
以下、ASCsの調製法の一例を説明する。
(1)脂肪組織からの細胞集団の調製
脂肪組織は動物から切除、吸引などの手段で採取される。ここでの用語「動物」はヒト、及びヒト以外の哺乳動物(ペット動物、家畜、実験動物を含む。具体的には例えばマウス、ラット、モルモット、ハムスター、サル、ウシ、ブタ、ヤギ、ヒツジ、イヌ、ネコ等)を含む。免疫拒絶の問題を回避するため、本発明の組織再生用組成物を適用する対象(レシピエント)と同一の個体から脂肪組織を採取することが好ましい。但し、同種の動物の脂肪組織(他家)又は異種動物の脂肪組織の使用を妨げるものではない。
【0035】
脂肪組織として皮下脂肪、内臓脂肪、筋肉内脂肪、筋肉間脂肪を例示できる。この中でも皮下脂肪は局所麻酔下で非常に簡単に採取できるため、採取の際の患者への負担が少なく、好ましい細胞源といえる。通常は一種類の脂肪組織を用いるが、二種類以上の脂肪組織を併用することも可能である。また、複数回に分けて採取した脂肪組織(同種の脂肪組織でなくてもよい)を混合し、以降の操作に使用してもよい。脂肪組織の採取量は、ドナーの種類や組織の種類、或いは必要とされるASCsの量を考慮して定めることができ、例えば、0.5〜100g程度である。ヒトをドナーとする場合にはドナーへの負担を考慮して一度に採取する量を約10〜20g以下にすることが好ましい。採取した脂肪組織は、必要に応じてそれに付着した血液成分の除去及び細片化を経た後、以下の酵素処理に供される。尚、脂肪組織を適当な緩衝液や培養液中で洗浄することによって血液成分を除去することができる。
【0036】
酵素処理は、脂肪組織をコラゲナーゼ、トリプシン、ディスパーゼ等の酵素によって消化することにより行う。このような酵素処理は当業者に既知の手法及び条件により実施すればよい(例えば、R.I. Freshney, Culture of Animal Cells: A Manual of Basic Technique, 4th Edition, A John Wiley & Sones Inc., Publication参照)。好ましくは、後述の実施例に記載の手法及び条件によってここでの酵素処理を行う。以上の酵素処理によって得られた細胞集団は、多分化能幹細胞、内皮細胞、間質細胞、血球系細胞、及び/又はこれらの前駆細胞等を含む。細胞集団を構成する細胞の種類や比率などは、使用した脂肪組織の由来や種類に依存する。
【0037】
(2)沈降細胞集団(SVF画分:stromal vascular fractions)の取得
細胞集団は続いて遠心処理に供される。遠心処理による沈渣を沈降細胞集団(本明細書では「SVF画分」ともいう)として回収する。遠心処理の条件は、細胞の種類や量によって異なるが、例えば、1〜10分間、800〜1500rpmである。尚、遠心処理に先立ち、酵素処理後の細胞集団をろ過等に供し、その中に含まれる酵素未消化組織等を除去しておくことが好ましい。
【0038】
ここで得られた「SVF画分」はASCsを含む。従って、SVF画分を用いて本発明の組織再生用組成物を調製することができる。つまり、本発明の組織再生用組成物の一態様では、SVF画分が含有されることになる。尚、SVF画分を構成する細胞の種類や比率などは、使用した脂肪組織の由来や種類、酵素処理の条件などに依存する。また、SVF画分は、CD34陽性且つCD45陰性の細胞集団と、CD34陽性且つCD45陰性の細胞集団を含む点によって特徴付けられる(国際公開第2006/006692A1号パンフレット)。
【0039】
(3)SVF画分からの不要細胞成分の除去
接着性細胞(ASCs)の選択培養及び細胞の回収SVF画分にはASCsの他、他の細胞成分(内皮細胞、間質細胞、血球系細胞、これらの前駆細胞等)が含まれる。そこで本発明の一態様では以下の選択培養を行い、SVF画分から不要な細胞成分を除去する。そして、その結果得られた細胞をASCsとして本発明の組織再生用組成物に用いる。
【0040】
まず、SVF画分を適当な培地に懸濁した後、培養皿に播種し、一晩培養する。培地交換によって浮遊細胞(非接着性細胞)を除去する。SVF画分に含まれる不要な細胞成分(内皮細胞、間質細胞、血球系細胞、これらの前駆細胞等)は、非接着性細胞であるため、培地交換によって除去することができる。その後、適宜培地交換(例えば、3日に一度)をしながら培養を継続する。必要に応じて継代培養を行う。継代数は特に限定されない。尚、培養用の培地には、通常の動物細胞培養用の培地を使用することができる。例えば、Dulbecco's modified Eagle's Medium(DMEM)(日水製薬株式会社等)、α−MEM(大日本製薬株式会社等)、DMED:Ham's F12混合培地(1:1)(大日本製薬株式会社等)、Ham's F12 medium(大日本製薬株式会社等)、MCDB201培地(機能性ペプチド研究所)等を使用することができる。血清(ウシ胎仔血清、ヒト血清、羊血清など)又は血清代替物(Knockout serum replacement(KSR)など)を添加した培地を使用してもよい。血清又は血清代替物の添加量は、例えば、5%(v/v)〜30%(v/v)の範囲内で設定可能である。
【0041】
以上の操作によって接着性細胞が選択的に生存・増殖する。続いて、増殖した細胞を回収する。回収操作は常法に従えばよく、例えば、酵素処理(トリプシンやディスパーゼ処理)後の細胞をセルスクレイパーやピペットなどで剥離することによって容易に回収することができる。また、市販の温度感受性培養皿などを用いてシート培養した場合は、酵素処理をせずにそのままシート状に細胞を回収することも可能である。このようにして回収した細胞(ASCs)を用いることにより、ASCsを高純度で含有する組織再生用組成物を調製することができる。
【0042】
(4)低血清培養(低血清培地での選択的培養)及び細胞の回収
本発明の一態様では、上記(3)の操作の代わりに又は上記(3)の操作の後に以下の低血清培養を行う。そして、その結果得られた細胞をASCsとして本発明の組織再生用組成物に用いる。
【0043】
低血清培養では、SVF画分((3)の後にこの工程を実施する場合には(3)で回収した細胞を用いる)を低血清条件下で培養し、目的の多分化能幹細胞(即ち、ASCs)を選択的に増殖させる。低血清培養法では用いる血清が少量で済むことから、本発明の組織再生用組成物を投与する対象(レシピエント)自身の血清を使用することが可能となる。即ち、自己血清を用いた培養が可能となる。自己血清を使用することによって、製造工程中から異種動物材料を除き、安全性が高く且つ高い治療効果を期待できる細胞製剤が提供される。ここでの「低血清条件下」とは、5%以下の血清を培地中に含む条件である。好ましくは、2%(v/v)以下の血清を含む培養液中で細胞培養する。更に好ましくは、2%(v/v)以下の血清と1〜100ng/mlの線維芽細胞増殖因子−2を含有する培養液中で細胞培養する。
【0044】
血清はウシ胎仔血清に限られるものではなく、ヒト血清や羊血清等を用いることができる。好ましくはヒト血清、更に好ましくは本発明の組織再生用組成物を適用する対象の血清(即ち自己血清)を用いる。
【0045】
培地は、使用の際に含有する血清量が低いことを条件として、通常の動物細胞培養用の培地を使用することができる。例えば、Dulbecco's modified Eagle's Medium(DMEM)(日水製薬株式会社等)、α−MEM(大日本製薬株式会社等)、DMED:Ham's F12混合培地(1:1)(大日本製薬株式会社等)、Ham's F12 medium(大日本製薬株式会社等)、MCDB201培地(機能性ペプチド研究所)等を使用することができる。
【0046】
以上の方法で培養することによって、多分化能幹細胞(ASCs)を選択的に増殖させることができる。また、上記の培養条件で増殖する多分化能幹細胞(ASCs)は高い増殖活性を持つので、継代培養によって、本発明の組織再生用組成物に必要とされる数の細胞を容易に調製することができる。尚、SVF画分を低血清培養することによって選択的に増殖する細胞はCD13、CD90及びCD105陽性であり、CD31、CD34、CD45、CD106及びCD117陰性である(国際公開第2006/006692A1号パンフレット)。
【0047】
続いて、上記の低血清培養によって選択的に増殖した細胞を回収する。回収操作は上記(3)の場合と同様に行うことができる。回収した細胞(ASCs)を用いることにより、ASCsを高純度で含有する組織再生用組成物を調製することができる。
【0048】
(細胞の磁性ナノ粒子複合体による標識方法)
本発明により提供される磁性ナノ粒子複合体は、生理学的に許容される水性磁性ゾルの状態で静脈内に投与された時に、実質的に凝集したりすることがなく、標的部位に特異的に集積するという顕著な特性を有している。そのため、当該磁性ナノ粒子複合体は、各種疾病ないし癌などの病巣部位のMRI診断用造影剤や高周波磁場照射による局所磁場治療剤などとして極めて有用である。
【0049】
本発明の磁性ナノ粒子複合体をMRI造影剤又は磁場治療剤として用いる場合、磁性ナノ粒子複合体は水性ゾルの形で使用することが好ましい。水性ゾル中の磁性ナノ粒子複合体の濃度は、その用途などに応じて広範囲にわたって変えることができるが、通常、金属換算で約0.1〜約2mol/L、特に0.3〜2mol/Lの範囲内が適している。また、該水性ゾルには、必要に応じて、例えば、塩化ナトリウム等の無機塩;ブドウ糖等の単糖類;マンニトール、ソルビトール等の糖アルコール類;乳酸塩、クエン酸塩、酒石酸塩等の有機酸塩;リン酸緩衝剤、トリス緩衝剤等の生理学的に許容される種々の助剤を添加することもできる。
【0050】
本発明の磁性ナノ粒子複合体をMRI造影剤として使用する場合、その投与量は、診断部位などによって異なるが、通常、金属換算で約1μmol/kg(体重)〜約10mmol/kg(体重)、好ましくは約2μmol/kg(体重)〜約1mmol/kg(体重)、更に好ましくは約5μmol/kg(体重)〜約100μmol/kg(体重)の範囲内である。投与は、例えば、静脈内、動脈内などへの注射、注入などにより行うことできるが、場合によっては、経口投与、腸内直接投与、膀胱内投与なども可能である。
【0051】
本発明の好ましい形態の磁性ナノ粒子複合体は、保存安定性に優れている。例えば、本発明の好ましい形態の磁性ナノ粒子複合体は、静脈投与すると、当該磁性ナノ粒子複合体が有する導入機能性分子の性質に従って、特異的且つ効率的に数分ないし24時間後には目的部位に集積する。これにより、MRI撮像によって病変部位の診断が好適に行われる。
【0052】
一方、本発明の磁性ナノ粒子複合体を磁場治療剤として使用する場合、その投与量は、処置すべき患者の症状の軽重、年齢、治療部位などによって異なるが、通常、金属換算で約10μmol/kg(体重)〜約10mmol/kg(体重)、好ましくは約20μmol/kg(体重)〜約1mmol/kg(体重)の範囲内である。投与は、前述のMRI造影剤の場合と同様、例えば、静脈内、動脈内などへの注射、注入などにより行うことができるが、場合によっては、治療部位への直接投与も可能である。
【0053】
本発明の好ましい形態の磁性ナノ粒子複合体は、保存安定性に優れている。例えば、本発明の好ましい形態の磁性ナノ粒子複合体は、静脈投与すると、当該磁性ナノ粒子複合体が有する導入機能性分子の性質に従い、特異的且つ効率的に数分ないし24時間後には目的部位に集積する。これにより、高周波磁場照射を実施することによって病変部位の治療が好適に行われる。照射する高周波磁場の周波数としては、一般に20KHz〜10MHz、好ましくは50KHz〜1MHz、更に好ましくは100〜500KHzの範囲内が適当である。また、磁場強度としては、一般に1mT以上、好ましくは5mT以上、更に好ましくは10mT以上が適切である。
【0054】
(本発明の磁性ナノ複合体の臨床的意義)
近年、MRI診断下での高周波焦点照射が可能になり、病変に対するピンポイント温熱療法が試行されている。本発明の磁性ナノ粒子複合体を用いるMRIによる微少病変の画像化は、このピンポイント療法を行う際のナビゲーターとなり、より精度の高い治療法の実現が可能になるものと期待される。
【0055】
磁性ナノ粒子に標的機能性分子を結合させ、MRIによる画像化を試みることは、幾つかの分子種について試みられてきた。例えば、モノクローナル抗体を用いることにより特異性の高い標的化が可能になる。しかし、抗体を臨床に応用する際、ヒト型抗体に変換させることが必須であることや、使用できるモノクローナル抗体の数が限られていること、また、1分子当たりの分子量が大きいために磁性ナノ粒子に対して再現性よく結合させるためのシステムが煩雑なこと、さらには、抗体を調製する際にエンドトキシンの混在を完全に防ぐことが困難なこと等、解決しなければならない問題が多く残されている。
これに対し、本発明の磁性ナノ粒子複合体は、磁性ナノ粒子と蛍光物質とを混合させるだけで、磁性ナノ粒子複合体(磁性−蛍光ハイブリット材料)を形成することができる。
【実施例】
【0056】
以下、実施例によって本発明を具体的に説明するが、本発明はこれらに限定されるものではない。
本発明において、蛍光物質としてのQDs(量子ドット)と、TMADM(磁性粒子)を同時に分子イメージングできるかを検討した。
TMADMを細胞内へのキャリアとして用い、QDsが細胞内に取り込まれるかを検討する。ここで、QDs655濃度を一定にし、TMADM濃度を変化させた。
【0057】
(実験方法)
[材料]
<動物>
ASCs:C57BL/6 Cr オスから採集し、上記ASCsの調製法により調製したASCsを用いた。なお、Pass回数(継代回数)は1〜5回である。
【0058】
<イメージング材料>
QSsとしては、Invitrogen社製の、Qdot ITK(Inovator's Tool Kit)Carboxyl Quantum Dots、又は、Qdot ITK(Inovator's Tool Kit)Amino(PEG) Quantum Dotsを用いた。以下、Qdot ITK(Inovator's Tool Kit)Carboxyl Quantum DotsをQDs655(−)、Qdot ITK(Inovator's Tool Kit)Amino(PEG) Quantum DotsをQDs655(+)と称する。また、QDs655(−)、QDs655(+)を区別する必要が特にないときは、単に、QDs655と総称する。QDs655(−)、QDs655(+)は、それぞれ、濃度が8μMとなるように、50mM borate,pH9.0に懸濁されている。当該QDs655(−)、QDs655(+)の各懸濁液を250μL用意した。なお、当該QDs655(−)、QDs655(+)の各懸濁液は、2−6℃で保存することにより(凍結してはならない。)、少なくとも6ヶ月間安定である。
【0059】
磁性材料としては、名糖産業社製の、TMADM−03(テトラメチルアミノデキストランマグネタイト)、又は、ATDM(アルカリトリーティッドデキストランマグネタイト)を用いた。TMADM、ATDMは、それぞれ、濃度が5mg−Fe/mLとなるように、懸濁されている。当該TMADM、ATDMの各懸濁液を50mL用意した。なお、当該TMADM、ATDMの各懸濁液は、2−6℃で保存することができる(凍結してはならない。)。
磁性材料は、複合体を金属酸化物の金属質量に換算して、0.05mg/mLの濃度となるように、pH9.0のホウ酸バッファーで希釈して、複合体の水性ゾルを得た。
【0060】
図1にTMADMの構造を示し、図2にATDMの構造を示す。ここで、ATDMは比較対象である。
【0061】
[試験方法]
<細胞準備>
(1)C57BL/6 Cr SLC オスから脂肪細胞を分離し、上記ASCsの調製法によりASCsを調製した。ここで、「C57BL/6 Cr SLC」とは、近交系マウスの代表的な1種であり、黒い毛色を有している。近交系とは、兄妹交配あるいは親子交配を20代繰り返して、遺伝的統御が確立されているものである。
継代培養を繰り返し、2回passしたものを必要細胞数より多めに用意しておく。
(2)ASCsを96wellに1×104cells/wellで巻き込む。これは、細胞数をカウントした後、どのくらいの数を培養皿に巻き込むかを示している。基本的に、96wellプレートは、プレート及び各wellの面積が一律であり、その面積にどれだけの細胞数を巻き込んだかを示している。
接着するまで最低2時間静置した。
【0062】
<QDs655調整>
培地として、TMADM及びATDMが凝集しないDMEM+15%FBSを使用した。
また、QDs655が8nMにおいてASCsに対して毒性を示すことがなく、R8でほぼ100%導入することが分かっている。そのため、濃度としては8nMで試験を行った。ここで、R8のRとは、アミノ酸のアルギニンである。すなわち、R8はオクタアルギニンであり、アルギニンは電気的にプラスに帯電していることから、それらが8つ以上結合したものは細胞内への導入剤として注目されている。
【0063】
(3)QDs655(1μL)を培地(999μL)にて希釈した。これにより、8nMのQDs655を調製した。
(4)それらに対し、表1に示す量のTMADM又はATDMを添加した。
(5)TMADM又はATDMを添加した後、15分くらい反応のため、静置した。 (6)24時間後、蛍光顕微鏡にて、QDs655の取り込み状況を観察した。
【0064】
【表1】

【0065】
その結果を図3、図4に示す。図3は、本発明に係る顕微鏡写真及び蛍光顕微鏡写真であり、図4は、本発明に係る蛍光強度比較を示すグラフである。
なお、図3の左側に顕微鏡写真を示し、図3の右側に蛍光顕微鏡写真を示す。また、図3の左側の顕微鏡写真の右下に示すスケールの大きさは200μmである。
また、図4の縦軸は、蛍光強度を示している。図4に示すグラフでは、ASCsのみを観察した場合における蛍光強度によって補正を行っている。
【0066】
図3(a)は、ASCsのみを観察した結果を示す。図3(a)の蛍光顕微鏡写真では、蛍光がほとんど発せられていない。すなわち、ASCsのみでは、蛍光を発することはできない。
【0067】
図3(b)は、ASCsにQDs655(−)のみを添加して観察した結果を示す。図3(c)は、ASCsにQDs655(+)のみを添加して観察した結果を示す。図3(b)、(c)の蛍光顕微鏡写真では、蛍光がほとんど発せられていない。すなわち、ASCsにQDs655(−)又はQDs655(+)のみを添加しただけでは、蛍光を発することはできない。換言すれば、QDs655(−)又はQDs655(+)のみをASCsに添加しただけでは、QDs655(−)又はQDs655(+)はASCsに導入されない。
【0068】
図3(d)は、ASCsにTMADMのみを添加して観察した結果を示す。図3(e)は、ASCsにATDMのみを添加して観察した結果を示す。図3(d)、(e)の蛍光顕微鏡写真では、蛍光がほとんど発せられていない。すなわち、ASCsにTMADM又はATDMのみを添加しただけでは、蛍光を発することはできない。換言すれば、TMADM又はATDMは、蛍光を発していない。
【0069】
図3(f)は、ASCsにQDs655(−)と、3.0μgのTMADMとを添加して観察した結果を示す。図3(g)は、ASCsにQDs655(−)と、15μgのTMADMとを添加して観察した結果を示す。図3(h)は、ASCsにQDs655(−)と、30μgのTMADMとを添加して観察した結果を示す。図3(f)、(g)、(h)の蛍光顕微鏡写真では、ASCsの細胞質部分に相当する位置において、蛍光が発せられている。すなわち、蛍光量子ドットであるQDs655(−)が、TMADMをキャリアとしてASCsの細胞質に取り込まれている。
【0070】
図4に示すグラフおいて、TMADMを添加する量を増加させるほど、QDs655(−)の蛍光強度が大きくなっている(図4のグラフの右下斜線のハッチングで示すバーを参照。)。このことからも、QDs655(−)は、TMADMをキャリアとしてASCsの細胞内に取り込まれていることが分かる。換言すれば、TMADMとQDs655(−)とを15分程度混合するだけで、TMADMとQDS655(−)とからなる磁性ナノ粒子複合体(磁性−蛍光ハイブリット材料)が形成され、当該磁性ナノ粒子複合体がASCsの細胞内に取り込まれたと言える。
【0071】
図3(i)は、ASCsにQDs655(−)と、3.0μgのATDMとを添加して観察した結果を示す。図3(j)は、ASCsにQDs655(−)と、15μgのATDMとを添加して観察した結果を示す。図3(k)は、ASCsにQDs655(−)と、30μgのATDMとを添加して観察した結果を示す。図3(i)、(j)、(k)の蛍光顕微鏡写真では、ASCsの細胞質部分に相当する位置において、蛍光が発せられている部分が若干存在する。すなわち、蛍光量子ドットであるQDs655(−)が、ATDMをキャリアとしてASCsの細胞質に若干取り込まれていると考えられる。
【0072】
図4に示すグラフにおいて、ATDMを添加する量と、QDs655(−)の蛍光強度との間に相関性は見られない(図4のグラフの左下斜線のハッチングで示すバーを参照。)。そのため、QDs655(−)は、ATDMをキャリアとしてASCsの細胞内に取り込まれたとは言い切れない。
【0073】
図3(l)は、ASCsにQDs655(+)と、3.0μgのTMADMとを添加して観察した結果を示す。図3(m)は、ASCsにQDs655(+)と、15μgのTMADMとを添加して観察した結果を示す。図3(n)は、ASCsにQDs655(+)と、30μgのTMADMとを添加して観察した結果を示す。図3(l)、(m)、(n)の蛍光顕微鏡写真では、蛍光がほとんど発せられていない。すなわち、蛍光量子ドットであるQDs655(+)は、TMADMをキャリアとしてASCsの細胞質に取り込まれていない。
【0074】
図4に示すグラフにおいて、TMADMを添加する量と、QDS655(+)の蛍光強度との間に相関性は見られない(図4のグラフの黒で示すバーを参照。)。このことからも、QDs655(+)は、TMADMをキャリアとしてASCsの細胞内に取り込まれていないことが分かる。これは、蛍光量子ドットであるQDs655(+)がプラスに帯電しているため、表面がプラスに帯電した磁性粒子であるTMADMと複合体を形成できないためと考えられる。
【0075】
図3(o)は、ASCsにQDs655(+)と、3.0μgのATDMとを添加して観察した結果を示す。図3(p)は、ASCsにQDs655(+)と、15μgのATDMとを添加して観察した結果を示す。図3(q)は、ASCsにQDs655(+)と、30μgのATDMとを添加して観察した結果を示す。図3(o)、(p)、(q)の蛍光顕微鏡写真では、蛍光が発せられている部分が若干存在する。すなわち、蛍光量子ドットであるQDs655(−)が、何らかの形で、ASCsの細胞質に若干取り込まれていると考えられる。
【0076】
図4に示すグラフにおいて、ATDMを添加する量と、QDs655(+)の蛍光強度との間に相関性は見られない(図4のグラフの白で示すバーを参照。)。そのため、QDs655(+)は、ATDMをキャリアとしてASCsの細胞内に取り込まれたとは言い切れない。
【0077】
本発明に係る磁性ナノ粒子複合体は、核磁気共鳴イメージング(MRI)により、各種の疾病、癌などの病巣部位を特異的に検出することができる造影剤、高周波磁場を照射することにより病巣部位の温度を上昇させ、または細胞攪乱して病巣部位のみを選択的且つ特異的に死滅させる処置、各種疾病ないし癌の病巣部位のMRI診断用造影剤、局所磁場治療剤、併せて、蛍光による病巣部位を特異的に検出することができる蛍光剤、再生医療で臨床応用されている幹細胞移植治療におけるMRI、蛍光による詳細な細胞挙動解析、、幹細胞の集積箇所分析、及び細胞分化状態の把握等に有用である。
【技術分野】
【0001】
本発明は、各種細胞を磁性と蛍光とにより高効率にラベル化することが可能な磁性ナノ粒子複合体及び当該磁性ナノ粒子複合体による標識方法に関する。
【背景技術】
【0002】
近年、診断及びバイオセンサーを含む生物学的適用において、磁気物質はますます重要になってきている。そして、ナノ粒子を利用した生体染色(bio−imaging)、細胞分離(cell separaration)、生体内ドラッグデリバリー(drug delivery)及び遺伝子デリバリー(gene delivery)が、主要研究対象になってきている。特に、発光性量子ドットナノ粒子を利用して細胞内に量子ドット(quantum dot)を取り込み(uptake)、量子ドットから発散される蛍光を外部で測定する研究をはじめ、ナノ粒子を利用したバイオ分野へのアプローチが、数多く研究されている。
【0003】
また、量子ドットをはじめとする大部分のナノ粒子は、カドミウム、亜鉛、コバルトなどの重金属からなり、バイオ分野へ応用するためには、合成されたナノ粒子の表面を生体に適合するように(biocompatible)処理しなければならない。例えば、生体に無毒性を示すシリカやポリエチレングリコール(PEG)のような無機、有機化合物を、合成されたナノ粒子の表面に導入することによって、ナノ粒子の親水性を増加させることができる。このようにして、生体内の循環時間(circulation time)を増加させるなどの研究が急速に進められている。
【0004】
最近、国内外の研究者らは、量子ドットを利用したバイオ分野へのアプローチに対する問題点を解決する研究が盛んに行っている。例えば、国内外の研究者らは、磁気的性質を示すナノ粒子を合成し、当該ナノ粒子にシリカシェルを導入することにより、当該ナノ粒子をバイオ分野に適用させる研究を行っている。
【0005】
また、量子ドットを合成する技術は、非常に複雑で且つ難しい条件を経なければならならず、表面処理過程を通じた全体収率が非常に低いという問題点を有している。最近、量子ドットの表面に特定の癌細胞の結合が可能な抗体を導入させて癌細胞を認識する研究が進められている。しかし、この研究の最大の難点の1つである、量子ドットから発生する光を検出して位置を確認する方法は、生体外(in vitro)研究だけに有効であり、生体内(in vivo)の研究に対しては限界がある。その理由は、量子ドットから発散される光が生体組職を貫いて検出されにくいことにある。
【0006】
このような背景のもと、磁性を有するナノ粒子を生体内に導入し、磁性体が有する磁気的性質を磁気共鳴装置(MRI)のような外部の強い磁場によって検出するなどの有効利用が期待されている。
【0007】
本研究により、磁性ナノ粒子と蛍光物質を結合した材料を設計し合成することにより、ダブルイメージングが可能になることがわかってきた。
【0008】
しかしながら、これを実現するには、磁性粒子と蛍光物質を結合する合成作業が必要であり、その材料の調製に多大な手間と時間がかかるという問題がある。さらに、磁性粒子と蛍光物質を結合させることにより、単色の蛍光で発光させることしか出来ないという問題点もあった。
【0009】
例えば、特許文献1には、蛍光性を有する磁性ナノ粒子、その製造方法及びその用途に関する発明が記載されている。特許文献1の磁性ナノ粒子は、光学的性質及び磁気的性質を同時に有する。そのため、様々なバイオ分野への適用が可能である。また、シリカシェル等の水溶性物質を利用して表面改質することによって、多様な化学官能基をナノ物質に導入することができる。そして、これらの化学官能基を利用して細胞内への浸透力を増加または減少させることができるだけでなく、所望の特定の細胞だけに作用するように選択性を付与することができる。
【0010】
また、例えば、特許文献2には、ナノメートルサイズの蛍光性磁性粒子およびそれらの粒子の作製方法が記載されている。このナノ粒子は、磁性物質と蛍光物質を含むコア粒子を有し、粒子のサイズは約1マイクロメートル未満である。このナノ粒子は無機物の層または有機物の層で覆われて表面修飾され、多くの生物学的アッセイで使用される。
【0011】
しかしながら、特許文献1および特許文献2に係る発明は、磁性粒子と蛍光物質を結合して磁性ナノ粒子複合体を容易に形成し、磁性ナノ粒子複合体によって高効率かつ短時間で細胞を標識することができないという問題点がある。
【先行技術文献】
【特許文献】
【0012】
【特許文献1】特表2009−508105号公報
【特許文献2】特表2007−506934号公報
【発明の概要】
【発明が解決しようとする課題】
【0013】
本発明は、上述の問題に鑑みなされたもので、酸化鉄表面を第3級アミンで被覆することにより、表面をプラスに帯電させた磁性ナノ粒子と、量子ドット等の蛍光物質とを混合することにより、自己組織化により磁性−蛍光ハイブリット材料を高効率に得ることが可能な磁性ナノ粒子複合体及び当該磁性ナノ粒子複合体により細胞を高効率かつ短時間に標識する標識方法を提供することを目的とする。
【課題を解決するための手段】
【0014】
上述の課題を解決するべく鋭意研究した結果、以前、本発明者らは、新規な磁性ナノ粒子(TMADM)の開発に成功した。当該磁性ナノ粒子(TMADM)は、酸化鉄表面を第3級アミンで被覆することにより、表面をプラスに帯電させたものである。当該磁性ナノ粒子(TMADM)は、表面がプラスに帯電しているため、細胞内への導入効率が非常に高い特徴を有している。
【0015】
本発明者らは、今回、この磁性ナノ粒子(TMADM)と、マイナスに帯電している量子ドットとを、たった15分程度混合させるだけで、自己組織化により、磁性−蛍光ハイブリット材料を形成させ、当該磁性−蛍光ハイブリット材料を細胞に添加するだけで、高効率かつ短時間に、細胞を磁性、蛍光の両方で標識化(ダブルイメージング)することを可能とする標識方法を構築した。
【0016】
本発明に係る磁性ナノ粒子複合体は、酸化鉄表面を第3級アミンで被覆して表面をプラスに帯電した磁性ナノ粒子とマイナスに帯電している蛍光物質とを含む。
【0017】
本発明に係る磁性ナノ粒子複合体は、前記蛍光物質が、量子ドットであることが好ましい。
【0018】
本発明に係る磁性ナノ粒子複合体による細胞の標識方法は、酸化鉄表面を第3級アミンで被覆して表面をプラスに帯電した磁性ナノ粒子とマイナスに帯電している蛍光物質とを混合して細胞に添加する方法である。
【0019】
本発明に係る磁性ナノ粒子複合体による細胞の標識方法は、前記蛍光物質が量子ドットであることが好ましい。
【発明の効果】
【0020】
本発明によれば、磁性ナノ粒子をマイナスチャージの蛍光物質と共に、短時間混合させて細胞に添加するだけで、高効率に細胞を磁性、蛍光の両方で標識化することを可能とし、これにより、発光性量子ドットに留まらず、様々な蛍光物質を細胞内に導入することができる。
【図面の簡単な説明】
【0021】
【図1】本発明に係るTMADMの構造図である。
【図2】比較例に係るATDMの構造図である。
【図3】本発明に係る顕微鏡写真及び蛍光顕微鏡写真である。
【図4】本発明に係る蛍光強度比較を示すグラフである。
【発明を実施するための形態】
【0022】
以下、本発明の好適な実施形態につき説明する。
本発明は、酸化鉄表面を第3級アミンで被覆して表面をプラスに帯電させた磁性ナノ粒子(以下、「TMADM」と称する。)とマイナスに帯電している蛍光物質とを含む磁性ナノ粒子複合体である。
【0023】
また、本発明は、酸化鉄表面を第3級アミンで被覆して表面をプラスに帯電させた磁性ナノ粒子とマイナスに帯電している蛍光物質を混合して細胞に添加する、細胞の標識方法である。
これにより、本発明は、当該磁性ナノ粒子複合体(磁性−蛍光ハイブリット材料)を細胞に添加して、細胞を磁性、蛍光の両方で標識化(ダブルイメージング)することができる。
【0024】
以下、磁性ナノ粒子(TMADM)について説明する。
本発明のTMADMを構成する酸化鉄としては、磁性金属酸化物であり、強磁性の粒子が用いられ、好ましくは、保持力が小さく、超常磁性であることが望ましい。
【0025】
具体的な磁性金属酸化物としては、例えば、下記式(1)で表される化合物が挙げられる。
(MIIO)l・M2IIIO3 (1)
(式(1)中、MIIは2価の金属原子を表し、MIIIは3価の金属原子を表し、lは0〜1の範囲内の実数を表す。)
【0026】
上記式(1)において、2価の金属原子MIIとしては、例えば、マグネシウム、カルシウム、マンガン、鉄、ニッケル、コバルト、銅、亜鉛、ストロンチウム、バリウム等が挙げられ、これらは単独で使用することもでき、あるいは2種以上併用することもできる。また、3価の金属原子MIIIとしては、例えば、アルミニウム、鉄、イットリウム、ネオジウム、サマリウム、ユーロピウム、ガドリニウム等が挙げられ、これらはそれぞれ単独で使用するか、あるいは2種以上組み合わせて用いることができる。
【0027】
磁性金属酸化物は、上記式(1)で表される化合物中、好ましくは、MIIIが3価の鉄である磁性金属酸化物、すなわち下記式(2)で示されるフェライトである。
(MIIO)m・Fe2O3 (2)
(式(2)中、MIIは2価の金属原子を表し、mは0〜1の範囲内の実数を表す。)
【0028】
ここで、MIIとしては、上記式(1)において挙げたものと同じ金属原子を挙げることができる。特に、MIIが2価の鉄である場合の上記式(2)の磁性金属酸化物、すなわち下記式(3)で表される磁性酸化鉄が好ましい。
(FeO)n・Fe2O3 (3)
(式(3)中、nは0〜1の範囲内の実数を表す。)
【0029】
なお、上記式(3)において、n=0の場合は、γ−酸化鉄(γ−Fe2O3)であり、また、n=1の場合は、マグネタイト(Fe3O4)である。なお、磁性金属酸化物には、結晶水を有する磁性金属酸化物も包含される。
【0030】
本発明の複合体は保磁力が小さく、超常磁性であることが好ましい。一般に、磁性体の磁化は粒子径の減少に従って減少し、粒子径が10nm以下になるとその傾向が強くなる。また、磁性体の保磁力も、粒子径の減少に伴って減少する。
従って、磁性金属酸化物の粒子径は、好ましくは2〜20nm、さらに好ましくは3〜15nm、さらに好ましくは3〜10nmの範囲内にある。
【0031】
また、本発明の第3級アミンとしては、アミノアルキルエーテル基、アミノシラン基等を有するものが用いられる。本発明の被覆方法としては、アミノアルキルエーテル化多糖を用いることが好ましい。本発明の蛍光物質には、量子ドット(QDs)の他、フルオロセイン(FITC)、ローダミン(TRITC)、PE、Alex Fluor、サイアニン(Cr3、Cy5)、テキサスレッド(Texas Red)等が用いられる。
【0032】
磁性ナノ粒子(TMADM)とマイナスに帯電している蛍光量子ドット(QDs655(−))とを混合する条件について、具体的には、1×104cellsの細胞に対して、磁性ナノ粒子を1〜15μg/Feに調整したものと、量子ドットを8.0nMに調整したものを使用する培地であらかじめ混合して用いることができる。混合時間は15分で十分である。最も高効率であるのは、磁性ナノ粒子3μg/Feの場合である。
【0033】
本発明の細胞の準備において、「ASCs」とは、脂肪組織由来幹細胞であり、脂肪組織に含まれる体性幹細胞のことをいうが、多分化能を維持している限りにおいて、当該体性幹細胞の培養(継代培養を含む)により得られる細胞も、ASCsに該当するものとする。後述の通り、ASCsはSVF画分を構成する細胞として又はSVF画分を用いた培養によって増殖した細胞として、単離された状態に調製される(ASCsの調製法は後述する。)。ここでの「単離された状態」とは、その本来の環境(即ち生体の一部を構成した状態)から取り出された状態、即ち人為的操作によって本来の存在状態と異なる状態で存在していることを意味する。
【0034】
(ASCsの調製法)
以下、ASCsの調製法の一例を説明する。
(1)脂肪組織からの細胞集団の調製
脂肪組織は動物から切除、吸引などの手段で採取される。ここでの用語「動物」はヒト、及びヒト以外の哺乳動物(ペット動物、家畜、実験動物を含む。具体的には例えばマウス、ラット、モルモット、ハムスター、サル、ウシ、ブタ、ヤギ、ヒツジ、イヌ、ネコ等)を含む。免疫拒絶の問題を回避するため、本発明の組織再生用組成物を適用する対象(レシピエント)と同一の個体から脂肪組織を採取することが好ましい。但し、同種の動物の脂肪組織(他家)又は異種動物の脂肪組織の使用を妨げるものではない。
【0035】
脂肪組織として皮下脂肪、内臓脂肪、筋肉内脂肪、筋肉間脂肪を例示できる。この中でも皮下脂肪は局所麻酔下で非常に簡単に採取できるため、採取の際の患者への負担が少なく、好ましい細胞源といえる。通常は一種類の脂肪組織を用いるが、二種類以上の脂肪組織を併用することも可能である。また、複数回に分けて採取した脂肪組織(同種の脂肪組織でなくてもよい)を混合し、以降の操作に使用してもよい。脂肪組織の採取量は、ドナーの種類や組織の種類、或いは必要とされるASCsの量を考慮して定めることができ、例えば、0.5〜100g程度である。ヒトをドナーとする場合にはドナーへの負担を考慮して一度に採取する量を約10〜20g以下にすることが好ましい。採取した脂肪組織は、必要に応じてそれに付着した血液成分の除去及び細片化を経た後、以下の酵素処理に供される。尚、脂肪組織を適当な緩衝液や培養液中で洗浄することによって血液成分を除去することができる。
【0036】
酵素処理は、脂肪組織をコラゲナーゼ、トリプシン、ディスパーゼ等の酵素によって消化することにより行う。このような酵素処理は当業者に既知の手法及び条件により実施すればよい(例えば、R.I. Freshney, Culture of Animal Cells: A Manual of Basic Technique, 4th Edition, A John Wiley & Sones Inc., Publication参照)。好ましくは、後述の実施例に記載の手法及び条件によってここでの酵素処理を行う。以上の酵素処理によって得られた細胞集団は、多分化能幹細胞、内皮細胞、間質細胞、血球系細胞、及び/又はこれらの前駆細胞等を含む。細胞集団を構成する細胞の種類や比率などは、使用した脂肪組織の由来や種類に依存する。
【0037】
(2)沈降細胞集団(SVF画分:stromal vascular fractions)の取得
細胞集団は続いて遠心処理に供される。遠心処理による沈渣を沈降細胞集団(本明細書では「SVF画分」ともいう)として回収する。遠心処理の条件は、細胞の種類や量によって異なるが、例えば、1〜10分間、800〜1500rpmである。尚、遠心処理に先立ち、酵素処理後の細胞集団をろ過等に供し、その中に含まれる酵素未消化組織等を除去しておくことが好ましい。
【0038】
ここで得られた「SVF画分」はASCsを含む。従って、SVF画分を用いて本発明の組織再生用組成物を調製することができる。つまり、本発明の組織再生用組成物の一態様では、SVF画分が含有されることになる。尚、SVF画分を構成する細胞の種類や比率などは、使用した脂肪組織の由来や種類、酵素処理の条件などに依存する。また、SVF画分は、CD34陽性且つCD45陰性の細胞集団と、CD34陽性且つCD45陰性の細胞集団を含む点によって特徴付けられる(国際公開第2006/006692A1号パンフレット)。
【0039】
(3)SVF画分からの不要細胞成分の除去
接着性細胞(ASCs)の選択培養及び細胞の回収SVF画分にはASCsの他、他の細胞成分(内皮細胞、間質細胞、血球系細胞、これらの前駆細胞等)が含まれる。そこで本発明の一態様では以下の選択培養を行い、SVF画分から不要な細胞成分を除去する。そして、その結果得られた細胞をASCsとして本発明の組織再生用組成物に用いる。
【0040】
まず、SVF画分を適当な培地に懸濁した後、培養皿に播種し、一晩培養する。培地交換によって浮遊細胞(非接着性細胞)を除去する。SVF画分に含まれる不要な細胞成分(内皮細胞、間質細胞、血球系細胞、これらの前駆細胞等)は、非接着性細胞であるため、培地交換によって除去することができる。その後、適宜培地交換(例えば、3日に一度)をしながら培養を継続する。必要に応じて継代培養を行う。継代数は特に限定されない。尚、培養用の培地には、通常の動物細胞培養用の培地を使用することができる。例えば、Dulbecco's modified Eagle's Medium(DMEM)(日水製薬株式会社等)、α−MEM(大日本製薬株式会社等)、DMED:Ham's F12混合培地(1:1)(大日本製薬株式会社等)、Ham's F12 medium(大日本製薬株式会社等)、MCDB201培地(機能性ペプチド研究所)等を使用することができる。血清(ウシ胎仔血清、ヒト血清、羊血清など)又は血清代替物(Knockout serum replacement(KSR)など)を添加した培地を使用してもよい。血清又は血清代替物の添加量は、例えば、5%(v/v)〜30%(v/v)の範囲内で設定可能である。
【0041】
以上の操作によって接着性細胞が選択的に生存・増殖する。続いて、増殖した細胞を回収する。回収操作は常法に従えばよく、例えば、酵素処理(トリプシンやディスパーゼ処理)後の細胞をセルスクレイパーやピペットなどで剥離することによって容易に回収することができる。また、市販の温度感受性培養皿などを用いてシート培養した場合は、酵素処理をせずにそのままシート状に細胞を回収することも可能である。このようにして回収した細胞(ASCs)を用いることにより、ASCsを高純度で含有する組織再生用組成物を調製することができる。
【0042】
(4)低血清培養(低血清培地での選択的培養)及び細胞の回収
本発明の一態様では、上記(3)の操作の代わりに又は上記(3)の操作の後に以下の低血清培養を行う。そして、その結果得られた細胞をASCsとして本発明の組織再生用組成物に用いる。
【0043】
低血清培養では、SVF画分((3)の後にこの工程を実施する場合には(3)で回収した細胞を用いる)を低血清条件下で培養し、目的の多分化能幹細胞(即ち、ASCs)を選択的に増殖させる。低血清培養法では用いる血清が少量で済むことから、本発明の組織再生用組成物を投与する対象(レシピエント)自身の血清を使用することが可能となる。即ち、自己血清を用いた培養が可能となる。自己血清を使用することによって、製造工程中から異種動物材料を除き、安全性が高く且つ高い治療効果を期待できる細胞製剤が提供される。ここでの「低血清条件下」とは、5%以下の血清を培地中に含む条件である。好ましくは、2%(v/v)以下の血清を含む培養液中で細胞培養する。更に好ましくは、2%(v/v)以下の血清と1〜100ng/mlの線維芽細胞増殖因子−2を含有する培養液中で細胞培養する。
【0044】
血清はウシ胎仔血清に限られるものではなく、ヒト血清や羊血清等を用いることができる。好ましくはヒト血清、更に好ましくは本発明の組織再生用組成物を適用する対象の血清(即ち自己血清)を用いる。
【0045】
培地は、使用の際に含有する血清量が低いことを条件として、通常の動物細胞培養用の培地を使用することができる。例えば、Dulbecco's modified Eagle's Medium(DMEM)(日水製薬株式会社等)、α−MEM(大日本製薬株式会社等)、DMED:Ham's F12混合培地(1:1)(大日本製薬株式会社等)、Ham's F12 medium(大日本製薬株式会社等)、MCDB201培地(機能性ペプチド研究所)等を使用することができる。
【0046】
以上の方法で培養することによって、多分化能幹細胞(ASCs)を選択的に増殖させることができる。また、上記の培養条件で増殖する多分化能幹細胞(ASCs)は高い増殖活性を持つので、継代培養によって、本発明の組織再生用組成物に必要とされる数の細胞を容易に調製することができる。尚、SVF画分を低血清培養することによって選択的に増殖する細胞はCD13、CD90及びCD105陽性であり、CD31、CD34、CD45、CD106及びCD117陰性である(国際公開第2006/006692A1号パンフレット)。
【0047】
続いて、上記の低血清培養によって選択的に増殖した細胞を回収する。回収操作は上記(3)の場合と同様に行うことができる。回収した細胞(ASCs)を用いることにより、ASCsを高純度で含有する組織再生用組成物を調製することができる。
【0048】
(細胞の磁性ナノ粒子複合体による標識方法)
本発明により提供される磁性ナノ粒子複合体は、生理学的に許容される水性磁性ゾルの状態で静脈内に投与された時に、実質的に凝集したりすることがなく、標的部位に特異的に集積するという顕著な特性を有している。そのため、当該磁性ナノ粒子複合体は、各種疾病ないし癌などの病巣部位のMRI診断用造影剤や高周波磁場照射による局所磁場治療剤などとして極めて有用である。
【0049】
本発明の磁性ナノ粒子複合体をMRI造影剤又は磁場治療剤として用いる場合、磁性ナノ粒子複合体は水性ゾルの形で使用することが好ましい。水性ゾル中の磁性ナノ粒子複合体の濃度は、その用途などに応じて広範囲にわたって変えることができるが、通常、金属換算で約0.1〜約2mol/L、特に0.3〜2mol/Lの範囲内が適している。また、該水性ゾルには、必要に応じて、例えば、塩化ナトリウム等の無機塩;ブドウ糖等の単糖類;マンニトール、ソルビトール等の糖アルコール類;乳酸塩、クエン酸塩、酒石酸塩等の有機酸塩;リン酸緩衝剤、トリス緩衝剤等の生理学的に許容される種々の助剤を添加することもできる。
【0050】
本発明の磁性ナノ粒子複合体をMRI造影剤として使用する場合、その投与量は、診断部位などによって異なるが、通常、金属換算で約1μmol/kg(体重)〜約10mmol/kg(体重)、好ましくは約2μmol/kg(体重)〜約1mmol/kg(体重)、更に好ましくは約5μmol/kg(体重)〜約100μmol/kg(体重)の範囲内である。投与は、例えば、静脈内、動脈内などへの注射、注入などにより行うことできるが、場合によっては、経口投与、腸内直接投与、膀胱内投与なども可能である。
【0051】
本発明の好ましい形態の磁性ナノ粒子複合体は、保存安定性に優れている。例えば、本発明の好ましい形態の磁性ナノ粒子複合体は、静脈投与すると、当該磁性ナノ粒子複合体が有する導入機能性分子の性質に従って、特異的且つ効率的に数分ないし24時間後には目的部位に集積する。これにより、MRI撮像によって病変部位の診断が好適に行われる。
【0052】
一方、本発明の磁性ナノ粒子複合体を磁場治療剤として使用する場合、その投与量は、処置すべき患者の症状の軽重、年齢、治療部位などによって異なるが、通常、金属換算で約10μmol/kg(体重)〜約10mmol/kg(体重)、好ましくは約20μmol/kg(体重)〜約1mmol/kg(体重)の範囲内である。投与は、前述のMRI造影剤の場合と同様、例えば、静脈内、動脈内などへの注射、注入などにより行うことができるが、場合によっては、治療部位への直接投与も可能である。
【0053】
本発明の好ましい形態の磁性ナノ粒子複合体は、保存安定性に優れている。例えば、本発明の好ましい形態の磁性ナノ粒子複合体は、静脈投与すると、当該磁性ナノ粒子複合体が有する導入機能性分子の性質に従い、特異的且つ効率的に数分ないし24時間後には目的部位に集積する。これにより、高周波磁場照射を実施することによって病変部位の治療が好適に行われる。照射する高周波磁場の周波数としては、一般に20KHz〜10MHz、好ましくは50KHz〜1MHz、更に好ましくは100〜500KHzの範囲内が適当である。また、磁場強度としては、一般に1mT以上、好ましくは5mT以上、更に好ましくは10mT以上が適切である。
【0054】
(本発明の磁性ナノ複合体の臨床的意義)
近年、MRI診断下での高周波焦点照射が可能になり、病変に対するピンポイント温熱療法が試行されている。本発明の磁性ナノ粒子複合体を用いるMRIによる微少病変の画像化は、このピンポイント療法を行う際のナビゲーターとなり、より精度の高い治療法の実現が可能になるものと期待される。
【0055】
磁性ナノ粒子に標的機能性分子を結合させ、MRIによる画像化を試みることは、幾つかの分子種について試みられてきた。例えば、モノクローナル抗体を用いることにより特異性の高い標的化が可能になる。しかし、抗体を臨床に応用する際、ヒト型抗体に変換させることが必須であることや、使用できるモノクローナル抗体の数が限られていること、また、1分子当たりの分子量が大きいために磁性ナノ粒子に対して再現性よく結合させるためのシステムが煩雑なこと、さらには、抗体を調製する際にエンドトキシンの混在を完全に防ぐことが困難なこと等、解決しなければならない問題が多く残されている。
これに対し、本発明の磁性ナノ粒子複合体は、磁性ナノ粒子と蛍光物質とを混合させるだけで、磁性ナノ粒子複合体(磁性−蛍光ハイブリット材料)を形成することができる。
【実施例】
【0056】
以下、実施例によって本発明を具体的に説明するが、本発明はこれらに限定されるものではない。
本発明において、蛍光物質としてのQDs(量子ドット)と、TMADM(磁性粒子)を同時に分子イメージングできるかを検討した。
TMADMを細胞内へのキャリアとして用い、QDsが細胞内に取り込まれるかを検討する。ここで、QDs655濃度を一定にし、TMADM濃度を変化させた。
【0057】
(実験方法)
[材料]
<動物>
ASCs:C57BL/6 Cr オスから採集し、上記ASCsの調製法により調製したASCsを用いた。なお、Pass回数(継代回数)は1〜5回である。
【0058】
<イメージング材料>
QSsとしては、Invitrogen社製の、Qdot ITK(Inovator's Tool Kit)Carboxyl Quantum Dots、又は、Qdot ITK(Inovator's Tool Kit)Amino(PEG) Quantum Dotsを用いた。以下、Qdot ITK(Inovator's Tool Kit)Carboxyl Quantum DotsをQDs655(−)、Qdot ITK(Inovator's Tool Kit)Amino(PEG) Quantum DotsをQDs655(+)と称する。また、QDs655(−)、QDs655(+)を区別する必要が特にないときは、単に、QDs655と総称する。QDs655(−)、QDs655(+)は、それぞれ、濃度が8μMとなるように、50mM borate,pH9.0に懸濁されている。当該QDs655(−)、QDs655(+)の各懸濁液を250μL用意した。なお、当該QDs655(−)、QDs655(+)の各懸濁液は、2−6℃で保存することにより(凍結してはならない。)、少なくとも6ヶ月間安定である。
【0059】
磁性材料としては、名糖産業社製の、TMADM−03(テトラメチルアミノデキストランマグネタイト)、又は、ATDM(アルカリトリーティッドデキストランマグネタイト)を用いた。TMADM、ATDMは、それぞれ、濃度が5mg−Fe/mLとなるように、懸濁されている。当該TMADM、ATDMの各懸濁液を50mL用意した。なお、当該TMADM、ATDMの各懸濁液は、2−6℃で保存することができる(凍結してはならない。)。
磁性材料は、複合体を金属酸化物の金属質量に換算して、0.05mg/mLの濃度となるように、pH9.0のホウ酸バッファーで希釈して、複合体の水性ゾルを得た。
【0060】
図1にTMADMの構造を示し、図2にATDMの構造を示す。ここで、ATDMは比較対象である。
【0061】
[試験方法]
<細胞準備>
(1)C57BL/6 Cr SLC オスから脂肪細胞を分離し、上記ASCsの調製法によりASCsを調製した。ここで、「C57BL/6 Cr SLC」とは、近交系マウスの代表的な1種であり、黒い毛色を有している。近交系とは、兄妹交配あるいは親子交配を20代繰り返して、遺伝的統御が確立されているものである。
継代培養を繰り返し、2回passしたものを必要細胞数より多めに用意しておく。
(2)ASCsを96wellに1×104cells/wellで巻き込む。これは、細胞数をカウントした後、どのくらいの数を培養皿に巻き込むかを示している。基本的に、96wellプレートは、プレート及び各wellの面積が一律であり、その面積にどれだけの細胞数を巻き込んだかを示している。
接着するまで最低2時間静置した。
【0062】
<QDs655調整>
培地として、TMADM及びATDMが凝集しないDMEM+15%FBSを使用した。
また、QDs655が8nMにおいてASCsに対して毒性を示すことがなく、R8でほぼ100%導入することが分かっている。そのため、濃度としては8nMで試験を行った。ここで、R8のRとは、アミノ酸のアルギニンである。すなわち、R8はオクタアルギニンであり、アルギニンは電気的にプラスに帯電していることから、それらが8つ以上結合したものは細胞内への導入剤として注目されている。
【0063】
(3)QDs655(1μL)を培地(999μL)にて希釈した。これにより、8nMのQDs655を調製した。
(4)それらに対し、表1に示す量のTMADM又はATDMを添加した。
(5)TMADM又はATDMを添加した後、15分くらい反応のため、静置した。 (6)24時間後、蛍光顕微鏡にて、QDs655の取り込み状況を観察した。
【0064】
【表1】

【0065】
その結果を図3、図4に示す。図3は、本発明に係る顕微鏡写真及び蛍光顕微鏡写真であり、図4は、本発明に係る蛍光強度比較を示すグラフである。
なお、図3の左側に顕微鏡写真を示し、図3の右側に蛍光顕微鏡写真を示す。また、図3の左側の顕微鏡写真の右下に示すスケールの大きさは200μmである。
また、図4の縦軸は、蛍光強度を示している。図4に示すグラフでは、ASCsのみを観察した場合における蛍光強度によって補正を行っている。
【0066】
図3(a)は、ASCsのみを観察した結果を示す。図3(a)の蛍光顕微鏡写真では、蛍光がほとんど発せられていない。すなわち、ASCsのみでは、蛍光を発することはできない。
【0067】
図3(b)は、ASCsにQDs655(−)のみを添加して観察した結果を示す。図3(c)は、ASCsにQDs655(+)のみを添加して観察した結果を示す。図3(b)、(c)の蛍光顕微鏡写真では、蛍光がほとんど発せられていない。すなわち、ASCsにQDs655(−)又はQDs655(+)のみを添加しただけでは、蛍光を発することはできない。換言すれば、QDs655(−)又はQDs655(+)のみをASCsに添加しただけでは、QDs655(−)又はQDs655(+)はASCsに導入されない。
【0068】
図3(d)は、ASCsにTMADMのみを添加して観察した結果を示す。図3(e)は、ASCsにATDMのみを添加して観察した結果を示す。図3(d)、(e)の蛍光顕微鏡写真では、蛍光がほとんど発せられていない。すなわち、ASCsにTMADM又はATDMのみを添加しただけでは、蛍光を発することはできない。換言すれば、TMADM又はATDMは、蛍光を発していない。
【0069】
図3(f)は、ASCsにQDs655(−)と、3.0μgのTMADMとを添加して観察した結果を示す。図3(g)は、ASCsにQDs655(−)と、15μgのTMADMとを添加して観察した結果を示す。図3(h)は、ASCsにQDs655(−)と、30μgのTMADMとを添加して観察した結果を示す。図3(f)、(g)、(h)の蛍光顕微鏡写真では、ASCsの細胞質部分に相当する位置において、蛍光が発せられている。すなわち、蛍光量子ドットであるQDs655(−)が、TMADMをキャリアとしてASCsの細胞質に取り込まれている。
【0070】
図4に示すグラフおいて、TMADMを添加する量を増加させるほど、QDs655(−)の蛍光強度が大きくなっている(図4のグラフの右下斜線のハッチングで示すバーを参照。)。このことからも、QDs655(−)は、TMADMをキャリアとしてASCsの細胞内に取り込まれていることが分かる。換言すれば、TMADMとQDs655(−)とを15分程度混合するだけで、TMADMとQDS655(−)とからなる磁性ナノ粒子複合体(磁性−蛍光ハイブリット材料)が形成され、当該磁性ナノ粒子複合体がASCsの細胞内に取り込まれたと言える。
【0071】
図3(i)は、ASCsにQDs655(−)と、3.0μgのATDMとを添加して観察した結果を示す。図3(j)は、ASCsにQDs655(−)と、15μgのATDMとを添加して観察した結果を示す。図3(k)は、ASCsにQDs655(−)と、30μgのATDMとを添加して観察した結果を示す。図3(i)、(j)、(k)の蛍光顕微鏡写真では、ASCsの細胞質部分に相当する位置において、蛍光が発せられている部分が若干存在する。すなわち、蛍光量子ドットであるQDs655(−)が、ATDMをキャリアとしてASCsの細胞質に若干取り込まれていると考えられる。
【0072】
図4に示すグラフにおいて、ATDMを添加する量と、QDs655(−)の蛍光強度との間に相関性は見られない(図4のグラフの左下斜線のハッチングで示すバーを参照。)。そのため、QDs655(−)は、ATDMをキャリアとしてASCsの細胞内に取り込まれたとは言い切れない。
【0073】
図3(l)は、ASCsにQDs655(+)と、3.0μgのTMADMとを添加して観察した結果を示す。図3(m)は、ASCsにQDs655(+)と、15μgのTMADMとを添加して観察した結果を示す。図3(n)は、ASCsにQDs655(+)と、30μgのTMADMとを添加して観察した結果を示す。図3(l)、(m)、(n)の蛍光顕微鏡写真では、蛍光がほとんど発せられていない。すなわち、蛍光量子ドットであるQDs655(+)は、TMADMをキャリアとしてASCsの細胞質に取り込まれていない。
【0074】
図4に示すグラフにおいて、TMADMを添加する量と、QDS655(+)の蛍光強度との間に相関性は見られない(図4のグラフの黒で示すバーを参照。)。このことからも、QDs655(+)は、TMADMをキャリアとしてASCsの細胞内に取り込まれていないことが分かる。これは、蛍光量子ドットであるQDs655(+)がプラスに帯電しているため、表面がプラスに帯電した磁性粒子であるTMADMと複合体を形成できないためと考えられる。
【0075】
図3(o)は、ASCsにQDs655(+)と、3.0μgのATDMとを添加して観察した結果を示す。図3(p)は、ASCsにQDs655(+)と、15μgのATDMとを添加して観察した結果を示す。図3(q)は、ASCsにQDs655(+)と、30μgのATDMとを添加して観察した結果を示す。図3(o)、(p)、(q)の蛍光顕微鏡写真では、蛍光が発せられている部分が若干存在する。すなわち、蛍光量子ドットであるQDs655(−)が、何らかの形で、ASCsの細胞質に若干取り込まれていると考えられる。
【0076】
図4に示すグラフにおいて、ATDMを添加する量と、QDs655(+)の蛍光強度との間に相関性は見られない(図4のグラフの白で示すバーを参照。)。そのため、QDs655(+)は、ATDMをキャリアとしてASCsの細胞内に取り込まれたとは言い切れない。
【0077】
本発明に係る磁性ナノ粒子複合体は、核磁気共鳴イメージング(MRI)により、各種の疾病、癌などの病巣部位を特異的に検出することができる造影剤、高周波磁場を照射することにより病巣部位の温度を上昇させ、または細胞攪乱して病巣部位のみを選択的且つ特異的に死滅させる処置、各種疾病ないし癌の病巣部位のMRI診断用造影剤、局所磁場治療剤、併せて、蛍光による病巣部位を特異的に検出することができる蛍光剤、再生医療で臨床応用されている幹細胞移植治療におけるMRI、蛍光による詳細な細胞挙動解析、、幹細胞の集積箇所分析、及び細胞分化状態の把握等に有用である。
【特許請求の範囲】
【請求項1】
酸化鉄表面を第3級アミンで被覆して表面をプラスに帯電させた磁性ナノ粒子とマイナスに帯電している蛍光物質とを含む磁性ナノ粒子複合体。
【請求項2】
前記蛍光物質が、量子ドットであることを特徴とする請求項1に記載の磁性ナノ粒子複合体。
【請求項3】
酸化鉄表面を第3級アミンで被覆して表面をプラスに帯電させた磁性ナノ粒子とマイナスに帯電している蛍光物質とを混合して細胞に添加する、磁性ナノ粒子複合体による細胞の標識方法。
【請求項4】
前記蛍光物質が、量子ドットであることを特徴とする請求項3に記載の磁性ナノ粒子複合体による細胞の標識方法。
【請求項1】
酸化鉄表面を第3級アミンで被覆して表面をプラスに帯電させた磁性ナノ粒子とマイナスに帯電している蛍光物質とを含む磁性ナノ粒子複合体。
【請求項2】
前記蛍光物質が、量子ドットであることを特徴とする請求項1に記載の磁性ナノ粒子複合体。
【請求項3】
酸化鉄表面を第3級アミンで被覆して表面をプラスに帯電させた磁性ナノ粒子とマイナスに帯電している蛍光物質とを混合して細胞に添加する、磁性ナノ粒子複合体による細胞の標識方法。
【請求項4】
前記蛍光物質が、量子ドットであることを特徴とする請求項3に記載の磁性ナノ粒子複合体による細胞の標識方法。
【図1】


【図2】


【図4】


【図3】




【図2】


【図4】


【図3】


【公開番号】特開2012−37259(P2012−37259A)
【公開日】平成24年2月23日(2012.2.23)
【国際特許分類】
【出願番号】特願2010−175079(P2010−175079)
【出願日】平成22年8月4日(2010.8.4)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り (1)平成22年2月5日付 日本再生医療学会発行の「再生医療 第9回 日本再生医療学会総会プログラム・抄録 第9巻/増刊号」に掲載
【出願人】(504139662)国立大学法人名古屋大学 (996)
【Fターム(参考)】
【公開日】平成24年2月23日(2012.2.23)
【国際特許分類】
【出願日】平成22年8月4日(2010.8.4)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り (1)平成22年2月5日付 日本再生医療学会発行の「再生医療 第9回 日本再生医療学会総会プログラム・抄録 第9巻/増刊号」に掲載
【出願人】(504139662)国立大学法人名古屋大学 (996)
【Fターム(参考)】
[ Back to top ]

