磁気共鳴イメージング装置
【課題】撮像時間を短縮するとともに、静止組織の信号強度が精度良く消された流体画像を生成する。
【解決手段】実施形態に係るMRI装置は、データ収集部と、画像再構成部と、基準画像生成部と、流体画像生成部とを備える。データ収集部は、撮像領域の少なくとも上流部分にRF波を印加することで該撮像領域に流入する流体の標識化を行い、前記RF波を印加してから所定の待ち時間が経過した後に磁気共鳴データの収集を行うタグモードを前記待ち時間を変えながら繰り返し実行する。画像再構成部は、前記タグモードで収集された磁気共鳴データに基づいて、それぞれ複数の異なる前記待ち時間に対応する複数のタグ画像を再構成する。基準画像生成部は、前記複数のタグ画像に基づいて基準画像を生成する。流体画像生成部は、前記複数のタグ画像それぞれと前記基準画像との差分画像を流体画像として生成する。
【解決手段】実施形態に係るMRI装置は、データ収集部と、画像再構成部と、基準画像生成部と、流体画像生成部とを備える。データ収集部は、撮像領域の少なくとも上流部分にRF波を印加することで該撮像領域に流入する流体の標識化を行い、前記RF波を印加してから所定の待ち時間が経過した後に磁気共鳴データの収集を行うタグモードを前記待ち時間を変えながら繰り返し実行する。画像再構成部は、前記タグモードで収集された磁気共鳴データに基づいて、それぞれ複数の異なる前記待ち時間に対応する複数のタグ画像を再構成する。基準画像生成部は、前記複数のタグ画像に基づいて基準画像を生成する。流体画像生成部は、前記複数のタグ画像それぞれと前記基準画像との差分画像を流体画像として生成する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、磁気共鳴イメージング(Magnetic Resonance Imaging:MRI)装置に関する。
【背景技術】
【0002】
MRI装置は、静磁場中に置かれた被検体の原子核スピンをラーモア周波数のRF(Radio Frequency)パルスで磁気的に励起し、この励起にともなって発生する磁気共鳴信号から被検体内を表す画像を再構成する装置である。そして、従来、かかるMRI装置を用いて血流を撮像する方法がある(例えば、特許文献1参照)。
【0003】
例えば、非造影で血流を撮像する方法の一例として、ASL(Arterial Spin Labeling)がある(例えば、非特許文献1〜5参照)。ASLでは、一般的に、MRI装置は、タグモードで撮像されたタグ画像とコントロールモードで撮像されたコントロール画像との差分画像を生成することで、静止組織が消された血流成分のみの画像を生成する。
【0004】
ここでいうタグモードとは、例えば、撮像領域(画像化領域)を通る動脈の上流部分にRFパルスを印加することで、撮像領域に流入する血液にタグと呼ばれる標識(ラベルとも呼ばれる)を付加し、RFパルスを印加してから所定のラベル後の待ち時間(Inversion Time:TI)が経過した後にイメージングを行う撮像モードである。また、コントロールモードとは、撮像領域の上流部分へのRFパルスの印加による流体の標識化を行わずに所定の待ち時間が経過した後に磁気共鳴データの収集を行う撮像モードである。すなわち、コントロールモードは、非造影MRA(MR Angiography)の撮像モードのうちのタグモード以外の撮像モードである。かかるコントロールモードとしては、例えば、流体にタグ付けを行わずに非造影撮像を行うものや、撮像領域内の流体にタグ付けを行うもの、撮像領域の下流部分の流体にタグ付けするものなどがある。
【0005】
また、TIを変えながらASLを繰り返し行うことで、血流の動態画像を生成する方法もある。この方法では、MRI装置は、タグ画像及びコントロール画像のペアをTIごとに生成し、血流成分のみを含む差分画像をTIごとに生成する。このように、複数のTIごとにタグ画像とコントロール画像とをペアで収集して各画像の差分画像を生成する方式を以下では「N−N差分方式」と呼ぶ。
【0006】
また、タグ画像とコントロール画像との差分画像を生成するのではなく、タグ画像のみを用いて血流画像を生成する方法もある。例えば、mIR(Multiple IR)法と呼ばれる方法がある(例えば、非特許文献5〜7参照)。この方法では、MRI装置は、撮像領域に対して領域選択的なサチュレーションパルスを印加した後に領域非選択反転(Inversion Recovery:IR)パルスを複数回印加する。そして、MRI装置は、静止組織の縦磁化が縦緩和によって負値からゼロ付近に回復した時点で磁気共鳴データの収集を開始することで、静止組織の信号強度が抑制された血流画像を生成する。このように、mIR法を用いることで、差分画像を生成することなく血流画像を得る方式を以下では「mIR差分レス方式」と呼ぶ。
【0007】
さらに、N−N差分方式にmIR法を併用する方式も提案されている(例えば、非特許文献7参照)。この方法では、MRI装置は、mIR法を用いてタグ画像及びコントロール画像それぞれを生成したうえで、タグ画像とコントロール画像との差分画像を生成する。この方式を以下では「mIR N−N差分方式」と呼ぶ。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2009−56072号公報
【非特許文献】
【0009】
【非特許文献1】Edelmann RR et al. Radiology 192:512(1994)
【非特許文献2】木村徳典,「 Modified STAR using asymmetric inversion slabs (ASTAR)法による非侵襲血流イメージング」,日磁医誌2001;20(8),374-385
【非特許文献3】Kwong KK,Chesler DA,koff RM,Donahue KM,et al.,"MR perfusion studies with T1-weighted echo planar imaging.",MRM(Mag. Reson. Med),34:878-887 (1995)
【非特許文献4】Dixon WT et al.,MRM,18:257 (1991)
【非特許文献5】Non-enhanced Time-Resolved MRA using Inflow Arterial Spin Labeling,2009ISMRM,pp3487
【非特許文献6】Quantitative Dynamic MR Angiography using ASL based TrueFISP.,2009ISMRM,pp3635
【非特許文献7】Mani S et al.,MRM,37:898-905 (1997)
【発明の概要】
【発明が解決しようとする課題】
【0010】
しかしながら、従来のN−N差分方式では、静止組織を精度良く消すことができるものの、撮像時間が長くなるという課題があった。図15は、従来のN−N差分方式におけるTIに対する信号変化を示す図である。図15において、縦軸はタグ画像における信号強度(Stag)を示しており、横軸はTIを示している。図15に示すように、N−N差分方式では、TIの変化に応じてタグ画像における静止組織の信号強度(図15に示すSstationary)が変化する。また、コントロール画像における信号強度もタグ画像と同様に変化する。このことから、静止組織を精度良く消すためには、TIごとにタグ画像及びコントロール画像のペアを生成してTIごとに差分画像を生成する必要がある。したがって、N−N差分方式では、同じTIで2回のデータ収集(タグ画像用のデータ収集及びコントロール画像用のデータ収集)を行う必要があり、その結果、撮像時間が長くなっていた。
【0011】
また、従来のmIR差分レス方式では、タグ画像のみを用いて血流画像を生成するため撮像時間が短縮されるものの、静止組織が精度良く消されるように領域非選択IRパルスの印加回数及びデータ収集の開始タイミングを調整することが難しいという課題があった。通常、撮像領域に含まれる静止組織には、脂肪や脳脊髄液、白質、灰白質など、複数の種類の組織が含まれる。しかし、RFパルスの印加により励起されてから定常状態に回復するまでの時間を示す縦緩和時間(T1)は、組織の種類ごとに異なる。そのため、全ての種類の組織について縦磁化がゼロ付近に回復する時点が揃うように、領域非選択IRパルスの印加回数及びデータ収集の開始タイミングを調整することは難しい。例えば、領域非選択IRパルスの印加回数を2回に設定した場合には、脂肪などのTIが短い組織が残存しやすい。また、領域非選択IRパルスの印加回数を2回に設定してTIが短い組織の信号強度をゼロ付近にすることもできるが、この場合には、脳脊髄液などのTIが長い組織の信号強度をゼロ付近にすることができなくなる。なお、領域非選択IRパルスの印加回数を3回以上に増やすことで、複数種類の組織の信号強度をゼロ付近にすることもできるが、この場合には撮像時間が長くなってしまう。このように、mIR差分レス方式では、静止組織が精度良く消されるように領域非選択IRパルスの印加回数及びデータ収集の開始タイミングを調整することのみによる背景抑制には限界があった。
【0012】
なお、上記課題は、血流画像が撮像される場合に限って生じるものではなく、他の流体(例えば、脳脊髄液など)の流れを示す流体画像が撮像される場合にも同様に生じるものである。
【0013】
本発明は、上記に鑑みてなされたものであって、撮像時間を短縮するとともに、静止組織の信号強度が精度良く消された流体画像を生成することが可能な磁気共鳴イメージング装置を提供することを目的とする。
【課題を解決するための手段】
【0014】
上述した課題を解決し、目的を達成するために、本発明に係るMRI装置は、撮像領域の少なくとも上流部分にRFパルスを印加することで該撮像領域に流入する流体の標識化を行い、前記RFパルスを印加してから所定の待ち時間が経過した後に磁気共鳴データの収集を行うタグモードを前記待ち時間を変えながら繰り返し実行するデータ収集手段と、前記タグモードで収集された磁気共鳴データに基づいて、それぞれ複数の異なる前記待ち時間に対応する複数のタグ画像を再構成する画像再構成手段と、前記複数のタグ画像に基づいて基準画像を生成する基準画像生成手段と、前記複数のタグ画像それぞれと前記基準画像との差分画像を流体画像として生成する流体画像生成手段とを備える。
【0015】
また、本発明に係るMRI装置は、撮像領域の上流部分へのRFパルスの印加による流体の標識化を行わずに前記撮像領域にRFパルスを印加した後に所定の待ち時間が経過した後に磁気共鳴データの収集を行うコントロールモードを前記待ち時間を変えながら繰り返し実行するデータ収集手段と、前記コントロールモードで収集された磁気共鳴データに基づいて、それぞれ複数の異なる前記待ち時間に対応する複数のコントロール画像を再構成する画像再構成手段と、前記複数のコントロール画像に基づいて基準画像を生成する基準画像生成手段と、前記複数のコントロール画像それぞれと前記基準画像との差分画像を流体画像として生成する流体画像生成手段とを備える。
【0016】
また、本発明に係るMRI装置は、被検体内を流れる流体の標識化を行うためのRF波を該被検体に印加してから所定の待ち時間が経過した後に磁気共鳴データの収集を行う撮像モードを前記待ち時間を変えながら繰り返し実行するデータ収集部と、前記磁気共鳴データに基づいて、それぞれ複数の異なる前記待ち時間に対応する複数の画像を再構成する画像再構成部と、前記複数の画像に基づいて基準画像を生成する基準画像生成部と、前記複数の画像それぞれと前記基準画像との差分画像を流体画像として生成する流体画像生成部とを備える。
【0017】
また、本発明に係るMRI装置は、被検体内を流れる流体の標識化を行うためのRF波を該被検体に印加してから所定の待ち時間が経過した後に撮像領域の磁気共鳴データの収集を行う撮像モードを前記待ち時間を変えながら繰り返し実行するデータ収集部と、前記磁気共鳴データに基づいて、それぞれ複数の異なる前記待ち時間に対応する複数の画像を再構成する画像再構成部と、前記複数の画像の中から、前記撮像領域に標識化された流体が流入する前の画像又は前記撮像領域内の流体の磁化が緩和しきった後の画像を基準画像とし、前記複数の画像のうちの少なくとも1つと当該基準画像とを差分して流体画像を生成する流体画像生成部とを備える。
【発明の効果】
【0018】
本発明によれば、撮像時間を短縮するとともに、静止組織の信号強度が精度良く消された流体画像を生成することが可能になるという効果を奏する。
【図面の簡単な説明】
【0019】
【図1】図1は、本実施例1に係るMRI装置の全体構成を示す図である。
【図2】図2は、本実施例1に係るMRI装置の詳細な構成を示す機能ブロック図である。
【図3】図3は、本実施例1に係る計算機システムによる血流画像の生成手順を示すフローチャートである。
【図4】図4は、本実施例1に係る撮像条件設定部により設定される撮像条件の一例を示すタイムチャートである。
【図5】図5は、図4に示す各パルスの印加領域及び撮像領域の一例を示す図である。
【図6】図6は、図4に示す飽和パルス及び領域非選択IRパルスの印加前後における縦磁化の時間変化を示す図である。
【図7】図7は、本実施例1に係る基準画像生成部による基準画像の候補の選択を説明するための図である。
【図8】図8は、本実施例1に係る血流画像生成部による血流画像の生成を説明するための図である。
【図9】図9は、実施例1の変形例に係る撮像条件設定部により設定される撮像条件の一例を示すタイムチャートである。
【図10】図10は、図9に示す各パルスの印加領域及び撮像領域の一例を示す図である。
【図11】図11は、本実施例2に係る計算機システムによる血流画像の生成手順を示すフローチャートである。
【図12】図12は、本実施例2に係る撮像条件設定部により設定される撮像条件の一例を示すタイムチャートである。
【図13】図13は、図12に示す各パルスの印加領域及び撮像領域の一例を示す図である。
【図14】図14は、single tag & multi TI方式における信号強度の減衰を示す図である。
【図15】図15は、従来のN−N差分方式におけるTIに対する信号変化を示す図である。
【発明を実施するための形態】
【0020】
以下に、MRI装置の実施形態を図面に基づいて詳細に説明する。なお、MRIの実施形態は以下に示すものに限定されない。例えば、以下に示す実施形態では血流画像が撮像される場合について説明するが、他の流体(例えば、脳脊髄液など)の流れを示す流体画像が撮像される場合にも同様に実施が可能である。
【0021】
実施形態に係るMRI装置は、データ収集部と、画像再構成部と、基準画像生成部と、流体画像生成部とを備える。データ収集部は、RF波を撮像領域の上流部分に与えるか、又は、RF波を撮像領域のみに印加することにより、上流部分と撮像領域内とに縦磁化の大きさの差異を与える。画像再構成部は、前記データ収集部によって収集された磁気共鳴データに基づいて、それぞれ複数の異なる前記待ち時間に対応する複数のラベル画像を再構成する。基準画像生成部は、前記複数のラベル画像に基づいて基準画像を生成する。流体画像生成部は、前記複数のラベル画像それぞれと前記基準画像との差分画像を流体画像として生成する。
【0022】
(第1の実施形態)
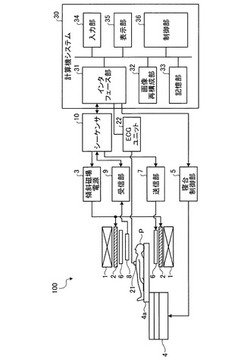
最初に、mIR差分レス方式に関する実施形態を第1の実施形態として説明する。図1は、第1の実施形態に係るMRI装置100の全体構成を示す図である。図1に示すように、このMRI装置100は、静磁場磁石1、傾斜磁場コイル(coil)2、傾斜磁場電源3、寝台4、寝台制御部5、送信RFコイル6、送信部7、受信RFコイル8、受信部9、シーケンサ(sequencer)10、ECG(Electrocardiogram)センサ(sensor)21、ECGユニット(unit)22、及び計算機システム30を備える。
【0023】
静磁場磁石1は、中空の円筒形状に形成された磁石であり、内部の空間に一様な静磁場を発生する。この静磁場磁石1としては、例えば永久磁石、超伝導磁石等が使用される。
【0024】
傾斜磁場コイル2は、中空の円筒形状に形成されたコイルであり、静磁場磁石1の内側に配置される。この傾斜磁場コイル2は、互いに直交するX,Y,Zの各軸に対応する3つのコイルが組み合わされて形成されており、これら3つのコイルは、後述する傾斜磁場電源3から個別に電流供給を受けて、X,Y,Zの各軸に沿って磁場強度が変化する傾斜磁場を発生させる。なお、Z軸方向は、静磁場と同方向とする。傾斜磁場電源3は、傾斜磁場コイル2に電流を供給する。
【0025】
ここで、傾斜磁場コイル2によって発生するX,Y,Z各軸の傾斜磁場は、例えば、スライス(slice)選択用傾斜磁場Gs、位相エンコード(encode)用傾斜磁場Ge及びリードアウト(readout)用傾斜磁場Grにそれぞれ対応する。スライス選択用傾斜磁場Gsは、任意に撮像断面を決めるために利用される。位相エンコード用傾斜磁場Geは、空間的位置に応じて磁気共鳴信号の位相を変化させるために利用される。リードアウト用傾斜磁場Grは、空間的位置に応じて磁気共鳴信号の周波数を変化させるために利用される。
【0026】
寝台4は、被検体Pが載置される天板4aを備え、後述する寝台制御部5による制御のもと、被検体Pが載置された状態で天板4aを傾斜磁場コイル2の空洞(撮像口)内へ挿入する。通常、この寝台4は、長手方向が静磁場磁石1の中心軸と平行になるように設置される。寝台制御部5は、制御部36による制御のもと、寝台4を制御する装置であり、寝台4を駆動して、天板4aを長手方向及び上下方向へ移動する。
【0027】
送信RFコイル6は、傾斜磁場コイル2の内側に配置され、送信部7から高周波パルスの供給を受けて高周波磁場を発生する。送信部7は、ラーモア周波数に対応する高周波パルスを送信RFコイル6に送信する。
【0028】
受信RFコイル8は、傾斜磁場コイル2の内側に配置され、上記の高周波磁場の影響によって被検体Pから放射される磁気共鳴信号を受信する。この受信RFコイル8は、磁気共鳴信号を受信すると、その磁気共鳴信号を受信部9へ出力する。
【0029】
受信部9は、受信RFコイル8から出力される磁気共鳴信号に基づいてk空間データを生成する。具体的には、この受信部9は、受信RFコイル8から出力される磁気共鳴信号をデジタル(digital)変換することによってk空間データを生成する。このk空間データには、前述したスライス選択用傾斜磁場Gs、位相エンコード用傾斜磁場Ge及びリードアウト用傾斜磁場Grによって、PE(Phase Encode)方向、RO(Read Out)方向、SE(Slice Encode)方向の空間周波数の情報が対応付けられている。そして、k空間データを生成すると、受信部9は、そのk空間データをシーケンサ10へ送信する。
【0030】
シーケンサ10は、計算機システム30から送信されるシーケンス(sequence)情報に基づいて、傾斜磁場電源3、送信部7及び受信部9を駆動することによって、被検体Pのスキャンを行う。ここで、シーケンス情報とは、傾斜磁場電源3が傾斜磁場コイル2に供給する電源の強さや電源を供給するタイミング、送信部7が送信RFコイル6に送信するRF信号の強さやRF信号を送信するタイミング、受信部9が磁気共鳴信号を検出するタイミングなど、スキャン(scan)を行うための手順を定義した情報である。
【0031】
なお、シーケンサ10は、傾斜磁場電源3、送信部7及び受信部9を駆動して被検体Pをスキャンした結果、受信部9からk空間データが送信されると、そのk空間データを計算機システム30へ転送する。
【0032】
ECGセンサ21は、被検体Pの体表に付着され、被検体Pの心拍、脈波、呼吸などのECG信号を電気信号として検出する。ECGユニット22は、ECGセンサ21により検出されたECG信号にA/D変換処理やディレー処理を含む各種処理を施してゲート(gate)信号を生成し、生成したゲート信号をシーケンサ10に送信する。
【0033】
計算機システム30は、MRI装置100の全体制御を行う。例えば、計算機システム30は、上述した各部を駆動することで、データ収集や画像再構成などを行う。この計算機システム30は、インタフェース(intrerface)部31、画像再構成部32、記憶部33、入力部34、表示部35、及び制御部36を有する。
【0034】
インタフェース部31は、計算機システム30とシーケンサ10との間でやり取りされる各種信号の送受信を制御する。例えば、このインタフェース部31は、シーケンサ10に対してシーケンス情報を送信し、シーケンサ10からk空間データを受信する。k空間データを受信すると、インタフェース部31は、各k空間データを被検体Pごとに記憶部33に格納する。
【0035】
画像再構成部32は、記憶部33によって記憶されたk空間データに対して後処理すなわちフーリエ(Fourier)変換等の再構成処理を施すことで、被検体Pの体内が描出された画像データを生成する。
【0036】
記憶部33は、インタフェース部31により受信されたk空間データや、画像再構成部32により生成された画像データなどを被検体Pごとに記憶する。
【0037】
入力部34は、操作者からの各種指示や情報入力を受け付ける。この入力部34としては、マウス(mouse)やトラックボール(trackball)などのポインティングデバイス(pointing device)、モード切替スイッチ(switch)等の選択デバイス、あるいはキーボード(keyboard)等の入力デバイスを適宜に利用可能である。
【0038】
表示部35は、制御部36による制御のもと、スペクトラムデータ(spectrum data)あるいは画像データ等の各種の情報を表示する。この表示部35としては、液晶表示器などの表示デバイスを利用可能である。
【0039】
制御部36は、図示していないCPU(Central Processing Unit)やメモリ(memory)等を有し、MRI装置100の全体制御を行う。具体的には、この制御部36は、入力部34を介して操作者から受け付けられた各種指示に基づいてシーケンス情報を生成し、生成したシーケンス情報をシーケンサ10に送信することによってスキャンを制御したり、スキャンの結果としてシーケンサ10から送られるk空間データに基づいて行われる画像の再構成を制御したりする。
【0040】
このような構成のもと、第1の実施形態に係るMRI装置100では、シーケンサ10が、TIを変えながらコントロールモードを繰り返し実行する。なお、第1の実施形態では、シーケンサ10は、撮像領域(画像化領域)の上流部分へのRF波の印加による血液の標識化を行わずに、撮像領域にRF波を印加した後に所定の待ち時間(以下、TI)が経過してから磁気共鳴データの収集を行うコントロールモードをTIを変えながら繰り返し実行する。すなわち、第1の実施形態では、シーケンサ10は、撮像領域内の血液にタグを付加する撮像モードをコントロールモードとして繰り返し実行する。そして、計算機システム30が、コントロールモードで収集された磁気共鳴データに基づいて、それぞれ複数の異なるTIに対応する複数のコントロール画像を再構成する。また、計算機システム30は、複数のコントロール画像に基づいて基準画像を生成し、複数のコントロール画像それぞれと基準画像との差分画像を血流画像として生成する。
【0041】
すなわち、第1の実施形態に係るMRI装置100は、TIごとに生成された複数のコントロール画像を用いて基準画像を生成し、その基準画像と各コントロール画像との差分画像を生成する。このように、TIごとに生成された複数の画像それぞれと、各画像の中から選択された基準画像との差分画像を生成する方式を「N−1差分方式」と呼ぶ。かかるN−1差分方式によれば、コントロール画像のみを用いることで撮像時間が短縮される。さらに、差分画像を生成することで血流以外の静止組織の信号強度が精度良く抑えられる。したがって、第1の実施形態によれば、撮像時間を短縮するとともに、静止組織が精度良く消された血流画像を生成することが可能になる。
【0042】
以下では、第1の実施形態に係るMRI装置100についてさらに具体的に説明する。図2は、第1の実施形態に係るMRI装置100の詳細な構成を示す機能ブロック図である。図2は、図1に示したシーケンサ10及び計算機システム30を示している。また、図2は、計算機システム30が有する機能部のうち、インタフェース部31、画像再構成部32、記憶部33、入力部34、表示部35、及び制御部36を示している。
【0043】
図2に示すように、記憶部33は、撮像パラメータ(parameter)記憶部33a、k空間データ記憶部33b、及び画像データ記憶部33cを有する。
【0044】
撮像パラメータ記憶部33aは、血流画像を得るための撮像条件を設定するうえで必要な各種の撮像パラメータを記憶する。k空間データ記憶部33bは、インタフェース部31を介してシーケンサ10から受信されたk空間データを記憶する。画像データ記憶部33cは、画像再構成部32によりk空間データから再構成された画像を記憶する。
【0045】
また、制御部36は、撮像条件設定部36a、シーケンサ制御部36b、基準画像生成部36c、及び血流画像生成部36dを有する。
【0046】
撮像条件設定部36aは、入力部34を介して操作者から受け付けられた各種指示と、撮像パラメータ記憶部33aにより記憶された撮像パラメータとに基づいて撮像条件を設定する。
【0047】
シーケンサ制御部36bは、撮像条件設定部36aにより設定された撮像条件に基づいてシーケンス情報を生成し、生成したシーケンス情報をインタフェース部31を介してシーケンサ10に送信する。また、シーケンサ制御部36bは、インタフェース部31を介してシーケンサ10から受信したk空間データをk空間データ記憶部33bに格納する。
【0048】
基準画像生成部36cは、画像データ記憶部33cに記憶された複数のコントロール画像に基づいて基準画像を生成する。例えば、基準画像生成部36cは、撮像領域に血液が流入する前の画像又は撮像領域内の血液の磁化が緩和しきった後の画像をコントロール画像の中から選択し、選択した画像に基づいて基準画像を生成する。
【0049】
血流画像生成部36dは、画像再構成部32により再構成された複数のコントロール画像それぞれと、基準画像生成部36cにより生成された基準画像との差分画像を血流画像として生成する。また、血流画像生成部36dは、生成した血流画像を表示部35に表示させる。
【0050】
次に、第1の実施形態に係るMRI装置100による血流画像の生成手順について説明する。図3は、第1の実施形態に係る計算機システム30による血流画像の生成手順を示すフローチャートである。図3に示すように、第1の実施形態では、制御部30が操作者から撮像の開始指示を受け付けると(ステップ(step)S11,Yes)、以下に示す処理を実行する。
【0051】
まず、撮像条件設定部36aが、TIを変えながらコントロールモードを繰り返し実行する撮像条件を設定する(ステップS12)。なお、第1の実施形態では、撮像条件設定部36aは、コントロールモードの撮像条件として、撮像領域に領域選択的な飽和パルスを印加することで撮像領域内の血液にタグを付加し、飽和パルスを印加してから所定のTIが経過した後にデータ収集を行う撮像条件を設定する。
【0052】
図4は、第1の実施形態に係る撮像条件設定部36aにより設定される撮像条件の一例を示すタイムチャートである。また、図5は、図4に示す各パルスの印加領域及び撮像領域の一例を示す図である。また、図6は、図4に示す飽和パルス及び領域非選択IRパルスの印加前後における縦磁化の時間変化を示す図である。
【0053】
図4に示すように、例えば、撮像条件設定部36aは、TI1、TI2、TI3、TI4、・・・TInの順でTIを変えながら繰り返し時間Trepeatごとにコントロールモード(図4に示すcontrol)を繰り返し実行する撮像条件を設定する。このとき、撮像条件設定部36aは、例えば、100(最短)〜1600ms程度の範囲で100msごとにTIを設定する。
【0054】
そして、コントロールモードでは、図4に示すように、まず、撮像領域に対して領域選択的な飽和パルスSATが印加される。ここで、飽和パルスSATは90°パルスである。例えば、図5に示すように、被検体Pの頭部に撮像領域41が設定されていたとする。なお、図5に示す矢印は、撮像領域41に流入する血流を示している。この場合には、例えば、飽和パルスSATは、撮像領域41を包含する印加領域42に印加される。なお、飽和パルスSATの印加領域42は撮像領域41と一致していてもよい。また、飽和パルスSATを印加するタイミングは、例えば、ECGユニット22により生成されるゲート信号に基づいて制御される。
【0055】
飽和パルスSATが印加されると、印加領域42内にある組織の磁化ベクトル(vector)が90°倒れて縦磁化がゼロになる。図6は、T1=250msの脂肪(fat)、T1=800msの白質(WM:White Matter)及び灰白質(GM:Gray Matter)、T1=3000msの脳脊髄液(CSF:Cerebrospinal Fluid)、印加領域42内で飽和パルスSATの影響を受けたT1=1200msの静止血液(stationary blood)、印加領域42に流入するT1=1200msの血液(inflow blood)に関する縦磁化の変化を示している。また、図6は、TI1=1200msとした場合を示している。例えば、図6に示すように、TI=0で飽和パルスSATが印加されると、各組織の縦磁化がゼロになる。
【0056】
その後、時間の経過とともに、撮像領域41内に含まれる組織の縦磁化は組織ごとのT1に応じて回復する。そして、データ収集(図4に示すimaging)の開始からTInss1だけ前の時点で、1番目の領域非選択IRパルスnssIR1が印加される。ここで、領域非選択IRパルスnssIR1は180°パルスである。この領域非選択IRパルスnssIR1は、例えば図5に示すように、撮像領域41と撮像領域41に流入する血液の上流部分とを含む印加領域43に印加される。
【0057】
そして、1番目の領域非選択IRパルスnssIR1が印加されると、印加領域43内にある組織の磁化ベクトルが180°反転して負値となる。例えば、図6に示すように、TI1=1200msからTInss1だけ前の時点で領域非選択IRパルスnssIR1が印加されると、各組織の縦磁化が反転して負値となる。
【0058】
その後、時間の経過とともに、撮像領域41内に含まれる組織の縦磁化は組織ごとのT1に応じて回復する。そして、データ収集(図4に示すimaging)の開始からTInss2だけ前の時点で、2番目の領域非選択IRパルスnssIR2が印加される。ここで、領域非選択IRパルスnssIR2は180°パルスである。この領域非選択IRパルスnssIR2は、1番目の領域非選択IRパルスnssIR1と同じく、図5に示す印加領域43に印加される。
【0059】
そして、2番目の領域非選択IRパルスnssIR2が印加されると、印加領域43内にある組織の磁化ベクトルが180°反転する。ここで、図6に示すように、TInss2は、飽和パルスSATの印加領域42に流入した血液の縦磁化が負値であり、かつ、信号を抑制すべき他の組織の縦磁化が正値となるタイミングで領域非選択IRパルスnssIR2が印加されるように設定される。これにより、領域非選択IRパルスnssIR2が印加された時点で、印加領域42に流入した血液の縦磁化が正値に反転する一方、信号を抑制すべき組織の縦磁化は負値に反転することになる。
【0060】
さらに、図6に示すように、2番目の領域非選択IRパルスnssIR2が印加された後に、信号を抑制すべき組織の縦磁化の絶対値がゼロ付近とみなせる範囲内となったタイミングで撮像領域41からのデータ収集が開始される。例えば、図6は、脳の白質及び灰白質の信号強度が選択的に抑制されるようにデータ収集の開始タイミングが設定された場合を示している。このように、静止組織の信号強度が抑制されるようにデータ収集の開始タイミングを設定することで、静止組織の信号強度が抑えられたコントロール画像が得られる。
【0061】
なお、第1の実施形態では、領域非選択IRパルスが2回印加される場合について説明するが、領域非選択IRパルスは1回又は3回以上印加されてもよい。
【0062】
また、データ収集用の撮像シーケンスとしては、例えば、SSFP(Steady State Free Precession)が用いられる。または、GRE(Gradient Echo)やFSE(Fast Spin Echo)、EPI(Echo Planar Imaging)などが用いられてもよい。
【0063】
図3の説明にもどって、撮像条件設定部36aにより撮像条件が設定されると、シーケンサ制御部36bが、撮像条件に基づいてシーケンス情報を生成してシーケンサ10に送信する。そして、シーケンス情報を受信したシーケンサ10が、撮像条件に基づいてスキャンを実施する(ステップS13)。具体的には、シーケンサ10は、撮像領域内に流入する血液又は撮像領域内の血液にタグを付加する領域選択的な飽和パルスを印加してから所定のTIが経過した時点で磁気共鳴データの収集を開始するコントロールモードを、TIを変えながら繰り返し実行する。
【0064】
続いて、画像再構成部32が、コントロールモードで収集された磁気共鳴データに基づいて、それぞれ複数の異なるTIに対応する複数のコントロール画像を再構成する(ステップS14)。
【0065】
その後、基準画像生成部36cが、画像データ記憶部33cに記憶された複数のコントロール画像の中から基準画像の候補を選択する(ステップS15)。例えば、基準画像生成部36cは、TIごとに再構成された複数のコントロール画像のうち、撮像領域に血液が流入する前のコントロール画像を選択する。または、基準画像生成部36cは、TIごとに再構成された複数のコントロール画像のうち、撮像領域内の血液の磁化が緩和しきった後のコントロール画像を選択する。
【0066】
図7は、第1の実施形態に係る基準画像生成部36cによる基準画像の候補の選択を説明するための図である。図7は、TIごとに再構成された複数のコントロール画像に関する信号値の変化を示している。図7において、縦軸は信号強度(Stag)を示しており、横軸はTIを示している。
【0067】
なお、ここでいう信号値は、例えば、コントロール画像に含まれる複数の画素から画素値が閾値以上である画素を抽出し、抽出した画素値の平均値を求めることによって得られる。または、ここでいう信号値は、操作者によって血管部分に設定された関心領域(Region Of Interest:ROI)内に含まれる画素の画素値の平均値でもよい。
【0068】
また、ここで用いられる閾値としては、例えば、空気を示す信号値を除去することができる程度の値があらかじめ設定される。または、例えば、閾値として、TIが最も短いコントロール画像に含まれる画素の画素値の中で最大の画素値の5パーセント(percent)の値が用いられる。この場合は、全てのTIのコントロール画像について、同じ閾値が用いられる。
【0069】
そして、例えば、基準画像生成部36cは、血流が無い時点でのコントロール画像との間で信号強度の差が閾値以下となるコントロール画像を複数のコントロール画像から選択する。例えば、図7に示すように、TI=TI1〜TInに対応するコントロール画像が生成されていたとする。この場合には、基準画像生成部36cは、TI=TI1、TI2、TIn−1及びTInに対応するコントロール画像をそれぞれ基準画像の候補として選択する。すなわち、基準画像生成部36cは、TIが十分に短いコントロール画像、又はTIが十分に長いコントロール画像をそれぞれ基準画像として選択する。なお、このとき選択される基準画像の候補は1つであってもよいし、複数であってもよい。
【0070】
図3の説明にもどって、基準画像生成部36cは、基準画像の候補を選択した後に、選択した基準画像の候補から基準画像を生成する(ステップS16)。例えば、基準画像生成部36cは、基準画像として選択した複数の画像の平均画像を基準画像として生成する。このように、複数の画像の平均画像を用いることで、基準画像のSN比を向上させることができる。なお、基準画像生成部36cは、基準画像の候補として1つの画像を選択したときには、その画像を基準画像として用いる。すなわち、ここでいう基準画像の生成には、複数の画像から基準画像を生成することと、1つの画像を基準画像として用いることとが含まれる。
【0071】
また、基準画像生成部36cは、複数のコントロール画像のうち血流部と背景組織との信号差が小さいコントロール画像を用いて基準画像を生成してもよい。
【0072】
なお、ここでは、基準画像生成部36cが基準画像の候補を自動的に選択する場合について説明した。しかし、例えば、基準画像生成部36cは、複数のコントロール画像の中から基準画像の候補とするコントロール画像を選択する操作を操作者から受け付け、操作者によって選択されたコントロール画像を用いて基準画像を生成してもよい。この場合は、例えば、基準画像生成部36cは、TIごとに再構成された複数のコントロール画像を表示部35に表示させ、表示された複数のコントロール画像の中から1つ又は複数のコントロール画像を選択する操作を操作者から受け付ける。または、例えば、基準画像生成部36cは、図7に示したような、TIごとに再構成された複数のコントロール画像に関する信号値の変化を表す情報を表示部35に表示させる。この場合は、基準画像生成部36cは、1つ又は複数のコントロール画像を選択する操作として、表示された複数のコントロール画像に関する情報の中から1つ又は複数の情報を選択する操作を操作者から受け付ける。
【0073】
その後、血流画像生成部36dが、画像再構成部32により再構成された複数のコントロール画像それぞれと、基準画像生成部36cにより生成された基準画像との差分画像を血流画像として生成する(ステップS17)。
【0074】
図8は、第1の実施形態に係る血流画像生成部36dによる血流画像の生成を説明するための図である。図8において、縦軸は差分画像における信号強度(Ssub)を示しており、横軸はTIを示している。また、図8は、図7に示したTI=TI1、TI2、TIn−1及びTInに対応するコントロール画像の平均画像が基準画像として生成された場合を示している。この場合には、図8に示すように、血流画像生成部36dによって生成される各差分画像のうち、TI=TI1、TI2、TIn−1及びTInに対応する差分画像の信号強度がほぼゼロになる。すなわち、血流画像生成部36dにより生成される血流画像では、静止組織の信号強度がほぼゼロになるので、静止組織が精度良く消されることになる。
【0075】
図3の説明にもどって、血流画像生成部36dは、血流画像を生成した後に、生成した血流画像を表示部35に表示させる(ステップS18)。このとき、例えば、血流画像生成部36dは、生成した複数の血流画像を動態表示として表示部35にシネ表示又は並列表示させる。
【0076】
上述したように、第1の実施形態では、シーケンサ10が、撮像領域の上流部分へのRF波の印加による血液の標識化を行わずに撮像領域にRF波を印加した後に所定のTIが経過した後に磁気共鳴データの収集を行うコントロールモードをTIを変えながら繰り返し実行する。そして、画像再構成部32が、コントロールモードで収集された磁気共鳴データに基づいて、それぞれ複数の異なるTIに対応する複数のコントロール画像を再構成する。その後、基準画像生成部36cが、複数のコントロール画像に基づいて基準画像を生成する。また、血流画像生成部36dが、複数のコントロール画像それぞれと基準画像との差分画像を血流画像として生成する。したがって、第1の実施形態によれば、撮像時間を短縮するとともに、静止組織が精度良く消された血流画像を生成することが可能になる。
【0077】
また、第1の実施形態では、シーケンサ10が、コントロールモードが実行される際に、撮像領域に含まれる組織のうち少なくとも1種類の組織の縦磁化が略ゼロになった時点で磁気共鳴データの収集が開始されるように、撮像領域及び当該撮像領域に流入する血液を含む範囲に非選択反転パルスを印加する。したがって、第1の実施形態によれば、静止組織の信号強度が抑えられたコントロール画像を再構成することができるので、より精度良く静止組織が消された血流画像を生成することが可能になる。
【0078】
また、第1の実施形態では、基準画像生成部36cが、撮像領域に血液が流入する前の画像又は撮像領域内の血液の磁化が緩和しきった後の画像をコントロール画像の中から選択し、選択した画像に基づいて基準画像を生成する。したがって、第1の実施形態によれば、血流部分の信号強度を低下させることなく、血流画像を生成することができる。
【0079】
また、第1の実施形態では、基準画像生成部36cが、撮像領域に血液が流入する前の画像又は撮像領域内の血液の磁化が緩和しきった後の画像を複数選択し、選択した複数の画像の平均画像を基準画像として生成する。したがって、第1の実施形態によれば、基準画像のSN比を向上させることができるので、より精度が高い血流画像を得ることが可能になる。
【0080】
また、第1の実施形態では、シーケンサ10が、磁気共鳴データを収集する際の撮像シーケンスとしてSSFPを用いる。一般的に、SSFPでは、縦磁化を定常状態にするためにデータ収集の最初に複数のダミーパルス(dummy pulse)を印加する必要がある。そのため、SSFPでは、TIやTrepeatが長くなり、その結果、撮像時間も長くなる。しかし、第1の実施形態によれば、従来のmIR差分レス方式よりもダミーパルス数を削減できるので、最短のTIやTrepeatを短縮することができる。
【0081】
なお、上記で説明した第1の実施形態の変形例として、例えば、シーケンサ10が、磁気共鳴データを収集する前に、撮像領域を含む範囲に飽和パルスを印加するようにしてもよい。図9は、第1の実施形態の変形例に係る撮像条件設定部36aにより設定される撮像条件の一例を示すタイムチャートである。また、図10は、図9に示す各パルスの印加領域及び撮像領域の一例を示す図である。
【0082】
図9に示すように、例えば、撮像条件設定部36aは、データ収集(図9に示すimaging)を開始する直前に、脂肪の信号強度を抑制するための飽和パルスfat−SATを印加する。この飽和パルスfat−SATは、例えば図10に示すように、撮像領域41を包含する印加領域51に印加される。これにより、TIを変化させた場合でも、脂肪などのT1値が短い組織の信号強度がほぼ同じ強度になる。このうえで、血流画像生成部36dが差分画像を生成することによって、脂肪などのT1値が短い組織の信号強度を精度良く消すことができる。
(第2の実施形態)
【0083】
次に、mIR N−N差分方式に関する実施形態を第2の実施形態として説明する。なお、第2の実施形態に係るMRI装置の構成は図1及び2に示したものと同じである。
【0084】
第2の実施形態では、シーケンサ10は、撮像領域の少なくとも上流部分にRF波を印加することで撮像領域に流入する流体の標識化を行い、RF波を印加してからTIが経過した後に磁気共鳴データの収集を行うタグモードをTIを変えながら繰り返し実行する。そして、計算機システム30が、タグモードで収集された磁気共鳴データに基づいて、それぞれ複数の異なる前記待ち時間に対応する複数のタグ画像を再構成する。また、計算機システム30は、複数のタグ画像に基づいて基準画像を生成し、その基準画像と各タグ画像との差分画像を生成する。
【0085】
なお、第2の実施形態では、シーケンサ10は、撮像領域の上流部分へのRF波の印加による血流の標識化を行わずに、撮像領域にRF波を印加した後にTIが経過した後に磁気共鳴データの収集を行うコントロールモードをタグモードの実行回数より少ない回数だけさらに実行する。また、計算機システム30は、コントロールモードで収集された磁気共鳴データに基づいて、タグ画像より少ない数のコントロール画像をさらに再構成する。
【0086】
そして、計算機システム30は、タグ画像より少ない数のコントロール画像を用いて1つの基準画像を生成し、生成した基準画像と複数のタグ画像それぞれとの差分画像を生成する。このように、タグ画像より少ない数のコントロール画像から1つの基準画像を生成し、各タグ画像と基準画像との差分画像を生成する方式を「N−M収集N−1差分方式」と呼ぶ。なお、N及びMはいずれも自然数であり、1≦M<Nである。
【0087】
または、計算機システム30は、タグ画像より少ない数のコントロール画像を用いて、複数の異なるTIにそれぞれ対応する複数の差分用コントロール画像を生成する。そして、計算機システム30は、TIごとにタグ画像と差分用コントロール画像との差分画像を生成する。このように、タグ画像より少ない数のコントロール画像からタグ画像と同じ数の差分用コントロール画像を生成し、TIごとにタグ画像と差分用コントロール画像との差分画像を生成する方式を「N−M収集N−N差分方式」と呼ぶ。
【0088】
以下では、第2の実施形態に係るMRI装置による血流画像の生成手順について説明する。図11は、第2の実施形態に係る計算機システム30による血流画像の生成手順を示すフローチャートである。図11に示すように、第2の実施形態では、制御部30が操作者から撮像の開始指示を受け付けると(ステップS21,Yes)、以下に示す処理を実行する。
【0089】
まず、撮像条件設定部36aが、タグモード及びコントロールモードをそれぞれ実行する撮像条件を設定する。なお、第2の実施形態では、撮像条件設定部36aは、タグモードの撮像条件として、撮像領域と撮像領域の上流部分とを包含する領域にIRパルスを印加することで、その領域内の血液にタグを付加し、IRパルスを印加してから所定のTIが経過した後にイメージングを行う撮像条件を設定する。また、第2の実施形態では、撮像条件設定部36aは、コントロールモードの撮像条件として、撮像領域にIRパルスを印加することで撮像領域内の血液にタグを付加し、飽和パルスを印加してから所定のTIが経過した後にデータ収集を行う撮像条件を設定する。
【0090】
なお、このとき、撮像条件設定部36aは、TIを変えながらタグモードが繰り返し実行されるとともに、タグモードの実行回数より少ない回数だけコントロールモードが実行されるように撮像条件を設定する(ステップS22)。
【0091】
図12は、第2の実施形態に係る撮像条件設定部36aにより設定される撮像条件の一例を示すタイムチャートである。また、図13は、図12に示す各パルスの印加領域及び撮像領域の一例を示す図である。
【0092】
図12に示すように、例えば、撮像条件設定部36aは、TI1、TI2、TI3、TI4、・・・TInの順でTIを変えながら、繰り返し時間Trepeatごとにタグモード(図12に示すtag)を繰り返し実行する撮像条件を設定する。このとき、撮像条件設定部36aは、コントロールモードについては、TI1〜TInのうち一部のTIのみで実行されるように撮像条件を設定する。すなわち、撮像条件設定部36aは、コントロールモードの実行回数がタグモードの実行回数より少なくなるように撮像条件を設定する。
【0093】
このように、撮像条件設定部36aが、タグモードの実行回数より少ない回数だけコントロールモードを実行するように撮像条件を設定することで、TIごとにタグモード及びコントロールモードをそれぞれ実行する従来のN−N差分方式やmIR N−N差分方式と比べて、撮像時間を短縮することができる。
【0094】
そして、タグモードでは、図12に示すように、まず、撮像領域に対して領域選択的な飽和パルスSATが印加される。ここで、飽和パルスSATは、90°パルスである。例えば、図13に示すように、被検体Pの頭部に撮像領域61が設定されていたとする。なお、図13に示す矢印は、撮像領域61に流入する血流を示している。この場合には、例えば、飽和パルスSATは、撮像領域61を包含する印加領域64に印加される。なお、飽和パルスSATの印加領域64は撮像領域61と一致していてもよい。また、飽和パルスSATを印加するタイミングは、例えば、ECGユニット22により生成されるゲート信号に基づいて制御される。なお、飽和パルスSATの印加による各組織への影響は第1の実施形態で説明したものと同じであるので、ここでは説明を省略する。
【0095】
飽和パルスSATに続いて、タグモード用のIRパルスtag IRが印加される。ここで、IRパルスtag IRは180°パルスである。このIRパルスtag IRは、例えば図13に示すように、撮像領域61と撮像領域61の上流部分とを包含する印加領域63に印加される。これにより、印加領域63内にある組織の磁化ベクトルが180°反転する。
【0096】
その後、データ収集(図12に示すimaging)の開始からTInss1だけ前の時点で、1番目の領域非選択IRパルスnssIR1が印加される。また、領域非選択IRパルスnssIR1が印加された後に、データ収集(図12に示すimaging)の開始からTInss2だけ前の時点で、2番目の領域非選択IRパルスnssIR2が印加される。ここで、領域非選択IRパルスnssIR1及びnssIR2は、それぞれ180°パルスである。これら領域非選択IRパルスnssIR1及びnssIR2は、例えば図13に示すように、撮像領域61と撮像領域61の上流部分とを含む印加領域65に印加される。なお、領域非選択IRパルスnssIR1及びnssIR2による各組織への影響は第1の実施形態1で説明したものと同じであるので、ここでは説明を省略する。
【0097】
そして、第1の実施形態と同様に、2番目の領域非選択IRパルスnssIR2が印加された後に、信号を抑制すべき組織の縦磁化の絶対値がゼロ付近とみなせる範囲内となったタイミングで撮像領域61からのデータ収集が開始される。
【0098】
一方、コントロールモードでは、図12に示すように、まず、撮像領域に対して領域選択的な飽和パルスSATが印加される。ここで、飽和パルスSATは90°パルスである。図13に示す例では、例えば、飽和パルスSATは、タグモードと同様に印加領域64に印加される。
【0099】
飽和パルスSATに続いて、コントロールモード用のIRパルスcontrol IRが印加される。ここで、IRパルスcontrol IRは180°パルスである。このIRパルスcontrol IRは、例えば図13に示すように、撮像領域61を包含する印加領域62に印加される。これにより、印加領域62内にある組織の磁化ベクトルが180°反転する。
【0100】
その後、データ収集(図12に示すimaging)の開始からTInss1だけ前の時点で、1番目の領域非選択IRパルスnssIR1が印加される。また、領域非選択IRパルスnssIR1が印加された後に、データ収集(図12に示すimaging)の開始からTInss2だけ前の時点で、2番目の領域非選択IRパルスnssIR2が印加される。これら領域非選択IRパルスnssIR1及びnssIR2は、例えば図13に示すように、タグモードと同様に印加領域65に印加される。なお、領域非選択IRパルスnssIR1及びnssIR2による各組織への影響は第1の実施形態で説明したものと同じであるので、ここでは説明を省略する。
【0101】
そして、第1の実施形態と同様に、2番目の領域非選択IRパルスnssIR2が印加された後に、信号を抑制すべき組織の縦磁化の絶対値がゼロ付近とみなせる範囲内となったタイミングで撮像領域61からのデータ収集が開始される。
【0102】
なお、タグモード及びコントロールモードにおけるデータ収集用の撮像シーケンスとしては、第1の実施形態と同様に、例えば、SSFP(Steady State Free Precession)が用いられる。または、GRE(Gradient Echo)やFSE(Fast Spin Echo)、EPI(Echo Planar Imaging)などが用いられてもよい。
【0103】
また、撮像条件設定部36aは、タグモードを実行する際に用いられる収集条件と同じ収集条件でコントロールモードを実行するように撮像条件を設定することが望ましい。これにより、データ収集を開始する直前に脂肪抑制パルスを印加しない場合でも、タグモードとコントロールモードとの間で静止組織の信号強度を揃えることができ、静止組織をさらに精度良く消すことが可能になる。
【0104】
なお、図12では、タグモードとコントロールモードとが同じTIごとに実行される例を示した。しかし、例えば、撮像条件設定部36aは、全てのTIについてタグモードを実行した後に、タグモードの実行回数より少ない回数だけコントロールモードが実行されるように撮像条件を設定してもよい。または、撮像条件設定部36aは、逆に、コントロールモードが実行された後にタグモードが実行されるように撮像条件を設定してもよい。
【0105】
図11の説明にもどって、撮像条件設定部36aにより撮像条件が設定されると、シーケンサ制御部36bが、撮像条件に基づいてシーケンス情報を生成してシーケンサ10に送信する。そして、シーケンス情報を受信したシーケンサ10が、撮像条件に基づいてスキャンを実施する(ステップS23)。具体的には、シーケンサ10は、撮像条件設定部36aは、TIを変えながらタグモードを繰り返し実行するとともに、タグモードの実行回数より少ない回数だけコントロールモードを実行する。
【0106】
続いて、画像再構成部32が、タグモードで収集された磁気共鳴データに基づいて、それぞれ複数の異なるTIに対応する複数のタグ画像を再構成する(ステップS24)。さらに、画像再構成部32は、コントロールモードで収集された磁気共鳴データに基づいて少なくとも1つのコントロール画像を再構成する(ステップS25)。
【0107】
その後、基準画像生成部36cが、第1の実施形態と同様に、画像データ記憶部33cに記憶された複数のタグ画像及びコントロール画像の中から基準画像の候補を選択する(ステップS26)。例えば、基準画像生成部36cは、複数のタグ画像及びコントロール画像のうち、撮像領域に血液が流入する前の画像を選択する。または、基準画像生成部36cは、TIごとに再構成された複数のタグ画像のうち、撮像領域内の血液の磁化が緩和しきった後の画像を選択する。なお、このとき選択される基準画像の候補は1つであってもよいし、複数であってもよい。
【0108】
図11の説明にもどって、基準画像生成部36cは、基準画像の候補を選択した後に、選択した基準画像の候補から基準画像を生成する(ステップS27)。例えば、基準画像生成部36cは、基準画像として選択した複数の画像の平均画像を基準画像として生成する。このように、複数の画像の平均画像を用いることで、基準画像のSN比を向上させることができる。なお、基準画像生成部36cは、基準画像の候補として1つの画像を選択したときには、その画像を基準画像として用いる。すなわち、ここでいう基準画像の生成には、複数の画像から基準画像を生成することと、1つの画像を基準画像として用いることとが含まれる。
【0109】
また、基準画像生成部36cは、複数のタグ画像及びコントロール画像のうち血流部と背景組織との信号差が小さい画像を用いて基準画像を生成してもよい。
【0110】
その後、血流画像生成部36dが、画像再構成部32により再構成された複数のタグ画像それぞれと、基準画像生成部36cにより生成された基準画像との差分画像を血流画像として生成する(ステップS28)。ここで、血流画像生成部36dにより生成される血流画像では、第1の実施形態と同様に静止組織の信号強度がほぼゼロになり、静止組織が精度良く消されることになる。
【0111】
図11の説明にもどって、血流画像生成部36dは、血流画像を生成した後に、生成した血流画像を表示部35に表示させる(ステップS29)。このとき、例えば、血流画像生成部36dは、生成した複数の血流画像を動態表示として表示部35にシネ表示又は並列表示させる。
【0112】
上述したように、第2の実施形態では、シーケンサ10が、撮像領域の少なくとも上流部分にIRパルスを印加することで、撮像領域に流入する血液の標識化を行い、IRパルスを印加してから所定のTIが経過した後に磁気共鳴データの収集を行うタグモードをTIを変えながら繰り返し実行する。また、シーケンサ10は、撮像領域の上流部分へのIRパルスの印加による血液の標識化を行わずに撮像領域にRF波を印加した後に所定のTIが経過した後に磁気共鳴データの収集を行うコントロールモードをタグモードの実行回数より少ない回数だけさらに実行する。そして、画像再構成部32が、タグモードで収集された磁気共鳴データに基づいて、それぞれ複数の異なるTIに対応する複数のタグ画像を再構成する。また、画像再構成部32は、コントロールモードで収集された磁気共鳴データに基づいて少なくとも1つのコントロール画像を再構成する。その後、基準画像生成部36cが、複数のタグ画像及びコントロール画像に基づいて基準画像を生成する。また、血流画像生成部36dが、複数のタグ画像それぞれと基準画像との差分画像を流体画像として生成する。したがって、第2の実施形態によれば、撮像時間を短縮するとともに、静止組織が精度良く消された血流画像を生成することが可能になる。
【0113】
また、第2の実施形態では、シーケンサ10が、タグモードを実行する際に用いられる収集条件と同じ収集条件でコントロールモードを実行する。したがって、例えば、データ収集を開始する直前に脂肪抑制パルスを印加しない場合でも、タグモードとコントロールモードとの間で静止組織の信号強度を揃えることができ、静止組織をさらに精度良く消すことが可能になる。
【0114】
なお、第2の実施形態では、撮像領域内の血液にタグを付加するFAIR(Flow-sensitive Alternating Inversion Recovery)系の手法をシーケンサ10が実施する場合について説明した。しかしながら、例えば、撮像領域内に流入する血液にタグを付加するSTAR(Signal Targeting with Alternating Radio frequency)系の手法をシーケンサ10が実施する場合でも同様に実施可能である。
【0115】
また、第2の実施形態では、1つの基準画像と複数のタグ画像それぞれとの差分画像を血流画像として生成することとした。しかしながら、例えば、コントロール画像を補間することでタグ画像と同じ数の基準画像を生成するようにしてもよい。この場合には、基準画像生成部36cが、コントロール画像に基づいて複数の異なるTIにそれぞれ対応する複数の基準画像を生成する。そして、血流画像生成部36dが、TIごとにタグ画像と基準画像との差分画像を血流画像として生成する。
【0116】
例えば、基準画像生成部36cは、モデル(model)関数のフィッティング(fitting)などの計算処理を行うことで、収集済みのタグ画像より少ない数のTIのコントロール画像から各タグ画像と同じ数の差分用コントロール画像を生成する。少なくとも2つのコントロール画像がある場合には、基準画像生成部36cは、線形近似することで複数の差分用コントロール画像を生成すればよい。また、3つのコントロール画像がある場合には、基準画像生成部36cは、2次関数で近似することで複数の差分用コントロール画像を生成すればよい。
【0117】
このように、タグ画像と同じ数の差分用コントロール画像を生成してTIごとに差分画像を生成することで、静止組織の信号強度がTIに依存して変化する場合でも、静止組織が精度良く消された血流画像を生成することが可能になる。
【0118】
また、第2の実施形態では、シーケンサ10が、タグモード及びコントロールモードが実行される際に、第1の実施形態と同様に、撮像領域に含まれる組織のうち少なくとも1種類の組織の縦磁化が略ゼロになった時点で磁気共鳴データの収集が開始されるように、撮像領域及び当該撮像領域に流入する血液を含む範囲に非選択反転パルスを印加する。したがって、第2の実施形態によれば、静止組織の信号強度が抑えられたタグ画像を再構成することができるので、より精度良く静止組織が消された血流画像を生成することが可能になる。
【0119】
また、第2の実施形態では、基準画像生成部36cが、第1の実施形態と同様に、撮像領域に血液が流入する前の画像又は撮像領域内の血液の磁化が緩和しきった後の画像をタグ画像の中から選択し、選択した画像に基づいて基準画像を生成する。したがって、第2の実施形態によれば、血流部分の信号強度を低下させることなく、血流画像を生成することができる。
【0120】
また、第2の実施形態では、基準画像生成部36cが、第1の実施形態と同様に、撮像領域に血液が流入する前の画像又は撮像領域内の血液の磁化が緩和しきった後の画像を複数選択し、選択した複数の画像の平均画像を基準画像として生成する。したがって、第2の実施形態によれば、基準画像のSN比を向上させることができるので、より精度が高い血流画像を得ることが可能になる。
【0121】
また、第2の実施形態では、シーケンサ10が、第1の実施形態と同様に、磁気共鳴データを収集する際の撮像シーケンスとしてSSFPを用いる。一般的に、SSFPは縦磁化を定常状態にするためにデータ収集の最初に複数のダミーパルスを印加する必要があるため、TIやTrepeatが長くなる。そして、その結果、撮像時間も長くなる。しかし、第2の実施形態によれば、従来のmIR N−N差分方式よりもダミーパルス数を削減できるので、最短のTIやTrepeatを短縮することができる。
【0122】
また、第2の実施形態では、シーケンサ10が、第1の実施形態と同様に、磁気共鳴データの収集を開始する前に撮像領域を含む範囲に飽和パルスを印加してもよい。これにより、TIを変化させた場合でも、脂肪などのT1値が短い組織の信号強度がほぼ同じ強度になるので、脂肪などのT1値が短い組織の信号強度を精度良く消すことができる。
【0123】
なお、第1及び第2の実施形態では、シーケンサ10が、データ収集を行うごとにタグ付け用のIRパルスを印加するsingle tag & single TI方式を用いる場合について説明した。しかしながら、例えば、シーケンサ10が、IRパルスを1回印加した後に複数のデータ収集を連続して行うsingle tag & multi TI方式を用いる場合でも同様に実施可能である。
【0124】
なお、single tag & multi TI方式では、通常、縦磁化の回復が不十分になるため、TIが長くなるにつれて各組織の信号強度が減衰する。図14は、実施形態の変形例に係るsingle tag & multi TI方式における信号強度の減衰を示す図である。図14に示すように、この場合には、タグ画像における静止組織の信号強度(図14に示すSstationary)がTIの増加とともに減衰する。そこで、例えば、生成された血流画像に対して縦緩和の補正を行うようにしてもよい。
【0125】
この場合には、血流画像生成部36dが、血液のT1値に基づいて、血流画像に対してTIに応じた緩和補正を行う。例えば、血流画像生成部36dは、血液のT1値をT1bloodとした場合に、血液の縦緩和を補正するための逆関数、1/exp[−TI/T1blood]をスケーリング(scaling)する補正を行う。または、例えば、血流画像生成部36dは、ラベル後の待ち時間TIや、mIR法におけるIRパルスの数m、血液のT1値T1blood、データ収集における励起パルスの繰り返し間隔TR(Repetition Time)、データ収集における1ショットごとのエンコード数N、タグ付け用のIRパルスの繰り返し時間Trepeatを変数とする関数による補正を行う。なお、差分後の血流信号のみになれば、CBF(Cerebral Blood Flow)の定量が目的ではなく、血管動態の形態イメージングが目的である場合には、信号強度のTIごとの補正は必ずしも行われなくてもよい。
【0126】
なお、上記実施形態1及び2では、撮像領域に対して領域非選択IRパルスや飽和パルスを印加する場合について説明した。しかし、例えば、シーケンサ10が、血流の標識化を行うためのRF波を撮像領域の上流部分又は下流部分に印加し、そのRF波を印加してからTIが経過するまでの間は撮像領域にRF波を印加しないようにしてもよい。
【0127】
また、上記実施形態1及び2では、血流の標識化を行うために短期間の反転パルスを印加する場合について説明した。しかし、近年では、撮像領域に流入する血流の標識化を行う方法として、連続的又は間欠的に反転パルスを印加する方法もある。他の実施形態として、このような方法を用いることも可能である。この場合には、例えば、MRI装置は、標識化を行うための反転パルスを撮像領域の上流側に連続的又は間欠的に印加し、反転パルスを印加してから撮像領域のイメージングを行う(高周波励起パルスを印加する)までの待ち時間TIを固定又は変化させながら磁気共鳴データの収集を行う。また、MRI装置は、収集された磁気共鳴データに基づいて、複数のTIに対応する複数のMR画像を再構成する。そして、MRI装置は、再構成した複数のMR画像に基づいて基準画像を生成し、複数のMR画像それぞれと基準画像との差分画像を血流画像として生成する。または再構成した複数のMR画像のうち、撮像領域の上流側の標識化領域でcontinuous またはpulsed continuous 反転パルスが印加された流体が撮像領域に到達していないMR画像(タグ画像)を基準画像として用いても良い。また基準画像と差分されるMR画像(タグ画像)は複数のTIに対応する複数のMR画像それぞれではなく、1枚以上であれば良い。なお、標識化を行うための反転パルスはRFパルスに限られず、RF連続波であってもよい。ここでは、RFパルスやRF連続波を総称してRF波と呼ぶ。
【0128】
本発明のいくつかの実施形態を説明したが、これらの実施形態は、例として提示したものであり、発明の範囲を限定することは意図していない。これら実施形態は、その他の様々な形態で実施されることが可能であり、発明の要旨を逸脱しない範囲で、種々の省略、置き換え、変更を行うことができる。これら実施形態やその変形は、発明の範囲や要旨に含まれると同様に、特許請求の範囲に記載された発明とその均等の範囲に含まれるものである。
【符号の説明】
【0129】
100 MRI(磁気共鳴イメージング)装置
10 シーケンサ
30 計算機システム
32 画像再構成部
36 制御部
36c 基準画像生成部
36d 血流画像生成部
【技術分野】
【0001】
本発明は、磁気共鳴イメージング(Magnetic Resonance Imaging:MRI)装置に関する。
【背景技術】
【0002】
MRI装置は、静磁場中に置かれた被検体の原子核スピンをラーモア周波数のRF(Radio Frequency)パルスで磁気的に励起し、この励起にともなって発生する磁気共鳴信号から被検体内を表す画像を再構成する装置である。そして、従来、かかるMRI装置を用いて血流を撮像する方法がある(例えば、特許文献1参照)。
【0003】
例えば、非造影で血流を撮像する方法の一例として、ASL(Arterial Spin Labeling)がある(例えば、非特許文献1〜5参照)。ASLでは、一般的に、MRI装置は、タグモードで撮像されたタグ画像とコントロールモードで撮像されたコントロール画像との差分画像を生成することで、静止組織が消された血流成分のみの画像を生成する。
【0004】
ここでいうタグモードとは、例えば、撮像領域(画像化領域)を通る動脈の上流部分にRFパルスを印加することで、撮像領域に流入する血液にタグと呼ばれる標識(ラベルとも呼ばれる)を付加し、RFパルスを印加してから所定のラベル後の待ち時間(Inversion Time:TI)が経過した後にイメージングを行う撮像モードである。また、コントロールモードとは、撮像領域の上流部分へのRFパルスの印加による流体の標識化を行わずに所定の待ち時間が経過した後に磁気共鳴データの収集を行う撮像モードである。すなわち、コントロールモードは、非造影MRA(MR Angiography)の撮像モードのうちのタグモード以外の撮像モードである。かかるコントロールモードとしては、例えば、流体にタグ付けを行わずに非造影撮像を行うものや、撮像領域内の流体にタグ付けを行うもの、撮像領域の下流部分の流体にタグ付けするものなどがある。
【0005】
また、TIを変えながらASLを繰り返し行うことで、血流の動態画像を生成する方法もある。この方法では、MRI装置は、タグ画像及びコントロール画像のペアをTIごとに生成し、血流成分のみを含む差分画像をTIごとに生成する。このように、複数のTIごとにタグ画像とコントロール画像とをペアで収集して各画像の差分画像を生成する方式を以下では「N−N差分方式」と呼ぶ。
【0006】
また、タグ画像とコントロール画像との差分画像を生成するのではなく、タグ画像のみを用いて血流画像を生成する方法もある。例えば、mIR(Multiple IR)法と呼ばれる方法がある(例えば、非特許文献5〜7参照)。この方法では、MRI装置は、撮像領域に対して領域選択的なサチュレーションパルスを印加した後に領域非選択反転(Inversion Recovery:IR)パルスを複数回印加する。そして、MRI装置は、静止組織の縦磁化が縦緩和によって負値からゼロ付近に回復した時点で磁気共鳴データの収集を開始することで、静止組織の信号強度が抑制された血流画像を生成する。このように、mIR法を用いることで、差分画像を生成することなく血流画像を得る方式を以下では「mIR差分レス方式」と呼ぶ。
【0007】
さらに、N−N差分方式にmIR法を併用する方式も提案されている(例えば、非特許文献7参照)。この方法では、MRI装置は、mIR法を用いてタグ画像及びコントロール画像それぞれを生成したうえで、タグ画像とコントロール画像との差分画像を生成する。この方式を以下では「mIR N−N差分方式」と呼ぶ。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2009−56072号公報
【非特許文献】
【0009】
【非特許文献1】Edelmann RR et al. Radiology 192:512(1994)
【非特許文献2】木村徳典,「 Modified STAR using asymmetric inversion slabs (ASTAR)法による非侵襲血流イメージング」,日磁医誌2001;20(8),374-385
【非特許文献3】Kwong KK,Chesler DA,koff RM,Donahue KM,et al.,"MR perfusion studies with T1-weighted echo planar imaging.",MRM(Mag. Reson. Med),34:878-887 (1995)
【非特許文献4】Dixon WT et al.,MRM,18:257 (1991)
【非特許文献5】Non-enhanced Time-Resolved MRA using Inflow Arterial Spin Labeling,2009ISMRM,pp3487
【非特許文献6】Quantitative Dynamic MR Angiography using ASL based TrueFISP.,2009ISMRM,pp3635
【非特許文献7】Mani S et al.,MRM,37:898-905 (1997)
【発明の概要】
【発明が解決しようとする課題】
【0010】
しかしながら、従来のN−N差分方式では、静止組織を精度良く消すことができるものの、撮像時間が長くなるという課題があった。図15は、従来のN−N差分方式におけるTIに対する信号変化を示す図である。図15において、縦軸はタグ画像における信号強度(Stag)を示しており、横軸はTIを示している。図15に示すように、N−N差分方式では、TIの変化に応じてタグ画像における静止組織の信号強度(図15に示すSstationary)が変化する。また、コントロール画像における信号強度もタグ画像と同様に変化する。このことから、静止組織を精度良く消すためには、TIごとにタグ画像及びコントロール画像のペアを生成してTIごとに差分画像を生成する必要がある。したがって、N−N差分方式では、同じTIで2回のデータ収集(タグ画像用のデータ収集及びコントロール画像用のデータ収集)を行う必要があり、その結果、撮像時間が長くなっていた。
【0011】
また、従来のmIR差分レス方式では、タグ画像のみを用いて血流画像を生成するため撮像時間が短縮されるものの、静止組織が精度良く消されるように領域非選択IRパルスの印加回数及びデータ収集の開始タイミングを調整することが難しいという課題があった。通常、撮像領域に含まれる静止組織には、脂肪や脳脊髄液、白質、灰白質など、複数の種類の組織が含まれる。しかし、RFパルスの印加により励起されてから定常状態に回復するまでの時間を示す縦緩和時間(T1)は、組織の種類ごとに異なる。そのため、全ての種類の組織について縦磁化がゼロ付近に回復する時点が揃うように、領域非選択IRパルスの印加回数及びデータ収集の開始タイミングを調整することは難しい。例えば、領域非選択IRパルスの印加回数を2回に設定した場合には、脂肪などのTIが短い組織が残存しやすい。また、領域非選択IRパルスの印加回数を2回に設定してTIが短い組織の信号強度をゼロ付近にすることもできるが、この場合には、脳脊髄液などのTIが長い組織の信号強度をゼロ付近にすることができなくなる。なお、領域非選択IRパルスの印加回数を3回以上に増やすことで、複数種類の組織の信号強度をゼロ付近にすることもできるが、この場合には撮像時間が長くなってしまう。このように、mIR差分レス方式では、静止組織が精度良く消されるように領域非選択IRパルスの印加回数及びデータ収集の開始タイミングを調整することのみによる背景抑制には限界があった。
【0012】
なお、上記課題は、血流画像が撮像される場合に限って生じるものではなく、他の流体(例えば、脳脊髄液など)の流れを示す流体画像が撮像される場合にも同様に生じるものである。
【0013】
本発明は、上記に鑑みてなされたものであって、撮像時間を短縮するとともに、静止組織の信号強度が精度良く消された流体画像を生成することが可能な磁気共鳴イメージング装置を提供することを目的とする。
【課題を解決するための手段】
【0014】
上述した課題を解決し、目的を達成するために、本発明に係るMRI装置は、撮像領域の少なくとも上流部分にRFパルスを印加することで該撮像領域に流入する流体の標識化を行い、前記RFパルスを印加してから所定の待ち時間が経過した後に磁気共鳴データの収集を行うタグモードを前記待ち時間を変えながら繰り返し実行するデータ収集手段と、前記タグモードで収集された磁気共鳴データに基づいて、それぞれ複数の異なる前記待ち時間に対応する複数のタグ画像を再構成する画像再構成手段と、前記複数のタグ画像に基づいて基準画像を生成する基準画像生成手段と、前記複数のタグ画像それぞれと前記基準画像との差分画像を流体画像として生成する流体画像生成手段とを備える。
【0015】
また、本発明に係るMRI装置は、撮像領域の上流部分へのRFパルスの印加による流体の標識化を行わずに前記撮像領域にRFパルスを印加した後に所定の待ち時間が経過した後に磁気共鳴データの収集を行うコントロールモードを前記待ち時間を変えながら繰り返し実行するデータ収集手段と、前記コントロールモードで収集された磁気共鳴データに基づいて、それぞれ複数の異なる前記待ち時間に対応する複数のコントロール画像を再構成する画像再構成手段と、前記複数のコントロール画像に基づいて基準画像を生成する基準画像生成手段と、前記複数のコントロール画像それぞれと前記基準画像との差分画像を流体画像として生成する流体画像生成手段とを備える。
【0016】
また、本発明に係るMRI装置は、被検体内を流れる流体の標識化を行うためのRF波を該被検体に印加してから所定の待ち時間が経過した後に磁気共鳴データの収集を行う撮像モードを前記待ち時間を変えながら繰り返し実行するデータ収集部と、前記磁気共鳴データに基づいて、それぞれ複数の異なる前記待ち時間に対応する複数の画像を再構成する画像再構成部と、前記複数の画像に基づいて基準画像を生成する基準画像生成部と、前記複数の画像それぞれと前記基準画像との差分画像を流体画像として生成する流体画像生成部とを備える。
【0017】
また、本発明に係るMRI装置は、被検体内を流れる流体の標識化を行うためのRF波を該被検体に印加してから所定の待ち時間が経過した後に撮像領域の磁気共鳴データの収集を行う撮像モードを前記待ち時間を変えながら繰り返し実行するデータ収集部と、前記磁気共鳴データに基づいて、それぞれ複数の異なる前記待ち時間に対応する複数の画像を再構成する画像再構成部と、前記複数の画像の中から、前記撮像領域に標識化された流体が流入する前の画像又は前記撮像領域内の流体の磁化が緩和しきった後の画像を基準画像とし、前記複数の画像のうちの少なくとも1つと当該基準画像とを差分して流体画像を生成する流体画像生成部とを備える。
【発明の効果】
【0018】
本発明によれば、撮像時間を短縮するとともに、静止組織の信号強度が精度良く消された流体画像を生成することが可能になるという効果を奏する。
【図面の簡単な説明】
【0019】
【図1】図1は、本実施例1に係るMRI装置の全体構成を示す図である。
【図2】図2は、本実施例1に係るMRI装置の詳細な構成を示す機能ブロック図である。
【図3】図3は、本実施例1に係る計算機システムによる血流画像の生成手順を示すフローチャートである。
【図4】図4は、本実施例1に係る撮像条件設定部により設定される撮像条件の一例を示すタイムチャートである。
【図5】図5は、図4に示す各パルスの印加領域及び撮像領域の一例を示す図である。
【図6】図6は、図4に示す飽和パルス及び領域非選択IRパルスの印加前後における縦磁化の時間変化を示す図である。
【図7】図7は、本実施例1に係る基準画像生成部による基準画像の候補の選択を説明するための図である。
【図8】図8は、本実施例1に係る血流画像生成部による血流画像の生成を説明するための図である。
【図9】図9は、実施例1の変形例に係る撮像条件設定部により設定される撮像条件の一例を示すタイムチャートである。
【図10】図10は、図9に示す各パルスの印加領域及び撮像領域の一例を示す図である。
【図11】図11は、本実施例2に係る計算機システムによる血流画像の生成手順を示すフローチャートである。
【図12】図12は、本実施例2に係る撮像条件設定部により設定される撮像条件の一例を示すタイムチャートである。
【図13】図13は、図12に示す各パルスの印加領域及び撮像領域の一例を示す図である。
【図14】図14は、single tag & multi TI方式における信号強度の減衰を示す図である。
【図15】図15は、従来のN−N差分方式におけるTIに対する信号変化を示す図である。
【発明を実施するための形態】
【0020】
以下に、MRI装置の実施形態を図面に基づいて詳細に説明する。なお、MRIの実施形態は以下に示すものに限定されない。例えば、以下に示す実施形態では血流画像が撮像される場合について説明するが、他の流体(例えば、脳脊髄液など)の流れを示す流体画像が撮像される場合にも同様に実施が可能である。
【0021】
実施形態に係るMRI装置は、データ収集部と、画像再構成部と、基準画像生成部と、流体画像生成部とを備える。データ収集部は、RF波を撮像領域の上流部分に与えるか、又は、RF波を撮像領域のみに印加することにより、上流部分と撮像領域内とに縦磁化の大きさの差異を与える。画像再構成部は、前記データ収集部によって収集された磁気共鳴データに基づいて、それぞれ複数の異なる前記待ち時間に対応する複数のラベル画像を再構成する。基準画像生成部は、前記複数のラベル画像に基づいて基準画像を生成する。流体画像生成部は、前記複数のラベル画像それぞれと前記基準画像との差分画像を流体画像として生成する。
【0022】
(第1の実施形態)
最初に、mIR差分レス方式に関する実施形態を第1の実施形態として説明する。図1は、第1の実施形態に係るMRI装置100の全体構成を示す図である。図1に示すように、このMRI装置100は、静磁場磁石1、傾斜磁場コイル(coil)2、傾斜磁場電源3、寝台4、寝台制御部5、送信RFコイル6、送信部7、受信RFコイル8、受信部9、シーケンサ(sequencer)10、ECG(Electrocardiogram)センサ(sensor)21、ECGユニット(unit)22、及び計算機システム30を備える。
【0023】
静磁場磁石1は、中空の円筒形状に形成された磁石であり、内部の空間に一様な静磁場を発生する。この静磁場磁石1としては、例えば永久磁石、超伝導磁石等が使用される。
【0024】
傾斜磁場コイル2は、中空の円筒形状に形成されたコイルであり、静磁場磁石1の内側に配置される。この傾斜磁場コイル2は、互いに直交するX,Y,Zの各軸に対応する3つのコイルが組み合わされて形成されており、これら3つのコイルは、後述する傾斜磁場電源3から個別に電流供給を受けて、X,Y,Zの各軸に沿って磁場強度が変化する傾斜磁場を発生させる。なお、Z軸方向は、静磁場と同方向とする。傾斜磁場電源3は、傾斜磁場コイル2に電流を供給する。
【0025】
ここで、傾斜磁場コイル2によって発生するX,Y,Z各軸の傾斜磁場は、例えば、スライス(slice)選択用傾斜磁場Gs、位相エンコード(encode)用傾斜磁場Ge及びリードアウト(readout)用傾斜磁場Grにそれぞれ対応する。スライス選択用傾斜磁場Gsは、任意に撮像断面を決めるために利用される。位相エンコード用傾斜磁場Geは、空間的位置に応じて磁気共鳴信号の位相を変化させるために利用される。リードアウト用傾斜磁場Grは、空間的位置に応じて磁気共鳴信号の周波数を変化させるために利用される。
【0026】
寝台4は、被検体Pが載置される天板4aを備え、後述する寝台制御部5による制御のもと、被検体Pが載置された状態で天板4aを傾斜磁場コイル2の空洞(撮像口)内へ挿入する。通常、この寝台4は、長手方向が静磁場磁石1の中心軸と平行になるように設置される。寝台制御部5は、制御部36による制御のもと、寝台4を制御する装置であり、寝台4を駆動して、天板4aを長手方向及び上下方向へ移動する。
【0027】
送信RFコイル6は、傾斜磁場コイル2の内側に配置され、送信部7から高周波パルスの供給を受けて高周波磁場を発生する。送信部7は、ラーモア周波数に対応する高周波パルスを送信RFコイル6に送信する。
【0028】
受信RFコイル8は、傾斜磁場コイル2の内側に配置され、上記の高周波磁場の影響によって被検体Pから放射される磁気共鳴信号を受信する。この受信RFコイル8は、磁気共鳴信号を受信すると、その磁気共鳴信号を受信部9へ出力する。
【0029】
受信部9は、受信RFコイル8から出力される磁気共鳴信号に基づいてk空間データを生成する。具体的には、この受信部9は、受信RFコイル8から出力される磁気共鳴信号をデジタル(digital)変換することによってk空間データを生成する。このk空間データには、前述したスライス選択用傾斜磁場Gs、位相エンコード用傾斜磁場Ge及びリードアウト用傾斜磁場Grによって、PE(Phase Encode)方向、RO(Read Out)方向、SE(Slice Encode)方向の空間周波数の情報が対応付けられている。そして、k空間データを生成すると、受信部9は、そのk空間データをシーケンサ10へ送信する。
【0030】
シーケンサ10は、計算機システム30から送信されるシーケンス(sequence)情報に基づいて、傾斜磁場電源3、送信部7及び受信部9を駆動することによって、被検体Pのスキャンを行う。ここで、シーケンス情報とは、傾斜磁場電源3が傾斜磁場コイル2に供給する電源の強さや電源を供給するタイミング、送信部7が送信RFコイル6に送信するRF信号の強さやRF信号を送信するタイミング、受信部9が磁気共鳴信号を検出するタイミングなど、スキャン(scan)を行うための手順を定義した情報である。
【0031】
なお、シーケンサ10は、傾斜磁場電源3、送信部7及び受信部9を駆動して被検体Pをスキャンした結果、受信部9からk空間データが送信されると、そのk空間データを計算機システム30へ転送する。
【0032】
ECGセンサ21は、被検体Pの体表に付着され、被検体Pの心拍、脈波、呼吸などのECG信号を電気信号として検出する。ECGユニット22は、ECGセンサ21により検出されたECG信号にA/D変換処理やディレー処理を含む各種処理を施してゲート(gate)信号を生成し、生成したゲート信号をシーケンサ10に送信する。
【0033】
計算機システム30は、MRI装置100の全体制御を行う。例えば、計算機システム30は、上述した各部を駆動することで、データ収集や画像再構成などを行う。この計算機システム30は、インタフェース(intrerface)部31、画像再構成部32、記憶部33、入力部34、表示部35、及び制御部36を有する。
【0034】
インタフェース部31は、計算機システム30とシーケンサ10との間でやり取りされる各種信号の送受信を制御する。例えば、このインタフェース部31は、シーケンサ10に対してシーケンス情報を送信し、シーケンサ10からk空間データを受信する。k空間データを受信すると、インタフェース部31は、各k空間データを被検体Pごとに記憶部33に格納する。
【0035】
画像再構成部32は、記憶部33によって記憶されたk空間データに対して後処理すなわちフーリエ(Fourier)変換等の再構成処理を施すことで、被検体Pの体内が描出された画像データを生成する。
【0036】
記憶部33は、インタフェース部31により受信されたk空間データや、画像再構成部32により生成された画像データなどを被検体Pごとに記憶する。
【0037】
入力部34は、操作者からの各種指示や情報入力を受け付ける。この入力部34としては、マウス(mouse)やトラックボール(trackball)などのポインティングデバイス(pointing device)、モード切替スイッチ(switch)等の選択デバイス、あるいはキーボード(keyboard)等の入力デバイスを適宜に利用可能である。
【0038】
表示部35は、制御部36による制御のもと、スペクトラムデータ(spectrum data)あるいは画像データ等の各種の情報を表示する。この表示部35としては、液晶表示器などの表示デバイスを利用可能である。
【0039】
制御部36は、図示していないCPU(Central Processing Unit)やメモリ(memory)等を有し、MRI装置100の全体制御を行う。具体的には、この制御部36は、入力部34を介して操作者から受け付けられた各種指示に基づいてシーケンス情報を生成し、生成したシーケンス情報をシーケンサ10に送信することによってスキャンを制御したり、スキャンの結果としてシーケンサ10から送られるk空間データに基づいて行われる画像の再構成を制御したりする。
【0040】
このような構成のもと、第1の実施形態に係るMRI装置100では、シーケンサ10が、TIを変えながらコントロールモードを繰り返し実行する。なお、第1の実施形態では、シーケンサ10は、撮像領域(画像化領域)の上流部分へのRF波の印加による血液の標識化を行わずに、撮像領域にRF波を印加した後に所定の待ち時間(以下、TI)が経過してから磁気共鳴データの収集を行うコントロールモードをTIを変えながら繰り返し実行する。すなわち、第1の実施形態では、シーケンサ10は、撮像領域内の血液にタグを付加する撮像モードをコントロールモードとして繰り返し実行する。そして、計算機システム30が、コントロールモードで収集された磁気共鳴データに基づいて、それぞれ複数の異なるTIに対応する複数のコントロール画像を再構成する。また、計算機システム30は、複数のコントロール画像に基づいて基準画像を生成し、複数のコントロール画像それぞれと基準画像との差分画像を血流画像として生成する。
【0041】
すなわち、第1の実施形態に係るMRI装置100は、TIごとに生成された複数のコントロール画像を用いて基準画像を生成し、その基準画像と各コントロール画像との差分画像を生成する。このように、TIごとに生成された複数の画像それぞれと、各画像の中から選択された基準画像との差分画像を生成する方式を「N−1差分方式」と呼ぶ。かかるN−1差分方式によれば、コントロール画像のみを用いることで撮像時間が短縮される。さらに、差分画像を生成することで血流以外の静止組織の信号強度が精度良く抑えられる。したがって、第1の実施形態によれば、撮像時間を短縮するとともに、静止組織が精度良く消された血流画像を生成することが可能になる。
【0042】
以下では、第1の実施形態に係るMRI装置100についてさらに具体的に説明する。図2は、第1の実施形態に係るMRI装置100の詳細な構成を示す機能ブロック図である。図2は、図1に示したシーケンサ10及び計算機システム30を示している。また、図2は、計算機システム30が有する機能部のうち、インタフェース部31、画像再構成部32、記憶部33、入力部34、表示部35、及び制御部36を示している。
【0043】
図2に示すように、記憶部33は、撮像パラメータ(parameter)記憶部33a、k空間データ記憶部33b、及び画像データ記憶部33cを有する。
【0044】
撮像パラメータ記憶部33aは、血流画像を得るための撮像条件を設定するうえで必要な各種の撮像パラメータを記憶する。k空間データ記憶部33bは、インタフェース部31を介してシーケンサ10から受信されたk空間データを記憶する。画像データ記憶部33cは、画像再構成部32によりk空間データから再構成された画像を記憶する。
【0045】
また、制御部36は、撮像条件設定部36a、シーケンサ制御部36b、基準画像生成部36c、及び血流画像生成部36dを有する。
【0046】
撮像条件設定部36aは、入力部34を介して操作者から受け付けられた各種指示と、撮像パラメータ記憶部33aにより記憶された撮像パラメータとに基づいて撮像条件を設定する。
【0047】
シーケンサ制御部36bは、撮像条件設定部36aにより設定された撮像条件に基づいてシーケンス情報を生成し、生成したシーケンス情報をインタフェース部31を介してシーケンサ10に送信する。また、シーケンサ制御部36bは、インタフェース部31を介してシーケンサ10から受信したk空間データをk空間データ記憶部33bに格納する。
【0048】
基準画像生成部36cは、画像データ記憶部33cに記憶された複数のコントロール画像に基づいて基準画像を生成する。例えば、基準画像生成部36cは、撮像領域に血液が流入する前の画像又は撮像領域内の血液の磁化が緩和しきった後の画像をコントロール画像の中から選択し、選択した画像に基づいて基準画像を生成する。
【0049】
血流画像生成部36dは、画像再構成部32により再構成された複数のコントロール画像それぞれと、基準画像生成部36cにより生成された基準画像との差分画像を血流画像として生成する。また、血流画像生成部36dは、生成した血流画像を表示部35に表示させる。
【0050】
次に、第1の実施形態に係るMRI装置100による血流画像の生成手順について説明する。図3は、第1の実施形態に係る計算機システム30による血流画像の生成手順を示すフローチャートである。図3に示すように、第1の実施形態では、制御部30が操作者から撮像の開始指示を受け付けると(ステップ(step)S11,Yes)、以下に示す処理を実行する。
【0051】
まず、撮像条件設定部36aが、TIを変えながらコントロールモードを繰り返し実行する撮像条件を設定する(ステップS12)。なお、第1の実施形態では、撮像条件設定部36aは、コントロールモードの撮像条件として、撮像領域に領域選択的な飽和パルスを印加することで撮像領域内の血液にタグを付加し、飽和パルスを印加してから所定のTIが経過した後にデータ収集を行う撮像条件を設定する。
【0052】
図4は、第1の実施形態に係る撮像条件設定部36aにより設定される撮像条件の一例を示すタイムチャートである。また、図5は、図4に示す各パルスの印加領域及び撮像領域の一例を示す図である。また、図6は、図4に示す飽和パルス及び領域非選択IRパルスの印加前後における縦磁化の時間変化を示す図である。
【0053】
図4に示すように、例えば、撮像条件設定部36aは、TI1、TI2、TI3、TI4、・・・TInの順でTIを変えながら繰り返し時間Trepeatごとにコントロールモード(図4に示すcontrol)を繰り返し実行する撮像条件を設定する。このとき、撮像条件設定部36aは、例えば、100(最短)〜1600ms程度の範囲で100msごとにTIを設定する。
【0054】
そして、コントロールモードでは、図4に示すように、まず、撮像領域に対して領域選択的な飽和パルスSATが印加される。ここで、飽和パルスSATは90°パルスである。例えば、図5に示すように、被検体Pの頭部に撮像領域41が設定されていたとする。なお、図5に示す矢印は、撮像領域41に流入する血流を示している。この場合には、例えば、飽和パルスSATは、撮像領域41を包含する印加領域42に印加される。なお、飽和パルスSATの印加領域42は撮像領域41と一致していてもよい。また、飽和パルスSATを印加するタイミングは、例えば、ECGユニット22により生成されるゲート信号に基づいて制御される。
【0055】
飽和パルスSATが印加されると、印加領域42内にある組織の磁化ベクトル(vector)が90°倒れて縦磁化がゼロになる。図6は、T1=250msの脂肪(fat)、T1=800msの白質(WM:White Matter)及び灰白質(GM:Gray Matter)、T1=3000msの脳脊髄液(CSF:Cerebrospinal Fluid)、印加領域42内で飽和パルスSATの影響を受けたT1=1200msの静止血液(stationary blood)、印加領域42に流入するT1=1200msの血液(inflow blood)に関する縦磁化の変化を示している。また、図6は、TI1=1200msとした場合を示している。例えば、図6に示すように、TI=0で飽和パルスSATが印加されると、各組織の縦磁化がゼロになる。
【0056】
その後、時間の経過とともに、撮像領域41内に含まれる組織の縦磁化は組織ごとのT1に応じて回復する。そして、データ収集(図4に示すimaging)の開始からTInss1だけ前の時点で、1番目の領域非選択IRパルスnssIR1が印加される。ここで、領域非選択IRパルスnssIR1は180°パルスである。この領域非選択IRパルスnssIR1は、例えば図5に示すように、撮像領域41と撮像領域41に流入する血液の上流部分とを含む印加領域43に印加される。
【0057】
そして、1番目の領域非選択IRパルスnssIR1が印加されると、印加領域43内にある組織の磁化ベクトルが180°反転して負値となる。例えば、図6に示すように、TI1=1200msからTInss1だけ前の時点で領域非選択IRパルスnssIR1が印加されると、各組織の縦磁化が反転して負値となる。
【0058】
その後、時間の経過とともに、撮像領域41内に含まれる組織の縦磁化は組織ごとのT1に応じて回復する。そして、データ収集(図4に示すimaging)の開始からTInss2だけ前の時点で、2番目の領域非選択IRパルスnssIR2が印加される。ここで、領域非選択IRパルスnssIR2は180°パルスである。この領域非選択IRパルスnssIR2は、1番目の領域非選択IRパルスnssIR1と同じく、図5に示す印加領域43に印加される。
【0059】
そして、2番目の領域非選択IRパルスnssIR2が印加されると、印加領域43内にある組織の磁化ベクトルが180°反転する。ここで、図6に示すように、TInss2は、飽和パルスSATの印加領域42に流入した血液の縦磁化が負値であり、かつ、信号を抑制すべき他の組織の縦磁化が正値となるタイミングで領域非選択IRパルスnssIR2が印加されるように設定される。これにより、領域非選択IRパルスnssIR2が印加された時点で、印加領域42に流入した血液の縦磁化が正値に反転する一方、信号を抑制すべき組織の縦磁化は負値に反転することになる。
【0060】
さらに、図6に示すように、2番目の領域非選択IRパルスnssIR2が印加された後に、信号を抑制すべき組織の縦磁化の絶対値がゼロ付近とみなせる範囲内となったタイミングで撮像領域41からのデータ収集が開始される。例えば、図6は、脳の白質及び灰白質の信号強度が選択的に抑制されるようにデータ収集の開始タイミングが設定された場合を示している。このように、静止組織の信号強度が抑制されるようにデータ収集の開始タイミングを設定することで、静止組織の信号強度が抑えられたコントロール画像が得られる。
【0061】
なお、第1の実施形態では、領域非選択IRパルスが2回印加される場合について説明するが、領域非選択IRパルスは1回又は3回以上印加されてもよい。
【0062】
また、データ収集用の撮像シーケンスとしては、例えば、SSFP(Steady State Free Precession)が用いられる。または、GRE(Gradient Echo)やFSE(Fast Spin Echo)、EPI(Echo Planar Imaging)などが用いられてもよい。
【0063】
図3の説明にもどって、撮像条件設定部36aにより撮像条件が設定されると、シーケンサ制御部36bが、撮像条件に基づいてシーケンス情報を生成してシーケンサ10に送信する。そして、シーケンス情報を受信したシーケンサ10が、撮像条件に基づいてスキャンを実施する(ステップS13)。具体的には、シーケンサ10は、撮像領域内に流入する血液又は撮像領域内の血液にタグを付加する領域選択的な飽和パルスを印加してから所定のTIが経過した時点で磁気共鳴データの収集を開始するコントロールモードを、TIを変えながら繰り返し実行する。
【0064】
続いて、画像再構成部32が、コントロールモードで収集された磁気共鳴データに基づいて、それぞれ複数の異なるTIに対応する複数のコントロール画像を再構成する(ステップS14)。
【0065】
その後、基準画像生成部36cが、画像データ記憶部33cに記憶された複数のコントロール画像の中から基準画像の候補を選択する(ステップS15)。例えば、基準画像生成部36cは、TIごとに再構成された複数のコントロール画像のうち、撮像領域に血液が流入する前のコントロール画像を選択する。または、基準画像生成部36cは、TIごとに再構成された複数のコントロール画像のうち、撮像領域内の血液の磁化が緩和しきった後のコントロール画像を選択する。
【0066】
図7は、第1の実施形態に係る基準画像生成部36cによる基準画像の候補の選択を説明するための図である。図7は、TIごとに再構成された複数のコントロール画像に関する信号値の変化を示している。図7において、縦軸は信号強度(Stag)を示しており、横軸はTIを示している。
【0067】
なお、ここでいう信号値は、例えば、コントロール画像に含まれる複数の画素から画素値が閾値以上である画素を抽出し、抽出した画素値の平均値を求めることによって得られる。または、ここでいう信号値は、操作者によって血管部分に設定された関心領域(Region Of Interest:ROI)内に含まれる画素の画素値の平均値でもよい。
【0068】
また、ここで用いられる閾値としては、例えば、空気を示す信号値を除去することができる程度の値があらかじめ設定される。または、例えば、閾値として、TIが最も短いコントロール画像に含まれる画素の画素値の中で最大の画素値の5パーセント(percent)の値が用いられる。この場合は、全てのTIのコントロール画像について、同じ閾値が用いられる。
【0069】
そして、例えば、基準画像生成部36cは、血流が無い時点でのコントロール画像との間で信号強度の差が閾値以下となるコントロール画像を複数のコントロール画像から選択する。例えば、図7に示すように、TI=TI1〜TInに対応するコントロール画像が生成されていたとする。この場合には、基準画像生成部36cは、TI=TI1、TI2、TIn−1及びTInに対応するコントロール画像をそれぞれ基準画像の候補として選択する。すなわち、基準画像生成部36cは、TIが十分に短いコントロール画像、又はTIが十分に長いコントロール画像をそれぞれ基準画像として選択する。なお、このとき選択される基準画像の候補は1つであってもよいし、複数であってもよい。
【0070】
図3の説明にもどって、基準画像生成部36cは、基準画像の候補を選択した後に、選択した基準画像の候補から基準画像を生成する(ステップS16)。例えば、基準画像生成部36cは、基準画像として選択した複数の画像の平均画像を基準画像として生成する。このように、複数の画像の平均画像を用いることで、基準画像のSN比を向上させることができる。なお、基準画像生成部36cは、基準画像の候補として1つの画像を選択したときには、その画像を基準画像として用いる。すなわち、ここでいう基準画像の生成には、複数の画像から基準画像を生成することと、1つの画像を基準画像として用いることとが含まれる。
【0071】
また、基準画像生成部36cは、複数のコントロール画像のうち血流部と背景組織との信号差が小さいコントロール画像を用いて基準画像を生成してもよい。
【0072】
なお、ここでは、基準画像生成部36cが基準画像の候補を自動的に選択する場合について説明した。しかし、例えば、基準画像生成部36cは、複数のコントロール画像の中から基準画像の候補とするコントロール画像を選択する操作を操作者から受け付け、操作者によって選択されたコントロール画像を用いて基準画像を生成してもよい。この場合は、例えば、基準画像生成部36cは、TIごとに再構成された複数のコントロール画像を表示部35に表示させ、表示された複数のコントロール画像の中から1つ又は複数のコントロール画像を選択する操作を操作者から受け付ける。または、例えば、基準画像生成部36cは、図7に示したような、TIごとに再構成された複数のコントロール画像に関する信号値の変化を表す情報を表示部35に表示させる。この場合は、基準画像生成部36cは、1つ又は複数のコントロール画像を選択する操作として、表示された複数のコントロール画像に関する情報の中から1つ又は複数の情報を選択する操作を操作者から受け付ける。
【0073】
その後、血流画像生成部36dが、画像再構成部32により再構成された複数のコントロール画像それぞれと、基準画像生成部36cにより生成された基準画像との差分画像を血流画像として生成する(ステップS17)。
【0074】
図8は、第1の実施形態に係る血流画像生成部36dによる血流画像の生成を説明するための図である。図8において、縦軸は差分画像における信号強度(Ssub)を示しており、横軸はTIを示している。また、図8は、図7に示したTI=TI1、TI2、TIn−1及びTInに対応するコントロール画像の平均画像が基準画像として生成された場合を示している。この場合には、図8に示すように、血流画像生成部36dによって生成される各差分画像のうち、TI=TI1、TI2、TIn−1及びTInに対応する差分画像の信号強度がほぼゼロになる。すなわち、血流画像生成部36dにより生成される血流画像では、静止組織の信号強度がほぼゼロになるので、静止組織が精度良く消されることになる。
【0075】
図3の説明にもどって、血流画像生成部36dは、血流画像を生成した後に、生成した血流画像を表示部35に表示させる(ステップS18)。このとき、例えば、血流画像生成部36dは、生成した複数の血流画像を動態表示として表示部35にシネ表示又は並列表示させる。
【0076】
上述したように、第1の実施形態では、シーケンサ10が、撮像領域の上流部分へのRF波の印加による血液の標識化を行わずに撮像領域にRF波を印加した後に所定のTIが経過した後に磁気共鳴データの収集を行うコントロールモードをTIを変えながら繰り返し実行する。そして、画像再構成部32が、コントロールモードで収集された磁気共鳴データに基づいて、それぞれ複数の異なるTIに対応する複数のコントロール画像を再構成する。その後、基準画像生成部36cが、複数のコントロール画像に基づいて基準画像を生成する。また、血流画像生成部36dが、複数のコントロール画像それぞれと基準画像との差分画像を血流画像として生成する。したがって、第1の実施形態によれば、撮像時間を短縮するとともに、静止組織が精度良く消された血流画像を生成することが可能になる。
【0077】
また、第1の実施形態では、シーケンサ10が、コントロールモードが実行される際に、撮像領域に含まれる組織のうち少なくとも1種類の組織の縦磁化が略ゼロになった時点で磁気共鳴データの収集が開始されるように、撮像領域及び当該撮像領域に流入する血液を含む範囲に非選択反転パルスを印加する。したがって、第1の実施形態によれば、静止組織の信号強度が抑えられたコントロール画像を再構成することができるので、より精度良く静止組織が消された血流画像を生成することが可能になる。
【0078】
また、第1の実施形態では、基準画像生成部36cが、撮像領域に血液が流入する前の画像又は撮像領域内の血液の磁化が緩和しきった後の画像をコントロール画像の中から選択し、選択した画像に基づいて基準画像を生成する。したがって、第1の実施形態によれば、血流部分の信号強度を低下させることなく、血流画像を生成することができる。
【0079】
また、第1の実施形態では、基準画像生成部36cが、撮像領域に血液が流入する前の画像又は撮像領域内の血液の磁化が緩和しきった後の画像を複数選択し、選択した複数の画像の平均画像を基準画像として生成する。したがって、第1の実施形態によれば、基準画像のSN比を向上させることができるので、より精度が高い血流画像を得ることが可能になる。
【0080】
また、第1の実施形態では、シーケンサ10が、磁気共鳴データを収集する際の撮像シーケンスとしてSSFPを用いる。一般的に、SSFPでは、縦磁化を定常状態にするためにデータ収集の最初に複数のダミーパルス(dummy pulse)を印加する必要がある。そのため、SSFPでは、TIやTrepeatが長くなり、その結果、撮像時間も長くなる。しかし、第1の実施形態によれば、従来のmIR差分レス方式よりもダミーパルス数を削減できるので、最短のTIやTrepeatを短縮することができる。
【0081】
なお、上記で説明した第1の実施形態の変形例として、例えば、シーケンサ10が、磁気共鳴データを収集する前に、撮像領域を含む範囲に飽和パルスを印加するようにしてもよい。図9は、第1の実施形態の変形例に係る撮像条件設定部36aにより設定される撮像条件の一例を示すタイムチャートである。また、図10は、図9に示す各パルスの印加領域及び撮像領域の一例を示す図である。
【0082】
図9に示すように、例えば、撮像条件設定部36aは、データ収集(図9に示すimaging)を開始する直前に、脂肪の信号強度を抑制するための飽和パルスfat−SATを印加する。この飽和パルスfat−SATは、例えば図10に示すように、撮像領域41を包含する印加領域51に印加される。これにより、TIを変化させた場合でも、脂肪などのT1値が短い組織の信号強度がほぼ同じ強度になる。このうえで、血流画像生成部36dが差分画像を生成することによって、脂肪などのT1値が短い組織の信号強度を精度良く消すことができる。
(第2の実施形態)
【0083】
次に、mIR N−N差分方式に関する実施形態を第2の実施形態として説明する。なお、第2の実施形態に係るMRI装置の構成は図1及び2に示したものと同じである。
【0084】
第2の実施形態では、シーケンサ10は、撮像領域の少なくとも上流部分にRF波を印加することで撮像領域に流入する流体の標識化を行い、RF波を印加してからTIが経過した後に磁気共鳴データの収集を行うタグモードをTIを変えながら繰り返し実行する。そして、計算機システム30が、タグモードで収集された磁気共鳴データに基づいて、それぞれ複数の異なる前記待ち時間に対応する複数のタグ画像を再構成する。また、計算機システム30は、複数のタグ画像に基づいて基準画像を生成し、その基準画像と各タグ画像との差分画像を生成する。
【0085】
なお、第2の実施形態では、シーケンサ10は、撮像領域の上流部分へのRF波の印加による血流の標識化を行わずに、撮像領域にRF波を印加した後にTIが経過した後に磁気共鳴データの収集を行うコントロールモードをタグモードの実行回数より少ない回数だけさらに実行する。また、計算機システム30は、コントロールモードで収集された磁気共鳴データに基づいて、タグ画像より少ない数のコントロール画像をさらに再構成する。
【0086】
そして、計算機システム30は、タグ画像より少ない数のコントロール画像を用いて1つの基準画像を生成し、生成した基準画像と複数のタグ画像それぞれとの差分画像を生成する。このように、タグ画像より少ない数のコントロール画像から1つの基準画像を生成し、各タグ画像と基準画像との差分画像を生成する方式を「N−M収集N−1差分方式」と呼ぶ。なお、N及びMはいずれも自然数であり、1≦M<Nである。
【0087】
または、計算機システム30は、タグ画像より少ない数のコントロール画像を用いて、複数の異なるTIにそれぞれ対応する複数の差分用コントロール画像を生成する。そして、計算機システム30は、TIごとにタグ画像と差分用コントロール画像との差分画像を生成する。このように、タグ画像より少ない数のコントロール画像からタグ画像と同じ数の差分用コントロール画像を生成し、TIごとにタグ画像と差分用コントロール画像との差分画像を生成する方式を「N−M収集N−N差分方式」と呼ぶ。
【0088】
以下では、第2の実施形態に係るMRI装置による血流画像の生成手順について説明する。図11は、第2の実施形態に係る計算機システム30による血流画像の生成手順を示すフローチャートである。図11に示すように、第2の実施形態では、制御部30が操作者から撮像の開始指示を受け付けると(ステップS21,Yes)、以下に示す処理を実行する。
【0089】
まず、撮像条件設定部36aが、タグモード及びコントロールモードをそれぞれ実行する撮像条件を設定する。なお、第2の実施形態では、撮像条件設定部36aは、タグモードの撮像条件として、撮像領域と撮像領域の上流部分とを包含する領域にIRパルスを印加することで、その領域内の血液にタグを付加し、IRパルスを印加してから所定のTIが経過した後にイメージングを行う撮像条件を設定する。また、第2の実施形態では、撮像条件設定部36aは、コントロールモードの撮像条件として、撮像領域にIRパルスを印加することで撮像領域内の血液にタグを付加し、飽和パルスを印加してから所定のTIが経過した後にデータ収集を行う撮像条件を設定する。
【0090】
なお、このとき、撮像条件設定部36aは、TIを変えながらタグモードが繰り返し実行されるとともに、タグモードの実行回数より少ない回数だけコントロールモードが実行されるように撮像条件を設定する(ステップS22)。
【0091】
図12は、第2の実施形態に係る撮像条件設定部36aにより設定される撮像条件の一例を示すタイムチャートである。また、図13は、図12に示す各パルスの印加領域及び撮像領域の一例を示す図である。
【0092】
図12に示すように、例えば、撮像条件設定部36aは、TI1、TI2、TI3、TI4、・・・TInの順でTIを変えながら、繰り返し時間Trepeatごとにタグモード(図12に示すtag)を繰り返し実行する撮像条件を設定する。このとき、撮像条件設定部36aは、コントロールモードについては、TI1〜TInのうち一部のTIのみで実行されるように撮像条件を設定する。すなわち、撮像条件設定部36aは、コントロールモードの実行回数がタグモードの実行回数より少なくなるように撮像条件を設定する。
【0093】
このように、撮像条件設定部36aが、タグモードの実行回数より少ない回数だけコントロールモードを実行するように撮像条件を設定することで、TIごとにタグモード及びコントロールモードをそれぞれ実行する従来のN−N差分方式やmIR N−N差分方式と比べて、撮像時間を短縮することができる。
【0094】
そして、タグモードでは、図12に示すように、まず、撮像領域に対して領域選択的な飽和パルスSATが印加される。ここで、飽和パルスSATは、90°パルスである。例えば、図13に示すように、被検体Pの頭部に撮像領域61が設定されていたとする。なお、図13に示す矢印は、撮像領域61に流入する血流を示している。この場合には、例えば、飽和パルスSATは、撮像領域61を包含する印加領域64に印加される。なお、飽和パルスSATの印加領域64は撮像領域61と一致していてもよい。また、飽和パルスSATを印加するタイミングは、例えば、ECGユニット22により生成されるゲート信号に基づいて制御される。なお、飽和パルスSATの印加による各組織への影響は第1の実施形態で説明したものと同じであるので、ここでは説明を省略する。
【0095】
飽和パルスSATに続いて、タグモード用のIRパルスtag IRが印加される。ここで、IRパルスtag IRは180°パルスである。このIRパルスtag IRは、例えば図13に示すように、撮像領域61と撮像領域61の上流部分とを包含する印加領域63に印加される。これにより、印加領域63内にある組織の磁化ベクトルが180°反転する。
【0096】
その後、データ収集(図12に示すimaging)の開始からTInss1だけ前の時点で、1番目の領域非選択IRパルスnssIR1が印加される。また、領域非選択IRパルスnssIR1が印加された後に、データ収集(図12に示すimaging)の開始からTInss2だけ前の時点で、2番目の領域非選択IRパルスnssIR2が印加される。ここで、領域非選択IRパルスnssIR1及びnssIR2は、それぞれ180°パルスである。これら領域非選択IRパルスnssIR1及びnssIR2は、例えば図13に示すように、撮像領域61と撮像領域61の上流部分とを含む印加領域65に印加される。なお、領域非選択IRパルスnssIR1及びnssIR2による各組織への影響は第1の実施形態1で説明したものと同じであるので、ここでは説明を省略する。
【0097】
そして、第1の実施形態と同様に、2番目の領域非選択IRパルスnssIR2が印加された後に、信号を抑制すべき組織の縦磁化の絶対値がゼロ付近とみなせる範囲内となったタイミングで撮像領域61からのデータ収集が開始される。
【0098】
一方、コントロールモードでは、図12に示すように、まず、撮像領域に対して領域選択的な飽和パルスSATが印加される。ここで、飽和パルスSATは90°パルスである。図13に示す例では、例えば、飽和パルスSATは、タグモードと同様に印加領域64に印加される。
【0099】
飽和パルスSATに続いて、コントロールモード用のIRパルスcontrol IRが印加される。ここで、IRパルスcontrol IRは180°パルスである。このIRパルスcontrol IRは、例えば図13に示すように、撮像領域61を包含する印加領域62に印加される。これにより、印加領域62内にある組織の磁化ベクトルが180°反転する。
【0100】
その後、データ収集(図12に示すimaging)の開始からTInss1だけ前の時点で、1番目の領域非選択IRパルスnssIR1が印加される。また、領域非選択IRパルスnssIR1が印加された後に、データ収集(図12に示すimaging)の開始からTInss2だけ前の時点で、2番目の領域非選択IRパルスnssIR2が印加される。これら領域非選択IRパルスnssIR1及びnssIR2は、例えば図13に示すように、タグモードと同様に印加領域65に印加される。なお、領域非選択IRパルスnssIR1及びnssIR2による各組織への影響は第1の実施形態で説明したものと同じであるので、ここでは説明を省略する。
【0101】
そして、第1の実施形態と同様に、2番目の領域非選択IRパルスnssIR2が印加された後に、信号を抑制すべき組織の縦磁化の絶対値がゼロ付近とみなせる範囲内となったタイミングで撮像領域61からのデータ収集が開始される。
【0102】
なお、タグモード及びコントロールモードにおけるデータ収集用の撮像シーケンスとしては、第1の実施形態と同様に、例えば、SSFP(Steady State Free Precession)が用いられる。または、GRE(Gradient Echo)やFSE(Fast Spin Echo)、EPI(Echo Planar Imaging)などが用いられてもよい。
【0103】
また、撮像条件設定部36aは、タグモードを実行する際に用いられる収集条件と同じ収集条件でコントロールモードを実行するように撮像条件を設定することが望ましい。これにより、データ収集を開始する直前に脂肪抑制パルスを印加しない場合でも、タグモードとコントロールモードとの間で静止組織の信号強度を揃えることができ、静止組織をさらに精度良く消すことが可能になる。
【0104】
なお、図12では、タグモードとコントロールモードとが同じTIごとに実行される例を示した。しかし、例えば、撮像条件設定部36aは、全てのTIについてタグモードを実行した後に、タグモードの実行回数より少ない回数だけコントロールモードが実行されるように撮像条件を設定してもよい。または、撮像条件設定部36aは、逆に、コントロールモードが実行された後にタグモードが実行されるように撮像条件を設定してもよい。
【0105】
図11の説明にもどって、撮像条件設定部36aにより撮像条件が設定されると、シーケンサ制御部36bが、撮像条件に基づいてシーケンス情報を生成してシーケンサ10に送信する。そして、シーケンス情報を受信したシーケンサ10が、撮像条件に基づいてスキャンを実施する(ステップS23)。具体的には、シーケンサ10は、撮像条件設定部36aは、TIを変えながらタグモードを繰り返し実行するとともに、タグモードの実行回数より少ない回数だけコントロールモードを実行する。
【0106】
続いて、画像再構成部32が、タグモードで収集された磁気共鳴データに基づいて、それぞれ複数の異なるTIに対応する複数のタグ画像を再構成する(ステップS24)。さらに、画像再構成部32は、コントロールモードで収集された磁気共鳴データに基づいて少なくとも1つのコントロール画像を再構成する(ステップS25)。
【0107】
その後、基準画像生成部36cが、第1の実施形態と同様に、画像データ記憶部33cに記憶された複数のタグ画像及びコントロール画像の中から基準画像の候補を選択する(ステップS26)。例えば、基準画像生成部36cは、複数のタグ画像及びコントロール画像のうち、撮像領域に血液が流入する前の画像を選択する。または、基準画像生成部36cは、TIごとに再構成された複数のタグ画像のうち、撮像領域内の血液の磁化が緩和しきった後の画像を選択する。なお、このとき選択される基準画像の候補は1つであってもよいし、複数であってもよい。
【0108】
図11の説明にもどって、基準画像生成部36cは、基準画像の候補を選択した後に、選択した基準画像の候補から基準画像を生成する(ステップS27)。例えば、基準画像生成部36cは、基準画像として選択した複数の画像の平均画像を基準画像として生成する。このように、複数の画像の平均画像を用いることで、基準画像のSN比を向上させることができる。なお、基準画像生成部36cは、基準画像の候補として1つの画像を選択したときには、その画像を基準画像として用いる。すなわち、ここでいう基準画像の生成には、複数の画像から基準画像を生成することと、1つの画像を基準画像として用いることとが含まれる。
【0109】
また、基準画像生成部36cは、複数のタグ画像及びコントロール画像のうち血流部と背景組織との信号差が小さい画像を用いて基準画像を生成してもよい。
【0110】
その後、血流画像生成部36dが、画像再構成部32により再構成された複数のタグ画像それぞれと、基準画像生成部36cにより生成された基準画像との差分画像を血流画像として生成する(ステップS28)。ここで、血流画像生成部36dにより生成される血流画像では、第1の実施形態と同様に静止組織の信号強度がほぼゼロになり、静止組織が精度良く消されることになる。
【0111】
図11の説明にもどって、血流画像生成部36dは、血流画像を生成した後に、生成した血流画像を表示部35に表示させる(ステップS29)。このとき、例えば、血流画像生成部36dは、生成した複数の血流画像を動態表示として表示部35にシネ表示又は並列表示させる。
【0112】
上述したように、第2の実施形態では、シーケンサ10が、撮像領域の少なくとも上流部分にIRパルスを印加することで、撮像領域に流入する血液の標識化を行い、IRパルスを印加してから所定のTIが経過した後に磁気共鳴データの収集を行うタグモードをTIを変えながら繰り返し実行する。また、シーケンサ10は、撮像領域の上流部分へのIRパルスの印加による血液の標識化を行わずに撮像領域にRF波を印加した後に所定のTIが経過した後に磁気共鳴データの収集を行うコントロールモードをタグモードの実行回数より少ない回数だけさらに実行する。そして、画像再構成部32が、タグモードで収集された磁気共鳴データに基づいて、それぞれ複数の異なるTIに対応する複数のタグ画像を再構成する。また、画像再構成部32は、コントロールモードで収集された磁気共鳴データに基づいて少なくとも1つのコントロール画像を再構成する。その後、基準画像生成部36cが、複数のタグ画像及びコントロール画像に基づいて基準画像を生成する。また、血流画像生成部36dが、複数のタグ画像それぞれと基準画像との差分画像を流体画像として生成する。したがって、第2の実施形態によれば、撮像時間を短縮するとともに、静止組織が精度良く消された血流画像を生成することが可能になる。
【0113】
また、第2の実施形態では、シーケンサ10が、タグモードを実行する際に用いられる収集条件と同じ収集条件でコントロールモードを実行する。したがって、例えば、データ収集を開始する直前に脂肪抑制パルスを印加しない場合でも、タグモードとコントロールモードとの間で静止組織の信号強度を揃えることができ、静止組織をさらに精度良く消すことが可能になる。
【0114】
なお、第2の実施形態では、撮像領域内の血液にタグを付加するFAIR(Flow-sensitive Alternating Inversion Recovery)系の手法をシーケンサ10が実施する場合について説明した。しかしながら、例えば、撮像領域内に流入する血液にタグを付加するSTAR(Signal Targeting with Alternating Radio frequency)系の手法をシーケンサ10が実施する場合でも同様に実施可能である。
【0115】
また、第2の実施形態では、1つの基準画像と複数のタグ画像それぞれとの差分画像を血流画像として生成することとした。しかしながら、例えば、コントロール画像を補間することでタグ画像と同じ数の基準画像を生成するようにしてもよい。この場合には、基準画像生成部36cが、コントロール画像に基づいて複数の異なるTIにそれぞれ対応する複数の基準画像を生成する。そして、血流画像生成部36dが、TIごとにタグ画像と基準画像との差分画像を血流画像として生成する。
【0116】
例えば、基準画像生成部36cは、モデル(model)関数のフィッティング(fitting)などの計算処理を行うことで、収集済みのタグ画像より少ない数のTIのコントロール画像から各タグ画像と同じ数の差分用コントロール画像を生成する。少なくとも2つのコントロール画像がある場合には、基準画像生成部36cは、線形近似することで複数の差分用コントロール画像を生成すればよい。また、3つのコントロール画像がある場合には、基準画像生成部36cは、2次関数で近似することで複数の差分用コントロール画像を生成すればよい。
【0117】
このように、タグ画像と同じ数の差分用コントロール画像を生成してTIごとに差分画像を生成することで、静止組織の信号強度がTIに依存して変化する場合でも、静止組織が精度良く消された血流画像を生成することが可能になる。
【0118】
また、第2の実施形態では、シーケンサ10が、タグモード及びコントロールモードが実行される際に、第1の実施形態と同様に、撮像領域に含まれる組織のうち少なくとも1種類の組織の縦磁化が略ゼロになった時点で磁気共鳴データの収集が開始されるように、撮像領域及び当該撮像領域に流入する血液を含む範囲に非選択反転パルスを印加する。したがって、第2の実施形態によれば、静止組織の信号強度が抑えられたタグ画像を再構成することができるので、より精度良く静止組織が消された血流画像を生成することが可能になる。
【0119】
また、第2の実施形態では、基準画像生成部36cが、第1の実施形態と同様に、撮像領域に血液が流入する前の画像又は撮像領域内の血液の磁化が緩和しきった後の画像をタグ画像の中から選択し、選択した画像に基づいて基準画像を生成する。したがって、第2の実施形態によれば、血流部分の信号強度を低下させることなく、血流画像を生成することができる。
【0120】
また、第2の実施形態では、基準画像生成部36cが、第1の実施形態と同様に、撮像領域に血液が流入する前の画像又は撮像領域内の血液の磁化が緩和しきった後の画像を複数選択し、選択した複数の画像の平均画像を基準画像として生成する。したがって、第2の実施形態によれば、基準画像のSN比を向上させることができるので、より精度が高い血流画像を得ることが可能になる。
【0121】
また、第2の実施形態では、シーケンサ10が、第1の実施形態と同様に、磁気共鳴データを収集する際の撮像シーケンスとしてSSFPを用いる。一般的に、SSFPは縦磁化を定常状態にするためにデータ収集の最初に複数のダミーパルスを印加する必要があるため、TIやTrepeatが長くなる。そして、その結果、撮像時間も長くなる。しかし、第2の実施形態によれば、従来のmIR N−N差分方式よりもダミーパルス数を削減できるので、最短のTIやTrepeatを短縮することができる。
【0122】
また、第2の実施形態では、シーケンサ10が、第1の実施形態と同様に、磁気共鳴データの収集を開始する前に撮像領域を含む範囲に飽和パルスを印加してもよい。これにより、TIを変化させた場合でも、脂肪などのT1値が短い組織の信号強度がほぼ同じ強度になるので、脂肪などのT1値が短い組織の信号強度を精度良く消すことができる。
【0123】
なお、第1及び第2の実施形態では、シーケンサ10が、データ収集を行うごとにタグ付け用のIRパルスを印加するsingle tag & single TI方式を用いる場合について説明した。しかしながら、例えば、シーケンサ10が、IRパルスを1回印加した後に複数のデータ収集を連続して行うsingle tag & multi TI方式を用いる場合でも同様に実施可能である。
【0124】
なお、single tag & multi TI方式では、通常、縦磁化の回復が不十分になるため、TIが長くなるにつれて各組織の信号強度が減衰する。図14は、実施形態の変形例に係るsingle tag & multi TI方式における信号強度の減衰を示す図である。図14に示すように、この場合には、タグ画像における静止組織の信号強度(図14に示すSstationary)がTIの増加とともに減衰する。そこで、例えば、生成された血流画像に対して縦緩和の補正を行うようにしてもよい。
【0125】
この場合には、血流画像生成部36dが、血液のT1値に基づいて、血流画像に対してTIに応じた緩和補正を行う。例えば、血流画像生成部36dは、血液のT1値をT1bloodとした場合に、血液の縦緩和を補正するための逆関数、1/exp[−TI/T1blood]をスケーリング(scaling)する補正を行う。または、例えば、血流画像生成部36dは、ラベル後の待ち時間TIや、mIR法におけるIRパルスの数m、血液のT1値T1blood、データ収集における励起パルスの繰り返し間隔TR(Repetition Time)、データ収集における1ショットごとのエンコード数N、タグ付け用のIRパルスの繰り返し時間Trepeatを変数とする関数による補正を行う。なお、差分後の血流信号のみになれば、CBF(Cerebral Blood Flow)の定量が目的ではなく、血管動態の形態イメージングが目的である場合には、信号強度のTIごとの補正は必ずしも行われなくてもよい。
【0126】
なお、上記実施形態1及び2では、撮像領域に対して領域非選択IRパルスや飽和パルスを印加する場合について説明した。しかし、例えば、シーケンサ10が、血流の標識化を行うためのRF波を撮像領域の上流部分又は下流部分に印加し、そのRF波を印加してからTIが経過するまでの間は撮像領域にRF波を印加しないようにしてもよい。
【0127】
また、上記実施形態1及び2では、血流の標識化を行うために短期間の反転パルスを印加する場合について説明した。しかし、近年では、撮像領域に流入する血流の標識化を行う方法として、連続的又は間欠的に反転パルスを印加する方法もある。他の実施形態として、このような方法を用いることも可能である。この場合には、例えば、MRI装置は、標識化を行うための反転パルスを撮像領域の上流側に連続的又は間欠的に印加し、反転パルスを印加してから撮像領域のイメージングを行う(高周波励起パルスを印加する)までの待ち時間TIを固定又は変化させながら磁気共鳴データの収集を行う。また、MRI装置は、収集された磁気共鳴データに基づいて、複数のTIに対応する複数のMR画像を再構成する。そして、MRI装置は、再構成した複数のMR画像に基づいて基準画像を生成し、複数のMR画像それぞれと基準画像との差分画像を血流画像として生成する。または再構成した複数のMR画像のうち、撮像領域の上流側の標識化領域でcontinuous またはpulsed continuous 反転パルスが印加された流体が撮像領域に到達していないMR画像(タグ画像)を基準画像として用いても良い。また基準画像と差分されるMR画像(タグ画像)は複数のTIに対応する複数のMR画像それぞれではなく、1枚以上であれば良い。なお、標識化を行うための反転パルスはRFパルスに限られず、RF連続波であってもよい。ここでは、RFパルスやRF連続波を総称してRF波と呼ぶ。
【0128】
本発明のいくつかの実施形態を説明したが、これらの実施形態は、例として提示したものであり、発明の範囲を限定することは意図していない。これら実施形態は、その他の様々な形態で実施されることが可能であり、発明の要旨を逸脱しない範囲で、種々の省略、置き換え、変更を行うことができる。これら実施形態やその変形は、発明の範囲や要旨に含まれると同様に、特許請求の範囲に記載された発明とその均等の範囲に含まれるものである。
【符号の説明】
【0129】
100 MRI(磁気共鳴イメージング)装置
10 シーケンサ
30 計算機システム
32 画像再構成部
36 制御部
36c 基準画像生成部
36d 血流画像生成部
【特許請求の範囲】
【請求項1】
撮像領域の少なくとも上流部分にRF波を印加することで該撮像領域に流入する流体の標識化を行い、前記RF波を印加してから所定の待ち時間が経過した後に磁気共鳴データの収集を行うタグモードを前記待ち時間を変えながら繰り返し実行するデータ収集部と、
前記タグモードで収集された磁気共鳴データに基づいて、それぞれ複数の異なる前記待ち時間に対応する複数のタグ画像を再構成する画像再構成部と、
前記複数のタグ画像に基づいて基準画像を生成する基準画像生成部と、
前記複数のタグ画像それぞれと前記基準画像との差分画像を流体画像として生成する流体画像生成部と
を備える、磁気共鳴イメージング装置。
【請求項2】
前記基準画像生成部は、前記複数のタグ画像のうち血流部と背景組織との信号差が小さいタグ画像を用いて前記基準画像を生成する、請求項1に記載の磁気共鳴イメージング装置。
【請求項3】
前記流体画像生成部により生成された複数の流体画像を動態表示としてシネ表示又は並列表示する表示部をさらに備える、請求項1に記載の磁気共鳴イメージング装置。
【請求項4】
前記データ収集部は、前記タグモードが実行される際に、前記撮像領域に含まれる組織のうち少なくとも1種類の組織の縦磁化が略ゼロになった時点で磁気共鳴データの収集が開始されるように、前記撮像領域及び当該撮像領域に流入する流体を含む範囲に非選択反転パルスを印加する、請求項1に記載の磁気共鳴イメージング装置。
【請求項5】
前記データ収集部は、前記磁気共鳴データの収集を開始する直前に前記撮像領域を含む範囲に飽和パルスを印加する、請求項1に記載の磁気共鳴イメージング装置。
【請求項6】
前記基準画像生成部は、前記撮像領域に流体が流入する前の画像又は前記撮像領域内の流体の磁化が緩和しきった後の画像を前記タグ画像の中から選択し、選択した画像に基づいて前記基準画像を生成する、請求項1に記載の磁気共鳴イメージング装置。
【請求項7】
前記基準画像生成部は、前記撮像領域に流体が流入する前の画像又は前記撮像領域内の流体の磁化が緩和しきった後の画像を複数選択し、選択した複数の画像の平均画像を前記基準画像として生成する、請求項6に記載の磁気共鳴イメージング装置。
【請求項8】
前記データ収集部は、前記撮像領域の上流部分へのRF波の印加による前記流体の標識化を行わずに前記撮像領域にRF波を印加した後に所定の待ち時間が経過した後に磁気共鳴データの収集を行うコントロールモードを前記タグモードの実行回数より少ない回数だけさらに実行し、
前記画像再構成部は、前記コントロールモードで収集された磁気共鳴データに基づいて、前記タグ画像より少ない数のコントロール画像をさらに再構成し、
前記基準画像生成部は、前記タグ画像より少ない数のコントロール画像を用いて、1つの基準画像又は前記複数の異なる前記待ち時間にそれぞれ対応する複数の差分用コントロール画像を生成し、
前記流体画像生成部は、前記複数のタグ画像それぞれと前記基準画像との差分画像を生成するか、又は、前記待ち時間ごとにタグ画像と差分用コントロール画像との差分画像を生成する、
請求項1に記載の磁気共鳴イメージング装置。
【請求項9】
前記データ収集部は、前記タグモードを実行する際に用いられる収集条件と同じ収集条件で前記コントロールモードを実行する、請求項8に記載の磁気共鳴イメージング装置。
【請求項10】
前記データ収集部は、前記磁気共鳴データを収集する際の撮像シーケンスとしてSSFP(Steady State Free Precession)、GRE(Gradient Echo)、FSE(Fast Spin Echo)、又はEPI(Echo Planar Imaging)を用いる、請求項1に記載の磁気共鳴イメージング装置。
【請求項11】
前記流体画像生成部は、流体のT1値に基づいて、前記流体画像に対して前記待ち時間に応じた縦緩和補正をさらに行う、請求項1に記載の磁気共鳴イメージング装置。
【請求項12】
前記データ収集部は、前記流体の標識化を行うためのRF波を前記撮像領域の上流部分又は下流部分に印加し、該RF波を印加してから所定の待ち時間が経過するまでの間は前記撮像領域にRF波を印加しない、請求項1に起債の磁気共鳴イメージング装置。
【請求項13】
撮像領域の上流部分へのRF波の印加による流体の標識化を行わずに前記撮像領域にRF波を印加した後に所定の待ち時間が経過した後に磁気共鳴データの収集を行うコントロールモードを前記待ち時間を変えながら繰り返し実行するデータ収集部と、
前記コントロールモードで収集された磁気共鳴データに基づいて、それぞれ複数の異なる前記待ち時間に対応する複数のコントロール画像を再構成する画像再構成部と、
前記複数のコントロール画像に基づいて基準画像を生成する基準画像生成部と、
前記複数のコントロール画像それぞれと前記基準画像との差分画像を流体画像として生成する流体画像生成部と
を備える、磁気共鳴イメージング装置。
【請求項14】
前記基準画像生成部は、前記複数のコントロール画像のうち血流部と背景組織との信号差が小さいコントロール画像を用いて前記基準画像を生成する、請求項13に記載の磁気共鳴イメージング装置。
【請求項15】
前記流体画像生成部により生成された複数の流体画像を動態表示としてシネ表示又は並列表示する表示部をさらに備える、請求項13に記載の磁気共鳴イメージング装置。
【請求項16】
前記データ収集部は、前記コントロールモードが実行される際に、前記撮像領域に含まれる組織のうち少なくとも1種類の組織の縦磁化が略ゼロになった時点で磁気共鳴データの収集が開始されるように、前記撮像領域及び当該撮像領域に流入する流体を含む範囲に非選択反転パルスを印加する、請求項13に記載の磁気共鳴イメージング装置。
【請求項17】
前記データ収集部は、前記磁気共鳴データの収集を開始する直前に前記撮像領域を含む範囲に飽和パルスを印加する、請求項13に記載の磁気共鳴イメージング装置。
【請求項18】
前記基準画像生成部は、前記撮像領域に流体が流入する前の画像又は前記撮像領域内の流体の磁化が緩和しきった後の画像を前記コントロール画像の中から選択し、選択した画像に基づいて前記基準画像を生成する、請求項13に記載の磁気共鳴イメージング装置。
【請求項19】
前記基準画像生成部は、前記撮像領域に流体が流入する前の画像又は前記撮像領域内の流体の磁化が緩和しきった後の画像を複数選択し、選択した複数の画像の平均画像を前記基準画像として生成する、請求項18に記載の磁気共鳴イメージング装置。
【請求項20】
被検体内を流れる流体の標識化を行うためのRF波を該被検体に印加してから所定の待ち時間が経過した後に磁気共鳴データの収集を行う撮像モードを前記待ち時間を変えながら繰り返し実行するデータ収集部と、
前記磁気共鳴データに基づいて、それぞれ複数の異なる前記待ち時間に対応する複数の画像を再構成する画像再構成部と、
前記複数の画像に基づいて基準画像を生成する基準画像生成部と、
前記複数の画像それぞれと前記基準画像との差分画像を流体画像として生成する流体画像生成部と
を備える、磁気共鳴イメージング装置。
【請求項21】
被検体内を流れる流体の標識化を行うためのRF波を該被検体に印加してから所定の待ち時間が経過した後に撮像領域の磁気共鳴データの収集を行う撮像モードを前記待ち時間を変えながら繰り返し実行するデータ収集部と、
前記磁気共鳴データに基づいて、それぞれ複数の異なる前記待ち時間に対応する複数の画像を再構成する画像再構成部と、
前記複数の画像の中から、前記撮像領域に標識化された流体が流入する前の画像又は前記撮像領域内の流体の磁化が緩和しきった後の画像を基準画像とし、前記複数の画像のうちの少なくとも1つと当該基準画像とを差分して流体画像を生成する流体画像生成部と
を備える、磁気共鳴イメージング装置。
【請求項1】
撮像領域の少なくとも上流部分にRF波を印加することで該撮像領域に流入する流体の標識化を行い、前記RF波を印加してから所定の待ち時間が経過した後に磁気共鳴データの収集を行うタグモードを前記待ち時間を変えながら繰り返し実行するデータ収集部と、
前記タグモードで収集された磁気共鳴データに基づいて、それぞれ複数の異なる前記待ち時間に対応する複数のタグ画像を再構成する画像再構成部と、
前記複数のタグ画像に基づいて基準画像を生成する基準画像生成部と、
前記複数のタグ画像それぞれと前記基準画像との差分画像を流体画像として生成する流体画像生成部と
を備える、磁気共鳴イメージング装置。
【請求項2】
前記基準画像生成部は、前記複数のタグ画像のうち血流部と背景組織との信号差が小さいタグ画像を用いて前記基準画像を生成する、請求項1に記載の磁気共鳴イメージング装置。
【請求項3】
前記流体画像生成部により生成された複数の流体画像を動態表示としてシネ表示又は並列表示する表示部をさらに備える、請求項1に記載の磁気共鳴イメージング装置。
【請求項4】
前記データ収集部は、前記タグモードが実行される際に、前記撮像領域に含まれる組織のうち少なくとも1種類の組織の縦磁化が略ゼロになった時点で磁気共鳴データの収集が開始されるように、前記撮像領域及び当該撮像領域に流入する流体を含む範囲に非選択反転パルスを印加する、請求項1に記載の磁気共鳴イメージング装置。
【請求項5】
前記データ収集部は、前記磁気共鳴データの収集を開始する直前に前記撮像領域を含む範囲に飽和パルスを印加する、請求項1に記載の磁気共鳴イメージング装置。
【請求項6】
前記基準画像生成部は、前記撮像領域に流体が流入する前の画像又は前記撮像領域内の流体の磁化が緩和しきった後の画像を前記タグ画像の中から選択し、選択した画像に基づいて前記基準画像を生成する、請求項1に記載の磁気共鳴イメージング装置。
【請求項7】
前記基準画像生成部は、前記撮像領域に流体が流入する前の画像又は前記撮像領域内の流体の磁化が緩和しきった後の画像を複数選択し、選択した複数の画像の平均画像を前記基準画像として生成する、請求項6に記載の磁気共鳴イメージング装置。
【請求項8】
前記データ収集部は、前記撮像領域の上流部分へのRF波の印加による前記流体の標識化を行わずに前記撮像領域にRF波を印加した後に所定の待ち時間が経過した後に磁気共鳴データの収集を行うコントロールモードを前記タグモードの実行回数より少ない回数だけさらに実行し、
前記画像再構成部は、前記コントロールモードで収集された磁気共鳴データに基づいて、前記タグ画像より少ない数のコントロール画像をさらに再構成し、
前記基準画像生成部は、前記タグ画像より少ない数のコントロール画像を用いて、1つの基準画像又は前記複数の異なる前記待ち時間にそれぞれ対応する複数の差分用コントロール画像を生成し、
前記流体画像生成部は、前記複数のタグ画像それぞれと前記基準画像との差分画像を生成するか、又は、前記待ち時間ごとにタグ画像と差分用コントロール画像との差分画像を生成する、
請求項1に記載の磁気共鳴イメージング装置。
【請求項9】
前記データ収集部は、前記タグモードを実行する際に用いられる収集条件と同じ収集条件で前記コントロールモードを実行する、請求項8に記載の磁気共鳴イメージング装置。
【請求項10】
前記データ収集部は、前記磁気共鳴データを収集する際の撮像シーケンスとしてSSFP(Steady State Free Precession)、GRE(Gradient Echo)、FSE(Fast Spin Echo)、又はEPI(Echo Planar Imaging)を用いる、請求項1に記載の磁気共鳴イメージング装置。
【請求項11】
前記流体画像生成部は、流体のT1値に基づいて、前記流体画像に対して前記待ち時間に応じた縦緩和補正をさらに行う、請求項1に記載の磁気共鳴イメージング装置。
【請求項12】
前記データ収集部は、前記流体の標識化を行うためのRF波を前記撮像領域の上流部分又は下流部分に印加し、該RF波を印加してから所定の待ち時間が経過するまでの間は前記撮像領域にRF波を印加しない、請求項1に起債の磁気共鳴イメージング装置。
【請求項13】
撮像領域の上流部分へのRF波の印加による流体の標識化を行わずに前記撮像領域にRF波を印加した後に所定の待ち時間が経過した後に磁気共鳴データの収集を行うコントロールモードを前記待ち時間を変えながら繰り返し実行するデータ収集部と、
前記コントロールモードで収集された磁気共鳴データに基づいて、それぞれ複数の異なる前記待ち時間に対応する複数のコントロール画像を再構成する画像再構成部と、
前記複数のコントロール画像に基づいて基準画像を生成する基準画像生成部と、
前記複数のコントロール画像それぞれと前記基準画像との差分画像を流体画像として生成する流体画像生成部と
を備える、磁気共鳴イメージング装置。
【請求項14】
前記基準画像生成部は、前記複数のコントロール画像のうち血流部と背景組織との信号差が小さいコントロール画像を用いて前記基準画像を生成する、請求項13に記載の磁気共鳴イメージング装置。
【請求項15】
前記流体画像生成部により生成された複数の流体画像を動態表示としてシネ表示又は並列表示する表示部をさらに備える、請求項13に記載の磁気共鳴イメージング装置。
【請求項16】
前記データ収集部は、前記コントロールモードが実行される際に、前記撮像領域に含まれる組織のうち少なくとも1種類の組織の縦磁化が略ゼロになった時点で磁気共鳴データの収集が開始されるように、前記撮像領域及び当該撮像領域に流入する流体を含む範囲に非選択反転パルスを印加する、請求項13に記載の磁気共鳴イメージング装置。
【請求項17】
前記データ収集部は、前記磁気共鳴データの収集を開始する直前に前記撮像領域を含む範囲に飽和パルスを印加する、請求項13に記載の磁気共鳴イメージング装置。
【請求項18】
前記基準画像生成部は、前記撮像領域に流体が流入する前の画像又は前記撮像領域内の流体の磁化が緩和しきった後の画像を前記コントロール画像の中から選択し、選択した画像に基づいて前記基準画像を生成する、請求項13に記載の磁気共鳴イメージング装置。
【請求項19】
前記基準画像生成部は、前記撮像領域に流体が流入する前の画像又は前記撮像領域内の流体の磁化が緩和しきった後の画像を複数選択し、選択した複数の画像の平均画像を前記基準画像として生成する、請求項18に記載の磁気共鳴イメージング装置。
【請求項20】
被検体内を流れる流体の標識化を行うためのRF波を該被検体に印加してから所定の待ち時間が経過した後に磁気共鳴データの収集を行う撮像モードを前記待ち時間を変えながら繰り返し実行するデータ収集部と、
前記磁気共鳴データに基づいて、それぞれ複数の異なる前記待ち時間に対応する複数の画像を再構成する画像再構成部と、
前記複数の画像に基づいて基準画像を生成する基準画像生成部と、
前記複数の画像それぞれと前記基準画像との差分画像を流体画像として生成する流体画像生成部と
を備える、磁気共鳴イメージング装置。
【請求項21】
被検体内を流れる流体の標識化を行うためのRF波を該被検体に印加してから所定の待ち時間が経過した後に撮像領域の磁気共鳴データの収集を行う撮像モードを前記待ち時間を変えながら繰り返し実行するデータ収集部と、
前記磁気共鳴データに基づいて、それぞれ複数の異なる前記待ち時間に対応する複数の画像を再構成する画像再構成部と、
前記複数の画像の中から、前記撮像領域に標識化された流体が流入する前の画像又は前記撮像領域内の流体の磁化が緩和しきった後の画像を基準画像とし、前記複数の画像のうちの少なくとも1つと当該基準画像とを差分して流体画像を生成する流体画像生成部と
を備える、磁気共鳴イメージング装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【公開番号】特開2011−183152(P2011−183152A)
【公開日】平成23年9月22日(2011.9.22)
【国際特許分類】
【出願番号】特願2011−24332(P2011−24332)
【出願日】平成23年2月7日(2011.2.7)
【出願人】(000003078)株式会社東芝 (54,554)
【出願人】(594164542)東芝メディカルシステムズ株式会社 (4,066)
【Fターム(参考)】
【公開日】平成23年9月22日(2011.9.22)
【国際特許分類】
【出願日】平成23年2月7日(2011.2.7)
【出願人】(000003078)株式会社東芝 (54,554)
【出願人】(594164542)東芝メディカルシステムズ株式会社 (4,066)
【Fターム(参考)】
[ Back to top ]

