神経保護および神経変性疾患の治療のためのクラブラン酸塩製剤
神経変性疾患を治療するか、神経保護を与えるか、または神経細胞の消失または死滅を防止する方法を提供する。即時放出または持続放出固体剤形における医薬的に活性な成分としてクラブラン酸塩を含む安定な固体医薬組成物を使用する。例示的な神経変性疾患としては、パーキンソン病、アルツハイマー病および多発性硬化症が挙げられる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、クラブラン酸、医薬的に許容され得るクラブラン酸塩、塩組成物および誘導体を含む安定な固体経口剤形の使用に関する。特に、本発明は、毎日の使用に適し且つ神経保護および神経変性疾患の治療のためのクラブラン酸塩の治療レベルを達成するクラブラン酸カリウムの即時放出組成物および持続放出組成物を提供する。
【背景技術】
【0002】
クラブラン酸の名前は、クラブラン酸が誘導されるストレプトマイセス・クラブリゲルス(Streptomyces clavuligerus)の微生物に由来する。クラブラン酸は、アミノ酸のアルギニンと糖グリセルアルデヒド3-リン酸から生合成的に生成される。
クラブラン酸は、β-ラクタム抗生物質の特徴を示すβ-ラクタム環を共有するにもかかわらず、内因性抗菌活性がごくわずかである。しかしながら、化学構造の類似性によって、分子がβ-ラクタム抗生物質に対して耐性を与えるある種の細菌が分泌するβ-ラクタマーゼの競合阻害剤として作用することができる。チカルシリンまたはアモキシリンのようなβ-ラクタム抗生物質と組み合わせて投与される場合、クラブラン酸はスペクトルを延長することができ且つ抗生物質(AHFS、1991)の活性を増強することができる。この相乗活性は、β-ラクタム抗生物質を自然に分解するとともに不活性化する細菌のβ-ラクタラクタマーゼの不可逆的競合阻害剤としてクラブラン酸が作用することから可能である(Brown et al., J Antibiot (Tokyo). 1976, 29:668-669; Reading and Cole, Antimicrob Agents Chemother. 1977, 11:852-857)。
β-ラクタマーゼについての阻害作用に加えて、クラブラン酸は、神経保護に、また、不安および性機能不全を治療するのに有効性を示した。クラブラン酸の神経保護および神経学的活性についていくつかの機序が提案された。Koppel et al.は、米国特許第6,489,319号明細書; 同第6,610,681号明細書; 同第6,627,625号明細書において、1μg/kg未満でi.p.投与される場合にクラブラン酸自体が抗不安効果を有することを記載しており、これらの明細書の各々の記載は本願明細書に全体として含まれるものとする。米国特許第6,426,342号明細書には、ラットをクラブラン酸で1μg/kgのi.p.投与量で治療する場合のクラブラン酸の強力な神経保護活性が記載されており、この明細書の記載は本願明細書に全体として含まれるものとする。米国特許第7,166,626号明細書には、性機能不全をクラブラン酸を投与して治療する方法が開示されており、この明細書の記載は本願明細書に全体として含まれるものとする。米国特許第6,489,319号明細書には、クラブラン酸がCNS活性と行動を10ng〜10μg/kgの範囲にある投与量で変化させ得ることが報告されている。このように、クラブラン酸のユニークな神経学的活性プロファイルから、化合物がユニークな一連の神経原性標的と相互作用するという強力な証拠が提供される。Rothstein et alによっても、いくつかのβ-ラクタム抗生物質がグルタメート神経伝達物質トランスポータのための遺伝子を活性化することによって神経保護を与え得ることが証明された(Nature, 2005, 433:73-77)。1928年のペニシリンの発見で最初に同定されたので、β-ラクタム抗生物質は特に最も広く用いられている抗生物質であり、通常の抗菌投与量で実質的な毒性CNS作用を示さなかった。それ故、β-ラクタム抗生物質は、CNS関連疾患の治療に新規で安全な治療剤として用いることができる。
【0003】
クラブラン酸およびその誘導体または塩(ひとまとめにしてクラブラン酸塩と呼ぶ)を含有する乾燥製剤の多数の不安定性によって、医薬的に許容され得る担体を生成させる結合剤、流動促進剤、崩壊剤、乾燥剤等さえも含む賦形剤の複雑な配合を含めることが必要とされた。このことは、一部には、クラブラン酸塩が水性媒体において非常に不安定である非常に吸湿性の材料であるという事実に起因する。それ故、配合方法は、生成物が貯蔵中にその効力を保持することができるが、その後充分な溶解速度を得ることを確実にしなければならない。このような一方法は、国際公開第92/19227号パンフレットに開示され、細胞内と細胞外双方の崩壊剤を含めることを命じており、この明細書の記載は本願明細書に全体として含まれるものとする。米国特許第4,537,887号明細書に記載されている他の方法は、組成物自体の中に食用乾燥剤を含むことを指定しており、この明細書の記載は本願明細書に全体として含まれるものとする。他の方法は、アモキシシリン/クラブラン酸の組み合せを収容する容器内に乾燥剤を含むことを必要としている。この点で、米国特許第4,301,149号明細書および同第4,441,609号明細書が特に顕著であり、これらの明細書の記載は本願明細書に全体として含まれるものとする。クラブラン酸カリウムは遊離酸および吸湿性が最も低い医薬的に許容され得るクラブラン酸塩より安定であり、それ故、市販の製剤に最も頻繁に用いられている。しかしながら、クラブラン酸カリウムはまだ極めて吸湿性であり且つ加水分解に感受性があるのでアモキシシリン/クラブラン酸併用製剤が低湿度条件下でさえ貯蔵時に劣化する傾向がある。アモキシシリンの結晶化における水の存在はこれらの剤形の不安定性に関与し、劣化し始めるとクラブラン酸の分解が加速されることになる。
【発明の概要】
【発明が解決しようとする課題】
【0004】
クラブラン酸は、湿気と熱に感受性があることから例外的にむずかしい材料である。神経保護を与えるかまたは神経変性疾患を治療するために経口的に活性である、特に10μg〜10mg、例えば、約0.1mg〜約5mgのような低用量でのクラブラン酸塩のみの、即ち、抗生物質を含まない安定な固体製剤を開発することが求められている。
【課題を解決するための手段】
【0005】
本発明は、即時放出組成物または持続放出組成物の形で、クラブラン酸塩を含有する安定な経口投薬組成物を経口投与することを含む神経保護を与え且つ神経変性疾患を治療するための方法である。剤形は、毎日の使用に適している、クラブラン酸またはその誘導体または塩、例えば、クラブラン酸カリウムまたはClavitesseTMから調製することができる。
本発明は、上述の欠点および不利益を安定な経口クラブラン酸塩医薬組成物およびその組成物を用いて神経保護を与え且つ神経変性疾患を治療するための方法を開発することによって克服し且つ解消するものである。一般的に言えば、本発明は、クラブラン酸塩を医薬的に活性な成分として含む、安定な固体医薬組成物、特に、即時放出組成物または持続放出組成物の使用に関する。医薬組成物は、錠剤、カプセル剤、丸剤、トローチ剤または散剤のような固体剤形で与えることができる。医薬組成物は、クラブラン酸塩を1つ以上の医薬的に許容され得る賦形剤の存在下に含むことができ、クラブラン酸塩は、約10μg〜約10mg、例えば、約0.1mg〜約5mgの量で存在する。組成物は、投与時に治療的に有効な量のクラブラン酸塩を与えることができる。クラブラン酸塩の例としては、クラブラン酸、クラブラン酸誘導体およびクラブラン酸の医薬的に許容され得る塩が挙げられる。クラブラン酸塩は、組成物の約0.01質量%〜約10質量%の量で存在することができる。ある実施態様において、組成物の水分含量は、全質量の約4%未満である。製剤は、錠剤、カプセル剤、丸剤、トローチ剤または散剤の形である。本発明の例示的固体医薬組成物は、25℃および60%相対湿度での貯蔵後または30℃において65%相対湿度での貯蔵後3ヶ月間で水分含量が10%未満であり得る。
【0006】
例示的組成物において、クラブラン酸塩は、クラブラン酸カリウムである。クラブラン酸カリウムは、例えば、粉末としてまたは二酸化ケイ素または微結晶性セルロースとの1:1混合物として与えることができる。例示的組成物は、投与後約5〜約30分以内に80%を超えるクラブラン酸塩を錠剤から放出する即時放出組成物である。例示的実施態様において、組成物は、クラブラン酸カリウム粉末を1つ以上の医薬的に許容され得る賦形剤の存在下に凍結乾燥する方法によって調製される。即時放出組成物の例において、組成物は、約10質量%〜約20質量%の結合剤または希釈剤、約45質量%〜約55質量%の充填剤、約20質量%〜約40質量%の崩壊剤および約3質量%〜約6質量%の滑沢剤を含有し得る。このような実施態様において、例示的な結合剤または希釈剤は、Maltrin M150であり、例示的充填剤は、プロソルブ(Prosolve) SMCC 50であり、例示的崩壊剤は、ファルマバースト(Pharmaburst)および/またはL HPC LH-11および/またはAcdisolであり、例示的滑沢剤は、ステアリン酸である。
他の例示的実施態様において、組成物は、二酸化ケイ素または微結晶性セルロースとの1:1混合物中のクラブラン酸カリウムを1つ以上の医薬的に許容され得る賦形剤の存在下に凍結乾燥する方法によって調製される。即時放出組成物の他の例において、組成物は、約50-60%の充填剤、約20-30%の崩壊剤、約0.5-5%の流動増強剤/湿気防止剤および/または約3〜6%の滑沢剤を含有し得る。このような実施態様において、例示的充填剤は、Prosolve SMCC 50であり、例示的崩壊剤は、Pharmaburstおよび/またはAcdisolであり、例示的流動増強剤/湿気防止剤は、Carbosilであり、例示的滑沢剤は、ステアリン酸マグネシウムである。
【0007】
他の実施態様において、医薬組成物は、クラブラン酸カリウムを少なくとも約4時間にわたって放出する持続放出組成物である。持続放出組成物は、クラブラン酸カリウム粉末または微結晶性セルロースとの1:1混合物中のクラブラン酸カリウムを1つ以上の医薬的に許容され得る賦形剤の存在下に凍結乾燥させて調製され得る。例示的賦形剤には、マトリックス、充填剤、流動促進剤および滑沢剤の1つ以上が含まれ得る。持続放出組成物の例において、組成物は、約20質量%〜約40質量%のマトリックス、約50質量%〜約75質量%の充填剤、約0.1質量%〜約1質量%の流動促進剤および約1質量%〜約2質量%の滑沢剤を含有し得る。このような実施態様において、例示的マトリックスは、クルセル(Klucel) LF、メトセル(Methocel) K100LV Prem CR、ユードラジット(Eudragit) S100、カルボポール(Carbopol) 971P、カルボポール(Carbopol) 974P、メタクリレートコポリマータイプAもしくはメタクリレートコポリマータイプBまたはこれらの混合物であり; 例示的充填剤は、無水ラクトース、アビセル(Avicel) PH-112、アビセル(Avicel) PH-113、イソマルト(Isomalt)、またはこれらの混合物であり; 例示的流動促進剤は、カルボシル(Carbosil)であり; 例示的滑沢剤は、ステアリン酸マグネシウムおよびタルクの少なくとも1つである。
【0008】
他の実施態様において、本発明の方法に用いられる固体医薬剤形は、クラブラン酸、クラブラン酸誘導体またはクラブラン酸の医薬的に許容され得る塩のようなクラブラン酸塩を準備し、クラブラン酸塩と少なくとも1つの賦形剤とを混合し、クラブラン酸塩と少なくとも1つの賦形剤の混合物を造粒し、クラブラン酸塩と少なくとも1つの賦形剤の造粒混合物を凍結乾燥することによって調製される。造粒工程は、例えば、湿式造粒である。例示的なクラブラン酸塩は、クラブラン酸カリウム、例えば、クラブラン酸カリウムの粉末または二酸化ケイ素若しくは微結晶性セルロースとの1:1混合物としてのクラブラン酸カリウムの形である。例示的方法において、賦形剤は、結合剤、希釈剤、充填剤、崩壊剤、マトリックス、充填剤、流動促進剤、流動増強剤、湿気防止剤、および滑沢剤の少なくとも1つである。方法には、剤形を錠剤またはビーズに形成すること、および、必要により、錠剤またはビーズを遅延放出ポリマーでコーティングしてもよいことが含まれ得る。本発明には、本発明の安定な固体医薬組成物を経口投与して、神経保護を与えるかまたはパーキンソン病、アルツハイマー病または多発性硬化症のような神経変性疾患の治療に効果的な量のクラブラン酸塩を与えることが含まれる。
【0009】
本発明のさらに他の実施態様は、経口投与に適しているクラブラン酸塩の即時放出製剤と持続放出製剤の使用に関する。
本発明のさらに他の実施態様は、医薬製剤を調製する凍結乾燥方法であって、凍結乾燥が水和された医薬組成物を脱水する乾燥プロセスを含む、前記方法に関する。
本発明の他の実施態様は、クラブラン酸塩を含有する医薬組成物の調製方法および薬剤としてのその使用に関する。
他の実施態様において、本発明は、治療的に有効な量のクラブラン酸塩、例えば、クラブラン酸、クラブラン酸誘導体またはクラブラン酸の医薬的に許容され得る塩を含む安定な経口製剤を経口投与することによって神経変性疾患を治療する方法である。他の例示的実施形態は、クラブラン酸を含有する安定な経口製剤を経口投与することを含む神経保護を与える方法である。神経保護には、神経変性疾患に由来の細胞消失または細胞死を防止することが含まれる。さらに他の実施態様は、クラブラン酸塩の安定な経口製剤を経口投与することを含む神経細胞消失または細胞死を防止する方法である。本発明の方法に従って治療可能な神経変性疾患の例としては、パーキンソン病、アルツハイマー病、および多発性硬化症が挙げられる。治療には、例えば、発作または振戦の頻度の減少、発症時間の短縮または重症度の低下、記憶喪失の減少、または神経細胞死の減少が含まれ得る。
【0010】
本発明の例示的方法において、クラブラン酸塩は、クラブラン酸カリウムである。安定な経口製剤は、錠剤、カプセル剤、丸剤、トローチ剤、液剤、懸濁剤、バッカル錠、舌下錠、口腔内崩壊錠、薄膜または散剤の形であり得る。製剤は、少なくとも約4時間クラブラン酸を放出する持続放出組成物; 約0.5時間未満においてクラブラン酸を放出する即時放出組成物; または他の形であり得る。ある実施形態において、クラブラン酸カリウムは、クラブラン酸カリウム粉末または二酸化ケイ素若しくは微結晶性セルロースとの1:1混合物としてのクラブラン酸カリウムである。本発明において有効な製剤には、マトリックス、充填剤、流動促進剤、および滑沢剤の1つ以上が含まれ得る。マトリックスは、例えば、Methocel K100LV Prem CR、Eudragit S100、Carbopol 971P、Carbopol 974P、メタクリレートコポリマータイプA、メタクリレートコポリマータイプBまたはこれらの混合物であり得る。充填剤は、例えば、無水ラクトース、Avicel PH-112、Avicel PH-113、Isomalt、またはこれらの混合物であり得る。流動促進剤は、例えば、Carbosilであり得る。例示的滑沢剤は、ステアリン酸マグネシウム、タルクまたはこれらの混合物である。
本発明の方法に用いられる製剤を調製する例示的方法は、クラブラン酸と少なくとも1つの賦形剤を混合すること、クラブラン酸と少なくとも1つの賦形剤の混合物を造粒すること、およびクラブラン酸と少なくとも1つの賦形剤の造粒混合物を凍結乾燥することを含む。
本発明によれば、製剤は、約0.001mg/kg/日〜約1.0mg/kg/日のクラブラン酸塩を与える量で投与することができる。ある実施態様において、製剤は、約0.01mg/kg/日〜約1.0mg/kg/日を与える量で投与することができる。製剤は、1日1回または複数回で投与することができる。
【図面の簡単な説明】
【0011】
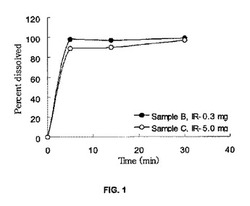
【図1】図1は、クラブラン酸塩即時放出製剤、試料B(●)およびC(○)の試験管内溶解プロファイルを示す図である。
【図2】図2は、クラブラン酸塩持続放出製剤、試料Fの試験管内溶解プロファイルを示す図である。
【図3】図3は、クラブラン酸塩持続放出製剤、試料Iの試験管内溶解プロファイルを示す図である。
【図4】図4は、試料D(5mg/クラブラン酸カリウムと微結晶性セルロースの1:1混合物の錠剤)の25℃/60%湿度(●)および30℃/65%湿度(▲)での安定性を示す図である。
【図5】図5は、試料E(5mg/クラブラン酸カリウムと二酸化ケイ素の1:1混合物の錠剤)の25℃/60%湿度(●)および30℃/65%湿度(▲)での安定性を示す図である。
【図6】図6は、試料F(5mg/クラブラン酸カリウムと微結晶性セルロースの1:1混合物の錠剤)の2〜8℃(○)、25℃/60%湿度(●)および30℃/65%湿度(▲)での安定性を示す図である。
【図7】図7は、試料G(5mg/錠剤)の2〜8℃(○)、25℃/60%湿度(●)および30℃/65%湿度(▲)での安定性を示す図である。
【図8】図8は、黒質緻密部(SNpc)におけるチロシンヒドロキシラーゼ(TH)のための免疫組織化学を示す図である。TH陽性ニューロンの数は、正常なグループと比較してMPTP (1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン)-生理的食塩水グループにおいて著しく減少した。TH陽性のニューロンの数は、MPTP-クラブラン酸塩処理グループにおいて保存が良かった。
【図9】図9は、MPTP (1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン)-処理動物における黒質緻密部(SNpc)ニューロン残存に対するクラブラン酸塩処理の効果を示す図である。
【図10】図10は、マウスPDモデルにおけるポールテストを用いたMPTP (1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン)-誘導神経毒性に対するクラブラン酸塩の行動効果を示す図である。
【図11】図11は、CA3部位におけるカイニン酸(KA)誘導海馬神経毒性に対するクラブラン酸塩の効果を示す図である。
【図12】図12は、正常グループ、カイニン酸+生理的食塩水およびカイニン酸+クラブラン酸塩処理グループにおけるCA3領域のクレシルバイオレット染色の結果を示す図である。
【発明を実施するための形態】
【0012】
本明細書に用いられる用語クラブラン酸塩には、下記のクラブラン酸(I)、医薬的に許容され得るクラブラン酸塩、塩組成物およびエステルのような誘導体が含まれる。医薬的に許容され得るクラブラン酸塩の例は、クラブラン酸カリウムである。クラブラン酸カリウムは、純粋な化合物としてまたは、例えば、ClavitesseTM、クラブラン酸カリウムと微結晶性セルロースとの1:1混合物またはクラブラン酸カリウムと二酸化ケイ素との1:1混合物(DSM Anti-Infectives B.V.、オランダから入手し得る)として供給され得る。
【0013】
【化1】

(I)
【0014】
例示的誘導体としては、クラブラン酸、例えば、アシルオキシアルキル基、例えば、アセトキシメチル、ピバロイルオキシメチル、β-アセトキシエチル、β-ピバロイルオキシエチル、1-(シクロヘキシルカルボニルオキシ)プロパ-1-イル、(1-アミノエチル)カルボニルオキシメチル、アルコキシカルボニルオキシアルキル基、例えば、エトキシカルボニルオキシメチル、アルファ-エトキシカルボニルオキシエチル、ジアルキルアミノアルキル基、例えば、エトキシカルボニルオキシメチル、β-エトキシカルボニルオキシエチル、ジアルキルアミノアルキル、特にジ低級アルキルアミノアルキル、例えば、ジメチルアミノメチル、ジメチルアミノエチル、ジエチルアミノメチルまたはジエチルアミノエチル-2-(アルコキシカルボニル)-2-アルケニル基、例えば、2-(イソブトキシカルボニル)ペンタ-2-エニル、2-(エトキシカルボニル)ブタ-2-エニル、ラクトン基、例えば、フタリジル、ジメトキシフタリジルの活性エステルが挙げられる。
例示的塩としては、クラブラン酸の医薬的に許容され得る塩、例えば、アルミニウム、アルカリ金属塩、例えば、ナトリウムまたはカリウム、アルカリ土類金属塩、例えば、カルシウムまたはマグネシウム、およびアンモニウムまたは置換アンモニウム塩、例えば、低級アルキルアミン、例えばトリエチルアミン、ヒドロキシ-低級アルキルアミン、例えば2-ヒドロキシエチリデン、ビス-(2-ヒドロキシエチル)アミンまたはトリス-(2-ヒドロキシエチル)アミン、シクロアルキルアミン、例えば、ジシクロヘキシルアミン、またはプロカイン、ジベンジルアミン、N,N-ジベンジルエチレンジアミン、1-エフェナミン、N-メチルモルホリン、N-エチルピペリジン、N-ベンジル-β-フェネチルアミン、デヒドロアビエチルアミン、N,N'-ビスデヒドロアビエチルアミン、エチレンジアミン、またはピリジンタイプ、例えば、ピリジン、コリジンまたはキノリン、または他のアミンの塩基との塩、リチウム塩および銀塩が挙げられる。
【0015】
本明細書に用いられる用語“経口投与”は、治療薬または組成物を飲み込むにしても飲み込まないにしても、被検者の口内に入れる治療薬またはその組成物の被検者への送達の形を含む。従って、“経口投与”には、口腔内投与および舌下投与並びに食道内投与がある。治療薬の吸収は、口、食道、胃、十二指腸、回腸および結腸を含む胃腸管の1つ以上の部分において行われ得る。
本明細書に用いられる、治療薬またはその組成物を投与することができる“被検者”には、いずれの性別もいかなる年齢のヒト患者をも含まれ、さらにヒト以外の動物、特に家畜またはペット、例示的にはネコ、イヌまたはウマが含まれる。
用語“神経変性疾患”は、変性、機能の全体的または部分的消失、または神経系の不規則な機能を伴う状態、障害および/または疾病を意味する。従って、このような方法で神経系(中枢か末梢)の構成部分または態様に影響する状態、障害および/または疾病は、神経変性疾患とみなされ得る。神経変性疾患としては、認知障害、運動障害、精神障害、疼痛障害、睡眠障害等が挙げられるが、これらに限定されない。例示的神経変性障害としては、パーキンソン病、アルツハイマー病および多発性硬化症が挙げられるが、これらに限定されない。例示的運動障害には、種々のジスキネジア、例えば、振戦、ジストニア、舞踏病、アテトーシス、チック障害、眼瞼痙攣だけでなく、片側バリスム、ミオクローヌス、限局性ジストニア、例えば、書痙または斜頚、下肢静止不能症候群および羽ばたき振戦が含まれ得る。これらの過剰な或いは異常な不随意運動は、速度、頻度、周期性および進行性の特性が著しく変動し得る。このような動きは、しばしば重なった障害、例えばパーキンソン病、本質的な振戦、即ち、良性の振戦または家系性の振戦、チック障害、例えばトゥレット症候群、特発性ジストニア(書痙を誘発する)、進行性核上麻痺、ウィルソン病に見ることができる。
【0016】
本明細書に用いられる用語“治療する”、“治療”等は、検出可能な、臨床的に有意な改善、発症の遅れ、発症の防止、または障害もしくは状態の障害もしくは症状の改善を意味する。治療は、治癒を必要としないかまたは要求しない。
“神経保護”は、特に、神経変性疾患または神経学的障害、すなわち、中枢または末梢神経系を含む、神経学的または神経システムに影響する障害の発症を遅延または防止する方法を意味する。神経保護作用または神経保護的効果は、経験的に、例えば、行動変化または認知変化またはその欠如によって、生理的に、例えば、未治療の対照と比較したニューロンの保存または欠如または破壊またはニューロン死、または神経学的システムの部分に対する副作用の欠如を測定する他の測定基準を示すことによって測定され得る。ニューロンの残存または減少がないことが証明され得る例示的位置には、黒質緻密部(SNpc)および海馬CA3部位が含まれる。
本明細書に用いられる“賦形剤”は、治療薬の被検者への送達のための担体または賦形剤として用いられるかまたは医薬組成物に添加してその加工、取扱い、貯蔵、崩壊、分散、溶解、放出または官能特性を改善するかまたは組成物の用量単位の経口投与に適するカプセルまたは錠剤のような分離した製品への配合を可能にするかまたは容易にする、それ自体は治療薬でない物質を意味する。賦形剤には、例示として限定せずに、希釈剤、崩壊剤、結合剤、接着剤、湿潤剤、ポリマー、潤滑剤、流動促進剤、不愉快な味または臭いを隠蔽または中和するために添加される物質、香味剤、色素、芳香剤、および組成物の外観を改善するために添加される物質が含まれ得る。
【0017】
従って、本発明は、経口投与に適しているクラブラン酸カリウムまたはClavitesseTMの即時放出製剤または持続放出製剤の使用に関する。本発明の製剤は、クラブラン酸塩の迅速放出調製物の量またはクラブラン酸塩の遅延放出(または持続放出)調製物の量を含む。即時放出製剤はそのクラブラン酸塩の迅速放出に特徴を有し、この迅速放出は、投与後約5〜約30分以内にクラブラン酸塩の最大放出を得ることに特徴を有する。持続放出製剤は、例えば、少なくとも約4時間かけてクラブラン酸塩のより遅い放出に特徴を有する。他の例示的実施態様において、持続放出製剤は、クラブラン酸塩を少なくとも約6時間または少なくとも約8時間にわたって放出し得る。これらのまたは他の実施態様は、クラブラン酸塩を、最初の投与後、少なくとも約3時間、少なくとも約4時間、少なくとも約5時間、少なくとも約6時間、少なくとも約7時間、または少なくとも約8時間放出し続けることができる。例示的な実施態様において、本発明は、即時放出製剤または持続放出製剤を含む錠剤またはカプセル剤であり、製剤の全質量よりはむしろ製剤中の薬剤の全量に基づき、約10μg〜10mgのまたは活性化合物の全質量の約0.01%〜10%の量の活性化合物を含んでいる。
本発明の神経保護および神経変性障害の治療は、クラブラン酸の安定な固体製剤を経口投与することによって達成され得る。治療は、対象物の残存、行動試験、免疫組織学的評価、例えば、細胞またはニューロンの残存を測定するか、または障害を示す具体的な症状の頻度または強度を測定することを含む、多くの方法で評価することができる。動物モデルまたはヒトの研究において、行動試験には、例えば、速度や向きに関して評価される運動不全等に、例えば、それ自体で適応する能力の評価が含まれ得る。行動試験には、迷路、例えば、モーリス水迷路試験等の使用による記憶を試験することが含まれ得る。免疫組織学的評価は、自由浮遊切片の染色に続いて細胞計数または当該技術において一般に知られる他の技術で行うことができる。症状による試験には、例えば、種々の症状、例えば、発作または振戦の数、振動数または輝度を評価すること、または記憶の保持を評価することが含まれ得る。
【0018】
本発明によれば、MPTP(1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン)-誘導パーキンソン病動物モデルにおいて、MPTP-生理食塩水グループと比較して安定な固体クラブラン酸の経口投与によって前処理されるグループにおいてTH(チロシンヒドロキシラーゼ)-陽性ニューロンの数が保存されることがわかった。さらに、クラブラン酸による前処理動物は、カイニン酸誘導海馬細胞死に対して著しい神経保護効果を示した。処理動物もまた、対照と比較して発作や軽度の発作の機能活動に対する発症が長くかかることを示した。
神経保護または神経変性疾患の治療のためのある実施態様において、安定な固体製剤は、約0.001mg/kg〜約1.0mg/kgのクラブラン酸塩を与える量で投与され得る。ある実施態様において、安定な固体製剤は、約0.01mg/kg〜約1.0mg/kgのクラブラン酸塩を与える量において投与され得る。ある実施態様において、安定な固体製剤は、約0.1mg/kg〜約1.0mg/kgのクラブラン酸塩を与える量で投与され得る。このような用量は、効力評価によって示されるように1日1回、1日2回、1日3回以上投与され得る。適切で便利な単位量、例えば、1回分0.1mg、1回分0.5mg、1回分1.0mg、1回分5mg等で投与するための剤形が配合され得る。例示的実施態様において、安定な固体製剤には、1回分約5mgのクラブラン酸塩が含まれる。
一日量は、1回の投薬で投与されるかまたは1日の間に投与されるように複数回に分けることもできる。複数回は、1日2回、3回、4回以上であり得る。理解されるように、持続放出組成物は、同様の合計一日量を送達しつつ服用されなければならない一日量の全体数を少なくするための手段を与えることができる。安定な固体剤形は、不足投薬または過量投薬が一般的でないことを確実にし得るので本発明に用いるのに特に有利である。絶対的には少量の分解によってさえも実際に投与されるクラブラン酸塩の割合の比較的大きい変化が生じ得る本適用においてこのことは特に重大である。クラブラン酸塩の以前の使用、例えば、β-ラクタマーゼ阻害剤として抗生物質と共に補助剤での使用においては、安定性のないことが過剰なクラブラン酸塩を用いることによって解決することができるので、分解は効力に対して影響しない。しかしながら、クラブラン酸塩が活性医薬成分である本明細書に記載される適用においては、開業医が治療に適する予測可能な所定量でクラブラン酸塩を投与することができることがより重要である。これにより、治療効力だけでなく患者服薬遵守をさらに増加させることができる。
【0019】
錠剤またはカプセル剤のような医薬剤の経口投与は、静脈内(i.v.)または筋肉内(i.m.)のような非経口投与よりある種の利点を有する。痛みを伴う注射用製剤による治療を必要とする疾患は、経口剤形で治療し得る症状より重篤であると考えられる。しかしながら、経口製剤による大きな利点は、自己投与に対するその適性を保っており、一方、非経口製剤は、ほとんどの場合、医師または医療補助員によって投与されなければならない。本発明については、神経変性疾患の少なくともある指標に関して経口投与が効力増加を有することが示されている。
種々の薬剤物質の種類、例えば、粒度分布、嵩密度、流動性、湿潤挙動、表面積および粘着傾向は、大きく変動し、錠剤のような固体剤形の加工性に影響し得る。クラブラン酸塩は、非常に吸湿性であり、水との接触時に、結晶状態から、劣った安定性を示すアモルファス状態に変化する。これらのハードルの組み合わせは、標準の錠剤製造プロセスを極めて難しいものにし、クラブラン酸塩の製剤の貯蔵を問題あるものとし、クラブラン酸塩を含有する製剤の貯蔵および調製に特別な条件をもたらした。
クラブラン酸カリウムは、最も一般的で容易に処理される形態であるが、配合するのに例外的に難しい物質の状態を維持し、極めて吸湿性で水分感受性である。分解は、水および水性媒体の存在下に容易に生じる。クラブラン酸塩が活性医薬成分である本明細書に記載されるような適用においては、開業医が治療のために適する予測可能な所定の量でクラブラン酸を投与することができることがより重要である。安定な経口剤形を投与することは、これらの場合の治療使用に望ましいことである。
従って、クラブラン酸塩が単独の有効成分である神経保護および神経変性疾患の治療に、クラブラン酸塩の特性を考慮する上記の問題を克服する適切で強固なクラブラン酸塩製剤が求められている。クラブラン酸塩製剤に直面する問題は、わずかな分解でさえも被検者に利用し得るクラブラン酸塩量の劇的な変化につながり得る10μg〜10mgのような低用量の製剤の場合に特に難しい。
【0020】
本発明は、クラブラン酸塩の安定な経口剤形の調製および神経保護および神経変性疾患の治療におけるその使用に関する。本発明に用いられる固体経口剤形は、固体経口剤形の調製に通常適している添加剤または賦形剤を含むことができる。固体経口剤形としては、例えば、錠剤、カプセル剤、丸剤、トローチ剤および散剤が挙げられる。カプセル剤の場合、固体経口剤形は、カプセルの中のビーズであり得る。本発明の例示的実施態様において、固体経口剤形は、安定な固体錠剤である。
錠剤配合物に一般に用いられる打錠助剤を用いることができ、対象物についての広範な文献を参照する、特に、Fiedlerの“Lexicon der Hilfstoffe”, 4th Edition, ECV Aulendorf 1996を参照のこと、この文献の記載は、本願明細書に含まれるものとする。これには、充填剤、結合剤、崩壊剤、滑沢剤、流動促進剤、安定剤、充填剤または希釈剤、界面活性剤、フィルム形成剤、軟化剤、顔料等が含まれるが、これらに限定されない。
充填剤としては、デンプン、例えば、ジャガイモデンプン、小麦のデンプン、コーンスターチ、ヒドロキシプロピルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルメチルセルロース(HPMC)および、微結晶性セルロース、例えば、登録商標AVICEL、FILTRAK、HEWETEN、Prosolve SMCC50またはPHARMACELとして入手し得る製品が挙げられる。充填剤の他の例としては、マルトース、イソマルト、ラクトース(例えば、Pharmatose(登録商標))、スクロース、グルコース、マンニトール、ソルビトール、および炭酸カルシウムが挙げられる。
結合剤としては、デンプン、糖、セルロースまたはヒドロキシプロピルセルロースのような変性セルロース、ラクトース、またはキシリトール、ソルビトールもしくはマルチトールのような糖アルコールが挙げられる。例示的結合剤は、マルトデキストリン(Maltrin M150)である。
【0021】
崩壊剤としては、カルボキシメチルセルロースカルシウム(CMC-Ca)、カルボキシメチルセルロースナトリウム(CMC-Na)、架橋PVP(例えば、CROSPOVIDONE、POLYPLASDONEまたはKOLLIDON XL)、アルギン酸、アルギン酸ナトリウムおよびグアーガムを挙げることができる。架橋PVP(CROSPOVIDONE)、架橋CMC(Ac-Di-Sol)、カルボキシメチルデンプンNa(PIRIMOJELおよびEXPLOTAB)、Pharmaburstおよびヒドロキシプロピルセルロース(L HPC LH-11)が例示的な崩壊剤である。
マトリックスには、例えば、Methocel K100 Prem-MまたはEudragit RS PO粉末、メタクリルコポリマー(例えば、メタクリルコポリマータイプA、メタクリルコポリマータイプB、Carbopol)、および当該技術において知られる他のものが含まれ得る。
流動促進剤の例としては、コロイド状二酸化ケイ素のようなコロイド状シリカ、例えば、ヒュームドシリカ(Cabosil、Aerosil)、三ケイ酸マグネシウム(Mg)、粉末セルロース、デンプン、タルクおよび第三リン酸カルシウムまたはこれらと充填剤もしくは結合剤、例えば、ケイ化微結晶性セルロース(PROSOLV)との組み合わせが挙げられる。Cabosilは、流動増強剤/湿気防止剤としても機能し得る。
さらに、充填剤または希釈剤には、粉砂糖、圧縮糖、デキストレート、デキストリン、デキストロース、ラクトース、マンニトール、微結晶性セルロース、例えば、AVICELのような約0.45g/cm3の密度を有する微結晶性セルロース、粉末セルロース、ソルビトール、スクロースおよびタルクが含まれ得る。
滑沢剤としては、ステアリン酸およびその塩、例えば、ステアリン酸マグネシウム、ステアリン酸アルミニウム、ステアリン酸カルシウム、PEG4000〜PEG8000、タルク、水素化ヒマシ油、グリセロールエステル、Na-ステアリルフマレート、水素化綿実油等が挙げられる。一般の滑沢剤は、ステアリン酸およびステアリン酸Mgである。
【0022】
錠剤およびカプセル剤は、さらに、腸溶コーティング並びに光保護、および嚥下性のための他の放出制御コーティングで調製され得る。腸溶コーティングの例としては、例えば、メタクリル酸コポリマー、酢酸セルロース(およびそのコハク酸、フタル酸の変形例)、スチロールマレイン酸コポリマー、ポリメタクリル酸/アクリル酸コポリマー、ヒドロキシプロピルメチルセルロースフタレート、ポリビニルアセテートフタレート、ヒドロキシエチルエチルセルロースフタレート、ヒドロキシプロピルメチルセルロースアセテートスクシネート、セルロースアセテートテトラヒドロフタレート、アクリル樹脂、トリメリテート、およびシェラックから調製される化合物が挙げられてもよい。腸溶コーティングに例示的なポリマーとしては、Eudragitのようなメタクリルコポリマーが挙げられる。腸溶コーティングに適切な他のポリマーは、当該技術において既知である。コーティングは、医薬的に許容された色素で着色され得る。コーティング液中の色素や他の賦形剤の量は、変動してもよく、即時錠剤または持続放出錠剤の性能に影響しない。コーティング液は、一般に、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、セルロースエステルまたはエーテル、アクリルポリマーまたはポリマーの混合物のようなフィルム形成ポリマーを含む。コーティング溶液は、一般に、プロピレングリコール、ソルビタンモノオレート、ソルビン酸、二酸化チタンのような充填剤、医薬的に許容され得る色素をさらに含む水溶液である。
本発明に用いられる安定な固体経口剤形は、活性成分としての治療的に有効な量のクラブラン酸塩、および添加剤としての充填剤を含む。さらに添加剤としては、結合剤、崩壊剤、滑沢剤、流動促進剤、安定剤、希釈剤、界面活性剤、フィルム形成剤、顔料、軟化剤および固化防止剤等が挙げられるが、これらに限定されない。
【0023】
クラブラン酸カリウムは、表10に示されるように、約35%の相対湿度に96時間さらされた場合に比較的低い水分含量(乾燥質量基準で<1%)を有する。しかしながら、約40%の相対湿度を超える湿度においては最終的に潮解が生じていると思われる。50%の相対湿度にさらされた乾燥クラブラン酸カリウムによる吸湿は、ほぼ1.44%/時間の速度で生じる。
クラブラン酸塩を含有する医薬組成物の調製中、凍結乾燥、またはフリーズドライの使用はクラブラン酸塩錠剤の安定性を約97%まで向上させる(表11参照)。
本発明に用いられる安定な個体経口医薬組成物には、医薬的に活性な成分(API)としてクラブラン酸塩を約10μg〜10mg、例えば、約0.1mg〜約5mgの範囲にある用量で含まれ得る。例示的実施態様において、クラブラン酸塩は、クラブラン酸の塩、例えば、クラブラン酸カリウムである。クラブラン酸がCNS活性および挙動を10ng〜10μg/kgの範囲にある腹腔内(i.p.)用量で変化させ得ることが報告されている(米国特許第6,489,319号明細書を参照のこと)。
本発明によれば、約10μg〜10mgのクラブラン酸塩、例えば、約0.1mg〜約5mgのクラブラン酸塩を含有する、例えば、即時放出剤形や持続放出剤形を含む、多くの剤形で投与することができる。このような剤形は、神経保護および神経変性疾患およびその症状の治療に使用し得る。
即時放出剤形は、望ましくは、本明細書に開示される標準分析によって測定された場合に約30分未満にクラブラン酸塩が少なくとも約80%(w/v)溶解する。本発明の実施態様によれば即時放出医薬組成物は、固体剤形を処理することができない患者に好都合な投与として適切な水溶液(例えば、水、食塩水、ジュース)またはコロイド状懸濁液(例えば、粉ミルクまたはミルク)に迅速に溶解させ得る。このような患者の例示は、乳児、小児、および嚥下障害を経験することがあり得る成人である。例示的実施態様において、組成物を水溶液に入れた時点からおよそ15分でクラブラン酸塩の少なくとも約80%が水溶液に溶解する。他の実施態様において、組成物を水溶液にさらした後に、約30分、または約15分でクラブラン酸塩の少なくとも約90%が水溶液に放出される。図1に示されるように、本発明を実施するのに有効な例示的即時放出組成物は、水溶液にさらした後15分以内にクラブラン酸塩の90%を放出する。
【0024】
持続放出組成物は、活性成分、即ち、クラブラン酸塩を、長時間かけて、例えば、約8時間かけてまたは約10時間にかけて放出し得る。持続放出製剤は、製剤が胃腸管に達すると直ぐに活性成分を放出し始め、徐々に溶解するとともに活性成分をほぼ一定の方法で放出し続けることができる。このプロファルは、投与後の血流中の活性成分がより安定したレベルになることから望ましい。図2に示されるように、本発明を実施するのに有効な例示的持続放出組成物は、投与後約8〜10時間までにクラブラン酸塩の放出が実質的なレベルになり得る。
本発明の実施態様に用いられる医薬組成物は、重要な利点を与える。水分の含有量の制御は、クラブラン酸塩が吸湿性であり且つ水中で不安定または加水分解性であることからクラブラン酸塩含有組成物の配合および貯蔵において大きな課題である。安定な即時放出または持続放出組成物を調製するための凍結乾燥の使用は、特に、クラブラン酸塩が凍結乾燥前に賦形剤と組み合せられる場合に、予期しないことに安定性を増強する。
本発明に用いられる実施態様において、(1)クラブラン酸塩と少なくとも1つの賦形剤とを混合することによってクラブラン酸塩組成物を調製する工程、(2)凍結固形物に変換するまでクラブラン酸塩組成物、例えば、クラブラン酸塩の量を0℃以下で凍結する工程、(3)クラブラン酸塩組成物を気密容器内で脱水させる工程を含む凍結乾燥クラブラン酸組成物が使用し得る。薬剤を含む、粉末形態の脱水(凍結乾燥)組成物は、錠剤に圧縮されるかまたは標準サイズのビーズとして調製される前に、他の賦形剤と混合され得る。
最終乾燥製剤の水分含量は低い。本明細書において用いられる種々の実施態様は、約10%(質量)を超えない、約5%を超えない、約4%を超えない、またはそれよりも低い最終水分含量を有し得る。本発明のこのような実施態様の乾燥製剤は、長期間非常に貯蔵安定で、例えば、25℃および60%相対湿度または30℃および65%相対湿度のような条件において約30日間、約60日間または約90日間安定である。適切な液体による希釈時には、実質的に所定の初期用量で充分に強力である。
【0025】
本発明において用いられる製剤は、ポリマー、例えば、Eudragit(メタクリル酸とエチルアクリレートのアニオン性コポリマー)のようなマトリックス、Maltrin M50のような結合剤/希釈剤および/またはPharmaburstのような崩壊剤、充填剤、クラブラン酸塩、および他の賦形剤(実施例参照)を乾式混合し、続いて、混合物を水を用いて、適切な造粒物が得られるまで造粒することによって調製され得る。造粒は、当該技術において既知の方法によって行われる。湿潤顆粒を凍結乾燥機内で凍結乾燥し、篩分けし、適切な粒度に粉砕する。滑沢剤を乾燥造粒物と混合して、最終製剤を得ることができる。クラブラン酸塩が吸湿性であり且つ水中で不安定であるので、混合物が湿ったままである時間を最短にする必要があり、例えば、計量と造粒から凍結乾燥までの処理時間は、約1時間であり得る。
本発明において用いられる組成物は、例えば、錠剤またはカプセル剤の形で、経口投与される。錠剤は、当該技術において知られる手法によって調製し、治療的に有効な量のクラブラン酸塩とこのような手法によって錠剤を形成するのに必要な賦形剤を含有し得る。プラセボ粒子もまた、クラブラン酸塩を含まないが同じ組成で製造され得る。
【0026】
成人のヒト被検者において神経保護または神経変性疾患の治療に使用し得る安定な固体クラブラン酸塩製剤の例示的用量は、約5mg/日〜約100mg/日であり得る。例示的実施態様において、一日量は、約5mg〜約70mg、例えば、約5mg〜約50mgまたは約7mg〜約70mgである。他の例示的用量は、約10mg/日〜約50mg/日、約5mg/日、7mg/日、10mg/日、20mg/日、25mg/日、または35mg/日であり得る。上で開示したように、一日量は1日1回、1日2回、1日3回以上投与され得る。理解されるように、一般的には、持続放出製剤の使用には1日当たりより少ない用量を投与することが必要とされ得る。一例として、例えば、10mgの一日量は、1回10mgの投薬、2回5mg、3回約3.33mgまたは4回2.5mgとして投与され得る。他の投薬量は、具体的な個体に対して必要な用量が算出され得る。
本発明に従って投与される安定な固体剤形は、単位剤形として供給され得る。単位剤形は、所定量のクラブラン酸塩活性物質を含有する1回量である。単位剤形の例としては、錠剤、トローチ剤、カプセル剤および粉末を含有する小包が挙げられるが、これに限定されない。本発明に従って投与する単位剤形には、例えば、0.1mg、0.25mg、1mg、1.5mg、2.0mg、2.5mg、5.0mg、7.5mg、10mgまたは他の量のクラブラン酸塩が含まれ得る。1回量は、1単位剤形、複数単位剤形または部分的単位剤形を含み得る。一例として、例えば、5mgの用量は、各々が2.5mgのクラブラン酸塩を含有する2単位剤形、5.0mgのクラブラン酸塩を含有する1単位剤形、または10mgのクラブラン酸塩を含有する単位剤形の半分として投与され得る。他の単位剤形を含む他の投薬量は、容易に算出され得る。
【0027】
薬物動態試験
本発明の製剤についてのバイオアベイラビリティを、錠剤形の即時製剤または持続製剤を健常な被検者に投与し且つ血漿中のクラブラン酸塩レベルを24時間にわたって種々の時間間隔で測定することによって測定した。血漿試料について、文献に記載されている手順と同様な有効な高性能液体クロマトグラフィー手順を用いて、BAS Analytics(West Lafayette、インディアナ州)によりクラブラン酸塩を分析した。例えば、Chu S-Y, et al., "Simultaneous determination of clarithromycin and 14(R)-hydroxyclarithromycin in plasma and urine using high performance liquid chromatography with electrochemical detection", J. Chromatography, 571, pp 199-208 (1991)を参照のこと。
【実施例】
【0028】
下記の実施例は、例示のみのためであり、添付の請求の範囲の範囲を制限することを意味しない。
実施例1:クラブラン酸塩の調製
実施例1A-クラブラン酸カリウム粉末を用いる即時放出クラブラン酸塩錠剤の調製
錠剤調製プロセスの例示的説明: 水が造粒工程に含まれ、その後、乾燥させて低水分含量(<3%)の顆粒を得る湿式造粒錠剤配合方法を見出した。乾燥配合物は、従来技術の配合物と比較して非吸湿性であるが、そこから調製される錠剤の等価な物理的特性(例えば、溶解性、崩壊性、バイオアベイラビリティ、他の物理的性質)を維持している。結合剤/希釈剤の存在下にクラブラン酸塩を水で造粒することによって錠剤調製を行った。
試料Cの調製については、Maltrin M150(130g)を精製水に溶解し、クラブラン酸カリウム(API; 59.5g)を添加した。Prosolve SMCC-50(490.5g)、Pharmaburst(130.0g)、L HPC LH-11(120.0g)、Acdisol(20.0g)およびステアリン酸(50g)を計量し、バッグを振盪且つ回転させることによってバッグ内で混合した。この混合物をHobartミキサーのボウルに移し、API/Maltrin M150溶液を混合物に10分間撹拌しつつ添加した。湿塊化が完了した後、Hobartミキサーのボウルの内容物を押出機に移し、押出した。押出物をスフェロナイザーに入れ、球形化した材料をバッグ内に集め、gortex-lyoguardトレーにおいて凍結乾燥した。乾燥材料を篩分けし、錠剤に圧縮するかまたは標準サイズのビーズに調製した。試料AおよびBを試料Cと同じ方法で調製した。
【0029】
実施例1B - ClavitesseTMを用いる即時放出クラブラン酸塩錠剤の調製
試料Dの調製については、ClavitesseTM (API; 50.6g)、Prosolve SMCC 50 (213.4g)、Pharmaburst(100.0g)、Acdisol(8.0g)、Cabosil(8.0g)およびステアリン酸マグネシウム(20.0g)を計量し、2〜8℃のgortex-lyoguardトレーにおいて一晩凍結乾燥した。翌日、API、Prosolve SMCC 50、PharmaburstおよびAcdisolをバッグ内で混合し、#40メッシュにより篩分けし、Vブレンダー中に取出し、7分間混合した。この混合物を再度篩分けし、Vブレンダー内で4分間混合した。Cabosilとステアリン酸マグネシウムを篩分けし、APIを含有する混合物とVブレンダー内で4分間混合した。ブレンドをgortex-lyoguardトレーにおいて一晩凍結乾燥した。材料を錠剤に圧縮し、錠剤をgortex-lyoguardトレーにおいて凍結乾燥し、包装した。試料Eを試料Dと同じ方法で調製した。
【0030】
実施例1C - ClavitesseTMを用いる持続放出クラブラン酸塩錠剤の調製
試料Fの調製については、適切な量のClavitesse(API; 41.07g)、Methocell K100LV Prem CR(90.0g)、Isomalt(83.55g)、Avicel PH-112 (80.04g)、Cabosil (1.5g)、タルク(2.4g)およびステアリン酸マグネシウム(1.5g)を計量し、凍結乾燥機において2-8℃のgortex-lyoguardトレーにおいて一晩乾燥した。各成分を篩分けし、別々のバッグに集めた。APIとMethocel K100LV Prem CRをVブレンダーに入れ、混合し、適切な篩によって篩分けし、混合を続けた。Avicel PH-112とIsomaltを混合物に添加し、混合した。得られた混合物を再度篩分けし且つ混合した。Cabosilとタルクを混合し、この混合物に添加し、混合した。ステアリン酸マグネシウムを、Vブレンダー内でこの混合物と混合した。最終ブレンドをgortex- lyoguardトレー内で一晩凍結乾燥し、錠剤に圧縮するかまたは標準サイズのビーズに調製した。錠剤を、持続放出コーティーングとしてより高い硬度で圧縮した。錠剤またはビーズを、遅延放出ポリマーのEudragitでコーティーングした。
【0031】
実施例1D - クラブラン酸カリウム粉末を用いる持続放出クラブラン酸塩錠剤の調製
クラブラン酸カリウムを用いた持続放出錠剤、試料Gの製造については、クラブラン酸カリウム(API; 20.69g)を#60メッシュにより篩分けし、他の賦形剤、Methocel K100LV Prem CR (90.02g)、Isomalt (83.56g)、Avicel PH-112 (100.41g)、Cabosil(1.52g)、タルク(2.4g)およびステアリン酸マグネシウム(1.5g)を#40メッシュにより篩分けした。各成分を別々のバッグに集めた。APIとMethocel K100LV Prem CRをVブレンダーに入れ、5分間混合した。この混合物を篩分けし、さらに5分間混合した。この混合物にAvicel PH-112とIsomaltを添加し、Vブレンダー内で、5分間混合した。得られた混合物を篩分けし、さらに5分間混合した。Cabosilとタルクを混合し、混合物に入れ、その後、得られた混合物を2分間混合した。最後に、この混合物とステアリン酸マグネシウムをVブレンダー内で3分間混合し、最終ブレンドをgortex-lyoguardトレーにおいて一晩凍結乾燥し、その後、錠剤に圧縮するかまたは標準サイズのビーズに調製した。錠剤を持続放出コーティーングとしてより高い硬度で圧縮した。錠剤またはビーズを遅延放出ポリマー、Eudragitでコーティーングした。試料HおよびIを試料Gと同じ方法で調製した。
【0032】
実施例2: クラブラン酸塩の分析
調製した医薬組成物のクラブラン酸塩含量を、Waters HPLC (高性能液体クロマトグラフィー)システム(カラム: μBondapack-NH2 (10μm) 300mm×3.9mm、移動相: CH3CN: pH 5.2 KH2PO4 = 65:35、流量:1.0ml/分)によって以下の手順を用いて測定した: 約10個の錠剤を正確に計量し、粉砕し、100mlの水を加え、この混合物を20分間超音波処理した。水で希釈した後、この溶液の一部をろ過し、HPLCに注入した。主要ピークを、HPLCによる標準調製物のクロマトグラムに相応する試料の保持時間によって同定した。クラブラン酸塩%を、参照基準の応答係数と比較した分析物応答係数に基づいて算出した。
クラブラン酸塩標準曲線の直線性を、0.01mg/mlの設定濃度の参照基準の25、50、75、100、125、150%で確認した。R2は、0.9998であった。クラブラン酸塩の0.01mg/mlの設定濃度において、精密さは6試料を用いてRSD1.4パーセントで確認した。正確さは、0.01mg/mlの50%、100%、および150%のスパイク処理プラセボブレンドを3回の実験で調製し、分析することによって求めた。
【0033】
実施例3: 例示的配合および特性
以下の試験は、種々の用量を有する即時放出(IR)錠剤および持続放出(ER)錠剤として設計された錠剤配合を記載するものである。以下の表は、本配合による錠剤の物理的性質も示している。
実施例3A - クラブラン酸カリウムを用いる即時放出組成物
上述の方法を用いて下記の表1に示されるクラブラン酸カリウム粉末と賦形剤から即時放出組成物を調製した。
【0034】
表1

API*: 活性医薬成分。
【0035】
表2は、クラブラン酸カリウム粉末を用いた即時放出錠剤の特性をまとめたものである。試料C錠剤は、優れた安定性を示し、2〜8℃で1週間後に94.4%のクラブラン酸カリウムを含有していた。
【0036】
表2

【0037】
実施例3B - ClavitesseTMを用いる即時放出組成物
表3に示されるようにClavitesseTMを用いて5mgのクラブラン酸塩を含む即時放出組成物を調製した。
【0038】
表3

API*: 活性医薬成分。
【0039】
表4は、ClavitesseTMを用いた即時放出錠剤の特性をまとめたものである。
【0040】
表4

【0041】
実施例3C - ClavitesseTMおよびクラブラン酸カリウム粉末を用いる持続放出組成物
表5-8に示されるように、ClavitesseTMまたはクラブラン酸カリウム粉末を用いて持続放出組成物を調製した。
【0042】
表5

API*: 活性医薬成分。
【0043】
表6

API*: 活性医薬成分。
【0044】
表7

API*: 活性医薬成分。
【0045】
表8

API*:活性医薬成分。
【0046】
表9は、ClavitesseTMおよびクラブラン酸カリウム粉末を用いた持続放出錠剤の特性をまとめたものである。
【0047】
表9

【0048】
実施例4: 試験管内溶解実験
錠剤を500mlの溶媒に入れた(即時放出錠剤に対しては脱イオン水、持続放出錠剤に対しては最初の2時間がpH 1.2溶液、その後、次の8時間がpH 7.0のクエン酸緩衝液)。この混合物を100rpmおよび37℃で旋回させ、試料を定期的に収集し、溶解したクラブラン酸塩量をHPLCによって試験した。
結果を図1-3に示す。図1は、試料Bおよび試料Cのクラブラン酸塩即時放出製剤の試験管内溶解プロファイルを示すグラフである。図1に示されるように、即時放出錠剤中のクラブラン酸塩の90%以上が、水溶液にさらした後15分以内に溶解した。図2は、試料Fのクラブラン酸塩持続放出製剤の試験管内溶解プロファイルを示すグラフである。図3は、試料Iのクラブラン酸塩持続放出製剤の試験管内溶解プロファイルを示すグラフである。図2および3に示されるように、持続放出錠剤中のクラブラン酸塩の全用量は、侵食および溶解メカニズムによって、少なくとも約8〜10時間にわたって徐々に放出されていた。持続放出形態におけるクラブラン酸塩の放出は、pH 1.2溶液中には検出されなかった。
【0049】
実施例5: 安定性試験
固体形態でのクラブラン酸カリウムは、水蒸気の存在下に吸湿性でもありでは不安定でもある。クラブラン酸塩の安定性試験を、クロマトグラフィー法によりモニターすることによって行った。静的または均衡論的アプローチを、試料を異なる相対湿度のチャンバ内で収着等温線を生成させる試みで貯蔵することによって行った。収着等温線は、大気中の平衡水分含量と相対湿度(RH)間の定量的相関関係を示す。表10は、種々の湿度条件にさらした後のクラブラン酸カリウム粉末中の水分の含有量の変化を示すものである。
【0050】
表10

【0051】
表10に示されるように、クラブラン酸カリウムは、約35%以下の相対湿度に96時間さらした場合に、比較的低い水分含量(乾燥質量基準で<1%)を有する。しかしながら、約40%相対湿度よりも高い湿度においては最終的に潮解が生じているようである。約50%相対湿度にさらした乾燥クラブラン酸カリウムによる水分吸収は、毎時約1.44%の速度で生じている。
クラブラン酸カリウムは、配合するのに例外的に難しい物質であり、極度に水分および熱に感受性である。水および水性媒態の存在下に分解が容易に起る。幾つかの方法を試験して、活性成分クラブラン酸塩を無傷のまま保つ湿式造粒後の適切な水分除去条件を見出した。試料Cの材料を、湿式造粒によって製造し、球形化した。水分含有球形化製剤をトレーに移し、水分除去のための種々の貯蔵条件に供した。
表11にまとめたように、30℃で69時間の貯蔵(貯蔵1)または45℃で75時間の貯蔵(貯蔵2)によって、それぞれ、45%および60%までのクラブラン酸カリウムの分解が生じた。流動床系での乾燥によって、わずか1.5時間で13%だけクラブラン酸塩の分解が生じた。これらのデータは、クラブラン酸カリウムが温度感受性でもあることを示している。凍結乾燥は、21時間の凍結乾燥プロセス後に活性成分の97%を保持した。表11の結果は、クラブラン酸塩製剤中の水分含量を減少させ且つ製剤の安定性を増大させるためにクラブラン酸塩の凍結乾燥を使用し得ることを示している。
【0052】
表 11

【0053】
ClavitesseTMから調製された即時放出錠剤、試料Dおよび試料Eの安定性を3ヶ月までの間評価した。図4は、25℃/60%湿度および30℃/65%湿度での試料D(クラブラン酸カリウムと微結晶性セルロースの1:1混合物の5mg/錠剤)の安定性を示すグラフである。図5は、25℃/60%湿度および30℃/65%湿度での試料E(クラブラン酸カリウムと二酸化ケイ素の1:1混合物の5mg/錠剤)の安定性を示すグラフである。表4および図4と図5に示されるように、試料Dと試料Eに従って調製された両錠剤は、はじめに4%未満の水分を含有しており、25℃/60%湿度、即ち、クラブラン酸塩には比較的高湿度条件において7%未満分解していた。ClavitesseTMから調製された持続放出錠剤、試料Fと試料Gの安定性を2ヶ月までの間評価した。図6は、2-8℃、25℃/60%湿度および30℃/65%湿度での試料F(クラブラン酸カリウムと微結晶性セルロースの1:1混合物の5mg/錠剤)の安定性を示すグラフである。図7は、2-8℃、25℃/60%湿度および30℃/65%湿度での試料G(5mg/錠剤)の安定性を示すグラフである。表5および図6と図7に示されるように、試料Fおよび試料Gに従って調製された錠剤は、はじめに4%未満の水分を含有しており、30℃/65%湿度、即ち、クラブラン酸塩には比較的高湿度条件において1.6%未満分解していた。それ故、ClavitesseTM中の微結晶性セルロースまたは二酸化ケイ素は、錠剤中の水分を捕捉することによってクラブラン酸カリウムの安定性の増大にさらに寄与し得る。
【0054】
実施例6. 薬物動態試験
ビ−グル犬の血漿中のクラブラン酸塩量を、LC/MS/MS法によって測定した。分析物のクロマトグラフィー分離を、逆相PLRP-S高分子カラムにより行った。クラブラン酸カリウムとタゾバクタム(参照化合物)の保持時間は、それぞれ、8.51分および8.54分であった。全体のクロマトグラフィー操作時間は25分であった。M/S分析は、Applied BiosystemsのAPI 2 000三連四重極質量分析計により負エレクトロスプレーイオン化モードにおける多反応モニタリングによって行った。質量スペクトルデータを、Analyst 1.4.1(Applied Biosystems)によって分析した。薬物動態分析は、PK Solutions 2.0 (Summit Research Services)を用いることにより行った。
【0055】
実施例6A - 雄ビーグル犬の即時放出(IR)錠剤の経口投与
3匹の雄ビ−グル犬を、治療の間の休薬期間を含む交叉デザインでの試験全体に用いた。イヌに実施例3AのIR錠剤としての試験物質を経口経路で投与し、投与間の24時間より短い休薬期間はなかった。動物を試験物質の投与前の一晩絶食させ、投与後4時間で給餌した。全ての治療中、血液試料(1.5ml)を橈側皮静脈から静脈穿刺により投与後0分、5分、15分、30分、1時間、1.5時間、2時間、2.5時間、3時間、4時間、6時間、9時間および12時間でヘパリン処理チューブに採血した。血漿を3,000rpmで10分間の遠心分離によって得、LC-MS/MSシステムによって分析した。関連の平均薬物動態パラメーターを表12に示す。
【0056】
実施例6B - 雄ビーグル犬のクラブラン酸カリウム溶液のIV投与
3匹の雄ビ−グル犬を、治療の間の休薬期間を含む交叉デザインでの試験全体に用いた。イヌに水溶液としての試験物質を静脈内経路で投与し、投与間の24時間より短い休薬期間はなかった。動物を試験物質の投与前の一晩絶食させ、投与後4時間で給餌した。全ての治療中、血液試料(1.5ml)を橈側皮静脈から静脈穿刺により投与後0分、5分、15分、30分、1時間、1.5時間、2時間、2.5時間、3時間、4時間、6時間、9時間および12時間でヘパリン処理チューブに採血した。血漿を3,000rpmで10分間の遠心分離によって得、LC-MS/MSシステムによって分析した。関連の平均薬物動態パラメーターを表12に示す。
【0057】
実施例6C - 雄ビーグル犬の持続放出(ER)錠剤の経口投与
4匹の雄ビ−グル犬を、治療の間の休薬期間を含む交叉デザインでの試験全体に用いた。イヌに実施例3CのER錠剤としての試験物質を経口経路で投与し、投与間の24時間より短い休薬期間はなかった。動物を試験物質の投与前の一晩絶食させ、投与後4時間で給餌した。全ての治療中、血液試料(1.5ml)を橈側皮静脈から静脈穿刺により投与後1時間、2時間、3時間、4時間、5時間、6時間、7時間、8時間、9時間、10時間、11時間および12時間でヘパリン処理チューブに採血した。血漿を3,000rpmで10分間の遠心分離によって得、LC-MS/MSシステムによって分析した。関連の平均薬物動態パラメーターを表12に示す。
【0058】
表12

*PKパラメータ: Tmax: 最高濃度までの時間、Cmax: 最高濃度、AUC: 曲線下の領域、CL: クリアランス、Vd: 分布容積、Vss: 定常状態の分布容積、t1/2: 半減期、MRTinf: 平均滞留時間、F: バイオアベイラビリティ
【0059】
クラブラン酸カリウムは、経口投与した場合に30〜41%の平均バイオアベイラビリティで絶食動物に良好に吸収されていることがわかった。見掛けの終末半減期は、0.5時間であった。
【0060】
実施例7: パーキンソン病の動物モデル
手順
MPTP(1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン)誘導パーキンソン病動物モデルにおいてクラブラン酸塩の神経保護作用を試験した。生後8週の雄C57BL/6マウスを10匹の6つのグループに分けた。MPTP処理の前に3回(1日1回)、10匹の動物をクラブラン酸塩で具体的な用量および投与経路(グループ2-5)で治療し、残りの動物(グループ1と6)は生理的食塩水の賦形剤を投与した。(表13を参照。) MPTPを4回腹腔内に20mg/kg(合計80mg/kg)の用量で投与した。MPTP処理後2回(1日1回)、動物にクラブラン酸塩または生理的食塩水の賦形剤の他の投与を与えた。動物について挙動の変化を試験した。MPTP処理を生き残った動物を7日後に犠牲にし、脳について黒質緻密部(SNpc)の組織学変化を調べた。実験動物として同じ体重および年齢の10匹の未処理対照動物を犠牲にし、比較基準として海馬形態を用いた。
【0061】
表13

【0062】
行動試験
パーキンソン病のげっ歯類モデルを評価するためにポールテストを効果的に用いた。この試験において、上に向いている金属ポールの上にマウスを配置し、下に向かって下降する時間を測定する。運動障害は、下に向かって下降する時間の増加と相関する。
ワイヤで包まれたポール(高さ50cm、幅1cm)の上にマウスを配置した。ポールの底を動物のホームケージ内に置いた。下に向かってポールを下降するのに必要とする時間を記録した。MPTP処理マウスは、下に向かってポールを下降する時間がより遅いことが知られている。試験日に、5回の試験にわたって動物を記録し、5回の成績に対する平均を算出した。マウスが所定の試験でポールから落ちるかまたはポールを降りることができない場合には、その動物の以前の試験の中から最も長い時間を不成功の実験として記録した。
MPTP-生理的食塩水グループは、正常グループと比較して自発運動時間の著しい増加を示した。TH-IR(チロシンヒドロキシラーゼ免疫活性)ニューロンの自発運動時間は、低用量クラブラン酸塩治療グループ(0.01mg/kg、i.p.および0.1mg/kg、ga)において著しく減少した。しかし、時間は、MPTPおよび高用量クラブラン酸塩治療グループとほとんど差がなかった。図10は、マウスPDモデルにおいてポールテストを用いたMPTP誘導神経毒性に対するクラブラン酸塩の行動的影響を示す図である。各々の棒は、平均±S.E.M.を表す。*: 対照グループと比較したP値<0.05、##: P値<0.01、###: MPTPのみの処理グループと比較したP値<0.001。(T-LA、自発運動時間; ga、強制経口。) 表14は、MPTP誘導PDモデルの自発運動時間に対するクラブラン酸塩の行動的影響を示すものである。
【0063】
表14

【0064】
組織処理
実験終了時に、動物を10mg/kgのペントバルビタールナトリウムのIP注射によって麻酔し、次に、pH 7.4の10mlのPBS、続いて50mlの4%パラホルムアルデヒド/PBSで5分間かけて経心的に潅流した。脳を頭蓋骨から取り出し、同じ固定液に4時間浸漬することにより後固定し、次に、PBS中の30%スクロースに移した。スクロース液で平衡した後、冠状断面を低温切断を用いて40μmの厚さに切断して貯蔵溶液に入れ、染色する前に4℃で貯蔵した。
【0065】
チロシンヒドロキシラーゼ(TH)免疫組織化学
自由浮遊切片について免疫組織化学を行った。5連続の切片の1つにすべての染色を行った。すべての切片を同時に同じ抗体の溶液を用い且つインキュベーション時間と洗浄を各脳について同じであることを確実にして染色した。下記のプロトコールを用いた。切片をPBSで洗浄した。内因性ペルオキシダーゼ酵素活性をPBS中の3%過酸化水素に10分間浸漬を用いて急冷し、続いてPBS中で洗浄および再平衡した。PBSの3%正常ヤギ血清/0.1%トリトンX-100の溶液中で1時間のプレインキュベーション時間後、切片をポリクローナル抗-TH(チロシンヒドロキシラーゼ)抗体(Chemicon)中で1%正常ヤギ血清/0.1%トリトンX-100の1:2,000の希釈液で室温において一晩インキュベートした。充分に洗浄した後、0.1%トリトンX-100/PBS中のビオチン化抗ウサギ抗体(Vector、1:200)を90分間適用した。次に、切片を15分間洗浄した後、ABC溶液(Vector、1:100)/PBSを1時間適用し、続いてPBS中で充分に洗浄した。0.1μl/mlの過酸化水素を含有するPBS中の0.02%DAB溶液中で3分間インキュベートすることによってホースラディッシュペルオキシダーゼ標識を示した。切片を上昇アルコール系列中で脱水したゼラチン被覆顕微鏡スライド、Histomount培養液を用いて透き通ったカバーガラス上に載置した。
【0066】
データの定量化および統計分析
光学分別器、参照量または計数された要素(ニューロン)の寸法に影響されない不偏細胞計数方法用いてニューロンを計数した。この方法は、コンピュータ制御電動式ステージを備えたツァイスplanapochromat対物レンズを備えるAxiophot写真用顕微鏡(Zeiss、ドイツ)、ビデオカメラ、およびStereo Investigatorソフトウェア(MicroBrightField、ウィリストン、ヴァーモント州)からなるコンピュータ支援画像解析システムを用いて実施した。解剖学的参照として標準マウスアトラス(PaxinosおよびFranklin、2004)を用いてSNの全範囲にわたって第5切片ごとのSNpcについてニューロンの数を計数することによって細胞計数を行った。
各実験グループの統計分析をスチューデントt検定によって評価した。p < 0.05の場合に差を有意とみなした。すべての統計分析は、GraphPad Prismソフトウェアを用いて行った。
【0067】
結果
正常グループにおいて、多くのTH-免疫反応性(IR)ニューロンは黒質緻密部に分配され、若干のTH-IRニューロンは黒質網様部に点在した。MPTP-生理的食塩水グループは、正常グループと比較してTH-IRニューロンの有意な減少を示した。クラブラン酸塩治療グループ(ipおよびga)において、TH-IRニューロンは、MPTP誘導TH-IRニューロン損傷から著しく保護されていた。図8は、黒質緻密部(SNpc)におけるチロシンヒドロキシラーゼ(TH)について免疫組織化学を示す図である。TH-陽性のニューロンの数は、MPTP-生理的食塩水グループにおいて正常グループと比較して著しく減少した。TH陽性のニューロンの数は、MPTP-クラブラン酸塩治療グループにおいて良好に保存された。図9は、MPTP処理動物における黒質緻密部(SNpc)ニューロン生存に対するクラブラン酸塩治療の効果を示す図である。MPTP処理グループにおいて、SNpc内のTH-陽性ニューロンが著しく減少した。双方のクラブラン酸塩治療グループ(ipおよびga)において、SNpc内のTH-陽性ニューロンが著しく保護され、強制経口治療後の細胞がより多く保護された。TH-陽性SNpcニューロンを内側と外側のSNpcを分けている第3の脳神経根の側方AP-3.16でSNpcの最も広い寸法を両側で計数した。(*:正常グループ、##と比較したP値 < 0.05: P値< 0.05、###: MPTPのみの処理グループと比較したP値 < 0.001。ip、腹腔内; ga、強制経口。)
【0068】
実施例8: カイニン酸動物モデル
手順
神経保護剤として、カイニン酸塩動物モデルにおいてクラブラン酸塩を試験した。体重300-350グラムの30匹の雄スプラグダウレイラットを3つのグループに分けた。カイニン酸塩処理の1時間前に、7匹の動物を10μg/kgのIP用量でクラブラン酸塩で処理し、残りの動物を生理的食塩水を投与した。カイニン酸塩を20mg/kgの用量で7匹のクラブラン酸塩治療動物と13匹の生理的食塩水賦形剤処理動物にIP投与した。次の60分にわたって、動物について発作活動を観察した。カイニン酸処理の60分後に動物にクラブラン酸塩または生理的食塩水賦形剤の他のIP注射(10μg/kg)を投与した。カイニン酸処理を生存した動物を7日後に犠牲にし、脳について海馬の組織学的変化を調べた。実験動物として同じ体重と年齢の10匹の未処理の対照動物を犠牲にし、海馬の形態を比較のための基準として用いた。
【0069】
組織処理およびクレシルバイオレット染色
実験終了時に、動物を10mg/kgのペントバルビタールナトリウムのIP注射によって麻酔し、次にpH 7.4の100mlのPBSで、続いて250mlの4%パラホルムアルデヒド/PBSで5分間にわたって経心的に潅流した。脳を頭蓋骨から取り出し、同じ固定液に4時間浸漬することによって後固定し、次に、30%スクロース/PBSに移した。スクロース溶液で平衡した後、冠状断面を低温切断を用いて40μmの厚さに切断し、貯蔵溶液に入れ、染色前に4℃で貯蔵した。すべての染色を5連続の切片の1つで行った。各脳からの1連続の切片を、以下のように一般のニューロン染色クレシルバイオレットを用いて染色した。切片をゼラチン被覆顕微鏡スライドに載置し、室温で一晩乾燥させた。次に、スライドを、下降系列のアルコール(90%、80%、および70%のエタノール)に5分間浸漬し、次に蒸留水に30分間浸漬することにより水和させた。染色をクレシルバイオレット溶液(0.1M酢酸ナトリウム緩衝液、pH 3.5中5%)に3分間浸漬することによって行った。染色と脱水の分化を上昇系列のアルコール(70%、80%、90%、95%、および100%のエタノール)で行った後、キシレンで洗浄し、Histomount封入剤を用いてカバーガラスにした。
【0070】
データの定量化および統計分析
カイニン酸塩誘導ニューロン損傷に対するクラブラン酸塩の影響を評価するために、コンピュータによって動作するCCDカメラ(Multiscan、フラートン、カリフォルニア州)を備えてた画像分析システムを用いてニューロン数の測定を行った。クレシルバイオレット陽性ニューロンの数を1動物当たり5切片/動物の1mmの直径の海馬において計数した。クレシルバイオレットの陽性ニューロンの数を対照グループと比較した。データを平均±SEMとして表す。データは、一方向のANOVA SPSSプログラムによって評価し、ダンカンの複数の範囲試験を用いて平均を評価した。統計的有意性は、P < 0.05で考慮された。
【0071】
結果
クラブラン酸を投与した動物は、生理的食塩水のみを投与された対照と比較して発作と穏やかな発作活動に対してより長い発症を示した。それぞれ、カイニン酸塩+生理的食塩水グループの6匹がカイニン酸処理の24時間以内に死亡した。しかし、クラブラン酸塩+カイニン酸塩グループは、死亡を示さなかった。表15は、発作評価段階(Sperk et al.、1983)を表にするものである。発作率は、カイニン酸処理の60-120分後に測定した。
クラブラン酸塩を投与した動物は、 カイニン酸塩誘導の海馬細胞死に対して著しい神経保護作用を示した。図11は、カイニン酸塩(KA)誘導海馬神経毒性に対するクラブラン酸塩の影響を示す図である。CA3におけるニューロンの数は、KA処理ラット(KA+生理的食塩水)において著しく減少した。KA処理ラットに対するクラブラン酸塩処理は、CA3領域に対して強い神経保護作用を示した。カイニン酸塩-生理的食塩水処理グループにおいて、錐体細胞層におけるクレシルバイオレットの陽性CA3細胞がカイニン酸処理の7日後に著しく減少した。このグループにおいて、錐体細胞層におけるクレシルバイオレット陽性ニューロンは、正常なグループと比較して29.7%であった。クラブラン酸塩処理グループにおいて、錐体ニューロンの88.7%がクレシルバイオレットに陽性であった。図12は、正常、カイニン酸塩+生理的食塩水、およびカイニン酸塩+クラブラン酸塩治療グループのCA3領域においてクレシルバイオレット染色を示す図である。KA+生理的食塩水グループは、正常なグループと比較してクレシルバイオレット陽性ニューロンの著しい減少を示した。クラブラン酸塩治療グループにおいて、大量のクレシルバイオレット陽性ニューロンがCA3領域における錐体細胞層に観察された。各々の棒は、平均±S.E.M.を表す(*: 対照グループと比較したP値 < 0.05。#: KA+生理的食塩水グループと比較P値 < 0.05。) また、クラブラン酸塩治療ラットは、カイニン酸塩-食塩水で処理された動物と比較してCA3におけるニューロンの正常な形態を有するように見えた。
【0072】
表 15

【0073】
本明細書において例示し述べてきた実施態様は、本発明を実施し使用するために本発明者らが知る最良の方法を当業者に教示することのみを意図している。本明細書においては、本発明の範囲を限定するものとみなされるものは何もない。提示した実施例は、全て代表的であり非限定的である。本発明の上記の実施態様は、上記の教示に照らして当業者が理解されるように、本発明から逸脱することなく、修正または変更し得る。従って、特許請求の範囲およびその等価の範囲内において、明記したのと別の形で本発明を実施し得ることを理解すべきである。
【技術分野】
【0001】
本発明は、クラブラン酸、医薬的に許容され得るクラブラン酸塩、塩組成物および誘導体を含む安定な固体経口剤形の使用に関する。特に、本発明は、毎日の使用に適し且つ神経保護および神経変性疾患の治療のためのクラブラン酸塩の治療レベルを達成するクラブラン酸カリウムの即時放出組成物および持続放出組成物を提供する。
【背景技術】
【0002】
クラブラン酸の名前は、クラブラン酸が誘導されるストレプトマイセス・クラブリゲルス(Streptomyces clavuligerus)の微生物に由来する。クラブラン酸は、アミノ酸のアルギニンと糖グリセルアルデヒド3-リン酸から生合成的に生成される。
クラブラン酸は、β-ラクタム抗生物質の特徴を示すβ-ラクタム環を共有するにもかかわらず、内因性抗菌活性がごくわずかである。しかしながら、化学構造の類似性によって、分子がβ-ラクタム抗生物質に対して耐性を与えるある種の細菌が分泌するβ-ラクタマーゼの競合阻害剤として作用することができる。チカルシリンまたはアモキシリンのようなβ-ラクタム抗生物質と組み合わせて投与される場合、クラブラン酸はスペクトルを延長することができ且つ抗生物質(AHFS、1991)の活性を増強することができる。この相乗活性は、β-ラクタム抗生物質を自然に分解するとともに不活性化する細菌のβ-ラクタラクタマーゼの不可逆的競合阻害剤としてクラブラン酸が作用することから可能である(Brown et al., J Antibiot (Tokyo). 1976, 29:668-669; Reading and Cole, Antimicrob Agents Chemother. 1977, 11:852-857)。
β-ラクタマーゼについての阻害作用に加えて、クラブラン酸は、神経保護に、また、不安および性機能不全を治療するのに有効性を示した。クラブラン酸の神経保護および神経学的活性についていくつかの機序が提案された。Koppel et al.は、米国特許第6,489,319号明細書; 同第6,610,681号明細書; 同第6,627,625号明細書において、1μg/kg未満でi.p.投与される場合にクラブラン酸自体が抗不安効果を有することを記載しており、これらの明細書の各々の記載は本願明細書に全体として含まれるものとする。米国特許第6,426,342号明細書には、ラットをクラブラン酸で1μg/kgのi.p.投与量で治療する場合のクラブラン酸の強力な神経保護活性が記載されており、この明細書の記載は本願明細書に全体として含まれるものとする。米国特許第7,166,626号明細書には、性機能不全をクラブラン酸を投与して治療する方法が開示されており、この明細書の記載は本願明細書に全体として含まれるものとする。米国特許第6,489,319号明細書には、クラブラン酸がCNS活性と行動を10ng〜10μg/kgの範囲にある投与量で変化させ得ることが報告されている。このように、クラブラン酸のユニークな神経学的活性プロファイルから、化合物がユニークな一連の神経原性標的と相互作用するという強力な証拠が提供される。Rothstein et alによっても、いくつかのβ-ラクタム抗生物質がグルタメート神経伝達物質トランスポータのための遺伝子を活性化することによって神経保護を与え得ることが証明された(Nature, 2005, 433:73-77)。1928年のペニシリンの発見で最初に同定されたので、β-ラクタム抗生物質は特に最も広く用いられている抗生物質であり、通常の抗菌投与量で実質的な毒性CNS作用を示さなかった。それ故、β-ラクタム抗生物質は、CNS関連疾患の治療に新規で安全な治療剤として用いることができる。
【0003】
クラブラン酸およびその誘導体または塩(ひとまとめにしてクラブラン酸塩と呼ぶ)を含有する乾燥製剤の多数の不安定性によって、医薬的に許容され得る担体を生成させる結合剤、流動促進剤、崩壊剤、乾燥剤等さえも含む賦形剤の複雑な配合を含めることが必要とされた。このことは、一部には、クラブラン酸塩が水性媒体において非常に不安定である非常に吸湿性の材料であるという事実に起因する。それ故、配合方法は、生成物が貯蔵中にその効力を保持することができるが、その後充分な溶解速度を得ることを確実にしなければならない。このような一方法は、国際公開第92/19227号パンフレットに開示され、細胞内と細胞外双方の崩壊剤を含めることを命じており、この明細書の記載は本願明細書に全体として含まれるものとする。米国特許第4,537,887号明細書に記載されている他の方法は、組成物自体の中に食用乾燥剤を含むことを指定しており、この明細書の記載は本願明細書に全体として含まれるものとする。他の方法は、アモキシシリン/クラブラン酸の組み合せを収容する容器内に乾燥剤を含むことを必要としている。この点で、米国特許第4,301,149号明細書および同第4,441,609号明細書が特に顕著であり、これらの明細書の記載は本願明細書に全体として含まれるものとする。クラブラン酸カリウムは遊離酸および吸湿性が最も低い医薬的に許容され得るクラブラン酸塩より安定であり、それ故、市販の製剤に最も頻繁に用いられている。しかしながら、クラブラン酸カリウムはまだ極めて吸湿性であり且つ加水分解に感受性があるのでアモキシシリン/クラブラン酸併用製剤が低湿度条件下でさえ貯蔵時に劣化する傾向がある。アモキシシリンの結晶化における水の存在はこれらの剤形の不安定性に関与し、劣化し始めるとクラブラン酸の分解が加速されることになる。
【発明の概要】
【発明が解決しようとする課題】
【0004】
クラブラン酸は、湿気と熱に感受性があることから例外的にむずかしい材料である。神経保護を与えるかまたは神経変性疾患を治療するために経口的に活性である、特に10μg〜10mg、例えば、約0.1mg〜約5mgのような低用量でのクラブラン酸塩のみの、即ち、抗生物質を含まない安定な固体製剤を開発することが求められている。
【課題を解決するための手段】
【0005】
本発明は、即時放出組成物または持続放出組成物の形で、クラブラン酸塩を含有する安定な経口投薬組成物を経口投与することを含む神経保護を与え且つ神経変性疾患を治療するための方法である。剤形は、毎日の使用に適している、クラブラン酸またはその誘導体または塩、例えば、クラブラン酸カリウムまたはClavitesseTMから調製することができる。
本発明は、上述の欠点および不利益を安定な経口クラブラン酸塩医薬組成物およびその組成物を用いて神経保護を与え且つ神経変性疾患を治療するための方法を開発することによって克服し且つ解消するものである。一般的に言えば、本発明は、クラブラン酸塩を医薬的に活性な成分として含む、安定な固体医薬組成物、特に、即時放出組成物または持続放出組成物の使用に関する。医薬組成物は、錠剤、カプセル剤、丸剤、トローチ剤または散剤のような固体剤形で与えることができる。医薬組成物は、クラブラン酸塩を1つ以上の医薬的に許容され得る賦形剤の存在下に含むことができ、クラブラン酸塩は、約10μg〜約10mg、例えば、約0.1mg〜約5mgの量で存在する。組成物は、投与時に治療的に有効な量のクラブラン酸塩を与えることができる。クラブラン酸塩の例としては、クラブラン酸、クラブラン酸誘導体およびクラブラン酸の医薬的に許容され得る塩が挙げられる。クラブラン酸塩は、組成物の約0.01質量%〜約10質量%の量で存在することができる。ある実施態様において、組成物の水分含量は、全質量の約4%未満である。製剤は、錠剤、カプセル剤、丸剤、トローチ剤または散剤の形である。本発明の例示的固体医薬組成物は、25℃および60%相対湿度での貯蔵後または30℃において65%相対湿度での貯蔵後3ヶ月間で水分含量が10%未満であり得る。
【0006】
例示的組成物において、クラブラン酸塩は、クラブラン酸カリウムである。クラブラン酸カリウムは、例えば、粉末としてまたは二酸化ケイ素または微結晶性セルロースとの1:1混合物として与えることができる。例示的組成物は、投与後約5〜約30分以内に80%を超えるクラブラン酸塩を錠剤から放出する即時放出組成物である。例示的実施態様において、組成物は、クラブラン酸カリウム粉末を1つ以上の医薬的に許容され得る賦形剤の存在下に凍結乾燥する方法によって調製される。即時放出組成物の例において、組成物は、約10質量%〜約20質量%の結合剤または希釈剤、約45質量%〜約55質量%の充填剤、約20質量%〜約40質量%の崩壊剤および約3質量%〜約6質量%の滑沢剤を含有し得る。このような実施態様において、例示的な結合剤または希釈剤は、Maltrin M150であり、例示的充填剤は、プロソルブ(Prosolve) SMCC 50であり、例示的崩壊剤は、ファルマバースト(Pharmaburst)および/またはL HPC LH-11および/またはAcdisolであり、例示的滑沢剤は、ステアリン酸である。
他の例示的実施態様において、組成物は、二酸化ケイ素または微結晶性セルロースとの1:1混合物中のクラブラン酸カリウムを1つ以上の医薬的に許容され得る賦形剤の存在下に凍結乾燥する方法によって調製される。即時放出組成物の他の例において、組成物は、約50-60%の充填剤、約20-30%の崩壊剤、約0.5-5%の流動増強剤/湿気防止剤および/または約3〜6%の滑沢剤を含有し得る。このような実施態様において、例示的充填剤は、Prosolve SMCC 50であり、例示的崩壊剤は、Pharmaburstおよび/またはAcdisolであり、例示的流動増強剤/湿気防止剤は、Carbosilであり、例示的滑沢剤は、ステアリン酸マグネシウムである。
【0007】
他の実施態様において、医薬組成物は、クラブラン酸カリウムを少なくとも約4時間にわたって放出する持続放出組成物である。持続放出組成物は、クラブラン酸カリウム粉末または微結晶性セルロースとの1:1混合物中のクラブラン酸カリウムを1つ以上の医薬的に許容され得る賦形剤の存在下に凍結乾燥させて調製され得る。例示的賦形剤には、マトリックス、充填剤、流動促進剤および滑沢剤の1つ以上が含まれ得る。持続放出組成物の例において、組成物は、約20質量%〜約40質量%のマトリックス、約50質量%〜約75質量%の充填剤、約0.1質量%〜約1質量%の流動促進剤および約1質量%〜約2質量%の滑沢剤を含有し得る。このような実施態様において、例示的マトリックスは、クルセル(Klucel) LF、メトセル(Methocel) K100LV Prem CR、ユードラジット(Eudragit) S100、カルボポール(Carbopol) 971P、カルボポール(Carbopol) 974P、メタクリレートコポリマータイプAもしくはメタクリレートコポリマータイプBまたはこれらの混合物であり; 例示的充填剤は、無水ラクトース、アビセル(Avicel) PH-112、アビセル(Avicel) PH-113、イソマルト(Isomalt)、またはこれらの混合物であり; 例示的流動促進剤は、カルボシル(Carbosil)であり; 例示的滑沢剤は、ステアリン酸マグネシウムおよびタルクの少なくとも1つである。
【0008】
他の実施態様において、本発明の方法に用いられる固体医薬剤形は、クラブラン酸、クラブラン酸誘導体またはクラブラン酸の医薬的に許容され得る塩のようなクラブラン酸塩を準備し、クラブラン酸塩と少なくとも1つの賦形剤とを混合し、クラブラン酸塩と少なくとも1つの賦形剤の混合物を造粒し、クラブラン酸塩と少なくとも1つの賦形剤の造粒混合物を凍結乾燥することによって調製される。造粒工程は、例えば、湿式造粒である。例示的なクラブラン酸塩は、クラブラン酸カリウム、例えば、クラブラン酸カリウムの粉末または二酸化ケイ素若しくは微結晶性セルロースとの1:1混合物としてのクラブラン酸カリウムの形である。例示的方法において、賦形剤は、結合剤、希釈剤、充填剤、崩壊剤、マトリックス、充填剤、流動促進剤、流動増強剤、湿気防止剤、および滑沢剤の少なくとも1つである。方法には、剤形を錠剤またはビーズに形成すること、および、必要により、錠剤またはビーズを遅延放出ポリマーでコーティングしてもよいことが含まれ得る。本発明には、本発明の安定な固体医薬組成物を経口投与して、神経保護を与えるかまたはパーキンソン病、アルツハイマー病または多発性硬化症のような神経変性疾患の治療に効果的な量のクラブラン酸塩を与えることが含まれる。
【0009】
本発明のさらに他の実施態様は、経口投与に適しているクラブラン酸塩の即時放出製剤と持続放出製剤の使用に関する。
本発明のさらに他の実施態様は、医薬製剤を調製する凍結乾燥方法であって、凍結乾燥が水和された医薬組成物を脱水する乾燥プロセスを含む、前記方法に関する。
本発明の他の実施態様は、クラブラン酸塩を含有する医薬組成物の調製方法および薬剤としてのその使用に関する。
他の実施態様において、本発明は、治療的に有効な量のクラブラン酸塩、例えば、クラブラン酸、クラブラン酸誘導体またはクラブラン酸の医薬的に許容され得る塩を含む安定な経口製剤を経口投与することによって神経変性疾患を治療する方法である。他の例示的実施形態は、クラブラン酸を含有する安定な経口製剤を経口投与することを含む神経保護を与える方法である。神経保護には、神経変性疾患に由来の細胞消失または細胞死を防止することが含まれる。さらに他の実施態様は、クラブラン酸塩の安定な経口製剤を経口投与することを含む神経細胞消失または細胞死を防止する方法である。本発明の方法に従って治療可能な神経変性疾患の例としては、パーキンソン病、アルツハイマー病、および多発性硬化症が挙げられる。治療には、例えば、発作または振戦の頻度の減少、発症時間の短縮または重症度の低下、記憶喪失の減少、または神経細胞死の減少が含まれ得る。
【0010】
本発明の例示的方法において、クラブラン酸塩は、クラブラン酸カリウムである。安定な経口製剤は、錠剤、カプセル剤、丸剤、トローチ剤、液剤、懸濁剤、バッカル錠、舌下錠、口腔内崩壊錠、薄膜または散剤の形であり得る。製剤は、少なくとも約4時間クラブラン酸を放出する持続放出組成物; 約0.5時間未満においてクラブラン酸を放出する即時放出組成物; または他の形であり得る。ある実施形態において、クラブラン酸カリウムは、クラブラン酸カリウム粉末または二酸化ケイ素若しくは微結晶性セルロースとの1:1混合物としてのクラブラン酸カリウムである。本発明において有効な製剤には、マトリックス、充填剤、流動促進剤、および滑沢剤の1つ以上が含まれ得る。マトリックスは、例えば、Methocel K100LV Prem CR、Eudragit S100、Carbopol 971P、Carbopol 974P、メタクリレートコポリマータイプA、メタクリレートコポリマータイプBまたはこれらの混合物であり得る。充填剤は、例えば、無水ラクトース、Avicel PH-112、Avicel PH-113、Isomalt、またはこれらの混合物であり得る。流動促進剤は、例えば、Carbosilであり得る。例示的滑沢剤は、ステアリン酸マグネシウム、タルクまたはこれらの混合物である。
本発明の方法に用いられる製剤を調製する例示的方法は、クラブラン酸と少なくとも1つの賦形剤を混合すること、クラブラン酸と少なくとも1つの賦形剤の混合物を造粒すること、およびクラブラン酸と少なくとも1つの賦形剤の造粒混合物を凍結乾燥することを含む。
本発明によれば、製剤は、約0.001mg/kg/日〜約1.0mg/kg/日のクラブラン酸塩を与える量で投与することができる。ある実施態様において、製剤は、約0.01mg/kg/日〜約1.0mg/kg/日を与える量で投与することができる。製剤は、1日1回または複数回で投与することができる。
【図面の簡単な説明】
【0011】
【図1】図1は、クラブラン酸塩即時放出製剤、試料B(●)およびC(○)の試験管内溶解プロファイルを示す図である。
【図2】図2は、クラブラン酸塩持続放出製剤、試料Fの試験管内溶解プロファイルを示す図である。
【図3】図3は、クラブラン酸塩持続放出製剤、試料Iの試験管内溶解プロファイルを示す図である。
【図4】図4は、試料D(5mg/クラブラン酸カリウムと微結晶性セルロースの1:1混合物の錠剤)の25℃/60%湿度(●)および30℃/65%湿度(▲)での安定性を示す図である。
【図5】図5は、試料E(5mg/クラブラン酸カリウムと二酸化ケイ素の1:1混合物の錠剤)の25℃/60%湿度(●)および30℃/65%湿度(▲)での安定性を示す図である。
【図6】図6は、試料F(5mg/クラブラン酸カリウムと微結晶性セルロースの1:1混合物の錠剤)の2〜8℃(○)、25℃/60%湿度(●)および30℃/65%湿度(▲)での安定性を示す図である。
【図7】図7は、試料G(5mg/錠剤)の2〜8℃(○)、25℃/60%湿度(●)および30℃/65%湿度(▲)での安定性を示す図である。
【図8】図8は、黒質緻密部(SNpc)におけるチロシンヒドロキシラーゼ(TH)のための免疫組織化学を示す図である。TH陽性ニューロンの数は、正常なグループと比較してMPTP (1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン)-生理的食塩水グループにおいて著しく減少した。TH陽性のニューロンの数は、MPTP-クラブラン酸塩処理グループにおいて保存が良かった。
【図9】図9は、MPTP (1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン)-処理動物における黒質緻密部(SNpc)ニューロン残存に対するクラブラン酸塩処理の効果を示す図である。
【図10】図10は、マウスPDモデルにおけるポールテストを用いたMPTP (1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン)-誘導神経毒性に対するクラブラン酸塩の行動効果を示す図である。
【図11】図11は、CA3部位におけるカイニン酸(KA)誘導海馬神経毒性に対するクラブラン酸塩の効果を示す図である。
【図12】図12は、正常グループ、カイニン酸+生理的食塩水およびカイニン酸+クラブラン酸塩処理グループにおけるCA3領域のクレシルバイオレット染色の結果を示す図である。
【発明を実施するための形態】
【0012】
本明細書に用いられる用語クラブラン酸塩には、下記のクラブラン酸(I)、医薬的に許容され得るクラブラン酸塩、塩組成物およびエステルのような誘導体が含まれる。医薬的に許容され得るクラブラン酸塩の例は、クラブラン酸カリウムである。クラブラン酸カリウムは、純粋な化合物としてまたは、例えば、ClavitesseTM、クラブラン酸カリウムと微結晶性セルロースとの1:1混合物またはクラブラン酸カリウムと二酸化ケイ素との1:1混合物(DSM Anti-Infectives B.V.、オランダから入手し得る)として供給され得る。
【0013】
【化1】

(I)
【0014】
例示的誘導体としては、クラブラン酸、例えば、アシルオキシアルキル基、例えば、アセトキシメチル、ピバロイルオキシメチル、β-アセトキシエチル、β-ピバロイルオキシエチル、1-(シクロヘキシルカルボニルオキシ)プロパ-1-イル、(1-アミノエチル)カルボニルオキシメチル、アルコキシカルボニルオキシアルキル基、例えば、エトキシカルボニルオキシメチル、アルファ-エトキシカルボニルオキシエチル、ジアルキルアミノアルキル基、例えば、エトキシカルボニルオキシメチル、β-エトキシカルボニルオキシエチル、ジアルキルアミノアルキル、特にジ低級アルキルアミノアルキル、例えば、ジメチルアミノメチル、ジメチルアミノエチル、ジエチルアミノメチルまたはジエチルアミノエチル-2-(アルコキシカルボニル)-2-アルケニル基、例えば、2-(イソブトキシカルボニル)ペンタ-2-エニル、2-(エトキシカルボニル)ブタ-2-エニル、ラクトン基、例えば、フタリジル、ジメトキシフタリジルの活性エステルが挙げられる。
例示的塩としては、クラブラン酸の医薬的に許容され得る塩、例えば、アルミニウム、アルカリ金属塩、例えば、ナトリウムまたはカリウム、アルカリ土類金属塩、例えば、カルシウムまたはマグネシウム、およびアンモニウムまたは置換アンモニウム塩、例えば、低級アルキルアミン、例えばトリエチルアミン、ヒドロキシ-低級アルキルアミン、例えば2-ヒドロキシエチリデン、ビス-(2-ヒドロキシエチル)アミンまたはトリス-(2-ヒドロキシエチル)アミン、シクロアルキルアミン、例えば、ジシクロヘキシルアミン、またはプロカイン、ジベンジルアミン、N,N-ジベンジルエチレンジアミン、1-エフェナミン、N-メチルモルホリン、N-エチルピペリジン、N-ベンジル-β-フェネチルアミン、デヒドロアビエチルアミン、N,N'-ビスデヒドロアビエチルアミン、エチレンジアミン、またはピリジンタイプ、例えば、ピリジン、コリジンまたはキノリン、または他のアミンの塩基との塩、リチウム塩および銀塩が挙げられる。
【0015】
本明細書に用いられる用語“経口投与”は、治療薬または組成物を飲み込むにしても飲み込まないにしても、被検者の口内に入れる治療薬またはその組成物の被検者への送達の形を含む。従って、“経口投与”には、口腔内投与および舌下投与並びに食道内投与がある。治療薬の吸収は、口、食道、胃、十二指腸、回腸および結腸を含む胃腸管の1つ以上の部分において行われ得る。
本明細書に用いられる、治療薬またはその組成物を投与することができる“被検者”には、いずれの性別もいかなる年齢のヒト患者をも含まれ、さらにヒト以外の動物、特に家畜またはペット、例示的にはネコ、イヌまたはウマが含まれる。
用語“神経変性疾患”は、変性、機能の全体的または部分的消失、または神経系の不規則な機能を伴う状態、障害および/または疾病を意味する。従って、このような方法で神経系(中枢か末梢)の構成部分または態様に影響する状態、障害および/または疾病は、神経変性疾患とみなされ得る。神経変性疾患としては、認知障害、運動障害、精神障害、疼痛障害、睡眠障害等が挙げられるが、これらに限定されない。例示的神経変性障害としては、パーキンソン病、アルツハイマー病および多発性硬化症が挙げられるが、これらに限定されない。例示的運動障害には、種々のジスキネジア、例えば、振戦、ジストニア、舞踏病、アテトーシス、チック障害、眼瞼痙攣だけでなく、片側バリスム、ミオクローヌス、限局性ジストニア、例えば、書痙または斜頚、下肢静止不能症候群および羽ばたき振戦が含まれ得る。これらの過剰な或いは異常な不随意運動は、速度、頻度、周期性および進行性の特性が著しく変動し得る。このような動きは、しばしば重なった障害、例えばパーキンソン病、本質的な振戦、即ち、良性の振戦または家系性の振戦、チック障害、例えばトゥレット症候群、特発性ジストニア(書痙を誘発する)、進行性核上麻痺、ウィルソン病に見ることができる。
【0016】
本明細書に用いられる用語“治療する”、“治療”等は、検出可能な、臨床的に有意な改善、発症の遅れ、発症の防止、または障害もしくは状態の障害もしくは症状の改善を意味する。治療は、治癒を必要としないかまたは要求しない。
“神経保護”は、特に、神経変性疾患または神経学的障害、すなわち、中枢または末梢神経系を含む、神経学的または神経システムに影響する障害の発症を遅延または防止する方法を意味する。神経保護作用または神経保護的効果は、経験的に、例えば、行動変化または認知変化またはその欠如によって、生理的に、例えば、未治療の対照と比較したニューロンの保存または欠如または破壊またはニューロン死、または神経学的システムの部分に対する副作用の欠如を測定する他の測定基準を示すことによって測定され得る。ニューロンの残存または減少がないことが証明され得る例示的位置には、黒質緻密部(SNpc)および海馬CA3部位が含まれる。
本明細書に用いられる“賦形剤”は、治療薬の被検者への送達のための担体または賦形剤として用いられるかまたは医薬組成物に添加してその加工、取扱い、貯蔵、崩壊、分散、溶解、放出または官能特性を改善するかまたは組成物の用量単位の経口投与に適するカプセルまたは錠剤のような分離した製品への配合を可能にするかまたは容易にする、それ自体は治療薬でない物質を意味する。賦形剤には、例示として限定せずに、希釈剤、崩壊剤、結合剤、接着剤、湿潤剤、ポリマー、潤滑剤、流動促進剤、不愉快な味または臭いを隠蔽または中和するために添加される物質、香味剤、色素、芳香剤、および組成物の外観を改善するために添加される物質が含まれ得る。
【0017】
従って、本発明は、経口投与に適しているクラブラン酸カリウムまたはClavitesseTMの即時放出製剤または持続放出製剤の使用に関する。本発明の製剤は、クラブラン酸塩の迅速放出調製物の量またはクラブラン酸塩の遅延放出(または持続放出)調製物の量を含む。即時放出製剤はそのクラブラン酸塩の迅速放出に特徴を有し、この迅速放出は、投与後約5〜約30分以内にクラブラン酸塩の最大放出を得ることに特徴を有する。持続放出製剤は、例えば、少なくとも約4時間かけてクラブラン酸塩のより遅い放出に特徴を有する。他の例示的実施態様において、持続放出製剤は、クラブラン酸塩を少なくとも約6時間または少なくとも約8時間にわたって放出し得る。これらのまたは他の実施態様は、クラブラン酸塩を、最初の投与後、少なくとも約3時間、少なくとも約4時間、少なくとも約5時間、少なくとも約6時間、少なくとも約7時間、または少なくとも約8時間放出し続けることができる。例示的な実施態様において、本発明は、即時放出製剤または持続放出製剤を含む錠剤またはカプセル剤であり、製剤の全質量よりはむしろ製剤中の薬剤の全量に基づき、約10μg〜10mgのまたは活性化合物の全質量の約0.01%〜10%の量の活性化合物を含んでいる。
本発明の神経保護および神経変性障害の治療は、クラブラン酸の安定な固体製剤を経口投与することによって達成され得る。治療は、対象物の残存、行動試験、免疫組織学的評価、例えば、細胞またはニューロンの残存を測定するか、または障害を示す具体的な症状の頻度または強度を測定することを含む、多くの方法で評価することができる。動物モデルまたはヒトの研究において、行動試験には、例えば、速度や向きに関して評価される運動不全等に、例えば、それ自体で適応する能力の評価が含まれ得る。行動試験には、迷路、例えば、モーリス水迷路試験等の使用による記憶を試験することが含まれ得る。免疫組織学的評価は、自由浮遊切片の染色に続いて細胞計数または当該技術において一般に知られる他の技術で行うことができる。症状による試験には、例えば、種々の症状、例えば、発作または振戦の数、振動数または輝度を評価すること、または記憶の保持を評価することが含まれ得る。
【0018】
本発明によれば、MPTP(1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン)-誘導パーキンソン病動物モデルにおいて、MPTP-生理食塩水グループと比較して安定な固体クラブラン酸の経口投与によって前処理されるグループにおいてTH(チロシンヒドロキシラーゼ)-陽性ニューロンの数が保存されることがわかった。さらに、クラブラン酸による前処理動物は、カイニン酸誘導海馬細胞死に対して著しい神経保護効果を示した。処理動物もまた、対照と比較して発作や軽度の発作の機能活動に対する発症が長くかかることを示した。
神経保護または神経変性疾患の治療のためのある実施態様において、安定な固体製剤は、約0.001mg/kg〜約1.0mg/kgのクラブラン酸塩を与える量で投与され得る。ある実施態様において、安定な固体製剤は、約0.01mg/kg〜約1.0mg/kgのクラブラン酸塩を与える量において投与され得る。ある実施態様において、安定な固体製剤は、約0.1mg/kg〜約1.0mg/kgのクラブラン酸塩を与える量で投与され得る。このような用量は、効力評価によって示されるように1日1回、1日2回、1日3回以上投与され得る。適切で便利な単位量、例えば、1回分0.1mg、1回分0.5mg、1回分1.0mg、1回分5mg等で投与するための剤形が配合され得る。例示的実施態様において、安定な固体製剤には、1回分約5mgのクラブラン酸塩が含まれる。
一日量は、1回の投薬で投与されるかまたは1日の間に投与されるように複数回に分けることもできる。複数回は、1日2回、3回、4回以上であり得る。理解されるように、持続放出組成物は、同様の合計一日量を送達しつつ服用されなければならない一日量の全体数を少なくするための手段を与えることができる。安定な固体剤形は、不足投薬または過量投薬が一般的でないことを確実にし得るので本発明に用いるのに特に有利である。絶対的には少量の分解によってさえも実際に投与されるクラブラン酸塩の割合の比較的大きい変化が生じ得る本適用においてこのことは特に重大である。クラブラン酸塩の以前の使用、例えば、β-ラクタマーゼ阻害剤として抗生物質と共に補助剤での使用においては、安定性のないことが過剰なクラブラン酸塩を用いることによって解決することができるので、分解は効力に対して影響しない。しかしながら、クラブラン酸塩が活性医薬成分である本明細書に記載される適用においては、開業医が治療に適する予測可能な所定量でクラブラン酸塩を投与することができることがより重要である。これにより、治療効力だけでなく患者服薬遵守をさらに増加させることができる。
【0019】
錠剤またはカプセル剤のような医薬剤の経口投与は、静脈内(i.v.)または筋肉内(i.m.)のような非経口投与よりある種の利点を有する。痛みを伴う注射用製剤による治療を必要とする疾患は、経口剤形で治療し得る症状より重篤であると考えられる。しかしながら、経口製剤による大きな利点は、自己投与に対するその適性を保っており、一方、非経口製剤は、ほとんどの場合、医師または医療補助員によって投与されなければならない。本発明については、神経変性疾患の少なくともある指標に関して経口投与が効力増加を有することが示されている。
種々の薬剤物質の種類、例えば、粒度分布、嵩密度、流動性、湿潤挙動、表面積および粘着傾向は、大きく変動し、錠剤のような固体剤形の加工性に影響し得る。クラブラン酸塩は、非常に吸湿性であり、水との接触時に、結晶状態から、劣った安定性を示すアモルファス状態に変化する。これらのハードルの組み合わせは、標準の錠剤製造プロセスを極めて難しいものにし、クラブラン酸塩の製剤の貯蔵を問題あるものとし、クラブラン酸塩を含有する製剤の貯蔵および調製に特別な条件をもたらした。
クラブラン酸カリウムは、最も一般的で容易に処理される形態であるが、配合するのに例外的に難しい物質の状態を維持し、極めて吸湿性で水分感受性である。分解は、水および水性媒体の存在下に容易に生じる。クラブラン酸塩が活性医薬成分である本明細書に記載されるような適用においては、開業医が治療のために適する予測可能な所定の量でクラブラン酸を投与することができることがより重要である。安定な経口剤形を投与することは、これらの場合の治療使用に望ましいことである。
従って、クラブラン酸塩が単独の有効成分である神経保護および神経変性疾患の治療に、クラブラン酸塩の特性を考慮する上記の問題を克服する適切で強固なクラブラン酸塩製剤が求められている。クラブラン酸塩製剤に直面する問題は、わずかな分解でさえも被検者に利用し得るクラブラン酸塩量の劇的な変化につながり得る10μg〜10mgのような低用量の製剤の場合に特に難しい。
【0020】
本発明は、クラブラン酸塩の安定な経口剤形の調製および神経保護および神経変性疾患の治療におけるその使用に関する。本発明に用いられる固体経口剤形は、固体経口剤形の調製に通常適している添加剤または賦形剤を含むことができる。固体経口剤形としては、例えば、錠剤、カプセル剤、丸剤、トローチ剤および散剤が挙げられる。カプセル剤の場合、固体経口剤形は、カプセルの中のビーズであり得る。本発明の例示的実施態様において、固体経口剤形は、安定な固体錠剤である。
錠剤配合物に一般に用いられる打錠助剤を用いることができ、対象物についての広範な文献を参照する、特に、Fiedlerの“Lexicon der Hilfstoffe”, 4th Edition, ECV Aulendorf 1996を参照のこと、この文献の記載は、本願明細書に含まれるものとする。これには、充填剤、結合剤、崩壊剤、滑沢剤、流動促進剤、安定剤、充填剤または希釈剤、界面活性剤、フィルム形成剤、軟化剤、顔料等が含まれるが、これらに限定されない。
充填剤としては、デンプン、例えば、ジャガイモデンプン、小麦のデンプン、コーンスターチ、ヒドロキシプロピルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルメチルセルロース(HPMC)および、微結晶性セルロース、例えば、登録商標AVICEL、FILTRAK、HEWETEN、Prosolve SMCC50またはPHARMACELとして入手し得る製品が挙げられる。充填剤の他の例としては、マルトース、イソマルト、ラクトース(例えば、Pharmatose(登録商標))、スクロース、グルコース、マンニトール、ソルビトール、および炭酸カルシウムが挙げられる。
結合剤としては、デンプン、糖、セルロースまたはヒドロキシプロピルセルロースのような変性セルロース、ラクトース、またはキシリトール、ソルビトールもしくはマルチトールのような糖アルコールが挙げられる。例示的結合剤は、マルトデキストリン(Maltrin M150)である。
【0021】
崩壊剤としては、カルボキシメチルセルロースカルシウム(CMC-Ca)、カルボキシメチルセルロースナトリウム(CMC-Na)、架橋PVP(例えば、CROSPOVIDONE、POLYPLASDONEまたはKOLLIDON XL)、アルギン酸、アルギン酸ナトリウムおよびグアーガムを挙げることができる。架橋PVP(CROSPOVIDONE)、架橋CMC(Ac-Di-Sol)、カルボキシメチルデンプンNa(PIRIMOJELおよびEXPLOTAB)、Pharmaburstおよびヒドロキシプロピルセルロース(L HPC LH-11)が例示的な崩壊剤である。
マトリックスには、例えば、Methocel K100 Prem-MまたはEudragit RS PO粉末、メタクリルコポリマー(例えば、メタクリルコポリマータイプA、メタクリルコポリマータイプB、Carbopol)、および当該技術において知られる他のものが含まれ得る。
流動促進剤の例としては、コロイド状二酸化ケイ素のようなコロイド状シリカ、例えば、ヒュームドシリカ(Cabosil、Aerosil)、三ケイ酸マグネシウム(Mg)、粉末セルロース、デンプン、タルクおよび第三リン酸カルシウムまたはこれらと充填剤もしくは結合剤、例えば、ケイ化微結晶性セルロース(PROSOLV)との組み合わせが挙げられる。Cabosilは、流動増強剤/湿気防止剤としても機能し得る。
さらに、充填剤または希釈剤には、粉砂糖、圧縮糖、デキストレート、デキストリン、デキストロース、ラクトース、マンニトール、微結晶性セルロース、例えば、AVICELのような約0.45g/cm3の密度を有する微結晶性セルロース、粉末セルロース、ソルビトール、スクロースおよびタルクが含まれ得る。
滑沢剤としては、ステアリン酸およびその塩、例えば、ステアリン酸マグネシウム、ステアリン酸アルミニウム、ステアリン酸カルシウム、PEG4000〜PEG8000、タルク、水素化ヒマシ油、グリセロールエステル、Na-ステアリルフマレート、水素化綿実油等が挙げられる。一般の滑沢剤は、ステアリン酸およびステアリン酸Mgである。
【0022】
錠剤およびカプセル剤は、さらに、腸溶コーティング並びに光保護、および嚥下性のための他の放出制御コーティングで調製され得る。腸溶コーティングの例としては、例えば、メタクリル酸コポリマー、酢酸セルロース(およびそのコハク酸、フタル酸の変形例)、スチロールマレイン酸コポリマー、ポリメタクリル酸/アクリル酸コポリマー、ヒドロキシプロピルメチルセルロースフタレート、ポリビニルアセテートフタレート、ヒドロキシエチルエチルセルロースフタレート、ヒドロキシプロピルメチルセルロースアセテートスクシネート、セルロースアセテートテトラヒドロフタレート、アクリル樹脂、トリメリテート、およびシェラックから調製される化合物が挙げられてもよい。腸溶コーティングに例示的なポリマーとしては、Eudragitのようなメタクリルコポリマーが挙げられる。腸溶コーティングに適切な他のポリマーは、当該技術において既知である。コーティングは、医薬的に許容された色素で着色され得る。コーティング液中の色素や他の賦形剤の量は、変動してもよく、即時錠剤または持続放出錠剤の性能に影響しない。コーティング液は、一般に、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、セルロースエステルまたはエーテル、アクリルポリマーまたはポリマーの混合物のようなフィルム形成ポリマーを含む。コーティング溶液は、一般に、プロピレングリコール、ソルビタンモノオレート、ソルビン酸、二酸化チタンのような充填剤、医薬的に許容され得る色素をさらに含む水溶液である。
本発明に用いられる安定な固体経口剤形は、活性成分としての治療的に有効な量のクラブラン酸塩、および添加剤としての充填剤を含む。さらに添加剤としては、結合剤、崩壊剤、滑沢剤、流動促進剤、安定剤、希釈剤、界面活性剤、フィルム形成剤、顔料、軟化剤および固化防止剤等が挙げられるが、これらに限定されない。
【0023】
クラブラン酸カリウムは、表10に示されるように、約35%の相対湿度に96時間さらされた場合に比較的低い水分含量(乾燥質量基準で<1%)を有する。しかしながら、約40%の相対湿度を超える湿度においては最終的に潮解が生じていると思われる。50%の相対湿度にさらされた乾燥クラブラン酸カリウムによる吸湿は、ほぼ1.44%/時間の速度で生じる。
クラブラン酸塩を含有する医薬組成物の調製中、凍結乾燥、またはフリーズドライの使用はクラブラン酸塩錠剤の安定性を約97%まで向上させる(表11参照)。
本発明に用いられる安定な個体経口医薬組成物には、医薬的に活性な成分(API)としてクラブラン酸塩を約10μg〜10mg、例えば、約0.1mg〜約5mgの範囲にある用量で含まれ得る。例示的実施態様において、クラブラン酸塩は、クラブラン酸の塩、例えば、クラブラン酸カリウムである。クラブラン酸がCNS活性および挙動を10ng〜10μg/kgの範囲にある腹腔内(i.p.)用量で変化させ得ることが報告されている(米国特許第6,489,319号明細書を参照のこと)。
本発明によれば、約10μg〜10mgのクラブラン酸塩、例えば、約0.1mg〜約5mgのクラブラン酸塩を含有する、例えば、即時放出剤形や持続放出剤形を含む、多くの剤形で投与することができる。このような剤形は、神経保護および神経変性疾患およびその症状の治療に使用し得る。
即時放出剤形は、望ましくは、本明細書に開示される標準分析によって測定された場合に約30分未満にクラブラン酸塩が少なくとも約80%(w/v)溶解する。本発明の実施態様によれば即時放出医薬組成物は、固体剤形を処理することができない患者に好都合な投与として適切な水溶液(例えば、水、食塩水、ジュース)またはコロイド状懸濁液(例えば、粉ミルクまたはミルク)に迅速に溶解させ得る。このような患者の例示は、乳児、小児、および嚥下障害を経験することがあり得る成人である。例示的実施態様において、組成物を水溶液に入れた時点からおよそ15分でクラブラン酸塩の少なくとも約80%が水溶液に溶解する。他の実施態様において、組成物を水溶液にさらした後に、約30分、または約15分でクラブラン酸塩の少なくとも約90%が水溶液に放出される。図1に示されるように、本発明を実施するのに有効な例示的即時放出組成物は、水溶液にさらした後15分以内にクラブラン酸塩の90%を放出する。
【0024】
持続放出組成物は、活性成分、即ち、クラブラン酸塩を、長時間かけて、例えば、約8時間かけてまたは約10時間にかけて放出し得る。持続放出製剤は、製剤が胃腸管に達すると直ぐに活性成分を放出し始め、徐々に溶解するとともに活性成分をほぼ一定の方法で放出し続けることができる。このプロファルは、投与後の血流中の活性成分がより安定したレベルになることから望ましい。図2に示されるように、本発明を実施するのに有効な例示的持続放出組成物は、投与後約8〜10時間までにクラブラン酸塩の放出が実質的なレベルになり得る。
本発明の実施態様に用いられる医薬組成物は、重要な利点を与える。水分の含有量の制御は、クラブラン酸塩が吸湿性であり且つ水中で不安定または加水分解性であることからクラブラン酸塩含有組成物の配合および貯蔵において大きな課題である。安定な即時放出または持続放出組成物を調製するための凍結乾燥の使用は、特に、クラブラン酸塩が凍結乾燥前に賦形剤と組み合せられる場合に、予期しないことに安定性を増強する。
本発明に用いられる実施態様において、(1)クラブラン酸塩と少なくとも1つの賦形剤とを混合することによってクラブラン酸塩組成物を調製する工程、(2)凍結固形物に変換するまでクラブラン酸塩組成物、例えば、クラブラン酸塩の量を0℃以下で凍結する工程、(3)クラブラン酸塩組成物を気密容器内で脱水させる工程を含む凍結乾燥クラブラン酸組成物が使用し得る。薬剤を含む、粉末形態の脱水(凍結乾燥)組成物は、錠剤に圧縮されるかまたは標準サイズのビーズとして調製される前に、他の賦形剤と混合され得る。
最終乾燥製剤の水分含量は低い。本明細書において用いられる種々の実施態様は、約10%(質量)を超えない、約5%を超えない、約4%を超えない、またはそれよりも低い最終水分含量を有し得る。本発明のこのような実施態様の乾燥製剤は、長期間非常に貯蔵安定で、例えば、25℃および60%相対湿度または30℃および65%相対湿度のような条件において約30日間、約60日間または約90日間安定である。適切な液体による希釈時には、実質的に所定の初期用量で充分に強力である。
【0025】
本発明において用いられる製剤は、ポリマー、例えば、Eudragit(メタクリル酸とエチルアクリレートのアニオン性コポリマー)のようなマトリックス、Maltrin M50のような結合剤/希釈剤および/またはPharmaburstのような崩壊剤、充填剤、クラブラン酸塩、および他の賦形剤(実施例参照)を乾式混合し、続いて、混合物を水を用いて、適切な造粒物が得られるまで造粒することによって調製され得る。造粒は、当該技術において既知の方法によって行われる。湿潤顆粒を凍結乾燥機内で凍結乾燥し、篩分けし、適切な粒度に粉砕する。滑沢剤を乾燥造粒物と混合して、最終製剤を得ることができる。クラブラン酸塩が吸湿性であり且つ水中で不安定であるので、混合物が湿ったままである時間を最短にする必要があり、例えば、計量と造粒から凍結乾燥までの処理時間は、約1時間であり得る。
本発明において用いられる組成物は、例えば、錠剤またはカプセル剤の形で、経口投与される。錠剤は、当該技術において知られる手法によって調製し、治療的に有効な量のクラブラン酸塩とこのような手法によって錠剤を形成するのに必要な賦形剤を含有し得る。プラセボ粒子もまた、クラブラン酸塩を含まないが同じ組成で製造され得る。
【0026】
成人のヒト被検者において神経保護または神経変性疾患の治療に使用し得る安定な固体クラブラン酸塩製剤の例示的用量は、約5mg/日〜約100mg/日であり得る。例示的実施態様において、一日量は、約5mg〜約70mg、例えば、約5mg〜約50mgまたは約7mg〜約70mgである。他の例示的用量は、約10mg/日〜約50mg/日、約5mg/日、7mg/日、10mg/日、20mg/日、25mg/日、または35mg/日であり得る。上で開示したように、一日量は1日1回、1日2回、1日3回以上投与され得る。理解されるように、一般的には、持続放出製剤の使用には1日当たりより少ない用量を投与することが必要とされ得る。一例として、例えば、10mgの一日量は、1回10mgの投薬、2回5mg、3回約3.33mgまたは4回2.5mgとして投与され得る。他の投薬量は、具体的な個体に対して必要な用量が算出され得る。
本発明に従って投与される安定な固体剤形は、単位剤形として供給され得る。単位剤形は、所定量のクラブラン酸塩活性物質を含有する1回量である。単位剤形の例としては、錠剤、トローチ剤、カプセル剤および粉末を含有する小包が挙げられるが、これに限定されない。本発明に従って投与する単位剤形には、例えば、0.1mg、0.25mg、1mg、1.5mg、2.0mg、2.5mg、5.0mg、7.5mg、10mgまたは他の量のクラブラン酸塩が含まれ得る。1回量は、1単位剤形、複数単位剤形または部分的単位剤形を含み得る。一例として、例えば、5mgの用量は、各々が2.5mgのクラブラン酸塩を含有する2単位剤形、5.0mgのクラブラン酸塩を含有する1単位剤形、または10mgのクラブラン酸塩を含有する単位剤形の半分として投与され得る。他の単位剤形を含む他の投薬量は、容易に算出され得る。
【0027】
薬物動態試験
本発明の製剤についてのバイオアベイラビリティを、錠剤形の即時製剤または持続製剤を健常な被検者に投与し且つ血漿中のクラブラン酸塩レベルを24時間にわたって種々の時間間隔で測定することによって測定した。血漿試料について、文献に記載されている手順と同様な有効な高性能液体クロマトグラフィー手順を用いて、BAS Analytics(West Lafayette、インディアナ州)によりクラブラン酸塩を分析した。例えば、Chu S-Y, et al., "Simultaneous determination of clarithromycin and 14(R)-hydroxyclarithromycin in plasma and urine using high performance liquid chromatography with electrochemical detection", J. Chromatography, 571, pp 199-208 (1991)を参照のこと。
【実施例】
【0028】
下記の実施例は、例示のみのためであり、添付の請求の範囲の範囲を制限することを意味しない。
実施例1:クラブラン酸塩の調製
実施例1A-クラブラン酸カリウム粉末を用いる即時放出クラブラン酸塩錠剤の調製
錠剤調製プロセスの例示的説明: 水が造粒工程に含まれ、その後、乾燥させて低水分含量(<3%)の顆粒を得る湿式造粒錠剤配合方法を見出した。乾燥配合物は、従来技術の配合物と比較して非吸湿性であるが、そこから調製される錠剤の等価な物理的特性(例えば、溶解性、崩壊性、バイオアベイラビリティ、他の物理的性質)を維持している。結合剤/希釈剤の存在下にクラブラン酸塩を水で造粒することによって錠剤調製を行った。
試料Cの調製については、Maltrin M150(130g)を精製水に溶解し、クラブラン酸カリウム(API; 59.5g)を添加した。Prosolve SMCC-50(490.5g)、Pharmaburst(130.0g)、L HPC LH-11(120.0g)、Acdisol(20.0g)およびステアリン酸(50g)を計量し、バッグを振盪且つ回転させることによってバッグ内で混合した。この混合物をHobartミキサーのボウルに移し、API/Maltrin M150溶液を混合物に10分間撹拌しつつ添加した。湿塊化が完了した後、Hobartミキサーのボウルの内容物を押出機に移し、押出した。押出物をスフェロナイザーに入れ、球形化した材料をバッグ内に集め、gortex-lyoguardトレーにおいて凍結乾燥した。乾燥材料を篩分けし、錠剤に圧縮するかまたは標準サイズのビーズに調製した。試料AおよびBを試料Cと同じ方法で調製した。
【0029】
実施例1B - ClavitesseTMを用いる即時放出クラブラン酸塩錠剤の調製
試料Dの調製については、ClavitesseTM (API; 50.6g)、Prosolve SMCC 50 (213.4g)、Pharmaburst(100.0g)、Acdisol(8.0g)、Cabosil(8.0g)およびステアリン酸マグネシウム(20.0g)を計量し、2〜8℃のgortex-lyoguardトレーにおいて一晩凍結乾燥した。翌日、API、Prosolve SMCC 50、PharmaburstおよびAcdisolをバッグ内で混合し、#40メッシュにより篩分けし、Vブレンダー中に取出し、7分間混合した。この混合物を再度篩分けし、Vブレンダー内で4分間混合した。Cabosilとステアリン酸マグネシウムを篩分けし、APIを含有する混合物とVブレンダー内で4分間混合した。ブレンドをgortex-lyoguardトレーにおいて一晩凍結乾燥した。材料を錠剤に圧縮し、錠剤をgortex-lyoguardトレーにおいて凍結乾燥し、包装した。試料Eを試料Dと同じ方法で調製した。
【0030】
実施例1C - ClavitesseTMを用いる持続放出クラブラン酸塩錠剤の調製
試料Fの調製については、適切な量のClavitesse(API; 41.07g)、Methocell K100LV Prem CR(90.0g)、Isomalt(83.55g)、Avicel PH-112 (80.04g)、Cabosil (1.5g)、タルク(2.4g)およびステアリン酸マグネシウム(1.5g)を計量し、凍結乾燥機において2-8℃のgortex-lyoguardトレーにおいて一晩乾燥した。各成分を篩分けし、別々のバッグに集めた。APIとMethocel K100LV Prem CRをVブレンダーに入れ、混合し、適切な篩によって篩分けし、混合を続けた。Avicel PH-112とIsomaltを混合物に添加し、混合した。得られた混合物を再度篩分けし且つ混合した。Cabosilとタルクを混合し、この混合物に添加し、混合した。ステアリン酸マグネシウムを、Vブレンダー内でこの混合物と混合した。最終ブレンドをgortex- lyoguardトレー内で一晩凍結乾燥し、錠剤に圧縮するかまたは標準サイズのビーズに調製した。錠剤を、持続放出コーティーングとしてより高い硬度で圧縮した。錠剤またはビーズを、遅延放出ポリマーのEudragitでコーティーングした。
【0031】
実施例1D - クラブラン酸カリウム粉末を用いる持続放出クラブラン酸塩錠剤の調製
クラブラン酸カリウムを用いた持続放出錠剤、試料Gの製造については、クラブラン酸カリウム(API; 20.69g)を#60メッシュにより篩分けし、他の賦形剤、Methocel K100LV Prem CR (90.02g)、Isomalt (83.56g)、Avicel PH-112 (100.41g)、Cabosil(1.52g)、タルク(2.4g)およびステアリン酸マグネシウム(1.5g)を#40メッシュにより篩分けした。各成分を別々のバッグに集めた。APIとMethocel K100LV Prem CRをVブレンダーに入れ、5分間混合した。この混合物を篩分けし、さらに5分間混合した。この混合物にAvicel PH-112とIsomaltを添加し、Vブレンダー内で、5分間混合した。得られた混合物を篩分けし、さらに5分間混合した。Cabosilとタルクを混合し、混合物に入れ、その後、得られた混合物を2分間混合した。最後に、この混合物とステアリン酸マグネシウムをVブレンダー内で3分間混合し、最終ブレンドをgortex-lyoguardトレーにおいて一晩凍結乾燥し、その後、錠剤に圧縮するかまたは標準サイズのビーズに調製した。錠剤を持続放出コーティーングとしてより高い硬度で圧縮した。錠剤またはビーズを遅延放出ポリマー、Eudragitでコーティーングした。試料HおよびIを試料Gと同じ方法で調製した。
【0032】
実施例2: クラブラン酸塩の分析
調製した医薬組成物のクラブラン酸塩含量を、Waters HPLC (高性能液体クロマトグラフィー)システム(カラム: μBondapack-NH2 (10μm) 300mm×3.9mm、移動相: CH3CN: pH 5.2 KH2PO4 = 65:35、流量:1.0ml/分)によって以下の手順を用いて測定した: 約10個の錠剤を正確に計量し、粉砕し、100mlの水を加え、この混合物を20分間超音波処理した。水で希釈した後、この溶液の一部をろ過し、HPLCに注入した。主要ピークを、HPLCによる標準調製物のクロマトグラムに相応する試料の保持時間によって同定した。クラブラン酸塩%を、参照基準の応答係数と比較した分析物応答係数に基づいて算出した。
クラブラン酸塩標準曲線の直線性を、0.01mg/mlの設定濃度の参照基準の25、50、75、100、125、150%で確認した。R2は、0.9998であった。クラブラン酸塩の0.01mg/mlの設定濃度において、精密さは6試料を用いてRSD1.4パーセントで確認した。正確さは、0.01mg/mlの50%、100%、および150%のスパイク処理プラセボブレンドを3回の実験で調製し、分析することによって求めた。
【0033】
実施例3: 例示的配合および特性
以下の試験は、種々の用量を有する即時放出(IR)錠剤および持続放出(ER)錠剤として設計された錠剤配合を記載するものである。以下の表は、本配合による錠剤の物理的性質も示している。
実施例3A - クラブラン酸カリウムを用いる即時放出組成物
上述の方法を用いて下記の表1に示されるクラブラン酸カリウム粉末と賦形剤から即時放出組成物を調製した。
【0034】
表1

API*: 活性医薬成分。
【0035】
表2は、クラブラン酸カリウム粉末を用いた即時放出錠剤の特性をまとめたものである。試料C錠剤は、優れた安定性を示し、2〜8℃で1週間後に94.4%のクラブラン酸カリウムを含有していた。
【0036】
表2

【0037】
実施例3B - ClavitesseTMを用いる即時放出組成物
表3に示されるようにClavitesseTMを用いて5mgのクラブラン酸塩を含む即時放出組成物を調製した。
【0038】
表3

API*: 活性医薬成分。
【0039】
表4は、ClavitesseTMを用いた即時放出錠剤の特性をまとめたものである。
【0040】
表4

【0041】
実施例3C - ClavitesseTMおよびクラブラン酸カリウム粉末を用いる持続放出組成物
表5-8に示されるように、ClavitesseTMまたはクラブラン酸カリウム粉末を用いて持続放出組成物を調製した。
【0042】
表5

API*: 活性医薬成分。
【0043】
表6

API*: 活性医薬成分。
【0044】
表7

API*: 活性医薬成分。
【0045】
表8

API*:活性医薬成分。
【0046】
表9は、ClavitesseTMおよびクラブラン酸カリウム粉末を用いた持続放出錠剤の特性をまとめたものである。
【0047】
表9

【0048】
実施例4: 試験管内溶解実験
錠剤を500mlの溶媒に入れた(即時放出錠剤に対しては脱イオン水、持続放出錠剤に対しては最初の2時間がpH 1.2溶液、その後、次の8時間がpH 7.0のクエン酸緩衝液)。この混合物を100rpmおよび37℃で旋回させ、試料を定期的に収集し、溶解したクラブラン酸塩量をHPLCによって試験した。
結果を図1-3に示す。図1は、試料Bおよび試料Cのクラブラン酸塩即時放出製剤の試験管内溶解プロファイルを示すグラフである。図1に示されるように、即時放出錠剤中のクラブラン酸塩の90%以上が、水溶液にさらした後15分以内に溶解した。図2は、試料Fのクラブラン酸塩持続放出製剤の試験管内溶解プロファイルを示すグラフである。図3は、試料Iのクラブラン酸塩持続放出製剤の試験管内溶解プロファイルを示すグラフである。図2および3に示されるように、持続放出錠剤中のクラブラン酸塩の全用量は、侵食および溶解メカニズムによって、少なくとも約8〜10時間にわたって徐々に放出されていた。持続放出形態におけるクラブラン酸塩の放出は、pH 1.2溶液中には検出されなかった。
【0049】
実施例5: 安定性試験
固体形態でのクラブラン酸カリウムは、水蒸気の存在下に吸湿性でもありでは不安定でもある。クラブラン酸塩の安定性試験を、クロマトグラフィー法によりモニターすることによって行った。静的または均衡論的アプローチを、試料を異なる相対湿度のチャンバ内で収着等温線を生成させる試みで貯蔵することによって行った。収着等温線は、大気中の平衡水分含量と相対湿度(RH)間の定量的相関関係を示す。表10は、種々の湿度条件にさらした後のクラブラン酸カリウム粉末中の水分の含有量の変化を示すものである。
【0050】
表10

【0051】
表10に示されるように、クラブラン酸カリウムは、約35%以下の相対湿度に96時間さらした場合に、比較的低い水分含量(乾燥質量基準で<1%)を有する。しかしながら、約40%相対湿度よりも高い湿度においては最終的に潮解が生じているようである。約50%相対湿度にさらした乾燥クラブラン酸カリウムによる水分吸収は、毎時約1.44%の速度で生じている。
クラブラン酸カリウムは、配合するのに例外的に難しい物質であり、極度に水分および熱に感受性である。水および水性媒態の存在下に分解が容易に起る。幾つかの方法を試験して、活性成分クラブラン酸塩を無傷のまま保つ湿式造粒後の適切な水分除去条件を見出した。試料Cの材料を、湿式造粒によって製造し、球形化した。水分含有球形化製剤をトレーに移し、水分除去のための種々の貯蔵条件に供した。
表11にまとめたように、30℃で69時間の貯蔵(貯蔵1)または45℃で75時間の貯蔵(貯蔵2)によって、それぞれ、45%および60%までのクラブラン酸カリウムの分解が生じた。流動床系での乾燥によって、わずか1.5時間で13%だけクラブラン酸塩の分解が生じた。これらのデータは、クラブラン酸カリウムが温度感受性でもあることを示している。凍結乾燥は、21時間の凍結乾燥プロセス後に活性成分の97%を保持した。表11の結果は、クラブラン酸塩製剤中の水分含量を減少させ且つ製剤の安定性を増大させるためにクラブラン酸塩の凍結乾燥を使用し得ることを示している。
【0052】
表 11

【0053】
ClavitesseTMから調製された即時放出錠剤、試料Dおよび試料Eの安定性を3ヶ月までの間評価した。図4は、25℃/60%湿度および30℃/65%湿度での試料D(クラブラン酸カリウムと微結晶性セルロースの1:1混合物の5mg/錠剤)の安定性を示すグラフである。図5は、25℃/60%湿度および30℃/65%湿度での試料E(クラブラン酸カリウムと二酸化ケイ素の1:1混合物の5mg/錠剤)の安定性を示すグラフである。表4および図4と図5に示されるように、試料Dと試料Eに従って調製された両錠剤は、はじめに4%未満の水分を含有しており、25℃/60%湿度、即ち、クラブラン酸塩には比較的高湿度条件において7%未満分解していた。ClavitesseTMから調製された持続放出錠剤、試料Fと試料Gの安定性を2ヶ月までの間評価した。図6は、2-8℃、25℃/60%湿度および30℃/65%湿度での試料F(クラブラン酸カリウムと微結晶性セルロースの1:1混合物の5mg/錠剤)の安定性を示すグラフである。図7は、2-8℃、25℃/60%湿度および30℃/65%湿度での試料G(5mg/錠剤)の安定性を示すグラフである。表5および図6と図7に示されるように、試料Fおよび試料Gに従って調製された錠剤は、はじめに4%未満の水分を含有しており、30℃/65%湿度、即ち、クラブラン酸塩には比較的高湿度条件において1.6%未満分解していた。それ故、ClavitesseTM中の微結晶性セルロースまたは二酸化ケイ素は、錠剤中の水分を捕捉することによってクラブラン酸カリウムの安定性の増大にさらに寄与し得る。
【0054】
実施例6. 薬物動態試験
ビ−グル犬の血漿中のクラブラン酸塩量を、LC/MS/MS法によって測定した。分析物のクロマトグラフィー分離を、逆相PLRP-S高分子カラムにより行った。クラブラン酸カリウムとタゾバクタム(参照化合物)の保持時間は、それぞれ、8.51分および8.54分であった。全体のクロマトグラフィー操作時間は25分であった。M/S分析は、Applied BiosystemsのAPI 2 000三連四重極質量分析計により負エレクトロスプレーイオン化モードにおける多反応モニタリングによって行った。質量スペクトルデータを、Analyst 1.4.1(Applied Biosystems)によって分析した。薬物動態分析は、PK Solutions 2.0 (Summit Research Services)を用いることにより行った。
【0055】
実施例6A - 雄ビーグル犬の即時放出(IR)錠剤の経口投与
3匹の雄ビ−グル犬を、治療の間の休薬期間を含む交叉デザインでの試験全体に用いた。イヌに実施例3AのIR錠剤としての試験物質を経口経路で投与し、投与間の24時間より短い休薬期間はなかった。動物を試験物質の投与前の一晩絶食させ、投与後4時間で給餌した。全ての治療中、血液試料(1.5ml)を橈側皮静脈から静脈穿刺により投与後0分、5分、15分、30分、1時間、1.5時間、2時間、2.5時間、3時間、4時間、6時間、9時間および12時間でヘパリン処理チューブに採血した。血漿を3,000rpmで10分間の遠心分離によって得、LC-MS/MSシステムによって分析した。関連の平均薬物動態パラメーターを表12に示す。
【0056】
実施例6B - 雄ビーグル犬のクラブラン酸カリウム溶液のIV投与
3匹の雄ビ−グル犬を、治療の間の休薬期間を含む交叉デザインでの試験全体に用いた。イヌに水溶液としての試験物質を静脈内経路で投与し、投与間の24時間より短い休薬期間はなかった。動物を試験物質の投与前の一晩絶食させ、投与後4時間で給餌した。全ての治療中、血液試料(1.5ml)を橈側皮静脈から静脈穿刺により投与後0分、5分、15分、30分、1時間、1.5時間、2時間、2.5時間、3時間、4時間、6時間、9時間および12時間でヘパリン処理チューブに採血した。血漿を3,000rpmで10分間の遠心分離によって得、LC-MS/MSシステムによって分析した。関連の平均薬物動態パラメーターを表12に示す。
【0057】
実施例6C - 雄ビーグル犬の持続放出(ER)錠剤の経口投与
4匹の雄ビ−グル犬を、治療の間の休薬期間を含む交叉デザインでの試験全体に用いた。イヌに実施例3CのER錠剤としての試験物質を経口経路で投与し、投与間の24時間より短い休薬期間はなかった。動物を試験物質の投与前の一晩絶食させ、投与後4時間で給餌した。全ての治療中、血液試料(1.5ml)を橈側皮静脈から静脈穿刺により投与後1時間、2時間、3時間、4時間、5時間、6時間、7時間、8時間、9時間、10時間、11時間および12時間でヘパリン処理チューブに採血した。血漿を3,000rpmで10分間の遠心分離によって得、LC-MS/MSシステムによって分析した。関連の平均薬物動態パラメーターを表12に示す。
【0058】
表12

*PKパラメータ: Tmax: 最高濃度までの時間、Cmax: 最高濃度、AUC: 曲線下の領域、CL: クリアランス、Vd: 分布容積、Vss: 定常状態の分布容積、t1/2: 半減期、MRTinf: 平均滞留時間、F: バイオアベイラビリティ
【0059】
クラブラン酸カリウムは、経口投与した場合に30〜41%の平均バイオアベイラビリティで絶食動物に良好に吸収されていることがわかった。見掛けの終末半減期は、0.5時間であった。
【0060】
実施例7: パーキンソン病の動物モデル
手順
MPTP(1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン)誘導パーキンソン病動物モデルにおいてクラブラン酸塩の神経保護作用を試験した。生後8週の雄C57BL/6マウスを10匹の6つのグループに分けた。MPTP処理の前に3回(1日1回)、10匹の動物をクラブラン酸塩で具体的な用量および投与経路(グループ2-5)で治療し、残りの動物(グループ1と6)は生理的食塩水の賦形剤を投与した。(表13を参照。) MPTPを4回腹腔内に20mg/kg(合計80mg/kg)の用量で投与した。MPTP処理後2回(1日1回)、動物にクラブラン酸塩または生理的食塩水の賦形剤の他の投与を与えた。動物について挙動の変化を試験した。MPTP処理を生き残った動物を7日後に犠牲にし、脳について黒質緻密部(SNpc)の組織学変化を調べた。実験動物として同じ体重および年齢の10匹の未処理対照動物を犠牲にし、比較基準として海馬形態を用いた。
【0061】
表13

【0062】
行動試験
パーキンソン病のげっ歯類モデルを評価するためにポールテストを効果的に用いた。この試験において、上に向いている金属ポールの上にマウスを配置し、下に向かって下降する時間を測定する。運動障害は、下に向かって下降する時間の増加と相関する。
ワイヤで包まれたポール(高さ50cm、幅1cm)の上にマウスを配置した。ポールの底を動物のホームケージ内に置いた。下に向かってポールを下降するのに必要とする時間を記録した。MPTP処理マウスは、下に向かってポールを下降する時間がより遅いことが知られている。試験日に、5回の試験にわたって動物を記録し、5回の成績に対する平均を算出した。マウスが所定の試験でポールから落ちるかまたはポールを降りることができない場合には、その動物の以前の試験の中から最も長い時間を不成功の実験として記録した。
MPTP-生理的食塩水グループは、正常グループと比較して自発運動時間の著しい増加を示した。TH-IR(チロシンヒドロキシラーゼ免疫活性)ニューロンの自発運動時間は、低用量クラブラン酸塩治療グループ(0.01mg/kg、i.p.および0.1mg/kg、ga)において著しく減少した。しかし、時間は、MPTPおよび高用量クラブラン酸塩治療グループとほとんど差がなかった。図10は、マウスPDモデルにおいてポールテストを用いたMPTP誘導神経毒性に対するクラブラン酸塩の行動的影響を示す図である。各々の棒は、平均±S.E.M.を表す。*: 対照グループと比較したP値<0.05、##: P値<0.01、###: MPTPのみの処理グループと比較したP値<0.001。(T-LA、自発運動時間; ga、強制経口。) 表14は、MPTP誘導PDモデルの自発運動時間に対するクラブラン酸塩の行動的影響を示すものである。
【0063】
表14

【0064】
組織処理
実験終了時に、動物を10mg/kgのペントバルビタールナトリウムのIP注射によって麻酔し、次に、pH 7.4の10mlのPBS、続いて50mlの4%パラホルムアルデヒド/PBSで5分間かけて経心的に潅流した。脳を頭蓋骨から取り出し、同じ固定液に4時間浸漬することにより後固定し、次に、PBS中の30%スクロースに移した。スクロース液で平衡した後、冠状断面を低温切断を用いて40μmの厚さに切断して貯蔵溶液に入れ、染色する前に4℃で貯蔵した。
【0065】
チロシンヒドロキシラーゼ(TH)免疫組織化学
自由浮遊切片について免疫組織化学を行った。5連続の切片の1つにすべての染色を行った。すべての切片を同時に同じ抗体の溶液を用い且つインキュベーション時間と洗浄を各脳について同じであることを確実にして染色した。下記のプロトコールを用いた。切片をPBSで洗浄した。内因性ペルオキシダーゼ酵素活性をPBS中の3%過酸化水素に10分間浸漬を用いて急冷し、続いてPBS中で洗浄および再平衡した。PBSの3%正常ヤギ血清/0.1%トリトンX-100の溶液中で1時間のプレインキュベーション時間後、切片をポリクローナル抗-TH(チロシンヒドロキシラーゼ)抗体(Chemicon)中で1%正常ヤギ血清/0.1%トリトンX-100の1:2,000の希釈液で室温において一晩インキュベートした。充分に洗浄した後、0.1%トリトンX-100/PBS中のビオチン化抗ウサギ抗体(Vector、1:200)を90分間適用した。次に、切片を15分間洗浄した後、ABC溶液(Vector、1:100)/PBSを1時間適用し、続いてPBS中で充分に洗浄した。0.1μl/mlの過酸化水素を含有するPBS中の0.02%DAB溶液中で3分間インキュベートすることによってホースラディッシュペルオキシダーゼ標識を示した。切片を上昇アルコール系列中で脱水したゼラチン被覆顕微鏡スライド、Histomount培養液を用いて透き通ったカバーガラス上に載置した。
【0066】
データの定量化および統計分析
光学分別器、参照量または計数された要素(ニューロン)の寸法に影響されない不偏細胞計数方法用いてニューロンを計数した。この方法は、コンピュータ制御電動式ステージを備えたツァイスplanapochromat対物レンズを備えるAxiophot写真用顕微鏡(Zeiss、ドイツ)、ビデオカメラ、およびStereo Investigatorソフトウェア(MicroBrightField、ウィリストン、ヴァーモント州)からなるコンピュータ支援画像解析システムを用いて実施した。解剖学的参照として標準マウスアトラス(PaxinosおよびFranklin、2004)を用いてSNの全範囲にわたって第5切片ごとのSNpcについてニューロンの数を計数することによって細胞計数を行った。
各実験グループの統計分析をスチューデントt検定によって評価した。p < 0.05の場合に差を有意とみなした。すべての統計分析は、GraphPad Prismソフトウェアを用いて行った。
【0067】
結果
正常グループにおいて、多くのTH-免疫反応性(IR)ニューロンは黒質緻密部に分配され、若干のTH-IRニューロンは黒質網様部に点在した。MPTP-生理的食塩水グループは、正常グループと比較してTH-IRニューロンの有意な減少を示した。クラブラン酸塩治療グループ(ipおよびga)において、TH-IRニューロンは、MPTP誘導TH-IRニューロン損傷から著しく保護されていた。図8は、黒質緻密部(SNpc)におけるチロシンヒドロキシラーゼ(TH)について免疫組織化学を示す図である。TH-陽性のニューロンの数は、MPTP-生理的食塩水グループにおいて正常グループと比較して著しく減少した。TH陽性のニューロンの数は、MPTP-クラブラン酸塩治療グループにおいて良好に保存された。図9は、MPTP処理動物における黒質緻密部(SNpc)ニューロン生存に対するクラブラン酸塩治療の効果を示す図である。MPTP処理グループにおいて、SNpc内のTH-陽性ニューロンが著しく減少した。双方のクラブラン酸塩治療グループ(ipおよびga)において、SNpc内のTH-陽性ニューロンが著しく保護され、強制経口治療後の細胞がより多く保護された。TH-陽性SNpcニューロンを内側と外側のSNpcを分けている第3の脳神経根の側方AP-3.16でSNpcの最も広い寸法を両側で計数した。(*:正常グループ、##と比較したP値 < 0.05: P値< 0.05、###: MPTPのみの処理グループと比較したP値 < 0.001。ip、腹腔内; ga、強制経口。)
【0068】
実施例8: カイニン酸動物モデル
手順
神経保護剤として、カイニン酸塩動物モデルにおいてクラブラン酸塩を試験した。体重300-350グラムの30匹の雄スプラグダウレイラットを3つのグループに分けた。カイニン酸塩処理の1時間前に、7匹の動物を10μg/kgのIP用量でクラブラン酸塩で処理し、残りの動物を生理的食塩水を投与した。カイニン酸塩を20mg/kgの用量で7匹のクラブラン酸塩治療動物と13匹の生理的食塩水賦形剤処理動物にIP投与した。次の60分にわたって、動物について発作活動を観察した。カイニン酸処理の60分後に動物にクラブラン酸塩または生理的食塩水賦形剤の他のIP注射(10μg/kg)を投与した。カイニン酸処理を生存した動物を7日後に犠牲にし、脳について海馬の組織学的変化を調べた。実験動物として同じ体重と年齢の10匹の未処理の対照動物を犠牲にし、海馬の形態を比較のための基準として用いた。
【0069】
組織処理およびクレシルバイオレット染色
実験終了時に、動物を10mg/kgのペントバルビタールナトリウムのIP注射によって麻酔し、次にpH 7.4の100mlのPBSで、続いて250mlの4%パラホルムアルデヒド/PBSで5分間にわたって経心的に潅流した。脳を頭蓋骨から取り出し、同じ固定液に4時間浸漬することによって後固定し、次に、30%スクロース/PBSに移した。スクロース溶液で平衡した後、冠状断面を低温切断を用いて40μmの厚さに切断し、貯蔵溶液に入れ、染色前に4℃で貯蔵した。すべての染色を5連続の切片の1つで行った。各脳からの1連続の切片を、以下のように一般のニューロン染色クレシルバイオレットを用いて染色した。切片をゼラチン被覆顕微鏡スライドに載置し、室温で一晩乾燥させた。次に、スライドを、下降系列のアルコール(90%、80%、および70%のエタノール)に5分間浸漬し、次に蒸留水に30分間浸漬することにより水和させた。染色をクレシルバイオレット溶液(0.1M酢酸ナトリウム緩衝液、pH 3.5中5%)に3分間浸漬することによって行った。染色と脱水の分化を上昇系列のアルコール(70%、80%、90%、95%、および100%のエタノール)で行った後、キシレンで洗浄し、Histomount封入剤を用いてカバーガラスにした。
【0070】
データの定量化および統計分析
カイニン酸塩誘導ニューロン損傷に対するクラブラン酸塩の影響を評価するために、コンピュータによって動作するCCDカメラ(Multiscan、フラートン、カリフォルニア州)を備えてた画像分析システムを用いてニューロン数の測定を行った。クレシルバイオレット陽性ニューロンの数を1動物当たり5切片/動物の1mmの直径の海馬において計数した。クレシルバイオレットの陽性ニューロンの数を対照グループと比較した。データを平均±SEMとして表す。データは、一方向のANOVA SPSSプログラムによって評価し、ダンカンの複数の範囲試験を用いて平均を評価した。統計的有意性は、P < 0.05で考慮された。
【0071】
結果
クラブラン酸を投与した動物は、生理的食塩水のみを投与された対照と比較して発作と穏やかな発作活動に対してより長い発症を示した。それぞれ、カイニン酸塩+生理的食塩水グループの6匹がカイニン酸処理の24時間以内に死亡した。しかし、クラブラン酸塩+カイニン酸塩グループは、死亡を示さなかった。表15は、発作評価段階(Sperk et al.、1983)を表にするものである。発作率は、カイニン酸処理の60-120分後に測定した。
クラブラン酸塩を投与した動物は、 カイニン酸塩誘導の海馬細胞死に対して著しい神経保護作用を示した。図11は、カイニン酸塩(KA)誘導海馬神経毒性に対するクラブラン酸塩の影響を示す図である。CA3におけるニューロンの数は、KA処理ラット(KA+生理的食塩水)において著しく減少した。KA処理ラットに対するクラブラン酸塩処理は、CA3領域に対して強い神経保護作用を示した。カイニン酸塩-生理的食塩水処理グループにおいて、錐体細胞層におけるクレシルバイオレットの陽性CA3細胞がカイニン酸処理の7日後に著しく減少した。このグループにおいて、錐体細胞層におけるクレシルバイオレット陽性ニューロンは、正常なグループと比較して29.7%であった。クラブラン酸塩処理グループにおいて、錐体ニューロンの88.7%がクレシルバイオレットに陽性であった。図12は、正常、カイニン酸塩+生理的食塩水、およびカイニン酸塩+クラブラン酸塩治療グループのCA3領域においてクレシルバイオレット染色を示す図である。KA+生理的食塩水グループは、正常なグループと比較してクレシルバイオレット陽性ニューロンの著しい減少を示した。クラブラン酸塩治療グループにおいて、大量のクレシルバイオレット陽性ニューロンがCA3領域における錐体細胞層に観察された。各々の棒は、平均±S.E.M.を表す(*: 対照グループと比較したP値 < 0.05。#: KA+生理的食塩水グループと比較P値 < 0.05。) また、クラブラン酸塩治療ラットは、カイニン酸塩-食塩水で処理された動物と比較してCA3におけるニューロンの正常な形態を有するように見えた。
【0072】
表 15

【0073】
本明細書において例示し述べてきた実施態様は、本発明を実施し使用するために本発明者らが知る最良の方法を当業者に教示することのみを意図している。本明細書においては、本発明の範囲を限定するものとみなされるものは何もない。提示した実施例は、全て代表的であり非限定的である。本発明の上記の実施態様は、上記の教示に照らして当業者が理解されるように、本発明から逸脱することなく、修正または変更し得る。従って、特許請求の範囲およびその等価の範囲内において、明記したのと別の形で本発明を実施し得ることを理解すべきである。
【特許請求の範囲】
【請求項1】
クラブラン酸塩を治療的に有効な量で含む安定な経口製剤を経口投与することを含む神経変性疾患を治療する方法であって、前記クラブラン酸塩がクラブラン酸、クラブラン酸誘導体またはクラブラン酸の医薬的に許容され得る塩からなる群より選ばれる、前記方法。
【請求項2】
クラブラン酸塩を治療的に有効な量で含む安定な経口製剤を経口投与することを含む神経保護を与える方法であって、前記クラブラン酸塩がクラブラン酸、クラブラン酸誘導体またはクラブラン酸の医薬的に許容され得る塩からなる群より選ばれる、前記方法。
【請求項3】
クラブラン酸塩を治療的に有効な量で含む安定な経口製剤を経口投与することを含む神経細胞の消失または死滅を防止する方法であって、クラブラン酸塩がクラブラン酸、クラブラン酸誘導体またはクラブラン酸の医薬的に許容され得る塩からなる群より選ばれる、前記方法。
【請求項4】
神経保護が、神経変性疾患に由来の細胞消失または細胞死を防止することを含む、請求項2に記載の方法。
【請求項5】
前記神経変性疾患が、パーキンソン病、アルツハイマー病、および多発性硬化症からなる群より選ばれる、請求項1または4に記載の方法。
【請求項6】
前記クラブラン酸塩が、クラブラン酸カリウムである、請求項1〜5のいずれか1項に記載の方法。
【請求項7】
前記経口製剤が、錠剤、カプセル剤、丸剤、トローチ剤、液剤、懸濁剤、バッカル錠、舌下錠、口腔内崩壊錠剤、薄膜または散剤の形である、請求項1〜6のいずれか1項に記載の方法。
【請求項8】
前記製剤が、クラブラン酸塩を少なくとも約4時間放出する持続放出組成物である、請求項1〜7のいずれか1項の方法。
【請求項9】
前記製剤が、クラブラン酸塩を約0.5時間未満で放出する即時放出組成物である、請求項1〜7のいずれか1項に記載の方法。
【請求項10】
前記クラブラン酸カリウムが、クラブラン酸カリウム粉末、または二酸化ケイ素若しくは微結晶性セルロースとの1:1混合物としてのクラブラン酸カリウムである、請求項6に記載の方法。
【請求項11】
前記製剤が、クラブラン酸塩と少なくとも1つの賦形剤とを混合し、クラブラン酸塩と前記少なくとも1つの賦形剤との混合物を造粒し、かつ、クラブラン酸塩と前記少なくとも1つの賦形剤との造粒混合物を凍結乾燥するプロセスによって調製される、請求項1〜10のいずれか1項に記載の方法。
【請求項12】
前記製剤が、約0.001mg/kg/日〜約1.0mg/kg/日のクラブラン酸塩を与える量で投与される、請求項1〜11のいずれか1項に記載の方法。
【請求項13】
前記製剤が、1日1回投与される、請求項1〜12のいずれか1項に記載の方法。
【請求項14】
前記製剤が、複数回投与される、請求項1〜13のいずれか1項に記載の方法。
【請求項15】
治療が、発作または振戦の頻度、発症時間または重症度を低減させることを含む、請求項1〜14のいずれか1項に記載の方法。
【請求項16】
治療が、記憶喪失を減じることを含む、請求項1〜15のいずれか1項に記載の方法。
【請求項17】
治療が、神経細胞死を減少させることを含む、請求項1〜16のいずれか1項に記載の方法。
【請求項18】
前記製剤が、マトリックス、充填剤、流動促進剤、および滑沢剤の1つ以上を含む、請求項1〜17のいずれか1項に記載の方法。
【請求項19】
前記マトリックスが、メトセル(Methocel) K100LV Prem CR、ユードラジット(Eudragit) S100、カルボポール(Carbopol) 971P、カルボポール(Carbopol) 974P、メタクリレートコポリマータイプAおよびメタクリレートコポリマータイプBおよびこれらの混合物からなる群より選ばれ、前記充填剤が、無水ラクトース、アビセル(Avicel) PH-112、アビセル(Avicel) PH-113、イソマルト(Isomalt)、およびこれらの混合物からなる群より選ばれ; 前記流動促進剤が、カルボシル(Carbosil)であり、前記滑沢剤が、ステアリン酸マグネシウムおよびタルクのうちの少なくとも1つである、請求項18に記載の方法。
【請求項1】
クラブラン酸塩を治療的に有効な量で含む安定な経口製剤を経口投与することを含む神経変性疾患を治療する方法であって、前記クラブラン酸塩がクラブラン酸、クラブラン酸誘導体またはクラブラン酸の医薬的に許容され得る塩からなる群より選ばれる、前記方法。
【請求項2】
クラブラン酸塩を治療的に有効な量で含む安定な経口製剤を経口投与することを含む神経保護を与える方法であって、前記クラブラン酸塩がクラブラン酸、クラブラン酸誘導体またはクラブラン酸の医薬的に許容され得る塩からなる群より選ばれる、前記方法。
【請求項3】
クラブラン酸塩を治療的に有効な量で含む安定な経口製剤を経口投与することを含む神経細胞の消失または死滅を防止する方法であって、クラブラン酸塩がクラブラン酸、クラブラン酸誘導体またはクラブラン酸の医薬的に許容され得る塩からなる群より選ばれる、前記方法。
【請求項4】
神経保護が、神経変性疾患に由来の細胞消失または細胞死を防止することを含む、請求項2に記載の方法。
【請求項5】
前記神経変性疾患が、パーキンソン病、アルツハイマー病、および多発性硬化症からなる群より選ばれる、請求項1または4に記載の方法。
【請求項6】
前記クラブラン酸塩が、クラブラン酸カリウムである、請求項1〜5のいずれか1項に記載の方法。
【請求項7】
前記経口製剤が、錠剤、カプセル剤、丸剤、トローチ剤、液剤、懸濁剤、バッカル錠、舌下錠、口腔内崩壊錠剤、薄膜または散剤の形である、請求項1〜6のいずれか1項に記載の方法。
【請求項8】
前記製剤が、クラブラン酸塩を少なくとも約4時間放出する持続放出組成物である、請求項1〜7のいずれか1項の方法。
【請求項9】
前記製剤が、クラブラン酸塩を約0.5時間未満で放出する即時放出組成物である、請求項1〜7のいずれか1項に記載の方法。
【請求項10】
前記クラブラン酸カリウムが、クラブラン酸カリウム粉末、または二酸化ケイ素若しくは微結晶性セルロースとの1:1混合物としてのクラブラン酸カリウムである、請求項6に記載の方法。
【請求項11】
前記製剤が、クラブラン酸塩と少なくとも1つの賦形剤とを混合し、クラブラン酸塩と前記少なくとも1つの賦形剤との混合物を造粒し、かつ、クラブラン酸塩と前記少なくとも1つの賦形剤との造粒混合物を凍結乾燥するプロセスによって調製される、請求項1〜10のいずれか1項に記載の方法。
【請求項12】
前記製剤が、約0.001mg/kg/日〜約1.0mg/kg/日のクラブラン酸塩を与える量で投与される、請求項1〜11のいずれか1項に記載の方法。
【請求項13】
前記製剤が、1日1回投与される、請求項1〜12のいずれか1項に記載の方法。
【請求項14】
前記製剤が、複数回投与される、請求項1〜13のいずれか1項に記載の方法。
【請求項15】
治療が、発作または振戦の頻度、発症時間または重症度を低減させることを含む、請求項1〜14のいずれか1項に記載の方法。
【請求項16】
治療が、記憶喪失を減じることを含む、請求項1〜15のいずれか1項に記載の方法。
【請求項17】
治療が、神経細胞死を減少させることを含む、請求項1〜16のいずれか1項に記載の方法。
【請求項18】
前記製剤が、マトリックス、充填剤、流動促進剤、および滑沢剤の1つ以上を含む、請求項1〜17のいずれか1項に記載の方法。
【請求項19】
前記マトリックスが、メトセル(Methocel) K100LV Prem CR、ユードラジット(Eudragit) S100、カルボポール(Carbopol) 971P、カルボポール(Carbopol) 974P、メタクリレートコポリマータイプAおよびメタクリレートコポリマータイプBおよびこれらの混合物からなる群より選ばれ、前記充填剤が、無水ラクトース、アビセル(Avicel) PH-112、アビセル(Avicel) PH-113、イソマルト(Isomalt)、およびこれらの混合物からなる群より選ばれ; 前記流動促進剤が、カルボシル(Carbosil)であり、前記滑沢剤が、ステアリン酸マグネシウムおよびタルクのうちの少なくとも1つである、請求項18に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【公表番号】特表2012−525427(P2012−525427A)
【公表日】平成24年10月22日(2012.10.22)
【国際特許分類】
【出願番号】特願2012−508734(P2012−508734)
【出願日】平成22年4月29日(2010.4.29)
【国際出願番号】PCT/US2010/032983
【国際公開番号】WO2010/127125
【国際公開日】平成22年11月4日(2010.11.4)
【出願人】(510116716)レクサン ファーマシューティカルズ インコーポレイテッド (4)
【Fターム(参考)】
【公表日】平成24年10月22日(2012.10.22)
【国際特許分類】
【出願日】平成22年4月29日(2010.4.29)
【国際出願番号】PCT/US2010/032983
【国際公開番号】WO2010/127125
【国際公開日】平成22年11月4日(2010.11.4)
【出願人】(510116716)レクサン ファーマシューティカルズ インコーポレイテッド (4)
【Fターム(参考)】
[ Back to top ]

