神経変性状態の治療のための治療薬としての1,4−ベンゾキサジン化合物およびその誘導体
本発明は、アルツハイマー病、パーキンソン病、またはハンチントン病などの疾患、および虚血性発作などの状態を含む神経変性から保護するためにキナーゼ活性を阻害するための組成物および方法を含み、この方法は、対象に治療有効量の1,4−ベンゾキサジン化合物およびその誘導体を提供するステップを含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、全般的に神経変性障害の分野に関し、より詳細にはアルツハイマー病、パーキンソン病、筋萎縮性側索硬化症(ALS)またはハンチントン病などの疾患、ならびに虚血性発作および外傷性脳損傷などの状態を含む、神経変性から保護するための新規の組成物および方法に関する。
【背景技術】
【0002】
本発明の範囲を限定することなく、本発明の背景は、アルツハイマー病、パーキンソン病またはハンチントン病、および虚血性発作などの状態を含む神経変性病態に対する神経保護薬として作用する新規の治療化合物に関連して説明される。
【0003】
アルツハイマー病、パーキンソン病、ALSまたはハンチントン病などの疾患、ならびに虚血性発作および外傷性脳損傷などの状態は、年間で何百万もの人々を冒し、社会に莫大な経済的負担を与えている。これら状態の特徴は、ニューロンの異常で過度な損失である。これら病態におけるニューロン死を防ぐための有効な戦略は現在のところない。
【0004】
アルツハイマー病(AD)などの神経変性障害は、神経原線維変化、神経突起斑、および神経細胞死によって特徴付けられる。アルツハイマー病は、変性末期疾患であり、そのための治療法は知られておらず、脳における斑および錯綜によって特徴付けられる。その最も一般的な形態において、アルツハイマー病は65歳を超える人々を悩ましており、発症率は低いが早期発症型も存在する。
【発明の概要】
【0005】
〔発明の開示〕
本発明者は、神経変性の組織培養範例を使用してニューロン死を防ぐ能力のために小分子化合物を合成しスクリーニングした。これらの調査は、強力な神経保護活性を有する化合物として2−ベンジリデン−2H−1,4−ベンゾキサジン−3−(4H)−オンの特定を導いた。本明細書において、2−ベンジリデン−2H−1,4−ベンゾキサジン−3−(4H)−オンおよびその誘導体は、脳内の感受性の高いニューロン集団を保護することができ、ゆえに神経変性状態を治療するための治療アプローチを表すことができるということが証明される。現在のところ神経変性疾患を治癒、軽減、または治療する有効な戦略はない。1,4−ベンゾキサジン−3−(4H)−オン類の化合物が、神経変性から保護するということはこれまで示されていなかった。これらの化合物は、新規の治療ツールであることを表している。
【0006】
本発明は、これらに限定されるものではないが、アルツハイマー病、パーキンソン病、ハンチントン病、および筋萎縮性側索硬化症、ならびに、虚血性発作および外傷性脳損傷などの神経学的状態を含む神経変性疾患の治療における新規の治療ツールとして、HSB13およびその誘導体などの1,4−ベンゾキサジン化合物を含む。本発明は、多くの異なる1,4−ベンゾキサジン化合物およびその誘導体を含む組成物を作製し使用するための組成物および方法を含む。1,4−ベンゾキサジン化合物およびその誘導体は、神経変性の組織培養モデルにおいて評価された。これらの化合物は、神経変性の異なる組織培養モデルにおいて保護性である。
【0007】
本発明は、神経変性の組織培養モデルにおいて高度に神経保護性である1,4−ベンゾキサジン類の幾つかの化合物を説明する。仮定のためで決して本発明の限定ではなく、薬理学的阻害剤を使用して、これらの化合物の作用機構はRaf−MEK−ERKまたはPI 3キナーゼ−Aktシグナル経路も、あるいは、プロテインキナーゼA(PKA)、カルシウムカルモジュリンキナーゼA(CaMK)およびヒストンデアセチラーゼ(HDAC)などの他の生存促進分子も含まないということが提案されるということが見出された。
【0008】
1,4−ベンゾキサジン化合物およびその誘導体は、線条体変性を減少し、ハンチントン病を化学的に誘導されたマウスモデルにおいて行動遂行を改善するということが見出された。HSB−13、HSB−22およびASK−2などの化合物を含む幾つかの1,4−ベンゾキサジンは、培養小脳顆粒ニューロンを低カリウム処置により誘導される死から保護した。HSB−13は、HT−22神経芽腫細胞をホモシステイン酸(HCA)誘導神経毒性から保護した。また、ASK−2は、一次皮質ニューロンをHCA誘導神経毒性から保護することも見出された。HSB−13は、線条体変性を減少した。HSB−13は、ハンチントン病の3−ニトロプロピオン酸マウスモデルにおける行動遂行を改善する。
【0009】
本発明は、これらの化合物のうちの1つである、HSB−13として表示される、(Z)−6−アミノ−2−(3,’5’−ジブロモ−4’−ヒドロキシベンジリデン)−2H−ベンゾ[b][l,4]オキサジン−3(4H)−オンの、ハンチントン病の3−ニトロプロピオン酸(3−NP)誘導マウスモデルにおける研究を説明する。HSB−13は、線条体変性を減少し、3−NPが投与されたマウスにおける行動遂行を改善した。本発明者は、化合物HSB−13は、ハンチントン病のよく特徴付けられ受け入れられているモデルシステム、およびアミロイド前駆体タンパク質(APP)毒性のショウジョウバエモデルにおいて保護性であることを見出した。本発明のHSB−13ファミリーの化合物および新しく作られるそれらの誘導体は、神経変性疾患の治療における新規の治療ツールであることを表している。
【0010】
本発明は、これらに限定されるものではないが、アルツハイマー病、パーキンソン病、ハンチントン病、および筋萎縮性側索硬化症、ならびに、虚血性発作および外傷性脳損傷などの神経学的状態を含む神経変性疾患の治療における新規の治療ツールとして、HSB13およびその誘導体などの1,4−ベンゾキサジン化合物を含む。本発明において説明される化合物は、対象、例えばヒト、ヒト以外の霊長類、ラット、マウス、およびハエに神経保護を提供する。本発明は、多くの異なる1,4−ベンゾキサジン化合物およびその誘導体を含む組成物を作製し使用するための組成物および方法を含む。1,4−ベンゾキサジン化合物およびその誘導体は、神経変性の組織培養モデルにおいて評価された。驚いたことに、これらの化合物は、神経変性の異なる組織培養モデルにおいて保護性であるということが見出された。
【0011】
本発明の化合物は、対象における1以上のニューロンの死、異常または過度な損失を調節すること、神経毒性、対象における自発運動遂行、および/または、アミロイド前駆体タンパク質および他の部分の毒性効果に影響を及ぼすことによって、神経学的状態の調節を提供する。
【0012】
1,4−ベンゾキサジン化合物およびその誘導体は、線条体変性を減少し、ハンチントン病を化学的に誘導されたマウスモデルにおける行動遂行を改善するということが見出された。HSB−13、HSB−22およびASK−2などの化合物を含む幾つかの1,4−ベンゾキサジンは、培養小脳顆粒ニューロンを低カリウム処置により誘導される死から保護した。HSB−13は、HT−22神経芽腫細胞をホモシステイン酸(HCA)誘導神経毒性から保護した。HSB−13はまた、よく特徴付けられ一般的に使用されるアルツハイマー病の組織培養モデルである、βアミロイド(Aβ)誘導ニューロン死から皮質ニューロンを保護する。ASK−2は、一次皮質ニューロンをHCA誘導神経毒性から保護する。HSB−13は、線条体変性を減少し、ハンチントン病の3−ニトロプロピオン酸マウスモデルにおける行動遂行を改善した。
【0013】
本発明は、以下の式の化合物を含む。
【化1】

式中、AおよびBは、C、N、S、Oから選択される。R1〜R7は、H、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、C1〜C6エーテル基、C1〜C6エステル基、C1〜C6アルキルアルカノアート基、C1〜C6アルコキシ基、ケト基、および、オキソ基から独立して選択される。R8は、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、エーテル基、エステル基、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基である。R9〜R13は、H、C1〜C6アルキル;C1〜C6アルケニル、ハロ、置換されたC1〜C6アルキル、置換されたC1〜C6アルケニル、カルボニル、炭酸エステル、アセトキシ基、アセチル基、エーテル、エステル、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基から独立して選択される。
【0014】
本発明はまた、神経学的状態の調節が必要な対象を特定すること;およびその対象に組成物を提供することによって、対象における神経学的状態から保護するか、その神経学的状態を治療するか、減少させるか、または調節する方法を提供する。この組成物は、以下の構造を有する。
【化2】

式中、Aは、C、N、S、Oから選択され;Bは、C、N、S,Oから選択され;R1〜R7は、H、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、C1〜C6エーテル基、C1〜C6エステル基、C1〜C6アルキルアルカノアート基、C1〜C6アルコキシ基、ケト基、および、オキソ基から独立して選択され;R8は、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、エーテル基、エステル基、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基であり;ならびに、R9〜R13は、H、C1〜C6アルキル;C1〜C6アルケニル、ハロ、置換されたC1〜C6アルキル、置換されたC1〜C6アルケニル、カルボニル、炭酸エステル、アセトキシ基、アセチル基、エーテル、エステル、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基から独立して選択される。
【0015】
本発明は、神経変性状態に対する保護を必要とする対象を特定すること、および、以下の式を有する組成物の治療有効量をその対象に提供することによって、対象における神経変性状態を減少させるか、改善するか、治療するか、または、その神経変性状態から保護する方法を提供する。
【化3】

式中、Aは、C、N、S、Oから選択され;Bは、C、N、S、Oから選択され;R1〜R7は、H、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、C1〜C6エーテル基、C1〜C6エステル基、C1〜C6アルキルアルカノアート基、C1〜C6アルコキシ基、ケト基、および、オキソ基から独立して選択され;R8は、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、エーテル基、エステル基、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基であり;ならびに、R9〜R13は、H、C1〜C6アルキル;C1〜C6アルケニル、ハロ、置換されたC1〜C6アルキル、置換されたC1〜C6アルケニル、カルボニル、炭酸エステル、アセトキシ基、アセチル基、エーテル、エステル、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基から独立して選択される。
【0016】
別の実施形態において、本発明はまた、対象においてキナーゼを阻害するための組成物および方法を含み、この方法は、増加したキナーゼ活性から保護する必要がある対象を特定するステップと;対象においてキナーゼ活性を低下させるのに有効な組成物の量を対象に提供するステップとを含み、この組成物は以下の式を含む。
【化4】

式中、Aは、C、N、S、Oから選択され;Bは、C、N、S、Oから選択され;R1〜R7は、H、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、C1〜C6エーテル基、C1〜C6エステル基、C1〜C6アルキルアルカノアート基、C1〜C6アルコキシ基、ケト基、および、オキソ基から独立して選択され;R8は、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、エーテル基、エステル基、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基であり;ならびに、R9〜R13は、H、C1〜C6アルキル;C1〜C6アルケニル、ハロ、置換されたC1〜C6アルキル、置換されたC1〜C6アルケニル、カルボニル、炭酸エステル、アセトキシ基、アセチル基、エーテル、エステル、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基から独立して選択される。
【0017】
一態様において、本方法はさらに、対象におけるキナーゼ活性レベルを測定するステップを含む。別の態様において、キナーゼ活性の増加に対する保護を必要とする対象は、神経学的状態、例えばアルツハイマー病、パーキンソン病、ハンチントン病、発作、または、虚血性発作を患っているものである。一態様において、その状態は、ウイルス感染、例えばHIVなどのレトロウイルス感染を含む。別の態様において、キナーゼ活性の低下は神経学的状態から保護し、1以上のニューロンの死、1以上のニューロンの損失、1以上のニューロンにおける毒性を防止、改善された自発運動遂行、あるいは、アミロイド前駆体タンパク質および他の部分の毒性効果からの保護を含む。一態様において、対象は、ガンを患っている。さらに別の態様において、阻害されるキナーゼは、GSK3α、GSK3β、p38β、およびB−Rafのうちの少なくとも1つを含む。別の関連態様において、阻害されるキナーゼは、CDK1、CDK2、ROCK1、JNK2、MLK3、および、c−Rafのうちの少なくとも1つを含む。阻害剤は、例えば100nM〜500nMまでの間で提供されうる。本方法はさらに、対象に化合物を提供してから治療後の活性を決定する前に、GSK3α、GSK3β、p38α、p38β、B−Raf、CDK1、CDK2、JNK2、JNK3、および、MLK3のうちの少なくとも1つの活性を決定するステップを含みうる。
【0018】
本発明の別の実施形態は、ガン、自己免疫疾患、AIDS、および免疫系の他の疾患を含むアポトーシスの規制緩和を含む疾患を治療するために使用される方法および組成物を提供する。同様に、当該発明は、キナーゼによる影響を受ける状態を治療すること、例えば活性がニューロン生存にとって有害であるキナーゼの阻害に使用される方法および組成物を提供する。本発明は、例えばGSK3α、GSK3β、p38βおよびB−Rafのキナーゼ活性に影響を及ぼすために使用される方法および組成物を提供する。
【0019】
本発明の特徴および利点のより完全な理解のために、ここで添付の図面と共に本発明の詳細な説明を述べる。
【図面の簡単な説明】
【0020】
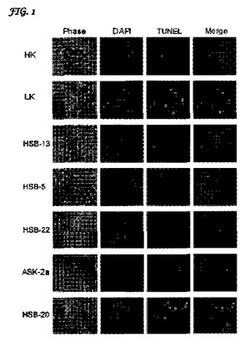
【図1】LK誘導ニューロン死から保護する1,4−ベンゾキサジン化合物を示す画像である。小脳顆粒ニューロンの培養物は、HK培地、LK培地、または、5種類の1,4−ベンゾキサジン化合物、すなわちHSB−13、HSB−5、HSB−22、ASK−2a、およびHSB−20のうちの1種類を含有するLK培地に交換された。全ての化合物は、25μM濃度で使用された。生存能が、位相差顕微鏡検査、DAPI染色(アポトーシスニューロンが、凝縮した核または断片化した核によって検出される)、あるいは、TUNEL染色(アポトーシス核が緑色に標識付けされる)によって24時間後に評価された。DAPIおよびTUNEL染色画像は、同じ場からのものである。HSB−13、HSB−5、HSB−22、およびASK−2aは保護性であったが、HSB−20は保護性ではなかった。
【図2】4種類の神経保護ベンゾキサジンの構造のうちの幾つかの概略図である。HSB−13、ASK−2、ASK−2a、および、HSB−13の構造が示されている。本文に説明されているように、ASK−2aは、ASK2よりもはるかに高い神経保護性を示した。HSB−13は、最も高い神経保護性を示した。
【図3】1,4−ベンゾキサジンによる神経保護におけるシグナル伝達経路の阻害の効果を示すプロットである。小脳顆粒ニューロンの培養物は、LK培地、HSB−13を含有するLK培地、または、HSB−13と、PD98059(40μM)、U0126(10μM)、ワートマニン(100nm)、Akt阻害剤−X(5μM)、KN−62(10μM)、H89(10μM)およびTSA(1μM)のうちのいずれかとを含有するLK培地に交換された。生存能は、DAPI染色によって24時間後に定量化された。HK培地に交換された対照培養における生存能に結果を標準化した。
【図4】保護性1,4−ベンゾキサジン化合物で処理されたニューロン培養物におけるシグナル伝達タンパク質のウェスタンブロット解析を示す画像である。小脳顆粒ニューロンの培養物は、HK培地、LK培地、あるいは、HSB−13、HSB−22、またはASK−2aを含有するLK培地に3時間交換された。全細胞溶解物が、リン酸Akt(Ser473)、リン酸MEK、リン酸ERK、および、リン酸GSK3に対する抗体を使用してウェスタンブロット法によって調製され分析された。αチューブリンに対する抗体も使用されて、同様量の溶解物が各レーンに装填されたことを示した。
【図5】c−junおよびATF−3発現におけるベンゾキサジンの効果を示す画像である。小脳ニューロン培養は、3時間、HK、LK、あるいは、25μMのHSB−13、25μMのASK−2a、または25μMのHSB−22を含有するLK培地で処理した。全細胞溶解物が次に調製され、c−junおよびATF−3に対する抗体を使用してウェスタンブロット解析された。αチューブリンに対する抗体も使用されて、同様量の溶解物が各レーンに装填されたことを示した。
【図6A】HT−22細胞でのHSB−13の効果、および細胞死の定量化を示している。図6Aは、HCA誘導毒性に対するHT−22細胞でのHSB−13の保護効果を示している。HT−22細胞は、添加剤を用いない(無)、1.5mMのHCA、あるいは、25μMのHSB−13、25μMのASK−2a、および25μMのHSB−22を加えた1.5mMのHCAで処理された。図6Aにおいて、処理後24時間の培養物の様子が、位相差顕微鏡検査(位相)によって視覚化された。細胞死は、DAPIおよびTUNEL染色を使用して評価された。図6Bは、DAPI染色によるニューロン生存能の定量化を示している。生存能は無処理培養(対照)の%として表現された。
【図6B】HT−22細胞でのHSB−13の効果、および細胞死の定量化を示している。図6Aは、HCA誘導毒性に対するHT−22細胞でのHSB−13の保護効果を示している。HT−22細胞は、添加剤を用いない(無)、1.5mMのHCA、あるいは、25μMのHSB−13、25μMのASK−2a、および25μMのHSB−22を加えた1.5mMのHCAで処理された。図6Aにおいて、処理後24時間の培養物の様子が、位相差顕微鏡検査(位相)によって視覚化された。細胞死は、DAPIおよびTUNEL染色を使用して評価された。図6Bは、DAPI染色によるニューロン生存能の定量化を示している。生存能は無処理培養(対照)の%として表現された。
【図7】神経保護および運動性活性におけるHSB−13の効果を示している。図7Aは、生体内における3−NP神経毒性に対するHSB−13の保護効果を示すプロットである。図7Aにおける組織学的解析。対照、3−NP、および、3−NP+HSB−13で処理されたマウスからの冠状切片40μmのクレシルバイオレット染色。上パネル:低倍率で線条体における細胞の選択的損失を示している。下パネル:背外側部分の線条体の高倍率画像。図7Bは、生理食塩水(対照)、3−NP、および3−NP+HSB−13が投与されたマウスの自発運動活性測定を要約するグラフを示している。投与量および投与条件は、方法において詳述されている。活性は15分間を超えて測定された。a)総運動時間;b)総運動距離;c)運動ごとの平均距離;d)平均速度が示されている。棒は、平均±SDを示す。*は、3−NP値と3−NP+HSB−13値との間の統計的有意性を示す(P値<0.05)。統計的解析は、独立両側スチューデントt検定(unpaired, two-tailed Student's T test)を使用して行われた。
【図8】HSB−13はショウジョウバエにおいてAPP695誘導毒性から保護するということを示す画像である。ヒトAPP695を発現するハエの生存を対照と比較した。HSB−13での処理は、APP発現ハエの生存率を著しく増加した。n=15〜20匹のハエの群を用いた独立研究の数。棒は、平均±SEMを示す。図8は、HSB−13がHCA誘導毒性に対してHT−22細胞を保護するということを示す画像である。HT−22細胞は、添加物を用いない(対照)、2mMのHCA、あるいは、2mMのHCA+25μMのHSB−13で処理された。処理後24時間の培養物の様子が示されている。
【図9】HSB−13がHCA誘導毒性に対してHT−22細胞を保護するということを示す画像である。HT−22細胞は、添加物を用いない(対照)、2mMのHCA、または、2mMのHCA+25μMのHSB−13で処理された。処理後24時間の培養物の様子が示されている。
【図10】図10Aおよび図10Bは3−NPが生体内において3−NP神経毒性に対して保護性であるということを示す画像である。図10A:組織学的解析。対照、3−NP、および、3−NP+HSB−13で処理されたマウスからの冠状切片50μmのクレシルバイオレット染色。投与量および投与条件は、方法において詳述されている。上パネル:低倍率で線条体における細胞の選択的損失を示している。下パネル:背外側部分の線条体の高倍率画像。図10B:自発運動活性の分析。生理食塩水(対照)、3−NP、および3−NP+HSB−13が投与されたマウスの自発運動活性測定。投与量および投与条件は、方法において詳述されている。活性は15分間を超えて測定された。A)全運動エピソード;B)総運動距離;C)平均速度;D)垂直面進入が示されている。棒は、平均±SDを示す。
【発明を実施するための形態】
【0021】
〔発明の説明〕
本発明の様々な実施形態の作製および使用は、以下で詳細に論じられるが、本発明は、多様な特定情況において具現化されうる多くの適用可能な発明概念を提供するということが認識されるべきである。本明細書において論じられる特定実施形態は、本発明を作製し使用するための特定方法の単なる例示に過ぎず、本発明の範囲を定めるものではない。
【0022】
本発明の理解を容易にするために、多くの用語が以下で定義される。本明細書で定義される用語は、本発明に関連する分野の通常の技術者によって一般的に理解されるとおりの意味を有する。「a」「an」および「the」などの用語は、単一実体にのみ言及するように意図されず、例示のために使用されうる特定例の一般的分類を含む。本明細書における用語法は、本発明の特定実施形態を説明するために使用されるが、それらの使用は、特許請求の範囲で概説されている場合を除き、本発明の範囲を定めるものでない。
【0023】
アルツハイマー病、パーキンソン病、および筋萎縮性側索硬化症(ALS)などの神経変性疾患は、患者の生活の質を損ない、家族の介護者に多大な負担を負わせ、年間何十億ドルも社会的コストがかかっている。神経変性疾患の発症に対する最も一貫した危険因子は、加齢である。平均余命の劇的な増加のため、加齢に関連する障害に悩まされる人々の発生率が上昇傾向にあり、主要な健康問題を示している。この多様な障害の組の間で共有される共通点は、ある特定集団のニューロンの進行性かつ止むことのない損失である。神経変性疾患に対する現在の薬物療法は、これらの疾患に関連する症状のみを緩和し、しかし根底にある原因、例えばニューロンの変性には影響を及ぼさない。ニューロンの損失が弱まることなく継続するので、そのような緩和治療は、疾患進行に効果を及ぼさない。ゆえにニューロン死の小分子阻害剤の特定は、緊急で決定的に重要である。
【0024】
アルツハイマー病(AD)などの神経変性障害は、神経原線維変化、神経突起斑、および神経細胞死によって特徴付けられる。アルツハイマー病は、変性末期疾患であり、そのための治療法は知られておらず、脳における斑および錯綜によって特徴付けられる。その最も一般的な形態において、アルツハイマー病は65歳を超える人々を悩ましており、発症率は低いが早期発症型も存在する。神経変性状態は、毎年ますます多くの人々を襲っており、これら状態の多くのための従来治療は、治療という点ではほんのわずかしか提供しない。いくつかの例では、神経変性状態は、多発性硬化症などの特定の疾患に特異的に関連し、一方で、他の例では、これら状態は、加齢、または例えば遺伝的障害および自己免疫疾患などの身体の他の何らかの状態もしくはプロセスに、より全般的に関連する。しかしながらこれらの状態は、衰弱および低下した身体機能によって、時には低下した精神機能によっても特徴付けられる。
【0025】
本発明者は、GW5074と呼ばれるc−Rafの細胞透過性化学阻害剤{5−ヨード−3−[(3’,5’−ジブロモ−4’−ヒドロキシフェニル)メチレン]−2−インドリノン}が、様々な異なるアポトーシス刺激によって誘導された培養ニューロンの死を完全に阻害するということを先に証明している(チン(Chin)ら、2004年)。GW5074はまた、一般的に使用されるハンチントン病の生体内範例である、3−ニトロプロピオン酸が投与されたマウスにおいて、線条体変性を防ぎ、行動遂行を改善する。GW5074は、3’置換インドロンである(チンら、2004年)。多くの他の3置換インドロンもまた、ニューロン死を阻害することが見出されている(ジョンソン(Johnson)ら、2005年;チェン(Chen)ら、2008年)。GW5074ならびに多くの他の3−置換インドロンは、高度に保護性であるが、より高い濃度で使用された場合に毒性を示す(チンら、2004年;ジョンソンら、2005年;チェンら、2008年)。構造活性相関の研究が、追加の3置換インドロンは神経保護性であると同時に、高用量であっても培養ニューロンへの毒性がないということを特定している(バルデラモス(Balderamos)ら、2008年)。他の研究者は、c−jun N−末端キナーゼ(JNK)、サイクリン依存性キナーゼ(CDK)、グリコーゲン合成酵素キナーゼ(GSK3)、およびp53を含む様々な異なるアポトーシス促進タンパク質を標的にする多くのニューロンアポトーシス化学阻害剤を同様に特定している(デメロ(D'Mello)ら、2005年)。
【0026】
本発明は、治療価値を有し、かつ、カリウム欠乏によりアポトーシスを起こすよう誘導された培養小脳顆粒ニューロンにおいて神経保護性である、幾つかの1,4ベンゾキサジン誘導体を提供する。これら化合物のうちの幾つかはまた、酸化ストレスおよびAβ誘導ニューロン死に対して試験されて、無毒性レベルで有効であることを見出された。
【0027】
HSB−13として指定される、これらの化合物の1つは、ハンチントン病の3−ニトロプロピオン酸モデルにおいて生体内で試験された。HSB−13は、神経変性に対するかなりの保護を提供し、マウスにおいて自発運動遂行を改善した。HSB−13はまた、ショウジョウバエにおいてアミロイド前駆体タンパク質(APP)誘導毒性に対して保護性であった。これらの研究は、1,4−ベンゾキサジン化合物を、神経変性に対する治療価値を有する新規の神経保護剤として特定する。
【0028】
幾つかの神経変性疾患に関連する症状を改善するための薬物療法は利用可能であるが、しかしながら、これらの種類の療法は、ニューロンの止むことのない変性を阻止しないので、疾患進行の速度を緩めるものではない。神経変性病態におけるニューロンの異常損失を阻止するための戦略は現在のところない。幾つかの候補化合物は、先に特定されており、これらの多くは、前臨床治験にある。幾つかはヒト治験でも試験されたが、失敗であった。2−ベンジリデン−2H−1,4−ベンゾキサジン−3−(4H)−オンの化合物は、神経変性病態の治療の候補薬物として試験されたことはない。
【0029】
用語「アルキル」、「アルケニル」、「アルキニル」、および「アルキレン」は、典型的には長さが約1〜約12の範囲の炭素原子、好ましくは1〜約6原子の炭化水素鎖を指し、直鎖および分枝鎖を含む。特に断りのない限り、本明細書で言及される任意のアルキルまたはアルキレンの好ましい実施形態は、C1〜C6アルキルである(例えばメチルまたはエチル)。
【0030】
「シクロアルキル」は、飽和または不飽和の環状炭化水素鎖を指し、架橋、融合、またはスピロ環状化合物を含み、好ましくは3〜約12炭素原子、より好ましくは3〜約8原子を含む。
【0031】
「アリール」は、1つ以上の芳香環を意味し、その各々は5または6のコア炭素原子からなる。多重アリール環は、ナフチルの場合のように融合されるか、または、ビフェニルの場合のように融合されていなくてもよい。アリール環はまた、1以上の環状炭化水素、ヘテロアリールまたは複素環と融合されていても、あるいは非融合であってもよい。
【0032】
「ヘテロアリール」は、1〜4のヘテロ原子、好ましくはN、OもしくはS、またはそれらの組み合わせを含むアリール基であり、そのヘテロアリール基は、炭素原子または窒素原子を、C1〜C6アルキル、−−CF3、フェニル、ベンジル、もしくはチエニルで任意に置換されるか、または、ヘテロアリール基の炭素原子が酸素原子とともに、カルボニル基を形成するか、あるいは、そのヘテロアリール基は、フェニル環と任意に融合される。ヘテロアリール環はまた、1以上の環状炭化水素、複素環、アリール、またはヘテロアリール環と融合されうる。ヘテロアリールは、1つのヘテロ原子を有する5員ヘテロアリール(例えばチオフェン、ピロール、フラン);2つのヘテロ原子を1,2位または1,3位に有する5員へテロアリール(例えば、オキサゾール、ピラゾール、イミダゾール、チアゾール、プリン);3つのヘテロ原子を有する5員ヘテロアリール(例えばトリアゾール、チアジアゾール);3つのヘテロ原子を有する5員ヘテロアリール;1つのヘテロ原子を有する6員ヘテロアリール(例えば、ピリジン、キノリン、イソキノリン、フェナントリン(phenanthrine)、5,6−シクロヘプテノピリジン(5,6-cycloheptenopyridine));2つのヘテロ原子を有する6員へテロアリール(例えばピリダジン、シンノリン、フタラジン、ピラジン、ピリミジン、キナゾリン);3つのヘテロ原子を有する6員ヘテロアリール(例えば、1,3,5−トリアジン);および、4つのヘテロ原子を有する6員ヘテロアリールを含むが、これらに限定されない。
【0033】
「複素環」または「複素環式の」は、不飽和または芳香族の特徴を有するか、または有しない、5〜12原子、好ましくは5〜7原子の1以上の環を意味し、その少なくとも1つの環原子は、炭素ではない。好ましいヘテロ原子は、硫黄、酸素、および、窒素を含む。多重環も融合されうる。
【0034】
「ヘテロ原子」は、炭化水素類似化合物の任意の非炭素原子を意味する。例とし酸素、硫黄、窒素、燐、砒素、珪素、セレン、テルル、スズ、およびホウ素を含む。
【0035】
用語「アルキレン」は、メチレン(−CH2−)、プロピレン(−CH2CH2CH2−)、クロロエチレン(−CHClCH2−)、2−チオブテン−CH2CH(SH)CH2CH2、1−ブロモ−3−ヒドロキシル−4−メチルペンテン(−CHBrCH2CH(OH)CH(CH3)CH2−)などの上記で定義されたような二価アルキル基を指す。
【0036】
用語「アルケニル」は、1以上の炭素−炭素二重結合を含む、分岐または非分岐の炭化水素鎖を表す。
【0037】
用語「アルキニル」は、1以上の炭素−炭素三重結合を含む、分岐または非分岐の炭化水素鎖を指す。
【0038】
用語「アリール」は、フェニルおよびナフチルなどの、好ましくは約6〜14の間の炭素原子を有する少なくとも1つの芳香環を形成する炭素原子鎖を指し、これら炭素原子は、そのような鎖に一般的に結合される1以上の官能基、例えばヒドロキシル、ブロモ、フルオロ、クロロ、ヨード、メルカプトまたはチオ、シアノ、シアノアミド、アルキルチオ、複素環、アリール、ヘテロアリール、カルボキシル、カルボアルコイル(carbalkoyl)、アルキル、アルケニル、ニトロ、アミノ、アルコキシル、アミドなどで置換されて、ビフェニル、ヨードビフェニル、メトキシビフェニル、アントリル、ブロモフェニル、ヨードフェニル、クロロフェニル、ヒドロキシフェニル、メトキシフェニル、ホルミルフェニル、アセチルフェニル、トリフルオロメチルチオフェニル、トリフルオロメトキシフェニル、アルキルチオフェニル、トリアルキルアンモニウムフェニル、アミドフェニル、チアゾリルフェニル、オキサゾリルフェニル、イミダゾリルフェニル、イミダゾリルメチルフェニルなどのアリール基を形成しうる。
【0039】
用語「アルコキシ」は、−−OR−−を指し、ここでRはアルキルである。
【0040】
用語「アミド」は、アミド結合:−−C(O)NHR(ここでRは水素またはアルキルである)を指す。
【0041】
用語「アミノ」は、アミン結合:−−NR−−を指し、ここでRは、水素またはアルキルである。用語「カルボキシル」は、−−C(O)O−−を指し、用語「カルボニル」は、−−C(O)−−を指す。
【0042】
用語「アルキルカルボキシル」は、上記で定義されたようなアルキル基がC(O)O基、例えばCH3C(O)O−−、CH3CH2C(O)O−−などで置換されたものを指す。
【0043】
用語「炭素環」は、シクロペンチル、シクロヘキシルなど約5〜約8の環炭素を有する環状炭化水素鎖を意味する。これらの基は、上記の「アルキル」で定義されたような1以上の官能基で任意に置換されうる。
【0044】
用語「ハロゲン」は、塩素、フッ素、臭素、ヨウ素、およびそれらの混合物を含む。
【0045】
用語「複素環」は、N、OおよびSから選択された0〜4のヘテロ原子を含みうる直鎖または環系を意味し、ここで窒素原子および硫黄原子は任意に酸化され、窒素原子は任意に四級化される。
【0046】
用語「カルバモイル」は、基−−C(O)NH2を指す。
【0047】
用語「ヒドロキシアルキル」は、上記で定義されたようなアルキル基がヒドロキシ基によって置換されたものを意味する。
【0048】
用語「アルキルカルボニル」は単独または組み合わせで、アルカンカルボン酸から誘導されたアシル基、すなわちアルキル−C(O)−−を意味し、例えばアセチル、プロピオニル、ブチリル、バレリル、4−メチルバレリルなどがある。
【0049】
特に指定されない限り、全ての細胞培養培地および試薬は、インビトロゲン(Invitrogen)(カリフォルニア州カールズバッド)から購入され、全ての化学薬品はシグマ−アルドリッチ(Sigma- Aldrich)(ミズーリ州セントルイス)から得た。無水溶媒は、フィッシャー・サイエンティフィック(Fischer Scientific)(ペンシルベニア州ピッツバーグ)から購入された。PD98059、U0126、ワートマニン、Akt阻害剤−X、トリコスタチン酸A(TSA)、KN62、H89は、Calbiochem(カリフォルニア州ラ・ホーヤ)から購入された。この論文で使用される抗体は、以下のとおりであった:抗リン酸MEK(9121S)、抗リン酸AKT473(9271S)、抗リン酸GSK3α/β(9331S)、c−Jun(2315S)は、セル・シグナリング・テクノロジー(Cell Signaling Technology)(米国マサチューセッツ州ベバリー)から得た;抗ATF−3(C−19、sc−188)、抗リン酸ERK(E−40、sc−7383)、抗−α−チューブリン(TU−02 sc−8035)は、サンタクルスバイオテクノロジー(Santa CruzBiotechnology)(米国カリフォルニア州サンタクルス)から得た。全ての抗体は、1:1000希釈で使用された。
【0050】
1,4−ベンゾキサジン化合物の合成。化合物HSB−1−7、HSB−11、HSB−12、HSB−14、HSB−15、ASK−1、およびASK−2:適切なアルデヒド(15mmol)を適切に置換された2H−1,4−ベンゾキサジン−3(4H)−オン(10mmol)、無水酢酸(4mL)、およびトリエチルアミン(2mL)の混合物に加えた。反応混合物を7時間還流し、一晩室温で放置して、砕いた氷に注いだ。得た固体を濾過によって収集しアセトニトリルで洗浄した(70〜88%収率)。粗生成物をエタノールによる再結晶によって精製した。化合物ΗSB−8、ΗSB−11、HSB−12、HSB14−19、HSB−24、ASK−1、およびASK−2:適切なアルデヒド(15mmol)を適切に置換された2H−1,4−ベンゾキサジン−3(4H)−オン(10mmol)、無水酢酸(4mL)、およびトリエチルアミン(2mL)の混合物に加えた。反応混合物を7時間還流し、一晩室温で放置して、砕いた氷に注いだ。得た固体を濾過によって収集しアセトニトリルで洗浄した(70〜88%収率)。粗生成物をエタノールによる再結晶によって精製した。
【0051】
HSB−13:触媒量のラネーニッケルを少量ずつ攪拌しながら、エタノール(20mL)中のHSB−1(2mmol)およびヒドラジン水和物(1mL)の混合物に加えた。反応混合物を3時間還流し、次いで濾過した。濾液を減圧下で蒸発乾固させた。粗生成物をエタノールによる再結晶によって精製した(70%収率)。
【0052】
HSB−23、HSB−25、およびAsk−2a:これら化合物のそれぞれのエステル(HSB−2、HSB−24、およびASK−2)(1mmol)をメタノール(10mL)中、0℃で炭酸カリウム(3mmol)を用いて処理し、3時間室温で攪拌して、それぞれのアルコールHSB−23、HSB−25、およびASK−2aを得た(70〜75%収率)。
【0053】
HSB−22:ナトリウムメトキシドを一部分、無水DMF(10mL)中の2H−1,4−ベンゾキサジン−3(4H)−オン(10mmol)およびピロール−2−カルボキアルデヒド(16mmol)の混合物に加えた。反応混合物を48時間還流し、次いで室温まで冷却して、砕いた氷に注ぎ、一晩4℃で放置した。沈殿した固体を濾過によって収集し、水で洗浄して、乾燥させた。沈殿物をエタノール(150mL)とともに沸騰させて、不純物を除去するために熱いうちに濾過した。濾液を減圧下で蒸発乾固させて、移動相として(95:5)のトルエン:酢酸エチルを使用してシリカゲルカラム上で残渣をクロマトグラフィーにかけた(21%収率)。
【0054】
HSB−9およびHSB−10:ナトリウムメトキシドを一部分、無水DMF(10mL)中の2H−1,4−ベンゾキサジン−3(4H)−オン(10mmol)および4−ジメチルアミノベンズアルデヒド(16mmol)の混合物に加えた。反応混合物を一晩還流し、次いで室温まで冷却して砕いた氷に注ぎ、冷却装置内に一晩放置した。沈殿した固体を濾過によって収集し、水で洗浄し乾燥させた。粗生成物をそれぞれエタノールによる再結晶(30%収率)、およびDMFエタノールによる再結晶(40%収率)によって精製した(40%収率)。
【0055】
HSB−20およびHSB−21:ナトリウムメトキシドを一部分、無水DMF(10mL)中の2H−1,4−ベンゾキサジン−3(4H)−オン(10mmol)およびインドール−3−カルボキアルデヒド(16mmol)の混合物に加えた。反応混合物を24時間還流し、次いで室温まで冷却して砕いた氷に注ぎ、冷却装置内に一晩放置した。沈殿した固体を濾過によって収集し、水で洗浄し乾燥させた。粗生成物を(9:1)のトルエン:酢酸エチルを使用してシリカゲルカラム上でクロマトグラフィーにかけた(25〜30%収率)。
【0056】
ASK−8、ASK−9およびASK−11:無水ベンゼン(10mL)中、2H−1,4−ベンゾチアジン−3(4H)−チオン(2H-1, 4-benzothazin-3(4H)-thione)(2.7mmol)、適切なアルデヒド(3.3mmol)、および触媒量のピペリジンを含有する反応混合物を、90℃で4時間攪拌し、次いで室温まで冷却した。冷却中に沈殿した粗生成物を真空濾過によって収集し、ベンゼンで洗浄し、乾燥させて、酢酸エチル−ヘキサン(1:4容量/容量)を使用してシリカゲル上でカラム・クロマトグラフィーによって精製した(86〜90%収率)。
【0057】
【化5】

(Z)−2,6−ジブロモ−4−((3−オキソ−3,4−ジヒドロ−2Η−ベンゾ[b][l,4]オキサジン−2−イリデン)メチル)フェニルアセタート:(0.5g、3.35mmol)の2H−l,4−ベンゾキサジン−3(4H)−オン、1.4gの4−ヒドロキシ−3,5−ジブロモベンズアルデヒド、1.68mL(17.729mmol)の無水酢酸、および0.7mL(5mmol)のトリエチルアミンの撹拌混合物を7時間還流し、一晩室温で放置し、砕いた氷に注いだ。沈殿した固体を濾過によって収集し、アセトニトリルで洗浄した。粗生成物をDMF:エタノールによる再結晶によって精製した。
【0058】
実施例2.反応−2:(Z)−2−(3,5−ジブロモベンジリデン)−2H−ベンゾ[b][l,4]オキサジン−3(4H)−オン
【化6】

(Z)−2−(3,5−ジブロモベンジリデン)−2H−ベンゾ[b][l,4]オキサジン−3(4H)−オン。化学合成は、実施例1、反応−1の場合と同じであった。
【0059】
小脳顆粒ニューロンの培養および処理:顆粒ニューロン培養物を先に説明されたように生後6〜7日のウィスターラットの分離した小脳から得た(デメロら、1993年)。ポリ−L−リジン被覆24ウェル皿の中の、10%ウシ胎仔血清(FCS)、25mMのKCl、2mMのグルタミン(インビトロゲン)、および100μg/mLゲンタマイシンを補ったイーグルの基礎培地(BME)に、細胞を1×106細胞/皿の密度でプレーティングした。非ニューロン細胞の複製を防ぐために、プレーティングの18〜22時間後に、シトシンアラビノフラノシド(10μM)を培養培地に加えた。我々の研究室および他の研究者による先の免疫細胞化学的解析は、これらの培養物は95%を超える顆粒ニューロンを含有する高純度を有するということを示している(Thangniponら、2003年;キングズバリ(Kingsbury)ら、2005年)。
【0060】
ニューロン培養を処理前7〜8日間維持した。処理のために、細胞を一度すすぎ、次いで低K+培地中(無血清BME培地;LKと呼ぶ)、あるいは対照培養の場合、高K+培地中(20mMのKClを補った無血清BME培地;HKと呼ぶ)に維持した。処理のために、(ジメチルスルホキシド中に溶解した)化合物を、HKからの交換時に1μM、5μMまたは25μMの濃度でLK培地に直接加えた。4’,6’−ジアミジノ−2−フェニルインドールハイドロクロライド(DAPI)染色によって、生存能を24時間アッセイした(以下を参照のこと)。各化合物を(各々の濃度で)二つ組にして試験し、実験を少なくとも3回繰り返した。
【0061】
HK培地、LK培地、または、様々な化合物を補ったLK培地で処理したニューロン培養の生存能状態を、位相差顕微鏡検査で評価し、先に説明されたようなDAPIで細胞核を染色することによって定量化した(ヤルチン(Yalcin)ら、2003年;モリソン(Morrison)ら、2006年;Majzadehら、2007年)。簡潔に言えば、細胞を4%パラホルムアルデヒドに20分間4℃で固定した。リン酸緩衝食塩水中で洗浄した後、ジアミジノ−2−フェニルインドールハイドロクロライド(DAPI;リン酸緩衝食塩水中1μg/mL)を15分間室温で加えて、紫外線(260nm)下で見た。凝縮または断片化した核を有する細胞を死亡として評点を付けた。生存能をHK培地に交換した対照培養物のパーセントとして表した。独立両側スチューデントt検定を使用して統計的解析を行い、LK処理を受けた対照培養の平均ニューロン生存と比較した。
【0062】
マウスHT−22神経芽腫細胞株をATCC(米国バージニア州マナッサス)から購入し、10%FBS、100単位/mLのペニシリン、および、100μg/mLのストレプトマイシンを補った4.5g/Lのグルコース(ピルビン酸ナトリウムを含まない)を含むダルベッコ変法イーグル培地(DMEM)中で培養した。培養物をHCA処理のために〜30%集密でプレーティングした。HCAをpH7.5に調節した150mMの貯蔵液として作製し、最終濃度1.5mMで使用した。
【0063】
初代培養の皮質ニューロンを胎生期18日のラットから培養した。培養物を5uMの熟成Aβペプチド(Aβ25−35;シグマ−アルドリッチから購入した)で1〜2日後、処理した。ニューロン生存能を24時間後にアッセイした。
【0064】
ニューロン培養物のTUNELアッセイを、プロメガ(Promega)(ウィスコンシン州マディソン)からのDEADEND(商標)蛍光分析TUNELシステム(DEADEND(TM) Fluorometric TUNEL System)を製造業者の指示に従って使用して、培養物処理の24時間後に行った。活性型カスパーゼ3の免疫細胞化学的解析のために、ニューロン培養細胞を固定し5分間0.2%トリトンで処理した。30の間PBS中の5%BSAおよび5%ヤギ血清を含有するPBSでブロッキングした後、カバーガラスを一晩4℃で活性型カスパーゼ−3一次抗体とともにインキュベートした。リン酸緩衝食塩水(PBS)で3回洗浄した後、細胞を二次抗体と共に45分間25℃でインキュベートし、その後細胞をPBSで洗浄した。核を視覚化するために、細胞をDAPIで15分間25℃で染色した。
【0065】
培養培地を除去し、細胞を氷冷のリン酸緩衝食塩水(PBS)で2回洗浄し、溶解緩衝液中[1%トリトン、20mMのTris−HCl(pH7.5)、150mMのNaCl、1mMのNa2EDTA、1mMのEGTA、2.5mMのピロリン酸ナトリウム、1mMのβ−グリセロリン酸、1mMのNa3VO4、1μg/mLのロイペプチン、および、1プロテアーゼ阻害剤の混合物]に溶解した。ブラッドフォードタンパク質アッセイ試薬(米国カリフォルニア州ハーキュリーズのBio−Rad)を使用して、タンパク質濃度を測定し標準化した。標準化に続いて、40μgのタンパク質をウェスタンブロット法にかけた。高めた化学発光によって免疫反応性を検査した(米国ニュージャージー州ピスカタウェイのアマシャム・バイオサイエンス(Amersham Bioscience))。
【0066】
HSB−13(2mg/kg)を用いるか、または用いずに、3−NPを10回の腹腔内注射(50mg/kgを1日2回、5日間)で投与した生後8週のC57BL/6雄性マウス(マサチューセッツ州ウィルミントンのチャールズ・リバー・ラボラトリーズ社(Charles River Laboratories, Inc))に対して3−ニトロプロピオン酸投与および行動評価を行った。HSB−13の注射は、3−NP投与の30分前に行った。対照動物は生理食塩水注射を受けた。5日間の注射の後日、先に説明されたような(チンら、2004年;チェンら2008b年)TRU−SCAN(登録商標)活動監視システム(ペンシルベニア州のクールバーン・インストルメンツ(Coulborn Instruments))を使用して自発運動活性をアッセイした。以下の行動パラメータを選択した:(1)総運動時間、(2)総運動距離:床面における全てのベクトルX−Y座標変化の合計、(3)運動毎の平均距離、(4)平均速度:全てのX−T座標変化を定めた運動の平均速度。行動評価に続いて、マウスに深く麻酔をかけて脳を取り除いた。脳を0.1Mのリン酸緩衝液中の4%パラホルムアルデヒド内で固定し、0.1Mのリン酸緩衝液中の20%スクロース内で凍結保護した。冠状切片をクリオスタット上で40ミクロンに切断し、先に説明されたように(チンら、2004年;チェンら、2008b年)クレシルバイオレット(シグマ−アルドリッチ)で染色した。
【0067】
ヒトAPP695の発現を、UAS−APP695カセットを保有する遺伝子導入ハエ(フォスグリーン(Fossgreen)ら、1998年)を、UAS/GAL4システムを使用してアクチン−GAL4プロモーターを含むハエ(ブランド(Brand)およびペリモン(Perrimon)、1993年)と交雑させることによって遍在的に誘導した。ハエを、25℃の暗所で、異なる濃度のHSB−13(0μM、2.5μM、5μM、および50μM)を含有する10%酵母ペーストで飼養した。生存しているAPP695発現後代のパーセンテージを、それらを同一交雑種から得たプロモーターを含まないカセットを保有する、したがって先に説明された(グリーブ(Greeve)ら、2004年)のと全く同じ条件下で飼養した対照後代と比較することによって決定した。
【0068】
培養小脳顆粒ニューロンをHK培地からLK培地に交換すると、約50%の細胞が24時間以内にアポトーシスを起こした(デメロら、1993年)。本発明者は、この広く使用され認識されているモデルを利用して、LK誘導ニューロン死から保護する能力について、計20種類の異なる1,4−ベンゾキサジン誘導体を試験した。各化合物を3つの異なる投与量、すなわち1μM、5μMおよび25μMで試験し、生存能をDAPI染色によって定量化した。最も高い投与量は、化合物の潜在的な毒性効果について試験するために含めた。重要な結果は、アポトーシスの別の信頼性のあるアッセイである、TUNEL染色を使用して確証した(図1)。表1および図1に示すように、本発明は、重要な神経保護効果を有する幾つかの化合物を特定する。2つの最も保護性のある化合物は、HSB−13およびHSB−22であり、双方ともAr=3’,5’−ジブロモ−4’−ヒドロキシフェニルである(図1)。これらの化合物は、1μMで頑強な保護を提供し、保護はこの研究で使用されるより高い2つの投与量で維持される。高レベルの神経保護を示す別の化合物は、ASK−2aである(Ar=3’,5’−ジブロモ−4’−ヒドロキシフェニル)。この化合物による保護は、より低い2つの投与量でのHSB−13およびHSB−22で観察される保護よりも低い。HSB−4、HSB−9、ASK−8、およびASK−9を含む幾つかの化合物は、1μM投与量で、最大または最大に近い効力を示した。より高いレベルの保護を1μMよりも低い投与量で観察することができるかどうか調べるために、これらの化合物の分析を0.5μM、0.25μM、および0.1μMの投与量まで広げた。全ての場合で、保護は、これらの投与量において1μMで観察された保護よりも低かった。ゆえに、1,4−ベンゾキサジン化合物は、培養ニューロンをアポトーシスから保護した。
【0069】
化合物の構造、およびそれらが与える神経保護の程度に基づき、以下の結論を引き出すことができる:(a)ASK−2aと比較した場合にHSB−13およびHSB−22で幾分より高いレベルの保護が観察され、これは、6位に置換基がないことに関係しているかもしれない、(b)HSB−13およびHSB−22の4’−OHの重要性が、4’−OH基の代わりに4’−OAc基を有する(図2)ASK2による保護の減少、ならびに、3’,5’−ジブロモ(ASK−1)および3’,4’,5’−トリメトキシ(HSB−6)誘導体による神経保護の欠如によって、示される、(c)5μMで保護性であったHSB−7(ピリジン−2−イル)を例外として、複素環誘導体、すなわちHSB−11(チオフェン−2−イル)、HSB−12(チオフェン−3−イル)、HSB−4(チオフェン−3−イル)は不活性であった、そして(d)4’−OHから4’−OCOCH3エステルへの変換が入り混じった結果を与えた。例えば、化合物HSB−2(6−Cl)、HSB−5(6−F)およびHSB−3(6−メチル)は、25μMで高度に保護性であり、また、HSB−1(6−ニトロ)は、5μMで有効であったが他の2つの試験濃度では有効ではなかった。相対的に、4’−OH化合物である、HSB−13(6−NH2)、HSB−22(6−Cl)、およびASK−2a(6−H)は、3つ全ての濃度で有効であった。
【0070】
3−置換インドロンを用いた先の研究が、2位のC=OをC=Sで置換することは、神経保護活性を完全に破壊することを明らかにした(バルデラモスら、2008年)。しかしながら、本発明に含まれるベンゾキサジンの場合、ASK−9(ピロール−2−イルおよびN−Me)ならびにASK−11(2’,5’−ジメトキシフェニル)は、かなりのレベルの保護を示した。しかしながら、ASK−8(チオフェン−2−イル)は不活性であった。
【0071】
表1:21種の化合物の各々を3つの濃度(1μM、5μM、および25μM)で試験し、LK培地に加えた。生存を、HK培地を受けた対照培養における%生存で表す。データは、少なくとも3つの研究からの平均値を表し、それら研究の各々は、二つ組にして行われた。いかなる添加物も含まないLK培地において、平均生存は48%であった。
【化7】

【表1】

【表2】

【0072】
Raf−MEK−ERKおよびPI−3キナーゼ−Aktシグナル伝達は、多くの神経栄養ポリペプチド、薬理学的剤、および神経保護化合物の保護性効果を媒介する、哺乳動物細胞における2つのよく確立された強力な抗アポトーシス経路である(デメロおよびチン、2005年;ヘトマン(Hetman)ら、2006年)。これら経路のいずれも1,4−ベンゾキサジンの神経保護効果に関与するかどうかを決定するために、本発明者は、これらの経路の薬理学的阻害がそれらの神経保護性効力に影響を及ぼすかどうかを研究した。図3に示すように、構造的に異なるが高度に選択的な2つのMEK阻害剤である、PD98059もU0125も、HSB−13により神経保護性を減少しなかった。同様に、試験した化合物(PI−3キナーゼ阻害剤、ワートマニン、Akt阻害剤X、または、市販のAktの阻害剤)のいずれも、LK誘導アポトーシスに対してニューロンを保護するHSB−13の能力を減少しなかった(図3)。これらの研究で利用した投与量において、これらの阻害剤は、HK処理の結果生じるERKまたはAkt刺激を完全に阻害する。HSB−13で観察されたように、MEK−ERKおよびPI−3K−Akt経路の薬理学的阻害は、ASK−2aまたはHSB−22の神経保護作用に効果を及ぼさなかった。
【0073】
ウェスタンブロット解析を行って1,4−ベンゾキサジンによる神経保護がMEK−ERKまたはPI3キナーゼ−Aktシグナル伝達の活性化に関与しないことを確証した。MEK、ERK、およびAktの活性化は、それらのリン酸化を必要とし、リン酸化は、リン酸化部位特異的抗体を使用して検出することができる(チンら、2004年;ジョンソンら、2005年;Majdzadehら、2008年)。本発明者および他の者によって先に報告されたように(チンら、2004年;ジョンソンら、2005年;Majdzadehら、2008年)、MEKおよびERKのリン酸化は、小脳顆粒ニューロンのLK処理に続いて減少する。この減少は、HSB−13、HSB−22、またはASK−2aによって妨げられない(図4)。AktのSer473でのリン酸化はまた、LK処理の6時間後わずかに減少される(チンら、2004年;ジョンソンら、2005年;Majdzadehら、2008年)。このことも、ASK−2aまたはHSB−22を用いた処理による影響を受けない(図4)。しかしながら、HSB−13はLKにおいて見られるものよりもさらに多くのAkt(Ser473)リン酸化を阻害する。HSB−13と他の2つの神経保護化合物との間のリン酸化パターンの顕著な相違は、HSB−13がHSB−22およびASK−2aとは違ったようにシグナル伝達分子に影響を及ぼすということを示唆する。
【0074】
Raf−MEK−ERK経路およびPI−3キナーゼ−Akt経路は、HSB−13による神経保護に必要ではないので、ニューロン生存を促進することが知られている他のシグナル伝達分子の関与が決定された。GSK3βは、多くのニューロン系および非ニューロン系におけるアポトーシスの間に活性化されるアポトーシス促進分子である。生存促進条件下で、GSK3βを、Aktおよび他のキナーゼによって誘導されうる修飾である、阻害部位でのリン酸化によって不活性化された状態に保つ。図4に示すように、GSK3βの脱リン酸化は、HSB−13によって阻害されない。相対的に、HSB−22およびASK−2aはGSK3βの脱リン酸化を阻害する。
【0075】
小脳顆粒ニューロンのHKを用いた処理は、カルシウム−カルモジュリンキナーゼ(CaMK)を活性化し、KN−62などの薬理学的阻害剤を用いたCaMKの阻害は、HK媒介生存を阻害する(シー(See)ら、2001年;リスマン(Linseman)ら、2003年;モリソンら、2006年)。しかしながら、HSB−13による神経保護は、KN−62処理によって減少されない(図3)。本発明者は、幾人かの研究者がサイクリックAMP類似体およびプロテインキナーゼAの薬理学的活性化因子は、他の生存促進刺激がない場合に小脳顆粒ニューロンおよび他のニューロンタイプの生存を促進するということを示していることを認識した(ライデル(Rydel)およびグリーン(Greene)、1988年;デメロら、1993年;ハンソン(Hanson)ら、1998年)。PKA媒介ニューロン生存は、強力で選択的なPKA阻害剤である、H89を用いた処理によってブロッキングされる(リー(Li)ら、2000年;バーヴェ(Bhave)およびホフマン(Hoffman)、2004年)。図3に示すように、H89を用いた処理は、HSB−13媒介神経保護に影響を及ぼさない。本発明者は、トリコスタチンAなどのヒストンデアセチラーゼ阻害剤は、小脳顆粒ニューロンの生存を維持するHKの能力をブロッキングするということを先に報告している(サルミネン(Salminen)ら、1998年;Boutillierら、2002年;モリソンら、2006年)。しかしながら、TSA処理もまた、HSB−13の神経保護効力を著しく阻害するものではなかった(図3)。
【0076】
C−jun発現は、様々な組織培養、および、ニューロンアポトーシスの生体内範例において誘導される(シェンケル(Schenkel)ら、2004年)。この転写因子の活性化は、LK誘導小脳顆粒ニューロンにおけるニューロン死、ならびに他のモデルのニューロン死に必要であることが示されている(エスタス(Estus)ら、1994年;ハム(Ham)ら、1995年;ワトソン(Watson)ら、1998年)。図5に示すように、LKによるc−jun発現の誘導は、HSB−13、HSB−22、およびASK−2aによって阻害される。HSB−13を用いた処理は、c−jun発現を阻害し、それはHK処理培養で見られるものより低くさえある。発現がアポトーシスの間にニューロンにおいて刺激される別の転写因子は、CREBファミリータンパク質のメンバーである、ATF−3であり、これは、異なるモデルにおいてニューロン死を促進することが示されている(ハイ(Hai)ら、1999年;Vlugら、2005年;チェンら2008a年)。siRNAを使用したATF−3発現の抑制は、小脳顆粒ニューロンのLK媒介死を阻害し、このことは本発明者によって先に説明されている(チェンら、2008a年)。図5に示すように、ATF−3のLK媒介増加は、3つ全ての神経保護性ベンゾキサジンによって阻害される。c−junで観察されるように、この抑制は、HSB−13で最も頑強であった。結果として、これらの組成物は、c−junおよびATF−3の活性を阻害することができ、ひいてはガン、およびc−junのようなオンコプロテインを処置することにおいて役割を果たす。
【0077】
マウス神経芽腫HT−22細胞株のホモシステイン酸(HCA)を用いた処理は、グルタチオン欠乏および酸化ストレスを通してアポトーシスを誘導する(マーフィ(Murphy)ら、1990年;ラタン(Ratan)ら、1994a年、1994b年)。本発明者は、HSB−13、HSB−22、およびASK−2aが、この酸化ストレス誘導ニューロン死の範例において保護性であるかどうかを研究した。図6Aおよび図6Bに示すように、HSB−13は、HCA誘導細胞死を防ぐ。最も高い保護は、25μM濃度で観察されたが、HSB−13は、5μMでも頑強な保護をもたらした。驚くことに、それらの構造的類似性を鑑みて、ASK−2aおよびHSB−22は、検査された3つの投与量のいずれにおいても保護しなかった(データ示さず)。3つ全てのベンゾキサジンはLK媒介ニューロン死から保護するが、HSB−13のみがHCA誘導アポトーシスに対して保護性であるという研究結果は、これら2つの範例におけるアポトーシスの根底にある分子機構が異なるということを示唆する。さらに、この結果は、6位のアミノ基は(図2を参照のこと)HCA毒性に対する保護に必要であるということを示唆する。また我々は、HSB−13はAβ毒性に対して初代培養または皮脂ニューロンを保護するということ見出した。ゆえに、HSB−13は酸化ストレス誘導ニューロン死に対して保護性であるが、ASK−2aおよびHSB−22はそうではない。
【0078】
小脳顆粒ニューロン培養物、およびHT−22細胞は、HSB−13が組織培養範例において強力で多用途の神経保護効力を有するということを示した。げっ歯類およびヒト以外の霊長類におけるニトロプロピオン酸(3−NP)投与は、選択的線条体変性、自発舞踏病様運動、およびジストニー運動を含む、HDの臨床的および病態生理学的特徴の大部分を再現する。ゆえにこの神経毒の投与は、HDのための有用なモデルとして働く(Brouilletら、1999年)。本発明者は、この生体内範例においてHSB−13の効力を調査した。図7Aに示すように、3−NPを投与したマウスは、広範囲の線条体損傷を示した。この変性は、2mg/kg体重の濃度で投与された場合にHSB−13によって大幅に減少される(図7A)。3−NP誘導の線条体神経変性に対するHSB−13による保護は、自発運動遂行の著しい改善と相関した(図7B)。具体的には、全て3−NP投与によって損なわれた、総運動時間:総運動距離;運動ごとの平均距離、および、運動の平均速度は、HSB−13を受けた動物において顕著により高まり、HSB−13がハンチントン病(HD)の生体内モデルにおいて神経保護性であるということが証明された。
【0079】
本発明者はまた、遍在的にAPP695を発現するハエモデルを使用することによって、APP誘導毒性に対するHSB−13の有益な効果を研究した(グリーブら、2004年)。図8に示すように、無処置のハエは、APP695を発現しない同一条件下で飼養された対照ハエと比較して、たった約5%の生存率しか示さない。増加した濃度のHSB−13を含有する餌でこれらのハエを飼養することによって結果として、APP発現ハエの生存率において、等しく処置された対照ハエと比較して、50μMでの65%から50μMでの44%までの範囲と、著しく増加した。これらの生存率は、無処置ハエと比較してほぼ10倍高く(全てのp値<0.05)、このことは、HSB−13はまた、ショウジョウバエ生体内モデルにおいてAPP誘導毒性から保護するということを示す。
【0080】
ゆえに本発明は、小脳顆粒ニューロンのLK誘導アポトーシスに対して保護性である幾つかの新規の化合物を説明する。本発明の焦点は、3つのこれら化合物、つまりHSB−13、HSB−22、およびASK−2aであった。構造的に類似しているが、これらの化合物のうちの1つである、HSB−13だけが、海馬の神経芽腫HT22細胞のHCA誘導毒性に対して保護性である。ASK−2aおよびHSB−22は、一次顆粒ニューロンにおいて優れた神経保護を提供し、このことは、ASK−2aおよびHSB−22は、酸化ストレスが決定的な要素でないニューロン死の他の範例において効果的であり得るということを示唆する。LKおよびHCA誘導細胞死に加えて、HSB−13は、Aβ誘導毒性およびHCA毒性に対して一次皮質ニューロンを保護する。HSB−13の増加した多用途性は、単一置換基、すなわち6位のアミノ基の存在に起因すると考えられる。
【0081】
本明細書で提供されているデータは、HSB−13はまた、2つの別個の神経変性生体内モデルにおいて保護性であるということも証明している。実際、HSB−13は線条体変性を減少し、化学的に誘導されたハンチントン病のマウスモデルにおいて行動遂行を改善し、ハエにおいてAPP毒性から保護する。組織培養、および神経変性の生体内範例におけるHSB−13の有効性は、HSB−13またはその誘導体が、ヒト神経変性状態の治療における治療薬としての価値を有することができるということを示唆する。
【0082】
本発明者による研究は、PI−3キナーゼ−AktおよびRaf−MEK−ERKシグナル伝達経路、または、CaMK、PKAおよびHDACなどのHK媒介ニューロン生存に関与する他の分子が、これら化合物の保護する能力に関与しないということを示唆し、異なる作用機構を示唆する。しかしながら、これらの研究は、これらの化合物がATF−3およびc−junの活性化を阻害するが、このことが媒介される上流機構はまだ詳細に説明されないでいるということを示している。HCA誘導毒性から保護するその能力について観察したように、シグナル伝達分子のうちの幾つかにおけるHSB−13の効果は、HSB−22またはAsk−2a処理によって誘発された効果とは質的に異なる。例えば、ATF−3およびc−junの抑制は、HSB−22およびASK−2aで見られるものと比較して、HSB−13でははるかにより頑強である。HSB−13はまた、AktのSer473のリン酸化を阻害する唯一の化合物である。そしてGSK3活性化の程度は、その脱リン酸化によって判断すると、HSB−22およびASK−2aよりもHSB−13でより高まる。これらの相違点の幾つかは、何故HSB−13がHCA誘導毒性に対して保護性であるのに、HSB−22またはASK−2aはそうではないのかを説明することを可能にし得る。
【0083】
本発明の化合物の作用機構をより良く理解するために、限定目的ではなく、20種の異なるキナーゼに対するHSB−13およびASK−2aの効果を生体外で調べた。この研究の結果は、表2および表3に提示されている。500nM濃度で、ASK−2aは、GSK3α、GSK3β、p38α、p38β、JNK3、MLK3、および、B−Rafのキナーゼ活性を実質的に阻害した。上述のキナーゼを阻害することに加えて、HSB−13は、500nMで使用された場合、CDK1、CDK2、CDK5、および、ROCK1をも阻害した。双方の化合物とも、p38βに対して最も強力な阻害を示した。上記で説明したように、ASK−2aは、LK誘導死に対して小脳顆粒ニューロンを保護するが、HT−22細胞のHCA誘導毒性に対して無効性である。対照的に、HSB−13は、双方の範例において保護性である。これは、HCA処理HT−22培養におけるHSB−13の保護効果が、CDKへのその阻害効果に起因するということを示す。先の研究が、CDK阻害剤は多くの異なるアポトーシス刺激に対してニューロンを保護することができるということを確立している。
【0084】
100nMでHSB−13は、GSK3α、GSK3β、p38β、および、B−Rafを阻害することにおいて、相当により選択的である。強力な神経保護効果を有する3置換インドロンである、GW5074も、B−Rafを阻害する。GW5074はGSK3βを弱く阻害するが、B−Rafが構造的に異なる神経保護化合物によって阻害されるという研究結果は、このキナーゼの阻害を、神経保護の根底にある分子機構における重要事象として関係づける。
【0085】
表2:生体外で測定した20種の異なるキナーゼに対する500nMのASK−2aの効果。キナーゼ活性を(ASK−2aを用いない)対照アッセイにおける活性のパーセンテージとして表す。値は、二つ組にして行ったアッセイの平均である。キナーゼ活性の実質的な阻害(>20%)は、太字になっている。
【0086】
表2:生体外で測定した20種の異なるキナーゼに対する100nMおよび500nMのASK−2aの効果。
【表3】

【0087】
各キナーゼの活性を100nMまたは500nMいずれかのASK−2aの存在下、生体外で測定した。キナーゼ活性は、(ASK−2aを用いない)対照アッセイにおける活性のパーセンテージとして表す。値は、二つ組にして行ったアッセイの平均である。キナーゼ活性の実質的な阻害(>20%)は、太字になっている。
【0088】
HSB−13により、GSK3α、GSK3β、p38β、および、B−Rafは効果的に阻害されるということが見出された(100nM濃度で)。また、CDK1、CDK2、ROCK1、JNK2、MLK3、および、c−Rafも阻害された(これら全ては500nMで阻害される)。ASK2aを使用して、GSK3α、GSK3β、p38α、p38β、JNK3、および、B−Rafは効果的に阻害されるが(100nMで)、MLK3はより低い効率で阻害されるということが見出された。したがって、1,4−ベンゾキサジンの標的であるキナーゼは、GSK3α、GSK3β、p38α、p38β、B−Raf、CDK1、CDK2、JNK2、JNK3、および、MLK3を含む。
【0089】
表3:生体外で測定した20種の異なるキナーゼに対する500nMのHSB−13の効果。キナーゼ活性を(HSB−13を用いない)対照アッセイにおける活性のパーセンテージとして表す。値は、二つ組にして行ったアッセイの平均である。キナーゼ活性の実質的な阻害(>20%)は、太字になっている。
【0090】
表3:生体外で測定した20種の異なるキナーゼに対する100nMおよび500nMのHSB−13の効果。
【表4】

1,4−ベンゾキサジン化合物は、アポトーシスから培養ニューロンを保護するということを見出した。培養小脳顆粒ニューロンがLK培地に交換されると、約50%の細胞が24時間以内にアポトーシスを起こす。この研究では、図1に示された構造の合計20種の異なる1,4−ベンゾキサジン誘導体を、小脳顆粒ニューロンのLK誘導死から保護するそれらの能力について試験した。各化合物を3つの異なる投与量、すなわち1μM、5μM、および、25μMで試験した。ニューロン生存能を、アポトーシス細胞死の一般的で信頼性のあるアッセイである、DAPI染色によって定量化した。ニューロン死に対する効果の結果を表4にまとめた。幾つかの場合において、DAPI染色から得た結果を、2つの他のアポトーシスアッセイ、すなわちTUNEL染色および活性型カスパーゼ−3免疫細胞化学によって確証した。
【0091】
【表5】

【0092】
表4は、20種の化合物を提供しており、それら各々が3つの濃度(1μM、5μM、および25μM)で試験されLK培地に加えられた。生存を、HK培地を受けた対照培養における生存の%で表す。データは少なくとも3回の実験からの平均値を表し、その実験の各々は二つ組にして行われた。いかなる添加物も含まないLK培地において、平均生存は48.16±8.44%であった。化合物は、表4に記載された置換を伴う以下に記載された基本構造を有した。
【化8】

【0093】
詳細な構造活性相関は行わなかったが、20種の化合物の我々の分析は、以下のことを示唆する。(1)親化合物(コア構造については表4を参照のこと)、最も有効な神経保護化合物はASK−2(Ar=3,5−ジブロモ−4−ヒドロキシフェニル)である。表4に示すように、ASK−2は25μMおよび5μMで高度に保護的であるが(それぞれ102.5%および92.1%)、1μLでは中程度に保護的なだけである(80.3%)。4−OHの重要性は、3,5−ジブロモ(ASK−1)、および3,4,5−トリメトキシ(HSB−6)誘導体による神経保護の欠如によって示される。5μMで中程度に活性(88%)であったHSB−7(ピリジル−3−イル)を例外として、親複素環誘導体、すなわちASK−9(チオフェン−2−イル)、HSB−4(チオフェン−3−イル)は不活性であった。(2)ASK−2の6位をアミノ基または塩素原子で置換することにより[HSB−13またはHSB−22]、ある特定濃度で改善した活性がもたらされる。例えば、HSB−22は、全ての濃度で高度に保護的であり、すなわち1μM、5μM、および、25μMで、それぞれ92%、97%、および、90.6%である。化合物HSB−13は、5μMのASK−2(92.2)よりもかなり有効であり(100.8%)、25μMのASK−2(102.5)とほぼ同じくらい有効(99.5)であった。(3)表題の化合物の神経保護能力への7位での置換は、6−置換と比較した場合はるかに不明白である。たった1つの濃度のみが高度に有効である。例えば、化合物HSB−2(7−Cl)、HSB−5(7−F)、およびHSB−(7−メチル)は、25μMの溶液において高度に保護性であり(〜97%)、HSB−1(7−ニトロ)は、5μMで有効であった。4つ全てが、他の2つの試験溶液において有効というわけではなかった。(4)C=OのC=Sによる置換は入り混じった結果を与えた。この研究では、ASK−9(ピロール−2−イルおよびN−Me)は1μMで中程度の活性(84.5%)であり、ASK−11(2,5−ジメトキシフェニル)は、5μMで高度に活性(90.7%)であった。しかしながら、ASK−8(チオフェン−2−イル)は不活性であった。
【0094】
培養小脳顆粒ニューロンの分析により、HSB−13は強力な神経保護効力を有するものとして特定された。したがって、我々はHSB−13を選択して、その保護効果が他のニューロンタイプおよびアポトーシス刺激にまで及ぶかどうかを調べた。海馬由来神経芽腫細胞株であるHT−22をホモシステイン酸(HCA)で処理することは、アポトーシスを導くグルタチオン欠乏に起因する酸化ストレスを引き起こす(マーフィら、1990年;ラタンら、1994a年、1994b年)。図9に示すように、2mMのHCAでの処理は、24時間でほぼ完全な細胞死をもたらし、これは25uM濃度のHSB−13によって妨げられた。HSB−13はこの範例において5uMで使用された場合は保護性ではなかった。
【0095】
HSB−13は、ハンチントン病(HD)の生体内モデルにおいて神経保護性である。げっ歯類およびヒト以外の霊長類におけるニトロプロピオン酸(3−NP)投与は、選択的線条体変性、自発舞踏病様運動、およびジストニー運動を含む、HDの臨床的および病態生理学的特徴の大部分を再現する。ゆえにこの神経毒の投与は、HDのための有用なモデルとして働く(Brouilletら、1999年に概説されている)。HSB−13の効力が決定された。図10Aに示すように、S−NPを投与したマウスは、広範囲の両側線条体損傷を示す。この変性は、2.5mg/kg体重の濃度で投与された場合にHSB−13によって大幅に減少される(図10)。3−NP誘導の線条体神経変性に対するHSB−13による保護は、自発運動遂行の著しい改善と相関した。具体的には、全て3−NP投与によって損なわれた、全運動エピソード、総運動距離、および、運動の平均速度は、HSB−13を受けた動物において顕著により高まった(図10B)。
【0096】
3−ニトロプロピオン酸投与および行動評価。生後8週のC57BL/6雄性マウス(マサチューセッツ州ウィルミントンのチャールズ・リバー・ラボラトリーズ社)に、HSB−13(92.5mg/kg)を用いるか、または用いずに、10回の腹腔内注射(50mg/kgを1日2回、5日間)で3−NPを投与した。HSB−13の注射は、3−NP投与の30分前までに行った。対照動物は生理食塩水注射を受けた。5日間の注射の後日、先に説明されたように(チンら、2004年)TRU−SCAN(登録商標)活動監視システム(ペンシルベニア州のクールバーン・インストルメンツ)を使用して自発運動活性をアッセイした。以下の行動パラメータを選択した:(i)全運動エピソード:床面における各運動とは、少なくとも1つのサンプル間隔の間で静止状態がない一連の座標変化である、(2)総運動距離:床面における全てのベクトルX−Y座標変化の合計、および、(3)平均速度:全てのX−T座標変化を定めた運動の平均速度。行動評価に続いて、マウスに深く麻酔をかけて脳を取り除いた。脳を0.1Mのリン酸緩衝液中の4%パラホルムアルデヒド内で固定し、0.1Mのリン酸緩衝液中の20%スクロース内で凍結保護した。冠状切片をクリオスタット上で50ミクロンに切断し、クレシルバイオレット(シグマ)で染色した。
【0097】
本発明は、神経保護剤としての1,4ベンゾキサジンの初めての実証であり、このクラスの化合物がヒト神経変性障害の治療のための新規治療薬になるという素晴しい可能性をもたらす。
【0098】
細胞のc−Rafおよび/またはB−Raf活性に対する化合物の効果の評価。c−RafまたはB−Rafの活性を、細胞溶解物による免疫沈降に続いて評価する。簡潔に言えば、約250μgのタンパク質を、(c−RafまたはB−Rafのいずれかに対する)1.0μgの一次抗体、および、12μLのタンパク質A/Gプラス・アガロースビーズとともに一晩インキュベートする。免疫沈降物を30秒間6000rpmで遠心分離することによって収集し、溶解緩衝液で2回、350mMのNaClを補った溶解緩衝液で2回、そしてキナーゼ緩衝液(25mMのpH7.4のHEPES、および、10mMのMgCl2)で2回、洗浄する。精製した組換えGST−MEK1 K97Mタンパク質を基質として、85μMのATPを補ったキナーゼ緩衝液に35分間30℃で加える。生体外キナーゼアッセイのために、化合物をキナーゼ緩衝液に加え、ATP添加によるキナーゼ反応が始まる前に、30℃で5分間インキュベートする。キナーゼ反応を6×SDSサンプル緩衝液の添加によって停止し、5分間沸騰させる。タンパク質をSDS−PAGEによって分離し、ウェスタンブロット法にかける。キナーゼ活性のレベルを、ウェスタンブロット法にしたがい、リン酸−MEK抗体により検出する。
【0099】
昆虫細胞から精製した化合物c−RafおよびB−Rafの効果。生体外キナーゼアッセイを、アップステイト・バイオテクノロジー(Upstate Biotechnology)のキナーゼ・プロファイリング・サービス(Kinase
Profiling service)を使用して、標準条件下で、精製キナーゼ(Sf9昆虫細胞のバキュロウイルスによって発現される)、および、合成基質を使用して行った。簡潔に言えば、各アッセイについて、5〜10mUの精製キナーゼを、8mMのpH7.2のMOPS、0.2mMのEDTA、10mMの酢酸マグネシウム、および、[γ−33P−ATP]を含有する緩衝液中の化合物(0.1〜1uM濃度)と共に40分間室温でインキュベートする。MBPを基質として使用する。キナーゼ活性は、33Pの取り込みを、P30フィルター上に一定分量を付け、50mMのリン酸中で洗浄してシンチレーション計数することによる測定によって定量化する。
【0100】
幾つかの場合、c−RafおよびB−Rafへの効果を、以下のようにSignalChemによってアッセイする。プロテインキナーゼアッセイを(二つ組または三つ組で)、周囲温度で20〜40分間、25μLの最終容量で行った。アッセイを33P−ATPの添加によって開始し、反応混合物を周囲温度でプロテインキナーゼ標的に応じて20〜40分間インキュベートした。インキュベーション期間の後、10μLの反応混合物をマルチスクリーン・ホスホセルロースP81プレート上に置くことによってアッセイを終了した。マルチスクリーン・ホスホセルロースP81プレートを1%リン酸溶液中でそれぞれ約15分間3回洗浄した。
【0101】
P81プレート上の放射能をTriluxシンチレーションカウンター内でシンチレーション流体の存在下で計数した。適切な基質の添加を除いて、ブランク対照を全てのアッセイ要素に含め(同量のアッセイ希釈緩衝液で置き換える)、各プロテインキナーゼ標的に対して据えた。各プロテインキナーゼ標的に対する修正した活性を、ブランク対照値を除くことによって決定した。
【0102】
本明細書において論じられた任意の実施形態は、本発明の任意の方法、キット、試薬、または組成物に関して実施されうる、あるいはその逆についても同様であることが企図されている。さらに、本発明の組成物は、本発明の方法を達成するために使用されうる。
【0103】
本明細書において説明された特定の実施形態は、例示目的で示されており、本発明の限定として示されているのではないことは理解されるであろう。本発明の主要な特徴は、本発明の範囲から逸脱することなく様々な実施形態において利用されうる。当業者は、本明細書において説明された具体的な手順に対する多数の同等物を認識する、あるいは、単なる日常の実験を使用して、それらを確認することができるであろう。そのような同等物は、本発明の範囲内にあると見なされ、特許請求の範囲によって含まれる。
【0104】
本明細書において言及された全ての刊行物および特許出願は、本発明が属する技術分野の通常の技術者の技術レベルを示す。全ての刊行物および特許出願は、個々の各刊行物または特許出願が具体的に個々に示されて参照により組み込まれたかのような程度に、参照によって本明細書において組み込まれる。
【0105】
語「a」または「an」の使用は、特許請求の範囲および/または明細書において用語「含む(comprising)」と関連して使用される場合、「1つ」を意味することができるが、「1以上」、「少なくとも1つ」、および、「1または2以上」の意味とも一致する。特許請求の範囲において用語「または」の使用は、二者択一のみに言及するか、またはその二者択一は相互に排他的であるように明らかに指示されていない限り「および/または」を意味するように使用されるが、本開示は、二者択一ならびに「および/または」のみに言及する定義を支持する。本出願の全体にわたって、用語「約」が、値が装置の誤差による固有の変動、この値を決定するために利用される方法、または、研究対象の中に存在する変動を含むことを示すために使用される。
【0106】
本明細書および請求項に使用されるように、語「含む(comprising)」(およびcomprisingの任意の形態、例えば「comprise」および「comprises」など)、語「有する(having)」(およびhavingの任意の形態、例えば「have」および「has」など)、語「含む(including)」(およびincludingの任意の形態、例えば「includes」および「include」など)、あるいは、語「含有する(containing)」(およびcontainingの任意の形態、例えば「contains」および「contain」など)は包含的であり、すなわち制限がなく、追加の列挙されていない要素または方法ステップを排除するものではない。
【0107】
本明細書において使用される用語「またはその組み合わせ」は、この語の前に列挙されている項目の全ての並べ替えおよび組み合わせを指す。例えば、「A、B、C、またはその組み合わせ」は、A、B、C、AB、AC、BCもしくはABC、また特定の文脈で順番が重要な場合には、BA、CA、CB、CBA、BCA、ACB、BACもしくはCAB:のうちの少なくとも1つを含むように意図される。この例を続けると、1以上の項目もしくは用語の繰り返しを含む組み合わせ、例えばBB、AAA、MB、BBC、AAABCCCC、CBBAAA、CABABBなどがはっきりと含まれる。当業者は、典型的には、文脈から特に明らかでない限り、項目または任意の組み合わせの項目の数に制限はないということを理解するであろう。
【0108】
本明細書において開示され主張された組成物および/または方法の全ては、本開示を考慮すると過度な実験をすることなく作製され遂行されうる。本発明の組成物および方法は、好ましい実施形態によって説明されたが、変動が、組成物および/または方法に、ならびに、本明細書において説明された方法のステップもしくはステップのシーケンスにおいて、本発明の概念、精神および範囲から逸脱することなく、適用されうるということが当業者には明らかであろう。当業者にとって明らかなそのような類似の置換および修正の全ては、添付の特許請求の範囲によって定められる本明細書の精神、範囲および概念の範囲内にあると考えられる。
【0109】
〔参照〕
バルデラモス(Balderamos M)M、アンカチ(Ankati)H、アクバチニ(Akubathini)SK、パテル(Patel)AV、カミラ(Kamila)S、Mukherjee C、ワング(Wang)L、Biehl ER、デメロ(D'Mello)SR。(2008年)有効な神経保護剤としての3−置換インドリン−2−オンの合成および構造活性相関研究(Synthesis and Structure-Activity Relationship Studies of
3-Substituted Indolin-2-ones as Effective Neuroprotective Agents)。エクスペリメンタル・バイオロジー・アンド・メディスン(Exp Biol Med.)233:1395〜1402。
バーヴェ(Bhave)SV、ホフマン(Hoffman)PL。(2004年)ホスファチジルイノシトール3’−OHキナーゼおよびプロテインキナーゼA経路は、培養小脳顆粒ニューロンにおいて下垂体アデニリルシクラーゼ活性化ポリペプチドの抗アポトーシス効果を媒介する:エタノールによる調整(Phosphatidylinositol 3'-OH kinase and protein kinase A pathways
mediate the anti-apoptotic effect of pituitary adenylyl cyclase-activating
polypeptide in cultured cerebellar granule neurons: modulation by ethanol)。ジャーナル・オブ・ニューロケミストリー(J Neurochem.)88:359〜369。
ブランド(Brand)AHおよびペリモン(Perrimon)N、(1993年)細胞運命を変更し優性表現型を生成する手段としての標的遺伝子発現(Targeted gene expression as a means of altering cell fates and
generating dominant phenotypes)。ディベロップメント(Development)(英国ケンブリッジ)118:401〜415。
Boutillier,A.L.、E.Trinh、および、J.P.レフラー(Loeffler)(2002年)HDACタンパク質によるE2F1転写活性の構成的抑制は、ニューロン生存に必須である(Constitutive repression of E2F1 transcriptional activity through
HDAC proteins is essential for neuronal survival)。アナルズ・オブ・ザ・ニューヨークアカデミー・オブ・サイエンシス(Ann. N. Y. Acad. Sci.)973:438〜442。
チェン(Chen)HM、ワング(Wang)L、デメロ(D'Mello)SR。(2008a年)B−RafによるATF−3発現の阻害は、GW5074の神経保護作用を媒介する(Inhibition of ATF-3 expression by B -Raf mediates the
neuroprotective action of GW5074)。ジャーナル・オブ・ニューロケミストリー。2008年5月;105:1300〜1312。
チェン(Chen)H−C、ワング(Wang)L、デメロ(D'Mello)SR。(2008b年)市販で一般的に使用されるPKRの化学阻害剤は、サイクリン依存キナーゼを阻害することによってニューロンを保護する(A commercially available and commonly used chemical inhibitor of PKR
protects neurons by inhibiting cyclin-dependent kinase)ヨーロピアン・ジャーナル・オブ・ニューロサイエンス(Eur. J. Neurosci)(近刊)。
チン(Chin)PC、リュー(Liu)L、モリソン(Morrison)B、Bottiglieri T、ラタン(Ratan)RR、デメロ(D'Mello)SR。(2004年)c−Raf阻害剤GW5074は、MEK−ERKおよびAkt非依存性機構による神経変性の生体外および動物モデルにおいて神経保護を提供する(The c-Raf inhibitor GW5074 provides neuroprotection in vitro and in
an animal model of neurodegeneration through a MEK-ERK and Akt-independent
mechanism)。ジャーナル・オブ・ニューロケミストリー。90:595〜608。
デメロSR、ガルリ(Galli)C、カリサーノ(Calissano)P。(1993年)細胞外カリウムの減少による小脳顆粒ニューロンにおけるアポトーシス誘導:IGF−IおよびサイクリックAMPによる死の阻害(Induction of Apoptosis in Cerebellar Granule Neurons by Lowering of
Extracellular Potassiium : Inhibition of Death by IGF-I and cyclic AMP)。米国科学アカデミー紀要(Proc. Natl. Acad. Sci.)(米国)90:10989〜10993。
デメロSR、チンPC。(2005年)ニューロンアポトーシスの理解による神経変性状態の治療(Treating neurodegenerative conditions through the understanding of
neuronal apoptosis)。カレント・ドラッグ・ターゲッツ・CNS・アンド・ニューロロジカル・ディスオーダース(Curr Drug Targets CNS Neural Disord.)4:3〜23。
エスタス(Estus)S.、ザックス(Zaks)W.J.、フリーマン(Freeman)R.S.、グルダ(Gruda)M.、ブラボ(Bravo)R.、および、ジョンソン(Johnson)E.M.ジュニア(1994年)プログラムされた細胞死の間のニューロンにおける変化した遺伝子発現:ニューロンアポトーシスの必要に応じたc−junの識別(Altered gene expression in neurons during programmed cell death:
identification of c-jun as necessary for neuronal apoptosis)。ザ・ジャーナル・オブ・セル・バイオロジー127(J Cell Biol 127)、1717〜1727。
フォスグリーン(Fossgreen)A、ブルックナー(Bruckner)B、チェック(Czech)C、マスターズ(Masters)CL、Beyreuther Kら、(1998年)ヒトアミロイド前駆体タンパク質を発現する遺伝子導入ショウジョウバエは、γセクレターゼ活性および疱疹翼表現型を示す(Transgenic Drosophila expressing human amyloid precursor protein
show gamma-secretase activity and a blistered-wing phenotype)。米国科学アカデミー紀要95:13703〜13708。
グリーブ(Greeve)I、クレッチュマー(Kretzschmar)D、Tschape JA、Beyn A、Brellinger Cら、(2004年)遺伝子導入ショウジョウバエにおける年齢依存性神経変性およびアルツハイマーアミロイド斑形成(Age-dependent neurodegeneration and Alzheimer-amyloid plaque
formation in transgenic Drosophila)。ザ・ジャーナル・オブ・ニューロサイエンス(J Neurosci)24:3899〜3906。
ハイ(Hai)T.、ウルフガング(Wolfgang)C.D.、マーシー(Marsee)D.K.、アレン(Allen)A.E.、および、Sivaprasad U.(1999年)ATF3およびストレス反応(ATF3 and stress responses)。ジーン・エクスプッション7(Gene
Expr 7)、321〜335。
ハム(Ham)J.、Babij C、ホイットフィールド(Whitfield)J.、Pfarr C.M.、ルラルマン(Lallemand)D.、Yaniv M.、および、ルビン(Rubin)L.L.(1995年)c−Junドミナントネガティブ変異体は、プログラムされた細胞死から交感神経細胞を保護する(A c- Jun dominant negative mutant protects sympathetic neurons
against programmed cell death)。ニューロン14(Neuron 14)、927−939。
ハンソン(Hanson),M G,ジュニア;シェン(Shen),S;Wiemelt,A P;マクモリス(McMorris),F A;Barres,B A。(1998年)サイクリックAMP上昇は、生体外において脊髄運動ニューロンの生存を促進するのに十分である(Cyclic AMP elevation is sufficient to promote the survival of spinal
motor neurons in vitro)。ザ・ジャーナル・オブ・ニューロサイエンス。18:7361〜7371。
ヘトマン(Hetman)M、Kharebava G.(2006年)NMDA受容体によって活性化された生存シグナル伝達経路(Survival signaling pathways activated by NMDA receptors)。カレント・トピックス・イン・メディシナル・ケミストリー(Curr Top Med Chem.)6:787〜799。
ジョンソン(Johnson)K、リューL、Majdzadeh N、チャベス(Chavez)C、チンPC、モリソンB、ワングL、パークJ、Chugh P、チェンHM、デメロSR。(2005年)サイクリン依存性キナーゼ阻害剤GW8510によるニューロンアポトーシス阻害:神経保護剤の開発のためのスカフォールドとしての3’置換インドロンの識別(Inhibition of neuronal apoptosis by the cyclin-dependent kinase
inhibitor GW8510: identification of 3' substituted indolones as a scaffold for
the development of neuroprotective drugs)。ジャーナル・オブ・ニューロケミストリー。93:538〜548。
キングズバリ(Kingsbury)AE、ガロ(Gallo)V、ウッダムス(Woodhams)PL、バラージュ(Balazs)R。(1985年)化学的に定義された血清添加の培地で培養された小脳介在ニューロンの生存、形態、および接着特性(Survival, morphology and adhesion properties of cerebellar
interneurones cultured in chemically defined and serum-supplemented medium)。ブレイン・リサーチ(Brain Res.)349:17〜25。
レビ(Levi),G.、アロイシ(Aloisi),F.、チオッティ(Ciotti),M.T.、Thangnipon,W.、キングズバリ(Kingsburry),A.、および、バラージュ(Balazs),R.、98%純粋小脳顆粒細胞培養の調製(Preparation of
98% pure cerebellar granule cell cultures)(1989年)A.シャハル(Shahar),J.ヴェリス(Vellis)、およびB.A.ハブ(Habu)(編集)、神経系の切開および組織培養マニュアル(Dissection and
Tissue Culture Manual of the Nervous system)、アランR.リス(Alan
R. Liss)、ニューヨーク、211〜214ページ。
リーM、ワングX、メインツァー(Meintzer)MK、レッシグ(Laessig)T、バーンバウム(Birnbaum)MJ、ハイデンリッヒ(Heidenreich)KA。(2000年)サイクリックAMPは、グリコーゲン合成酵素キナーゼ3βのリン酸化によりニューロン生存を促進する(Cyclic AMP promotes neuronal survival by phosphorylation of glycogen
synthase kinase 3beta)。モレキュラー・セル・バイオロジー(Mol Cell Biol.)20:9356〜9363。
リスマン(Linseman)DA、バートリー(Bartley)CM、レー(Le)SS、レッシグTA、ブシャール(Bouchard)RJ、メインツァーMK、リーM、ハイデンリッヒKA。(2003年)内在性Ca(2+)による筋細胞エンハンサー因子−2リプレッサーヒストンデアセチラーゼ−5の不活性化//カルモジュリン依存性キナーゼIIは、脱分極媒介の小脳顆粒ニューロン生存を促進する(Inactivation of the myocyte enhancer factor-2 repressor histone
deacetylase-5 by endogenous Ca(2+) //calmodulin-dependent kinase II promotes
depolarization-mediated cerebellar granule neuron survival)。ザ・ジャーナル・オブ・バイオロジカル・ケミストリー(J Biol Chem.)278:41472〜41481。
Majdzadeh N、ワングL、モリソンBE、バッセル−デュビー(Bassel-Duby)R、オルソン(Olson)EN、デメロSR。(2008年)HDAC4は、細胞周期進行を阻害し、ニューロンを細胞死から保護する(HDAC4 inhibits cell-cycle progression and protects neurons from cell
death)。ディベロップメンタル・ニューロバイオロジー(Dev Neurobiol.)68:1076〜1092。
モロゾワ(Morozova)N、Khrapko K、パニー(Panee)J、リューW、ハーニー(Harney)JWら。(2007年)海馬細胞におけるグルタチオン欠乏は、HおよびLフェリチン、ならびにグルタチオンS−トランスフェラーゼmRNAのレベルを上昇させる(Glutathione depletion in hippocampal cells increases levels of H and
L ferritin and glutathione S-transferase mRNAs)。ジーンズ・トゥ・セルズ(Genes Cells)12: 561〜567。
モリソンBE、Majdzadeh N、チャン(Zhang)X、ライルス(Lyles)L、バッセル−デュビーR、オルソンEN、デメロSR(2006年)ヒストンデアセチラーゼ関連タンパク質による神経保護(Neuroprotection by histone deacetylase-related protein)。モレキュラー・セル・バイオロジー。26:3550〜3564。
マーフィ(Murphy),T.H.、シュナール(Schnaar),R.L.およびコイル(Coyle),J.T.(1990年)未熟皮質ニューロンは、シスチン取り込みの阻害によるグルタミン酸毒性に対して一意的に感受性がある。(Immature cortical neurons are uniquely sensitive to glutamate
toxicity by inhibition of cystine uptake)。ザ・FASEB・ジャーナル(Faseb J),4、1624〜1633。
ラタン(Ratan),R.R.、マーフィ,T.H.、および、バラバン(Baraban),J.M.(1994a年)巨大分子合成阻害剤は、システインをタンパク質合成からグルタチオンへそらすことによって胚皮質ニューロンにおける酸化ストレス誘導アポトーシスを防ぐ(Macromolecular synthesis inhibitors prevent oxidative stress-induced
apoptosis in embryonic cortical neurons by shunting cysteine from protein
synthesis to glutathione)。ザ・ジャーナル・オブ・ニューロサイエンス,14、4385〜4392。
ラタン,R.R.、マーフィ,T.H.、および、バラバン,J.M.(1994b年)酸化ストレスは、胚皮質ニューロンにおいてアポトーシスを誘導する(Oxidative stress induces apoptosis in embryonic cortical neurons)。ジャーナル・オブ・ニューロケミストリー,62、376〜379。
ライデル(Rydel),R E;グリーン(Greene),L A。cAMP類似体は、神経成長因子とは無関係にラット交感および感覚ニューロン培養物において生存および神経突起成長を促進する(cAMP analogs promote survival and neurite outgrowth in cultures of
rat sympathetic and sensory neurons independently of nerve growth factor)。米国科学アカデミー紀要1988年;85:1257〜1261。
サルミネン(Salminen)A、タピオラ(Tapiola)T、コルホネン(Korhonen)P、スローネン(Suuronen)T。(1998年)ヒストンデアセチラーゼ阻害剤により誘導されたニューロンアポトーシス(Neuronal apoptosis induced by histone deacetylase inhibitors)。ブレイン・リサーチ・モレキュラー・ブレイン・リサーチ(Brain Res Mol Brain Res.)61:203〜206。
シェンケル(Schenkel)J.(2004年)生体内での神経変性に続くc−Jun転写因子の活性化(Activation of the c-Jun transcription factor following
neurodegeneration in vivo)。ニューロサイエンス・レターズ(Neurosci
Lett.)。361:36〜39。
シー(See)V、Boutillier AL、ビト(Bito)H、レフラー(Loeffler)JP。(2001年)カルシウム/カルモジュリン依存性プロテインキナーゼIV型(CaMKIV)は、小脳顆粒ニューロンにおいてカリウム欠乏によって誘導されるアポトーシスを阻害する。(Calcium/calmodulin-dependent protein kinase type IV (CaMKIV)
inhibits apoptosis induced by potassium deprivation in cerebellar granule
neurons)。ザ・FASEB・ジャーナル 15:134〜144。
Thangnipon W、キングズバリA、ウェブ(Webb)M、バラージュR。(1983年)生体外でのラット小脳細胞の観察:基層の影響、カリウム濃度、および、ニューロンとアストロサイトとの間の関係
(Observations on rat cerebellar cells in vitro: influence of
substratum, potassium concentration and relationship between neurones and
astrocytes)。ブレイン・リサーチ。313:177〜89。
Vlug A.S.、Teuling E.、Haasdijk E.D.、フレンチ(French)P.、フーゲンラード(Hoogenraad)C.C.、および、Jaarsma D.(2005年)ATF3発現は、筋萎縮性側索硬化症−SOD1遺伝子導入マウスにおける脊髄運動ニューロンの死に先行し、c−Junリン酸化、CHOP発現、細胞体樹状突起ユビキチン化、および、ゴルジ断片化に相関する(ATF3 expression precedes death of spinal motoneurons in amyotrophic
lateral sclerosis-SODl transgenic mice and correlates with c-Jun
phosphorylation, CHOP expression, somato-dendritic ubiquitination and Golgi
fragmentation)。ヨーロピアン・ジャーナル・オブ・ニューロサイエンス 22,1881〜1894。
ワトソン(Watson)A.、エイラーズ(Eilers)A.、ルラルマンD.、Kyriakis J.、ルビンL.L.、および、ハムJ.(1998年)c−Junのリン酸化は、小脳顆粒ニューロンにおける生存シグナル伝達中止により誘導されるアポトーシスに必要である。(Phosphorylation of c-Jun is necessary for apoptosis induced by
survival signal withdrawal in cerebellar granule neurons)。ザ・ジャーナル・オブ・ニューロサイエンス18,751〜762。
ヤルチン(Yalcin)A、Koulich E、モハメド(Mohamed)S、リューL、デメロSR。(2003年)小脳顆粒ニューロンにおけるアポトーシスは、CBP過剰リン酸化に関連し、CBPとNF−KBとの間の相互作用を減少させる(Apoptosis in cerebellar granule neurons is associated with CBP
hyperphosphorylation and reduced interaction between CBP and NF-KB)ジャーナル・オブ・ニューロケミストリー 84:397〜408。
【技術分野】
【0001】
本発明は、全般的に神経変性障害の分野に関し、より詳細にはアルツハイマー病、パーキンソン病、筋萎縮性側索硬化症(ALS)またはハンチントン病などの疾患、ならびに虚血性発作および外傷性脳損傷などの状態を含む、神経変性から保護するための新規の組成物および方法に関する。
【背景技術】
【0002】
本発明の範囲を限定することなく、本発明の背景は、アルツハイマー病、パーキンソン病またはハンチントン病、および虚血性発作などの状態を含む神経変性病態に対する神経保護薬として作用する新規の治療化合物に関連して説明される。
【0003】
アルツハイマー病、パーキンソン病、ALSまたはハンチントン病などの疾患、ならびに虚血性発作および外傷性脳損傷などの状態は、年間で何百万もの人々を冒し、社会に莫大な経済的負担を与えている。これら状態の特徴は、ニューロンの異常で過度な損失である。これら病態におけるニューロン死を防ぐための有効な戦略は現在のところない。
【0004】
アルツハイマー病(AD)などの神経変性障害は、神経原線維変化、神経突起斑、および神経細胞死によって特徴付けられる。アルツハイマー病は、変性末期疾患であり、そのための治療法は知られておらず、脳における斑および錯綜によって特徴付けられる。その最も一般的な形態において、アルツハイマー病は65歳を超える人々を悩ましており、発症率は低いが早期発症型も存在する。
【発明の概要】
【0005】
〔発明の開示〕
本発明者は、神経変性の組織培養範例を使用してニューロン死を防ぐ能力のために小分子化合物を合成しスクリーニングした。これらの調査は、強力な神経保護活性を有する化合物として2−ベンジリデン−2H−1,4−ベンゾキサジン−3−(4H)−オンの特定を導いた。本明細書において、2−ベンジリデン−2H−1,4−ベンゾキサジン−3−(4H)−オンおよびその誘導体は、脳内の感受性の高いニューロン集団を保護することができ、ゆえに神経変性状態を治療するための治療アプローチを表すことができるということが証明される。現在のところ神経変性疾患を治癒、軽減、または治療する有効な戦略はない。1,4−ベンゾキサジン−3−(4H)−オン類の化合物が、神経変性から保護するということはこれまで示されていなかった。これらの化合物は、新規の治療ツールであることを表している。
【0006】
本発明は、これらに限定されるものではないが、アルツハイマー病、パーキンソン病、ハンチントン病、および筋萎縮性側索硬化症、ならびに、虚血性発作および外傷性脳損傷などの神経学的状態を含む神経変性疾患の治療における新規の治療ツールとして、HSB13およびその誘導体などの1,4−ベンゾキサジン化合物を含む。本発明は、多くの異なる1,4−ベンゾキサジン化合物およびその誘導体を含む組成物を作製し使用するための組成物および方法を含む。1,4−ベンゾキサジン化合物およびその誘導体は、神経変性の組織培養モデルにおいて評価された。これらの化合物は、神経変性の異なる組織培養モデルにおいて保護性である。
【0007】
本発明は、神経変性の組織培養モデルにおいて高度に神経保護性である1,4−ベンゾキサジン類の幾つかの化合物を説明する。仮定のためで決して本発明の限定ではなく、薬理学的阻害剤を使用して、これらの化合物の作用機構はRaf−MEK−ERKまたはPI 3キナーゼ−Aktシグナル経路も、あるいは、プロテインキナーゼA(PKA)、カルシウムカルモジュリンキナーゼA(CaMK)およびヒストンデアセチラーゼ(HDAC)などの他の生存促進分子も含まないということが提案されるということが見出された。
【0008】
1,4−ベンゾキサジン化合物およびその誘導体は、線条体変性を減少し、ハンチントン病を化学的に誘導されたマウスモデルにおいて行動遂行を改善するということが見出された。HSB−13、HSB−22およびASK−2などの化合物を含む幾つかの1,4−ベンゾキサジンは、培養小脳顆粒ニューロンを低カリウム処置により誘導される死から保護した。HSB−13は、HT−22神経芽腫細胞をホモシステイン酸(HCA)誘導神経毒性から保護した。また、ASK−2は、一次皮質ニューロンをHCA誘導神経毒性から保護することも見出された。HSB−13は、線条体変性を減少した。HSB−13は、ハンチントン病の3−ニトロプロピオン酸マウスモデルにおける行動遂行を改善する。
【0009】
本発明は、これらの化合物のうちの1つである、HSB−13として表示される、(Z)−6−アミノ−2−(3,’5’−ジブロモ−4’−ヒドロキシベンジリデン)−2H−ベンゾ[b][l,4]オキサジン−3(4H)−オンの、ハンチントン病の3−ニトロプロピオン酸(3−NP)誘導マウスモデルにおける研究を説明する。HSB−13は、線条体変性を減少し、3−NPが投与されたマウスにおける行動遂行を改善した。本発明者は、化合物HSB−13は、ハンチントン病のよく特徴付けられ受け入れられているモデルシステム、およびアミロイド前駆体タンパク質(APP)毒性のショウジョウバエモデルにおいて保護性であることを見出した。本発明のHSB−13ファミリーの化合物および新しく作られるそれらの誘導体は、神経変性疾患の治療における新規の治療ツールであることを表している。
【0010】
本発明は、これらに限定されるものではないが、アルツハイマー病、パーキンソン病、ハンチントン病、および筋萎縮性側索硬化症、ならびに、虚血性発作および外傷性脳損傷などの神経学的状態を含む神経変性疾患の治療における新規の治療ツールとして、HSB13およびその誘導体などの1,4−ベンゾキサジン化合物を含む。本発明において説明される化合物は、対象、例えばヒト、ヒト以外の霊長類、ラット、マウス、およびハエに神経保護を提供する。本発明は、多くの異なる1,4−ベンゾキサジン化合物およびその誘導体を含む組成物を作製し使用するための組成物および方法を含む。1,4−ベンゾキサジン化合物およびその誘導体は、神経変性の組織培養モデルにおいて評価された。驚いたことに、これらの化合物は、神経変性の異なる組織培養モデルにおいて保護性であるということが見出された。
【0011】
本発明の化合物は、対象における1以上のニューロンの死、異常または過度な損失を調節すること、神経毒性、対象における自発運動遂行、および/または、アミロイド前駆体タンパク質および他の部分の毒性効果に影響を及ぼすことによって、神経学的状態の調節を提供する。
【0012】
1,4−ベンゾキサジン化合物およびその誘導体は、線条体変性を減少し、ハンチントン病を化学的に誘導されたマウスモデルにおける行動遂行を改善するということが見出された。HSB−13、HSB−22およびASK−2などの化合物を含む幾つかの1,4−ベンゾキサジンは、培養小脳顆粒ニューロンを低カリウム処置により誘導される死から保護した。HSB−13は、HT−22神経芽腫細胞をホモシステイン酸(HCA)誘導神経毒性から保護した。HSB−13はまた、よく特徴付けられ一般的に使用されるアルツハイマー病の組織培養モデルである、βアミロイド(Aβ)誘導ニューロン死から皮質ニューロンを保護する。ASK−2は、一次皮質ニューロンをHCA誘導神経毒性から保護する。HSB−13は、線条体変性を減少し、ハンチントン病の3−ニトロプロピオン酸マウスモデルにおける行動遂行を改善した。
【0013】
本発明は、以下の式の化合物を含む。
【化1】

式中、AおよびBは、C、N、S、Oから選択される。R1〜R7は、H、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、C1〜C6エーテル基、C1〜C6エステル基、C1〜C6アルキルアルカノアート基、C1〜C6アルコキシ基、ケト基、および、オキソ基から独立して選択される。R8は、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、エーテル基、エステル基、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基である。R9〜R13は、H、C1〜C6アルキル;C1〜C6アルケニル、ハロ、置換されたC1〜C6アルキル、置換されたC1〜C6アルケニル、カルボニル、炭酸エステル、アセトキシ基、アセチル基、エーテル、エステル、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基から独立して選択される。
【0014】
本発明はまた、神経学的状態の調節が必要な対象を特定すること;およびその対象に組成物を提供することによって、対象における神経学的状態から保護するか、その神経学的状態を治療するか、減少させるか、または調節する方法を提供する。この組成物は、以下の構造を有する。
【化2】

式中、Aは、C、N、S、Oから選択され;Bは、C、N、S,Oから選択され;R1〜R7は、H、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、C1〜C6エーテル基、C1〜C6エステル基、C1〜C6アルキルアルカノアート基、C1〜C6アルコキシ基、ケト基、および、オキソ基から独立して選択され;R8は、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、エーテル基、エステル基、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基であり;ならびに、R9〜R13は、H、C1〜C6アルキル;C1〜C6アルケニル、ハロ、置換されたC1〜C6アルキル、置換されたC1〜C6アルケニル、カルボニル、炭酸エステル、アセトキシ基、アセチル基、エーテル、エステル、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基から独立して選択される。
【0015】
本発明は、神経変性状態に対する保護を必要とする対象を特定すること、および、以下の式を有する組成物の治療有効量をその対象に提供することによって、対象における神経変性状態を減少させるか、改善するか、治療するか、または、その神経変性状態から保護する方法を提供する。
【化3】

式中、Aは、C、N、S、Oから選択され;Bは、C、N、S、Oから選択され;R1〜R7は、H、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、C1〜C6エーテル基、C1〜C6エステル基、C1〜C6アルキルアルカノアート基、C1〜C6アルコキシ基、ケト基、および、オキソ基から独立して選択され;R8は、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、エーテル基、エステル基、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基であり;ならびに、R9〜R13は、H、C1〜C6アルキル;C1〜C6アルケニル、ハロ、置換されたC1〜C6アルキル、置換されたC1〜C6アルケニル、カルボニル、炭酸エステル、アセトキシ基、アセチル基、エーテル、エステル、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基から独立して選択される。
【0016】
別の実施形態において、本発明はまた、対象においてキナーゼを阻害するための組成物および方法を含み、この方法は、増加したキナーゼ活性から保護する必要がある対象を特定するステップと;対象においてキナーゼ活性を低下させるのに有効な組成物の量を対象に提供するステップとを含み、この組成物は以下の式を含む。
【化4】

式中、Aは、C、N、S、Oから選択され;Bは、C、N、S、Oから選択され;R1〜R7は、H、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、C1〜C6エーテル基、C1〜C6エステル基、C1〜C6アルキルアルカノアート基、C1〜C6アルコキシ基、ケト基、および、オキソ基から独立して選択され;R8は、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、エーテル基、エステル基、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基であり;ならびに、R9〜R13は、H、C1〜C6アルキル;C1〜C6アルケニル、ハロ、置換されたC1〜C6アルキル、置換されたC1〜C6アルケニル、カルボニル、炭酸エステル、アセトキシ基、アセチル基、エーテル、エステル、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基から独立して選択される。
【0017】
一態様において、本方法はさらに、対象におけるキナーゼ活性レベルを測定するステップを含む。別の態様において、キナーゼ活性の増加に対する保護を必要とする対象は、神経学的状態、例えばアルツハイマー病、パーキンソン病、ハンチントン病、発作、または、虚血性発作を患っているものである。一態様において、その状態は、ウイルス感染、例えばHIVなどのレトロウイルス感染を含む。別の態様において、キナーゼ活性の低下は神経学的状態から保護し、1以上のニューロンの死、1以上のニューロンの損失、1以上のニューロンにおける毒性を防止、改善された自発運動遂行、あるいは、アミロイド前駆体タンパク質および他の部分の毒性効果からの保護を含む。一態様において、対象は、ガンを患っている。さらに別の態様において、阻害されるキナーゼは、GSK3α、GSK3β、p38β、およびB−Rafのうちの少なくとも1つを含む。別の関連態様において、阻害されるキナーゼは、CDK1、CDK2、ROCK1、JNK2、MLK3、および、c−Rafのうちの少なくとも1つを含む。阻害剤は、例えば100nM〜500nMまでの間で提供されうる。本方法はさらに、対象に化合物を提供してから治療後の活性を決定する前に、GSK3α、GSK3β、p38α、p38β、B−Raf、CDK1、CDK2、JNK2、JNK3、および、MLK3のうちの少なくとも1つの活性を決定するステップを含みうる。
【0018】
本発明の別の実施形態は、ガン、自己免疫疾患、AIDS、および免疫系の他の疾患を含むアポトーシスの規制緩和を含む疾患を治療するために使用される方法および組成物を提供する。同様に、当該発明は、キナーゼによる影響を受ける状態を治療すること、例えば活性がニューロン生存にとって有害であるキナーゼの阻害に使用される方法および組成物を提供する。本発明は、例えばGSK3α、GSK3β、p38βおよびB−Rafのキナーゼ活性に影響を及ぼすために使用される方法および組成物を提供する。
【0019】
本発明の特徴および利点のより完全な理解のために、ここで添付の図面と共に本発明の詳細な説明を述べる。
【図面の簡単な説明】
【0020】
【図1】LK誘導ニューロン死から保護する1,4−ベンゾキサジン化合物を示す画像である。小脳顆粒ニューロンの培養物は、HK培地、LK培地、または、5種類の1,4−ベンゾキサジン化合物、すなわちHSB−13、HSB−5、HSB−22、ASK−2a、およびHSB−20のうちの1種類を含有するLK培地に交換された。全ての化合物は、25μM濃度で使用された。生存能が、位相差顕微鏡検査、DAPI染色(アポトーシスニューロンが、凝縮した核または断片化した核によって検出される)、あるいは、TUNEL染色(アポトーシス核が緑色に標識付けされる)によって24時間後に評価された。DAPIおよびTUNEL染色画像は、同じ場からのものである。HSB−13、HSB−5、HSB−22、およびASK−2aは保護性であったが、HSB−20は保護性ではなかった。
【図2】4種類の神経保護ベンゾキサジンの構造のうちの幾つかの概略図である。HSB−13、ASK−2、ASK−2a、および、HSB−13の構造が示されている。本文に説明されているように、ASK−2aは、ASK2よりもはるかに高い神経保護性を示した。HSB−13は、最も高い神経保護性を示した。
【図3】1,4−ベンゾキサジンによる神経保護におけるシグナル伝達経路の阻害の効果を示すプロットである。小脳顆粒ニューロンの培養物は、LK培地、HSB−13を含有するLK培地、または、HSB−13と、PD98059(40μM)、U0126(10μM)、ワートマニン(100nm)、Akt阻害剤−X(5μM)、KN−62(10μM)、H89(10μM)およびTSA(1μM)のうちのいずれかとを含有するLK培地に交換された。生存能は、DAPI染色によって24時間後に定量化された。HK培地に交換された対照培養における生存能に結果を標準化した。
【図4】保護性1,4−ベンゾキサジン化合物で処理されたニューロン培養物におけるシグナル伝達タンパク質のウェスタンブロット解析を示す画像である。小脳顆粒ニューロンの培養物は、HK培地、LK培地、あるいは、HSB−13、HSB−22、またはASK−2aを含有するLK培地に3時間交換された。全細胞溶解物が、リン酸Akt(Ser473)、リン酸MEK、リン酸ERK、および、リン酸GSK3に対する抗体を使用してウェスタンブロット法によって調製され分析された。αチューブリンに対する抗体も使用されて、同様量の溶解物が各レーンに装填されたことを示した。
【図5】c−junおよびATF−3発現におけるベンゾキサジンの効果を示す画像である。小脳ニューロン培養は、3時間、HK、LK、あるいは、25μMのHSB−13、25μMのASK−2a、または25μMのHSB−22を含有するLK培地で処理した。全細胞溶解物が次に調製され、c−junおよびATF−3に対する抗体を使用してウェスタンブロット解析された。αチューブリンに対する抗体も使用されて、同様量の溶解物が各レーンに装填されたことを示した。
【図6A】HT−22細胞でのHSB−13の効果、および細胞死の定量化を示している。図6Aは、HCA誘導毒性に対するHT−22細胞でのHSB−13の保護効果を示している。HT−22細胞は、添加剤を用いない(無)、1.5mMのHCA、あるいは、25μMのHSB−13、25μMのASK−2a、および25μMのHSB−22を加えた1.5mMのHCAで処理された。図6Aにおいて、処理後24時間の培養物の様子が、位相差顕微鏡検査(位相)によって視覚化された。細胞死は、DAPIおよびTUNEL染色を使用して評価された。図6Bは、DAPI染色によるニューロン生存能の定量化を示している。生存能は無処理培養(対照)の%として表現された。
【図6B】HT−22細胞でのHSB−13の効果、および細胞死の定量化を示している。図6Aは、HCA誘導毒性に対するHT−22細胞でのHSB−13の保護効果を示している。HT−22細胞は、添加剤を用いない(無)、1.5mMのHCA、あるいは、25μMのHSB−13、25μMのASK−2a、および25μMのHSB−22を加えた1.5mMのHCAで処理された。図6Aにおいて、処理後24時間の培養物の様子が、位相差顕微鏡検査(位相)によって視覚化された。細胞死は、DAPIおよびTUNEL染色を使用して評価された。図6Bは、DAPI染色によるニューロン生存能の定量化を示している。生存能は無処理培養(対照)の%として表現された。
【図7】神経保護および運動性活性におけるHSB−13の効果を示している。図7Aは、生体内における3−NP神経毒性に対するHSB−13の保護効果を示すプロットである。図7Aにおける組織学的解析。対照、3−NP、および、3−NP+HSB−13で処理されたマウスからの冠状切片40μmのクレシルバイオレット染色。上パネル:低倍率で線条体における細胞の選択的損失を示している。下パネル:背外側部分の線条体の高倍率画像。図7Bは、生理食塩水(対照)、3−NP、および3−NP+HSB−13が投与されたマウスの自発運動活性測定を要約するグラフを示している。投与量および投与条件は、方法において詳述されている。活性は15分間を超えて測定された。a)総運動時間;b)総運動距離;c)運動ごとの平均距離;d)平均速度が示されている。棒は、平均±SDを示す。*は、3−NP値と3−NP+HSB−13値との間の統計的有意性を示す(P値<0.05)。統計的解析は、独立両側スチューデントt検定(unpaired, two-tailed Student's T test)を使用して行われた。
【図8】HSB−13はショウジョウバエにおいてAPP695誘導毒性から保護するということを示す画像である。ヒトAPP695を発現するハエの生存を対照と比較した。HSB−13での処理は、APP発現ハエの生存率を著しく増加した。n=15〜20匹のハエの群を用いた独立研究の数。棒は、平均±SEMを示す。図8は、HSB−13がHCA誘導毒性に対してHT−22細胞を保護するということを示す画像である。HT−22細胞は、添加物を用いない(対照)、2mMのHCA、あるいは、2mMのHCA+25μMのHSB−13で処理された。処理後24時間の培養物の様子が示されている。
【図9】HSB−13がHCA誘導毒性に対してHT−22細胞を保護するということを示す画像である。HT−22細胞は、添加物を用いない(対照)、2mMのHCA、または、2mMのHCA+25μMのHSB−13で処理された。処理後24時間の培養物の様子が示されている。
【図10】図10Aおよび図10Bは3−NPが生体内において3−NP神経毒性に対して保護性であるということを示す画像である。図10A:組織学的解析。対照、3−NP、および、3−NP+HSB−13で処理されたマウスからの冠状切片50μmのクレシルバイオレット染色。投与量および投与条件は、方法において詳述されている。上パネル:低倍率で線条体における細胞の選択的損失を示している。下パネル:背外側部分の線条体の高倍率画像。図10B:自発運動活性の分析。生理食塩水(対照)、3−NP、および3−NP+HSB−13が投与されたマウスの自発運動活性測定。投与量および投与条件は、方法において詳述されている。活性は15分間を超えて測定された。A)全運動エピソード;B)総運動距離;C)平均速度;D)垂直面進入が示されている。棒は、平均±SDを示す。
【発明を実施するための形態】
【0021】
〔発明の説明〕
本発明の様々な実施形態の作製および使用は、以下で詳細に論じられるが、本発明は、多様な特定情況において具現化されうる多くの適用可能な発明概念を提供するということが認識されるべきである。本明細書において論じられる特定実施形態は、本発明を作製し使用するための特定方法の単なる例示に過ぎず、本発明の範囲を定めるものではない。
【0022】
本発明の理解を容易にするために、多くの用語が以下で定義される。本明細書で定義される用語は、本発明に関連する分野の通常の技術者によって一般的に理解されるとおりの意味を有する。「a」「an」および「the」などの用語は、単一実体にのみ言及するように意図されず、例示のために使用されうる特定例の一般的分類を含む。本明細書における用語法は、本発明の特定実施形態を説明するために使用されるが、それらの使用は、特許請求の範囲で概説されている場合を除き、本発明の範囲を定めるものでない。
【0023】
アルツハイマー病、パーキンソン病、および筋萎縮性側索硬化症(ALS)などの神経変性疾患は、患者の生活の質を損ない、家族の介護者に多大な負担を負わせ、年間何十億ドルも社会的コストがかかっている。神経変性疾患の発症に対する最も一貫した危険因子は、加齢である。平均余命の劇的な増加のため、加齢に関連する障害に悩まされる人々の発生率が上昇傾向にあり、主要な健康問題を示している。この多様な障害の組の間で共有される共通点は、ある特定集団のニューロンの進行性かつ止むことのない損失である。神経変性疾患に対する現在の薬物療法は、これらの疾患に関連する症状のみを緩和し、しかし根底にある原因、例えばニューロンの変性には影響を及ぼさない。ニューロンの損失が弱まることなく継続するので、そのような緩和治療は、疾患進行に効果を及ぼさない。ゆえにニューロン死の小分子阻害剤の特定は、緊急で決定的に重要である。
【0024】
アルツハイマー病(AD)などの神経変性障害は、神経原線維変化、神経突起斑、および神経細胞死によって特徴付けられる。アルツハイマー病は、変性末期疾患であり、そのための治療法は知られておらず、脳における斑および錯綜によって特徴付けられる。その最も一般的な形態において、アルツハイマー病は65歳を超える人々を悩ましており、発症率は低いが早期発症型も存在する。神経変性状態は、毎年ますます多くの人々を襲っており、これら状態の多くのための従来治療は、治療という点ではほんのわずかしか提供しない。いくつかの例では、神経変性状態は、多発性硬化症などの特定の疾患に特異的に関連し、一方で、他の例では、これら状態は、加齢、または例えば遺伝的障害および自己免疫疾患などの身体の他の何らかの状態もしくはプロセスに、より全般的に関連する。しかしながらこれらの状態は、衰弱および低下した身体機能によって、時には低下した精神機能によっても特徴付けられる。
【0025】
本発明者は、GW5074と呼ばれるc−Rafの細胞透過性化学阻害剤{5−ヨード−3−[(3’,5’−ジブロモ−4’−ヒドロキシフェニル)メチレン]−2−インドリノン}が、様々な異なるアポトーシス刺激によって誘導された培養ニューロンの死を完全に阻害するということを先に証明している(チン(Chin)ら、2004年)。GW5074はまた、一般的に使用されるハンチントン病の生体内範例である、3−ニトロプロピオン酸が投与されたマウスにおいて、線条体変性を防ぎ、行動遂行を改善する。GW5074は、3’置換インドロンである(チンら、2004年)。多くの他の3置換インドロンもまた、ニューロン死を阻害することが見出されている(ジョンソン(Johnson)ら、2005年;チェン(Chen)ら、2008年)。GW5074ならびに多くの他の3−置換インドロンは、高度に保護性であるが、より高い濃度で使用された場合に毒性を示す(チンら、2004年;ジョンソンら、2005年;チェンら、2008年)。構造活性相関の研究が、追加の3置換インドロンは神経保護性であると同時に、高用量であっても培養ニューロンへの毒性がないということを特定している(バルデラモス(Balderamos)ら、2008年)。他の研究者は、c−jun N−末端キナーゼ(JNK)、サイクリン依存性キナーゼ(CDK)、グリコーゲン合成酵素キナーゼ(GSK3)、およびp53を含む様々な異なるアポトーシス促進タンパク質を標的にする多くのニューロンアポトーシス化学阻害剤を同様に特定している(デメロ(D'Mello)ら、2005年)。
【0026】
本発明は、治療価値を有し、かつ、カリウム欠乏によりアポトーシスを起こすよう誘導された培養小脳顆粒ニューロンにおいて神経保護性である、幾つかの1,4ベンゾキサジン誘導体を提供する。これら化合物のうちの幾つかはまた、酸化ストレスおよびAβ誘導ニューロン死に対して試験されて、無毒性レベルで有効であることを見出された。
【0027】
HSB−13として指定される、これらの化合物の1つは、ハンチントン病の3−ニトロプロピオン酸モデルにおいて生体内で試験された。HSB−13は、神経変性に対するかなりの保護を提供し、マウスにおいて自発運動遂行を改善した。HSB−13はまた、ショウジョウバエにおいてアミロイド前駆体タンパク質(APP)誘導毒性に対して保護性であった。これらの研究は、1,4−ベンゾキサジン化合物を、神経変性に対する治療価値を有する新規の神経保護剤として特定する。
【0028】
幾つかの神経変性疾患に関連する症状を改善するための薬物療法は利用可能であるが、しかしながら、これらの種類の療法は、ニューロンの止むことのない変性を阻止しないので、疾患進行の速度を緩めるものではない。神経変性病態におけるニューロンの異常損失を阻止するための戦略は現在のところない。幾つかの候補化合物は、先に特定されており、これらの多くは、前臨床治験にある。幾つかはヒト治験でも試験されたが、失敗であった。2−ベンジリデン−2H−1,4−ベンゾキサジン−3−(4H)−オンの化合物は、神経変性病態の治療の候補薬物として試験されたことはない。
【0029】
用語「アルキル」、「アルケニル」、「アルキニル」、および「アルキレン」は、典型的には長さが約1〜約12の範囲の炭素原子、好ましくは1〜約6原子の炭化水素鎖を指し、直鎖および分枝鎖を含む。特に断りのない限り、本明細書で言及される任意のアルキルまたはアルキレンの好ましい実施形態は、C1〜C6アルキルである(例えばメチルまたはエチル)。
【0030】
「シクロアルキル」は、飽和または不飽和の環状炭化水素鎖を指し、架橋、融合、またはスピロ環状化合物を含み、好ましくは3〜約12炭素原子、より好ましくは3〜約8原子を含む。
【0031】
「アリール」は、1つ以上の芳香環を意味し、その各々は5または6のコア炭素原子からなる。多重アリール環は、ナフチルの場合のように融合されるか、または、ビフェニルの場合のように融合されていなくてもよい。アリール環はまた、1以上の環状炭化水素、ヘテロアリールまたは複素環と融合されていても、あるいは非融合であってもよい。
【0032】
「ヘテロアリール」は、1〜4のヘテロ原子、好ましくはN、OもしくはS、またはそれらの組み合わせを含むアリール基であり、そのヘテロアリール基は、炭素原子または窒素原子を、C1〜C6アルキル、−−CF3、フェニル、ベンジル、もしくはチエニルで任意に置換されるか、または、ヘテロアリール基の炭素原子が酸素原子とともに、カルボニル基を形成するか、あるいは、そのヘテロアリール基は、フェニル環と任意に融合される。ヘテロアリール環はまた、1以上の環状炭化水素、複素環、アリール、またはヘテロアリール環と融合されうる。ヘテロアリールは、1つのヘテロ原子を有する5員ヘテロアリール(例えばチオフェン、ピロール、フラン);2つのヘテロ原子を1,2位または1,3位に有する5員へテロアリール(例えば、オキサゾール、ピラゾール、イミダゾール、チアゾール、プリン);3つのヘテロ原子を有する5員ヘテロアリール(例えばトリアゾール、チアジアゾール);3つのヘテロ原子を有する5員ヘテロアリール;1つのヘテロ原子を有する6員ヘテロアリール(例えば、ピリジン、キノリン、イソキノリン、フェナントリン(phenanthrine)、5,6−シクロヘプテノピリジン(5,6-cycloheptenopyridine));2つのヘテロ原子を有する6員へテロアリール(例えばピリダジン、シンノリン、フタラジン、ピラジン、ピリミジン、キナゾリン);3つのヘテロ原子を有する6員ヘテロアリール(例えば、1,3,5−トリアジン);および、4つのヘテロ原子を有する6員ヘテロアリールを含むが、これらに限定されない。
【0033】
「複素環」または「複素環式の」は、不飽和または芳香族の特徴を有するか、または有しない、5〜12原子、好ましくは5〜7原子の1以上の環を意味し、その少なくとも1つの環原子は、炭素ではない。好ましいヘテロ原子は、硫黄、酸素、および、窒素を含む。多重環も融合されうる。
【0034】
「ヘテロ原子」は、炭化水素類似化合物の任意の非炭素原子を意味する。例とし酸素、硫黄、窒素、燐、砒素、珪素、セレン、テルル、スズ、およびホウ素を含む。
【0035】
用語「アルキレン」は、メチレン(−CH2−)、プロピレン(−CH2CH2CH2−)、クロロエチレン(−CHClCH2−)、2−チオブテン−CH2CH(SH)CH2CH2、1−ブロモ−3−ヒドロキシル−4−メチルペンテン(−CHBrCH2CH(OH)CH(CH3)CH2−)などの上記で定義されたような二価アルキル基を指す。
【0036】
用語「アルケニル」は、1以上の炭素−炭素二重結合を含む、分岐または非分岐の炭化水素鎖を表す。
【0037】
用語「アルキニル」は、1以上の炭素−炭素三重結合を含む、分岐または非分岐の炭化水素鎖を指す。
【0038】
用語「アリール」は、フェニルおよびナフチルなどの、好ましくは約6〜14の間の炭素原子を有する少なくとも1つの芳香環を形成する炭素原子鎖を指し、これら炭素原子は、そのような鎖に一般的に結合される1以上の官能基、例えばヒドロキシル、ブロモ、フルオロ、クロロ、ヨード、メルカプトまたはチオ、シアノ、シアノアミド、アルキルチオ、複素環、アリール、ヘテロアリール、カルボキシル、カルボアルコイル(carbalkoyl)、アルキル、アルケニル、ニトロ、アミノ、アルコキシル、アミドなどで置換されて、ビフェニル、ヨードビフェニル、メトキシビフェニル、アントリル、ブロモフェニル、ヨードフェニル、クロロフェニル、ヒドロキシフェニル、メトキシフェニル、ホルミルフェニル、アセチルフェニル、トリフルオロメチルチオフェニル、トリフルオロメトキシフェニル、アルキルチオフェニル、トリアルキルアンモニウムフェニル、アミドフェニル、チアゾリルフェニル、オキサゾリルフェニル、イミダゾリルフェニル、イミダゾリルメチルフェニルなどのアリール基を形成しうる。
【0039】
用語「アルコキシ」は、−−OR−−を指し、ここでRはアルキルである。
【0040】
用語「アミド」は、アミド結合:−−C(O)NHR(ここでRは水素またはアルキルである)を指す。
【0041】
用語「アミノ」は、アミン結合:−−NR−−を指し、ここでRは、水素またはアルキルである。用語「カルボキシル」は、−−C(O)O−−を指し、用語「カルボニル」は、−−C(O)−−を指す。
【0042】
用語「アルキルカルボキシル」は、上記で定義されたようなアルキル基がC(O)O基、例えばCH3C(O)O−−、CH3CH2C(O)O−−などで置換されたものを指す。
【0043】
用語「炭素環」は、シクロペンチル、シクロヘキシルなど約5〜約8の環炭素を有する環状炭化水素鎖を意味する。これらの基は、上記の「アルキル」で定義されたような1以上の官能基で任意に置換されうる。
【0044】
用語「ハロゲン」は、塩素、フッ素、臭素、ヨウ素、およびそれらの混合物を含む。
【0045】
用語「複素環」は、N、OおよびSから選択された0〜4のヘテロ原子を含みうる直鎖または環系を意味し、ここで窒素原子および硫黄原子は任意に酸化され、窒素原子は任意に四級化される。
【0046】
用語「カルバモイル」は、基−−C(O)NH2を指す。
【0047】
用語「ヒドロキシアルキル」は、上記で定義されたようなアルキル基がヒドロキシ基によって置換されたものを意味する。
【0048】
用語「アルキルカルボニル」は単独または組み合わせで、アルカンカルボン酸から誘導されたアシル基、すなわちアルキル−C(O)−−を意味し、例えばアセチル、プロピオニル、ブチリル、バレリル、4−メチルバレリルなどがある。
【0049】
特に指定されない限り、全ての細胞培養培地および試薬は、インビトロゲン(Invitrogen)(カリフォルニア州カールズバッド)から購入され、全ての化学薬品はシグマ−アルドリッチ(Sigma- Aldrich)(ミズーリ州セントルイス)から得た。無水溶媒は、フィッシャー・サイエンティフィック(Fischer Scientific)(ペンシルベニア州ピッツバーグ)から購入された。PD98059、U0126、ワートマニン、Akt阻害剤−X、トリコスタチン酸A(TSA)、KN62、H89は、Calbiochem(カリフォルニア州ラ・ホーヤ)から購入された。この論文で使用される抗体は、以下のとおりであった:抗リン酸MEK(9121S)、抗リン酸AKT473(9271S)、抗リン酸GSK3α/β(9331S)、c−Jun(2315S)は、セル・シグナリング・テクノロジー(Cell Signaling Technology)(米国マサチューセッツ州ベバリー)から得た;抗ATF−3(C−19、sc−188)、抗リン酸ERK(E−40、sc−7383)、抗−α−チューブリン(TU−02 sc−8035)は、サンタクルスバイオテクノロジー(Santa CruzBiotechnology)(米国カリフォルニア州サンタクルス)から得た。全ての抗体は、1:1000希釈で使用された。
【0050】
1,4−ベンゾキサジン化合物の合成。化合物HSB−1−7、HSB−11、HSB−12、HSB−14、HSB−15、ASK−1、およびASK−2:適切なアルデヒド(15mmol)を適切に置換された2H−1,4−ベンゾキサジン−3(4H)−オン(10mmol)、無水酢酸(4mL)、およびトリエチルアミン(2mL)の混合物に加えた。反応混合物を7時間還流し、一晩室温で放置して、砕いた氷に注いだ。得た固体を濾過によって収集しアセトニトリルで洗浄した(70〜88%収率)。粗生成物をエタノールによる再結晶によって精製した。化合物ΗSB−8、ΗSB−11、HSB−12、HSB14−19、HSB−24、ASK−1、およびASK−2:適切なアルデヒド(15mmol)を適切に置換された2H−1,4−ベンゾキサジン−3(4H)−オン(10mmol)、無水酢酸(4mL)、およびトリエチルアミン(2mL)の混合物に加えた。反応混合物を7時間還流し、一晩室温で放置して、砕いた氷に注いだ。得た固体を濾過によって収集しアセトニトリルで洗浄した(70〜88%収率)。粗生成物をエタノールによる再結晶によって精製した。
【0051】
HSB−13:触媒量のラネーニッケルを少量ずつ攪拌しながら、エタノール(20mL)中のHSB−1(2mmol)およびヒドラジン水和物(1mL)の混合物に加えた。反応混合物を3時間還流し、次いで濾過した。濾液を減圧下で蒸発乾固させた。粗生成物をエタノールによる再結晶によって精製した(70%収率)。
【0052】
HSB−23、HSB−25、およびAsk−2a:これら化合物のそれぞれのエステル(HSB−2、HSB−24、およびASK−2)(1mmol)をメタノール(10mL)中、0℃で炭酸カリウム(3mmol)を用いて処理し、3時間室温で攪拌して、それぞれのアルコールHSB−23、HSB−25、およびASK−2aを得た(70〜75%収率)。
【0053】
HSB−22:ナトリウムメトキシドを一部分、無水DMF(10mL)中の2H−1,4−ベンゾキサジン−3(4H)−オン(10mmol)およびピロール−2−カルボキアルデヒド(16mmol)の混合物に加えた。反応混合物を48時間還流し、次いで室温まで冷却して、砕いた氷に注ぎ、一晩4℃で放置した。沈殿した固体を濾過によって収集し、水で洗浄して、乾燥させた。沈殿物をエタノール(150mL)とともに沸騰させて、不純物を除去するために熱いうちに濾過した。濾液を減圧下で蒸発乾固させて、移動相として(95:5)のトルエン:酢酸エチルを使用してシリカゲルカラム上で残渣をクロマトグラフィーにかけた(21%収率)。
【0054】
HSB−9およびHSB−10:ナトリウムメトキシドを一部分、無水DMF(10mL)中の2H−1,4−ベンゾキサジン−3(4H)−オン(10mmol)および4−ジメチルアミノベンズアルデヒド(16mmol)の混合物に加えた。反応混合物を一晩還流し、次いで室温まで冷却して砕いた氷に注ぎ、冷却装置内に一晩放置した。沈殿した固体を濾過によって収集し、水で洗浄し乾燥させた。粗生成物をそれぞれエタノールによる再結晶(30%収率)、およびDMFエタノールによる再結晶(40%収率)によって精製した(40%収率)。
【0055】
HSB−20およびHSB−21:ナトリウムメトキシドを一部分、無水DMF(10mL)中の2H−1,4−ベンゾキサジン−3(4H)−オン(10mmol)およびインドール−3−カルボキアルデヒド(16mmol)の混合物に加えた。反応混合物を24時間還流し、次いで室温まで冷却して砕いた氷に注ぎ、冷却装置内に一晩放置した。沈殿した固体を濾過によって収集し、水で洗浄し乾燥させた。粗生成物を(9:1)のトルエン:酢酸エチルを使用してシリカゲルカラム上でクロマトグラフィーにかけた(25〜30%収率)。
【0056】
ASK−8、ASK−9およびASK−11:無水ベンゼン(10mL)中、2H−1,4−ベンゾチアジン−3(4H)−チオン(2H-1, 4-benzothazin-3(4H)-thione)(2.7mmol)、適切なアルデヒド(3.3mmol)、および触媒量のピペリジンを含有する反応混合物を、90℃で4時間攪拌し、次いで室温まで冷却した。冷却中に沈殿した粗生成物を真空濾過によって収集し、ベンゼンで洗浄し、乾燥させて、酢酸エチル−ヘキサン(1:4容量/容量)を使用してシリカゲル上でカラム・クロマトグラフィーによって精製した(86〜90%収率)。
【0057】
【化5】

(Z)−2,6−ジブロモ−4−((3−オキソ−3,4−ジヒドロ−2Η−ベンゾ[b][l,4]オキサジン−2−イリデン)メチル)フェニルアセタート:(0.5g、3.35mmol)の2H−l,4−ベンゾキサジン−3(4H)−オン、1.4gの4−ヒドロキシ−3,5−ジブロモベンズアルデヒド、1.68mL(17.729mmol)の無水酢酸、および0.7mL(5mmol)のトリエチルアミンの撹拌混合物を7時間還流し、一晩室温で放置し、砕いた氷に注いだ。沈殿した固体を濾過によって収集し、アセトニトリルで洗浄した。粗生成物をDMF:エタノールによる再結晶によって精製した。
【0058】
実施例2.反応−2:(Z)−2−(3,5−ジブロモベンジリデン)−2H−ベンゾ[b][l,4]オキサジン−3(4H)−オン
【化6】

(Z)−2−(3,5−ジブロモベンジリデン)−2H−ベンゾ[b][l,4]オキサジン−3(4H)−オン。化学合成は、実施例1、反応−1の場合と同じであった。
【0059】
小脳顆粒ニューロンの培養および処理:顆粒ニューロン培養物を先に説明されたように生後6〜7日のウィスターラットの分離した小脳から得た(デメロら、1993年)。ポリ−L−リジン被覆24ウェル皿の中の、10%ウシ胎仔血清(FCS)、25mMのKCl、2mMのグルタミン(インビトロゲン)、および100μg/mLゲンタマイシンを補ったイーグルの基礎培地(BME)に、細胞を1×106細胞/皿の密度でプレーティングした。非ニューロン細胞の複製を防ぐために、プレーティングの18〜22時間後に、シトシンアラビノフラノシド(10μM)を培養培地に加えた。我々の研究室および他の研究者による先の免疫細胞化学的解析は、これらの培養物は95%を超える顆粒ニューロンを含有する高純度を有するということを示している(Thangniponら、2003年;キングズバリ(Kingsbury)ら、2005年)。
【0060】
ニューロン培養を処理前7〜8日間維持した。処理のために、細胞を一度すすぎ、次いで低K+培地中(無血清BME培地;LKと呼ぶ)、あるいは対照培養の場合、高K+培地中(20mMのKClを補った無血清BME培地;HKと呼ぶ)に維持した。処理のために、(ジメチルスルホキシド中に溶解した)化合物を、HKからの交換時に1μM、5μMまたは25μMの濃度でLK培地に直接加えた。4’,6’−ジアミジノ−2−フェニルインドールハイドロクロライド(DAPI)染色によって、生存能を24時間アッセイした(以下を参照のこと)。各化合物を(各々の濃度で)二つ組にして試験し、実験を少なくとも3回繰り返した。
【0061】
HK培地、LK培地、または、様々な化合物を補ったLK培地で処理したニューロン培養の生存能状態を、位相差顕微鏡検査で評価し、先に説明されたようなDAPIで細胞核を染色することによって定量化した(ヤルチン(Yalcin)ら、2003年;モリソン(Morrison)ら、2006年;Majzadehら、2007年)。簡潔に言えば、細胞を4%パラホルムアルデヒドに20分間4℃で固定した。リン酸緩衝食塩水中で洗浄した後、ジアミジノ−2−フェニルインドールハイドロクロライド(DAPI;リン酸緩衝食塩水中1μg/mL)を15分間室温で加えて、紫外線(260nm)下で見た。凝縮または断片化した核を有する細胞を死亡として評点を付けた。生存能をHK培地に交換した対照培養物のパーセントとして表した。独立両側スチューデントt検定を使用して統計的解析を行い、LK処理を受けた対照培養の平均ニューロン生存と比較した。
【0062】
マウスHT−22神経芽腫細胞株をATCC(米国バージニア州マナッサス)から購入し、10%FBS、100単位/mLのペニシリン、および、100μg/mLのストレプトマイシンを補った4.5g/Lのグルコース(ピルビン酸ナトリウムを含まない)を含むダルベッコ変法イーグル培地(DMEM)中で培養した。培養物をHCA処理のために〜30%集密でプレーティングした。HCAをpH7.5に調節した150mMの貯蔵液として作製し、最終濃度1.5mMで使用した。
【0063】
初代培養の皮質ニューロンを胎生期18日のラットから培養した。培養物を5uMの熟成Aβペプチド(Aβ25−35;シグマ−アルドリッチから購入した)で1〜2日後、処理した。ニューロン生存能を24時間後にアッセイした。
【0064】
ニューロン培養物のTUNELアッセイを、プロメガ(Promega)(ウィスコンシン州マディソン)からのDEADEND(商標)蛍光分析TUNELシステム(DEADEND(TM) Fluorometric TUNEL System)を製造業者の指示に従って使用して、培養物処理の24時間後に行った。活性型カスパーゼ3の免疫細胞化学的解析のために、ニューロン培養細胞を固定し5分間0.2%トリトンで処理した。30の間PBS中の5%BSAおよび5%ヤギ血清を含有するPBSでブロッキングした後、カバーガラスを一晩4℃で活性型カスパーゼ−3一次抗体とともにインキュベートした。リン酸緩衝食塩水(PBS)で3回洗浄した後、細胞を二次抗体と共に45分間25℃でインキュベートし、その後細胞をPBSで洗浄した。核を視覚化するために、細胞をDAPIで15分間25℃で染色した。
【0065】
培養培地を除去し、細胞を氷冷のリン酸緩衝食塩水(PBS)で2回洗浄し、溶解緩衝液中[1%トリトン、20mMのTris−HCl(pH7.5)、150mMのNaCl、1mMのNa2EDTA、1mMのEGTA、2.5mMのピロリン酸ナトリウム、1mMのβ−グリセロリン酸、1mMのNa3VO4、1μg/mLのロイペプチン、および、1プロテアーゼ阻害剤の混合物]に溶解した。ブラッドフォードタンパク質アッセイ試薬(米国カリフォルニア州ハーキュリーズのBio−Rad)を使用して、タンパク質濃度を測定し標準化した。標準化に続いて、40μgのタンパク質をウェスタンブロット法にかけた。高めた化学発光によって免疫反応性を検査した(米国ニュージャージー州ピスカタウェイのアマシャム・バイオサイエンス(Amersham Bioscience))。
【0066】
HSB−13(2mg/kg)を用いるか、または用いずに、3−NPを10回の腹腔内注射(50mg/kgを1日2回、5日間)で投与した生後8週のC57BL/6雄性マウス(マサチューセッツ州ウィルミントンのチャールズ・リバー・ラボラトリーズ社(Charles River Laboratories, Inc))に対して3−ニトロプロピオン酸投与および行動評価を行った。HSB−13の注射は、3−NP投与の30分前に行った。対照動物は生理食塩水注射を受けた。5日間の注射の後日、先に説明されたような(チンら、2004年;チェンら2008b年)TRU−SCAN(登録商標)活動監視システム(ペンシルベニア州のクールバーン・インストルメンツ(Coulborn Instruments))を使用して自発運動活性をアッセイした。以下の行動パラメータを選択した:(1)総運動時間、(2)総運動距離:床面における全てのベクトルX−Y座標変化の合計、(3)運動毎の平均距離、(4)平均速度:全てのX−T座標変化を定めた運動の平均速度。行動評価に続いて、マウスに深く麻酔をかけて脳を取り除いた。脳を0.1Mのリン酸緩衝液中の4%パラホルムアルデヒド内で固定し、0.1Mのリン酸緩衝液中の20%スクロース内で凍結保護した。冠状切片をクリオスタット上で40ミクロンに切断し、先に説明されたように(チンら、2004年;チェンら、2008b年)クレシルバイオレット(シグマ−アルドリッチ)で染色した。
【0067】
ヒトAPP695の発現を、UAS−APP695カセットを保有する遺伝子導入ハエ(フォスグリーン(Fossgreen)ら、1998年)を、UAS/GAL4システムを使用してアクチン−GAL4プロモーターを含むハエ(ブランド(Brand)およびペリモン(Perrimon)、1993年)と交雑させることによって遍在的に誘導した。ハエを、25℃の暗所で、異なる濃度のHSB−13(0μM、2.5μM、5μM、および50μM)を含有する10%酵母ペーストで飼養した。生存しているAPP695発現後代のパーセンテージを、それらを同一交雑種から得たプロモーターを含まないカセットを保有する、したがって先に説明された(グリーブ(Greeve)ら、2004年)のと全く同じ条件下で飼養した対照後代と比較することによって決定した。
【0068】
培養小脳顆粒ニューロンをHK培地からLK培地に交換すると、約50%の細胞が24時間以内にアポトーシスを起こした(デメロら、1993年)。本発明者は、この広く使用され認識されているモデルを利用して、LK誘導ニューロン死から保護する能力について、計20種類の異なる1,4−ベンゾキサジン誘導体を試験した。各化合物を3つの異なる投与量、すなわち1μM、5μMおよび25μMで試験し、生存能をDAPI染色によって定量化した。最も高い投与量は、化合物の潜在的な毒性効果について試験するために含めた。重要な結果は、アポトーシスの別の信頼性のあるアッセイである、TUNEL染色を使用して確証した(図1)。表1および図1に示すように、本発明は、重要な神経保護効果を有する幾つかの化合物を特定する。2つの最も保護性のある化合物は、HSB−13およびHSB−22であり、双方ともAr=3’,5’−ジブロモ−4’−ヒドロキシフェニルである(図1)。これらの化合物は、1μMで頑強な保護を提供し、保護はこの研究で使用されるより高い2つの投与量で維持される。高レベルの神経保護を示す別の化合物は、ASK−2aである(Ar=3’,5’−ジブロモ−4’−ヒドロキシフェニル)。この化合物による保護は、より低い2つの投与量でのHSB−13およびHSB−22で観察される保護よりも低い。HSB−4、HSB−9、ASK−8、およびASK−9を含む幾つかの化合物は、1μM投与量で、最大または最大に近い効力を示した。より高いレベルの保護を1μMよりも低い投与量で観察することができるかどうか調べるために、これらの化合物の分析を0.5μM、0.25μM、および0.1μMの投与量まで広げた。全ての場合で、保護は、これらの投与量において1μMで観察された保護よりも低かった。ゆえに、1,4−ベンゾキサジン化合物は、培養ニューロンをアポトーシスから保護した。
【0069】
化合物の構造、およびそれらが与える神経保護の程度に基づき、以下の結論を引き出すことができる:(a)ASK−2aと比較した場合にHSB−13およびHSB−22で幾分より高いレベルの保護が観察され、これは、6位に置換基がないことに関係しているかもしれない、(b)HSB−13およびHSB−22の4’−OHの重要性が、4’−OH基の代わりに4’−OAc基を有する(図2)ASK2による保護の減少、ならびに、3’,5’−ジブロモ(ASK−1)および3’,4’,5’−トリメトキシ(HSB−6)誘導体による神経保護の欠如によって、示される、(c)5μMで保護性であったHSB−7(ピリジン−2−イル)を例外として、複素環誘導体、すなわちHSB−11(チオフェン−2−イル)、HSB−12(チオフェン−3−イル)、HSB−4(チオフェン−3−イル)は不活性であった、そして(d)4’−OHから4’−OCOCH3エステルへの変換が入り混じった結果を与えた。例えば、化合物HSB−2(6−Cl)、HSB−5(6−F)およびHSB−3(6−メチル)は、25μMで高度に保護性であり、また、HSB−1(6−ニトロ)は、5μMで有効であったが他の2つの試験濃度では有効ではなかった。相対的に、4’−OH化合物である、HSB−13(6−NH2)、HSB−22(6−Cl)、およびASK−2a(6−H)は、3つ全ての濃度で有効であった。
【0070】
3−置換インドロンを用いた先の研究が、2位のC=OをC=Sで置換することは、神経保護活性を完全に破壊することを明らかにした(バルデラモスら、2008年)。しかしながら、本発明に含まれるベンゾキサジンの場合、ASK−9(ピロール−2−イルおよびN−Me)ならびにASK−11(2’,5’−ジメトキシフェニル)は、かなりのレベルの保護を示した。しかしながら、ASK−8(チオフェン−2−イル)は不活性であった。
【0071】
表1:21種の化合物の各々を3つの濃度(1μM、5μM、および25μM)で試験し、LK培地に加えた。生存を、HK培地を受けた対照培養における%生存で表す。データは、少なくとも3つの研究からの平均値を表し、それら研究の各々は、二つ組にして行われた。いかなる添加物も含まないLK培地において、平均生存は48%であった。
【化7】

【表1】

【表2】

【0072】
Raf−MEK−ERKおよびPI−3キナーゼ−Aktシグナル伝達は、多くの神経栄養ポリペプチド、薬理学的剤、および神経保護化合物の保護性効果を媒介する、哺乳動物細胞における2つのよく確立された強力な抗アポトーシス経路である(デメロおよびチン、2005年;ヘトマン(Hetman)ら、2006年)。これら経路のいずれも1,4−ベンゾキサジンの神経保護効果に関与するかどうかを決定するために、本発明者は、これらの経路の薬理学的阻害がそれらの神経保護性効力に影響を及ぼすかどうかを研究した。図3に示すように、構造的に異なるが高度に選択的な2つのMEK阻害剤である、PD98059もU0125も、HSB−13により神経保護性を減少しなかった。同様に、試験した化合物(PI−3キナーゼ阻害剤、ワートマニン、Akt阻害剤X、または、市販のAktの阻害剤)のいずれも、LK誘導アポトーシスに対してニューロンを保護するHSB−13の能力を減少しなかった(図3)。これらの研究で利用した投与量において、これらの阻害剤は、HK処理の結果生じるERKまたはAkt刺激を完全に阻害する。HSB−13で観察されたように、MEK−ERKおよびPI−3K−Akt経路の薬理学的阻害は、ASK−2aまたはHSB−22の神経保護作用に効果を及ぼさなかった。
【0073】
ウェスタンブロット解析を行って1,4−ベンゾキサジンによる神経保護がMEK−ERKまたはPI3キナーゼ−Aktシグナル伝達の活性化に関与しないことを確証した。MEK、ERK、およびAktの活性化は、それらのリン酸化を必要とし、リン酸化は、リン酸化部位特異的抗体を使用して検出することができる(チンら、2004年;ジョンソンら、2005年;Majdzadehら、2008年)。本発明者および他の者によって先に報告されたように(チンら、2004年;ジョンソンら、2005年;Majdzadehら、2008年)、MEKおよびERKのリン酸化は、小脳顆粒ニューロンのLK処理に続いて減少する。この減少は、HSB−13、HSB−22、またはASK−2aによって妨げられない(図4)。AktのSer473でのリン酸化はまた、LK処理の6時間後わずかに減少される(チンら、2004年;ジョンソンら、2005年;Majdzadehら、2008年)。このことも、ASK−2aまたはHSB−22を用いた処理による影響を受けない(図4)。しかしながら、HSB−13はLKにおいて見られるものよりもさらに多くのAkt(Ser473)リン酸化を阻害する。HSB−13と他の2つの神経保護化合物との間のリン酸化パターンの顕著な相違は、HSB−13がHSB−22およびASK−2aとは違ったようにシグナル伝達分子に影響を及ぼすということを示唆する。
【0074】
Raf−MEK−ERK経路およびPI−3キナーゼ−Akt経路は、HSB−13による神経保護に必要ではないので、ニューロン生存を促進することが知られている他のシグナル伝達分子の関与が決定された。GSK3βは、多くのニューロン系および非ニューロン系におけるアポトーシスの間に活性化されるアポトーシス促進分子である。生存促進条件下で、GSK3βを、Aktおよび他のキナーゼによって誘導されうる修飾である、阻害部位でのリン酸化によって不活性化された状態に保つ。図4に示すように、GSK3βの脱リン酸化は、HSB−13によって阻害されない。相対的に、HSB−22およびASK−2aはGSK3βの脱リン酸化を阻害する。
【0075】
小脳顆粒ニューロンのHKを用いた処理は、カルシウム−カルモジュリンキナーゼ(CaMK)を活性化し、KN−62などの薬理学的阻害剤を用いたCaMKの阻害は、HK媒介生存を阻害する(シー(See)ら、2001年;リスマン(Linseman)ら、2003年;モリソンら、2006年)。しかしながら、HSB−13による神経保護は、KN−62処理によって減少されない(図3)。本発明者は、幾人かの研究者がサイクリックAMP類似体およびプロテインキナーゼAの薬理学的活性化因子は、他の生存促進刺激がない場合に小脳顆粒ニューロンおよび他のニューロンタイプの生存を促進するということを示していることを認識した(ライデル(Rydel)およびグリーン(Greene)、1988年;デメロら、1993年;ハンソン(Hanson)ら、1998年)。PKA媒介ニューロン生存は、強力で選択的なPKA阻害剤である、H89を用いた処理によってブロッキングされる(リー(Li)ら、2000年;バーヴェ(Bhave)およびホフマン(Hoffman)、2004年)。図3に示すように、H89を用いた処理は、HSB−13媒介神経保護に影響を及ぼさない。本発明者は、トリコスタチンAなどのヒストンデアセチラーゼ阻害剤は、小脳顆粒ニューロンの生存を維持するHKの能力をブロッキングするということを先に報告している(サルミネン(Salminen)ら、1998年;Boutillierら、2002年;モリソンら、2006年)。しかしながら、TSA処理もまた、HSB−13の神経保護効力を著しく阻害するものではなかった(図3)。
【0076】
C−jun発現は、様々な組織培養、および、ニューロンアポトーシスの生体内範例において誘導される(シェンケル(Schenkel)ら、2004年)。この転写因子の活性化は、LK誘導小脳顆粒ニューロンにおけるニューロン死、ならびに他のモデルのニューロン死に必要であることが示されている(エスタス(Estus)ら、1994年;ハム(Ham)ら、1995年;ワトソン(Watson)ら、1998年)。図5に示すように、LKによるc−jun発現の誘導は、HSB−13、HSB−22、およびASK−2aによって阻害される。HSB−13を用いた処理は、c−jun発現を阻害し、それはHK処理培養で見られるものより低くさえある。発現がアポトーシスの間にニューロンにおいて刺激される別の転写因子は、CREBファミリータンパク質のメンバーである、ATF−3であり、これは、異なるモデルにおいてニューロン死を促進することが示されている(ハイ(Hai)ら、1999年;Vlugら、2005年;チェンら2008a年)。siRNAを使用したATF−3発現の抑制は、小脳顆粒ニューロンのLK媒介死を阻害し、このことは本発明者によって先に説明されている(チェンら、2008a年)。図5に示すように、ATF−3のLK媒介増加は、3つ全ての神経保護性ベンゾキサジンによって阻害される。c−junで観察されるように、この抑制は、HSB−13で最も頑強であった。結果として、これらの組成物は、c−junおよびATF−3の活性を阻害することができ、ひいてはガン、およびc−junのようなオンコプロテインを処置することにおいて役割を果たす。
【0077】
マウス神経芽腫HT−22細胞株のホモシステイン酸(HCA)を用いた処理は、グルタチオン欠乏および酸化ストレスを通してアポトーシスを誘導する(マーフィ(Murphy)ら、1990年;ラタン(Ratan)ら、1994a年、1994b年)。本発明者は、HSB−13、HSB−22、およびASK−2aが、この酸化ストレス誘導ニューロン死の範例において保護性であるかどうかを研究した。図6Aおよび図6Bに示すように、HSB−13は、HCA誘導細胞死を防ぐ。最も高い保護は、25μM濃度で観察されたが、HSB−13は、5μMでも頑強な保護をもたらした。驚くことに、それらの構造的類似性を鑑みて、ASK−2aおよびHSB−22は、検査された3つの投与量のいずれにおいても保護しなかった(データ示さず)。3つ全てのベンゾキサジンはLK媒介ニューロン死から保護するが、HSB−13のみがHCA誘導アポトーシスに対して保護性であるという研究結果は、これら2つの範例におけるアポトーシスの根底にある分子機構が異なるということを示唆する。さらに、この結果は、6位のアミノ基は(図2を参照のこと)HCA毒性に対する保護に必要であるということを示唆する。また我々は、HSB−13はAβ毒性に対して初代培養または皮脂ニューロンを保護するということ見出した。ゆえに、HSB−13は酸化ストレス誘導ニューロン死に対して保護性であるが、ASK−2aおよびHSB−22はそうではない。
【0078】
小脳顆粒ニューロン培養物、およびHT−22細胞は、HSB−13が組織培養範例において強力で多用途の神経保護効力を有するということを示した。げっ歯類およびヒト以外の霊長類におけるニトロプロピオン酸(3−NP)投与は、選択的線条体変性、自発舞踏病様運動、およびジストニー運動を含む、HDの臨床的および病態生理学的特徴の大部分を再現する。ゆえにこの神経毒の投与は、HDのための有用なモデルとして働く(Brouilletら、1999年)。本発明者は、この生体内範例においてHSB−13の効力を調査した。図7Aに示すように、3−NPを投与したマウスは、広範囲の線条体損傷を示した。この変性は、2mg/kg体重の濃度で投与された場合にHSB−13によって大幅に減少される(図7A)。3−NP誘導の線条体神経変性に対するHSB−13による保護は、自発運動遂行の著しい改善と相関した(図7B)。具体的には、全て3−NP投与によって損なわれた、総運動時間:総運動距離;運動ごとの平均距離、および、運動の平均速度は、HSB−13を受けた動物において顕著により高まり、HSB−13がハンチントン病(HD)の生体内モデルにおいて神経保護性であるということが証明された。
【0079】
本発明者はまた、遍在的にAPP695を発現するハエモデルを使用することによって、APP誘導毒性に対するHSB−13の有益な効果を研究した(グリーブら、2004年)。図8に示すように、無処置のハエは、APP695を発現しない同一条件下で飼養された対照ハエと比較して、たった約5%の生存率しか示さない。増加した濃度のHSB−13を含有する餌でこれらのハエを飼養することによって結果として、APP発現ハエの生存率において、等しく処置された対照ハエと比較して、50μMでの65%から50μMでの44%までの範囲と、著しく増加した。これらの生存率は、無処置ハエと比較してほぼ10倍高く(全てのp値<0.05)、このことは、HSB−13はまた、ショウジョウバエ生体内モデルにおいてAPP誘導毒性から保護するということを示す。
【0080】
ゆえに本発明は、小脳顆粒ニューロンのLK誘導アポトーシスに対して保護性である幾つかの新規の化合物を説明する。本発明の焦点は、3つのこれら化合物、つまりHSB−13、HSB−22、およびASK−2aであった。構造的に類似しているが、これらの化合物のうちの1つである、HSB−13だけが、海馬の神経芽腫HT22細胞のHCA誘導毒性に対して保護性である。ASK−2aおよびHSB−22は、一次顆粒ニューロンにおいて優れた神経保護を提供し、このことは、ASK−2aおよびHSB−22は、酸化ストレスが決定的な要素でないニューロン死の他の範例において効果的であり得るということを示唆する。LKおよびHCA誘導細胞死に加えて、HSB−13は、Aβ誘導毒性およびHCA毒性に対して一次皮質ニューロンを保護する。HSB−13の増加した多用途性は、単一置換基、すなわち6位のアミノ基の存在に起因すると考えられる。
【0081】
本明細書で提供されているデータは、HSB−13はまた、2つの別個の神経変性生体内モデルにおいて保護性であるということも証明している。実際、HSB−13は線条体変性を減少し、化学的に誘導されたハンチントン病のマウスモデルにおいて行動遂行を改善し、ハエにおいてAPP毒性から保護する。組織培養、および神経変性の生体内範例におけるHSB−13の有効性は、HSB−13またはその誘導体が、ヒト神経変性状態の治療における治療薬としての価値を有することができるということを示唆する。
【0082】
本発明者による研究は、PI−3キナーゼ−AktおよびRaf−MEK−ERKシグナル伝達経路、または、CaMK、PKAおよびHDACなどのHK媒介ニューロン生存に関与する他の分子が、これら化合物の保護する能力に関与しないということを示唆し、異なる作用機構を示唆する。しかしながら、これらの研究は、これらの化合物がATF−3およびc−junの活性化を阻害するが、このことが媒介される上流機構はまだ詳細に説明されないでいるということを示している。HCA誘導毒性から保護するその能力について観察したように、シグナル伝達分子のうちの幾つかにおけるHSB−13の効果は、HSB−22またはAsk−2a処理によって誘発された効果とは質的に異なる。例えば、ATF−3およびc−junの抑制は、HSB−22およびASK−2aで見られるものと比較して、HSB−13でははるかにより頑強である。HSB−13はまた、AktのSer473のリン酸化を阻害する唯一の化合物である。そしてGSK3活性化の程度は、その脱リン酸化によって判断すると、HSB−22およびASK−2aよりもHSB−13でより高まる。これらの相違点の幾つかは、何故HSB−13がHCA誘導毒性に対して保護性であるのに、HSB−22またはASK−2aはそうではないのかを説明することを可能にし得る。
【0083】
本発明の化合物の作用機構をより良く理解するために、限定目的ではなく、20種の異なるキナーゼに対するHSB−13およびASK−2aの効果を生体外で調べた。この研究の結果は、表2および表3に提示されている。500nM濃度で、ASK−2aは、GSK3α、GSK3β、p38α、p38β、JNK3、MLK3、および、B−Rafのキナーゼ活性を実質的に阻害した。上述のキナーゼを阻害することに加えて、HSB−13は、500nMで使用された場合、CDK1、CDK2、CDK5、および、ROCK1をも阻害した。双方の化合物とも、p38βに対して最も強力な阻害を示した。上記で説明したように、ASK−2aは、LK誘導死に対して小脳顆粒ニューロンを保護するが、HT−22細胞のHCA誘導毒性に対して無効性である。対照的に、HSB−13は、双方の範例において保護性である。これは、HCA処理HT−22培養におけるHSB−13の保護効果が、CDKへのその阻害効果に起因するということを示す。先の研究が、CDK阻害剤は多くの異なるアポトーシス刺激に対してニューロンを保護することができるということを確立している。
【0084】
100nMでHSB−13は、GSK3α、GSK3β、p38β、および、B−Rafを阻害することにおいて、相当により選択的である。強力な神経保護効果を有する3置換インドロンである、GW5074も、B−Rafを阻害する。GW5074はGSK3βを弱く阻害するが、B−Rafが構造的に異なる神経保護化合物によって阻害されるという研究結果は、このキナーゼの阻害を、神経保護の根底にある分子機構における重要事象として関係づける。
【0085】
表2:生体外で測定した20種の異なるキナーゼに対する500nMのASK−2aの効果。キナーゼ活性を(ASK−2aを用いない)対照アッセイにおける活性のパーセンテージとして表す。値は、二つ組にして行ったアッセイの平均である。キナーゼ活性の実質的な阻害(>20%)は、太字になっている。
【0086】
表2:生体外で測定した20種の異なるキナーゼに対する100nMおよび500nMのASK−2aの効果。
【表3】

【0087】
各キナーゼの活性を100nMまたは500nMいずれかのASK−2aの存在下、生体外で測定した。キナーゼ活性は、(ASK−2aを用いない)対照アッセイにおける活性のパーセンテージとして表す。値は、二つ組にして行ったアッセイの平均である。キナーゼ活性の実質的な阻害(>20%)は、太字になっている。
【0088】
HSB−13により、GSK3α、GSK3β、p38β、および、B−Rafは効果的に阻害されるということが見出された(100nM濃度で)。また、CDK1、CDK2、ROCK1、JNK2、MLK3、および、c−Rafも阻害された(これら全ては500nMで阻害される)。ASK2aを使用して、GSK3α、GSK3β、p38α、p38β、JNK3、および、B−Rafは効果的に阻害されるが(100nMで)、MLK3はより低い効率で阻害されるということが見出された。したがって、1,4−ベンゾキサジンの標的であるキナーゼは、GSK3α、GSK3β、p38α、p38β、B−Raf、CDK1、CDK2、JNK2、JNK3、および、MLK3を含む。
【0089】
表3:生体外で測定した20種の異なるキナーゼに対する500nMのHSB−13の効果。キナーゼ活性を(HSB−13を用いない)対照アッセイにおける活性のパーセンテージとして表す。値は、二つ組にして行ったアッセイの平均である。キナーゼ活性の実質的な阻害(>20%)は、太字になっている。
【0090】
表3:生体外で測定した20種の異なるキナーゼに対する100nMおよび500nMのHSB−13の効果。
【表4】

1,4−ベンゾキサジン化合物は、アポトーシスから培養ニューロンを保護するということを見出した。培養小脳顆粒ニューロンがLK培地に交換されると、約50%の細胞が24時間以内にアポトーシスを起こす。この研究では、図1に示された構造の合計20種の異なる1,4−ベンゾキサジン誘導体を、小脳顆粒ニューロンのLK誘導死から保護するそれらの能力について試験した。各化合物を3つの異なる投与量、すなわち1μM、5μM、および、25μMで試験した。ニューロン生存能を、アポトーシス細胞死の一般的で信頼性のあるアッセイである、DAPI染色によって定量化した。ニューロン死に対する効果の結果を表4にまとめた。幾つかの場合において、DAPI染色から得た結果を、2つの他のアポトーシスアッセイ、すなわちTUNEL染色および活性型カスパーゼ−3免疫細胞化学によって確証した。
【0091】
【表5】

【0092】
表4は、20種の化合物を提供しており、それら各々が3つの濃度(1μM、5μM、および25μM)で試験されLK培地に加えられた。生存を、HK培地を受けた対照培養における生存の%で表す。データは少なくとも3回の実験からの平均値を表し、その実験の各々は二つ組にして行われた。いかなる添加物も含まないLK培地において、平均生存は48.16±8.44%であった。化合物は、表4に記載された置換を伴う以下に記載された基本構造を有した。
【化8】

【0093】
詳細な構造活性相関は行わなかったが、20種の化合物の我々の分析は、以下のことを示唆する。(1)親化合物(コア構造については表4を参照のこと)、最も有効な神経保護化合物はASK−2(Ar=3,5−ジブロモ−4−ヒドロキシフェニル)である。表4に示すように、ASK−2は25μMおよび5μMで高度に保護的であるが(それぞれ102.5%および92.1%)、1μLでは中程度に保護的なだけである(80.3%)。4−OHの重要性は、3,5−ジブロモ(ASK−1)、および3,4,5−トリメトキシ(HSB−6)誘導体による神経保護の欠如によって示される。5μMで中程度に活性(88%)であったHSB−7(ピリジル−3−イル)を例外として、親複素環誘導体、すなわちASK−9(チオフェン−2−イル)、HSB−4(チオフェン−3−イル)は不活性であった。(2)ASK−2の6位をアミノ基または塩素原子で置換することにより[HSB−13またはHSB−22]、ある特定濃度で改善した活性がもたらされる。例えば、HSB−22は、全ての濃度で高度に保護的であり、すなわち1μM、5μM、および、25μMで、それぞれ92%、97%、および、90.6%である。化合物HSB−13は、5μMのASK−2(92.2)よりもかなり有効であり(100.8%)、25μMのASK−2(102.5)とほぼ同じくらい有効(99.5)であった。(3)表題の化合物の神経保護能力への7位での置換は、6−置換と比較した場合はるかに不明白である。たった1つの濃度のみが高度に有効である。例えば、化合物HSB−2(7−Cl)、HSB−5(7−F)、およびHSB−(7−メチル)は、25μMの溶液において高度に保護性であり(〜97%)、HSB−1(7−ニトロ)は、5μMで有効であった。4つ全てが、他の2つの試験溶液において有効というわけではなかった。(4)C=OのC=Sによる置換は入り混じった結果を与えた。この研究では、ASK−9(ピロール−2−イルおよびN−Me)は1μMで中程度の活性(84.5%)であり、ASK−11(2,5−ジメトキシフェニル)は、5μMで高度に活性(90.7%)であった。しかしながら、ASK−8(チオフェン−2−イル)は不活性であった。
【0094】
培養小脳顆粒ニューロンの分析により、HSB−13は強力な神経保護効力を有するものとして特定された。したがって、我々はHSB−13を選択して、その保護効果が他のニューロンタイプおよびアポトーシス刺激にまで及ぶかどうかを調べた。海馬由来神経芽腫細胞株であるHT−22をホモシステイン酸(HCA)で処理することは、アポトーシスを導くグルタチオン欠乏に起因する酸化ストレスを引き起こす(マーフィら、1990年;ラタンら、1994a年、1994b年)。図9に示すように、2mMのHCAでの処理は、24時間でほぼ完全な細胞死をもたらし、これは25uM濃度のHSB−13によって妨げられた。HSB−13はこの範例において5uMで使用された場合は保護性ではなかった。
【0095】
HSB−13は、ハンチントン病(HD)の生体内モデルにおいて神経保護性である。げっ歯類およびヒト以外の霊長類におけるニトロプロピオン酸(3−NP)投与は、選択的線条体変性、自発舞踏病様運動、およびジストニー運動を含む、HDの臨床的および病態生理学的特徴の大部分を再現する。ゆえにこの神経毒の投与は、HDのための有用なモデルとして働く(Brouilletら、1999年に概説されている)。HSB−13の効力が決定された。図10Aに示すように、S−NPを投与したマウスは、広範囲の両側線条体損傷を示す。この変性は、2.5mg/kg体重の濃度で投与された場合にHSB−13によって大幅に減少される(図10)。3−NP誘導の線条体神経変性に対するHSB−13による保護は、自発運動遂行の著しい改善と相関した。具体的には、全て3−NP投与によって損なわれた、全運動エピソード、総運動距離、および、運動の平均速度は、HSB−13を受けた動物において顕著により高まった(図10B)。
【0096】
3−ニトロプロピオン酸投与および行動評価。生後8週のC57BL/6雄性マウス(マサチューセッツ州ウィルミントンのチャールズ・リバー・ラボラトリーズ社)に、HSB−13(92.5mg/kg)を用いるか、または用いずに、10回の腹腔内注射(50mg/kgを1日2回、5日間)で3−NPを投与した。HSB−13の注射は、3−NP投与の30分前までに行った。対照動物は生理食塩水注射を受けた。5日間の注射の後日、先に説明されたように(チンら、2004年)TRU−SCAN(登録商標)活動監視システム(ペンシルベニア州のクールバーン・インストルメンツ)を使用して自発運動活性をアッセイした。以下の行動パラメータを選択した:(i)全運動エピソード:床面における各運動とは、少なくとも1つのサンプル間隔の間で静止状態がない一連の座標変化である、(2)総運動距離:床面における全てのベクトルX−Y座標変化の合計、および、(3)平均速度:全てのX−T座標変化を定めた運動の平均速度。行動評価に続いて、マウスに深く麻酔をかけて脳を取り除いた。脳を0.1Mのリン酸緩衝液中の4%パラホルムアルデヒド内で固定し、0.1Mのリン酸緩衝液中の20%スクロース内で凍結保護した。冠状切片をクリオスタット上で50ミクロンに切断し、クレシルバイオレット(シグマ)で染色した。
【0097】
本発明は、神経保護剤としての1,4ベンゾキサジンの初めての実証であり、このクラスの化合物がヒト神経変性障害の治療のための新規治療薬になるという素晴しい可能性をもたらす。
【0098】
細胞のc−Rafおよび/またはB−Raf活性に対する化合物の効果の評価。c−RafまたはB−Rafの活性を、細胞溶解物による免疫沈降に続いて評価する。簡潔に言えば、約250μgのタンパク質を、(c−RafまたはB−Rafのいずれかに対する)1.0μgの一次抗体、および、12μLのタンパク質A/Gプラス・アガロースビーズとともに一晩インキュベートする。免疫沈降物を30秒間6000rpmで遠心分離することによって収集し、溶解緩衝液で2回、350mMのNaClを補った溶解緩衝液で2回、そしてキナーゼ緩衝液(25mMのpH7.4のHEPES、および、10mMのMgCl2)で2回、洗浄する。精製した組換えGST−MEK1 K97Mタンパク質を基質として、85μMのATPを補ったキナーゼ緩衝液に35分間30℃で加える。生体外キナーゼアッセイのために、化合物をキナーゼ緩衝液に加え、ATP添加によるキナーゼ反応が始まる前に、30℃で5分間インキュベートする。キナーゼ反応を6×SDSサンプル緩衝液の添加によって停止し、5分間沸騰させる。タンパク質をSDS−PAGEによって分離し、ウェスタンブロット法にかける。キナーゼ活性のレベルを、ウェスタンブロット法にしたがい、リン酸−MEK抗体により検出する。
【0099】
昆虫細胞から精製した化合物c−RafおよびB−Rafの効果。生体外キナーゼアッセイを、アップステイト・バイオテクノロジー(Upstate Biotechnology)のキナーゼ・プロファイリング・サービス(Kinase
Profiling service)を使用して、標準条件下で、精製キナーゼ(Sf9昆虫細胞のバキュロウイルスによって発現される)、および、合成基質を使用して行った。簡潔に言えば、各アッセイについて、5〜10mUの精製キナーゼを、8mMのpH7.2のMOPS、0.2mMのEDTA、10mMの酢酸マグネシウム、および、[γ−33P−ATP]を含有する緩衝液中の化合物(0.1〜1uM濃度)と共に40分間室温でインキュベートする。MBPを基質として使用する。キナーゼ活性は、33Pの取り込みを、P30フィルター上に一定分量を付け、50mMのリン酸中で洗浄してシンチレーション計数することによる測定によって定量化する。
【0100】
幾つかの場合、c−RafおよびB−Rafへの効果を、以下のようにSignalChemによってアッセイする。プロテインキナーゼアッセイを(二つ組または三つ組で)、周囲温度で20〜40分間、25μLの最終容量で行った。アッセイを33P−ATPの添加によって開始し、反応混合物を周囲温度でプロテインキナーゼ標的に応じて20〜40分間インキュベートした。インキュベーション期間の後、10μLの反応混合物をマルチスクリーン・ホスホセルロースP81プレート上に置くことによってアッセイを終了した。マルチスクリーン・ホスホセルロースP81プレートを1%リン酸溶液中でそれぞれ約15分間3回洗浄した。
【0101】
P81プレート上の放射能をTriluxシンチレーションカウンター内でシンチレーション流体の存在下で計数した。適切な基質の添加を除いて、ブランク対照を全てのアッセイ要素に含め(同量のアッセイ希釈緩衝液で置き換える)、各プロテインキナーゼ標的に対して据えた。各プロテインキナーゼ標的に対する修正した活性を、ブランク対照値を除くことによって決定した。
【0102】
本明細書において論じられた任意の実施形態は、本発明の任意の方法、キット、試薬、または組成物に関して実施されうる、あるいはその逆についても同様であることが企図されている。さらに、本発明の組成物は、本発明の方法を達成するために使用されうる。
【0103】
本明細書において説明された特定の実施形態は、例示目的で示されており、本発明の限定として示されているのではないことは理解されるであろう。本発明の主要な特徴は、本発明の範囲から逸脱することなく様々な実施形態において利用されうる。当業者は、本明細書において説明された具体的な手順に対する多数の同等物を認識する、あるいは、単なる日常の実験を使用して、それらを確認することができるであろう。そのような同等物は、本発明の範囲内にあると見なされ、特許請求の範囲によって含まれる。
【0104】
本明細書において言及された全ての刊行物および特許出願は、本発明が属する技術分野の通常の技術者の技術レベルを示す。全ての刊行物および特許出願は、個々の各刊行物または特許出願が具体的に個々に示されて参照により組み込まれたかのような程度に、参照によって本明細書において組み込まれる。
【0105】
語「a」または「an」の使用は、特許請求の範囲および/または明細書において用語「含む(comprising)」と関連して使用される場合、「1つ」を意味することができるが、「1以上」、「少なくとも1つ」、および、「1または2以上」の意味とも一致する。特許請求の範囲において用語「または」の使用は、二者択一のみに言及するか、またはその二者択一は相互に排他的であるように明らかに指示されていない限り「および/または」を意味するように使用されるが、本開示は、二者択一ならびに「および/または」のみに言及する定義を支持する。本出願の全体にわたって、用語「約」が、値が装置の誤差による固有の変動、この値を決定するために利用される方法、または、研究対象の中に存在する変動を含むことを示すために使用される。
【0106】
本明細書および請求項に使用されるように、語「含む(comprising)」(およびcomprisingの任意の形態、例えば「comprise」および「comprises」など)、語「有する(having)」(およびhavingの任意の形態、例えば「have」および「has」など)、語「含む(including)」(およびincludingの任意の形態、例えば「includes」および「include」など)、あるいは、語「含有する(containing)」(およびcontainingの任意の形態、例えば「contains」および「contain」など)は包含的であり、すなわち制限がなく、追加の列挙されていない要素または方法ステップを排除するものではない。
【0107】
本明細書において使用される用語「またはその組み合わせ」は、この語の前に列挙されている項目の全ての並べ替えおよび組み合わせを指す。例えば、「A、B、C、またはその組み合わせ」は、A、B、C、AB、AC、BCもしくはABC、また特定の文脈で順番が重要な場合には、BA、CA、CB、CBA、BCA、ACB、BACもしくはCAB:のうちの少なくとも1つを含むように意図される。この例を続けると、1以上の項目もしくは用語の繰り返しを含む組み合わせ、例えばBB、AAA、MB、BBC、AAABCCCC、CBBAAA、CABABBなどがはっきりと含まれる。当業者は、典型的には、文脈から特に明らかでない限り、項目または任意の組み合わせの項目の数に制限はないということを理解するであろう。
【0108】
本明細書において開示され主張された組成物および/または方法の全ては、本開示を考慮すると過度な実験をすることなく作製され遂行されうる。本発明の組成物および方法は、好ましい実施形態によって説明されたが、変動が、組成物および/または方法に、ならびに、本明細書において説明された方法のステップもしくはステップのシーケンスにおいて、本発明の概念、精神および範囲から逸脱することなく、適用されうるということが当業者には明らかであろう。当業者にとって明らかなそのような類似の置換および修正の全ては、添付の特許請求の範囲によって定められる本明細書の精神、範囲および概念の範囲内にあると考えられる。
【0109】
〔参照〕
バルデラモス(Balderamos M)M、アンカチ(Ankati)H、アクバチニ(Akubathini)SK、パテル(Patel)AV、カミラ(Kamila)S、Mukherjee C、ワング(Wang)L、Biehl ER、デメロ(D'Mello)SR。(2008年)有効な神経保護剤としての3−置換インドリン−2−オンの合成および構造活性相関研究(Synthesis and Structure-Activity Relationship Studies of
3-Substituted Indolin-2-ones as Effective Neuroprotective Agents)。エクスペリメンタル・バイオロジー・アンド・メディスン(Exp Biol Med.)233:1395〜1402。
バーヴェ(Bhave)SV、ホフマン(Hoffman)PL。(2004年)ホスファチジルイノシトール3’−OHキナーゼおよびプロテインキナーゼA経路は、培養小脳顆粒ニューロンにおいて下垂体アデニリルシクラーゼ活性化ポリペプチドの抗アポトーシス効果を媒介する:エタノールによる調整(Phosphatidylinositol 3'-OH kinase and protein kinase A pathways
mediate the anti-apoptotic effect of pituitary adenylyl cyclase-activating
polypeptide in cultured cerebellar granule neurons: modulation by ethanol)。ジャーナル・オブ・ニューロケミストリー(J Neurochem.)88:359〜369。
ブランド(Brand)AHおよびペリモン(Perrimon)N、(1993年)細胞運命を変更し優性表現型を生成する手段としての標的遺伝子発現(Targeted gene expression as a means of altering cell fates and
generating dominant phenotypes)。ディベロップメント(Development)(英国ケンブリッジ)118:401〜415。
Boutillier,A.L.、E.Trinh、および、J.P.レフラー(Loeffler)(2002年)HDACタンパク質によるE2F1転写活性の構成的抑制は、ニューロン生存に必須である(Constitutive repression of E2F1 transcriptional activity through
HDAC proteins is essential for neuronal survival)。アナルズ・オブ・ザ・ニューヨークアカデミー・オブ・サイエンシス(Ann. N. Y. Acad. Sci.)973:438〜442。
チェン(Chen)HM、ワング(Wang)L、デメロ(D'Mello)SR。(2008a年)B−RafによるATF−3発現の阻害は、GW5074の神経保護作用を媒介する(Inhibition of ATF-3 expression by B -Raf mediates the
neuroprotective action of GW5074)。ジャーナル・オブ・ニューロケミストリー。2008年5月;105:1300〜1312。
チェン(Chen)H−C、ワング(Wang)L、デメロ(D'Mello)SR。(2008b年)市販で一般的に使用されるPKRの化学阻害剤は、サイクリン依存キナーゼを阻害することによってニューロンを保護する(A commercially available and commonly used chemical inhibitor of PKR
protects neurons by inhibiting cyclin-dependent kinase)ヨーロピアン・ジャーナル・オブ・ニューロサイエンス(Eur. J. Neurosci)(近刊)。
チン(Chin)PC、リュー(Liu)L、モリソン(Morrison)B、Bottiglieri T、ラタン(Ratan)RR、デメロ(D'Mello)SR。(2004年)c−Raf阻害剤GW5074は、MEK−ERKおよびAkt非依存性機構による神経変性の生体外および動物モデルにおいて神経保護を提供する(The c-Raf inhibitor GW5074 provides neuroprotection in vitro and in
an animal model of neurodegeneration through a MEK-ERK and Akt-independent
mechanism)。ジャーナル・オブ・ニューロケミストリー。90:595〜608。
デメロSR、ガルリ(Galli)C、カリサーノ(Calissano)P。(1993年)細胞外カリウムの減少による小脳顆粒ニューロンにおけるアポトーシス誘導:IGF−IおよびサイクリックAMPによる死の阻害(Induction of Apoptosis in Cerebellar Granule Neurons by Lowering of
Extracellular Potassiium : Inhibition of Death by IGF-I and cyclic AMP)。米国科学アカデミー紀要(Proc. Natl. Acad. Sci.)(米国)90:10989〜10993。
デメロSR、チンPC。(2005年)ニューロンアポトーシスの理解による神経変性状態の治療(Treating neurodegenerative conditions through the understanding of
neuronal apoptosis)。カレント・ドラッグ・ターゲッツ・CNS・アンド・ニューロロジカル・ディスオーダース(Curr Drug Targets CNS Neural Disord.)4:3〜23。
エスタス(Estus)S.、ザックス(Zaks)W.J.、フリーマン(Freeman)R.S.、グルダ(Gruda)M.、ブラボ(Bravo)R.、および、ジョンソン(Johnson)E.M.ジュニア(1994年)プログラムされた細胞死の間のニューロンにおける変化した遺伝子発現:ニューロンアポトーシスの必要に応じたc−junの識別(Altered gene expression in neurons during programmed cell death:
identification of c-jun as necessary for neuronal apoptosis)。ザ・ジャーナル・オブ・セル・バイオロジー127(J Cell Biol 127)、1717〜1727。
フォスグリーン(Fossgreen)A、ブルックナー(Bruckner)B、チェック(Czech)C、マスターズ(Masters)CL、Beyreuther Kら、(1998年)ヒトアミロイド前駆体タンパク質を発現する遺伝子導入ショウジョウバエは、γセクレターゼ活性および疱疹翼表現型を示す(Transgenic Drosophila expressing human amyloid precursor protein
show gamma-secretase activity and a blistered-wing phenotype)。米国科学アカデミー紀要95:13703〜13708。
グリーブ(Greeve)I、クレッチュマー(Kretzschmar)D、Tschape JA、Beyn A、Brellinger Cら、(2004年)遺伝子導入ショウジョウバエにおける年齢依存性神経変性およびアルツハイマーアミロイド斑形成(Age-dependent neurodegeneration and Alzheimer-amyloid plaque
formation in transgenic Drosophila)。ザ・ジャーナル・オブ・ニューロサイエンス(J Neurosci)24:3899〜3906。
ハイ(Hai)T.、ウルフガング(Wolfgang)C.D.、マーシー(Marsee)D.K.、アレン(Allen)A.E.、および、Sivaprasad U.(1999年)ATF3およびストレス反応(ATF3 and stress responses)。ジーン・エクスプッション7(Gene
Expr 7)、321〜335。
ハム(Ham)J.、Babij C、ホイットフィールド(Whitfield)J.、Pfarr C.M.、ルラルマン(Lallemand)D.、Yaniv M.、および、ルビン(Rubin)L.L.(1995年)c−Junドミナントネガティブ変異体は、プログラムされた細胞死から交感神経細胞を保護する(A c- Jun dominant negative mutant protects sympathetic neurons
against programmed cell death)。ニューロン14(Neuron 14)、927−939。
ハンソン(Hanson),M G,ジュニア;シェン(Shen),S;Wiemelt,A P;マクモリス(McMorris),F A;Barres,B A。(1998年)サイクリックAMP上昇は、生体外において脊髄運動ニューロンの生存を促進するのに十分である(Cyclic AMP elevation is sufficient to promote the survival of spinal
motor neurons in vitro)。ザ・ジャーナル・オブ・ニューロサイエンス。18:7361〜7371。
ヘトマン(Hetman)M、Kharebava G.(2006年)NMDA受容体によって活性化された生存シグナル伝達経路(Survival signaling pathways activated by NMDA receptors)。カレント・トピックス・イン・メディシナル・ケミストリー(Curr Top Med Chem.)6:787〜799。
ジョンソン(Johnson)K、リューL、Majdzadeh N、チャベス(Chavez)C、チンPC、モリソンB、ワングL、パークJ、Chugh P、チェンHM、デメロSR。(2005年)サイクリン依存性キナーゼ阻害剤GW8510によるニューロンアポトーシス阻害:神経保護剤の開発のためのスカフォールドとしての3’置換インドロンの識別(Inhibition of neuronal apoptosis by the cyclin-dependent kinase
inhibitor GW8510: identification of 3' substituted indolones as a scaffold for
the development of neuroprotective drugs)。ジャーナル・オブ・ニューロケミストリー。93:538〜548。
キングズバリ(Kingsbury)AE、ガロ(Gallo)V、ウッダムス(Woodhams)PL、バラージュ(Balazs)R。(1985年)化学的に定義された血清添加の培地で培養された小脳介在ニューロンの生存、形態、および接着特性(Survival, morphology and adhesion properties of cerebellar
interneurones cultured in chemically defined and serum-supplemented medium)。ブレイン・リサーチ(Brain Res.)349:17〜25。
レビ(Levi),G.、アロイシ(Aloisi),F.、チオッティ(Ciotti),M.T.、Thangnipon,W.、キングズバリ(Kingsburry),A.、および、バラージュ(Balazs),R.、98%純粋小脳顆粒細胞培養の調製(Preparation of
98% pure cerebellar granule cell cultures)(1989年)A.シャハル(Shahar),J.ヴェリス(Vellis)、およびB.A.ハブ(Habu)(編集)、神経系の切開および組織培養マニュアル(Dissection and
Tissue Culture Manual of the Nervous system)、アランR.リス(Alan
R. Liss)、ニューヨーク、211〜214ページ。
リーM、ワングX、メインツァー(Meintzer)MK、レッシグ(Laessig)T、バーンバウム(Birnbaum)MJ、ハイデンリッヒ(Heidenreich)KA。(2000年)サイクリックAMPは、グリコーゲン合成酵素キナーゼ3βのリン酸化によりニューロン生存を促進する(Cyclic AMP promotes neuronal survival by phosphorylation of glycogen
synthase kinase 3beta)。モレキュラー・セル・バイオロジー(Mol Cell Biol.)20:9356〜9363。
リスマン(Linseman)DA、バートリー(Bartley)CM、レー(Le)SS、レッシグTA、ブシャール(Bouchard)RJ、メインツァーMK、リーM、ハイデンリッヒKA。(2003年)内在性Ca(2+)による筋細胞エンハンサー因子−2リプレッサーヒストンデアセチラーゼ−5の不活性化//カルモジュリン依存性キナーゼIIは、脱分極媒介の小脳顆粒ニューロン生存を促進する(Inactivation of the myocyte enhancer factor-2 repressor histone
deacetylase-5 by endogenous Ca(2+) //calmodulin-dependent kinase II promotes
depolarization-mediated cerebellar granule neuron survival)。ザ・ジャーナル・オブ・バイオロジカル・ケミストリー(J Biol Chem.)278:41472〜41481。
Majdzadeh N、ワングL、モリソンBE、バッセル−デュビー(Bassel-Duby)R、オルソン(Olson)EN、デメロSR。(2008年)HDAC4は、細胞周期進行を阻害し、ニューロンを細胞死から保護する(HDAC4 inhibits cell-cycle progression and protects neurons from cell
death)。ディベロップメンタル・ニューロバイオロジー(Dev Neurobiol.)68:1076〜1092。
モロゾワ(Morozova)N、Khrapko K、パニー(Panee)J、リューW、ハーニー(Harney)JWら。(2007年)海馬細胞におけるグルタチオン欠乏は、HおよびLフェリチン、ならびにグルタチオンS−トランスフェラーゼmRNAのレベルを上昇させる(Glutathione depletion in hippocampal cells increases levels of H and
L ferritin and glutathione S-transferase mRNAs)。ジーンズ・トゥ・セルズ(Genes Cells)12: 561〜567。
モリソンBE、Majdzadeh N、チャン(Zhang)X、ライルス(Lyles)L、バッセル−デュビーR、オルソンEN、デメロSR(2006年)ヒストンデアセチラーゼ関連タンパク質による神経保護(Neuroprotection by histone deacetylase-related protein)。モレキュラー・セル・バイオロジー。26:3550〜3564。
マーフィ(Murphy),T.H.、シュナール(Schnaar),R.L.およびコイル(Coyle),J.T.(1990年)未熟皮質ニューロンは、シスチン取り込みの阻害によるグルタミン酸毒性に対して一意的に感受性がある。(Immature cortical neurons are uniquely sensitive to glutamate
toxicity by inhibition of cystine uptake)。ザ・FASEB・ジャーナル(Faseb J),4、1624〜1633。
ラタン(Ratan),R.R.、マーフィ,T.H.、および、バラバン(Baraban),J.M.(1994a年)巨大分子合成阻害剤は、システインをタンパク質合成からグルタチオンへそらすことによって胚皮質ニューロンにおける酸化ストレス誘導アポトーシスを防ぐ(Macromolecular synthesis inhibitors prevent oxidative stress-induced
apoptosis in embryonic cortical neurons by shunting cysteine from protein
synthesis to glutathione)。ザ・ジャーナル・オブ・ニューロサイエンス,14、4385〜4392。
ラタン,R.R.、マーフィ,T.H.、および、バラバン,J.M.(1994b年)酸化ストレスは、胚皮質ニューロンにおいてアポトーシスを誘導する(Oxidative stress induces apoptosis in embryonic cortical neurons)。ジャーナル・オブ・ニューロケミストリー,62、376〜379。
ライデル(Rydel),R E;グリーン(Greene),L A。cAMP類似体は、神経成長因子とは無関係にラット交感および感覚ニューロン培養物において生存および神経突起成長を促進する(cAMP analogs promote survival and neurite outgrowth in cultures of
rat sympathetic and sensory neurons independently of nerve growth factor)。米国科学アカデミー紀要1988年;85:1257〜1261。
サルミネン(Salminen)A、タピオラ(Tapiola)T、コルホネン(Korhonen)P、スローネン(Suuronen)T。(1998年)ヒストンデアセチラーゼ阻害剤により誘導されたニューロンアポトーシス(Neuronal apoptosis induced by histone deacetylase inhibitors)。ブレイン・リサーチ・モレキュラー・ブレイン・リサーチ(Brain Res Mol Brain Res.)61:203〜206。
シェンケル(Schenkel)J.(2004年)生体内での神経変性に続くc−Jun転写因子の活性化(Activation of the c-Jun transcription factor following
neurodegeneration in vivo)。ニューロサイエンス・レターズ(Neurosci
Lett.)。361:36〜39。
シー(See)V、Boutillier AL、ビト(Bito)H、レフラー(Loeffler)JP。(2001年)カルシウム/カルモジュリン依存性プロテインキナーゼIV型(CaMKIV)は、小脳顆粒ニューロンにおいてカリウム欠乏によって誘導されるアポトーシスを阻害する。(Calcium/calmodulin-dependent protein kinase type IV (CaMKIV)
inhibits apoptosis induced by potassium deprivation in cerebellar granule
neurons)。ザ・FASEB・ジャーナル 15:134〜144。
Thangnipon W、キングズバリA、ウェブ(Webb)M、バラージュR。(1983年)生体外でのラット小脳細胞の観察:基層の影響、カリウム濃度、および、ニューロンとアストロサイトとの間の関係
(Observations on rat cerebellar cells in vitro: influence of
substratum, potassium concentration and relationship between neurones and
astrocytes)。ブレイン・リサーチ。313:177〜89。
Vlug A.S.、Teuling E.、Haasdijk E.D.、フレンチ(French)P.、フーゲンラード(Hoogenraad)C.C.、および、Jaarsma D.(2005年)ATF3発現は、筋萎縮性側索硬化症−SOD1遺伝子導入マウスにおける脊髄運動ニューロンの死に先行し、c−Junリン酸化、CHOP発現、細胞体樹状突起ユビキチン化、および、ゴルジ断片化に相関する(ATF3 expression precedes death of spinal motoneurons in amyotrophic
lateral sclerosis-SODl transgenic mice and correlates with c-Jun
phosphorylation, CHOP expression, somato-dendritic ubiquitination and Golgi
fragmentation)。ヨーロピアン・ジャーナル・オブ・ニューロサイエンス 22,1881〜1894。
ワトソン(Watson)A.、エイラーズ(Eilers)A.、ルラルマンD.、Kyriakis J.、ルビンL.L.、および、ハムJ.(1998年)c−Junのリン酸化は、小脳顆粒ニューロンにおける生存シグナル伝達中止により誘導されるアポトーシスに必要である。(Phosphorylation of c-Jun is necessary for apoptosis induced by
survival signal withdrawal in cerebellar granule neurons)。ザ・ジャーナル・オブ・ニューロサイエンス18,751〜762。
ヤルチン(Yalcin)A、Koulich E、モハメド(Mohamed)S、リューL、デメロSR。(2003年)小脳顆粒ニューロンにおけるアポトーシスは、CBP過剰リン酸化に関連し、CBPとNF−KBとの間の相互作用を減少させる(Apoptosis in cerebellar granule neurons is associated with CBP
hyperphosphorylation and reduced interaction between CBP and NF-KB)ジャーナル・オブ・ニューロケミストリー 84:397〜408。
【特許請求の範囲】
【請求項1】
式(I)の化合物であって、
【化1】

式中、
Aは、C、N、S、Oから選択され;
Bは、C、N、S、Oから選択され;
R1〜R7は、H、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、C1〜C6エーテル基、C1〜C6エステル基、C1〜C6アルキルアルカノアート基、C1〜C6アルコキシ基、ケト基、および、オキソ基から独立して選択され;
R8は、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、エーテル基、エステル基、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基であり;
R9〜R13は、H、C1〜C6アルキル;C1〜C6アルケニル、ハロ、置換されたC1〜C6アルキル、置換されたC1〜C6アルケニル、カルボニル、炭酸エステル、アセトキシ基、アセチル基、エーテル、エステル、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基から独立して選択される、化合物。
【請求項2】
Aは、Oから選択され;
Bは、Nから選択され;
R2〜R6は、H、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、C1〜C6エーテル基、C1〜C6エステル基、C1〜C6アルキルアルカノアート基、C1〜C6アルコキシ基、ケト基、および、オキソ基から独立して選択され;
R7は、オキソ基であり;
R8は、C1アルケニル基であり;
R9およびR13は、ハロゲンであり;
R10〜R12は、水素であり;
R11は、アセトキシ基である、請求項1に記載の化合物。
【請求項3】
(Z)−2,6−ジブロモ−4−((3−オキソ−3,4−ジヒドロ−2Η−ベンゾ[b][l,4]オキサジン−2−イリデン)メチル)フェニルアセタートと、
(Z)−2−(3,5−ジブロモベンジリデン)−2H−ベンゾ[b][l,4]オキサジン−3(4H)−オンと、
を含む、化合物。
【請求項4】
対象において神経学的状態から保護する方法であって、
前記神経学的状態から保護する必要がある対象を特定するステップと、
前記対象に以下の式を含む組成物を提供するステップと、を含み、
【化2】

式中、
Aは、C、N、S、Oから選択され;
Bは、C、N、S,Oから選択され;
R1〜R7は、H、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、C1〜C6エーテル基、C1〜C6エステル基、C1〜C6アルキルアルカノアート基、C1〜C6アルコキシ基、ケト基、および、オキソ基から独立して選択され;
R8は、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、エーテル基、エステル基、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基であり;
R9〜R13は、H、C1〜C6アルキル;C1〜C6アルケニル、ハロ、置換されたC1〜C6アルキル、置換されたC1〜C6アルケニル、カルボニル、炭酸エステル、アセトキシ基、アセチル基、エーテル、エステル、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基から独立して選択される、方法。
【請求項5】
Aは、Oから選択され;
Bは、Nから選択され;
R2〜R6は、H、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、C1〜C6エーテル基、C1〜C6エステル基、C1〜C6アルキルアルカノアート基、C1〜C6アルコキシ基、ケト基、および、オキソ基から独立して選択され;
R7は、オキソ基であり;
R8は、C1アルケニル基であり;
R9およびR13は、ハロゲンであり;
R10〜R12は、水素であり;
R11は、アセトキシ基である、請求項4に記載の方法。
【請求項6】
前記神経学的状態は、これらに限定されないが、アルツハイマー病、パーキンソン病、ハンチントン病、発作、および、虚血性発作を含む、請求項4に記載の方法。
【請求項7】
前記対象は、ヒト、ヒト以外の霊長類、イヌ、ネコ、ウマ、雌ウシ、雄ウシ、ラット、マウス、および、ハエから選択される、請求項4に記載の方法。
【請求項8】
前記神経学的状態からの前記保護は、1以上のニューロンの死、1以上のニューロンの損失、1以上のニューロンにおける毒性の防止、改善された自発運動遂行、あるいは、アミロイド前駆体タンパク質および他の部分の毒性効果からの保護を含む、請求項4に記載の方法。
【請求項9】
神経学的状態から対象を保護する方法であって、
前記対象に治療有効量の(Z)−2,6−ジブロモ−4−((3−オキソ−3,4−ジヒドロ−2Η−ベンゾ[b][l,4]オキサジン−2−イリデン)メチル)フェニルアセタート、(Z)−2−(3,5−ジブロモベンジリデン)−2H−ベンゾ[b][l,4]オキサジン−3(4H)−オンを提供するステップを含む、方法。
【請求項10】
神経学的状態から対象を保護する方法であって、
前記神経学的状態から保護する必要のある前記対象を特定するステップと、
前記対象に治療有効量の以下の式を有する組成物を提供するステップと、を含み、
【化3】

式中、
Aは、C、N、S、Oから選択され;
Bは、C、N、S、Oから選択され;
R1〜R7は、H、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、C1〜C6エーテル基、C1〜C6エステル基、C1〜C6アルキルアルカノアート基、C1〜C6アルコキシ基、ケト基、および、オキソ基から独立して選択され;
R8は、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、エーテル基、エステル基、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基であり;
R9〜R13は、H、C1〜C6アルキル;C1〜C6アルケニル、ハロ、置換されたC1〜C6アルキル、置換されたC1〜C6アルケニル、カルボニル、炭酸エステル、アセトキシ基、アセチル基、エーテル、エステル、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基から独立して選択される、方法。
【請求項11】
前記神経学的状態は、これらに限定されないが、アルツハイマー病、パーキンソン病、ハンチントン病、発作、および、虚血性発作を含む、請求項10に記載の方法。
【請求項12】
前記対象は、ヒト、ヒト以外の霊長類、イヌ、ネコ、ウマ、雌ウシ、雄ウシ、ラット、マウス、および、ハエから選択される、請求項10に記載の方法。
【請求項13】
前記神経学的状態からの前記保護は、1以上のニューロンの死、1以上のニューロンの損失、1以上のニューロンにおける毒性の防止、改善された自発運動遂行、あるいは、アミロイド前駆体タンパク質および他の部分の毒性効果からの保護を含む、請求項4に記載の方法。
【請求項14】
対象においてキナーゼを阻害する方法であって、
増加したキナーゼ活性から保護する必要のある前記対象を特定するステップと、
前記対象においてキナーゼ活性を減少させるのに有効な量の以下の式を含む組成物を前記対象に提供するステップと、を含み、
【化4】

式中、
Aは、C、N、S、Oから選択され;
Bは、C、N、S、Oから選択され;
R1〜R7は、H、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、C1〜C6エーテル基、C1〜C6エステル基、C1〜C6アルキルアルカノアート基、C1〜C6アルコキシ基、ケト基、および、オキソ基から独立して選択され;
R8は、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、エーテル基、エステル基、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基であり;
R9〜R13は、H、C1〜C6アルキル;C1〜C6アルケニル、ハロ、置換されたC1〜C6アルキル、置換されたC1〜C6アルケニル、カルボニル、炭酸エステル、アセトキシ基、アセチル基、エーテル、エステル、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基から独立して選択される、方法。
【請求項15】
前記対象においてキナーゼ活性のレベルを測定するステップをさらに含む、請求項14に記載の方法。
【請求項16】
キナーゼ活性の増加から保護する必要のある前記対象は、神経学的状態を有する、請求項14に記載の方法。
【請求項17】
前記神経学的状態は、アルツハイマー病、パーキンソン病、ハンチントン病、発作、または、虚血性発作を含む、請求項16に記載の方法。
【請求項18】
前記キナーゼ活性の減少は、神経学的状態から保護することであり、1以上のニューロンの死、1以上のニューロンの損失、1以上のニューロンにおける毒性の防止、改善された自発運動遂行、あるいは、アミロイド前駆体タンパク質および他の部分の毒性効果からの保護を含む、請求項14に記載の方法。
【請求項19】
前記対象はガンを患っている、請求項14に記載の方法。
【請求項20】
前記阻害されたキナーゼは、GSK3α、GSK3β、p38β、および、B−Rafのうちの少なくとも1つを含む、請求項14に記載の方法。
【請求項21】
前記阻害されたキナーゼは、CDK1,CDK2、ROCK1、JNK2、MLK3、および、c−Rafのうちの少なくとも1つを含む、請求項14に記載の方法。
【請求項22】
前記阻害剤は、100〜500nMの間で提供される、請求項14に記載の方法。
【請求項23】
前記対象に前記化合物を提供して処置後の活性を決定する前に、GSK3α、GSK3β、p38α、p38β、B−Raf、CDKl、CDK2、JNK2、JNK3、および、MLK3のうちの少なくとも1つの活性を決定するステップをさらに含む、請求項14に記載の方法。
【請求項24】
前記状態は、ウイルス感染を含む、請求項14に記載の方法。
【請求項1】
式(I)の化合物であって、
【化1】

式中、
Aは、C、N、S、Oから選択され;
Bは、C、N、S、Oから選択され;
R1〜R7は、H、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、C1〜C6エーテル基、C1〜C6エステル基、C1〜C6アルキルアルカノアート基、C1〜C6アルコキシ基、ケト基、および、オキソ基から独立して選択され;
R8は、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、エーテル基、エステル基、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基であり;
R9〜R13は、H、C1〜C6アルキル;C1〜C6アルケニル、ハロ、置換されたC1〜C6アルキル、置換されたC1〜C6アルケニル、カルボニル、炭酸エステル、アセトキシ基、アセチル基、エーテル、エステル、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基から独立して選択される、化合物。
【請求項2】
Aは、Oから選択され;
Bは、Nから選択され;
R2〜R6は、H、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、C1〜C6エーテル基、C1〜C6エステル基、C1〜C6アルキルアルカノアート基、C1〜C6アルコキシ基、ケト基、および、オキソ基から独立して選択され;
R7は、オキソ基であり;
R8は、C1アルケニル基であり;
R9およびR13は、ハロゲンであり;
R10〜R12は、水素であり;
R11は、アセトキシ基である、請求項1に記載の化合物。
【請求項3】
(Z)−2,6−ジブロモ−4−((3−オキソ−3,4−ジヒドロ−2Η−ベンゾ[b][l,4]オキサジン−2−イリデン)メチル)フェニルアセタートと、
(Z)−2−(3,5−ジブロモベンジリデン)−2H−ベンゾ[b][l,4]オキサジン−3(4H)−オンと、
を含む、化合物。
【請求項4】
対象において神経学的状態から保護する方法であって、
前記神経学的状態から保護する必要がある対象を特定するステップと、
前記対象に以下の式を含む組成物を提供するステップと、を含み、
【化2】

式中、
Aは、C、N、S、Oから選択され;
Bは、C、N、S,Oから選択され;
R1〜R7は、H、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、C1〜C6エーテル基、C1〜C6エステル基、C1〜C6アルキルアルカノアート基、C1〜C6アルコキシ基、ケト基、および、オキソ基から独立して選択され;
R8は、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、エーテル基、エステル基、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基であり;
R9〜R13は、H、C1〜C6アルキル;C1〜C6アルケニル、ハロ、置換されたC1〜C6アルキル、置換されたC1〜C6アルケニル、カルボニル、炭酸エステル、アセトキシ基、アセチル基、エーテル、エステル、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基から独立して選択される、方法。
【請求項5】
Aは、Oから選択され;
Bは、Nから選択され;
R2〜R6は、H、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、C1〜C6エーテル基、C1〜C6エステル基、C1〜C6アルキルアルカノアート基、C1〜C6アルコキシ基、ケト基、および、オキソ基から独立して選択され;
R7は、オキソ基であり;
R8は、C1アルケニル基であり;
R9およびR13は、ハロゲンであり;
R10〜R12は、水素であり;
R11は、アセトキシ基である、請求項4に記載の方法。
【請求項6】
前記神経学的状態は、これらに限定されないが、アルツハイマー病、パーキンソン病、ハンチントン病、発作、および、虚血性発作を含む、請求項4に記載の方法。
【請求項7】
前記対象は、ヒト、ヒト以外の霊長類、イヌ、ネコ、ウマ、雌ウシ、雄ウシ、ラット、マウス、および、ハエから選択される、請求項4に記載の方法。
【請求項8】
前記神経学的状態からの前記保護は、1以上のニューロンの死、1以上のニューロンの損失、1以上のニューロンにおける毒性の防止、改善された自発運動遂行、あるいは、アミロイド前駆体タンパク質および他の部分の毒性効果からの保護を含む、請求項4に記載の方法。
【請求項9】
神経学的状態から対象を保護する方法であって、
前記対象に治療有効量の(Z)−2,6−ジブロモ−4−((3−オキソ−3,4−ジヒドロ−2Η−ベンゾ[b][l,4]オキサジン−2−イリデン)メチル)フェニルアセタート、(Z)−2−(3,5−ジブロモベンジリデン)−2H−ベンゾ[b][l,4]オキサジン−3(4H)−オンを提供するステップを含む、方法。
【請求項10】
神経学的状態から対象を保護する方法であって、
前記神経学的状態から保護する必要のある前記対象を特定するステップと、
前記対象に治療有効量の以下の式を有する組成物を提供するステップと、を含み、
【化3】

式中、
Aは、C、N、S、Oから選択され;
Bは、C、N、S、Oから選択され;
R1〜R7は、H、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、C1〜C6エーテル基、C1〜C6エステル基、C1〜C6アルキルアルカノアート基、C1〜C6アルコキシ基、ケト基、および、オキソ基から独立して選択され;
R8は、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、エーテル基、エステル基、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基であり;
R9〜R13は、H、C1〜C6アルキル;C1〜C6アルケニル、ハロ、置換されたC1〜C6アルキル、置換されたC1〜C6アルケニル、カルボニル、炭酸エステル、アセトキシ基、アセチル基、エーテル、エステル、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基から独立して選択される、方法。
【請求項11】
前記神経学的状態は、これらに限定されないが、アルツハイマー病、パーキンソン病、ハンチントン病、発作、および、虚血性発作を含む、請求項10に記載の方法。
【請求項12】
前記対象は、ヒト、ヒト以外の霊長類、イヌ、ネコ、ウマ、雌ウシ、雄ウシ、ラット、マウス、および、ハエから選択される、請求項10に記載の方法。
【請求項13】
前記神経学的状態からの前記保護は、1以上のニューロンの死、1以上のニューロンの損失、1以上のニューロンにおける毒性の防止、改善された自発運動遂行、あるいは、アミロイド前駆体タンパク質および他の部分の毒性効果からの保護を含む、請求項4に記載の方法。
【請求項14】
対象においてキナーゼを阻害する方法であって、
増加したキナーゼ活性から保護する必要のある前記対象を特定するステップと、
前記対象においてキナーゼ活性を減少させるのに有効な量の以下の式を含む組成物を前記対象に提供するステップと、を含み、
【化4】

式中、
Aは、C、N、S、Oから選択され;
Bは、C、N、S、Oから選択され;
R1〜R7は、H、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、C1〜C6エーテル基、C1〜C6エステル基、C1〜C6アルキルアルカノアート基、C1〜C6アルコキシ基、ケト基、および、オキソ基から独立して選択され;
R8は、C1〜C6アルキル基、C1〜C6アルケニル基、ハロ基、置換されたC1〜C6アルキル基、置換されたC1〜C6アルケニル基、カルボニル基、炭酸エステル基、エーテル基、エステル基、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基であり;
R9〜R13は、H、C1〜C6アルキル;C1〜C6アルケニル、ハロ、置換されたC1〜C6アルキル、置換されたC1〜C6アルケニル、カルボニル、炭酸エステル、アセトキシ基、アセチル基、エーテル、エステル、アルキルアルカノアート基、アルコキシ基、ケト基、および、オキソ基から独立して選択される、方法。
【請求項15】
前記対象においてキナーゼ活性のレベルを測定するステップをさらに含む、請求項14に記載の方法。
【請求項16】
キナーゼ活性の増加から保護する必要のある前記対象は、神経学的状態を有する、請求項14に記載の方法。
【請求項17】
前記神経学的状態は、アルツハイマー病、パーキンソン病、ハンチントン病、発作、または、虚血性発作を含む、請求項16に記載の方法。
【請求項18】
前記キナーゼ活性の減少は、神経学的状態から保護することであり、1以上のニューロンの死、1以上のニューロンの損失、1以上のニューロンにおける毒性の防止、改善された自発運動遂行、あるいは、アミロイド前駆体タンパク質および他の部分の毒性効果からの保護を含む、請求項14に記載の方法。
【請求項19】
前記対象はガンを患っている、請求項14に記載の方法。
【請求項20】
前記阻害されたキナーゼは、GSK3α、GSK3β、p38β、および、B−Rafのうちの少なくとも1つを含む、請求項14に記載の方法。
【請求項21】
前記阻害されたキナーゼは、CDK1,CDK2、ROCK1、JNK2、MLK3、および、c−Rafのうちの少なくとも1つを含む、請求項14に記載の方法。
【請求項22】
前記阻害剤は、100〜500nMの間で提供される、請求項14に記載の方法。
【請求項23】
前記対象に前記化合物を提供して処置後の活性を決定する前に、GSK3α、GSK3β、p38α、p38β、B−Raf、CDKl、CDK2、JNK2、JNK3、および、MLK3のうちの少なくとも1つの活性を決定するステップをさらに含む、請求項14に記載の方法。
【請求項24】
前記状態は、ウイルス感染を含む、請求項14に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6A】


【図6B】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6A】


【図6B】


【図7】


【図8】


【図9】


【図10】


【公表番号】特表2012−500220(P2012−500220A)
【公表日】平成24年1月5日(2012.1.5)
【国際特許分類】
【出願番号】特願2011−523206(P2011−523206)
【出願日】平成21年8月14日(2009.8.14)
【国際出願番号】PCT/US2009/053932
【国際公開番号】WO2010/019911
【国際公開日】平成22年2月18日(2010.2.18)
【出願人】(500039463)ボード・オブ・リージエンツ,ザ・ユニバーシテイ・オブ・テキサス・システム (115)
【出願人】(511039119)サザン メソディスト ユニバーシティー (1)
【Fターム(参考)】
【公表日】平成24年1月5日(2012.1.5)
【国際特許分類】
【出願日】平成21年8月14日(2009.8.14)
【国際出願番号】PCT/US2009/053932
【国際公開番号】WO2010/019911
【国際公開日】平成22年2月18日(2010.2.18)
【出願人】(500039463)ボード・オブ・リージエンツ,ザ・ユニバーシテイ・オブ・テキサス・システム (115)
【出願人】(511039119)サザン メソディスト ユニバーシティー (1)
【Fターム(参考)】
[ Back to top ]

