神経変性疾患の治療薬
【課題】安全かつ簡便に調製することができ、神経系疾患の治療に有効な細胞材料を提供することを課題とする。
【解決手段】骨髄又は臍帯血由来の単離された、神経細胞又はグリア細胞へ分化しうる細胞であって、SH2(+)、SH3(+)、SH4(+)、CD29(+)、CD44(+)、CD14(−)、CD34(−)、及びCD45(−)の性質で単離された細胞からなる、神経変性疾患の治療薬を提供する。
【解決手段】骨髄又は臍帯血由来の単離された、神経細胞又はグリア細胞へ分化しうる細胞であって、SH2(+)、SH3(+)、SH4(+)、CD29(+)、CD44(+)、CD14(−)、CD34(−)、及びCD45(−)の性質で単離された細胞からなる、神経変性疾患の治療薬を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、骨髄細胞、臍帯血細胞、または胎児肝臓細胞由来の、神経系細胞へ分化しうる細胞および該細胞を含む細胞分画に関する。該細胞および細胞分画は、神経系疾患の治療、特に、自家移植治療への応用が期待される。
【背景技術】
【0002】
稀突起膠細胞(オリゴデンドログリア:oligodendrocyte)(Archer DR,et al.1994.Exp Neurol 125:268−77.、Blakemore WF,Crang AJ.1988.Dev Neurosci 10:1−11.、Gumpel M,et al.1987.Ann New York Acad Sci 495:71−85.)、またはシュワン細胞(Blakemore WF.1977.Nature 266:68−9.、Blakemore WF,Crang AJ.1988.Dev Neurosci 10:1−11.、Honmou O,et al.1996.J Neurosci 16:3199−208.)もしくはオルファクトリーエンシーティング細胞(olfactory ensheating cells)(Franklin RJ,et al.1996.Glia 17:217−24.、Imaizumi T,et al.1998.J Neurosci 18(16):6176−6185.、Kato T,et al.2000.Glia 30:209−218.)などの髄鞘形成細胞を移植すると、動物モデルにおいて再有髄化が誘発され、電気生理学機能を回復させることができる(Utzschneider DA,et al.1994.Proc Natl Acad Sci USA 91:53−7.、Honmou O,et al.1996.J Neurosci 16:3199−208.)。このような細胞を患者若しくは他人から調製して、細胞治療法に用いることも不可能ではないが、組織材料を脳または神経から採取しなければならないため問題が多い。
【0003】
脳から得られる神経前駆細胞または幹細胞には、自己複製能力があり、さまざまな細胞系譜の神経細胞や膠細胞に分化することが知られている(Gage FH,et al.1995.Proc Natl Acad Sci USA 92:11879−83.、Lois C,Alvarez−Buylla A.1993.Proc Natl Acad Sei USA 90:2074−7.、Morshead CM,et al.1994.Neuron 13:1071−82.、Reynolds BA, Weiss S.1992.Science 255:1707−10.)。胎児組織から採取したヒト神経幹細胞を新生仔マウスの脳に移植すると、神経細胞と星状細胞に分化したり(Chalmers−Redman RM,et al.1997.Neurosci 76:1121−8.、Moyer MP,et al.1997.Transplant Proc 29:2040−1.、Svendsen CN,et al.1997.Exp Neurol 148:135−46.)、また再有髄化させることもできる(Flax JD,et al.1998.Nat Biotechnol 16:1033−9.)。脱髄化した齧歯類の脊髄に成人脳由来の神経前駆細胞を移植すると、再有髄化が行なわれて、インパルスの伝導を回復したことが報告されている(Akiyama Y,et al.2001.Exp Neurol.)。
【0004】
これらの研究は、上記細胞が、神経系疾患の修復術に利用できるかもしれないことを示唆しているため、大きな関心を引いている。(Akiyama Y,et al.2001.Exp Neurol,.、Chalmers−Redman RM,et al.1997.Neurosci 76:1121−8.、Moyer MP,et al.1997.Transplant Proc 29:2040−1.、Svendsen CN,et al.1997.Exp Neurol 148:135−46.、Yandava BD, et al.1999.Proc Natl Acad Sci USA 96:7029−34.)。しかし、これらの細胞は、採取方法の確立や栄養因子を用いて細胞増殖させる必要があるなど、細胞移植療法(自家移植を含む)の確立には、まだ問題が残っている。
最近の研究によって、神経幹細胞が、インビボで造血細胞を発生させうることが明らかになり、神経前駆細胞は神経細胞系譜には限定されないことが示された(Bjornson CR,et al.1999.Science 283:534−7.)。さらに、骨髄間質細胞を新生仔マウスの側脳質に注入すると星細胞へ分化したり(Kopen GC,et al.Proc Natl Acad Sci USA 96:10711−6.)、または、適当な細胞培養条件下では、インビトロで神経細胞に分化することが報告されている(Woodbury D, et al.2000.J Neurosci Res 61:364−70.)。
【発明の概要】
【発明が解決しようとする課題】
【0005】
ところで、本発明者は、これまでにヒト成人由来の神経細胞を、脳より抽出・培養し、セルライン化し、その機能を検討したところ、当該神経細胞には、自己複製機能と多分化機能が存在することを新規に見出している。すなわち、脳より得た神経細胞の前駆細胞(progenitor cell)を単一細胞展開(single cell expansion)し、セルライン化したものをin vitroの系でクローン分析を行ったところ、自己複製能(すなわち、増殖能)と、多分化能[すなわち、ニューロン(neuron)、膠星状細胞(アストログリア;astrocytes)、稀突起膠細胞(オリゴデンドログリア;oligodendrocytes)への分化]が認められ、したがって、この細胞には神経幹細胞の性質があることを確認している。
【0006】
実際に、この細胞をラット虚血モデル、外傷モデルを用いて移植実験を行ったところ、極めて良好な生着率、遊走、分化を示した。また、当該細胞を脊髄脱髄モデルラットへ移植したところ、機能的な髄鞘が形成されることを認めている。すなわち、脊髄脱髄モデルラットにおいて、脱髄された神経軸索が再有髄化され、神経機能が回復するものであり、当該細胞の移植治療法の効果を、組織学的、電気生理学的、行動科学的に確認している。
上記の事実から判断すれば、自己の大脳より少量の神経組織を採取して、神経幹細胞を抽出・培養し、得られた神経幹細胞を、自己の脊髄の損傷部位に移植することは、自家移植療法として、極めて応用性の高い治療法となるものと考えられる。
【0007】
しかしながら、大脳より神経幹細胞を含んだ組織を採取することは、採取にあたって神経脱落症状が発生しないとはいえ、容易なことではない。したがって、より安全で、かつ簡便な自家移植療法を確立することは、今日の複雑な各種疾患に対する治療法の確立という点から、極めて重要なことといえる。
【0008】
そこで、本発明は、安全かつ簡便に調製することができ、神経系疾患の治療に有効な細胞材料を提供することを課題とする。さらに、本発明は、該細胞材料を利用した神経系疾患の治療法、好ましくは自家移植療法を提供することを課題とする。
【課題を解決するための手段】
【0009】
本発明者らは、上記の現状を鑑み、ドナー細胞の獲得のために、神経幹細胞の採取技術より容易であり、今日の医療の現場で日常的に行なわれている、骨髄より骨髄細胞を採取する技術に着目した。そこで、まず、マウスの骨髄より骨髄細胞を採取して、単核細胞分画だけを分離し、これをドナー細胞としてラット脊髄脱髄モデルへ移植した。その結果、驚くべきことに、脱髄された神経軸索が再有髄化されることを見出した。すなわち、本発明者らは、骨髄細胞より調製した単核細胞分画が神経系細胞への分化能を有するものであることを新規に見出した。さらに、本発明者らは、該単核細胞分画から分離した、中胚葉幹細胞を含む細胞分画、間質細胞を含む細胞分画、およびAC133陽性細胞を含む細胞分画が神経系細胞への分化能を有することを見出した。これら細胞分画は、骨髄細胞のみならず、臍帯血細胞から調製することも可能である。また、AC133陽性細胞は、胎児肝細胞から調製することも可能である。
【0010】
従って、本発明は、骨髄細胞、臍帯血細胞、または胎児肝細胞より分離して得た細胞の一分画であって、神経系細胞へ分化し得る細胞を含む細胞分画を提供する。
【0011】
他の一つの態様において、該細胞分画は、SH2(+),SH3(+),SH4(+),CD29(+),CD44(+),CD14(−),CD34(−),CD45(−)の特徴を有する中胚葉幹細胞を含む細胞分画である。
【0012】
他の一つの態様において、該細胞分画は、Lin(−),Sca−1(+),CD10(+),CD11D(+),CD44(+),CD45(+),CD71(+),CD90(+),CD105(+),CDW123(+),CD127(+),CD164(+),フィブロネクチン(+),ALPH(+),コラーゲナーゼ−1(+)の特徴を有する間質細胞を含む細胞分画である。
【0013】
他の一つの態様において、該細胞分画は、AC133(+)の特徴を有する細胞を含む細胞分画である。
【0014】
また、本発明は、上記細胞分画に含まれる、神経系細胞へ分化し得る細胞を提供する。
【0015】
さらに本発明は、上記単核細胞分画または上記細胞を含む神経系疾患の治療のための組成物を提供する。好ましい態様において、神経系疾患は、中枢性および末梢性の脱髄疾患、中枢性および末梢性の変性疾患、脳卒中、脳腫瘍、高次機能障害、精神疾患、痴呆、てんかん、外傷性の神経系疾患、並びに脊髄梗塞からなる群より選択される疾患である。
【0016】
さらに本発明は、上記単核細胞分画、上記細胞、または上記組成物を移植することによる神経系疾患に対する治療方法を提供する。好ましい態様において、該ドナー細胞は、レシピエントに由来している。
【0017】
本発明は、骨髄細胞、臍帯血細胞、または胎児肝細胞より分離して得た単核細胞分画であって、神経系細胞へ分化しうることを特徴とする細胞を含む細胞分画を提供する。本発明が提供する細胞分画に含まれる細胞の神経系細胞への分化は、いわゆる血液系細胞の神経系細胞への形質転換により生じるのか、それとも骨髄細胞などの中に存在する神経細胞に分化できる未熟な細胞の分化によるものであるかは明確ではないが、神経系細胞へ分化する細胞は、主として、幹細胞、即ち、自己増殖能と多分化能を有する細胞であると考えられる。また、神経系細胞へ分化する細胞は、ある程度他の胚葉へ分化している幹細胞でありうる。
【0018】
本発明の細胞分画に含まれる細胞は、栄養因子によって増殖することは要せず(栄養因子によって増殖することは可能である)、神経自己移植技術の開発という点では簡便で、かつ現実性の高いものであり、その医療産業上の有益性は多大なものであるといえる。本発明の細胞分画は、一般的には、脊椎動物に由来する。好ましくは哺乳動物(例えば、マウス、ラット、ヒトなど)由来である。
【0019】
本発明の細胞分画は、脊椎動物から採取した骨髄細胞または臍帯血細胞を、2000回転で比重に応じた分離に十分な時間、溶液中にて密度勾配遠心を行ない、遠心後、比重1.07g/mlから1.1g/mlの範囲に含まれる一定の比重の細胞分画を回収することにより調製することができる。ここで「比重に応じた分離に十分な時間」とは、密度勾配遠心のための溶液内で、細胞がその比重に応じた位置を占めるのに十分な時間を意味する。通常、10〜30分間程度である。回収する細胞分画の比重は、好ましくは1.07g/mlから1.08g/mlの範囲(例えば、1.077g/ml)である。密度勾配遠心のための溶液としては、Ficol液やPercol液を用いることができるがこれらに制限されない。
【0020】
具体例を示せば、まず、脊椎動物より採取した骨髄液(5−10μl)を溶液(1L−15を2ml+Ficolを3ml)に混合し、遠心(2000回転で15分間)し、単核細胞分画(約1ml)を抽出する。この単核細胞分画を細胞の洗浄のために培養溶液(NPBM 2ml)に混合して、再度、遠心(2000回転で15分間)する。次いで、上澄みを除去した後、沈降した細胞を回収する。本発明の細胞分画の採取源としては、大腿骨以外にも、胸骨や、骨盤を形成している腸骨から採取することもできる。これらの骨以外でも大きい骨であれば採取可能である。また、骨髄バンクに保存してある骨髄液や臍帯血から採取することも可能である。
【0021】
本発明の細胞分画の他の態様は、骨髄細胞または臍帯血細胞より単離・精製して得た単核細胞分画であって、神経系細胞へ分化しうる中胚葉幹細胞を含む細胞分画である。「中胚葉幹細胞」とは、自己と同じ能力を持った細胞をコピー(分裂、増殖)することができ、中胚葉の組織を構成している全ての細胞へ分化し得る能力を持った細胞を指す。中胚葉細胞とは、発生学的に中胚葉と分類される組織を構成している細胞を指し、血液細胞も含まれる。中胚葉幹細胞は、例えば、SH2(+),SH3(+),SH4(+),CD29(+),CD44(+),CD14(−),CD34(−),CD45(−)の特徴を有する細胞である。中胚葉幹細胞を含む細胞分画は、例えば、骨髄細胞または臍帯血細胞から遠心分離して得た上記の細胞分画の中から、上記SH2等の細胞表面マーカーを有する細胞を選択することにより得ることができる。
【0022】
また、神経系細胞へ分化しうる中胚葉幹細胞を含む細胞分画は、脊椎動物から採取した骨髄細胞または臍帯血細胞を、900gで比重に応じた分離に十分な時間、溶液中にて密度勾配遠心を行ない、遠心後、比重1.07g/mlから1.1g/mlの範囲に含まれる一定の比重の細胞分画を回収することにより調製することができる。ここで「比重に応じた分離に十分な時間」とは、密度勾配遠心のための溶液内で、細胞がその比重に応じた位置を占めるのに十分な時間を意味する。通常、10〜30分間程度である。回収する細胞分画の比重は、細胞の由来する動物の種類(例えば、ヒト、ラット、マウス)により変動しうる。密度勾配遠心のための溶液としては、Ficol液やPercol液を用いることができるがこれらに制限されない。
【0023】
具体例を示せば、まず、脊椎動物から採取した骨髄液(25ml)または臍帯血を同量のPBS溶液に混合し、遠心(900gで10分間)し、沈降細胞をPBSに混合して回収(細胞密度は4×107細胞/ml程度)することにより、血液成分を除去する。その後、そのうち5mlをPercol液(1.073g/ml)と混合し、遠心(900gで30分間)し、単核細胞分画を抽出する。細胞の洗浄のために、抽出した単核細胞分画を培養溶液(DMEM,10% FBS,1% anti−biotic−antimycotic solution)に混合し、遠心(2000回転で15分間)する。次いで、遠心後の上澄みを除去し、沈降した細胞を回収し、培養する(37℃、5% CO2 in air)。
【0024】
本発明の細胞分画の他の態様は、骨髄細胞または臍帯血細胞より分離して得た単核細胞分画であって、神経系細胞へ分化しうる間質細胞を含む細胞分画である。間質細胞は、例えば、Lin(−),Sca−1(+),CD10(+),CD11D(+),CD44(+),CD45(+),CD71(+),CD90(+),CD105(+),CDW123(+),CD127(+),CD164(+),フィブロネクチン(+),ALPH(+),コラーゲナーゼ−1(+)の特徴を有する細胞である。間質細胞を含む細胞分画は、例えば、骨髄細胞または臍帯血細胞から遠心分離して得た上記の細胞分画の中から、上記Lin等の細胞表面マーカーを有する細胞を選択することにより得ることができる。
【0025】
また、脊椎動物から採取した骨髄細胞または臍帯血細胞を、800gで比重に応じた分離に十分な時間、溶液中にて密度勾配遠心を行ない、遠心後、比重1.07g/mlから1.1g/mlの範囲に含まれる一定の比重の細胞分画を回収することにより調製することができる。ここで「比重に応じた分離に十分な時間」とは、密度勾配遠心のための溶液内で、細胞がその比重に応じた位置を占めるのに十分な時間を意味する。通常、10〜30分間程度である。回収する細胞分画の比重は、好ましくは1.07g/mlから1.08gmlの範囲(例えば、1.077g/ml)である。密度勾配遠心のための溶液としては、Ficol液やPercol液を用いることができるがこれらに制限されない。
【0026】
具体例を示せば、まず、脊椎動物から採取した骨髄液または臍帯血を同量の溶液(PBS+2%BSA+0.6% クエン酸ナトリウム+1%ペニシリン−ストレプトマイシン)溶液に混合し、そのうちの5mlをFicol+Paque液(1.077g/ml)と混合し、遠心(800gで20分間)し、単核細胞分画を抽出する。この単核細胞分画を細胞の洗浄のために培養溶液(Alfa MEM,12.5% FBS,12.5% ウマ血清,0.2% i−イノシトール,20mM 葉酸,0.1mM 2−メルカプトエタノール,2mM L−グルタミン,1μM ヒドロコルチゾン,1% anti−biotic−antimycotic solution)に混合し、遠心(2000回転、15分間)する。次いで、遠心後の上澄みを除去した後、沈降した細胞を回収し、培養する(37℃、5% CO2 in air)。
【0027】
本発明の細胞分画の他の態様は、骨髄細胞、臍帯血細胞、または胎児肝細胞より分離して得た単核細胞分画であって、神経系細胞へ分化しうるAC133(+)の特徴を有する細胞を含む細胞分画である。この細胞分画は、例えば、骨髄細胞または臍帯血細胞から遠心分離して得た上記の細胞分画の中から、上記AC133(+)の細胞表面マーカーを有する細胞を選択することにより得ることができる。
【0028】
また、脊椎動物から採取した胎児肝細胞を、2000回転で比重に応じた分離に十分な時間、溶液中にて密度勾配遠心を行ない、遠心後、比重1.07g/mlから1.1g/mlの範囲に含まれる細胞分画を回収し、この細胞分画から、AC133(+)の特徴を有する細胞を回収することにより調製することができる。ここで「比重に応じた分離に十分な時間」とは、密度勾配遠心のための溶液内で、細胞がその比重に応じた位置を占めるのに十分な時間を意味する。通常、10〜30分間程度である。密度勾配遠心のための溶液としては、Ficol液やPercol液を用いることができるがこれらに制限されない。
【0029】
具体例を示せば、まず、脊椎動物から採取した肝臓組織をL−15溶液内で洗浄し、酵素処理(L−15+0.01%DnaseI、0.25%トリプシン,0.1%コラゲナーゼを含む溶液中で、37度で30分間)し、ピペッティングにより単一細胞にする。この単一細胞となった胎児肝細胞から、実施例1(1)において大腿骨から単核細胞分画を調製したのと同様に、遠心分離を行なう。これにより得られた細胞を洗浄し、洗浄後の細胞からAC133抗体を利用してAC133(+)細胞を回収する。これにより胎児肝細胞から神経系細胞へ分化しうる細胞を調製することができる。抗体を利用したAC133(+)細胞の回収は、マグネットビーズを利用して、または、セルソーター(FACSなど)を利用して行なうことができる。
【0030】
これら中胚葉幹細胞、間質細胞、あるいはAC133陽性細胞を含む細胞分画は、脊髄脱髄領域への移植後に、効率よく再有髄化する。特に、上記中胚葉幹細胞を含む細胞分画は、脳梗塞モデルへの移植に用いても、良好に生着し、神経系細胞あるいはグリア細胞に分化することができる。
【0031】
本発明は、また、上記細胞分画に含まれる、神経系細胞に分化し得る細胞を提供する。該細胞には、例えば、上記細胞分画に含まれる神経幹細胞、中胚葉幹細胞、および間質細胞、AC133陽性細胞が含まれるが、神経系細胞に分化し得る限り、これらに制限されない。
【0032】
本発明は、また、本発明の細胞分画または細胞を含む、神経系疾患の治療ための組成物を提供する。本発明の細胞分画や細胞はそのまま移植に用いることも可能であるが、移植による治療効率を向上させるために、種々の薬剤を添加した、あるいは遺伝子導入した組成物として、移植することも考えられる。本発明の組成物の調製においては、例えば、(1)本発明の細胞分画に含まれる細胞の増殖率を向上させるまたは神経系細胞への分化を促進する物質の添加、あるいはこのような効果を有する遺伝子の導入、(2)本発明の細胞分画に含まれる細胞の損傷神経組織内での生存率を向上させる物質の添加、あるいはこのような効果を有する遺伝子の導入、(3)本発明の細胞分画に含まれる細胞が、損傷神経組織から受ける悪影響を阻止する物質の添加、あるいはこのような効果を有する遺伝子の導入、(4)ドナー細胞の寿命を延長させる物質の添加、あるいはこのような効果を有する遺伝子の導入、(5)細胞周期を調節する物質の添加、あるいはこのような効果を有する遺伝子の導入、(6)免疫反応の抑制を目的とした物質の添加、あるいはこのような効果を有する遺伝子の導入、(7)エネルギー代謝を活発にする物質の添加、あるいはこのような効果を有する遺伝子の導入、(8)ドナー細胞のホスト組織内での遊走能を向上させる物質、あるいはこのような効果を有する遺伝子の導入、(9)血流を向上させる物質、あるいはこのような効果を有する遺伝子の導入(血管新生誘導も含む)、を行なうことが考えられるが、これらに制限されるものではない。
【0033】
本発明の細胞分画、細胞、および組成物は、神経系疾患の治療に用いることができる。治療の対象となる神経系疾患としては、例えば、中枢性および末梢性の脱髄疾患、中枢性および末梢性の変性疾患、脳卒中(脳梗塞、脳出血、クモ膜下出血を含む)、脳腫瘍、痴呆を含む高次機能障害、精神疾患、てんかん、外傷性の神経系疾患(頭部外傷、脳挫傷、脊髄損傷を含む)、並びに脊髄梗塞が挙げられるが、これらに制限されない。
【0034】
本発明によれば、レシピエント由来の骨髄細胞から分離して得た細胞をドナー細胞として移植することができる(自家移植療法)。この事は、移植による拒絶反応の危険性も少なく、免疫抑制剤を併用しなければならない困難性がない点で好ましい。自家移植療法が困難な場合には、他人または他の動物由来の細胞を利用することも可能である。細胞は冷凍保存したものであってもよい。ドナー細胞は、臍帯血由来であってもよい。
【0035】
骨髄液の採取は、例えば、採取源となる動物(ヒトを含む)を麻酔し(局所または全身麻酔)、胸骨若しくは腸骨に針を刺し、シリンジで吸引することにより行なうことができる。また、出生時に臍帯に直接針を刺し、注射器で吸引して、臍帯血を採取保存しておくことは確立された技術となっている。
【0036】
患者への細胞の移植は、例えば、移植する細胞を、人工脳脊髄液や生理食塩水などを用いて浮遊させた状態で注射器に溜め、手術により損傷した神経組織を露出し、この損傷部位に注射針で直接注入することにより行なうことができる。本発明の細胞分画に含まれる細胞は、遊走能が高いため、神経系組織内を移動することができる。したがって、損傷部位の近傍へ移植してもよい。また、脳脊髄液中への注入でも効果が期待できる。この場合、通常の腰椎突刺で細胞を注入することができるため、患者の手術の必要はなく、局所麻酔のみで済むため、病室で患者を処置できる点で好適である。さらに、静脈内への注入でも効果が期待できる。従って、通常の輸血の要領での移植が可能となり、病棟での移植操作が可能である点で好適である。
【0037】
また、本発明の細胞分画に含まれる細胞は、その遊走能の高さから、遺伝子の運び屋(ベクター)として利用することも考えられる。例えば、脳腫瘍などの各種神経疾患に対する遺伝子治療用ベクターとしてに利用が期待される。
【図面の簡単な説明】
【0038】
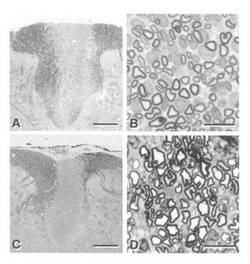
【図1】図1は、1mm間隔で試験した背面カラム横断面の光学顕微鏡写真である;(A)正常、および(C)損傷をおこした脱髄軸索。背面カラムを高倍率で観察したものが、(B)正常軸索、および(D)脱髄軸索である。スケールバーは250μm(A,C)および10μm(B,D)を表す。
【図2】図2は、(A)成体マウスの骨髄細胞移植後、および(C)シュワン細胞移植後のラット脊髄の再有髄化を示す写真である。(B)骨髄細胞移植後、および(D)シュワン細胞移植後の再有髄化軸索を高倍率で観察した写真である。スケールバーは、250μm(A,C)および10μm(B,D)を表す。
【図3】図3は、骨髄移植後の脊髄後索における再有髄化軸索を電子顕微鏡で観察した写真である。基質X−Galで組識を処理し、β−ガラクトシダーゼ遺伝子を持つ骨髄移植細胞(反応生成物を矢印で表す)を損傷中に検出した。高倍率試験により、繊維の周りに基底板(basal lamina)が観察された(くさび;スケールバー1μm)。移植細胞に存在する大きな細胞質領域と核領域、および基底板は、末梢の髄鞘形成の特徴を示す。
【発明を実施するための形態】
【0039】
以下に本発明を、具体的試験例に基づく実施例を説明しながら、さらに詳細に説明していく。
[実施例1]骨髄細胞およびシュワン細胞の調製
(1)骨髄単核細胞
マウス骨髄細胞(10μl)を、LacZ(β−ガラクトシダーゼの構造遺伝子)トランスジェニックマウス(ジャクソン研究所)の大腿骨より採取した。採取した細胞サンプルを、Ficoll 3mlを含有するL−15培地(2ml)中に希釈して、遠心分離(2,000rpm、15分間)した。単核球画分から細胞を集め、2mlの無血清培地(前駆神経細胞維持培地(Neural Progenitor cell Maintenance Medium):NPMM)中に懸濁し、さらに遠心分離(2,000rpm、15分間)して、上澄みを除去し、沈降した細胞を回収した。この細胞を再びNPMMに懸濁した。
【0040】
(2)シュワン細胞
本望らの方法(J.Neurosci.,16(10):3199−3208,1996)に従い、新生児マウス(P1−3)の坐骨神経からシュワン細胞の初代培養細胞を樹立した。すなわち、坐骨神経から酵素的および物理的処理によって細胞を解離させて、1プレートあたり8×105個の細胞を、ポリ(L−リジン)コートした100−mm2の組織培養皿に接種し、10%(v/v)ウシ胎児血清入りのダルベッコ修正イーグル培地(DMEM)中で培養した。
【0041】
[実施例2]実験動物の作製と細胞移植
(1)脱髄モデルラットの調製
12週齢のウイスター(wistar)系ラットを用いて実験を行なった。脊髄後索にX−線を照射した後、臭化エチジウムを注射して(EB−X処理)、局所的な脱髄傷害を生じさせた。すなわち、ケタミン(75mg/kg)およびキシラジン(10mg/kg)をラットの腹腔内に投与して麻酔し、鉛製遮蔽板(4mm厚)中に設けた2x4cmの開口部を通して、第10胸椎レベル(T−10)から尾部に向かう脊髄部分に対し、SoftxM−150WZ放射線治療機(100kV,1.15mA,SSD20cm,照射量200cグレイ/分)を使用して表面線量40グレイのX−線を照射した。X−線照射後3日目にラットを上記と同様に麻酔してから、無菌条件下で第11胸椎部位(T−11)の脊弓を切除した。先端を長く延ばしたガラスマイクロピペットにより、後索部位に臭化エチジウム(EB)を直接注射して、脱髄損傷部位を生じさせた。すなわち、深さ0.7mmと0.4mmの位置に0.3mg/ml EB含有生理食塩水0.5μlを注射した。
【0042】
(2)前駆神経細胞の移植
EB注射を行なってから3日後に、上記EB−X傷害部位の中央に、実施例1で得た細胞懸濁液1μl(1x104 cells/μl)を注射により移植した。移植処理を施したラットには、シクロスポリンA(10mg/kg/日)を投与して免疫抑制した。
【0043】
[実施例3]組織学的試験
ラットの腹腔内にペントバルビタールナトリウム(60mg/kg)を投与して深麻酔し、心臓カニューレを通して、最初にリン酸緩衝液(PBS)を灌流し、次いで、0.14M Sorensen’s(セーレンセン)リン酸緩衝液(pH7.4)中2%グルタールアルデヒドおよび2%パラホルムアルデヒドを含有する固定液を灌流した。インサイチューで10分間固定した後、脊髄を慎重に切り出し、1mmの長さに切り分けてから、新しい固定液中に保存した。この組織を、Sorensen’sリン酸緩衝液で数回洗浄し、25℃にて2時間、1%オスミウム酸(OsO4)中で後固定した後、エタノール溶液の濃度を上げながら脱水し、プロピレンオキサイドに通してからEPON中に包理した。切片を1μm厚に切り出して、0.5%メチレンブルーおよび0.5%アズールIIを含有する0.5%ホウ酸溶液で対比染色し、光学顕微鏡(Zeiss社製:Axioskop FS)を用いて観察した。また、薄片をウラニルおよび鉛塩で対比染色し、JEOL JEM1200EX電子顕微鏡(日本電子社製)を60kVで操作しながら観察を行なった。
【0044】
細胞を最初に注射した部位近傍にある後索中核内の領域50×50μmを標準化して、形態計測を行なった。この領域内における再有髄化軸索と軸索に結合している細胞体数とを数え、密度を1平方ミリメートル当たりにして計算した。この標準化領域内における軸索と細胞体の直径、多小葉核をもつ細胞の数、および軸索の有髄化を示す細胞の数も調べた。核実験条件毎に、5匹のラットを解析し(n=5)、ラット1匹当たり5つの切片を調製して、計測を行なった。計測値の変動は標準誤差で示す(±SEM)。
【0045】
脊髄後索は、ほとんどが有髄軸索からできている(図1A、B)。腰椎脊髄の後索にX−線を照射すると内生グリア細胞の増殖が阻害され、さらに、その部位に核キレート剤である臭化エチジウムを投与すると、稀突起膠細胞(オリゴデンドログリア:oligodendrocyte)などのグリア細胞(glial cell:神経膠細胞)が損傷して局所的な脱髄化が生じた。このようにして生じた損傷部位では、神経軸索は保存されていたが、内因性グリア細胞[膠星状細胞(アストログリア:astrocytes)および稀突起膠細胞]は、ほぼ完全に欠失していた(図1C)。光学顕微鏡の倍率を上げて観察すると、この損傷部位では、脱髄軸索からなる密集部が、髄鞘の破片が存在する領域とマクロファージが存在する領域とによって隔てられながらも、近接して並んでいるのが分かる(図1D)。損傷部位は、後索の背腹側ほぼ全領域にわたって、5−7mmの長さで見られた。シュワン細胞または膠星状細胞による内因性浸潤は、6週ないし8週後になるまではほとんど見られないが、浸潤が始まると、これらのグリア細胞が周縁部から侵入してくる。このことから、脱髄およびグリア細胞の欠失した状態が、少なくとも6週間はin vivoで継続することが分かる。
【0046】
免疫抑制した脊髄脱髄モデルラットの損傷部位の中央部に、LacZトランスジェニックマウス骨髄細胞(BM)を移植してから3週間後には、広範囲で脱髄軸索の再有髄化が見られた(図2A、B)。後索の舌状領域全域にわたり、また、損傷部位の前後全領域にわたっても再有髄化が見られた。図2Cおよび図2Dは、同種異系シュワン細胞(SC)をEB−X損傷モデルラットに移植したときに見られる再有髄化パターンを示している。骨髄細胞を移植した場合にも、シュワン細胞を移植した場合にも、再有髄化された軸索の周りに大きな核領域と細胞質領域ができ、末梢神経の髄鞘と同じ特徴を示したことが注目される。
【0047】
[実施例4]in vivoにおけるβ−ガラクトシダーゼ反応生成物の検出
移植してから3週間後に、β−ガラクトシダーゼを発現する髄鞘形成細胞をin vivoで観察した。脊髄を採取し、リン酸緩衝液中0.5%グルタールアルデヒドで1時間固定してから、ビブラトームを用いて100μm厚の切片を切り出した。この切片を、X−Gal発色液(35mM K3Fe(CN)6/35mM K4Fe(CN)6・3H2O/2mM MgCl2−リン酸緩衝液)中最終濃度1mg/mlのX−Gal(β−ガラクトシダーゼと反応し発色する基質)と共に37℃で一晩インキュベートし、細胞内を青色に発色させて、β−ガラクトシダーゼを発現する髄鞘形成細胞を検出した。次に、この切片を3.6%(v/v)グルタールアルデヒド含有リン酸緩衝液(0.14M)中でさらに3時間固定し、青色の反応生成物(β−ガラクトシダーゼ反応生成物)の存在を光学顕微鏡で観察した。1%オスミウム酸によって組織染色を行ない、エタノールの段階希釈液で脱水し、さらに、プロピレンオキサイドに短時間浸した後、EPON中に包理した。そして、それ以上の染色は行なわずに、電子顕微鏡下で超薄切片を観察した。
【0048】
電子顕微鏡で解析すると、ドナー細胞由来の髄鞘形成細胞の大半は基底膜を保持していた(図3:くさび印)。また、髄鞘形成細胞は比較的大きな細胞核と細胞質を保持していることから、末梢型の髄鞘を形成したことが分かる。
【0049】
本実験で用いた損傷モデルでは、6週間以上経過しないと稀突起膠細胞またはシュワン細胞による内因性の再有髄化はほとんど起こらないことが確認された。さらに、電子顕微鏡レベルでは、LacZをレポーター遺伝子としてもつドナー細胞、すなわちX−Gal陽性細胞は、髄鞘を形成することが観察された(図3:矢印)。
【0050】
骨髄細胞をEB−X損傷部位に移植した後には、ニューロンおよびグリア細胞への分化が見られたが、これは、シュワン細胞を移植した後には見られなかった。EB−X損傷部位中のLacZ陽性細胞(骨髄移植細胞)の5%がニューロン特異的エノラーゼ(Neuron Specifiic Enolase:NSE)に対して免疫応答性を示し、3.9%がグリア線維酸性タンパク質(glial fibrillary acidic protein:GFAP)に対して免疫応答性を示したことは、骨髄細胞の一部は、それぞれ、インビボでニューロン様またはグリア細胞に分化しうることを示唆している。
【0051】
さらに、本発明者らは、実施例1(1)で得られた細胞画分から、抗体を利用して細胞表面マーカーSH2(+),SH3(+),CD29(+),CD44(+),CD14(−),CD34(−),CD45(−)の性質を示す中胚葉幹細胞(mesenchymal stem cell)を単離した。これをラット脊髄脱髄領域に移植すると、さらに効率よく再有髄化されることを発見した。この細胞をラット脳梗塞モデルへの移植に用いても、良好に生着し、神経細胞やグリア細胞に分化することが分かった。
【0052】
さらに、本発明者らは、実施例1(1)で得られた細胞画分から、細胞表面マーカーLin(−),Sca−1(+),CD10(+),CD11D(+),CD44(+),CD45(+),CD71(+),CD90(+),CD105(+),CDW123(+),CD127(+),CD164(+),フィブロネクチン(+),ALPH(+),コラーゲナーゼ−1(+)の性質を示す間質細胞(stromal cells)を単離した。この細胞をラット脊髄脱髄領域に移植したときにも、効率よく再有髄化された。
【0053】
さらに、本発明者らは、実施例1(1)で得られた細胞画分から、細胞表面マーカーAC133(+)の性質を示す細胞を単離した。この細胞をラット脊髄脱髄領域に移植したときにも、効率よく再有髄化された。
【0054】
また、本発明者らは、以下の手法によりラット胎児肝細胞から神経系細胞へ分化し得るAC133陽性細胞を含む細胞分画を得た。即ち、まず、ラット胎児から採取した肝臓組織をL−15溶液内で洗浄し、酵素処理(L−15+0.01%Dnasel,0.25%トリプシン,0.1%コラゲナーゼを含む溶液中で、37度で30分間)し、数回ピペッティングして、組織を単一細胞にまで分離した。この単一細胞となった胎児肝細胞から、実施例1(1)において大腿骨から単核細胞分画を調製したのと同様に、遠心分離を行なうことにより単核細胞分画を得た。これを洗浄し、洗浄後の細胞分画からAC133抗体を利用してAC133(+)細胞を回収した。AC133(+)細胞の回収は、マグネットビーズを利用して、または、セルソーター(FACSなど)を利用して行なうことができる。これにより得られたACT33陽性細胞をラット脊髄脱髄領域に移植したときにも、効率よく再有髄化された。
【産業上の利用可能性】
【0055】
以上に記載したように、本発明は、骨髄由来の骨髄細胞、臍帯血由来の細胞、あるいは胎児肝臓由来の細胞を採取し、単離・精製して得た単核細胞分画を提供するものである。かかる単核細胞分画を脊髄脱髄モデル動物に移植したところ、脱髄された神経軸索が再有髄化されることが確認された。
【0056】
移植に用いる細胞は、骨髄から吸引した少量の骨髄液から比較的簡単に単離することができ、細胞を採取してから数十分内に、移植用に調製することができる。したがって、これらの細胞は、脱髄疾患治療のための自家移植を行うための有効かつ再生可能な細胞材料となりうる。
【0057】
この事実は、中枢神経系脱髄疾患の治療として、神経自家移植技術の開発にひとつの光明を与えるものである。また、本発明はより一般的で、広領域の脳神経損傷に対する神経移植・再生療法への応用も可能であると考えられる。すなわち、中枢神経系および末梢神経系の虚血性脳神経損傷、外傷性脳神経損傷、脳神経変性疾患、代謝性神経疾患への自家移植療法に光明を与えるものである。
【0058】
本発明は、血球系細胞をドナー細胞として用いている。このため、神経系疾患に対する移植療法であるにもかかわらず、神経組織への直接移植のみならず、血管内への移植も可能である。即ち、血管内への移植により神経組織へドナー細胞が移行し、神経組織を再生する可能性がある。従って、本発明は、非侵襲的な移植治療法の開発に光明を与えるものである。
【0059】
さらに、本発明は、血球系細胞から神経系細胞への分化の機序を解く糸口を提供している。このような分化を規定する遺伝子が同定・解析されれば、それら遺伝子を利用して体内に存在する血球系細胞を効率良く、また十分量、神経系細胞へ形質転換させることが期待できる。従って、本発明は、神経組織の再生を促すための”遺伝子治療”へ光明を与えるものである。
【技術分野】
【0001】
本発明は、骨髄細胞、臍帯血細胞、または胎児肝臓細胞由来の、神経系細胞へ分化しうる細胞および該細胞を含む細胞分画に関する。該細胞および細胞分画は、神経系疾患の治療、特に、自家移植治療への応用が期待される。
【背景技術】
【0002】
稀突起膠細胞(オリゴデンドログリア:oligodendrocyte)(Archer DR,et al.1994.Exp Neurol 125:268−77.、Blakemore WF,Crang AJ.1988.Dev Neurosci 10:1−11.、Gumpel M,et al.1987.Ann New York Acad Sci 495:71−85.)、またはシュワン細胞(Blakemore WF.1977.Nature 266:68−9.、Blakemore WF,Crang AJ.1988.Dev Neurosci 10:1−11.、Honmou O,et al.1996.J Neurosci 16:3199−208.)もしくはオルファクトリーエンシーティング細胞(olfactory ensheating cells)(Franklin RJ,et al.1996.Glia 17:217−24.、Imaizumi T,et al.1998.J Neurosci 18(16):6176−6185.、Kato T,et al.2000.Glia 30:209−218.)などの髄鞘形成細胞を移植すると、動物モデルにおいて再有髄化が誘発され、電気生理学機能を回復させることができる(Utzschneider DA,et al.1994.Proc Natl Acad Sci USA 91:53−7.、Honmou O,et al.1996.J Neurosci 16:3199−208.)。このような細胞を患者若しくは他人から調製して、細胞治療法に用いることも不可能ではないが、組織材料を脳または神経から採取しなければならないため問題が多い。
【0003】
脳から得られる神経前駆細胞または幹細胞には、自己複製能力があり、さまざまな細胞系譜の神経細胞や膠細胞に分化することが知られている(Gage FH,et al.1995.Proc Natl Acad Sci USA 92:11879−83.、Lois C,Alvarez−Buylla A.1993.Proc Natl Acad Sei USA 90:2074−7.、Morshead CM,et al.1994.Neuron 13:1071−82.、Reynolds BA, Weiss S.1992.Science 255:1707−10.)。胎児組織から採取したヒト神経幹細胞を新生仔マウスの脳に移植すると、神経細胞と星状細胞に分化したり(Chalmers−Redman RM,et al.1997.Neurosci 76:1121−8.、Moyer MP,et al.1997.Transplant Proc 29:2040−1.、Svendsen CN,et al.1997.Exp Neurol 148:135−46.)、また再有髄化させることもできる(Flax JD,et al.1998.Nat Biotechnol 16:1033−9.)。脱髄化した齧歯類の脊髄に成人脳由来の神経前駆細胞を移植すると、再有髄化が行なわれて、インパルスの伝導を回復したことが報告されている(Akiyama Y,et al.2001.Exp Neurol.)。
【0004】
これらの研究は、上記細胞が、神経系疾患の修復術に利用できるかもしれないことを示唆しているため、大きな関心を引いている。(Akiyama Y,et al.2001.Exp Neurol,.、Chalmers−Redman RM,et al.1997.Neurosci 76:1121−8.、Moyer MP,et al.1997.Transplant Proc 29:2040−1.、Svendsen CN,et al.1997.Exp Neurol 148:135−46.、Yandava BD, et al.1999.Proc Natl Acad Sci USA 96:7029−34.)。しかし、これらの細胞は、採取方法の確立や栄養因子を用いて細胞増殖させる必要があるなど、細胞移植療法(自家移植を含む)の確立には、まだ問題が残っている。
最近の研究によって、神経幹細胞が、インビボで造血細胞を発生させうることが明らかになり、神経前駆細胞は神経細胞系譜には限定されないことが示された(Bjornson CR,et al.1999.Science 283:534−7.)。さらに、骨髄間質細胞を新生仔マウスの側脳質に注入すると星細胞へ分化したり(Kopen GC,et al.Proc Natl Acad Sci USA 96:10711−6.)、または、適当な細胞培養条件下では、インビトロで神経細胞に分化することが報告されている(Woodbury D, et al.2000.J Neurosci Res 61:364−70.)。
【発明の概要】
【発明が解決しようとする課題】
【0005】
ところで、本発明者は、これまでにヒト成人由来の神経細胞を、脳より抽出・培養し、セルライン化し、その機能を検討したところ、当該神経細胞には、自己複製機能と多分化機能が存在することを新規に見出している。すなわち、脳より得た神経細胞の前駆細胞(progenitor cell)を単一細胞展開(single cell expansion)し、セルライン化したものをin vitroの系でクローン分析を行ったところ、自己複製能(すなわち、増殖能)と、多分化能[すなわち、ニューロン(neuron)、膠星状細胞(アストログリア;astrocytes)、稀突起膠細胞(オリゴデンドログリア;oligodendrocytes)への分化]が認められ、したがって、この細胞には神経幹細胞の性質があることを確認している。
【0006】
実際に、この細胞をラット虚血モデル、外傷モデルを用いて移植実験を行ったところ、極めて良好な生着率、遊走、分化を示した。また、当該細胞を脊髄脱髄モデルラットへ移植したところ、機能的な髄鞘が形成されることを認めている。すなわち、脊髄脱髄モデルラットにおいて、脱髄された神経軸索が再有髄化され、神経機能が回復するものであり、当該細胞の移植治療法の効果を、組織学的、電気生理学的、行動科学的に確認している。
上記の事実から判断すれば、自己の大脳より少量の神経組織を採取して、神経幹細胞を抽出・培養し、得られた神経幹細胞を、自己の脊髄の損傷部位に移植することは、自家移植療法として、極めて応用性の高い治療法となるものと考えられる。
【0007】
しかしながら、大脳より神経幹細胞を含んだ組織を採取することは、採取にあたって神経脱落症状が発生しないとはいえ、容易なことではない。したがって、より安全で、かつ簡便な自家移植療法を確立することは、今日の複雑な各種疾患に対する治療法の確立という点から、極めて重要なことといえる。
【0008】
そこで、本発明は、安全かつ簡便に調製することができ、神経系疾患の治療に有効な細胞材料を提供することを課題とする。さらに、本発明は、該細胞材料を利用した神経系疾患の治療法、好ましくは自家移植療法を提供することを課題とする。
【課題を解決するための手段】
【0009】
本発明者らは、上記の現状を鑑み、ドナー細胞の獲得のために、神経幹細胞の採取技術より容易であり、今日の医療の現場で日常的に行なわれている、骨髄より骨髄細胞を採取する技術に着目した。そこで、まず、マウスの骨髄より骨髄細胞を採取して、単核細胞分画だけを分離し、これをドナー細胞としてラット脊髄脱髄モデルへ移植した。その結果、驚くべきことに、脱髄された神経軸索が再有髄化されることを見出した。すなわち、本発明者らは、骨髄細胞より調製した単核細胞分画が神経系細胞への分化能を有するものであることを新規に見出した。さらに、本発明者らは、該単核細胞分画から分離した、中胚葉幹細胞を含む細胞分画、間質細胞を含む細胞分画、およびAC133陽性細胞を含む細胞分画が神経系細胞への分化能を有することを見出した。これら細胞分画は、骨髄細胞のみならず、臍帯血細胞から調製することも可能である。また、AC133陽性細胞は、胎児肝細胞から調製することも可能である。
【0010】
従って、本発明は、骨髄細胞、臍帯血細胞、または胎児肝細胞より分離して得た細胞の一分画であって、神経系細胞へ分化し得る細胞を含む細胞分画を提供する。
【0011】
他の一つの態様において、該細胞分画は、SH2(+),SH3(+),SH4(+),CD29(+),CD44(+),CD14(−),CD34(−),CD45(−)の特徴を有する中胚葉幹細胞を含む細胞分画である。
【0012】
他の一つの態様において、該細胞分画は、Lin(−),Sca−1(+),CD10(+),CD11D(+),CD44(+),CD45(+),CD71(+),CD90(+),CD105(+),CDW123(+),CD127(+),CD164(+),フィブロネクチン(+),ALPH(+),コラーゲナーゼ−1(+)の特徴を有する間質細胞を含む細胞分画である。
【0013】
他の一つの態様において、該細胞分画は、AC133(+)の特徴を有する細胞を含む細胞分画である。
【0014】
また、本発明は、上記細胞分画に含まれる、神経系細胞へ分化し得る細胞を提供する。
【0015】
さらに本発明は、上記単核細胞分画または上記細胞を含む神経系疾患の治療のための組成物を提供する。好ましい態様において、神経系疾患は、中枢性および末梢性の脱髄疾患、中枢性および末梢性の変性疾患、脳卒中、脳腫瘍、高次機能障害、精神疾患、痴呆、てんかん、外傷性の神経系疾患、並びに脊髄梗塞からなる群より選択される疾患である。
【0016】
さらに本発明は、上記単核細胞分画、上記細胞、または上記組成物を移植することによる神経系疾患に対する治療方法を提供する。好ましい態様において、該ドナー細胞は、レシピエントに由来している。
【0017】
本発明は、骨髄細胞、臍帯血細胞、または胎児肝細胞より分離して得た単核細胞分画であって、神経系細胞へ分化しうることを特徴とする細胞を含む細胞分画を提供する。本発明が提供する細胞分画に含まれる細胞の神経系細胞への分化は、いわゆる血液系細胞の神経系細胞への形質転換により生じるのか、それとも骨髄細胞などの中に存在する神経細胞に分化できる未熟な細胞の分化によるものであるかは明確ではないが、神経系細胞へ分化する細胞は、主として、幹細胞、即ち、自己増殖能と多分化能を有する細胞であると考えられる。また、神経系細胞へ分化する細胞は、ある程度他の胚葉へ分化している幹細胞でありうる。
【0018】
本発明の細胞分画に含まれる細胞は、栄養因子によって増殖することは要せず(栄養因子によって増殖することは可能である)、神経自己移植技術の開発という点では簡便で、かつ現実性の高いものであり、その医療産業上の有益性は多大なものであるといえる。本発明の細胞分画は、一般的には、脊椎動物に由来する。好ましくは哺乳動物(例えば、マウス、ラット、ヒトなど)由来である。
【0019】
本発明の細胞分画は、脊椎動物から採取した骨髄細胞または臍帯血細胞を、2000回転で比重に応じた分離に十分な時間、溶液中にて密度勾配遠心を行ない、遠心後、比重1.07g/mlから1.1g/mlの範囲に含まれる一定の比重の細胞分画を回収することにより調製することができる。ここで「比重に応じた分離に十分な時間」とは、密度勾配遠心のための溶液内で、細胞がその比重に応じた位置を占めるのに十分な時間を意味する。通常、10〜30分間程度である。回収する細胞分画の比重は、好ましくは1.07g/mlから1.08g/mlの範囲(例えば、1.077g/ml)である。密度勾配遠心のための溶液としては、Ficol液やPercol液を用いることができるがこれらに制限されない。
【0020】
具体例を示せば、まず、脊椎動物より採取した骨髄液(5−10μl)を溶液(1L−15を2ml+Ficolを3ml)に混合し、遠心(2000回転で15分間)し、単核細胞分画(約1ml)を抽出する。この単核細胞分画を細胞の洗浄のために培養溶液(NPBM 2ml)に混合して、再度、遠心(2000回転で15分間)する。次いで、上澄みを除去した後、沈降した細胞を回収する。本発明の細胞分画の採取源としては、大腿骨以外にも、胸骨や、骨盤を形成している腸骨から採取することもできる。これらの骨以外でも大きい骨であれば採取可能である。また、骨髄バンクに保存してある骨髄液や臍帯血から採取することも可能である。
【0021】
本発明の細胞分画の他の態様は、骨髄細胞または臍帯血細胞より単離・精製して得た単核細胞分画であって、神経系細胞へ分化しうる中胚葉幹細胞を含む細胞分画である。「中胚葉幹細胞」とは、自己と同じ能力を持った細胞をコピー(分裂、増殖)することができ、中胚葉の組織を構成している全ての細胞へ分化し得る能力を持った細胞を指す。中胚葉細胞とは、発生学的に中胚葉と分類される組織を構成している細胞を指し、血液細胞も含まれる。中胚葉幹細胞は、例えば、SH2(+),SH3(+),SH4(+),CD29(+),CD44(+),CD14(−),CD34(−),CD45(−)の特徴を有する細胞である。中胚葉幹細胞を含む細胞分画は、例えば、骨髄細胞または臍帯血細胞から遠心分離して得た上記の細胞分画の中から、上記SH2等の細胞表面マーカーを有する細胞を選択することにより得ることができる。
【0022】
また、神経系細胞へ分化しうる中胚葉幹細胞を含む細胞分画は、脊椎動物から採取した骨髄細胞または臍帯血細胞を、900gで比重に応じた分離に十分な時間、溶液中にて密度勾配遠心を行ない、遠心後、比重1.07g/mlから1.1g/mlの範囲に含まれる一定の比重の細胞分画を回収することにより調製することができる。ここで「比重に応じた分離に十分な時間」とは、密度勾配遠心のための溶液内で、細胞がその比重に応じた位置を占めるのに十分な時間を意味する。通常、10〜30分間程度である。回収する細胞分画の比重は、細胞の由来する動物の種類(例えば、ヒト、ラット、マウス)により変動しうる。密度勾配遠心のための溶液としては、Ficol液やPercol液を用いることができるがこれらに制限されない。
【0023】
具体例を示せば、まず、脊椎動物から採取した骨髄液(25ml)または臍帯血を同量のPBS溶液に混合し、遠心(900gで10分間)し、沈降細胞をPBSに混合して回収(細胞密度は4×107細胞/ml程度)することにより、血液成分を除去する。その後、そのうち5mlをPercol液(1.073g/ml)と混合し、遠心(900gで30分間)し、単核細胞分画を抽出する。細胞の洗浄のために、抽出した単核細胞分画を培養溶液(DMEM,10% FBS,1% anti−biotic−antimycotic solution)に混合し、遠心(2000回転で15分間)する。次いで、遠心後の上澄みを除去し、沈降した細胞を回収し、培養する(37℃、5% CO2 in air)。
【0024】
本発明の細胞分画の他の態様は、骨髄細胞または臍帯血細胞より分離して得た単核細胞分画であって、神経系細胞へ分化しうる間質細胞を含む細胞分画である。間質細胞は、例えば、Lin(−),Sca−1(+),CD10(+),CD11D(+),CD44(+),CD45(+),CD71(+),CD90(+),CD105(+),CDW123(+),CD127(+),CD164(+),フィブロネクチン(+),ALPH(+),コラーゲナーゼ−1(+)の特徴を有する細胞である。間質細胞を含む細胞分画は、例えば、骨髄細胞または臍帯血細胞から遠心分離して得た上記の細胞分画の中から、上記Lin等の細胞表面マーカーを有する細胞を選択することにより得ることができる。
【0025】
また、脊椎動物から採取した骨髄細胞または臍帯血細胞を、800gで比重に応じた分離に十分な時間、溶液中にて密度勾配遠心を行ない、遠心後、比重1.07g/mlから1.1g/mlの範囲に含まれる一定の比重の細胞分画を回収することにより調製することができる。ここで「比重に応じた分離に十分な時間」とは、密度勾配遠心のための溶液内で、細胞がその比重に応じた位置を占めるのに十分な時間を意味する。通常、10〜30分間程度である。回収する細胞分画の比重は、好ましくは1.07g/mlから1.08gmlの範囲(例えば、1.077g/ml)である。密度勾配遠心のための溶液としては、Ficol液やPercol液を用いることができるがこれらに制限されない。
【0026】
具体例を示せば、まず、脊椎動物から採取した骨髄液または臍帯血を同量の溶液(PBS+2%BSA+0.6% クエン酸ナトリウム+1%ペニシリン−ストレプトマイシン)溶液に混合し、そのうちの5mlをFicol+Paque液(1.077g/ml)と混合し、遠心(800gで20分間)し、単核細胞分画を抽出する。この単核細胞分画を細胞の洗浄のために培養溶液(Alfa MEM,12.5% FBS,12.5% ウマ血清,0.2% i−イノシトール,20mM 葉酸,0.1mM 2−メルカプトエタノール,2mM L−グルタミン,1μM ヒドロコルチゾン,1% anti−biotic−antimycotic solution)に混合し、遠心(2000回転、15分間)する。次いで、遠心後の上澄みを除去した後、沈降した細胞を回収し、培養する(37℃、5% CO2 in air)。
【0027】
本発明の細胞分画の他の態様は、骨髄細胞、臍帯血細胞、または胎児肝細胞より分離して得た単核細胞分画であって、神経系細胞へ分化しうるAC133(+)の特徴を有する細胞を含む細胞分画である。この細胞分画は、例えば、骨髄細胞または臍帯血細胞から遠心分離して得た上記の細胞分画の中から、上記AC133(+)の細胞表面マーカーを有する細胞を選択することにより得ることができる。
【0028】
また、脊椎動物から採取した胎児肝細胞を、2000回転で比重に応じた分離に十分な時間、溶液中にて密度勾配遠心を行ない、遠心後、比重1.07g/mlから1.1g/mlの範囲に含まれる細胞分画を回収し、この細胞分画から、AC133(+)の特徴を有する細胞を回収することにより調製することができる。ここで「比重に応じた分離に十分な時間」とは、密度勾配遠心のための溶液内で、細胞がその比重に応じた位置を占めるのに十分な時間を意味する。通常、10〜30分間程度である。密度勾配遠心のための溶液としては、Ficol液やPercol液を用いることができるがこれらに制限されない。
【0029】
具体例を示せば、まず、脊椎動物から採取した肝臓組織をL−15溶液内で洗浄し、酵素処理(L−15+0.01%DnaseI、0.25%トリプシン,0.1%コラゲナーゼを含む溶液中で、37度で30分間)し、ピペッティングにより単一細胞にする。この単一細胞となった胎児肝細胞から、実施例1(1)において大腿骨から単核細胞分画を調製したのと同様に、遠心分離を行なう。これにより得られた細胞を洗浄し、洗浄後の細胞からAC133抗体を利用してAC133(+)細胞を回収する。これにより胎児肝細胞から神経系細胞へ分化しうる細胞を調製することができる。抗体を利用したAC133(+)細胞の回収は、マグネットビーズを利用して、または、セルソーター(FACSなど)を利用して行なうことができる。
【0030】
これら中胚葉幹細胞、間質細胞、あるいはAC133陽性細胞を含む細胞分画は、脊髄脱髄領域への移植後に、効率よく再有髄化する。特に、上記中胚葉幹細胞を含む細胞分画は、脳梗塞モデルへの移植に用いても、良好に生着し、神経系細胞あるいはグリア細胞に分化することができる。
【0031】
本発明は、また、上記細胞分画に含まれる、神経系細胞に分化し得る細胞を提供する。該細胞には、例えば、上記細胞分画に含まれる神経幹細胞、中胚葉幹細胞、および間質細胞、AC133陽性細胞が含まれるが、神経系細胞に分化し得る限り、これらに制限されない。
【0032】
本発明は、また、本発明の細胞分画または細胞を含む、神経系疾患の治療ための組成物を提供する。本発明の細胞分画や細胞はそのまま移植に用いることも可能であるが、移植による治療効率を向上させるために、種々の薬剤を添加した、あるいは遺伝子導入した組成物として、移植することも考えられる。本発明の組成物の調製においては、例えば、(1)本発明の細胞分画に含まれる細胞の増殖率を向上させるまたは神経系細胞への分化を促進する物質の添加、あるいはこのような効果を有する遺伝子の導入、(2)本発明の細胞分画に含まれる細胞の損傷神経組織内での生存率を向上させる物質の添加、あるいはこのような効果を有する遺伝子の導入、(3)本発明の細胞分画に含まれる細胞が、損傷神経組織から受ける悪影響を阻止する物質の添加、あるいはこのような効果を有する遺伝子の導入、(4)ドナー細胞の寿命を延長させる物質の添加、あるいはこのような効果を有する遺伝子の導入、(5)細胞周期を調節する物質の添加、あるいはこのような効果を有する遺伝子の導入、(6)免疫反応の抑制を目的とした物質の添加、あるいはこのような効果を有する遺伝子の導入、(7)エネルギー代謝を活発にする物質の添加、あるいはこのような効果を有する遺伝子の導入、(8)ドナー細胞のホスト組織内での遊走能を向上させる物質、あるいはこのような効果を有する遺伝子の導入、(9)血流を向上させる物質、あるいはこのような効果を有する遺伝子の導入(血管新生誘導も含む)、を行なうことが考えられるが、これらに制限されるものではない。
【0033】
本発明の細胞分画、細胞、および組成物は、神経系疾患の治療に用いることができる。治療の対象となる神経系疾患としては、例えば、中枢性および末梢性の脱髄疾患、中枢性および末梢性の変性疾患、脳卒中(脳梗塞、脳出血、クモ膜下出血を含む)、脳腫瘍、痴呆を含む高次機能障害、精神疾患、てんかん、外傷性の神経系疾患(頭部外傷、脳挫傷、脊髄損傷を含む)、並びに脊髄梗塞が挙げられるが、これらに制限されない。
【0034】
本発明によれば、レシピエント由来の骨髄細胞から分離して得た細胞をドナー細胞として移植することができる(自家移植療法)。この事は、移植による拒絶反応の危険性も少なく、免疫抑制剤を併用しなければならない困難性がない点で好ましい。自家移植療法が困難な場合には、他人または他の動物由来の細胞を利用することも可能である。細胞は冷凍保存したものであってもよい。ドナー細胞は、臍帯血由来であってもよい。
【0035】
骨髄液の採取は、例えば、採取源となる動物(ヒトを含む)を麻酔し(局所または全身麻酔)、胸骨若しくは腸骨に針を刺し、シリンジで吸引することにより行なうことができる。また、出生時に臍帯に直接針を刺し、注射器で吸引して、臍帯血を採取保存しておくことは確立された技術となっている。
【0036】
患者への細胞の移植は、例えば、移植する細胞を、人工脳脊髄液や生理食塩水などを用いて浮遊させた状態で注射器に溜め、手術により損傷した神経組織を露出し、この損傷部位に注射針で直接注入することにより行なうことができる。本発明の細胞分画に含まれる細胞は、遊走能が高いため、神経系組織内を移動することができる。したがって、損傷部位の近傍へ移植してもよい。また、脳脊髄液中への注入でも効果が期待できる。この場合、通常の腰椎突刺で細胞を注入することができるため、患者の手術の必要はなく、局所麻酔のみで済むため、病室で患者を処置できる点で好適である。さらに、静脈内への注入でも効果が期待できる。従って、通常の輸血の要領での移植が可能となり、病棟での移植操作が可能である点で好適である。
【0037】
また、本発明の細胞分画に含まれる細胞は、その遊走能の高さから、遺伝子の運び屋(ベクター)として利用することも考えられる。例えば、脳腫瘍などの各種神経疾患に対する遺伝子治療用ベクターとしてに利用が期待される。
【図面の簡単な説明】
【0038】
【図1】図1は、1mm間隔で試験した背面カラム横断面の光学顕微鏡写真である;(A)正常、および(C)損傷をおこした脱髄軸索。背面カラムを高倍率で観察したものが、(B)正常軸索、および(D)脱髄軸索である。スケールバーは250μm(A,C)および10μm(B,D)を表す。
【図2】図2は、(A)成体マウスの骨髄細胞移植後、および(C)シュワン細胞移植後のラット脊髄の再有髄化を示す写真である。(B)骨髄細胞移植後、および(D)シュワン細胞移植後の再有髄化軸索を高倍率で観察した写真である。スケールバーは、250μm(A,C)および10μm(B,D)を表す。
【図3】図3は、骨髄移植後の脊髄後索における再有髄化軸索を電子顕微鏡で観察した写真である。基質X−Galで組識を処理し、β−ガラクトシダーゼ遺伝子を持つ骨髄移植細胞(反応生成物を矢印で表す)を損傷中に検出した。高倍率試験により、繊維の周りに基底板(basal lamina)が観察された(くさび;スケールバー1μm)。移植細胞に存在する大きな細胞質領域と核領域、および基底板は、末梢の髄鞘形成の特徴を示す。
【発明を実施するための形態】
【0039】
以下に本発明を、具体的試験例に基づく実施例を説明しながら、さらに詳細に説明していく。
[実施例1]骨髄細胞およびシュワン細胞の調製
(1)骨髄単核細胞
マウス骨髄細胞(10μl)を、LacZ(β−ガラクトシダーゼの構造遺伝子)トランスジェニックマウス(ジャクソン研究所)の大腿骨より採取した。採取した細胞サンプルを、Ficoll 3mlを含有するL−15培地(2ml)中に希釈して、遠心分離(2,000rpm、15分間)した。単核球画分から細胞を集め、2mlの無血清培地(前駆神経細胞維持培地(Neural Progenitor cell Maintenance Medium):NPMM)中に懸濁し、さらに遠心分離(2,000rpm、15分間)して、上澄みを除去し、沈降した細胞を回収した。この細胞を再びNPMMに懸濁した。
【0040】
(2)シュワン細胞
本望らの方法(J.Neurosci.,16(10):3199−3208,1996)に従い、新生児マウス(P1−3)の坐骨神経からシュワン細胞の初代培養細胞を樹立した。すなわち、坐骨神経から酵素的および物理的処理によって細胞を解離させて、1プレートあたり8×105個の細胞を、ポリ(L−リジン)コートした100−mm2の組織培養皿に接種し、10%(v/v)ウシ胎児血清入りのダルベッコ修正イーグル培地(DMEM)中で培養した。
【0041】
[実施例2]実験動物の作製と細胞移植
(1)脱髄モデルラットの調製
12週齢のウイスター(wistar)系ラットを用いて実験を行なった。脊髄後索にX−線を照射した後、臭化エチジウムを注射して(EB−X処理)、局所的な脱髄傷害を生じさせた。すなわち、ケタミン(75mg/kg)およびキシラジン(10mg/kg)をラットの腹腔内に投与して麻酔し、鉛製遮蔽板(4mm厚)中に設けた2x4cmの開口部を通して、第10胸椎レベル(T−10)から尾部に向かう脊髄部分に対し、SoftxM−150WZ放射線治療機(100kV,1.15mA,SSD20cm,照射量200cグレイ/分)を使用して表面線量40グレイのX−線を照射した。X−線照射後3日目にラットを上記と同様に麻酔してから、無菌条件下で第11胸椎部位(T−11)の脊弓を切除した。先端を長く延ばしたガラスマイクロピペットにより、後索部位に臭化エチジウム(EB)を直接注射して、脱髄損傷部位を生じさせた。すなわち、深さ0.7mmと0.4mmの位置に0.3mg/ml EB含有生理食塩水0.5μlを注射した。
【0042】
(2)前駆神経細胞の移植
EB注射を行なってから3日後に、上記EB−X傷害部位の中央に、実施例1で得た細胞懸濁液1μl(1x104 cells/μl)を注射により移植した。移植処理を施したラットには、シクロスポリンA(10mg/kg/日)を投与して免疫抑制した。
【0043】
[実施例3]組織学的試験
ラットの腹腔内にペントバルビタールナトリウム(60mg/kg)を投与して深麻酔し、心臓カニューレを通して、最初にリン酸緩衝液(PBS)を灌流し、次いで、0.14M Sorensen’s(セーレンセン)リン酸緩衝液(pH7.4)中2%グルタールアルデヒドおよび2%パラホルムアルデヒドを含有する固定液を灌流した。インサイチューで10分間固定した後、脊髄を慎重に切り出し、1mmの長さに切り分けてから、新しい固定液中に保存した。この組織を、Sorensen’sリン酸緩衝液で数回洗浄し、25℃にて2時間、1%オスミウム酸(OsO4)中で後固定した後、エタノール溶液の濃度を上げながら脱水し、プロピレンオキサイドに通してからEPON中に包理した。切片を1μm厚に切り出して、0.5%メチレンブルーおよび0.5%アズールIIを含有する0.5%ホウ酸溶液で対比染色し、光学顕微鏡(Zeiss社製:Axioskop FS)を用いて観察した。また、薄片をウラニルおよび鉛塩で対比染色し、JEOL JEM1200EX電子顕微鏡(日本電子社製)を60kVで操作しながら観察を行なった。
【0044】
細胞を最初に注射した部位近傍にある後索中核内の領域50×50μmを標準化して、形態計測を行なった。この領域内における再有髄化軸索と軸索に結合している細胞体数とを数え、密度を1平方ミリメートル当たりにして計算した。この標準化領域内における軸索と細胞体の直径、多小葉核をもつ細胞の数、および軸索の有髄化を示す細胞の数も調べた。核実験条件毎に、5匹のラットを解析し(n=5)、ラット1匹当たり5つの切片を調製して、計測を行なった。計測値の変動は標準誤差で示す(±SEM)。
【0045】
脊髄後索は、ほとんどが有髄軸索からできている(図1A、B)。腰椎脊髄の後索にX−線を照射すると内生グリア細胞の増殖が阻害され、さらに、その部位に核キレート剤である臭化エチジウムを投与すると、稀突起膠細胞(オリゴデンドログリア:oligodendrocyte)などのグリア細胞(glial cell:神経膠細胞)が損傷して局所的な脱髄化が生じた。このようにして生じた損傷部位では、神経軸索は保存されていたが、内因性グリア細胞[膠星状細胞(アストログリア:astrocytes)および稀突起膠細胞]は、ほぼ完全に欠失していた(図1C)。光学顕微鏡の倍率を上げて観察すると、この損傷部位では、脱髄軸索からなる密集部が、髄鞘の破片が存在する領域とマクロファージが存在する領域とによって隔てられながらも、近接して並んでいるのが分かる(図1D)。損傷部位は、後索の背腹側ほぼ全領域にわたって、5−7mmの長さで見られた。シュワン細胞または膠星状細胞による内因性浸潤は、6週ないし8週後になるまではほとんど見られないが、浸潤が始まると、これらのグリア細胞が周縁部から侵入してくる。このことから、脱髄およびグリア細胞の欠失した状態が、少なくとも6週間はin vivoで継続することが分かる。
【0046】
免疫抑制した脊髄脱髄モデルラットの損傷部位の中央部に、LacZトランスジェニックマウス骨髄細胞(BM)を移植してから3週間後には、広範囲で脱髄軸索の再有髄化が見られた(図2A、B)。後索の舌状領域全域にわたり、また、損傷部位の前後全領域にわたっても再有髄化が見られた。図2Cおよび図2Dは、同種異系シュワン細胞(SC)をEB−X損傷モデルラットに移植したときに見られる再有髄化パターンを示している。骨髄細胞を移植した場合にも、シュワン細胞を移植した場合にも、再有髄化された軸索の周りに大きな核領域と細胞質領域ができ、末梢神経の髄鞘と同じ特徴を示したことが注目される。
【0047】
[実施例4]in vivoにおけるβ−ガラクトシダーゼ反応生成物の検出
移植してから3週間後に、β−ガラクトシダーゼを発現する髄鞘形成細胞をin vivoで観察した。脊髄を採取し、リン酸緩衝液中0.5%グルタールアルデヒドで1時間固定してから、ビブラトームを用いて100μm厚の切片を切り出した。この切片を、X−Gal発色液(35mM K3Fe(CN)6/35mM K4Fe(CN)6・3H2O/2mM MgCl2−リン酸緩衝液)中最終濃度1mg/mlのX−Gal(β−ガラクトシダーゼと反応し発色する基質)と共に37℃で一晩インキュベートし、細胞内を青色に発色させて、β−ガラクトシダーゼを発現する髄鞘形成細胞を検出した。次に、この切片を3.6%(v/v)グルタールアルデヒド含有リン酸緩衝液(0.14M)中でさらに3時間固定し、青色の反応生成物(β−ガラクトシダーゼ反応生成物)の存在を光学顕微鏡で観察した。1%オスミウム酸によって組織染色を行ない、エタノールの段階希釈液で脱水し、さらに、プロピレンオキサイドに短時間浸した後、EPON中に包理した。そして、それ以上の染色は行なわずに、電子顕微鏡下で超薄切片を観察した。
【0048】
電子顕微鏡で解析すると、ドナー細胞由来の髄鞘形成細胞の大半は基底膜を保持していた(図3:くさび印)。また、髄鞘形成細胞は比較的大きな細胞核と細胞質を保持していることから、末梢型の髄鞘を形成したことが分かる。
【0049】
本実験で用いた損傷モデルでは、6週間以上経過しないと稀突起膠細胞またはシュワン細胞による内因性の再有髄化はほとんど起こらないことが確認された。さらに、電子顕微鏡レベルでは、LacZをレポーター遺伝子としてもつドナー細胞、すなわちX−Gal陽性細胞は、髄鞘を形成することが観察された(図3:矢印)。
【0050】
骨髄細胞をEB−X損傷部位に移植した後には、ニューロンおよびグリア細胞への分化が見られたが、これは、シュワン細胞を移植した後には見られなかった。EB−X損傷部位中のLacZ陽性細胞(骨髄移植細胞)の5%がニューロン特異的エノラーゼ(Neuron Specifiic Enolase:NSE)に対して免疫応答性を示し、3.9%がグリア線維酸性タンパク質(glial fibrillary acidic protein:GFAP)に対して免疫応答性を示したことは、骨髄細胞の一部は、それぞれ、インビボでニューロン様またはグリア細胞に分化しうることを示唆している。
【0051】
さらに、本発明者らは、実施例1(1)で得られた細胞画分から、抗体を利用して細胞表面マーカーSH2(+),SH3(+),CD29(+),CD44(+),CD14(−),CD34(−),CD45(−)の性質を示す中胚葉幹細胞(mesenchymal stem cell)を単離した。これをラット脊髄脱髄領域に移植すると、さらに効率よく再有髄化されることを発見した。この細胞をラット脳梗塞モデルへの移植に用いても、良好に生着し、神経細胞やグリア細胞に分化することが分かった。
【0052】
さらに、本発明者らは、実施例1(1)で得られた細胞画分から、細胞表面マーカーLin(−),Sca−1(+),CD10(+),CD11D(+),CD44(+),CD45(+),CD71(+),CD90(+),CD105(+),CDW123(+),CD127(+),CD164(+),フィブロネクチン(+),ALPH(+),コラーゲナーゼ−1(+)の性質を示す間質細胞(stromal cells)を単離した。この細胞をラット脊髄脱髄領域に移植したときにも、効率よく再有髄化された。
【0053】
さらに、本発明者らは、実施例1(1)で得られた細胞画分から、細胞表面マーカーAC133(+)の性質を示す細胞を単離した。この細胞をラット脊髄脱髄領域に移植したときにも、効率よく再有髄化された。
【0054】
また、本発明者らは、以下の手法によりラット胎児肝細胞から神経系細胞へ分化し得るAC133陽性細胞を含む細胞分画を得た。即ち、まず、ラット胎児から採取した肝臓組織をL−15溶液内で洗浄し、酵素処理(L−15+0.01%Dnasel,0.25%トリプシン,0.1%コラゲナーゼを含む溶液中で、37度で30分間)し、数回ピペッティングして、組織を単一細胞にまで分離した。この単一細胞となった胎児肝細胞から、実施例1(1)において大腿骨から単核細胞分画を調製したのと同様に、遠心分離を行なうことにより単核細胞分画を得た。これを洗浄し、洗浄後の細胞分画からAC133抗体を利用してAC133(+)細胞を回収した。AC133(+)細胞の回収は、マグネットビーズを利用して、または、セルソーター(FACSなど)を利用して行なうことができる。これにより得られたACT33陽性細胞をラット脊髄脱髄領域に移植したときにも、効率よく再有髄化された。
【産業上の利用可能性】
【0055】
以上に記載したように、本発明は、骨髄由来の骨髄細胞、臍帯血由来の細胞、あるいは胎児肝臓由来の細胞を採取し、単離・精製して得た単核細胞分画を提供するものである。かかる単核細胞分画を脊髄脱髄モデル動物に移植したところ、脱髄された神経軸索が再有髄化されることが確認された。
【0056】
移植に用いる細胞は、骨髄から吸引した少量の骨髄液から比較的簡単に単離することができ、細胞を採取してから数十分内に、移植用に調製することができる。したがって、これらの細胞は、脱髄疾患治療のための自家移植を行うための有効かつ再生可能な細胞材料となりうる。
【0057】
この事実は、中枢神経系脱髄疾患の治療として、神経自家移植技術の開発にひとつの光明を与えるものである。また、本発明はより一般的で、広領域の脳神経損傷に対する神経移植・再生療法への応用も可能であると考えられる。すなわち、中枢神経系および末梢神経系の虚血性脳神経損傷、外傷性脳神経損傷、脳神経変性疾患、代謝性神経疾患への自家移植療法に光明を与えるものである。
【0058】
本発明は、血球系細胞をドナー細胞として用いている。このため、神経系疾患に対する移植療法であるにもかかわらず、神経組織への直接移植のみならず、血管内への移植も可能である。即ち、血管内への移植により神経組織へドナー細胞が移行し、神経組織を再生する可能性がある。従って、本発明は、非侵襲的な移植治療法の開発に光明を与えるものである。
【0059】
さらに、本発明は、血球系細胞から神経系細胞への分化の機序を解く糸口を提供している。このような分化を規定する遺伝子が同定・解析されれば、それら遺伝子を利用して体内に存在する血球系細胞を効率良く、また十分量、神経系細胞へ形質転換させることが期待できる。従って、本発明は、神経組織の再生を促すための”遺伝子治療”へ光明を与えるものである。
【特許請求の範囲】
【請求項1】
骨髄又は臍帯血由来の単離された、神経細胞又はグリア細胞へ分化しうる細胞であって、SH2(+)、SH3(+)、SH4(+)、CD29(+)、CD44(+)、CD14(−)、CD34(−)、及びCD45(−)の性質で単離された細胞
からなる、神経変性疾患の治療薬。
【請求項2】
骨髄又は臍帯血由来の単離された、神経細胞又はグリア細胞へ分化しうる細胞であって、SH2(+)、SH3(+)、SH4(+)、CD29(+)、CD44(+)、CD14(−)、CD34(−)、及びCD45(−)の性質で単離された細胞
からなる、脱髄疾患の治療薬。
【請求項3】
骨髄又は臍帯血由来の単離された、神経細胞又はグリア細胞へ分化しうる細胞であって、SH2(+)、SH3(+)、SH4(+)、CD29(+)、CD44(+)、CD14(−)、CD34(−)、及びCD45(−)の性質で単離された細胞
からなる、脳腫瘍の治療薬。
【請求項4】
骨髄又は臍帯血由来の単離された、神経細胞又はグリア細胞へ分化しうる細胞であって、SH2(+)、SH3(+)、SH4(+)、CD29(+)、CD44(+)、CD14(−)、CD34(−)、及びCD45(−)の性質で単離された細胞
からなる、てんかんの治療薬。
【請求項1】
骨髄又は臍帯血由来の単離された、神経細胞又はグリア細胞へ分化しうる細胞であって、SH2(+)、SH3(+)、SH4(+)、CD29(+)、CD44(+)、CD14(−)、CD34(−)、及びCD45(−)の性質で単離された細胞
からなる、神経変性疾患の治療薬。
【請求項2】
骨髄又は臍帯血由来の単離された、神経細胞又はグリア細胞へ分化しうる細胞であって、SH2(+)、SH3(+)、SH4(+)、CD29(+)、CD44(+)、CD14(−)、CD34(−)、及びCD45(−)の性質で単離された細胞
からなる、脱髄疾患の治療薬。
【請求項3】
骨髄又は臍帯血由来の単離された、神経細胞又はグリア細胞へ分化しうる細胞であって、SH2(+)、SH3(+)、SH4(+)、CD29(+)、CD44(+)、CD14(−)、CD34(−)、及びCD45(−)の性質で単離された細胞
からなる、脳腫瘍の治療薬。
【請求項4】
骨髄又は臍帯血由来の単離された、神経細胞又はグリア細胞へ分化しうる細胞であって、SH2(+)、SH3(+)、SH4(+)、CD29(+)、CD44(+)、CD14(−)、CD34(−)、及びCD45(−)の性質で単離された細胞
からなる、てんかんの治療薬。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2010−260873(P2010−260873A)
【公開日】平成22年11月18日(2010.11.18)
【国際特許分類】
【出願番号】特願2010−180888(P2010−180888)
【出願日】平成22年8月12日(2010.8.12)
【分割の表示】特願2002−505965(P2002−505965)の分割
【原出願日】平成13年6月26日(2001.6.26)
【出願人】(506100495)NCメディカルリサーチ株式会社 (10)
【出願人】(000002990)あすか製薬株式会社 (39)
【出願人】(503460736)三井住友海上ケアネット株式会社 (3)
【出願人】(000005108)株式会社日立製作所 (27,607)
【Fターム(参考)】
【公開日】平成22年11月18日(2010.11.18)
【国際特許分類】
【出願日】平成22年8月12日(2010.8.12)
【分割の表示】特願2002−505965(P2002−505965)の分割
【原出願日】平成13年6月26日(2001.6.26)
【出願人】(506100495)NCメディカルリサーチ株式会社 (10)
【出願人】(000002990)あすか製薬株式会社 (39)
【出願人】(503460736)三井住友海上ケアネット株式会社 (3)
【出願人】(000005108)株式会社日立製作所 (27,607)
【Fターム(参考)】
[ Back to top ]

