神経幹細胞
【課題】細胞を対称的に分裂している自己再生状態に維持できる、大量の神経幹細胞を培養するための方法および条件を開発すること。
【解決手段】神経幹細胞の集団であって、該細胞の少なくとも90%が、対称的に分裂している神経幹細胞であり、そして該細胞の1%以下が、成熟した星状細胞、ニューロン、および乏突起膠細胞に対するマーカーの発現に対して陽性である、集団。
【解決手段】神経幹細胞の集団であって、該細胞の少なくとも90%が、対称的に分裂している神経幹細胞であり、そして該細胞の1%以下が、成熟した星状細胞、ニューロン、および乏突起膠細胞に対するマーカーの発現に対して陽性である、集団。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、神経幹細胞、ならびに幹細胞の対称分裂および自己再生を促進するための神経幹細胞(NS細胞またはNSC)の培養条件および培養方法に関する。組成物、細胞集団、細胞株、および単一の神経幹細胞もまた提供される。
【背景技術】
【0002】
神経幹細胞は種々の供給源からインビトロで単離されるといわれているが、これまで、これらの細胞を対称分裂している未分化状態で大規模培養で増殖することはできなかった。この状態での細胞の長期の増殖が、実験的観点および治療的観点の両方から、非常に望ましい。純粋な神経幹細胞集団を有することにより、ニューロン、星状細胞、および乏突起膠細胞の3つの細胞型への方向付けられた分化が可能になる。
【0003】
神経幹細胞を培養する1つの公知の方法は、不均質な細胞集団中の微量成分であるにも関わらず、神経球系である。この系は、不均質な細胞の凝集体の連続継代を包含するが、真の神経幹細胞はほんのわずかな割合でしかない。神経球中の細胞の大部分は、分化が方向付けられた前駆体である。
【0004】
神経球の異質性および不安定性、ならびにそれがニューロンを生成する能力に制限があることの多くの報告がある(例えば、Morsheadら, 2002)。Rappaら Neuroscience 2003は、フィブロネクチン上にそれらを1〜7日間播種し、次いで神経球を再形成することにより神経球細胞をトランスフェクトするための方法を報告しているが、(ある場合には)神経球内の幹細胞のいかなる顕著な特徴づけも提供していない。
【0005】
Suslovら 2002は、神経球系が、その中の任意の幹細胞の有意義な特徴づけを可能にするには不均質すぎることの明確なデータを提供している。主な結論は、神経球内の異質性がある−「クローン内神経細胞系統多様性を示す、すなわち、それらは、NSCに加えて、異なる分化状態のニューロンおよび膠細胞前駆体を含む」−だけでなく、異なるクローン神経球株間の遺伝子発現プロフィールに大きな差異が存在することである。Suslovの遺伝子発現プロファイリングは、「得られた分子表現型は、我々の系の中のクローン原性NSCが不均質であり、別個の神経発達方向の決定を反映しているサブセットを有することを示している」と論文中に明白に確認されているように、神経球内の幹細胞の定義を構成していない。
【0006】
この分野における多くの文献は、膠細胞の特性を記載している。Skoghら MCN 2001は、GFAPを発現しそしてRC2およびネスチンに対して可変的に染色する膠細胞の培養物を記載している−マウスGFAPは、インビボにて放射神経膠で発現されていないことに留意されたい(Rakic, 2003)。彼らは、彼らの細胞が、神経原性放射神経膠のホールマークであるPax6を発現していないことを報告しており(Malatestaら, 2001, 2003)、そして彼らは、他の放射神経膠マーカーはどれも調べていない。彼らは、不均質な培養物を有していたが、クローン分析を実施しなかった。
【0007】
インビトロでの放射神経膠の他の報告は、それらを分化の中間体または終末産物としてみなしている。したがって、Bibelら(Nat Neurosci, 2004)は、一過性放射神経膠様細胞を介するES細胞からのニューロンの生成を報告しており、そしてGreggおよびWeiss(J Neurosci, 23: 11587-601,2003; 米国特許公開2003/0032181)は、放射神経膠への神経球細胞の「分化」を記載している。Hartfussら(Dev Biol, 2001)は、放射神経膠が神経球に存在していることを示している。
【0008】
GreggおよびWeissは、放射神経膠が神経球の分化産物であることを見出し、「これらの結果は、神経幹細胞がRGC[放射神経膠細胞]を生じ得ること、およびRGCが導く移動は成体CNSにおいて繰り返され得ることを示唆している」と結論した。優勢な意見は、放射神経膠が、神経球から生じる分化した細胞型の1つであるというものである。
【0009】
LiourおよびYu(Glia, 2003)は、放射神経膠細胞分化がES細胞から得られ得ることを示しているが、この分野の他の報告と同様に、神経原性放射神経膠の発現を報告していない。
【0010】
Gobbelら Brain Res 2003は、「基材に緩く付着した増殖した細胞の球状塊としての」、すなわち、均一な単層としてではない、多分化能性ラット細胞の増殖を報告している。さらに、この論文の要約は、「これらの細胞は、3つの分裂のうち約2つにおいて分裂終了細胞を生じ、このため増殖を困難にしている」と結論している。それらの培養物中には広範囲の膠原性分化があるが、著者らは「比較的少ない」(<3%)のニューロンを見出している。彼らは、彼らの細胞の分子表現型を提供していない。
【0011】
WO01/30981は、ニューロンに分化し得る細胞の培養物を記載している。しかし、これらの細胞は、GFAPおよびネスチンに対して陽性であり、星状膠細胞として記載され、そして比較的純粋でない混合集団である。
【0012】
幹細胞が特定の細胞微環境、すなわちニッチを必要とするという概念は、幹細胞生物学において通説である。常に認められているわけではないが、神経球において、幹細胞は、前駆体、芽球細胞、および未熟分化子孫の中で総細胞のほんのわずかな割合しか占めていないことが知られている。この混合細胞型の凝集は、その中で小部分である、幹細胞であり得る細胞のためのニッチを構成し得る。
【0013】
文献の中で、ES細胞から神経幹細胞の均質な集団を誘導するとの報告はなく、唯一、神経膠に制限されるようになる前に一過的に増殖され得る神経上皮前駆細胞を誘導するとの報告がある(例えば、Brustleら, Science 1999)。
【発明の概要】
【発明が解決しようとする課題】
【0014】
したがって、当該分野には多数の課題が存在している。
【0015】
全ての報告は、それらの培養物が不均質であることを認めている。対称的に分裂しかつ未分化の状態で神経幹細胞の大規模培養を維持するために、神経球系を使用することはできなかった。多数の神経幹細胞を培養する他の試みは、5〜20継代を越えてはうまくいかず、また細胞が分化する傾向が高いことによって妨害されてきた。例外は、成体ラット海馬幹細胞における研究であるが、これらは、核型が異常であり、そして低い効率でニューロンを形成する。
【0016】
一過性の神経発生前駆体が知られているが、永久または半永久の自己再生幹細胞は単離精製されていない。
【0017】
ES細胞から神経幹細胞を誘導し、次いでこれらの神経幹細胞を純粋培養で維持することが望まれているが、これは、これまでできていない。また、移植のためにES細胞から神経幹細胞を誘導することも望まれているが、公知のES誘導細胞集団中のESおよび他の非神経細胞の残存は、レシピエント動物に腫瘍を生じる。さらに、胎児および出生後CNSから純粋な神経幹集団を得ることが望まれている。
【0018】
神経幹細胞の挙動を制御する分子および細胞事象の完全な理解は、胚発生の理解のための経路としてだけではなく、将来の治療適用のために神経幹細胞が単離され増殖されそして制御され得る枠組みとしてもまた、必須である。当該分野で公知の神経幹細胞の培養方法は、上記の理由のために、このような研究および治療適用に使用するには不適切である。したがって、細胞を対称的に分裂している自己再生状態に維持できる、大量の神経幹細胞を培養するための方法および条件を開発することが所望され得る。限定培地の使用は、臨床設定で非常に所望され得るので、上記要件を満たしている、限定した培養培地を有することが特に所望され得る。
【0019】
本発明は、上記課題の1つ以上を解決する。
【課題を解決するための手段】
【0020】
より詳細には、本発明は、神経幹(NS)細胞の対称分裂を促進する方法を提供し、この方法は、
(a)EGFファミリーのレセプターから下流のシグナル伝達経路のアクチベーター;および
(b)FGFレセプターから下流のシグナル伝達経路のアクチベーター
を含む培地で、該細胞を培養する工程
を含む。
【0021】
好ましい実施態様では、細胞は、血清の不在下で、例えば、血清を含まずかつ血清抽出物を含まない培地で培養される。さらに、細胞は基材に付着されて、別の言い方をすれば、接着培養で、培養されることが好ましい。また、培養培地が、インスリンまたは細胞上のインスリンレセプターの別のアゴニストを含むことが好ましい。
【0022】
本発明においては、用語「促進する」は、神経幹細胞を対称的に分裂している状態に維持することを包含すると理解される。
【0023】
本発明の別の局面によれば、多くの継代にわたって未分化状態での神経幹細胞の自己再生および対称分裂を支持する、および好ましくは促進する培養培地が提供される。この培地は、神経幹細胞の非対称分裂および分化を実質的に防ぐ。
【0024】
本発明はさらに、本明細書中のプロトコルに詳細に記載されるように、神経幹細胞を得る方法を提供し、そしてさらに、このような方法により得られる細胞を提供する。
【0025】
本発明はまた、神経細胞集団、組成物、細胞株、クローン原性細胞株、および単一の神経幹細胞を提供し、これらは、自己再生性の対称的に分裂している神経幹細胞を含む。
【0026】
本発明のさらなる局面は、ES細胞から神経幹細胞への分化を促進するための方法、および自己再生性の対称的に分裂している実質的に未分化の状態で得られる神経幹細胞を維持するための方法を提供する。
【図面の簡単な説明】
【0027】
【図1A】ES細胞からの神経幹(NS)細胞の生成を示す。
【図1B】ES細胞からの神経幹(NS)細胞の生成を示す。
【図1C】ES細胞からの神経幹(NS)細胞の生成を示す。
【図1D】ES細胞からの神経幹(NS)細胞の生成を示す。
【図1E】ES細胞からの神経幹(NS)細胞の生成を示す。
【図1F】ES細胞からの神経幹(NS)細胞の生成を示す。
【図1G】ES細胞からの神経幹(NS)細胞の生成を示す。
【図2A】NS細胞が種々のES細胞株および胎児前脳から誘導され得ることを示す。
【図2B】NS細胞が種々のES細胞株および胎児前脳から誘導され得ることを示す。
【図2C】NS細胞が種々のES細胞株および胎児前脳から誘導され得ることを示す。
【図3】NS細胞が成体脳内に取り込まれ分化することを示す。
【図4A】ヒトES細胞または胎児由来NS細胞を示す。
【図4B】ヒトES細胞または胎児由来NS細胞を示す。
【図4C】ヒトES細胞または胎児由来NS細胞を示す。
【図5A】分化培地中で培養したNS細胞の電圧および電流クランプ条件下での電気活動を示す。
【図5B】分化培地中で培養したNS細胞の電圧および電流クランプ条件下での電気活動を示す。
【図5C】分化培地中で培養したNS細胞の電圧および電流クランプ条件下での電気活動を示す。
【図5D】分化培地中で培養したNS細胞の電圧および電流クランプ条件下での電気活動を示す。
【図5E】分化培地中で培養したNS細胞の電圧および電流クランプ条件下での電気活動を示す。
【発明を実施するための形態】
【0028】
(定義の節)
「神経幹細胞」
本明細書中で使用される用語「神経幹細胞」とは、ニューロンおよび神経膠の両方を生成する潜在能を維持しながら20〜30よりも多くの細胞分裂を受け得る細胞を記載している。好ましくは、該細胞は、40より多くの、より好ましくは50より多くの、最も好ましくは無制限のこのような細胞分裂を受け得る。
【0029】
神経幹細胞は、対称的または非対称的のいずれかで分裂し得る。対称的に分裂している場合、神経幹細胞は、分裂して2つの娘神経幹細胞または2つの方向付けられた前駆体を形成する。しかし、他に記載されない限り、対称分裂とは、本明細書中では対称的な自己再生をいう。非対称的に分裂している場合、神経幹細胞は、分裂して1つの娘神経幹細胞と1つの方向付けられた前駆体(例えば、ニューロン前駆体または神経膠前駆体のいずれか)とを形成する。
【0030】
本発明の神経幹細胞は、放射神経膠として記載され得、そして放射神経膠マーカーRC2、3CB2、GLAST、BLBP、およびPax6の少なくとも1つ(および好ましくは全部)を発現することが示されている。好ましくは、本発明の神経幹細胞は、RC2、3CB2、およびGLASTを発現している。より好ましくは、細胞は、RC2、3CB2、GLAST、および、BLBPもしくはPax−6の少なくとも1つを発現している。本発明の神経幹細胞はまた、それらが神経前駆体マーカーのネスチンもしくはビメンチン、ルイスX抗原、ムサシ−1、またはプロミニンの少なくとも1つ(好ましくは全部)発現に対して陽性であり、そしてOct−4またはNanogの少なくとも1つ(好ましくは両方)の発現に対して陰性であることでもまた特徴付けられ得る(実施例1〜3もまた参照のこと)。
【0031】
本発明の神経幹細胞は、定義により多分化能性である、すなわち、それらは、多数の神経細胞型(例えば、ニューロン/神経膠)に分化し得る。以下の実施例は、本発明の方法に従って培養された神経幹細胞が、それらの潜在能を保持しており、そして全ての期待される細胞型に分化し得ることを確証している。
【0032】
「神経幹細胞の供給源」
広範な種々の供給源から本発明の神経幹細胞を誘導することができる。例えば、神経幹細胞は、胚から直接、成体組織から、胎児組織から、または胚性幹(ES)細胞(野生型または遺伝子改変ES細胞のいずれか)から誘導され得る。好ましくは、本発明の神経幹細胞は、マウスもしくはヒトのES細胞から誘導されるか、またはマウスもしくはヒトの胎児細胞から誘導される。
【0033】
本発明の神経幹細胞は、とりわけ、ヒト、霊長類、げっ歯類、および鳥類に由来し得る。好ましくは、神経幹細胞は、哺乳動物、特にマウス、ラット、およびヒトに由来する。
【0034】
「EGFレセプターファミリー」
本明細書中で使用される用語「EGFレセプターファミリー」は、EGFシグナル伝達因子のファミリーによって活性化され得るレセプター(通常、ホモダイマーもしくはヘテロダイマーレセプター)のファミリーを記載している。レセプターは、4つの非常に相同性の高い膜貫通糖タンパク質ErbB−1(EGF−Rとしても知られる)、ErbB−2、ErbB−3、およびErbB−4のファミリーで構成される。
【0035】
「EGFレセプター」というときは、EGFレセプターファミリーの任意のモノマーもしくはダイマーレセプター複合体を包含する。
【0036】
各レセプターは、細胞外リガンド結合ドメイン、単一疎水性膜貫通ドメイン、および1型レセプターチロシンキナーゼ活性によってシグナル伝達の原因となる細胞質チロシンキナーゼドメインを有する。これらのレセプターのいずれかへのリガンドの結合は、レセプターの二量体化および自己リン酸化、続いて多数の細胞基質のリン酸化を生じ、種々の生物学的効果に至る。レセプターの二量体化は、レセプターリガンドおよび毒性環境刺激(例えば、UV照射)を含む種々の刺激によって引き起こされ得る。各ダイマーレセプターは、異なるSH2含有エフェクタータンパク質を補充することによって別個のシグナル伝達経路を開始させる。例えば、EGF−Rダイマーは、グアニンヌクレオチド放出因子SOSにカップリングされたアダプタータンパク質Grbと複合体化し得る。Grb−SOS複合体は、レセプター中のホスホチロシン部位に直接結合し得るか、またはShcを介して間接的に結合し得る。これらのタンパク質相互作用は、SOSをRasに近接した位置にもたらし、Rasを活性化させる。このことは引き続き、ERKおよびJNKのシグナル伝達経路を活性化させ、引き続き、遺伝子発現を調節する転写因子(例えば、c−fos、AP−1、およびElk−1)を活性化させる。EGFレセプターはまた、PLCγシグナル伝達経路も活性化させ得る。
【0037】
「FGFレセプター」
本明細書中で使用される用語「FGFレセプター」は、膜貫通FGFレセプターチロシンキナーゼのファミリーの任意のメンバーを記載している。これらのレセプターの4つの主要なイソ型FGFR1、2、3、および4が存在し、そしてそれらは、ヘパリンおよびヘパラン硫酸(HS)系と密に関連して作用することが知られている。FGFレセプターというときは、FGFレセプターファミリーの任意のモノマーまたはダイマー(ホモもしくはヘテロダイマー)複合体を含む。
【0038】
FGFレセプターと関連した細胞性シグナル伝達経路は、MAPキナーゼ経路、およびPLCγ経路を含む。
【0039】
「培養培地」
本発明で使用される培養培地は、好ましくは、必要に応じて付加成分が添加された基本培地を含む。
【0040】
基本培地は、神経幹細胞のための炭素および/またはビタミンおよび/またはミネラルの必須供給源を供給する培地である。基本培地は、一般に、タンパク質を含まず、そしてそれ自身単独では神経幹細胞の自己再生/対称分裂を支持し得ない。
【0041】
好ましくは、本発明で使用される培養培地は、例えば、血清および/またはフィーダー細胞のような非限定である成分、すなわち、その含有量が不明である成分、または未特定の非限定または変動のある因子を含み得る成分、を含まない。血清を含まずかつ血清抽出物を含まない、完全限定培地を用いる利点は、神経幹細胞の培養およびそれに続く操作のために、効率的かつ一貫したプロトコルが導かれ得ることである。
【0042】
「培養表面」
本発明の全ての局面における神経幹細胞の培養のための代表的な表面は、細胞培養に有用であると当該分野で認識されている培養表面であり、そしてこれらには、プラスチック製表面、金属製表面、複合材製表面が含まれるが、通常は、広く市販されているプラスチック製組織培養プレートのような表面が用いられる。このようなプレートは、しばしば、直径数センチメートルである。スケールアップのために、このタイプのプレートは、ずっとより大きい直径で用いられ得、そして多くの繰り返しプレートユニットが用いられ得る。
【0043】
培養表面は、通常には表面上にコーティングされた、細胞接着タンパク質をさらに含み得る。幹細胞上に存在するレセプターもしくは他の分子が、該タンパク質または他の細胞培養基材に結合し、そしてこれは、表面への接着を促進し、そして増殖を促進する。ゼラチンでコーティングしたプレートが特に好ましい。
【0044】
本発明は、EGFレセプターのアゴニストまたはEGFおよびFGF−2レセプターの両方のアゴニストを含む培地中の基材に付着した神経幹細胞の培養が、幹細胞の制限のない対称分裂を促進しそしてニューロン/神経膠へのそれらの分化を実質的に防ぐとの知見に基づく。
【0045】
本発明の種々の局面を、ここに詳述する。
【0046】
本発明の第一の局面は、神経幹(NS)細胞の対称分裂を促進する方法を提供し、この方法は、
(a)EGFファミリーのレセプターから下流のシグナル伝達経路のアクチベーター;および
(b)FGFレセプターから下流のシグナル伝達経路のアクチベーター
を含む培地で、該細胞を培養する工程
を含む。
【0047】
本発明の別の方法は、神経幹細胞を得るために、以下の工程を含む:
(1)神経幹細胞を含む細胞の混合集団を得る工程;
(2)(a)EGFファミリーのレセプターから下流のシグナル伝達経路のアクチベーター;および(b)FGFレセプターから下流のシグナル伝達経路のアクチベーターを含む培地に該細胞を再播種する工程;
(3)該細胞を培養する工程;
(4)細胞の凝集体を回収する工程;
(5)(a)EGFファミリーのレセプターから下流のシグナル伝達経路のアクチベーター;および(b)FGFレセプターから下流のシグナル伝達経路のアクチベーターを含む培地に該細胞を再播種する工程;
(6)該細胞を培養する工程;
(7)(a)EGFファミリーのレセプターから下流のシグナル伝達経路のアクチベーター;および(b)FGFレセプターから下流のシグナル伝達経路のアクチベーターを含む培地に、単一細胞として細胞を再播種する工程。
【0048】
この方法は、例えば、このようなマーカーの発現を、それらの分化した子孫でのその発現に比較して神経幹細胞で優先的に活性なプロモーターに連結させることにより、神経幹細胞特異的マーカーを発現している細胞について選択することが付加され得る。好ましくは、この方法は、65%以下のコンフルエンスで、より好ましくは55%以下のコンフルエンスで、特に50%を下回るコンフルエンスで、細胞を継代させる工程を含む。
【0049】
本発明の方法の他の好ましい特徴は、実施例9で本発明のプロトコルに記載される通りである。
【0050】
本発明の培養物は、好ましくは、接着培養であり、すなわち細胞が基材に付着されている。
【0051】
基材は、代表的には、培養容器または別の物理的支持体での表面、例えば、培養ディッシュ、フラスコ、ビーズ、もしくは他のキャリアでの表面である。好ましくは、基材は、細胞の接着性を向上させるためにコーティングされていおり、そして適切なコーティングには、ラミニン、ポリリジン、ポリオルニチン、およびゼラチンが含まれる。細胞が、単層培養で増殖し、懸濁中で増殖せず、細胞のボールもしくは塊として増殖しないこともまた好ましい。より高い密度では、細胞は、互いに積み重なり始め得るが、培養物は、基材に付着されて、本質的に単層であるかまたは単層として開始する。
【0052】
EGFファミリーのレセプターから下流の1つ以上のシグナル伝達経路は、好ましくは、EGFファミリーのレセプターのアゴニストを用いて活性化され得る。EGFファミリーのレセプターのアゴニストは、適切には、シグナル伝達因子のEGFファミリーのメンバーであり、そして好ましくは、EGFレセプターの細胞外ドメインに結合する。用語「アゴニスト」はまた、シグナル伝達因子のEGFファミリーに対する模倣物、融合タンパク質、抗体、シグナル伝達因子のEGFファミリーのキメラ、ならびにそれらのフラグメント、改変体および誘導体も包含し、これらは、EGFファミリーのレセプターを活性化し得る。
【0053】
シグナル伝達因子のEGFファミリーを構成する分子は、それらが少なくとも1つのEGF様ドメインを含む点で特徴付けられ得る。このドメインは、ジスルフィド結合の形成を通して3つのペプチドループを生じる6つのシステイン残基によって定義され得る。
【0054】
EGFレセプターファミリーのレセプターを通して作用し得そしてこれらのレセプターの下流の経路を活性化し得る特定のアゴニストとしては、EGF、TGF−α、アンフィレグリン、ヘパリン結合EGF、エピレグリン、ベータセルリン、ニューレグリン1〜4、およびCripto−1が挙げられる。好ましくは、アゴニストは、EGFそれ自体である。
【0055】
FGFのレセプターから下流の1つ以上のシグナル伝達経路は、好ましくは、FGFのレセプターのアゴニストを用いて活性化され得る。FGFのレセプターのアゴニストは、適切には、シグナル伝達因子のFGFファミリーのメンバーである。用語「アゴニスト」はまた、シグナル伝達因子のFGFファミリーに対する模倣物、融合タンパク質、抗体、シグナル伝達因子のFGFファミリーのキメラ、ならびにそれらのフラグメント、改変体および誘導体も包含すると意図され、これらは、FGFのレセプターを活性化し得る。
【0056】
好ましくは、FGFレセプターのアゴニストは、FGF−2またはラミニン−FGFである。
【0057】
EGFレセプターファミリーのレセプターまたはFGFレセプターのいずれかの下流のシグナル伝達経路の活性化はまた、構成的に活性なレセプターによって、またはそれぞれのシグナル伝達経路の下流のエフェクター(例えば、MEKもしくはBcl2)によっても引き起こされ得ることが理解される。本発明の特に好ましい実施態様では、シグナル伝達経路は、細胞透過性小分子によって活性化される。これは、それぞれのレセプターを迂回し、シグナル伝達経路を直接活性化し得る。したがって、本発明では、用語「アクチベーター」は、EGFレセプターファミリーのレセプターまたはFGFレセプターの下流のシグナル伝達経路を活性化し得る全ての分子を包含する。
【0058】
本発明の神経幹細胞培養物の維持におけるアクチベーターの有効性は、以下の実施例1−1および1−2において実証されている。ここでは、神経幹細胞のバルクおよびクローン集団が、EGFおよびFGF−2を含む培地で維持され、そして多数回継代され得る。さらに、試験した細胞集団中では神経幹細胞マーカーが至るところに存在することによって示されるように、神経幹細胞の分化は無視し得る程度であるか全く存在しない(実施例1−3を参照のこと)。そしてそれらはそれらの潜在能を保持し、全ての期待される細胞型に分化し得る(実施例1−4を参照のこと)。
【0059】
したがって、本発明は、自己再生性の対称的に分裂している未分化状態で神経幹細胞の大きな集団を維持する効率的な方法を提供する。本発明の組成物は、神経幹細胞を含む組成物であって、神経幹細胞が接着培養中にあり、そして組成物中の細胞の少なくとも50%、70%、または80%が神経幹細胞である組成物を包含する。神経幹細胞の割合は、さらに好ましくは少なくとも90%、より好ましくは少なくとも95%、非常に好ましくは少なくとも97%である。さらに、本発明の神経幹細胞は、大いに継代され得る。神経幹細胞は、少なくとも30回、より好ましくは少なくとも60回、非常に好ましくは少なくとも90回継代されていることが好ましい。なおさらに、本発明の神経細胞の集団では、該細胞の少なくとも80%、好ましくは少なくとも90%、より好ましくは少なくとも95%が、対称的に分裂している神経幹細胞である。この組成物中の細胞は、単独または組み合わせて、本発明の任意の特徴および全部の特徴によってさらに特徴付けられ得る。
【0060】
組成物もまた提供され、この組成物は、
神経幹細胞;
EGFファミリーのレセプターから下流のシグナル伝達経路のアクチベーター;および
FGFレセプターから下流のシグナル伝達経路のアクチベーター
を含む。
【0061】
組成物は、好ましくは、基本培地を含む。また、組成物中の神経幹細胞の少なくとも80%、好ましくは少なくとも90%、より好ましくは少なくとも95%が、対称的に分裂している神経幹細胞であることが好ましい。
【0062】
上記神経細胞集団および組成物の両方において、神経幹細胞は、好ましくは、オンコジーンをコードする外因性遺伝物質を含まない。すなわち、それらは、不死化ストラテジーを受けていない。特定の実施態様では、集団/組成物の神経幹細胞は、それらが、
神経前駆体マーカーのネスチンもしくはビメンチン;
Sox−2;
放射神経膠細胞特異的マーカーのRC2、3CB2、GLAST、BLBP、もしくはPax−6;
ルイスX抗原;
ムサシ−1;および
プロミニン
の少なくとも1つの発現に対して陽性であり、そして
Oct4、および
Nanog
の少なくとも1つの発現に対して陰性であることで特徴付けられている。
【0063】
好ましくは、細胞は、RC2、3CB2、およびGLASTの発現に対して陽性である。他の実施態様では(必要に応じて先行のマーカープロフィールに加え)、細胞は、BLBP、Pax−6、神経前駆体マーカーのネスチンもしくはビメンチン、ルイスX抗原、ムサシ−1、またはプロミニンの少なくとも1つの発現に対して陽性である。特に好ましい実施態様では(そして必要に応じて先行のマーカープロフィールに加え)、細胞は、Oct4またはNanogの少なくとも1つの発現に対して陰性である。
【0064】
さらなる実施態様では(必要に応じて上のマーカープロフィールに加え)、細胞は、Sox−2の発現に対して陽性であり、そしてSox−1の発現に対して陰性である。マウス由来NS細胞を含む特定の組成物/集団では、細胞の1%以下が、GFAPまたはβIIIチューブリンの発現に対して陽性であり、それにより星状細胞またはニューロンへの細胞の分化が無視し得る程度であることが確認される。他の組成物/集団では、細胞の1%以下が、成熟した星状細胞、ニューロン、または乏突起膠細胞に対するマーカーの発現に対して陽性である。
【0065】
本発明はまた、ラット細胞を用いて実施された。したがって、本発明者らは、ラットCNSから細胞を採取し、そして本発明の方法を用いて、ラット神経幹細胞の培養物を得た。ラット神経幹細胞は、(i)高純度、代表的には80%または90%を超えるラット神経幹細胞、および(ii)多数回の倍加、50を超える、100を超える、さらに200を超える倍加後に、その高割合(最少で50%)がニューロンおよび神経膠を形成する能力を保持している細胞であるとの特性を有する。当該分野では、ラット由来の細胞は、明らかに非常に不均質であり、成体海馬からのみであった。本発明者らは、この供給源から細胞を得ずに、代わりにラットCNSから得た。この点において、本発明の方法は、3種(ラット、マウス、ヒト)の全てにわたって有効であったことが注目に値する。本発明の方法に従って、単一の細胞が、神経幹細胞コロニーを形成すれば、ニューロンがそのコロニー中の細胞から得られ得ることが一般に理解される。これは、例えば、(i)核に対して(すなわち、全ての細胞を染色)および(ii)ニューロンに対して(すなわち、ニューロンのみ)個別に染色することによって測定される。染色された細胞の相対数を比較することにより、ニューロンを形成する細胞の割合が算定され得る。
【0066】
本発明の第二の局面は、神経幹細胞の調製のための方法を提供し、この方法は、(i)上記の方法に従って神経幹細胞を培養し、それによって神経幹細胞の培養物を得る工程、および(ii)該培養物から神経幹細胞を単離する工程を含む。好ましくは、単離された神経幹細胞は、対称的な様式で分裂するように条件付けられた細胞である。
【0067】
多数の細胞供給源が用いられ得、そこから神経幹細胞が誘導される。1つの方法では、細胞は、動物の神経組織から得られ、そして本発明に従って培養され、対称的に分裂している神経幹細胞の培養物が得られる。神経組織は、成体または胎児の組織に由来し得る。神経組織は、CNSに由来し得、そして神経幹細胞の対称分裂集団は、ヒトおよびマウスの両方からの成体および胎児の両方のCNSから採取された抽出物から得られ得る。神経組織は、好ましくは、放射神経膠表現型を有すると同定された細胞を含む。例えば、この表現型を有する細胞は、小脳および網膜からの抽出物で同定されており、その両方ともが、適切なさらなる細胞供給源を表す。神経幹細胞は、疾患のモデリングに有用な罹患神経組織から得られ得、例えば、細胞は、この目的で脳腫瘍から得られ得る。
【0068】
本発明を使用する選択肢には、罹患個体から神経幹細胞を誘導し、次いで(i)アッセイのためにこれらの細胞を使用するか、または(ii)その個体に細胞を戻す移植の前に遺伝子改変を実施することがある。したがって、神経変性障害(例はアルツハイマー病およびパーキンソン病を含む);または脳腫瘍を有する個体から、細胞が得られ得る。
【0069】
神経幹細胞を得る別の方法は、
(i)神経幹細胞に分化し得る多分化能性もしくは分化多能性幹細胞を得る工程、
(ii)(i)の細胞を、分化多能性細胞に対して非許容性である培地でそして(a)EGFファミリーのレセプターの下流のシグナル伝達経路のアゴニストおよび(b)FGFファミリーのレセプターの下流のシグナル伝達経路のアゴニストの存在下で培養する工程
を含む。
【0070】
使用に際して、混入している可能性のあるES細胞が、この方法によって除去されるか、または少なくとも実質的に数が減少され、より純粋でかつ移植の際に奇形腫を生じる可能性がより少ない培養物が得られる。
【0071】
幹細胞は、適切には分化多能性幹細胞であり、特にESまたはEG細胞である。方法は、好ましくは、EGFレセプターのアゴニストおよびFGFレセプターのアゴニストの存在下で細胞を培養する工程を含む。
【0072】
本発明のNS細胞を用いて、本発明者らは、EGFおよびFGFを除去しそして血清またはBMP4を添加することによって星状細胞を得、本発明者らは、EGFを除去し、次いで約1週間おいた後にFGFを除去し、そしてラミニン上に細胞を播種することによってニューロンを得、そして本発明者らは、EGFおよびFGFを両方とも除去することによって乏突起膠細胞を得た。一般に、神経幹細胞を生成するために使用される本発明の方法は全て、必要に応じて、神経幹細胞をニューロン、星状細胞、または乏突起膠細胞に分化する工程、および次いでさらに必要に応じて(例えば、アッセイで、移植のために、またはそれ以外に)、ニューロン、星状細胞、または乏突起膠細胞を用いる工程をさらに含む。
【0073】
神経幹細胞培養物が単離されると、次いで、それは、神経幹細胞株を樹立するために使用され得る。このような細胞株の樹立は、好ましくは、
(a)単一の神経幹細胞を得る工程、
(b)前記の方法のいずれかに従って神経幹細胞を培養する工程
を含み、それによって、神経幹細胞のクローン集団を得る。
【0074】
特定の実施態様では、細胞株を樹立するために使用される単一の神経幹細胞は、対称的に分裂している神経幹細胞、または対称的な様式で分裂するように条件付けられた神経幹細胞である。好ましくは、単一の神経幹細胞は、神経幹細胞を調製するために、上記の方法に従って得られる。
【0075】
好ましい実施態様では、上記の方法によって得られる神経幹細胞株は、神経幹細胞のクローン集団(すなわち、その中の細胞の全てが単一の神経幹細胞の子孫である)である。
【0076】
単一の神経幹細胞および細胞株(必要に応じて上記の方法によって得られ得る)もまた、本発明の一部を形成する。第一の実施態様では、細胞株が提供され、そこでは細胞が、EGFレセプターファミリーのレセプターの下流のシグナル伝達経路のアクチベーター、およびFGFレセプターの下流のシグナル伝達経路のアクチベーターの存在下で維持されている。他の実施態様では、単一の神経幹細胞および細胞株の細胞は、それらが、
神経前駆体マーカーのネスチンもしくはビメンチン;
Sox−2;
放射神経膠細胞特異的マーカーであるRC2、3CB2、GLAST、BLBP、もしくはPax−6;
ルイスX抗原;
ムサシ−1;および
プロミニン
の少なくとも1つの発現に対して陽性であり、そしてそれらが、
Oct4、および
Nanog
の少なくとも1つの発現に対して陰性であることで特徴付けられている。
【0077】
好ましくは、細胞は、RC2、3CB2、およびGLASTの発現に対して陽性である。他の実施態様では、(必要に応じて先行のマーカープロフィールに加え)細胞は、BLBP、Pax−6、神経前駆体マーカーのネスチンもしくはビメンチン、ルイスX抗原、ムサシ−1、またはプロミニンの少なくとも1つの発現に対して陽性である。特に好ましい実施態様(そして必要に応じて先行のマーカープロフィールに加え)細胞は、Oct4またはNanogの少なくとも1つの発現に対して陰性である。
【0078】
他の特定の実施態様では、(必要に応じて上のマーカープロフィールに加え)細胞は、Sox−2の発現に対して陽性であり、そしてSox−1の発現に対して陰性である。特定のマウス由来細胞株では、細胞の1%以下が、GFAPまたはβIIIチューブリンの発現に対して陽性である。他の(例えば、ヒト)細胞株では、細胞の1%以下が、成熟した星状細胞、ニューロン、または乏突起膠細胞に対するマーカーの発現に対して陽性である。
【0079】
単一の神経幹細胞および細胞株の細胞の両方とも、オンコジーンをコードする外因性遺伝物質を含まないこと、すなわち、それらは、不死化ストラテジーを受けていないことが好ましい。記載の細胞株が、神経幹細胞株であることも好ましい。
【0080】
第三の局面では、本発明は、対称的に分裂している神経幹細胞のトランスフェクトされた集団を得てこれを維持する方法を提供し、この方法は、
(a)選択マーカーAをコードする構築物でES細胞をトランスフェクトする工程であって、使用に際して、該選択マーカーが、神経前駆細胞特異的プロモーターの制御下で発現される、工程;
(b)該ES細胞の神経前駆細胞への分化を促進する工程;
(c)該選択マーカーAを発現している神経前駆細胞について選択する工程;および
(d)該選択された細胞を、前に記載の方法のいずれかに従って培養する工程
を含む。
【0081】
選択マーカーAは、抗生物質耐性、細胞表面マーカー、または例えばEP−A−0695351に記載されるような別の選択マーカーをコードし得る。神経前駆細胞特異的プロモーターは、Sox−1、Sox−2、Sox−3、BLBP、およびネスチン神経エンハンサーからなる群から選択され得る。この選択ストラテジーのさらなる詳細を、実施例1−1に示す。
【0082】
本発明の神経幹細胞(すなわち、本発明の単一の神経幹細胞ならびに組成物、細胞株、および集団中に存在する神経幹細胞)は、遺伝子改変され得る。したがって、本発明の神経幹細胞をトランスフェクトする方法が提供され、この方法は、
(a)選択マーカーBおよびポリペプチドをコードする構築物で神経幹細胞をトランスフェクトする工程;および
(b)該選択マーカーBを発現する神経幹細胞について選択する工程
を含む。
【0083】
選択マーカーBは、抗生物質耐性または細胞表面マーカーをコードし得、そして選択マーカーAと同じかまたは異なり得る。適切なトランスフェクション方法は、公知の方法であり、エレクトロポレーション、リポフェクション、ヌクレオフェクション(necleofection)、およびレトロウイルストランスフェクションおよびレンチウイルストランスフェクションが含まれる。
【0084】
遺伝子改変神経幹細胞もまた本発明の一部を形成し、したがって、本発明は、この構築物をさらに含む、本発明の単一の神経幹細胞または組成物、集団、もしくは細胞株中に存在するような神経幹細胞を提供する。このような神経幹細胞は、選択マーカーBに加え、選択マーカーAをすでに含み得ることが理解される。
【0085】
前記のように、本発明の方法は、任意の供給源から誘導された神経幹細胞との使用に適している。1つの特定の実施態様では、本発明は、ES細胞の供給源から神経幹細胞を得るための方法を提供する。この方法によれば、例えば単層での培養または胚様体分化により、ES細胞を神経前駆体に転換し、次いでNSA培地中で該神経前駆体を培養することにより、ES細胞の神経幹細胞への分化が促進される。さらに、NSA培地は、付加成分(例えば、付加グルコースおよびHEPES)を含み得ることが意図される。代替として、グルコースおよびHEPESが付加された培地(好ましくは基本培地)もまた、この分化を促進するために使用され得る。
【0086】
NSAおよび/またはグルコースおよびHEPESの存在下で、条件は、神経幹細胞の増殖が好まれるような条件であり、培養物中に存在するいかなる非神経細胞もが優先的に死滅するという利点が付加される。このことは、実質的に純粋な神経幹細胞培養物(例えば、存在する全細胞の少なくとも80%、好ましくは少なくとも90%、より好ましくは少なくとも95%)を生じる。実施例1−5は、この方法の更なる詳細を提供する。
【0087】
好ましい実施態様では、実施例1−5の方法は、対称的に分裂している神経幹細胞の集団を調製するために使用され得る。引き続き、集団は、上記の本発明の培養方法のいずれかを用いて維持される。
【0088】
実施例1−5の方法はまた、神経幹細胞へのES細胞の分化に関する因子の効果についてアッセイするために使用され得る。好ましいアッセイ実施態様では、ES細胞が、試験される因子の存在下で、実施例1−5に記載の方法を用いて培養される。因子の効果は、例えば、得られた細胞のマーカープロフィールを決定する、すなわち、細胞が、本発明の細胞と同様のマーカープロフィールを有するか、またはESマーカープロフィールが維持されているかを示すことにより、評価され得る。試験される因子は、誘導因子またはブロッキング因子のいずれでもあり得る。
【0089】
神経性疾患および神経変性疾患、および脳損傷の治療において、特に、パーキンソン病およびアルツハイマー病、多発性硬化症、および筋萎縮性側索硬化症のような疾患の治療において、神経幹細胞の使用に大きな関心がある。本発明の方法、組成物、細胞集団、細胞株、および単一の細胞は全て、このような治療において、ならびにこのような治療のための調製物の製造において、用いられ得る。本発明を用いて治療され得る特定の神経性/神経変性疾患としては、以下が挙げられる:パーキンソン病、運動ニューロン疾患、卒中、多発性硬化症、およびハンチントン病。
【0090】
したがって、第5の局面では、本発明は、細胞療法のため、および神経変性疾患および脳損傷の治療用組成物の製造のための、上に記載の細胞株、神経細胞集団、単一の神経細胞、および組成物の使用を提供する。このような調製物は、リン酸緩衝化生理食塩水(PBS)中に処方され得る。
【0091】
上に列挙した疾患の治療の方法は、本発明の単一の細胞、細胞株、組成物、または細胞集団の患者への移植を含み得る。好ましくは、患者は哺乳動物であり、より好ましくは、患者はヒトである。このような移植は、胚および成体の両CNSでの成功が示されており、そして実施例1−6に詳細に記載している。
【0092】
本発明の細胞、および特に細胞株は、神経幹細胞の分化に関する誘導因子またはブロッキング因子の効果をアッセイするために使用され得る。このようなアッセイは、本発明の神経幹細胞(すなわち、組成物、細胞株、および集団中に存在する細胞、または単一の神経幹細胞)と、試験される因子とを接触させる工程を含み得る。神経幹細胞の分化に関する因子の効果は、適切には、得られた細胞のマーカープロフィールを決定する、すなわち、細胞が、本発明の細胞と同様のマーカープロフィールを有するか、またはこれらのマーカーが失われたかを示すことにより、評価され得る。本発明の細胞はまた、薬剤をアッセイするのにも適している。
【0093】
ニューロンまたは神経膠を形成する細胞の割合を評価するために、細胞をクローン増殖する。細胞が個々に播種されると全ての細胞がクローンコロニーを形成するわけではないが、クローンコロニーを形成するもののうち一般には50%以上が、ニューロン(適切なプロトコル下で)または神経膠(再度、適切なプロトコル下で)をつくる。これらの細胞は、従来技術から区別される。従来技術は、神経幹細胞特性を有する細胞の同定およびその増殖さえも議論しているが、それらの集団は非常に不均質であったからである。これは、重要な相違である。純粋でない集団は、残りの神経幹細胞にシグナル伝達を提供する細胞を含むからであり、このことは、分化を刺激しそしてさらには神経幹細胞の割合を減少させる。先行技術の方法は、個々の細胞から神経球を生成し得るが、本発明は、個々の細胞から実質的に純粋な集団の生成を可能にしている。
【0094】
本発明の特定の実施態様(以下の実施例により詳細に記載する)では、全てのNS細胞コロニーが、15%以上、好ましくは少なくとも20%、より好ましくは約20〜30%のTuJ陽性ニューロンを生成している。より高い密度の培養で、本発明者らは、TuJ陽性細胞を計数した。LC1 NS細胞の35%がニューロン形態を獲得し、そして1年よりも長い連続培養である115継代後にもβIIIチューブリンを発現していた。これらの細胞は、この期で二倍体核型を保持していた。LC1は、クローン化されていない集団である。したがって、データは、神経膠に制限された前駆体または遺伝的形質転換に対する選択圧が最小限であったことを示している。
【0095】
本発明の細胞は、異種細胞と共培養することなくかつ非限定の条件培地、細胞外マトリックス画分または血清を用いることなく増殖され得、これは、ES細胞以外の幹細胞のタイプについて以前に示されていない特徴である。したがって、本発明によれば、神経幹細胞が、好ましくは、規定された条件で均質な培養で増殖される。マイクロウェル中に単離された単一のNSCでさえも増殖し得、このことは、EGFおよびFGF以外の細胞外シグナルへの依存が最小限であること、およびインビトロでは、NSCにとって必須の外的自己再生シグナルが、EGFおよびFGFに対して減少され得ることを示している。
【0096】
実施例により詳細に示したさらなる実施態様では、実質的に全てのコロニー(播種している単一の細胞から発達したコロニーの少なくとも90%、好ましくは少なくとも95%、より好ましくは少なくとも97%)が、(i)FGF+EGFにおいて神経前駆体マーカーの同一の均質な発現と分化マーカーの不在とを示し、そして(ii)増殖因子の除去に際してニューロンを生成している。特定の実施例では、全てのコロニーがこれらの特性を有していた。これは、対称的な自己再生の証拠である。さらに、非クローンNS細胞培養物におけるコロニーアッセイからのデータは、クローンNS5株由来のデータと比較可能であった。NS5からの増殖可能な未分化のコロニーの連続的な形成は、クローン原性細胞が幹細胞であること、およびそれらの数がNS集団と比例して増大していることを示している。形式的に、幹細胞数の増加は、2つの機構を介して生じ得る:デノボ生成または対称的な自己再生分裂。前者は、前幹細胞供給源、すなわち、分化多能性細胞または胎児原基を必要とし、それらのいずれも、本明細書中のNS細胞培養物中には存在しない。そこで、対称的な自己再生がNS細胞培養で生じていなければならない。
【0097】
以下の実施例で得られた特定のNS細胞は、Sox2、Pax6、Emx2、Olig1、Olig2、ネスチン、BLBP、GLAST、ビメンチンを発現し、そしてRC2、3CB2、SSEA−1、およびプロミニンに対して免疫反応性である。好ましくは、それらは、Sox1を発現せず、そしてGFAPおよびニューロン抗原に対して陰性である。これらのNS細胞は、分化多能性マーカーおよび他の胚葉のマーカーを欠く。本発明者らは、ES細胞での場合と同様に、神経幹細胞の特徴がCNS発生の間でマスクされており、エクスビボでのみ真に実証可能であることを主張する。Sox1発現がNS細胞で維持されなかったという知見は、新規で予期されないものであり、そしてSox1を用いる連続的な系統選択は実りあるものではないことを示している。
【0098】
本発明のさらなる実施態様では、ES細胞由来非クローン化(CGR8−NS)およびクローン化(NS5)NS株および胎児皮質由来非クローン化(Cor1)およびクローン化(Cor1−3)NS株により例証されるNS細胞は、培養物中に放射神経膠マーカー3CB2、BLBP、GLAST、ネスチン、RC2、およびビメンチンの発現を示している。GFAPの発現は、これらの培養物のいずれにおいても、好ましくは細胞の10%未満、より好ましくは5%未満、特に2%未満である。特定の実施例では、GFAP発現は、細胞の1%未満で見られた。本発明者らはまた、115継代後のES細胞由来NS細胞において、GFAPおよびβIIIチューブリンはなく、ネスチンおよびRC2の均一な発現を示した。このことは、NS細胞表現型が安定であることを示している。本発明の好ましい細胞は、ES細胞から分化され、そして30継代後、好ましくは60継代後、より好ましくは100継代後に、(1)ネスチンおよびRC2の発現が続きそして(2)GFAPおよびβIIIチューブリンの発現がないことが続く。GFAPおよびβIIIチューブリンの発現がないとは、細胞の5%未満、好ましくは細胞の2%未満に発現が見られることを意味する。
【0099】
本発明者らは、RT−PCRによって分析を実施し、特定のNS細胞に分化多能性、中胚葉、または内胚葉の特異的転写因子がないことを確認した。本発明者らはまた、アフィメトリックス(RTM)発現プロファイリングを実施し、系統の不適切な転写物がないことを確認し、そして3つの異なるNS細胞培養(ES由来、胎児皮質由来、およびクローン胎児皮質由来)において神経マーカーおよび放射神経膠マーカーの一貫した発現を実証している。
【0100】
ES細胞からの分化によりNS細胞を得ることは、好ましくは、連続接着培養で細胞を維持する工程を含み、そしてより好ましくは、神経球を形成する工程を省く。しかし、胎児または成体脳由来の一次細胞単離物からの細胞の分化によりNS細胞を得ることは、必要に応じて、(i)まず懸濁凝集体または神経球を形成する工程、および(ii)引き続き接着培養に細胞を維持する工程を含む。本発明者らは、実施例において、数日後に、これらの凝集体がゼラチンコートされたプラスチックに付着され得、次いでNS細胞が増殖することを見出した。
【0101】
本発明者らは、本発明の細胞の初期および後期継代で生成したニューロンおよび星状細胞の割合を、(詳細には、LC1 NS細胞に対して、8継代目および115継代目で)決定した。後者の培養は、12ヶ月の増殖を表し、倍加時間は24時間であった。後期継代で得られたニューロンの数にはささやかに減少があるが、これはなお35%よりも多くを占める。独立して46C ES細胞から誘導されたNS5クローン株は、30継代目に同様のレベルのニューロン分化効率を示している。GFAP免疫反応性星状細胞の生成は、LC1 NS細胞についておよびNS5細胞についても、両時点で100%に近づいた。さらに、多数回継代で増殖し、次いでGFPレンチウイルスを形質導入しそして移植前にさらに増殖させたLC1 NS細胞を用いて、インビボでのデータを得た。このデータは、ニューロンおよび星状細胞の両方の広範な分化を示している。放射神経膠マーカー発現の均一性と組み合わせて、非クローン化LC1 NS細胞についての安定な分化能に関するデータは、FGFおよびEGFにおける接着培養が、幹細胞自己再生を好み、そして神経膠またはニューロンのいずれかの運命への方向付けを抑制することを示している。
【0102】
本発明者らは、ES細胞からの分化により得られたNS細胞が、5週間にわたって腫瘍の形成なく移植され得ること、したがって、マウス脳において4週以内に巨視的な奇形腫を生じたES細胞とは異なることを見出した。
【0103】
本発明はまた、核再プログラミング方法、ならびにこれらの方法によって得られる細胞および動物にも関する。
【0104】
核再プログラミングは、体細胞、必要に応じて幹細胞もしくは終末分化細胞の核が、比較的より高い潜在能の細胞の核として挙動するように再プログラミングされる技術である。最終的には、完全に再プログラミングされた核が、分化多能性細胞の核として作用し、そして再プログラミングは、しばしば分化多能性に対して様々に再プログラミングすることを意味する。核移入による再プログラミングの方法は、当該技術分野で十分に確立されており、WO96/07732に記載の発明(時に、「ドリー羊」発明といわれる)後に十分に公開されるようになった。したがって、核移入は、非ヒト動物をクローン化するために使用され得る。
【0105】
核移入方法は、多くの課題を有する。まず、それらは低効率のままであり、得られた細胞が、真に分化多能性であるように再プログラミングされるのはまれである。再プログラミングの一部として核で遺伝子操作を実施し得ることも所望され得る。しかし、現時点では、この操作は、ドナー核のクローン集団を得るのが困難であるため、可能ではないかまたは信頼性がない。クローン核を用いてさえも、再プログラミング方法は、多くの独立した工程を必要とする複雑な手順である。最後に、いくつかの種に由来するES細胞は、単離するのがなお困難である。再プログラミング技術の使用は、そのようなことが利用できかつ信頼性があれば、これらの種において分化多能性細胞への代替の経路を提供する。
【0106】
本発明のさらなる局面は、上記課題に対する代替のアプローチを提供すること、およびそれらへの解決を提供することを目的として有する。
【0107】
したがって、本発明は、核再プログラミングの方法を提供し、この方法では、ドナー核が本発明の神経幹細胞から得られる。
【0108】
本発明の神経核細胞は、高い効率で再プログラミング可能であることが見出されており、したがって、本発明は、効率的な再プログラミング方法を提供し、そしてまた、多くの種の遺伝子改変された再プログラミングされた細胞(特に分化多能性幹細胞)の作製を容易にする。本発明によって個々の神経幹細胞をクローン増殖できることとは、全てが同じ遺伝子改変を用いて、遺伝子操作後に細胞のクローン集団が得られ得、そして再プログラミング方法で使用され得ることを意味する。
【0109】
特定の細胞表面マーカーの存在および/または他のものの不在に従って神経幹細胞を同定することもまた可能である。このことは、神経幹細胞は、混合集団(例えば、脳ホモジネート)から直接採集され得るので、本明細書中に記載の本発明の局面に従って培養する工程が省かれ得るという利点を有する。
【0110】
したがって、核再プログラミングの方法が本明細書中に提供され、この方法では、ドナー核が、本発明の任意の実施態様または局面に従って得られた神経幹細胞に由来する。
【0111】
核再プログラミングの特定の方法は
ドナー細胞を得る工程;
レシピエント細胞を得る工程;
該ドナー細胞の核を該レシピエント細胞に移入する工程であって、該ドナー細胞が、(i)神経幹細胞、または(ii)本発明の方法に従って得られた細胞である、工程;および
該細胞を培養して該ドナー細胞の核を再プログラミングし、それによって再プログラミングされた細胞を得る工程
を含む。
【0112】
レシピエント細胞の核は、一般に、プロセス中の一段階で除去され、そのため得られる細胞は二倍体であり、これは、必要に応じて該ドナー細胞の核の移入前におよび必要に応じて該ドナー細胞の核の移入後になされる。
【0113】
本発明のNS細胞によって提供される関心のある可能性の1つは、遺伝的病変(例えば、悪性を誘導し得る)を導入することである。したがって、さらなる選択肢は、ドナー細胞核を遺伝子操作することである。これは、目的の変異または遺伝子を導入するために使用され得、例えば、アッセイまたは他の試験目的のために細胞または動物を生成し得、複数の細胞が全て同じ操作で得られる。操作の範囲は広範である。一例は、疾患原因遺伝子配列または推定疾患原因遺伝子配列をドナー細胞核に導入することであり、薬物スクリーニングに有用である。さらなる選択肢は、再プログラミングされた細胞から誘導された組織を含む動物を得、そして該組織を用いてアッセイを実施することである。細胞は、例えば卵母細胞への核転移によって、分化多能性に戻るように再プログラミングされることが好ましい。
【0114】
本発明の特定の実施態様では、所望の神経幹細胞における細胞表面マーカーの本発明からの知識を利用することにより、そうでなければ混合集団からの神経幹細胞の単離に必要とされる培養工程の省略が可能になる。1つのこのような再プログラミング方法は、細胞の混合集団を提供する工程、その細胞表面マーカープロフィールに基づいて該混合集団から神経幹細胞を単離する工程、および該単離された細胞の核をレシピエント細胞に移入する工程を含む。
【0115】
他の方法と同様に、単離された細胞は、レシピエント細胞へのその核の移入の前に遺伝子操作され得る。また、単離された細胞は、集団中の1つの細胞の核をレシピエント細胞に移入する前に細胞のクローン集団を得るために培養され得る。
【0116】
より詳細には、本発明の細胞の応用には、高スループット薬物スクリーニングがある。本発明の神経幹細胞とそれから得られるニューロン、神経膠などとの両方ともが、スクリーニングのために、例えば、細胞のいずれかの型で活性である因子を同定するために使用され得る。細胞または子孫は、脳内癌のモデルで使用され得る。細胞および子孫は、神経系(特に、CNS)の腫瘍から得られ得、そしてそれに由来する神経細胞およびそれらの子孫が、スクリーンにおいて使用され得る。スクリーンの性質は全てに対して明らかであると考えられるが、概要では、本発明の細胞またはそれらの分化した子孫を得る工程、試験因子の存在下で該細胞または子孫を培養する工程、および該細胞または子孫に関する該因子の効果を決定する工程を含む。特定のスクリーニング使用で、細胞が提供され、この細胞は、本発明の細胞または本発明によって得られる細胞であり、そしてEGFレセプターまたはさらなるEGFレセプターを発現するように改変されている。
【0117】
細胞は、スクリーンで使用される前に改変され得る。例えば、細胞は、遺伝子において変異を導入するように、または疾患(特に、神経細胞の疾患であり、パーキンソン病およびアルツハイマー病を含む)に関与していることが知られているもしくは関与の疑いのある遺伝子産物をコードする核酸を導入するように、遺伝子改変され得る。パーキン変異が導入され得る。アルツハイマー病に関与するタンパク質(例えば、APP)をコードする遺伝子が発現または変異され得、またはその発現を変更され得る。
【0118】
本発明の細胞は、細胞療法の細胞の供給源として有用である。それらは、患者からの幹細胞の供給源を提供し、これは、潜在的に核移入のための核の供給源であり得る。それらは、遺伝子療法(神経防御遺伝子療法を含む)の送達のために用いられ得る。一例の療法では、本発明の細胞は、神経膠細胞由来神経栄養因子(GDNF)を発現している。これらの細胞は、本発明に従いそして細胞を遺伝子操作することにより得られ得る。細胞は、損傷した神経回路の回復および/または脳機能の回復のために移植され得る。
【0119】
本発明の利点は、得られる細胞の純度にある。純粋な集団は、移植または培養において制御することがより容易であり、不均質な培養においては、より多くの細胞が神経膠運命に既に方向付けられているのでニューロンが得られる割合が低くなる。いくつかの療法は、ニューロンおよび星状細胞の両方を必要とする。他の療法は、神経膠細胞を必要とする(例えば、MSについては乏突起膠細胞、他の適用については星状細胞、遊走細胞)。
【0120】
非ヒト動物をクローン化する方法が本発明によって提供される。非ヒト動物をクローン化する1つの方法は、(i)該非ヒト動物から神経幹細胞を得る工程、(ii)該非ヒト動物と同じ種の卵母細胞を得る工程、(iii)該神経幹細胞の核を該卵母細胞に移入する工程、および(iv)(iii)で得られた細胞を該同じ種の雌に移植する工程を含む。したがって、本発明は、神経幹細胞の単離に基づく非ヒト動物クローニングの効率的な方法を提供する。このクローニング方法は、実質的に全ての非ヒト動物に対して適用できると考えられる。特に家畜動物(ウシ、ブタ、ヒツジ、ネコ、イヌ、ニワトリ、および他を含む)およびまた実験動物(マウスおよびラットを含む)に対してである。
【0121】
本発明により、初めて、ES細胞と同様に、二倍体のクローン原性のトランスフェクト可能な組織幹細胞の純粋な集団の増殖が可能になる。これは、種々の新規な実験機会を切り開く、幹細胞生物学において顕著な前進である。例えば、「神経幹細胞」のプロファイリングに関する以前の研究は、不均質な神経球培養(例えば、Suslovら)への信頼に大いに妥協している。さらに、NS細胞の放射神経膠特徴が、それらのインビボの対応物を定義している。放射神経膠の純粋な集団を培養および遺伝子操作できることはまた、幹細胞および特殊化された足場細胞の両方として機能し得る、これらの目立った細胞の細胞生物学を分析するための新規な機会を切り開く。最後に、異種細胞または細胞抽出物を含まない単純な培地でNS細胞を増殖できることは、自己再生が、増殖因子単独によって駆動され得、そしてこれまで幹細胞生物学者によって不可欠であると考えられていた複雑な微細環境ニッチを必要としないことを確立する。本発明は、細胞を用いる核再プログラミングおよび必要に応じた遺伝子操作への新規なアプローチを切り開く。
【0122】
本発明は、NS細胞からのニューロンの効率的な生成を提供する。本明細書中のプロトコルにより詳細に記載した方法において、ニューロンを得る方法は、(a)FGFレセプターのアゴニストの存在下でかつEGFレセプターのアゴニストの不在下で、神経幹細胞を培養する工程;および(b)その後、FGFレセプターのアゴニストの不在下でかつEGFレセプターのアゴニストの不在下で、該細胞を培養する工程を含む。例えばEGFが存在しない期間は、例えばFGFが実質的に除去された場合にニューロンになるように細胞を刺激することが見出されている。神経幹細胞は、好ましくは、単層培養で播種される。代表的には、NS細胞は、EGFを含まないがFGF−2を含む培地に移され、そしてある期間(言わば少なくとも2日間または少なくとも4日間)培養され、その後、FGF−2もまた培地から除去される(それを含まない培地に細胞が移されることを含む)。特定の方法では、細胞をEGFのないFGF−2中で1週間増殖させ、次いでFGF−2を除去する。FGFの除去により、培養中に幾らかの細胞死が生じるが、良好な割合が生存しニューロンを形成する。この方法は、NS細胞の誘導のために、本明細書中に記載の方法のいずれかへの必要に応じた追加として使用され得る。
【0123】
本発明の全ての局面の方法/使用は、インビボまたはインビトロのいずれかにて実施され得ることが理解される。
【0124】
本発明の方法および組成物は、添付の図面において図示される。
【0125】
図1は、ES細胞からの神経幹(NS)細胞の生成を示す;
図2は、NS細胞が種々のES細胞株および胎児前脳から誘導され得ることを示す;
図3は、NS細胞が成体脳内に取り込まれ分化することを示す;
図4は、ヒトES細胞または胎児由来NS細胞を示す;および
図5は、分化培地中で培養したNS細胞の電圧および電流クランプ条件下での電気活動を示す。
【0126】
より詳細に図面を参照して、図1は、ES細胞からの神経幹(NS)細胞の生成を示す:A.EGFおよびFGF−2中で増殖された接着NS細胞培養物(LC1)(a)は、ニューロン抗原(b)または星状細胞抗原(c)の発現を示さず、そして前駆体マーカーであるRC2(d)およびネスチン(示さず)の均一な発現を示している。LC1細胞は、血清の添加に際して免疫陽性星状細胞に分化し(e)、そして増殖因子の除去に際してニューロンを生成する(f〜h)。得られるニューロンの割合は、115継代後もなお総細胞の35%より多い(i)。B,クローンNS−5細胞は、Sox1神経系統選択によって生成された。aおよびcは、それぞれ1継代目および5継代目の神経前駆体の位相画像であり、bおよびdは、対応するSox1−GFP蛍光である。eは、Terasakiウェルへの播種1時間後の単一の細胞。fは、20継代目のクローン細胞株の位相差画像である。C,ES細胞および神経幹細胞/放射神経膠細胞マーカーについてのRT−PCR(46C、親ES株;P5、神経分化後5継代目;NS−5クローンNS株;LC1、NS集団(17継代目);脳、E12.5/E16.5マウス脳)。D,神経幹細胞/放射神経膠マーカーに対するNS−5免疫反応性。E,NS−5の星状細胞(a,b)およびニューロン(d,e)への分化とネスチン免疫反応性の喪失(c,f)。F,NS−5細胞のコロニー(a)は、増殖因子除去に際してニューロンを生成し(b)、そしてEGF/FGFの存在下で、RC2およびBLBPの均質な発現を保持し、GFAPに対する免疫反応性を喪失している(c,d)。G,NS−5の中期広がり(31継代目)。
【0127】
図2は、NS細胞が種々のES細胞株および胎児前脳から誘導され得ることを示す:NS細胞は、独立したES細胞株(CGR8、E14Tg2a)または一次皮質(Cor−1)および線条体(Str−1)組織から誘導した。A,幹細胞/放射神経膠マーカーのRT−PCR。B,転写調節因子についてのRT−PCR。C,ES由来株(CGR8−NS)および胎児由来株(Cor−1)は、形態学(a,f)および神経幹細胞/放射神経膠マーカー免疫反応性(b,c,g,h)ではLC1とは区別不能であり、各々はニューロン(d,i)および星状細胞(e,j)に分化し得る。
【0128】
図3は、NS細胞が成体脳内に取り込まれ分化することを示す:a〜h eGFPをレンチウイルス形質導入し、海馬(a,b)または線条体(c〜h)に移植4週間後のLC1 NS細胞の共焦点像。b,d,それぞれパネルaおよびcのより高い倍率の差込図。e,f,ニューロンマーカーTuJ(e,赤)またはMAP−2(f,赤)の共発現(黄)を示しているeGFP移植NS細胞(緑)の例。g,星状膠マーカーGFAP(赤)。h,神経前駆体マーカーネスチン(赤)。i,成体マウス線条体への移植の4週間後の移植片に由来するニューロン(MAP2)、星状膠(GFAP)、前駆体(ネスチン)、および増殖(Ki67)細胞の定量分析。データは、5匹の独立した動物由来の少なくとも500のeGFP+細胞の平均(±標準偏差)である。スケールバー:a,c,100μm;b,d,e,40μm;f〜h,20μm。
【0129】
図4は、ヒトES細胞または胎児由来NS細胞を示す。A,ヒトES細胞からの誘導。a,ヒトES一次培養物。b,神経ロゼット構造へのヒトES細胞の分化。c,NS増殖培地における9継代目。d,個々の細胞は放射神経膠形態を示す。e〜h,神経幹細胞/放射神経膠マーカーに対する免疫染色。B,ヒト胎児前脳からの誘導。i,皮質から生成した神経球。j,付着および成長。k,NS増殖培地における5継代目。l,放射神経膠形態。m〜p,神経幹細胞/放射神経膠マーカー。C,分化。q,TuJ陽性未熟ニューロン。r,GFAP陽性星状膠。
【0130】
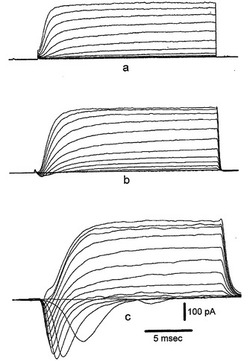
図5は、以下を示す:A.分化培地における6日(a)、12日(b)、および30日(c)間のインキュベーション後の3つの異なるNS細胞からの異なる膜電位(−90mVの保持電位から−70mVと+40mVとの間)で得られる内向きおよび外向きの重畳電流追跡。B.(A)において示される電流記録が得られた直後に電圧クランプから電流クランプに切り替えることによる、(A)と同じ3つの細胞(a,bおよびc)における脱分極矩形電流パルスの注入後に得られた重畳電圧応答。破線は、−60mVの電圧レベルを表している。C.ラベルにより示されるように時間が増加している間に分化培地で培養した細胞からの−20mVで誘発された平均Na+電流。バーは、SEを示している。D.10mM Ba2+中およびTTXの存在下の−40mVおよび0mVで誘発された内向きの重畳電流;保持電位は−90mVであった。E.(D)と同じ細胞からの電流/電圧関係。
【0131】
本発明は、以下の実施例を用いて実証される。
【実施例】
【0132】
(実施例1−1)
(NS細胞のバルク集団の単離および培養)
接着単層培養での50〜70%の間のSox1陽性神経前駆体の効率的かつ一貫した生成を可能にするES細胞分化プロトコルが、近年確立された。これらの培養物内の神経前駆体(マウス由来)を単離し増殖しそして特徴付けるために、Sox1遺伝子座にターゲティングしたGFP−IRES−ピューロマイシンレポーターカセットを含む以前に生成された細胞株(46C細胞)を使用した(Yingら, 2003b)。ピューロマイシンを7日後に分化培養物に添加し、そして3日以内に、残りの細胞の95%より多くがGFP+神経前駆体となった。この時点で、細胞を、(ピューロマイシンなしで)EGF/FGF−2を添加したN2B27培地に再播種した。これらの細胞は迅速に増殖し、数継代内で均質な形態をとった。
【0133】
これらの46C神経前駆細胞(46C−NP)は、20継代より多くの間培養物中で継続して維持され、特徴的な二極性の形態を保持していた。これらの培養物は、ほとんど細胞死を示さず、そして高い播種効率を有し、倍加時間は約25時間であった。
【0134】
(実施例1−2)
(細胞株の培養)
クローン細胞株を単離するために、46C−NP細胞の5継代目バルク培養物からの単一の細胞を、マイクロウェルプレートの別々のウェル中に播種した。スコア付けした95の単一の細胞のうち15がコロニーに増殖し、そしてこれらのうち4株が10継代より多くにわたって継続して増殖し続けた。1つの株(NP5)は、バルク集団で観察されたのと同一である均質な形態を有する特徴的な二極性の細胞を示した。このNP5株は、無期限に培養物中で維持された(NP5 41継代目;5ヶ月以上)。
【0135】
(実施例1−3)
(NS細胞の特徴づけ)
バルク細胞集団およびクローン株の両方ともを特徴付けるために、種々のマーカーについて免疫細胞化学を用いた。予期されるように、細胞株の各々は、神経前駆体マーカーであるネスチンもしくはビメンチンに対して陽性であることが判明した。重要なことに、これらの細胞はまた、放射神経膠特異的マーカーであるRC2、3CB2および星状細胞特異的グルタミン酸輸送因子(GLAST)に対しても陽性であった。細胞の1%未満がGFAPまたはβIIIチューブリンのいずれかに対して陽性であった。このことは、これらの細胞の継代の間に、星状細胞またはニューロンへの自発的分化がほとんど生じていないことを示唆している。霊長類/ヒト細胞とは異なり、げっ歯類放射神経膠は、GFAPに対して陰性である。さらに、これらの細胞は、成体神経幹細胞に対して富化するために以前に使用されたSSEA−1、ルイスX抗原を認識する抗体に対して免疫反応性である。
【0136】
種々のマーカーを用いてRT−PCRを実施し、放射神経膠としてのそれらの同一性を確認した。4つのクローン株の全てならびにバルク集団は、免疫細胞化学と一致して、Oct4またはNanogに対して陰性であり(このことは、それらがES細胞ではないことを確証している)、一方、それらは、ネスチン、ビメンチン、およびGLASTを発現していた。さらに、各細胞株は、BLBP、放射神経膠マーカーの発現を示した。これらの細胞はまた、ムサシ−1およびプロミニンも発現している。
【0137】
興味深いことに、46C−NPのバルク培養物は、GFPレポーターにより評価されるように、Sox1の発現を徐々に喪失し、5継代目まで(約2週間)に、ほとんどの細胞が緑色ではなくなった。また、Sox1駆動GFP発現を示したクローン株はなく、RT−PCRは、これらの細胞がSox1を発現せず、代わりに関連のSoxB1クラスのタンパク質であるSox2を発現していることを確証した。まとめると、これらの結果は、種々のSox1発現神経前駆体が、ピューロマイシン選択ストラテジーを用いて単離され得ること、および前脳放射神経膠の特性を有するSox1−,Sox2+細胞が、単離およびクローン増殖され得ることを示唆している。
【0138】
(実施例1−4)
(ニューロンおよび神経膠へのNS細胞株分化)
NS細胞株により発現された分子マーカーは、それらが神経前駆細胞の型であることを確証している。これらの細胞が真の多分化能性幹細胞である(すなわち、ニューロンまたは神経膠のいずれかとして分化し得る)ことを確認するために、細胞の潜在能を試験するために設計した種々の条件を試験した。
【0139】
神経前駆体の以前の研究は、マイトジェンの除去および/または血清もしくは他のサイトカインの添加を包含するプロトコルによって、分化を誘導した。本発明の場合では、EGF、FGF、または両方を、プラスチック上で培養した増殖中のNP5および46C−NP細胞から除去した。EGFおよびFGFの両方を同時に除去することにより、24時間以内に急速かつ広範囲の細胞死が生じた。比べて、FGF単独での培養は、3日間かかって細胞死に至った。EGF単独での培養では、細胞死も分化も生じなかったが、細胞増殖は減少した。したがって、明らかに、EGFは、プラスチック上で培養したNS細胞に対して必須の細胞生存シグナル(部分的にFGFシグナル伝達により補償される)として作用している。
【0140】
サイトカインの除去後の細胞の増殖に関する血清の効果もまた試験した。このようにして処理した細胞は、EGFの不在下でさえも生存し、そして同期様式で迅速に分化し、これにより細胞の100%が、GFAPに対して陽性およびネスチンに対して陰性に染色した大きな扁平の星状細胞を獲得した。したがって、増殖集団内の全てのNS細胞が、星状細胞として分化し得る。この効果は、プラスチック上のEGF/FGF除去後の血清の不在下でのBMP4の添加によって模倣され得る。CNTFおよびTGF−βは、星状細胞形態が異なりそしてより多くの細胞死が初期にあったが、BMP4と同様に挙動した。BMP、CNTFおよびLIFは各々、一次皮質前駆体から星状細胞運命を誘導することが示されている(Grossら, 1996; LillienおよびRaff, 1990; Nakashimaら, 1999)。これらの研究と一致して、BMP−4または血清処理でのId遺伝子(>30倍)の迅速な誘導が見られた(データは示さず)。
【0141】
ニューロン分化を誘導しようとして、ラミニン処理ディッシュでのEGFの除去を試験した。プラスチック上での細胞の培養で見られた細胞死を回避するために、細胞を、FGFを含むがEGFを含まないラミニン基材上に播種した。プラスチックまたはゼラチン上でのこれらの条件で見られたPCDは生じておらず、細胞は生存していた。細胞の形態が、より拡張された二極性の突起に変化しており、これは、放射神経膠の特徴的なエンドフィートを有する。これらの細胞は、(BrdU取り込みによって)増殖において激烈な減少を示したが、放射神経膠マーカー(RC2、ビメンチン、ネスチン)を維持しており、分化しておらず、ほんの少ない割合のニューロンまたは星状細胞のみが高密度の領域で見られた。ニューロン分化を誘導するために、6日後、培地をNSA/N2 +FGF2からNSA/B27(FGF2なし)に変更した。このことにより、MAP2およびβIIIチューブリン抗体染色により判断されるように約40〜60%の細胞のニューロン分化が促進された。これらのニューロンは、GABA免疫反応性によって評価されるようにGABA原性(GABAergic)であったが、星状細胞(GFAP)はほとんど存在しなかった。これらの結果は、ニューロン分化の妨害におけるFGFの以前に記載された役割と一致している。
【0142】
各細胞株が、ES細胞と同様に首尾よく凍結されそして融解され得ることもまた見出された。
【0143】
さらなる試験において、単一の細胞から始まる分化を試みた。このクローン発現および分化は、細胞の全てがニューロンを形成する能力を有することを示した。
【0144】
(実施例1−5)
(遺伝子選抜ストラテジーを用いない任意のES細胞株からのNS細胞の単離)
NP5を単離するために用いられるN2B27培地は、ES細胞の神経前駆体への変換に対してもともと最適化されており、このため、ES細胞および神経前駆体の両方の良好な生存が可能になった。したがって、ピューロマイシン選択がなければ、ES細胞および非神経細胞型のキャリーオーバーのために、EGFおよびFGF−2を用いて46C−NP細胞を効率的に増殖することができなかった(データは示さず)。これを克服しそして他のターゲティングされないES株からの放射神経膠細胞の生成を可能にするために、神経前駆体を生存および増殖させるが他の細胞型はそうではない他の基本培地の組合せを試験した。
【0145】
市販の培地であるNS−A培地(Euroclone)を用いて、7日目での46C ES細胞単層分化の再播種が、細胞の塊/球の形成ならびに非神経細胞の細胞死を生じることが分かった。引き続いて、これらの細胞塊の付着が生じ、そして細胞の均質な集団が大きくなった。この継代可能な細胞集団(>75継代)のさらなる特徴づけにより、ピューロマイシン選択ストラテジーを用いて以前に見られた発現されたマーカーの同一のプロフィールが明らかになった。したがって、細胞は神経前駆体マーカー(ネスチン、ビメンチン)に対して陽性であり、また放射神経膠マーカー(RC2、GLAST、BLBPおよびPax6)に対しても陽性であった。46C−NP細胞は、形態においてほんのわずかな差異を有しそしてマーカー遺伝子の差異がないことがかつて確立されているN2B27またはNSA培地のいずれにおいても、同様に挙動した。
【0146】
このプロトコルを用いて、6つの他のES株からの細胞株を単離した:CGR8、E14T、Oct4−GIP、S11、R1およびV6.5。これらの細胞株の各々は、同様の形態および発現プロフィールを有し、そして広範に継代され得る。
【0147】
(実施例1−6)
(NS細胞の移植)
インビボでNS細胞の能力を試験するために、それらを、胚性および成体CNSの両方へ、ならびに腎臓嚢移植片に移植した。
【0148】
エレクトロポレーションをNP5において試験した。それらは、矩形波エレクトロポレーターを用いて効率的にエレクトロポレートされることが見出された。細胞はまた、リポフェクタミン添加試薬を用いてトランスフェクト可能である。これは、マウスに用いられる全ての遺伝子操作が利用可能になるので、大きな利点である。
【0149】
移植した細胞の迅速な評価を可能にするために、eGFPマーカー遺伝子を保有するレンチウイルス粒子で46C−NPを形質導入した。感染は非常に効率的であり、細胞のほぼ95%が首尾よくマーキングされ、eGFPシグナルは継代と共に強くかつ安定であった。レンチウイルス感染の使用により、トランスジーンは安定に組み込まれ、そしてシグナルは、移植した細胞の長期分析に安定なままとなった。
【0150】
胚性脳(未熟神経細胞を持続しそして分化を方向付けることが可能な分子および因子の全てを含む環境)での移植後の細胞の挙動を評価した。E14.5マウス胚をレシピエントとして用い、Magrassiおよび共同研究者(Magrassiら, Development 1999)によって以前に記載された手順に従って、100,000個の細胞を2μLの最終容量中に再懸濁した。細胞は、移植後良好に生存し(概算により、移植片中で約20000個の細胞であった)、eGFPシグナルは、容易に検出可能であり、そしてそれらは、移植後に初期の時点で既に遊走活動を提示した。移植後の種々の時点(4日、7日、2週間、および1ヶ月)で移植した細胞が獲得した運命を分析した。4日目および1週間の時点で、細胞の大部分は、ネスチン免疫反応性によって示されるようになお未熟であったが、23%は、ニューロンマーカーTuj−1を発現し、そして16.3%は、神経膠マーカーGFAPを獲得していた。これらのデータは、移植したNSが、多分化能性NS細胞から予期されるように、インビボでニューロンおよび神経膠の両方を生成し得ることを示している。
【0151】
NS細胞を、成体線条体にも移植した。これらの移植体では、細胞は良好に生存し(いずれにせよ生存は、胚性移植片におけるよりも低い)、そしてニューロンおよび神経膠の両運命の方向に分化した。移植後2週間目に実施した定量分析は、細胞の43.3%がニューロン特異的マーカーTuj−1を発現し、一方、26.6%が神経膠マーカーGFAPに対して免疫反応性を提示したことを示した。少ない割合の細胞(11.1%)が、ネスチンの発現により示されるように未熟な表現型を保持していた。
【0152】
腎臓嚢へのNP5−GFP細胞は、奇形腫を生じなかった(n=4、データは示さず)。
【0153】
(実施例2)
(実施例2−1)
(方法)
(マウス細胞の培養および分化)
ES細胞および神経分化は、YingおよびSmith, 2003によって詳述されている。LC1と命名したNS細胞および他のES細胞由来NS細胞を、N2および10ng/mlのEGFおよびFGF−2の両方を添加したNS−A培地(Euroclone)(NS増殖培地)においてコーティングされていないプラスチック上で7日目の神経分化単層培養物を再播種することにより、通常通りに生成した。細胞は凝集体を形成し、引き続いて付着しそしてNS細胞を大きくした。7日目に0.5μg/mlのピューロマイシンを分化接着培養物に添加した後に生成された細胞を、46C−NS細胞と命名した。3日後に、細胞を、ピューロマイシンのない10ng/mLのEGFおよびFGF−2(Peprotech)の両方を含むN2B27培地において、コーティングされていないT75フラスコ中に再播種した。クローン株NS−5を、限定希釈によって96ウェルマイクロウェルプレート(Nunc)中に単一の細胞を播種することにより生成した(播種1時間後に単一の細胞をスコア付けした)。一次培養物を、E16.5マウス胚の皮質/線条体から標準プロトコルを用いて生成し、そして0.1%ゼラチンで処理したフラスコ上に付着させた。次いで、Cor−1およびStr−1細胞を、NS増殖培地を用いてゼラチン上で増殖させた。星状細胞分化のために、NS細胞を、1%ウシ胎児血清または10ng/ml BMP4(R&D System)を添加したNS−A培地中に1×105細胞/ウェルで、4ウェルプレート上に再播種した。ニューロン分化のために、5×104NS細胞を、FGF−2単独を添加したNS−Aにおいてポリオルニチン/ラミニン処理ウェル中に播種した。7日後、培地を、増殖因子を含まないB27(Gibco)を添加したNS−Aに切り替えた。クローン分化のために、NS−5またはCor−1培養物からの1000細胞を、ラミニンで前処理した10cmプレートに播種し、EGF/FGF−2中で12日間増殖させ、そして上記のようにインサイチュで分化させた。
【0154】
(NS細胞の特徴づけ)
免疫細胞化学を、適切なTRITCまたはFITC二次結合体とDAPIでの核対比染色とを用いて実施した。以下の希釈で一次抗体を用いた:ネスチン(1:10)、ビメンチン(1:50)、Pax6(1:5)、3CB2(1:20)、RC2(1:50)(DSHB);TuJ(1:200)(Covance);GFAP(1:300)(ポリおよびモノ、Sigma)、MAP2(1:200)(ChemiconおよびBecton Dickinson);NeuN(1:200)、GABA(1:200)、Gad65/67(1:200)(Chemicon);シナプトフィシン(1:200)(Sigma);Olig2(1:5000)(H. Takebayashi);Emx2(1:2000)(A. Corte);BLBP(1:500)(N. Heintz);プロミニン/mAb13A4(1:200)(W. Huttner)。陰性コントロールはES細胞、分化したNS細胞または二次単独であった。RT−PCRのために、全RNAをRNeasyキット(Qiagen)を用いて抽出し、そしてcDNAをSuperscript II(Invitrogen)を用いて生成した。β−アクチン(25サイクル)を除いて、全てのマーカーについてPCRを30サイクル実施した。中期広がりのために、細胞を5mlの0.56% KClで20分間処理し、氷上でメタノール:酢酸(3:1)中に15分間固定し、スライドガラス上に広げ、そしてTOPRO−3(Molecular probes)で染色した。
【0155】
(ヒト胚および胎児培養物)
インフォームドコンセントのもとでのヒト組織に関する研究は、Research Ethics Committee of Lothian Health Boardによって認可された。凍結した余剰のヒト胚が、Human Fertilisation and Embryology Authorityにより発行されたライセンスR0132下での研究のために贈与された。Polkinghorneガイドライン下の研究のために同意のもとに選択中絶したカーネギー19/20期の胎児からヒト皮質を切り出した。
【0156】
(移植)
Magrassiら, 1998に記載により胎児手術を実施した。ガラスキャピラリーを用いて、1μLのHBSSの容量中に5×104個の細胞を、透照下で曝露したE14.5 Sprague Dawleyラット胎児の終脳小胞に注入した。注入された胎児を、満期まで発生のために腹腔内に戻した。分娩後、移植後7日目(出生後日数(P)1、n=16)および5週目(P30、n=8)で動物を屠殺した。成体移植のために、129またはCD1マウスをKopf定位枠内に置き、そして5μLのHBSS中に懸濁した2×105個のNS細胞を線条体(n=22)または海馬(n=21)に注入した。移植されたマウスを2週後(n=16)および4週後(n=10)に屠殺し、そして4%パラホルムアルデヒドを経心臓にて灌流した。低温切片(16μm)を以下の抗体で染色した:(マウス):NeuN(1:100)およびKi67(1:10)(Chemicon)、MAP2(1:200;Becton Dickinson)、ネスチン(1:5;Ron McKay);(ウサギ):βIIIチューブリン(1:500;Covance);GFAP(1:200;Dako);二次抗体、Texas Red(Vector)(Jackson ImmunoResearch)およびAlexaFluor 488(Molecular Probes)。切片を変退色防止溶液中で保存し、そしてNikon TE2000-S ECLIPSEおよびBiorad Radiance 2100共焦点顕微鏡で分析した。
【0157】
(実施例2−2)
本発明者らは、ES細胞の単層分化を7日間誘導し、次いでEGFおよびFGF−2を添加した基本培地(NS−A+N2)に再播種した。これらの最少条件(ES細胞生存に対して非許容)下で生存している細胞が主として結合して浮遊塊となる。3〜5日後、これらの凝集体を採取し、そして新鮮な培地に再播種した。それらは、2〜3日以内に付着し、そして二極細胞の形態的に均質な集団に大きくなった(LC1と命名)。継代に際して、LC1細胞は、接着培養物として増殖し続け、しばしば、格子状網を形成した。それらは、連続的かつ迅速に増殖され得、倍加時間は約24時間である。LC1細胞は、神経前駆マーカーのネスチンおよびRC2を提示するが、星状細胞分化マーカーのGFAPまたはニューロン抗原の発現は無視し得る程度である(図1A)。血清またはBMPへの曝露に際して、LC1細胞は、48時間以内に代表的な星状細胞形態をとり、そして引き続き、GFAPを均一に発現する(図1A,e)。対照的に、ニューロン突起を有する細胞は、EGFなしで5〜7日間ラミニン上に再播種しそしてFGF−2を除去した後に出現する。これらの細胞は、ニューロンマーカーのIII型β−チューブリン、MAP2(図1A,f,g)およびneuN(示さず)を発現している。ほとんどのニューロンは、GAD67(図1A,g)およびGABA(示さず)に対して染色し、そして7日目まで、亜集団が、成熟マーカーのシナプトフィシンの発現を示す(図1A,h)。115継代後でさえも、多数のニューロン(>35%)が生成される(図1A,i)。LC1細胞が後期継代で二倍体染色体内容物を保持しているという所見(示さず)とともに、このことは、自己再生神経幹(NS)細胞の存在を確証している。
【0158】
(実施例2−3)
細胞凝集がNS細胞の生成に必須であるか否かを決定するために、本発明者らは、誘導プロセスを通して細胞付着を維持した。このために、本発明者らは、GFPirespacレポーター/選択カセットがSox1遺伝子(神経分化の特異的マーカー(Aubertら, 2003)である)に組み込まれている46C ES細胞を用いる系統選択(Liら, 1998)を利用した。分化誘導後の一過性のピューロマイシン選択により、残余ES細胞のない神経前駆体の精製された集団を得た(Stavridisら, 2003)(図1B a,b)。次いで、FGF−2およびEGFを、富化培地中でSox1発現神経前駆体に与えた。この条件で細胞は接着したままであった。細胞異質性は3〜4継代にわたって減少した。二極細胞の数が累進的に増大し、広範囲に格子を形成し始めたからである。興味深いことに、Sox1の発現はこの段階で喪失したが(図1B c,d)、細胞は、Sox2およびネスチンに対してなお陽性であった。神経幹(NS)細胞の存在を確立するために、単一の細胞をTerasakiウェルに単離し、そして接着培養として増殖させた(図1B,e,f)。まず、同様の形態および増殖特性の5つのクローン株を、バルクLC1集団に誘導した。これらの細胞は、分化多能性因子のOct4およびNanog、ならびにまた初期神経マーカーのSox1の検出可能な発現を欠いていたが、汎神経上皮マーカーのSox2およびネスチンを保持していた(図1C)。したがって、NS細胞は、連続接着培養によってSox1陽性初期神経外胚葉前駆体から生成された。
【0159】
(実施例2−4)
クローンNS−5をさらに詳細に試験し、そしてPax6、Glast、およびBLBPのmRNAを発現していること、および、RC2、ビメンチン、3CB2、SSEA1/Lex1、およびプロミニンに対して免疫陽性であることを見出した(図1D)。このマーカーセットは、神経原性放射神経膠に対する診断に有用であるとみなされており、神経系の発生の間のニューロンおよび星状細胞の両方の前駆体である(Campbellら, 2002; Hartfussら, 2001)。クローン化されていないLC1細胞と同様に、NS−5細胞は、星状細胞およびニューロン分化に対してコンピテントであった(図1E)。EGF+FGF−2にクローン密度で播種したNS−5細胞は、二極細胞のコロニーを生じた。全てのコロニーが、事実上全ての細胞でのRC2およびBLBPの発現、ならびにGFAPの不在を示した(図1F,c,d)。これらのサブクローンを選抜し、そして連続して増殖させた。NS培養内でのニューロン分化可能な細胞の頻度を決定するために、本発明者らは、再度、NS−5細胞をクローン密度で播種し、EGF/FGF−2中で12日間、次いでFGF−2単独で5日間、次いでさらに7日間増殖因子なしで増殖させた。全てのコロニー(126/126)が、TuJ陽性細胞を生成した(図1F,b)。これらのデータは、NS培養物中の全てのコロニー形成細胞が、ニューロン分化に対してコンピテントであったことを示した。最終的に、LC1と同様に、NS−5細胞は、二倍体染色体相補体を維持しており(図1G)、そして複雑な細胞微細環境の必要なく自己再生する非形質転換クローン神経幹(NS)細胞株であることを表していた。
【0160】
(実施例2−5)
無血清単層誘導プロトコルがNS細胞生成に予め必要であるか否かを評価するために、ES細胞を、胚様体形成および血清含有培地中のレチン酸への曝露によって分化を誘導した(Bainら, 1995)。凝集体を、G418を用いるSox2系統選択(Liら, 1998; Billonら, 2002)に48時間供し、次いで血清なしでFGF−2およびEGFの存在下で再播種した。付着した後、Sox2陽性、ネスチン陽性の細胞が増殖した。これらの細胞は、NS細胞に代表的な二極性の形態および格子状の増殖を提示し、さらに多重継代後に星状細胞およびニューロン分化能を有した(データは示さず)。このように、NS細胞が、胚様体から誘導された。
【0161】
(実施例2−6)
3つの独立したES細胞単離株E14TG2a、CGR8、およびR1から、LC1について記載したような系統選択を行わずに単層誘導を用いてNS細胞を誘導した。試験したNS株は全てが、細胞の少なくとも95%においてネスチンおよびRC2を発現した。CGR8およびE14TG2a由来NS細胞のより詳細な研究により、フルパネルの放射神経膠マーカー(図2A)、神経前駆体マーカーSox2およびSox3、ならびにbHLH転写因子Olig2およびMash1(図2B)を示した。Sox1がダウンレギュレートされたがSox2は維持されたことは、これらの転写因子の推定の決定的機能(Pevnyら, 1998)を考慮して、これらのNS細胞の顕著な特徴であった。このように、Sox1は、全ての神経外胚葉前駆体をマークしているが、Sox2が重要な役割を果たしていると考えられる幹細胞においては、これは保持されなかった。NS細胞はまた、Emx2を発現していた。Emx2は、神経前駆細胞の増殖に関与している(Heinら, 2001; Galliら, 2002)。試験した全てのNS培養物は、形態学および免疫染色の両方によって評価される星状細胞およびニューロンの分化を受けた(図2C)。
【0162】
(実施例2−7)
それらの放射神経膠への明らかな関係を考慮して、本発明者らは、NS細胞が、エクスビボ増殖へのES細胞の前適応から生じるか、または胎児神経組織から誘導され得るかを調べた。E16.5胎児脳からの一次胎児CNS細胞は、増殖因子を添加した基本培地ではプラスチックへの接着はわずかであり、自発的に凝集体を形成した。6〜7日後、これらの凝集体は、ゼラチンコーティングしたプラスチック上に定着した。14日後、成長体をトリプシン処理し、そしてゼラチンコーティングしたプラスチック上に播種した。3つの別個の実験において、NS細胞と形態学的に同定可能な細胞が増殖し、そして引き続き増殖させて、連続細胞株になった。これらの胎児脳誘導物は、ES細胞由来NS細胞と同じ放射神経膠および神経原性マーカーを発現し(図2A、B)、そして一致したmRNAプロフィールを示した。それらは、同様に、星状細胞およびニューロン分化に対してコンピテントであった(図2C)。NS−5について記載したように、皮質誘導Cor−1細胞を単一の細胞として播種し、次いでコロニーを引き続く増殖因子除去に供した。全てのコロニーが、TuJ陽性ニューロンを生成していた。このことは、Cor1培養物中の全てのクローン原性細胞が神経原性であることを示していた。Cor−1細胞もまた、個々の細胞から容易にサブクローン化されそして連続的に増殖された。これは、自己再生を示す。このように、NS細胞が胎児脳から誘導され、そしてこれは、ES細胞由来NS細胞の重要な特性を共有していた。
【0163】
ほとんどのNS細胞は、放射神経膠であると認められる、伸長した二極性の形態、平板状の伸長部、エンドフィートおよび卵形の核(Rakic, 2003)を有していた。短い伸長部を有する扁平状の緻密な細胞もまた存在していた。中期マーカーであるリン酸化ヒストンH3に対する免疫染色により、緻密な細胞は、有系分裂しているものであることが示された。時間差ビデオ顕微鏡により、細胞分裂前に形態が活発に変化していることが確認された。さらに、この時間差により、NS細胞が、運動間の核移動を受けていることが明らかになった。これは、インビボでの神経上皮および放射神経膠細胞の十分に特徴付けられた特徴である。
【0164】
したがって、NS細胞は、神経原性放射神経膠の連続的に増殖可能なインビトロアナログであった。
【0165】
(実施例2−8)
凍結/融解した40継代目のマウス神経球を、NS増殖培地中でゼラチンコーティングしたプラスチックに付着させた。NS細胞と区別不能な二極細胞が生じた。これらの細胞は、均一なRC2陽性GFAP陰性の集団として連続的に増殖され得、次いで星状細胞またはニューロンへの分化が誘導され得る。
【0166】
(実施例2−9)
本発明者らは、マウス脳への移植の際のNS細胞の挙動を調べた。レンチウイルスeGFP発現ベクターを用いて形質導入したES細胞由来LC1細胞を、E14.5での子宮内注入により発生中の脳に導入した(Magrassiら, 1998)。出生後、動物を屠殺し、そして脳切片のeGFP陽性細胞の存在を調べた。NS細胞子孫は、種々の脳領域に遊走していた。免疫組織化学分析により、eGFPと、前駆体マーカーネスチン、ニューロンマーカーTuJ、NeuN、およびMAP2と、ならびに数は少なくなるがGFAPとが共発現していることが明らかになった。NS細胞を成体マウス線条体にも注入した。この場合、GFP陽性細胞は、注入部位の近辺に局在したままであった。移植4週間後、GFP発現細胞の44.4±5.7%がニューロン形態を有しそしてMAP2に対して免疫陽性であり、37.4±6.1%がGFAPを発現し、そして4.2±1.9%がネスチンの発現を保持していた(図3)。増殖マーカーKi67は、GFP陽性細胞の1.0±0.6%でのみ検出された。このことは、NS細胞がインビボで細胞周期から回収されたことを示している。このことと一致して、本発明者らは、移植の1ヵ月後に調べた全部で35の脳において、制御されない増殖または腫瘍形成の組織学的証拠がないことを認めた。さらに、マウス腎臓嚢に移植されたNS細胞は、増殖せず、奇形腫も生じなかった。これらのデータは、NS細胞が胎児脳および成体脳の両環境において生存しそして分化し得ること、およびES細胞(Brustleら, 1997)とは異なり、それらは奇形腫を生じないことを示していた。さらに、この比較的高い頻度でのニューロン分化は、継代した神経球の移植片(Rossiら, 2002)とは非常に対照的である。
【0167】
(実施例2−10)
最後に、本発明者らは、同様のNS細胞が、ヒト供給源から単離され得るか否かを調べた。贈与された余剰胚からヒトES細胞を誘導する過程において、本発明者らは、培養5〜6週後に、神経上皮細胞に代表的であるロゼット状構造への広範な分化を認めた。これらの細胞をNS増殖培地に移した。さらに3〜4週後、NS細胞に類似の二極細胞がこれらの培養物から出現し(図4A)、そして5ヶ月間連続的に培養した。本発明者らはまた、選択中絶からカーネギー19〜20期のヒト胎児皮質組織を確保した。解離した細胞はまず浮遊凝集体を形成した。マウス胎児脳からのNS細胞の誘導と同様に、その7日後に再播種し、そしてゼラチンコーティングしたプラスチックに付着させた。増殖している培養物が樹立された(図4B)。ES細胞および胎児組織の両方からのヒトNS培養物は、二極細胞が付随した扁平状の細胞の存在によって特徴付けられた。しかし、全ての細胞が、未熟前駆体マーカーであるネスチン、ビメンチン、および3CB2を発現していた(図4B)。時間差モニタリングによって、2つの細胞形態が形成されかつこれらは互換性であることが確証された。これらのヒト細胞はまた、低レベルのGFAPを提示し、これは、放射神経膠中のヒトGFAPプロモーターの活性(Rakic, 2003; Malatestaら, 2000)と一致した。それらは、マウス細胞よりもゆっくりと増殖した。倍加時間は数日間であった。EGFおよびFGF−2を引き続き除去した後、それらは、未熟なニューロン細胞を生成しているようであった(図4C)。強いGFAP免疫反応性を有する代表的な星状細胞形態の細胞が、血清中の継代後に生成された(図4C)。
【0168】
(実施例3)
特定の処理後、これらの細胞が、成熟した機能的なニューロンに効率的に転換し得るか否かを電気生理学的観点から知るために、インビトロでの分化の間、培養物におけるNS細胞の電気生理学特性を、パッチクランプ技術のホールセル改変型を用いることにより調べた。
【0169】
(電気生理学記録用溶液)
電極と細胞との間のシールを、以下からなるバス溶液中で確立した(ミリモル/lで表す):155 NaCl、1.0 CaCl2、1 MgCl2、3.0 KCl、10 グルコース、10 HEPES/NaOH(pH7.4)。ホールセルコンフィギュレーションを確立した後、電流クランプ記録および電圧クランプ中の総電流記録のために、ピペット充填溶液は以下を含んだ(ミリモル/lで表す):128 KCl、10 NaCl、11 EGTA、4 Mg−ATP、10 HEPES/KOH(pH7.4)。電圧クランプ条件下での電圧ゲートNa+チャネルの研究のために、パッチピペットを以下で満たした(ミリモル/lで表す):130 CsCl、10 NaCl、20 TEA−Cl、10 EGTA、2 MgCl2、4 Mg−ATP、10 HEPES/CsOH(pH7.4)。そして細胞外溶液は以下を含んだ(ミリモル/lで表す):130 NaCl、2 CaC12、2 MgCl2、10 グルコース、5 テトラエチルアンモニウム−Cl、CdCl2 0.2、10 HEPES/NaOH(pH7.4)。電圧ゲートCa2+チャネルの研究のために、パッチピペットを以下で満たした(ミリモル/lで表す):120 CsCl、20 TEA−Cl、10 EGTA、2 MgCl2、4 Mg−ATP、10 HEPES/CsOH(pH7.4)。そして細胞外溶液は以下を含んだ(ミリモル/lで表す):130 NaCl、10 BaCl2、10 グルコース、5 テトラエチルアンモニウム−Cl、10 4−AP 1、TTX 10−3、HEPES/NaOH(pH7.4)。
【0170】
(パッチクランプ記録)
イオン電流を、Axopatch 200Bパッチクランプ増幅器(Axon Instruments Inc., Burlingame, CA)によって室温(20〜24℃)でパッチクランプホールセル配置(19)を用いて電圧クランプ条件下で記録し、そしてIBM互換PCとインターフェースしたDigidata 1322A A/D変換器(Axon Instruments Inc., Burlingame, CA)を用いて、26〜100μsecのサンプリング間隔でデジタル化した。刺激、データの取得、およびデータ分析は、以下のソフトウェアパッケージを用いて実施した:pClamp 9(Axon Instruments Inc., Burlingame, CA)およびORIGIN 6(Microcal Software Inc., Northampton, MA)。電圧クランプ実験のために、まず、漏洩および容量の電流の線形成分をアナログサーキットリによって減少させ、次いでP/N法でほぼ完全にキャンセルした。パッチピペットをホウケイ酸ガラス管から作製し、火入れした。ピペットは、内部溶液で満たしたときに3〜4MΩの最終抵抗を有していた。電流は5KHzでフィルタリングした。
【0171】
図5Aは、内向き(Na+)および外向き(K+)の両電圧ゲートイオン電流の分離に適したバスおよびピペット充填溶液を用いた、インビトロ分化の異なる段階での3つのNS細胞(それぞれ分化培地中で6日、20日、および30日間培養)における脱分極試験電位に対するホールセル電圧クランプ工程の間に得られた電流記録を示す。電流追跡の簡単な観察から、相当に大きな外向きの電圧ゲート電流がインビトロ分化の初期段階で既に存在していることが明らかである(6日、トレースa)。この電流は、5mMテトラエチルアンモニウム−Clを含む細胞外生理食塩水の適用によってブロックされ、遅延整流K+電流の特徴を有する。その振幅は、分化の後期段階でわずかにのみ増大した(20〜30日、それぞれトレースbおよびc)。対照的に、内向き電流の振幅は、6日後では無視し得る程度であるが、分化培地への曝露時間の増加によって劇的に増大している。図5Bは、図5Aに示した同じ細胞における電圧クランプから電流クランプモードへの切り替え後に、約−80mVの保持電位からの70〜300pAの間の矩形脱分極電流刺激の細胞内注入後に誘発された電圧応答を示す。確かに、電圧ゲート内向き電流の振幅の増大は、分化している細胞が活動電位を誘発する能力を反映している。実際、6日間のみ分化剤に曝露されて無視し得る程度の内向きを示している細胞は、再生電圧応答を誘発することができなかった(図5Bに(a)で示したトレース)。対照的に、比較的速い脱分極速度を有するオーバーシュート作用電位が、30日間分化培地で培養され(図5Bに(c)で示したトレース)そして大きな内向き電流を提示する(図Aのトレースc)細胞において誘発され得た。中間型の状況(不全活動電位を有する)が、分化剤で20日間処理され(図5Bに(b)で示したトレース)そして中位の内向き電流を提示している(図Aのトレースb)細胞で見られた。この予備分析から、これらの細胞の興奮特性が、内向き電圧ゲートコンダクタンスの大きさに対して厳密に相関していることが分かる。分化培地への曝露時間の関数としてのこのコンダクタンスの定量分析のために、内向き電流は、分化の異なる段階の細胞を用いそして電圧ゲートNa+チャネルの活動の研究に特異的な細胞内および細胞外生理食塩水を適用して、誘発される(方法を参照のこと)。細胞分化の任意の時間で、速い不活性化内向き電流は、選択的Naチャネルブロッカーであるテトロドトキシン(1μM)によって完全にブロックされ、そして−20〜−10mVの間の試験電位でピークとなった。これは、ニューロンにおける電圧ゲートNa+電流の代表的な特徴を示している(データは示さず)。図5Cには、分化培地への曝露時間の関数として−20mVでのNa+電流振幅の発生が示される。興味深いことに、Na+コンダクタンスの増大は、分化培地への細胞曝露の増大と十分に相関している。確かに、平均して、Na+電流振幅は処理30日以内で約10倍増大している(最初の5日間の55±14pA(n=17)から25日より長い間の−434±135pA(n=13)へ)。同じように、電流クランプ条件下のNa+電流により誘発された再生電位(閾値とピーク値との間で測定されたΔV)は、インビトロ分化の最初の15日間(n=6)は0から+20mVの間であったが、処理が25日より長ければ、+30から+70mVの間の値に達した(n=6)。全体では、分化培地で25日より長く処理されたNS細胞で見られた興奮特性および原電圧ゲートNa+コンダクタンスの特性は、それらの成体表現型に発達しているニューロンに代表的である。以前の結論を立証する別の特徴は、少なくとも7日間またはそれより長く分化培地に曝露した後に試験した細胞のほとんどにおける電圧ゲートCa2+チャネルコンダクタンスの存在である。図5Dは、10mM Ba2+のバス中に入れた同じ細胞からの示した試験電位に対する膜脱分極により得られるサンプル追跡を示す。−40mVで誘発された速い活性化およびやや速い不活性化(Δh=21ms)電流成分は、ニューロンLVA Ca2+チャネル電流(CarboneおよびLux, 1987)を暗示している。対照的に、0mVで誘発されたBa2+電流は、ゆっくりとした(Δh=73ms)不完全な不活性化を提示し、ニューロンHVA Ca2+チャネル電流の代表的な特徴を有する。この細胞における2つの別個(LVAおよびHVA)のCa2+チャネルコンダクタンスの存在は、図5Eの電流−電圧関係によって確証される。平均して、LVA電流は−40mVでピークであるが、HVA電流についてI/V関係は0mVでピークであった。HVA Ba2+電流は、27細胞のうち19で検出可能であったが、LVA電流成分は、HVA Ca2+電流を既に発現している細胞の60%で測定された(n=13)。
【0172】
このデータは、本発明の神経幹細胞から生成されたニューロンが機能し得ることを示している:それらは、活動電位を刺激し得、これは、活性ニューロンの顕著な特徴である。
【0173】
したがって、本発明にしたがって、本発明者らは、所定のNS細胞をES細胞および胎児脳抽出物の分化した子孫として誘導しそして均質に増殖した。NS細胞は、簡単な接着単層培養でクローン増殖し、そして二倍体を維持した。増殖の延長後、それらは、インビトロおよび成体脳への移植の両方で、ニューロンおよび星状細胞に効率的に分化した。NS細胞はまた、インビトロで乏突起膠細胞も形成した。NS細胞は、放射神経膠の形態および分子特徴、ニューロンおよび星状細胞の胎児前駆体、を均一に発現していた。本発明者らは、マウスおよびヒトの両方の胎児脳から接着NS細胞株を樹立できた。
【0174】
(実施例6)
以下のプロトコルを用いて、NS細胞を、マウスES細胞および胎児皮質から得た。誘導されたNS細胞は、放射神経膠マーカーを均一に発現していた。CGR8 ES細胞またはE16胎児皮質(内部参照:Cor−1およびクローン誘導体Cor−1.3)から特異的に誘導されたNS細胞を、免疫化学により指示マーカーの発現について分析した。ハイパワーでの試験は、放射神経膠マーカーが、ほとんど全ての細胞において各々発現されており、一方、均一にGFAPに対して陰性であったことを示した。
【0175】
(実施例7)
以下のプロトコルを用いて、NS細胞を、増殖させたマウス胎児前脳神経球から誘導した。長期胎児神経球培養物(40継代)由来のNS株は、ES由来NS株と同一の形態を示し、神経前駆細胞/放射神経膠マーカー免疫反応性を発現し、そしてニューロンおよび星状細胞に分化し得た。これは、新鮮な胎児神経球から得られたNS細胞が、凍結し次いで長期間神経球として増殖した神経球から得られたものと同じであることを示した。
【0176】
(実施例8)
LC1マウスNS細胞を胎児ラット脳に移植した。eGFPを用いてレンチウイルス形質導入したNS細胞の共焦点像を、E14.5ラットの脳室への移植1週間後に撮影した。ドナー細胞は、塊状でおよび単一の細胞として、脳室から柔組織に移動した。移植された細胞は、eGFPとニューロンマーカーMAP2、星状膠マーカーGFAPまたは前駆細胞マーカーネスチンとの共局在を示した。したがって、NS細胞は、胎児ラット脳における移植後、移動しそして分化した。
【0177】
(実施例9)
(NS細胞株の誘導および操作のためのプロトコル)
本発明者らは、NS細胞株の誘導および操作のために、以下のプロトコルを案出した。
【0178】
(ES細胞からのマウスNS細胞株の誘導)
ES細胞は、接着単層培養においてSox1発現神経前駆体に効率的に変換され得る[P1]。このES細胞分化に関する詳細なプロトコルおよびトラブルシューティングは他にも記載される[P2]。簡潔には、ES細胞を、ゼラチンコーティングした組織培養プラスチック上で10%ウシ胎児血清および100U/ml組換え白血病阻害因子(LIF)を添加した培地中にフィーダーを与えない条件下で通常通りに培養する[P3]。未分化のES細胞を、T75フラスコ(Iwaki)中で約80%コンフルエンスまで増殖させ、トリプシン処理し、そしてN2B27培地中に再懸濁する[P2]。細胞を、少なくとも10分間0.1%ゼラチン溶液(Sigma)でコーティングし次いで乾燥させておいた9cmプレート(Iwaki)上に播種する。初期播種密度は、効率的な神経誘導にとって重大なパラメーターであり、そしてES細胞株間で変動し得るので、本発明者らは、プレート当たりいくつかの異なる細胞密度(0.8×106、1×106、および1.2×106)で、通常通りに播種する。脱着または死亡した細胞を除去する過程で、毎日、培養培地を入れ替える。これらの条件下では、50〜80%の細胞が4〜5日以内に神経系統分化を受け、そして5日目から先では明白なニューロン分化が検出可能となる。
【0179】
不均質な前駆体培養物の均質NS細胞株への変換は、以下のようにして達成され得る。7日目の分化培養物をトリプシン処理し、そして2〜3×106個の細胞を、NS増殖培地(これはL−グルタミン、2mM 最終(Gibco)、改変N2補充物(ウマからの調製直後のもの)[P2]ならびに10ng/mlのマウスEGF(Peprotech)およびヒトFGF−2(Peprotech)を添加したNS−A培地(Euroclone)を含む)中で非コーティングT75フラスコ中に再播種する。増殖培地は、4週間までの間、4℃で保存され得る。2〜3日以内に、フラスコは、懸濁培養物中に数千もの浮遊凝集体を含むようになる(絶対数は、初期ES細胞分化の効率に従って変動する)。細胞凝集体は、穏やかな遠心分離によって回収するか、または10分間30mlユニバーサル管中で重力に従って静置させる。この工程は、破片および死細胞を除去することによりNS細胞創始物を濃縮し、そして完全な培地交換を確実にする。細胞を、ゼラチンコーティングしたT75フラスコ(Iwaki)上で10mlの新鮮なNS増殖培地に再播種する。さらに3〜7日後、細胞凝集体は、フラスコに付着し、そしてその後まもなく、特徴的な二極NS細胞形態を有する細胞が生じる。広範な細胞成長後(さらに3〜4日後)、集団全体をトリプシン処理し、そして増殖培地中でゼラチンコーティングしたT75フラスコ上に単一の細胞として再播種する。細胞は、非常に迅速に増殖し(倍加時間約25時間)、そして接着したままである。数継代以内に、残りの分化した細胞および芽球細胞は排除され(GFAPおよびTuJ1免疫染色によってモニタリングする)、そして培養物は、NS細胞マーカーに対して均一に陽性である。
【0180】
46C ES細胞(Soxl−GFP−IRES−pacノックイン)[P4]のために、ピューロマイシン(0.5μg/ml)を用いる一過性の選択が、非神経細胞を排除しそして連続接着培養を介してNS細胞を誘導するために使用され得る。46C ES細胞(1×106)を、ゼラチンコーティングした9cmディッシュ上でN2B27培地中に播種して、神経方向付けを誘導する。6日後、ピューロマイシンを48時間添加する。次いで、富化されたSox1発現細胞集団(約3〜5×106)を、ゼラチンコーティングした9cmプレート上でEGF(10ng/ml)およびFGF−2(10ng/ml)を含むN2B27培地中に再播種する。初期に形態学的に不均質なSox1を発現する集団は、Sox1陰性特徴を、そして3〜4継代後には、均一なNS細胞形態およびマーカー発現を、累進的に獲得する。
【0181】
(胎児CNSおよび神経球からのマウスNS細胞株の誘導)
細胞クラスターは、NS細胞増殖培地中での胎児E16.5皮質および一次培養物の解離の際に懸濁液中で形成される。これらの一次凝集体は、増殖培地中でゼラチンコーティング基材上に播種することにより、接着NS細胞株に容易に変換され得る。付着を促進するために、まず破片/死細胞を沈降によって有効に除去し、そして培地を完全に交換することが重要である。細胞凝集体が付着し、そして2〜5日にわたって増殖する。引き続き、増殖している細胞をトリプシン処理して単一の細胞にし、再播種し、そしてNS細胞増殖培地中で増殖させ得る。継代した胎児神経球[P5]から、NS細胞は、便宜的には、解離およびNS増殖培地中でのゼラチンコーティングしたプラスチック上への直接播種によって樹立され得る。初期の数継代の間、誘導されたNS株は、特に細胞密度が高くなる場合には、凝集する傾向を有し、フラスコから脱着し、そして神経球を再形成する。したがって、培養物は、50%以下のコンフルエンスで継代されるべきである。自発的に凝集する傾向は、可変性であるが、一般には、さらなる継代の際にまたはクローン細胞株の樹立を通して減少される。
【0182】
(NS細胞の継代および増殖)
一旦樹立されると、NS細胞をNS増殖培地で増殖させる。NS細胞を、ゼラチンコーティングしたプラスチック/フラスコ上で増殖させ、そして1/2から1/5に通常通りに分割する。NS細胞は、約25時間の倍加時間を有する。トリプシン/EDTAを用いて、またはカルシウムマグネシウム非含有PBS(Sigma)とのインキュベーションによって、細胞を継代させる。クローン株の樹立のために、単一の細胞を、増殖培地中でゼラチンコーティングしたマイクロウェル中に堆積させ得る。より厳格ではないが、細胞は、非常に低い密度で播種し得る(9cmディッシュ当たり1000細胞)。コロニーが、2週間以内に出現し、そして選抜され増殖され得る。
【0183】
(NS細胞の凍結保存および回収)
NS細胞は、凍結/融解後に容易に回収される。通常通りに、本発明者らは、60〜90%のコンフルエンスであるT75フラスコをトリプシン処理し、そして1.5ml NS増殖培地+10% DMSO中にペレットを再懸濁する。次いで、これを3つの1ml凍結管(Nunc)に分け、そして−80℃で貯蔵する。NS細胞は、これらの条件では6ヶ月より長い貯蔵後でも回収可能である。長期貯蔵のために、凍結バイアルを液体窒素に移す。バイアルを急速に37℃にし、続いて10mlの予温NS増殖培地に移すことにより、NS細胞を融解する。細胞をペレット化し、次いで新鮮な増殖培地中に再懸濁してDMSOを除去する。凍結保存後の細胞回収率は、NS細胞については95%を超える。
【0184】
(NS細胞の星状細胞およびニューロン分化)
NS細胞のGFAP陽性星状細胞への迅速な分化は、ゼラチンコーティングしたフラスコ/プレート上でNS−A(N2あり、EGF/FGFなし)中でBMP4(10ng/ml)または1% FCSにNS細胞を曝露してから2日以内に生じる。細胞密度は、星状細胞分化にとって重要なパラメーターではない。
【0185】
ニューロン分化のために、NS細胞を、Accutase(Sigma)またはカルシウム/マグネシウム非含有PBSを用いて細胞を脱着して回収し、そして0.5〜1.0×104個の細胞を、FGF−2(5ng/ml)、改変N2、およびB27(Gibco)を添加したNS−A培地中で、ポリオルニチン/ラミニンコーティングした4ウェルマルチディッシュプレート(Nunc)の各ウェル中に再播種する。本発明者らは、NS−A基本培地が、他の基本培地よりもニューロン分化に対してより許容性であることを見出している。培地の容量の半分を2〜3日ごとに取り替え、培地の条件付けを維持する。これらの条件で7日後、本発明者らは、EGFもFGFも含まない0.25×N2およびB27を添加したNeurobasal培地(Gibco)と1:1の比で混合したNS−Aに、培地を交換する。この処方物は、さらなるニューロン分化および成熟を促進する。より長期のニューロン培養(14日を越える)のために、本発明者らは、BDNF(10ng/ml)の存在下でB27を含むがN2を含まないNeurobasalに、培地を交換する。
【0186】
(ヒトNS細胞の培養およびニューロン分化)
100U/ml組換えヒト白血病阻害因子(LIF)をさらに添加したマウスNS細胞と同様の増殖培地中で、ヒトNS細胞を、0.1%ゼラチン(Sigma)でコーティングしたフラスコ/プレート上で増殖させる。細胞は、約1週の倍加時間を有する。それらを、約30%のコンフルエンスに達するとトリプシンで継代させ、そして1/2に分ける。単層培養を維持しそして凝集および脱着を防ぐために、過剰増殖は避けるべきである。
【0187】
ニューロン分化のために、ヒトNS細胞を、Accutase(Sigma)を用いて回収し、そして約1×104個の細胞を、増殖培地中で、ポリオルニチン/ラミニン(Sigma)コーティングした12ウェルプレート(Iwaki)の各ウェル中に再播種する。細胞を、それらが約80%のコンフルエンスに達するまで増殖させる。ニューロン分化は、増殖培地からEGFおよびLIFを除去することにより誘導する。EGFおよびLIFのない状態で7日後、0.5×N2、B27、FGF2(5ng/ml)、およびBDNF(10ng/ml)を添加したNeurobasal培地(Gibco)と1:1の比で混合したNS−Aに、培地を交換する。これらの条件でさらに7日後、培地を、N2もFGF−2も含まないB27およびBDNF(10ng/ml)を添加したNeurobasal培地に交換する。このプロトコル全体を通して、マウスNS細胞と同様に、培地の容量の半分を2〜3日ごとに取り替える。さらに10日後、TuJ1およびMAP2と免疫反応性であるニューロン形態の細胞は、全細胞数の40%までになる。GFAP陽性細胞がほとんど出現しないニューロン分化に関するマウスNS細胞プロトコルとは対照的に、有意な数の星状細胞もまた生成される。
【0188】
したがって、本発明は、対称的に分裂している未分化状態で、多くの種の神経幹細胞を得て維持するための方法および培地を提供する。本発明は、ES細胞、胎児および成体供給源から得られるまたは摘出される細胞を用いて実施されている。全ての場合において、本明細書中に記載の方法に従うことにより得られた結果の細胞は、実質的に同じように見え、挙動する;それらは全て、多数(例えば数百)の倍加にわたって高純度培養で維持され得、高い割合の細胞が、ニューロンおよび神経膠を形成する能力を保持している。特に、ヒト(ES、胎児CNS)、マウス(ES、胎児CNS、成体CNS)およびラット(胎児CNS)から、NS細胞が首尾よく得られている。マウス神経幹細胞は、培養物中で純粋な集団で増殖され、そして移植された後、腫瘍を形成することなく増殖するが、インビボで分化している。
【0189】
(参考文献)
1.Reynolds, B. A.およびWeiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science 255, 1707-10 (1992).
2.Garcion, E., Halilagic, A., Faissner, A.およびffrench-Constant, C. Generation of an environmental niche for neural stem cell development by the extracellular matrix molecule tenascin C. Development 131, 3423-32 (2004).
3.Morshead, C. M., Benveniste, P., Iscove, N. N.およびvan der Kooy, D. Hematopoietic competence is a rare property of neural stem cells that may depend on genetic and epigenetic alterations. Nat Med 8, 268-73 (2002).
4.Suslov, O. N., Kukekov, V. G., Ignatova, T. N.およびSteindler, D. A. Neural stem cell heterogeneity demonstrated by molecular phenotyping of clonal neurospheres. Proc Natl Acad Sci U S A 99, 14506-11 (2002).
5.Malatesta, P.ら Neuronal or glial progeny: regional differences in radial glia fate. Neuron 37, 751-64 (2003).
6.Anthony, T. E., Klein, C., Fishell, G.およびHeintz, N. Radial glia serve as neuronal progenitors in all regions of the central nervous system. Neuron 41, 881-90 (2004).
7.Ying, Q. -L., Stavridis, M., Griffiths, D., Li, M.およびSmith, A. Conversion of embryonic stem cells to neuroectodermal precursors in adherent monoculture. Nature Biotechnology 21, 183-186 (2003).
8.Bain, G.,.Kitchens, D., Yao, M., Huettner, J. E.およびGottlieb, D. I. Embryonic stem cells express neuronal properties in vitro. Dev Biol 168, 342-57. (1995).
9.Li, M., Pevny, L., Lovell-Badge, R.およびSmith, A. Generation of purified neural precursors from embryonic stem cells by lineage selection. Curr Biol 8, 971-4 (1998).
10.Aubert, J.ら Screening for mammalian neural genes via fluorescence-activated cell sorter purification of neural precursors from Sox1-gfp knock-in mice. Proc Natl Acad Sci U S A 100 Suppl 1, 11836-41 (2003).
11.Stavridis, M. P.およびSmith, A. G. Neural differentiation of mouse embryonic stem cells. Biochem Soc Trans 31, 45-9. (2003).
12.Campbell, K.およびGotz, M. Radial glia: multi-purpose cells for vertebrate brain development. Trends Neurosci 25, 235-8 (2002).
13.Hartfuss, E., Galli, R., Heins, N.およびGotz, M. Characterization of CNS precursor subtypes and radial glia. Dev Biol 229, 15-30 (2001).
14.Billon, N., Jolicoeur, C., Ying, Q. L., Smith, A.およびRaff, M. Normal timing of oligodendrocyte development from genetically engineered, lineage-selectable mouse ES cells. J Cell Sci 115, 3657-65. (2002).
15.Bibel, M.ら Differentiation of mouse embryonic stem cells into a defined neuronal lineage. Nat Neurosci 7, 1003-9 (2004).
16.Gabay, L., Lowell, S., Rubin, L. L.およびAnderson, D. J. Deregulation ofdorsoventral patterning by FGF confers trilineage differentiation capacity on CNS stem cells in vitro. Neuron 40, 485-99 (2003).
17.Hack, M. A., Sugimori, M., Lundberg, C., Nakafuku, M.およびGotz, M. Regionalization and fate specification in neurospheres: the role of Olig2 and Pax6.Mol Cell Neurosci 25, 664-78 (2004).
18.Pevny, L. H., Sockanathan, S., Placzek, M.およびLovell-Badge, R. A role for SOX1 in neural determination. Development 125, 1967-78. (1998).
19.Heins, N.ら Emx2 promotes symmetric cell divisions and a multipotential fate in precursors from the cerebral cortex. Mol Cell Neurosci 18, 485-502 (2001).
20.Galli, R.ら Emx2 regulates the proliferation of stem cells of the adult mammalian central nervous system. Development 129, 1633-44 (2002).
21.Rakic, P. Elusive radial glial cells: historical and evolutionary perspective. Glia 43, 19-32 (2003).
22.Gregg, C.およびWeiss, S. Generation of functional radial glial cells by embryonic and adult forebrain neural stem cells. J Neurosci 23, 11587-601 (2003).
23.Magrassi, L.ら Basal ganglia precursors found in aggregates following embryonic transplantation adopt a striatal phenotype in heterotopic locations. Development 125, 2847-55 (1998).
24.Brustle, O.ら In vitro-generated neural precursors participate in mammalian brain development. Proc Natl Acad Sci U S A 94, 14809-14 (1997).
25.Rossi, F.およびCattaneo, E. Opinion: neural stem cell therapy for neurological diseases: dreams and reality. Nat Rev Neurosci 3, 401-9 (2002).
26.Malatesta, P., Hartfuss, E.およびGotz, M. Isolation of radial glial cells by fluorescent-activated cell sorting reveals a neuronal lineage. Development 127, 5253-63 (2000).
27.Gottlieb, D. I. Large-scale sources of neural stem cells. Annu Rev Neurosci 25, 381-407 (2002).
28.Temple, S. Division and differentiation of isolated CNS blast cells in microculture. Nature 340, 471-3 (1989).
29.Johe, K. K., Hazel, T. G., Muller, T., Dugich-Djordjevic, M. M.およびMcKay, R. D. Single factors direct the differentiation of stem cells from the fetal and adult central nervous system. Genes Dev 10, 3129-40 (1996).
30.Frederiksen, K., Jat, P. S., Valtz, N., Levy, D.およびMcKay, R. Immortalization of precursor cells from the mammalian CNS. Neuron 1, 439-48 (1988).
31.Alvarez-Buylla, A., Garcia-Verdugo, J. M.およびTramontin, A. D. A unified hypothesis on the lineage of neural stem cells. Nat Rev Neurosci 2, 287-93 (2001).
32.Palmer, T. D., Takahashi, J.およびGage, F. H. The adult hippocampus contains primordial stem cells. Mol. Cell. Neurosci. 8, 389-404 (1997).
33.Ying, Q. -L.およびSmith, A. G. Differentiation of Embryonic Stem Cells (Wassarman, P.およびKeller, G.編) 327-341 (Elsevier, 2003).
34.Carbone EおよびLux HD (1987) Kinetics and selectivity of a low voltage activated calcium current in chick and rat sensory neurons. J Physiol (Lond) 386:547-570.
(プロトコル参考文献)
P1. Ying Q-L, Stavridis M, Griffiths D, Li M, Smith A (2003) Conversion of embryonic stem cells to neuroectodermal precursors in adherent monoculture. Nature Biotechnology 21: 183-186.
P2. Ying QL, Smith AG (2003) Defined conditions for neural commitment and differentiation. Methods Enzymol 365: 327-341.
P3. Smith AG (1991) Culture and differentiation of embryonic stem cells. J Tiss Cult Meth 13: 89-94.
P4. Stavridis MP, Smith AG (2003) Neural differentiation of mouse embryonic stem cells. Biochem Soc Trans 31: 45-49.
P5. Reynolds BA, Weiss S (1996) Clonal and population analyses demonstrate that an EGF-responsive mammalian embryonic CNS precursor is a stem cell. Dev Biol 175: 1-13.
【技術分野】
【0001】
本発明は、神経幹細胞、ならびに幹細胞の対称分裂および自己再生を促進するための神経幹細胞(NS細胞またはNSC)の培養条件および培養方法に関する。組成物、細胞集団、細胞株、および単一の神経幹細胞もまた提供される。
【背景技術】
【0002】
神経幹細胞は種々の供給源からインビトロで単離されるといわれているが、これまで、これらの細胞を対称分裂している未分化状態で大規模培養で増殖することはできなかった。この状態での細胞の長期の増殖が、実験的観点および治療的観点の両方から、非常に望ましい。純粋な神経幹細胞集団を有することにより、ニューロン、星状細胞、および乏突起膠細胞の3つの細胞型への方向付けられた分化が可能になる。
【0003】
神経幹細胞を培養する1つの公知の方法は、不均質な細胞集団中の微量成分であるにも関わらず、神経球系である。この系は、不均質な細胞の凝集体の連続継代を包含するが、真の神経幹細胞はほんのわずかな割合でしかない。神経球中の細胞の大部分は、分化が方向付けられた前駆体である。
【0004】
神経球の異質性および不安定性、ならびにそれがニューロンを生成する能力に制限があることの多くの報告がある(例えば、Morsheadら, 2002)。Rappaら Neuroscience 2003は、フィブロネクチン上にそれらを1〜7日間播種し、次いで神経球を再形成することにより神経球細胞をトランスフェクトするための方法を報告しているが、(ある場合には)神経球内の幹細胞のいかなる顕著な特徴づけも提供していない。
【0005】
Suslovら 2002は、神経球系が、その中の任意の幹細胞の有意義な特徴づけを可能にするには不均質すぎることの明確なデータを提供している。主な結論は、神経球内の異質性がある−「クローン内神経細胞系統多様性を示す、すなわち、それらは、NSCに加えて、異なる分化状態のニューロンおよび膠細胞前駆体を含む」−だけでなく、異なるクローン神経球株間の遺伝子発現プロフィールに大きな差異が存在することである。Suslovの遺伝子発現プロファイリングは、「得られた分子表現型は、我々の系の中のクローン原性NSCが不均質であり、別個の神経発達方向の決定を反映しているサブセットを有することを示している」と論文中に明白に確認されているように、神経球内の幹細胞の定義を構成していない。
【0006】
この分野における多くの文献は、膠細胞の特性を記載している。Skoghら MCN 2001は、GFAPを発現しそしてRC2およびネスチンに対して可変的に染色する膠細胞の培養物を記載している−マウスGFAPは、インビボにて放射神経膠で発現されていないことに留意されたい(Rakic, 2003)。彼らは、彼らの細胞が、神経原性放射神経膠のホールマークであるPax6を発現していないことを報告しており(Malatestaら, 2001, 2003)、そして彼らは、他の放射神経膠マーカーはどれも調べていない。彼らは、不均質な培養物を有していたが、クローン分析を実施しなかった。
【0007】
インビトロでの放射神経膠の他の報告は、それらを分化の中間体または終末産物としてみなしている。したがって、Bibelら(Nat Neurosci, 2004)は、一過性放射神経膠様細胞を介するES細胞からのニューロンの生成を報告しており、そしてGreggおよびWeiss(J Neurosci, 23: 11587-601,2003; 米国特許公開2003/0032181)は、放射神経膠への神経球細胞の「分化」を記載している。Hartfussら(Dev Biol, 2001)は、放射神経膠が神経球に存在していることを示している。
【0008】
GreggおよびWeissは、放射神経膠が神経球の分化産物であることを見出し、「これらの結果は、神経幹細胞がRGC[放射神経膠細胞]を生じ得ること、およびRGCが導く移動は成体CNSにおいて繰り返され得ることを示唆している」と結論した。優勢な意見は、放射神経膠が、神経球から生じる分化した細胞型の1つであるというものである。
【0009】
LiourおよびYu(Glia, 2003)は、放射神経膠細胞分化がES細胞から得られ得ることを示しているが、この分野の他の報告と同様に、神経原性放射神経膠の発現を報告していない。
【0010】
Gobbelら Brain Res 2003は、「基材に緩く付着した増殖した細胞の球状塊としての」、すなわち、均一な単層としてではない、多分化能性ラット細胞の増殖を報告している。さらに、この論文の要約は、「これらの細胞は、3つの分裂のうち約2つにおいて分裂終了細胞を生じ、このため増殖を困難にしている」と結論している。それらの培養物中には広範囲の膠原性分化があるが、著者らは「比較的少ない」(<3%)のニューロンを見出している。彼らは、彼らの細胞の分子表現型を提供していない。
【0011】
WO01/30981は、ニューロンに分化し得る細胞の培養物を記載している。しかし、これらの細胞は、GFAPおよびネスチンに対して陽性であり、星状膠細胞として記載され、そして比較的純粋でない混合集団である。
【0012】
幹細胞が特定の細胞微環境、すなわちニッチを必要とするという概念は、幹細胞生物学において通説である。常に認められているわけではないが、神経球において、幹細胞は、前駆体、芽球細胞、および未熟分化子孫の中で総細胞のほんのわずかな割合しか占めていないことが知られている。この混合細胞型の凝集は、その中で小部分である、幹細胞であり得る細胞のためのニッチを構成し得る。
【0013】
文献の中で、ES細胞から神経幹細胞の均質な集団を誘導するとの報告はなく、唯一、神経膠に制限されるようになる前に一過的に増殖され得る神経上皮前駆細胞を誘導するとの報告がある(例えば、Brustleら, Science 1999)。
【発明の概要】
【発明が解決しようとする課題】
【0014】
したがって、当該分野には多数の課題が存在している。
【0015】
全ての報告は、それらの培養物が不均質であることを認めている。対称的に分裂しかつ未分化の状態で神経幹細胞の大規模培養を維持するために、神経球系を使用することはできなかった。多数の神経幹細胞を培養する他の試みは、5〜20継代を越えてはうまくいかず、また細胞が分化する傾向が高いことによって妨害されてきた。例外は、成体ラット海馬幹細胞における研究であるが、これらは、核型が異常であり、そして低い効率でニューロンを形成する。
【0016】
一過性の神経発生前駆体が知られているが、永久または半永久の自己再生幹細胞は単離精製されていない。
【0017】
ES細胞から神経幹細胞を誘導し、次いでこれらの神経幹細胞を純粋培養で維持することが望まれているが、これは、これまでできていない。また、移植のためにES細胞から神経幹細胞を誘導することも望まれているが、公知のES誘導細胞集団中のESおよび他の非神経細胞の残存は、レシピエント動物に腫瘍を生じる。さらに、胎児および出生後CNSから純粋な神経幹集団を得ることが望まれている。
【0018】
神経幹細胞の挙動を制御する分子および細胞事象の完全な理解は、胚発生の理解のための経路としてだけではなく、将来の治療適用のために神経幹細胞が単離され増殖されそして制御され得る枠組みとしてもまた、必須である。当該分野で公知の神経幹細胞の培養方法は、上記の理由のために、このような研究および治療適用に使用するには不適切である。したがって、細胞を対称的に分裂している自己再生状態に維持できる、大量の神経幹細胞を培養するための方法および条件を開発することが所望され得る。限定培地の使用は、臨床設定で非常に所望され得るので、上記要件を満たしている、限定した培養培地を有することが特に所望され得る。
【0019】
本発明は、上記課題の1つ以上を解決する。
【課題を解決するための手段】
【0020】
より詳細には、本発明は、神経幹(NS)細胞の対称分裂を促進する方法を提供し、この方法は、
(a)EGFファミリーのレセプターから下流のシグナル伝達経路のアクチベーター;および
(b)FGFレセプターから下流のシグナル伝達経路のアクチベーター
を含む培地で、該細胞を培養する工程
を含む。
【0021】
好ましい実施態様では、細胞は、血清の不在下で、例えば、血清を含まずかつ血清抽出物を含まない培地で培養される。さらに、細胞は基材に付着されて、別の言い方をすれば、接着培養で、培養されることが好ましい。また、培養培地が、インスリンまたは細胞上のインスリンレセプターの別のアゴニストを含むことが好ましい。
【0022】
本発明においては、用語「促進する」は、神経幹細胞を対称的に分裂している状態に維持することを包含すると理解される。
【0023】
本発明の別の局面によれば、多くの継代にわたって未分化状態での神経幹細胞の自己再生および対称分裂を支持する、および好ましくは促進する培養培地が提供される。この培地は、神経幹細胞の非対称分裂および分化を実質的に防ぐ。
【0024】
本発明はさらに、本明細書中のプロトコルに詳細に記載されるように、神経幹細胞を得る方法を提供し、そしてさらに、このような方法により得られる細胞を提供する。
【0025】
本発明はまた、神経細胞集団、組成物、細胞株、クローン原性細胞株、および単一の神経幹細胞を提供し、これらは、自己再生性の対称的に分裂している神経幹細胞を含む。
【0026】
本発明のさらなる局面は、ES細胞から神経幹細胞への分化を促進するための方法、および自己再生性の対称的に分裂している実質的に未分化の状態で得られる神経幹細胞を維持するための方法を提供する。
【図面の簡単な説明】
【0027】
【図1A】ES細胞からの神経幹(NS)細胞の生成を示す。
【図1B】ES細胞からの神経幹(NS)細胞の生成を示す。
【図1C】ES細胞からの神経幹(NS)細胞の生成を示す。
【図1D】ES細胞からの神経幹(NS)細胞の生成を示す。
【図1E】ES細胞からの神経幹(NS)細胞の生成を示す。
【図1F】ES細胞からの神経幹(NS)細胞の生成を示す。
【図1G】ES細胞からの神経幹(NS)細胞の生成を示す。
【図2A】NS細胞が種々のES細胞株および胎児前脳から誘導され得ることを示す。
【図2B】NS細胞が種々のES細胞株および胎児前脳から誘導され得ることを示す。
【図2C】NS細胞が種々のES細胞株および胎児前脳から誘導され得ることを示す。
【図3】NS細胞が成体脳内に取り込まれ分化することを示す。
【図4A】ヒトES細胞または胎児由来NS細胞を示す。
【図4B】ヒトES細胞または胎児由来NS細胞を示す。
【図4C】ヒトES細胞または胎児由来NS細胞を示す。
【図5A】分化培地中で培養したNS細胞の電圧および電流クランプ条件下での電気活動を示す。
【図5B】分化培地中で培養したNS細胞の電圧および電流クランプ条件下での電気活動を示す。
【図5C】分化培地中で培養したNS細胞の電圧および電流クランプ条件下での電気活動を示す。
【図5D】分化培地中で培養したNS細胞の電圧および電流クランプ条件下での電気活動を示す。
【図5E】分化培地中で培養したNS細胞の電圧および電流クランプ条件下での電気活動を示す。
【発明を実施するための形態】
【0028】
(定義の節)
「神経幹細胞」
本明細書中で使用される用語「神経幹細胞」とは、ニューロンおよび神経膠の両方を生成する潜在能を維持しながら20〜30よりも多くの細胞分裂を受け得る細胞を記載している。好ましくは、該細胞は、40より多くの、より好ましくは50より多くの、最も好ましくは無制限のこのような細胞分裂を受け得る。
【0029】
神経幹細胞は、対称的または非対称的のいずれかで分裂し得る。対称的に分裂している場合、神経幹細胞は、分裂して2つの娘神経幹細胞または2つの方向付けられた前駆体を形成する。しかし、他に記載されない限り、対称分裂とは、本明細書中では対称的な自己再生をいう。非対称的に分裂している場合、神経幹細胞は、分裂して1つの娘神経幹細胞と1つの方向付けられた前駆体(例えば、ニューロン前駆体または神経膠前駆体のいずれか)とを形成する。
【0030】
本発明の神経幹細胞は、放射神経膠として記載され得、そして放射神経膠マーカーRC2、3CB2、GLAST、BLBP、およびPax6の少なくとも1つ(および好ましくは全部)を発現することが示されている。好ましくは、本発明の神経幹細胞は、RC2、3CB2、およびGLASTを発現している。より好ましくは、細胞は、RC2、3CB2、GLAST、および、BLBPもしくはPax−6の少なくとも1つを発現している。本発明の神経幹細胞はまた、それらが神経前駆体マーカーのネスチンもしくはビメンチン、ルイスX抗原、ムサシ−1、またはプロミニンの少なくとも1つ(好ましくは全部)発現に対して陽性であり、そしてOct−4またはNanogの少なくとも1つ(好ましくは両方)の発現に対して陰性であることでもまた特徴付けられ得る(実施例1〜3もまた参照のこと)。
【0031】
本発明の神経幹細胞は、定義により多分化能性である、すなわち、それらは、多数の神経細胞型(例えば、ニューロン/神経膠)に分化し得る。以下の実施例は、本発明の方法に従って培養された神経幹細胞が、それらの潜在能を保持しており、そして全ての期待される細胞型に分化し得ることを確証している。
【0032】
「神経幹細胞の供給源」
広範な種々の供給源から本発明の神経幹細胞を誘導することができる。例えば、神経幹細胞は、胚から直接、成体組織から、胎児組織から、または胚性幹(ES)細胞(野生型または遺伝子改変ES細胞のいずれか)から誘導され得る。好ましくは、本発明の神経幹細胞は、マウスもしくはヒトのES細胞から誘導されるか、またはマウスもしくはヒトの胎児細胞から誘導される。
【0033】
本発明の神経幹細胞は、とりわけ、ヒト、霊長類、げっ歯類、および鳥類に由来し得る。好ましくは、神経幹細胞は、哺乳動物、特にマウス、ラット、およびヒトに由来する。
【0034】
「EGFレセプターファミリー」
本明細書中で使用される用語「EGFレセプターファミリー」は、EGFシグナル伝達因子のファミリーによって活性化され得るレセプター(通常、ホモダイマーもしくはヘテロダイマーレセプター)のファミリーを記載している。レセプターは、4つの非常に相同性の高い膜貫通糖タンパク質ErbB−1(EGF−Rとしても知られる)、ErbB−2、ErbB−3、およびErbB−4のファミリーで構成される。
【0035】
「EGFレセプター」というときは、EGFレセプターファミリーの任意のモノマーもしくはダイマーレセプター複合体を包含する。
【0036】
各レセプターは、細胞外リガンド結合ドメイン、単一疎水性膜貫通ドメイン、および1型レセプターチロシンキナーゼ活性によってシグナル伝達の原因となる細胞質チロシンキナーゼドメインを有する。これらのレセプターのいずれかへのリガンドの結合は、レセプターの二量体化および自己リン酸化、続いて多数の細胞基質のリン酸化を生じ、種々の生物学的効果に至る。レセプターの二量体化は、レセプターリガンドおよび毒性環境刺激(例えば、UV照射)を含む種々の刺激によって引き起こされ得る。各ダイマーレセプターは、異なるSH2含有エフェクタータンパク質を補充することによって別個のシグナル伝達経路を開始させる。例えば、EGF−Rダイマーは、グアニンヌクレオチド放出因子SOSにカップリングされたアダプタータンパク質Grbと複合体化し得る。Grb−SOS複合体は、レセプター中のホスホチロシン部位に直接結合し得るか、またはShcを介して間接的に結合し得る。これらのタンパク質相互作用は、SOSをRasに近接した位置にもたらし、Rasを活性化させる。このことは引き続き、ERKおよびJNKのシグナル伝達経路を活性化させ、引き続き、遺伝子発現を調節する転写因子(例えば、c−fos、AP−1、およびElk−1)を活性化させる。EGFレセプターはまた、PLCγシグナル伝達経路も活性化させ得る。
【0037】
「FGFレセプター」
本明細書中で使用される用語「FGFレセプター」は、膜貫通FGFレセプターチロシンキナーゼのファミリーの任意のメンバーを記載している。これらのレセプターの4つの主要なイソ型FGFR1、2、3、および4が存在し、そしてそれらは、ヘパリンおよびヘパラン硫酸(HS)系と密に関連して作用することが知られている。FGFレセプターというときは、FGFレセプターファミリーの任意のモノマーまたはダイマー(ホモもしくはヘテロダイマー)複合体を含む。
【0038】
FGFレセプターと関連した細胞性シグナル伝達経路は、MAPキナーゼ経路、およびPLCγ経路を含む。
【0039】
「培養培地」
本発明で使用される培養培地は、好ましくは、必要に応じて付加成分が添加された基本培地を含む。
【0040】
基本培地は、神経幹細胞のための炭素および/またはビタミンおよび/またはミネラルの必須供給源を供給する培地である。基本培地は、一般に、タンパク質を含まず、そしてそれ自身単独では神経幹細胞の自己再生/対称分裂を支持し得ない。
【0041】
好ましくは、本発明で使用される培養培地は、例えば、血清および/またはフィーダー細胞のような非限定である成分、すなわち、その含有量が不明である成分、または未特定の非限定または変動のある因子を含み得る成分、を含まない。血清を含まずかつ血清抽出物を含まない、完全限定培地を用いる利点は、神経幹細胞の培養およびそれに続く操作のために、効率的かつ一貫したプロトコルが導かれ得ることである。
【0042】
「培養表面」
本発明の全ての局面における神経幹細胞の培養のための代表的な表面は、細胞培養に有用であると当該分野で認識されている培養表面であり、そしてこれらには、プラスチック製表面、金属製表面、複合材製表面が含まれるが、通常は、広く市販されているプラスチック製組織培養プレートのような表面が用いられる。このようなプレートは、しばしば、直径数センチメートルである。スケールアップのために、このタイプのプレートは、ずっとより大きい直径で用いられ得、そして多くの繰り返しプレートユニットが用いられ得る。
【0043】
培養表面は、通常には表面上にコーティングされた、細胞接着タンパク質をさらに含み得る。幹細胞上に存在するレセプターもしくは他の分子が、該タンパク質または他の細胞培養基材に結合し、そしてこれは、表面への接着を促進し、そして増殖を促進する。ゼラチンでコーティングしたプレートが特に好ましい。
【0044】
本発明は、EGFレセプターのアゴニストまたはEGFおよびFGF−2レセプターの両方のアゴニストを含む培地中の基材に付着した神経幹細胞の培養が、幹細胞の制限のない対称分裂を促進しそしてニューロン/神経膠へのそれらの分化を実質的に防ぐとの知見に基づく。
【0045】
本発明の種々の局面を、ここに詳述する。
【0046】
本発明の第一の局面は、神経幹(NS)細胞の対称分裂を促進する方法を提供し、この方法は、
(a)EGFファミリーのレセプターから下流のシグナル伝達経路のアクチベーター;および
(b)FGFレセプターから下流のシグナル伝達経路のアクチベーター
を含む培地で、該細胞を培養する工程
を含む。
【0047】
本発明の別の方法は、神経幹細胞を得るために、以下の工程を含む:
(1)神経幹細胞を含む細胞の混合集団を得る工程;
(2)(a)EGFファミリーのレセプターから下流のシグナル伝達経路のアクチベーター;および(b)FGFレセプターから下流のシグナル伝達経路のアクチベーターを含む培地に該細胞を再播種する工程;
(3)該細胞を培養する工程;
(4)細胞の凝集体を回収する工程;
(5)(a)EGFファミリーのレセプターから下流のシグナル伝達経路のアクチベーター;および(b)FGFレセプターから下流のシグナル伝達経路のアクチベーターを含む培地に該細胞を再播種する工程;
(6)該細胞を培養する工程;
(7)(a)EGFファミリーのレセプターから下流のシグナル伝達経路のアクチベーター;および(b)FGFレセプターから下流のシグナル伝達経路のアクチベーターを含む培地に、単一細胞として細胞を再播種する工程。
【0048】
この方法は、例えば、このようなマーカーの発現を、それらの分化した子孫でのその発現に比較して神経幹細胞で優先的に活性なプロモーターに連結させることにより、神経幹細胞特異的マーカーを発現している細胞について選択することが付加され得る。好ましくは、この方法は、65%以下のコンフルエンスで、より好ましくは55%以下のコンフルエンスで、特に50%を下回るコンフルエンスで、細胞を継代させる工程を含む。
【0049】
本発明の方法の他の好ましい特徴は、実施例9で本発明のプロトコルに記載される通りである。
【0050】
本発明の培養物は、好ましくは、接着培養であり、すなわち細胞が基材に付着されている。
【0051】
基材は、代表的には、培養容器または別の物理的支持体での表面、例えば、培養ディッシュ、フラスコ、ビーズ、もしくは他のキャリアでの表面である。好ましくは、基材は、細胞の接着性を向上させるためにコーティングされていおり、そして適切なコーティングには、ラミニン、ポリリジン、ポリオルニチン、およびゼラチンが含まれる。細胞が、単層培養で増殖し、懸濁中で増殖せず、細胞のボールもしくは塊として増殖しないこともまた好ましい。より高い密度では、細胞は、互いに積み重なり始め得るが、培養物は、基材に付着されて、本質的に単層であるかまたは単層として開始する。
【0052】
EGFファミリーのレセプターから下流の1つ以上のシグナル伝達経路は、好ましくは、EGFファミリーのレセプターのアゴニストを用いて活性化され得る。EGFファミリーのレセプターのアゴニストは、適切には、シグナル伝達因子のEGFファミリーのメンバーであり、そして好ましくは、EGFレセプターの細胞外ドメインに結合する。用語「アゴニスト」はまた、シグナル伝達因子のEGFファミリーに対する模倣物、融合タンパク質、抗体、シグナル伝達因子のEGFファミリーのキメラ、ならびにそれらのフラグメント、改変体および誘導体も包含し、これらは、EGFファミリーのレセプターを活性化し得る。
【0053】
シグナル伝達因子のEGFファミリーを構成する分子は、それらが少なくとも1つのEGF様ドメインを含む点で特徴付けられ得る。このドメインは、ジスルフィド結合の形成を通して3つのペプチドループを生じる6つのシステイン残基によって定義され得る。
【0054】
EGFレセプターファミリーのレセプターを通して作用し得そしてこれらのレセプターの下流の経路を活性化し得る特定のアゴニストとしては、EGF、TGF−α、アンフィレグリン、ヘパリン結合EGF、エピレグリン、ベータセルリン、ニューレグリン1〜4、およびCripto−1が挙げられる。好ましくは、アゴニストは、EGFそれ自体である。
【0055】
FGFのレセプターから下流の1つ以上のシグナル伝達経路は、好ましくは、FGFのレセプターのアゴニストを用いて活性化され得る。FGFのレセプターのアゴニストは、適切には、シグナル伝達因子のFGFファミリーのメンバーである。用語「アゴニスト」はまた、シグナル伝達因子のFGFファミリーに対する模倣物、融合タンパク質、抗体、シグナル伝達因子のFGFファミリーのキメラ、ならびにそれらのフラグメント、改変体および誘導体も包含すると意図され、これらは、FGFのレセプターを活性化し得る。
【0056】
好ましくは、FGFレセプターのアゴニストは、FGF−2またはラミニン−FGFである。
【0057】
EGFレセプターファミリーのレセプターまたはFGFレセプターのいずれかの下流のシグナル伝達経路の活性化はまた、構成的に活性なレセプターによって、またはそれぞれのシグナル伝達経路の下流のエフェクター(例えば、MEKもしくはBcl2)によっても引き起こされ得ることが理解される。本発明の特に好ましい実施態様では、シグナル伝達経路は、細胞透過性小分子によって活性化される。これは、それぞれのレセプターを迂回し、シグナル伝達経路を直接活性化し得る。したがって、本発明では、用語「アクチベーター」は、EGFレセプターファミリーのレセプターまたはFGFレセプターの下流のシグナル伝達経路を活性化し得る全ての分子を包含する。
【0058】
本発明の神経幹細胞培養物の維持におけるアクチベーターの有効性は、以下の実施例1−1および1−2において実証されている。ここでは、神経幹細胞のバルクおよびクローン集団が、EGFおよびFGF−2を含む培地で維持され、そして多数回継代され得る。さらに、試験した細胞集団中では神経幹細胞マーカーが至るところに存在することによって示されるように、神経幹細胞の分化は無視し得る程度であるか全く存在しない(実施例1−3を参照のこと)。そしてそれらはそれらの潜在能を保持し、全ての期待される細胞型に分化し得る(実施例1−4を参照のこと)。
【0059】
したがって、本発明は、自己再生性の対称的に分裂している未分化状態で神経幹細胞の大きな集団を維持する効率的な方法を提供する。本発明の組成物は、神経幹細胞を含む組成物であって、神経幹細胞が接着培養中にあり、そして組成物中の細胞の少なくとも50%、70%、または80%が神経幹細胞である組成物を包含する。神経幹細胞の割合は、さらに好ましくは少なくとも90%、より好ましくは少なくとも95%、非常に好ましくは少なくとも97%である。さらに、本発明の神経幹細胞は、大いに継代され得る。神経幹細胞は、少なくとも30回、より好ましくは少なくとも60回、非常に好ましくは少なくとも90回継代されていることが好ましい。なおさらに、本発明の神経細胞の集団では、該細胞の少なくとも80%、好ましくは少なくとも90%、より好ましくは少なくとも95%が、対称的に分裂している神経幹細胞である。この組成物中の細胞は、単独または組み合わせて、本発明の任意の特徴および全部の特徴によってさらに特徴付けられ得る。
【0060】
組成物もまた提供され、この組成物は、
神経幹細胞;
EGFファミリーのレセプターから下流のシグナル伝達経路のアクチベーター;および
FGFレセプターから下流のシグナル伝達経路のアクチベーター
を含む。
【0061】
組成物は、好ましくは、基本培地を含む。また、組成物中の神経幹細胞の少なくとも80%、好ましくは少なくとも90%、より好ましくは少なくとも95%が、対称的に分裂している神経幹細胞であることが好ましい。
【0062】
上記神経細胞集団および組成物の両方において、神経幹細胞は、好ましくは、オンコジーンをコードする外因性遺伝物質を含まない。すなわち、それらは、不死化ストラテジーを受けていない。特定の実施態様では、集団/組成物の神経幹細胞は、それらが、
神経前駆体マーカーのネスチンもしくはビメンチン;
Sox−2;
放射神経膠細胞特異的マーカーのRC2、3CB2、GLAST、BLBP、もしくはPax−6;
ルイスX抗原;
ムサシ−1;および
プロミニン
の少なくとも1つの発現に対して陽性であり、そして
Oct4、および
Nanog
の少なくとも1つの発現に対して陰性であることで特徴付けられている。
【0063】
好ましくは、細胞は、RC2、3CB2、およびGLASTの発現に対して陽性である。他の実施態様では(必要に応じて先行のマーカープロフィールに加え)、細胞は、BLBP、Pax−6、神経前駆体マーカーのネスチンもしくはビメンチン、ルイスX抗原、ムサシ−1、またはプロミニンの少なくとも1つの発現に対して陽性である。特に好ましい実施態様では(そして必要に応じて先行のマーカープロフィールに加え)、細胞は、Oct4またはNanogの少なくとも1つの発現に対して陰性である。
【0064】
さらなる実施態様では(必要に応じて上のマーカープロフィールに加え)、細胞は、Sox−2の発現に対して陽性であり、そしてSox−1の発現に対して陰性である。マウス由来NS細胞を含む特定の組成物/集団では、細胞の1%以下が、GFAPまたはβIIIチューブリンの発現に対して陽性であり、それにより星状細胞またはニューロンへの細胞の分化が無視し得る程度であることが確認される。他の組成物/集団では、細胞の1%以下が、成熟した星状細胞、ニューロン、または乏突起膠細胞に対するマーカーの発現に対して陽性である。
【0065】
本発明はまた、ラット細胞を用いて実施された。したがって、本発明者らは、ラットCNSから細胞を採取し、そして本発明の方法を用いて、ラット神経幹細胞の培養物を得た。ラット神経幹細胞は、(i)高純度、代表的には80%または90%を超えるラット神経幹細胞、および(ii)多数回の倍加、50を超える、100を超える、さらに200を超える倍加後に、その高割合(最少で50%)がニューロンおよび神経膠を形成する能力を保持している細胞であるとの特性を有する。当該分野では、ラット由来の細胞は、明らかに非常に不均質であり、成体海馬からのみであった。本発明者らは、この供給源から細胞を得ずに、代わりにラットCNSから得た。この点において、本発明の方法は、3種(ラット、マウス、ヒト)の全てにわたって有効であったことが注目に値する。本発明の方法に従って、単一の細胞が、神経幹細胞コロニーを形成すれば、ニューロンがそのコロニー中の細胞から得られ得ることが一般に理解される。これは、例えば、(i)核に対して(すなわち、全ての細胞を染色)および(ii)ニューロンに対して(すなわち、ニューロンのみ)個別に染色することによって測定される。染色された細胞の相対数を比較することにより、ニューロンを形成する細胞の割合が算定され得る。
【0066】
本発明の第二の局面は、神経幹細胞の調製のための方法を提供し、この方法は、(i)上記の方法に従って神経幹細胞を培養し、それによって神経幹細胞の培養物を得る工程、および(ii)該培養物から神経幹細胞を単離する工程を含む。好ましくは、単離された神経幹細胞は、対称的な様式で分裂するように条件付けられた細胞である。
【0067】
多数の細胞供給源が用いられ得、そこから神経幹細胞が誘導される。1つの方法では、細胞は、動物の神経組織から得られ、そして本発明に従って培養され、対称的に分裂している神経幹細胞の培養物が得られる。神経組織は、成体または胎児の組織に由来し得る。神経組織は、CNSに由来し得、そして神経幹細胞の対称分裂集団は、ヒトおよびマウスの両方からの成体および胎児の両方のCNSから採取された抽出物から得られ得る。神経組織は、好ましくは、放射神経膠表現型を有すると同定された細胞を含む。例えば、この表現型を有する細胞は、小脳および網膜からの抽出物で同定されており、その両方ともが、適切なさらなる細胞供給源を表す。神経幹細胞は、疾患のモデリングに有用な罹患神経組織から得られ得、例えば、細胞は、この目的で脳腫瘍から得られ得る。
【0068】
本発明を使用する選択肢には、罹患個体から神経幹細胞を誘導し、次いで(i)アッセイのためにこれらの細胞を使用するか、または(ii)その個体に細胞を戻す移植の前に遺伝子改変を実施することがある。したがって、神経変性障害(例はアルツハイマー病およびパーキンソン病を含む);または脳腫瘍を有する個体から、細胞が得られ得る。
【0069】
神経幹細胞を得る別の方法は、
(i)神経幹細胞に分化し得る多分化能性もしくは分化多能性幹細胞を得る工程、
(ii)(i)の細胞を、分化多能性細胞に対して非許容性である培地でそして(a)EGFファミリーのレセプターの下流のシグナル伝達経路のアゴニストおよび(b)FGFファミリーのレセプターの下流のシグナル伝達経路のアゴニストの存在下で培養する工程
を含む。
【0070】
使用に際して、混入している可能性のあるES細胞が、この方法によって除去されるか、または少なくとも実質的に数が減少され、より純粋でかつ移植の際に奇形腫を生じる可能性がより少ない培養物が得られる。
【0071】
幹細胞は、適切には分化多能性幹細胞であり、特にESまたはEG細胞である。方法は、好ましくは、EGFレセプターのアゴニストおよびFGFレセプターのアゴニストの存在下で細胞を培養する工程を含む。
【0072】
本発明のNS細胞を用いて、本発明者らは、EGFおよびFGFを除去しそして血清またはBMP4を添加することによって星状細胞を得、本発明者らは、EGFを除去し、次いで約1週間おいた後にFGFを除去し、そしてラミニン上に細胞を播種することによってニューロンを得、そして本発明者らは、EGFおよびFGFを両方とも除去することによって乏突起膠細胞を得た。一般に、神経幹細胞を生成するために使用される本発明の方法は全て、必要に応じて、神経幹細胞をニューロン、星状細胞、または乏突起膠細胞に分化する工程、および次いでさらに必要に応じて(例えば、アッセイで、移植のために、またはそれ以外に)、ニューロン、星状細胞、または乏突起膠細胞を用いる工程をさらに含む。
【0073】
神経幹細胞培養物が単離されると、次いで、それは、神経幹細胞株を樹立するために使用され得る。このような細胞株の樹立は、好ましくは、
(a)単一の神経幹細胞を得る工程、
(b)前記の方法のいずれかに従って神経幹細胞を培養する工程
を含み、それによって、神経幹細胞のクローン集団を得る。
【0074】
特定の実施態様では、細胞株を樹立するために使用される単一の神経幹細胞は、対称的に分裂している神経幹細胞、または対称的な様式で分裂するように条件付けられた神経幹細胞である。好ましくは、単一の神経幹細胞は、神経幹細胞を調製するために、上記の方法に従って得られる。
【0075】
好ましい実施態様では、上記の方法によって得られる神経幹細胞株は、神経幹細胞のクローン集団(すなわち、その中の細胞の全てが単一の神経幹細胞の子孫である)である。
【0076】
単一の神経幹細胞および細胞株(必要に応じて上記の方法によって得られ得る)もまた、本発明の一部を形成する。第一の実施態様では、細胞株が提供され、そこでは細胞が、EGFレセプターファミリーのレセプターの下流のシグナル伝達経路のアクチベーター、およびFGFレセプターの下流のシグナル伝達経路のアクチベーターの存在下で維持されている。他の実施態様では、単一の神経幹細胞および細胞株の細胞は、それらが、
神経前駆体マーカーのネスチンもしくはビメンチン;
Sox−2;
放射神経膠細胞特異的マーカーであるRC2、3CB2、GLAST、BLBP、もしくはPax−6;
ルイスX抗原;
ムサシ−1;および
プロミニン
の少なくとも1つの発現に対して陽性であり、そしてそれらが、
Oct4、および
Nanog
の少なくとも1つの発現に対して陰性であることで特徴付けられている。
【0077】
好ましくは、細胞は、RC2、3CB2、およびGLASTの発現に対して陽性である。他の実施態様では、(必要に応じて先行のマーカープロフィールに加え)細胞は、BLBP、Pax−6、神経前駆体マーカーのネスチンもしくはビメンチン、ルイスX抗原、ムサシ−1、またはプロミニンの少なくとも1つの発現に対して陽性である。特に好ましい実施態様(そして必要に応じて先行のマーカープロフィールに加え)細胞は、Oct4またはNanogの少なくとも1つの発現に対して陰性である。
【0078】
他の特定の実施態様では、(必要に応じて上のマーカープロフィールに加え)細胞は、Sox−2の発現に対して陽性であり、そしてSox−1の発現に対して陰性である。特定のマウス由来細胞株では、細胞の1%以下が、GFAPまたはβIIIチューブリンの発現に対して陽性である。他の(例えば、ヒト)細胞株では、細胞の1%以下が、成熟した星状細胞、ニューロン、または乏突起膠細胞に対するマーカーの発現に対して陽性である。
【0079】
単一の神経幹細胞および細胞株の細胞の両方とも、オンコジーンをコードする外因性遺伝物質を含まないこと、すなわち、それらは、不死化ストラテジーを受けていないことが好ましい。記載の細胞株が、神経幹細胞株であることも好ましい。
【0080】
第三の局面では、本発明は、対称的に分裂している神経幹細胞のトランスフェクトされた集団を得てこれを維持する方法を提供し、この方法は、
(a)選択マーカーAをコードする構築物でES細胞をトランスフェクトする工程であって、使用に際して、該選択マーカーが、神経前駆細胞特異的プロモーターの制御下で発現される、工程;
(b)該ES細胞の神経前駆細胞への分化を促進する工程;
(c)該選択マーカーAを発現している神経前駆細胞について選択する工程;および
(d)該選択された細胞を、前に記載の方法のいずれかに従って培養する工程
を含む。
【0081】
選択マーカーAは、抗生物質耐性、細胞表面マーカー、または例えばEP−A−0695351に記載されるような別の選択マーカーをコードし得る。神経前駆細胞特異的プロモーターは、Sox−1、Sox−2、Sox−3、BLBP、およびネスチン神経エンハンサーからなる群から選択され得る。この選択ストラテジーのさらなる詳細を、実施例1−1に示す。
【0082】
本発明の神経幹細胞(すなわち、本発明の単一の神経幹細胞ならびに組成物、細胞株、および集団中に存在する神経幹細胞)は、遺伝子改変され得る。したがって、本発明の神経幹細胞をトランスフェクトする方法が提供され、この方法は、
(a)選択マーカーBおよびポリペプチドをコードする構築物で神経幹細胞をトランスフェクトする工程;および
(b)該選択マーカーBを発現する神経幹細胞について選択する工程
を含む。
【0083】
選択マーカーBは、抗生物質耐性または細胞表面マーカーをコードし得、そして選択マーカーAと同じかまたは異なり得る。適切なトランスフェクション方法は、公知の方法であり、エレクトロポレーション、リポフェクション、ヌクレオフェクション(necleofection)、およびレトロウイルストランスフェクションおよびレンチウイルストランスフェクションが含まれる。
【0084】
遺伝子改変神経幹細胞もまた本発明の一部を形成し、したがって、本発明は、この構築物をさらに含む、本発明の単一の神経幹細胞または組成物、集団、もしくは細胞株中に存在するような神経幹細胞を提供する。このような神経幹細胞は、選択マーカーBに加え、選択マーカーAをすでに含み得ることが理解される。
【0085】
前記のように、本発明の方法は、任意の供給源から誘導された神経幹細胞との使用に適している。1つの特定の実施態様では、本発明は、ES細胞の供給源から神経幹細胞を得るための方法を提供する。この方法によれば、例えば単層での培養または胚様体分化により、ES細胞を神経前駆体に転換し、次いでNSA培地中で該神経前駆体を培養することにより、ES細胞の神経幹細胞への分化が促進される。さらに、NSA培地は、付加成分(例えば、付加グルコースおよびHEPES)を含み得ることが意図される。代替として、グルコースおよびHEPESが付加された培地(好ましくは基本培地)もまた、この分化を促進するために使用され得る。
【0086】
NSAおよび/またはグルコースおよびHEPESの存在下で、条件は、神経幹細胞の増殖が好まれるような条件であり、培養物中に存在するいかなる非神経細胞もが優先的に死滅するという利点が付加される。このことは、実質的に純粋な神経幹細胞培養物(例えば、存在する全細胞の少なくとも80%、好ましくは少なくとも90%、より好ましくは少なくとも95%)を生じる。実施例1−5は、この方法の更なる詳細を提供する。
【0087】
好ましい実施態様では、実施例1−5の方法は、対称的に分裂している神経幹細胞の集団を調製するために使用され得る。引き続き、集団は、上記の本発明の培養方法のいずれかを用いて維持される。
【0088】
実施例1−5の方法はまた、神経幹細胞へのES細胞の分化に関する因子の効果についてアッセイするために使用され得る。好ましいアッセイ実施態様では、ES細胞が、試験される因子の存在下で、実施例1−5に記載の方法を用いて培養される。因子の効果は、例えば、得られた細胞のマーカープロフィールを決定する、すなわち、細胞が、本発明の細胞と同様のマーカープロフィールを有するか、またはESマーカープロフィールが維持されているかを示すことにより、評価され得る。試験される因子は、誘導因子またはブロッキング因子のいずれでもあり得る。
【0089】
神経性疾患および神経変性疾患、および脳損傷の治療において、特に、パーキンソン病およびアルツハイマー病、多発性硬化症、および筋萎縮性側索硬化症のような疾患の治療において、神経幹細胞の使用に大きな関心がある。本発明の方法、組成物、細胞集団、細胞株、および単一の細胞は全て、このような治療において、ならびにこのような治療のための調製物の製造において、用いられ得る。本発明を用いて治療され得る特定の神経性/神経変性疾患としては、以下が挙げられる:パーキンソン病、運動ニューロン疾患、卒中、多発性硬化症、およびハンチントン病。
【0090】
したがって、第5の局面では、本発明は、細胞療法のため、および神経変性疾患および脳損傷の治療用組成物の製造のための、上に記載の細胞株、神経細胞集団、単一の神経細胞、および組成物の使用を提供する。このような調製物は、リン酸緩衝化生理食塩水(PBS)中に処方され得る。
【0091】
上に列挙した疾患の治療の方法は、本発明の単一の細胞、細胞株、組成物、または細胞集団の患者への移植を含み得る。好ましくは、患者は哺乳動物であり、より好ましくは、患者はヒトである。このような移植は、胚および成体の両CNSでの成功が示されており、そして実施例1−6に詳細に記載している。
【0092】
本発明の細胞、および特に細胞株は、神経幹細胞の分化に関する誘導因子またはブロッキング因子の効果をアッセイするために使用され得る。このようなアッセイは、本発明の神経幹細胞(すなわち、組成物、細胞株、および集団中に存在する細胞、または単一の神経幹細胞)と、試験される因子とを接触させる工程を含み得る。神経幹細胞の分化に関する因子の効果は、適切には、得られた細胞のマーカープロフィールを決定する、すなわち、細胞が、本発明の細胞と同様のマーカープロフィールを有するか、またはこれらのマーカーが失われたかを示すことにより、評価され得る。本発明の細胞はまた、薬剤をアッセイするのにも適している。
【0093】
ニューロンまたは神経膠を形成する細胞の割合を評価するために、細胞をクローン増殖する。細胞が個々に播種されると全ての細胞がクローンコロニーを形成するわけではないが、クローンコロニーを形成するもののうち一般には50%以上が、ニューロン(適切なプロトコル下で)または神経膠(再度、適切なプロトコル下で)をつくる。これらの細胞は、従来技術から区別される。従来技術は、神経幹細胞特性を有する細胞の同定およびその増殖さえも議論しているが、それらの集団は非常に不均質であったからである。これは、重要な相違である。純粋でない集団は、残りの神経幹細胞にシグナル伝達を提供する細胞を含むからであり、このことは、分化を刺激しそしてさらには神経幹細胞の割合を減少させる。先行技術の方法は、個々の細胞から神経球を生成し得るが、本発明は、個々の細胞から実質的に純粋な集団の生成を可能にしている。
【0094】
本発明の特定の実施態様(以下の実施例により詳細に記載する)では、全てのNS細胞コロニーが、15%以上、好ましくは少なくとも20%、より好ましくは約20〜30%のTuJ陽性ニューロンを生成している。より高い密度の培養で、本発明者らは、TuJ陽性細胞を計数した。LC1 NS細胞の35%がニューロン形態を獲得し、そして1年よりも長い連続培養である115継代後にもβIIIチューブリンを発現していた。これらの細胞は、この期で二倍体核型を保持していた。LC1は、クローン化されていない集団である。したがって、データは、神経膠に制限された前駆体または遺伝的形質転換に対する選択圧が最小限であったことを示している。
【0095】
本発明の細胞は、異種細胞と共培養することなくかつ非限定の条件培地、細胞外マトリックス画分または血清を用いることなく増殖され得、これは、ES細胞以外の幹細胞のタイプについて以前に示されていない特徴である。したがって、本発明によれば、神経幹細胞が、好ましくは、規定された条件で均質な培養で増殖される。マイクロウェル中に単離された単一のNSCでさえも増殖し得、このことは、EGFおよびFGF以外の細胞外シグナルへの依存が最小限であること、およびインビトロでは、NSCにとって必須の外的自己再生シグナルが、EGFおよびFGFに対して減少され得ることを示している。
【0096】
実施例により詳細に示したさらなる実施態様では、実質的に全てのコロニー(播種している単一の細胞から発達したコロニーの少なくとも90%、好ましくは少なくとも95%、より好ましくは少なくとも97%)が、(i)FGF+EGFにおいて神経前駆体マーカーの同一の均質な発現と分化マーカーの不在とを示し、そして(ii)増殖因子の除去に際してニューロンを生成している。特定の実施例では、全てのコロニーがこれらの特性を有していた。これは、対称的な自己再生の証拠である。さらに、非クローンNS細胞培養物におけるコロニーアッセイからのデータは、クローンNS5株由来のデータと比較可能であった。NS5からの増殖可能な未分化のコロニーの連続的な形成は、クローン原性細胞が幹細胞であること、およびそれらの数がNS集団と比例して増大していることを示している。形式的に、幹細胞数の増加は、2つの機構を介して生じ得る:デノボ生成または対称的な自己再生分裂。前者は、前幹細胞供給源、すなわち、分化多能性細胞または胎児原基を必要とし、それらのいずれも、本明細書中のNS細胞培養物中には存在しない。そこで、対称的な自己再生がNS細胞培養で生じていなければならない。
【0097】
以下の実施例で得られた特定のNS細胞は、Sox2、Pax6、Emx2、Olig1、Olig2、ネスチン、BLBP、GLAST、ビメンチンを発現し、そしてRC2、3CB2、SSEA−1、およびプロミニンに対して免疫反応性である。好ましくは、それらは、Sox1を発現せず、そしてGFAPおよびニューロン抗原に対して陰性である。これらのNS細胞は、分化多能性マーカーおよび他の胚葉のマーカーを欠く。本発明者らは、ES細胞での場合と同様に、神経幹細胞の特徴がCNS発生の間でマスクされており、エクスビボでのみ真に実証可能であることを主張する。Sox1発現がNS細胞で維持されなかったという知見は、新規で予期されないものであり、そしてSox1を用いる連続的な系統選択は実りあるものではないことを示している。
【0098】
本発明のさらなる実施態様では、ES細胞由来非クローン化(CGR8−NS)およびクローン化(NS5)NS株および胎児皮質由来非クローン化(Cor1)およびクローン化(Cor1−3)NS株により例証されるNS細胞は、培養物中に放射神経膠マーカー3CB2、BLBP、GLAST、ネスチン、RC2、およびビメンチンの発現を示している。GFAPの発現は、これらの培養物のいずれにおいても、好ましくは細胞の10%未満、より好ましくは5%未満、特に2%未満である。特定の実施例では、GFAP発現は、細胞の1%未満で見られた。本発明者らはまた、115継代後のES細胞由来NS細胞において、GFAPおよびβIIIチューブリンはなく、ネスチンおよびRC2の均一な発現を示した。このことは、NS細胞表現型が安定であることを示している。本発明の好ましい細胞は、ES細胞から分化され、そして30継代後、好ましくは60継代後、より好ましくは100継代後に、(1)ネスチンおよびRC2の発現が続きそして(2)GFAPおよびβIIIチューブリンの発現がないことが続く。GFAPおよびβIIIチューブリンの発現がないとは、細胞の5%未満、好ましくは細胞の2%未満に発現が見られることを意味する。
【0099】
本発明者らは、RT−PCRによって分析を実施し、特定のNS細胞に分化多能性、中胚葉、または内胚葉の特異的転写因子がないことを確認した。本発明者らはまた、アフィメトリックス(RTM)発現プロファイリングを実施し、系統の不適切な転写物がないことを確認し、そして3つの異なるNS細胞培養(ES由来、胎児皮質由来、およびクローン胎児皮質由来)において神経マーカーおよび放射神経膠マーカーの一貫した発現を実証している。
【0100】
ES細胞からの分化によりNS細胞を得ることは、好ましくは、連続接着培養で細胞を維持する工程を含み、そしてより好ましくは、神経球を形成する工程を省く。しかし、胎児または成体脳由来の一次細胞単離物からの細胞の分化によりNS細胞を得ることは、必要に応じて、(i)まず懸濁凝集体または神経球を形成する工程、および(ii)引き続き接着培養に細胞を維持する工程を含む。本発明者らは、実施例において、数日後に、これらの凝集体がゼラチンコートされたプラスチックに付着され得、次いでNS細胞が増殖することを見出した。
【0101】
本発明者らは、本発明の細胞の初期および後期継代で生成したニューロンおよび星状細胞の割合を、(詳細には、LC1 NS細胞に対して、8継代目および115継代目で)決定した。後者の培養は、12ヶ月の増殖を表し、倍加時間は24時間であった。後期継代で得られたニューロンの数にはささやかに減少があるが、これはなお35%よりも多くを占める。独立して46C ES細胞から誘導されたNS5クローン株は、30継代目に同様のレベルのニューロン分化効率を示している。GFAP免疫反応性星状細胞の生成は、LC1 NS細胞についておよびNS5細胞についても、両時点で100%に近づいた。さらに、多数回継代で増殖し、次いでGFPレンチウイルスを形質導入しそして移植前にさらに増殖させたLC1 NS細胞を用いて、インビボでのデータを得た。このデータは、ニューロンおよび星状細胞の両方の広範な分化を示している。放射神経膠マーカー発現の均一性と組み合わせて、非クローン化LC1 NS細胞についての安定な分化能に関するデータは、FGFおよびEGFにおける接着培養が、幹細胞自己再生を好み、そして神経膠またはニューロンのいずれかの運命への方向付けを抑制することを示している。
【0102】
本発明者らは、ES細胞からの分化により得られたNS細胞が、5週間にわたって腫瘍の形成なく移植され得ること、したがって、マウス脳において4週以内に巨視的な奇形腫を生じたES細胞とは異なることを見出した。
【0103】
本発明はまた、核再プログラミング方法、ならびにこれらの方法によって得られる細胞および動物にも関する。
【0104】
核再プログラミングは、体細胞、必要に応じて幹細胞もしくは終末分化細胞の核が、比較的より高い潜在能の細胞の核として挙動するように再プログラミングされる技術である。最終的には、完全に再プログラミングされた核が、分化多能性細胞の核として作用し、そして再プログラミングは、しばしば分化多能性に対して様々に再プログラミングすることを意味する。核移入による再プログラミングの方法は、当該技術分野で十分に確立されており、WO96/07732に記載の発明(時に、「ドリー羊」発明といわれる)後に十分に公開されるようになった。したがって、核移入は、非ヒト動物をクローン化するために使用され得る。
【0105】
核移入方法は、多くの課題を有する。まず、それらは低効率のままであり、得られた細胞が、真に分化多能性であるように再プログラミングされるのはまれである。再プログラミングの一部として核で遺伝子操作を実施し得ることも所望され得る。しかし、現時点では、この操作は、ドナー核のクローン集団を得るのが困難であるため、可能ではないかまたは信頼性がない。クローン核を用いてさえも、再プログラミング方法は、多くの独立した工程を必要とする複雑な手順である。最後に、いくつかの種に由来するES細胞は、単離するのがなお困難である。再プログラミング技術の使用は、そのようなことが利用できかつ信頼性があれば、これらの種において分化多能性細胞への代替の経路を提供する。
【0106】
本発明のさらなる局面は、上記課題に対する代替のアプローチを提供すること、およびそれらへの解決を提供することを目的として有する。
【0107】
したがって、本発明は、核再プログラミングの方法を提供し、この方法では、ドナー核が本発明の神経幹細胞から得られる。
【0108】
本発明の神経核細胞は、高い効率で再プログラミング可能であることが見出されており、したがって、本発明は、効率的な再プログラミング方法を提供し、そしてまた、多くの種の遺伝子改変された再プログラミングされた細胞(特に分化多能性幹細胞)の作製を容易にする。本発明によって個々の神経幹細胞をクローン増殖できることとは、全てが同じ遺伝子改変を用いて、遺伝子操作後に細胞のクローン集団が得られ得、そして再プログラミング方法で使用され得ることを意味する。
【0109】
特定の細胞表面マーカーの存在および/または他のものの不在に従って神経幹細胞を同定することもまた可能である。このことは、神経幹細胞は、混合集団(例えば、脳ホモジネート)から直接採集され得るので、本明細書中に記載の本発明の局面に従って培養する工程が省かれ得るという利点を有する。
【0110】
したがって、核再プログラミングの方法が本明細書中に提供され、この方法では、ドナー核が、本発明の任意の実施態様または局面に従って得られた神経幹細胞に由来する。
【0111】
核再プログラミングの特定の方法は
ドナー細胞を得る工程;
レシピエント細胞を得る工程;
該ドナー細胞の核を該レシピエント細胞に移入する工程であって、該ドナー細胞が、(i)神経幹細胞、または(ii)本発明の方法に従って得られた細胞である、工程;および
該細胞を培養して該ドナー細胞の核を再プログラミングし、それによって再プログラミングされた細胞を得る工程
を含む。
【0112】
レシピエント細胞の核は、一般に、プロセス中の一段階で除去され、そのため得られる細胞は二倍体であり、これは、必要に応じて該ドナー細胞の核の移入前におよび必要に応じて該ドナー細胞の核の移入後になされる。
【0113】
本発明のNS細胞によって提供される関心のある可能性の1つは、遺伝的病変(例えば、悪性を誘導し得る)を導入することである。したがって、さらなる選択肢は、ドナー細胞核を遺伝子操作することである。これは、目的の変異または遺伝子を導入するために使用され得、例えば、アッセイまたは他の試験目的のために細胞または動物を生成し得、複数の細胞が全て同じ操作で得られる。操作の範囲は広範である。一例は、疾患原因遺伝子配列または推定疾患原因遺伝子配列をドナー細胞核に導入することであり、薬物スクリーニングに有用である。さらなる選択肢は、再プログラミングされた細胞から誘導された組織を含む動物を得、そして該組織を用いてアッセイを実施することである。細胞は、例えば卵母細胞への核転移によって、分化多能性に戻るように再プログラミングされることが好ましい。
【0114】
本発明の特定の実施態様では、所望の神経幹細胞における細胞表面マーカーの本発明からの知識を利用することにより、そうでなければ混合集団からの神経幹細胞の単離に必要とされる培養工程の省略が可能になる。1つのこのような再プログラミング方法は、細胞の混合集団を提供する工程、その細胞表面マーカープロフィールに基づいて該混合集団から神経幹細胞を単離する工程、および該単離された細胞の核をレシピエント細胞に移入する工程を含む。
【0115】
他の方法と同様に、単離された細胞は、レシピエント細胞へのその核の移入の前に遺伝子操作され得る。また、単離された細胞は、集団中の1つの細胞の核をレシピエント細胞に移入する前に細胞のクローン集団を得るために培養され得る。
【0116】
より詳細には、本発明の細胞の応用には、高スループット薬物スクリーニングがある。本発明の神経幹細胞とそれから得られるニューロン、神経膠などとの両方ともが、スクリーニングのために、例えば、細胞のいずれかの型で活性である因子を同定するために使用され得る。細胞または子孫は、脳内癌のモデルで使用され得る。細胞および子孫は、神経系(特に、CNS)の腫瘍から得られ得、そしてそれに由来する神経細胞およびそれらの子孫が、スクリーンにおいて使用され得る。スクリーンの性質は全てに対して明らかであると考えられるが、概要では、本発明の細胞またはそれらの分化した子孫を得る工程、試験因子の存在下で該細胞または子孫を培養する工程、および該細胞または子孫に関する該因子の効果を決定する工程を含む。特定のスクリーニング使用で、細胞が提供され、この細胞は、本発明の細胞または本発明によって得られる細胞であり、そしてEGFレセプターまたはさらなるEGFレセプターを発現するように改変されている。
【0117】
細胞は、スクリーンで使用される前に改変され得る。例えば、細胞は、遺伝子において変異を導入するように、または疾患(特に、神経細胞の疾患であり、パーキンソン病およびアルツハイマー病を含む)に関与していることが知られているもしくは関与の疑いのある遺伝子産物をコードする核酸を導入するように、遺伝子改変され得る。パーキン変異が導入され得る。アルツハイマー病に関与するタンパク質(例えば、APP)をコードする遺伝子が発現または変異され得、またはその発現を変更され得る。
【0118】
本発明の細胞は、細胞療法の細胞の供給源として有用である。それらは、患者からの幹細胞の供給源を提供し、これは、潜在的に核移入のための核の供給源であり得る。それらは、遺伝子療法(神経防御遺伝子療法を含む)の送達のために用いられ得る。一例の療法では、本発明の細胞は、神経膠細胞由来神経栄養因子(GDNF)を発現している。これらの細胞は、本発明に従いそして細胞を遺伝子操作することにより得られ得る。細胞は、損傷した神経回路の回復および/または脳機能の回復のために移植され得る。
【0119】
本発明の利点は、得られる細胞の純度にある。純粋な集団は、移植または培養において制御することがより容易であり、不均質な培養においては、より多くの細胞が神経膠運命に既に方向付けられているのでニューロンが得られる割合が低くなる。いくつかの療法は、ニューロンおよび星状細胞の両方を必要とする。他の療法は、神経膠細胞を必要とする(例えば、MSについては乏突起膠細胞、他の適用については星状細胞、遊走細胞)。
【0120】
非ヒト動物をクローン化する方法が本発明によって提供される。非ヒト動物をクローン化する1つの方法は、(i)該非ヒト動物から神経幹細胞を得る工程、(ii)該非ヒト動物と同じ種の卵母細胞を得る工程、(iii)該神経幹細胞の核を該卵母細胞に移入する工程、および(iv)(iii)で得られた細胞を該同じ種の雌に移植する工程を含む。したがって、本発明は、神経幹細胞の単離に基づく非ヒト動物クローニングの効率的な方法を提供する。このクローニング方法は、実質的に全ての非ヒト動物に対して適用できると考えられる。特に家畜動物(ウシ、ブタ、ヒツジ、ネコ、イヌ、ニワトリ、および他を含む)およびまた実験動物(マウスおよびラットを含む)に対してである。
【0121】
本発明により、初めて、ES細胞と同様に、二倍体のクローン原性のトランスフェクト可能な組織幹細胞の純粋な集団の増殖が可能になる。これは、種々の新規な実験機会を切り開く、幹細胞生物学において顕著な前進である。例えば、「神経幹細胞」のプロファイリングに関する以前の研究は、不均質な神経球培養(例えば、Suslovら)への信頼に大いに妥協している。さらに、NS細胞の放射神経膠特徴が、それらのインビボの対応物を定義している。放射神経膠の純粋な集団を培養および遺伝子操作できることはまた、幹細胞および特殊化された足場細胞の両方として機能し得る、これらの目立った細胞の細胞生物学を分析するための新規な機会を切り開く。最後に、異種細胞または細胞抽出物を含まない単純な培地でNS細胞を増殖できることは、自己再生が、増殖因子単独によって駆動され得、そしてこれまで幹細胞生物学者によって不可欠であると考えられていた複雑な微細環境ニッチを必要としないことを確立する。本発明は、細胞を用いる核再プログラミングおよび必要に応じた遺伝子操作への新規なアプローチを切り開く。
【0122】
本発明は、NS細胞からのニューロンの効率的な生成を提供する。本明細書中のプロトコルにより詳細に記載した方法において、ニューロンを得る方法は、(a)FGFレセプターのアゴニストの存在下でかつEGFレセプターのアゴニストの不在下で、神経幹細胞を培養する工程;および(b)その後、FGFレセプターのアゴニストの不在下でかつEGFレセプターのアゴニストの不在下で、該細胞を培養する工程を含む。例えばEGFが存在しない期間は、例えばFGFが実質的に除去された場合にニューロンになるように細胞を刺激することが見出されている。神経幹細胞は、好ましくは、単層培養で播種される。代表的には、NS細胞は、EGFを含まないがFGF−2を含む培地に移され、そしてある期間(言わば少なくとも2日間または少なくとも4日間)培養され、その後、FGF−2もまた培地から除去される(それを含まない培地に細胞が移されることを含む)。特定の方法では、細胞をEGFのないFGF−2中で1週間増殖させ、次いでFGF−2を除去する。FGFの除去により、培養中に幾らかの細胞死が生じるが、良好な割合が生存しニューロンを形成する。この方法は、NS細胞の誘導のために、本明細書中に記載の方法のいずれかへの必要に応じた追加として使用され得る。
【0123】
本発明の全ての局面の方法/使用は、インビボまたはインビトロのいずれかにて実施され得ることが理解される。
【0124】
本発明の方法および組成物は、添付の図面において図示される。
【0125】
図1は、ES細胞からの神経幹(NS)細胞の生成を示す;
図2は、NS細胞が種々のES細胞株および胎児前脳から誘導され得ることを示す;
図3は、NS細胞が成体脳内に取り込まれ分化することを示す;
図4は、ヒトES細胞または胎児由来NS細胞を示す;および
図5は、分化培地中で培養したNS細胞の電圧および電流クランプ条件下での電気活動を示す。
【0126】
より詳細に図面を参照して、図1は、ES細胞からの神経幹(NS)細胞の生成を示す:A.EGFおよびFGF−2中で増殖された接着NS細胞培養物(LC1)(a)は、ニューロン抗原(b)または星状細胞抗原(c)の発現を示さず、そして前駆体マーカーであるRC2(d)およびネスチン(示さず)の均一な発現を示している。LC1細胞は、血清の添加に際して免疫陽性星状細胞に分化し(e)、そして増殖因子の除去に際してニューロンを生成する(f〜h)。得られるニューロンの割合は、115継代後もなお総細胞の35%より多い(i)。B,クローンNS−5細胞は、Sox1神経系統選択によって生成された。aおよびcは、それぞれ1継代目および5継代目の神経前駆体の位相画像であり、bおよびdは、対応するSox1−GFP蛍光である。eは、Terasakiウェルへの播種1時間後の単一の細胞。fは、20継代目のクローン細胞株の位相差画像である。C,ES細胞および神経幹細胞/放射神経膠細胞マーカーについてのRT−PCR(46C、親ES株;P5、神経分化後5継代目;NS−5クローンNS株;LC1、NS集団(17継代目);脳、E12.5/E16.5マウス脳)。D,神経幹細胞/放射神経膠マーカーに対するNS−5免疫反応性。E,NS−5の星状細胞(a,b)およびニューロン(d,e)への分化とネスチン免疫反応性の喪失(c,f)。F,NS−5細胞のコロニー(a)は、増殖因子除去に際してニューロンを生成し(b)、そしてEGF/FGFの存在下で、RC2およびBLBPの均質な発現を保持し、GFAPに対する免疫反応性を喪失している(c,d)。G,NS−5の中期広がり(31継代目)。
【0127】
図2は、NS細胞が種々のES細胞株および胎児前脳から誘導され得ることを示す:NS細胞は、独立したES細胞株(CGR8、E14Tg2a)または一次皮質(Cor−1)および線条体(Str−1)組織から誘導した。A,幹細胞/放射神経膠マーカーのRT−PCR。B,転写調節因子についてのRT−PCR。C,ES由来株(CGR8−NS)および胎児由来株(Cor−1)は、形態学(a,f)および神経幹細胞/放射神経膠マーカー免疫反応性(b,c,g,h)ではLC1とは区別不能であり、各々はニューロン(d,i)および星状細胞(e,j)に分化し得る。
【0128】
図3は、NS細胞が成体脳内に取り込まれ分化することを示す:a〜h eGFPをレンチウイルス形質導入し、海馬(a,b)または線条体(c〜h)に移植4週間後のLC1 NS細胞の共焦点像。b,d,それぞれパネルaおよびcのより高い倍率の差込図。e,f,ニューロンマーカーTuJ(e,赤)またはMAP−2(f,赤)の共発現(黄)を示しているeGFP移植NS細胞(緑)の例。g,星状膠マーカーGFAP(赤)。h,神経前駆体マーカーネスチン(赤)。i,成体マウス線条体への移植の4週間後の移植片に由来するニューロン(MAP2)、星状膠(GFAP)、前駆体(ネスチン)、および増殖(Ki67)細胞の定量分析。データは、5匹の独立した動物由来の少なくとも500のeGFP+細胞の平均(±標準偏差)である。スケールバー:a,c,100μm;b,d,e,40μm;f〜h,20μm。
【0129】
図4は、ヒトES細胞または胎児由来NS細胞を示す。A,ヒトES細胞からの誘導。a,ヒトES一次培養物。b,神経ロゼット構造へのヒトES細胞の分化。c,NS増殖培地における9継代目。d,個々の細胞は放射神経膠形態を示す。e〜h,神経幹細胞/放射神経膠マーカーに対する免疫染色。B,ヒト胎児前脳からの誘導。i,皮質から生成した神経球。j,付着および成長。k,NS増殖培地における5継代目。l,放射神経膠形態。m〜p,神経幹細胞/放射神経膠マーカー。C,分化。q,TuJ陽性未熟ニューロン。r,GFAP陽性星状膠。
【0130】
図5は、以下を示す:A.分化培地における6日(a)、12日(b)、および30日(c)間のインキュベーション後の3つの異なるNS細胞からの異なる膜電位(−90mVの保持電位から−70mVと+40mVとの間)で得られる内向きおよび外向きの重畳電流追跡。B.(A)において示される電流記録が得られた直後に電圧クランプから電流クランプに切り替えることによる、(A)と同じ3つの細胞(a,bおよびc)における脱分極矩形電流パルスの注入後に得られた重畳電圧応答。破線は、−60mVの電圧レベルを表している。C.ラベルにより示されるように時間が増加している間に分化培地で培養した細胞からの−20mVで誘発された平均Na+電流。バーは、SEを示している。D.10mM Ba2+中およびTTXの存在下の−40mVおよび0mVで誘発された内向きの重畳電流;保持電位は−90mVであった。E.(D)と同じ細胞からの電流/電圧関係。
【0131】
本発明は、以下の実施例を用いて実証される。
【実施例】
【0132】
(実施例1−1)
(NS細胞のバルク集団の単離および培養)
接着単層培養での50〜70%の間のSox1陽性神経前駆体の効率的かつ一貫した生成を可能にするES細胞分化プロトコルが、近年確立された。これらの培養物内の神経前駆体(マウス由来)を単離し増殖しそして特徴付けるために、Sox1遺伝子座にターゲティングしたGFP−IRES−ピューロマイシンレポーターカセットを含む以前に生成された細胞株(46C細胞)を使用した(Yingら, 2003b)。ピューロマイシンを7日後に分化培養物に添加し、そして3日以内に、残りの細胞の95%より多くがGFP+神経前駆体となった。この時点で、細胞を、(ピューロマイシンなしで)EGF/FGF−2を添加したN2B27培地に再播種した。これらの細胞は迅速に増殖し、数継代内で均質な形態をとった。
【0133】
これらの46C神経前駆細胞(46C−NP)は、20継代より多くの間培養物中で継続して維持され、特徴的な二極性の形態を保持していた。これらの培養物は、ほとんど細胞死を示さず、そして高い播種効率を有し、倍加時間は約25時間であった。
【0134】
(実施例1−2)
(細胞株の培養)
クローン細胞株を単離するために、46C−NP細胞の5継代目バルク培養物からの単一の細胞を、マイクロウェルプレートの別々のウェル中に播種した。スコア付けした95の単一の細胞のうち15がコロニーに増殖し、そしてこれらのうち4株が10継代より多くにわたって継続して増殖し続けた。1つの株(NP5)は、バルク集団で観察されたのと同一である均質な形態を有する特徴的な二極性の細胞を示した。このNP5株は、無期限に培養物中で維持された(NP5 41継代目;5ヶ月以上)。
【0135】
(実施例1−3)
(NS細胞の特徴づけ)
バルク細胞集団およびクローン株の両方ともを特徴付けるために、種々のマーカーについて免疫細胞化学を用いた。予期されるように、細胞株の各々は、神経前駆体マーカーであるネスチンもしくはビメンチンに対して陽性であることが判明した。重要なことに、これらの細胞はまた、放射神経膠特異的マーカーであるRC2、3CB2および星状細胞特異的グルタミン酸輸送因子(GLAST)に対しても陽性であった。細胞の1%未満がGFAPまたはβIIIチューブリンのいずれかに対して陽性であった。このことは、これらの細胞の継代の間に、星状細胞またはニューロンへの自発的分化がほとんど生じていないことを示唆している。霊長類/ヒト細胞とは異なり、げっ歯類放射神経膠は、GFAPに対して陰性である。さらに、これらの細胞は、成体神経幹細胞に対して富化するために以前に使用されたSSEA−1、ルイスX抗原を認識する抗体に対して免疫反応性である。
【0136】
種々のマーカーを用いてRT−PCRを実施し、放射神経膠としてのそれらの同一性を確認した。4つのクローン株の全てならびにバルク集団は、免疫細胞化学と一致して、Oct4またはNanogに対して陰性であり(このことは、それらがES細胞ではないことを確証している)、一方、それらは、ネスチン、ビメンチン、およびGLASTを発現していた。さらに、各細胞株は、BLBP、放射神経膠マーカーの発現を示した。これらの細胞はまた、ムサシ−1およびプロミニンも発現している。
【0137】
興味深いことに、46C−NPのバルク培養物は、GFPレポーターにより評価されるように、Sox1の発現を徐々に喪失し、5継代目まで(約2週間)に、ほとんどの細胞が緑色ではなくなった。また、Sox1駆動GFP発現を示したクローン株はなく、RT−PCRは、これらの細胞がSox1を発現せず、代わりに関連のSoxB1クラスのタンパク質であるSox2を発現していることを確証した。まとめると、これらの結果は、種々のSox1発現神経前駆体が、ピューロマイシン選択ストラテジーを用いて単離され得ること、および前脳放射神経膠の特性を有するSox1−,Sox2+細胞が、単離およびクローン増殖され得ることを示唆している。
【0138】
(実施例1−4)
(ニューロンおよび神経膠へのNS細胞株分化)
NS細胞株により発現された分子マーカーは、それらが神経前駆細胞の型であることを確証している。これらの細胞が真の多分化能性幹細胞である(すなわち、ニューロンまたは神経膠のいずれかとして分化し得る)ことを確認するために、細胞の潜在能を試験するために設計した種々の条件を試験した。
【0139】
神経前駆体の以前の研究は、マイトジェンの除去および/または血清もしくは他のサイトカインの添加を包含するプロトコルによって、分化を誘導した。本発明の場合では、EGF、FGF、または両方を、プラスチック上で培養した増殖中のNP5および46C−NP細胞から除去した。EGFおよびFGFの両方を同時に除去することにより、24時間以内に急速かつ広範囲の細胞死が生じた。比べて、FGF単独での培養は、3日間かかって細胞死に至った。EGF単独での培養では、細胞死も分化も生じなかったが、細胞増殖は減少した。したがって、明らかに、EGFは、プラスチック上で培養したNS細胞に対して必須の細胞生存シグナル(部分的にFGFシグナル伝達により補償される)として作用している。
【0140】
サイトカインの除去後の細胞の増殖に関する血清の効果もまた試験した。このようにして処理した細胞は、EGFの不在下でさえも生存し、そして同期様式で迅速に分化し、これにより細胞の100%が、GFAPに対して陽性およびネスチンに対して陰性に染色した大きな扁平の星状細胞を獲得した。したがって、増殖集団内の全てのNS細胞が、星状細胞として分化し得る。この効果は、プラスチック上のEGF/FGF除去後の血清の不在下でのBMP4の添加によって模倣され得る。CNTFおよびTGF−βは、星状細胞形態が異なりそしてより多くの細胞死が初期にあったが、BMP4と同様に挙動した。BMP、CNTFおよびLIFは各々、一次皮質前駆体から星状細胞運命を誘導することが示されている(Grossら, 1996; LillienおよびRaff, 1990; Nakashimaら, 1999)。これらの研究と一致して、BMP−4または血清処理でのId遺伝子(>30倍)の迅速な誘導が見られた(データは示さず)。
【0141】
ニューロン分化を誘導しようとして、ラミニン処理ディッシュでのEGFの除去を試験した。プラスチック上での細胞の培養で見られた細胞死を回避するために、細胞を、FGFを含むがEGFを含まないラミニン基材上に播種した。プラスチックまたはゼラチン上でのこれらの条件で見られたPCDは生じておらず、細胞は生存していた。細胞の形態が、より拡張された二極性の突起に変化しており、これは、放射神経膠の特徴的なエンドフィートを有する。これらの細胞は、(BrdU取り込みによって)増殖において激烈な減少を示したが、放射神経膠マーカー(RC2、ビメンチン、ネスチン)を維持しており、分化しておらず、ほんの少ない割合のニューロンまたは星状細胞のみが高密度の領域で見られた。ニューロン分化を誘導するために、6日後、培地をNSA/N2 +FGF2からNSA/B27(FGF2なし)に変更した。このことにより、MAP2およびβIIIチューブリン抗体染色により判断されるように約40〜60%の細胞のニューロン分化が促進された。これらのニューロンは、GABA免疫反応性によって評価されるようにGABA原性(GABAergic)であったが、星状細胞(GFAP)はほとんど存在しなかった。これらの結果は、ニューロン分化の妨害におけるFGFの以前に記載された役割と一致している。
【0142】
各細胞株が、ES細胞と同様に首尾よく凍結されそして融解され得ることもまた見出された。
【0143】
さらなる試験において、単一の細胞から始まる分化を試みた。このクローン発現および分化は、細胞の全てがニューロンを形成する能力を有することを示した。
【0144】
(実施例1−5)
(遺伝子選抜ストラテジーを用いない任意のES細胞株からのNS細胞の単離)
NP5を単離するために用いられるN2B27培地は、ES細胞の神経前駆体への変換に対してもともと最適化されており、このため、ES細胞および神経前駆体の両方の良好な生存が可能になった。したがって、ピューロマイシン選択がなければ、ES細胞および非神経細胞型のキャリーオーバーのために、EGFおよびFGF−2を用いて46C−NP細胞を効率的に増殖することができなかった(データは示さず)。これを克服しそして他のターゲティングされないES株からの放射神経膠細胞の生成を可能にするために、神経前駆体を生存および増殖させるが他の細胞型はそうではない他の基本培地の組合せを試験した。
【0145】
市販の培地であるNS−A培地(Euroclone)を用いて、7日目での46C ES細胞単層分化の再播種が、細胞の塊/球の形成ならびに非神経細胞の細胞死を生じることが分かった。引き続いて、これらの細胞塊の付着が生じ、そして細胞の均質な集団が大きくなった。この継代可能な細胞集団(>75継代)のさらなる特徴づけにより、ピューロマイシン選択ストラテジーを用いて以前に見られた発現されたマーカーの同一のプロフィールが明らかになった。したがって、細胞は神経前駆体マーカー(ネスチン、ビメンチン)に対して陽性であり、また放射神経膠マーカー(RC2、GLAST、BLBPおよびPax6)に対しても陽性であった。46C−NP細胞は、形態においてほんのわずかな差異を有しそしてマーカー遺伝子の差異がないことがかつて確立されているN2B27またはNSA培地のいずれにおいても、同様に挙動した。
【0146】
このプロトコルを用いて、6つの他のES株からの細胞株を単離した:CGR8、E14T、Oct4−GIP、S11、R1およびV6.5。これらの細胞株の各々は、同様の形態および発現プロフィールを有し、そして広範に継代され得る。
【0147】
(実施例1−6)
(NS細胞の移植)
インビボでNS細胞の能力を試験するために、それらを、胚性および成体CNSの両方へ、ならびに腎臓嚢移植片に移植した。
【0148】
エレクトロポレーションをNP5において試験した。それらは、矩形波エレクトロポレーターを用いて効率的にエレクトロポレートされることが見出された。細胞はまた、リポフェクタミン添加試薬を用いてトランスフェクト可能である。これは、マウスに用いられる全ての遺伝子操作が利用可能になるので、大きな利点である。
【0149】
移植した細胞の迅速な評価を可能にするために、eGFPマーカー遺伝子を保有するレンチウイルス粒子で46C−NPを形質導入した。感染は非常に効率的であり、細胞のほぼ95%が首尾よくマーキングされ、eGFPシグナルは継代と共に強くかつ安定であった。レンチウイルス感染の使用により、トランスジーンは安定に組み込まれ、そしてシグナルは、移植した細胞の長期分析に安定なままとなった。
【0150】
胚性脳(未熟神経細胞を持続しそして分化を方向付けることが可能な分子および因子の全てを含む環境)での移植後の細胞の挙動を評価した。E14.5マウス胚をレシピエントとして用い、Magrassiおよび共同研究者(Magrassiら, Development 1999)によって以前に記載された手順に従って、100,000個の細胞を2μLの最終容量中に再懸濁した。細胞は、移植後良好に生存し(概算により、移植片中で約20000個の細胞であった)、eGFPシグナルは、容易に検出可能であり、そしてそれらは、移植後に初期の時点で既に遊走活動を提示した。移植後の種々の時点(4日、7日、2週間、および1ヶ月)で移植した細胞が獲得した運命を分析した。4日目および1週間の時点で、細胞の大部分は、ネスチン免疫反応性によって示されるようになお未熟であったが、23%は、ニューロンマーカーTuj−1を発現し、そして16.3%は、神経膠マーカーGFAPを獲得していた。これらのデータは、移植したNSが、多分化能性NS細胞から予期されるように、インビボでニューロンおよび神経膠の両方を生成し得ることを示している。
【0151】
NS細胞を、成体線条体にも移植した。これらの移植体では、細胞は良好に生存し(いずれにせよ生存は、胚性移植片におけるよりも低い)、そしてニューロンおよび神経膠の両運命の方向に分化した。移植後2週間目に実施した定量分析は、細胞の43.3%がニューロン特異的マーカーTuj−1を発現し、一方、26.6%が神経膠マーカーGFAPに対して免疫反応性を提示したことを示した。少ない割合の細胞(11.1%)が、ネスチンの発現により示されるように未熟な表現型を保持していた。
【0152】
腎臓嚢へのNP5−GFP細胞は、奇形腫を生じなかった(n=4、データは示さず)。
【0153】
(実施例2)
(実施例2−1)
(方法)
(マウス細胞の培養および分化)
ES細胞および神経分化は、YingおよびSmith, 2003によって詳述されている。LC1と命名したNS細胞および他のES細胞由来NS細胞を、N2および10ng/mlのEGFおよびFGF−2の両方を添加したNS−A培地(Euroclone)(NS増殖培地)においてコーティングされていないプラスチック上で7日目の神経分化単層培養物を再播種することにより、通常通りに生成した。細胞は凝集体を形成し、引き続いて付着しそしてNS細胞を大きくした。7日目に0.5μg/mlのピューロマイシンを分化接着培養物に添加した後に生成された細胞を、46C−NS細胞と命名した。3日後に、細胞を、ピューロマイシンのない10ng/mLのEGFおよびFGF−2(Peprotech)の両方を含むN2B27培地において、コーティングされていないT75フラスコ中に再播種した。クローン株NS−5を、限定希釈によって96ウェルマイクロウェルプレート(Nunc)中に単一の細胞を播種することにより生成した(播種1時間後に単一の細胞をスコア付けした)。一次培養物を、E16.5マウス胚の皮質/線条体から標準プロトコルを用いて生成し、そして0.1%ゼラチンで処理したフラスコ上に付着させた。次いで、Cor−1およびStr−1細胞を、NS増殖培地を用いてゼラチン上で増殖させた。星状細胞分化のために、NS細胞を、1%ウシ胎児血清または10ng/ml BMP4(R&D System)を添加したNS−A培地中に1×105細胞/ウェルで、4ウェルプレート上に再播種した。ニューロン分化のために、5×104NS細胞を、FGF−2単独を添加したNS−Aにおいてポリオルニチン/ラミニン処理ウェル中に播種した。7日後、培地を、増殖因子を含まないB27(Gibco)を添加したNS−Aに切り替えた。クローン分化のために、NS−5またはCor−1培養物からの1000細胞を、ラミニンで前処理した10cmプレートに播種し、EGF/FGF−2中で12日間増殖させ、そして上記のようにインサイチュで分化させた。
【0154】
(NS細胞の特徴づけ)
免疫細胞化学を、適切なTRITCまたはFITC二次結合体とDAPIでの核対比染色とを用いて実施した。以下の希釈で一次抗体を用いた:ネスチン(1:10)、ビメンチン(1:50)、Pax6(1:5)、3CB2(1:20)、RC2(1:50)(DSHB);TuJ(1:200)(Covance);GFAP(1:300)(ポリおよびモノ、Sigma)、MAP2(1:200)(ChemiconおよびBecton Dickinson);NeuN(1:200)、GABA(1:200)、Gad65/67(1:200)(Chemicon);シナプトフィシン(1:200)(Sigma);Olig2(1:5000)(H. Takebayashi);Emx2(1:2000)(A. Corte);BLBP(1:500)(N. Heintz);プロミニン/mAb13A4(1:200)(W. Huttner)。陰性コントロールはES細胞、分化したNS細胞または二次単独であった。RT−PCRのために、全RNAをRNeasyキット(Qiagen)を用いて抽出し、そしてcDNAをSuperscript II(Invitrogen)を用いて生成した。β−アクチン(25サイクル)を除いて、全てのマーカーについてPCRを30サイクル実施した。中期広がりのために、細胞を5mlの0.56% KClで20分間処理し、氷上でメタノール:酢酸(3:1)中に15分間固定し、スライドガラス上に広げ、そしてTOPRO−3(Molecular probes)で染色した。
【0155】
(ヒト胚および胎児培養物)
インフォームドコンセントのもとでのヒト組織に関する研究は、Research Ethics Committee of Lothian Health Boardによって認可された。凍結した余剰のヒト胚が、Human Fertilisation and Embryology Authorityにより発行されたライセンスR0132下での研究のために贈与された。Polkinghorneガイドライン下の研究のために同意のもとに選択中絶したカーネギー19/20期の胎児からヒト皮質を切り出した。
【0156】
(移植)
Magrassiら, 1998に記載により胎児手術を実施した。ガラスキャピラリーを用いて、1μLのHBSSの容量中に5×104個の細胞を、透照下で曝露したE14.5 Sprague Dawleyラット胎児の終脳小胞に注入した。注入された胎児を、満期まで発生のために腹腔内に戻した。分娩後、移植後7日目(出生後日数(P)1、n=16)および5週目(P30、n=8)で動物を屠殺した。成体移植のために、129またはCD1マウスをKopf定位枠内に置き、そして5μLのHBSS中に懸濁した2×105個のNS細胞を線条体(n=22)または海馬(n=21)に注入した。移植されたマウスを2週後(n=16)および4週後(n=10)に屠殺し、そして4%パラホルムアルデヒドを経心臓にて灌流した。低温切片(16μm)を以下の抗体で染色した:(マウス):NeuN(1:100)およびKi67(1:10)(Chemicon)、MAP2(1:200;Becton Dickinson)、ネスチン(1:5;Ron McKay);(ウサギ):βIIIチューブリン(1:500;Covance);GFAP(1:200;Dako);二次抗体、Texas Red(Vector)(Jackson ImmunoResearch)およびAlexaFluor 488(Molecular Probes)。切片を変退色防止溶液中で保存し、そしてNikon TE2000-S ECLIPSEおよびBiorad Radiance 2100共焦点顕微鏡で分析した。
【0157】
(実施例2−2)
本発明者らは、ES細胞の単層分化を7日間誘導し、次いでEGFおよびFGF−2を添加した基本培地(NS−A+N2)に再播種した。これらの最少条件(ES細胞生存に対して非許容)下で生存している細胞が主として結合して浮遊塊となる。3〜5日後、これらの凝集体を採取し、そして新鮮な培地に再播種した。それらは、2〜3日以内に付着し、そして二極細胞の形態的に均質な集団に大きくなった(LC1と命名)。継代に際して、LC1細胞は、接着培養物として増殖し続け、しばしば、格子状網を形成した。それらは、連続的かつ迅速に増殖され得、倍加時間は約24時間である。LC1細胞は、神経前駆マーカーのネスチンおよびRC2を提示するが、星状細胞分化マーカーのGFAPまたはニューロン抗原の発現は無視し得る程度である(図1A)。血清またはBMPへの曝露に際して、LC1細胞は、48時間以内に代表的な星状細胞形態をとり、そして引き続き、GFAPを均一に発現する(図1A,e)。対照的に、ニューロン突起を有する細胞は、EGFなしで5〜7日間ラミニン上に再播種しそしてFGF−2を除去した後に出現する。これらの細胞は、ニューロンマーカーのIII型β−チューブリン、MAP2(図1A,f,g)およびneuN(示さず)を発現している。ほとんどのニューロンは、GAD67(図1A,g)およびGABA(示さず)に対して染色し、そして7日目まで、亜集団が、成熟マーカーのシナプトフィシンの発現を示す(図1A,h)。115継代後でさえも、多数のニューロン(>35%)が生成される(図1A,i)。LC1細胞が後期継代で二倍体染色体内容物を保持しているという所見(示さず)とともに、このことは、自己再生神経幹(NS)細胞の存在を確証している。
【0158】
(実施例2−3)
細胞凝集がNS細胞の生成に必須であるか否かを決定するために、本発明者らは、誘導プロセスを通して細胞付着を維持した。このために、本発明者らは、GFPirespacレポーター/選択カセットがSox1遺伝子(神経分化の特異的マーカー(Aubertら, 2003)である)に組み込まれている46C ES細胞を用いる系統選択(Liら, 1998)を利用した。分化誘導後の一過性のピューロマイシン選択により、残余ES細胞のない神経前駆体の精製された集団を得た(Stavridisら, 2003)(図1B a,b)。次いで、FGF−2およびEGFを、富化培地中でSox1発現神経前駆体に与えた。この条件で細胞は接着したままであった。細胞異質性は3〜4継代にわたって減少した。二極細胞の数が累進的に増大し、広範囲に格子を形成し始めたからである。興味深いことに、Sox1の発現はこの段階で喪失したが(図1B c,d)、細胞は、Sox2およびネスチンに対してなお陽性であった。神経幹(NS)細胞の存在を確立するために、単一の細胞をTerasakiウェルに単離し、そして接着培養として増殖させた(図1B,e,f)。まず、同様の形態および増殖特性の5つのクローン株を、バルクLC1集団に誘導した。これらの細胞は、分化多能性因子のOct4およびNanog、ならびにまた初期神経マーカーのSox1の検出可能な発現を欠いていたが、汎神経上皮マーカーのSox2およびネスチンを保持していた(図1C)。したがって、NS細胞は、連続接着培養によってSox1陽性初期神経外胚葉前駆体から生成された。
【0159】
(実施例2−4)
クローンNS−5をさらに詳細に試験し、そしてPax6、Glast、およびBLBPのmRNAを発現していること、および、RC2、ビメンチン、3CB2、SSEA1/Lex1、およびプロミニンに対して免疫陽性であることを見出した(図1D)。このマーカーセットは、神経原性放射神経膠に対する診断に有用であるとみなされており、神経系の発生の間のニューロンおよび星状細胞の両方の前駆体である(Campbellら, 2002; Hartfussら, 2001)。クローン化されていないLC1細胞と同様に、NS−5細胞は、星状細胞およびニューロン分化に対してコンピテントであった(図1E)。EGF+FGF−2にクローン密度で播種したNS−5細胞は、二極細胞のコロニーを生じた。全てのコロニーが、事実上全ての細胞でのRC2およびBLBPの発現、ならびにGFAPの不在を示した(図1F,c,d)。これらのサブクローンを選抜し、そして連続して増殖させた。NS培養内でのニューロン分化可能な細胞の頻度を決定するために、本発明者らは、再度、NS−5細胞をクローン密度で播種し、EGF/FGF−2中で12日間、次いでFGF−2単独で5日間、次いでさらに7日間増殖因子なしで増殖させた。全てのコロニー(126/126)が、TuJ陽性細胞を生成した(図1F,b)。これらのデータは、NS培養物中の全てのコロニー形成細胞が、ニューロン分化に対してコンピテントであったことを示した。最終的に、LC1と同様に、NS−5細胞は、二倍体染色体相補体を維持しており(図1G)、そして複雑な細胞微細環境の必要なく自己再生する非形質転換クローン神経幹(NS)細胞株であることを表していた。
【0160】
(実施例2−5)
無血清単層誘導プロトコルがNS細胞生成に予め必要であるか否かを評価するために、ES細胞を、胚様体形成および血清含有培地中のレチン酸への曝露によって分化を誘導した(Bainら, 1995)。凝集体を、G418を用いるSox2系統選択(Liら, 1998; Billonら, 2002)に48時間供し、次いで血清なしでFGF−2およびEGFの存在下で再播種した。付着した後、Sox2陽性、ネスチン陽性の細胞が増殖した。これらの細胞は、NS細胞に代表的な二極性の形態および格子状の増殖を提示し、さらに多重継代後に星状細胞およびニューロン分化能を有した(データは示さず)。このように、NS細胞が、胚様体から誘導された。
【0161】
(実施例2−6)
3つの独立したES細胞単離株E14TG2a、CGR8、およびR1から、LC1について記載したような系統選択を行わずに単層誘導を用いてNS細胞を誘導した。試験したNS株は全てが、細胞の少なくとも95%においてネスチンおよびRC2を発現した。CGR8およびE14TG2a由来NS細胞のより詳細な研究により、フルパネルの放射神経膠マーカー(図2A)、神経前駆体マーカーSox2およびSox3、ならびにbHLH転写因子Olig2およびMash1(図2B)を示した。Sox1がダウンレギュレートされたがSox2は維持されたことは、これらの転写因子の推定の決定的機能(Pevnyら, 1998)を考慮して、これらのNS細胞の顕著な特徴であった。このように、Sox1は、全ての神経外胚葉前駆体をマークしているが、Sox2が重要な役割を果たしていると考えられる幹細胞においては、これは保持されなかった。NS細胞はまた、Emx2を発現していた。Emx2は、神経前駆細胞の増殖に関与している(Heinら, 2001; Galliら, 2002)。試験した全てのNS培養物は、形態学および免疫染色の両方によって評価される星状細胞およびニューロンの分化を受けた(図2C)。
【0162】
(実施例2−7)
それらの放射神経膠への明らかな関係を考慮して、本発明者らは、NS細胞が、エクスビボ増殖へのES細胞の前適応から生じるか、または胎児神経組織から誘導され得るかを調べた。E16.5胎児脳からの一次胎児CNS細胞は、増殖因子を添加した基本培地ではプラスチックへの接着はわずかであり、自発的に凝集体を形成した。6〜7日後、これらの凝集体は、ゼラチンコーティングしたプラスチック上に定着した。14日後、成長体をトリプシン処理し、そしてゼラチンコーティングしたプラスチック上に播種した。3つの別個の実験において、NS細胞と形態学的に同定可能な細胞が増殖し、そして引き続き増殖させて、連続細胞株になった。これらの胎児脳誘導物は、ES細胞由来NS細胞と同じ放射神経膠および神経原性マーカーを発現し(図2A、B)、そして一致したmRNAプロフィールを示した。それらは、同様に、星状細胞およびニューロン分化に対してコンピテントであった(図2C)。NS−5について記載したように、皮質誘導Cor−1細胞を単一の細胞として播種し、次いでコロニーを引き続く増殖因子除去に供した。全てのコロニーが、TuJ陽性ニューロンを生成していた。このことは、Cor1培養物中の全てのクローン原性細胞が神経原性であることを示していた。Cor−1細胞もまた、個々の細胞から容易にサブクローン化されそして連続的に増殖された。これは、自己再生を示す。このように、NS細胞が胎児脳から誘導され、そしてこれは、ES細胞由来NS細胞の重要な特性を共有していた。
【0163】
ほとんどのNS細胞は、放射神経膠であると認められる、伸長した二極性の形態、平板状の伸長部、エンドフィートおよび卵形の核(Rakic, 2003)を有していた。短い伸長部を有する扁平状の緻密な細胞もまた存在していた。中期マーカーであるリン酸化ヒストンH3に対する免疫染色により、緻密な細胞は、有系分裂しているものであることが示された。時間差ビデオ顕微鏡により、細胞分裂前に形態が活発に変化していることが確認された。さらに、この時間差により、NS細胞が、運動間の核移動を受けていることが明らかになった。これは、インビボでの神経上皮および放射神経膠細胞の十分に特徴付けられた特徴である。
【0164】
したがって、NS細胞は、神経原性放射神経膠の連続的に増殖可能なインビトロアナログであった。
【0165】
(実施例2−8)
凍結/融解した40継代目のマウス神経球を、NS増殖培地中でゼラチンコーティングしたプラスチックに付着させた。NS細胞と区別不能な二極細胞が生じた。これらの細胞は、均一なRC2陽性GFAP陰性の集団として連続的に増殖され得、次いで星状細胞またはニューロンへの分化が誘導され得る。
【0166】
(実施例2−9)
本発明者らは、マウス脳への移植の際のNS細胞の挙動を調べた。レンチウイルスeGFP発現ベクターを用いて形質導入したES細胞由来LC1細胞を、E14.5での子宮内注入により発生中の脳に導入した(Magrassiら, 1998)。出生後、動物を屠殺し、そして脳切片のeGFP陽性細胞の存在を調べた。NS細胞子孫は、種々の脳領域に遊走していた。免疫組織化学分析により、eGFPと、前駆体マーカーネスチン、ニューロンマーカーTuJ、NeuN、およびMAP2と、ならびに数は少なくなるがGFAPとが共発現していることが明らかになった。NS細胞を成体マウス線条体にも注入した。この場合、GFP陽性細胞は、注入部位の近辺に局在したままであった。移植4週間後、GFP発現細胞の44.4±5.7%がニューロン形態を有しそしてMAP2に対して免疫陽性であり、37.4±6.1%がGFAPを発現し、そして4.2±1.9%がネスチンの発現を保持していた(図3)。増殖マーカーKi67は、GFP陽性細胞の1.0±0.6%でのみ検出された。このことは、NS細胞がインビボで細胞周期から回収されたことを示している。このことと一致して、本発明者らは、移植の1ヵ月後に調べた全部で35の脳において、制御されない増殖または腫瘍形成の組織学的証拠がないことを認めた。さらに、マウス腎臓嚢に移植されたNS細胞は、増殖せず、奇形腫も生じなかった。これらのデータは、NS細胞が胎児脳および成体脳の両環境において生存しそして分化し得ること、およびES細胞(Brustleら, 1997)とは異なり、それらは奇形腫を生じないことを示していた。さらに、この比較的高い頻度でのニューロン分化は、継代した神経球の移植片(Rossiら, 2002)とは非常に対照的である。
【0167】
(実施例2−10)
最後に、本発明者らは、同様のNS細胞が、ヒト供給源から単離され得るか否かを調べた。贈与された余剰胚からヒトES細胞を誘導する過程において、本発明者らは、培養5〜6週後に、神経上皮細胞に代表的であるロゼット状構造への広範な分化を認めた。これらの細胞をNS増殖培地に移した。さらに3〜4週後、NS細胞に類似の二極細胞がこれらの培養物から出現し(図4A)、そして5ヶ月間連続的に培養した。本発明者らはまた、選択中絶からカーネギー19〜20期のヒト胎児皮質組織を確保した。解離した細胞はまず浮遊凝集体を形成した。マウス胎児脳からのNS細胞の誘導と同様に、その7日後に再播種し、そしてゼラチンコーティングしたプラスチックに付着させた。増殖している培養物が樹立された(図4B)。ES細胞および胎児組織の両方からのヒトNS培養物は、二極細胞が付随した扁平状の細胞の存在によって特徴付けられた。しかし、全ての細胞が、未熟前駆体マーカーであるネスチン、ビメンチン、および3CB2を発現していた(図4B)。時間差モニタリングによって、2つの細胞形態が形成されかつこれらは互換性であることが確証された。これらのヒト細胞はまた、低レベルのGFAPを提示し、これは、放射神経膠中のヒトGFAPプロモーターの活性(Rakic, 2003; Malatestaら, 2000)と一致した。それらは、マウス細胞よりもゆっくりと増殖した。倍加時間は数日間であった。EGFおよびFGF−2を引き続き除去した後、それらは、未熟なニューロン細胞を生成しているようであった(図4C)。強いGFAP免疫反応性を有する代表的な星状細胞形態の細胞が、血清中の継代後に生成された(図4C)。
【0168】
(実施例3)
特定の処理後、これらの細胞が、成熟した機能的なニューロンに効率的に転換し得るか否かを電気生理学的観点から知るために、インビトロでの分化の間、培養物におけるNS細胞の電気生理学特性を、パッチクランプ技術のホールセル改変型を用いることにより調べた。
【0169】
(電気生理学記録用溶液)
電極と細胞との間のシールを、以下からなるバス溶液中で確立した(ミリモル/lで表す):155 NaCl、1.0 CaCl2、1 MgCl2、3.0 KCl、10 グルコース、10 HEPES/NaOH(pH7.4)。ホールセルコンフィギュレーションを確立した後、電流クランプ記録および電圧クランプ中の総電流記録のために、ピペット充填溶液は以下を含んだ(ミリモル/lで表す):128 KCl、10 NaCl、11 EGTA、4 Mg−ATP、10 HEPES/KOH(pH7.4)。電圧クランプ条件下での電圧ゲートNa+チャネルの研究のために、パッチピペットを以下で満たした(ミリモル/lで表す):130 CsCl、10 NaCl、20 TEA−Cl、10 EGTA、2 MgCl2、4 Mg−ATP、10 HEPES/CsOH(pH7.4)。そして細胞外溶液は以下を含んだ(ミリモル/lで表す):130 NaCl、2 CaC12、2 MgCl2、10 グルコース、5 テトラエチルアンモニウム−Cl、CdCl2 0.2、10 HEPES/NaOH(pH7.4)。電圧ゲートCa2+チャネルの研究のために、パッチピペットを以下で満たした(ミリモル/lで表す):120 CsCl、20 TEA−Cl、10 EGTA、2 MgCl2、4 Mg−ATP、10 HEPES/CsOH(pH7.4)。そして細胞外溶液は以下を含んだ(ミリモル/lで表す):130 NaCl、10 BaCl2、10 グルコース、5 テトラエチルアンモニウム−Cl、10 4−AP 1、TTX 10−3、HEPES/NaOH(pH7.4)。
【0170】
(パッチクランプ記録)
イオン電流を、Axopatch 200Bパッチクランプ増幅器(Axon Instruments Inc., Burlingame, CA)によって室温(20〜24℃)でパッチクランプホールセル配置(19)を用いて電圧クランプ条件下で記録し、そしてIBM互換PCとインターフェースしたDigidata 1322A A/D変換器(Axon Instruments Inc., Burlingame, CA)を用いて、26〜100μsecのサンプリング間隔でデジタル化した。刺激、データの取得、およびデータ分析は、以下のソフトウェアパッケージを用いて実施した:pClamp 9(Axon Instruments Inc., Burlingame, CA)およびORIGIN 6(Microcal Software Inc., Northampton, MA)。電圧クランプ実験のために、まず、漏洩および容量の電流の線形成分をアナログサーキットリによって減少させ、次いでP/N法でほぼ完全にキャンセルした。パッチピペットをホウケイ酸ガラス管から作製し、火入れした。ピペットは、内部溶液で満たしたときに3〜4MΩの最終抵抗を有していた。電流は5KHzでフィルタリングした。
【0171】
図5Aは、内向き(Na+)および外向き(K+)の両電圧ゲートイオン電流の分離に適したバスおよびピペット充填溶液を用いた、インビトロ分化の異なる段階での3つのNS細胞(それぞれ分化培地中で6日、20日、および30日間培養)における脱分極試験電位に対するホールセル電圧クランプ工程の間に得られた電流記録を示す。電流追跡の簡単な観察から、相当に大きな外向きの電圧ゲート電流がインビトロ分化の初期段階で既に存在していることが明らかである(6日、トレースa)。この電流は、5mMテトラエチルアンモニウム−Clを含む細胞外生理食塩水の適用によってブロックされ、遅延整流K+電流の特徴を有する。その振幅は、分化の後期段階でわずかにのみ増大した(20〜30日、それぞれトレースbおよびc)。対照的に、内向き電流の振幅は、6日後では無視し得る程度であるが、分化培地への曝露時間の増加によって劇的に増大している。図5Bは、図5Aに示した同じ細胞における電圧クランプから電流クランプモードへの切り替え後に、約−80mVの保持電位からの70〜300pAの間の矩形脱分極電流刺激の細胞内注入後に誘発された電圧応答を示す。確かに、電圧ゲート内向き電流の振幅の増大は、分化している細胞が活動電位を誘発する能力を反映している。実際、6日間のみ分化剤に曝露されて無視し得る程度の内向きを示している細胞は、再生電圧応答を誘発することができなかった(図5Bに(a)で示したトレース)。対照的に、比較的速い脱分極速度を有するオーバーシュート作用電位が、30日間分化培地で培養され(図5Bに(c)で示したトレース)そして大きな内向き電流を提示する(図Aのトレースc)細胞において誘発され得た。中間型の状況(不全活動電位を有する)が、分化剤で20日間処理され(図5Bに(b)で示したトレース)そして中位の内向き電流を提示している(図Aのトレースb)細胞で見られた。この予備分析から、これらの細胞の興奮特性が、内向き電圧ゲートコンダクタンスの大きさに対して厳密に相関していることが分かる。分化培地への曝露時間の関数としてのこのコンダクタンスの定量分析のために、内向き電流は、分化の異なる段階の細胞を用いそして電圧ゲートNa+チャネルの活動の研究に特異的な細胞内および細胞外生理食塩水を適用して、誘発される(方法を参照のこと)。細胞分化の任意の時間で、速い不活性化内向き電流は、選択的Naチャネルブロッカーであるテトロドトキシン(1μM)によって完全にブロックされ、そして−20〜−10mVの間の試験電位でピークとなった。これは、ニューロンにおける電圧ゲートNa+電流の代表的な特徴を示している(データは示さず)。図5Cには、分化培地への曝露時間の関数として−20mVでのNa+電流振幅の発生が示される。興味深いことに、Na+コンダクタンスの増大は、分化培地への細胞曝露の増大と十分に相関している。確かに、平均して、Na+電流振幅は処理30日以内で約10倍増大している(最初の5日間の55±14pA(n=17)から25日より長い間の−434±135pA(n=13)へ)。同じように、電流クランプ条件下のNa+電流により誘発された再生電位(閾値とピーク値との間で測定されたΔV)は、インビトロ分化の最初の15日間(n=6)は0から+20mVの間であったが、処理が25日より長ければ、+30から+70mVの間の値に達した(n=6)。全体では、分化培地で25日より長く処理されたNS細胞で見られた興奮特性および原電圧ゲートNa+コンダクタンスの特性は、それらの成体表現型に発達しているニューロンに代表的である。以前の結論を立証する別の特徴は、少なくとも7日間またはそれより長く分化培地に曝露した後に試験した細胞のほとんどにおける電圧ゲートCa2+チャネルコンダクタンスの存在である。図5Dは、10mM Ba2+のバス中に入れた同じ細胞からの示した試験電位に対する膜脱分極により得られるサンプル追跡を示す。−40mVで誘発された速い活性化およびやや速い不活性化(Δh=21ms)電流成分は、ニューロンLVA Ca2+チャネル電流(CarboneおよびLux, 1987)を暗示している。対照的に、0mVで誘発されたBa2+電流は、ゆっくりとした(Δh=73ms)不完全な不活性化を提示し、ニューロンHVA Ca2+チャネル電流の代表的な特徴を有する。この細胞における2つの別個(LVAおよびHVA)のCa2+チャネルコンダクタンスの存在は、図5Eの電流−電圧関係によって確証される。平均して、LVA電流は−40mVでピークであるが、HVA電流についてI/V関係は0mVでピークであった。HVA Ba2+電流は、27細胞のうち19で検出可能であったが、LVA電流成分は、HVA Ca2+電流を既に発現している細胞の60%で測定された(n=13)。
【0172】
このデータは、本発明の神経幹細胞から生成されたニューロンが機能し得ることを示している:それらは、活動電位を刺激し得、これは、活性ニューロンの顕著な特徴である。
【0173】
したがって、本発明にしたがって、本発明者らは、所定のNS細胞をES細胞および胎児脳抽出物の分化した子孫として誘導しそして均質に増殖した。NS細胞は、簡単な接着単層培養でクローン増殖し、そして二倍体を維持した。増殖の延長後、それらは、インビトロおよび成体脳への移植の両方で、ニューロンおよび星状細胞に効率的に分化した。NS細胞はまた、インビトロで乏突起膠細胞も形成した。NS細胞は、放射神経膠の形態および分子特徴、ニューロンおよび星状細胞の胎児前駆体、を均一に発現していた。本発明者らは、マウスおよびヒトの両方の胎児脳から接着NS細胞株を樹立できた。
【0174】
(実施例6)
以下のプロトコルを用いて、NS細胞を、マウスES細胞および胎児皮質から得た。誘導されたNS細胞は、放射神経膠マーカーを均一に発現していた。CGR8 ES細胞またはE16胎児皮質(内部参照:Cor−1およびクローン誘導体Cor−1.3)から特異的に誘導されたNS細胞を、免疫化学により指示マーカーの発現について分析した。ハイパワーでの試験は、放射神経膠マーカーが、ほとんど全ての細胞において各々発現されており、一方、均一にGFAPに対して陰性であったことを示した。
【0175】
(実施例7)
以下のプロトコルを用いて、NS細胞を、増殖させたマウス胎児前脳神経球から誘導した。長期胎児神経球培養物(40継代)由来のNS株は、ES由来NS株と同一の形態を示し、神経前駆細胞/放射神経膠マーカー免疫反応性を発現し、そしてニューロンおよび星状細胞に分化し得た。これは、新鮮な胎児神経球から得られたNS細胞が、凍結し次いで長期間神経球として増殖した神経球から得られたものと同じであることを示した。
【0176】
(実施例8)
LC1マウスNS細胞を胎児ラット脳に移植した。eGFPを用いてレンチウイルス形質導入したNS細胞の共焦点像を、E14.5ラットの脳室への移植1週間後に撮影した。ドナー細胞は、塊状でおよび単一の細胞として、脳室から柔組織に移動した。移植された細胞は、eGFPとニューロンマーカーMAP2、星状膠マーカーGFAPまたは前駆細胞マーカーネスチンとの共局在を示した。したがって、NS細胞は、胎児ラット脳における移植後、移動しそして分化した。
【0177】
(実施例9)
(NS細胞株の誘導および操作のためのプロトコル)
本発明者らは、NS細胞株の誘導および操作のために、以下のプロトコルを案出した。
【0178】
(ES細胞からのマウスNS細胞株の誘導)
ES細胞は、接着単層培養においてSox1発現神経前駆体に効率的に変換され得る[P1]。このES細胞分化に関する詳細なプロトコルおよびトラブルシューティングは他にも記載される[P2]。簡潔には、ES細胞を、ゼラチンコーティングした組織培養プラスチック上で10%ウシ胎児血清および100U/ml組換え白血病阻害因子(LIF)を添加した培地中にフィーダーを与えない条件下で通常通りに培養する[P3]。未分化のES細胞を、T75フラスコ(Iwaki)中で約80%コンフルエンスまで増殖させ、トリプシン処理し、そしてN2B27培地中に再懸濁する[P2]。細胞を、少なくとも10分間0.1%ゼラチン溶液(Sigma)でコーティングし次いで乾燥させておいた9cmプレート(Iwaki)上に播種する。初期播種密度は、効率的な神経誘導にとって重大なパラメーターであり、そしてES細胞株間で変動し得るので、本発明者らは、プレート当たりいくつかの異なる細胞密度(0.8×106、1×106、および1.2×106)で、通常通りに播種する。脱着または死亡した細胞を除去する過程で、毎日、培養培地を入れ替える。これらの条件下では、50〜80%の細胞が4〜5日以内に神経系統分化を受け、そして5日目から先では明白なニューロン分化が検出可能となる。
【0179】
不均質な前駆体培養物の均質NS細胞株への変換は、以下のようにして達成され得る。7日目の分化培養物をトリプシン処理し、そして2〜3×106個の細胞を、NS増殖培地(これはL−グルタミン、2mM 最終(Gibco)、改変N2補充物(ウマからの調製直後のもの)[P2]ならびに10ng/mlのマウスEGF(Peprotech)およびヒトFGF−2(Peprotech)を添加したNS−A培地(Euroclone)を含む)中で非コーティングT75フラスコ中に再播種する。増殖培地は、4週間までの間、4℃で保存され得る。2〜3日以内に、フラスコは、懸濁培養物中に数千もの浮遊凝集体を含むようになる(絶対数は、初期ES細胞分化の効率に従って変動する)。細胞凝集体は、穏やかな遠心分離によって回収するか、または10分間30mlユニバーサル管中で重力に従って静置させる。この工程は、破片および死細胞を除去することによりNS細胞創始物を濃縮し、そして完全な培地交換を確実にする。細胞を、ゼラチンコーティングしたT75フラスコ(Iwaki)上で10mlの新鮮なNS増殖培地に再播種する。さらに3〜7日後、細胞凝集体は、フラスコに付着し、そしてその後まもなく、特徴的な二極NS細胞形態を有する細胞が生じる。広範な細胞成長後(さらに3〜4日後)、集団全体をトリプシン処理し、そして増殖培地中でゼラチンコーティングしたT75フラスコ上に単一の細胞として再播種する。細胞は、非常に迅速に増殖し(倍加時間約25時間)、そして接着したままである。数継代以内に、残りの分化した細胞および芽球細胞は排除され(GFAPおよびTuJ1免疫染色によってモニタリングする)、そして培養物は、NS細胞マーカーに対して均一に陽性である。
【0180】
46C ES細胞(Soxl−GFP−IRES−pacノックイン)[P4]のために、ピューロマイシン(0.5μg/ml)を用いる一過性の選択が、非神経細胞を排除しそして連続接着培養を介してNS細胞を誘導するために使用され得る。46C ES細胞(1×106)を、ゼラチンコーティングした9cmディッシュ上でN2B27培地中に播種して、神経方向付けを誘導する。6日後、ピューロマイシンを48時間添加する。次いで、富化されたSox1発現細胞集団(約3〜5×106)を、ゼラチンコーティングした9cmプレート上でEGF(10ng/ml)およびFGF−2(10ng/ml)を含むN2B27培地中に再播種する。初期に形態学的に不均質なSox1を発現する集団は、Sox1陰性特徴を、そして3〜4継代後には、均一なNS細胞形態およびマーカー発現を、累進的に獲得する。
【0181】
(胎児CNSおよび神経球からのマウスNS細胞株の誘導)
細胞クラスターは、NS細胞増殖培地中での胎児E16.5皮質および一次培養物の解離の際に懸濁液中で形成される。これらの一次凝集体は、増殖培地中でゼラチンコーティング基材上に播種することにより、接着NS細胞株に容易に変換され得る。付着を促進するために、まず破片/死細胞を沈降によって有効に除去し、そして培地を完全に交換することが重要である。細胞凝集体が付着し、そして2〜5日にわたって増殖する。引き続き、増殖している細胞をトリプシン処理して単一の細胞にし、再播種し、そしてNS細胞増殖培地中で増殖させ得る。継代した胎児神経球[P5]から、NS細胞は、便宜的には、解離およびNS増殖培地中でのゼラチンコーティングしたプラスチック上への直接播種によって樹立され得る。初期の数継代の間、誘導されたNS株は、特に細胞密度が高くなる場合には、凝集する傾向を有し、フラスコから脱着し、そして神経球を再形成する。したがって、培養物は、50%以下のコンフルエンスで継代されるべきである。自発的に凝集する傾向は、可変性であるが、一般には、さらなる継代の際にまたはクローン細胞株の樹立を通して減少される。
【0182】
(NS細胞の継代および増殖)
一旦樹立されると、NS細胞をNS増殖培地で増殖させる。NS細胞を、ゼラチンコーティングしたプラスチック/フラスコ上で増殖させ、そして1/2から1/5に通常通りに分割する。NS細胞は、約25時間の倍加時間を有する。トリプシン/EDTAを用いて、またはカルシウムマグネシウム非含有PBS(Sigma)とのインキュベーションによって、細胞を継代させる。クローン株の樹立のために、単一の細胞を、増殖培地中でゼラチンコーティングしたマイクロウェル中に堆積させ得る。より厳格ではないが、細胞は、非常に低い密度で播種し得る(9cmディッシュ当たり1000細胞)。コロニーが、2週間以内に出現し、そして選抜され増殖され得る。
【0183】
(NS細胞の凍結保存および回収)
NS細胞は、凍結/融解後に容易に回収される。通常通りに、本発明者らは、60〜90%のコンフルエンスであるT75フラスコをトリプシン処理し、そして1.5ml NS増殖培地+10% DMSO中にペレットを再懸濁する。次いで、これを3つの1ml凍結管(Nunc)に分け、そして−80℃で貯蔵する。NS細胞は、これらの条件では6ヶ月より長い貯蔵後でも回収可能である。長期貯蔵のために、凍結バイアルを液体窒素に移す。バイアルを急速に37℃にし、続いて10mlの予温NS増殖培地に移すことにより、NS細胞を融解する。細胞をペレット化し、次いで新鮮な増殖培地中に再懸濁してDMSOを除去する。凍結保存後の細胞回収率は、NS細胞については95%を超える。
【0184】
(NS細胞の星状細胞およびニューロン分化)
NS細胞のGFAP陽性星状細胞への迅速な分化は、ゼラチンコーティングしたフラスコ/プレート上でNS−A(N2あり、EGF/FGFなし)中でBMP4(10ng/ml)または1% FCSにNS細胞を曝露してから2日以内に生じる。細胞密度は、星状細胞分化にとって重要なパラメーターではない。
【0185】
ニューロン分化のために、NS細胞を、Accutase(Sigma)またはカルシウム/マグネシウム非含有PBSを用いて細胞を脱着して回収し、そして0.5〜1.0×104個の細胞を、FGF−2(5ng/ml)、改変N2、およびB27(Gibco)を添加したNS−A培地中で、ポリオルニチン/ラミニンコーティングした4ウェルマルチディッシュプレート(Nunc)の各ウェル中に再播種する。本発明者らは、NS−A基本培地が、他の基本培地よりもニューロン分化に対してより許容性であることを見出している。培地の容量の半分を2〜3日ごとに取り替え、培地の条件付けを維持する。これらの条件で7日後、本発明者らは、EGFもFGFも含まない0.25×N2およびB27を添加したNeurobasal培地(Gibco)と1:1の比で混合したNS−Aに、培地を交換する。この処方物は、さらなるニューロン分化および成熟を促進する。より長期のニューロン培養(14日を越える)のために、本発明者らは、BDNF(10ng/ml)の存在下でB27を含むがN2を含まないNeurobasalに、培地を交換する。
【0186】
(ヒトNS細胞の培養およびニューロン分化)
100U/ml組換えヒト白血病阻害因子(LIF)をさらに添加したマウスNS細胞と同様の増殖培地中で、ヒトNS細胞を、0.1%ゼラチン(Sigma)でコーティングしたフラスコ/プレート上で増殖させる。細胞は、約1週の倍加時間を有する。それらを、約30%のコンフルエンスに達するとトリプシンで継代させ、そして1/2に分ける。単層培養を維持しそして凝集および脱着を防ぐために、過剰増殖は避けるべきである。
【0187】
ニューロン分化のために、ヒトNS細胞を、Accutase(Sigma)を用いて回収し、そして約1×104個の細胞を、増殖培地中で、ポリオルニチン/ラミニン(Sigma)コーティングした12ウェルプレート(Iwaki)の各ウェル中に再播種する。細胞を、それらが約80%のコンフルエンスに達するまで増殖させる。ニューロン分化は、増殖培地からEGFおよびLIFを除去することにより誘導する。EGFおよびLIFのない状態で7日後、0.5×N2、B27、FGF2(5ng/ml)、およびBDNF(10ng/ml)を添加したNeurobasal培地(Gibco)と1:1の比で混合したNS−Aに、培地を交換する。これらの条件でさらに7日後、培地を、N2もFGF−2も含まないB27およびBDNF(10ng/ml)を添加したNeurobasal培地に交換する。このプロトコル全体を通して、マウスNS細胞と同様に、培地の容量の半分を2〜3日ごとに取り替える。さらに10日後、TuJ1およびMAP2と免疫反応性であるニューロン形態の細胞は、全細胞数の40%までになる。GFAP陽性細胞がほとんど出現しないニューロン分化に関するマウスNS細胞プロトコルとは対照的に、有意な数の星状細胞もまた生成される。
【0188】
したがって、本発明は、対称的に分裂している未分化状態で、多くの種の神経幹細胞を得て維持するための方法および培地を提供する。本発明は、ES細胞、胎児および成体供給源から得られるまたは摘出される細胞を用いて実施されている。全ての場合において、本明細書中に記載の方法に従うことにより得られた結果の細胞は、実質的に同じように見え、挙動する;それらは全て、多数(例えば数百)の倍加にわたって高純度培養で維持され得、高い割合の細胞が、ニューロンおよび神経膠を形成する能力を保持している。特に、ヒト(ES、胎児CNS)、マウス(ES、胎児CNS、成体CNS)およびラット(胎児CNS)から、NS細胞が首尾よく得られている。マウス神経幹細胞は、培養物中で純粋な集団で増殖され、そして移植された後、腫瘍を形成することなく増殖するが、インビボで分化している。
【0189】
(参考文献)
1.Reynolds, B. A.およびWeiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science 255, 1707-10 (1992).
2.Garcion, E., Halilagic, A., Faissner, A.およびffrench-Constant, C. Generation of an environmental niche for neural stem cell development by the extracellular matrix molecule tenascin C. Development 131, 3423-32 (2004).
3.Morshead, C. M., Benveniste, P., Iscove, N. N.およびvan der Kooy, D. Hematopoietic competence is a rare property of neural stem cells that may depend on genetic and epigenetic alterations. Nat Med 8, 268-73 (2002).
4.Suslov, O. N., Kukekov, V. G., Ignatova, T. N.およびSteindler, D. A. Neural stem cell heterogeneity demonstrated by molecular phenotyping of clonal neurospheres. Proc Natl Acad Sci U S A 99, 14506-11 (2002).
5.Malatesta, P.ら Neuronal or glial progeny: regional differences in radial glia fate. Neuron 37, 751-64 (2003).
6.Anthony, T. E., Klein, C., Fishell, G.およびHeintz, N. Radial glia serve as neuronal progenitors in all regions of the central nervous system. Neuron 41, 881-90 (2004).
7.Ying, Q. -L., Stavridis, M., Griffiths, D., Li, M.およびSmith, A. Conversion of embryonic stem cells to neuroectodermal precursors in adherent monoculture. Nature Biotechnology 21, 183-186 (2003).
8.Bain, G.,.Kitchens, D., Yao, M., Huettner, J. E.およびGottlieb, D. I. Embryonic stem cells express neuronal properties in vitro. Dev Biol 168, 342-57. (1995).
9.Li, M., Pevny, L., Lovell-Badge, R.およびSmith, A. Generation of purified neural precursors from embryonic stem cells by lineage selection. Curr Biol 8, 971-4 (1998).
10.Aubert, J.ら Screening for mammalian neural genes via fluorescence-activated cell sorter purification of neural precursors from Sox1-gfp knock-in mice. Proc Natl Acad Sci U S A 100 Suppl 1, 11836-41 (2003).
11.Stavridis, M. P.およびSmith, A. G. Neural differentiation of mouse embryonic stem cells. Biochem Soc Trans 31, 45-9. (2003).
12.Campbell, K.およびGotz, M. Radial glia: multi-purpose cells for vertebrate brain development. Trends Neurosci 25, 235-8 (2002).
13.Hartfuss, E., Galli, R., Heins, N.およびGotz, M. Characterization of CNS precursor subtypes and radial glia. Dev Biol 229, 15-30 (2001).
14.Billon, N., Jolicoeur, C., Ying, Q. L., Smith, A.およびRaff, M. Normal timing of oligodendrocyte development from genetically engineered, lineage-selectable mouse ES cells. J Cell Sci 115, 3657-65. (2002).
15.Bibel, M.ら Differentiation of mouse embryonic stem cells into a defined neuronal lineage. Nat Neurosci 7, 1003-9 (2004).
16.Gabay, L., Lowell, S., Rubin, L. L.およびAnderson, D. J. Deregulation ofdorsoventral patterning by FGF confers trilineage differentiation capacity on CNS stem cells in vitro. Neuron 40, 485-99 (2003).
17.Hack, M. A., Sugimori, M., Lundberg, C., Nakafuku, M.およびGotz, M. Regionalization and fate specification in neurospheres: the role of Olig2 and Pax6.Mol Cell Neurosci 25, 664-78 (2004).
18.Pevny, L. H., Sockanathan, S., Placzek, M.およびLovell-Badge, R. A role for SOX1 in neural determination. Development 125, 1967-78. (1998).
19.Heins, N.ら Emx2 promotes symmetric cell divisions and a multipotential fate in precursors from the cerebral cortex. Mol Cell Neurosci 18, 485-502 (2001).
20.Galli, R.ら Emx2 regulates the proliferation of stem cells of the adult mammalian central nervous system. Development 129, 1633-44 (2002).
21.Rakic, P. Elusive radial glial cells: historical and evolutionary perspective. Glia 43, 19-32 (2003).
22.Gregg, C.およびWeiss, S. Generation of functional radial glial cells by embryonic and adult forebrain neural stem cells. J Neurosci 23, 11587-601 (2003).
23.Magrassi, L.ら Basal ganglia precursors found in aggregates following embryonic transplantation adopt a striatal phenotype in heterotopic locations. Development 125, 2847-55 (1998).
24.Brustle, O.ら In vitro-generated neural precursors participate in mammalian brain development. Proc Natl Acad Sci U S A 94, 14809-14 (1997).
25.Rossi, F.およびCattaneo, E. Opinion: neural stem cell therapy for neurological diseases: dreams and reality. Nat Rev Neurosci 3, 401-9 (2002).
26.Malatesta, P., Hartfuss, E.およびGotz, M. Isolation of radial glial cells by fluorescent-activated cell sorting reveals a neuronal lineage. Development 127, 5253-63 (2000).
27.Gottlieb, D. I. Large-scale sources of neural stem cells. Annu Rev Neurosci 25, 381-407 (2002).
28.Temple, S. Division and differentiation of isolated CNS blast cells in microculture. Nature 340, 471-3 (1989).
29.Johe, K. K., Hazel, T. G., Muller, T., Dugich-Djordjevic, M. M.およびMcKay, R. D. Single factors direct the differentiation of stem cells from the fetal and adult central nervous system. Genes Dev 10, 3129-40 (1996).
30.Frederiksen, K., Jat, P. S., Valtz, N., Levy, D.およびMcKay, R. Immortalization of precursor cells from the mammalian CNS. Neuron 1, 439-48 (1988).
31.Alvarez-Buylla, A., Garcia-Verdugo, J. M.およびTramontin, A. D. A unified hypothesis on the lineage of neural stem cells. Nat Rev Neurosci 2, 287-93 (2001).
32.Palmer, T. D., Takahashi, J.およびGage, F. H. The adult hippocampus contains primordial stem cells. Mol. Cell. Neurosci. 8, 389-404 (1997).
33.Ying, Q. -L.およびSmith, A. G. Differentiation of Embryonic Stem Cells (Wassarman, P.およびKeller, G.編) 327-341 (Elsevier, 2003).
34.Carbone EおよびLux HD (1987) Kinetics and selectivity of a low voltage activated calcium current in chick and rat sensory neurons. J Physiol (Lond) 386:547-570.
(プロトコル参考文献)
P1. Ying Q-L, Stavridis M, Griffiths D, Li M, Smith A (2003) Conversion of embryonic stem cells to neuroectodermal precursors in adherent monoculture. Nature Biotechnology 21: 183-186.
P2. Ying QL, Smith AG (2003) Defined conditions for neural commitment and differentiation. Methods Enzymol 365: 327-341.
P3. Smith AG (1991) Culture and differentiation of embryonic stem cells. J Tiss Cult Meth 13: 89-94.
P4. Stavridis MP, Smith AG (2003) Neural differentiation of mouse embryonic stem cells. Biochem Soc Trans 31: 45-49.
P5. Reynolds BA, Weiss S (1996) Clonal and population analyses demonstrate that an EGF-responsive mammalian embryonic CNS precursor is a stem cell. Dev Biol 175: 1-13.
【特許請求の範囲】
【請求項1】
神経幹細胞の集団であって、該細胞の少なくとも90%が、対称的に分裂している神経幹細胞であり、そして該細胞の1%以下が、成熟した星状細胞、ニューロン、および乏突起膠細胞に対するマーカーの発現に対して陽性である、集団。
【請求項2】
神経幹細胞の集団であって、該細胞の少なくとも80%が、対称的に分裂している神経幹細胞であり、そして該細胞の1%以下が、成熟した星状細胞、ニューロン、および乏突起膠細胞に対するマーカーの発現に対して陽性である、集団。
【請求項3】
前記細胞の少なくとも90%が、対称的に分裂している神経幹細胞である、請求項2に記載の神経幹細胞の集団。
【請求項4】
前記細胞の少なくとも95%が、対称的に分裂している神経幹細胞である、請求項2に記載の神経幹細胞の集団。
【請求項5】
前記神経幹細胞がヒト神経幹細胞である、請求項1から4のいずれかに記載の神経幹細胞の集団。
【請求項6】
前記神経幹細胞がラット神経幹細胞である、請求項1から4のいずれかに記載の神経幹細胞の集団。
【請求項7】
前記神経幹細胞がマウス神経幹細胞である、請求項1から4のいずれかに記載の神経幹細胞の集団。
【請求項8】
前記集団中の神経幹細胞が、それらがマーカーRC2、3CB2、およびBLBPの発現に対して陽性であることで特徴付けられている、請求項1から7のいずれかに記載の神経幹細胞の集団。
【請求項9】
前記集団中の神経幹細胞がさらに、それらが
GLAST、Pax−6、神経前駆体マーカーのネスチンもしくはビメンチン、ルイスX抗原、ムサシ−1、またはプロミニン
の少なくとも1つの発現に対して陽性であることで特徴付けられている、請求項8に記載の神経幹細胞の集団。
【請求項10】
前記集団中の神経幹細胞がさらに、それらが
Oct4またはNanog
の少なくとも1つの発現に対して陰性であることで特徴付けられている、請求項8または9に記載の神経幹細胞の集団。
【請求項11】
前記集団中の神経幹細胞が、Sox−2の発現に対して陽性であり、そしてSox−1の発現に対して陰性である、請求項8から10のいずれかに記載の神経幹細胞の集団。
【請求項12】
前記集団中の神経幹細胞が、オンコジーンをコードする外因性核酸を含まないか、または前記神経幹細胞が、不死化幹細胞ではない、請求項8から11のいずれかに記載の神経幹細胞の集団。
【請求項13】
細胞が、EGFファミリーのレセプターのアゴニスト、およびFGFレセプターのアゴニストの存在下で維持され、該細胞の少なくとも80%が、対称的に分裂している神経幹細胞であり、そして該細胞の1%以下が、成熟した星状細胞、ニューロン、および乏突起膠細胞に対するマーカーの発現に対して陽性である、細胞株。
【請求項14】
前記細胞の少なくとも90%が、対称的に分裂している神経幹細胞である、請求項13に記載の細胞株。
【請求項15】
前記細胞の少なくとも95%が、対称的に分裂している神経幹細胞である、請求項13に記載の細胞株。
【請求項16】
神経幹細胞を含む組成物であって、該神経幹細胞が接着培養中にあり、該組成物中の該細胞の少なくとも80%が、対称的に分裂している神経幹細胞であり、そして該細胞の1%以下が、成熟した星状細胞、ニューロン、および乏突起膠細胞に対するマーカーの発現に対して陽性である、組成物。
【請求項17】
前記細胞の少なくとも90%が、対称的に分裂している神経幹細胞である、請求項16に記載の組成物。
【請求項18】
前記細胞の少なくとも95%が、対称的に分裂している神経幹細胞である、請求項16に記載の組成物。
【請求項19】
神経幹細胞を含む組成物であって、該組成物中の該細胞の少なくとも95%が、対称的に分裂している神経幹細胞である、組成物。
【請求項20】
前記神経幹細胞がヒト神経幹細胞である、請求項16から19のいずれかに記載の組成物。
【請求項21】
前記神経幹細胞がラット神経幹細胞である、請求項16から19のいずれかに記載の組成物。
【請求項22】
前記神経幹細胞がマウス神経幹細胞である、請求項16から19のいずれかに記載の組成物。
【請求項23】
神経変性疾患および脳損傷の治療用調製物の製造のための、請求項1から12に記載の集団、請求項13から15に記載の細胞株、または請求項16から22に記載の組成物中に存在する神経幹細胞の使用。
【請求項1】
神経幹細胞の集団であって、該細胞の少なくとも90%が、対称的に分裂している神経幹細胞であり、そして該細胞の1%以下が、成熟した星状細胞、ニューロン、および乏突起膠細胞に対するマーカーの発現に対して陽性である、集団。
【請求項2】
神経幹細胞の集団であって、該細胞の少なくとも80%が、対称的に分裂している神経幹細胞であり、そして該細胞の1%以下が、成熟した星状細胞、ニューロン、および乏突起膠細胞に対するマーカーの発現に対して陽性である、集団。
【請求項3】
前記細胞の少なくとも90%が、対称的に分裂している神経幹細胞である、請求項2に記載の神経幹細胞の集団。
【請求項4】
前記細胞の少なくとも95%が、対称的に分裂している神経幹細胞である、請求項2に記載の神経幹細胞の集団。
【請求項5】
前記神経幹細胞がヒト神経幹細胞である、請求項1から4のいずれかに記載の神経幹細胞の集団。
【請求項6】
前記神経幹細胞がラット神経幹細胞である、請求項1から4のいずれかに記載の神経幹細胞の集団。
【請求項7】
前記神経幹細胞がマウス神経幹細胞である、請求項1から4のいずれかに記載の神経幹細胞の集団。
【請求項8】
前記集団中の神経幹細胞が、それらがマーカーRC2、3CB2、およびBLBPの発現に対して陽性であることで特徴付けられている、請求項1から7のいずれかに記載の神経幹細胞の集団。
【請求項9】
前記集団中の神経幹細胞がさらに、それらが
GLAST、Pax−6、神経前駆体マーカーのネスチンもしくはビメンチン、ルイスX抗原、ムサシ−1、またはプロミニン
の少なくとも1つの発現に対して陽性であることで特徴付けられている、請求項8に記載の神経幹細胞の集団。
【請求項10】
前記集団中の神経幹細胞がさらに、それらが
Oct4またはNanog
の少なくとも1つの発現に対して陰性であることで特徴付けられている、請求項8または9に記載の神経幹細胞の集団。
【請求項11】
前記集団中の神経幹細胞が、Sox−2の発現に対して陽性であり、そしてSox−1の発現に対して陰性である、請求項8から10のいずれかに記載の神経幹細胞の集団。
【請求項12】
前記集団中の神経幹細胞が、オンコジーンをコードする外因性核酸を含まないか、または前記神経幹細胞が、不死化幹細胞ではない、請求項8から11のいずれかに記載の神経幹細胞の集団。
【請求項13】
細胞が、EGFファミリーのレセプターのアゴニスト、およびFGFレセプターのアゴニストの存在下で維持され、該細胞の少なくとも80%が、対称的に分裂している神経幹細胞であり、そして該細胞の1%以下が、成熟した星状細胞、ニューロン、および乏突起膠細胞に対するマーカーの発現に対して陽性である、細胞株。
【請求項14】
前記細胞の少なくとも90%が、対称的に分裂している神経幹細胞である、請求項13に記載の細胞株。
【請求項15】
前記細胞の少なくとも95%が、対称的に分裂している神経幹細胞である、請求項13に記載の細胞株。
【請求項16】
神経幹細胞を含む組成物であって、該神経幹細胞が接着培養中にあり、該組成物中の該細胞の少なくとも80%が、対称的に分裂している神経幹細胞であり、そして該細胞の1%以下が、成熟した星状細胞、ニューロン、および乏突起膠細胞に対するマーカーの発現に対して陽性である、組成物。
【請求項17】
前記細胞の少なくとも90%が、対称的に分裂している神経幹細胞である、請求項16に記載の組成物。
【請求項18】
前記細胞の少なくとも95%が、対称的に分裂している神経幹細胞である、請求項16に記載の組成物。
【請求項19】
神経幹細胞を含む組成物であって、該組成物中の該細胞の少なくとも95%が、対称的に分裂している神経幹細胞である、組成物。
【請求項20】
前記神経幹細胞がヒト神経幹細胞である、請求項16から19のいずれかに記載の組成物。
【請求項21】
前記神経幹細胞がラット神経幹細胞である、請求項16から19のいずれかに記載の組成物。
【請求項22】
前記神経幹細胞がマウス神経幹細胞である、請求項16から19のいずれかに記載の組成物。
【請求項23】
神経変性疾患および脳損傷の治療用調製物の製造のための、請求項1から12に記載の集団、請求項13から15に記載の細胞株、または請求項16から22に記載の組成物中に存在する神経幹細胞の使用。
【図1A】


【図1B】


【図1C】


【図1D】


【図1E】


【図1F】


【図1G】


【図2A】


【図2B】


【図2C】


【図3】


【図4A】


【図4B】


【図4C】


【図5A】


【図5B】


【図5C】


【図5D】


【図5E】




【図1B】


【図1C】


【図1D】


【図1E】


【図1F】


【図1G】


【図2A】


【図2B】


【図2C】


【図3】


【図4A】


【図4B】


【図4C】


【図5A】


【図5B】


【図5C】


【図5D】


【図5E】


【公開番号】特開2012−34706(P2012−34706A)
【公開日】平成24年2月23日(2012.2.23)
【国際特許分類】
【出願番号】特願2011−247986(P2011−247986)
【出願日】平成23年11月11日(2011.11.11)
【分割の表示】特願2007−526548(P2007−526548)の分割
【原出願日】平成17年6月9日(2005.6.9)
【出願人】(500219618)ザ・ユニバーシティ・コート・オブ・ザ・ユニバーシティ・オブ・エディンバラ (21)
【氏名又は名称原語表記】The University Court of the University of Edinburgh
【Fターム(参考)】
【公開日】平成24年2月23日(2012.2.23)
【国際特許分類】
【出願日】平成23年11月11日(2011.11.11)
【分割の表示】特願2007−526548(P2007−526548)の分割
【原出願日】平成17年6月9日(2005.6.9)
【出願人】(500219618)ザ・ユニバーシティ・コート・オブ・ザ・ユニバーシティ・オブ・エディンバラ (21)
【氏名又は名称原語表記】The University Court of the University of Edinburgh
【Fターム(参考)】
[ Back to top ]

