神経線維保護剤組成物、これを用いた刺激性物質の評価方法及び評価システム
【課題】刺激性物質の電気生理学的評価において知覚神経線維を評価対象外の刺激要因から有効に保護し、経時的計測においてベースラインの太さを安定的に維持する神経線維保護剤組成物と、これを用いた刺激性物質の評価方法及び評価システムを提供する。
【解決手段】実質的に油性成分からなり、25℃における粘度(mPa・s)が500〜500,000の範囲内である神経線維保護剤組成物。これを用いた刺激性物質の評価方法及び評価システム。
【解決手段】実質的に油性成分からなり、25℃における粘度(mPa・s)が500〜500,000の範囲内である神経線維保護剤組成物。これを用いた刺激性物質の評価方法及び評価システム。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、神経線維保護剤組成物、これを用いた刺激性物質の評価方法及び評価システムに関する。更に詳しくは本発明は、電気生理学的手法による刺激性物質の評価において、評価系の環境内に不可避的に存在する評価対象外の刺激要因から神経線維を保護して評価上のノイズ混入を防止するための神経線維保護剤組成物と、この組成物の使用下に神経線維を用いて行う刺激性物質の評価方法と、この評価方法を有効に実施できる評価システムに関する。
【背景技術】
【0002】
従来、刺激性物質を評価する方法として、一定の実験動物の神経線維に電極を接続したもとで、被験物質を当該実験動物の知覚神経線維に作用させ、知覚神経線維が、直接に又は刺激シグナルの伝達を介して、この被験物質を刺激性物質と認識した時に生じる電位変化を測定する手法が知られている。
【0003】
しかし、このような評価においては、通常、知覚神経線維に対する電極の良好な接続状態を確保するため、動物の体組織中の神経線維を外部に剥き出した状態にする。即ち、知覚神経線維が評価対象外の刺激要因に対して暴露された状態になる。従って、知覚神経線維が評価対象外の刺激要因に対しても応答する結果となって、電極がこれらの評価対象外の応答をノイズとして拾い、測定が不安定になるという問題があった。
【0004】
そこで、例えば下記の非特許文献1では、刺激性物質の評価の際に神経線維を常温下のパラフィンオイルの液溜まりで被覆して評価対象外の刺激要因から保護することにより、ノイズを低減させることを試みている。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】D.BLIGNY etal., “REDUCED MECHANOSENSITIVITY OF DUODENAL VAGAL AFFERENT NEURONS AFTER ANACUTE SWITCH FROM MILK-BASED TO PLANT-BASED DIETS IN ANAESTHETIZED PIGS”,JOURNAL OF PHYSIOLOGY AND PHARMACOLOGY 2005, 56, Supp 3, 89-100
【発明の開示】
【発明が解決しようとする課題】
【0006】
ところで、刺激性物質を評価する電気生理学的手法は、具体的には刺激性物質に起因する知覚神経線維の正/負の電位変化その他の電気的変量を測定して刺激性物質を評価するものである。
【0007】
そして、例えば正/負の電位変化に関しては、知覚神経線維は元々、刺激性物質の作用を受けていない状態においても一定の振幅の正/負の電位変化を示すことが知られている。このような定常的状態における正/負の電位変化の振幅(Amplitude)は、小さな連続したスパイク(ピーク状の振幅部分)として測定時間内に電位変化測定グラフに連続記録される。これらのスパイクを、以下、「定常スパイク」と呼ぶ。定常スパイクは電位変化測定グラフにおいて一定の太さの帯のように現われるので、「ベースライン」と呼ばれることがある。知覚神経線維が刺激性物質の作用を受けると、このベースラインを超えて正/負の電位変化を示す大きなピーク状の振幅部分(スパイク)が現われる。これを、以下、「神経発火スパイク」と呼ぶが、この神経発火スパイクが刺激性物質の評価指標となる。
【0008】
従って、仮に刺激性物質の評価中に何らかの原因によりベースラインを構成する定常スパイクの振幅が大きく(ベースラインが太く)なれば、電位変化測定グラフにおいて神経発火スパイクのうち振幅の比較的小さなものがベースライン中に埋没して解析できなくなる。しかし、神経発火スパイクの発生頻度は必須の評価ファクターであるため、振幅の比較的小さな神経発火スパイクが解析できない場合は、刺激性物質の正確な評価が困難となる。
【0009】
非特許文献1で用いられている神経線維保護剤としての常温下のパラフィンオイルは、評価対象外の刺激要因から知覚神経線維を保護するという効果は期待できるものの、測定時間の経過に伴いベースラインが徐々に太くなり、振幅の比較的小さな神経発火スパイクを解析することができなくなるという問題を生じる。
【0010】
この問題は測定時間の経過に伴い次第に大きく発現するものであり、極めて短時間で測定を終了する場合には無視し得る可能性がある。しかし実際には、この種の評価においては、ある程度以上の経時的な測定を行って、評価系が安定化した状態における測定結果を得たいと言う要求がある。しかも、例えば徐々に経皮吸収される刺激性物質の評価等においては、ある程度以上の長い時間にわたる経時的測定を行うことが絶対的条件である。従って、「測定時間の経過に伴いベースラインが徐々に太くなる」という問題がある。
【0011】
上記した評価対象外の刺激要因としては、例えば、神経線維の乾燥をもたらす低湿度の環境空気、知覚神経線維に刺激を与え得る環境空気中の刺激性ガス成分や刺激性塵埃等が考えられる。刺激性物質の電気生理学的評価は知覚神経線維の微弱な電気的変量の測定によって行うため、評価の際に知覚神経線維を評価対象外の刺激要因から保護して評価上のノイズ混入を避けることは極めて重要である。
【0012】
そこで本発明は、評価対象外の刺激要因から知覚神経線維を有効に保護し、かつ経時的測定においてベースラインの太さを安定的に維持する神経線維保護剤と、これを用いた刺激性物質の評価方法及び評価システムを提供することを、解決すべき課題とする。
【課題を解決するための手段】
【0013】
本発明における幾つかの主要な技術用語を以下に定義する。
【0014】
単に「神経線維」と言うときは、末梢神経線維を意味する。末梢神経線維には知覚神経線維と運動神経線維が包含されるが、実際に評価に利用されるのは知覚神経線維である。
【0015】
「刺激性物質」とは、電気生理学的手法による刺激性評価の対象となり得る物質を限定なく包含する概念である。本発明において特に重要な刺激性物質はヒトや動物に皮膚刺激を与える物質であるが、この他にも発痛物質や起痒物質等を例示することができる。
【0016】
刺激性物質を神経線維又は知覚神経線維に「作用させる」形態は、要するに知覚神経線維に対して電気生理学的手法による測定が可能な電気的変量を生じさせることができる形態である限りにおいて、限定されない。具体的には、皮膚刺激性の物質を動物の皮膚に塗布その他の手段で適用する形態、発痛物質や起痒物質を動物に皮内注射する形態、等を例示することができる。
【0017】
「刺激性物質の電気生理学的評価」とは、刺激性物質に起因して生じる知覚神経線維の電気的変量の測定によって当該刺激性物質を評価することを言う。電気的変量の内容は刺激性物質の評価指標となる限りにおいて限定されないが、好ましくは、刺激性物質に起因して生じる知覚神経線維の正/負の電位変化であり、特に好ましくは、刺激性物質に起因して生じる正/負の電位変化におけるスパイクである。
【0018】
「正/負の電位変化」とは、「正及び/又は負の電位変化」を意味し、「正及び負の電位変化」を対象とする場合も、「正又は負のいずれか一方の電位変化」を対象とする場合も包含する概念である。
【0019】
(第1発明の構成)
上記課題を解決するための本願第1発明の構成は、刺激性物質の電気生理学的評価において知覚神経線維を保護するために用いる保護剤組成物であって、実質的に油性成分からなり、25℃における粘度(mPa・s)が500〜500,000の範囲内である、神経線維保護剤組成物である。
【0020】
上記第1発明において「油性成分」とは、液体の状態にあるときに水と相分離する疎水性の物質を言い、より具体的には、実施形態欄において後述する各種の油性成分を総称する概念である。
【0021】
「実質的に油性成分からなり」とは、神経線維保護剤組成物が油性成分のみからなり、あるいは、不純物又は付加的成分として油性成分以外の成分を含むとしても、油性成分の含有量が90質量%以上、より好ましくは95質量%以上であることをいう。
【0022】
第1発明に規定する粘度(mPa・s)は、例えばTV−10M形粘度計/デジタル形(東機産業株式会社)等の回転粘度計を用いて、静止流体の粘度として測定されるものである。ところで、例えばラノリンのみからなる神経線維保護剤組成物は、後述の実施例欄の「第2実施例」の項に示すように、静止状態では500,000mPa・sに近い粘度を示す。しかし、撹拌状態では粘度が181,000程度まで下がる。このような非ニュートン流体の性質を示す組成物は、撹拌して粘度を下げた状態で神経線維に塗布することが好ましい。
【0023】
(第2発明の構成)
上記課題を解決するための本願第2発明の構成は、前記第1発明に係る神経線維保護剤組成物において、(A)ワセリン及び(B)ラノリンから選ばれる1種以上が油性成分の20質量%以上を占める、神経線維保護剤組成物である。
【0024】
上記第2発明において、「ワセリン」とは石油から得た半固形の炭化水素類の混合物であり、平成11年8月30日第1刷発行の化粧品原料基準 新訂版(発行 株式会社 薬事日報社)に記載のものを言う。又、「ラノリン」とはヒツジOvis aries Linne(Bovidae)の毛から得た脂肪ようの物質を精製したもので、平成11年8月30日第1刷発行の化粧品原料基準 新訂版(発行 株式会社 薬事日報社)に記載のものを言う。
【0025】
(第3発明の構成)
上記課題を解決するための本願第3発明の構成は、前記第2発明に係る神経線維保護剤組成物が、更に油性成分として(C)液状炭化水素から選ばれる1種以上を含有し、かつ、25℃における粘度(mPa・s)が25,000〜150,000の範囲内である、神経線維保護剤組成物である。
【0026】
上記第3発明において、「液状炭化水素」とは、炭素と水素からなる化合物であって、25℃において液状、即ち特定の空間形状を短時間でも保持することができない流動性液体であるものを言う。
【0027】
(第4発明の構成)
上記課題を解決するための本願第4発明の構成は、第1発明〜第3発明のいずれかに記載の神経線維保護剤組成物により被覆した非ヒト動物の知覚神経線維に刺激性物質を作用させて当該刺激性物質を評価する、刺激性物質の評価方法である。
【0028】
上記第4発明において、「非ヒト動物」の範囲は限定されない。好ましくは、各種の哺乳動物を例示できる。特に、マウス、ラット、モルモットその他の各種の齧歯目動物や、それら以外の哺乳動物であってこの種の実験に用いられることがあるサル、イヌ、ネコ等を好ましく例示できる。
【0029】
(第5発明の構成)
上記課題を解決するための本願第5発明の構成は、以下の(イ)〜(ハ)の構成要素を含む、刺激性物質の評価システムである。
【0030】
(イ)非ヒト動物の神経線維。
【0031】
(ロ)上記神経線維を被覆している請求項1〜請求項3のいずれかに記載の神経線維保護剤組成物。
【0032】
(ハ)上記神経線維に接触させた電極を含んで構成される知覚神経線維の電位変化の測定・記録手段。
【発明の効果】
【0033】
第1発明の神経線維保護剤組成物を用いれば、刺激性物質の電気生理学的評価において知覚神経線維を評価対象外の刺激要因から有効に保護し、かつ、経時的測定においてベースラインの太さを安定的に維持することができる。
【0034】
保護剤組成物が実質的に油性成分からなるものではない場合、知覚神経線維を評価対象外の刺激要因から有効に保護することができない。
【0035】
又、保護剤組成物が10質量%を超える非油性の成分(特に水や親水性の物質)を含有する場合には、第1に保護剤組成物を介して測定用電極間で通電が起こってアースされた状態となったり、第2に評価対象外の刺激要因によるノイズが増えたりして、評価が安定しない。
【0036】
神経線維保護剤組成物の25℃における粘度が500mPa・s未満であると、流動性が過剰であるため神経線維に対する被覆状態を維持できない。又、25℃における粘度が500,000mPa・sを超えると逆に流動性が著しく不足するため、神経線維を万遍なく被覆することができない。従って、第1発明に規定する粘度の範囲を外れる神経線維保護剤組成物を用いると、神経線維に対する保護が不十分となり、電気生理学的評価におけるノイズの混入を防止できない。非特許文献1で用いられるパラフィンオイルは25℃における粘度が約200mPa・sであって、第1発明に規定する粘度の範囲を外れる。
【0037】
第2発明によれば(A)ワセリン及び(B)ラノリンから選ばれる1種以上が油性成分の20質量%以上を占めるので、神経線維保護剤組成物による神経線維の保護効果が一層顕著に確保される。
【0038】
その理由は次の通りである。即ち、ワセリンやラノリンで保護された神経線維は、経時的測定においてスパイクピーク安定性が特に良好であることが判明した。「スパイクピーク安定性」とは、刺激を受けている状態での経時的測定において、神経線維が刺激性物質の作用に対して鋭敏に反応する活性な状態を良好に維持し、単位時間当たりの神経発火スパイク数が変化しないことを言う。不適当な神経線維保護剤組成物を用いると、単位時間当たりの神経発火スパイクのスパイクピーク数が経時的に低下してスパイクピーク安定性が確保されず、評価の信頼性が不十分となる。このようなスパイクピーク安定性は、詳しくは実施例において述べるように、実際には以下のような公知の方法で評価する。
【0039】
即ち、第1のステップとして、神経線維保護剤組成物で保護された神経線維に対する刺激性物質の作用を経時的に測定する際、その測定開始の直前と測定終了の直後において、特定の同じ物理的刺激(例えば、神経線維を含む皮膚組織等に対する加圧)を与えた状態での単位時間(測定ユニット)当たりの神経発火スパイク数をカウントする。
【0040】
第2のステップとして、測定開始直前における上記カウント数を「B1」とし、測定終了直後における上記カウント数を「B2」とした場合、B1に対するB2の比「B2/B1」を求める。B2/B1の値は、経時的な測定の前後において、神経線維が同じ刺激に対して同程度に反応するか否か、即ちスパイクピーク安定性の指標となる。B2/B1の値が1.0に近い程、スパイクピーク安定性が良好であることになる。そして、スパイクピーク安定性が悪いと、評価の信頼性が必ずしも十分であるとは言えない。
【0041】
第3発明によれば、神経線維保護剤組成物が更に油性成分として(C)液状炭化水素から選ばれる1種以上を含有するので、例えばワセリンやラノリンの配合により流動性が不足しがちな神経線維保護剤組成物に好適な流動性を付与することができる。更に、液状炭化水素は、ワセリンやラノリンによって良好に維持されるスパイクピークの反応性を阻害しない。又、神経線維保護剤組成物の粘度が第3発明に規定する範囲内であると、知覚神経線維に対する被覆効果が一層確実である。
【0042】
第4発明によれば、第1発明〜第3発明のいずれかに係る神経線維保護剤組成物を用いた有効な刺激性物質の評価方法が提供される。
【0043】
第5発明によれば、第1発明〜第3発明のいずれかに係る神経線維保護剤組成物を用いた有効な刺激性物質の評価システムが提供される。
【図面の簡単な説明】
【0044】
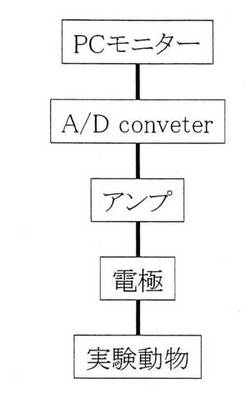
【図1】本発明に係る評価システムの一実施例の概念図を示す。
【図2】図1の概念図に相当する評価システム要部の写真を示し、図2(a)はその要部の全体の写真、図2(b)は剥離した皮膚組織と電極の部分の拡大写真である。
【図3】比較例1に係る好ましくない電位変化測定グラフの一例を示す。
【図4】図3の測定グラフに対応するAmplitude Histogram を示す。
【図5】実施例1に係る好ましい電位変化測定グラフの一例を示す。
【図6】図5の測定グラフに対応するRateMeterを示す。
【図7】実施例6に係る好ましい電位変化測定グラフの一例を示す。
【図8】図7の測定グラフに対応するAmplitudeHistogramを示す。
【発明を実施するための最良の形態】
【0045】
次に、本発明を実施するための形態を、その最良の形態を含めて説明する。
【0046】
〔神経線維保護剤組成物〕
本発明に係る神経線維保護剤組成物は、刺激性物質の電気生理学的評価において用いられる組成物である。神経線維保護剤組成物は実質的に油性成分からなり、25℃における粘度(mPa・s)が500〜500,000の範囲内である。神経線維保護剤組成物は、油性成分の1種以上を合計で90質量%以上、より好ましくは合計で95質量%以上含有する。神経線維保護剤組成物は油性成分以外の成分を10質量%以下の範囲内で含有しても構わない。油性成分以外の成分の種類は特段に限定されないが、例えば溶剤、界面活性剤等が挙げられる。
【0047】
油性成分の内、より好ましいものはロウ類及び非液状炭化水素(25℃において液状ではない炭化水素)であり、とりわけ好ましいものは、「発明の効果」欄において述べた理由から、ロウ類の一種であるラノリンと非液状炭化水素の一種であるワセリンから選ばれる1種以上である。ラノリン及び/又はワセリンは好ましくは油性成分の20質量%以上、更に好ましくは30質量%以上を占める。
【0048】
特に好ましい実施形態において、神経線維保護剤組成物は、油性成分の1種以上を合計で90質量%以上含有し、その油性成分の20質量%以上がラノリン及び/又はワセリンであり、更に液状炭化水素から選ばれる1種以上を含有し、神経線維保護剤組成物の粘度(mPa・s)が25,000〜150,000の範囲内である。液状炭化水素の含有量は限定されないが、例えば油性成分の10〜70質量%の範囲内とすることが好ましい。
【0049】
〔油性成分〕
油性成分の定義は「第1発明の構成」欄で述べた通りであるが、好ましくは、1)油脂、2)ロウ類、3)高級アルコール、4)高級脂肪酸、5)アルキルグリセリルエーテル、6)エステル類、7)シリコーン類、8)炭化水素が包含される。
【0050】
1)油脂としては、オリーブ油、ローズヒップ油、ツバキ油、シア脂、マカデミアナッツ油、アーモンド油、茶実油、サザンカ油、サフラワー油、ヒマワリ油、大豆油、綿実油、ゴマ油、牛脂、カカオ脂、トウモロコシ油、落花生油、ナタネ油、コメヌカ油、コメ胚芽油、小麦胚芽油、ハトムギ油、ブドウ種子油、アボカド油、カロット油、マカダミアナッツ油、ヒマシ油、アマニ油、ヤシ油、ミンク油、卵黄油等が例示される。
【0051】
2)ロウ類としては、ミツロウ(蜜蝋)、キャンデリラロウ、カルナウバロウ、ホホバ油、ラノリン、鯨ロウ、コメヌカロウ、サトウキビロウ、パームロウ、モンタンロウ、綿ロウ、ベイベリーロウ、イボタロウ、カポックロウ、セラックロウ等が例示される。ロウ類の中でも、前記した理由から、特にラノリンが好ましい。
【0052】
3)高級アルコールとしては、ラウリルアルコール、ミリスチルアルコール、セチルアルコール(セタノール)、ステアリルアルコール、セトステアリルアルコール、アラキルアルコール、ベヘニルアルコール、2−ヘキシルデカノール、イソステアリルアルコール、2−オクチルドデカノール、デシルテトラデカノール、オレイルアルコール、リノレイルアルコール、リノレニルアルコール、ラノリンアルコール等が例示される。
【0053】
4)高級脂肪酸としては、ラウリン酸、ミリスチン酸、パルミチン酸、ステアリン酸、ベヘニン酸、イソステアリン酸、ヒドロキシステアリン酸、12−ヒドロキシステアリン酸、オレイン酸、ウンデシレン酸、リノール酸、リシノール酸、ラノリン脂肪酸が例示される。
【0054】
5)アルキルグリセリルエーテルとしては、バチルアルコール(モノステアリルグリセリルエーテル)、キミルアルコール(モノセチルグリセリルエーテル)、セラキルアルコール(モノオレイルグリセリルエーテル)、イソステアリルグリセリルエーテル等が例示される。
【0055】
6)エステル類としては、アジピン酸ジイソプロピル、アジピン酸ジイソブチル、アジピン酸ジオクチル、アジピン酸−2−ヘキシルデシル、アジピン酸ジイソステアリル、ミリスチン酸イソプロピル、オクタン酸セチル、イソオクタン酸セチル、イソノナン酸イソノニル、イソノナン酸イソデシル、イソノナン酸イソトリデシル、セバシン酸ジイソプロピル、ミリスチン酸オクチルドデシル、パルミチン酸イソプロピル、ステアリン酸ブチル、ステアリン酸ステアリル、ラウリン酸ヘキシル、ミリスチン酸ミリスチル、オレイン酸デシル、ジメチルオクタン酸ヘキシルデシル、ミリスチン酸トリイソデシル、ミリスチン酸イソステアリル、パルミチン酸2−エチルへキシル、リシノール酸オクチルドデシル、脂肪酸(C10−30)(コレステリル/ラノステリル)、乳酸ラウリル、乳酸セチル、乳酸ミリスチル、乳酸オクチルドデシル、酢酸ラノリン、ステアリン酸イソセチル、イソステアリン酸イソセチル、12−ヒドロキシステアリン酸コレステリル、ジ−2−エチルヘキサン酸エチレングリコール、ジペンタエリスリトール脂肪酸エステル、モノイソステアリン酸N−アルキルグリコール、カプリン酸セチル、トリカプリル酸グリセリル、ジカプリン酸ネオペンチルグリコール、リンゴ酸ジイソステアリル、ラノリン誘導体等が例示される。
【0056】
7)シリコーン類としては、ジメチルポリシロキサン(INCI名:ジメチコン)、ヒドロキシ末端基を有するジメチルポリシロキサン(INCI名:ジメチコノール)、メチルフェニルポリシロキサン、デカメチルシクロペンタシロキサン、ドデカメチルシクロヘキサシロキサン、ポリエーテル変性シリコーン、平均重合度が650〜10000の高重合シリコーン、アミノ変性シリコーン、ベタイン変性シリコーン、アルキル変性シリコーン、アルコキシ変性シリコーン、メルカプト変性シリコーン、カルボキシ変性シリコーン、フッ素変性シリコーン等が例示される。
【0057】
上記のうち、アミノ変性シリコーンとしては、アミノプロピルメチルシロキサン・ジメチルシロキサン共重合体(INCI名:アミノプロピルジメチコン)、アミノエチルアミノプロピルシロキサン・ジメチルシロキサン共重合体(INCI名:アモジメチコン)、アミノエチルアミノプロピルメチルシロキサン・ジメチルシロキサン共重合体(INCI名:トリメチルシリルアモジメチコン)等が例示される。
【0058】
8)炭化水素としては、α−オレフィンオリゴマー、軽質イソパラフィン、軽質流動イソパラフィン、流動イソパラフィン、流動パラフィン、軽質流動パラフィン、スクワラン、ポリブテン、パラフィン、ポリエチレン末、マイクロクリスタリンワックス、ワセリン等が例示される。
【0059】
前記した理由から、炭化水素の中でも特にワセリンが好ましい。又、追加的に配合する油性成分としては、液状炭化水素、とりわけ軽質流動イソパラフィン、流動イソパラフィン、流動パラフィン、軽質流動パラフィンが好ましい。
【0060】
〔刺激性物質の評価方法〕
本発明に係る刺激性物質の評価方法は、上記いずれかの神経線維保護剤組成物により被覆した非ヒト動物の神経線維(より具体的には、知覚神経線維)に刺激性物質を作用させて当該刺激性物質を評価する方法である。
【0061】
ここで言う「被覆」とは、動物の体組織中の神経線維の内、評価のために外部に剥き出した状態である部分を、神経線維保護剤組成物により万遍なく被覆し、又はその部分を線維保護剤組成物に浸漬することを言う。
【0062】
刺激性物質の評価方法においては、上記の被覆状態にある神経線維に電極を接触させ、知覚神経線維に刺激性物質を作用させて一定の電気的測定を行う。このような測定の実施形態は限定されないが、好ましくは、神経線維を、当該神経線維を含む皮膚組織との組織的一体性を維持したままで外部に剥き出して、この神経線維を神経線維保護剤組成物により被覆すると共に電極を接触させ、この状態において刺激性物質を作用させることにより、知覚神経線維に対する刺激作用を電極を通じた測定により読み取る、という実施形態が挙げられる。その際、知覚神経線維の中枢神経系との連絡を維持しても良いし、その連絡を切断しても構わない。
【0063】
刺激性物質を作用させる形態としては、皮膚刺激性の物質を動物の皮膚に塗布その他の手段で適用し、その皮膚付着又は経皮吸収による刺激作用を発現させる形態、発痛物質や起痒物質を動物に皮内注射し、その刺激作用を発現させる形態等が例示される。
【0064】
「神経線維を外部に剥き出す」方法として、例えば動物の皮膚組織中の神経線維を、好ましくはその皮膚組織との組織的一体性を維持したままで、動物体の本体から剥がすようにカットして裏返しに捲る、という方法がある。その際、当該皮膚組織を動物体の本体から完全に切り離しても良いが、皮膚組織及び知覚神経線維の活性状態を経時的に維持する上では、皮膚組織が動物体の本体とつながった状態に保つ方が好ましい。
【0065】
以上の実施形態の他にも、要するに、神経線維を外部に剥き出して神経線維保護剤組成物により被覆し、かつ知覚神経線維に刺激性物質を作用させて一定の電気的測定を行い得る実施形態である限りにおいて、本発明の刺激性物質の評価方法に包含される。
【0066】
次に、刺激性物質の評価方法における電気的測定として、例えば、以下の(1)〜(3)のいずれかの測定を挙げることができる。
(1)刺激性物質に起因する知覚神経線維の電気的変量の測定。
(2)刺激性物質に起因する知覚神経線維の正/負の電位変化の測定。
(3)刺激性物質に起因する知覚神経線維の正/負の電位変化におけるスパイクの測定。
【0067】
上記の内、(1)は(2)及び(3)を包含する概念であり、(2)は(3)を包含する概念である。(1)の「電気的変量」とは、電極によって読み取り可能であり、かつ知覚神経線維に対する刺激性物質の作用を正しく反映する電気的な変量である限りにおいて、その内容を限定されない。(2)の「正/負の電位変化」とは、(3)の電位変化上のスパイク以外のカテゴリーの電位変化であって、電極を通じて読み取り可能であり、かつ知覚神経線維に対する刺激性物質の作用を正しく反映する電位変化である限りにおいて、内容を限定されない。
【0068】
〔刺激性物質の評価システム〕
本発明に係る刺激性物質の評価システムは、(イ)非ヒト動物の神経線維と、(ロ)上記神経線維を被覆している前記いずれかの神経線維保護剤組成物と、(ハ)上記神経線維に接触させた電極を含んで構成される知覚神経線維の電位変化の測定・記録手段、という構成要素を含む。
【0069】
上記(イ)の非ヒト動物の神経線維は、好ましくは、刺激性物質に対して正常な電気的変量あるいは電位変化を示す状態に維持されている。上記(ロ)の「知覚神経線維を被覆している」の意味は、「刺激性物質の評価方法」の項で述べた通りである。又、上記(ハ)の測定・記録手段は、知覚神経線維に接触させた電極を含んで構成され、知覚神経線維の電位変化等の電気的変量を測定・記録することができる限りにおいて具体的構成は限定されない。
【実施例】
【0070】
以下に本発明の実施例及び比較例を説明する。本発明の技術的範囲はこれらの実施例及び比較例によって限定されない。
【0071】
〔第1実施例:神経線維保護剤組成物の調製〕
末尾の表1に示す実施例1〜6、表2に示す実施例7〜13に係る神経線維保護剤組成物と、末尾の表3に示す比較例1〜3に係る神経線維保護剤組成物を調製した。表1〜3において成分の組成を示す数値の単位は「質量%」である。これらの表に示す成分の内、合計4種類の流動パラフィン、流動イソパラフィンは、いずれも液状炭化水素に相当する。
【0072】
なお、実施例1で配合している「シリコン(KF-96H-10000CS)」とは、信越化学工業株式会社製のジメチルシリコーンオイルである。又、実施例3で配合している「メチルポリシロキサン」としては、Ge東芝シリコーン株式会社製の「TSF451-1000」を用いている。
【0073】
〔第2実施例:神経線維保護剤組成物の粘度測定〕
上記した実施例および比較例に係る神経線維保護剤組成物は、室温25℃で12時間静置保存した後、粘度測定を行なった。実施例1、3、5〜13に係る神経線維保護剤組成物の粘度(mPa・s)を、TV−10M形粘度計/デジタル形を用い、ローターNo.4にて、回転数3rpm、25℃、1分間の条件で測定した。又、実施例2、4及び比較例1〜3に係る神経線維保護剤組成物の粘度(mPa・s)は、TV−10M形粘度計/デジタル形を用い、ローターNo.4にて、回転数12rpm、25℃、1分間の条件で測定した。この粘度測定法は、JIS Z 8803に従うものである。その測定結果を表1〜3の「粘度」の項に示す。
【0074】
〔第3実施例:刺激性物質の評価システム〕
(実験動物の神経線維についての準備処置)
実験動物としてマウスを用い、そのマウスの試験に用いる部位の皮膚を予め刈毛・剃毛した。この刈毛・剃毛の処置から1週間後に、皮膚に炎症や傷がみられないマウスを選択し、試験に供した。
【0075】
試験直前に麻酔薬を用いてマウスに麻酔をかけた。第3実施例では麻酔薬としてバルビツール酸系化合物であるペントバルビタールナトリウムを用いた。なお、麻酔薬としては他のバルビツール酸系化合物を用いても良いし、その他の任意の麻酔薬、例えばウレタン等の麻酔薬を用いても構わない。
【0076】
(電極のセッティング、神経線維保護剤組成物による神経線維の被覆)
前記した麻酔下で、マウスの神経線維を含む皮膚組織をカットして動物体の本体から剥離させた。より具体的には、図2(a)の写真に示すようにマウスの神経線維を含む皮膚組織をマウスの本体から剥がすようにカットして裏返しに捲るという方法で外部に剥き出した。その際、剥離させた皮膚組織の一端部はマウスの本体とつながった状態に保った。
【0077】
次に、図2(b)の写真に示すように、裏返しに捲った皮膚組織から神経線維を少し浮き上がる状態に剥離させ、剥離させた神経線維に双極電極を接続した。そして、実施例1〜13、比較例1〜3に係る神経線維保護剤組成物を、それぞれ撹拌棒に付着させて神経線維の上に滴下することにより、これらの組成物で神経線維を被覆した。
【0078】
(刺激性物質の評価システムの構成)
第3実施例に係る刺激性物質評価システムの概略を図1に示す。図1の電極からモニターに至る機器の配線、接続が前記第5発明の(ハ)に規定する「知覚神経線維の電位変化の測定・記録手段」を構成する。
【0079】
即ち、実施例1〜13、比較例1〜3に係る神経線維保護剤組成物で被覆したマウス(図1で「実験動物」と表記)の神経線維に双極電極を接触させておき、マウスの神経線維を流れる微弱な電位変化を双極電極(図1で「電極」と表記)で測定する。そして測定した電位変化をアンプを用いて増幅し、この増幅された電気信号(アナログ信号)をアナログ/デジタル変換装置(図1で「A/D converter」と表記)を用いてデジタル信号に変換し、コンピューターのモニター(図1で「PCモニターと表記)で表記させる。
【0080】
このような電位変化の測定・記録手段として、具体的には、日本光電社製のデータ収録解析システム「PowerLab」を用いた。この機器の内訳は次の通りである。このうち「使用ソフトウェア」とは、電位変化測定グラフのAmplitude Histogramへの変換に用いるもので、詳しくは後述する。
【0081】
電極:双極鉤型電極
生体アンプ:Dual-Channel
Bioelectric Amplifier(MEG-2100)
交流/直流コンバーター:Powerlab2/26
使用ソフトウェア:PowerLab
Chart5(v5.1.1)
〔第4実施例:刺激性物質の評価〕
(刺激性物質の適用)
第3実施例で述べたように電極をセッティングし、神経線維を保護剤組成物により被覆した後、マウスの当該皮膚組織に刺激性物質を適用する前に、予め神経線維の定常的状態における電位変化の測定グラフを予備的にチェックし、ベースラインの太さが一定であること(これは後述のベースライン安定性とは異なる)、さらに不可避的に存在する評価対象外の刺激要因によるノイズが経時的に増加してこないことを確認した。又、マウスの当該皮膚組織における知覚神経の反応が確認される受容野を確認して、この受容野に刺激性物質を適用した。
【0082】
動物体の本体から剥離させた皮膚組織に刺激性物質を適用する場合、一般的に、その刺激性物質が液体であれば、例えばカバーガラス上に極めて薄く延ばした脱脂綿に当該液体を湿らせたものを、皮膚組織の角質層側にスライドインさせて適用させることができる。刺激性物質がクリーム等の半固形剤である場合は、カバーガラス上に薄く塗ったものを同様の操作により適用させることができる。液体状の刺激性物質を、予め確認した皮膚組織の受容野内に皮内注射することもできる。
【0083】
第4実施例においては、ヒトや動物に皮膚刺激を与える刺激性物質として知られるヒスタミンの1mg/mL生理食塩水溶液を用い、その20μlを皮膚組織の受容野内に皮内注射した。
【0084】
(知覚神経線維の電位変化の測定)
上記の皮内注射の直後から60分間にわたり評価システムによる知覚神経線維の電位変化の測定を行い、その測定グラフの記録を前記の刺激性物質適用前の電位変化の測定グラフの記録と共に保存した。ここにおいて、刺激性物質適用前の電位変化の測定グラフで得られた振幅のスパイクを定常スパイクとし、刺激性物質適用後の電位変化の測定グラフで得られた、定常スパイクの振幅よりも大きな振幅のスパイクを神経発火スパイクとする。
【0085】
(電位変化測定グラフのAmplitude Histogramへの変換)
得られた電位変化測定グラフのデータを前記PowerLab Chart5(v5.1.1)を用いてヒストグラム解析を行った。
【0086】
このソフトウェアPowerLab Chart5(v5.1.1)は、具体的には、測定ユニット中の定常スパイクや神経発火スパイクを含めた全スパイクの検出をDiscriminator Settings(スパイク検出・識別設定)により設定するものである。測定ユニットとして、試験開始(刺激性物質適用直後の電位変化測定開始時点)からの一定時間(60秒)と、試験終了(電位変化測定終了時点)前の一定時間(60秒)をそれぞれ採用した。
【0087】
このような測定ユニットの採用により、「測定時間中のベースラインの太さが安定的に維持されているか否か」、言い換えれば「測定時間の経過に伴いベースラインが太くなり、振幅の比較的小さな神経発火スパイクを解析することができなくなる」というベースライン安定性に関わる問題を生じるか否かを、実施例1〜13、比較例1〜3について検証することができる。
【0088】
より具体的には、Discriminator Settingsの設定において、定常スパイクを認識させるためにノイズ閾値(Noise Threshold)の値を0ボルトとし、スパイク一波形分(Waveform Period)を2ミリ秒として、この条件下で得られる定常スパイクを検出した。なお、上記Noise Thresholdに関し、通常、神経発火スパイクを識別させる場合はNoise Thresholdの設定で定常スパイクの振幅以上の値を入力し、入力した値よりも小さな振幅のスパイクを排除する。
【0089】
その後、前記の測定ユニット中の定常スパイクの振幅をヒストグラム解析ウィンドウ(Amplitude Histogram)により表示させた。ヒストグラム解析ウィンドウとは、ユニット中の定常スパイクの振幅を特定の電圧レンジごとに振り分けて、そのスパイク数を表示したものである。
【0090】
(ベースラインの評価)
上記Amplitude Histogramより、実施例1〜13、比較例1〜3に係る神経線維保護剤組成物の塗布直後の最大カウント/binの値(A1)と、計測終了時の最大カウント/binの値(A2)を求めた。
【0091】
ここに、「最大カウント/bin」とは測定ユニット中の定常スパイクの振幅をbinで設定した電圧レンジ毎に振り分けた中で、定常スパイクのカウント数の最も多い電圧レンジに含まれる定常スパイクの平均振幅を言い、「bin」とはAmplitude
Histogramにおける各バー(棒グラフ)の電圧レンジをいう。従って、「A1」は神経線維保護剤組成物の塗布直後(測定開始時)における最大頻度の定常スパイクの振幅を、「A2」は測定終了時における最大頻度の定常スパイクの振幅を、それぞれ意味する。つまり、最大頻度のスパイク振幅の変化がなければ一定の電圧レンジで連続記録が出来ていることを示し、ベースラインが安定していることを示す。そのため、A2とA1との差である「A2−A1」によって、ベースラインの太さが安定的に維持されているかどうかを評価できる。
【0092】
そこで、実施例1〜13、比較例1〜3に係る神経線維保護剤組成物を用いた場合のベースライン安定性を、実際に算定された「A2−A1」の値によって5段階評価した。その結果を表1〜3の「ベースライン安定性」の項に示す。なお、ベースラインが計測開始後に一旦太くなり、次いで細くなるという事例は、例えば測定中に「マウスの麻酔が切れる」等の例外的な事態が起こらない限り、経験的に存在しない。従って、ベースライン安定性に関する上記の評価方式は信頼性がある。
【0093】
この5段階評価の内容は、「A2−A1」の値が、負電圧側及び正電圧側の少なくとも一方の側において、絶対値表記で0.01v以下の範囲内であった場合を「5」、以下、同様の表記において、0.01vより大きく0.02v以下の範囲内であった場合を「4」、0.02vより大きく0.03v以下の範囲内であった場合を「3」、0.03vより大きく0.04v以下の範囲内であった場合を「2」及び、0.04vより大きかった場合を「1」とした。
【0094】
例えば、比較例1に係る神経線維保護剤組成物を用いた場合の電位変化の測定グラフを図3に示し、これに基づいて得られたAmplitude Histogram(測定開始直後と測定終了直前のもの)を図4に示す。この場合には「A2−A1」の値が大きく、「ベースライン安定性に欠ける」ことが良く分かる。
【0095】
〔第5実施例:神経線維保護剤組成物の被覆性の評価〕
実施例1〜13、比較例1〜3に係る神経線維保護剤組成物を神経線維に塗布した際の神経線維に対する被覆状態の良好さを4段階で評価した。
【0096】
塗布した保護剤組成物が神経線維を万遍なく包み込む状態で経時的に留まる場合を「被覆状態が非常に良い」と評価して「◎」、同様に、保護剤組成物が神経線維を万遍なく包み込むことができる場合を「被覆状態が良い」と評価して「○」、保護剤組成物が神経線維を万遍なく包み込むことができない場合を「被覆状態が良くない」と評価して「△」、保護剤組成物が神経線維を万遍なく包み込むことが全くできず広がってしまう場合を「被覆状態が非常に良くない」と評価して「×」とした。この評価結果を表1〜3の「被覆性」の項に示す。
【0097】
なお、この評価においては、攪拌棒の先に付着させた保護剤組成物を神経線維に滴下するという塗布方法を用いたが、その他の任意の塗布方法によって塗布しても構わず、それらの塗布方法による場合でも、被覆性の評価結果は同様である。
【0098】
〔第6実施例:スパイクピーク安定性の評価〕
測定ユニット中のスパイクの検出をDiscriminator
Settingsにより設定した。具体的には、Discriminator
Settingsの設定でノイズ閾値(Noise
Threshold)の値を、前記したベースライン安定性の評価の項目で得られた「最大カウント/bin」の値(単位:ボルト)、Waveform
Periodを2ミリ秒とし、この条件で得られた神経発火スパイクを検出した。その後、前記と同様の測定ユニット中における神経発火スパイクのカウント数をヒストグラム解析グラフ(Rate Meter)により求めた。又、1ユニットの解析時間を10秒とした。「Rate Meter」とは、測定ユニットで得られた神経発火スパイクのカウント数を特定の秒単位の幅ごとに表示したものである。
【0099】
即ち、実施例1〜13、比較例1〜3に係る神経線維保護剤組成物を用いた場合において、その経時的な測定の開始直前の時点、及び終了直後の時点における、発明の効果欄で前記した物理的刺激(神経線維を含む皮膚組織等に対する一定の加圧)を加え続けた場合の、単位時間(測定ユニット)当たりの神経発火スパイク数をカウントした。加圧の手段としてNorth Coast Medical 社製のモノフィラメント圧痛覚計であるTouch-Test(登録商標)Sensory
Evaluatorsを使用し、フォンフレイ(von Frey)フィラメントの製品No. NC12775-11、Evaluator size: 4.56を用いて、Target Force in grams: 4、即ち4gの重さの圧力を加え続けた。
【0100】
上記のRate Meterより、測定開始直前に一定の圧力を加え続けた場合の測定ユニット中の神経発火スパイクのカウント数(B1)と、測定終了直後に同じ一定の圧力を加え続けた場合の測定ユニット中の神経発火スパイクのカウント数(B2)を求めた。こうして、B2のB1に対する比「B2/B1」によってスパイクピーク安定性を評価できる。即ち、同一圧力に対する反応性を評価しているという理由から、B2/B1の値が1.0に近いほどスパイクピーク安定性が良好であり、1.0から離れるほどスパイクピーク安定性に欠ける、と考えることができる。
【0101】
そこで、実施例1〜13、比較例1〜3に係る神経線維保護剤組成物を用いた場合のスパイクピーク安定性を、それらの場合に算定されたB2/B1の値によって5段階評価した。
【0102】
この5段階評価の内容は、B2/B1の値が、0.9以上かつ1.1未満であった場合を評価点「5」、以下、同様の表記において、0.8以上0.9未満もしくは1.1以上1.2未満であった場合を評価点「4」、0.7以上0.8未満もしくは1.2以上1.3未満であった場合を評価点「3」、0.6以上0.7未満もしくは1.3以上1.4未満であった場合を評価点「2」、0.6未満もしくは1.4以上であった場合を評価点「1」とした。評価点が大きいほど、スパイクピーク安定性が良好である。評価結果を表1〜3の「スパイクピーク安定性」の項に示す。
【0103】
例えば、実施例1に係る神経線維保護剤組成物を用いた場合の電位変化の測定グラフ(測定開始直後と測定終了直前のもの)を図5に示し、これに基づいて得られた、対応する測定開始直後と測定終了直前のRate Meterを図6に示す。この場合、「B2/B1」の値が1.0に近く、評価点が「5」であって「スパイクピーク安定性が良好である」と評価することができる。
【0104】
一方、実施例6に係る神経線維保護剤組成物を用いた場合の経時的測定における電位変化の測定グラフを図7に示し、これに基づいて得られたAmplitude Histogram(測定開始直後と測定終了直前のもの)を図8に示す。この場合には「A2−A1」の値が絶対値表記で0.01v以下と極めて小さく、「ベースライン安定性が非常に優れる」ことが良く分かる。
【0105】
【表1】

【0106】
【表2】

【0107】
【表3】

【産業上の利用可能性】
【0108】
本発明によって、刺激性物質の電気生理学的評価において知覚神経線維を評価対象外の刺激要因から有効に保護し、経時的計測においてベースラインの太さを安定的に維持する神経線維保護剤組成物と、これを用いた刺激性物質の評価方法及び評価システムが提供される。
【技術分野】
【0001】
本発明は、神経線維保護剤組成物、これを用いた刺激性物質の評価方法及び評価システムに関する。更に詳しくは本発明は、電気生理学的手法による刺激性物質の評価において、評価系の環境内に不可避的に存在する評価対象外の刺激要因から神経線維を保護して評価上のノイズ混入を防止するための神経線維保護剤組成物と、この組成物の使用下に神経線維を用いて行う刺激性物質の評価方法と、この評価方法を有効に実施できる評価システムに関する。
【背景技術】
【0002】
従来、刺激性物質を評価する方法として、一定の実験動物の神経線維に電極を接続したもとで、被験物質を当該実験動物の知覚神経線維に作用させ、知覚神経線維が、直接に又は刺激シグナルの伝達を介して、この被験物質を刺激性物質と認識した時に生じる電位変化を測定する手法が知られている。
【0003】
しかし、このような評価においては、通常、知覚神経線維に対する電極の良好な接続状態を確保するため、動物の体組織中の神経線維を外部に剥き出した状態にする。即ち、知覚神経線維が評価対象外の刺激要因に対して暴露された状態になる。従って、知覚神経線維が評価対象外の刺激要因に対しても応答する結果となって、電極がこれらの評価対象外の応答をノイズとして拾い、測定が不安定になるという問題があった。
【0004】
そこで、例えば下記の非特許文献1では、刺激性物質の評価の際に神経線維を常温下のパラフィンオイルの液溜まりで被覆して評価対象外の刺激要因から保護することにより、ノイズを低減させることを試みている。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】D.BLIGNY etal., “REDUCED MECHANOSENSITIVITY OF DUODENAL VAGAL AFFERENT NEURONS AFTER ANACUTE SWITCH FROM MILK-BASED TO PLANT-BASED DIETS IN ANAESTHETIZED PIGS”,JOURNAL OF PHYSIOLOGY AND PHARMACOLOGY 2005, 56, Supp 3, 89-100
【発明の開示】
【発明が解決しようとする課題】
【0006】
ところで、刺激性物質を評価する電気生理学的手法は、具体的には刺激性物質に起因する知覚神経線維の正/負の電位変化その他の電気的変量を測定して刺激性物質を評価するものである。
【0007】
そして、例えば正/負の電位変化に関しては、知覚神経線維は元々、刺激性物質の作用を受けていない状態においても一定の振幅の正/負の電位変化を示すことが知られている。このような定常的状態における正/負の電位変化の振幅(Amplitude)は、小さな連続したスパイク(ピーク状の振幅部分)として測定時間内に電位変化測定グラフに連続記録される。これらのスパイクを、以下、「定常スパイク」と呼ぶ。定常スパイクは電位変化測定グラフにおいて一定の太さの帯のように現われるので、「ベースライン」と呼ばれることがある。知覚神経線維が刺激性物質の作用を受けると、このベースラインを超えて正/負の電位変化を示す大きなピーク状の振幅部分(スパイク)が現われる。これを、以下、「神経発火スパイク」と呼ぶが、この神経発火スパイクが刺激性物質の評価指標となる。
【0008】
従って、仮に刺激性物質の評価中に何らかの原因によりベースラインを構成する定常スパイクの振幅が大きく(ベースラインが太く)なれば、電位変化測定グラフにおいて神経発火スパイクのうち振幅の比較的小さなものがベースライン中に埋没して解析できなくなる。しかし、神経発火スパイクの発生頻度は必須の評価ファクターであるため、振幅の比較的小さな神経発火スパイクが解析できない場合は、刺激性物質の正確な評価が困難となる。
【0009】
非特許文献1で用いられている神経線維保護剤としての常温下のパラフィンオイルは、評価対象外の刺激要因から知覚神経線維を保護するという効果は期待できるものの、測定時間の経過に伴いベースラインが徐々に太くなり、振幅の比較的小さな神経発火スパイクを解析することができなくなるという問題を生じる。
【0010】
この問題は測定時間の経過に伴い次第に大きく発現するものであり、極めて短時間で測定を終了する場合には無視し得る可能性がある。しかし実際には、この種の評価においては、ある程度以上の経時的な測定を行って、評価系が安定化した状態における測定結果を得たいと言う要求がある。しかも、例えば徐々に経皮吸収される刺激性物質の評価等においては、ある程度以上の長い時間にわたる経時的測定を行うことが絶対的条件である。従って、「測定時間の経過に伴いベースラインが徐々に太くなる」という問題がある。
【0011】
上記した評価対象外の刺激要因としては、例えば、神経線維の乾燥をもたらす低湿度の環境空気、知覚神経線維に刺激を与え得る環境空気中の刺激性ガス成分や刺激性塵埃等が考えられる。刺激性物質の電気生理学的評価は知覚神経線維の微弱な電気的変量の測定によって行うため、評価の際に知覚神経線維を評価対象外の刺激要因から保護して評価上のノイズ混入を避けることは極めて重要である。
【0012】
そこで本発明は、評価対象外の刺激要因から知覚神経線維を有効に保護し、かつ経時的測定においてベースラインの太さを安定的に維持する神経線維保護剤と、これを用いた刺激性物質の評価方法及び評価システムを提供することを、解決すべき課題とする。
【課題を解決するための手段】
【0013】
本発明における幾つかの主要な技術用語を以下に定義する。
【0014】
単に「神経線維」と言うときは、末梢神経線維を意味する。末梢神経線維には知覚神経線維と運動神経線維が包含されるが、実際に評価に利用されるのは知覚神経線維である。
【0015】
「刺激性物質」とは、電気生理学的手法による刺激性評価の対象となり得る物質を限定なく包含する概念である。本発明において特に重要な刺激性物質はヒトや動物に皮膚刺激を与える物質であるが、この他にも発痛物質や起痒物質等を例示することができる。
【0016】
刺激性物質を神経線維又は知覚神経線維に「作用させる」形態は、要するに知覚神経線維に対して電気生理学的手法による測定が可能な電気的変量を生じさせることができる形態である限りにおいて、限定されない。具体的には、皮膚刺激性の物質を動物の皮膚に塗布その他の手段で適用する形態、発痛物質や起痒物質を動物に皮内注射する形態、等を例示することができる。
【0017】
「刺激性物質の電気生理学的評価」とは、刺激性物質に起因して生じる知覚神経線維の電気的変量の測定によって当該刺激性物質を評価することを言う。電気的変量の内容は刺激性物質の評価指標となる限りにおいて限定されないが、好ましくは、刺激性物質に起因して生じる知覚神経線維の正/負の電位変化であり、特に好ましくは、刺激性物質に起因して生じる正/負の電位変化におけるスパイクである。
【0018】
「正/負の電位変化」とは、「正及び/又は負の電位変化」を意味し、「正及び負の電位変化」を対象とする場合も、「正又は負のいずれか一方の電位変化」を対象とする場合も包含する概念である。
【0019】
(第1発明の構成)
上記課題を解決するための本願第1発明の構成は、刺激性物質の電気生理学的評価において知覚神経線維を保護するために用いる保護剤組成物であって、実質的に油性成分からなり、25℃における粘度(mPa・s)が500〜500,000の範囲内である、神経線維保護剤組成物である。
【0020】
上記第1発明において「油性成分」とは、液体の状態にあるときに水と相分離する疎水性の物質を言い、より具体的には、実施形態欄において後述する各種の油性成分を総称する概念である。
【0021】
「実質的に油性成分からなり」とは、神経線維保護剤組成物が油性成分のみからなり、あるいは、不純物又は付加的成分として油性成分以外の成分を含むとしても、油性成分の含有量が90質量%以上、より好ましくは95質量%以上であることをいう。
【0022】
第1発明に規定する粘度(mPa・s)は、例えばTV−10M形粘度計/デジタル形(東機産業株式会社)等の回転粘度計を用いて、静止流体の粘度として測定されるものである。ところで、例えばラノリンのみからなる神経線維保護剤組成物は、後述の実施例欄の「第2実施例」の項に示すように、静止状態では500,000mPa・sに近い粘度を示す。しかし、撹拌状態では粘度が181,000程度まで下がる。このような非ニュートン流体の性質を示す組成物は、撹拌して粘度を下げた状態で神経線維に塗布することが好ましい。
【0023】
(第2発明の構成)
上記課題を解決するための本願第2発明の構成は、前記第1発明に係る神経線維保護剤組成物において、(A)ワセリン及び(B)ラノリンから選ばれる1種以上が油性成分の20質量%以上を占める、神経線維保護剤組成物である。
【0024】
上記第2発明において、「ワセリン」とは石油から得た半固形の炭化水素類の混合物であり、平成11年8月30日第1刷発行の化粧品原料基準 新訂版(発行 株式会社 薬事日報社)に記載のものを言う。又、「ラノリン」とはヒツジOvis aries Linne(Bovidae)の毛から得た脂肪ようの物質を精製したもので、平成11年8月30日第1刷発行の化粧品原料基準 新訂版(発行 株式会社 薬事日報社)に記載のものを言う。
【0025】
(第3発明の構成)
上記課題を解決するための本願第3発明の構成は、前記第2発明に係る神経線維保護剤組成物が、更に油性成分として(C)液状炭化水素から選ばれる1種以上を含有し、かつ、25℃における粘度(mPa・s)が25,000〜150,000の範囲内である、神経線維保護剤組成物である。
【0026】
上記第3発明において、「液状炭化水素」とは、炭素と水素からなる化合物であって、25℃において液状、即ち特定の空間形状を短時間でも保持することができない流動性液体であるものを言う。
【0027】
(第4発明の構成)
上記課題を解決するための本願第4発明の構成は、第1発明〜第3発明のいずれかに記載の神経線維保護剤組成物により被覆した非ヒト動物の知覚神経線維に刺激性物質を作用させて当該刺激性物質を評価する、刺激性物質の評価方法である。
【0028】
上記第4発明において、「非ヒト動物」の範囲は限定されない。好ましくは、各種の哺乳動物を例示できる。特に、マウス、ラット、モルモットその他の各種の齧歯目動物や、それら以外の哺乳動物であってこの種の実験に用いられることがあるサル、イヌ、ネコ等を好ましく例示できる。
【0029】
(第5発明の構成)
上記課題を解決するための本願第5発明の構成は、以下の(イ)〜(ハ)の構成要素を含む、刺激性物質の評価システムである。
【0030】
(イ)非ヒト動物の神経線維。
【0031】
(ロ)上記神経線維を被覆している請求項1〜請求項3のいずれかに記載の神経線維保護剤組成物。
【0032】
(ハ)上記神経線維に接触させた電極を含んで構成される知覚神経線維の電位変化の測定・記録手段。
【発明の効果】
【0033】
第1発明の神経線維保護剤組成物を用いれば、刺激性物質の電気生理学的評価において知覚神経線維を評価対象外の刺激要因から有効に保護し、かつ、経時的測定においてベースラインの太さを安定的に維持することができる。
【0034】
保護剤組成物が実質的に油性成分からなるものではない場合、知覚神経線維を評価対象外の刺激要因から有効に保護することができない。
【0035】
又、保護剤組成物が10質量%を超える非油性の成分(特に水や親水性の物質)を含有する場合には、第1に保護剤組成物を介して測定用電極間で通電が起こってアースされた状態となったり、第2に評価対象外の刺激要因によるノイズが増えたりして、評価が安定しない。
【0036】
神経線維保護剤組成物の25℃における粘度が500mPa・s未満であると、流動性が過剰であるため神経線維に対する被覆状態を維持できない。又、25℃における粘度が500,000mPa・sを超えると逆に流動性が著しく不足するため、神経線維を万遍なく被覆することができない。従って、第1発明に規定する粘度の範囲を外れる神経線維保護剤組成物を用いると、神経線維に対する保護が不十分となり、電気生理学的評価におけるノイズの混入を防止できない。非特許文献1で用いられるパラフィンオイルは25℃における粘度が約200mPa・sであって、第1発明に規定する粘度の範囲を外れる。
【0037】
第2発明によれば(A)ワセリン及び(B)ラノリンから選ばれる1種以上が油性成分の20質量%以上を占めるので、神経線維保護剤組成物による神経線維の保護効果が一層顕著に確保される。
【0038】
その理由は次の通りである。即ち、ワセリンやラノリンで保護された神経線維は、経時的測定においてスパイクピーク安定性が特に良好であることが判明した。「スパイクピーク安定性」とは、刺激を受けている状態での経時的測定において、神経線維が刺激性物質の作用に対して鋭敏に反応する活性な状態を良好に維持し、単位時間当たりの神経発火スパイク数が変化しないことを言う。不適当な神経線維保護剤組成物を用いると、単位時間当たりの神経発火スパイクのスパイクピーク数が経時的に低下してスパイクピーク安定性が確保されず、評価の信頼性が不十分となる。このようなスパイクピーク安定性は、詳しくは実施例において述べるように、実際には以下のような公知の方法で評価する。
【0039】
即ち、第1のステップとして、神経線維保護剤組成物で保護された神経線維に対する刺激性物質の作用を経時的に測定する際、その測定開始の直前と測定終了の直後において、特定の同じ物理的刺激(例えば、神経線維を含む皮膚組織等に対する加圧)を与えた状態での単位時間(測定ユニット)当たりの神経発火スパイク数をカウントする。
【0040】
第2のステップとして、測定開始直前における上記カウント数を「B1」とし、測定終了直後における上記カウント数を「B2」とした場合、B1に対するB2の比「B2/B1」を求める。B2/B1の値は、経時的な測定の前後において、神経線維が同じ刺激に対して同程度に反応するか否か、即ちスパイクピーク安定性の指標となる。B2/B1の値が1.0に近い程、スパイクピーク安定性が良好であることになる。そして、スパイクピーク安定性が悪いと、評価の信頼性が必ずしも十分であるとは言えない。
【0041】
第3発明によれば、神経線維保護剤組成物が更に油性成分として(C)液状炭化水素から選ばれる1種以上を含有するので、例えばワセリンやラノリンの配合により流動性が不足しがちな神経線維保護剤組成物に好適な流動性を付与することができる。更に、液状炭化水素は、ワセリンやラノリンによって良好に維持されるスパイクピークの反応性を阻害しない。又、神経線維保護剤組成物の粘度が第3発明に規定する範囲内であると、知覚神経線維に対する被覆効果が一層確実である。
【0042】
第4発明によれば、第1発明〜第3発明のいずれかに係る神経線維保護剤組成物を用いた有効な刺激性物質の評価方法が提供される。
【0043】
第5発明によれば、第1発明〜第3発明のいずれかに係る神経線維保護剤組成物を用いた有効な刺激性物質の評価システムが提供される。
【図面の簡単な説明】
【0044】
【図1】本発明に係る評価システムの一実施例の概念図を示す。
【図2】図1の概念図に相当する評価システム要部の写真を示し、図2(a)はその要部の全体の写真、図2(b)は剥離した皮膚組織と電極の部分の拡大写真である。
【図3】比較例1に係る好ましくない電位変化測定グラフの一例を示す。
【図4】図3の測定グラフに対応するAmplitude Histogram を示す。
【図5】実施例1に係る好ましい電位変化測定グラフの一例を示す。
【図6】図5の測定グラフに対応するRateMeterを示す。
【図7】実施例6に係る好ましい電位変化測定グラフの一例を示す。
【図8】図7の測定グラフに対応するAmplitudeHistogramを示す。
【発明を実施するための最良の形態】
【0045】
次に、本発明を実施するための形態を、その最良の形態を含めて説明する。
【0046】
〔神経線維保護剤組成物〕
本発明に係る神経線維保護剤組成物は、刺激性物質の電気生理学的評価において用いられる組成物である。神経線維保護剤組成物は実質的に油性成分からなり、25℃における粘度(mPa・s)が500〜500,000の範囲内である。神経線維保護剤組成物は、油性成分の1種以上を合計で90質量%以上、より好ましくは合計で95質量%以上含有する。神経線維保護剤組成物は油性成分以外の成分を10質量%以下の範囲内で含有しても構わない。油性成分以外の成分の種類は特段に限定されないが、例えば溶剤、界面活性剤等が挙げられる。
【0047】
油性成分の内、より好ましいものはロウ類及び非液状炭化水素(25℃において液状ではない炭化水素)であり、とりわけ好ましいものは、「発明の効果」欄において述べた理由から、ロウ類の一種であるラノリンと非液状炭化水素の一種であるワセリンから選ばれる1種以上である。ラノリン及び/又はワセリンは好ましくは油性成分の20質量%以上、更に好ましくは30質量%以上を占める。
【0048】
特に好ましい実施形態において、神経線維保護剤組成物は、油性成分の1種以上を合計で90質量%以上含有し、その油性成分の20質量%以上がラノリン及び/又はワセリンであり、更に液状炭化水素から選ばれる1種以上を含有し、神経線維保護剤組成物の粘度(mPa・s)が25,000〜150,000の範囲内である。液状炭化水素の含有量は限定されないが、例えば油性成分の10〜70質量%の範囲内とすることが好ましい。
【0049】
〔油性成分〕
油性成分の定義は「第1発明の構成」欄で述べた通りであるが、好ましくは、1)油脂、2)ロウ類、3)高級アルコール、4)高級脂肪酸、5)アルキルグリセリルエーテル、6)エステル類、7)シリコーン類、8)炭化水素が包含される。
【0050】
1)油脂としては、オリーブ油、ローズヒップ油、ツバキ油、シア脂、マカデミアナッツ油、アーモンド油、茶実油、サザンカ油、サフラワー油、ヒマワリ油、大豆油、綿実油、ゴマ油、牛脂、カカオ脂、トウモロコシ油、落花生油、ナタネ油、コメヌカ油、コメ胚芽油、小麦胚芽油、ハトムギ油、ブドウ種子油、アボカド油、カロット油、マカダミアナッツ油、ヒマシ油、アマニ油、ヤシ油、ミンク油、卵黄油等が例示される。
【0051】
2)ロウ類としては、ミツロウ(蜜蝋)、キャンデリラロウ、カルナウバロウ、ホホバ油、ラノリン、鯨ロウ、コメヌカロウ、サトウキビロウ、パームロウ、モンタンロウ、綿ロウ、ベイベリーロウ、イボタロウ、カポックロウ、セラックロウ等が例示される。ロウ類の中でも、前記した理由から、特にラノリンが好ましい。
【0052】
3)高級アルコールとしては、ラウリルアルコール、ミリスチルアルコール、セチルアルコール(セタノール)、ステアリルアルコール、セトステアリルアルコール、アラキルアルコール、ベヘニルアルコール、2−ヘキシルデカノール、イソステアリルアルコール、2−オクチルドデカノール、デシルテトラデカノール、オレイルアルコール、リノレイルアルコール、リノレニルアルコール、ラノリンアルコール等が例示される。
【0053】
4)高級脂肪酸としては、ラウリン酸、ミリスチン酸、パルミチン酸、ステアリン酸、ベヘニン酸、イソステアリン酸、ヒドロキシステアリン酸、12−ヒドロキシステアリン酸、オレイン酸、ウンデシレン酸、リノール酸、リシノール酸、ラノリン脂肪酸が例示される。
【0054】
5)アルキルグリセリルエーテルとしては、バチルアルコール(モノステアリルグリセリルエーテル)、キミルアルコール(モノセチルグリセリルエーテル)、セラキルアルコール(モノオレイルグリセリルエーテル)、イソステアリルグリセリルエーテル等が例示される。
【0055】
6)エステル類としては、アジピン酸ジイソプロピル、アジピン酸ジイソブチル、アジピン酸ジオクチル、アジピン酸−2−ヘキシルデシル、アジピン酸ジイソステアリル、ミリスチン酸イソプロピル、オクタン酸セチル、イソオクタン酸セチル、イソノナン酸イソノニル、イソノナン酸イソデシル、イソノナン酸イソトリデシル、セバシン酸ジイソプロピル、ミリスチン酸オクチルドデシル、パルミチン酸イソプロピル、ステアリン酸ブチル、ステアリン酸ステアリル、ラウリン酸ヘキシル、ミリスチン酸ミリスチル、オレイン酸デシル、ジメチルオクタン酸ヘキシルデシル、ミリスチン酸トリイソデシル、ミリスチン酸イソステアリル、パルミチン酸2−エチルへキシル、リシノール酸オクチルドデシル、脂肪酸(C10−30)(コレステリル/ラノステリル)、乳酸ラウリル、乳酸セチル、乳酸ミリスチル、乳酸オクチルドデシル、酢酸ラノリン、ステアリン酸イソセチル、イソステアリン酸イソセチル、12−ヒドロキシステアリン酸コレステリル、ジ−2−エチルヘキサン酸エチレングリコール、ジペンタエリスリトール脂肪酸エステル、モノイソステアリン酸N−アルキルグリコール、カプリン酸セチル、トリカプリル酸グリセリル、ジカプリン酸ネオペンチルグリコール、リンゴ酸ジイソステアリル、ラノリン誘導体等が例示される。
【0056】
7)シリコーン類としては、ジメチルポリシロキサン(INCI名:ジメチコン)、ヒドロキシ末端基を有するジメチルポリシロキサン(INCI名:ジメチコノール)、メチルフェニルポリシロキサン、デカメチルシクロペンタシロキサン、ドデカメチルシクロヘキサシロキサン、ポリエーテル変性シリコーン、平均重合度が650〜10000の高重合シリコーン、アミノ変性シリコーン、ベタイン変性シリコーン、アルキル変性シリコーン、アルコキシ変性シリコーン、メルカプト変性シリコーン、カルボキシ変性シリコーン、フッ素変性シリコーン等が例示される。
【0057】
上記のうち、アミノ変性シリコーンとしては、アミノプロピルメチルシロキサン・ジメチルシロキサン共重合体(INCI名:アミノプロピルジメチコン)、アミノエチルアミノプロピルシロキサン・ジメチルシロキサン共重合体(INCI名:アモジメチコン)、アミノエチルアミノプロピルメチルシロキサン・ジメチルシロキサン共重合体(INCI名:トリメチルシリルアモジメチコン)等が例示される。
【0058】
8)炭化水素としては、α−オレフィンオリゴマー、軽質イソパラフィン、軽質流動イソパラフィン、流動イソパラフィン、流動パラフィン、軽質流動パラフィン、スクワラン、ポリブテン、パラフィン、ポリエチレン末、マイクロクリスタリンワックス、ワセリン等が例示される。
【0059】
前記した理由から、炭化水素の中でも特にワセリンが好ましい。又、追加的に配合する油性成分としては、液状炭化水素、とりわけ軽質流動イソパラフィン、流動イソパラフィン、流動パラフィン、軽質流動パラフィンが好ましい。
【0060】
〔刺激性物質の評価方法〕
本発明に係る刺激性物質の評価方法は、上記いずれかの神経線維保護剤組成物により被覆した非ヒト動物の神経線維(より具体的には、知覚神経線維)に刺激性物質を作用させて当該刺激性物質を評価する方法である。
【0061】
ここで言う「被覆」とは、動物の体組織中の神経線維の内、評価のために外部に剥き出した状態である部分を、神経線維保護剤組成物により万遍なく被覆し、又はその部分を線維保護剤組成物に浸漬することを言う。
【0062】
刺激性物質の評価方法においては、上記の被覆状態にある神経線維に電極を接触させ、知覚神経線維に刺激性物質を作用させて一定の電気的測定を行う。このような測定の実施形態は限定されないが、好ましくは、神経線維を、当該神経線維を含む皮膚組織との組織的一体性を維持したままで外部に剥き出して、この神経線維を神経線維保護剤組成物により被覆すると共に電極を接触させ、この状態において刺激性物質を作用させることにより、知覚神経線維に対する刺激作用を電極を通じた測定により読み取る、という実施形態が挙げられる。その際、知覚神経線維の中枢神経系との連絡を維持しても良いし、その連絡を切断しても構わない。
【0063】
刺激性物質を作用させる形態としては、皮膚刺激性の物質を動物の皮膚に塗布その他の手段で適用し、その皮膚付着又は経皮吸収による刺激作用を発現させる形態、発痛物質や起痒物質を動物に皮内注射し、その刺激作用を発現させる形態等が例示される。
【0064】
「神経線維を外部に剥き出す」方法として、例えば動物の皮膚組織中の神経線維を、好ましくはその皮膚組織との組織的一体性を維持したままで、動物体の本体から剥がすようにカットして裏返しに捲る、という方法がある。その際、当該皮膚組織を動物体の本体から完全に切り離しても良いが、皮膚組織及び知覚神経線維の活性状態を経時的に維持する上では、皮膚組織が動物体の本体とつながった状態に保つ方が好ましい。
【0065】
以上の実施形態の他にも、要するに、神経線維を外部に剥き出して神経線維保護剤組成物により被覆し、かつ知覚神経線維に刺激性物質を作用させて一定の電気的測定を行い得る実施形態である限りにおいて、本発明の刺激性物質の評価方法に包含される。
【0066】
次に、刺激性物質の評価方法における電気的測定として、例えば、以下の(1)〜(3)のいずれかの測定を挙げることができる。
(1)刺激性物質に起因する知覚神経線維の電気的変量の測定。
(2)刺激性物質に起因する知覚神経線維の正/負の電位変化の測定。
(3)刺激性物質に起因する知覚神経線維の正/負の電位変化におけるスパイクの測定。
【0067】
上記の内、(1)は(2)及び(3)を包含する概念であり、(2)は(3)を包含する概念である。(1)の「電気的変量」とは、電極によって読み取り可能であり、かつ知覚神経線維に対する刺激性物質の作用を正しく反映する電気的な変量である限りにおいて、その内容を限定されない。(2)の「正/負の電位変化」とは、(3)の電位変化上のスパイク以外のカテゴリーの電位変化であって、電極を通じて読み取り可能であり、かつ知覚神経線維に対する刺激性物質の作用を正しく反映する電位変化である限りにおいて、内容を限定されない。
【0068】
〔刺激性物質の評価システム〕
本発明に係る刺激性物質の評価システムは、(イ)非ヒト動物の神経線維と、(ロ)上記神経線維を被覆している前記いずれかの神経線維保護剤組成物と、(ハ)上記神経線維に接触させた電極を含んで構成される知覚神経線維の電位変化の測定・記録手段、という構成要素を含む。
【0069】
上記(イ)の非ヒト動物の神経線維は、好ましくは、刺激性物質に対して正常な電気的変量あるいは電位変化を示す状態に維持されている。上記(ロ)の「知覚神経線維を被覆している」の意味は、「刺激性物質の評価方法」の項で述べた通りである。又、上記(ハ)の測定・記録手段は、知覚神経線維に接触させた電極を含んで構成され、知覚神経線維の電位変化等の電気的変量を測定・記録することができる限りにおいて具体的構成は限定されない。
【実施例】
【0070】
以下に本発明の実施例及び比較例を説明する。本発明の技術的範囲はこれらの実施例及び比較例によって限定されない。
【0071】
〔第1実施例:神経線維保護剤組成物の調製〕
末尾の表1に示す実施例1〜6、表2に示す実施例7〜13に係る神経線維保護剤組成物と、末尾の表3に示す比較例1〜3に係る神経線維保護剤組成物を調製した。表1〜3において成分の組成を示す数値の単位は「質量%」である。これらの表に示す成分の内、合計4種類の流動パラフィン、流動イソパラフィンは、いずれも液状炭化水素に相当する。
【0072】
なお、実施例1で配合している「シリコン(KF-96H-10000CS)」とは、信越化学工業株式会社製のジメチルシリコーンオイルである。又、実施例3で配合している「メチルポリシロキサン」としては、Ge東芝シリコーン株式会社製の「TSF451-1000」を用いている。
【0073】
〔第2実施例:神経線維保護剤組成物の粘度測定〕
上記した実施例および比較例に係る神経線維保護剤組成物は、室温25℃で12時間静置保存した後、粘度測定を行なった。実施例1、3、5〜13に係る神経線維保護剤組成物の粘度(mPa・s)を、TV−10M形粘度計/デジタル形を用い、ローターNo.4にて、回転数3rpm、25℃、1分間の条件で測定した。又、実施例2、4及び比較例1〜3に係る神経線維保護剤組成物の粘度(mPa・s)は、TV−10M形粘度計/デジタル形を用い、ローターNo.4にて、回転数12rpm、25℃、1分間の条件で測定した。この粘度測定法は、JIS Z 8803に従うものである。その測定結果を表1〜3の「粘度」の項に示す。
【0074】
〔第3実施例:刺激性物質の評価システム〕
(実験動物の神経線維についての準備処置)
実験動物としてマウスを用い、そのマウスの試験に用いる部位の皮膚を予め刈毛・剃毛した。この刈毛・剃毛の処置から1週間後に、皮膚に炎症や傷がみられないマウスを選択し、試験に供した。
【0075】
試験直前に麻酔薬を用いてマウスに麻酔をかけた。第3実施例では麻酔薬としてバルビツール酸系化合物であるペントバルビタールナトリウムを用いた。なお、麻酔薬としては他のバルビツール酸系化合物を用いても良いし、その他の任意の麻酔薬、例えばウレタン等の麻酔薬を用いても構わない。
【0076】
(電極のセッティング、神経線維保護剤組成物による神経線維の被覆)
前記した麻酔下で、マウスの神経線維を含む皮膚組織をカットして動物体の本体から剥離させた。より具体的には、図2(a)の写真に示すようにマウスの神経線維を含む皮膚組織をマウスの本体から剥がすようにカットして裏返しに捲るという方法で外部に剥き出した。その際、剥離させた皮膚組織の一端部はマウスの本体とつながった状態に保った。
【0077】
次に、図2(b)の写真に示すように、裏返しに捲った皮膚組織から神経線維を少し浮き上がる状態に剥離させ、剥離させた神経線維に双極電極を接続した。そして、実施例1〜13、比較例1〜3に係る神経線維保護剤組成物を、それぞれ撹拌棒に付着させて神経線維の上に滴下することにより、これらの組成物で神経線維を被覆した。
【0078】
(刺激性物質の評価システムの構成)
第3実施例に係る刺激性物質評価システムの概略を図1に示す。図1の電極からモニターに至る機器の配線、接続が前記第5発明の(ハ)に規定する「知覚神経線維の電位変化の測定・記録手段」を構成する。
【0079】
即ち、実施例1〜13、比較例1〜3に係る神経線維保護剤組成物で被覆したマウス(図1で「実験動物」と表記)の神経線維に双極電極を接触させておき、マウスの神経線維を流れる微弱な電位変化を双極電極(図1で「電極」と表記)で測定する。そして測定した電位変化をアンプを用いて増幅し、この増幅された電気信号(アナログ信号)をアナログ/デジタル変換装置(図1で「A/D converter」と表記)を用いてデジタル信号に変換し、コンピューターのモニター(図1で「PCモニターと表記)で表記させる。
【0080】
このような電位変化の測定・記録手段として、具体的には、日本光電社製のデータ収録解析システム「PowerLab」を用いた。この機器の内訳は次の通りである。このうち「使用ソフトウェア」とは、電位変化測定グラフのAmplitude Histogramへの変換に用いるもので、詳しくは後述する。
【0081】
電極:双極鉤型電極
生体アンプ:Dual-Channel
Bioelectric Amplifier(MEG-2100)
交流/直流コンバーター:Powerlab2/26
使用ソフトウェア:PowerLab
Chart5(v5.1.1)
〔第4実施例:刺激性物質の評価〕
(刺激性物質の適用)
第3実施例で述べたように電極をセッティングし、神経線維を保護剤組成物により被覆した後、マウスの当該皮膚組織に刺激性物質を適用する前に、予め神経線維の定常的状態における電位変化の測定グラフを予備的にチェックし、ベースラインの太さが一定であること(これは後述のベースライン安定性とは異なる)、さらに不可避的に存在する評価対象外の刺激要因によるノイズが経時的に増加してこないことを確認した。又、マウスの当該皮膚組織における知覚神経の反応が確認される受容野を確認して、この受容野に刺激性物質を適用した。
【0082】
動物体の本体から剥離させた皮膚組織に刺激性物質を適用する場合、一般的に、その刺激性物質が液体であれば、例えばカバーガラス上に極めて薄く延ばした脱脂綿に当該液体を湿らせたものを、皮膚組織の角質層側にスライドインさせて適用させることができる。刺激性物質がクリーム等の半固形剤である場合は、カバーガラス上に薄く塗ったものを同様の操作により適用させることができる。液体状の刺激性物質を、予め確認した皮膚組織の受容野内に皮内注射することもできる。
【0083】
第4実施例においては、ヒトや動物に皮膚刺激を与える刺激性物質として知られるヒスタミンの1mg/mL生理食塩水溶液を用い、その20μlを皮膚組織の受容野内に皮内注射した。
【0084】
(知覚神経線維の電位変化の測定)
上記の皮内注射の直後から60分間にわたり評価システムによる知覚神経線維の電位変化の測定を行い、その測定グラフの記録を前記の刺激性物質適用前の電位変化の測定グラフの記録と共に保存した。ここにおいて、刺激性物質適用前の電位変化の測定グラフで得られた振幅のスパイクを定常スパイクとし、刺激性物質適用後の電位変化の測定グラフで得られた、定常スパイクの振幅よりも大きな振幅のスパイクを神経発火スパイクとする。
【0085】
(電位変化測定グラフのAmplitude Histogramへの変換)
得られた電位変化測定グラフのデータを前記PowerLab Chart5(v5.1.1)を用いてヒストグラム解析を行った。
【0086】
このソフトウェアPowerLab Chart5(v5.1.1)は、具体的には、測定ユニット中の定常スパイクや神経発火スパイクを含めた全スパイクの検出をDiscriminator Settings(スパイク検出・識別設定)により設定するものである。測定ユニットとして、試験開始(刺激性物質適用直後の電位変化測定開始時点)からの一定時間(60秒)と、試験終了(電位変化測定終了時点)前の一定時間(60秒)をそれぞれ採用した。
【0087】
このような測定ユニットの採用により、「測定時間中のベースラインの太さが安定的に維持されているか否か」、言い換えれば「測定時間の経過に伴いベースラインが太くなり、振幅の比較的小さな神経発火スパイクを解析することができなくなる」というベースライン安定性に関わる問題を生じるか否かを、実施例1〜13、比較例1〜3について検証することができる。
【0088】
より具体的には、Discriminator Settingsの設定において、定常スパイクを認識させるためにノイズ閾値(Noise Threshold)の値を0ボルトとし、スパイク一波形分(Waveform Period)を2ミリ秒として、この条件下で得られる定常スパイクを検出した。なお、上記Noise Thresholdに関し、通常、神経発火スパイクを識別させる場合はNoise Thresholdの設定で定常スパイクの振幅以上の値を入力し、入力した値よりも小さな振幅のスパイクを排除する。
【0089】
その後、前記の測定ユニット中の定常スパイクの振幅をヒストグラム解析ウィンドウ(Amplitude Histogram)により表示させた。ヒストグラム解析ウィンドウとは、ユニット中の定常スパイクの振幅を特定の電圧レンジごとに振り分けて、そのスパイク数を表示したものである。
【0090】
(ベースラインの評価)
上記Amplitude Histogramより、実施例1〜13、比較例1〜3に係る神経線維保護剤組成物の塗布直後の最大カウント/binの値(A1)と、計測終了時の最大カウント/binの値(A2)を求めた。
【0091】
ここに、「最大カウント/bin」とは測定ユニット中の定常スパイクの振幅をbinで設定した電圧レンジ毎に振り分けた中で、定常スパイクのカウント数の最も多い電圧レンジに含まれる定常スパイクの平均振幅を言い、「bin」とはAmplitude
Histogramにおける各バー(棒グラフ)の電圧レンジをいう。従って、「A1」は神経線維保護剤組成物の塗布直後(測定開始時)における最大頻度の定常スパイクの振幅を、「A2」は測定終了時における最大頻度の定常スパイクの振幅を、それぞれ意味する。つまり、最大頻度のスパイク振幅の変化がなければ一定の電圧レンジで連続記録が出来ていることを示し、ベースラインが安定していることを示す。そのため、A2とA1との差である「A2−A1」によって、ベースラインの太さが安定的に維持されているかどうかを評価できる。
【0092】
そこで、実施例1〜13、比較例1〜3に係る神経線維保護剤組成物を用いた場合のベースライン安定性を、実際に算定された「A2−A1」の値によって5段階評価した。その結果を表1〜3の「ベースライン安定性」の項に示す。なお、ベースラインが計測開始後に一旦太くなり、次いで細くなるという事例は、例えば測定中に「マウスの麻酔が切れる」等の例外的な事態が起こらない限り、経験的に存在しない。従って、ベースライン安定性に関する上記の評価方式は信頼性がある。
【0093】
この5段階評価の内容は、「A2−A1」の値が、負電圧側及び正電圧側の少なくとも一方の側において、絶対値表記で0.01v以下の範囲内であった場合を「5」、以下、同様の表記において、0.01vより大きく0.02v以下の範囲内であった場合を「4」、0.02vより大きく0.03v以下の範囲内であった場合を「3」、0.03vより大きく0.04v以下の範囲内であった場合を「2」及び、0.04vより大きかった場合を「1」とした。
【0094】
例えば、比較例1に係る神経線維保護剤組成物を用いた場合の電位変化の測定グラフを図3に示し、これに基づいて得られたAmplitude Histogram(測定開始直後と測定終了直前のもの)を図4に示す。この場合には「A2−A1」の値が大きく、「ベースライン安定性に欠ける」ことが良く分かる。
【0095】
〔第5実施例:神経線維保護剤組成物の被覆性の評価〕
実施例1〜13、比較例1〜3に係る神経線維保護剤組成物を神経線維に塗布した際の神経線維に対する被覆状態の良好さを4段階で評価した。
【0096】
塗布した保護剤組成物が神経線維を万遍なく包み込む状態で経時的に留まる場合を「被覆状態が非常に良い」と評価して「◎」、同様に、保護剤組成物が神経線維を万遍なく包み込むことができる場合を「被覆状態が良い」と評価して「○」、保護剤組成物が神経線維を万遍なく包み込むことができない場合を「被覆状態が良くない」と評価して「△」、保護剤組成物が神経線維を万遍なく包み込むことが全くできず広がってしまう場合を「被覆状態が非常に良くない」と評価して「×」とした。この評価結果を表1〜3の「被覆性」の項に示す。
【0097】
なお、この評価においては、攪拌棒の先に付着させた保護剤組成物を神経線維に滴下するという塗布方法を用いたが、その他の任意の塗布方法によって塗布しても構わず、それらの塗布方法による場合でも、被覆性の評価結果は同様である。
【0098】
〔第6実施例:スパイクピーク安定性の評価〕
測定ユニット中のスパイクの検出をDiscriminator
Settingsにより設定した。具体的には、Discriminator
Settingsの設定でノイズ閾値(Noise
Threshold)の値を、前記したベースライン安定性の評価の項目で得られた「最大カウント/bin」の値(単位:ボルト)、Waveform
Periodを2ミリ秒とし、この条件で得られた神経発火スパイクを検出した。その後、前記と同様の測定ユニット中における神経発火スパイクのカウント数をヒストグラム解析グラフ(Rate Meter)により求めた。又、1ユニットの解析時間を10秒とした。「Rate Meter」とは、測定ユニットで得られた神経発火スパイクのカウント数を特定の秒単位の幅ごとに表示したものである。
【0099】
即ち、実施例1〜13、比較例1〜3に係る神経線維保護剤組成物を用いた場合において、その経時的な測定の開始直前の時点、及び終了直後の時点における、発明の効果欄で前記した物理的刺激(神経線維を含む皮膚組織等に対する一定の加圧)を加え続けた場合の、単位時間(測定ユニット)当たりの神経発火スパイク数をカウントした。加圧の手段としてNorth Coast Medical 社製のモノフィラメント圧痛覚計であるTouch-Test(登録商標)Sensory
Evaluatorsを使用し、フォンフレイ(von Frey)フィラメントの製品No. NC12775-11、Evaluator size: 4.56を用いて、Target Force in grams: 4、即ち4gの重さの圧力を加え続けた。
【0100】
上記のRate Meterより、測定開始直前に一定の圧力を加え続けた場合の測定ユニット中の神経発火スパイクのカウント数(B1)と、測定終了直後に同じ一定の圧力を加え続けた場合の測定ユニット中の神経発火スパイクのカウント数(B2)を求めた。こうして、B2のB1に対する比「B2/B1」によってスパイクピーク安定性を評価できる。即ち、同一圧力に対する反応性を評価しているという理由から、B2/B1の値が1.0に近いほどスパイクピーク安定性が良好であり、1.0から離れるほどスパイクピーク安定性に欠ける、と考えることができる。
【0101】
そこで、実施例1〜13、比較例1〜3に係る神経線維保護剤組成物を用いた場合のスパイクピーク安定性を、それらの場合に算定されたB2/B1の値によって5段階評価した。
【0102】
この5段階評価の内容は、B2/B1の値が、0.9以上かつ1.1未満であった場合を評価点「5」、以下、同様の表記において、0.8以上0.9未満もしくは1.1以上1.2未満であった場合を評価点「4」、0.7以上0.8未満もしくは1.2以上1.3未満であった場合を評価点「3」、0.6以上0.7未満もしくは1.3以上1.4未満であった場合を評価点「2」、0.6未満もしくは1.4以上であった場合を評価点「1」とした。評価点が大きいほど、スパイクピーク安定性が良好である。評価結果を表1〜3の「スパイクピーク安定性」の項に示す。
【0103】
例えば、実施例1に係る神経線維保護剤組成物を用いた場合の電位変化の測定グラフ(測定開始直後と測定終了直前のもの)を図5に示し、これに基づいて得られた、対応する測定開始直後と測定終了直前のRate Meterを図6に示す。この場合、「B2/B1」の値が1.0に近く、評価点が「5」であって「スパイクピーク安定性が良好である」と評価することができる。
【0104】
一方、実施例6に係る神経線維保護剤組成物を用いた場合の経時的測定における電位変化の測定グラフを図7に示し、これに基づいて得られたAmplitude Histogram(測定開始直後と測定終了直前のもの)を図8に示す。この場合には「A2−A1」の値が絶対値表記で0.01v以下と極めて小さく、「ベースライン安定性が非常に優れる」ことが良く分かる。
【0105】
【表1】

【0106】
【表2】

【0107】
【表3】

【産業上の利用可能性】
【0108】
本発明によって、刺激性物質の電気生理学的評価において知覚神経線維を評価対象外の刺激要因から有効に保護し、経時的計測においてベースラインの太さを安定的に維持する神経線維保護剤組成物と、これを用いた刺激性物質の評価方法及び評価システムが提供される。
【特許請求の範囲】
【請求項1】
刺激性物質の電気生理学的評価において知覚神経線維を保護するために用いる保護剤組成物であって、実質的に油性成分からなり、25℃における粘度(mPa・s)が500〜500,000の範囲内であることを特徴とする神経線維保護剤組成物。
【請求項2】
前記神経線維保護剤組成物において、(A)ワセリン及び(B)ラノリンから選ばれる1種以上が油性成分の20質量%以上を占めることを特徴とする請求項1に記載の神経線維保護剤組成物。
【請求項3】
前記神経線維保護剤組成物が、更に油性成分として(C)液状炭化水素から選ばれる1種以上を含有し、25℃における粘度(mPa・s)が25,000〜150,000の範囲内であることを特徴とする請求項2に記載の神経線維保護剤組成物。
【請求項4】
請求項1〜請求項3のいずれかに記載の神経線維保護剤組成物により被覆した非ヒト動物の知覚神経線維に刺激性物質を作用させて当該刺激性物質を評価することを特徴とする刺激性物質の評価方法。
【請求項5】
以下の(イ)〜(ハ)の構成要素を含むことを特徴とする刺激性物質の評価システム。
(イ)非ヒト動物の神経線維。
(ロ)上記神経線維を被覆している請求項1〜請求項3のいずれかに記載の神経線維保護剤組成物。
(ハ)上記神経線維に接触させた電極を含んで構成される知覚神経線維の電位変化の測定・記録手段。
【請求項1】
刺激性物質の電気生理学的評価において知覚神経線維を保護するために用いる保護剤組成物であって、実質的に油性成分からなり、25℃における粘度(mPa・s)が500〜500,000の範囲内であることを特徴とする神経線維保護剤組成物。
【請求項2】
前記神経線維保護剤組成物において、(A)ワセリン及び(B)ラノリンから選ばれる1種以上が油性成分の20質量%以上を占めることを特徴とする請求項1に記載の神経線維保護剤組成物。
【請求項3】
前記神経線維保護剤組成物が、更に油性成分として(C)液状炭化水素から選ばれる1種以上を含有し、25℃における粘度(mPa・s)が25,000〜150,000の範囲内であることを特徴とする請求項2に記載の神経線維保護剤組成物。
【請求項4】
請求項1〜請求項3のいずれかに記載の神経線維保護剤組成物により被覆した非ヒト動物の知覚神経線維に刺激性物質を作用させて当該刺激性物質を評価することを特徴とする刺激性物質の評価方法。
【請求項5】
以下の(イ)〜(ハ)の構成要素を含むことを特徴とする刺激性物質の評価システム。
(イ)非ヒト動物の神経線維。
(ロ)上記神経線維を被覆している請求項1〜請求項3のいずれかに記載の神経線維保護剤組成物。
(ハ)上記神経線維に接触させた電極を含んで構成される知覚神経線維の電位変化の測定・記録手段。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2012−201646(P2012−201646A)
【公開日】平成24年10月22日(2012.10.22)
【国際特許分類】
【出願番号】特願2011−68757(P2011−68757)
【出願日】平成23年3月25日(2011.3.25)
【出願人】(000113274)ホーユー株式会社 (278)
【出願人】(305060567)国立大学法人富山大学 (194)
【Fターム(参考)】
【公開日】平成24年10月22日(2012.10.22)
【国際特許分類】
【出願日】平成23年3月25日(2011.3.25)
【出願人】(000113274)ホーユー株式会社 (278)
【出願人】(305060567)国立大学法人富山大学 (194)
【Fターム(参考)】
[ Back to top ]

