立体構造予測方法,立体構造予測プログラム及び質量分析装置
【課題】
質量分析装置を用いて、タンパク質やペプチドの立体構造の形成に重要な所定結合部位を予測し、立体構造情報の取得を実現する。
【解決手段】
質量分析の前処理法として、タンパク質またはペプチド試料に対して、立体構造の形成に重要な所定結合を切断する切断剤を添加して前処理を行い測定試料とする場合と、切断剤を添加せずに前処理を行い測定試料とする場合の2通りを行い、この2通りで処理した測定試料を質量分析装置で測定し、得られた測定データを比較解析することで、所定結合の部位を予測する。
質量分析装置を用いて、タンパク質やペプチドの立体構造の形成に重要な所定結合部位を予測し、立体構造情報の取得を実現する。
【解決手段】
質量分析の前処理法として、タンパク質またはペプチド試料に対して、立体構造の形成に重要な所定結合を切断する切断剤を添加して前処理を行い測定試料とする場合と、切断剤を添加せずに前処理を行い測定試料とする場合の2通りを行い、この2通りで処理した測定試料を質量分析装置で測定し、得られた測定データを比較解析することで、所定結合の部位を予測する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、立体構造予測方法,立体構造予測プログラム及び質量分析装置に関し、特にタンパク質またはペプチドの立体構造解析と翻訳後修飾部位の解析に好適な技術に関する。
【背景技術】
【0002】
質量分析のための一般的な前処理方法では、タンパク質やペプチドに含まれるシステイン残基間のジスルフィド結合を還元化する還元剤や水素結合を切断する変性剤などを添加することによって、タンパク質の立体構造を形成するために重要な結合を切断し、タンパク質分解酵素などによるタンパク質のペプチド断片化が効率良く進むよう処理する。そのため、得られる質量分析データにはタンパク質の立体構造情報は含まれていない。これに対し、非特許文献1では対象試料のジスルフィド結合を切断せずに質量分析し、対象試料のアミノ酸配列を基に構築したMS/MSスペクトルデータベースに対して、データベース検索してジスルフィド結合を予測する。
【0003】
【非特許文献1】Jiaxi Wang, Bin Ma, Weiwu Chen“Disulfide bonded Dipeptide Analysis with PEAKS and Q-TOF Mass Spectrometry”ASMS2007,June 3−7、P.6−P.7
【発明の開示】
【発明が解決しようとする課題】
【0004】
タンパク質は、固有の立体構造をとることによって、生体中でそれぞれの機能を発揮することができる。そのため、生体中でタンパク質がどのような機能を果たすかを解明するためには、立体構造の解析が重要となる。
【0005】
タンパク質の立体構造形成には、アミノ酸配列上で離れた位置に存在するシステイン残基間のジスルフィド結合や水素結合などが大きく影響する。また、機能発現のためには糖鎖やリン酸基などの翻訳後修飾が重要となっている。
【0006】
現在の質量分析装置では、前処理段階でタンパク質やペプチドの構造形成に重要な結合を決断するという処置を行うため、このような結合部位についての情報が失われ、立体構造を推測することができないという課題がある。さらに、前述の非特許文献1では、ジスルフィド結合に関する質量分析について述べているが、MS/MSスペクトルデータベースを構築する際に、構造予測する対象試料のアミノ酸配列が不明である場合を配慮されていない、またジスルフィド結合以外のタンパク質立体構造を形成するために重要な結合や翻訳後修飾部位の予測に対応していない、という課題がある。
【0007】
本発明の1つの目的は、立体構造形成に重要な結合を保ったままの試料を質量分析し、得られたデータから結合部位や翻訳後修飾部位を予測し、立体構造情報の取得を実現することである。
【課題を解決するための手段】
【0008】
本発明の1つの特徴は、立体構造形成に重要な結合または翻訳後修飾部位の結合を切断する切断剤を添加する第1の方法を用いて質量分析して得られた第1のデータファイルと、前述の切断剤を添加しない第2の方法を用いて質量分析して得られた第2のデータファイルを比較解析する方法にある。これにより、タンパク質またはペプチドの立体構造形成に重要な結合の部位や、翻訳後修飾の部位を質量分析装置で予測する方法を実現するものである。
【0009】
本発明の他の特徴は、(1)立体構造解析方法において、前記第1の方法と前記第2の方法で前処理し、それぞれの試料を質量分析装置で測定することにより、タンパク質やペプチドの立体構造情報を得るものである。
【0010】
本発明のその他の特徴は、(2)立体構造解析プログラムにおいて、前記第1の方法で前処理した試料の質量分析データをデータベース検索して、アミノ酸配列を同定する。同定されたアミノ酸配列から、立体構造形成に重要な結合に関わるアミノ酸残基を含むペプチドが結合を形成するとしたときの質量、または翻訳後修飾されるアミノ酸残基を含むペプチドが翻訳後修飾されるとしたときの質量を求める。この質量を、第2の方法で前処理した試料の質量分析データと比較し、一致する質量を探索することで、立体構造に重要な結合を形成する部位、または翻訳後修飾される部位を予測するものである。
【発明の効果】
【0011】
本発明の1つの態様によれば、質量分析データから、タンパク質またはペプチドの立体構造形成に重要な結合の部位や、翻訳後修飾部位を予測することが可能となる。
【0012】
また、本発明の他の態様によれば、複雑な処理や条件検討をせずに簡便にタンパク質の構造を解析することが可能となり、今まで困難であったタンパク質の構造や機能の解明に貢献できる。
【発明を実施するための最良の形態】
【0013】
本発明の実施形態の一例を、図1から図8を用いて説明する。
【0014】
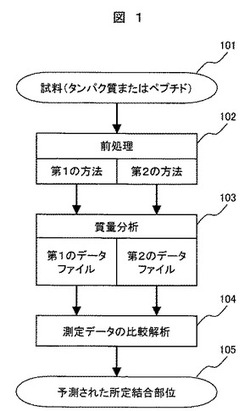
図1は、本発明の実施形態の処理の流れを示した図である。
【0015】
試料(タンパク質またはペプチド)101を2通りの方法で前処理102を行う。1つは、切断剤を添加して所定結合を切断する第1の方法である。もう1つは、切断剤を添加せずに所定結合を切断しない第2の方法である。この2通りで前処理を行い、ペプチド断片化する。この2通りで処理した試料を質量分析103し、それぞれの測定データとして、第1のデータファイルと第2のデータファイルを得る。この第1のデータファイルと第2のデータファイルを比較解析処理104することで、予測された所定結合部位105の情報を得る。以下、各段階について詳細に説明する。
【0016】
1.前処理
図2は、本発明の実施形態の前処理の一例を示す概略図である。
【0017】
図2左側の左フローは、第1の方法を表しており、クロマトグラフ質量分析装置の通常の前処理方法と同じである。タンパク質またはペプチドである試料201に、切断剤を添加する切断剤の添加処理202を行い、所定結合を切断後、タンパク質試料の場合は酵素消化処理203を行うことにより、ペプチド断片化し、測定試料204とする。
【0018】
図2右側の右フローは、第2の方法を表しており、所定結合を切断しない前処理方法である。タンパク質またはペプチドである試料201に、タンパク質試料の場合は酵素消化処理203して、測定試料204とする。
【0019】
2.質量分析
図3は、本発明の実施形態のクロマトグラフ質量分析装置の構成例を示す概略図である。
【0020】
前処理後の測定試料301を、液体クロマトグラフ部302の分離カラム303を用い、吸着・分配などの相互作用によって、ペプチド成分が保持時間に従って分離される。そして、質量分析装置本体304のイオン源305でイオン化後、質量分離装置306で質量分離されて検出器307で質量数とその信号強度が検出される。この検出データを、コンピュータを有するデータ処理装置308に取り込み、各ペプチドフラグメントの保持時間,質量対電荷比m/z(mはイオン質量、zはイオンの荷数),信号強度の情報を含む測定データが得られる。質量分離装置306は、図で示したイオントラップ方式の他、磁場型・四重極型・飛行時間型などの質量分離を行う装置であってもよい。
【0021】
3.データ解析
図4は、本発明の実施形態における測定データの比較解析の説明図である。
【0022】
第1の方法で前処理した試料の測定データである第1のデータファイル401について、既存のデータベース検索ソフトウェアを用いてデータベース検索402し、ペプチドのアミノ酸配列の同定403を行う。そして、同定されたペプチドのアミノ酸配列から所定結合に関わるアミノ酸残基を含むペプチドの抽出404を行う。この抽出したペプチドが所定結合を形成すると仮定したときの質量対電荷比を算出し、第1の質量対電荷比リストの作成405を行う。
【0023】
一方、第2の方法で前処理した試料の測定データである第2のデータファイル406から、第2の質量対電荷比リストの作成407を行う。この第2の質量対電荷比リストと、第1の質量対電荷比リストの作成405で作成した第1の質量対電荷比リストの質量対電荷比を比較する質量対電荷比の比較処理408を行う。そして、一致する質量対電荷比の抽出409を行う。これにより、所定結合を形成するアミノ酸残基の予測410を行う。このようにして、所定結合を形成するアミノ酸残基を同定することによって、タンパク質またはペプチドの立体構造を予測することが可能となる。図4の符号404,405,408,409,410の各段階について、図5,図6で更に詳細に説明する。
【0024】
図5は、図4に示す比較解析の詳細を表す図である。第1のデータファイル501をデータベース検索してペプチドのアミノ酸配列を同定して得られた結果であるデータベース検索によるペプチドのアミノ酸配列の同定結果502から、所定結合に関わるアミノ酸残基を含むペプチドPiとペプチドPjが、所定結合を形成すると仮定したときの質量M(Pi,j)503を求める。この質量M(Pi,j)503について、電荷z=2,3,4,5のときの質量対電荷比を算出して質量対電荷比の計算値M(Pi,j)/z(z=2,3,4,5)504とする。この質量対電荷比の計算値M(Pi,j)/z(z=2,3,4,5)504と、第2のデータファイルから得られる質量対電荷比m/zn505とを比較する比較処理506を実行する。比較処理506では、m/znに対して、±1.0以内で一致するM(Pi,j)/zがある場合(図中YES)、このPiとPjの所定結合に関わるアミノ酸残基の間で所定結合が形成されるとの予測結果507を得る。
【0025】
図6は、図5に示す比較解析の詳細を記号で記載した図である。符号601は、所定結合に関わるアミノ酸残基を含むペプチドPiとPjが所定結合を形成すると仮定したときの質量M(Pi,j)を示し、ペプチドの総当りの組合せで質量を求める。符号602は、電荷z=2,3,4,5のときの質量対電荷比の計算値M(Pi,j)/zであり、符号603は、第2のデータファイルから得られる質量対電荷比m/znである。そして、電荷z=2,3,4,5のときの質量対電荷比の計算値M(Pi,j)/z602と第2のデータファイルから得られる質量対電荷比m/zn603とを比較することとなる。
【実施例1】
【0026】
以下に本発明の実施例1について図面を用いて説明する。
【0027】
実施例1として、ウシ血清アルブミン(BSA)の立体構造形成に重要な役割を果たすジスルフィド(S−S)結合部位の同定する場合を挙げる。図7において、アミノ酸配列701は、ウシ血清アルブミン(BSA)のアミノ酸配列であり、35個のシステイン残基を含んでいる。ウシ血清アルブミンのジスルフィド結合部位を示す符号702では、34個のシステイン残基によって17ヶ所のS−S結合が形成されていることを示している。
【0028】
まず、実施例1における前処理について説明する。前処理における第1の方法では、S−S結合を切断する切断剤として、還元剤であるジチオスレイトール添加する。還元化されチオール基となったシステイン残基のを、ヨードアセトアミドによってアルキル化する。そして、トリプシンなどのタンパク質分解酵素を用いて、BSAをペプチド断片化する。これを調製して測定試料とする。第2の方法では、切断剤を添加せずにタンパク質分解酵素でペプチド断片化した後に、これを調製して測定試料とする。
【0029】
この2種の試料を、nanoLC/IT−TOF(ナノ液体クロマトグラフ/イオントラップ−飛行時間型)質量分析装置(NanoFrontierL(日立ハイテク))によって質量分析し、測定データとして、第1のデータファイルと第2のデータファイルを得る。
【0030】
次にデータ解析について説明する。第1のデータファイルをデータベース検索ソフトウェアMascotで検索する。この結果、システイン残基32個を含む23のペプチド断片のアミノ酸配列が同定される。確認として、第2のデータファイルをMascot検索したところ、システイン残基を含むペプチド断片は同定されず、S−S結合が切断されていないことが検証される。
【0031】
データベース検索の結果得られた23のペプチド断片について、総当りの組合せでS−S結合を形成したときの質量M(Pi,j)を算出する。このM(Pi,j)から、z=2,3,4,5のときの質量対電荷比M(Pi,j)/zを算出する。
【0032】
この第1のデータファイルから算出したM(Pi,j)/zと、第2のデータファイルのうち信号強度が500以上になるm/znとを比較して、この差が±1.0以内にあるものを抽出する。そして、抽出されたM(Pi,j)/zの値をもつペプチドPiとPjのシステイン間で、S−S結合を形成していると予測される。
【0033】
図8に、BSAのジスルフィド結合部位を予測するときのデータの一例を示す。ウシ血清アルブミンの第1のデータファイルから算出される質量対電荷比M(Pi,j)/zの一例801として、ウシ血清アルブミンの第1のデータファイルから同定された質量1033.5のペプチドPiと質量1493.6のペプチドPjが、ジスルフィド結合を形成すると仮定するとその質量は2357.0と算出され、この質量対電荷比M(Pi,j)/zはz=5のとき472.4となることを示す。
【0034】
ウシ血清アルブミンの第2のデータファイルから得られる質量対電荷比m/znの一例802に示すように、ウシ血清アルブミンの第2のデータファイルにm/zn473.3345があるため、このペプチドPiとPjはS−S結合を形成すると予測される。
【0035】
ウシ血清アルブミンの114番目のシステイン残基と125番目のシステイン残基はジスルフィド結合を形成していることを示すチャート803に示すように、ペプチドPiの125番目のシステイン残基と、ペプチドPjの114番目のシステイン残基は、実際にS−S結合を形成しており、本発明が有効であることが示される。
【0036】
以上より、本発明によって、タンパク質またはペプチドの立体構造を簡便に予測できるようになり、質量分析装置でタンパク質やペプチドの質量や一次構造だけでなく、二次構造や三次構造まで解析できるようになるという効果が得られる。
【0037】
本明細書の開示の一例を以下列挙すると、
1.タンパク質またはペプチドを有する試料について切断剤を添加して所定結合を切断して処理する第1の工程と、前記試料について前記切断剤を添加しないで所定結合を残したまま処理する第2の工程とを有する前処理工程と、前記第1の工程で得られた測定試料と前記第2の工程で得られた測定試料に関する質量分析データを比較することで所定結合の部位を予測する工程と、を有することにより立体構造を予測する立体構造予測方法。
【0038】
2.上記1.において、前記所定結合は、タンパク質またはペプチドが立体構造を形成するための重要な結合、または翻訳後修飾部位における結合であり、前記切断剤は、前記所定結合を解離させる物質であることを特徴とする立体構造予測方法。
【0039】
3.上記2.において、前記タンパク質またはペプチドが立体構造を形成するための重要な結合とは、ジスルフィド結合,水素結合,イオン結合,疎水性相互作用であり、翻訳後修飾部位における結合とは、リン酸化部位や糖鎖修飾部位などであり、前記所定結合を解離させる物質とは、ジスルフィド結合に対して還元性を示す物質や水素結合を切断する変性剤などであることを特徴とする立体構造予測方法。
【0040】
4.タンパク質またはペプチドを有する試料について切断剤を添加して所定結合を切断して処理する第1の工程を用いて得られる測定試料の質量分析データから同定された、前記所定結合に関わるアミノ酸残基を含むペプチドの質量を基に、2つ以上のペプチドの前記所定結合に関わるアミノ酸残基間でジスルフィド結合を形成しているときに観測される予測質量を算出する手順と、前記予測質量と前記試料について前記切断剤を添加しないで所定結合を残したまま処理する第2の工程を用いて得られる測定試料の質量分析データを比較して一致する質量があるかを探索する手順を、コンピュータに実行させる立体構造予測プログラム。
【0041】
5.上記4.において、前記プログラムとは、前記所定結合の部位を予測することにより立体構造を予測することを特徴とする立体構造予測プログラム。
【0042】
6.試料を成分に分離し、その分離された成分をイオン化して質量を分析する質量分析部と、前記質量分析部からの分析データを処理するデータ処理部を有する質量分析装置において、タンパク質またはペプチドを有する試料について切断剤を添加して所定結合を切断して処理する第1の工程を用いて得られる測定試料を質量分析した結果を第1のデータファイルとする処理と、前記試料について前記切断剤を添加しないで所定結合を残したまま処理する第2の工程を用いて得られる測定試料を質量分析した結果を第2のデータファイルとする処理と、を実行することを特徴とする質量分析装置。
【0043】
本発明は、上記実施例に限定されるものではなく、その技術思想の範囲内で、種々変形可能である。
【図面の簡単な説明】
【0044】
【図1】本発明の実施形態の処理の流れを示した図である。
【図2】本発明の実施形態の一例である前処理の概略図である。
【図3】本発明の実施形態のクロマトグラフ質量分析装置の構成例を示す概略図である。
【図4】本発明の実施形態における測定データの比較解析の説明図である。
【図5】図4に示す比較解析の詳細を表す図である。
【図6】図5に示す比較解析の詳細を記号で記載した図である。
【図7】ウシ血清アルブミンのアミノ酸配列とジスルフィド結合部位である。
【図8】BSAのジスルフィド結合部位予測の一例である。
【符号の説明】
【0045】
101 試料(タンパク質またはペプチド)
102 前処理
103 質量分析
104 比較解析処理
105 予測された所定結合部位
201 試料
202 切断剤の添加処理
203 酵素消化処理
204 測定試料
301 前処理後の測定試料
302 液体クロマトグラフ部
303 分離カラム
304 質量分析装置本体
305 イオン源
306 質量分離装置
307 検出器
308 データ処理装置
401 第1の方法で前処理した試料の測定データである第1のデータファイル
402 データベース検索
403 ペプチドのアミノ酸配列の同定
404 所定結合に関わるアミノ酸残基を含むペプチドの抽出
405 第1の質量対電荷比リストの作成
406 第2の方法で前処理した試料の測定データである第2のデータファイル
407 第2の質量対電荷比リストの作成
408 質量対電荷比の比較処理
409 一致する質量対電荷比の抽出
410 所定結合を形成するアミノ酸残基の予測
501 第1のデータファイル
502 データベース検索によるペプチドのアミノ酸配列の同定結果
503 質量M(Pi,j)
504 質量対電荷比の計算値M(Pi,j)/z(z=2,3,4,5)
505 第2のデータファイルから得られる質量対電荷比m/zn
506 比較処理
507 予測結果
601 所定結合に関わるアミノ酸残基を含むペプチドPiとPjが所定結合を形成すると仮定したときの質量M(Pi,j)
602 電荷z=2,3,4,5のときの質量対電荷比の計算値M(Pi,j)/z
603 第2のデータファイルから得られる質量対電荷比m/zn
701 アミノ酸配列
702 ウシ血清アルブミンのジスルフィド結合部位
801 ウシ血清アルブミンの第1のデータファイルから算出される質量対電荷比M(Pi,j)/zの一例
802 ウシ血清アルブミンの第2のデータファイルから得られる質量対電荷比m/znの一例
803 ウシ血清アルブミンの114番目のシステイン残基と125番目のシステイン残
基はジスルフィド結合を形成していることを示すチャート
【技術分野】
【0001】
本発明は、立体構造予測方法,立体構造予測プログラム及び質量分析装置に関し、特にタンパク質またはペプチドの立体構造解析と翻訳後修飾部位の解析に好適な技術に関する。
【背景技術】
【0002】
質量分析のための一般的な前処理方法では、タンパク質やペプチドに含まれるシステイン残基間のジスルフィド結合を還元化する還元剤や水素結合を切断する変性剤などを添加することによって、タンパク質の立体構造を形成するために重要な結合を切断し、タンパク質分解酵素などによるタンパク質のペプチド断片化が効率良く進むよう処理する。そのため、得られる質量分析データにはタンパク質の立体構造情報は含まれていない。これに対し、非特許文献1では対象試料のジスルフィド結合を切断せずに質量分析し、対象試料のアミノ酸配列を基に構築したMS/MSスペクトルデータベースに対して、データベース検索してジスルフィド結合を予測する。
【0003】
【非特許文献1】Jiaxi Wang, Bin Ma, Weiwu Chen“Disulfide bonded Dipeptide Analysis with PEAKS and Q-TOF Mass Spectrometry”ASMS2007,June 3−7、P.6−P.7
【発明の開示】
【発明が解決しようとする課題】
【0004】
タンパク質は、固有の立体構造をとることによって、生体中でそれぞれの機能を発揮することができる。そのため、生体中でタンパク質がどのような機能を果たすかを解明するためには、立体構造の解析が重要となる。
【0005】
タンパク質の立体構造形成には、アミノ酸配列上で離れた位置に存在するシステイン残基間のジスルフィド結合や水素結合などが大きく影響する。また、機能発現のためには糖鎖やリン酸基などの翻訳後修飾が重要となっている。
【0006】
現在の質量分析装置では、前処理段階でタンパク質やペプチドの構造形成に重要な結合を決断するという処置を行うため、このような結合部位についての情報が失われ、立体構造を推測することができないという課題がある。さらに、前述の非特許文献1では、ジスルフィド結合に関する質量分析について述べているが、MS/MSスペクトルデータベースを構築する際に、構造予測する対象試料のアミノ酸配列が不明である場合を配慮されていない、またジスルフィド結合以外のタンパク質立体構造を形成するために重要な結合や翻訳後修飾部位の予測に対応していない、という課題がある。
【0007】
本発明の1つの目的は、立体構造形成に重要な結合を保ったままの試料を質量分析し、得られたデータから結合部位や翻訳後修飾部位を予測し、立体構造情報の取得を実現することである。
【課題を解決するための手段】
【0008】
本発明の1つの特徴は、立体構造形成に重要な結合または翻訳後修飾部位の結合を切断する切断剤を添加する第1の方法を用いて質量分析して得られた第1のデータファイルと、前述の切断剤を添加しない第2の方法を用いて質量分析して得られた第2のデータファイルを比較解析する方法にある。これにより、タンパク質またはペプチドの立体構造形成に重要な結合の部位や、翻訳後修飾の部位を質量分析装置で予測する方法を実現するものである。
【0009】
本発明の他の特徴は、(1)立体構造解析方法において、前記第1の方法と前記第2の方法で前処理し、それぞれの試料を質量分析装置で測定することにより、タンパク質やペプチドの立体構造情報を得るものである。
【0010】
本発明のその他の特徴は、(2)立体構造解析プログラムにおいて、前記第1の方法で前処理した試料の質量分析データをデータベース検索して、アミノ酸配列を同定する。同定されたアミノ酸配列から、立体構造形成に重要な結合に関わるアミノ酸残基を含むペプチドが結合を形成するとしたときの質量、または翻訳後修飾されるアミノ酸残基を含むペプチドが翻訳後修飾されるとしたときの質量を求める。この質量を、第2の方法で前処理した試料の質量分析データと比較し、一致する質量を探索することで、立体構造に重要な結合を形成する部位、または翻訳後修飾される部位を予測するものである。
【発明の効果】
【0011】
本発明の1つの態様によれば、質量分析データから、タンパク質またはペプチドの立体構造形成に重要な結合の部位や、翻訳後修飾部位を予測することが可能となる。
【0012】
また、本発明の他の態様によれば、複雑な処理や条件検討をせずに簡便にタンパク質の構造を解析することが可能となり、今まで困難であったタンパク質の構造や機能の解明に貢献できる。
【発明を実施するための最良の形態】
【0013】
本発明の実施形態の一例を、図1から図8を用いて説明する。
【0014】
図1は、本発明の実施形態の処理の流れを示した図である。
【0015】
試料(タンパク質またはペプチド)101を2通りの方法で前処理102を行う。1つは、切断剤を添加して所定結合を切断する第1の方法である。もう1つは、切断剤を添加せずに所定結合を切断しない第2の方法である。この2通りで前処理を行い、ペプチド断片化する。この2通りで処理した試料を質量分析103し、それぞれの測定データとして、第1のデータファイルと第2のデータファイルを得る。この第1のデータファイルと第2のデータファイルを比較解析処理104することで、予測された所定結合部位105の情報を得る。以下、各段階について詳細に説明する。
【0016】
1.前処理
図2は、本発明の実施形態の前処理の一例を示す概略図である。
【0017】
図2左側の左フローは、第1の方法を表しており、クロマトグラフ質量分析装置の通常の前処理方法と同じである。タンパク質またはペプチドである試料201に、切断剤を添加する切断剤の添加処理202を行い、所定結合を切断後、タンパク質試料の場合は酵素消化処理203を行うことにより、ペプチド断片化し、測定試料204とする。
【0018】
図2右側の右フローは、第2の方法を表しており、所定結合を切断しない前処理方法である。タンパク質またはペプチドである試料201に、タンパク質試料の場合は酵素消化処理203して、測定試料204とする。
【0019】
2.質量分析
図3は、本発明の実施形態のクロマトグラフ質量分析装置の構成例を示す概略図である。
【0020】
前処理後の測定試料301を、液体クロマトグラフ部302の分離カラム303を用い、吸着・分配などの相互作用によって、ペプチド成分が保持時間に従って分離される。そして、質量分析装置本体304のイオン源305でイオン化後、質量分離装置306で質量分離されて検出器307で質量数とその信号強度が検出される。この検出データを、コンピュータを有するデータ処理装置308に取り込み、各ペプチドフラグメントの保持時間,質量対電荷比m/z(mはイオン質量、zはイオンの荷数),信号強度の情報を含む測定データが得られる。質量分離装置306は、図で示したイオントラップ方式の他、磁場型・四重極型・飛行時間型などの質量分離を行う装置であってもよい。
【0021】
3.データ解析
図4は、本発明の実施形態における測定データの比較解析の説明図である。
【0022】
第1の方法で前処理した試料の測定データである第1のデータファイル401について、既存のデータベース検索ソフトウェアを用いてデータベース検索402し、ペプチドのアミノ酸配列の同定403を行う。そして、同定されたペプチドのアミノ酸配列から所定結合に関わるアミノ酸残基を含むペプチドの抽出404を行う。この抽出したペプチドが所定結合を形成すると仮定したときの質量対電荷比を算出し、第1の質量対電荷比リストの作成405を行う。
【0023】
一方、第2の方法で前処理した試料の測定データである第2のデータファイル406から、第2の質量対電荷比リストの作成407を行う。この第2の質量対電荷比リストと、第1の質量対電荷比リストの作成405で作成した第1の質量対電荷比リストの質量対電荷比を比較する質量対電荷比の比較処理408を行う。そして、一致する質量対電荷比の抽出409を行う。これにより、所定結合を形成するアミノ酸残基の予測410を行う。このようにして、所定結合を形成するアミノ酸残基を同定することによって、タンパク質またはペプチドの立体構造を予測することが可能となる。図4の符号404,405,408,409,410の各段階について、図5,図6で更に詳細に説明する。
【0024】
図5は、図4に示す比較解析の詳細を表す図である。第1のデータファイル501をデータベース検索してペプチドのアミノ酸配列を同定して得られた結果であるデータベース検索によるペプチドのアミノ酸配列の同定結果502から、所定結合に関わるアミノ酸残基を含むペプチドPiとペプチドPjが、所定結合を形成すると仮定したときの質量M(Pi,j)503を求める。この質量M(Pi,j)503について、電荷z=2,3,4,5のときの質量対電荷比を算出して質量対電荷比の計算値M(Pi,j)/z(z=2,3,4,5)504とする。この質量対電荷比の計算値M(Pi,j)/z(z=2,3,4,5)504と、第2のデータファイルから得られる質量対電荷比m/zn505とを比較する比較処理506を実行する。比較処理506では、m/znに対して、±1.0以内で一致するM(Pi,j)/zがある場合(図中YES)、このPiとPjの所定結合に関わるアミノ酸残基の間で所定結合が形成されるとの予測結果507を得る。
【0025】
図6は、図5に示す比較解析の詳細を記号で記載した図である。符号601は、所定結合に関わるアミノ酸残基を含むペプチドPiとPjが所定結合を形成すると仮定したときの質量M(Pi,j)を示し、ペプチドの総当りの組合せで質量を求める。符号602は、電荷z=2,3,4,5のときの質量対電荷比の計算値M(Pi,j)/zであり、符号603は、第2のデータファイルから得られる質量対電荷比m/znである。そして、電荷z=2,3,4,5のときの質量対電荷比の計算値M(Pi,j)/z602と第2のデータファイルから得られる質量対電荷比m/zn603とを比較することとなる。
【実施例1】
【0026】
以下に本発明の実施例1について図面を用いて説明する。
【0027】
実施例1として、ウシ血清アルブミン(BSA)の立体構造形成に重要な役割を果たすジスルフィド(S−S)結合部位の同定する場合を挙げる。図7において、アミノ酸配列701は、ウシ血清アルブミン(BSA)のアミノ酸配列であり、35個のシステイン残基を含んでいる。ウシ血清アルブミンのジスルフィド結合部位を示す符号702では、34個のシステイン残基によって17ヶ所のS−S結合が形成されていることを示している。
【0028】
まず、実施例1における前処理について説明する。前処理における第1の方法では、S−S結合を切断する切断剤として、還元剤であるジチオスレイトール添加する。還元化されチオール基となったシステイン残基のを、ヨードアセトアミドによってアルキル化する。そして、トリプシンなどのタンパク質分解酵素を用いて、BSAをペプチド断片化する。これを調製して測定試料とする。第2の方法では、切断剤を添加せずにタンパク質分解酵素でペプチド断片化した後に、これを調製して測定試料とする。
【0029】
この2種の試料を、nanoLC/IT−TOF(ナノ液体クロマトグラフ/イオントラップ−飛行時間型)質量分析装置(NanoFrontierL(日立ハイテク))によって質量分析し、測定データとして、第1のデータファイルと第2のデータファイルを得る。
【0030】
次にデータ解析について説明する。第1のデータファイルをデータベース検索ソフトウェアMascotで検索する。この結果、システイン残基32個を含む23のペプチド断片のアミノ酸配列が同定される。確認として、第2のデータファイルをMascot検索したところ、システイン残基を含むペプチド断片は同定されず、S−S結合が切断されていないことが検証される。
【0031】
データベース検索の結果得られた23のペプチド断片について、総当りの組合せでS−S結合を形成したときの質量M(Pi,j)を算出する。このM(Pi,j)から、z=2,3,4,5のときの質量対電荷比M(Pi,j)/zを算出する。
【0032】
この第1のデータファイルから算出したM(Pi,j)/zと、第2のデータファイルのうち信号強度が500以上になるm/znとを比較して、この差が±1.0以内にあるものを抽出する。そして、抽出されたM(Pi,j)/zの値をもつペプチドPiとPjのシステイン間で、S−S結合を形成していると予測される。
【0033】
図8に、BSAのジスルフィド結合部位を予測するときのデータの一例を示す。ウシ血清アルブミンの第1のデータファイルから算出される質量対電荷比M(Pi,j)/zの一例801として、ウシ血清アルブミンの第1のデータファイルから同定された質量1033.5のペプチドPiと質量1493.6のペプチドPjが、ジスルフィド結合を形成すると仮定するとその質量は2357.0と算出され、この質量対電荷比M(Pi,j)/zはz=5のとき472.4となることを示す。
【0034】
ウシ血清アルブミンの第2のデータファイルから得られる質量対電荷比m/znの一例802に示すように、ウシ血清アルブミンの第2のデータファイルにm/zn473.3345があるため、このペプチドPiとPjはS−S結合を形成すると予測される。
【0035】
ウシ血清アルブミンの114番目のシステイン残基と125番目のシステイン残基はジスルフィド結合を形成していることを示すチャート803に示すように、ペプチドPiの125番目のシステイン残基と、ペプチドPjの114番目のシステイン残基は、実際にS−S結合を形成しており、本発明が有効であることが示される。
【0036】
以上より、本発明によって、タンパク質またはペプチドの立体構造を簡便に予測できるようになり、質量分析装置でタンパク質やペプチドの質量や一次構造だけでなく、二次構造や三次構造まで解析できるようになるという効果が得られる。
【0037】
本明細書の開示の一例を以下列挙すると、
1.タンパク質またはペプチドを有する試料について切断剤を添加して所定結合を切断して処理する第1の工程と、前記試料について前記切断剤を添加しないで所定結合を残したまま処理する第2の工程とを有する前処理工程と、前記第1の工程で得られた測定試料と前記第2の工程で得られた測定試料に関する質量分析データを比較することで所定結合の部位を予測する工程と、を有することにより立体構造を予測する立体構造予測方法。
【0038】
2.上記1.において、前記所定結合は、タンパク質またはペプチドが立体構造を形成するための重要な結合、または翻訳後修飾部位における結合であり、前記切断剤は、前記所定結合を解離させる物質であることを特徴とする立体構造予測方法。
【0039】
3.上記2.において、前記タンパク質またはペプチドが立体構造を形成するための重要な結合とは、ジスルフィド結合,水素結合,イオン結合,疎水性相互作用であり、翻訳後修飾部位における結合とは、リン酸化部位や糖鎖修飾部位などであり、前記所定結合を解離させる物質とは、ジスルフィド結合に対して還元性を示す物質や水素結合を切断する変性剤などであることを特徴とする立体構造予測方法。
【0040】
4.タンパク質またはペプチドを有する試料について切断剤を添加して所定結合を切断して処理する第1の工程を用いて得られる測定試料の質量分析データから同定された、前記所定結合に関わるアミノ酸残基を含むペプチドの質量を基に、2つ以上のペプチドの前記所定結合に関わるアミノ酸残基間でジスルフィド結合を形成しているときに観測される予測質量を算出する手順と、前記予測質量と前記試料について前記切断剤を添加しないで所定結合を残したまま処理する第2の工程を用いて得られる測定試料の質量分析データを比較して一致する質量があるかを探索する手順を、コンピュータに実行させる立体構造予測プログラム。
【0041】
5.上記4.において、前記プログラムとは、前記所定結合の部位を予測することにより立体構造を予測することを特徴とする立体構造予測プログラム。
【0042】
6.試料を成分に分離し、その分離された成分をイオン化して質量を分析する質量分析部と、前記質量分析部からの分析データを処理するデータ処理部を有する質量分析装置において、タンパク質またはペプチドを有する試料について切断剤を添加して所定結合を切断して処理する第1の工程を用いて得られる測定試料を質量分析した結果を第1のデータファイルとする処理と、前記試料について前記切断剤を添加しないで所定結合を残したまま処理する第2の工程を用いて得られる測定試料を質量分析した結果を第2のデータファイルとする処理と、を実行することを特徴とする質量分析装置。
【0043】
本発明は、上記実施例に限定されるものではなく、その技術思想の範囲内で、種々変形可能である。
【図面の簡単な説明】
【0044】
【図1】本発明の実施形態の処理の流れを示した図である。
【図2】本発明の実施形態の一例である前処理の概略図である。
【図3】本発明の実施形態のクロマトグラフ質量分析装置の構成例を示す概略図である。
【図4】本発明の実施形態における測定データの比較解析の説明図である。
【図5】図4に示す比較解析の詳細を表す図である。
【図6】図5に示す比較解析の詳細を記号で記載した図である。
【図7】ウシ血清アルブミンのアミノ酸配列とジスルフィド結合部位である。
【図8】BSAのジスルフィド結合部位予測の一例である。
【符号の説明】
【0045】
101 試料(タンパク質またはペプチド)
102 前処理
103 質量分析
104 比較解析処理
105 予測された所定結合部位
201 試料
202 切断剤の添加処理
203 酵素消化処理
204 測定試料
301 前処理後の測定試料
302 液体クロマトグラフ部
303 分離カラム
304 質量分析装置本体
305 イオン源
306 質量分離装置
307 検出器
308 データ処理装置
401 第1の方法で前処理した試料の測定データである第1のデータファイル
402 データベース検索
403 ペプチドのアミノ酸配列の同定
404 所定結合に関わるアミノ酸残基を含むペプチドの抽出
405 第1の質量対電荷比リストの作成
406 第2の方法で前処理した試料の測定データである第2のデータファイル
407 第2の質量対電荷比リストの作成
408 質量対電荷比の比較処理
409 一致する質量対電荷比の抽出
410 所定結合を形成するアミノ酸残基の予測
501 第1のデータファイル
502 データベース検索によるペプチドのアミノ酸配列の同定結果
503 質量M(Pi,j)
504 質量対電荷比の計算値M(Pi,j)/z(z=2,3,4,5)
505 第2のデータファイルから得られる質量対電荷比m/zn
506 比較処理
507 予測結果
601 所定結合に関わるアミノ酸残基を含むペプチドPiとPjが所定結合を形成すると仮定したときの質量M(Pi,j)
602 電荷z=2,3,4,5のときの質量対電荷比の計算値M(Pi,j)/z
603 第2のデータファイルから得られる質量対電荷比m/zn
701 アミノ酸配列
702 ウシ血清アルブミンのジスルフィド結合部位
801 ウシ血清アルブミンの第1のデータファイルから算出される質量対電荷比M(Pi,j)/zの一例
802 ウシ血清アルブミンの第2のデータファイルから得られる質量対電荷比m/znの一例
803 ウシ血清アルブミンの114番目のシステイン残基と125番目のシステイン残
基はジスルフィド結合を形成していることを示すチャート
【特許請求の範囲】
【請求項1】
タンパク質またはペプチドを有する試料について切断剤を添加して所定結合を切断して処理する第1の工程と、前記試料について前記切断剤を添加しないで所定結合を残したまま処理する第2の工程とを有する前処理工程と、
前記第1の工程で得られた測定試料と前記第2の工程で得られた測定試料に関する質量分析データを比較することで所定結合の部位を予測する工程と、
を有することにより立体構造を予測する立体構造予測方法。
【請求項2】
請求項1において、
前記所定結合は、タンパク質またはペプチドが立体構造を形成するための重要な結合、または翻訳後修飾部位における結合であり、前記切断剤は、前記所定結合を解離させる物質であることを特徴とする立体構造予測方法。
【請求項3】
請求項2において、
前記タンパク質またはペプチドが立体構造を形成するための重要な結合とは、ジスルフィド結合,水素結合,イオン結合,疎水性相互作用であり、翻訳後修飾部位における結合とは、リン酸化部位や糖鎖修飾部位などであり、前記所定結合を解離させる物質とは、ジスルフィド結合に対して還元性を示す物質や水素結合を切断する変性剤などであることを特徴とする立体構造予測方法。
【請求項4】
タンパク質またはペプチドを有する試料について切断剤を添加して所定結合を切断して処理する第1の工程を用いて得られる測定試料の質量分析データから同定された、前記所定結合に関わるアミノ酸残基を含むペプチドの質量を基に、2つ以上のペプチドの前記所定結合に関わるアミノ酸残基間でジスルフィド結合を形成しているときに観測される予測質量を算出する手順と、
前記予測質量と前記試料について前記切断剤を添加しないで所定結合を残したまま処理する第2の工程を用いて得られる測定試料の質量分析データを比較して一致する質量があるかを探索する手順を、コンピュータに実行させる立体構造予測プログラム。
【請求項5】
請求項4において、
前記プログラムとは、前記所定結合の部位を予測することにより立体構造を予測することを特徴とする立体構造予測プログラム。
【請求項6】
試料を成分に分離し、その分離された成分をイオン化して質量を分析する質量分析部と、前記質量分析部からの分析データを処理するデータ処理部を有する質量分析装置において、
タンパク質またはペプチドを有する試料について切断剤を添加して所定結合を切断して処理する第1の工程を用いて得られる測定試料を質量分析した結果を第1のデータファイルとする処理と、
前記試料について前記切断剤を添加しないで所定結合を残したまま処理する第2の工程を用いて得られる測定試料を質量分析した結果を第2のデータファイルとする処理と、を
実行することを特徴とする質量分析装置。
【請求項1】
タンパク質またはペプチドを有する試料について切断剤を添加して所定結合を切断して処理する第1の工程と、前記試料について前記切断剤を添加しないで所定結合を残したまま処理する第2の工程とを有する前処理工程と、
前記第1の工程で得られた測定試料と前記第2の工程で得られた測定試料に関する質量分析データを比較することで所定結合の部位を予測する工程と、
を有することにより立体構造を予測する立体構造予測方法。
【請求項2】
請求項1において、
前記所定結合は、タンパク質またはペプチドが立体構造を形成するための重要な結合、または翻訳後修飾部位における結合であり、前記切断剤は、前記所定結合を解離させる物質であることを特徴とする立体構造予測方法。
【請求項3】
請求項2において、
前記タンパク質またはペプチドが立体構造を形成するための重要な結合とは、ジスルフィド結合,水素結合,イオン結合,疎水性相互作用であり、翻訳後修飾部位における結合とは、リン酸化部位や糖鎖修飾部位などであり、前記所定結合を解離させる物質とは、ジスルフィド結合に対して還元性を示す物質や水素結合を切断する変性剤などであることを特徴とする立体構造予測方法。
【請求項4】
タンパク質またはペプチドを有する試料について切断剤を添加して所定結合を切断して処理する第1の工程を用いて得られる測定試料の質量分析データから同定された、前記所定結合に関わるアミノ酸残基を含むペプチドの質量を基に、2つ以上のペプチドの前記所定結合に関わるアミノ酸残基間でジスルフィド結合を形成しているときに観測される予測質量を算出する手順と、
前記予測質量と前記試料について前記切断剤を添加しないで所定結合を残したまま処理する第2の工程を用いて得られる測定試料の質量分析データを比較して一致する質量があるかを探索する手順を、コンピュータに実行させる立体構造予測プログラム。
【請求項5】
請求項4において、
前記プログラムとは、前記所定結合の部位を予測することにより立体構造を予測することを特徴とする立体構造予測プログラム。
【請求項6】
試料を成分に分離し、その分離された成分をイオン化して質量を分析する質量分析部と、前記質量分析部からの分析データを処理するデータ処理部を有する質量分析装置において、
タンパク質またはペプチドを有する試料について切断剤を添加して所定結合を切断して処理する第1の工程を用いて得られる測定試料を質量分析した結果を第1のデータファイルとする処理と、
前記試料について前記切断剤を添加しないで所定結合を残したまま処理する第2の工程を用いて得られる測定試料を質量分析した結果を第2のデータファイルとする処理と、を
実行することを特徴とする質量分析装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2009−168695(P2009−168695A)
【公開日】平成21年7月30日(2009.7.30)
【国際特許分類】
【出願番号】特願2008−8617(P2008−8617)
【出願日】平成20年1月18日(2008.1.18)
【出願人】(501387839)株式会社日立ハイテクノロジーズ (4,325)
【Fターム(参考)】
【公開日】平成21年7月30日(2009.7.30)
【国際特許分類】
【出願日】平成20年1月18日(2008.1.18)
【出願人】(501387839)株式会社日立ハイテクノロジーズ (4,325)
【Fターム(参考)】
[ Back to top ]

