第VII因子または第VIIa因子のGlaドメイン変種
【課題】ヒト第VII因子またはヒト第VIIa因子ポリペプチドのGlaドメイン変種を提供する。
【解決手段】ヒト第VII因子またはヒト第VIIa因子に関連する1〜15個のアミノ酸改変を有し、34位における置換によって疎水性アミノ酸残基が導入されているか、または36位にアミノ酸の置換を有するか、または10位および32位にアミノ酸の置換、ならびに74位、77位および116位から選択される部位における少なくとも一つのさらなるアミノ酸置換を有する、前記ポリペプチド変種。
【解決手段】ヒト第VII因子またはヒト第VIIa因子に関連する1〜15個のアミノ酸改変を有し、34位における置換によって疎水性アミノ酸残基が導入されているか、または36位にアミノ酸の置換を有するか、または10位および32位にアミノ酸の置換、ならびに74位、77位および116位から選択される部位における少なくとも一つのさらなるアミノ酸置換を有する、前記ポリペプチド変種。
【発明の詳細な説明】
【技術分野】
【0001】
発明の分野
本発明は、第VII因子(FVII)または第VIIa因子(FVIIa)ポリペプチドの新規のGlaドメイン変種、ならびに、治療、特に様々な凝固関連障害の治療のための、そのようなポリペプチド変種の使用に関する。
【背景技術】
【0002】
発明の背景
血液凝固は、最終的にフィブリン凝血が起こる様々な血液成分(または因子)の複雑な相互作用からなるプロセスである。一般的に、「凝固カスケード」と呼ばれてきた事象に関与する血液成分は、プロ酵素またはチモーゲン、すなわち、活性化因子の作用によって活性型に変換される酵素的に不活性なタンパク質である。これらの凝固因子の1つはFVIIである。
【0003】
FVIIは、肝臓において合成され、血液中に分子量53 kDaの一本鎖糖タンパク質として分泌されるビタミンK依存的血漿タンパク質である(BrozeおよびMajerus、J. Biol. Chem. 1980;255:1242〜1247)。FVIIチモーゲンは、単一の部位R152-I153でのタンパク質溶解切断によって活性型(FVIIa)に変換され、それによって単一のジスルフィド結合によって結合された二つの鎖が得られる。組織因子と複合体を形成したFVIIa(FVIIa複合体)は第IX因子(FIX)と第X因子(FX)の両方をその活性型に変換することができ、その後迅速なトロンビン形成およびフィブリン形成に至る反応が起こる(OsterudおよびRapaport、Proc Natl Acad Sci USA 1977;74:5260〜5264)。
【0004】
FVIIは、ビタミンK依存的カルボキシル化を含む翻訳後改変を受け、それによって分子のN末端領域においてγ-カルボキシグルタミン酸残基10個が得られる。したがって、配列番号:1に示される残基番号6位、7位、14位、16位、19位、20位、25位、26位、29位および35位は、FVII活性にとって重要なGlaドメインにおけるγカルボキシグルタミン酸残基である。他の翻訳後改変には、145位および322位での天然に存在する二つのN-グリコシル化部位での、ならびに52位および60位での天然に存在する二つのO-グリコシル化部位でのそれぞれ糖部分の結合が含まれる。
【0005】
ヒトFVII(hFVII)をコードする遺伝子は、第13染色体のq34-qter9にマッピングされている(de Grouchyら、Hum Genet. 1984;66:230〜233)。これはエキソン9個を含み、12.8 Kbに及ぶ(O'Haraら、Proc Natl Acad Sci USA 1987;84:5158〜5162)。FVIIの遺伝子構築およびタンパク質構造は、他のビタミンK依存的前凝固タンパク質と類似であり、エキソン1aおよび1bはシグナル配列をコードし;エキソン2はポリペプチドおよびGlaドメイン;エキソン3は短い疎水性領域;エキソン4および5は上皮細胞増殖因子様ドメイン;およびエキソン6〜8はセリンプロテアーゼ触媒ドメインをコードする(Yoshitakeら、Biochemistry 1985;24:3736〜3750)。
【0006】
hFVIIa(Pikeら、Proc Natl Acad Sci USA、1999;96:8925〜30、およびKemball-Cookら、J. Struct. Biol. 1999;127:213〜223)、X線結晶学的方法を用いて可溶性組織因子と複合体を形成したhFVIIa(Bannerら、Nature 1996;380:41、およびZhangら、J. Mol. Biol.、 1999;285:2089)、およびhFVIIのより小さい断片(Muranyiら、Biochemistry、 1998;37:10605およびKaoら、Biochemistry、 1999;38:7097)の実験的三次元構造に関する報告がある。
【0007】
FVIIのいくつかのタンパク質工学による変種が報告されている(DickinsonおよびRuf、J Biol Chem、1997;272:19875〜19879、Kemball-Cookら、J Biol Chem、 1998;273:8516〜8521、Bharadwajら、J Biol Chem、1996;271:30685〜30691、Rufら、Biochemistry、1999;38:1957〜1966)。
【0008】
BHKまたは他の哺乳類細胞におけるFVIIの発現(国際公開公報第92/15686号、国際公開公報第91/11514号、および国際公開公報第88/10295号)ならびに真核細胞におけるFVIIおよびkex2エンドプロテアーゼの同時発現(国際公開公報第00/28065号)に関する報告が存在する。
【0009】
組み換え型ヒトFVIIa(rhFVIIa)の市販の調製物は、商品名NovoSeven(登録商標)として販売されている。NovoSeven(登録商標)は、血友病AまたはB患者における出血事例の治療に適応されている。NovoSeven(登録商標)は、現在市販されている出血事例の有効かつ信頼できる治療のための唯一のrhFVIIaである。
【0010】
152位のアルギニンおよび/または153位のイソロイシンが改変されているFVIIの不活性型が、国際公開公報第91/11514号において報告されている。これらのアミノ酸は活性化部位に存在する。国際公開公報第96/12800号は、セリンプロテアーゼ阻害剤によるFVIIaの不活化を記述している。α-アミノ基I153位でのFVIIaのカルバミル化による不活化は、Petersenら、Eur. J. Biochem、1999;261:124〜129によって記述されている。不活性型は、組織因子との結合および凝固活性の阻害に関して野生型FVIIまたはFVIIaと競合することができる。FVIIaの不活性型は、敗血症患者または心筋梗塞もしくは血栓症発作のリスクがある患者のような高凝固状態にある患者を治療するために用いることが示唆されている。
【0011】
外傷などの制御不能な出血の治療に関連して、FVIIaは組織因子と結合せずにFXをFXaへ活性化させることができると考えられており、この活性化反応はまず活性型血小板で生じると考えられている(Hednerら、Blood Coagulation & Fibrinolysis, 2000; 11; 107-111)。しかし、hFVIIaまたはrhFVIIaは、組織因子の非存在下ではFXに対する活性が低く、結果的に、例えば外傷患者の制御不能な出血の治療には、比較的高用量かつ複数用量のhFVIIaまたはrhFVIIaを投与することが必要となる。したがって、より効率的に(失血を最小限にするように)制御不能な出血を治療するためには、組織因子の非存在下でFXに対して高い活性を有する改良型FVIIa分子が必要である。そのような改良型FVIIa分子は、制御不能な出血に関連して投与された場合、rhFVIIaと比較して短い凝固時間(より早い作用/凝血活性の増加)を示すはずである。
【0012】
FVII/ FVIIaのGlaドメイン変種は、国際公開公報第99/20767号、米国特許第6,017,882号、および国際公開公報第00/66753号に開示されており、Glaドメインに位置するいくつかの残基が、リン脂質膜結合ひいてはFXの活性化に重要であるものとして同定された。特に、10位および32位の残基が重要であり、リン脂質膜結合親和性の増加ひいてはFXの活性化が、P10QおよびK32Eの変異を行うことで達成されうることが見出された。特に、限界的な凝固条件、例えば低レベルの組織因子が存在する条件下では、rhFVIIa と比較してFXの活性化が増強されることが明らかとなった。
【0013】
国際公開公報第01/58935号は、指向されたグリコシル化またはPEG化手段によって、とりわけ半減期が増加したFVIIまたはFVIIa分子を開発する新たな戦略を開示している。
【0014】
国際公開公報第03/093465号は、Glaドメイン内にある種の改変を有し、Glaドメインの外部に一つまたは複数のN-グリコシル化部位が導入されている、FVIIまたはFVIIaの変種を開示している。
【0015】
国際公開公報第2004/029091号は、組織因子結合部位にある種の改変を有するFVIIまたはFVIIaの変種を開示している。
【0016】
本発明者らは、リン脂質膜結合親和性をさらに増加させ、ひいてはFX活性化をさらに増大させる、Glaドメイン内のさらなる残基を同定した。本発明のFVIIまたはFVIIa変種は、組織因子結合親和性の減少も示しうる。
【0017】
本発明の目的は、hFVIIa、rhFVIIaまたは[P10Q+K32E]rhFVIIaよりも効率的にFXをFXaに活性化することのできる、改良型FVIIまたはFVIIa分子(FVIIまたはFVIIa変種)を提供することである。特に、組織因子の非存在下で、hFVIIa、rhFVIIa または[P10Q+K32E]rhFVIIaよりも効率的にFXをFXaに活性化することのできる改良型FVIIまたはFVIIa分子(FVIIまたはFVIIa変種)を提供することが本発明の目的である。これらの目的は、本明細書に提供されたFVIIまたはFVIIa変種によって対処される。
【発明の概要】
【0018】
発明の簡単な開示
本発明の第一の局面は、配列番号:1に示すアミノ酸配列を有するヒト第VII因子(hFVII)またはヒト第VIIa因子(hFVIIa)に関連する1〜15個のアミノ酸改変を含むアミノ酸配列を有し、34位に疎水性アミノ酸残基が置換により導入されている、第VII因子(FVII)または第VIIa因子(FVIIa)ポリペプチド変種に関する。
【0019】
本発明の第二の局面は、配列番号:1に示すアミノ酸配列を有するヒト第VII因子(hFVII)またはヒト第VIIa因子(hFVIIa)に関連する1〜15個のアミノ酸改変を含むアミノ酸配列を有し、このアミノ酸配列が36位にアミノ酸置換を含む、第VII因子(FVII)または第VIIa因子(FVIIa)ポリペプチド変種に関する。
【0020】
本発明の第三の局面は、配列番号:1に示すアミノ酸配列を有するヒト第VII因子(hFVII)またはヒト第VIIa因子(hFVIIa)に関連する3〜15個のアミノ酸改変を含むアミノ酸配列を有し、アミノ酸配列が、10位および32位におけるアミノ酸置換、ならびに74位、77位、および116位からなる群より選択される部位における少なくとも一つのさらなるアミノ酸置換を含む、第VII因子(FVII)または第VIIa因子(FVIIa)ポリペプチド変種に関する。
【0021】
本発明のさらなる局面は、本発明のポリペプチド変種をコードするヌクレオチド配列、そのヌクレオチド配列を含む発現ベクター、そのヌクレオチド配列または発現ベクターを含む宿主細胞に関する。
【0022】
本発明のなおさらなる局面は、本発明のポリペプチド変種を含む薬学的組成物、本発明のポリペプチド変種または本発明の薬学的組成物の薬剤としての使用、ならびに本発明のポリペプチド変種または薬学的組成物を用いた治療方法に関する。
【0023】
本発明のさらなる局面は、添付の特許請求の範囲だけでなく、下記の記載からも明らかになる。
【図面の簡単な説明】
【0024】
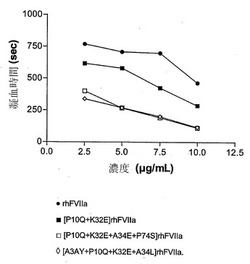
【図1】「全血アッセイ」でアッセイした場合の、本発明の変種濃度に対する凝固時間を示す。
【図2】「トロンボグラムアッセイ」において決定した、本発明変種の組織因子依存性トロンビン最大生成率を示す。
【図3】「トロンボグラムアッセイ」において決定した、本発明の変種のリン脂質依存性トロンビン最大生成率を示す。
【発明を実施するための形態】
【0025】
発明の詳細な開示
定義
本記載および特許請求の範囲の文脈において、以下の定義を適用する。
【0026】
「FVII」または「FVIIポリペプチド」という用語は、一本鎖形状で提供されるFVII分子を意味する。FVIIポリペプチドの一例は、配列番号:1に示すアミノ酸配列を有する野生型ヒトFVII(hFVII)である。しかし、「FVIIポリペプチド」という用語には、例えば配列番号:1の断片や変種、特に配列番号:1と比較してその配列に少なくとも一個、例えば15個以内、好ましくは10個以内のアミノ酸改変を含む変種といったhFVII様分子も含まれるということが理解されるべきである。
【0027】
「FVIIa」または「FVIIaポリペプチド」という用語は、活性型二本鎖形状で提供されるFVIIa分子を意味する。FVIIa のアミノ酸配列を記載するのに配列番号:1のアミノ酸配列が使用される場合、一本鎖形状のR152とI153の間のペプチド結合が開裂し、それらの鎖の一方はアミノ酸残基1〜152となり、他方はアミノ酸残基153〜406となると理解される。
【0028】
「rFVII」および「rFVIIa」という用語は、組換え技術によって産生されたFVIIおよびFVIIaポリペプチドを意味する。
【0029】
「hFVII」および「hFVIIa」という用語はそれぞれ、配列番号:1に示されるアミノ酸配列を有するヒト野生型FVIIおよびFVIIaを意味する。
【0030】
「rhFVII」および「rhFVIIa」という用語は、組換え手段により作製された、配列番号:1に示されるアミノ酸配列を有するヒト野生型FVIIおよびFVIIaを意味する。rhFVIIaの一例は、NovoSeven(登録商標)である。
【0031】
本明細書で使用される場合、「Glaドメイン」という用語は、配列番号:1の1〜45位のアミノ酸残基を含むことを意図する。
【0032】
したがって、「Glaドメイン外に位置する部位」とは、配列番号:1の46〜406位のアミノ酸残基を含む。
【0033】
「FX」、「TF」および「TFPI」という略語は、それぞれ、第X因子、組織因子、組織因子経路阻害剤を意味する。
【0034】
「プロテアーゼドメイン」という用語は、N末端から数えて153〜406位の残基について使用される。
【0035】
「触媒部位」という用語は、ポリペプチド変種のS344、D242およびH193からなる触媒三構造を意味するために使用される。
【0036】
「親」という用語は、本発明に従って改変/改良されるべき分子を示すことを意図している。本発明によって改変される親ポリペプチドは、任意のFVIIまたはFVIIaポリペプチドであってよく、ゆえに任意の起源、例えば非ヒト哺乳動物起源に由来してもよいが、親ポリペプチドはhFVIIまたはhFVIIaであることが好ましい。
【0037】
「変種」とは、一つまたは複数のアミノ酸残基、通常は1〜15個のアミノ酸残基(例えば1、2、3、4、5、6、7、8、9、10、11、12、13、14、または15個のアミノ酸残基)、例えば1〜10個のアミノ酸残基、例えば1〜8、1〜6、1〜5、または1〜3個のアミノ酸残基が親ポリペプチドと異なるポリペプチドである。通常、親ポリペプチドはhFVIIまたはhFVIIaである。
【0038】
「結合型(または互換的に「結合型ポリペプチド」)」とは、1つまたは複数のポリペプチドを、ポリマー分子、親油性化合物、糖部分または有機誘導体化物質のような1つまたは複数の非ポリペプチド部分に共有結合させることによって形成された不均一な(組成の意味においてまたはキメラ)分子を示すと解釈される。好ましくは、結合型は、適切な濃度および条件で可溶性である、すなわち血液のような生理的液体において可溶性である。本発明の結合型ポリペプチドの例には、グリコシル化および/またはPEG化ポリペプチドが含まれる。
【0039】
「共有結合」または「共有結合した」という用語は、ポリペプチド変種および非ポリペプチド部分が、互いに直接共有結合しているか、または架橋、スペーサー、もしくは連結部分のような、少なくとも1つの介在する部分を通して、間接的に共有結合していることを意味する。
【0040】
「非ポリペプチド部分」という用語は、アミノ酸単量体から構成されペプチド結合によって結合されているペプチド重合体とは異なる分子を意味し、この分子は本発明のポリペプチド変種の結合基に結合することができる。そのような分子の好ましい例として、ポリマー分子、糖部分、親油性化合物または有機誘導体化物質が挙げられる。本発明の結合型変種の文脈で使用される場合、非ポリペプチド部分は、ポリペプチドの結合基を介して結合型変種のポリペプチド部分に結合していると理解される。上記に説明されているように、非ポリペプチド部分は、直接的または間接的に結合基と共有結合できる。
【0041】
「ポリマー分子」は、単量体がいずれもアミノ酸残基ではなく、ポリマーがヒトアルブミンまたは他の豊富な血漿タンパク質である場合を除く、二つまたはそれ以上の単量体の共有結合によって形成された分子である。「ポリマー」は、「ポリマー分子」という用語と互換的に用いてもよい。この用語はまた、インビトログリコシル化によって結合された糖質分子、すなわち、選択的にクロスリンク剤を用いて糖質分子をポリペプチド変種の結合基に共有結合させることを含む、通常インビトロで行われる合成グリコシル化を含むと解釈される。
【0042】
「糖部分」は、インビボグリコシル化によって(グリコシル化ポリペプチド変種の形でポリペプチド変種結合型を産生するために)ポリペプチド変種に結合することができる、1つまたは複数の単糖類残基を含む糖質含有分子を示すと解釈される。「インビボグリコシル化」という用語は、すなわちポリペプチド変種の発現のために用いられるグリコシル化細胞における翻訳後プロセシングの際に、例えばN-結合およびO-結合グリコシル化によって、インビボで起こる糖部分の任意の結合を意味すると解釈される。正確なオリゴ糖構造は、当該グリコシル化生物に依存するところが大きい。
【0043】
「N-グリコシル化部位」は、配列N-X-S/T/Cを有し、式中Xはプロリンを除く任意のアミノ酸残基、Nはアスパラギン、およびS/T/Cはセリン、トレオニン、またはシステインのいずれか、好ましくはセリンまたはトレオニンであり、最も好ましくはトレオニンである。好ましくは、アスパラギン残基に対して+3位のアミノ酸残基は、プロリン残基ではない。
【0044】
「O-グリコシル化部位」は、セリンまたはトレオニン残基のOH-基である。
【0045】
「結合基」という用語は、ポリペプチド変種の官能基、特にポリマー分子、親油性分子、糖部分または有機誘導体化物質のような非ポリペプチド部分を結合させることができるそのアミノ酸残基または糖質部分の官能基を示すと解釈される。有用な結合基およびそのマッチする非ポリペプチド残基は、下記の表から明らかであると思われる。
【0046】

【0047】
インビボN-グリコシル化の場合、「結合基」という用語は、N-グリコシル化部位を構成するアミノ酸残基を示すために従来とは異なる意味で用いられる(上記の配列N-X-S/T/C)。N-グリコシル化部位のアスパラギン残基は、それに対して糖部分がグリコシル化の際に結合する部位であるが、そのような結合は、N-グリコシル化部位の他のアミノ酸残基が存在しなければ、起こり得ない。
【0048】
したがって、非ポリペプチド部分が糖部分であって、結合がインビボN-グリコシル化によって得られる場合、ポリペプチドのアミノ酸配列の改変に関連して用いられる「非ポリペプチド部分に対する結合基を含むアミノ酸残基」という用語は、機能的インビボN-グリコシル化部位がアミノ酸配列に導入されるように、インビボN-グリコシル化部位を構成する1つまたは複数のアミノ酸残基を変化させるという意味であると理解すべきである。
【0049】
本出願において、アミノ酸名および原子名(例えば、CA、CB、CD、CG、SG、NZ、N、O、C等)は、IUPAC命名法(「IUPAC Nomenclature and Symbolism for Amino Acids and Peptides(residue names, atoms etc.)」、Eur. J. Biochem. 138:9〜37(1984)と共に、Eur. J. Biochem. 152:1(1985)の修正版)に基づいてタンパク質データバンク(PDB)(www.pdb.org )によって定義される通りに用いられる。
【0050】
「アミノ酸残基」という用語は、任意の天然または合成アミノ酸残基を含むと解釈され、かつ本来は20個の天然に存在するアミノ酸、すなわちアラニン(AlaまたはA)、システイン(CysまたはC)、アスパラギン酸(AspまたはD)、グルタミン酸(GluまたはE)、フェニルアラニン(PheまたはF)、グリシン(GlyまたはG)、ヒスチジン(HisまたはH)、イソロイシン(IleまたはI)、リジン(LysまたはK)、ロイシン(LeuまたはL)、メチオニン(MetまたはM)、アスパラギン(AsnまたはN)、プロリン(ProまたはP)、グルタミン(GlnまたはQ)、アルギニン(ArgまたはR)、セリン(SerまたはS)、トレオニン(ThrまたはT)、バリン(ValまたはV)、トリプトファン(TrpまたはW)、およびチロシン(TyrまたはY)残基からなる群より選択されるアミノ酸からなる群に含まれるアミノ酸残基を示すと解釈される。
【0051】
アミノ酸の位置を同定するために用いられる用語を以下に説明する:G124は、配列番号:1に示すアミノ酸配列において124位がグリシン残基で占められていることを示す。G124Rは、124位のグリシン残基がアルギニン残基に置換されていることを示す。もう1つの置換は、「/」で示され、例えばN145S/Tは、145位のアスパラギンがセリンまたはトレオニンのいずれかに置換されているアミノ酸配列を意味する。多数の置換は「+」で示し、例えばK143N+N145S/Tは、143位のリジン残基のアスパラギン残基への置換および145位のアスパラギン残基のセリンまたはトレオニン残基への置換を含むアミノ酸配列を意味する。G124の後のアラニン残基の挿入のような、さらなるアミノ酸残基の挿入は、G124GAで示される。G124の後で二つのさらなるアラニン残基が挿入される場合、G124GAA等によって示される。本明細書において用いる場合、「X位に挿入」または「X位での挿入」という用語は、アミノ酸残基がアミノ酸残基XとX+1とのあいだに挿入されることを意味する。アミノ酸残基の欠失は、星印で示される。例えば、124位のグリシン残基の欠失は、G124*によって示される。
【0052】
特に明記していない限り、本明細書において行ったアミノ酸残基の番号付けは、hFVII/hFVIIaポリペプチドのアミノ酸配列(配列番号:1)に対してなされている。
【0053】
特異的変異に関連して用いられる「異なる」という用語は、明記されたアミノ酸の差とは別にさらなる差が存在することを認めることを意図する。例えば、FX活性化を増大させるためにGlaドメインにおいて行った改変に加えて、ポリペプチドはこの効果に必ずしも関係しない他の改変を含んでも良い。
【0054】
したがって、本明細書に開示したアミノ酸改変に加えて、本発明のポリペプチド変種のアミノ酸配列は、望ましい場合、その他の改変(すなわち置換、挿入、または欠失)を含んでも良いことが理解される。これらには、例えばN-および/またはC-末端での1つまたはそれ以上のアミノ酸残基(例えば、アミノ酸残基1〜10個)の切断、またはN-および/またはC-末端での1つまたはそれ以上の余分の残基の付加、例えばN-末端でのメチオニン残基の付加、またはC-末端近傍もしくはC-末端でのシステインの導入と共に「保存的アミノ酸置換」、すなわち類似の特徴を有するアミノ酸、例えば小さいアミノ酸、酸性アミノ酸、極性アミノ酸、塩基性アミノ酸、疎水性アミノ酸、および芳香族アミノ酸の群内で行われる置換が含まれてもよい。
【0055】
そのような保存的置換の例を以下の表に示す。
【0056】

【0057】
さらなる改変の他の例については、「Glaドメイン外部での改変」および「Glaドメイン外部でのその他の改変」と題された項に開示されている。
【0058】
「ヌクレオチド配列」という用語は、二つまたはそれ以上のヌクレオチド分子が連続伸長したものを示すことを意図している。ヌクレオチド配列はゲノム起源、cDNA起源、RNA起源、半合成起源、合成起源、またはそれらの任意の組み合わせであってよい。
【0059】
「ベクター」という用語は、宿主細胞内で複製可能または宿主細胞ゲノム内に組み込み可能なプラスミドまたは他のヌクレオチド配列を意味し、それ自体は、ヌクレオチド配列のクローニングを容易にするため、すなわち有用な量の配列を産生するため、その配列にコードされた遺伝子産物の発現を誘導するため、および宿主細胞のゲノム内にヌクレオチド配列を組み込むために、適合する宿主細胞(ベクター-宿主系)と連動してさまざまな機能を実行するのに有用である。ベクターは、実行すべき機能に応じてさまざまな成分を含むであろう。
【0060】
「細胞」、「宿主細胞」、「細胞系」および「細胞培養物」は、本明細書において互換的に用いられ、このような全ての用語には、細胞の増殖および培養により生じる子孫が含まれることを理解すべきである。
【0061】
「形質転換」および「トランスフェクション」は互換的に用いられ、細胞にDNAを導入する工程を意味する。
【0062】
「機能的に結合される」とは、二つまたはそれ以上のヌクレオチド配列を、配列の通常の機能を実行できるような互いに関連した構造に、酵素的ライゲーションまたは他の手段によって共有結合することを意味する。一般的に、「機能的に結合される」とは、連結されたヌクレオチド配列が連続しており、分泌リーダーの場合には、連続しかつリーディングフェーズ内にあることを意味する。連結は、都合の良い制限部位でのライゲーションにより達成される。もしそのような部位が存在しなければ、合成オリゴヌクレオチドアダプターまたはリンカーを標準的な組換えDNA法とともに用いる。
【0063】
本発明の文脈において、「改変」または「アミノ酸改変」という用語は、アミノ酸側鎖の交換、アミノ酸残基の置換、アミノ酸残基の欠失、またはアミノ酸残基の挿入を含むことが意図される。
【0064】
「導入する」という用語は、特に既存のアミノ酸残基の置換による、またはさらなるアミノ酸残基の挿入による、アミノ酸残基の導入を意味する。
【0065】
「除去する」という用語は、特に除去されるアミノ酸残基を別のアミノ酸残基で置換することによる、あるいは除去されるアミノ酸残基を欠失(置換せずに)することによる、アミノ酸残基の除去を意味する。
【0066】
本発明の文脈において、「活性」という用語は、その活性が実際に測定されるアッセイに伴う関連した活性であると理解されるべきである。
【0067】
したがって、「アミド溶解活性」という用語は、本明細書に記載の「アミド溶解アッセイ」において測定された活性を意味するために用いられる。「アミド溶解活性」を示すために、本発明の変種はその活性化型において、本明細書に記載の「アミド溶解アッセイ」でアッセイした場合に、rhFVIIaのアミド溶解活性の少なくとも10%を有しなければならない。本発明の好ましい態様において、変種はその活性化型において、本明細書に記載の「アミド溶解アッセイ」でアッセイした場合に、rhFVIIaのアミド溶解活性の少なくとも20%、例えばrhFVIIaのアミド溶解活性の少なくとも30%、例えば少なくとも40%、より好ましくは少なくとも50%、例えば少なくとも60%、例えば少なくとも70%、さらにより好ましくは少なくとも80%、例えば少なくとも90%を有する。興味深い態様において、変種はその活性化型において、rhFVIIaと実質的に同じアミド溶解活性、例えばrhFVIIaのアミド溶解活性の75〜125%のアミド溶解活性を有する。
【0068】
「凝血活性」という用語は、本明細書に記述の「全血アッセイ」において測定された活性、すなわち凝血形成を得るために必要な時間を意味する。したがって、凝血時間がより短いということは凝血活性がより高いことに対応する。
【0069】
「凝血活性の増加」という用語は、本明細書に記載の「全血アッセイ」において測定し、同等の条件下で決定した場合に、本ポリペプチド変種の凝血時間がrhFVIIaまたは[P10Q+K32E]rhFVIIaにより生じたものと比較して、統計学的に有意に減少していることを示すために用いられる。
【0070】
本文脈において、「活性」という用語は、FXをFXaに活性化する本変種の能力にも関連して用いられる。この活性はまた「FX活性化活性」または「FXa生成活性」ともよばれ、本明細書に記載の「TF非依存性第X因子活性化アッセイ」において決定されうる。
【0071】
「FX活性化活性の増加」または「FXa生成活性の増加」という用語は、rhFVIIaまたは[P10Q+K32E]rhFVIIaなどの参照分子と比較して、活性化型の本発明の変種のFXをFXaに活性化する能力が統計学的に有意に増加していることを示すために使用される。本発明の変種が(その活性化型において)、どの程度増加したFX活性化活性を有するかということは、本明細書に記載の「TF非依存性第X因子活性化アッセイ」において簡便に決定することができる。
【0072】
所定の物質に関連して用いられる「免疫原性」という用語は、物質の免疫系からの反応の誘導能を示すことを意図する。免疫応答は、細胞性または抗体媒介反応であってもよい(例えば、免疫原性の詳しい定義に関しては、Roitt:Essential Immunology(第10版、Blackwell)を参照されたい)。通常、抗体の反応性の減少は、免疫原性の減少の指標となると思われる。免疫原性は、例えばインビボまたはインビトロでの当技術分野で既知の任意の適した方法を用いることによって決定してもよい。
【0073】
「機能的インビボ半減期」という用語は、その通常の意味において用いられ、すなわちポリペプチドの生物活性の50%が生体/標的臓器になお存在している時間、またはポリペプチドの活性が最初の値の50%である時間である。
【0074】
機能的なインビボ半減期を決定するための代用として、「血清半減期」、すなわち排泄される前にポリペプチドの50%が血漿または血流において循環している時間を決定してもよい。血清半減期の決定はしばしば機能的インビボ半減期を決定するより単純であり、血清半減期の程度は通常、機能的インビボ半減期の程度の良好な指標である。血清半減期に対する別の用語には、「血漿半減期」、「循環中半減期」、「血清クリアランス」、「血漿クリアランス」、および「クリアランス半減期」が含まれる。ポリペプチドは、細網内皮系(RES)、腎臓、脾臓、または肝臓の1つまたは複数の作用によって、組織因子、SEC受容体、もしくは他の受容体媒介排泄によって、または特異的もしくは非特異的タンパク質分解によって排泄される。通常、クリアランスは、大きさ(糸球体濾過速度のカットオフに関して)、電荷、結合した炭化水素鎖、およびタンパク質の細胞受容体の存在に依存する。保持される機能性は通常、前凝固、タンパク質溶解、または受容体結合活性から選択される。機能的インビボ半減期および血清半減期は、当技術分野で既知の任意の適した方法によって決定してもよい。
【0075】
機能的インビボ半減期または血清半減期に関して用いられる場合の「増加した」という用語は、ポリペプチド変種の関連する半減期が、同等の条件で決定した場合にrhFVIIaまたは[P10Q+K32E]rhFVIIaのような参照分子の半減期と比較して統計学的に有意に増加していることを示すために用いられる(典型的には、ラット、ウサギ、ブタ、またはサルなどの実験動物において決定される)。
【0076】
「AUCiv」または「静脈内投与した場合の曲線下面積」は、その通常の意味において、すなわちポリペプチド変種が静脈内投与されている場合、特にラットに静脈内投与されている場合の、血清-時間曲線における活性下面積として用いられる。典型的に、測定する活性は上記で定義される「凝固活性」である。実験的活性-時間点が決定された後、AUCivは、GraphPad Prism 3.01のようなコンピュータープログラムによって計算することが都合がよい可能性がある。
【0077】
異なる分子間で(例えば、本発明の変種とrhFVIIaまたは[P10Q+K32E]rhFVIIaなどの参照分子との間で)、直接AUCiv値を比較するためには、同量の活性を投与すべきであることが理解されるであろう。その結果、AUCiv値は典型的に標準化され(すなわち注射した用量の差が補正され)、AUCiv/投与用量として表される。
【0078】
「タンパク質分解に対する感受性の低下」という用語は主に、比較できる条件下で決定した場合に、ポリペプチド変種が、hFVIIa、rhFVIIaまたは[P10Q+K32E]rhFVIIaと比較してタンパク質分解に対する感受性が低下していることを意味すると解釈される。好ましくは、タンパク質分解は、少なくとも25%(例えば、25〜50%、25〜75%、または25〜100%)のような少なくとも10%(例えば、10〜25%または10〜50%)、より好ましくは少なくとも50%(例えば、50〜75%、または50〜100%)のような少なくとも35%、さらにより好ましくは、少なくとも75%(例えば、75〜100%)のような少なくとも60%、または少なくとも90%減少する。
【0079】
「腎クリアランス」という用語は、腎臓によって、例えば糸球体濾過、尿細管排泄または尿細管細胞における分解によって起こる任意のクリアランスを示すためにその通常の意味において用いられる。腎クリアランスは、大きさ(直径)、流体力学容積、対称性、形状/硬度、および電荷を含むポリペプチドの物理的特徴に依存する。通常、分子量約67 kDaを腎クリアランスに関するカットオフ値と見なすことが多い。腎クリアランスは、任意の適したアッセイ法、例えば確立されたインビボアッセイ法によって確立してもよい。典型的に、腎クリアランスは、標識された(例えば、放射標識または蛍光標識)ポリペプチドを患者に投与すること、および患者から採取した尿中の標識活性を測定することによって決定される。腎クリアランスの低下は、比較できる条件下で対応する参照ポリペプチド、例えばrhFVIIaまたは[P10Q+K32E]rhFVIIaと比較して決定される。好ましくは、ポリペプチド変種の腎クリアランス率は、rhFVIIaまたは[P10Q+K32E]rhFVIIaと比較して、少なくとも50%、好ましくは少なくとも75%、および最も好ましくは少なくとも90%減少する。
【0080】
「組織因子結合部位」、「活性部位領域」および「活性部位結合裂の隆起」という用語は、実施例1に定義されている。
【0081】
「疎水性アミノ酸残基」という用語には、次のアミノ酸残基が含まれる:イソロイシン(I)、ロイシン(L)、メチオニン(M)、バリン(V)、フェニルアラニン(F)、チロシン(T)およびトリプトファン(W)。
【0082】
「陰性荷電アミノ酸残基」と言う用語には、次のアミノ酸残基が含まれる:アスパラギン酸(D)、およびグルタミン酸(E)。
【0083】
「陽性荷電アミノ酸残基」という用語には、次のアミノ酸残基が含まれる:リジン(K)、アルギニン(R)、およびヒスチジン(H)。
【0084】
本発明の変種
親ポリペプチドのGlaドメインに行われた改変は、結果として生じる分子に、リン脂質膜結合親和性の増加、FXをFXaに活性化する能力の増加、および/または凝血活性の増加を提供することが好ましい。本発明の変種はまた、組織因子結合親和性が減少しており、組織因子に結合したときの活性が減少している。
【0085】
いかなる特定の理論に限定されるわけではないが、現在、リン脂質膜結合親和性の増強は、他の凝固因子、特にFXに近接している活性型ポリペプチド変種の、局所濃度の上昇をもたらすと考えられている。したがって、単純にFXに対する活性型FVII変種のモル比が高くなることにより、FXからFXaへの活性化率がより高くなる。FX活性化率の増加は、活性型トロンビン量の増加をもたらし、したがってフィブリン架橋率がより高くなる。
【0086】
結果として、本発明のポリペプチド変種を用いた医学的治療は、現在利用可能なrhFVIIa化合物(NovoSeven(登録商標))に対して、より低用量、増大した有効性、および/またはより迅速な作用などの有利な点を提供しうると考えられる。
【0087】
さらに、組織因子非依存性変種、すなわち野生型ヒト第VIIa因子と比較して組織因子と結合したときに活性が減少する変種は、望ましくない凝血形成(例えば血栓症または血栓塞栓症)の危険性が少ないという点において、特に外傷などの急性の制御不能な出血の治療に用いられる場合、確実に安全性の利点を提供すると考えられる。
【0088】
したがって、本発明の非常に好ましい態様において、ポリペプチド変種はその活性化型において、rhFVIIaまたは[P10Q+K32E]rhFVIIaなどの参照分子と比較して、特に本明細書に開示される「TF非依存性第X因子活性化アッセイ」などの組織因子非依存性アッセイでアッセイした場合に、FX活性化活性が増加している。より詳細には、活性型のポリペプチド変種のFX活性化活性と、参照分子のFX活性化活性との比率は、本明細書に開示される「TF非依存性第X因子活性化アッセイ」でアッセイした場合、少なくとも1.25であることが好ましい。より好ましくは、この比率は少なくとも1.5、例えば少なくとも1.75、例えば少なくとも2、さらにより好ましくは少なくとも3、例えば少なくとも4であり、最も好ましくは少なくとも5である。
【0089】
参照分子がrhFVIIaの場合、活性化型のポリペプチド変種のFX活性化活性と、rhFVIIaのFX活性化活性との比率は、本明細書に開示される「TF非依存性第X因子活性化アッセイ」でアッセイした場合、好ましくは少なくとも約5、典型的には少なくとも約10、例えば少なくとも約15または20である。
【0090】
もう一つの本発明の非常に好ましい態様において、rhFVIIaまたは[P10Q+K32E]rhFVIIaと比較して、本発明の変種は凝血活性が増加している(すなわち凝固時間が減少している)。本発明の好ましい態様において、本変種の場合の凝血形成に達する時間(t変種)と、rhFVIIaの場合の凝血形成に達する時間(t野生型)または[P10Q+K32E]rhFVIIaの場合の凝血形成に達する時間(tP10Q+K32E)との比率は、本明細書に開示されている「全血アッセイ」でアッセイした場合、多くても0.9である。より好ましくは、この比率は多くても0.75、例えば0.7であり、さらにより好ましくはその比率は多くても0.6であり、最も好ましくはその比率は多くても0.5である。
【0091】
上記の特性のうち一つまたは複数が、本明細書に記載されている改変によって達成されうる。
【0092】
第34位に疎水性アミノ酸残基を含む本発明の変種
上記のように、本発明は、第一の局面において、hFVIIまたは hFVIIa(配列番号:1)に関連する1〜15個のアミノ酸改変を含むアミノ酸配列を有し、34位に疎水性アミノ酸残基が置換により導入されているFVIIまたはFVIIaポリペプチド変種に関する。
【0093】
34位に導入された疎水性アミノ酸残基は、I、L、M、V、F、YおよびWからなる群より選択され、好ましくはI、LおよびVであり、特にLが好ましい。
【0094】
好ましい態様において、本変種はさらに10位におけるアミノ酸置換、特にP10Q、および/または32位におけるアミノ酸置換、特にK32Eをさらに含む。本発明の特に好ましい態様において、本変種は10位と32位の両方におけるアミノ酸置換、例えばP10Q+K32Eを含む。
【0095】
したがって、本発明の興味深い態様において、本変種はP10Q+K32E+A34Lの置換を含む。
【0096】
本発明の特に興味深い態様において、本変種は、3位と4位の間に少なくとも一つ(典型的には一つ)のアミノ酸残基の挿入をさらに含む。挿入されるアミノ酸残基は、疎水性アミノ酸残基であることが好ましい。挿入はA3AYであることが最も好ましい。したがって、本発明の特に興味深い態様において、本変種はA3AY+ P10Q+K32E+A34Lの改変を含む。
【0097】
上記の任意の改変に加えて、本変種は33位における置換をさらに含んでもよい。好ましくは、疎水性アミノ酸残基が置換によって33位に導入され、特にD33Fである。
【0098】
Glaドメインも他の部位、特に8位、11位、28位において、例えばR28FまたはR28Eなどの改変を含んでよい。他方で、Glaドメインは、膜結合特性が損なわれる程度にまで改変すべきではないということは理解されるべきである。したがって、γ-カルボキシル化される残基には改変を加えないことが好ましく、すなわち6位、7位、14位、16位、19位、20位、25位、26位、29位および35位の残基には改変を加えないことが好ましい。同様に、非ポリペプチド部分、例えば糖部分および/またはPEG基をGlaドメインに導入することは一般的に好ましくない。結果として、GlaドメインにはインビボN-グリコシル化部位を作出する改変を加えないことが好ましい。
【0099】
最後に、この項で論じたGlaドメインにおける改変は、Glaドメイン外に位置する部位における一つまたは複数の改変と組み合わせることが有利でありうると理解される(下記の「Glaドメイン外部での改変」および「Glaドメイン外部でのその他の改変」と題する項を参照)。
【0100】
第36位にアミノ酸置換を含む本発明の変種
上記のように、本発明は、第二の局面において、hFVIIまたは hFVIIa(配列番号:1)に関連する1〜15個のアミノ酸改変を含むアミノ酸配列を有し、アミノ酸配列が36位にアミノ酸置換を含む、FVIIまたはFVIIaポリペプチド変種に関する。
【0101】
好ましくは、36位に置換によって導入されるアミノ酸残基は陰性荷電アミノ酸残基であり、例えばR36EまたはR36D、特にR36Eである。
【0102】
好ましい態様において、本変種は10位におけるアミノ酸置換、特にP10Q、および/または32位におけるアミノ酸置換、特にK32Eをさらに含む。本発明の特に好ましい態様において、本変種は10位と32位の両方における置換、例えばP10Q+K32Eを含む。
【0103】
本変種は、38位における置換をさらに含んでもよい。例えばK38EまたはK38Dのように、陰性荷電アミノ酸残基が置換により38位に導入されることが好ましく、特にK38Eが好ましい。
【0104】
したがって、興味深い変種は、P10Q+K32E+R36EまたはP10Q+K32E+R36E+K38Eの置換を含むものである。
【0105】
特に興味深い態様において、本変種は34位におけるアミノ酸置換をさらに含む(すなわち、得られる変種は10+32+34+36または10+32+34+36+38の残基における置換を含む)。好ましくは、例えばA34EまたはA34Dのように、一つの陰性荷電アミノ酸残基が置換によって34位に導入される。
【0106】
好ましい変種の特定の例は、P10Q+K32E+A34E+R36EまたはP10Q+K32E+A34D+R36E+K38Eの置換を含むものである。
【0107】
本発明の興味深い態様において、本変種は3位と4位の間に少なくとも一つ(典型的には一つ)のアミノ酸残基の挿入をさらに含む。挿入されるアミノ酸残基は、疎水性アミノ酸残基であることが好ましい。最も好ましくは、挿入はA3AYである。
【0108】
上記の任意の改変に加えて、本変種は33位にさらなる置換を含んでもよい。好ましくは、疎水性アミノ酸残基が置換によって33位に導入され、特にD33Fが好ましい。
【0109】
Glaドメインも他の部位、特に8位、11位、28位において、R28FまたはR28Eなどの改変を含んでもよい。他方で、Glaドメインは、膜結合特性が損なわれる程度にまで改変すべきではないということが理解されるべきである。したがって、γ-カルボキシル化される残基には改変を加えないことが好ましく、すなわち6位、7位、14位、16位、19位、20位、25位、26位、29位および35位の残基には改変を加えないことが好ましい。同様に、非ポリペプチド部分、例えば糖部分および/またはPEG基をGlaドメインに導入することは一般的に好ましくない。結果として、GlaドメインにはインビボN-グリコシル化部位を作出する改変を加えないことが好ましい。
【0110】
最後に、この項で論じたGlaドメインにおける改変は、Glaドメイン外に位置する部位における一つまたは複数の改変と組み合わせることが有利でありうると理解される(下記の「Glaドメイン外部での改変」および「Glaドメイン外部でのその他の改変」と題する項を参照)。
【0111】
第74位、第77位または第116位にアミノ酸置換を含む本発明の変種
上記のように、本発明は、第三の局面において、hFVIIまたは hFVIIa(配列番号:1)に関連する3〜15個のアミノ酸改変を含むアミノ酸配列を有し、そのアミノ酸配列が、10位、32位におけるアミノ酸置換、ならびに74位、77位、および116位からなる群より選択される部位における少なくとも一つのさらなるアミノ酸置換を含む、FVIIまたはFVIIaポリペプチド変種に関する。
【0112】
好ましい態様において、10位のアミノ酸置換はP10Qであり、32位のアミノ酸置換はK32Eである。
【0113】
74位、77位または116位の置換は、P74S、E77AおよびE116Dからなる群より選択されることがさらに好ましい。
【0114】
興味深い態様において、本変種はさらに34位にアミノ酸置換を含む。好ましくは、例えばA34EまたはA34Dのように、陰性荷電アミノ酸残基が置換によって34位に導入されるのが好ましく、特にA34Eが好ましい。
【0115】
本発明のもう一つの興味深い態様において、本変種は3位と4位の間に少なくとも一つ(典型的には一つ)のアミノ酸残基の挿入をさらに含む。挿入されるアミノ酸残基は、疎水性アミノ酸残基であることが好ましい。最も好ましくは、挿入はA3AYである。
【0116】
本変種の興味深い特定の例として、A3AY+P10Q+K32E+E116D、A3AY+P10Q+K32E+E77A、およびP10Q+K32E+A34E+P74Sの改変を含む変種が挙げられる。
【0117】
上記の任意の改変に加えて、本変種は33位におけるさらなる置換を含んでもよい。好ましくは、疎水性アミノ酸残基が置換によって33位に導入され、特にD33Fが好ましい。
【0118】
Glaドメインも他の部位、特に8位、11位、および28位において、R28FまたはR28Eなどの改変を含んでもよい。上記で説明したように、Glaドメインは、膜結合特性が損なわれる程度にまで改変すべきではないということが理解されるべきであり、すなわち6位、7位、14位、16位、19位、20位、25位、26位、29位および35位の残基には改変を加えないことが好ましく、かつGlaドメインにはインビボN-グリコシル化部位を作出しないことが好ましい。
【0119】
最後に、この項で論じたGlaドメインにおける改変は、Glaドメイン外に位置する部位における一つまたは複数の改変と組み合わせることが有利でありうると理解される(下記の「Glaドメイン外部での改変」および「Glaドメイン外部でのその他の改変」と題された項を参照)。
【0120】
Glaドメイン外部での改変
循環rhFVIIaの半減期は2.3時間であることが、「Summary Basis for Approval for NovoSeven(登録商標)」、FDA参照番号96-0597に報告されている。望ましい治療的または予防的効果を達成し維持するためには、比較的高用量で頻繁に投与する必要がある。その結果、適切な用量調節を得ることが困難となり、頻繁な静脈内投与を必要とすることから患者の生活様式が制限される。
【0121】
循環半減期がより長く、かつ/または生物学的利用能が増加した(例えば静脈内投与された場合に曲線下面積がrhFVIIaと比較して増加している)分子は、必要な投与回数を減少させると考えられる。現在の頻繁な注射の必要性、および治療効果の増強を伴ったより最適な治療的FVIIaレベルを得る可能性を考えると、改良されたFVII様分子またはFVIIa様分子が必要なことは明らかである。
【0122】
したがって、本発明のさらなる目的は、生物学的利用能が増加しており(例えば、静脈内投与された場合に、rhFVIIaまたは[P10Q+K32E]rhFVIIaなどの参照分子と比較して曲線下面積が増加している)、rhFVIIaまたは[P10Q+K32E]rhFVIIaなどの参照分子と比較して、より効率的に(組織因子に結合することなく)第X因子を第Xa因子に活性化することのできる(それによって、外傷などの制御不能な出血、または血友病などの慢性的状態をより効率的に治療可能である)、改良型FVIIまたはFVII分子(FVIIまたはFVIIa変種)を提供することである。
【0123】
したがって、本発明の興味深い変種は、その活性型において、rhFVIIaまたは[P10Q+K32E]rhFVIIaなどの参照分子と比較して、静脈内投与された場合の曲線下面積(AUCiv)の増加をもたらすものである。これは、ラットに静脈内投与することによって簡便に決定することができる。より詳細には、本発明の興味深い変種は、活性型における変種のAUCivと、rhFVIIaまたは[P10Q+K32E]rhFVIIaなどの参照分子のAUCivとの間の比率が、特にラットに(静脈内)投与した場合、少なくとも1.25、例えば少なくとも1.5、例えば少なくとも1.75、より好ましくは少なくとも2、例えば少なくとも3であり、さらにより好ましくは少なくとも4、例えば少なくとも5であるものである。
【0124】
この効果は、rhFVIIaまたは[P10Q+K32E]rhFVIIaなどの参照分子と比較した機能的インビボ半減期の増加および/または血清半減期の増加にしばしば対応すると考えられる。したがって、本発明のもう一つの興味深い態様において、活性化型における本変種と、rhFVIIaまたは[P10Q+K32E]rhFVIIaなどの参照分子との機能的インビボ半減期または血清半減期の比率は、少なくとも1.25である。より好ましくは、活性化型における本変種と、rhFVIIaまたは[P10Q+K32E]rhFVIIaなどの参照分子との当該半減期の比率は、少なくとも1.5、例えば少なくとも1.75、例えば少なくとも2であり、さらにより好ましくは少なくとも3、例えば少なくとも4、例えば少なくとも5である。
【0125】
タンパク質の循環半減期を増加させる一つの方法は、そのタンパク質の腎クリアランスを確実に減少させることである。これは、タンパク質の腎クリアランスを減少させることのできる化学的部分、例えばポリエチレングリコール(PEG)をそのタンパク質に結合させることにより達成されうる。
【0126】
さらに、タンパク質に化学的部分を付加するか、またはタンパク質分解を受けるアミノ酸を置換することにより、さもなければそのタンパク質のタンパク質分解性劣化をもたらすタンパク質分解酵素の接触を効率的に遮断することができる。
【0127】
上記のように、タンパク質分解性劣化による不安定性は、現在のrhFVIIa治療における公知の問題である。したがって、タンパク質分解性劣化は、凍結乾燥製品とは反対に、調製物を溶液で得るにあたって大きな障害となる。安定した可溶性調製物を得ることの利点は、患者にとって扱いが容易であること、および緊急時に作用がより速いことであり、それにより生命を救える可能性がある。主要なタンパク質分解部位に部位特異的変異を加えることによってタンパク質の分解劣化を防ぐ試みが、国際公開公報第88/10295号に開示されている。
【0128】
国際公開公報第01/58935号は、AUCiv、機能的インビボ半減期、および/または血清半減期の増加をもたらす多くの適切な改変を開示している。国際公開公報第01/58935号に開示された変種は、改善されたFVII分子またはFVIIa分子を開発するための一般的な新たな方法の結果であり、これを本発明の親FVIIまたはFVIIaポリペプチドのために使用してもよい。
【0129】
より具体的には、親FVIIまたはFVIIaのポリペプチドにおいて非ポリペプチド部分に対する結合基を含むアミノ酸残基を除去および/または導入することにより、選択した非ポリペプチド部分への結合に対してより感受性のある分子を作製するためにポリペプチドを特異的に適合させること、結合パターンを最適化すること(例えば、FVIIまたはFVIIaのポリペプチド変種の表面上の非ポリペプチド部分の最適な分布および数を保証にすること、ならびに結合が意図される結合基のみが分子に存在することを保証すること)、ならびにそれによって、アミド分解活性を有し、さらにrhFVIIa分子と比較して1つまたは複数の改善された特徴を有する新規の結合分子を得ることが可能である。
【0130】
本発明の興味深い態様において、Glaドメイン外に位置する複数のアミノ酸残基は、変更され、例えばこの変更は、選択した非ポリペプチド部分に対する結合基を含むアミノ酸残基の除去および導入を含む。アミノ酸残基の除去および/または導入に加えて、ポリペプチド変種は、非ポリペプチド部分に対する結合基を含むアミノ酸残基の導入および/または除去に関連していない他の置換を含んでもよい。
【0131】
また、ポリペプチド変種は、ポリペプチド変種の触媒部位を阻害するためのセリンプロテイナーゼ阻害剤に結合されてもよい。または、触媒部位に存在する一つまたは複数のアミノ酸残基(S344、D242およびH193)を、得られる変種を不活性にするために変異させてもよい。そのような変異の一例はS344Aである。
【0132】
非ポリペプチド部分に対する結合基を含むアミノ酸残基は、それが除去または導入されているかに関わらず、選択した非ポリペプチド部分の性質に基づいて選択され、ほとんどの場合、ポリペプチド変種と非ポリペプチド部分との間で結合が達成される方法に基づいて選択される。例えば、非ポリペプチド部分が、ポリエチレングリコールまたはポリアルキレンオキサイドに由来する分子のようなポリマー分子である場合、結合基を含むアミノ酸残基は、リジン、システイン、アスパラギン酸、グルタミン酸、ヒスチジン、およびチロシンからなる群より選択されてもよく、好ましくは、リジン、システイン、アスパラギン酸、およびグルタミン酸からなる群より選択されてもよく、より好ましくはリジンおよびシステインからなる群より選択されてもよく、特にシステインであってよい。
【0133】
非ポリペプチド部分に対する結合基が、親ポリペプチドに導入されるか、または親ポリペプチドから除去される場合には、改変されるアミノ酸残基の位置は、好ましくは親FVIIまたはFVIIaのポリペプチドの表面に位置し、より好ましくは、その側鎖の少なくとも25%が表面に露出しているアミノ酸残基で占められ(本明細書の実施例1に定義されるように)、好ましくは、その側鎖の少なくとも50%が表面に露出しているアミノ酸残基で占められる(本明細書の実施例1に定義されるように)。そのような位置は、国際公開公報第01/58935号に記載されているように、hFVIIまたはhFVIIa分子の三次元構造の解析に基づいて同定されている。
【0134】
さらに、改変される位置は、好ましくは組織因子結合部位、および/または活性部位領域の外部、および/または活性部位結合裂の隆起の外部に位置するFVIIまたはFVIIa分子の一部から選択される。これらの部位/領域は、本明細書の実施例1および国際公開公報第01/58935号で同定されている。
【0135】
結合基を除去する場合には、そのような基を含み上記に定義される部位を占める当該アミノ酸残基は、問題の非ポリペプチド部分の結合基を含まない異なるアミノ酸残基で置換することが好ましい。通常、除去されるアミノ酸残基は、それに対する結合が不都合なもの、例えばそのポリペプチドの機能的部位またはその付近に位置するアミノ酸残基である(そのような部位における結合は、例えば受容体の認識障害のために、得られた結合物の不活性化または活性の減少をきたすことがあるため)。本文脈において、「機能的部位」という用語は、FVIIまたはFVIIaの機能または動作に必須であるか、そうでなければそれに関与する一つまたは複数のアミノ酸残基を示すことを意図する。そのようなアミノ酸残基は、機能的部位の一部である。機能的部位は、当技術分野で公知の方法により決定してもよく、好ましくはFVIIa-組織因子複合体の構造解析によって同定される(Bannerら、Nature 1996; 380:41-46を参照)。
【0136】
結合基を導入する場合には、そのような基を含むアミノ酸残基を、該当する部位へ、好ましくはその部位を占めるアミノ酸残基の置換によって導入する。
【0137】
FVIIまたは FVIIaポリペプチドにおいて、結合に利用可能なものとして存在する結合基の正確な数は、結合によって達成されることを望む効果に依存する。得られる効果は、例えば結合の性質や程度に依存する(例えば、非ポリペプチド部分の同一性、ポリペプチド変種への結合が望ましいかまたは結合可能な非ポリペプチド部分の数、結合すべき場所、または結合を避けるべき場所など)。
【0138】
親FVIIまたはFVIIaポリペプチドのGlaドメイン外部で改変されるアミノ酸残基の総数は(配列番号:1に示されているアミノ酸配列と比較して)、典型的には10個を超えない。好ましくは、FVIIまたはFVIIa変種は、配列番号:1に示す46〜406位のアミノ酸残基と1〜10個のアミノ酸残基が異なるアミノ酸配列を含み、典型的には1〜8個または2〜8個のアミノ酸残基、例えば1〜5個または2〜5個のアミノ酸残基、例えば1〜4個または1〜3個のアミノ酸残基、例えば1、2または3個のアミノ酸残基が配列番号:1に示す46〜406位のアミノ酸残基と異なるアミノ酸配列を含む。
【0139】
同様に、本発明のポリペプチド変種は、1〜10個の(さらなる)非ポリペプチド部分、典型的には1〜8個または2〜8個の(さらなる)非ポリペプチド部分、好ましくは1〜5個または2〜5個の(さらなる)非ポリペプチド部分、例えば1〜4個または1〜3個の(さらなる)非ポリペプチド部分、例えば1、2または3個の(さらなる)非ポリペプチド部分を含んでもよい。そのようなさらなる非ポリペプチド部分は、Glaドメイン外に位置する結合基に共有結合されることが理解される。
【0140】
非ポリペプチド部分が糖部分である本発明のポリペプチド変種
本発明の好ましい態様において、糖部分に対する結合基、例えばグリコシル化部位、特にインビボグリコシル化部位、例えばインビボN-グリコシル化部位が、Glaドメイン外に位置する部位において導入および/または除去されており、好ましくは導入されている。
【0141】
本発明の文脈において用いる場合、「天然に存在するグリコシル化部位」という用語は、N145、N322、S52およびS60の位置でのグリコシル化部位を含む。「天然に存在するインビボO-グリコシル化部位」という用語には、S52およびS60の位置が含まれ、「天然に存在するインビボN-グリコシル化部位」という用語には、N145およびN322の位置が含まれる。
【0142】
したがって、本発明の非常に興味深い態様において、非ポリペプチド部分は、糖部分であり、導入された結合基はグリコシル化部位、好ましくは、インビボO-グリコシル化部位またはインビボN-グリコシル化部位のようなインビボグリコシル化部位、特にインビボN-グリコシル化部位である。典型的に、1〜10個のグリコシル化部位、特にインビボN-グリコシル化部位は、好ましくは1〜8個、1〜6個、1〜4個または1〜3個のグリコシル化部位が導入されており、特にインビボN-グリコシル化部位は、Glaドメイン外に位置する一つまたは複数の位置に導入されている。例えば、特に、1個、2個または3個のグリコシル化部位、特にインビボN-グリコシル化部位が、Glaドメイン外に好ましくは置換によって導入されている。
【0143】
1つまたは複数のグリコシル化部位を含む、ポリペプチド変種を調製するために、ポリペプチド変種は、グリコシル化部位で糖(オリゴ糖)部分を結合することができる宿主細胞において発現させるか、またはインビトログリコシル化に供しなければならないと理解されると考えられる。グリコシル化宿主細胞の例は、以下の「糖部分へのカップリング」と題する項においてさらに示される。
【0144】
グリコシル化部位、特にインビボN-グリコシル化部位が導入されうる位置の例には、側鎖の少なくとも25%、例えば側鎖の少なくとも50%が表面に露出している(本明細書の実施例1に定義される)アミノ酸残基が含まれる。位置は、本明細書の実施例1に定義されるように、好ましくは組織因子結合部位および/もしくは活性部位領域の外部ならびに/または活性部位結合裂の隆起の外部に位置する分子の一部分から選択される。「側鎖の少なくとも25%(または少なくとも50%)が表面に露出している」という用語が、インビボN-グリコシル化部位の導入と関連して用いられる場合には、この用語は、糖部分が実際に結合する位置でのアミノ酸側鎖の表面到達性を意味すると理解されるべきである。多くの場合には、糖部分が実際に結合するアスパラギン残基に対して+2の位置にセリン残基またはトレオニン残基を導入する必要があり、セリン残基またはトレオニン残基が導入されるこれらの位置を埋没させることができる、すなわち表面に露出する側鎖を25%未満にすることができる。
【0145】
インビボN-グリコシル化部位を作出する、そのような置換の特定の好ましい例には、

およびそれらの組み合わせからなる群より選択される置換が含まれる。より好ましくは、

およびそれらの組み合わせからなる群より選択される置換によって、インビボN-グリコシル化部位が導入される。さらにより好ましくは、T106N、A175T、I205T、V253N、T267N+S269T、およびそれらの組み合わせからなる群より選択される置換、特にT106N、I205T、およびV253Nの一つ、二つまたは三つによってインビボN-グリコシル化部位が導入される。
【0146】
ある態様では、ただ一つのインビボN-グリコシル化部位のみが置換によって導入されている。別の態様では、二つまたはそれ以上(例えば二つ)のインビボN-グリコシル化部位が置換によって導入されている。二つのインビボN-グリコシル化部位を作出する好ましい置換の例には、

からなる群より選択された置換が含まれる。より好ましくは、置換は

からなる群より選択され、さらにより好ましくはT106N+I205T、T106N+V253NおよびI205T+V253Nからなる群より選択される。
【0147】
さらなる態様において、三つまたはそれ以上(例えば三つ)のインビボN-グリコシル化部位が置換により導入されている。三つのインビボN-グリコシル化部位を作出する好ましい置換の例には、I205T+ V253N+T267N+S269TおよびT106N+I205T+V253Nからなる群より選択される置換が含まれる。
【0148】
上記のように、インビボN-グリコシル化部位は、本明細書に定義されるような組織因子結合部位、活性部位領域、または活性部位結合裂の隆起の一部を形成しない部位に導入されることが好ましい。
【0149】
上述の34位および/または36位における置換、特に A34E/Lおよび/またはR36Eと組み合わせて、さらに上記の項で言及された任意の改変を互いに組み合わせてもよく、好ましくは上述の10位および/または32位における置換、特にP10Qおよび/またはK32Eと組み合わせてもよいことが理解される。インビボN-グリコシル化部位の導入のための上記の改変のうち、好ましい改変はT106N、I205T、およびV253Nの改変のうちの一つ、二つ、または三つを含み、特にこれらの改変のうち二つ、すなわちT106N+I205T、T106N+V253N、またはI205T+V253Nを含む。
【0150】
したがって、本発明の一つの好ましい態様において、FVIIまたはFVIIa変種はP10Q+K32E+A34E+R36E+T106N+I205Tの改変を含む。
【0151】
さらに好ましい態様において、FVIIまたはFVIIa変種はP10Q+K32E+A34E+R36E+T106N+V253Nの改変を含む。
【0152】
さらに好ましい態様において、FVIIまたはFVIIa変種はP10Q+K32E+A34E+R36E+I205T+V253Nの改変を含む。
【0153】
さらに好ましい態様において、FVIIまたはFVIIa変種はP10Q+K32E+A34L+T106N+I205Tの改変を含む。
【0154】
さらに好ましい態様において、FVIIまたはFVIIa変種はP10Q+K32E+A34L+T106N+V253Nの改変を含む。
【0155】
さらに好ましい態様において、FVIIまたはFVIIa変種はP10Q+K32E+A34L+I205T+V253Nの改変を含む。
【0156】
さらに好ましい態様において、FVIIまたはFVIIa変種はP10Q+K32E+A34L+R36E+T106N+I205Tの改変を含む。
【0157】
さらに好ましい態様において、FVIIまたはFVIIa変種はP10Q+K32E+A34L+R36E+T106N+V253Nの改変を含む。
【0158】
さらに好ましい態様において、FVIIまたはFVIIa変種はP10Q+K32E+A34L+R36E+I205T+V253Nの改変を含む。
【0159】
上記でも説明されているように、これらの改変のうちの任意の一つまたは複数を、少なくとも一個のアミノ酸残基、典型的には単一のアミノ酸残基の3位と4位の間への挿入と組み合わせてもよく、挿入される残基は好ましくは疎水性アミノ酸残基である。最も好ましくは、挿入はA3AYである。したがって、本発明のさらに好ましい態様において、FVIIまたはFVIIa変種は、

から選択される改変を含む。
【0160】
Glaドメイン外部でのその他の改変
本発明のさらなる態様において、FVIIまたはFVIIa変種は、上記の項に記載されている改変に加えて、例えば国際公開公報第02/22776号に記載されているものなどの、本ポリペプチドの内在性活性を増加させることが既知の変異を含んでもよい。
【0161】
例えば、本変種は、157位、158位、296位、298位、305位、334位、336位、337位、および374位からなる群より選択される部位における少なくとも一つの改変を含んでよい。好ましい置換の例には、V158D、E296D、M298Q、L305V、およびK337Aからなる群より選択される置換が含まれる。より好ましくは、置換は

からなる群より選択される。
【0162】
本発明のさらなる態様において、FVIIまたはFVIIa変種は、上記の項に記載されている改変に加えて、Neuenschwanderら、Biochemistry, 1995; 34:8701-8707に開示されているK341Qの置換などの、その他の変異も含んでよい。可能性のあるさらなる置換には、D196K、D196N、G237L、G237GAA、およびそれらの組み合わせが含まれる。
【0163】
FVIIまたはFVIIa変種の、非ポリペプチド部分への結合に関する追加の詳細な情報は、本明細書において参照され、かつ参照として本明細書に組み入れられる、国際公開公報第01/58935号および国際公開公報第03/093465号に見いだされる。
【0164】
本発明の結合型ポリペプチド変種の調製方法
一般的に、本発明による結合型変種は、変種ポリペプチドの発現のために行われる条件下で適切な宿主細胞を培養する工程、および変種ポリペプチドを回収する工程によって生産してもよく、ここで、
a)変種ポリペプチドは少なくとも1つのN-またはO-グリコシル化部位を含み、かつ宿主細胞はインビボグリコシル化を行うことができる真核宿主細胞であり、および/または
b)変種ポリペプチドは、インビトロで非ポリペプチド部分との結合を受ける。
【0165】
ポリマー分子との結合
変種ポリペプチドにカップリングされるポリマー分子は、天然または合成ホモポリマーまたはヘテロポリマーのような任意の適したポリマー分子であってもよく、典型的に分子量約500〜20,000 Daのような、分子量の範囲が約300〜100,000 Da、より好ましくは約500〜15,000 Daの範囲、さらにより好ましくは約3〜10 kDaの範囲のような約2〜12 kDaの範囲の分子である。本明細書において特定の分子量に関連して「約」という用語を用いる場合、「約」という用語は、通常、おおよその平均分子量を示し、所定のポリマー調製物において特定の分子量の分布が存在するという事実を反映する。
【0166】
ホモポリマーの例には、ポリオール(すなわち、ポリ-OH)、ポリアミン(すなわち、ポリ-NH2)、およびポリカルボン酸(すなわちポリ-COOH)が含まれる。ヘテロポリマーは、ヒドロキシル基およびアミン基のような異なるカップリング基を含むポリマーである。
【0167】
適したポリマー分子の例には、ポリエチレングリコール(PEG)およびポリプロピレングリコール(PPG)のようなポリアルキレングリコール(PAG)を含むポリアルキレンオキシド(PAO)、分枝状PEG、ポリビニルアルコール(PVA)、ポリカルボキシレート、ポリ-(ビニルピロリドン)、ポリエチレン-コ無水マレイン酸、ポリスチレン-コ無水マレイン酸、カルボキシメチルデキストランを含むデキストラン、または免疫原性を減少させる、ならびに/または機能的インビボ半減期および/もしくは血清半減期を増加させるために適した他の任意の生体ポリマーからなる群より選択されるポリマーが含まれる。ポリマー分子のもう1つの例は、ヒトアルブミンまたはもう1つの大量に存在する血漿タンパク質である。一般的に、ポリアルキレングリコールに由来するポリマーは生体適合性、非毒性、非抗原性、非免疫原性、水溶性を有し、生きている生物から容易に排泄される。
【0168】
PEGは、例えばデキストランのような多糖類と比較すると、クロスリンクすることができる反応基がごく少数であることから、好ましいポリマー分子である。特に、一官能基PEG、例えばメトキシポリエチレングリコール(mPEG)は、そのカップリング化学が比較的単純(1つの反応基のみがポリペプチド上の結合基を結合するために使用できる)であることから重要である。その結果、クロスリンクのリスクが消失すると、得られた結合型変種はより均一となり、ポリマー分子と変種ポリペプチドとの反応はより容易に制御される。
【0169】
1つ(または複数)のポリマー分子を変種ポリペプチドに共有結合させるために、ポリマー分子のヒドロキシル末端基は、活性型、すなわち反応官能基(その例には一級アミノ基、ヒドラジド(HZ)、チオール、コハク酸塩(SUC)、スクシニミジルスクシネート(SS)、スクシニミジルスクシンアミド(SSA)、スクシニミジルプロピオネート(SPA)、スクシニミジルブチレート(SBA)、スクシニミジルカルボキシメチレート(SCM)、ベンゾトリアゾールカーボネート(BTC)、N-ヒドロキシスクシンイミド(NHS)、アルデヒド、ニトロフェニルカーボネート(NPC)、およびトレシレート(TRES)が含まれる)と共に提供されなければならない。適した活性化ポリマー分子は市販されており、例えばNektar Therapeutics、Huntsville、AL、USAまたはPolyMASC Pharmaceuticals plc、UKから入手可能である。
【0170】
本発明の使用のための活性化された直鎖状または分枝状ポリマー分子の特定の例は、参照として本明細書に組み入れられるNektar Molecule Engineering Catalog 2003(Nektar Therapeutics)に記載されている。
【0171】
活性化PEGポリマーの特定の例には、以下の直鎖状PEG:NHS-PEG (例えばSPA-PEG、SSPA-PEG、SBA-PEG、SS-PEG、SSA-PEG、SC-PEG、SG-PEG、およびSCM-PEG)、およびNOR-PEG、BTC-PEG、EPOX-PEG、NCO-PEG、NPC-PEG、CDI-PEG、ALD-PEG、TRES-PEG、VS-PEG、IODO-PEG、およびMAL-PEG、ならびに、PEG2-NHSおよび米国特許第5,932,462号および米国特許第5,643,575号(ともに参照として本明細書に組み入れられる)に開示されているものなどの分枝鎖状PEGが含まれる。有用なポリマー分子、PEG化化学および結合方法をさらに開示している追加の刊行物は、国際公開公報第01/58935号および国際公開公報第03/093465号に列記されている。
【0172】
特にシステイン残基とのカップリングに好ましい活性化PEGポリマーの特定の例には、以下の直鎖状PEG:ビニルスルホンPEG (VS-PEG)、好ましくはビニルスルホンmPEG (VS-mPEG);マレイミド-PEG (MAL-PEG)、好ましくはマレイミド-mPEG (MAL-mPEG)およびオルトピリジル-ジスルフィドPEG (OPSS-PEG)、好ましくはオルトピリジル-ジスルフィドmPEG (OPSS-mPEG)が含まれる。典型的には、そのようなPEGまたはmPEGポリマーは、大きさが約5kDa、約10kDa、約12kDa、または約20kDaであると考えられる。
【0173】
使用される活性化方法および/または結合化学は、ポリマーの官能基(例えばアミン、ヒドロキシル、カルボキシル、アルデヒド、スルフィドリル、スクシニミジル、マレイミド、ビニルスルホン、またはハロ酢酸)だけでなく、本変種ポリペプチドの結合基(それらの例はさらに上記で示される)に依存することを、当業者は認識すると考えられる。PEG化は、本変種ポリペプチドの全ての利用可能な結合基(すなわちポリペプチド表面に露出している結合基)に結合するように行ってもよく、または一つまたは複数の特定の結合基、例えば米国特許第5,985,265号に記載されるN末端アミノ基もしくはシステイン残基に対して行ってもよい。さらに、結合は一段階で達成しても、段階的に(例えば国際公開公報第99/55377号に記載されているように)達成してもよい。
【0174】
システイン残基のPEG化(上記参照)のためには、通常、FVIIまたはFVIIa変種はPEG化前にジチオスレイトール(DDT)などの還元剤で処理される。その後、還元剤は、脱塩などの任意の従来法により除去される。PEGのシステイン残基への結合は、典型的にはpH6〜9の適切な緩衝液中で、4℃〜25℃のさまざまな温度で、最大で16時間までの期間行われる。
【0175】
PEG化は、結合するPEG分子の数、その分子のサイズおよび形状(例えばそれらが直鎖状であるか分枝鎖状であるか)、ならびに本変種ポリペプチドにおける結合部位に関して、最適な分子を産生するよう設計されることが理解される。使用するポリマーの分子量は、例えば達成されるべき望ましい作用に基づいて選択される。
【0176】
タンパク質上の単一の結合基(例えばN末端アミノ基)のみへの結合に関して、ポリマー分子は、直鎖状でも分枝鎖状でもよいが、好ましくは約10〜25kDa、例えば約15〜25kDa、例えば約20kDaの高分子量を有するのが有利である。
【0177】
通常、ポリマー結合は、できるだけ多くの利用可能なポリマー結合基がポリマー分子と反応することを目的とした条件下で行われる。これは、本ポリペプチドに対するポリマーの適切なモル過剰によって達成される。典型的には、ポリペプチドに対する活性化ポリマー分子のモル比は約1000対1まで、例えば約200対1まで、または約100対1までである。しかしながら、最適な反応を得るために、例えば約50対1、10対1、5対1、2対1、または1対1までなど、その比率がいくらか低い場合もある。
【0178】
リンカーを介して本ポリペプチドとポリマー分子をカップリングすることも本発明によって企図される。適切なリンカーは当業者に周知である;国際公開公報第01/58935号を参照。
【0179】
結合の後、残余の活性型ポリマー分子は、当技術分野で公知の方法、例えば反応混合物への一級アミンの添加によって遮断され、その結果生じた非活性型ポリマー分子は適切な方法によって除去される。
【0180】
状況に応じて、例えば変種ポリペプチドのアミノ酸配列、使用される活性型PEG化合物の性質、PEG対ポリペプチドのモル比を含む特定のPEG化条件に応じて、様々な程度のPEG化が得られる可能性があり、一般的に変種ポリペプチドに対するPEGの比率が高いほど高度のPEG化が得られる、ということが理解される。しかしながら、任意の所定のPEG化過程により生じるPEG化変種ポリペプチドは、通常、わずかにPEG化の程度が異なる結合ポリペプチド変種の確率的分布を含むと考えられる。
【0181】
糖部分へのカップリング
一つまたは複数のグリコシル化部位を含むFVII分子のインビボグリコシル化を達成するためには、変種ポリペプチドをコードするヌクレオチド配列は、グリコシル化する真核生物発現宿主に挿入されなければならない。発現宿主細胞は真菌(糸状菌または酵母)、昆虫または動物細胞から、またはトランスジェニック植物細胞から選択され得る。一つの態様において、宿主細胞は、CHO細胞、BHK細胞またはHEK細胞(たとえばHEK293細胞)などの哺乳類細胞、またはSF9細胞などの昆虫細胞、またはサッカロミセス・セレビジエ(Saccharomyces cerevisiae)またはピチア・パストリス(Pichia pastoris)などの酵母細胞、または後に記載される任意の宿主細胞である。
【0182】
例えば、国際公開公報第87/05330号およびAplinら、CRC Crit Rev. Biochem, pp. 259-306, 1981に記載されているように、糖部分(例えばデキストラン)と変種ポリペプチドのアミノ酸残基とのインビトロ共有結合も使用されうる。FVIIまたはFVIIa変種のインビトログリコシル化についてのさらなる情報は、国際公開公報第03/093465号も参照のこと。
【0183】
セリンプロテアーゼ阻害剤の結合
セリンプロテアーゼ阻害剤の結合は、国際公開公報第96/12800号に記載される方法に従って行うことができる。
【0184】
本発明のポリペプチド変種を調製する方法
グリコシル化型であってもよい、本発明のポリペプチド変種は、当技術分野で周知の任意の適した方法によって産生してもよい。そのような方法には、ポリペプチド変種をコードするヌクレオチド配列を構築する段階、および適した形質転換またはトランスフェクトした宿主において配列を発現させる段階が含まれる。好ましくは宿主細胞は、哺乳類細胞のようなγカルボキシル化宿主細胞である。しかし、本発明のポリペプチド変種は、あまり効率的ではないが、化学合成もしくは化学合成の組み合わせ、または化学合成と組み換えDNA技術の組み合わせによって産生してもよい。
【0185】
本発明のポリペプチドをコードするヌクレオチド配列は、親FVII、例えば配列番号1に示されるアミノ酸配列を有するhFVIIをコードするヌクレオチド配列を単離または合成すること、次に、1つ(または複数)の関連するアミノ酸残基の導入(すなわち挿入または置換)または除去(すなわち欠失または置換)を行うためにヌクレオチド配列を変化させることによって構築してもよい。
【0186】
ヌクレオチド配列は、通常の方法に従って部位特異的変異誘発によって簡便に改変される。または、ヌクレオチド配列は、化学合成によって、例えばオリゴヌクレオチドが所望のポリペプチドのアミノ酸配列に基づいてデザインされるオリゴヌクレオチドシンセサイザーを用いて、好ましくは組み換え型ポリペプチドが産生される宿主において都合がよいコドンを選択することによって、調製される。例えば、所望のポリペプチドの一部をコードするいくつかの小さいオリゴヌクレオチドを合成して、PCR(ポリメラーゼ連鎖反応)、ライゲーション、またはライゲーション連鎖反応(LCR)(Barany、Proc Natl Acad Sci USA 88:189〜193、1991)によって構築してもよい。個々のオリゴヌクレオチドは典型的に、相補的構築のために5'または3'オーバーハングを含む。
【0187】
一旦構築されると(合成、部位特異的突然変異、または他の方法による)、ポリペプチドをコードするヌクレオチド配列は組換えベクターに挿入され、望ましい形質転換宿主細胞において、FVIIの発現のために必要な制御配列に機能的に結合されている。
【0188】
当業者は、ポリペプチドを発現するための適したベクター、発現制御配列、および宿主を選択することができると思われる。組換えベクターは、自律的に複製するベクター、すなわちその複製が染色体の複製に依存しない染色体外実体として存在するベクター、例えばプラスミドであってもよい。または、ベクターは、宿主細胞に導入した場合、宿主細胞のゲノムに組み入れられ、それが組み入れられている1つまたは複数の染色体と共に複製されるベクターである。
【0189】
ベクターは好ましくは、その中で本発明のポリペプチド変種をコードするヌクレオチド配列が、ヌクレオチド配列の転写にとって必要なさらなるセグメントに機能的に結合している発現ベクターである。ベクターは、典型的にプラスミドまたはウイルスDNAに由来する。本明細書において言及した宿主細胞における発現に適した多くの発現ベクターが市販されているか、または文献に記述されている。FVIIを発現するための適したベクターに関する詳細な情報は、参照として組み入れられる国際公開公報第01/58935号に見出され得る。
【0190】
「制御配列」という用語は、本明細書において、本発明のポリペプチド変種の発現にとって必要または有利な全ての成分が含まれると定義される。各制御配列は、ポリペプチド変種をコードする核酸配列に対して先天的または外来配列であってもよい。そのような制御配列には、リーダー配列、ポリアデニル化配列、プロペプチド配列、プロモーター、エンハンサーまたは上流活性化配列、シグナルペプチド配列、および転写ターミネーターが含まれるが、これらに限定されることはない。少なくとも制御配列には、プロモーターが含まれる。
【0191】
本発明において、様々な発現制御配列が使用されてもよく、例えば、参照として組み入れられる国際公開公報第01/58935号に開示された任意の制御配列を使用してもよい。
【0192】
ポリペプチド変種をコードする本発明のヌクレオチド配列は、それが部位特異的突然変異、合成、PCRまたはその他の方法により調製されたかに関わらず、任意で、シグナルペプチドをコードするヌクレオチド配列を含んでもよい。シグナルペプチドは、ポリペプチド変種が発現される細胞から分泌される場合に存在する。そのようなシグナルペプチドは、存在する場合、ポリペプチド変種の発現に関して選択された細胞によって認識されるペプチドでなければならない。シグナルペプチドは、ポリペプチドに対して同種(すなわち、hFVIIに通常会合する)もしくは異種(すなわち、hFVIIとは異なる他の起源から発生する)であってよく、または宿主細胞に対して同種もしくは異種、すなわち宿主細胞から通常発現するシグナルペプチドもしくは宿主細胞から通常発現しないシグナルペプチドであってよい。適したシグナルペプチドのさらなる情報は、国際公開公報第01/58935号を参照されたい。
【0193】
細菌(しかし、あまり好ましくない)、真菌(酵母を含む)、植物、昆虫、哺乳類、もしくは他の適切な動物の細胞または細胞系、およびトランスジェニック動物または植物を含む、任意の適した宿主を、ポリペプチド変種を産生するために使用してもよい。哺乳類細胞が好ましい。細菌宿主細胞の例には、バチルス属(例えば、B.ブレビスもしくは枯草菌)、シュードモナス属またはストレプトミセス属のようなグラム陽性細菌;または大腸菌株のようなグラム陰性細菌が含まれる。適した糸状真菌宿主細胞の例には、アスペルギルス属(例えばA.オリゼー、A.ニガーもしくはA.ニデュランス);フザリウム属;またはトリコデルマ属の株が含まれる。適切な酵母宿主細胞の例には、サッカロミセス属(例えば、S.セレビジエ);分裂酵母;クリヴェロミセス属(Kluyveromyces);ピチア属(例えばP.パストリス(P. pastoris)もしくはP.メタノリカ(P. methanolica));ハンゼヌラ属(例えばH.ポリモルファ(H. Polymorpha));またはヤロウィア属(Yarrowia)の株が含まれる。適した昆虫宿主細胞の例には、スポドプテラ・フルギペルタ(Spodoptera frugiperda)(Sf9もしくはSf21)またはトリコプルシオア・ニ(Trichoplusioa ni)細胞(ハイファイブ(High Five))(米国特許第5,077,214号)のような、鱗翅目細胞系が含まれる。適した哺乳類宿主細胞の例には、チャイニーズハムスター卵巣(CHO)細胞系(例えばCHO-K1; ATCC CCL-61)、ミドリザル細胞系(COS)(例えばCOS 1(ATCC CRL-1650)、COS 7(ATCC CRL-1651)); マウス細胞(例えばNS/O);胎仔ハムスター腎臓(BHK)細胞系(例えばATCC CRL-1632またはATCC CCL-10);およびヒト細胞(例えばHEK 293(ATCC CRL-1573))が含まれる。さらなる適した細胞系は、当技術分野に公知であり、American Type Culture Collection、Rockville、Marylandのような、公共の寄託所から入手可能である。また、CHO細胞のような哺乳類細胞は、ポリペプチド変種の改善されたグリコシル化を提供するために、例えば米国特許第5,047,335号に記載されるような、シアリルトランスフェラーゼ、例えば1,6-シアリルトランスフェラーゼを発現するように改変されてもよい。
【0194】
分泌を増加させるために、本発明のポリペプチド変種を、エンドプロテアーゼと共に、特にPACE (対塩基性アミノ酸転換酵素)(例えば米国特許第5,986,079号に記載されている)、例えばKex2エンドプロテアーゼ(例えば国際公開公報第00/28065号に記載されている)と共に産生することは特に興味深い。
【0195】
上記細胞型に外因性DNAを導入する方法、ならびにFVII変種の発現、産生および精製に関するその他の情報は、本明細書に参照として組み入れられる国際公開公報第01/58935号に見出される。
【0196】
本発明の薬学的組成物およびその使用
さらなる局面において、本発明は、本発明のポリペプチド変種および薬学的に許容される担体または賦形剤を含む組成物、特に薬学的組成物に関する。
【0197】
本発明によるポリペプチド変種および薬学的組成物を、薬剤として使用してもよい。
【0198】
上記の改善された性質のために、本発明のポリペプチド変種、または本発明の薬学的組成物は、外傷患者、血小板減少症患者、抗凝固治療を受けている患者、静脈瘤出血または他の上部消化管出血を有する肝硬変患者、正位肝臓移植または肝切除を受ける患者(輸血を伴わない手術を可能にする)、または血友病患者における、制御できない出血事象の治療に特に有用である。
【0199】
外傷は、外因性物質によって引き起こされる生きている組織への損傷として定義される。これは米国における死因の第4位であり、経済に対しても大きな財政的負担となっている。
【0200】
外傷は、鈍的外傷または貫通性外傷のいずれかに分類される。鈍的外傷によって、内部圧迫、臓器損傷、および内出血が起こり、貫通性外傷(物質が体を貫通して組織、血管および臓器を破壊した結果として)によって外部出血が起こる。
【0201】
外傷は、例えば、交通事故、銃による損傷、墜落、機械の事故、および刺し傷などの多くの事象によって引き起こされる可能性がある。
【0202】
肝硬変は、慢性アルコール中毒、慢性ウイルス性肝炎(B型、C型、およびD型)および自己免疫性肝炎を含む直接的な肝損傷に加え、原発性胆汁性肝硬変、原発性硬化性胆管炎、および胆管閉鎖を含む胆管損傷による間接的な損傷によって引き起こされる可能性がある。あまり一般的でない肝硬変の原因には、嚢胞性線維症、α-1-アンチトリプシン欠損症、ヘモクロマトーシス、ウィルソン病、ガラクトース血症、および糖原病のような遺伝性疾患による直接的な肝損傷が含まれる。移植は、末期肝硬変患者を治療するための重要な介入である。
【0203】
したがって、さらなる局面において、本発明は、凝血形成が望ましい疾患または障害の治療のために薬剤を製造するために本発明のポリペプチド変種に関する。本発明のなおさらなる局面は、本発明のポリペプチド変種または薬学的組成物の有効量をそれを必要とする哺乳類に投与することを含む、凝血形成が望ましい疾患または障害を有する哺乳類を治療する方法に関する。
【0204】
凝血形成の増加が望ましい疾患/障害の例には、脳出血を含む出血および、外傷のような制御されない激しい出血のある患者が含まれるが、これらに限定されない。さらなる例には、生体移植を受ける患者、切除を受ける患者、および静脈瘤出血を有する患者が含まれる。本発明のポリペプチドが凝血形成の増加に有効であると意図される、他の広範にわたる疾患/障害は、血友病、例えば、フォンウィルブランド病、血友病A、血友病Bおよび血友病Cである。
【0205】
本発明のポリペプチド変種は治療的有効量で、通常、NovoSeven(登録商標)のようなrFVIIを用いた治療において用いられる用量とほぼ平行な用量でまたはより低い用量で患者に投与される。本明細書における「治療的有効量」とは、それが投与される病態に関連して望ましい作用を生じるために十分な用量を意味する。正確な用量は、状況に依存し、既知の技術を用いて当業者によって確認可能となると思われる。通常、用量は、治療される病態または適応の重症度または拡大を予防または弱めることができなければならない。本発明のポリペプチド変種または組成物の有効量は、中でも疾患、用量、投与スケジュールに依存し、ポリペプチド変種もしくは組成物が単独で投与されるのか、または他の治療物質と共に投与されるのかに関わらず、組成物の血漿半減期、および患者の全身健康に依存することは当業者には明らかであると思われる。
【0206】
本発明のポリペプチド変種は好ましくは、薬学的に許容される担体または賦形剤を含む組成物において投与される。「薬学的に許容される」とは、それが投与される患者において如何なる望ましくない作用も引き起こさない担体または賦形剤を意味する。そのような薬学的に許容される担体および賦形剤ならびに適切な薬学的製剤法は当技術分野で周知である(例えば、「Remington's Pharmaceutical Sciences」、第18版、A.R. Gennaro編、マック出版社[1990];「Pharmaceutical Formulation Development of Peptides and Proteins」、S. FrokjaerおよびL. Hovgaard編、Taylor およびFrancis[2000];および「Handbook of Pharmaceutical Excipients」、第3版、A. Kibbe編、Pharmaceutical Press[2000]を参照されたい)。
【0207】
本発明のポリペプチド変種は、「そのまま」および/またはその塩の形で用いることができる。適した塩には、ナトリウム、カリウム、およびマグネシウムのようなアルカリ金属塩またはアルカリ土類金属塩と共に、例えば亜鉛塩が含まれるがこれらに限定されない。これらの塩または複合体は、結晶および/または非晶系構造として存在してもよい。
【0208】
本発明の薬学的組成物は単独または他の治療物質と共に投与してもよい。これらの物質は、同じ薬学的組成物の一部として組み入れてもよく、または本発明のポリペプチド変種とは個別に、同時にまたはもう1つの治療スケジュールに従って投与してもよい。さらに、本発明のポリペプチド変種または薬学的組成物は、他の治療に対する補助剤として用いてもよい。
【0209】
本発明の目的に関して「患者」には、ヒトおよび他の哺乳類の両方が含まれる。したがって、方法はヒトの治療および獣医学応用の両方、特にヒトの治療に適用可能である。
【0210】
本発明のポリペプチド変種を含む薬学的組成物は、多様な剤形、例えば液体、ゲル、凍結乾燥、または圧縮個体の形で製剤化してもよい。好ましい剤形は治療される特定の適応に依存し、当業者に明らかであると思われる。
【0211】
特に、本発明のポリペプチド変種を含む薬学的組成物は、凍結乾燥または安定な可溶性型で調製してもよい。ポリペプチド変種は、当業者に公知の多様な方法によって凍結乾燥してもよい。ポリペプチド変種は、本明細書に記述のようにタンパク質分解部位の除去または保護による安定な溶解型であってもよい。安定な溶解調製物を得る長所は、患者がより容易に取り扱いできる点にあり、緊急の場合には、生命を救うようになりうるより迅速な作用である。好ましい剤形は、治療される特定の適応に依存し、当業者に明らかであると思われる。
【0212】
本発明の製剤の投与は、経口、皮下、静脈内、脳内、鼻腔内、経皮、腹腔内、筋肉内、肺内、膣内、直腸内、眼内、または他の任意の許容される方法を含むがこれらに限定されない多様な方法で行うことができる。製剤は、注入によって連続的に投与することができるが、ポンプまたは埋め込みのような当技術分野で周知の技術を用いるボーラス注射が許容される。場合によっては、製剤は溶液またはスプレーとして直接適用してもよい。
【0213】
非経口投与
薬学的組成物の好ましい例は、非経口投与のためにデザインされた溶液、特に好ましくは水溶液である。多くの場合において、薬学的溶液製剤は、直ちに使用するために適用な液体型で提供されるが、そのような非経口製剤はまた凍結または凍結乾燥型で提供してもよい。前者の場合、組成物は使用前に融解しなければならない。凍結乾燥調製物は一般的にその液体対応物より安定であることが当業者によって認識されていることから、後者の型は、組成物に含まれる活性化合物の安定性を広く多様な保存条件で増強するために用いられる。そのような凍結乾燥調製物は、注射用滅菌水または滅菌生理食塩液のような1つまたは複数の薬学的に許容される希釈剤を加えることによって使用前に溶解する。
【0214】
非経口投与の場合、それらは適当であれば、所望の程度の純度を有するポリペプチド変種を、当技術分野で典型的に用いられる(その全てが「賦形剤」と呼ばれる)1つまたは複数の薬学的に許容される担体、賦形剤、または安定化剤、例えば緩衝剤、安定化剤、保存剤、等張剤、非イオン性界面活性剤、または洗浄剤、抗酸化剤、および/または他の雑多な添加剤、例えば増量剤、充填剤、キレート剤、抗酸化剤、および共溶媒と混合することによって凍結乾燥製剤または水溶液として保存するために調製される。
【0215】
FVII変種の投与に適した非経口製剤および徐放性製剤に関する詳細な情報は、本明細書に参照として組み入れられている国際公開公報第01/58935号および国際公開公報第03/093465号に見出すことができる。
【0216】
本発明は、以下の非制限的な実施例によってさらに記載される。
【0217】
材料と方法
活性部位領域
活性部位領域を、触媒三構造(残基H193、D242、S344)における任意の原子から10Å以内に、少なくとも1つの原子を有する任意の残基として定義する。
【0218】
タンパク質分解に対する感受性低下の測定
タンパク質分解は、タンパク質分解が自己タンパク質分解である、米国特許第5,580,560号、実施例5に記載されるアッセイ法を用いて測定することができる。
【0219】
さらに、タンパク質溶解の減少は、放射標識試料を用いて、血液試料を採取してこれらにSDS-PAGEおよびオートラジオグラフィーを行うことによって、rhFVIIaと本発明のポリペプチド変種とのタンパク質分解を比較するインビボモデルにおいて試験することができる。
【0220】
タンパク質分解を決定するために用いられるアッセイ法によらず、「タンパク質分解の減少」は、クーマシー染色SDS-PAGEゲルのゲルスキャニング、HPLCによって測定されるように、または下記の組織因子比依存的活性アッセイ法を用いて野生型と比較して保存された触媒活性によって測定されるように、rhFVIIaによって得られた分解と比較した切断の測定可能な減少を意味すると解釈される。
【0221】
ポリペプチド変種の分子量の測定
ポリペプチド変種の分子量は、SDS-PAGE、ゲル濾過、ウェスタンブロット、マトリクス支援レーザー脱離質量分析、または平衡遠心、例えばLaemmli, U.K.、Nature Vol 227(1970)、pp.680〜85によるSDS-PAGEによって決定される。
【0222】
リン脂質膜結合親和性の決定
リン脂質膜結合親和性は、Nelsestuen et al., Biochemistry, 1977; 30; 10819-10824に記載のとおり、または米国特許第6,017,882号の実施例1に記載されているとおりに決定してよい。
【0223】
TF非依存的第X因子活性化アッセイ
本アッセイは、Nelsestuenら、J. Biol. Chem. 2001、276:39285〜39381の39826頁に詳細に記述されている。
【0224】
簡単に説明すると、アッセイされる分子(hFVII、rhFVIIa、またはその活性化型での本発明のポリペプチド変種)を、BSAを含むTris緩衝液において、リン脂質源(好ましくは、ホスファチジルコリンとホスファチジルセリンを8:2で)および再脂質添加された第X因子と混合する。明記されたインキュベーション期間の後、過剰量のEDTAを加えて反応を停止させる。次に、第Xa因子の濃度を、発色基質(S-2222、クロモゲニックス(Chromogenix))を添加した後の405 nmでの吸光度の変化から測定する。バックグラウンドに関して補正後、rhFVIIa(awt)の組織因子非依存的活性を、10分後の吸光度の変化として決定し、本発明のポリペプチド変種の組織因子非依存的活性(a変種)を、10分後の吸光度の変化として決定する。その活性化型のポリペプチド変種の活性と、rhFVIIaの活性との比をa変種/awtとして定義する。
【0225】
凝血アッセイ
FVIIaおよびその変種の凝血活性を一段階アッセイにおいて測定し、凝血時間をトロンボトラックIV凝固計(Medinor)において記録した。第VII因子枯渇ヒト血漿(American Diagnostica)を再構築して、室温で15〜20分平衡化した。次に、血漿50 μlを凝固計のカップに移した。
【0226】
FVIIaおよびその変種をグリオキサリン緩衝液(5.7 mMバルビツレート、4.3 mMクエン酸ナトリウム、117 mM NaCl、1 mg/ml BSA、pH 7.35)において希釈した。試料50 μlをカップに加えて、37℃で2分間インキュベートした。
【0227】
トロンボプラスチン(Medinor)を水に溶解して、CaCl2を最終濃度4.5 mMで加えた。トロンボプラスチン100 μlを加えて反応を開始した。
【0228】
TFの非存在下で凝血活性を測定するために、トロンボプラスチンを加えない同じアッセイを用いた。PRISMソフトウェアを用いてデータを分析した。
【0229】
全血アッセイ
FVIIaおよびその変種の凝血アッセイを一段階アッセイにおいて測定し、凝血時間をトロンボトラックIV凝固計(Medinor)において記録した。FVIIaまたはその変種100 μlを、10 mMグリシルグリシン、50 mM NaCl、37.5 mM CaCl2、pH 7.35を含む緩衝液において希釈して、反応カップに移した。10%0.13 Mクエン酸ナトリウムを抗凝固剤として含む血液50 μlを加えて凝血反応を開始した。エクセルまたはPRISMソフトウェアを用いてデータを分析した。
【0230】
アミド溶解アッセイ
変種が小さいペプチド基質を切断できるか否かは、発色基質S-2288(D-Ile-Pro-Arg-p-ニトロアニリド)を用いて測定することができる。FVIIaをアッセイ緩衝液(50 mM Na-Hepes、pH 7.5、150 mM NaCl、5 mM CaCl2、0.1%BSA、1 U/mlヘパリン)において約10〜90 nMに希釈した。さらに、可溶性TF(sTF)をアッセイ緩衝液において50〜450 nMに希釈する。アッセイ緩衝液120 μlをFVIIa試料20 μlおよびsTF 20 μlと混合する。室温で軽く振とうさせながら5分間インキュベートしてから37℃で10分間インキュベートした後、S-2288基質を1 mMとなるように加えて反応を開始させ、405 nmでの吸光度をいくつかの時点で決定する。
【0231】
ELISAアッセイ
FVII/FVIIa(または変種)濃度をELISAによって決定する。マイクロタイタープレートのウェルを、プロテアーゼドメインに対する抗体の2 μg/mlのPBS溶液を用いてコーティングした(100 μl/ウェル)。R.T(室温)で一晩コーティングした後、ウェルをTHT緩衝液(100 mM NaCl、50 mM Tris-塩酸、pH 7.2、0.05% Tween20)によって4回洗浄した。その後、1%カゼイン(100 mM NaCl、50 mM Tris-塩酸、pH 7.2を用いて2.5%保存液を希釈)200 μlをブロッキングのためにウェルに加える。室温で1時間インキュベートした後、ウェルを空にして、試料100 μl(任意で希釈緩衝液(THT+0.1%カゼイン)において希釈)を加える。室温で1時間さらにインキュベーションした後、THT緩衝液でウェルを4回洗浄し、EGF様ドメインに対する100 μlのビオチン標識抗体(1 μg/ml)を添加する。さらに室温で1時間インキュベーションした後、THT緩衝液で4回洗浄し、100 μlのストレプトアビジン-西洋ワサビペルオキシダーゼ(DAKO A/S、Glostrup、Denmark、10000倍希釈)を添加する。さらに室温で1時間インキュベーションした後、THT緩衝液で4回洗浄し、100 μlのTMB(3,3',5,5'-テトラメチルベンジジン、Kem-en-Tech A/S、Denmark)を添加する。暗室で室温で30分間インキュベーションした後、100 μlの1 M H2SO4を添加し、OD450nmを測定する。rhFVIIa(NovoSeven(登録商標))を用いて標準曲線を作製する。
【0232】
あるいは、FVII/FVIIaまたは変種を、プロテアーゼドメインよりむしろGlaドメインを介して定量化することができる。このELISAの条件において、ウェルをEGF様ドメインに対する抗体で一晩コーティングして、検出のために、カルシウム依存ビオチン標識抗Glaドメインモノクローナル抗体を使用する(2 μg/ml、1ウェル当たり100 μl)。この状件において、THTおよび希釈緩衝液に5 mM CaCl2を添加する。
【0233】
トロンボグラムアッセイ
ヒト血漿中のhFVIIa、rhFVIIa、またはFVIIa変種のトロンビン生成に対する効果は、Hemkerら(2000) Thromb Haemost 83:589-91の589ページに記載されているアッセイ法の改変版で試験される。簡単に説明すると、アッセイする分子(hFVIIa、rhFVIIa、または変種のいずれか)を、再脂質化組換え組織因子(例えばDade Behringのイノビン(Innovin))またはリン脂質(フォスファチジルコリンおよびフォスファチジルエタノールの比が8:2、またはフォスファチジルコリン、フォスファチジルセリン、およびフォスファチジルエタノールの比が4:2:4)のいずれかを含むFVII除去貧血小板血漿(PPP)と混合する。
【0234】
蛍光原性トロンビン基質および塩化カルシウムを加えることにより、反応を開始する。蛍光を連続的に測定し、トロンビンアミド溶解活性を、蛍光曲線の傾き(経時的な蛍光の増加)を計算することによって決定する。このようにして、最大トロンビンアミド溶解活性に達するまでの時間(Tmax)が得られ、かつトロンビン生成率(トロンビン活性の最大増加)、および総トロンビン仕事量(work)(曲線下面積(AUC))が計算できる。
【0235】
凍結クエン酸加FVII除去血漿を、凝固の接触経路を阻害するために、トウモロコシトリプシン阻害剤存在下(100μg/ml血漿)で解凍する。96ウェルマイクロタイタープレートのそれぞれのウェルに対して、80μlの血漿と、最終濃度が0.1から100nMの間とした被験rhFVIIまたは変種を含む緩衝液20μlを加える。組換えヒト組織因子(rTF)を、最終濃度が1pMとなるように5μlのアッセイ緩衝液中に加える。アッセイ緩衝液は、蒸留水に溶解した20mM Hepes、150mM NaClおよび60mg/ml BSAからなる。0.1Mの塩化カルシウムを含む20μlの基質溶液を加えることによって、反応を開始する。アッセイプレートおよび試薬は37℃にあらかじめ温めておき、その温度で反応を行う。使用する蛍光測定器は、390nmの励起フィルターおよび460nmの発光フィルターを備えたBMG Fluormeterである。透明底の96ウェルプレートのそれぞれのウェルにおいて、20〜40秒間隔で30〜180分間蛍光を測定する。データはPRISMソフトウェアを用いて解析する。
【0236】
組織因子結合表面プラズモン共鳴アッセイ(Biacoreアッセイ)
表面プラズモン共鳴解析は、野生型第VIIa因子とその変種の可溶性組織因子に対する相対的結合を決定するために用いた。細胞外ドメインを含む組換え可溶性組織因子を、NHS/EDCカップリングを用いてBiacore CM5チップ上で270反応単位カップリングさせた。可溶性組織因子は、チップ表面と相互作用させるため、pH 4.5でカップリングさせた。
【0237】
このアッセイにおいて、第VII因子タンパク質の組織因子結合を、本変種と野生型との相対的比較を可能にするため、FVIIaまたは変種の単一濃度で比較した。この濃度は、75から0μg/mlの間の濃度でチップ上に流した野生型FVIIaの標準曲線により決定した。10mMのEDTAを加えることによりFVIIaを除去した。この方法で、15μg/mlの濃度が直線領域内の結合を生ずることが明らかとなった。次に、FVIIaの変種を15μg/mlの濃度でチップ上に流し、組織因子に対するFVIIaまたは変種の相対的結合強度を決定した。
【実施例】
【0238】
実施例
実施例1
Banner et al.、J Mol Biol、1996; 285:2089による可溶性組織因子との複合体におけるhFVIIaのX線構造を、本実施例のために使用する。この実施例の計算に関するさらなる情報は、国際公開公報第01/58935号を参照されたい。
【0239】
表面の露出
部分的なASA計算を行った結果、それらの側鎖の25%より多くが表面に露出していることが決定された以下の残基が得られた:

(A1〜S45はGlaドメインに位置し、残りの位置はGlaドメイン外に位置する)。
【0240】
以下の残基は、それらの側鎖の50%より多くが表面に露出していることが決定された:

(A1〜S43はGlaドメインに位置し、残りの位置はGlaドメイン外に位置する)。
【0241】
組織因子結合部位
hFVII中の以下の残基が複合体中のASAを変更することを、ASA計算を使用して決定した。これらの残基を受容体結合部位を構成するものとして定義した:

【0242】
活性部位領域
活性部位領域を、触媒三構造(残基H193、D242、S344)における任意の原子から、距離10Å以内の少なくとも1つの原子を有する任意の残基として定義する:

【0243】
活性部位結合裂の隆起
活性部位結合裂領域の隆起を、N173、A175、K199、N200、N203、D289、R290、G291、A292、P321およびT370として、FVIIa構造1FAK.pdbの視覚的検査によって定義した。
【0244】
実施例2
哺乳類細胞におけるrhFVIIa発現の発現カセットの設計
rhFVIIa発現用の発現カセットは、国際公開公報第01/58935号の実施例2に記載されているように、設計およびクローニングした。
【0245】
実施例3
本発明の変種をコードする発現カセットの構築
置換されたコドンを有する変種FVIIオープンリーディングフレームを有する構築物を作製するために、標準的方法を用いて配列突出伸長(Sequence overhang extension : SOE) PCRを使用した。
【0246】
実施例4
CHO K1細胞におけるポリペプチド変種の発現
CHO K1細胞系(ATCC # CCL-61)を、MEMα、10% FCS(Gibco/BRL Cat # 10091)、P/Sおよび5 μg/mlのフィロキノンを用いたT-25フラスコ中に50%コンフルエントで播種して、コンフルエントとなるまで増殖させる。コンフルエントな単層細胞に、リポフェクトアミン2000物質(Life Technologies)を製造者の指示に従って使用して、5 μgの上記関連プラスミドをトランスフェクトさせる。トランスフェクションの24時間後、試料を採取して、例えばhFVIIのEGF1ドメインを認識するELISAなどを用いて、この試料を定量する。この時点で、安定したトランスフェクタントのプールを作製する目的で、関連した選択(例えば、ハイグロマイシンB)を細胞に適用してもよい。CHO K1細胞、およびプラスミド上の選択マーカーとしてハイグロマイシンB耐性遺伝子を使用する場合には、通常これは一週間以内に達成される。
【0247】
実施例5
ポリペプチド変種を安定して発現するCHO-K1細胞の作製
CHO-K1トランスフェクタントプールのバイアルを融解して、細胞を、25 mlのMEMα、10%FCS、フィロキノン(5 μg/ml)、100 U/mlペニシリン、100 μg/mlストレプトマイシンを含む175 cm2組織フラスコに播種して、24時間増殖させる。細胞を回収して、希釈し、細胞密度1/2個〜1個/ウェルで96ウェルマイクロタイタープレートに播種する。1週間増殖させた後、20〜100個の細胞のコロニーがウェルに存在し、1個のコロニーのみを含むウェルを標識する。さらに2週間後、1個のコロニーのみを含む全てのウェルにおける培地を、200 μlの新鮮な培地に交換する。24時間後、培地試料を採取して、例えばELISAによって分析する。高産生クローンを選択し、これをFVIIまたはその変種の大規模産生のために用いる。
【0248】
実施例6
ポリペプチド変種の精製および結果として生じた活性化
FVIIおよびFVII変種は以下のように精製する。技法は4℃で行う。大規模産生から回収した培養培地を、Millipore TFFシステムを用いて、30 kDaカットオフペリコンメンブレンを用いて限外濾過する。培地を濃縮した後、クエン酸塩を5 mMとなるように加えて、pHを8.6に調節する。必要であれば、伝導率を10 mS/cm未満に低下させる。その後、試料を、50 mM NaCl、10 mM Tris、pH 8.6によって平衡化したQ-セファロースカラムに適用する。100 mM NaCl、10 mM Tris、pH 8.6によってカラムを洗浄してから150 mM NaCl、10 mM Tris、pH 8.6によって洗浄した後、FVIIを10 mM Tris、25 mM NaCl、35 mM CaCl2、pH 8.6を用いて溶出する。
【0249】
第二のクロマトグラフィー段階に関して、モノクローナルカルシウム依存的抗Glaドメイン抗体をCNBr活性化セファロースFFに対して共役させることによってアフィニティカラムを調製する。樹脂1 mlあたり抗体約5.5 mgを共役させる。カラムを10 mM Tris、100 mM NaCl、35 mM CaCl2、pH 7.5によって平衡化する。NaClは、濃度100 mM NaClとなるように試料に加えて、pHを7.4〜7.6に調節する。試料のO/N適用後、カラムを100 mM NaCl、35 mM CaCl2、10 mM Tris、pH 7.5によって洗浄して、FVIIタンパク質を100 mM NaCl、50 mMクエン酸塩、75 mM Tris、pH 7.5によって溶出する。
【0250】
第三のクロマトグラフィーに関して、試料の伝導率を必要であれば10 mS/cm未満に低下させて、pHを8.6に調節する。次に、試料をQ-セファロースカラム(50 mM NaCl、10 mM Tris、pH 8.6によって平衡化した)に、有効な活性化を得るためにゲル1 mlあたりタンパク質約3〜5 mgの密度で適用する。適用後、カラムを50 mM NaCl、10 mM Tris、pH 8.6によって3〜4カラム容積(cv)/時間の流速で約4時間洗浄する。FVIIタンパク質を、40 cvで500 mM NaCl、10 mM Tris、pH 8.6の0〜100%の勾配を用いて溶出した。FVII含有分画をプールする。
【0251】
最終クロマトグラフィー段階に関して、伝導率を10 mS/cm未満に低下させる。その後、試料をQ-セファロースカラム(140 mM NaCl、10 mMグリシルグリシン、pH 8.6によって平衡化した)に、ゲル1 mlあたりタンパク質約3〜5 mgの濃度で適用する。次に、カラムを140 mM NaCl、10 mMグリシルグリシン、pH 8.6によって洗浄して、FVIIを140 mM NaCl、15 mM CaCl2、10 mMグリシルグリシン、pH 8.6によって溶出する。溶出液を10 mM CaCl2となるように希釈して、pHを6.8〜7.2に調節する。最後に、Tween80を0.01%となるように加えて、-80℃で保存するためにpHを5.5に調節する。
【0252】
実施例7
実験結果−FX活性化活性
本発明の変種を「TF非依存性第X因子活性化アッセイ」に供し、以下の結果が得られた(結果は参照としてのP10Q+K32E変種の活性のパーセンテージで表される)。
【0253】
【表1】

【0254】
上記の結果からわかるように、rhFVIIaと比較して、また[P10Q+K32E]rhFVIIaと比較して、本発明の変種はFX活性化活性の実質的な改善を示した。
【0255】
実施例8
実験結果−「全血アッセイ」における凝血活性
本発明の変種を「全血アッセイ」に供したところ、それらの凝血活性はrhFVIIaならびに[P10Q+K32E]rhFVIIaと比較して有意な増加(すなわち凝血時間の減少)を示すことが判明した。実験結果は図1および下記の表2に示す。
【0256】
【表2】

【0257】
実施例9
実験結果−「凝血アッセイ」における凝血活性
TF依存性凝血アッセイ(上記の材料と方法の項に記載されている「凝血アッセイ」)においてアッセイした場合、R36Eの置換を有する本発明の変種は、rhFVIIまたは他の本発明の変種と比較して、有意に凝血活性が減少することが明らかだった。下記の表3を参照。それにも関わらず、上記の実施例7に説明されているように、R36Eの置換を有する変種は「TF非依存性第X因子活性化アッセイ」において第X因子活性化活性が増加している。
【0258】
【表3】

【0259】
実施例10
実験結果−トロンボグラムアッセイにおけるトロンビン生成
リン脂質(PL)依存性および組織因子(TF)依存性トロンボグラムの両方を用いて(上記のトロンボグラムアッセイの記載を参照)、異なる変種タンパク質濃度におけるFVIIa変種の最大トロンビン生成率を決定した。最大トロンビン生成率(FU(蛍光単位)/sec2として表される)をpMで表した変種濃度の関数としてプロットすることによって、図2(最大組織因子依存性トロンビン生成率)および図3(最大リン脂質依存性トロンビン生成率)に示す結果が得られた。
【0260】
これらの結果から、FVIIa変種であるP10Q K32E A34E R36Eは、反応がPL依存性かTF依存性であるかによって、異なるトロンビン生成力を有することが明らかである。本変種の最大TF依存性トロンビン生成率は、FVIIa変種であるP10Q K32EまたはA3AY P10Q K32E A34Lと比較して、およそ10倍減少している(図2の破線)。また、P10Q K32E A34E R36Eでは他の変種と比較して、ラグタイム、ピークまでの時間、ピークの高さ、および(より少ない程度であるが)AUCも減少している(データは示していない)。TF依存性活性とは対照的に、P10Q K32E A34E R36E変種のPL依存性活性は、本実施例で試験した他の変種の活性と同等であり(図3参照)、すなわち本変種はTF依存性活性が実質的に減少しても十分なPL依存性活性を有する。
【0261】
同実験において、P10Q K32E A34E R36Eの変種を、図2に示すように高いTF依存性トロンビン生成率を有するP10Q K32E A34E P74Sの変種と直接比較した。二つの変種間のTF結合の差(すなわち変種P10Q K32E A34E R36EのTF結合の減少)は、おそらくA34Eの置換と共に、R36Eの置換の存在に直接起因すると考えられる。
【0262】
実施例11
実験結果−Biacoreアッセイにおける組織因子へのFVIIa結合
本発明の変種を、材料と方法の項に記載されているように、TFチップを用いたBiacoreシステム上での表面プラズモン共鳴によるアッセイに供したところ、以下の結果が得られた。
【0263】
【表4】

【0264】
トロンボグラムアッセイからのTF依存性トロンビン生成率のデータ(実施例10)と一致して、表4の結果はR36Eの置換により組織因子への結合が減少することを示す。
【0265】
同Biacoreアッセイにおいて、グリコシル化部位を導入する二つの追加の改変(T106N、およびV253NまたはI205Tのいずれか)とともに表4に列記される変種と同じ改変を有するFVIIa変種も、組織因子への結合について試験した。その結果は下記の表5に示す。
【0266】
【表5】

【0267】
これらの結果は表4の結果と一致しており、追加のグリコシル化部位がない表4の同変種(または野生型)と比較して、表5の変種における新たな二つのグリコシル化部位の存在は、組織因子結合の(さらなる)減少を提供する。表4の変種の場合のように、グリコシル化変種にR36Eの置換が存在すると、この置換を有しない他のグリコシル化変種の組織因子結合レベルよりも、組織因子結合レベルが実質的に低下する。
【技術分野】
【0001】
発明の分野
本発明は、第VII因子(FVII)または第VIIa因子(FVIIa)ポリペプチドの新規のGlaドメイン変種、ならびに、治療、特に様々な凝固関連障害の治療のための、そのようなポリペプチド変種の使用に関する。
【背景技術】
【0002】
発明の背景
血液凝固は、最終的にフィブリン凝血が起こる様々な血液成分(または因子)の複雑な相互作用からなるプロセスである。一般的に、「凝固カスケード」と呼ばれてきた事象に関与する血液成分は、プロ酵素またはチモーゲン、すなわち、活性化因子の作用によって活性型に変換される酵素的に不活性なタンパク質である。これらの凝固因子の1つはFVIIである。
【0003】
FVIIは、肝臓において合成され、血液中に分子量53 kDaの一本鎖糖タンパク質として分泌されるビタミンK依存的血漿タンパク質である(BrozeおよびMajerus、J. Biol. Chem. 1980;255:1242〜1247)。FVIIチモーゲンは、単一の部位R152-I153でのタンパク質溶解切断によって活性型(FVIIa)に変換され、それによって単一のジスルフィド結合によって結合された二つの鎖が得られる。組織因子と複合体を形成したFVIIa(FVIIa複合体)は第IX因子(FIX)と第X因子(FX)の両方をその活性型に変換することができ、その後迅速なトロンビン形成およびフィブリン形成に至る反応が起こる(OsterudおよびRapaport、Proc Natl Acad Sci USA 1977;74:5260〜5264)。
【0004】
FVIIは、ビタミンK依存的カルボキシル化を含む翻訳後改変を受け、それによって分子のN末端領域においてγ-カルボキシグルタミン酸残基10個が得られる。したがって、配列番号:1に示される残基番号6位、7位、14位、16位、19位、20位、25位、26位、29位および35位は、FVII活性にとって重要なGlaドメインにおけるγカルボキシグルタミン酸残基である。他の翻訳後改変には、145位および322位での天然に存在する二つのN-グリコシル化部位での、ならびに52位および60位での天然に存在する二つのO-グリコシル化部位でのそれぞれ糖部分の結合が含まれる。
【0005】
ヒトFVII(hFVII)をコードする遺伝子は、第13染色体のq34-qter9にマッピングされている(de Grouchyら、Hum Genet. 1984;66:230〜233)。これはエキソン9個を含み、12.8 Kbに及ぶ(O'Haraら、Proc Natl Acad Sci USA 1987;84:5158〜5162)。FVIIの遺伝子構築およびタンパク質構造は、他のビタミンK依存的前凝固タンパク質と類似であり、エキソン1aおよび1bはシグナル配列をコードし;エキソン2はポリペプチドおよびGlaドメイン;エキソン3は短い疎水性領域;エキソン4および5は上皮細胞増殖因子様ドメイン;およびエキソン6〜8はセリンプロテアーゼ触媒ドメインをコードする(Yoshitakeら、Biochemistry 1985;24:3736〜3750)。
【0006】
hFVIIa(Pikeら、Proc Natl Acad Sci USA、1999;96:8925〜30、およびKemball-Cookら、J. Struct. Biol. 1999;127:213〜223)、X線結晶学的方法を用いて可溶性組織因子と複合体を形成したhFVIIa(Bannerら、Nature 1996;380:41、およびZhangら、J. Mol. Biol.、 1999;285:2089)、およびhFVIIのより小さい断片(Muranyiら、Biochemistry、 1998;37:10605およびKaoら、Biochemistry、 1999;38:7097)の実験的三次元構造に関する報告がある。
【0007】
FVIIのいくつかのタンパク質工学による変種が報告されている(DickinsonおよびRuf、J Biol Chem、1997;272:19875〜19879、Kemball-Cookら、J Biol Chem、 1998;273:8516〜8521、Bharadwajら、J Biol Chem、1996;271:30685〜30691、Rufら、Biochemistry、1999;38:1957〜1966)。
【0008】
BHKまたは他の哺乳類細胞におけるFVIIの発現(国際公開公報第92/15686号、国際公開公報第91/11514号、および国際公開公報第88/10295号)ならびに真核細胞におけるFVIIおよびkex2エンドプロテアーゼの同時発現(国際公開公報第00/28065号)に関する報告が存在する。
【0009】
組み換え型ヒトFVIIa(rhFVIIa)の市販の調製物は、商品名NovoSeven(登録商標)として販売されている。NovoSeven(登録商標)は、血友病AまたはB患者における出血事例の治療に適応されている。NovoSeven(登録商標)は、現在市販されている出血事例の有効かつ信頼できる治療のための唯一のrhFVIIaである。
【0010】
152位のアルギニンおよび/または153位のイソロイシンが改変されているFVIIの不活性型が、国際公開公報第91/11514号において報告されている。これらのアミノ酸は活性化部位に存在する。国際公開公報第96/12800号は、セリンプロテアーゼ阻害剤によるFVIIaの不活化を記述している。α-アミノ基I153位でのFVIIaのカルバミル化による不活化は、Petersenら、Eur. J. Biochem、1999;261:124〜129によって記述されている。不活性型は、組織因子との結合および凝固活性の阻害に関して野生型FVIIまたはFVIIaと競合することができる。FVIIaの不活性型は、敗血症患者または心筋梗塞もしくは血栓症発作のリスクがある患者のような高凝固状態にある患者を治療するために用いることが示唆されている。
【0011】
外傷などの制御不能な出血の治療に関連して、FVIIaは組織因子と結合せずにFXをFXaへ活性化させることができると考えられており、この活性化反応はまず活性型血小板で生じると考えられている(Hednerら、Blood Coagulation & Fibrinolysis, 2000; 11; 107-111)。しかし、hFVIIaまたはrhFVIIaは、組織因子の非存在下ではFXに対する活性が低く、結果的に、例えば外傷患者の制御不能な出血の治療には、比較的高用量かつ複数用量のhFVIIaまたはrhFVIIaを投与することが必要となる。したがって、より効率的に(失血を最小限にするように)制御不能な出血を治療するためには、組織因子の非存在下でFXに対して高い活性を有する改良型FVIIa分子が必要である。そのような改良型FVIIa分子は、制御不能な出血に関連して投与された場合、rhFVIIaと比較して短い凝固時間(より早い作用/凝血活性の増加)を示すはずである。
【0012】
FVII/ FVIIaのGlaドメイン変種は、国際公開公報第99/20767号、米国特許第6,017,882号、および国際公開公報第00/66753号に開示されており、Glaドメインに位置するいくつかの残基が、リン脂質膜結合ひいてはFXの活性化に重要であるものとして同定された。特に、10位および32位の残基が重要であり、リン脂質膜結合親和性の増加ひいてはFXの活性化が、P10QおよびK32Eの変異を行うことで達成されうることが見出された。特に、限界的な凝固条件、例えば低レベルの組織因子が存在する条件下では、rhFVIIa と比較してFXの活性化が増強されることが明らかとなった。
【0013】
国際公開公報第01/58935号は、指向されたグリコシル化またはPEG化手段によって、とりわけ半減期が増加したFVIIまたはFVIIa分子を開発する新たな戦略を開示している。
【0014】
国際公開公報第03/093465号は、Glaドメイン内にある種の改変を有し、Glaドメインの外部に一つまたは複数のN-グリコシル化部位が導入されている、FVIIまたはFVIIaの変種を開示している。
【0015】
国際公開公報第2004/029091号は、組織因子結合部位にある種の改変を有するFVIIまたはFVIIaの変種を開示している。
【0016】
本発明者らは、リン脂質膜結合親和性をさらに増加させ、ひいてはFX活性化をさらに増大させる、Glaドメイン内のさらなる残基を同定した。本発明のFVIIまたはFVIIa変種は、組織因子結合親和性の減少も示しうる。
【0017】
本発明の目的は、hFVIIa、rhFVIIaまたは[P10Q+K32E]rhFVIIaよりも効率的にFXをFXaに活性化することのできる、改良型FVIIまたはFVIIa分子(FVIIまたはFVIIa変種)を提供することである。特に、組織因子の非存在下で、hFVIIa、rhFVIIa または[P10Q+K32E]rhFVIIaよりも効率的にFXをFXaに活性化することのできる改良型FVIIまたはFVIIa分子(FVIIまたはFVIIa変種)を提供することが本発明の目的である。これらの目的は、本明細書に提供されたFVIIまたはFVIIa変種によって対処される。
【発明の概要】
【0018】
発明の簡単な開示
本発明の第一の局面は、配列番号:1に示すアミノ酸配列を有するヒト第VII因子(hFVII)またはヒト第VIIa因子(hFVIIa)に関連する1〜15個のアミノ酸改変を含むアミノ酸配列を有し、34位に疎水性アミノ酸残基が置換により導入されている、第VII因子(FVII)または第VIIa因子(FVIIa)ポリペプチド変種に関する。
【0019】
本発明の第二の局面は、配列番号:1に示すアミノ酸配列を有するヒト第VII因子(hFVII)またはヒト第VIIa因子(hFVIIa)に関連する1〜15個のアミノ酸改変を含むアミノ酸配列を有し、このアミノ酸配列が36位にアミノ酸置換を含む、第VII因子(FVII)または第VIIa因子(FVIIa)ポリペプチド変種に関する。
【0020】
本発明の第三の局面は、配列番号:1に示すアミノ酸配列を有するヒト第VII因子(hFVII)またはヒト第VIIa因子(hFVIIa)に関連する3〜15個のアミノ酸改変を含むアミノ酸配列を有し、アミノ酸配列が、10位および32位におけるアミノ酸置換、ならびに74位、77位、および116位からなる群より選択される部位における少なくとも一つのさらなるアミノ酸置換を含む、第VII因子(FVII)または第VIIa因子(FVIIa)ポリペプチド変種に関する。
【0021】
本発明のさらなる局面は、本発明のポリペプチド変種をコードするヌクレオチド配列、そのヌクレオチド配列を含む発現ベクター、そのヌクレオチド配列または発現ベクターを含む宿主細胞に関する。
【0022】
本発明のなおさらなる局面は、本発明のポリペプチド変種を含む薬学的組成物、本発明のポリペプチド変種または本発明の薬学的組成物の薬剤としての使用、ならびに本発明のポリペプチド変種または薬学的組成物を用いた治療方法に関する。
【0023】
本発明のさらなる局面は、添付の特許請求の範囲だけでなく、下記の記載からも明らかになる。
【図面の簡単な説明】
【0024】
【図1】「全血アッセイ」でアッセイした場合の、本発明の変種濃度に対する凝固時間を示す。
【図2】「トロンボグラムアッセイ」において決定した、本発明変種の組織因子依存性トロンビン最大生成率を示す。
【図3】「トロンボグラムアッセイ」において決定した、本発明の変種のリン脂質依存性トロンビン最大生成率を示す。
【発明を実施するための形態】
【0025】
発明の詳細な開示
定義
本記載および特許請求の範囲の文脈において、以下の定義を適用する。
【0026】
「FVII」または「FVIIポリペプチド」という用語は、一本鎖形状で提供されるFVII分子を意味する。FVIIポリペプチドの一例は、配列番号:1に示すアミノ酸配列を有する野生型ヒトFVII(hFVII)である。しかし、「FVIIポリペプチド」という用語には、例えば配列番号:1の断片や変種、特に配列番号:1と比較してその配列に少なくとも一個、例えば15個以内、好ましくは10個以内のアミノ酸改変を含む変種といったhFVII様分子も含まれるということが理解されるべきである。
【0027】
「FVIIa」または「FVIIaポリペプチド」という用語は、活性型二本鎖形状で提供されるFVIIa分子を意味する。FVIIa のアミノ酸配列を記載するのに配列番号:1のアミノ酸配列が使用される場合、一本鎖形状のR152とI153の間のペプチド結合が開裂し、それらの鎖の一方はアミノ酸残基1〜152となり、他方はアミノ酸残基153〜406となると理解される。
【0028】
「rFVII」および「rFVIIa」という用語は、組換え技術によって産生されたFVIIおよびFVIIaポリペプチドを意味する。
【0029】
「hFVII」および「hFVIIa」という用語はそれぞれ、配列番号:1に示されるアミノ酸配列を有するヒト野生型FVIIおよびFVIIaを意味する。
【0030】
「rhFVII」および「rhFVIIa」という用語は、組換え手段により作製された、配列番号:1に示されるアミノ酸配列を有するヒト野生型FVIIおよびFVIIaを意味する。rhFVIIaの一例は、NovoSeven(登録商標)である。
【0031】
本明細書で使用される場合、「Glaドメイン」という用語は、配列番号:1の1〜45位のアミノ酸残基を含むことを意図する。
【0032】
したがって、「Glaドメイン外に位置する部位」とは、配列番号:1の46〜406位のアミノ酸残基を含む。
【0033】
「FX」、「TF」および「TFPI」という略語は、それぞれ、第X因子、組織因子、組織因子経路阻害剤を意味する。
【0034】
「プロテアーゼドメイン」という用語は、N末端から数えて153〜406位の残基について使用される。
【0035】
「触媒部位」という用語は、ポリペプチド変種のS344、D242およびH193からなる触媒三構造を意味するために使用される。
【0036】
「親」という用語は、本発明に従って改変/改良されるべき分子を示すことを意図している。本発明によって改変される親ポリペプチドは、任意のFVIIまたはFVIIaポリペプチドであってよく、ゆえに任意の起源、例えば非ヒト哺乳動物起源に由来してもよいが、親ポリペプチドはhFVIIまたはhFVIIaであることが好ましい。
【0037】
「変種」とは、一つまたは複数のアミノ酸残基、通常は1〜15個のアミノ酸残基(例えば1、2、3、4、5、6、7、8、9、10、11、12、13、14、または15個のアミノ酸残基)、例えば1〜10個のアミノ酸残基、例えば1〜8、1〜6、1〜5、または1〜3個のアミノ酸残基が親ポリペプチドと異なるポリペプチドである。通常、親ポリペプチドはhFVIIまたはhFVIIaである。
【0038】
「結合型(または互換的に「結合型ポリペプチド」)」とは、1つまたは複数のポリペプチドを、ポリマー分子、親油性化合物、糖部分または有機誘導体化物質のような1つまたは複数の非ポリペプチド部分に共有結合させることによって形成された不均一な(組成の意味においてまたはキメラ)分子を示すと解釈される。好ましくは、結合型は、適切な濃度および条件で可溶性である、すなわち血液のような生理的液体において可溶性である。本発明の結合型ポリペプチドの例には、グリコシル化および/またはPEG化ポリペプチドが含まれる。
【0039】
「共有結合」または「共有結合した」という用語は、ポリペプチド変種および非ポリペプチド部分が、互いに直接共有結合しているか、または架橋、スペーサー、もしくは連結部分のような、少なくとも1つの介在する部分を通して、間接的に共有結合していることを意味する。
【0040】
「非ポリペプチド部分」という用語は、アミノ酸単量体から構成されペプチド結合によって結合されているペプチド重合体とは異なる分子を意味し、この分子は本発明のポリペプチド変種の結合基に結合することができる。そのような分子の好ましい例として、ポリマー分子、糖部分、親油性化合物または有機誘導体化物質が挙げられる。本発明の結合型変種の文脈で使用される場合、非ポリペプチド部分は、ポリペプチドの結合基を介して結合型変種のポリペプチド部分に結合していると理解される。上記に説明されているように、非ポリペプチド部分は、直接的または間接的に結合基と共有結合できる。
【0041】
「ポリマー分子」は、単量体がいずれもアミノ酸残基ではなく、ポリマーがヒトアルブミンまたは他の豊富な血漿タンパク質である場合を除く、二つまたはそれ以上の単量体の共有結合によって形成された分子である。「ポリマー」は、「ポリマー分子」という用語と互換的に用いてもよい。この用語はまた、インビトログリコシル化によって結合された糖質分子、すなわち、選択的にクロスリンク剤を用いて糖質分子をポリペプチド変種の結合基に共有結合させることを含む、通常インビトロで行われる合成グリコシル化を含むと解釈される。
【0042】
「糖部分」は、インビボグリコシル化によって(グリコシル化ポリペプチド変種の形でポリペプチド変種結合型を産生するために)ポリペプチド変種に結合することができる、1つまたは複数の単糖類残基を含む糖質含有分子を示すと解釈される。「インビボグリコシル化」という用語は、すなわちポリペプチド変種の発現のために用いられるグリコシル化細胞における翻訳後プロセシングの際に、例えばN-結合およびO-結合グリコシル化によって、インビボで起こる糖部分の任意の結合を意味すると解釈される。正確なオリゴ糖構造は、当該グリコシル化生物に依存するところが大きい。
【0043】
「N-グリコシル化部位」は、配列N-X-S/T/Cを有し、式中Xはプロリンを除く任意のアミノ酸残基、Nはアスパラギン、およびS/T/Cはセリン、トレオニン、またはシステインのいずれか、好ましくはセリンまたはトレオニンであり、最も好ましくはトレオニンである。好ましくは、アスパラギン残基に対して+3位のアミノ酸残基は、プロリン残基ではない。
【0044】
「O-グリコシル化部位」は、セリンまたはトレオニン残基のOH-基である。
【0045】
「結合基」という用語は、ポリペプチド変種の官能基、特にポリマー分子、親油性分子、糖部分または有機誘導体化物質のような非ポリペプチド部分を結合させることができるそのアミノ酸残基または糖質部分の官能基を示すと解釈される。有用な結合基およびそのマッチする非ポリペプチド残基は、下記の表から明らかであると思われる。
【0046】

【0047】
インビボN-グリコシル化の場合、「結合基」という用語は、N-グリコシル化部位を構成するアミノ酸残基を示すために従来とは異なる意味で用いられる(上記の配列N-X-S/T/C)。N-グリコシル化部位のアスパラギン残基は、それに対して糖部分がグリコシル化の際に結合する部位であるが、そのような結合は、N-グリコシル化部位の他のアミノ酸残基が存在しなければ、起こり得ない。
【0048】
したがって、非ポリペプチド部分が糖部分であって、結合がインビボN-グリコシル化によって得られる場合、ポリペプチドのアミノ酸配列の改変に関連して用いられる「非ポリペプチド部分に対する結合基を含むアミノ酸残基」という用語は、機能的インビボN-グリコシル化部位がアミノ酸配列に導入されるように、インビボN-グリコシル化部位を構成する1つまたは複数のアミノ酸残基を変化させるという意味であると理解すべきである。
【0049】
本出願において、アミノ酸名および原子名(例えば、CA、CB、CD、CG、SG、NZ、N、O、C等)は、IUPAC命名法(「IUPAC Nomenclature and Symbolism for Amino Acids and Peptides(residue names, atoms etc.)」、Eur. J. Biochem. 138:9〜37(1984)と共に、Eur. J. Biochem. 152:1(1985)の修正版)に基づいてタンパク質データバンク(PDB)(www.pdb.org )によって定義される通りに用いられる。
【0050】
「アミノ酸残基」という用語は、任意の天然または合成アミノ酸残基を含むと解釈され、かつ本来は20個の天然に存在するアミノ酸、すなわちアラニン(AlaまたはA)、システイン(CysまたはC)、アスパラギン酸(AspまたはD)、グルタミン酸(GluまたはE)、フェニルアラニン(PheまたはF)、グリシン(GlyまたはG)、ヒスチジン(HisまたはH)、イソロイシン(IleまたはI)、リジン(LysまたはK)、ロイシン(LeuまたはL)、メチオニン(MetまたはM)、アスパラギン(AsnまたはN)、プロリン(ProまたはP)、グルタミン(GlnまたはQ)、アルギニン(ArgまたはR)、セリン(SerまたはS)、トレオニン(ThrまたはT)、バリン(ValまたはV)、トリプトファン(TrpまたはW)、およびチロシン(TyrまたはY)残基からなる群より選択されるアミノ酸からなる群に含まれるアミノ酸残基を示すと解釈される。
【0051】
アミノ酸の位置を同定するために用いられる用語を以下に説明する:G124は、配列番号:1に示すアミノ酸配列において124位がグリシン残基で占められていることを示す。G124Rは、124位のグリシン残基がアルギニン残基に置換されていることを示す。もう1つの置換は、「/」で示され、例えばN145S/Tは、145位のアスパラギンがセリンまたはトレオニンのいずれかに置換されているアミノ酸配列を意味する。多数の置換は「+」で示し、例えばK143N+N145S/Tは、143位のリジン残基のアスパラギン残基への置換および145位のアスパラギン残基のセリンまたはトレオニン残基への置換を含むアミノ酸配列を意味する。G124の後のアラニン残基の挿入のような、さらなるアミノ酸残基の挿入は、G124GAで示される。G124の後で二つのさらなるアラニン残基が挿入される場合、G124GAA等によって示される。本明細書において用いる場合、「X位に挿入」または「X位での挿入」という用語は、アミノ酸残基がアミノ酸残基XとX+1とのあいだに挿入されることを意味する。アミノ酸残基の欠失は、星印で示される。例えば、124位のグリシン残基の欠失は、G124*によって示される。
【0052】
特に明記していない限り、本明細書において行ったアミノ酸残基の番号付けは、hFVII/hFVIIaポリペプチドのアミノ酸配列(配列番号:1)に対してなされている。
【0053】
特異的変異に関連して用いられる「異なる」という用語は、明記されたアミノ酸の差とは別にさらなる差が存在することを認めることを意図する。例えば、FX活性化を増大させるためにGlaドメインにおいて行った改変に加えて、ポリペプチドはこの効果に必ずしも関係しない他の改変を含んでも良い。
【0054】
したがって、本明細書に開示したアミノ酸改変に加えて、本発明のポリペプチド変種のアミノ酸配列は、望ましい場合、その他の改変(すなわち置換、挿入、または欠失)を含んでも良いことが理解される。これらには、例えばN-および/またはC-末端での1つまたはそれ以上のアミノ酸残基(例えば、アミノ酸残基1〜10個)の切断、またはN-および/またはC-末端での1つまたはそれ以上の余分の残基の付加、例えばN-末端でのメチオニン残基の付加、またはC-末端近傍もしくはC-末端でのシステインの導入と共に「保存的アミノ酸置換」、すなわち類似の特徴を有するアミノ酸、例えば小さいアミノ酸、酸性アミノ酸、極性アミノ酸、塩基性アミノ酸、疎水性アミノ酸、および芳香族アミノ酸の群内で行われる置換が含まれてもよい。
【0055】
そのような保存的置換の例を以下の表に示す。
【0056】

【0057】
さらなる改変の他の例については、「Glaドメイン外部での改変」および「Glaドメイン外部でのその他の改変」と題された項に開示されている。
【0058】
「ヌクレオチド配列」という用語は、二つまたはそれ以上のヌクレオチド分子が連続伸長したものを示すことを意図している。ヌクレオチド配列はゲノム起源、cDNA起源、RNA起源、半合成起源、合成起源、またはそれらの任意の組み合わせであってよい。
【0059】
「ベクター」という用語は、宿主細胞内で複製可能または宿主細胞ゲノム内に組み込み可能なプラスミドまたは他のヌクレオチド配列を意味し、それ自体は、ヌクレオチド配列のクローニングを容易にするため、すなわち有用な量の配列を産生するため、その配列にコードされた遺伝子産物の発現を誘導するため、および宿主細胞のゲノム内にヌクレオチド配列を組み込むために、適合する宿主細胞(ベクター-宿主系)と連動してさまざまな機能を実行するのに有用である。ベクターは、実行すべき機能に応じてさまざまな成分を含むであろう。
【0060】
「細胞」、「宿主細胞」、「細胞系」および「細胞培養物」は、本明細書において互換的に用いられ、このような全ての用語には、細胞の増殖および培養により生じる子孫が含まれることを理解すべきである。
【0061】
「形質転換」および「トランスフェクション」は互換的に用いられ、細胞にDNAを導入する工程を意味する。
【0062】
「機能的に結合される」とは、二つまたはそれ以上のヌクレオチド配列を、配列の通常の機能を実行できるような互いに関連した構造に、酵素的ライゲーションまたは他の手段によって共有結合することを意味する。一般的に、「機能的に結合される」とは、連結されたヌクレオチド配列が連続しており、分泌リーダーの場合には、連続しかつリーディングフェーズ内にあることを意味する。連結は、都合の良い制限部位でのライゲーションにより達成される。もしそのような部位が存在しなければ、合成オリゴヌクレオチドアダプターまたはリンカーを標準的な組換えDNA法とともに用いる。
【0063】
本発明の文脈において、「改変」または「アミノ酸改変」という用語は、アミノ酸側鎖の交換、アミノ酸残基の置換、アミノ酸残基の欠失、またはアミノ酸残基の挿入を含むことが意図される。
【0064】
「導入する」という用語は、特に既存のアミノ酸残基の置換による、またはさらなるアミノ酸残基の挿入による、アミノ酸残基の導入を意味する。
【0065】
「除去する」という用語は、特に除去されるアミノ酸残基を別のアミノ酸残基で置換することによる、あるいは除去されるアミノ酸残基を欠失(置換せずに)することによる、アミノ酸残基の除去を意味する。
【0066】
本発明の文脈において、「活性」という用語は、その活性が実際に測定されるアッセイに伴う関連した活性であると理解されるべきである。
【0067】
したがって、「アミド溶解活性」という用語は、本明細書に記載の「アミド溶解アッセイ」において測定された活性を意味するために用いられる。「アミド溶解活性」を示すために、本発明の変種はその活性化型において、本明細書に記載の「アミド溶解アッセイ」でアッセイした場合に、rhFVIIaのアミド溶解活性の少なくとも10%を有しなければならない。本発明の好ましい態様において、変種はその活性化型において、本明細書に記載の「アミド溶解アッセイ」でアッセイした場合に、rhFVIIaのアミド溶解活性の少なくとも20%、例えばrhFVIIaのアミド溶解活性の少なくとも30%、例えば少なくとも40%、より好ましくは少なくとも50%、例えば少なくとも60%、例えば少なくとも70%、さらにより好ましくは少なくとも80%、例えば少なくとも90%を有する。興味深い態様において、変種はその活性化型において、rhFVIIaと実質的に同じアミド溶解活性、例えばrhFVIIaのアミド溶解活性の75〜125%のアミド溶解活性を有する。
【0068】
「凝血活性」という用語は、本明細書に記述の「全血アッセイ」において測定された活性、すなわち凝血形成を得るために必要な時間を意味する。したがって、凝血時間がより短いということは凝血活性がより高いことに対応する。
【0069】
「凝血活性の増加」という用語は、本明細書に記載の「全血アッセイ」において測定し、同等の条件下で決定した場合に、本ポリペプチド変種の凝血時間がrhFVIIaまたは[P10Q+K32E]rhFVIIaにより生じたものと比較して、統計学的に有意に減少していることを示すために用いられる。
【0070】
本文脈において、「活性」という用語は、FXをFXaに活性化する本変種の能力にも関連して用いられる。この活性はまた「FX活性化活性」または「FXa生成活性」ともよばれ、本明細書に記載の「TF非依存性第X因子活性化アッセイ」において決定されうる。
【0071】
「FX活性化活性の増加」または「FXa生成活性の増加」という用語は、rhFVIIaまたは[P10Q+K32E]rhFVIIaなどの参照分子と比較して、活性化型の本発明の変種のFXをFXaに活性化する能力が統計学的に有意に増加していることを示すために使用される。本発明の変種が(その活性化型において)、どの程度増加したFX活性化活性を有するかということは、本明細書に記載の「TF非依存性第X因子活性化アッセイ」において簡便に決定することができる。
【0072】
所定の物質に関連して用いられる「免疫原性」という用語は、物質の免疫系からの反応の誘導能を示すことを意図する。免疫応答は、細胞性または抗体媒介反応であってもよい(例えば、免疫原性の詳しい定義に関しては、Roitt:Essential Immunology(第10版、Blackwell)を参照されたい)。通常、抗体の反応性の減少は、免疫原性の減少の指標となると思われる。免疫原性は、例えばインビボまたはインビトロでの当技術分野で既知の任意の適した方法を用いることによって決定してもよい。
【0073】
「機能的インビボ半減期」という用語は、その通常の意味において用いられ、すなわちポリペプチドの生物活性の50%が生体/標的臓器になお存在している時間、またはポリペプチドの活性が最初の値の50%である時間である。
【0074】
機能的なインビボ半減期を決定するための代用として、「血清半減期」、すなわち排泄される前にポリペプチドの50%が血漿または血流において循環している時間を決定してもよい。血清半減期の決定はしばしば機能的インビボ半減期を決定するより単純であり、血清半減期の程度は通常、機能的インビボ半減期の程度の良好な指標である。血清半減期に対する別の用語には、「血漿半減期」、「循環中半減期」、「血清クリアランス」、「血漿クリアランス」、および「クリアランス半減期」が含まれる。ポリペプチドは、細網内皮系(RES)、腎臓、脾臓、または肝臓の1つまたは複数の作用によって、組織因子、SEC受容体、もしくは他の受容体媒介排泄によって、または特異的もしくは非特異的タンパク質分解によって排泄される。通常、クリアランスは、大きさ(糸球体濾過速度のカットオフに関して)、電荷、結合した炭化水素鎖、およびタンパク質の細胞受容体の存在に依存する。保持される機能性は通常、前凝固、タンパク質溶解、または受容体結合活性から選択される。機能的インビボ半減期および血清半減期は、当技術分野で既知の任意の適した方法によって決定してもよい。
【0075】
機能的インビボ半減期または血清半減期に関して用いられる場合の「増加した」という用語は、ポリペプチド変種の関連する半減期が、同等の条件で決定した場合にrhFVIIaまたは[P10Q+K32E]rhFVIIaのような参照分子の半減期と比較して統計学的に有意に増加していることを示すために用いられる(典型的には、ラット、ウサギ、ブタ、またはサルなどの実験動物において決定される)。
【0076】
「AUCiv」または「静脈内投与した場合の曲線下面積」は、その通常の意味において、すなわちポリペプチド変種が静脈内投与されている場合、特にラットに静脈内投与されている場合の、血清-時間曲線における活性下面積として用いられる。典型的に、測定する活性は上記で定義される「凝固活性」である。実験的活性-時間点が決定された後、AUCivは、GraphPad Prism 3.01のようなコンピュータープログラムによって計算することが都合がよい可能性がある。
【0077】
異なる分子間で(例えば、本発明の変種とrhFVIIaまたは[P10Q+K32E]rhFVIIaなどの参照分子との間で)、直接AUCiv値を比較するためには、同量の活性を投与すべきであることが理解されるであろう。その結果、AUCiv値は典型的に標準化され(すなわち注射した用量の差が補正され)、AUCiv/投与用量として表される。
【0078】
「タンパク質分解に対する感受性の低下」という用語は主に、比較できる条件下で決定した場合に、ポリペプチド変種が、hFVIIa、rhFVIIaまたは[P10Q+K32E]rhFVIIaと比較してタンパク質分解に対する感受性が低下していることを意味すると解釈される。好ましくは、タンパク質分解は、少なくとも25%(例えば、25〜50%、25〜75%、または25〜100%)のような少なくとも10%(例えば、10〜25%または10〜50%)、より好ましくは少なくとも50%(例えば、50〜75%、または50〜100%)のような少なくとも35%、さらにより好ましくは、少なくとも75%(例えば、75〜100%)のような少なくとも60%、または少なくとも90%減少する。
【0079】
「腎クリアランス」という用語は、腎臓によって、例えば糸球体濾過、尿細管排泄または尿細管細胞における分解によって起こる任意のクリアランスを示すためにその通常の意味において用いられる。腎クリアランスは、大きさ(直径)、流体力学容積、対称性、形状/硬度、および電荷を含むポリペプチドの物理的特徴に依存する。通常、分子量約67 kDaを腎クリアランスに関するカットオフ値と見なすことが多い。腎クリアランスは、任意の適したアッセイ法、例えば確立されたインビボアッセイ法によって確立してもよい。典型的に、腎クリアランスは、標識された(例えば、放射標識または蛍光標識)ポリペプチドを患者に投与すること、および患者から採取した尿中の標識活性を測定することによって決定される。腎クリアランスの低下は、比較できる条件下で対応する参照ポリペプチド、例えばrhFVIIaまたは[P10Q+K32E]rhFVIIaと比較して決定される。好ましくは、ポリペプチド変種の腎クリアランス率は、rhFVIIaまたは[P10Q+K32E]rhFVIIaと比較して、少なくとも50%、好ましくは少なくとも75%、および最も好ましくは少なくとも90%減少する。
【0080】
「組織因子結合部位」、「活性部位領域」および「活性部位結合裂の隆起」という用語は、実施例1に定義されている。
【0081】
「疎水性アミノ酸残基」という用語には、次のアミノ酸残基が含まれる:イソロイシン(I)、ロイシン(L)、メチオニン(M)、バリン(V)、フェニルアラニン(F)、チロシン(T)およびトリプトファン(W)。
【0082】
「陰性荷電アミノ酸残基」と言う用語には、次のアミノ酸残基が含まれる:アスパラギン酸(D)、およびグルタミン酸(E)。
【0083】
「陽性荷電アミノ酸残基」という用語には、次のアミノ酸残基が含まれる:リジン(K)、アルギニン(R)、およびヒスチジン(H)。
【0084】
本発明の変種
親ポリペプチドのGlaドメインに行われた改変は、結果として生じる分子に、リン脂質膜結合親和性の増加、FXをFXaに活性化する能力の増加、および/または凝血活性の増加を提供することが好ましい。本発明の変種はまた、組織因子結合親和性が減少しており、組織因子に結合したときの活性が減少している。
【0085】
いかなる特定の理論に限定されるわけではないが、現在、リン脂質膜結合親和性の増強は、他の凝固因子、特にFXに近接している活性型ポリペプチド変種の、局所濃度の上昇をもたらすと考えられている。したがって、単純にFXに対する活性型FVII変種のモル比が高くなることにより、FXからFXaへの活性化率がより高くなる。FX活性化率の増加は、活性型トロンビン量の増加をもたらし、したがってフィブリン架橋率がより高くなる。
【0086】
結果として、本発明のポリペプチド変種を用いた医学的治療は、現在利用可能なrhFVIIa化合物(NovoSeven(登録商標))に対して、より低用量、増大した有効性、および/またはより迅速な作用などの有利な点を提供しうると考えられる。
【0087】
さらに、組織因子非依存性変種、すなわち野生型ヒト第VIIa因子と比較して組織因子と結合したときに活性が減少する変種は、望ましくない凝血形成(例えば血栓症または血栓塞栓症)の危険性が少ないという点において、特に外傷などの急性の制御不能な出血の治療に用いられる場合、確実に安全性の利点を提供すると考えられる。
【0088】
したがって、本発明の非常に好ましい態様において、ポリペプチド変種はその活性化型において、rhFVIIaまたは[P10Q+K32E]rhFVIIaなどの参照分子と比較して、特に本明細書に開示される「TF非依存性第X因子活性化アッセイ」などの組織因子非依存性アッセイでアッセイした場合に、FX活性化活性が増加している。より詳細には、活性型のポリペプチド変種のFX活性化活性と、参照分子のFX活性化活性との比率は、本明細書に開示される「TF非依存性第X因子活性化アッセイ」でアッセイした場合、少なくとも1.25であることが好ましい。より好ましくは、この比率は少なくとも1.5、例えば少なくとも1.75、例えば少なくとも2、さらにより好ましくは少なくとも3、例えば少なくとも4であり、最も好ましくは少なくとも5である。
【0089】
参照分子がrhFVIIaの場合、活性化型のポリペプチド変種のFX活性化活性と、rhFVIIaのFX活性化活性との比率は、本明細書に開示される「TF非依存性第X因子活性化アッセイ」でアッセイした場合、好ましくは少なくとも約5、典型的には少なくとも約10、例えば少なくとも約15または20である。
【0090】
もう一つの本発明の非常に好ましい態様において、rhFVIIaまたは[P10Q+K32E]rhFVIIaと比較して、本発明の変種は凝血活性が増加している(すなわち凝固時間が減少している)。本発明の好ましい態様において、本変種の場合の凝血形成に達する時間(t変種)と、rhFVIIaの場合の凝血形成に達する時間(t野生型)または[P10Q+K32E]rhFVIIaの場合の凝血形成に達する時間(tP10Q+K32E)との比率は、本明細書に開示されている「全血アッセイ」でアッセイした場合、多くても0.9である。より好ましくは、この比率は多くても0.75、例えば0.7であり、さらにより好ましくはその比率は多くても0.6であり、最も好ましくはその比率は多くても0.5である。
【0091】
上記の特性のうち一つまたは複数が、本明細書に記載されている改変によって達成されうる。
【0092】
第34位に疎水性アミノ酸残基を含む本発明の変種
上記のように、本発明は、第一の局面において、hFVIIまたは hFVIIa(配列番号:1)に関連する1〜15個のアミノ酸改変を含むアミノ酸配列を有し、34位に疎水性アミノ酸残基が置換により導入されているFVIIまたはFVIIaポリペプチド変種に関する。
【0093】
34位に導入された疎水性アミノ酸残基は、I、L、M、V、F、YおよびWからなる群より選択され、好ましくはI、LおよびVであり、特にLが好ましい。
【0094】
好ましい態様において、本変種はさらに10位におけるアミノ酸置換、特にP10Q、および/または32位におけるアミノ酸置換、特にK32Eをさらに含む。本発明の特に好ましい態様において、本変種は10位と32位の両方におけるアミノ酸置換、例えばP10Q+K32Eを含む。
【0095】
したがって、本発明の興味深い態様において、本変種はP10Q+K32E+A34Lの置換を含む。
【0096】
本発明の特に興味深い態様において、本変種は、3位と4位の間に少なくとも一つ(典型的には一つ)のアミノ酸残基の挿入をさらに含む。挿入されるアミノ酸残基は、疎水性アミノ酸残基であることが好ましい。挿入はA3AYであることが最も好ましい。したがって、本発明の特に興味深い態様において、本変種はA3AY+ P10Q+K32E+A34Lの改変を含む。
【0097】
上記の任意の改変に加えて、本変種は33位における置換をさらに含んでもよい。好ましくは、疎水性アミノ酸残基が置換によって33位に導入され、特にD33Fである。
【0098】
Glaドメインも他の部位、特に8位、11位、28位において、例えばR28FまたはR28Eなどの改変を含んでよい。他方で、Glaドメインは、膜結合特性が損なわれる程度にまで改変すべきではないということは理解されるべきである。したがって、γ-カルボキシル化される残基には改変を加えないことが好ましく、すなわち6位、7位、14位、16位、19位、20位、25位、26位、29位および35位の残基には改変を加えないことが好ましい。同様に、非ポリペプチド部分、例えば糖部分および/またはPEG基をGlaドメインに導入することは一般的に好ましくない。結果として、GlaドメインにはインビボN-グリコシル化部位を作出する改変を加えないことが好ましい。
【0099】
最後に、この項で論じたGlaドメインにおける改変は、Glaドメイン外に位置する部位における一つまたは複数の改変と組み合わせることが有利でありうると理解される(下記の「Glaドメイン外部での改変」および「Glaドメイン外部でのその他の改変」と題する項を参照)。
【0100】
第36位にアミノ酸置換を含む本発明の変種
上記のように、本発明は、第二の局面において、hFVIIまたは hFVIIa(配列番号:1)に関連する1〜15個のアミノ酸改変を含むアミノ酸配列を有し、アミノ酸配列が36位にアミノ酸置換を含む、FVIIまたはFVIIaポリペプチド変種に関する。
【0101】
好ましくは、36位に置換によって導入されるアミノ酸残基は陰性荷電アミノ酸残基であり、例えばR36EまたはR36D、特にR36Eである。
【0102】
好ましい態様において、本変種は10位におけるアミノ酸置換、特にP10Q、および/または32位におけるアミノ酸置換、特にK32Eをさらに含む。本発明の特に好ましい態様において、本変種は10位と32位の両方における置換、例えばP10Q+K32Eを含む。
【0103】
本変種は、38位における置換をさらに含んでもよい。例えばK38EまたはK38Dのように、陰性荷電アミノ酸残基が置換により38位に導入されることが好ましく、特にK38Eが好ましい。
【0104】
したがって、興味深い変種は、P10Q+K32E+R36EまたはP10Q+K32E+R36E+K38Eの置換を含むものである。
【0105】
特に興味深い態様において、本変種は34位におけるアミノ酸置換をさらに含む(すなわち、得られる変種は10+32+34+36または10+32+34+36+38の残基における置換を含む)。好ましくは、例えばA34EまたはA34Dのように、一つの陰性荷電アミノ酸残基が置換によって34位に導入される。
【0106】
好ましい変種の特定の例は、P10Q+K32E+A34E+R36EまたはP10Q+K32E+A34D+R36E+K38Eの置換を含むものである。
【0107】
本発明の興味深い態様において、本変種は3位と4位の間に少なくとも一つ(典型的には一つ)のアミノ酸残基の挿入をさらに含む。挿入されるアミノ酸残基は、疎水性アミノ酸残基であることが好ましい。最も好ましくは、挿入はA3AYである。
【0108】
上記の任意の改変に加えて、本変種は33位にさらなる置換を含んでもよい。好ましくは、疎水性アミノ酸残基が置換によって33位に導入され、特にD33Fが好ましい。
【0109】
Glaドメインも他の部位、特に8位、11位、28位において、R28FまたはR28Eなどの改変を含んでもよい。他方で、Glaドメインは、膜結合特性が損なわれる程度にまで改変すべきではないということが理解されるべきである。したがって、γ-カルボキシル化される残基には改変を加えないことが好ましく、すなわち6位、7位、14位、16位、19位、20位、25位、26位、29位および35位の残基には改変を加えないことが好ましい。同様に、非ポリペプチド部分、例えば糖部分および/またはPEG基をGlaドメインに導入することは一般的に好ましくない。結果として、GlaドメインにはインビボN-グリコシル化部位を作出する改変を加えないことが好ましい。
【0110】
最後に、この項で論じたGlaドメインにおける改変は、Glaドメイン外に位置する部位における一つまたは複数の改変と組み合わせることが有利でありうると理解される(下記の「Glaドメイン外部での改変」および「Glaドメイン外部でのその他の改変」と題する項を参照)。
【0111】
第74位、第77位または第116位にアミノ酸置換を含む本発明の変種
上記のように、本発明は、第三の局面において、hFVIIまたは hFVIIa(配列番号:1)に関連する3〜15個のアミノ酸改変を含むアミノ酸配列を有し、そのアミノ酸配列が、10位、32位におけるアミノ酸置換、ならびに74位、77位、および116位からなる群より選択される部位における少なくとも一つのさらなるアミノ酸置換を含む、FVIIまたはFVIIaポリペプチド変種に関する。
【0112】
好ましい態様において、10位のアミノ酸置換はP10Qであり、32位のアミノ酸置換はK32Eである。
【0113】
74位、77位または116位の置換は、P74S、E77AおよびE116Dからなる群より選択されることがさらに好ましい。
【0114】
興味深い態様において、本変種はさらに34位にアミノ酸置換を含む。好ましくは、例えばA34EまたはA34Dのように、陰性荷電アミノ酸残基が置換によって34位に導入されるのが好ましく、特にA34Eが好ましい。
【0115】
本発明のもう一つの興味深い態様において、本変種は3位と4位の間に少なくとも一つ(典型的には一つ)のアミノ酸残基の挿入をさらに含む。挿入されるアミノ酸残基は、疎水性アミノ酸残基であることが好ましい。最も好ましくは、挿入はA3AYである。
【0116】
本変種の興味深い特定の例として、A3AY+P10Q+K32E+E116D、A3AY+P10Q+K32E+E77A、およびP10Q+K32E+A34E+P74Sの改変を含む変種が挙げられる。
【0117】
上記の任意の改変に加えて、本変種は33位におけるさらなる置換を含んでもよい。好ましくは、疎水性アミノ酸残基が置換によって33位に導入され、特にD33Fが好ましい。
【0118】
Glaドメインも他の部位、特に8位、11位、および28位において、R28FまたはR28Eなどの改変を含んでもよい。上記で説明したように、Glaドメインは、膜結合特性が損なわれる程度にまで改変すべきではないということが理解されるべきであり、すなわち6位、7位、14位、16位、19位、20位、25位、26位、29位および35位の残基には改変を加えないことが好ましく、かつGlaドメインにはインビボN-グリコシル化部位を作出しないことが好ましい。
【0119】
最後に、この項で論じたGlaドメインにおける改変は、Glaドメイン外に位置する部位における一つまたは複数の改変と組み合わせることが有利でありうると理解される(下記の「Glaドメイン外部での改変」および「Glaドメイン外部でのその他の改変」と題された項を参照)。
【0120】
Glaドメイン外部での改変
循環rhFVIIaの半減期は2.3時間であることが、「Summary Basis for Approval for NovoSeven(登録商標)」、FDA参照番号96-0597に報告されている。望ましい治療的または予防的効果を達成し維持するためには、比較的高用量で頻繁に投与する必要がある。その結果、適切な用量調節を得ることが困難となり、頻繁な静脈内投与を必要とすることから患者の生活様式が制限される。
【0121】
循環半減期がより長く、かつ/または生物学的利用能が増加した(例えば静脈内投与された場合に曲線下面積がrhFVIIaと比較して増加している)分子は、必要な投与回数を減少させると考えられる。現在の頻繁な注射の必要性、および治療効果の増強を伴ったより最適な治療的FVIIaレベルを得る可能性を考えると、改良されたFVII様分子またはFVIIa様分子が必要なことは明らかである。
【0122】
したがって、本発明のさらなる目的は、生物学的利用能が増加しており(例えば、静脈内投与された場合に、rhFVIIaまたは[P10Q+K32E]rhFVIIaなどの参照分子と比較して曲線下面積が増加している)、rhFVIIaまたは[P10Q+K32E]rhFVIIaなどの参照分子と比較して、より効率的に(組織因子に結合することなく)第X因子を第Xa因子に活性化することのできる(それによって、外傷などの制御不能な出血、または血友病などの慢性的状態をより効率的に治療可能である)、改良型FVIIまたはFVII分子(FVIIまたはFVIIa変種)を提供することである。
【0123】
したがって、本発明の興味深い変種は、その活性型において、rhFVIIaまたは[P10Q+K32E]rhFVIIaなどの参照分子と比較して、静脈内投与された場合の曲線下面積(AUCiv)の増加をもたらすものである。これは、ラットに静脈内投与することによって簡便に決定することができる。より詳細には、本発明の興味深い変種は、活性型における変種のAUCivと、rhFVIIaまたは[P10Q+K32E]rhFVIIaなどの参照分子のAUCivとの間の比率が、特にラットに(静脈内)投与した場合、少なくとも1.25、例えば少なくとも1.5、例えば少なくとも1.75、より好ましくは少なくとも2、例えば少なくとも3であり、さらにより好ましくは少なくとも4、例えば少なくとも5であるものである。
【0124】
この効果は、rhFVIIaまたは[P10Q+K32E]rhFVIIaなどの参照分子と比較した機能的インビボ半減期の増加および/または血清半減期の増加にしばしば対応すると考えられる。したがって、本発明のもう一つの興味深い態様において、活性化型における本変種と、rhFVIIaまたは[P10Q+K32E]rhFVIIaなどの参照分子との機能的インビボ半減期または血清半減期の比率は、少なくとも1.25である。より好ましくは、活性化型における本変種と、rhFVIIaまたは[P10Q+K32E]rhFVIIaなどの参照分子との当該半減期の比率は、少なくとも1.5、例えば少なくとも1.75、例えば少なくとも2であり、さらにより好ましくは少なくとも3、例えば少なくとも4、例えば少なくとも5である。
【0125】
タンパク質の循環半減期を増加させる一つの方法は、そのタンパク質の腎クリアランスを確実に減少させることである。これは、タンパク質の腎クリアランスを減少させることのできる化学的部分、例えばポリエチレングリコール(PEG)をそのタンパク質に結合させることにより達成されうる。
【0126】
さらに、タンパク質に化学的部分を付加するか、またはタンパク質分解を受けるアミノ酸を置換することにより、さもなければそのタンパク質のタンパク質分解性劣化をもたらすタンパク質分解酵素の接触を効率的に遮断することができる。
【0127】
上記のように、タンパク質分解性劣化による不安定性は、現在のrhFVIIa治療における公知の問題である。したがって、タンパク質分解性劣化は、凍結乾燥製品とは反対に、調製物を溶液で得るにあたって大きな障害となる。安定した可溶性調製物を得ることの利点は、患者にとって扱いが容易であること、および緊急時に作用がより速いことであり、それにより生命を救える可能性がある。主要なタンパク質分解部位に部位特異的変異を加えることによってタンパク質の分解劣化を防ぐ試みが、国際公開公報第88/10295号に開示されている。
【0128】
国際公開公報第01/58935号は、AUCiv、機能的インビボ半減期、および/または血清半減期の増加をもたらす多くの適切な改変を開示している。国際公開公報第01/58935号に開示された変種は、改善されたFVII分子またはFVIIa分子を開発するための一般的な新たな方法の結果であり、これを本発明の親FVIIまたはFVIIaポリペプチドのために使用してもよい。
【0129】
より具体的には、親FVIIまたはFVIIaのポリペプチドにおいて非ポリペプチド部分に対する結合基を含むアミノ酸残基を除去および/または導入することにより、選択した非ポリペプチド部分への結合に対してより感受性のある分子を作製するためにポリペプチドを特異的に適合させること、結合パターンを最適化すること(例えば、FVIIまたはFVIIaのポリペプチド変種の表面上の非ポリペプチド部分の最適な分布および数を保証にすること、ならびに結合が意図される結合基のみが分子に存在することを保証すること)、ならびにそれによって、アミド分解活性を有し、さらにrhFVIIa分子と比較して1つまたは複数の改善された特徴を有する新規の結合分子を得ることが可能である。
【0130】
本発明の興味深い態様において、Glaドメイン外に位置する複数のアミノ酸残基は、変更され、例えばこの変更は、選択した非ポリペプチド部分に対する結合基を含むアミノ酸残基の除去および導入を含む。アミノ酸残基の除去および/または導入に加えて、ポリペプチド変種は、非ポリペプチド部分に対する結合基を含むアミノ酸残基の導入および/または除去に関連していない他の置換を含んでもよい。
【0131】
また、ポリペプチド変種は、ポリペプチド変種の触媒部位を阻害するためのセリンプロテイナーゼ阻害剤に結合されてもよい。または、触媒部位に存在する一つまたは複数のアミノ酸残基(S344、D242およびH193)を、得られる変種を不活性にするために変異させてもよい。そのような変異の一例はS344Aである。
【0132】
非ポリペプチド部分に対する結合基を含むアミノ酸残基は、それが除去または導入されているかに関わらず、選択した非ポリペプチド部分の性質に基づいて選択され、ほとんどの場合、ポリペプチド変種と非ポリペプチド部分との間で結合が達成される方法に基づいて選択される。例えば、非ポリペプチド部分が、ポリエチレングリコールまたはポリアルキレンオキサイドに由来する分子のようなポリマー分子である場合、結合基を含むアミノ酸残基は、リジン、システイン、アスパラギン酸、グルタミン酸、ヒスチジン、およびチロシンからなる群より選択されてもよく、好ましくは、リジン、システイン、アスパラギン酸、およびグルタミン酸からなる群より選択されてもよく、より好ましくはリジンおよびシステインからなる群より選択されてもよく、特にシステインであってよい。
【0133】
非ポリペプチド部分に対する結合基が、親ポリペプチドに導入されるか、または親ポリペプチドから除去される場合には、改変されるアミノ酸残基の位置は、好ましくは親FVIIまたはFVIIaのポリペプチドの表面に位置し、より好ましくは、その側鎖の少なくとも25%が表面に露出しているアミノ酸残基で占められ(本明細書の実施例1に定義されるように)、好ましくは、その側鎖の少なくとも50%が表面に露出しているアミノ酸残基で占められる(本明細書の実施例1に定義されるように)。そのような位置は、国際公開公報第01/58935号に記載されているように、hFVIIまたはhFVIIa分子の三次元構造の解析に基づいて同定されている。
【0134】
さらに、改変される位置は、好ましくは組織因子結合部位、および/または活性部位領域の外部、および/または活性部位結合裂の隆起の外部に位置するFVIIまたはFVIIa分子の一部から選択される。これらの部位/領域は、本明細書の実施例1および国際公開公報第01/58935号で同定されている。
【0135】
結合基を除去する場合には、そのような基を含み上記に定義される部位を占める当該アミノ酸残基は、問題の非ポリペプチド部分の結合基を含まない異なるアミノ酸残基で置換することが好ましい。通常、除去されるアミノ酸残基は、それに対する結合が不都合なもの、例えばそのポリペプチドの機能的部位またはその付近に位置するアミノ酸残基である(そのような部位における結合は、例えば受容体の認識障害のために、得られた結合物の不活性化または活性の減少をきたすことがあるため)。本文脈において、「機能的部位」という用語は、FVIIまたはFVIIaの機能または動作に必須であるか、そうでなければそれに関与する一つまたは複数のアミノ酸残基を示すことを意図する。そのようなアミノ酸残基は、機能的部位の一部である。機能的部位は、当技術分野で公知の方法により決定してもよく、好ましくはFVIIa-組織因子複合体の構造解析によって同定される(Bannerら、Nature 1996; 380:41-46を参照)。
【0136】
結合基を導入する場合には、そのような基を含むアミノ酸残基を、該当する部位へ、好ましくはその部位を占めるアミノ酸残基の置換によって導入する。
【0137】
FVIIまたは FVIIaポリペプチドにおいて、結合に利用可能なものとして存在する結合基の正確な数は、結合によって達成されることを望む効果に依存する。得られる効果は、例えば結合の性質や程度に依存する(例えば、非ポリペプチド部分の同一性、ポリペプチド変種への結合が望ましいかまたは結合可能な非ポリペプチド部分の数、結合すべき場所、または結合を避けるべき場所など)。
【0138】
親FVIIまたはFVIIaポリペプチドのGlaドメイン外部で改変されるアミノ酸残基の総数は(配列番号:1に示されているアミノ酸配列と比較して)、典型的には10個を超えない。好ましくは、FVIIまたはFVIIa変種は、配列番号:1に示す46〜406位のアミノ酸残基と1〜10個のアミノ酸残基が異なるアミノ酸配列を含み、典型的には1〜8個または2〜8個のアミノ酸残基、例えば1〜5個または2〜5個のアミノ酸残基、例えば1〜4個または1〜3個のアミノ酸残基、例えば1、2または3個のアミノ酸残基が配列番号:1に示す46〜406位のアミノ酸残基と異なるアミノ酸配列を含む。
【0139】
同様に、本発明のポリペプチド変種は、1〜10個の(さらなる)非ポリペプチド部分、典型的には1〜8個または2〜8個の(さらなる)非ポリペプチド部分、好ましくは1〜5個または2〜5個の(さらなる)非ポリペプチド部分、例えば1〜4個または1〜3個の(さらなる)非ポリペプチド部分、例えば1、2または3個の(さらなる)非ポリペプチド部分を含んでもよい。そのようなさらなる非ポリペプチド部分は、Glaドメイン外に位置する結合基に共有結合されることが理解される。
【0140】
非ポリペプチド部分が糖部分である本発明のポリペプチド変種
本発明の好ましい態様において、糖部分に対する結合基、例えばグリコシル化部位、特にインビボグリコシル化部位、例えばインビボN-グリコシル化部位が、Glaドメイン外に位置する部位において導入および/または除去されており、好ましくは導入されている。
【0141】
本発明の文脈において用いる場合、「天然に存在するグリコシル化部位」という用語は、N145、N322、S52およびS60の位置でのグリコシル化部位を含む。「天然に存在するインビボO-グリコシル化部位」という用語には、S52およびS60の位置が含まれ、「天然に存在するインビボN-グリコシル化部位」という用語には、N145およびN322の位置が含まれる。
【0142】
したがって、本発明の非常に興味深い態様において、非ポリペプチド部分は、糖部分であり、導入された結合基はグリコシル化部位、好ましくは、インビボO-グリコシル化部位またはインビボN-グリコシル化部位のようなインビボグリコシル化部位、特にインビボN-グリコシル化部位である。典型的に、1〜10個のグリコシル化部位、特にインビボN-グリコシル化部位は、好ましくは1〜8個、1〜6個、1〜4個または1〜3個のグリコシル化部位が導入されており、特にインビボN-グリコシル化部位は、Glaドメイン外に位置する一つまたは複数の位置に導入されている。例えば、特に、1個、2個または3個のグリコシル化部位、特にインビボN-グリコシル化部位が、Glaドメイン外に好ましくは置換によって導入されている。
【0143】
1つまたは複数のグリコシル化部位を含む、ポリペプチド変種を調製するために、ポリペプチド変種は、グリコシル化部位で糖(オリゴ糖)部分を結合することができる宿主細胞において発現させるか、またはインビトログリコシル化に供しなければならないと理解されると考えられる。グリコシル化宿主細胞の例は、以下の「糖部分へのカップリング」と題する項においてさらに示される。
【0144】
グリコシル化部位、特にインビボN-グリコシル化部位が導入されうる位置の例には、側鎖の少なくとも25%、例えば側鎖の少なくとも50%が表面に露出している(本明細書の実施例1に定義される)アミノ酸残基が含まれる。位置は、本明細書の実施例1に定義されるように、好ましくは組織因子結合部位および/もしくは活性部位領域の外部ならびに/または活性部位結合裂の隆起の外部に位置する分子の一部分から選択される。「側鎖の少なくとも25%(または少なくとも50%)が表面に露出している」という用語が、インビボN-グリコシル化部位の導入と関連して用いられる場合には、この用語は、糖部分が実際に結合する位置でのアミノ酸側鎖の表面到達性を意味すると理解されるべきである。多くの場合には、糖部分が実際に結合するアスパラギン残基に対して+2の位置にセリン残基またはトレオニン残基を導入する必要があり、セリン残基またはトレオニン残基が導入されるこれらの位置を埋没させることができる、すなわち表面に露出する側鎖を25%未満にすることができる。
【0145】
インビボN-グリコシル化部位を作出する、そのような置換の特定の好ましい例には、

およびそれらの組み合わせからなる群より選択される置換が含まれる。より好ましくは、

およびそれらの組み合わせからなる群より選択される置換によって、インビボN-グリコシル化部位が導入される。さらにより好ましくは、T106N、A175T、I205T、V253N、T267N+S269T、およびそれらの組み合わせからなる群より選択される置換、特にT106N、I205T、およびV253Nの一つ、二つまたは三つによってインビボN-グリコシル化部位が導入される。
【0146】
ある態様では、ただ一つのインビボN-グリコシル化部位のみが置換によって導入されている。別の態様では、二つまたはそれ以上(例えば二つ)のインビボN-グリコシル化部位が置換によって導入されている。二つのインビボN-グリコシル化部位を作出する好ましい置換の例には、

からなる群より選択された置換が含まれる。より好ましくは、置換は

からなる群より選択され、さらにより好ましくはT106N+I205T、T106N+V253NおよびI205T+V253Nからなる群より選択される。
【0147】
さらなる態様において、三つまたはそれ以上(例えば三つ)のインビボN-グリコシル化部位が置換により導入されている。三つのインビボN-グリコシル化部位を作出する好ましい置換の例には、I205T+ V253N+T267N+S269TおよびT106N+I205T+V253Nからなる群より選択される置換が含まれる。
【0148】
上記のように、インビボN-グリコシル化部位は、本明細書に定義されるような組織因子結合部位、活性部位領域、または活性部位結合裂の隆起の一部を形成しない部位に導入されることが好ましい。
【0149】
上述の34位および/または36位における置換、特に A34E/Lおよび/またはR36Eと組み合わせて、さらに上記の項で言及された任意の改変を互いに組み合わせてもよく、好ましくは上述の10位および/または32位における置換、特にP10Qおよび/またはK32Eと組み合わせてもよいことが理解される。インビボN-グリコシル化部位の導入のための上記の改変のうち、好ましい改変はT106N、I205T、およびV253Nの改変のうちの一つ、二つ、または三つを含み、特にこれらの改変のうち二つ、すなわちT106N+I205T、T106N+V253N、またはI205T+V253Nを含む。
【0150】
したがって、本発明の一つの好ましい態様において、FVIIまたはFVIIa変種はP10Q+K32E+A34E+R36E+T106N+I205Tの改変を含む。
【0151】
さらに好ましい態様において、FVIIまたはFVIIa変種はP10Q+K32E+A34E+R36E+T106N+V253Nの改変を含む。
【0152】
さらに好ましい態様において、FVIIまたはFVIIa変種はP10Q+K32E+A34E+R36E+I205T+V253Nの改変を含む。
【0153】
さらに好ましい態様において、FVIIまたはFVIIa変種はP10Q+K32E+A34L+T106N+I205Tの改変を含む。
【0154】
さらに好ましい態様において、FVIIまたはFVIIa変種はP10Q+K32E+A34L+T106N+V253Nの改変を含む。
【0155】
さらに好ましい態様において、FVIIまたはFVIIa変種はP10Q+K32E+A34L+I205T+V253Nの改変を含む。
【0156】
さらに好ましい態様において、FVIIまたはFVIIa変種はP10Q+K32E+A34L+R36E+T106N+I205Tの改変を含む。
【0157】
さらに好ましい態様において、FVIIまたはFVIIa変種はP10Q+K32E+A34L+R36E+T106N+V253Nの改変を含む。
【0158】
さらに好ましい態様において、FVIIまたはFVIIa変種はP10Q+K32E+A34L+R36E+I205T+V253Nの改変を含む。
【0159】
上記でも説明されているように、これらの改変のうちの任意の一つまたは複数を、少なくとも一個のアミノ酸残基、典型的には単一のアミノ酸残基の3位と4位の間への挿入と組み合わせてもよく、挿入される残基は好ましくは疎水性アミノ酸残基である。最も好ましくは、挿入はA3AYである。したがって、本発明のさらに好ましい態様において、FVIIまたはFVIIa変種は、

から選択される改変を含む。
【0160】
Glaドメイン外部でのその他の改変
本発明のさらなる態様において、FVIIまたはFVIIa変種は、上記の項に記載されている改変に加えて、例えば国際公開公報第02/22776号に記載されているものなどの、本ポリペプチドの内在性活性を増加させることが既知の変異を含んでもよい。
【0161】
例えば、本変種は、157位、158位、296位、298位、305位、334位、336位、337位、および374位からなる群より選択される部位における少なくとも一つの改変を含んでよい。好ましい置換の例には、V158D、E296D、M298Q、L305V、およびK337Aからなる群より選択される置換が含まれる。より好ましくは、置換は

からなる群より選択される。
【0162】
本発明のさらなる態様において、FVIIまたはFVIIa変種は、上記の項に記載されている改変に加えて、Neuenschwanderら、Biochemistry, 1995; 34:8701-8707に開示されているK341Qの置換などの、その他の変異も含んでよい。可能性のあるさらなる置換には、D196K、D196N、G237L、G237GAA、およびそれらの組み合わせが含まれる。
【0163】
FVIIまたはFVIIa変種の、非ポリペプチド部分への結合に関する追加の詳細な情報は、本明細書において参照され、かつ参照として本明細書に組み入れられる、国際公開公報第01/58935号および国際公開公報第03/093465号に見いだされる。
【0164】
本発明の結合型ポリペプチド変種の調製方法
一般的に、本発明による結合型変種は、変種ポリペプチドの発現のために行われる条件下で適切な宿主細胞を培養する工程、および変種ポリペプチドを回収する工程によって生産してもよく、ここで、
a)変種ポリペプチドは少なくとも1つのN-またはO-グリコシル化部位を含み、かつ宿主細胞はインビボグリコシル化を行うことができる真核宿主細胞であり、および/または
b)変種ポリペプチドは、インビトロで非ポリペプチド部分との結合を受ける。
【0165】
ポリマー分子との結合
変種ポリペプチドにカップリングされるポリマー分子は、天然または合成ホモポリマーまたはヘテロポリマーのような任意の適したポリマー分子であってもよく、典型的に分子量約500〜20,000 Daのような、分子量の範囲が約300〜100,000 Da、より好ましくは約500〜15,000 Daの範囲、さらにより好ましくは約3〜10 kDaの範囲のような約2〜12 kDaの範囲の分子である。本明細書において特定の分子量に関連して「約」という用語を用いる場合、「約」という用語は、通常、おおよその平均分子量を示し、所定のポリマー調製物において特定の分子量の分布が存在するという事実を反映する。
【0166】
ホモポリマーの例には、ポリオール(すなわち、ポリ-OH)、ポリアミン(すなわち、ポリ-NH2)、およびポリカルボン酸(すなわちポリ-COOH)が含まれる。ヘテロポリマーは、ヒドロキシル基およびアミン基のような異なるカップリング基を含むポリマーである。
【0167】
適したポリマー分子の例には、ポリエチレングリコール(PEG)およびポリプロピレングリコール(PPG)のようなポリアルキレングリコール(PAG)を含むポリアルキレンオキシド(PAO)、分枝状PEG、ポリビニルアルコール(PVA)、ポリカルボキシレート、ポリ-(ビニルピロリドン)、ポリエチレン-コ無水マレイン酸、ポリスチレン-コ無水マレイン酸、カルボキシメチルデキストランを含むデキストラン、または免疫原性を減少させる、ならびに/または機能的インビボ半減期および/もしくは血清半減期を増加させるために適した他の任意の生体ポリマーからなる群より選択されるポリマーが含まれる。ポリマー分子のもう1つの例は、ヒトアルブミンまたはもう1つの大量に存在する血漿タンパク質である。一般的に、ポリアルキレングリコールに由来するポリマーは生体適合性、非毒性、非抗原性、非免疫原性、水溶性を有し、生きている生物から容易に排泄される。
【0168】
PEGは、例えばデキストランのような多糖類と比較すると、クロスリンクすることができる反応基がごく少数であることから、好ましいポリマー分子である。特に、一官能基PEG、例えばメトキシポリエチレングリコール(mPEG)は、そのカップリング化学が比較的単純(1つの反応基のみがポリペプチド上の結合基を結合するために使用できる)であることから重要である。その結果、クロスリンクのリスクが消失すると、得られた結合型変種はより均一となり、ポリマー分子と変種ポリペプチドとの反応はより容易に制御される。
【0169】
1つ(または複数)のポリマー分子を変種ポリペプチドに共有結合させるために、ポリマー分子のヒドロキシル末端基は、活性型、すなわち反応官能基(その例には一級アミノ基、ヒドラジド(HZ)、チオール、コハク酸塩(SUC)、スクシニミジルスクシネート(SS)、スクシニミジルスクシンアミド(SSA)、スクシニミジルプロピオネート(SPA)、スクシニミジルブチレート(SBA)、スクシニミジルカルボキシメチレート(SCM)、ベンゾトリアゾールカーボネート(BTC)、N-ヒドロキシスクシンイミド(NHS)、アルデヒド、ニトロフェニルカーボネート(NPC)、およびトレシレート(TRES)が含まれる)と共に提供されなければならない。適した活性化ポリマー分子は市販されており、例えばNektar Therapeutics、Huntsville、AL、USAまたはPolyMASC Pharmaceuticals plc、UKから入手可能である。
【0170】
本発明の使用のための活性化された直鎖状または分枝状ポリマー分子の特定の例は、参照として本明細書に組み入れられるNektar Molecule Engineering Catalog 2003(Nektar Therapeutics)に記載されている。
【0171】
活性化PEGポリマーの特定の例には、以下の直鎖状PEG:NHS-PEG (例えばSPA-PEG、SSPA-PEG、SBA-PEG、SS-PEG、SSA-PEG、SC-PEG、SG-PEG、およびSCM-PEG)、およびNOR-PEG、BTC-PEG、EPOX-PEG、NCO-PEG、NPC-PEG、CDI-PEG、ALD-PEG、TRES-PEG、VS-PEG、IODO-PEG、およびMAL-PEG、ならびに、PEG2-NHSおよび米国特許第5,932,462号および米国特許第5,643,575号(ともに参照として本明細書に組み入れられる)に開示されているものなどの分枝鎖状PEGが含まれる。有用なポリマー分子、PEG化化学および結合方法をさらに開示している追加の刊行物は、国際公開公報第01/58935号および国際公開公報第03/093465号に列記されている。
【0172】
特にシステイン残基とのカップリングに好ましい活性化PEGポリマーの特定の例には、以下の直鎖状PEG:ビニルスルホンPEG (VS-PEG)、好ましくはビニルスルホンmPEG (VS-mPEG);マレイミド-PEG (MAL-PEG)、好ましくはマレイミド-mPEG (MAL-mPEG)およびオルトピリジル-ジスルフィドPEG (OPSS-PEG)、好ましくはオルトピリジル-ジスルフィドmPEG (OPSS-mPEG)が含まれる。典型的には、そのようなPEGまたはmPEGポリマーは、大きさが約5kDa、約10kDa、約12kDa、または約20kDaであると考えられる。
【0173】
使用される活性化方法および/または結合化学は、ポリマーの官能基(例えばアミン、ヒドロキシル、カルボキシル、アルデヒド、スルフィドリル、スクシニミジル、マレイミド、ビニルスルホン、またはハロ酢酸)だけでなく、本変種ポリペプチドの結合基(それらの例はさらに上記で示される)に依存することを、当業者は認識すると考えられる。PEG化は、本変種ポリペプチドの全ての利用可能な結合基(すなわちポリペプチド表面に露出している結合基)に結合するように行ってもよく、または一つまたは複数の特定の結合基、例えば米国特許第5,985,265号に記載されるN末端アミノ基もしくはシステイン残基に対して行ってもよい。さらに、結合は一段階で達成しても、段階的に(例えば国際公開公報第99/55377号に記載されているように)達成してもよい。
【0174】
システイン残基のPEG化(上記参照)のためには、通常、FVIIまたはFVIIa変種はPEG化前にジチオスレイトール(DDT)などの還元剤で処理される。その後、還元剤は、脱塩などの任意の従来法により除去される。PEGのシステイン残基への結合は、典型的にはpH6〜9の適切な緩衝液中で、4℃〜25℃のさまざまな温度で、最大で16時間までの期間行われる。
【0175】
PEG化は、結合するPEG分子の数、その分子のサイズおよび形状(例えばそれらが直鎖状であるか分枝鎖状であるか)、ならびに本変種ポリペプチドにおける結合部位に関して、最適な分子を産生するよう設計されることが理解される。使用するポリマーの分子量は、例えば達成されるべき望ましい作用に基づいて選択される。
【0176】
タンパク質上の単一の結合基(例えばN末端アミノ基)のみへの結合に関して、ポリマー分子は、直鎖状でも分枝鎖状でもよいが、好ましくは約10〜25kDa、例えば約15〜25kDa、例えば約20kDaの高分子量を有するのが有利である。
【0177】
通常、ポリマー結合は、できるだけ多くの利用可能なポリマー結合基がポリマー分子と反応することを目的とした条件下で行われる。これは、本ポリペプチドに対するポリマーの適切なモル過剰によって達成される。典型的には、ポリペプチドに対する活性化ポリマー分子のモル比は約1000対1まで、例えば約200対1まで、または約100対1までである。しかしながら、最適な反応を得るために、例えば約50対1、10対1、5対1、2対1、または1対1までなど、その比率がいくらか低い場合もある。
【0178】
リンカーを介して本ポリペプチドとポリマー分子をカップリングすることも本発明によって企図される。適切なリンカーは当業者に周知である;国際公開公報第01/58935号を参照。
【0179】
結合の後、残余の活性型ポリマー分子は、当技術分野で公知の方法、例えば反応混合物への一級アミンの添加によって遮断され、その結果生じた非活性型ポリマー分子は適切な方法によって除去される。
【0180】
状況に応じて、例えば変種ポリペプチドのアミノ酸配列、使用される活性型PEG化合物の性質、PEG対ポリペプチドのモル比を含む特定のPEG化条件に応じて、様々な程度のPEG化が得られる可能性があり、一般的に変種ポリペプチドに対するPEGの比率が高いほど高度のPEG化が得られる、ということが理解される。しかしながら、任意の所定のPEG化過程により生じるPEG化変種ポリペプチドは、通常、わずかにPEG化の程度が異なる結合ポリペプチド変種の確率的分布を含むと考えられる。
【0181】
糖部分へのカップリング
一つまたは複数のグリコシル化部位を含むFVII分子のインビボグリコシル化を達成するためには、変種ポリペプチドをコードするヌクレオチド配列は、グリコシル化する真核生物発現宿主に挿入されなければならない。発現宿主細胞は真菌(糸状菌または酵母)、昆虫または動物細胞から、またはトランスジェニック植物細胞から選択され得る。一つの態様において、宿主細胞は、CHO細胞、BHK細胞またはHEK細胞(たとえばHEK293細胞)などの哺乳類細胞、またはSF9細胞などの昆虫細胞、またはサッカロミセス・セレビジエ(Saccharomyces cerevisiae)またはピチア・パストリス(Pichia pastoris)などの酵母細胞、または後に記載される任意の宿主細胞である。
【0182】
例えば、国際公開公報第87/05330号およびAplinら、CRC Crit Rev. Biochem, pp. 259-306, 1981に記載されているように、糖部分(例えばデキストラン)と変種ポリペプチドのアミノ酸残基とのインビトロ共有結合も使用されうる。FVIIまたはFVIIa変種のインビトログリコシル化についてのさらなる情報は、国際公開公報第03/093465号も参照のこと。
【0183】
セリンプロテアーゼ阻害剤の結合
セリンプロテアーゼ阻害剤の結合は、国際公開公報第96/12800号に記載される方法に従って行うことができる。
【0184】
本発明のポリペプチド変種を調製する方法
グリコシル化型であってもよい、本発明のポリペプチド変種は、当技術分野で周知の任意の適した方法によって産生してもよい。そのような方法には、ポリペプチド変種をコードするヌクレオチド配列を構築する段階、および適した形質転換またはトランスフェクトした宿主において配列を発現させる段階が含まれる。好ましくは宿主細胞は、哺乳類細胞のようなγカルボキシル化宿主細胞である。しかし、本発明のポリペプチド変種は、あまり効率的ではないが、化学合成もしくは化学合成の組み合わせ、または化学合成と組み換えDNA技術の組み合わせによって産生してもよい。
【0185】
本発明のポリペプチドをコードするヌクレオチド配列は、親FVII、例えば配列番号1に示されるアミノ酸配列を有するhFVIIをコードするヌクレオチド配列を単離または合成すること、次に、1つ(または複数)の関連するアミノ酸残基の導入(すなわち挿入または置換)または除去(すなわち欠失または置換)を行うためにヌクレオチド配列を変化させることによって構築してもよい。
【0186】
ヌクレオチド配列は、通常の方法に従って部位特異的変異誘発によって簡便に改変される。または、ヌクレオチド配列は、化学合成によって、例えばオリゴヌクレオチドが所望のポリペプチドのアミノ酸配列に基づいてデザインされるオリゴヌクレオチドシンセサイザーを用いて、好ましくは組み換え型ポリペプチドが産生される宿主において都合がよいコドンを選択することによって、調製される。例えば、所望のポリペプチドの一部をコードするいくつかの小さいオリゴヌクレオチドを合成して、PCR(ポリメラーゼ連鎖反応)、ライゲーション、またはライゲーション連鎖反応(LCR)(Barany、Proc Natl Acad Sci USA 88:189〜193、1991)によって構築してもよい。個々のオリゴヌクレオチドは典型的に、相補的構築のために5'または3'オーバーハングを含む。
【0187】
一旦構築されると(合成、部位特異的突然変異、または他の方法による)、ポリペプチドをコードするヌクレオチド配列は組換えベクターに挿入され、望ましい形質転換宿主細胞において、FVIIの発現のために必要な制御配列に機能的に結合されている。
【0188】
当業者は、ポリペプチドを発現するための適したベクター、発現制御配列、および宿主を選択することができると思われる。組換えベクターは、自律的に複製するベクター、すなわちその複製が染色体の複製に依存しない染色体外実体として存在するベクター、例えばプラスミドであってもよい。または、ベクターは、宿主細胞に導入した場合、宿主細胞のゲノムに組み入れられ、それが組み入れられている1つまたは複数の染色体と共に複製されるベクターである。
【0189】
ベクターは好ましくは、その中で本発明のポリペプチド変種をコードするヌクレオチド配列が、ヌクレオチド配列の転写にとって必要なさらなるセグメントに機能的に結合している発現ベクターである。ベクターは、典型的にプラスミドまたはウイルスDNAに由来する。本明細書において言及した宿主細胞における発現に適した多くの発現ベクターが市販されているか、または文献に記述されている。FVIIを発現するための適したベクターに関する詳細な情報は、参照として組み入れられる国際公開公報第01/58935号に見出され得る。
【0190】
「制御配列」という用語は、本明細書において、本発明のポリペプチド変種の発現にとって必要または有利な全ての成分が含まれると定義される。各制御配列は、ポリペプチド変種をコードする核酸配列に対して先天的または外来配列であってもよい。そのような制御配列には、リーダー配列、ポリアデニル化配列、プロペプチド配列、プロモーター、エンハンサーまたは上流活性化配列、シグナルペプチド配列、および転写ターミネーターが含まれるが、これらに限定されることはない。少なくとも制御配列には、プロモーターが含まれる。
【0191】
本発明において、様々な発現制御配列が使用されてもよく、例えば、参照として組み入れられる国際公開公報第01/58935号に開示された任意の制御配列を使用してもよい。
【0192】
ポリペプチド変種をコードする本発明のヌクレオチド配列は、それが部位特異的突然変異、合成、PCRまたはその他の方法により調製されたかに関わらず、任意で、シグナルペプチドをコードするヌクレオチド配列を含んでもよい。シグナルペプチドは、ポリペプチド変種が発現される細胞から分泌される場合に存在する。そのようなシグナルペプチドは、存在する場合、ポリペプチド変種の発現に関して選択された細胞によって認識されるペプチドでなければならない。シグナルペプチドは、ポリペプチドに対して同種(すなわち、hFVIIに通常会合する)もしくは異種(すなわち、hFVIIとは異なる他の起源から発生する)であってよく、または宿主細胞に対して同種もしくは異種、すなわち宿主細胞から通常発現するシグナルペプチドもしくは宿主細胞から通常発現しないシグナルペプチドであってよい。適したシグナルペプチドのさらなる情報は、国際公開公報第01/58935号を参照されたい。
【0193】
細菌(しかし、あまり好ましくない)、真菌(酵母を含む)、植物、昆虫、哺乳類、もしくは他の適切な動物の細胞または細胞系、およびトランスジェニック動物または植物を含む、任意の適した宿主を、ポリペプチド変種を産生するために使用してもよい。哺乳類細胞が好ましい。細菌宿主細胞の例には、バチルス属(例えば、B.ブレビスもしくは枯草菌)、シュードモナス属またはストレプトミセス属のようなグラム陽性細菌;または大腸菌株のようなグラム陰性細菌が含まれる。適した糸状真菌宿主細胞の例には、アスペルギルス属(例えばA.オリゼー、A.ニガーもしくはA.ニデュランス);フザリウム属;またはトリコデルマ属の株が含まれる。適切な酵母宿主細胞の例には、サッカロミセス属(例えば、S.セレビジエ);分裂酵母;クリヴェロミセス属(Kluyveromyces);ピチア属(例えばP.パストリス(P. pastoris)もしくはP.メタノリカ(P. methanolica));ハンゼヌラ属(例えばH.ポリモルファ(H. Polymorpha));またはヤロウィア属(Yarrowia)の株が含まれる。適した昆虫宿主細胞の例には、スポドプテラ・フルギペルタ(Spodoptera frugiperda)(Sf9もしくはSf21)またはトリコプルシオア・ニ(Trichoplusioa ni)細胞(ハイファイブ(High Five))(米国特許第5,077,214号)のような、鱗翅目細胞系が含まれる。適した哺乳類宿主細胞の例には、チャイニーズハムスター卵巣(CHO)細胞系(例えばCHO-K1; ATCC CCL-61)、ミドリザル細胞系(COS)(例えばCOS 1(ATCC CRL-1650)、COS 7(ATCC CRL-1651)); マウス細胞(例えばNS/O);胎仔ハムスター腎臓(BHK)細胞系(例えばATCC CRL-1632またはATCC CCL-10);およびヒト細胞(例えばHEK 293(ATCC CRL-1573))が含まれる。さらなる適した細胞系は、当技術分野に公知であり、American Type Culture Collection、Rockville、Marylandのような、公共の寄託所から入手可能である。また、CHO細胞のような哺乳類細胞は、ポリペプチド変種の改善されたグリコシル化を提供するために、例えば米国特許第5,047,335号に記載されるような、シアリルトランスフェラーゼ、例えば1,6-シアリルトランスフェラーゼを発現するように改変されてもよい。
【0194】
分泌を増加させるために、本発明のポリペプチド変種を、エンドプロテアーゼと共に、特にPACE (対塩基性アミノ酸転換酵素)(例えば米国特許第5,986,079号に記載されている)、例えばKex2エンドプロテアーゼ(例えば国際公開公報第00/28065号に記載されている)と共に産生することは特に興味深い。
【0195】
上記細胞型に外因性DNAを導入する方法、ならびにFVII変種の発現、産生および精製に関するその他の情報は、本明細書に参照として組み入れられる国際公開公報第01/58935号に見出される。
【0196】
本発明の薬学的組成物およびその使用
さらなる局面において、本発明は、本発明のポリペプチド変種および薬学的に許容される担体または賦形剤を含む組成物、特に薬学的組成物に関する。
【0197】
本発明によるポリペプチド変種および薬学的組成物を、薬剤として使用してもよい。
【0198】
上記の改善された性質のために、本発明のポリペプチド変種、または本発明の薬学的組成物は、外傷患者、血小板減少症患者、抗凝固治療を受けている患者、静脈瘤出血または他の上部消化管出血を有する肝硬変患者、正位肝臓移植または肝切除を受ける患者(輸血を伴わない手術を可能にする)、または血友病患者における、制御できない出血事象の治療に特に有用である。
【0199】
外傷は、外因性物質によって引き起こされる生きている組織への損傷として定義される。これは米国における死因の第4位であり、経済に対しても大きな財政的負担となっている。
【0200】
外傷は、鈍的外傷または貫通性外傷のいずれかに分類される。鈍的外傷によって、内部圧迫、臓器損傷、および内出血が起こり、貫通性外傷(物質が体を貫通して組織、血管および臓器を破壊した結果として)によって外部出血が起こる。
【0201】
外傷は、例えば、交通事故、銃による損傷、墜落、機械の事故、および刺し傷などの多くの事象によって引き起こされる可能性がある。
【0202】
肝硬変は、慢性アルコール中毒、慢性ウイルス性肝炎(B型、C型、およびD型)および自己免疫性肝炎を含む直接的な肝損傷に加え、原発性胆汁性肝硬変、原発性硬化性胆管炎、および胆管閉鎖を含む胆管損傷による間接的な損傷によって引き起こされる可能性がある。あまり一般的でない肝硬変の原因には、嚢胞性線維症、α-1-アンチトリプシン欠損症、ヘモクロマトーシス、ウィルソン病、ガラクトース血症、および糖原病のような遺伝性疾患による直接的な肝損傷が含まれる。移植は、末期肝硬変患者を治療するための重要な介入である。
【0203】
したがって、さらなる局面において、本発明は、凝血形成が望ましい疾患または障害の治療のために薬剤を製造するために本発明のポリペプチド変種に関する。本発明のなおさらなる局面は、本発明のポリペプチド変種または薬学的組成物の有効量をそれを必要とする哺乳類に投与することを含む、凝血形成が望ましい疾患または障害を有する哺乳類を治療する方法に関する。
【0204】
凝血形成の増加が望ましい疾患/障害の例には、脳出血を含む出血および、外傷のような制御されない激しい出血のある患者が含まれるが、これらに限定されない。さらなる例には、生体移植を受ける患者、切除を受ける患者、および静脈瘤出血を有する患者が含まれる。本発明のポリペプチドが凝血形成の増加に有効であると意図される、他の広範にわたる疾患/障害は、血友病、例えば、フォンウィルブランド病、血友病A、血友病Bおよび血友病Cである。
【0205】
本発明のポリペプチド変種は治療的有効量で、通常、NovoSeven(登録商標)のようなrFVIIを用いた治療において用いられる用量とほぼ平行な用量でまたはより低い用量で患者に投与される。本明細書における「治療的有効量」とは、それが投与される病態に関連して望ましい作用を生じるために十分な用量を意味する。正確な用量は、状況に依存し、既知の技術を用いて当業者によって確認可能となると思われる。通常、用量は、治療される病態または適応の重症度または拡大を予防または弱めることができなければならない。本発明のポリペプチド変種または組成物の有効量は、中でも疾患、用量、投与スケジュールに依存し、ポリペプチド変種もしくは組成物が単独で投与されるのか、または他の治療物質と共に投与されるのかに関わらず、組成物の血漿半減期、および患者の全身健康に依存することは当業者には明らかであると思われる。
【0206】
本発明のポリペプチド変種は好ましくは、薬学的に許容される担体または賦形剤を含む組成物において投与される。「薬学的に許容される」とは、それが投与される患者において如何なる望ましくない作用も引き起こさない担体または賦形剤を意味する。そのような薬学的に許容される担体および賦形剤ならびに適切な薬学的製剤法は当技術分野で周知である(例えば、「Remington's Pharmaceutical Sciences」、第18版、A.R. Gennaro編、マック出版社[1990];「Pharmaceutical Formulation Development of Peptides and Proteins」、S. FrokjaerおよびL. Hovgaard編、Taylor およびFrancis[2000];および「Handbook of Pharmaceutical Excipients」、第3版、A. Kibbe編、Pharmaceutical Press[2000]を参照されたい)。
【0207】
本発明のポリペプチド変種は、「そのまま」および/またはその塩の形で用いることができる。適した塩には、ナトリウム、カリウム、およびマグネシウムのようなアルカリ金属塩またはアルカリ土類金属塩と共に、例えば亜鉛塩が含まれるがこれらに限定されない。これらの塩または複合体は、結晶および/または非晶系構造として存在してもよい。
【0208】
本発明の薬学的組成物は単独または他の治療物質と共に投与してもよい。これらの物質は、同じ薬学的組成物の一部として組み入れてもよく、または本発明のポリペプチド変種とは個別に、同時にまたはもう1つの治療スケジュールに従って投与してもよい。さらに、本発明のポリペプチド変種または薬学的組成物は、他の治療に対する補助剤として用いてもよい。
【0209】
本発明の目的に関して「患者」には、ヒトおよび他の哺乳類の両方が含まれる。したがって、方法はヒトの治療および獣医学応用の両方、特にヒトの治療に適用可能である。
【0210】
本発明のポリペプチド変種を含む薬学的組成物は、多様な剤形、例えば液体、ゲル、凍結乾燥、または圧縮個体の形で製剤化してもよい。好ましい剤形は治療される特定の適応に依存し、当業者に明らかであると思われる。
【0211】
特に、本発明のポリペプチド変種を含む薬学的組成物は、凍結乾燥または安定な可溶性型で調製してもよい。ポリペプチド変種は、当業者に公知の多様な方法によって凍結乾燥してもよい。ポリペプチド変種は、本明細書に記述のようにタンパク質分解部位の除去または保護による安定な溶解型であってもよい。安定な溶解調製物を得る長所は、患者がより容易に取り扱いできる点にあり、緊急の場合には、生命を救うようになりうるより迅速な作用である。好ましい剤形は、治療される特定の適応に依存し、当業者に明らかであると思われる。
【0212】
本発明の製剤の投与は、経口、皮下、静脈内、脳内、鼻腔内、経皮、腹腔内、筋肉内、肺内、膣内、直腸内、眼内、または他の任意の許容される方法を含むがこれらに限定されない多様な方法で行うことができる。製剤は、注入によって連続的に投与することができるが、ポンプまたは埋め込みのような当技術分野で周知の技術を用いるボーラス注射が許容される。場合によっては、製剤は溶液またはスプレーとして直接適用してもよい。
【0213】
非経口投与
薬学的組成物の好ましい例は、非経口投与のためにデザインされた溶液、特に好ましくは水溶液である。多くの場合において、薬学的溶液製剤は、直ちに使用するために適用な液体型で提供されるが、そのような非経口製剤はまた凍結または凍結乾燥型で提供してもよい。前者の場合、組成物は使用前に融解しなければならない。凍結乾燥調製物は一般的にその液体対応物より安定であることが当業者によって認識されていることから、後者の型は、組成物に含まれる活性化合物の安定性を広く多様な保存条件で増強するために用いられる。そのような凍結乾燥調製物は、注射用滅菌水または滅菌生理食塩液のような1つまたは複数の薬学的に許容される希釈剤を加えることによって使用前に溶解する。
【0214】
非経口投与の場合、それらは適当であれば、所望の程度の純度を有するポリペプチド変種を、当技術分野で典型的に用いられる(その全てが「賦形剤」と呼ばれる)1つまたは複数の薬学的に許容される担体、賦形剤、または安定化剤、例えば緩衝剤、安定化剤、保存剤、等張剤、非イオン性界面活性剤、または洗浄剤、抗酸化剤、および/または他の雑多な添加剤、例えば増量剤、充填剤、キレート剤、抗酸化剤、および共溶媒と混合することによって凍結乾燥製剤または水溶液として保存するために調製される。
【0215】
FVII変種の投与に適した非経口製剤および徐放性製剤に関する詳細な情報は、本明細書に参照として組み入れられている国際公開公報第01/58935号および国際公開公報第03/093465号に見出すことができる。
【0216】
本発明は、以下の非制限的な実施例によってさらに記載される。
【0217】
材料と方法
活性部位領域
活性部位領域を、触媒三構造(残基H193、D242、S344)における任意の原子から10Å以内に、少なくとも1つの原子を有する任意の残基として定義する。
【0218】
タンパク質分解に対する感受性低下の測定
タンパク質分解は、タンパク質分解が自己タンパク質分解である、米国特許第5,580,560号、実施例5に記載されるアッセイ法を用いて測定することができる。
【0219】
さらに、タンパク質溶解の減少は、放射標識試料を用いて、血液試料を採取してこれらにSDS-PAGEおよびオートラジオグラフィーを行うことによって、rhFVIIaと本発明のポリペプチド変種とのタンパク質分解を比較するインビボモデルにおいて試験することができる。
【0220】
タンパク質分解を決定するために用いられるアッセイ法によらず、「タンパク質分解の減少」は、クーマシー染色SDS-PAGEゲルのゲルスキャニング、HPLCによって測定されるように、または下記の組織因子比依存的活性アッセイ法を用いて野生型と比較して保存された触媒活性によって測定されるように、rhFVIIaによって得られた分解と比較した切断の測定可能な減少を意味すると解釈される。
【0221】
ポリペプチド変種の分子量の測定
ポリペプチド変種の分子量は、SDS-PAGE、ゲル濾過、ウェスタンブロット、マトリクス支援レーザー脱離質量分析、または平衡遠心、例えばLaemmli, U.K.、Nature Vol 227(1970)、pp.680〜85によるSDS-PAGEによって決定される。
【0222】
リン脂質膜結合親和性の決定
リン脂質膜結合親和性は、Nelsestuen et al., Biochemistry, 1977; 30; 10819-10824に記載のとおり、または米国特許第6,017,882号の実施例1に記載されているとおりに決定してよい。
【0223】
TF非依存的第X因子活性化アッセイ
本アッセイは、Nelsestuenら、J. Biol. Chem. 2001、276:39285〜39381の39826頁に詳細に記述されている。
【0224】
簡単に説明すると、アッセイされる分子(hFVII、rhFVIIa、またはその活性化型での本発明のポリペプチド変種)を、BSAを含むTris緩衝液において、リン脂質源(好ましくは、ホスファチジルコリンとホスファチジルセリンを8:2で)および再脂質添加された第X因子と混合する。明記されたインキュベーション期間の後、過剰量のEDTAを加えて反応を停止させる。次に、第Xa因子の濃度を、発色基質(S-2222、クロモゲニックス(Chromogenix))を添加した後の405 nmでの吸光度の変化から測定する。バックグラウンドに関して補正後、rhFVIIa(awt)の組織因子非依存的活性を、10分後の吸光度の変化として決定し、本発明のポリペプチド変種の組織因子非依存的活性(a変種)を、10分後の吸光度の変化として決定する。その活性化型のポリペプチド変種の活性と、rhFVIIaの活性との比をa変種/awtとして定義する。
【0225】
凝血アッセイ
FVIIaおよびその変種の凝血活性を一段階アッセイにおいて測定し、凝血時間をトロンボトラックIV凝固計(Medinor)において記録した。第VII因子枯渇ヒト血漿(American Diagnostica)を再構築して、室温で15〜20分平衡化した。次に、血漿50 μlを凝固計のカップに移した。
【0226】
FVIIaおよびその変種をグリオキサリン緩衝液(5.7 mMバルビツレート、4.3 mMクエン酸ナトリウム、117 mM NaCl、1 mg/ml BSA、pH 7.35)において希釈した。試料50 μlをカップに加えて、37℃で2分間インキュベートした。
【0227】
トロンボプラスチン(Medinor)を水に溶解して、CaCl2を最終濃度4.5 mMで加えた。トロンボプラスチン100 μlを加えて反応を開始した。
【0228】
TFの非存在下で凝血活性を測定するために、トロンボプラスチンを加えない同じアッセイを用いた。PRISMソフトウェアを用いてデータを分析した。
【0229】
全血アッセイ
FVIIaおよびその変種の凝血アッセイを一段階アッセイにおいて測定し、凝血時間をトロンボトラックIV凝固計(Medinor)において記録した。FVIIaまたはその変種100 μlを、10 mMグリシルグリシン、50 mM NaCl、37.5 mM CaCl2、pH 7.35を含む緩衝液において希釈して、反応カップに移した。10%0.13 Mクエン酸ナトリウムを抗凝固剤として含む血液50 μlを加えて凝血反応を開始した。エクセルまたはPRISMソフトウェアを用いてデータを分析した。
【0230】
アミド溶解アッセイ
変種が小さいペプチド基質を切断できるか否かは、発色基質S-2288(D-Ile-Pro-Arg-p-ニトロアニリド)を用いて測定することができる。FVIIaをアッセイ緩衝液(50 mM Na-Hepes、pH 7.5、150 mM NaCl、5 mM CaCl2、0.1%BSA、1 U/mlヘパリン)において約10〜90 nMに希釈した。さらに、可溶性TF(sTF)をアッセイ緩衝液において50〜450 nMに希釈する。アッセイ緩衝液120 μlをFVIIa試料20 μlおよびsTF 20 μlと混合する。室温で軽く振とうさせながら5分間インキュベートしてから37℃で10分間インキュベートした後、S-2288基質を1 mMとなるように加えて反応を開始させ、405 nmでの吸光度をいくつかの時点で決定する。
【0231】
ELISAアッセイ
FVII/FVIIa(または変種)濃度をELISAによって決定する。マイクロタイタープレートのウェルを、プロテアーゼドメインに対する抗体の2 μg/mlのPBS溶液を用いてコーティングした(100 μl/ウェル)。R.T(室温)で一晩コーティングした後、ウェルをTHT緩衝液(100 mM NaCl、50 mM Tris-塩酸、pH 7.2、0.05% Tween20)によって4回洗浄した。その後、1%カゼイン(100 mM NaCl、50 mM Tris-塩酸、pH 7.2を用いて2.5%保存液を希釈)200 μlをブロッキングのためにウェルに加える。室温で1時間インキュベートした後、ウェルを空にして、試料100 μl(任意で希釈緩衝液(THT+0.1%カゼイン)において希釈)を加える。室温で1時間さらにインキュベーションした後、THT緩衝液でウェルを4回洗浄し、EGF様ドメインに対する100 μlのビオチン標識抗体(1 μg/ml)を添加する。さらに室温で1時間インキュベーションした後、THT緩衝液で4回洗浄し、100 μlのストレプトアビジン-西洋ワサビペルオキシダーゼ(DAKO A/S、Glostrup、Denmark、10000倍希釈)を添加する。さらに室温で1時間インキュベーションした後、THT緩衝液で4回洗浄し、100 μlのTMB(3,3',5,5'-テトラメチルベンジジン、Kem-en-Tech A/S、Denmark)を添加する。暗室で室温で30分間インキュベーションした後、100 μlの1 M H2SO4を添加し、OD450nmを測定する。rhFVIIa(NovoSeven(登録商標))を用いて標準曲線を作製する。
【0232】
あるいは、FVII/FVIIaまたは変種を、プロテアーゼドメインよりむしろGlaドメインを介して定量化することができる。このELISAの条件において、ウェルをEGF様ドメインに対する抗体で一晩コーティングして、検出のために、カルシウム依存ビオチン標識抗Glaドメインモノクローナル抗体を使用する(2 μg/ml、1ウェル当たり100 μl)。この状件において、THTおよび希釈緩衝液に5 mM CaCl2を添加する。
【0233】
トロンボグラムアッセイ
ヒト血漿中のhFVIIa、rhFVIIa、またはFVIIa変種のトロンビン生成に対する効果は、Hemkerら(2000) Thromb Haemost 83:589-91の589ページに記載されているアッセイ法の改変版で試験される。簡単に説明すると、アッセイする分子(hFVIIa、rhFVIIa、または変種のいずれか)を、再脂質化組換え組織因子(例えばDade Behringのイノビン(Innovin))またはリン脂質(フォスファチジルコリンおよびフォスファチジルエタノールの比が8:2、またはフォスファチジルコリン、フォスファチジルセリン、およびフォスファチジルエタノールの比が4:2:4)のいずれかを含むFVII除去貧血小板血漿(PPP)と混合する。
【0234】
蛍光原性トロンビン基質および塩化カルシウムを加えることにより、反応を開始する。蛍光を連続的に測定し、トロンビンアミド溶解活性を、蛍光曲線の傾き(経時的な蛍光の増加)を計算することによって決定する。このようにして、最大トロンビンアミド溶解活性に達するまでの時間(Tmax)が得られ、かつトロンビン生成率(トロンビン活性の最大増加)、および総トロンビン仕事量(work)(曲線下面積(AUC))が計算できる。
【0235】
凍結クエン酸加FVII除去血漿を、凝固の接触経路を阻害するために、トウモロコシトリプシン阻害剤存在下(100μg/ml血漿)で解凍する。96ウェルマイクロタイタープレートのそれぞれのウェルに対して、80μlの血漿と、最終濃度が0.1から100nMの間とした被験rhFVIIまたは変種を含む緩衝液20μlを加える。組換えヒト組織因子(rTF)を、最終濃度が1pMとなるように5μlのアッセイ緩衝液中に加える。アッセイ緩衝液は、蒸留水に溶解した20mM Hepes、150mM NaClおよび60mg/ml BSAからなる。0.1Mの塩化カルシウムを含む20μlの基質溶液を加えることによって、反応を開始する。アッセイプレートおよび試薬は37℃にあらかじめ温めておき、その温度で反応を行う。使用する蛍光測定器は、390nmの励起フィルターおよび460nmの発光フィルターを備えたBMG Fluormeterである。透明底の96ウェルプレートのそれぞれのウェルにおいて、20〜40秒間隔で30〜180分間蛍光を測定する。データはPRISMソフトウェアを用いて解析する。
【0236】
組織因子結合表面プラズモン共鳴アッセイ(Biacoreアッセイ)
表面プラズモン共鳴解析は、野生型第VIIa因子とその変種の可溶性組織因子に対する相対的結合を決定するために用いた。細胞外ドメインを含む組換え可溶性組織因子を、NHS/EDCカップリングを用いてBiacore CM5チップ上で270反応単位カップリングさせた。可溶性組織因子は、チップ表面と相互作用させるため、pH 4.5でカップリングさせた。
【0237】
このアッセイにおいて、第VII因子タンパク質の組織因子結合を、本変種と野生型との相対的比較を可能にするため、FVIIaまたは変種の単一濃度で比較した。この濃度は、75から0μg/mlの間の濃度でチップ上に流した野生型FVIIaの標準曲線により決定した。10mMのEDTAを加えることによりFVIIaを除去した。この方法で、15μg/mlの濃度が直線領域内の結合を生ずることが明らかとなった。次に、FVIIaの変種を15μg/mlの濃度でチップ上に流し、組織因子に対するFVIIaまたは変種の相対的結合強度を決定した。
【実施例】
【0238】
実施例
実施例1
Banner et al.、J Mol Biol、1996; 285:2089による可溶性組織因子との複合体におけるhFVIIaのX線構造を、本実施例のために使用する。この実施例の計算に関するさらなる情報は、国際公開公報第01/58935号を参照されたい。
【0239】
表面の露出
部分的なASA計算を行った結果、それらの側鎖の25%より多くが表面に露出していることが決定された以下の残基が得られた:

(A1〜S45はGlaドメインに位置し、残りの位置はGlaドメイン外に位置する)。
【0240】
以下の残基は、それらの側鎖の50%より多くが表面に露出していることが決定された:

(A1〜S43はGlaドメインに位置し、残りの位置はGlaドメイン外に位置する)。
【0241】
組織因子結合部位
hFVII中の以下の残基が複合体中のASAを変更することを、ASA計算を使用して決定した。これらの残基を受容体結合部位を構成するものとして定義した:

【0242】
活性部位領域
活性部位領域を、触媒三構造(残基H193、D242、S344)における任意の原子から、距離10Å以内の少なくとも1つの原子を有する任意の残基として定義する:

【0243】
活性部位結合裂の隆起
活性部位結合裂領域の隆起を、N173、A175、K199、N200、N203、D289、R290、G291、A292、P321およびT370として、FVIIa構造1FAK.pdbの視覚的検査によって定義した。
【0244】
実施例2
哺乳類細胞におけるrhFVIIa発現の発現カセットの設計
rhFVIIa発現用の発現カセットは、国際公開公報第01/58935号の実施例2に記載されているように、設計およびクローニングした。
【0245】
実施例3
本発明の変種をコードする発現カセットの構築
置換されたコドンを有する変種FVIIオープンリーディングフレームを有する構築物を作製するために、標準的方法を用いて配列突出伸長(Sequence overhang extension : SOE) PCRを使用した。
【0246】
実施例4
CHO K1細胞におけるポリペプチド変種の発現
CHO K1細胞系(ATCC # CCL-61)を、MEMα、10% FCS(Gibco/BRL Cat # 10091)、P/Sおよび5 μg/mlのフィロキノンを用いたT-25フラスコ中に50%コンフルエントで播種して、コンフルエントとなるまで増殖させる。コンフルエントな単層細胞に、リポフェクトアミン2000物質(Life Technologies)を製造者の指示に従って使用して、5 μgの上記関連プラスミドをトランスフェクトさせる。トランスフェクションの24時間後、試料を採取して、例えばhFVIIのEGF1ドメインを認識するELISAなどを用いて、この試料を定量する。この時点で、安定したトランスフェクタントのプールを作製する目的で、関連した選択(例えば、ハイグロマイシンB)を細胞に適用してもよい。CHO K1細胞、およびプラスミド上の選択マーカーとしてハイグロマイシンB耐性遺伝子を使用する場合には、通常これは一週間以内に達成される。
【0247】
実施例5
ポリペプチド変種を安定して発現するCHO-K1細胞の作製
CHO-K1トランスフェクタントプールのバイアルを融解して、細胞を、25 mlのMEMα、10%FCS、フィロキノン(5 μg/ml)、100 U/mlペニシリン、100 μg/mlストレプトマイシンを含む175 cm2組織フラスコに播種して、24時間増殖させる。細胞を回収して、希釈し、細胞密度1/2個〜1個/ウェルで96ウェルマイクロタイタープレートに播種する。1週間増殖させた後、20〜100個の細胞のコロニーがウェルに存在し、1個のコロニーのみを含むウェルを標識する。さらに2週間後、1個のコロニーのみを含む全てのウェルにおける培地を、200 μlの新鮮な培地に交換する。24時間後、培地試料を採取して、例えばELISAによって分析する。高産生クローンを選択し、これをFVIIまたはその変種の大規模産生のために用いる。
【0248】
実施例6
ポリペプチド変種の精製および結果として生じた活性化
FVIIおよびFVII変種は以下のように精製する。技法は4℃で行う。大規模産生から回収した培養培地を、Millipore TFFシステムを用いて、30 kDaカットオフペリコンメンブレンを用いて限外濾過する。培地を濃縮した後、クエン酸塩を5 mMとなるように加えて、pHを8.6に調節する。必要であれば、伝導率を10 mS/cm未満に低下させる。その後、試料を、50 mM NaCl、10 mM Tris、pH 8.6によって平衡化したQ-セファロースカラムに適用する。100 mM NaCl、10 mM Tris、pH 8.6によってカラムを洗浄してから150 mM NaCl、10 mM Tris、pH 8.6によって洗浄した後、FVIIを10 mM Tris、25 mM NaCl、35 mM CaCl2、pH 8.6を用いて溶出する。
【0249】
第二のクロマトグラフィー段階に関して、モノクローナルカルシウム依存的抗Glaドメイン抗体をCNBr活性化セファロースFFに対して共役させることによってアフィニティカラムを調製する。樹脂1 mlあたり抗体約5.5 mgを共役させる。カラムを10 mM Tris、100 mM NaCl、35 mM CaCl2、pH 7.5によって平衡化する。NaClは、濃度100 mM NaClとなるように試料に加えて、pHを7.4〜7.6に調節する。試料のO/N適用後、カラムを100 mM NaCl、35 mM CaCl2、10 mM Tris、pH 7.5によって洗浄して、FVIIタンパク質を100 mM NaCl、50 mMクエン酸塩、75 mM Tris、pH 7.5によって溶出する。
【0250】
第三のクロマトグラフィーに関して、試料の伝導率を必要であれば10 mS/cm未満に低下させて、pHを8.6に調節する。次に、試料をQ-セファロースカラム(50 mM NaCl、10 mM Tris、pH 8.6によって平衡化した)に、有効な活性化を得るためにゲル1 mlあたりタンパク質約3〜5 mgの密度で適用する。適用後、カラムを50 mM NaCl、10 mM Tris、pH 8.6によって3〜4カラム容積(cv)/時間の流速で約4時間洗浄する。FVIIタンパク質を、40 cvで500 mM NaCl、10 mM Tris、pH 8.6の0〜100%の勾配を用いて溶出した。FVII含有分画をプールする。
【0251】
最終クロマトグラフィー段階に関して、伝導率を10 mS/cm未満に低下させる。その後、試料をQ-セファロースカラム(140 mM NaCl、10 mMグリシルグリシン、pH 8.6によって平衡化した)に、ゲル1 mlあたりタンパク質約3〜5 mgの濃度で適用する。次に、カラムを140 mM NaCl、10 mMグリシルグリシン、pH 8.6によって洗浄して、FVIIを140 mM NaCl、15 mM CaCl2、10 mMグリシルグリシン、pH 8.6によって溶出する。溶出液を10 mM CaCl2となるように希釈して、pHを6.8〜7.2に調節する。最後に、Tween80を0.01%となるように加えて、-80℃で保存するためにpHを5.5に調節する。
【0252】
実施例7
実験結果−FX活性化活性
本発明の変種を「TF非依存性第X因子活性化アッセイ」に供し、以下の結果が得られた(結果は参照としてのP10Q+K32E変種の活性のパーセンテージで表される)。
【0253】
【表1】

【0254】
上記の結果からわかるように、rhFVIIaと比較して、また[P10Q+K32E]rhFVIIaと比較して、本発明の変種はFX活性化活性の実質的な改善を示した。
【0255】
実施例8
実験結果−「全血アッセイ」における凝血活性
本発明の変種を「全血アッセイ」に供したところ、それらの凝血活性はrhFVIIaならびに[P10Q+K32E]rhFVIIaと比較して有意な増加(すなわち凝血時間の減少)を示すことが判明した。実験結果は図1および下記の表2に示す。
【0256】
【表2】

【0257】
実施例9
実験結果−「凝血アッセイ」における凝血活性
TF依存性凝血アッセイ(上記の材料と方法の項に記載されている「凝血アッセイ」)においてアッセイした場合、R36Eの置換を有する本発明の変種は、rhFVIIまたは他の本発明の変種と比較して、有意に凝血活性が減少することが明らかだった。下記の表3を参照。それにも関わらず、上記の実施例7に説明されているように、R36Eの置換を有する変種は「TF非依存性第X因子活性化アッセイ」において第X因子活性化活性が増加している。
【0258】
【表3】

【0259】
実施例10
実験結果−トロンボグラムアッセイにおけるトロンビン生成
リン脂質(PL)依存性および組織因子(TF)依存性トロンボグラムの両方を用いて(上記のトロンボグラムアッセイの記載を参照)、異なる変種タンパク質濃度におけるFVIIa変種の最大トロンビン生成率を決定した。最大トロンビン生成率(FU(蛍光単位)/sec2として表される)をpMで表した変種濃度の関数としてプロットすることによって、図2(最大組織因子依存性トロンビン生成率)および図3(最大リン脂質依存性トロンビン生成率)に示す結果が得られた。
【0260】
これらの結果から、FVIIa変種であるP10Q K32E A34E R36Eは、反応がPL依存性かTF依存性であるかによって、異なるトロンビン生成力を有することが明らかである。本変種の最大TF依存性トロンビン生成率は、FVIIa変種であるP10Q K32EまたはA3AY P10Q K32E A34Lと比較して、およそ10倍減少している(図2の破線)。また、P10Q K32E A34E R36Eでは他の変種と比較して、ラグタイム、ピークまでの時間、ピークの高さ、および(より少ない程度であるが)AUCも減少している(データは示していない)。TF依存性活性とは対照的に、P10Q K32E A34E R36E変種のPL依存性活性は、本実施例で試験した他の変種の活性と同等であり(図3参照)、すなわち本変種はTF依存性活性が実質的に減少しても十分なPL依存性活性を有する。
【0261】
同実験において、P10Q K32E A34E R36Eの変種を、図2に示すように高いTF依存性トロンビン生成率を有するP10Q K32E A34E P74Sの変種と直接比較した。二つの変種間のTF結合の差(すなわち変種P10Q K32E A34E R36EのTF結合の減少)は、おそらくA34Eの置換と共に、R36Eの置換の存在に直接起因すると考えられる。
【0262】
実施例11
実験結果−Biacoreアッセイにおける組織因子へのFVIIa結合
本発明の変種を、材料と方法の項に記載されているように、TFチップを用いたBiacoreシステム上での表面プラズモン共鳴によるアッセイに供したところ、以下の結果が得られた。
【0263】
【表4】

【0264】
トロンボグラムアッセイからのTF依存性トロンビン生成率のデータ(実施例10)と一致して、表4の結果はR36Eの置換により組織因子への結合が減少することを示す。
【0265】
同Biacoreアッセイにおいて、グリコシル化部位を導入する二つの追加の改変(T106N、およびV253NまたはI205Tのいずれか)とともに表4に列記される変種と同じ改変を有するFVIIa変種も、組織因子への結合について試験した。その結果は下記の表5に示す。
【0266】
【表5】

【0267】
これらの結果は表4の結果と一致しており、追加のグリコシル化部位がない表4の同変種(または野生型)と比較して、表5の変種における新たな二つのグリコシル化部位の存在は、組織因子結合の(さらなる)減少を提供する。表4の変種の場合のように、グリコシル化変種にR36Eの置換が存在すると、この置換を有しない他のグリコシル化変種の組織因子結合レベルよりも、組織因子結合レベルが実質的に低下する。
【特許請求の範囲】
【請求項1】
配列番号:1に示すアミノ酸配列を有するヒト第VII因子(hFVII)またはヒト第VIIa因子(hFVIIa)に関連する1〜15個のアミノ酸改変を有し、(a)疎水性アミノ酸残基の34位における置換による導入、および(b)36位におけるアミノ酸置換から選択される少なくとも一つの改変を含む、第VII因子(FVII)または第VIIa因子(FVIIa)ポリペプチド変種。
【請求項2】
34位に疎水性アミノ酸残基が置換により導入されている、請求項1記載の変種。
【請求項3】
置換がA34I、A34L、A34M、A34V、A34F、A34Y、およびA34Wからなる群より選択される、請求項2記載の変種。
【請求項4】
置換がA34I、A34L、およびA34Vからなる群より選択される、請求項3記載の変種。
【請求項5】
置換がA34Lである、請求項4記載の変種。
【請求項6】
36位にアミノ酸置換をさらに含む、請求項2〜5のいずれか一項記載の変種。
【請求項7】
36位に陰性荷電アミノ酸残基が置換により導入されている、請求項6記載の変種。
【請求項8】
置換がR36Eである、請求項7記載の変種。
【請求項9】
A34L+R36Eの置換を含む、請求項8記載の変種。
【請求項10】
アミノ酸配列が36位におけるアミノ酸置換を含む、請求項1記載の変種。
【請求項11】
36位に陰性荷電アミノ酸残基が置換により導入されている、請求項10記載の変種。
【請求項12】
置換がR36Dである、請求項11記載の変種。
【請求項13】
置換がR36Eである、請求項11記載の変種。
【請求項14】
34位にアミノ酸置換をさらに含む、請求項10〜13のいずれか一項記載の変種。
【請求項15】
34位に陰性荷電アミノ酸残基が置換により導入されている、請求項14記載の変種。
【請求項16】
置換がA34Eである、請求項15記載の変種。
【請求項17】
A34E+R36Eの置換を含む、請求項16記載の変種。
【請求項18】
10位および/または32位にアミノ酸置換をさらに含む、請求項1〜17のいずれか一項記載の変種。
【請求項19】
K32Eの置換を含む、請求項18記載の変種。
【請求項20】
P10Qの置換を含む、請求項18記載の変種。
【請求項21】
P10Q+K32Eの置換を含む、請求項18記載の変種。
【請求項22】
P10Q+K32E+A34E+R36Eの置換を含む、請求項21記載の変種。
【請求項23】
P10Q+K32E+A34Lの置換を含む、請求項21記載の変種。
【請求項24】
P10Q+K32E+A34L+R36Eの置換を含む、請求項21記載の変種。
【請求項25】
非ポリペプチド部分への結合基を含む少なくとも一つのアミノ酸残基が、Glaドメイン外に位置する部位に導入されている、請求項1〜24のいずれか一項記載の変種。
【請求項26】
結合基がインビボグリコシル化部位である、請求項25記載の変種。
【請求項27】
グリコシル化部位が置換によって導入されたインビボN-グリコシル化部位である、請求項26記載の変種。
【請求項28】
インビボN-グリコシル化部位がA51N、G58N、T106N、K109N、G124N、K143N+N145T、A175T、I205S、I205T、V253N、T267N、T267N+S269T、S314N+K316S、S314N+K316T、R315N+V317S、R315N+V317T、K316N+G318S、K316N+G318T、G318N、D334N、およびそれらの組み合わせからなる群より選択される置換により導入されている、請求項27記載の変種。
【請求項29】
T106N、I205T、およびV253Nからなる群より選択される少なくとも一つの置換を含む、請求項28記載の変種。
【請求項30】
P10Q+K32E+A34E+R36E+T106N+I205Tの置換を含む、請求項29記載の変種。
【請求項31】
P10Q+K32E+A34E+R36E+T106N+V253Nの置換を含む、請求項29記載の変種。
【請求項32】
P10Q+K32E+A34E+R36E+I205T+V253Nの置換を含む、請求項29記載の変種。
【請求項33】
P10Q+K32E+A34L+T106N+I205Tの置換を含む、請求項29記載の変種。
【請求項34】
P10Q+K32E+A34L+T106N+V253Nの置換を含む、請求項29記載の変種。
【請求項35】
P10Q+K32E+A34L+I205T+V253Nの置換を含む、請求項29記載の変種。
【請求項36】
P10Q+K32E+A34L+R36E+T106N+I205Tの置換を含む、請求項29記載の変種。
【請求項37】
P10Q+K32E+A34L+R36E+T106N+V253Nの置換を含む、請求項29記載の変種。
【請求項38】
P10Q+K32E+A34L+R36E+I205T+V253Nの置換を含む、請求項29記載の変種。
【請求項39】
3位と4位の間に少なくとも一つのアミノ酸残基の挿入をさらに含む、請求項1〜38のいずれか一項記載の変種。
【請求項40】
3位と4位の間に一つのアミノ酸残基の挿入を含む、請求項39記載の変種。
【請求項41】
3位と4位の間に疎水性アミノ酸残基が挿入されている、請求項39または40記載の変種。
【請求項42】
挿入がA3AYである、請求項41記載の変種。
【請求項43】
A3AY+P10Q+K32E+A34E+R36Eの改変を含む、請求項42記載の変種。
【請求項44】
A3AY+P10Q+K32E+A34Lの改変を含む、請求項42記載の変種。
【請求項45】
A3AY+P10Q+K32E+A34L+R36Eの改変を含む、請求項42記載の変種。
【請求項46】
A3AY+P10Q+K32E+A34E+R36E+T106N+I205Tの改変を含む、請求項42記載の変種。
【請求項47】
A3AY+P10Q+K32E+A34E+R36E+T106N+V253Nの改変を含む、請求項42記載の変種。
【請求項48】
A3AY+P10Q+K32E+A34E+R36E+I205T+V253Nの改変を含む、請求項42記載の変種。
【請求項49】
A3AY+P10Q+K32E+A34L+T106N+I205Tの改変を含む、請求項42記載の変種。
【請求項50】
A3AY+P10Q+K32E+A34L+T106N+V253Nの改変を含む、請求項42記載の変種。
【請求項51】
A3AY+P10Q+K32E+A34L+I205T+V253Nの改変を含む、請求項42記載の変種。
【請求項52】
A3AY+P10Q+K32E+A34L+R36E+T106N+I205Tの改変を含む、請求項42記載の変種。
【請求項53】
A3AY+P10Q+K32E+A34L+R36E+T106N+V253Nの改変を含む、請求項42記載の変種。
【請求項54】
A3AY+P10Q+K32E+A34L+R36E+I205T+V253Nの改変を含む、請求項42記載の変種。
【請求項55】
配列番号:1に関連する6位、7位、14位、16位、19位、20位、25位、26位、29位および35位において改変が行われていない、請求項1〜54のいずれか一項記載の変種。
【請求項56】
変種が活性型である、請求項1〜55のいずれか一項記載の変種。
【請求項57】
本明細書に開示されている「TF非依存性第X因子活性化アッセイ」においてアッセイされた場合に、活性型の変種のFX活性化活性とrhFVIIaのFX活性化活性の比率が少なくとも約5である、請求項1〜56のいずれか一項記載の変種。
【請求項58】
請求項1〜57のいずれか一項に定義される変種をコードするヌクレオチド配列。
【請求項59】
請求項58記載のヌクレオチド配列を含む発現ベクター。
【請求項60】
請求項58記載のヌクレオチド配列または請求項59記載の発現ベクターを含む宿主細胞。
【請求項61】
インビボグリコシル化が可能なγ-カルボキシル化細胞である、請求項60記載の宿主細胞。
【請求項62】
請求項1〜57のいずれか一項に定義される変種および少なくとも一つの薬学的に許容される担体または賦形剤を含む組成物。
【請求項63】
請求項1〜57のいずれか一項に定義される変種、または請求項62に定義される組成物の、薬剤としての使用。
【請求項64】
凝血形成が望ましい疾患または障害の治療用の薬剤を製造するための、請求項1〜57のいずれか一項に定義される変種の使用。
【請求項65】
疾患または障害が、脳出血、外傷などの重度の制御不能な出血、移植または切除を受ける患者の出血、静脈瘤の出血、および血友病を含む、出血からなる群より選択される、請求項64記載の使用。
【請求項66】
疾患または障害が外傷である、請求項65記載の使用。
【請求項67】
疾患または障害が血友病である、請求項65記載の使用。
【請求項68】
凝血形成が望ましい疾患または障害を有する哺乳動物を治療する方法であって、請求項1〜57のいずれか一項に定義されている変種または請求項62記載の組成物の有効量を、必要としている哺乳動物に投与する段階を含む方法。
【請求項69】
疾患または障害が、脳出血、外傷などの重度の制御不能な出血、移植または切除を受ける患者の出血、静脈瘤の出血、および血友病を含む、出血からなる群より選択される、請求項68記載の方法。
【請求項70】
疾患または障害が外傷である、請求項69記載の方法。
【請求項71】
疾患または障害が血友病である、請求項69記載の方法。
【請求項1】
配列番号:1に示すアミノ酸配列を有するヒト第VII因子(hFVII)またはヒト第VIIa因子(hFVIIa)に関連する1〜15個のアミノ酸改変を有し、(a)疎水性アミノ酸残基の34位における置換による導入、および(b)36位におけるアミノ酸置換から選択される少なくとも一つの改変を含む、第VII因子(FVII)または第VIIa因子(FVIIa)ポリペプチド変種。
【請求項2】
34位に疎水性アミノ酸残基が置換により導入されている、請求項1記載の変種。
【請求項3】
置換がA34I、A34L、A34M、A34V、A34F、A34Y、およびA34Wからなる群より選択される、請求項2記載の変種。
【請求項4】
置換がA34I、A34L、およびA34Vからなる群より選択される、請求項3記載の変種。
【請求項5】
置換がA34Lである、請求項4記載の変種。
【請求項6】
36位にアミノ酸置換をさらに含む、請求項2〜5のいずれか一項記載の変種。
【請求項7】
36位に陰性荷電アミノ酸残基が置換により導入されている、請求項6記載の変種。
【請求項8】
置換がR36Eである、請求項7記載の変種。
【請求項9】
A34L+R36Eの置換を含む、請求項8記載の変種。
【請求項10】
アミノ酸配列が36位におけるアミノ酸置換を含む、請求項1記載の変種。
【請求項11】
36位に陰性荷電アミノ酸残基が置換により導入されている、請求項10記載の変種。
【請求項12】
置換がR36Dである、請求項11記載の変種。
【請求項13】
置換がR36Eである、請求項11記載の変種。
【請求項14】
34位にアミノ酸置換をさらに含む、請求項10〜13のいずれか一項記載の変種。
【請求項15】
34位に陰性荷電アミノ酸残基が置換により導入されている、請求項14記載の変種。
【請求項16】
置換がA34Eである、請求項15記載の変種。
【請求項17】
A34E+R36Eの置換を含む、請求項16記載の変種。
【請求項18】
10位および/または32位にアミノ酸置換をさらに含む、請求項1〜17のいずれか一項記載の変種。
【請求項19】
K32Eの置換を含む、請求項18記載の変種。
【請求項20】
P10Qの置換を含む、請求項18記載の変種。
【請求項21】
P10Q+K32Eの置換を含む、請求項18記載の変種。
【請求項22】
P10Q+K32E+A34E+R36Eの置換を含む、請求項21記載の変種。
【請求項23】
P10Q+K32E+A34Lの置換を含む、請求項21記載の変種。
【請求項24】
P10Q+K32E+A34L+R36Eの置換を含む、請求項21記載の変種。
【請求項25】
非ポリペプチド部分への結合基を含む少なくとも一つのアミノ酸残基が、Glaドメイン外に位置する部位に導入されている、請求項1〜24のいずれか一項記載の変種。
【請求項26】
結合基がインビボグリコシル化部位である、請求項25記載の変種。
【請求項27】
グリコシル化部位が置換によって導入されたインビボN-グリコシル化部位である、請求項26記載の変種。
【請求項28】
インビボN-グリコシル化部位がA51N、G58N、T106N、K109N、G124N、K143N+N145T、A175T、I205S、I205T、V253N、T267N、T267N+S269T、S314N+K316S、S314N+K316T、R315N+V317S、R315N+V317T、K316N+G318S、K316N+G318T、G318N、D334N、およびそれらの組み合わせからなる群より選択される置換により導入されている、請求項27記載の変種。
【請求項29】
T106N、I205T、およびV253Nからなる群より選択される少なくとも一つの置換を含む、請求項28記載の変種。
【請求項30】
P10Q+K32E+A34E+R36E+T106N+I205Tの置換を含む、請求項29記載の変種。
【請求項31】
P10Q+K32E+A34E+R36E+T106N+V253Nの置換を含む、請求項29記載の変種。
【請求項32】
P10Q+K32E+A34E+R36E+I205T+V253Nの置換を含む、請求項29記載の変種。
【請求項33】
P10Q+K32E+A34L+T106N+I205Tの置換を含む、請求項29記載の変種。
【請求項34】
P10Q+K32E+A34L+T106N+V253Nの置換を含む、請求項29記載の変種。
【請求項35】
P10Q+K32E+A34L+I205T+V253Nの置換を含む、請求項29記載の変種。
【請求項36】
P10Q+K32E+A34L+R36E+T106N+I205Tの置換を含む、請求項29記載の変種。
【請求項37】
P10Q+K32E+A34L+R36E+T106N+V253Nの置換を含む、請求項29記載の変種。
【請求項38】
P10Q+K32E+A34L+R36E+I205T+V253Nの置換を含む、請求項29記載の変種。
【請求項39】
3位と4位の間に少なくとも一つのアミノ酸残基の挿入をさらに含む、請求項1〜38のいずれか一項記載の変種。
【請求項40】
3位と4位の間に一つのアミノ酸残基の挿入を含む、請求項39記載の変種。
【請求項41】
3位と4位の間に疎水性アミノ酸残基が挿入されている、請求項39または40記載の変種。
【請求項42】
挿入がA3AYである、請求項41記載の変種。
【請求項43】
A3AY+P10Q+K32E+A34E+R36Eの改変を含む、請求項42記載の変種。
【請求項44】
A3AY+P10Q+K32E+A34Lの改変を含む、請求項42記載の変種。
【請求項45】
A3AY+P10Q+K32E+A34L+R36Eの改変を含む、請求項42記載の変種。
【請求項46】
A3AY+P10Q+K32E+A34E+R36E+T106N+I205Tの改変を含む、請求項42記載の変種。
【請求項47】
A3AY+P10Q+K32E+A34E+R36E+T106N+V253Nの改変を含む、請求項42記載の変種。
【請求項48】
A3AY+P10Q+K32E+A34E+R36E+I205T+V253Nの改変を含む、請求項42記載の変種。
【請求項49】
A3AY+P10Q+K32E+A34L+T106N+I205Tの改変を含む、請求項42記載の変種。
【請求項50】
A3AY+P10Q+K32E+A34L+T106N+V253Nの改変を含む、請求項42記載の変種。
【請求項51】
A3AY+P10Q+K32E+A34L+I205T+V253Nの改変を含む、請求項42記載の変種。
【請求項52】
A3AY+P10Q+K32E+A34L+R36E+T106N+I205Tの改変を含む、請求項42記載の変種。
【請求項53】
A3AY+P10Q+K32E+A34L+R36E+T106N+V253Nの改変を含む、請求項42記載の変種。
【請求項54】
A3AY+P10Q+K32E+A34L+R36E+I205T+V253Nの改変を含む、請求項42記載の変種。
【請求項55】
配列番号:1に関連する6位、7位、14位、16位、19位、20位、25位、26位、29位および35位において改変が行われていない、請求項1〜54のいずれか一項記載の変種。
【請求項56】
変種が活性型である、請求項1〜55のいずれか一項記載の変種。
【請求項57】
本明細書に開示されている「TF非依存性第X因子活性化アッセイ」においてアッセイされた場合に、活性型の変種のFX活性化活性とrhFVIIaのFX活性化活性の比率が少なくとも約5である、請求項1〜56のいずれか一項記載の変種。
【請求項58】
請求項1〜57のいずれか一項に定義される変種をコードするヌクレオチド配列。
【請求項59】
請求項58記載のヌクレオチド配列を含む発現ベクター。
【請求項60】
請求項58記載のヌクレオチド配列または請求項59記載の発現ベクターを含む宿主細胞。
【請求項61】
インビボグリコシル化が可能なγ-カルボキシル化細胞である、請求項60記載の宿主細胞。
【請求項62】
請求項1〜57のいずれか一項に定義される変種および少なくとも一つの薬学的に許容される担体または賦形剤を含む組成物。
【請求項63】
請求項1〜57のいずれか一項に定義される変種、または請求項62に定義される組成物の、薬剤としての使用。
【請求項64】
凝血形成が望ましい疾患または障害の治療用の薬剤を製造するための、請求項1〜57のいずれか一項に定義される変種の使用。
【請求項65】
疾患または障害が、脳出血、外傷などの重度の制御不能な出血、移植または切除を受ける患者の出血、静脈瘤の出血、および血友病を含む、出血からなる群より選択される、請求項64記載の使用。
【請求項66】
疾患または障害が外傷である、請求項65記載の使用。
【請求項67】
疾患または障害が血友病である、請求項65記載の使用。
【請求項68】
凝血形成が望ましい疾患または障害を有する哺乳動物を治療する方法であって、請求項1〜57のいずれか一項に定義されている変種または請求項62記載の組成物の有効量を、必要としている哺乳動物に投与する段階を含む方法。
【請求項69】
疾患または障害が、脳出血、外傷などの重度の制御不能な出血、移植または切除を受ける患者の出血、静脈瘤の出血、および血友病を含む、出血からなる群より選択される、請求項68記載の方法。
【請求項70】
疾患または障害が外傷である、請求項69記載の方法。
【請求項71】
疾患または障害が血友病である、請求項69記載の方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2012−105650(P2012−105650A)
【公開日】平成24年6月7日(2012.6.7)
【国際特許分類】
【出願番号】特願2011−277848(P2011−277848)
【出願日】平成23年12月20日(2011.12.20)
【分割の表示】特願2006−515723(P2006−515723)の分割
【原出願日】平成16年6月18日(2004.6.18)
【出願人】(509011776)バイエル ヘルスケア エルエルシー (3)
【Fターム(参考)】
【公開日】平成24年6月7日(2012.6.7)
【国際特許分類】
【出願日】平成23年12月20日(2011.12.20)
【分割の表示】特願2006−515723(P2006−515723)の分割
【原出願日】平成16年6月18日(2004.6.18)
【出願人】(509011776)バイエル ヘルスケア エルエルシー (3)
【Fターム(参考)】
[ Back to top ]

