筋ジストロフィーの病態及び治療評価のための分子マーカー
【課題】 筋ジストロフィーの発症に関係する新規マーカーを提供し、筋ジストロフィーの発症機構を解明すると共に、筋ジストロフィーの診断及び治療のための手段を提供すること。
【解決手段】サンプルにおいてc-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つのマーカーの発現を測定するための手段を含むことを特徴とする筋ジストロフィー診断薬。
【解決手段】サンプルにおいてc-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つのマーカーの発現を測定するための手段を含むことを特徴とする筋ジストロフィー診断薬。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、筋ジストロフィーの新規マーカーに基づいており、具体的には筋ジストロフィー診断薬に関する。また本発明は、筋ジストロフィーの治療薬又は治療法のスクリーニング方法、及び筋ジストロフィーの治療薬又は治療法の有効性の評価方法に関する。
【背景技術】
【0002】
筋ジストロフィーは進行性に全身の筋萎縮と筋力低下を引き起こす遺伝性疾患の総称である。筋ジストロフィーにおいて、デュシェンヌ(Duchenne)型筋ジストロフィー(DMD)はX染色体連鎖性遺伝を示し、出生男児3,500人に1人と最も頻度が高い。一般に、2〜5歳に歩行障害で発症し、13歳までに歩行不能となり、30歳前後で呼吸不全又は心不全により死亡する極めて重篤な疾患である。DMDは、筋形質膜に存在するジストロフィンをコードするジストロフィン遺伝子の変異により発症する。ジストロフィンは筋収縮及び弛緩の間に、筋線維の安定化と細胞内カルシウムの恒常性を維持する機能を有しているとされるが(非特許文献1)、ジストロフィンの欠損によって筋形質膜は脆弱となり、筋細胞内カルシウム濃度が増加して、様々なタンパク質分解酵素(プロテアーゼ)の活性化や筋壊死が起こると考えられている(非特許文献2)。治療法の開発には筋ジストロフィーの病態機序の理解が重要であり、このためにはモデル動物が必要不可である。しかし、最も頻用されるDMDの動物モデルであるmdxマウスは、筋壊死同様に筋再生も非常に活発であり(非特許文献3)、筋変性の分子機構は十分には明らかにされていない。
【0003】
新生児DMDにおいて血清又は血漿クレアチンキナーゼ(CK)値が高値であることが古くより報告されている(特許文献1及び非特許文献4〜7)が、その原因については十分解明されてはおらず、DMDの新生児診断も確立されていない。一方、他のDMDモデル動物である筋ジストロフィー犬(以下、「筋ジス犬」ともいう)は、出生時の血清CK値が著しい高値を示し、新生仔期の死亡率も高い(非特許文献8及び9)が、その詳細な原因は不明であった。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2005−130773号公報
【非特許文献】
【0005】
【非特許文献1】Infante JP, et al., Mol Cell Biochem 1999; 195: 155-167.
【非特許文献2】Hopf FW, et al., Am J Physiol 1996; 271: C1325-C1339.
【非特許文献3】Tanabe Y, et al., Acta Neuropathologica (Berl) 1986; 69: 91-95.
【非特許文献4】Heyck H, et al., Klin Wescher 1966; 44 695-700.
【非特許文献5】Demos J., Am J Phys Med 1971; 50: 271-284.
【非特許文献6】Zellweger H, et al., Pediatrics 1975; 55: 3-4.
【非特許文献7】Ionasescu V, et al., Lancet 1978; 2: 1251.
【非特許文献8】Valentine BA, et al., J Neurol Sci 1988; 88: 69-81.
【非特許文献9】Shimatsu Y, et al., Acta Myologica 2005; 24: 145-154.
【発明の概要】
【発明が解決しようとする課題】
【0006】
筋ジストロフィーでは筋障害や壊死により血清CKが著しく高い値を示すことから診断に用いられてきたが、運動や安静により値が容易に変動するために診断や病勢の把握には十分ではないことが指摘されてきた。
【0007】
従って、本発明の課題は、筋ジストロフィーの発症に関係する新規マーカーを提供し、筋ジストロフィーの発症機構を解明すると共に、筋ジストロフィーの診断及び治療のための手段を提供することである。
【課題を解決するための手段】
【0008】
本発明者は、上記課題を解決するため鋭意検討を行った結果、筋ジストロフィーに関連する4つの新規なマーカー、すなわちc-Fos、EGR1、IL-6及びIL-8を見出し、これらのマーカーの発現の測定を利用することによって、筋ジストロフィーを診断し、又は筋ジストロフィーの治療薬若しくは治療法をスクリーニングすることができるという知見を得、本発明を完成するに至った。
【0009】
すなわち、本発明は、以下の[1]〜[11]である。
[1]サンプルにおいてc-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つのマーカーの発現を測定するための手段を含むことを特徴とする筋ジストロフィー診断薬。
[2]測定手段がDNAプライマー及び/又はDNAプローブである、[1]に記載の診断薬。
[3]測定手段が抗体である、[1]に記載の診断薬。
[4]サンプルが、筋サンプル、血液サンプル及び血清サンプルからなる群より選択される、[1]〜[3]のいずれかに記載の診断薬。
[5]筋ジストロフィーの診断が、筋ジストロフィーの保因の判定又は筋ジストロフィーの発症の予測である、[1]〜[4]のいずれかに記載の診断薬。
【0010】
[6]被験者における筋ジストロフィーの診断方法であって、
(a)被験者からのサンプルにおいて、c-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つのマーカーの発現を測定するステップ、
(b)(a)の結果を基準と比較することにより、該被験者における筋ジストロフィーを診断するステップ
を含む方法。
【0011】
[7]筋ジストロフィーの治療薬又は治療法のスクリーニング方法であって、
(a)筋ジストロフィー発症動物又は筋ジストロフィー保因動物に由来する筋細胞を、被験治療薬又は治療法により処置するステップ、
(b)該筋細胞において、c-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つのマーカーの発現を測定するステップ、
(c)(b)の結果に基づいて被験治療薬又は治療法を筋ジストロフィーの治療薬又は治療法の候補として同定するステップ
を含む方法。
[8]筋ジストロフィーの治療薬又は治療法のスクリーニング方法であって、
(a)被験治療薬又は治療法による処置を受けた、筋ジストロフィー発症動物又は筋ジストロフィー保因動物からのサンプルにおいて、c-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つのマーカーの発現を測定するステップ、
(b)(a)の結果に基づいて被験治療薬又は治療法を筋ジストロフィーの治療薬又は治療法の候補として同定するステップ
を含む方法。
[9]被験治療薬又は治療法による処置を行う前に、筋細胞又はサンプルにおいて、c-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つのマーカーの発現を測定するステップをさらに含む、[7]又は[8]に記載の方法。
[10]筋細胞又はサンプルにおけるマーカーの発現が、非処置の筋細胞又はサンプルにおける同じマーカーの発現よりも低い場合には、被験治療薬又は治療法が筋ジストロフィーの治療薬又は治療法の候補として同定される、[7]〜[9]のいずれかに記載の方法。
【0012】
[11]筋ジストロフィーの治療薬又は治療法の有効性の評価方法であって、
(a)被験治療薬又は治療法による処置を受けた、筋ジストロフィー発症動物又は筋ジストロフィー保因動物からのサンプルにおいて、c-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つのマーカーの発現を測定するステップ、
(b)(a)の結果に基づいて被験治療薬又は治療法の有効性を評価するステップ
を含む方法。
[12]筋ジストロフィー発症動物又は筋ジストロフィー保因動物が、筋ジストロフィーを発症した若しくは保因しているヒト、又は筋ジストロフィーモデル動物である、[7]〜[11]のいずれかに記載の方法。
[13]c-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つの発現又は活性を阻害又は抑制する手段を含むことを特徴とする筋ジストロフィーの治療又は予防薬。
【発明の効果】
【0013】
本発明に係る筋ジストロフィー診断薬により、筋ジストロフィーの保因及び将来の発症を早期に診断及び予測することができ、筋ジストロフィーの早期治療に有用である。また、本発明に係る新規マーカーは、筋ジストロフィーとの関連性を有し、筋ジストロフィーの診断及び予測だけではなく、筋ジストロフィーの発症機序の解明、さらにはその治療や治療薬の開発などに用いることができる。
【図面の簡単な説明】
【0014】
【図1】正常犬、保因犬及び筋ジス犬における出生後クレアチニンキナーゼ(CK)値を示すグラフである。(A)自然分娩及び帝王切開で娩出された新生仔の出生後CK値。(B)新生仔の臍帯血及び呼吸開始後の静脈血血清CK値。(C)新生仔の血清CK値の経時的変化(呼吸開始前〜生後48時間後)。
【図2】呼吸開始前後の新生仔筋ジス犬の横隔膜の病理組織学的変化を示す写真である。
【図3】呼吸開始前(A)及び開始後(B)の正常犬及び筋ジス犬の横隔膜における遺伝子発現の変化をマイクロアレイを用いて調べた結果を示すグラフである。
【図4】呼吸開始前後の正常犬及び筋ジス犬の横隔膜におけるオステオポンチン発現の変化を定量PCRを用いて調べた結果を示すグラフである。
【図5】呼吸開始前後の正常犬及び筋ジス犬の横隔膜におけるオステオポンチン発現の変化をウエスタンブロットを用いて調べた結果を示す写真である。
【図6】呼吸開始前後の正常犬及び筋ジス犬の横隔膜におけるオステオポンチン発現の変化を免疫組織化学を用いて調べた結果を示す写真である。
【図7】呼吸開始前後の筋ジス犬の横隔膜における遺伝子発現の変化をマイクロアレイを用いて調べた結果を示すグラフである。
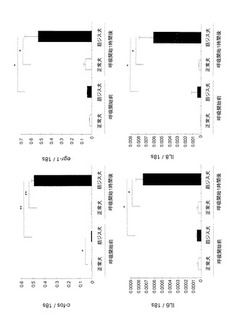
【図8】呼吸開始前後の正常犬及び筋ジス犬の横隔膜におけるc-Fos、EGR1、IL-6及びIL-8の発現の変化を定量PCRを用いて調べた結果を示すグラフである。
【図9】呼吸開始前後の正常犬及び筋ジス犬の横隔膜におけるc-Fos、EGR1、IL-6及びIL-8の発現の変化をウエスタンブロットを用いて調べた結果を示す写真である。
【図10】呼吸開始前後の正常犬及び筋ジス犬の横隔膜におけるc-Fos、EGR1、IL-6及びIL-8の発現の変化を免疫組織化学を用いて調べた結果を示す写真である。
【発明を実施するための形態】
【0015】
本発明は、筋ジストロフィーを診断するための新規なマーカーを提供する。本発明により提供されるマーカーは、正常ではその発現量が低く、筋ジストロフィーでは高く発現されるものであるため、筋ジストロフィーの保因者であるかどうかの診断や、筋ジストロフィーの発症の予測、筋ジストロフィーの治療薬又は治療法のスクリーニング、筋ジストロフィーの治療薬又は治療法の有効性の評価などに有用である。
【0016】
本発明者は、新生仔筋ジス犬の病態機序を明らかにすることにより、筋変性の機序を解明できる可能性があると考えた。健常新生児においてもDMDほどではないが、出生時に血清CK値は高く(Rudolph N,et al., Pediatrics 1966; 38: 1039-1046; Gilboa N, et al., Arch Dis Child 1976; 51: 283-285; Zellweger H, et al., Pediatrics 1975; 55: 30-34)、帝王切開により低下することから、高CK血症の原因として胎児が娩出時の産道からの圧迫、外傷、又は低酸素症が関与していると考えられている(Rudolph, 1966;Gilboa, 1976;Drummond LM. et al., Arch Dis Child 1979; 54: 362-366)。そこで、分娩時のストレス又は出生直後の呼吸開始が新生仔筋ジス犬の高CK血症に関連するかについて検討を行った(実施例1)。
【0017】
次に、新生仔筋ジス犬の横隔膜において、呼吸開始前後で発現が増加する遺伝子又は分子ついて検討したところ、呼吸開始前の筋ジス犬では正常犬と比較してオステオポンチンの発現量が増加していた。呼吸開始前の筋ジス犬新生仔の横隔膜ではオステオポンチンの発現が特異的に増加していたが、これは、stretch-activated channelを介して増加した細胞内Ca2+により活性化されたと考えられるが、再生時や線維化のみならず、筋壊死の前段階から活性化されており、筋ジストロフィーの病態の本質に関わる分子である可能性があり、おそらく炎症細胞の誘導に関連している可能性がある(実施例2)。
【0018】
一方、呼吸開始後の筋ジス犬において、即初期遺伝子でありサードメッセンジャーとも呼ばれるc-fos及びegr-1が、呼吸開始前の筋ジス犬と比較して増加していた。さらに、これらの遺伝子の下流に位置するインターロイキン-6(IL-6)及び-8(IL-8)の遺伝子の発現量も増加していた。これらの分子はstretch-activated channel及び筋細胞膜の機械的傷害部位より流入した細胞内Ca2+の著しい増加により活性化されたと考えられるが、IL-6やIL-8はマイオカインとも呼ばれ、筋細胞内在性に発現するサイトカイン・ケモカインであり、筋傷害早期に起こる好中球などの炎症細胞の誘導に関連していると考えられる(実施例2)。
【0019】
本発明者は、新生仔筋ジス犬の高CK血症の原因を究明することで、呼吸開始による機械的負荷前の横隔膜においてはオステオポンチンの発現が増加していること、呼吸開始による機械負荷後の横隔膜では、筋形質膜の破綻とカルシウムの流入がはじめに起こり、次いで即初期遺伝子が発現して下流の分子であるIL-6やIL-8のサイトカイン、ケモカインの発現を増加させて好中球などの炎症性細胞が誘導されるという二段階仮説を提案する。本研究で同定された遺伝子及び分子は、筋ジストロフィーの病態機序に新たな視点を与えるのみならず、病勢や治療効果の評価を得る上で新たな分子マーカーとなる。
【0020】
本発明では、上述のように、正常ではその発現量が低く筋ジストロフィーでは高く発現されるc-Fos及びEGR1、IL-6及びIL-8タンパク質及びそれをコードする遺伝子をマーカーとして利用する。本明細書中、これらの遺伝子及びタンパク質を「本発明のマーカー」と呼ぶ。なお、本発明のマーカーは、本明細書中「マーカー遺伝子」及び「マーカータンパク質」とも記載する。
【0021】
本発明のマーカータンパク質及びマーカー遺伝子は、当技術分野で公知であり、そのアミノ酸配列及び塩基配列も公知である。但し、本発明のマーカーについて、筋ジストロフィーとの関連性については報告されていない。本発明のマーカーの名称、アクセッション番号、塩基配列及びアミノ酸配列を、表1にまとめる。
【0022】
【表1】

【0023】
本発明では、表1に示されるマーカーをそれぞれ単独で使用することができる。すなわち、一実施形態では、c-Fosをマーカーとして使用する。別の実施形態では、EGR1をマーカーとして使用する。また別の実施形態では、IL-6をマーカーとして使用する。さらに別の実施形態では、IL-8をマーカーとして使用する。場合により、表1に示されるマーカーを組み合わせて使用することも可能である。あるいは、表1に示されるマーカーと、当技術分野で公知の他の筋ジストロフィーマーカーとを組み合わせてもよい。マーカーの組み合わせは、表1に示すマーカーを少なくとも1つ含む限り、任意の数及び種類のマーカーの組み合わせとすることができる。例えば、c-FosとERG-1、c-FosとIL-6、c-FosとIL-8、ERG-1とIL-6、ERG-1とIL-8、IL-6とIL-8、c-FosとERG-1とIL-6、c-FosとERG-1とIL-8、c-FosとIL-6とIL-8、又はERG-1とIL-6とIL-8を組み合わせて用いることができる。他のマーカーとしては、例えば血清クレアチニンキナーゼ(CK)値が挙げられる。このようにマーカーを組み合わせることによって、筋ジストロフィーの診断をより高精度に行うことができる。
【0024】
上述の通り、上記のマーカーは、筋ジストロフィーにおいて高レベルで発現される。本発明では、被験者由来のサンプルにおいて上記のマーカー又はマーカーの組合せの発現を測定する。2つ以上のマーカーについて発現を測定する場合、各マーカーの発現を測定するステップは、同時に行ってもよいし、前後して行ってもよい。また本発明では、「マーカーの発現」とは、マーカータンパク質又はその派生物若しくは誘導体の発現であってもよいし、あるいは該タンパク質をコードする遺伝子(mRNA)の発現であってもよい。「派生物」又は「誘導体」とは、マーカータンパク質から派生する物質又はマーカータンパク質の由来する物質を意味し、例えばシグナルペプチドを含むタンパク質、タンパク質の特定のサブユニット分子、修飾タンパク質、タンパク質断片などが含まれるが、これに限定されるものではない。
【0025】
従って、本発明に係る筋ジストロフィー診断薬(以下、「本診断薬」ともいう)は、被験者に由来するサンプル中のc-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つのマーカーの発現を測定するための手段を含むものである。
【0026】
使用するサンプルは、筋ジストロフィーについて診断しようとする被験者に由来するサンプルであれば特に限定されるものではなく、マーカーの発現を測定するための方法又は手段の種類に応じて適宜選択される。例えば生体液サンプル(血液、血清、血漿、尿、髄液、腹水等)、組織又は細胞サンプル(筋組織又は筋細胞、例えば横隔膜の組織又は細胞等)が挙げられ、採取の容易性の点から、筋細胞、血液、血清又は血漿などをサンプルとして用いることが好ましい。血漿を使用する場合には、抗凝固剤としてEDTAを使用することが好ましいが、ヘパリン、クエン酸ナトリウムなど当該分野で公知又は汎用されているものを使用することができる。血液サンプルの場合、採血後は氷冷又は冷蔵保存することが好ましい。また、組織又は細胞サンプルは、採取後に液体窒素、ドライアイスなど当該分野で公知又は汎用されている方法で直ちに凍結し、冷凍保存することが好ましい。筋細胞は、当技術分野で公知の方法により採取することができる。具体的には、例えば、骨格筋を細切し、50 ml円錐底チューブに移した後、筋重量1 gあたり4 mlのDispase2 (2.4 IU/ml) -Collagenase XI (0.2%) 溶液を加え、37℃、45〜60分間インキュベートし、途中15分ごとにピペットを用いてピペッティングする。その後、18 Gの注射針に数回通して組織片を粉砕し上清を回収する。上清を80μmのフィルターに通して細胞塊を除き、細胞懸濁液を50 ml円錐底チューブに移し、さらにDispase2 (2.4 IU/ml) -Collagenase XI (0.2%) 処理後のチューブに増殖培地を加え、その上清を同様にフィルターに通して回収する。増殖培地を加え、合計30 mlとし、数回ピペッティングを行い、1,000 rpmで5分間、4℃で遠心する。上清を捨て沈殿細胞に増殖培地20 mlを加え、再度懸濁した後、1,000 rpmで5分間、4℃で遠心する。沈殿細胞を増殖培地25 mlに懸濁し、コーティングなしの15 cm培養皿に移しbFGFを添加し、37℃、5%CO2濃度で90分間培養後、未付着細胞を含む上清を回収する。この上清を用いて培養皿の底面を洗い、180度向きを変えてもう一度37℃、5%CO2濃度で90分間培養し、上清を回収する。回収した上清を15 cmコラーゲンコート培養皿に移しbFGFを添加し、37℃、5%CO2濃度で一晩培養する。翌日筋芽細胞が30〜40%コンフルエント以上になっているようなら継代を行い、それ以下なら培地交換に留める。筋分化を防ぐために以後、毎日継代ないしは培地交換を行う。
【0027】
また被験者は、ヒト、及びその他の哺乳動物、例えば霊長類(サル、チンパンジーなど)、家畜動物(ウシ、ウマ、ブタ、ヒツジなど)、ペット用動物(イヌ、ネコなど)、実験動物(マウス、ラット、ウサギなど)であり、さらには爬虫類及び鳥類などであってもよい。
【0028】
マーカーの発現の測定は、サンプル中のマーカーの量又は濃度を、好ましくは半定量的又は定量的に測定することに関し、その量は、絶対量であってもよいし又は相対量であってもよい。測定は、直接的又は間接的に行うことができる。直接的な測定は、サンプル中に存在するマーカータンパク質又は遺伝子(mRNA)の分子数と直接相関するシグナルに基づいて、その量又は濃度を測定することに関する。そのようなシグナルは、例えばタンパク質又は遺伝子の特定の物理的又は化学的な特性に基づいている。間接的な測定は、二次成分(すなわちマーカータンパク質又はmRNA以外の成分)、例えば抗体やアプタマーなどのリガンド、標識又は酵素反応生成物から得られるシグナルの測定である。採用するマーカーの発現測定方法に応じて、本診断薬に含まれる測定手段も異なる。
【0029】
本発明の一実施形態では、マーカーの発現の測定は、サンプル中のマーカータンパク質の量を測定するための手段によって行うことができる。そのような手段は当技術分野で公知であり、例えば免疫アッセイの方法及び試薬などがある。またマーカータンパク質の発現の測定は、マーカータンパク質に特有の物理的又は化学的特性を測定するための手段、例えば正確な分子量又はNMRスペクトル等を測定するための手段によって行うことができる。マーカータンパク質の発現を測定するための手段としては、バイオセンサー、プロテインチップ、免疫アッセイと連結した光学装置、質量分析計、NMR分析計、二次元電気泳動装置又はクロマトグラフィー装置等の分析装置が挙げられる。
【0030】
例えば、サンプル中のマーカータンパク質の発現の測定は、免疫アッセイ(免疫学的測定法)により行うことができる。すなわちサンプル中のマーカータンパク質と、該タンパク質に特異的に結合する抗体との反応に基づいて、該タンパク質の発現を測定する。免疫アッセイは、当該分野で汎用されている方法であれば液相系及び固相系のいずれで行ってもよい。検出の容易性の点で、固相系を利用することが好ましい。また免疫アッセイの形式も限定されるものではなく、直接固相法の他、サンドイッチ法、競合法、ウエスタンブロッティング法、ELISA(enzyme linked immunosorbent assay)法などであってもよい。
【0031】
免疫アッセイを採用する場合には、本診断薬は、マーカータンパク質に対する抗体を含む。マーカータンパク質に対する抗体はモノクローナル抗体又はポリクローナル抗体のいずれであってもよいし、あるいはマーカータンパク質のエピトープに結合することができるFab、Fvフラグメントなどであってもよい。一次抗体と二次抗体を使用する場合には、両方ともモノクローナル抗体を用いることもでき、あるいは、一次抗体と二次抗体のいずれか一方をポリクローナル抗体とすることもできる。抗体は、当技術分野で公知の方法により調製することができ、また市販品として入手してもよい。
【0032】
マーカータンパク質と抗体との結合(反応)は、周知の方法に従って測定しうる。当業者であれば、採用する免疫アッセイの種類及び形式、使用する標識の種類などに応じて、各アッセイについての有効かつ最適な測定方法を決定することができる。例えば、サンプル中のマーカータンパク質と抗体との結合を容易に検出するために、該抗体を標識することにより該結合を直接検出するか、又は標識二次抗体若しくはビオチン−アビジン複合体等を用いることにより間接的に検出する。
【0033】
免疫アッセイとして固相系を選択する場合には、例えばサンプル中のタンパク質成分を固相に固定化することができ、例えば、(1)サンプルからタンパク質成分を調製する工程、(2)SDS-ポリアクリルアミドゲル電気泳動により分画する工程、(3)ゲル上のタンパク質を固相に転写する工程、(4)マーカータンパク質に対する抗体(一次抗体)と反応させる工程、(5)固相を洗浄する工程、(6)固相に一次抗体に対する標識抗体(二次抗体)を接触させる工程、(7)固相を洗浄する工程、(8)該標識を用いて各タンパク質の発現量を測定する工程からなる方法を採用することができる。あるいは、抗体を固相に固定してもよい。この方法は、いわゆる「サンドイッチ法」と呼ばれる方法であり、マーカーとして酵素を用いる場合には、「ELISA」として広く用いられている方法である。このような固相系の方法は、極微量のタンパク質の検出と操作の簡便化のため好ましい方法である。
【0034】
固相系においては、抗体又はサンプル中のタンパク質成分を固相(プレート、膜、ビーズ等)上に固定化し、この固相上においてマーカータンパク質と抗体との免疫学的結合を試験する。固相は、当技術分野で慣用的に使用されているものであれば特に限定されるものではなく、例えば市販のニトロセルロース膜又はPVDF膜を用いることができる。抗体又はサンプル中のタンパク質成分を固相上に固定化することによって、未結合のサンプル成分や試薬を容易に除去することができる。また特に、数種類の抗体を固定化したメンブレンを用いるタンパク質アレイ法では、少量の被験者由来のサンプル(血漿など)を用いて複数種のマーカータンパク質の発現を短時間で解析することができる。またこのような免疫アッセイは、例えば操作が簡便なテストストリップにおいても実施することができる。
【0035】
免疫アッセイとして液相系を選択する場合には、例えば、標識化抗体とサンプルとを接触させて標識化抗体とマーカータンパク質を結合させ、この結合体を分離し、標識シグナルを検出する。あるいは、マーカータンパク質に対する抗体(一次抗体)とサンプルとを接触させて一次抗体とマーカータンパク質を結合させ、この結合体に標識化抗体(二次抗体)を結合させ、この三者の結合体における標識シグナルを検出する。あるいは、さらにシグナルを増強させるためには、非標識の二次抗体を先ず抗体+マーカータンパク質結合体に結合させ、この二次抗体に標識物質を結合させるようにしてもよい。このような二次抗体への標識物質の結合は、例えば二次抗体をビオチン化し、標識物質をアビジン化しておくことによって行うことができる。
【0036】
免疫アッセイにおいて使用する抗体を標識するための標識としては、酵素、放射性同位体、蛍光色素又はアビジン−ビオチン系を使用することができる。酵素としては、通常の酵素免疫アッセイ(EIA)に用いられる酵素、例えば、パーオキシダーゼ、β-ガラクトシダーゼ、アルカリフォスファターゼ等を用いることができる。また、酵素阻害物質や補酵素等を用いることもできる。これら酵素と抗体との結合は、マレイミド化合物等の架橋剤を用いる公知の方法によって行うことができる。放射性同位体としては、125Iや3H等の通常のラジオイムノアッセイ(RIA)で用いられているものを使用することができる。蛍光色素としては、フルオレセインイソチオシアネート(FITC)やテトラメチルローダミンイソチオシアネート(TRITC)等の通常の蛍光抗体法に用いられるものを使用することができる。
【0037】
ビオチン−アビジン複合体系を利用する場合には、ビオチン化した抗体とサンプルとを反応させ、得られた複合体に標識を付加したアビジンを反応させる。アビジンは、ビオチンと特異的に結合することができるため、アビジンに付加した標識のシグナルを検出することによって、抗体とマーカータンパク質との結合を測定することができる。アビジンに付加する標識は特に限定されるものではないが、例えば酵素標識(ペルオキシダーゼ、アルカリホスファターゼなど)が好ましい。
【0038】
標識シグナルの検出もまた、当技術分野で公知の方法に従って行うことができる。例えば、酵素標識を用いる場合には、酵素作用によって分解して発色する基質を加え、基質の分解量を光学的に測定することによって酵素活性を求め、これを結合抗体量に換算し、標準値との比較から抗体量が算出される。基質は、使用する酵素の種類に応じて異なり、例えば酵素としてパーオキシダーゼを使用する場合には、3,3’,5,5’-テトラメチルベンジシンを、また酵素としてアルカリフォスファターゼを用いる場合には、パラニトロフェノール等を用いることができる。放射性標識を用いる場合には、放射性標識の発する放射線量をシンチレーションカウンター等により測定する。蛍光標識は、例えば蛍光顕微鏡、プレートリーダー等を用いて検出及び定量することができる。
【0039】
あるいは、免疫組織化学染色法(例えば免疫染色法)又は免疫電顕法のように、マーカータンパク質のin situ検出のために、マーカータンパク質に対する抗体を組織学的に用いることも可能である。in situ検出は、被験体から組織学的サンプル(例えば筋組織、筋細胞、横隔膜サンプル)を切除し(組織のパラフィン包埋切片など)、それに標識した抗体を接触させることにより実施しうる。
【0040】
以上の免疫学的方法では、サンプル中のマーカータンパク質とマーカータンパク質に対する抗体との結合量が多いほど、サンプル中にマーカータンパク質が多く発現されていることとなる。
【0041】
あるいは、マーカータンパク質の発現の測定は、質量分析法(MS)を使用して行うことができる。特に液体クロマトグラフィーと連結した質量分析計(LC/MS)による解析は鋭敏であるため有利である。質量分析法による測定は、例えば、(1)サンプルからタンパク質成分を調製する工程、(2)タンパク質・ペプチドに標識する工程、(3)タンパク質・ペプチドを分画する工程、(4)タンパク質・ペプチドを質量分析に供する工程、(5)質量分析値からマーカータンパク質群を同定する工程により行うことができる。標識としては、当技術分野で公知の同位体標識試薬を用いることができ、適当な標識試薬を市販品として入手することができる。また分画も当技術分野で公知の方法により行うことができ、例えば市販の強陽イオンカラム等を用いて行うことができる。この場合、本診断薬は、同位体標識試薬、分画用ミニカラムなどをマーカーの発現の測定手段として含む。
【0042】
また本発明においては、マーカーの発現の測定は、サンプル中のマーカー遺伝子の量を測定するための手段によって行うことができる。そのような手段は当技術分野で公知であり、例えば、マーカー遺伝子のDNAの全部若しくは一部の配列又はその相補配列を含むプライマーDNA又はプローブDNAがある。該プライマーDNA又はプローブDNAは、被験者由来のサンプル中に発現しているマーカー遺伝子のmRNA又は該mRNAに対応するcDNAと特異的に結合して、サンプル中のマーカー遺伝子の発現を検出することが可能である。
【0043】
プライマーDNA及びプローブDNAは、マーカー遺伝子のDNAの塩基配列に基づいて、公知のプログラムにより容易に設計することができ、また当業者に公知の方法に従って調製することができる。具体的には、マーカー遺伝子の塩基配列、例えば配列番号1、3、5、7、9、11、13又は15に示される塩基配列及びその相補配列に基づいて設計することができる。プライマーとして実質的な機能を有するDNAの長さとしては、10塩基以上が好ましく、さらに好ましくは15〜50塩基であり、さらに好ましくは20〜30塩基である。またプローブとして実質的な機能を有するDNAの長さとしては、10塩基以上が好ましく、さらに好ましくは15〜50塩基であり、さらに好ましくは20〜30塩基である。さらに、当業者には周知のように、プライマーDNA又はプローブDNAには、アニーリング又はハイブリダイズする部分以外の配列、例えばタグ配列などの付加配列が含まれていてもよい。
【0044】
被験者由来のサンプルにおけるマーカー遺伝子の発現を測定するためには、上記プライマーDNA及び/又はプローブDNAをそれぞれ増幅反応又はハイブリダイゼーション反応において用い、その増幅産物又はハイブリッド産物を検出する。そのような反応を行う場合には、通常は、当技術分野で周知の方法を使用して被験者由来のサンプルからmRNA又は該mRNAに対応するcDNAを調製する。例えば、RNAを抽出する場合には、グアニジン−塩化セシウム超遠心法、ホットフェノール法、又はチオシアン酸グアジニウム−フェノール−クロロホルム(AGPC)法などを利用することができる。cDNAは、公知の逆転写酵素を利用して調製することができる。以上のように調製したサンプルを用いて、以下に示す増幅反応及び/又はハイブリダイゼーション反応を行う。
【0045】
プライマーDNAを用いてmRNA又はcDNAを鋳型とした増幅反応を行い、その特異的増幅反応を検出することにより、サンプル中のマーカー遺伝子の発現の測定を行うことができる。増幅手法としては、特に限定されないが、ポリメラーゼ連鎖反応(PCR)法の原理を利用した公知の方法(PCR、RT-PCR、リアルタイムPCRなど)を挙げることができる。増幅産物の検出には、増幅反応により得られる増幅産物を特異的に認識することができる公知の手段を用いることができる。例えば、アガロースゲル電気泳動法等を利用して、特定のサイズの増幅断片が増幅されているか否かを確認することにより、特異的な増幅反応を検出することができる。
【0046】
あるいは、増幅反応の過程で取り込まれるdNTPに、放射性同位体、蛍光物質、発光物質などの標識体を作用させ、この標識体を検出することができる。放射性同位体としては、32P、125I、35Sなどを用いることができる。また蛍光物質としては、例えば、フルオレセインイソチオシアネート(FITC)、スルホローダミン(SR)、テトラメチルローダミン(TRITC)などを用いることができる。また発光物質としてはルシフェリンなどを用いることができる。これら標識体の種類や標識体の導入方法等に関しては、特に制限されることはなく、従来公知の各種手段を用いることができる。例えば標識体の導入方法としては、放射性同位体を用いるランダムプライム法が挙げられる。
【0047】
標識したdNTPを取り込んだ増幅産物を観察する方法としては、上述した標識体を検出するための当技術分野で公知の方法であればいずれの方法でもよい。例えば、標識体として放射性同位体を用いた場合には、放射活性を、例えば液体シンチレーションカウンター、γ-カウンターなどにより計測することができる。また標識体として蛍光を用いた場合には、その蛍光を蛍光顕微鏡、蛍光プレートリーダーなどを用いて検出することができる。
【0048】
また、プローブDNAを用いてサンプルに対するハイブリダイゼーション反応を行い、その特異的結合(ハイブリッド)を検出することにより、マーカー遺伝子の発現を測定することもできる。ハイブリダイゼーション反応は、プローブDNAがサンプル中のマーカー遺伝子のmRNA又はcDNAのみと特異的に結合するような条件、すなわちストリンジェントな条件下で行う必要がある。ハイブリダイゼーションを行う場合には、プローブDNAに蛍光標識(フルオレセイン、ローダミンなど)、放射性標識(32Pなど)、ビオチン標識等の適当な標識を付加することができる。
【0049】
標識化プローブDNAを用いた検出は、サンプル又はそれから調製したmRNA若しくはcDNAとプローブDNAとをハイブリダイズ可能なように接触させることを含む。具体的には、サンプル又はmRNA若しくはcDNAを適当な固相に固定化し、標識を付加したプローブDNAを添加することにより、あるいは標識プローブDNAを適当な固相に固定化し、サンプル又はmRNA若しくはcDNAを添加することにより、プローブDNAとサンプル又はmRNA若しくはcDNAとを接触させてハイブリダイゼーション反応を行い、ハイブリダイズしなかったプローブDNAを除去した後、サンプル又はmRNA若しくはcDNAとハイブリダイズしているプローブDNAの標識を検出する。標識が検出された場合には、サンプル中にマーカー遺伝子のmRNAが発現していることとなる。標識化プローブDNAを用いた発現の測定方法の例としては、サザンハイブリダイゼーション法、ノーザンハイブリダイゼーション法等を挙げることができる。
【0050】
以上のようにして、マーカーの発現を測定する手段を用いてサンプル中のマーカーの発現を測定し、その結果に基づいて筋ジストロフィーを診断することが可能である。本診断薬により診断の対象となるのは筋ジストロフィーであり、特にデュシェンヌ型筋ジストロフィーである。本明細書中、「筋ジストロフィーの診断」とは、被験者における筋ジストロフィーの保因を判定すること、筋ジストロフィーの発症を予測することを意味する。また本発明において「診断」は、既に診断された筋ジストロフィーの継続的なモニタリング、及び既に行った筋ジストロフィーの診断の確認も包含する。
【0051】
本発明の目的である診断は、診断しようとする被験者の全て(すなわち100%)について必ず正しい結果が得られることを意図するものではない。本発明においては、「診断」は、被験者を統計学的に有意な確率で診断できることを意図しており、例えば被験者の少なくとも60%、少なくとも80%又は少なくとも90%を、本発明によって適切に診断することができる。
【0052】
診断を行う際、被験者由来のサンプル中のマーカーの発現を、基準値と比較する。基準値は、健常者サンプルにおけるマーカーの発現の測定値、筋ジストロフィーの保因者又は発症者であると診断がなされた患者サンプルにおけるマーカーの発現の測定値などである。個々の被験者に適用する基準値は、マーカーの種類、被験者の種類、年齢などの様々な生理学的パラメータに応じて変化しうる。具体的な判定基準としては、被験者のサンプルにおけるマーカーの発現量が健常者のそれと比較して、10%以上、好ましくは30%以上、さらに好ましくは70%以上、最も好ましくは100%以上である場合には、筋ジストロフィーの可能性があると診断することができる。
【0053】
さらに筋ジストロフィーの診断は、他の公知の筋ジストロフィーの診断方法と組み合わせて行ってもよい。そのような公知の診断方法としては、血清クレアチンキナーゼ(CK)値の測定、単離骨格筋の張力測定、組織学的な筋最大直径及び中心核線維の頻度の計測、多重連鎖反応依存性プローブ増幅(Multiplex Ligation-dependent Probe Amplification:MLPA)法、ポリメラーゼ連鎖反応(PCR)法/シークエンス法による遺伝子変異の同定、あるいは抗ジストロフィン抗体を用いた免疫組織化学法又はウエスタンンブロット法によるジストロフィンタンパク質の定性・定量的解析法が挙げられる。
【0054】
本診断薬は、マーカーの発現を測定する手段以外にも診断に有用な他の成分を含んでもよく、それにより、マーカーの発現の測定を容易かつ簡便に行うことができ、筋ジストロフィーを診断することができる。
【0055】
本診断薬の一例は、免疫アッセイ用試薬セットであり、少なくともマーカータンパク質に対する抗体試薬を含む。さらに、希釈や洗浄用緩衝液、標準抗原、各抗体試薬に特異的に結合をする標識抗体試薬、発色・発光・蛍光を生じさせる基質試薬、手順と評価方法を記載した手順書等を含んでもよい。キットに含まれる抗体は、予め標識されたものであってもよいし、又は標識されていなくてもよい。また抗体は、固相支持体(例えば、メンブレン、ビーズ等)に固定されていてもよい。また本発明の診断薬の別の例は、質量分析用試薬セットであり、例えば同位体標識試薬、分画用ミニカラム、緩衝液、手順書等により構成される。本発明の診断薬のさらに別の例は、サンプル中のマーカー遺伝子の発現を測定するための手段(プライマーDNA、プローブDNAなど)を含むものであってもよい。
【0056】
本発明の診断薬は、該診断薬を使用するための手順及びプロトコールを記載した説明書、筋ジストロフィーの診断において使用する基準値又は基準範囲を示した表などを含んでもよい。
【0057】
本発明の診断薬に含まれる構成要素は、個別に提供されてもよいし、又は単一の容器内に提供されてもよい。好ましくは、本発明の診断薬は、必要な構成要素の全てを、即時に使用することができるように、例えば調整された濃度の構成要素として含む。
【0058】
さらに、上記マーカーを利用して、筋ジストロフィーの治療薬又は治療法の有効性を評価したり、筋ジストロフィーの治療薬又は治療法の候補をスクリーニングすることができる。すなわち、筋ジストロフィー発症動物若しくは筋ジストロフィー保因動物、又は筋ジストロフィー発症動物若しくは筋ジストロフィー保因動物に由来する筋細胞(例えば横隔膜細胞)を、被験治療薬又は治療法で処置し、該動物又は筋細胞におけるマーカーの発現を測定することによって、該被験治療薬又は治療法がマーカーの発現、すなわち筋ジストロフィーに影響を及ぼすか否かを判定することができる。
【0059】
本発明に係るスクリーニング方法(以下、「本スクリーニング方法」ともいう)、及び治療薬又は治療法の有効性を評価する方法(以下、「本評価方法」ともいう)においては、まず、筋ジストロフィー発症動物又は筋ジストロフィー保因動物を被験治療薬又は治療法で処置するか、あるいは筋ジストロフィー発症動物又は筋ジストロフィー保因動物に由来する筋細胞を被験治療薬又は治療法で処置する。
【0060】
本方法では、筋ジストロフィー発症動物又は筋ジストロフィー保因動物からサンプルを採取し、該サンプル中のマーカーの発現を測定する。あるいは、筋細胞におけるマーカーの発現を測定する。好ましくは、被験治療薬又は治療法による処置を行う前に、筋ジストロフィー発症動物又は筋ジストロフィー保因動物からサンプルを採取し、サンプル中のマーカーの発現を測定するか、あるいは筋細胞におけるマーカーの発現を測定する。筋ジストロフィー発症動物又は筋ジストロフィー保因動物、あるいは筋ジストロフィー発症動物又は筋ジストロフィー保因動物に由来する筋細胞を被験治療薬又は治療法で処置した後、適当な時期に、サンプル又は細胞中のマーカーの発現を測定する。例えば、処置の直後、30分後、1時間後、3時間後、5時間後、10時間後、15時間後、20時間後、24時間(1日)後、2〜10日後、10〜20日後、20〜30日後、1ヶ月〜6ヵ月後にマーカーの発現を測定する。サンプルの採取、サンプル中のマーカーの発現の測定については、前記と同様に行うことができる。
【0061】
対象となる動物は、筋ジストロフィーを発症した又は保因しているヒトであってもよいし、あるいは筋ジストロフィーモデル動物、好ましくは筋ジストロフィーモデル実験動物(マウス、イヌ、ラットなど)であってもよい。例えば、筋ジストロフィーのモデルマウス(mdxマウス:Sicinski, P. et al., Science 244:1578-1580, 1989)、筋ジストロフィーのモデルイヌ(c-xmdイヌ:Komegay, J.N. et al., Muscle Nerve 11:1056-1064, 1988;CXMDJイヌ:Shimatsu Y et al., Exp Anim. 52:93-7. 2003、Shimatsu Y et al., Acta Myol. 24:145-54. 2005)、筋ジストロフィーのモデルネコ(HFMDネコ:Vos, J. H. et al., J. Comp. Pathol. 96:335-41, 1986)などを用いることができる。一般的には、モデル動物において被験治療薬又は治療法の有効性が確認された後に、ヒトにおいて、例えば臨床試験などにより有効性の評価が行われる。
【0062】
本スクリーニング方法及び本評価方法の対象となる被験治療薬又は治療法の種類は特に限定されるものではない。例えば、被験治療薬又は治療法は、任意の物質的因子、具体的には、天然に生じる分子、例えば、アミノ酸、ペプチド、オリゴペプチド、ポリペプチド、タンパク質、核酸、脂質、炭水化物(糖等)、ステロイド、グリコペプチド、糖タンパク質、プロテオグリカンなど;天然に生じる分子の合成アナログ又は誘導体、例えば、ペプチド擬態物、核酸分子(アプタマー、アンチセンス核酸、二本鎖RNA(RNAi)等)など;天然に生じない分子、例えば、コンビナトリアルケミストリー技術等を用いて作成した低分子有機化合物(無機及び有機化合物ライブラリー、又はコンビナトリアルライブラリー等)など;並びにそれらの混合物を挙げることができる。また治療薬又は治療法は、単一物質であってもよいし、複数の物質から構成される複合体や、転写因子等であってもよい。さらに、被験治療薬又は治療法は、上記のような物質的因子に加えて、放射線、紫外線などであってもよい。
【0063】
また、被験治療薬又は治療法としては単一の治療薬又は治療法を独立に試験しても、いくつかの候補となる被験治療薬又は治療法の混合物(ライブラリーなどを含む)について試験をしてもよい。複数の被験治療薬又は治療法を含むライブラリーとしては、合成化合物ライブラリー(コンビナトリアルライブラリーなど)、ペプチドライブラリー(コンビナトリアルライブラリーなど)などが挙げられる。
【0064】
動物を被験治療薬又は治療法で処置する場合には、その処置量、処置期間、処置経路などの処置条件は、被験治療薬又は治療法の種類などにより異なるが、当業者であれば容易に決定することができる。例えば、動物に被験治療薬を投与する場合の投与経路は、被験治療薬の種類、使用する動物の種類などに応じて、筋肉内注射、経口投与、静脈注射、腹腔内注射、経皮投与、皮下注射等の投与形態を適宜使用することができる。
【0065】
筋細胞は、当技術分野で公知の方法により、例えば上述した方法で採取することができる。あるいは、市販の筋細胞又は公に入手可能な筋細胞を使用することも可能である。細胞を被験治療薬又は治療法と接触させる場合、その接触の条件は、その治療薬又は治療法の種類により異なるが、当業者であれば容易に決定することができる。例えば、そのような接触は、筋細胞を被験治療薬を添加した培地中で培養することにより、筋細胞を被験治療薬を含む溶液中に浸漬することにより、又は筋細胞上に被験治療薬を積層することにより行うことができる。
【0066】
また、被験治療薬又は治療法の効果及び有効性は、いくつかの条件で検討することも可能である。そのような条件としては、被験治療薬又は治療法で処置する時間又は期間、量(大小)、回数などが挙げられる。例えば、被験治療薬の希釈系列を調製するなどして複数の用量を設定することができる。被験治療薬又は治療法の処置期間も適宜設定することができるが、例えば、1日から数週間、数ヶ月、数年の期間にわたって処置を行うことができる。
【0067】
さらに、複数の治療薬及び/又は治療法の相加作用、相乗作用などを検討する場合には、被験治療薬及び/又は治療法を組み合わせて用いてもよい。
【0068】
続いて、動物又は細胞におけるマーカーの発現を測定する。マーカーの発現の測定は、上述したように行うことができる。マーカーの発現を測定した後、対照と比較し、マーカーの発現を低減する被験治療薬又は治療法を選択する。対照としては、被験治療薬又は治療法による処置を受けていない動物又は細胞などを用いることができる。
【0069】
また、本発明においては、一次スクリーニングとして、筋細胞を被験治療薬又は治療法で処置し、該筋細胞におけるマーカーの発現を測定して発現低減を示した被験治療薬又は治療法を選択し、次に二次スクリーニングとして、選択した被験治療薬又は治療法で動物を処置し、該動物におけるマーカーの発現を測定して発現低減を示した被験治療薬又は治療法を選択してもよい。
【0070】
さらに、治療薬又は治療法のスクリーニングにおいては、さらに、選択された被験治療薬又は治療法を、筋ジストロフィーモデル動物に投与して、被験治療薬又は治療法がモデル動物における筋ジストロフィーの発症、進行又は症状に影響を及ぼすか否かを判定してもよい。被験治療薬又は治療法がモデル動物における筋ジストロフィーの発症、進行又は症状に影響を及ぼすか否かの判定は、モデル動物の種類、判定しようとする症状、要因などにより異なるが、当業者であれば、筋ジストロフィーに及ぼす影響を適宜判定することができる。例えば、筋疾患又は筋障害に及ぼす影響を判定する場合には、筋力、血清クレアチンキナーゼ値の測定、単離骨格筋の張力測定、組織学的な筋最大直径及び中心核線維の頻度の計測などを行うことができる。
【0071】
上述のようにして、筋ジストロフィーの改善(例えば、症状の改善、発症若しくは進行の遅延)が認められる場合の被験治療薬又は治療法は、筋ジストロフィーの治療又は予防のための医薬の候補として選択することができる。
【0072】
以上から、本スクリーニング方法及び本評価方法により、筋ジストロフィーを治療又は予防するための治療薬又は治療法を同定し、さらには治療薬又は治療法の有効性を確認することができる。
【0073】
さらに、c-Fos、EGR1、IL-6又はIL-8は、発症時(生後)に発現が増大することから、c-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つの発現又は活性を阻害することにより、筋ジストロフィーを治療又は予防することができる。従って、本発明は、c-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つの発現又は活性を阻害又は抑制する手段を含むことを特徴とする筋ジストロフィーの治療又は予防薬にも関する。そのような手段としては、遺伝子の発現を阻害又は抑制する手段、例えばアンチセンス核酸、RNAiを利用する方法(マイクロRNA、siRNAなど)、及びタンパク質の発現を阻害又は抑制する手段、例えば抗体、アプタマー核酸などが挙げられる。
【実施例】
【0074】
以下、本発明を実施例及び図面によりさらに具体的に説明する。ただし、以下の実施例は、本発明を限定するものではない。
[実施例1]血清クレアチニンキナーゼ(CK)の変化
分娩時のストレスが新生児に筋障害を与えうること、帝王切開によりそのストレスを減らすことの報告を元に、予定的帝王切開を導入し、正常犬、保因犬及び筋ジス犬において自然分娩と帝王切開後の血清CK値の違いについて検討した。なお、保因犬とは、ジストロフィン遺伝子に変異を有している雌個体を意味する。すなわち、ヒト及び犬の染色体は23対、計46本の染色体から成り立っているが、このうち22対は常染色体であり、1対、2本は男女を決定する性染色体である。雄犬(男)がXとY染色体から成るのに対し、雌犬(女性)は2本のX染色体から構成される。筋ジストロフィーの原因遺伝子であるジストロフィン遺伝子はX染色体上に位置し、X染色体連鎖性遺伝を示すため、変異を有しているX染色体を持つ雄個体は発症する。2本のうち1本のX染色体のジストロフィン遺伝子に変異を有している雌個体は保因犬(保因者)と呼ばれる。この保因犬とオスの正常犬を交配させることで筋ジス犬が得られるが、保因犬は、通常無症状であるが、時に筋ジス犬と正常犬の中間的な症状を呈することがあり、症候性の保因犬と呼ばれる。
【0075】
対象には、国立精神・神経センター(現国立精神・神経医療研究センター)、神経研究所中型実験動物研究施設の筋ジス犬繁殖コロニーにおいて2001年12月から2008年4月の間に自然分娩(39回)によって得られた正常犬71頭、保因犬37頭、筋ジス犬34頭、及び予定的帝王切開(28回)より得られた正常犬39頭、保因犬26頭、筋ジス犬41頭を用いた。予定的帝王切開は、LHサージ法(Witness(登録商標) LH,Synbiotics,Kansus City,MO,USA)により想定された日時、又は妊娠保因犬の体温が急速に低下した時点で施行した(Kobayashi M, et al., Muscle Nerve 2009; 40: 815-826)。妊娠保因犬の帝王切開における麻酔の導入から維持にはイソフルラン(2.0〜3.0%)を用いた。新生仔の蘇生術は、獣医師及び獣医師の監視下で動物取り扱い技術者の資格を有し、蘇生術に経験を有する者が行った。蘇生後の犬に対し呼吸促進剤であるドキソプラムを使用し、酸素補給が行われた箱内で、乾燥かつ保温されたタオルの上に置かれた。
【0076】
血清クレアチニンキナーゼ(CK)値の経時的変化(臍帯血及び蘇生後30分、1、2、4、8、24、及び48時間後)を見るために、予定的帝王切開(3回)から得られた正常犬5頭、保因犬3頭、及び筋ジス犬6頭を用いた。また、帝王切開で得られた各群の犬各4頭を病理学的及び分子生物学的解析に供した。本研究は、国立精神・神経センター(現国立精神・神経医療研究センター)神経研究所 中型実験動物倫理問題検討委員会により承認(承認番号:13-03、14-03、15-03、16-03、17-03、18-03、19-04、及び20-04)を受け、同研究所の動物実験指針に従い実施した。
【0077】
血清クレアチニンキナーゼ(CK)の測定は、臍帯血又は静脈血を室温で10分間の1,800gの遠心を行って血清を分離した後、比色法(FDC3500,FujiFilm,Tokyo,Japan)により測定した。
【0078】
また、安楽死後、横隔膜を凍結固定し、7μmに薄切した後にヘマトキシリン・エオジン(H&E)染色及びカルシウム染色法であるアリザリン・レッド染色(pH 4.1)を行った。
【0079】
なお、2群間のデータの比較にはstudent-t検定を、死亡率の検定にはカイ二乗検定を用いた。データは平均値±標準誤差を用いて示し、p < 0.05を有意差ありと判定した。
【0080】
その結果、帝王切開後の血清CK値は正常犬及び保因犬では有意に低下していたが、筋ジス犬では低下は見られなかった(図1のA)。以上の結果は、分娩時のストレスが新生仔筋ジス犬の高CK血症の主たる原因ではないことを示唆している。出生直後には呼吸開始という重要な過程があるため、高CK血症の原因が肺呼吸開始に関連しているか否かを検討する目的で、帝王切開により得た新生仔に対し臍帯血(呼吸開始前の条件を反映)と呼吸開始1時間後の頸静脈血の血清CK値を比較検討した。呼吸開始後の血清CK値の値は、正常犬及び保因犬の臍帯血CK値との間に違いは見られなかった。
【0081】
一方、筋ジス犬の臍帯血CK値は正常犬の臍帯血に比べて既に約5倍高値を示していたが、筋ジス犬の呼吸開始後の静脈血CK値はさらに筋ジス犬臍帯血の約35倍、正常犬の呼吸開始後静脈血の約150倍に増加していた(図1のB)。各犬群で血清CK値は、呼吸開始後30分までに急速に増加し、呼吸開始後4〜8時間後の間にピークに達して48時間後には臍帯血CK値のレベルまでに戻っていたが、一定して筋ジス犬では高値を示していた(図1のC)。
【0082】
呼吸開始前の横隔膜の病理では、カルシウム陽性opaque線維数が散見されるのみで(矢印)、筋の基本的構築は保たれていた。一方、呼吸開始後では、多数のカルシウム陽性opaque線維数(矢印)、間質の増大を示し、硝子様変性像を呈し、好中球などの炎症細胞の浸潤はほとんど見られなかった(図2)。
【0083】
以上の結果から、呼吸開始による急激な機械的負荷により、横隔膜の筋線維の断裂を含む著しい筋障害が起こったと考えられた。一般にDMDでは出生時に呼吸障害は認めないが、未熟児においては呼吸障害が高度であることが報告されている(Phadek A, et al., Anesth Analg 2007; 105: 977-980)。筋ジス犬とDMDの呼吸障害の出現時期の違いは、筋ジス犬を含めイヌでは筋発達が他の動物やヒトに比べてかなり遅れていることから(Lanfossi M, et al., Acta Neuropathol 1999; 97: 127-138)、出生時の筋成熟の違いが関連している可能性がある。また、血清CK値の経時的観察から生後48時間後には全犬で臍帯血のレベルまで戻っていたが、筋ジス犬は高値を示していたことは、少なくとも生後2日以降には正常犬や保因犬で見られた分娩の影響はなくなっていると考えられ、同時点での血清CK値を用いた新生児のスクリーニングが可能であることを示唆している。DMDの早期診断は、将来の家族計画や今後開発されるうる治療法を早期より検討する上で重要と考えられるため、新生児期の様々な時点において血清CK値を測定することで、DMDの新生児スクリーニングの時期について新たな知見が得られる可能性がある。
【0084】
[実施例2]横隔膜における遺伝子発現の変化
本実施例では、cDNAマイクロアレイを用いて、筋ジス犬の横隔膜において呼吸開始前後で発現が増加している遺伝子について検討した。具体的には、呼吸開始前の正常犬と筋ジス犬新生仔は帝王切開で摘出し、蘇生前に剖検を行った(各4頭)。また、呼吸開始後の正常犬及び筋ジス犬新生仔は、蘇生1時間後に剖検を行った(各4頭)。採取し、凍結保存した横隔膜からRNeasy Mini Kit(Qiagen,Hilden,Germany)を用いてtotal RNAを抽出した。RNA濃度は、NanoDrop ND-1000 UV-分光光度計(NanoDrop Technologies,Wilmington,DE,USA)を用いて測定した。RNAの質を、Agilent Bioanalyzer 2100(Agilent Technologies,Santa Cruz,CA,USA)で検定した。個々のtotal RNA(500ng)は犬用のwhole genome oligo microarray 44K(Agilent Technologies)にアプライし、ハイブリダイゼーションはBio Matrix Research社(流山,千葉)で行った。蛍光イメージはAgilent Technologies microarray scanner(Agilent Technologies)を用いて得た。標準化はGeneSpring 10.0(Tomy Digital Biology,Denver,CO,USA)を用いてチップ間の遺伝子を比較して行った。正常犬と筋ジス犬の呼吸開始前と呼吸後の間で発現量に違いのある遺伝子を、ANOVA検定を行った後、Benjamini and Hochberg法による多群間検定を行って選別した。
【0085】
また、マイクロアレイの結果から各群間で10倍以上に発現が増加していた遺伝子については、定量的PCR法(リアルタイムPCR)を用いて検定を行った。用いた各個体のtotal RNAはcDNAマイクロアレイに用いたものと同じtotal RNAを使用した。18s RNA(内部コントロール)、オステオポンチン、c-fos、egr-1、IL6、及びIL8の各遺伝子の増幅用プライマーを設計した(表2)。
【0086】
【表2】

【0087】
リアルタイムPCRは、SYBR mixed Ex Taq II kit(Takara)を用いて95℃20秒間、60℃1分間の40サイクルのPCR反応をBioRad iCycler system(BioRad)で行った。各遺伝子の発現量は18s RNAに対する相対値[(Ct/18s RNA−Ct/目的の遺伝子)]として求めて、呼吸開始前後の正常犬及び筋ジス犬との多群間比較を行った。
【0088】
さらに、上記遺伝子に対応するタンパク質について、ウエスタンブロット法及び免疫組織化学法によるタンパク質の測定も実施した。ウエスタンブロット法は、以下の通り行った。すなわち、凍結固定した横隔膜をサンプルバッファー(62.5mM Tris-HCl,pH 6.8,2% SDS,10%グリセロール)でホモジナイズし、遠心分離(15,000g,10分間)後に上澄を採取した。DC Assayキット(BioRad,CA,USA)を用いてタンパク質濃度を測定した後、95℃で5分間の熱変性を行い、40μgをウエスタンブロットに供した。PVDF転写膜は0.1% Tween 20を含むトリス緩衝生理食塩水(TBST)+5%スキムミルクでブロッキングを行い、一次抗体を用いて4℃で16時間のインキュベーションを行った。一次抗体にはオステオポンチン(Rb-9097,Thermo Fisher Scientific)、c-Fos(#2250,Cell Signaling Technology)、EGR1(sc-189,Santa Cruz Biotechnology)、IL-6(AF1609,R&D Systems,Minneapolis,MN,USA)、及びIL-8(ab34100,Abcam)を用いた。転写膜をTBST液で洗浄後、二次抗体(マウス又はウサギ特異的HRP標識抗体)でインキュベートを行い、再度TBST液で洗浄し、ECL-Plus Western Blotting Detection System(GE HealthCare,Buckinghamshire,UK)で検出した。
【0089】
また、免疫組織化学は、薄切した凍結固定標本を15分間乾燥後、5%ウシ血清アルブミン(BSA)又は熱不活化正常ヤギ血清アルブミンを含むリン酸緩衝生理食塩水(PBS)(pH 7.4)で洗浄し、一次抗体で4℃で16時間のインキュベートを行った。一次抗体には、CD18(MCA1780,AbD Serotec,Oxford,UK)、CD68(M0876,Dako,Denmark)、CD11b(MCA1777S,AbD Serotec)、C5b-9(ab66768,Abcam,Cembridge,UK)、cleaved-caspase 3(#9661,Cell Signaling Technology,Beverly,MA,USA)、LC3(#4108、Cell Signaling Technology)、オステオポンチン(Rb-9097,Thermo Fisher Scientific,Waltham,MA,USA)、c-Fos(#2250,Cell Signaling Technology)、EGR1(#4153,Cell Signaling Technology)、IL-6(sc-80108、Santa Cruz Biotechnology,Sacta Crus,CA,USA)、及びIL-8(109-401-311,Rockland Immunohistochemical,Gilbertsville,PA,USA)を用いた。PBSを用いて室温で洗浄後、FITCで標識した二次抗体を用いて室温でインキュべート後に再びPBSで洗浄し、蛍光顕微鏡で観察した。
【0090】
なお、2群間のデータの比較にはstudent-t検定を、死亡率の検定にはカイ二乗検定を用いた。また、リアルタイムPCRのデータにおける多群間比較には、ANOVA検定を行った後、Tukey's法による多群間検定を行った。データは平均値±標準誤差を用いて示し、p < 0.05を有意差ありと判定した。
【0091】
その結果、呼吸開始前の筋ジス犬では、オステオポンチンが正常犬横隔膜の約27倍に著しく発現しており、タンパク量の増加と筋細胞質内及び間質に局在することを確認した(図3〜6)。また、オステオポンチンは呼吸開始後の筋ジス犬横隔膜においても高い発現を有していた。オステオポンチンは、ジストロフィン欠損筋の再生早期に高発現していること(Hirata A, et al., Am J Pathol 2003; 163: 203-205)や、線維化の促進に関連すること(Vetrone SA, et al., J Clin Invest 2009; 119: 1583-1594)が報告されている。オステオポンチンの活性化は、stretch-activated channelにより流入した細胞内カルシウムイオンによって起こり(Allen DG, et al., Can J Physiol Pharmacol 2010; 88: 83-91)、好中球やマクロファージを誘導するサイトカインとしての役割を有している(Wang KX, et al., Cytokine Growth Fact 2008; 19: 333-345)。本発明者のデータと既報告を考え合わせると、オステオポンチンは、筋ジストロフィーの病態のより早期の段階から発現して炎症細胞を誘導することなどに関連し、さらに後期に起こる線維化にも関与していると考えられ、DMDの病態に本質的な役割を担っている可能性がある。なお現在、DMDに対する治療における標的分子の一つとして考えられている(Vetrone SA, 2009、及びQureshi MM, et al., J Diet Suppl 2001; 7: 159-178)。
【0092】
呼吸開始後の筋ジス犬横隔膜では、転写因子/シグナル伝達分子であるc-fos及びegr-1が筋細胞核及び細胞質に強く発現していた(図7〜10)。即初期遺伝子であるc-fos及びegr-1は局所的な細胞内カルシウムイオン濃度により制御され(Schaefer A, et al., Biochem J 1998; 355: 505-511; Grembowicz KP, et al., Mol Biol Cell 1999; 10: 1247-1257)、下流の様々な遺伝子を誘導する。また、炎症/免疫応答遺伝子であるIL-6及びIL-8の発現も筋ジス犬横隔膜で著しく増加し、筋細胞質に局在していた(図7〜10)。IL-6及びIL-8は、それぞれEGR1(Schuringa JJ, et al., Cytokine 2001; 14: 78-87)及びc-Fos(Cullen EM, et al., Mol Immunol 2010; 47: 1701-1709)の下流遺伝子であり、ともに筋細胞内で産生されるサイトカイン(マイオカイン)として運動後の正常骨格筋において発現が増加することが報告されている(Pedersen BK, et al., J Appl Physiol 2007; 103: 1093-1098)。IL-6は、正常骨格筋の代謝恒常性の維持に関わっている可能性が指摘されているが(Febbraio MA, et al., FASEB J 2002; 16: 1335-1347)、機械的負荷後のジストロフィー筋における炎症誘発的な役割を担っているかもしれない。IL-8は傷害部位における好中球の誘導に関連する主なケモカインである(Peterson JM, et al., J Appl Physiol 2009; 106: 130-137)。抗体を用いた好中球の除去がmdxマウス筋壊死を減少させたことから、好中球がジストロフィーの初期の病態の中心的な役割を担っていることが報告されている(Hodgetts S, et al., Neuromuscl Disord 2006; 16: 591-602)。以上のデータから、ジストロフィー筋における機械的負荷から炎症性細胞が浸潤するまでの分子機構を明らかにしたと考えられる。
【0093】
以上から、c-fos、erg-1、IL-6及びIL-8は、筋ジス犬において呼吸開始後から高発現され、これらを筋ジストロフィーのマーカーとして使用できることがわかった。
【配列表フリーテキスト】
【0094】
配列番号17〜28:人工配列(プライマー)
【技術分野】
【0001】
本発明は、筋ジストロフィーの新規マーカーに基づいており、具体的には筋ジストロフィー診断薬に関する。また本発明は、筋ジストロフィーの治療薬又は治療法のスクリーニング方法、及び筋ジストロフィーの治療薬又は治療法の有効性の評価方法に関する。
【背景技術】
【0002】
筋ジストロフィーは進行性に全身の筋萎縮と筋力低下を引き起こす遺伝性疾患の総称である。筋ジストロフィーにおいて、デュシェンヌ(Duchenne)型筋ジストロフィー(DMD)はX染色体連鎖性遺伝を示し、出生男児3,500人に1人と最も頻度が高い。一般に、2〜5歳に歩行障害で発症し、13歳までに歩行不能となり、30歳前後で呼吸不全又は心不全により死亡する極めて重篤な疾患である。DMDは、筋形質膜に存在するジストロフィンをコードするジストロフィン遺伝子の変異により発症する。ジストロフィンは筋収縮及び弛緩の間に、筋線維の安定化と細胞内カルシウムの恒常性を維持する機能を有しているとされるが(非特許文献1)、ジストロフィンの欠損によって筋形質膜は脆弱となり、筋細胞内カルシウム濃度が増加して、様々なタンパク質分解酵素(プロテアーゼ)の活性化や筋壊死が起こると考えられている(非特許文献2)。治療法の開発には筋ジストロフィーの病態機序の理解が重要であり、このためにはモデル動物が必要不可である。しかし、最も頻用されるDMDの動物モデルであるmdxマウスは、筋壊死同様に筋再生も非常に活発であり(非特許文献3)、筋変性の分子機構は十分には明らかにされていない。
【0003】
新生児DMDにおいて血清又は血漿クレアチンキナーゼ(CK)値が高値であることが古くより報告されている(特許文献1及び非特許文献4〜7)が、その原因については十分解明されてはおらず、DMDの新生児診断も確立されていない。一方、他のDMDモデル動物である筋ジストロフィー犬(以下、「筋ジス犬」ともいう)は、出生時の血清CK値が著しい高値を示し、新生仔期の死亡率も高い(非特許文献8及び9)が、その詳細な原因は不明であった。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2005−130773号公報
【非特許文献】
【0005】
【非特許文献1】Infante JP, et al., Mol Cell Biochem 1999; 195: 155-167.
【非特許文献2】Hopf FW, et al., Am J Physiol 1996; 271: C1325-C1339.
【非特許文献3】Tanabe Y, et al., Acta Neuropathologica (Berl) 1986; 69: 91-95.
【非特許文献4】Heyck H, et al., Klin Wescher 1966; 44 695-700.
【非特許文献5】Demos J., Am J Phys Med 1971; 50: 271-284.
【非特許文献6】Zellweger H, et al., Pediatrics 1975; 55: 3-4.
【非特許文献7】Ionasescu V, et al., Lancet 1978; 2: 1251.
【非特許文献8】Valentine BA, et al., J Neurol Sci 1988; 88: 69-81.
【非特許文献9】Shimatsu Y, et al., Acta Myologica 2005; 24: 145-154.
【発明の概要】
【発明が解決しようとする課題】
【0006】
筋ジストロフィーでは筋障害や壊死により血清CKが著しく高い値を示すことから診断に用いられてきたが、運動や安静により値が容易に変動するために診断や病勢の把握には十分ではないことが指摘されてきた。
【0007】
従って、本発明の課題は、筋ジストロフィーの発症に関係する新規マーカーを提供し、筋ジストロフィーの発症機構を解明すると共に、筋ジストロフィーの診断及び治療のための手段を提供することである。
【課題を解決するための手段】
【0008】
本発明者は、上記課題を解決するため鋭意検討を行った結果、筋ジストロフィーに関連する4つの新規なマーカー、すなわちc-Fos、EGR1、IL-6及びIL-8を見出し、これらのマーカーの発現の測定を利用することによって、筋ジストロフィーを診断し、又は筋ジストロフィーの治療薬若しくは治療法をスクリーニングすることができるという知見を得、本発明を完成するに至った。
【0009】
すなわち、本発明は、以下の[1]〜[11]である。
[1]サンプルにおいてc-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つのマーカーの発現を測定するための手段を含むことを特徴とする筋ジストロフィー診断薬。
[2]測定手段がDNAプライマー及び/又はDNAプローブである、[1]に記載の診断薬。
[3]測定手段が抗体である、[1]に記載の診断薬。
[4]サンプルが、筋サンプル、血液サンプル及び血清サンプルからなる群より選択される、[1]〜[3]のいずれかに記載の診断薬。
[5]筋ジストロフィーの診断が、筋ジストロフィーの保因の判定又は筋ジストロフィーの発症の予測である、[1]〜[4]のいずれかに記載の診断薬。
【0010】
[6]被験者における筋ジストロフィーの診断方法であって、
(a)被験者からのサンプルにおいて、c-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つのマーカーの発現を測定するステップ、
(b)(a)の結果を基準と比較することにより、該被験者における筋ジストロフィーを診断するステップ
を含む方法。
【0011】
[7]筋ジストロフィーの治療薬又は治療法のスクリーニング方法であって、
(a)筋ジストロフィー発症動物又は筋ジストロフィー保因動物に由来する筋細胞を、被験治療薬又は治療法により処置するステップ、
(b)該筋細胞において、c-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つのマーカーの発現を測定するステップ、
(c)(b)の結果に基づいて被験治療薬又は治療法を筋ジストロフィーの治療薬又は治療法の候補として同定するステップ
を含む方法。
[8]筋ジストロフィーの治療薬又は治療法のスクリーニング方法であって、
(a)被験治療薬又は治療法による処置を受けた、筋ジストロフィー発症動物又は筋ジストロフィー保因動物からのサンプルにおいて、c-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つのマーカーの発現を測定するステップ、
(b)(a)の結果に基づいて被験治療薬又は治療法を筋ジストロフィーの治療薬又は治療法の候補として同定するステップ
を含む方法。
[9]被験治療薬又は治療法による処置を行う前に、筋細胞又はサンプルにおいて、c-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つのマーカーの発現を測定するステップをさらに含む、[7]又は[8]に記載の方法。
[10]筋細胞又はサンプルにおけるマーカーの発現が、非処置の筋細胞又はサンプルにおける同じマーカーの発現よりも低い場合には、被験治療薬又は治療法が筋ジストロフィーの治療薬又は治療法の候補として同定される、[7]〜[9]のいずれかに記載の方法。
【0012】
[11]筋ジストロフィーの治療薬又は治療法の有効性の評価方法であって、
(a)被験治療薬又は治療法による処置を受けた、筋ジストロフィー発症動物又は筋ジストロフィー保因動物からのサンプルにおいて、c-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つのマーカーの発現を測定するステップ、
(b)(a)の結果に基づいて被験治療薬又は治療法の有効性を評価するステップ
を含む方法。
[12]筋ジストロフィー発症動物又は筋ジストロフィー保因動物が、筋ジストロフィーを発症した若しくは保因しているヒト、又は筋ジストロフィーモデル動物である、[7]〜[11]のいずれかに記載の方法。
[13]c-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つの発現又は活性を阻害又は抑制する手段を含むことを特徴とする筋ジストロフィーの治療又は予防薬。
【発明の効果】
【0013】
本発明に係る筋ジストロフィー診断薬により、筋ジストロフィーの保因及び将来の発症を早期に診断及び予測することができ、筋ジストロフィーの早期治療に有用である。また、本発明に係る新規マーカーは、筋ジストロフィーとの関連性を有し、筋ジストロフィーの診断及び予測だけではなく、筋ジストロフィーの発症機序の解明、さらにはその治療や治療薬の開発などに用いることができる。
【図面の簡単な説明】
【0014】
【図1】正常犬、保因犬及び筋ジス犬における出生後クレアチニンキナーゼ(CK)値を示すグラフである。(A)自然分娩及び帝王切開で娩出された新生仔の出生後CK値。(B)新生仔の臍帯血及び呼吸開始後の静脈血血清CK値。(C)新生仔の血清CK値の経時的変化(呼吸開始前〜生後48時間後)。
【図2】呼吸開始前後の新生仔筋ジス犬の横隔膜の病理組織学的変化を示す写真である。
【図3】呼吸開始前(A)及び開始後(B)の正常犬及び筋ジス犬の横隔膜における遺伝子発現の変化をマイクロアレイを用いて調べた結果を示すグラフである。
【図4】呼吸開始前後の正常犬及び筋ジス犬の横隔膜におけるオステオポンチン発現の変化を定量PCRを用いて調べた結果を示すグラフである。
【図5】呼吸開始前後の正常犬及び筋ジス犬の横隔膜におけるオステオポンチン発現の変化をウエスタンブロットを用いて調べた結果を示す写真である。
【図6】呼吸開始前後の正常犬及び筋ジス犬の横隔膜におけるオステオポンチン発現の変化を免疫組織化学を用いて調べた結果を示す写真である。
【図7】呼吸開始前後の筋ジス犬の横隔膜における遺伝子発現の変化をマイクロアレイを用いて調べた結果を示すグラフである。
【図8】呼吸開始前後の正常犬及び筋ジス犬の横隔膜におけるc-Fos、EGR1、IL-6及びIL-8の発現の変化を定量PCRを用いて調べた結果を示すグラフである。
【図9】呼吸開始前後の正常犬及び筋ジス犬の横隔膜におけるc-Fos、EGR1、IL-6及びIL-8の発現の変化をウエスタンブロットを用いて調べた結果を示す写真である。
【図10】呼吸開始前後の正常犬及び筋ジス犬の横隔膜におけるc-Fos、EGR1、IL-6及びIL-8の発現の変化を免疫組織化学を用いて調べた結果を示す写真である。
【発明を実施するための形態】
【0015】
本発明は、筋ジストロフィーを診断するための新規なマーカーを提供する。本発明により提供されるマーカーは、正常ではその発現量が低く、筋ジストロフィーでは高く発現されるものであるため、筋ジストロフィーの保因者であるかどうかの診断や、筋ジストロフィーの発症の予測、筋ジストロフィーの治療薬又は治療法のスクリーニング、筋ジストロフィーの治療薬又は治療法の有効性の評価などに有用である。
【0016】
本発明者は、新生仔筋ジス犬の病態機序を明らかにすることにより、筋変性の機序を解明できる可能性があると考えた。健常新生児においてもDMDほどではないが、出生時に血清CK値は高く(Rudolph N,et al., Pediatrics 1966; 38: 1039-1046; Gilboa N, et al., Arch Dis Child 1976; 51: 283-285; Zellweger H, et al., Pediatrics 1975; 55: 30-34)、帝王切開により低下することから、高CK血症の原因として胎児が娩出時の産道からの圧迫、外傷、又は低酸素症が関与していると考えられている(Rudolph, 1966;Gilboa, 1976;Drummond LM. et al., Arch Dis Child 1979; 54: 362-366)。そこで、分娩時のストレス又は出生直後の呼吸開始が新生仔筋ジス犬の高CK血症に関連するかについて検討を行った(実施例1)。
【0017】
次に、新生仔筋ジス犬の横隔膜において、呼吸開始前後で発現が増加する遺伝子又は分子ついて検討したところ、呼吸開始前の筋ジス犬では正常犬と比較してオステオポンチンの発現量が増加していた。呼吸開始前の筋ジス犬新生仔の横隔膜ではオステオポンチンの発現が特異的に増加していたが、これは、stretch-activated channelを介して増加した細胞内Ca2+により活性化されたと考えられるが、再生時や線維化のみならず、筋壊死の前段階から活性化されており、筋ジストロフィーの病態の本質に関わる分子である可能性があり、おそらく炎症細胞の誘導に関連している可能性がある(実施例2)。
【0018】
一方、呼吸開始後の筋ジス犬において、即初期遺伝子でありサードメッセンジャーとも呼ばれるc-fos及びegr-1が、呼吸開始前の筋ジス犬と比較して増加していた。さらに、これらの遺伝子の下流に位置するインターロイキン-6(IL-6)及び-8(IL-8)の遺伝子の発現量も増加していた。これらの分子はstretch-activated channel及び筋細胞膜の機械的傷害部位より流入した細胞内Ca2+の著しい増加により活性化されたと考えられるが、IL-6やIL-8はマイオカインとも呼ばれ、筋細胞内在性に発現するサイトカイン・ケモカインであり、筋傷害早期に起こる好中球などの炎症細胞の誘導に関連していると考えられる(実施例2)。
【0019】
本発明者は、新生仔筋ジス犬の高CK血症の原因を究明することで、呼吸開始による機械的負荷前の横隔膜においてはオステオポンチンの発現が増加していること、呼吸開始による機械負荷後の横隔膜では、筋形質膜の破綻とカルシウムの流入がはじめに起こり、次いで即初期遺伝子が発現して下流の分子であるIL-6やIL-8のサイトカイン、ケモカインの発現を増加させて好中球などの炎症性細胞が誘導されるという二段階仮説を提案する。本研究で同定された遺伝子及び分子は、筋ジストロフィーの病態機序に新たな視点を与えるのみならず、病勢や治療効果の評価を得る上で新たな分子マーカーとなる。
【0020】
本発明では、上述のように、正常ではその発現量が低く筋ジストロフィーでは高く発現されるc-Fos及びEGR1、IL-6及びIL-8タンパク質及びそれをコードする遺伝子をマーカーとして利用する。本明細書中、これらの遺伝子及びタンパク質を「本発明のマーカー」と呼ぶ。なお、本発明のマーカーは、本明細書中「マーカー遺伝子」及び「マーカータンパク質」とも記載する。
【0021】
本発明のマーカータンパク質及びマーカー遺伝子は、当技術分野で公知であり、そのアミノ酸配列及び塩基配列も公知である。但し、本発明のマーカーについて、筋ジストロフィーとの関連性については報告されていない。本発明のマーカーの名称、アクセッション番号、塩基配列及びアミノ酸配列を、表1にまとめる。
【0022】
【表1】

【0023】
本発明では、表1に示されるマーカーをそれぞれ単独で使用することができる。すなわち、一実施形態では、c-Fosをマーカーとして使用する。別の実施形態では、EGR1をマーカーとして使用する。また別の実施形態では、IL-6をマーカーとして使用する。さらに別の実施形態では、IL-8をマーカーとして使用する。場合により、表1に示されるマーカーを組み合わせて使用することも可能である。あるいは、表1に示されるマーカーと、当技術分野で公知の他の筋ジストロフィーマーカーとを組み合わせてもよい。マーカーの組み合わせは、表1に示すマーカーを少なくとも1つ含む限り、任意の数及び種類のマーカーの組み合わせとすることができる。例えば、c-FosとERG-1、c-FosとIL-6、c-FosとIL-8、ERG-1とIL-6、ERG-1とIL-8、IL-6とIL-8、c-FosとERG-1とIL-6、c-FosとERG-1とIL-8、c-FosとIL-6とIL-8、又はERG-1とIL-6とIL-8を組み合わせて用いることができる。他のマーカーとしては、例えば血清クレアチニンキナーゼ(CK)値が挙げられる。このようにマーカーを組み合わせることによって、筋ジストロフィーの診断をより高精度に行うことができる。
【0024】
上述の通り、上記のマーカーは、筋ジストロフィーにおいて高レベルで発現される。本発明では、被験者由来のサンプルにおいて上記のマーカー又はマーカーの組合せの発現を測定する。2つ以上のマーカーについて発現を測定する場合、各マーカーの発現を測定するステップは、同時に行ってもよいし、前後して行ってもよい。また本発明では、「マーカーの発現」とは、マーカータンパク質又はその派生物若しくは誘導体の発現であってもよいし、あるいは該タンパク質をコードする遺伝子(mRNA)の発現であってもよい。「派生物」又は「誘導体」とは、マーカータンパク質から派生する物質又はマーカータンパク質の由来する物質を意味し、例えばシグナルペプチドを含むタンパク質、タンパク質の特定のサブユニット分子、修飾タンパク質、タンパク質断片などが含まれるが、これに限定されるものではない。
【0025】
従って、本発明に係る筋ジストロフィー診断薬(以下、「本診断薬」ともいう)は、被験者に由来するサンプル中のc-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つのマーカーの発現を測定するための手段を含むものである。
【0026】
使用するサンプルは、筋ジストロフィーについて診断しようとする被験者に由来するサンプルであれば特に限定されるものではなく、マーカーの発現を測定するための方法又は手段の種類に応じて適宜選択される。例えば生体液サンプル(血液、血清、血漿、尿、髄液、腹水等)、組織又は細胞サンプル(筋組織又は筋細胞、例えば横隔膜の組織又は細胞等)が挙げられ、採取の容易性の点から、筋細胞、血液、血清又は血漿などをサンプルとして用いることが好ましい。血漿を使用する場合には、抗凝固剤としてEDTAを使用することが好ましいが、ヘパリン、クエン酸ナトリウムなど当該分野で公知又は汎用されているものを使用することができる。血液サンプルの場合、採血後は氷冷又は冷蔵保存することが好ましい。また、組織又は細胞サンプルは、採取後に液体窒素、ドライアイスなど当該分野で公知又は汎用されている方法で直ちに凍結し、冷凍保存することが好ましい。筋細胞は、当技術分野で公知の方法により採取することができる。具体的には、例えば、骨格筋を細切し、50 ml円錐底チューブに移した後、筋重量1 gあたり4 mlのDispase2 (2.4 IU/ml) -Collagenase XI (0.2%) 溶液を加え、37℃、45〜60分間インキュベートし、途中15分ごとにピペットを用いてピペッティングする。その後、18 Gの注射針に数回通して組織片を粉砕し上清を回収する。上清を80μmのフィルターに通して細胞塊を除き、細胞懸濁液を50 ml円錐底チューブに移し、さらにDispase2 (2.4 IU/ml) -Collagenase XI (0.2%) 処理後のチューブに増殖培地を加え、その上清を同様にフィルターに通して回収する。増殖培地を加え、合計30 mlとし、数回ピペッティングを行い、1,000 rpmで5分間、4℃で遠心する。上清を捨て沈殿細胞に増殖培地20 mlを加え、再度懸濁した後、1,000 rpmで5分間、4℃で遠心する。沈殿細胞を増殖培地25 mlに懸濁し、コーティングなしの15 cm培養皿に移しbFGFを添加し、37℃、5%CO2濃度で90分間培養後、未付着細胞を含む上清を回収する。この上清を用いて培養皿の底面を洗い、180度向きを変えてもう一度37℃、5%CO2濃度で90分間培養し、上清を回収する。回収した上清を15 cmコラーゲンコート培養皿に移しbFGFを添加し、37℃、5%CO2濃度で一晩培養する。翌日筋芽細胞が30〜40%コンフルエント以上になっているようなら継代を行い、それ以下なら培地交換に留める。筋分化を防ぐために以後、毎日継代ないしは培地交換を行う。
【0027】
また被験者は、ヒト、及びその他の哺乳動物、例えば霊長類(サル、チンパンジーなど)、家畜動物(ウシ、ウマ、ブタ、ヒツジなど)、ペット用動物(イヌ、ネコなど)、実験動物(マウス、ラット、ウサギなど)であり、さらには爬虫類及び鳥類などであってもよい。
【0028】
マーカーの発現の測定は、サンプル中のマーカーの量又は濃度を、好ましくは半定量的又は定量的に測定することに関し、その量は、絶対量であってもよいし又は相対量であってもよい。測定は、直接的又は間接的に行うことができる。直接的な測定は、サンプル中に存在するマーカータンパク質又は遺伝子(mRNA)の分子数と直接相関するシグナルに基づいて、その量又は濃度を測定することに関する。そのようなシグナルは、例えばタンパク質又は遺伝子の特定の物理的又は化学的な特性に基づいている。間接的な測定は、二次成分(すなわちマーカータンパク質又はmRNA以外の成分)、例えば抗体やアプタマーなどのリガンド、標識又は酵素反応生成物から得られるシグナルの測定である。採用するマーカーの発現測定方法に応じて、本診断薬に含まれる測定手段も異なる。
【0029】
本発明の一実施形態では、マーカーの発現の測定は、サンプル中のマーカータンパク質の量を測定するための手段によって行うことができる。そのような手段は当技術分野で公知であり、例えば免疫アッセイの方法及び試薬などがある。またマーカータンパク質の発現の測定は、マーカータンパク質に特有の物理的又は化学的特性を測定するための手段、例えば正確な分子量又はNMRスペクトル等を測定するための手段によって行うことができる。マーカータンパク質の発現を測定するための手段としては、バイオセンサー、プロテインチップ、免疫アッセイと連結した光学装置、質量分析計、NMR分析計、二次元電気泳動装置又はクロマトグラフィー装置等の分析装置が挙げられる。
【0030】
例えば、サンプル中のマーカータンパク質の発現の測定は、免疫アッセイ(免疫学的測定法)により行うことができる。すなわちサンプル中のマーカータンパク質と、該タンパク質に特異的に結合する抗体との反応に基づいて、該タンパク質の発現を測定する。免疫アッセイは、当該分野で汎用されている方法であれば液相系及び固相系のいずれで行ってもよい。検出の容易性の点で、固相系を利用することが好ましい。また免疫アッセイの形式も限定されるものではなく、直接固相法の他、サンドイッチ法、競合法、ウエスタンブロッティング法、ELISA(enzyme linked immunosorbent assay)法などであってもよい。
【0031】
免疫アッセイを採用する場合には、本診断薬は、マーカータンパク質に対する抗体を含む。マーカータンパク質に対する抗体はモノクローナル抗体又はポリクローナル抗体のいずれであってもよいし、あるいはマーカータンパク質のエピトープに結合することができるFab、Fvフラグメントなどであってもよい。一次抗体と二次抗体を使用する場合には、両方ともモノクローナル抗体を用いることもでき、あるいは、一次抗体と二次抗体のいずれか一方をポリクローナル抗体とすることもできる。抗体は、当技術分野で公知の方法により調製することができ、また市販品として入手してもよい。
【0032】
マーカータンパク質と抗体との結合(反応)は、周知の方法に従って測定しうる。当業者であれば、採用する免疫アッセイの種類及び形式、使用する標識の種類などに応じて、各アッセイについての有効かつ最適な測定方法を決定することができる。例えば、サンプル中のマーカータンパク質と抗体との結合を容易に検出するために、該抗体を標識することにより該結合を直接検出するか、又は標識二次抗体若しくはビオチン−アビジン複合体等を用いることにより間接的に検出する。
【0033】
免疫アッセイとして固相系を選択する場合には、例えばサンプル中のタンパク質成分を固相に固定化することができ、例えば、(1)サンプルからタンパク質成分を調製する工程、(2)SDS-ポリアクリルアミドゲル電気泳動により分画する工程、(3)ゲル上のタンパク質を固相に転写する工程、(4)マーカータンパク質に対する抗体(一次抗体)と反応させる工程、(5)固相を洗浄する工程、(6)固相に一次抗体に対する標識抗体(二次抗体)を接触させる工程、(7)固相を洗浄する工程、(8)該標識を用いて各タンパク質の発現量を測定する工程からなる方法を採用することができる。あるいは、抗体を固相に固定してもよい。この方法は、いわゆる「サンドイッチ法」と呼ばれる方法であり、マーカーとして酵素を用いる場合には、「ELISA」として広く用いられている方法である。このような固相系の方法は、極微量のタンパク質の検出と操作の簡便化のため好ましい方法である。
【0034】
固相系においては、抗体又はサンプル中のタンパク質成分を固相(プレート、膜、ビーズ等)上に固定化し、この固相上においてマーカータンパク質と抗体との免疫学的結合を試験する。固相は、当技術分野で慣用的に使用されているものであれば特に限定されるものではなく、例えば市販のニトロセルロース膜又はPVDF膜を用いることができる。抗体又はサンプル中のタンパク質成分を固相上に固定化することによって、未結合のサンプル成分や試薬を容易に除去することができる。また特に、数種類の抗体を固定化したメンブレンを用いるタンパク質アレイ法では、少量の被験者由来のサンプル(血漿など)を用いて複数種のマーカータンパク質の発現を短時間で解析することができる。またこのような免疫アッセイは、例えば操作が簡便なテストストリップにおいても実施することができる。
【0035】
免疫アッセイとして液相系を選択する場合には、例えば、標識化抗体とサンプルとを接触させて標識化抗体とマーカータンパク質を結合させ、この結合体を分離し、標識シグナルを検出する。あるいは、マーカータンパク質に対する抗体(一次抗体)とサンプルとを接触させて一次抗体とマーカータンパク質を結合させ、この結合体に標識化抗体(二次抗体)を結合させ、この三者の結合体における標識シグナルを検出する。あるいは、さらにシグナルを増強させるためには、非標識の二次抗体を先ず抗体+マーカータンパク質結合体に結合させ、この二次抗体に標識物質を結合させるようにしてもよい。このような二次抗体への標識物質の結合は、例えば二次抗体をビオチン化し、標識物質をアビジン化しておくことによって行うことができる。
【0036】
免疫アッセイにおいて使用する抗体を標識するための標識としては、酵素、放射性同位体、蛍光色素又はアビジン−ビオチン系を使用することができる。酵素としては、通常の酵素免疫アッセイ(EIA)に用いられる酵素、例えば、パーオキシダーゼ、β-ガラクトシダーゼ、アルカリフォスファターゼ等を用いることができる。また、酵素阻害物質や補酵素等を用いることもできる。これら酵素と抗体との結合は、マレイミド化合物等の架橋剤を用いる公知の方法によって行うことができる。放射性同位体としては、125Iや3H等の通常のラジオイムノアッセイ(RIA)で用いられているものを使用することができる。蛍光色素としては、フルオレセインイソチオシアネート(FITC)やテトラメチルローダミンイソチオシアネート(TRITC)等の通常の蛍光抗体法に用いられるものを使用することができる。
【0037】
ビオチン−アビジン複合体系を利用する場合には、ビオチン化した抗体とサンプルとを反応させ、得られた複合体に標識を付加したアビジンを反応させる。アビジンは、ビオチンと特異的に結合することができるため、アビジンに付加した標識のシグナルを検出することによって、抗体とマーカータンパク質との結合を測定することができる。アビジンに付加する標識は特に限定されるものではないが、例えば酵素標識(ペルオキシダーゼ、アルカリホスファターゼなど)が好ましい。
【0038】
標識シグナルの検出もまた、当技術分野で公知の方法に従って行うことができる。例えば、酵素標識を用いる場合には、酵素作用によって分解して発色する基質を加え、基質の分解量を光学的に測定することによって酵素活性を求め、これを結合抗体量に換算し、標準値との比較から抗体量が算出される。基質は、使用する酵素の種類に応じて異なり、例えば酵素としてパーオキシダーゼを使用する場合には、3,3’,5,5’-テトラメチルベンジシンを、また酵素としてアルカリフォスファターゼを用いる場合には、パラニトロフェノール等を用いることができる。放射性標識を用いる場合には、放射性標識の発する放射線量をシンチレーションカウンター等により測定する。蛍光標識は、例えば蛍光顕微鏡、プレートリーダー等を用いて検出及び定量することができる。
【0039】
あるいは、免疫組織化学染色法(例えば免疫染色法)又は免疫電顕法のように、マーカータンパク質のin situ検出のために、マーカータンパク質に対する抗体を組織学的に用いることも可能である。in situ検出は、被験体から組織学的サンプル(例えば筋組織、筋細胞、横隔膜サンプル)を切除し(組織のパラフィン包埋切片など)、それに標識した抗体を接触させることにより実施しうる。
【0040】
以上の免疫学的方法では、サンプル中のマーカータンパク質とマーカータンパク質に対する抗体との結合量が多いほど、サンプル中にマーカータンパク質が多く発現されていることとなる。
【0041】
あるいは、マーカータンパク質の発現の測定は、質量分析法(MS)を使用して行うことができる。特に液体クロマトグラフィーと連結した質量分析計(LC/MS)による解析は鋭敏であるため有利である。質量分析法による測定は、例えば、(1)サンプルからタンパク質成分を調製する工程、(2)タンパク質・ペプチドに標識する工程、(3)タンパク質・ペプチドを分画する工程、(4)タンパク質・ペプチドを質量分析に供する工程、(5)質量分析値からマーカータンパク質群を同定する工程により行うことができる。標識としては、当技術分野で公知の同位体標識試薬を用いることができ、適当な標識試薬を市販品として入手することができる。また分画も当技術分野で公知の方法により行うことができ、例えば市販の強陽イオンカラム等を用いて行うことができる。この場合、本診断薬は、同位体標識試薬、分画用ミニカラムなどをマーカーの発現の測定手段として含む。
【0042】
また本発明においては、マーカーの発現の測定は、サンプル中のマーカー遺伝子の量を測定するための手段によって行うことができる。そのような手段は当技術分野で公知であり、例えば、マーカー遺伝子のDNAの全部若しくは一部の配列又はその相補配列を含むプライマーDNA又はプローブDNAがある。該プライマーDNA又はプローブDNAは、被験者由来のサンプル中に発現しているマーカー遺伝子のmRNA又は該mRNAに対応するcDNAと特異的に結合して、サンプル中のマーカー遺伝子の発現を検出することが可能である。
【0043】
プライマーDNA及びプローブDNAは、マーカー遺伝子のDNAの塩基配列に基づいて、公知のプログラムにより容易に設計することができ、また当業者に公知の方法に従って調製することができる。具体的には、マーカー遺伝子の塩基配列、例えば配列番号1、3、5、7、9、11、13又は15に示される塩基配列及びその相補配列に基づいて設計することができる。プライマーとして実質的な機能を有するDNAの長さとしては、10塩基以上が好ましく、さらに好ましくは15〜50塩基であり、さらに好ましくは20〜30塩基である。またプローブとして実質的な機能を有するDNAの長さとしては、10塩基以上が好ましく、さらに好ましくは15〜50塩基であり、さらに好ましくは20〜30塩基である。さらに、当業者には周知のように、プライマーDNA又はプローブDNAには、アニーリング又はハイブリダイズする部分以外の配列、例えばタグ配列などの付加配列が含まれていてもよい。
【0044】
被験者由来のサンプルにおけるマーカー遺伝子の発現を測定するためには、上記プライマーDNA及び/又はプローブDNAをそれぞれ増幅反応又はハイブリダイゼーション反応において用い、その増幅産物又はハイブリッド産物を検出する。そのような反応を行う場合には、通常は、当技術分野で周知の方法を使用して被験者由来のサンプルからmRNA又は該mRNAに対応するcDNAを調製する。例えば、RNAを抽出する場合には、グアニジン−塩化セシウム超遠心法、ホットフェノール法、又はチオシアン酸グアジニウム−フェノール−クロロホルム(AGPC)法などを利用することができる。cDNAは、公知の逆転写酵素を利用して調製することができる。以上のように調製したサンプルを用いて、以下に示す増幅反応及び/又はハイブリダイゼーション反応を行う。
【0045】
プライマーDNAを用いてmRNA又はcDNAを鋳型とした増幅反応を行い、その特異的増幅反応を検出することにより、サンプル中のマーカー遺伝子の発現の測定を行うことができる。増幅手法としては、特に限定されないが、ポリメラーゼ連鎖反応(PCR)法の原理を利用した公知の方法(PCR、RT-PCR、リアルタイムPCRなど)を挙げることができる。増幅産物の検出には、増幅反応により得られる増幅産物を特異的に認識することができる公知の手段を用いることができる。例えば、アガロースゲル電気泳動法等を利用して、特定のサイズの増幅断片が増幅されているか否かを確認することにより、特異的な増幅反応を検出することができる。
【0046】
あるいは、増幅反応の過程で取り込まれるdNTPに、放射性同位体、蛍光物質、発光物質などの標識体を作用させ、この標識体を検出することができる。放射性同位体としては、32P、125I、35Sなどを用いることができる。また蛍光物質としては、例えば、フルオレセインイソチオシアネート(FITC)、スルホローダミン(SR)、テトラメチルローダミン(TRITC)などを用いることができる。また発光物質としてはルシフェリンなどを用いることができる。これら標識体の種類や標識体の導入方法等に関しては、特に制限されることはなく、従来公知の各種手段を用いることができる。例えば標識体の導入方法としては、放射性同位体を用いるランダムプライム法が挙げられる。
【0047】
標識したdNTPを取り込んだ増幅産物を観察する方法としては、上述した標識体を検出するための当技術分野で公知の方法であればいずれの方法でもよい。例えば、標識体として放射性同位体を用いた場合には、放射活性を、例えば液体シンチレーションカウンター、γ-カウンターなどにより計測することができる。また標識体として蛍光を用いた場合には、その蛍光を蛍光顕微鏡、蛍光プレートリーダーなどを用いて検出することができる。
【0048】
また、プローブDNAを用いてサンプルに対するハイブリダイゼーション反応を行い、その特異的結合(ハイブリッド)を検出することにより、マーカー遺伝子の発現を測定することもできる。ハイブリダイゼーション反応は、プローブDNAがサンプル中のマーカー遺伝子のmRNA又はcDNAのみと特異的に結合するような条件、すなわちストリンジェントな条件下で行う必要がある。ハイブリダイゼーションを行う場合には、プローブDNAに蛍光標識(フルオレセイン、ローダミンなど)、放射性標識(32Pなど)、ビオチン標識等の適当な標識を付加することができる。
【0049】
標識化プローブDNAを用いた検出は、サンプル又はそれから調製したmRNA若しくはcDNAとプローブDNAとをハイブリダイズ可能なように接触させることを含む。具体的には、サンプル又はmRNA若しくはcDNAを適当な固相に固定化し、標識を付加したプローブDNAを添加することにより、あるいは標識プローブDNAを適当な固相に固定化し、サンプル又はmRNA若しくはcDNAを添加することにより、プローブDNAとサンプル又はmRNA若しくはcDNAとを接触させてハイブリダイゼーション反応を行い、ハイブリダイズしなかったプローブDNAを除去した後、サンプル又はmRNA若しくはcDNAとハイブリダイズしているプローブDNAの標識を検出する。標識が検出された場合には、サンプル中にマーカー遺伝子のmRNAが発現していることとなる。標識化プローブDNAを用いた発現の測定方法の例としては、サザンハイブリダイゼーション法、ノーザンハイブリダイゼーション法等を挙げることができる。
【0050】
以上のようにして、マーカーの発現を測定する手段を用いてサンプル中のマーカーの発現を測定し、その結果に基づいて筋ジストロフィーを診断することが可能である。本診断薬により診断の対象となるのは筋ジストロフィーであり、特にデュシェンヌ型筋ジストロフィーである。本明細書中、「筋ジストロフィーの診断」とは、被験者における筋ジストロフィーの保因を判定すること、筋ジストロフィーの発症を予測することを意味する。また本発明において「診断」は、既に診断された筋ジストロフィーの継続的なモニタリング、及び既に行った筋ジストロフィーの診断の確認も包含する。
【0051】
本発明の目的である診断は、診断しようとする被験者の全て(すなわち100%)について必ず正しい結果が得られることを意図するものではない。本発明においては、「診断」は、被験者を統計学的に有意な確率で診断できることを意図しており、例えば被験者の少なくとも60%、少なくとも80%又は少なくとも90%を、本発明によって適切に診断することができる。
【0052】
診断を行う際、被験者由来のサンプル中のマーカーの発現を、基準値と比較する。基準値は、健常者サンプルにおけるマーカーの発現の測定値、筋ジストロフィーの保因者又は発症者であると診断がなされた患者サンプルにおけるマーカーの発現の測定値などである。個々の被験者に適用する基準値は、マーカーの種類、被験者の種類、年齢などの様々な生理学的パラメータに応じて変化しうる。具体的な判定基準としては、被験者のサンプルにおけるマーカーの発現量が健常者のそれと比較して、10%以上、好ましくは30%以上、さらに好ましくは70%以上、最も好ましくは100%以上である場合には、筋ジストロフィーの可能性があると診断することができる。
【0053】
さらに筋ジストロフィーの診断は、他の公知の筋ジストロフィーの診断方法と組み合わせて行ってもよい。そのような公知の診断方法としては、血清クレアチンキナーゼ(CK)値の測定、単離骨格筋の張力測定、組織学的な筋最大直径及び中心核線維の頻度の計測、多重連鎖反応依存性プローブ増幅(Multiplex Ligation-dependent Probe Amplification:MLPA)法、ポリメラーゼ連鎖反応(PCR)法/シークエンス法による遺伝子変異の同定、あるいは抗ジストロフィン抗体を用いた免疫組織化学法又はウエスタンンブロット法によるジストロフィンタンパク質の定性・定量的解析法が挙げられる。
【0054】
本診断薬は、マーカーの発現を測定する手段以外にも診断に有用な他の成分を含んでもよく、それにより、マーカーの発現の測定を容易かつ簡便に行うことができ、筋ジストロフィーを診断することができる。
【0055】
本診断薬の一例は、免疫アッセイ用試薬セットであり、少なくともマーカータンパク質に対する抗体試薬を含む。さらに、希釈や洗浄用緩衝液、標準抗原、各抗体試薬に特異的に結合をする標識抗体試薬、発色・発光・蛍光を生じさせる基質試薬、手順と評価方法を記載した手順書等を含んでもよい。キットに含まれる抗体は、予め標識されたものであってもよいし、又は標識されていなくてもよい。また抗体は、固相支持体(例えば、メンブレン、ビーズ等)に固定されていてもよい。また本発明の診断薬の別の例は、質量分析用試薬セットであり、例えば同位体標識試薬、分画用ミニカラム、緩衝液、手順書等により構成される。本発明の診断薬のさらに別の例は、サンプル中のマーカー遺伝子の発現を測定するための手段(プライマーDNA、プローブDNAなど)を含むものであってもよい。
【0056】
本発明の診断薬は、該診断薬を使用するための手順及びプロトコールを記載した説明書、筋ジストロフィーの診断において使用する基準値又は基準範囲を示した表などを含んでもよい。
【0057】
本発明の診断薬に含まれる構成要素は、個別に提供されてもよいし、又は単一の容器内に提供されてもよい。好ましくは、本発明の診断薬は、必要な構成要素の全てを、即時に使用することができるように、例えば調整された濃度の構成要素として含む。
【0058】
さらに、上記マーカーを利用して、筋ジストロフィーの治療薬又は治療法の有効性を評価したり、筋ジストロフィーの治療薬又は治療法の候補をスクリーニングすることができる。すなわち、筋ジストロフィー発症動物若しくは筋ジストロフィー保因動物、又は筋ジストロフィー発症動物若しくは筋ジストロフィー保因動物に由来する筋細胞(例えば横隔膜細胞)を、被験治療薬又は治療法で処置し、該動物又は筋細胞におけるマーカーの発現を測定することによって、該被験治療薬又は治療法がマーカーの発現、すなわち筋ジストロフィーに影響を及ぼすか否かを判定することができる。
【0059】
本発明に係るスクリーニング方法(以下、「本スクリーニング方法」ともいう)、及び治療薬又は治療法の有効性を評価する方法(以下、「本評価方法」ともいう)においては、まず、筋ジストロフィー発症動物又は筋ジストロフィー保因動物を被験治療薬又は治療法で処置するか、あるいは筋ジストロフィー発症動物又は筋ジストロフィー保因動物に由来する筋細胞を被験治療薬又は治療法で処置する。
【0060】
本方法では、筋ジストロフィー発症動物又は筋ジストロフィー保因動物からサンプルを採取し、該サンプル中のマーカーの発現を測定する。あるいは、筋細胞におけるマーカーの発現を測定する。好ましくは、被験治療薬又は治療法による処置を行う前に、筋ジストロフィー発症動物又は筋ジストロフィー保因動物からサンプルを採取し、サンプル中のマーカーの発現を測定するか、あるいは筋細胞におけるマーカーの発現を測定する。筋ジストロフィー発症動物又は筋ジストロフィー保因動物、あるいは筋ジストロフィー発症動物又は筋ジストロフィー保因動物に由来する筋細胞を被験治療薬又は治療法で処置した後、適当な時期に、サンプル又は細胞中のマーカーの発現を測定する。例えば、処置の直後、30分後、1時間後、3時間後、5時間後、10時間後、15時間後、20時間後、24時間(1日)後、2〜10日後、10〜20日後、20〜30日後、1ヶ月〜6ヵ月後にマーカーの発現を測定する。サンプルの採取、サンプル中のマーカーの発現の測定については、前記と同様に行うことができる。
【0061】
対象となる動物は、筋ジストロフィーを発症した又は保因しているヒトであってもよいし、あるいは筋ジストロフィーモデル動物、好ましくは筋ジストロフィーモデル実験動物(マウス、イヌ、ラットなど)であってもよい。例えば、筋ジストロフィーのモデルマウス(mdxマウス:Sicinski, P. et al., Science 244:1578-1580, 1989)、筋ジストロフィーのモデルイヌ(c-xmdイヌ:Komegay, J.N. et al., Muscle Nerve 11:1056-1064, 1988;CXMDJイヌ:Shimatsu Y et al., Exp Anim. 52:93-7. 2003、Shimatsu Y et al., Acta Myol. 24:145-54. 2005)、筋ジストロフィーのモデルネコ(HFMDネコ:Vos, J. H. et al., J. Comp. Pathol. 96:335-41, 1986)などを用いることができる。一般的には、モデル動物において被験治療薬又は治療法の有効性が確認された後に、ヒトにおいて、例えば臨床試験などにより有効性の評価が行われる。
【0062】
本スクリーニング方法及び本評価方法の対象となる被験治療薬又は治療法の種類は特に限定されるものではない。例えば、被験治療薬又は治療法は、任意の物質的因子、具体的には、天然に生じる分子、例えば、アミノ酸、ペプチド、オリゴペプチド、ポリペプチド、タンパク質、核酸、脂質、炭水化物(糖等)、ステロイド、グリコペプチド、糖タンパク質、プロテオグリカンなど;天然に生じる分子の合成アナログ又は誘導体、例えば、ペプチド擬態物、核酸分子(アプタマー、アンチセンス核酸、二本鎖RNA(RNAi)等)など;天然に生じない分子、例えば、コンビナトリアルケミストリー技術等を用いて作成した低分子有機化合物(無機及び有機化合物ライブラリー、又はコンビナトリアルライブラリー等)など;並びにそれらの混合物を挙げることができる。また治療薬又は治療法は、単一物質であってもよいし、複数の物質から構成される複合体や、転写因子等であってもよい。さらに、被験治療薬又は治療法は、上記のような物質的因子に加えて、放射線、紫外線などであってもよい。
【0063】
また、被験治療薬又は治療法としては単一の治療薬又は治療法を独立に試験しても、いくつかの候補となる被験治療薬又は治療法の混合物(ライブラリーなどを含む)について試験をしてもよい。複数の被験治療薬又は治療法を含むライブラリーとしては、合成化合物ライブラリー(コンビナトリアルライブラリーなど)、ペプチドライブラリー(コンビナトリアルライブラリーなど)などが挙げられる。
【0064】
動物を被験治療薬又は治療法で処置する場合には、その処置量、処置期間、処置経路などの処置条件は、被験治療薬又は治療法の種類などにより異なるが、当業者であれば容易に決定することができる。例えば、動物に被験治療薬を投与する場合の投与経路は、被験治療薬の種類、使用する動物の種類などに応じて、筋肉内注射、経口投与、静脈注射、腹腔内注射、経皮投与、皮下注射等の投与形態を適宜使用することができる。
【0065】
筋細胞は、当技術分野で公知の方法により、例えば上述した方法で採取することができる。あるいは、市販の筋細胞又は公に入手可能な筋細胞を使用することも可能である。細胞を被験治療薬又は治療法と接触させる場合、その接触の条件は、その治療薬又は治療法の種類により異なるが、当業者であれば容易に決定することができる。例えば、そのような接触は、筋細胞を被験治療薬を添加した培地中で培養することにより、筋細胞を被験治療薬を含む溶液中に浸漬することにより、又は筋細胞上に被験治療薬を積層することにより行うことができる。
【0066】
また、被験治療薬又は治療法の効果及び有効性は、いくつかの条件で検討することも可能である。そのような条件としては、被験治療薬又は治療法で処置する時間又は期間、量(大小)、回数などが挙げられる。例えば、被験治療薬の希釈系列を調製するなどして複数の用量を設定することができる。被験治療薬又は治療法の処置期間も適宜設定することができるが、例えば、1日から数週間、数ヶ月、数年の期間にわたって処置を行うことができる。
【0067】
さらに、複数の治療薬及び/又は治療法の相加作用、相乗作用などを検討する場合には、被験治療薬及び/又は治療法を組み合わせて用いてもよい。
【0068】
続いて、動物又は細胞におけるマーカーの発現を測定する。マーカーの発現の測定は、上述したように行うことができる。マーカーの発現を測定した後、対照と比較し、マーカーの発現を低減する被験治療薬又は治療法を選択する。対照としては、被験治療薬又は治療法による処置を受けていない動物又は細胞などを用いることができる。
【0069】
また、本発明においては、一次スクリーニングとして、筋細胞を被験治療薬又は治療法で処置し、該筋細胞におけるマーカーの発現を測定して発現低減を示した被験治療薬又は治療法を選択し、次に二次スクリーニングとして、選択した被験治療薬又は治療法で動物を処置し、該動物におけるマーカーの発現を測定して発現低減を示した被験治療薬又は治療法を選択してもよい。
【0070】
さらに、治療薬又は治療法のスクリーニングにおいては、さらに、選択された被験治療薬又は治療法を、筋ジストロフィーモデル動物に投与して、被験治療薬又は治療法がモデル動物における筋ジストロフィーの発症、進行又は症状に影響を及ぼすか否かを判定してもよい。被験治療薬又は治療法がモデル動物における筋ジストロフィーの発症、進行又は症状に影響を及ぼすか否かの判定は、モデル動物の種類、判定しようとする症状、要因などにより異なるが、当業者であれば、筋ジストロフィーに及ぼす影響を適宜判定することができる。例えば、筋疾患又は筋障害に及ぼす影響を判定する場合には、筋力、血清クレアチンキナーゼ値の測定、単離骨格筋の張力測定、組織学的な筋最大直径及び中心核線維の頻度の計測などを行うことができる。
【0071】
上述のようにして、筋ジストロフィーの改善(例えば、症状の改善、発症若しくは進行の遅延)が認められる場合の被験治療薬又は治療法は、筋ジストロフィーの治療又は予防のための医薬の候補として選択することができる。
【0072】
以上から、本スクリーニング方法及び本評価方法により、筋ジストロフィーを治療又は予防するための治療薬又は治療法を同定し、さらには治療薬又は治療法の有効性を確認することができる。
【0073】
さらに、c-Fos、EGR1、IL-6又はIL-8は、発症時(生後)に発現が増大することから、c-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つの発現又は活性を阻害することにより、筋ジストロフィーを治療又は予防することができる。従って、本発明は、c-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つの発現又は活性を阻害又は抑制する手段を含むことを特徴とする筋ジストロフィーの治療又は予防薬にも関する。そのような手段としては、遺伝子の発現を阻害又は抑制する手段、例えばアンチセンス核酸、RNAiを利用する方法(マイクロRNA、siRNAなど)、及びタンパク質の発現を阻害又は抑制する手段、例えば抗体、アプタマー核酸などが挙げられる。
【実施例】
【0074】
以下、本発明を実施例及び図面によりさらに具体的に説明する。ただし、以下の実施例は、本発明を限定するものではない。
[実施例1]血清クレアチニンキナーゼ(CK)の変化
分娩時のストレスが新生児に筋障害を与えうること、帝王切開によりそのストレスを減らすことの報告を元に、予定的帝王切開を導入し、正常犬、保因犬及び筋ジス犬において自然分娩と帝王切開後の血清CK値の違いについて検討した。なお、保因犬とは、ジストロフィン遺伝子に変異を有している雌個体を意味する。すなわち、ヒト及び犬の染色体は23対、計46本の染色体から成り立っているが、このうち22対は常染色体であり、1対、2本は男女を決定する性染色体である。雄犬(男)がXとY染色体から成るのに対し、雌犬(女性)は2本のX染色体から構成される。筋ジストロフィーの原因遺伝子であるジストロフィン遺伝子はX染色体上に位置し、X染色体連鎖性遺伝を示すため、変異を有しているX染色体を持つ雄個体は発症する。2本のうち1本のX染色体のジストロフィン遺伝子に変異を有している雌個体は保因犬(保因者)と呼ばれる。この保因犬とオスの正常犬を交配させることで筋ジス犬が得られるが、保因犬は、通常無症状であるが、時に筋ジス犬と正常犬の中間的な症状を呈することがあり、症候性の保因犬と呼ばれる。
【0075】
対象には、国立精神・神経センター(現国立精神・神経医療研究センター)、神経研究所中型実験動物研究施設の筋ジス犬繁殖コロニーにおいて2001年12月から2008年4月の間に自然分娩(39回)によって得られた正常犬71頭、保因犬37頭、筋ジス犬34頭、及び予定的帝王切開(28回)より得られた正常犬39頭、保因犬26頭、筋ジス犬41頭を用いた。予定的帝王切開は、LHサージ法(Witness(登録商標) LH,Synbiotics,Kansus City,MO,USA)により想定された日時、又は妊娠保因犬の体温が急速に低下した時点で施行した(Kobayashi M, et al., Muscle Nerve 2009; 40: 815-826)。妊娠保因犬の帝王切開における麻酔の導入から維持にはイソフルラン(2.0〜3.0%)を用いた。新生仔の蘇生術は、獣医師及び獣医師の監視下で動物取り扱い技術者の資格を有し、蘇生術に経験を有する者が行った。蘇生後の犬に対し呼吸促進剤であるドキソプラムを使用し、酸素補給が行われた箱内で、乾燥かつ保温されたタオルの上に置かれた。
【0076】
血清クレアチニンキナーゼ(CK)値の経時的変化(臍帯血及び蘇生後30分、1、2、4、8、24、及び48時間後)を見るために、予定的帝王切開(3回)から得られた正常犬5頭、保因犬3頭、及び筋ジス犬6頭を用いた。また、帝王切開で得られた各群の犬各4頭を病理学的及び分子生物学的解析に供した。本研究は、国立精神・神経センター(現国立精神・神経医療研究センター)神経研究所 中型実験動物倫理問題検討委員会により承認(承認番号:13-03、14-03、15-03、16-03、17-03、18-03、19-04、及び20-04)を受け、同研究所の動物実験指針に従い実施した。
【0077】
血清クレアチニンキナーゼ(CK)の測定は、臍帯血又は静脈血を室温で10分間の1,800gの遠心を行って血清を分離した後、比色法(FDC3500,FujiFilm,Tokyo,Japan)により測定した。
【0078】
また、安楽死後、横隔膜を凍結固定し、7μmに薄切した後にヘマトキシリン・エオジン(H&E)染色及びカルシウム染色法であるアリザリン・レッド染色(pH 4.1)を行った。
【0079】
なお、2群間のデータの比較にはstudent-t検定を、死亡率の検定にはカイ二乗検定を用いた。データは平均値±標準誤差を用いて示し、p < 0.05を有意差ありと判定した。
【0080】
その結果、帝王切開後の血清CK値は正常犬及び保因犬では有意に低下していたが、筋ジス犬では低下は見られなかった(図1のA)。以上の結果は、分娩時のストレスが新生仔筋ジス犬の高CK血症の主たる原因ではないことを示唆している。出生直後には呼吸開始という重要な過程があるため、高CK血症の原因が肺呼吸開始に関連しているか否かを検討する目的で、帝王切開により得た新生仔に対し臍帯血(呼吸開始前の条件を反映)と呼吸開始1時間後の頸静脈血の血清CK値を比較検討した。呼吸開始後の血清CK値の値は、正常犬及び保因犬の臍帯血CK値との間に違いは見られなかった。
【0081】
一方、筋ジス犬の臍帯血CK値は正常犬の臍帯血に比べて既に約5倍高値を示していたが、筋ジス犬の呼吸開始後の静脈血CK値はさらに筋ジス犬臍帯血の約35倍、正常犬の呼吸開始後静脈血の約150倍に増加していた(図1のB)。各犬群で血清CK値は、呼吸開始後30分までに急速に増加し、呼吸開始後4〜8時間後の間にピークに達して48時間後には臍帯血CK値のレベルまでに戻っていたが、一定して筋ジス犬では高値を示していた(図1のC)。
【0082】
呼吸開始前の横隔膜の病理では、カルシウム陽性opaque線維数が散見されるのみで(矢印)、筋の基本的構築は保たれていた。一方、呼吸開始後では、多数のカルシウム陽性opaque線維数(矢印)、間質の増大を示し、硝子様変性像を呈し、好中球などの炎症細胞の浸潤はほとんど見られなかった(図2)。
【0083】
以上の結果から、呼吸開始による急激な機械的負荷により、横隔膜の筋線維の断裂を含む著しい筋障害が起こったと考えられた。一般にDMDでは出生時に呼吸障害は認めないが、未熟児においては呼吸障害が高度であることが報告されている(Phadek A, et al., Anesth Analg 2007; 105: 977-980)。筋ジス犬とDMDの呼吸障害の出現時期の違いは、筋ジス犬を含めイヌでは筋発達が他の動物やヒトに比べてかなり遅れていることから(Lanfossi M, et al., Acta Neuropathol 1999; 97: 127-138)、出生時の筋成熟の違いが関連している可能性がある。また、血清CK値の経時的観察から生後48時間後には全犬で臍帯血のレベルまで戻っていたが、筋ジス犬は高値を示していたことは、少なくとも生後2日以降には正常犬や保因犬で見られた分娩の影響はなくなっていると考えられ、同時点での血清CK値を用いた新生児のスクリーニングが可能であることを示唆している。DMDの早期診断は、将来の家族計画や今後開発されるうる治療法を早期より検討する上で重要と考えられるため、新生児期の様々な時点において血清CK値を測定することで、DMDの新生児スクリーニングの時期について新たな知見が得られる可能性がある。
【0084】
[実施例2]横隔膜における遺伝子発現の変化
本実施例では、cDNAマイクロアレイを用いて、筋ジス犬の横隔膜において呼吸開始前後で発現が増加している遺伝子について検討した。具体的には、呼吸開始前の正常犬と筋ジス犬新生仔は帝王切開で摘出し、蘇生前に剖検を行った(各4頭)。また、呼吸開始後の正常犬及び筋ジス犬新生仔は、蘇生1時間後に剖検を行った(各4頭)。採取し、凍結保存した横隔膜からRNeasy Mini Kit(Qiagen,Hilden,Germany)を用いてtotal RNAを抽出した。RNA濃度は、NanoDrop ND-1000 UV-分光光度計(NanoDrop Technologies,Wilmington,DE,USA)を用いて測定した。RNAの質を、Agilent Bioanalyzer 2100(Agilent Technologies,Santa Cruz,CA,USA)で検定した。個々のtotal RNA(500ng)は犬用のwhole genome oligo microarray 44K(Agilent Technologies)にアプライし、ハイブリダイゼーションはBio Matrix Research社(流山,千葉)で行った。蛍光イメージはAgilent Technologies microarray scanner(Agilent Technologies)を用いて得た。標準化はGeneSpring 10.0(Tomy Digital Biology,Denver,CO,USA)を用いてチップ間の遺伝子を比較して行った。正常犬と筋ジス犬の呼吸開始前と呼吸後の間で発現量に違いのある遺伝子を、ANOVA検定を行った後、Benjamini and Hochberg法による多群間検定を行って選別した。
【0085】
また、マイクロアレイの結果から各群間で10倍以上に発現が増加していた遺伝子については、定量的PCR法(リアルタイムPCR)を用いて検定を行った。用いた各個体のtotal RNAはcDNAマイクロアレイに用いたものと同じtotal RNAを使用した。18s RNA(内部コントロール)、オステオポンチン、c-fos、egr-1、IL6、及びIL8の各遺伝子の増幅用プライマーを設計した(表2)。
【0086】
【表2】

【0087】
リアルタイムPCRは、SYBR mixed Ex Taq II kit(Takara)を用いて95℃20秒間、60℃1分間の40サイクルのPCR反応をBioRad iCycler system(BioRad)で行った。各遺伝子の発現量は18s RNAに対する相対値[(Ct/18s RNA−Ct/目的の遺伝子)]として求めて、呼吸開始前後の正常犬及び筋ジス犬との多群間比較を行った。
【0088】
さらに、上記遺伝子に対応するタンパク質について、ウエスタンブロット法及び免疫組織化学法によるタンパク質の測定も実施した。ウエスタンブロット法は、以下の通り行った。すなわち、凍結固定した横隔膜をサンプルバッファー(62.5mM Tris-HCl,pH 6.8,2% SDS,10%グリセロール)でホモジナイズし、遠心分離(15,000g,10分間)後に上澄を採取した。DC Assayキット(BioRad,CA,USA)を用いてタンパク質濃度を測定した後、95℃で5分間の熱変性を行い、40μgをウエスタンブロットに供した。PVDF転写膜は0.1% Tween 20を含むトリス緩衝生理食塩水(TBST)+5%スキムミルクでブロッキングを行い、一次抗体を用いて4℃で16時間のインキュベーションを行った。一次抗体にはオステオポンチン(Rb-9097,Thermo Fisher Scientific)、c-Fos(#2250,Cell Signaling Technology)、EGR1(sc-189,Santa Cruz Biotechnology)、IL-6(AF1609,R&D Systems,Minneapolis,MN,USA)、及びIL-8(ab34100,Abcam)を用いた。転写膜をTBST液で洗浄後、二次抗体(マウス又はウサギ特異的HRP標識抗体)でインキュベートを行い、再度TBST液で洗浄し、ECL-Plus Western Blotting Detection System(GE HealthCare,Buckinghamshire,UK)で検出した。
【0089】
また、免疫組織化学は、薄切した凍結固定標本を15分間乾燥後、5%ウシ血清アルブミン(BSA)又は熱不活化正常ヤギ血清アルブミンを含むリン酸緩衝生理食塩水(PBS)(pH 7.4)で洗浄し、一次抗体で4℃で16時間のインキュベートを行った。一次抗体には、CD18(MCA1780,AbD Serotec,Oxford,UK)、CD68(M0876,Dako,Denmark)、CD11b(MCA1777S,AbD Serotec)、C5b-9(ab66768,Abcam,Cembridge,UK)、cleaved-caspase 3(#9661,Cell Signaling Technology,Beverly,MA,USA)、LC3(#4108、Cell Signaling Technology)、オステオポンチン(Rb-9097,Thermo Fisher Scientific,Waltham,MA,USA)、c-Fos(#2250,Cell Signaling Technology)、EGR1(#4153,Cell Signaling Technology)、IL-6(sc-80108、Santa Cruz Biotechnology,Sacta Crus,CA,USA)、及びIL-8(109-401-311,Rockland Immunohistochemical,Gilbertsville,PA,USA)を用いた。PBSを用いて室温で洗浄後、FITCで標識した二次抗体を用いて室温でインキュべート後に再びPBSで洗浄し、蛍光顕微鏡で観察した。
【0090】
なお、2群間のデータの比較にはstudent-t検定を、死亡率の検定にはカイ二乗検定を用いた。また、リアルタイムPCRのデータにおける多群間比較には、ANOVA検定を行った後、Tukey's法による多群間検定を行った。データは平均値±標準誤差を用いて示し、p < 0.05を有意差ありと判定した。
【0091】
その結果、呼吸開始前の筋ジス犬では、オステオポンチンが正常犬横隔膜の約27倍に著しく発現しており、タンパク量の増加と筋細胞質内及び間質に局在することを確認した(図3〜6)。また、オステオポンチンは呼吸開始後の筋ジス犬横隔膜においても高い発現を有していた。オステオポンチンは、ジストロフィン欠損筋の再生早期に高発現していること(Hirata A, et al., Am J Pathol 2003; 163: 203-205)や、線維化の促進に関連すること(Vetrone SA, et al., J Clin Invest 2009; 119: 1583-1594)が報告されている。オステオポンチンの活性化は、stretch-activated channelにより流入した細胞内カルシウムイオンによって起こり(Allen DG, et al., Can J Physiol Pharmacol 2010; 88: 83-91)、好中球やマクロファージを誘導するサイトカインとしての役割を有している(Wang KX, et al., Cytokine Growth Fact 2008; 19: 333-345)。本発明者のデータと既報告を考え合わせると、オステオポンチンは、筋ジストロフィーの病態のより早期の段階から発現して炎症細胞を誘導することなどに関連し、さらに後期に起こる線維化にも関与していると考えられ、DMDの病態に本質的な役割を担っている可能性がある。なお現在、DMDに対する治療における標的分子の一つとして考えられている(Vetrone SA, 2009、及びQureshi MM, et al., J Diet Suppl 2001; 7: 159-178)。
【0092】
呼吸開始後の筋ジス犬横隔膜では、転写因子/シグナル伝達分子であるc-fos及びegr-1が筋細胞核及び細胞質に強く発現していた(図7〜10)。即初期遺伝子であるc-fos及びegr-1は局所的な細胞内カルシウムイオン濃度により制御され(Schaefer A, et al., Biochem J 1998; 355: 505-511; Grembowicz KP, et al., Mol Biol Cell 1999; 10: 1247-1257)、下流の様々な遺伝子を誘導する。また、炎症/免疫応答遺伝子であるIL-6及びIL-8の発現も筋ジス犬横隔膜で著しく増加し、筋細胞質に局在していた(図7〜10)。IL-6及びIL-8は、それぞれEGR1(Schuringa JJ, et al., Cytokine 2001; 14: 78-87)及びc-Fos(Cullen EM, et al., Mol Immunol 2010; 47: 1701-1709)の下流遺伝子であり、ともに筋細胞内で産生されるサイトカイン(マイオカイン)として運動後の正常骨格筋において発現が増加することが報告されている(Pedersen BK, et al., J Appl Physiol 2007; 103: 1093-1098)。IL-6は、正常骨格筋の代謝恒常性の維持に関わっている可能性が指摘されているが(Febbraio MA, et al., FASEB J 2002; 16: 1335-1347)、機械的負荷後のジストロフィー筋における炎症誘発的な役割を担っているかもしれない。IL-8は傷害部位における好中球の誘導に関連する主なケモカインである(Peterson JM, et al., J Appl Physiol 2009; 106: 130-137)。抗体を用いた好中球の除去がmdxマウス筋壊死を減少させたことから、好中球がジストロフィーの初期の病態の中心的な役割を担っていることが報告されている(Hodgetts S, et al., Neuromuscl Disord 2006; 16: 591-602)。以上のデータから、ジストロフィー筋における機械的負荷から炎症性細胞が浸潤するまでの分子機構を明らかにしたと考えられる。
【0093】
以上から、c-fos、erg-1、IL-6及びIL-8は、筋ジス犬において呼吸開始後から高発現され、これらを筋ジストロフィーのマーカーとして使用できることがわかった。
【配列表フリーテキスト】
【0094】
配列番号17〜28:人工配列(プライマー)
【特許請求の範囲】
【請求項1】
サンプルにおいてc-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つのマーカーの発現を測定するための手段を含むことを特徴とする筋ジストロフィー診断薬。
【請求項2】
測定手段がDNAプライマー及び/又はDNAプローブである、請求項1に記載の診断薬。
【請求項3】
測定手段が抗体である、請求項1に記載の診断薬。
【請求項4】
サンプルが、筋サンプル、血液サンプル及び血清サンプルからなる群より選択される、請求項1〜3のいずれか1項に記載の診断薬。
【請求項5】
筋ジストロフィーの診断が、筋ジストロフィーの保因の判定又は筋ジストロフィーの発症の予測である、請求項1〜4のいずれか1項に記載の診断薬。
【請求項6】
筋ジストロフィーの治療薬又は治療法のスクリーニング方法であって、
(a)筋ジストロフィー発症動物又は筋ジストロフィー保因動物に由来する筋細胞を、被験治療薬又は治療法により処置するステップ、
(b)該筋細胞において、c-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つのマーカーの発現を測定するステップ、
(c)(b)の結果に基づいて被験治療薬又は治療法を筋ジストロフィーの治療薬又は治療法の候補として同定するステップ
を含む方法。
【請求項7】
筋ジストロフィーの治療薬又は治療法のスクリーニング方法であって、
(a)被験治療薬又は治療法による処置を受けた、筋ジストロフィー発症動物又は筋ジストロフィー保因動物からのサンプルにおいて、c-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つのマーカーの発現を測定するステップ、
(b)(a)の結果に基づいて被験治療薬又は治療法を筋ジストロフィーの治療薬又は治療法の候補として同定するステップ
を含む方法。
【請求項8】
被験治療薬又は治療法による処置を行う前に、筋細胞又はサンプルにおいて、c-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つのマーカーの発現を測定するステップをさらに含む、請求項6又は7に記載の方法。
【請求項9】
筋細胞又はサンプルにおけるマーカーの発現が、非処置の筋細胞又はサンプルにおける同じマーカーの発現よりも低い場合には、被験治療薬又は治療法が筋ジストロフィーの治療薬又は治療法の候補として同定される、請求項6〜8のいずれか1項に記載の方法。
【請求項10】
筋ジストロフィーの治療薬又は治療法の有効性の評価方法であって、
(a)被験治療薬又は治療法による処置を受けた、筋ジストロフィー発症動物又は筋ジストロフィー保因動物からのサンプルにおいて、c-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つのマーカーの発現を測定するステップ、
(b)(a)の結果に基づいて被験治療薬又は治療法の有効性を評価するステップ
を含む方法。
【請求項11】
筋ジストロフィー発症動物又は筋ジストロフィー保因動物が、筋ジストロフィーを発症した若しくは保因しているヒト、又は筋ジストロフィーモデル動物である、請求項6〜10のいずれか1項に記載の方法。
【請求項1】
サンプルにおいてc-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つのマーカーの発現を測定するための手段を含むことを特徴とする筋ジストロフィー診断薬。
【請求項2】
測定手段がDNAプライマー及び/又はDNAプローブである、請求項1に記載の診断薬。
【請求項3】
測定手段が抗体である、請求項1に記載の診断薬。
【請求項4】
サンプルが、筋サンプル、血液サンプル及び血清サンプルからなる群より選択される、請求項1〜3のいずれか1項に記載の診断薬。
【請求項5】
筋ジストロフィーの診断が、筋ジストロフィーの保因の判定又は筋ジストロフィーの発症の予測である、請求項1〜4のいずれか1項に記載の診断薬。
【請求項6】
筋ジストロフィーの治療薬又は治療法のスクリーニング方法であって、
(a)筋ジストロフィー発症動物又は筋ジストロフィー保因動物に由来する筋細胞を、被験治療薬又は治療法により処置するステップ、
(b)該筋細胞において、c-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つのマーカーの発現を測定するステップ、
(c)(b)の結果に基づいて被験治療薬又は治療法を筋ジストロフィーの治療薬又は治療法の候補として同定するステップ
を含む方法。
【請求項7】
筋ジストロフィーの治療薬又は治療法のスクリーニング方法であって、
(a)被験治療薬又は治療法による処置を受けた、筋ジストロフィー発症動物又は筋ジストロフィー保因動物からのサンプルにおいて、c-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つのマーカーの発現を測定するステップ、
(b)(a)の結果に基づいて被験治療薬又は治療法を筋ジストロフィーの治療薬又は治療法の候補として同定するステップ
を含む方法。
【請求項8】
被験治療薬又は治療法による処置を行う前に、筋細胞又はサンプルにおいて、c-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つのマーカーの発現を測定するステップをさらに含む、請求項6又は7に記載の方法。
【請求項9】
筋細胞又はサンプルにおけるマーカーの発現が、非処置の筋細胞又はサンプルにおける同じマーカーの発現よりも低い場合には、被験治療薬又は治療法が筋ジストロフィーの治療薬又は治療法の候補として同定される、請求項6〜8のいずれか1項に記載の方法。
【請求項10】
筋ジストロフィーの治療薬又は治療法の有効性の評価方法であって、
(a)被験治療薬又は治療法による処置を受けた、筋ジストロフィー発症動物又は筋ジストロフィー保因動物からのサンプルにおいて、c-Fos、EGR1、IL-6及びIL-8からなる群より選択される少なくとも1つのマーカーの発現を測定するステップ、
(b)(a)の結果に基づいて被験治療薬又は治療法の有効性を評価するステップ
を含む方法。
【請求項11】
筋ジストロフィー発症動物又は筋ジストロフィー保因動物が、筋ジストロフィーを発症した若しくは保因しているヒト、又は筋ジストロフィーモデル動物である、請求項6〜10のいずれか1項に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2013−7724(P2013−7724A)
【公開日】平成25年1月10日(2013.1.10)
【国際特許分類】
【出願番号】特願2011−142312(P2011−142312)
【出願日】平成23年6月27日(2011.6.27)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 研究集会名:第52回日本神経学会学術大会 主催者名:一般社団法人日本神経学会 開催日:平成23年5月18日〜20日 刊行物名:第52回日本神経学会学術大会 プログラム・抄録集 発行日:平成23年5月3日 掲載頁:367頁(01−214)
【出願人】(510147776)独立行政法人国立精神・神経医療研究センター (4)
【Fターム(参考)】
【公開日】平成25年1月10日(2013.1.10)
【国際特許分類】
【出願日】平成23年6月27日(2011.6.27)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 研究集会名:第52回日本神経学会学術大会 主催者名:一般社団法人日本神経学会 開催日:平成23年5月18日〜20日 刊行物名:第52回日本神経学会学術大会 プログラム・抄録集 発行日:平成23年5月3日 掲載頁:367頁(01−214)
【出願人】(510147776)独立行政法人国立精神・神経医療研究センター (4)
【Fターム(参考)】
[ Back to top ]

