粒子の特性評価方法及び装置
【課題】粒子からの信号と背景からの信号を明確に区別できる位相に敏感な技術を実装して粒子の特性評価における信号対雑音比を向上する方法と装置を提供する。
【解決手段】チャネル34は、検出領域における発光を変調する光学素子32を備える。光学素子32からの発光を時間の関数として検出する検出器31を有する。光は、チャネル34を移動する粒子36および粒子38から発光する。粒子36,38と光学素子装置32の間の相対運動により粒子36および38を適切に解析するために必要な変調が生じる。空間変調光学素子は、検出器31に対し時間変調された信号を生成する。この信号は、処理モジュール39で解析される。
【解決手段】チャネル34は、検出領域における発光を変調する光学素子32を備える。光学素子32からの発光を時間の関数として検出する検出器31を有する。光は、チャネル34を移動する粒子36および粒子38から発光する。粒子36,38と光学素子装置32の間の相対運動により粒子36および38を適切に解析するために必要な変調が生じる。空間変調光学素子は、検出器31に対し時間変調された信号を生成する。この信号は、処理モジュール39で解析される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、高感度での粒子特性評価のために空間変調された励起または発光を実施する方法および装置に関する。
【背景技術】
【0002】
粒子の特性評価方法(一般的に、検出、および、位置・姿勢の特定、粒子計数法、細胞分類など他の有用な特性評価に関する)では、背景に比べて粒子(一般的に、小物体)から得られる信号は通常弱いため、多くの場合、信号対雑音比(SNR)の低さが問題となる。特に、粒子の特性評価における光学的な方法に関して、問題である。また、信号対雑音比の低さは、細胞、エアロゾル、分子、周りの液体とは異なる液体の小体積(つまりエマルジョン)、または選択した位置に染色またはタグ付けされたDNA断片、などの個々の粒子を検出する場合に、特に顕著となる。
【0003】
DNAの件に関してみると、従来のDNA塩基配列決定法は、DNA鎖を小さな断片に分け、電気泳動によって断片を分類し、DNA塩基配列を精巧に再構築することによって行なわれていた。これに代わる処理方法が近年開発されたが、この代わりの処理方法では、特定の塩基配列を蛍光色素によりタグ付けする。分子を引き伸ばした(つまり「直鎖化」した)後、DNA鎖をマイクロ流体チャネル内において定速で移動させる。高空間分解能(約1μm)を有する特殊な蛍光読み取り装置を用いて、蛍光色素、つまりタグの位置を記録する。結果的に、タグの位置を含むDNA「光学バーコード」が記録されるので、DNA塩基配列を特定可能である。
【0004】
DNAに沿ったタグ間の一般的な距離は、数μmである。このため、1μmまたはより優れた空間分解能が必要となる。一般的に、共焦点顕微鏡を用いることでこの目的は達成できる。共焦点顕微鏡は、微小体積(1μm3以下)の蛍光の励起および検出を可能にする。
【0005】
図1に、空間分解された蛍光励起における従来の方法を概略的に示す。図のように、装置10は、検出器12、チャネル14、および励起光16を含む。チャネル14内の小体積を励起し、励起された小体積からの光を集める。タグ部22を有するDNA鎖20をチャネル14の励起部24に通し、タグの位置を、時間依存性検出信号を使用して算出する。
【0006】
【特許文献1】特開2004−275109号公報
【発明の開示】
【発明が解決しようとする課題】
【0007】
この方法は、効果的に実施されている。しかしながら、適切な大きさの励起体積と検出体積を確保するためには、高性能であってかさばる光学素子が必要となる。さらに、得られる信号対雑音比は所望するよりも低い。
【課題を解決するための手段】
【0008】
本発明の一態様に係る方法は、空間変調された励起領域を生成するステップと、粒子と励起領域との間で相対運動を起こすステップであって、粒子が励起領域にさらされて励起されることで時間変調された信号を得るステップと、変調された信号を記録するステップと、を含む。
【0009】
本発明の他の態様では、励起領域は、励起パターンを含む。
【0010】
本発明のさらに他の態様では、時間変調された信号は、粒子からの発光によって生じる。
【0011】
本発明のさらに他の態様では、励起領域は、干渉縞を含む。
【0012】
本発明のさらに他の態様では、励起領域は、少なくともシャドーマスクとレンズアレイのうちの1つによって生成される。
【0013】
本発明のさらに他の態様では、励起パターンは、化学発光によって生成される。
【0014】
本発明のさらに他の態様に係る方法は、さらに、信号に基づき粒子の位置を特定するステップと、信号に基づき粒子を数えるステップと、信号に基づき粒子を分類するステップと、のうちの少なくとも1つを含む。
【0015】
本発明のさらに他の態様では、検出は画素化検出器(pixilated detector)による検出を含む。
【0016】
本発明のさらに他の態様では、粒子は、DNA分子の一部またはDNA分子に付随の分子であって、信号を使用してDNA塩基配列を決定する。
【0017】
本発明のさらに他の態様では、検出は、蛍光を発する検体の蛍光スペクトルを受ける分光計を使用することを含む。
【0018】
本発明のさらに他の態様では、励起領域の生成は、幾何学的配置(geometry)、電界または磁界、蛍光消光、検体濃度、密度、および定常音波のうちの少なくとも1つに基づき空間変調パターンを生成することを含む。
【0019】
本発明のさらに他の態様では、励起パターンの生成は、環境に基づき空間変調された領域を生成することを含む。
【0020】
本発明のさらに他の態様では、粒子の位置を特定するように生成すること、引き起こすこと、および記録することは、二次元で行われる。
【0021】
本発明のさらに他の態様では、粒子の特性評価方法は、チャネル内で粒子を動かすステップと、粒子が時間変調された信号を生成するような環境をチャネルに沿って整えるステップと、時間変調された信号を検出および評価するステップと、を含む。
【0022】
本発明のさらに他の態様では、環境は、光学素子と、光学素子によって検出される光を発する粒子と、を含む。
【0023】
本発明のさらに他の態様では、粒子の位置の関数として粒子から取得した信号を変調するように、光学素子を操作可能である。
【0024】
本発明のさらに他の態様では、方法はさらに、光学素子を動かすことを含む。
【0025】
本発明のさらに他の態様では、光学素子は、少なくともシャドーマスクおよびマイクロレンズアレイのうちの1つである。
【0026】
本発明のさらに他の態様では、方法はさらに、信号に基づき粒子の位置を特定するステップと、信号に基づき粒子を数えるステップと、信号に基づき粒子を分類するステップと、のうちの少なくとも1つを含む。
【0027】
本発明のさらに他の態様では、検出は、画素化検出器による検出を含む。
【0028】
本発明のさらに他の態様では、粒子は、DNA分子の一部またはDNA分子に付随の分子であって、信号を使用してDNA塩基配列を決定する。
【0029】
本発明のさらに他の態様では、検出は、粒子の蛍光スペクトルを受ける分光計を使用することを含む。
【0030】
本発明のさらに他の態様では、幾何学的配置、電界または磁界、蛍光消光、検体濃度、密度、および定常音波のうちの少なくとも1つに基づき光をパターン化するように、光学素子を操作可能である。
【0031】
本発明のさらに他の態様では、粒子の特性評価装置は、空間変調された励起領域を生成する手段と、粒子と領域との間で相対運動を起こす手段であって、粒子は、時間変調された信号を得られるように、励起領域にさらされて励起される手段と、変調された信号を記録する手段と、を含む。
【0032】
本発明のさらに他の態様では、装置はさらに、信号に基づき粒子の位置を特定する手段と、信号に基づき粒子を数える手段と、信号に基づき粒子を分類する手段と、のうちの少なくとも1つを含む。
【0033】
本発明のさらに他の態様では、粒子の特性評価装置は、チャネルと、チャネル内で粒子を動かす手段と、粒子が時間変調された信号を生成するように操作できる、チャネルに沿った環境と、時間変調された信号を記録および評価する検出装置と、を含む。
【0034】
本発明のさらに他の態様では、環境は光学素子を含む。
【0035】
本発明のさらに他の態様では、装置はさらに、粒子を発光させるように操作できる反共振導波管を含む。
【0036】
本発明のさらに他の態様では、装置はさらに、信号に基づき蛍光検体の位置を特定する手段と、信号に基づき粒子を数える手段と、信号に基づき粒子を分類する手段と、のうちの少なくとも1つを含む。
【0037】
本発明のさらに他の態様では、環境は二次元評価を可能にする。
【発明を実施するための最良の形態】
【0038】
本発明は、粒子からの信号と背景からの信号を明確に区別できる位相に敏感な技術を実装することによって、粒子の特性評価における信号対雑音比を向上する方法と装置に関する。この方法は、粒子と環境との間に、制御された相対運動を意図的に生じさせることを基本とする。例えば、粒子と調整された環境とを動かすことによって、時間変調された信号を生じさせる。監視する応答には、雑音を含む背景信号と、変調された信号とが含まれ、粒子の時間的依存性が明確になる。粒子に属す信号を抽出するには、ハードウェアおよびソフトウェアによる両面の解決策を利用することができる。そして粒子に属す信号は、検出、位置/姿勢の特定、細胞分類などの多様な用途に適用可能な粒子の特性評価に使用できることを理解されたい。このような特性評価を達成するには、さまざまな技術を用いることができる。
【0039】
信号としては、時間の関数としていかなる形式の信号も意図されていることは、理解されるであろう。定期的である必要はなく、ランダムに変調された信号であっても、信号の構造さえ分かっていれば利用可能である。また、構造が分かっている場合で、解析上の法則に則っていない場合でもよい。つまり、粒子のオンおよびオフ状態を定義する時間間隔は、ランダムな長さになる場合がある。信号の時間依存性が装置に組み込まれている場合であっても、装置の時間依存性は、予想可能または分かっている場合、変動させてもよい。
【0040】
信号の符号化を異ならせる(例えば、チャープ性または完全な周期性など)ことによって、個々の用途に固有の効果をもたらすことができる。チャープ信号は、空間的分解能と粒子分類性能を向上する。完全な周期信号は、粒子速度の特定を可能にし、また粒子ごとの速度が異なる場合により適用性が高い。
【0041】
説明のため、図12において各種の信号を示す。例えば、信号12‐1は、周期信号である。信号12‐2は、チャープ信号であって、例えば直線的に周期が増加する信号である。ランダム信号12‐3も示す。これらの信号(および他の信号)は、本発明の目的を達成するための実施形態に関連して使用できることを理解されたい。
【0042】
本発明の実施形態は、次を含むさまざまなケースに関し記述されている。(1)動いている個々の粒子の収集。(2)直鎖化されたDNA鎖であって、対象物が与えられ、鎖の全長に渡って固定される(すなわち一般的にはDNA配列と呼ばれる)。(3)面上に潜在的に固定された粒子の収集(用途によっては、二次元の解析を必要とする)。
【0043】
また、検出対象となる粒子は、細胞、エアロゾル、選択した位置に染色したDNAのDNA物質断片、周りの液体部分とは異なる液体の小体積(つまり、エマルジョン)、液滴、他の流体の小体積、気泡、単分子、凝集分子、分子クラスタ、生体細胞、ウイルス、バクテリア、タンパク質、微粒子、ナノ粒子、およびエマルジョンなどを含む。液滴または流体の小体積は、屈折率、吸収性、および他の光学的特性に影響を与える、例えば、原子、分子および他の粒子を含む。対象物が一連の位置に渡って動く場合、対象物は「移動する」、または「移動される」ことになる。例えば対象物は、液体、気体、またはエアロゾルなどの流体内で運ぶことができ、その場合対象物は「流体によって搬送される」と表現される。さらに、チャネルとは、壁によって画定される物ばかりではなく、例えばエアロゾルの流れ内における粒子の流れによって画定される物など、さまざまな形式で画定されることを理解されたい。
【0044】
また、これらの粒子からの発光は、蛍光励起、弾性および非弾性の光散乱法、化学発光および他のタイプの光散乱法、および屈折技術などを含む、さまざまな光源によって生じる。さらに、これらの実装に使用される光は、紫外線、可視光線、赤外線、近赤外線などのさまざまな異なる種類の光を含む。より詳細には下記に述べるが、この粒子の特性評価方法が実装される環境は、粒子の空間変調された励起、または、検出領域における粒子からの発光に対する変調を含む。この点では、粒子は均一の励起を発光し、それを例えばシャドーマスクまたは他の光学素子を使用してフィルタすることによって、発光の空間変調を生じさせる。
【0045】
本発明の実施形態は、光学素子のみでなく、電気容量、誘導、抵抗などの非光学素子環境にも適用できることを理解されたい。図2〜14は、全般的に光学素子に関し、図15は、非光学素子の例に関する。
【0046】
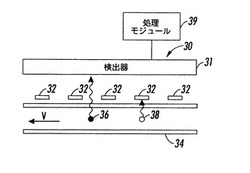
ここで図2を参照して、装置30を説明する。装置30において、チャネル34は、検出領域における発光を変調する光学素子32を備える。光学素子32は、レンズ、マスク、およびフィルタなど、さまざまな形式を取ることができる。さらに、光学素子32からの発光を時間の関数として検出する検出器31も示す。検出器31(およびここで説明する他の検出器)は、光ダイオード、アバランシェフォトダイオード、光電子増倍管などを含むさまざまな形式を取ることができることを理解されたい。また、検出器31および光学素子32は、1つの素子または装置に組み入れてもよい。
【0047】
光は、チャネル34を移動する粒子36および粒子38などの粒子から発光することができる。粒子からの発光は、上述のさまざまな現象によって生じされることができることを理解されたい。また、粒子36,38と光学素子装置32(つまり出力変調器)の間の相対運動によって、粒子36および38を適切に解析するために必要な変調が生じる。空間変調光学素子は、検出器31に対し時間変調された信号を生成する。この信号は、上述のとおり予想可能なさまざまな形式であって、粒子の特性評価を目的として、処理モジュール39を使用して解析可能である。
【0048】
上述のように、時間関数として生成される信号は、さまざまな環境因子に応じて、周期的、チャープ型、ランダムなど、さまざまな形式となる。本実施形態ならびに図3および図4の実施形態に適用可能な一形式では、光学素子は、信号の種類に適合する形式とすることができる。つまり、光学素子の構造は、図12において例として挙げた信号に使われる光学素子の構造に類似してもよい。
【0049】
相対運動は、粒子を動かすことによって、または検出器/光学素子を例えばチャネルに沿って動かすことによって、もしくは両方の要素を動かすことによって得られることを理解されたい。さらに、両方の要素を動かすことによって、一形式では、各要素が異なる速度で動く場合もある。
【0050】
次に図3を参照し、装置40を説明する。装置40は、チャネル42を含む。チャネル42は、粒子(粒子46や48など)が発光する領域44を備える。示されている領域44では、変調された励起部がさまざまな方法で生成される。これらの方法には、干渉、シャドーマスク、レンズアレイの使用、化学発光および蛍光消光の使用、が含まれる。粒子と励起部(または励起パターン)との間の相対運動は、粒子を動かすことによって、または励起パターンを動かすことによって、もしくは両方を動かすことによって実現できる。前の実施形態同様、両方を動かすことによって、一形式では、それぞれが異なる速度で動く場合もある。空間変調光学素子は、検出器41に対し時間変調された信号を生成する。この信号は、上述のとおり予想可能なさまざまな形式であって、粒子の特性評価を目的として、処理モジュール49を使用して解析可能である。
【0051】
次に図4を参照し、装置50を説明する。装置50は、チャネル52および反共振導波管54を含む。反共振導波管は、粒子がチャネル内部を移動するとき、チャネルに均一な照明を与える。変調は、ミラー56によって行なうことができ、ミラー56は、チャネルの内部または外部に適切に設置する。ここでも空間変調光学素子は、検出器51に対し時間変調された信号を生成する。この信号は、上述のとおり予想可能なさまざまな形式であって、粒子の特性評価を目的として、処理モジュール59を使用して解析可能である。
【0052】
図2〜4を参照して説明した実施形態から明確なように、本発明の実施形態は、粒子が他の種類の媒体(例えば液体)内を移動する際の粒子の特性評価を、変調によって改善して提供するものである。場合によっては、粒子から発光される光が変調され、他の場合では、粒子に対する励起を変調することによって変調が行なわれる。どちらの場合も、変調効果をもたらすのは、装置要素間の相対運動である。
【0053】
図11を参照し、他の実施形態を説明する。当然ながら、粒子を検出面に撮像するさまざまな構成が考えられる。そのような一例として示した構成では、粒子304が内部で移動するチャネル302付近に、装置300を設置する。粒子304は、検出器306によって検出される。検出器306の上には、光学素子308があり、空間パターンを生じるように操作することができる。粒子の検出は、光学素子310によって容易になる。光学素子310は、レンズまたはレンズ系など、さまざまな形式を取ることができる。粒子は、物体面320に位置し、像面322は、検出器306および光学素子308と対応する。
【0054】
この配置では、粒子サイズ、パターンサイズ、および空間分解能は、基本的に分離している。この点において光学素子310は、粒子304を拡大(または縮小)し、粒子304から離れた場所での検出を可能にする。示したように、粒子304からの光は像面322において変調される。そして検出器306は、チャネル302に接して配置しなくても、チャネル302内の粒子304からの光を検出することができる。この構成では、光学素子308は、光学素子310の像面322内またはその付近に位置する必要がある。これにより、粒子304と非光学素子308の「光学距離」は最小となる。検出器自身が光学素子を備え、さらに追加で拡大または縮小できることを理解されたい。さらに、検出器のサイズは、装置のサンプリングレートを決定する要因となる。このため小型であって、より高速の検出器にチャネルを縮小し、サンプリングレートを引き上げることが好適な場合もある。
【0055】
さらに、光学素子をチャネルに接して配置することもできる。その場合、検出器と光学素子との間の距離は、チャネルの大きさによって決定されるであろう。
【0056】
本発明の実施形態のより具体的な実施例は、DNA塩基配列決定法に関する。図5を参照し、本発明の実施形態に係る装置100を説明する。装置は、検出器102と、流体チャネル104と、空間変調された励起パターン108を有する励起光106と、を含む。パターン108は、チャネル104と位置が合わせられ、検出領域または検出部105を生成する。装置100は、例えばDNA鎖110の搬送を可能にする。DNA鎖110は、基幹部112と、それに埋め込まれている蛍光タグまたは粒子114を含む。少なくとも一形式では、干渉パターン108は、レーザ源などのエネルギ源によって生成され、粒子の流れに直角にサブミクロン単位の周波を有する。他の角度も使用可能であることを理解されたい。蛍光粒子114がパターン108を通ってチャネル104を移動する際に、蛍光粒子またはタグ114の速度および縞パターン108の周波に従って、蛍光発光は変調される。少なくとも1つの縞上の発光を記録する信号検出器102を使用できる。検出された信号は、検出器用高速読み出し機構によって記録され、検出部105、結果的には励起パターン108を通る間、蛍光粒子またはタグ114の「点滅」が取得される。示されているように、粒子の特性評価を目的として信号を解析するように、処理モジュール109を実装してもよい。
【0057】
本発明の実施形態は、信号対雑音比および空間分解能が高い蛍光検出を可能にし、下記に示すように、高額でかさばる光学素子を必要としない。
【0058】
上述の具体的な用途では、DNA基幹部112は、全体的には第1種類の蛍光体でラベル付けされており、直鎖分子の特定の部分は第2種類の蛍光体、つまり蛍光タグ114でラベル付けされている。図6に、本実施形態に係る検出機構をより詳しく示す。示されているとおり、均一にラベル付けされたDNA基幹部112が検出部105を通過するときには、蛍光基幹信号120は、まず階段状の関数で増加する。さらに、タグ114の1つが励起パターン108の間を通るときには、基幹信号120には、正弦信号122が重ねられる。これにより、結果的に検出信号126となる。
【0059】
図5に示した実施形態の例では、検出器は1台のみ示されているが、複数台の検出器を実装してもよい。また、本実施形態を実現するには、さまざまな構成の検出器が実装可能であることを理解されたい。
【0060】
この点に関し次に図7を参照して、装置200を説明する。装置200では、タグ部114とDNA基幹部112は異なる検出器で検出されることが好適である。一般的に、基幹部112およびタグ部114は、異なる波長域で発光する発光体によってラベル付けされる。適切なフィルタを使用すれば、タグからの蛍光のみが検出器202に入り、一方検出器204は基幹部からのみ光を受けるようにすることが可能である。簡単な光学部品を利用して、フィルタの波長に対する選択感度を向上することができる。例えば、マイクロレンズアレイは、蛍光を平行光にすることができる。対象光の第1波長のみを伝送するばかりではなく、対象光の第2波長を対向する検出器に効率よく反射するようにフィルタを設計し、蛍光の損失を最小限にすることもできる。図7の装置200は、DNAの複数の異なる箇所をマーク付けする異なる蛍光タグからの蛍光を、同時に測定するために使用することもできる。
【0061】
また、第2段階の検出器206および208を同様に実装し、例えば実施されるDNA解析をさらに正確にできることを理解されたい。例えば、DNAの特性評価をさらに正確にするには、DNA鎖の異なった場所を異なる色のタグによりマーク付けし、蛍光を測定してもよい。
【0062】
適切なパターンを生成するには、いくつかの周知技術を適用して、例えば図8(a)〜(d)に示すように、干渉パターンを生成することができる。縞模様は、一次元で定常波を生成することによって、通常生成できる。例えば図8(b)では、ミラー80がチャネルの方向に定常波を生成する。他の方向でもよい。隣接する2つの干渉最高点の間の距離dは、次のように計算できる。
【0063】
d=λ/(2sinα)
【0064】
ここで、αは2つの干渉ビーム間の相対角度、λは波長を示し、dはαに依存してλ/2と無限大との間で変動する。
【0065】
一般的には、励起パターンは、「外部から」上面または下面を介して、または「平面内で」側面から、チャネルに向けられる。検出部品は多くの場合、上部または底部に取り付けられるので、検出器に届く励起光の量を低減するには、「平面内の」励起の使用が好ましい。
【0066】
図8(a)〜(b)に示したすべての干渉計技術は、基体と空気の界面上における内部全反射(TIR)を利用した導波管構造とミラーを使用して、マイクロ流体チャンバ内で実現できる。図8(a)にプリズム干渉計、図8(b)にミラー80を使用するロイド干渉計、図8(c)にビームスプリッタ84およびミラー86を使用するマイケルソン干渉計を示す。さらに高い信号対雑音比を達成するには、チャネル方向に干渉パターンを周期的に動かしてもよい。これは、図8(c)に示すように、ミラーを周期的に動く台(例えば、スピーカや圧電素子など)に設置することによって実現できる。この技術は、静止した粒子を対象とする場合も適応可能である。これにより、二重変調技術の使用によって、装置の検出感度を向上できる。
【0067】
最後に、図8(d)に位相マスク干渉計88を示す。好適な方法は、図8(d)に示すような位相マスクまたは透過型回折格子に基づく。−1次に散乱する光は、+1次に散乱する光と干渉する。回折は、0次および2次への散乱を最小とするように設計するとよい。ここで示したほとんどの技術は、複数の流体チャネルを使用した励起が実行できるように設計可能である。図10に、位相マスク90のような位相マスクに基づき平行なチャネルを照射する他の設計を示す。
【0068】
本発明の実施形態の教示を反映した複数の装置を例として説明したが、本発明の実施形態に係る方法は、少なくとも1つの形式では、空間変調された環境を基本的に整えるステップと、その環境内で励起された粒子から発せられる光を検出するステップと、検出結果に基づき時間変調された信号を生成するステップとを含む。少なくとも1つの形式では、生成された信号を使用して、励起された粒子(例えばDNA鎖のタグなど)の位置を特定する。装置は、一つの形式では、空間変調された信号の生成および粒子の相対的な位置の特定など、その後の処理を可能にする処理モジュール(例えば、処理モジュール39,49,59,109)を備える。このような処理モジュールは、検出器内に組み込んでもよいし、検出器とは別に実装してもよい。この線に沿って、ここに記載する方法は、さまざまなハードウェア構成とソフトウェア技術を使用して実装可能なことを理解されたい。例えば、考えられる処理モジュールは、信号の生成と位置の特定を可能にするソフトウェアルーチンを含んでもよい。
【0069】
ここで図9を参照し、本発明の少なくとも一実施形態に係る方法500を説明する。最初に、励起パターンを生成する(ステップ502)。上述したように、励起は均一であって、シャドーマスクなど(例えば、変調器など)によってパターン化された出力を生成しもよい。次に、例えば蛍光検体と励起パターンの間に相対運動を形成する(ステップ504)。そして、時間を関数として発光または散乱された光を検出する(ステップ506)。その検出結果に基づいて空間変調された信号を生成する(ステップ508)。上述したように、空間変調された信号は、1つの形式では、DNA鎖のタグなど、蛍光粒子の相対的な位置を特定するために使用できる。
【0070】
DNAでの実装のように、蛍光発光に関する信号の検出については、変調された励起は、高い空間分解能を確保するだけではなく、同時に信号対雑音比を上げる方法を可能にする。背景信号に係るほとんどの発信源(例えば、幹線信号、散乱した励起によって励起された蛍光、およびその他のDCなどの電源)は、相関技術によって除外される。これによって、動いているタグから発せられる変調信号のみに対して検出感度が高い読み出し機構が可能となる。タグ速度が15μm/ms(またはmm/s)の場合を考えると、縞の幅が1μmであって、タグ付けされた部分の大きさが励起縞よりもかなり小さい周期的な励起パターンでは、周期ごとに約70μsの移動時間となる。これによって、蛍光信号の変調は、10kHz程度となる。さらに、蛍光と他の背景発信源(部屋の明かりなど)を区別するには、より高い周波数で励起源を変調するとよい。タグが1つの干渉縞を通過する間に、光源が数回オンおよびオフ状態に確実になるように、高い周波数を選ぶ必要がある。100kHzの変調周波数であれば、その基準を満たし、容易に実行可能である。さらに高速な検出器が利用可能となっているので、従来のロックインや相関技術を適用し、例えば、励起光を1MHzで検出器と同期させることによって、100kHzでより正確にサンプリングすることも可能である。
【0071】
本発明の実施形態の少なくとも1つの形式では、DNAのタグの位置を正確に特定するために、検出信号(取得手段にかかわらず)は、デコンボリューション処理される。信号は、高いサンプリングレートで記録される。時間情報は、上述のようにDNA鎖の速度を使用して位置情報に変換される。極めて周期的な励起パターンの場合は、時間依存性のある蛍光信号の周期性または他の周知技術によって、DNA鎖の速度を抽出する。解析は、フーリエ変換解析および最小二乗技術を含むさまざまな信号処理アルゴリズムを使用して実行できる。
【0072】
これらの技術は、より全般的には、粒子の特性評価を目的とするさらに他の検出にも適用可能である。図13を参照し、本発明のさらに他の実施形態を説明する。上述したとおり本発明は、一次元だけではなく、二次元にも適用可能である。この点に関し、粒子スキャナ200は、二次元の技術を使用して、粒子202の位置を特定することができる。粒子202は、粒子を含む流体中にあり、スキャナ200の土台部分に位置するスライド上に収容されている。スキャナ200は、変調パターン204および変調パターン206を含む。変調パターン204は、粒子202に対して、第1方向212に動き、一方変調パターン206は、続いて粒子202に対して、第2方向210に動く。一形式では、第1および第2方向は、実質的に相互に直角である。ベッド200の土台部分(または固定部分)も動かし、粒子と変調パターンとの間の相対運動を生成できることを理解されたい。さらに、変調パターン204および206は、粒子を励起する励起パターンとしてもよく、または、粒子からの一定な発光を変調するような光学素子として設けてもよい。意図された相対運動によって、光が検出され、粒子の位置の特定を可能にする対応する変調信号が生じる。この点に関し、両方の変調パターンが適切な信号を生成する位置に、粒子の位置を特定することができる。
【0073】
このような二次元の解析の実装は、有効である。例えば、このような形式の解析では、空間分解能がより高くなる。さらに、信号対雑音比も向上することができる。
【0074】
さらに、本発明の実施形態として、主に粒子に対する特性評価の光学的な方法に関連し、特に可視光を利用する方法を説明した。しかしながら本発明の技術は、他の非光学的な方法にも適用できることを理解されたい。
【0075】
図15において、変調出力信号として光の代わりに電気的な特性(静電容量、伝導率、インピーダンスなど)を利用する、非光学的な方法の一例を示す。この例では、粒子400は、光学アレイの代わりに、電極アレイ404を通ってチャネル402を移動する。電極アレイ404は、測定機器406に接続され、粒子の移動により影響を受ける時間依存信号(例えば、静電容量や電流など)を記録するように設定され、本発明の実施形態の目的を達成するように操作される。
【0076】
本発明の教示は、さらに広い範囲に及ぶ。例えば、蛍光強度が弱く、蛍光粒子が動いているあらゆる場合において、この技術を適用して、信号対雑音比を向上させることができる。例えば、下記のような場合である。
【0077】
粒子/分子数のカウントや血球計算を、変調された励起領域を通る蛍光分子数をカウントすることによって、高い信号対雑音比で行なうことができる。
【0078】
発光分光法:蛍光を分光計に入射することによって、変調された励起領域を通る粒子の蛍光スペクトルを、高い信号対雑音比で測定することができる。図14において、粒子600はチャネル602を移動する。シャドーマスク604は、検出器608の個々の画素に変調を与える。検出器608の各画素は、線形可変フィルタ606によって決まる部分領域Δ内において特定の波長で信号を記録する。この装置は、検出器612を備える粒子検出装置610に隣接して設置してもよい。
【0079】
本発明の実施形態に即し、粒子と空間変調された励起または発光パターンとの間の相対運動について述べたが、空間変調された励起パターンを通して粒子を動かすのではなく、検出装置をチャネルまたは搬送体/チップ上で走査してもよい。チップの場合、対象となる粒子はチップ上に固定され、粒子のチップ上の絶対位置を特定する。
【0080】
この考え方は、バイオチップの蛍光読み出し機構にも適用できる。
【0081】
空間変調は、他の方法でも実行可能である。例えば、幾何学的配置によって、空間変調の基礎を提供してもよい。この点に関し、例えばインタディジタル指形マスク(interdigitated finger−type mask)などの空間変調シャドーマスク、空間変調位相マスク、マイクロレンズアレイ、またはマイクロミラーアレイなどが使用できる。
【0082】
空間変調は、電場または磁場を使用することによっても得ることができる。この点に関し、場を変調することによって、蛍光発光強度を変えることができる。また、蛍光物質の濃度を場によって変調でき、さらに場によって光学経路を変えることができる。
【0083】
空間変調された音場(定常または変動音波、表面弾性波)も利用可能である。この点に関しても、場を変調することによって、蛍光発光強度を変えることができる。また、蛍光物質の濃度を場によって変調でき、さらに場によって光学経路を変えることができる。
【0084】
空間変調された蛍光消光を引き起こす移動経路内の空間変調された環境(例えば、固定分子コーティング(stationary molecular coating))も利用可能である。
【0085】
移動物質の発光特性を左右する空間変調された微小空洞共振器を同様に適用して、本発明の実施形態の目的を実現してもよい。
【0086】
本発明の利点は、明らかである。第1に、生成された信号の時間依存性を解析することによって、高い分解能で粒子の位置を特定できる。これは、空間変調された励起パターン(例えば、干渉パターンなど)を粒子と励起パターンとの間の相対運動と組み合わせることによって実現できる。
【0087】
第2に、空間分解能の下限は、干渉パターンの特徴量によって決まるが、特徴量は1μmよりもかなり小さくすることができる。信号対雑音比、信号の時間符号化、粒子とパターンの相対速度、検出器のサンプリングレート、および適用された評価技術によって、干渉パターンの特徴量よりも優れた空間分解能を達成可能である。
【0088】
第3に、解析された信号を、周期的な励起変化によって変調する。ロックイン技術や相関技術を適用して、信号対雑音比をかなり向上できる。
【0089】
第4に、極小さな体積に対して励起光の焦点を合わせたり、小さな体積からの光を集光したりするために、特別な光学素子を必要としない。
【0090】
第5に、これらの技術をラボオンチップ(lab−on−a−chip)プラットフォームに統合でき、容易に平行する複数の流体チャネルの解析に応用可能である。
【0091】
第6に、干渉パターン内の数個の蛍光粒子を同時に検出可能である。干渉パターンの特徴量によって、検出可能な2つの粒子間の距離が決まる。信号対雑音比、信号の時間符号化、粒子とパターンの相対速度、検出器のサンプリングレート、および適用された評価技術によって、干渉パターンの特徴量よりも優れた空間分解能を達成可能である。
【0092】
第7に、励起光強度を下げることによって、例えば生体細胞に対する損傷や染料の漂白を低減できる。
【0093】
上記開示したおよび他の特徴、機能、およびそれらの代わりは、他の多くの装置やアプリケーションに好適に組み込むことができることを理解されたい。また、現時点では予測も予想もできない代替案、変更、変形、または改善は、当業者によって後でなされる可能性があるが、それらは本発明の請求項に含まれるものと意図する。
【図面の簡単な説明】
【0094】
【図1】従来技術による装置を示す代表的な図である。
【図2】本発明の一実施形態を示す代表的な図である。
【図3】本発明の他の実施形態を示す代表的な図である。
【図4】本発明のさらに他の実施形態を示す代表的な図である。
【図5】本発明のさらに他の実施形態を示す代表的な図である。
【図6】本発明のさらに他の実施形態を示す代表的な図である。
【図7】本発明のさらに他の実施形態を示す代表的な図である。
【図8】本発明のさらに他の実施形態を示す代表的な図である。
【図9】本発明の一実施形態を示すフローチャートである。
【図10】本発明のさらに他の実施形態を示す代表的な図である。
【図11】本発明のさらに他の実施形態を示す代表的な図である。
【図12】本発明の実施形態において使用できる、さまざまな形式の信号を示す図である。
【図13】本発明のさらに他の実施形態を示す代表的な図である。
【図14】本発明のさらに他の実施形態を示す代表的な図である。
【図15】本発明のさらに他の実施形態を示す代表的な図である。
【符号の説明】
【0095】
10,30,40,50 装置、12,31,41,51 検出器、14,34,42,52 チャネル、16 励起光、20 DNA鎖、22 タグ部、24 励起部、32 光学素子、36,38,46,48 粒子、39,49,59 処理モジュール、50 反共振導波管、56 ミラー。
【技術分野】
【0001】
本発明は、高感度での粒子特性評価のために空間変調された励起または発光を実施する方法および装置に関する。
【背景技術】
【0002】
粒子の特性評価方法(一般的に、検出、および、位置・姿勢の特定、粒子計数法、細胞分類など他の有用な特性評価に関する)では、背景に比べて粒子(一般的に、小物体)から得られる信号は通常弱いため、多くの場合、信号対雑音比(SNR)の低さが問題となる。特に、粒子の特性評価における光学的な方法に関して、問題である。また、信号対雑音比の低さは、細胞、エアロゾル、分子、周りの液体とは異なる液体の小体積(つまりエマルジョン)、または選択した位置に染色またはタグ付けされたDNA断片、などの個々の粒子を検出する場合に、特に顕著となる。
【0003】
DNAの件に関してみると、従来のDNA塩基配列決定法は、DNA鎖を小さな断片に分け、電気泳動によって断片を分類し、DNA塩基配列を精巧に再構築することによって行なわれていた。これに代わる処理方法が近年開発されたが、この代わりの処理方法では、特定の塩基配列を蛍光色素によりタグ付けする。分子を引き伸ばした(つまり「直鎖化」した)後、DNA鎖をマイクロ流体チャネル内において定速で移動させる。高空間分解能(約1μm)を有する特殊な蛍光読み取り装置を用いて、蛍光色素、つまりタグの位置を記録する。結果的に、タグの位置を含むDNA「光学バーコード」が記録されるので、DNA塩基配列を特定可能である。
【0004】
DNAに沿ったタグ間の一般的な距離は、数μmである。このため、1μmまたはより優れた空間分解能が必要となる。一般的に、共焦点顕微鏡を用いることでこの目的は達成できる。共焦点顕微鏡は、微小体積(1μm3以下)の蛍光の励起および検出を可能にする。
【0005】
図1に、空間分解された蛍光励起における従来の方法を概略的に示す。図のように、装置10は、検出器12、チャネル14、および励起光16を含む。チャネル14内の小体積を励起し、励起された小体積からの光を集める。タグ部22を有するDNA鎖20をチャネル14の励起部24に通し、タグの位置を、時間依存性検出信号を使用して算出する。
【0006】
【特許文献1】特開2004−275109号公報
【発明の開示】
【発明が解決しようとする課題】
【0007】
この方法は、効果的に実施されている。しかしながら、適切な大きさの励起体積と検出体積を確保するためには、高性能であってかさばる光学素子が必要となる。さらに、得られる信号対雑音比は所望するよりも低い。
【課題を解決するための手段】
【0008】
本発明の一態様に係る方法は、空間変調された励起領域を生成するステップと、粒子と励起領域との間で相対運動を起こすステップであって、粒子が励起領域にさらされて励起されることで時間変調された信号を得るステップと、変調された信号を記録するステップと、を含む。
【0009】
本発明の他の態様では、励起領域は、励起パターンを含む。
【0010】
本発明のさらに他の態様では、時間変調された信号は、粒子からの発光によって生じる。
【0011】
本発明のさらに他の態様では、励起領域は、干渉縞を含む。
【0012】
本発明のさらに他の態様では、励起領域は、少なくともシャドーマスクとレンズアレイのうちの1つによって生成される。
【0013】
本発明のさらに他の態様では、励起パターンは、化学発光によって生成される。
【0014】
本発明のさらに他の態様に係る方法は、さらに、信号に基づき粒子の位置を特定するステップと、信号に基づき粒子を数えるステップと、信号に基づき粒子を分類するステップと、のうちの少なくとも1つを含む。
【0015】
本発明のさらに他の態様では、検出は画素化検出器(pixilated detector)による検出を含む。
【0016】
本発明のさらに他の態様では、粒子は、DNA分子の一部またはDNA分子に付随の分子であって、信号を使用してDNA塩基配列を決定する。
【0017】
本発明のさらに他の態様では、検出は、蛍光を発する検体の蛍光スペクトルを受ける分光計を使用することを含む。
【0018】
本発明のさらに他の態様では、励起領域の生成は、幾何学的配置(geometry)、電界または磁界、蛍光消光、検体濃度、密度、および定常音波のうちの少なくとも1つに基づき空間変調パターンを生成することを含む。
【0019】
本発明のさらに他の態様では、励起パターンの生成は、環境に基づき空間変調された領域を生成することを含む。
【0020】
本発明のさらに他の態様では、粒子の位置を特定するように生成すること、引き起こすこと、および記録することは、二次元で行われる。
【0021】
本発明のさらに他の態様では、粒子の特性評価方法は、チャネル内で粒子を動かすステップと、粒子が時間変調された信号を生成するような環境をチャネルに沿って整えるステップと、時間変調された信号を検出および評価するステップと、を含む。
【0022】
本発明のさらに他の態様では、環境は、光学素子と、光学素子によって検出される光を発する粒子と、を含む。
【0023】
本発明のさらに他の態様では、粒子の位置の関数として粒子から取得した信号を変調するように、光学素子を操作可能である。
【0024】
本発明のさらに他の態様では、方法はさらに、光学素子を動かすことを含む。
【0025】
本発明のさらに他の態様では、光学素子は、少なくともシャドーマスクおよびマイクロレンズアレイのうちの1つである。
【0026】
本発明のさらに他の態様では、方法はさらに、信号に基づき粒子の位置を特定するステップと、信号に基づき粒子を数えるステップと、信号に基づき粒子を分類するステップと、のうちの少なくとも1つを含む。
【0027】
本発明のさらに他の態様では、検出は、画素化検出器による検出を含む。
【0028】
本発明のさらに他の態様では、粒子は、DNA分子の一部またはDNA分子に付随の分子であって、信号を使用してDNA塩基配列を決定する。
【0029】
本発明のさらに他の態様では、検出は、粒子の蛍光スペクトルを受ける分光計を使用することを含む。
【0030】
本発明のさらに他の態様では、幾何学的配置、電界または磁界、蛍光消光、検体濃度、密度、および定常音波のうちの少なくとも1つに基づき光をパターン化するように、光学素子を操作可能である。
【0031】
本発明のさらに他の態様では、粒子の特性評価装置は、空間変調された励起領域を生成する手段と、粒子と領域との間で相対運動を起こす手段であって、粒子は、時間変調された信号を得られるように、励起領域にさらされて励起される手段と、変調された信号を記録する手段と、を含む。
【0032】
本発明のさらに他の態様では、装置はさらに、信号に基づき粒子の位置を特定する手段と、信号に基づき粒子を数える手段と、信号に基づき粒子を分類する手段と、のうちの少なくとも1つを含む。
【0033】
本発明のさらに他の態様では、粒子の特性評価装置は、チャネルと、チャネル内で粒子を動かす手段と、粒子が時間変調された信号を生成するように操作できる、チャネルに沿った環境と、時間変調された信号を記録および評価する検出装置と、を含む。
【0034】
本発明のさらに他の態様では、環境は光学素子を含む。
【0035】
本発明のさらに他の態様では、装置はさらに、粒子を発光させるように操作できる反共振導波管を含む。
【0036】
本発明のさらに他の態様では、装置はさらに、信号に基づき蛍光検体の位置を特定する手段と、信号に基づき粒子を数える手段と、信号に基づき粒子を分類する手段と、のうちの少なくとも1つを含む。
【0037】
本発明のさらに他の態様では、環境は二次元評価を可能にする。
【発明を実施するための最良の形態】
【0038】
本発明は、粒子からの信号と背景からの信号を明確に区別できる位相に敏感な技術を実装することによって、粒子の特性評価における信号対雑音比を向上する方法と装置に関する。この方法は、粒子と環境との間に、制御された相対運動を意図的に生じさせることを基本とする。例えば、粒子と調整された環境とを動かすことによって、時間変調された信号を生じさせる。監視する応答には、雑音を含む背景信号と、変調された信号とが含まれ、粒子の時間的依存性が明確になる。粒子に属す信号を抽出するには、ハードウェアおよびソフトウェアによる両面の解決策を利用することができる。そして粒子に属す信号は、検出、位置/姿勢の特定、細胞分類などの多様な用途に適用可能な粒子の特性評価に使用できることを理解されたい。このような特性評価を達成するには、さまざまな技術を用いることができる。
【0039】
信号としては、時間の関数としていかなる形式の信号も意図されていることは、理解されるであろう。定期的である必要はなく、ランダムに変調された信号であっても、信号の構造さえ分かっていれば利用可能である。また、構造が分かっている場合で、解析上の法則に則っていない場合でもよい。つまり、粒子のオンおよびオフ状態を定義する時間間隔は、ランダムな長さになる場合がある。信号の時間依存性が装置に組み込まれている場合であっても、装置の時間依存性は、予想可能または分かっている場合、変動させてもよい。
【0040】
信号の符号化を異ならせる(例えば、チャープ性または完全な周期性など)ことによって、個々の用途に固有の効果をもたらすことができる。チャープ信号は、空間的分解能と粒子分類性能を向上する。完全な周期信号は、粒子速度の特定を可能にし、また粒子ごとの速度が異なる場合により適用性が高い。
【0041】
説明のため、図12において各種の信号を示す。例えば、信号12‐1は、周期信号である。信号12‐2は、チャープ信号であって、例えば直線的に周期が増加する信号である。ランダム信号12‐3も示す。これらの信号(および他の信号)は、本発明の目的を達成するための実施形態に関連して使用できることを理解されたい。
【0042】
本発明の実施形態は、次を含むさまざまなケースに関し記述されている。(1)動いている個々の粒子の収集。(2)直鎖化されたDNA鎖であって、対象物が与えられ、鎖の全長に渡って固定される(すなわち一般的にはDNA配列と呼ばれる)。(3)面上に潜在的に固定された粒子の収集(用途によっては、二次元の解析を必要とする)。
【0043】
また、検出対象となる粒子は、細胞、エアロゾル、選択した位置に染色したDNAのDNA物質断片、周りの液体部分とは異なる液体の小体積(つまり、エマルジョン)、液滴、他の流体の小体積、気泡、単分子、凝集分子、分子クラスタ、生体細胞、ウイルス、バクテリア、タンパク質、微粒子、ナノ粒子、およびエマルジョンなどを含む。液滴または流体の小体積は、屈折率、吸収性、および他の光学的特性に影響を与える、例えば、原子、分子および他の粒子を含む。対象物が一連の位置に渡って動く場合、対象物は「移動する」、または「移動される」ことになる。例えば対象物は、液体、気体、またはエアロゾルなどの流体内で運ぶことができ、その場合対象物は「流体によって搬送される」と表現される。さらに、チャネルとは、壁によって画定される物ばかりではなく、例えばエアロゾルの流れ内における粒子の流れによって画定される物など、さまざまな形式で画定されることを理解されたい。
【0044】
また、これらの粒子からの発光は、蛍光励起、弾性および非弾性の光散乱法、化学発光および他のタイプの光散乱法、および屈折技術などを含む、さまざまな光源によって生じる。さらに、これらの実装に使用される光は、紫外線、可視光線、赤外線、近赤外線などのさまざまな異なる種類の光を含む。より詳細には下記に述べるが、この粒子の特性評価方法が実装される環境は、粒子の空間変調された励起、または、検出領域における粒子からの発光に対する変調を含む。この点では、粒子は均一の励起を発光し、それを例えばシャドーマスクまたは他の光学素子を使用してフィルタすることによって、発光の空間変調を生じさせる。
【0045】
本発明の実施形態は、光学素子のみでなく、電気容量、誘導、抵抗などの非光学素子環境にも適用できることを理解されたい。図2〜14は、全般的に光学素子に関し、図15は、非光学素子の例に関する。
【0046】
ここで図2を参照して、装置30を説明する。装置30において、チャネル34は、検出領域における発光を変調する光学素子32を備える。光学素子32は、レンズ、マスク、およびフィルタなど、さまざまな形式を取ることができる。さらに、光学素子32からの発光を時間の関数として検出する検出器31も示す。検出器31(およびここで説明する他の検出器)は、光ダイオード、アバランシェフォトダイオード、光電子増倍管などを含むさまざまな形式を取ることができることを理解されたい。また、検出器31および光学素子32は、1つの素子または装置に組み入れてもよい。
【0047】
光は、チャネル34を移動する粒子36および粒子38などの粒子から発光することができる。粒子からの発光は、上述のさまざまな現象によって生じされることができることを理解されたい。また、粒子36,38と光学素子装置32(つまり出力変調器)の間の相対運動によって、粒子36および38を適切に解析するために必要な変調が生じる。空間変調光学素子は、検出器31に対し時間変調された信号を生成する。この信号は、上述のとおり予想可能なさまざまな形式であって、粒子の特性評価を目的として、処理モジュール39を使用して解析可能である。
【0048】
上述のように、時間関数として生成される信号は、さまざまな環境因子に応じて、周期的、チャープ型、ランダムなど、さまざまな形式となる。本実施形態ならびに図3および図4の実施形態に適用可能な一形式では、光学素子は、信号の種類に適合する形式とすることができる。つまり、光学素子の構造は、図12において例として挙げた信号に使われる光学素子の構造に類似してもよい。
【0049】
相対運動は、粒子を動かすことによって、または検出器/光学素子を例えばチャネルに沿って動かすことによって、もしくは両方の要素を動かすことによって得られることを理解されたい。さらに、両方の要素を動かすことによって、一形式では、各要素が異なる速度で動く場合もある。
【0050】
次に図3を参照し、装置40を説明する。装置40は、チャネル42を含む。チャネル42は、粒子(粒子46や48など)が発光する領域44を備える。示されている領域44では、変調された励起部がさまざまな方法で生成される。これらの方法には、干渉、シャドーマスク、レンズアレイの使用、化学発光および蛍光消光の使用、が含まれる。粒子と励起部(または励起パターン)との間の相対運動は、粒子を動かすことによって、または励起パターンを動かすことによって、もしくは両方を動かすことによって実現できる。前の実施形態同様、両方を動かすことによって、一形式では、それぞれが異なる速度で動く場合もある。空間変調光学素子は、検出器41に対し時間変調された信号を生成する。この信号は、上述のとおり予想可能なさまざまな形式であって、粒子の特性評価を目的として、処理モジュール49を使用して解析可能である。
【0051】
次に図4を参照し、装置50を説明する。装置50は、チャネル52および反共振導波管54を含む。反共振導波管は、粒子がチャネル内部を移動するとき、チャネルに均一な照明を与える。変調は、ミラー56によって行なうことができ、ミラー56は、チャネルの内部または外部に適切に設置する。ここでも空間変調光学素子は、検出器51に対し時間変調された信号を生成する。この信号は、上述のとおり予想可能なさまざまな形式であって、粒子の特性評価を目的として、処理モジュール59を使用して解析可能である。
【0052】
図2〜4を参照して説明した実施形態から明確なように、本発明の実施形態は、粒子が他の種類の媒体(例えば液体)内を移動する際の粒子の特性評価を、変調によって改善して提供するものである。場合によっては、粒子から発光される光が変調され、他の場合では、粒子に対する励起を変調することによって変調が行なわれる。どちらの場合も、変調効果をもたらすのは、装置要素間の相対運動である。
【0053】
図11を参照し、他の実施形態を説明する。当然ながら、粒子を検出面に撮像するさまざまな構成が考えられる。そのような一例として示した構成では、粒子304が内部で移動するチャネル302付近に、装置300を設置する。粒子304は、検出器306によって検出される。検出器306の上には、光学素子308があり、空間パターンを生じるように操作することができる。粒子の検出は、光学素子310によって容易になる。光学素子310は、レンズまたはレンズ系など、さまざまな形式を取ることができる。粒子は、物体面320に位置し、像面322は、検出器306および光学素子308と対応する。
【0054】
この配置では、粒子サイズ、パターンサイズ、および空間分解能は、基本的に分離している。この点において光学素子310は、粒子304を拡大(または縮小)し、粒子304から離れた場所での検出を可能にする。示したように、粒子304からの光は像面322において変調される。そして検出器306は、チャネル302に接して配置しなくても、チャネル302内の粒子304からの光を検出することができる。この構成では、光学素子308は、光学素子310の像面322内またはその付近に位置する必要がある。これにより、粒子304と非光学素子308の「光学距離」は最小となる。検出器自身が光学素子を備え、さらに追加で拡大または縮小できることを理解されたい。さらに、検出器のサイズは、装置のサンプリングレートを決定する要因となる。このため小型であって、より高速の検出器にチャネルを縮小し、サンプリングレートを引き上げることが好適な場合もある。
【0055】
さらに、光学素子をチャネルに接して配置することもできる。その場合、検出器と光学素子との間の距離は、チャネルの大きさによって決定されるであろう。
【0056】
本発明の実施形態のより具体的な実施例は、DNA塩基配列決定法に関する。図5を参照し、本発明の実施形態に係る装置100を説明する。装置は、検出器102と、流体チャネル104と、空間変調された励起パターン108を有する励起光106と、を含む。パターン108は、チャネル104と位置が合わせられ、検出領域または検出部105を生成する。装置100は、例えばDNA鎖110の搬送を可能にする。DNA鎖110は、基幹部112と、それに埋め込まれている蛍光タグまたは粒子114を含む。少なくとも一形式では、干渉パターン108は、レーザ源などのエネルギ源によって生成され、粒子の流れに直角にサブミクロン単位の周波を有する。他の角度も使用可能であることを理解されたい。蛍光粒子114がパターン108を通ってチャネル104を移動する際に、蛍光粒子またはタグ114の速度および縞パターン108の周波に従って、蛍光発光は変調される。少なくとも1つの縞上の発光を記録する信号検出器102を使用できる。検出された信号は、検出器用高速読み出し機構によって記録され、検出部105、結果的には励起パターン108を通る間、蛍光粒子またはタグ114の「点滅」が取得される。示されているように、粒子の特性評価を目的として信号を解析するように、処理モジュール109を実装してもよい。
【0057】
本発明の実施形態は、信号対雑音比および空間分解能が高い蛍光検出を可能にし、下記に示すように、高額でかさばる光学素子を必要としない。
【0058】
上述の具体的な用途では、DNA基幹部112は、全体的には第1種類の蛍光体でラベル付けされており、直鎖分子の特定の部分は第2種類の蛍光体、つまり蛍光タグ114でラベル付けされている。図6に、本実施形態に係る検出機構をより詳しく示す。示されているとおり、均一にラベル付けされたDNA基幹部112が検出部105を通過するときには、蛍光基幹信号120は、まず階段状の関数で増加する。さらに、タグ114の1つが励起パターン108の間を通るときには、基幹信号120には、正弦信号122が重ねられる。これにより、結果的に検出信号126となる。
【0059】
図5に示した実施形態の例では、検出器は1台のみ示されているが、複数台の検出器を実装してもよい。また、本実施形態を実現するには、さまざまな構成の検出器が実装可能であることを理解されたい。
【0060】
この点に関し次に図7を参照して、装置200を説明する。装置200では、タグ部114とDNA基幹部112は異なる検出器で検出されることが好適である。一般的に、基幹部112およびタグ部114は、異なる波長域で発光する発光体によってラベル付けされる。適切なフィルタを使用すれば、タグからの蛍光のみが検出器202に入り、一方検出器204は基幹部からのみ光を受けるようにすることが可能である。簡単な光学部品を利用して、フィルタの波長に対する選択感度を向上することができる。例えば、マイクロレンズアレイは、蛍光を平行光にすることができる。対象光の第1波長のみを伝送するばかりではなく、対象光の第2波長を対向する検出器に効率よく反射するようにフィルタを設計し、蛍光の損失を最小限にすることもできる。図7の装置200は、DNAの複数の異なる箇所をマーク付けする異なる蛍光タグからの蛍光を、同時に測定するために使用することもできる。
【0061】
また、第2段階の検出器206および208を同様に実装し、例えば実施されるDNA解析をさらに正確にできることを理解されたい。例えば、DNAの特性評価をさらに正確にするには、DNA鎖の異なった場所を異なる色のタグによりマーク付けし、蛍光を測定してもよい。
【0062】
適切なパターンを生成するには、いくつかの周知技術を適用して、例えば図8(a)〜(d)に示すように、干渉パターンを生成することができる。縞模様は、一次元で定常波を生成することによって、通常生成できる。例えば図8(b)では、ミラー80がチャネルの方向に定常波を生成する。他の方向でもよい。隣接する2つの干渉最高点の間の距離dは、次のように計算できる。
【0063】
d=λ/(2sinα)
【0064】
ここで、αは2つの干渉ビーム間の相対角度、λは波長を示し、dはαに依存してλ/2と無限大との間で変動する。
【0065】
一般的には、励起パターンは、「外部から」上面または下面を介して、または「平面内で」側面から、チャネルに向けられる。検出部品は多くの場合、上部または底部に取り付けられるので、検出器に届く励起光の量を低減するには、「平面内の」励起の使用が好ましい。
【0066】
図8(a)〜(b)に示したすべての干渉計技術は、基体と空気の界面上における内部全反射(TIR)を利用した導波管構造とミラーを使用して、マイクロ流体チャンバ内で実現できる。図8(a)にプリズム干渉計、図8(b)にミラー80を使用するロイド干渉計、図8(c)にビームスプリッタ84およびミラー86を使用するマイケルソン干渉計を示す。さらに高い信号対雑音比を達成するには、チャネル方向に干渉パターンを周期的に動かしてもよい。これは、図8(c)に示すように、ミラーを周期的に動く台(例えば、スピーカや圧電素子など)に設置することによって実現できる。この技術は、静止した粒子を対象とする場合も適応可能である。これにより、二重変調技術の使用によって、装置の検出感度を向上できる。
【0067】
最後に、図8(d)に位相マスク干渉計88を示す。好適な方法は、図8(d)に示すような位相マスクまたは透過型回折格子に基づく。−1次に散乱する光は、+1次に散乱する光と干渉する。回折は、0次および2次への散乱を最小とするように設計するとよい。ここで示したほとんどの技術は、複数の流体チャネルを使用した励起が実行できるように設計可能である。図10に、位相マスク90のような位相マスクに基づき平行なチャネルを照射する他の設計を示す。
【0068】
本発明の実施形態の教示を反映した複数の装置を例として説明したが、本発明の実施形態に係る方法は、少なくとも1つの形式では、空間変調された環境を基本的に整えるステップと、その環境内で励起された粒子から発せられる光を検出するステップと、検出結果に基づき時間変調された信号を生成するステップとを含む。少なくとも1つの形式では、生成された信号を使用して、励起された粒子(例えばDNA鎖のタグなど)の位置を特定する。装置は、一つの形式では、空間変調された信号の生成および粒子の相対的な位置の特定など、その後の処理を可能にする処理モジュール(例えば、処理モジュール39,49,59,109)を備える。このような処理モジュールは、検出器内に組み込んでもよいし、検出器とは別に実装してもよい。この線に沿って、ここに記載する方法は、さまざまなハードウェア構成とソフトウェア技術を使用して実装可能なことを理解されたい。例えば、考えられる処理モジュールは、信号の生成と位置の特定を可能にするソフトウェアルーチンを含んでもよい。
【0069】
ここで図9を参照し、本発明の少なくとも一実施形態に係る方法500を説明する。最初に、励起パターンを生成する(ステップ502)。上述したように、励起は均一であって、シャドーマスクなど(例えば、変調器など)によってパターン化された出力を生成しもよい。次に、例えば蛍光検体と励起パターンの間に相対運動を形成する(ステップ504)。そして、時間を関数として発光または散乱された光を検出する(ステップ506)。その検出結果に基づいて空間変調された信号を生成する(ステップ508)。上述したように、空間変調された信号は、1つの形式では、DNA鎖のタグなど、蛍光粒子の相対的な位置を特定するために使用できる。
【0070】
DNAでの実装のように、蛍光発光に関する信号の検出については、変調された励起は、高い空間分解能を確保するだけではなく、同時に信号対雑音比を上げる方法を可能にする。背景信号に係るほとんどの発信源(例えば、幹線信号、散乱した励起によって励起された蛍光、およびその他のDCなどの電源)は、相関技術によって除外される。これによって、動いているタグから発せられる変調信号のみに対して検出感度が高い読み出し機構が可能となる。タグ速度が15μm/ms(またはmm/s)の場合を考えると、縞の幅が1μmであって、タグ付けされた部分の大きさが励起縞よりもかなり小さい周期的な励起パターンでは、周期ごとに約70μsの移動時間となる。これによって、蛍光信号の変調は、10kHz程度となる。さらに、蛍光と他の背景発信源(部屋の明かりなど)を区別するには、より高い周波数で励起源を変調するとよい。タグが1つの干渉縞を通過する間に、光源が数回オンおよびオフ状態に確実になるように、高い周波数を選ぶ必要がある。100kHzの変調周波数であれば、その基準を満たし、容易に実行可能である。さらに高速な検出器が利用可能となっているので、従来のロックインや相関技術を適用し、例えば、励起光を1MHzで検出器と同期させることによって、100kHzでより正確にサンプリングすることも可能である。
【0071】
本発明の実施形態の少なくとも1つの形式では、DNAのタグの位置を正確に特定するために、検出信号(取得手段にかかわらず)は、デコンボリューション処理される。信号は、高いサンプリングレートで記録される。時間情報は、上述のようにDNA鎖の速度を使用して位置情報に変換される。極めて周期的な励起パターンの場合は、時間依存性のある蛍光信号の周期性または他の周知技術によって、DNA鎖の速度を抽出する。解析は、フーリエ変換解析および最小二乗技術を含むさまざまな信号処理アルゴリズムを使用して実行できる。
【0072】
これらの技術は、より全般的には、粒子の特性評価を目的とするさらに他の検出にも適用可能である。図13を参照し、本発明のさらに他の実施形態を説明する。上述したとおり本発明は、一次元だけではなく、二次元にも適用可能である。この点に関し、粒子スキャナ200は、二次元の技術を使用して、粒子202の位置を特定することができる。粒子202は、粒子を含む流体中にあり、スキャナ200の土台部分に位置するスライド上に収容されている。スキャナ200は、変調パターン204および変調パターン206を含む。変調パターン204は、粒子202に対して、第1方向212に動き、一方変調パターン206は、続いて粒子202に対して、第2方向210に動く。一形式では、第1および第2方向は、実質的に相互に直角である。ベッド200の土台部分(または固定部分)も動かし、粒子と変調パターンとの間の相対運動を生成できることを理解されたい。さらに、変調パターン204および206は、粒子を励起する励起パターンとしてもよく、または、粒子からの一定な発光を変調するような光学素子として設けてもよい。意図された相対運動によって、光が検出され、粒子の位置の特定を可能にする対応する変調信号が生じる。この点に関し、両方の変調パターンが適切な信号を生成する位置に、粒子の位置を特定することができる。
【0073】
このような二次元の解析の実装は、有効である。例えば、このような形式の解析では、空間分解能がより高くなる。さらに、信号対雑音比も向上することができる。
【0074】
さらに、本発明の実施形態として、主に粒子に対する特性評価の光学的な方法に関連し、特に可視光を利用する方法を説明した。しかしながら本発明の技術は、他の非光学的な方法にも適用できることを理解されたい。
【0075】
図15において、変調出力信号として光の代わりに電気的な特性(静電容量、伝導率、インピーダンスなど)を利用する、非光学的な方法の一例を示す。この例では、粒子400は、光学アレイの代わりに、電極アレイ404を通ってチャネル402を移動する。電極アレイ404は、測定機器406に接続され、粒子の移動により影響を受ける時間依存信号(例えば、静電容量や電流など)を記録するように設定され、本発明の実施形態の目的を達成するように操作される。
【0076】
本発明の教示は、さらに広い範囲に及ぶ。例えば、蛍光強度が弱く、蛍光粒子が動いているあらゆる場合において、この技術を適用して、信号対雑音比を向上させることができる。例えば、下記のような場合である。
【0077】
粒子/分子数のカウントや血球計算を、変調された励起領域を通る蛍光分子数をカウントすることによって、高い信号対雑音比で行なうことができる。
【0078】
発光分光法:蛍光を分光計に入射することによって、変調された励起領域を通る粒子の蛍光スペクトルを、高い信号対雑音比で測定することができる。図14において、粒子600はチャネル602を移動する。シャドーマスク604は、検出器608の個々の画素に変調を与える。検出器608の各画素は、線形可変フィルタ606によって決まる部分領域Δ内において特定の波長で信号を記録する。この装置は、検出器612を備える粒子検出装置610に隣接して設置してもよい。
【0079】
本発明の実施形態に即し、粒子と空間変調された励起または発光パターンとの間の相対運動について述べたが、空間変調された励起パターンを通して粒子を動かすのではなく、検出装置をチャネルまたは搬送体/チップ上で走査してもよい。チップの場合、対象となる粒子はチップ上に固定され、粒子のチップ上の絶対位置を特定する。
【0080】
この考え方は、バイオチップの蛍光読み出し機構にも適用できる。
【0081】
空間変調は、他の方法でも実行可能である。例えば、幾何学的配置によって、空間変調の基礎を提供してもよい。この点に関し、例えばインタディジタル指形マスク(interdigitated finger−type mask)などの空間変調シャドーマスク、空間変調位相マスク、マイクロレンズアレイ、またはマイクロミラーアレイなどが使用できる。
【0082】
空間変調は、電場または磁場を使用することによっても得ることができる。この点に関し、場を変調することによって、蛍光発光強度を変えることができる。また、蛍光物質の濃度を場によって変調でき、さらに場によって光学経路を変えることができる。
【0083】
空間変調された音場(定常または変動音波、表面弾性波)も利用可能である。この点に関しても、場を変調することによって、蛍光発光強度を変えることができる。また、蛍光物質の濃度を場によって変調でき、さらに場によって光学経路を変えることができる。
【0084】
空間変調された蛍光消光を引き起こす移動経路内の空間変調された環境(例えば、固定分子コーティング(stationary molecular coating))も利用可能である。
【0085】
移動物質の発光特性を左右する空間変調された微小空洞共振器を同様に適用して、本発明の実施形態の目的を実現してもよい。
【0086】
本発明の利点は、明らかである。第1に、生成された信号の時間依存性を解析することによって、高い分解能で粒子の位置を特定できる。これは、空間変調された励起パターン(例えば、干渉パターンなど)を粒子と励起パターンとの間の相対運動と組み合わせることによって実現できる。
【0087】
第2に、空間分解能の下限は、干渉パターンの特徴量によって決まるが、特徴量は1μmよりもかなり小さくすることができる。信号対雑音比、信号の時間符号化、粒子とパターンの相対速度、検出器のサンプリングレート、および適用された評価技術によって、干渉パターンの特徴量よりも優れた空間分解能を達成可能である。
【0088】
第3に、解析された信号を、周期的な励起変化によって変調する。ロックイン技術や相関技術を適用して、信号対雑音比をかなり向上できる。
【0089】
第4に、極小さな体積に対して励起光の焦点を合わせたり、小さな体積からの光を集光したりするために、特別な光学素子を必要としない。
【0090】
第5に、これらの技術をラボオンチップ(lab−on−a−chip)プラットフォームに統合でき、容易に平行する複数の流体チャネルの解析に応用可能である。
【0091】
第6に、干渉パターン内の数個の蛍光粒子を同時に検出可能である。干渉パターンの特徴量によって、検出可能な2つの粒子間の距離が決まる。信号対雑音比、信号の時間符号化、粒子とパターンの相対速度、検出器のサンプリングレート、および適用された評価技術によって、干渉パターンの特徴量よりも優れた空間分解能を達成可能である。
【0092】
第7に、励起光強度を下げることによって、例えば生体細胞に対する損傷や染料の漂白を低減できる。
【0093】
上記開示したおよび他の特徴、機能、およびそれらの代わりは、他の多くの装置やアプリケーションに好適に組み込むことができることを理解されたい。また、現時点では予測も予想もできない代替案、変更、変形、または改善は、当業者によって後でなされる可能性があるが、それらは本発明の請求項に含まれるものと意図する。
【図面の簡単な説明】
【0094】
【図1】従来技術による装置を示す代表的な図である。
【図2】本発明の一実施形態を示す代表的な図である。
【図3】本発明の他の実施形態を示す代表的な図である。
【図4】本発明のさらに他の実施形態を示す代表的な図である。
【図5】本発明のさらに他の実施形態を示す代表的な図である。
【図6】本発明のさらに他の実施形態を示す代表的な図である。
【図7】本発明のさらに他の実施形態を示す代表的な図である。
【図8】本発明のさらに他の実施形態を示す代表的な図である。
【図9】本発明の一実施形態を示すフローチャートである。
【図10】本発明のさらに他の実施形態を示す代表的な図である。
【図11】本発明のさらに他の実施形態を示す代表的な図である。
【図12】本発明の実施形態において使用できる、さまざまな形式の信号を示す図である。
【図13】本発明のさらに他の実施形態を示す代表的な図である。
【図14】本発明のさらに他の実施形態を示す代表的な図である。
【図15】本発明のさらに他の実施形態を示す代表的な図である。
【符号の説明】
【0095】
10,30,40,50 装置、12,31,41,51 検出器、14,34,42,52 チャネル、16 励起光、20 DNA鎖、22 タグ部、24 励起部、32 光学素子、36,38,46,48 粒子、39,49,59 処理モジュール、50 反共振導波管、56 ミラー。
【特許請求の範囲】
【請求項1】
粒子の特性評価を行なう方法であって、
空間変調された励起領域を生成するステップと、
粒子と前記励起領域との間で相対運動を起こすステップであって、前記粒子が前記励起領域にさらされて励起されることで時間変調された信号を得るステップと、
前記変調された信号を記録するステップと、
を含む方法。
【請求項2】
粒子の特性評価を行なう方法であって、
チャネル内で粒子を動かすステップと、
前記粒子が時間変調された信号を生成するような環境を、前記チャネルに沿って整えるステップと、
前記時間変調された信号を検出および評価するステップと、
を含む方法。
【請求項3】
粒子の特性評価を行なう装置であって、
空間変調された励起領域を生成する手段と、
粒子と前記領域との間で相対運動を起こす手段であって、前記粒子が前記励起領域にさらされて励起されることで時間変調された信号を得る手段と、
前記変調された信号を記録する手段と、
を含む装置。
【請求項4】
粒子の特性評価を行なう装置であって、
チャネルと、
前記チャネル内で粒子を動かす手段と、
前記粒子が時間変調された信号を生成するように操作できる、前記チャネルに沿った環境と、
前記時間変調された信号を記録および評価する検出装置と、
を含む装置。
【請求項1】
粒子の特性評価を行なう方法であって、
空間変調された励起領域を生成するステップと、
粒子と前記励起領域との間で相対運動を起こすステップであって、前記粒子が前記励起領域にさらされて励起されることで時間変調された信号を得るステップと、
前記変調された信号を記録するステップと、
を含む方法。
【請求項2】
粒子の特性評価を行なう方法であって、
チャネル内で粒子を動かすステップと、
前記粒子が時間変調された信号を生成するような環境を、前記チャネルに沿って整えるステップと、
前記時間変調された信号を検出および評価するステップと、
を含む方法。
【請求項3】
粒子の特性評価を行なう装置であって、
空間変調された励起領域を生成する手段と、
粒子と前記領域との間で相対運動を起こす手段であって、前記粒子が前記励起領域にさらされて励起されることで時間変調された信号を得る手段と、
前記変調された信号を記録する手段と、
を含む装置。
【請求項4】
粒子の特性評価を行なう装置であって、
チャネルと、
前記チャネル内で粒子を動かす手段と、
前記粒子が時間変調された信号を生成するように操作できる、前記チャネルに沿った環境と、
前記時間変調された信号を記録および評価する検出装置と、
を含む装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【公開番号】特開2008−185585(P2008−185585A)
【公開日】平成20年8月14日(2008.8.14)
【国際特許分類】
【出願番号】特願2008−14517(P2008−14517)
【出願日】平成20年1月25日(2008.1.25)
【出願人】(502096543)パロ・アルト・リサーチ・センター・インコーポレーテッド (393)
【氏名又は名称原語表記】Palo Alto Research Center Incorporated
【Fターム(参考)】
【公開日】平成20年8月14日(2008.8.14)
【国際特許分類】
【出願日】平成20年1月25日(2008.1.25)
【出願人】(502096543)パロ・アルト・リサーチ・センター・インコーポレーテッド (393)
【氏名又は名称原語表記】Palo Alto Research Center Incorporated
【Fターム(参考)】
[ Back to top ]

