粒子保存溶液および粒子の保存方法
【課題】 本発明の目的は、一定量の粒子を効率良く、かつ精度良く分取することが可能な粒子保存溶液に関する。また、本発明の別の目的は、一定量の粒子を効率良く、かつ精度良く分取することが可能な粒子の保存方法に関する。
【解決手段】 本発明の粒子保存溶液は、生物由来物質を固定化するための粒子と、前記粒子を保存する保存液とを含む粒子保存溶液であって、前記粒子の比重(S1)と、前記保存液の比重(S2)との比重差が、0.4以下であることを特徴とする。また、本発明の粒子の保存方法は、上述に記載の粒子保存溶液を用いることを特徴とする。
【解決手段】 本発明の粒子保存溶液は、生物由来物質を固定化するための粒子と、前記粒子を保存する保存液とを含む粒子保存溶液であって、前記粒子の比重(S1)と、前記保存液の比重(S2)との比重差が、0.4以下であることを特徴とする。また、本発明の粒子の保存方法は、上述に記載の粒子保存溶液を用いることを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、 粒子保存溶液および粒子の保存方法に関する。
【背景技術】
【0002】
抗体ビーズ、レクチンビーズ、アビジンビーズ、ビオチンビーズ、ヒドラジドビーズなど表面を活性化させた微粒子が多数市販されている。しかし、それらの大半は水溶液あるいは有機溶媒の分散液として保存し、使用時に必要量を分取するという使用方法である(例えば、特許文献1参照)。しかし、微粒子のような固体を液体中に均一に分散させるのは困難であり、使用毎に分取量が変化してしまう。そのため、自動で分取することが難しく、処理する検体数が多い場合は特に、分散液を反応容器に移すのに手間がかかるという欠点がある。
【0003】
この様な背景から、一定量の微粒子があらかじめ反応容器に封入された状態での提供または、一定量の微粒子を簡便に分取する手法の提供が求められる。カラムにあらかじめ一定量の微粒子が封入された状態で販売されている例もあるが、分散液での保存、乾燥状態での保存ともに容器の表面等に付着してしまうことで一部の微粒子を失ってしまう。特に、少量の微粒子を反応に用いるような系の場合、そのことが原因で結果にばらつきが生じやすくなってしまう。また、微粒子分散液から一定量の微粒子を分取する方法として、攪拌子を使用して微粒子分散液を攪拌させ、そこから一定量の分散液を分取する方法もあるが、攪拌速度を最適化するなどの工夫が必要で微粒子の偏りが生じやすいため、一定量の微粒子を得るのは難しい。そこで、一定量の微粒子を容易に分取可能な新しい手法が必要とされる。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特表2008−536821号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明の目的は、一定量の粒子を効率良く、かつ精度良く分取することが可能な粒子保存溶液に関する。
また、本発明の別の目的は、一定量の粒子を効率良く、かつ精度良く分取することが可能な粒子の保存方法に関する。
【課題を解決するための手段】
【0006】
このような目的は、下記(1)〜(11)に記載の本発明により達成される。
(1) 生物由来物質を固定化するための粒子と、前記粒子を保存する保存液とを含む粒子保存溶液であって、
前記粒子の平均比重(S1)と、前記保存液の比重(S2)との比重差が、0.4以下であることを特徴とする粒子保存溶液。
(2)前記保存液の比重(S2)が、0.5〜5である(1)に記載の粒子保存溶液。
(3)前記粒子の平均粒子径(r)は、0.1〜500μmである(1)または(2)に記載の粒子保存溶液。
(4)前記粒子の平均比重をS1とし、粒子の比重の標準偏差をσとし、保存液の比重をS2としたとき、
S1−3σ<S2<S1+3σ を満足する(1)ないし(3)のいずれかに記載の粒子保存溶液。
(5)前記保存液は、2種類以上の溶液を混合してなる混合溶液である(1)ないし(4)のいずれかに記載の粒子保存溶液。
(6)前記保存液は、無機塩の水溶液である(1)ないし(4)のいずれかに記載の粒子保存溶液。
(7)前記無機塩は、セシウム塩、バリウム塩、ルビジウム塩、ストロンチウム塩、カリウム塩、カルシウム塩、ナトリウム塩、マグネシウム塩、リチウム塩、ベリリウム塩から選ばれる少なくとも一つである(6)に記載の粒子保存溶液。
(8)前記無機塩の含有量は、前記水溶液中の0.1〜50重量/体積%である(6)または(7)に記載の粒子保存溶液。
(9)前記保存液の沸点が、50℃以上である(1)ないし(8)のいずれかに記載の粒子保存溶液。
(10)前記粒子は、樹脂粒子である(1)ないし(9)のいずれかに記載の粒子保存溶液。
(11)(1)ないし(10)のいずれかに記載の粒子保存溶液を用いることを特徴とする粒子の保存方法。
(12)(1)ないし(10)のいずれかに記載の粒子保存溶液で、該溶液中の粒子の分散を測定する方法であり、該溶液の可視光線の透過率を測定する粒子保存溶液の測定方法。
(13)(12)に記載の可視光線の透過率の測定において、透過率の時間変化を測定する保存溶液の測定方法。
【発明の効果】
【0007】
本発明によれば、一定量の粒子を効率良く、かつ精度良く分取することが可能な粒子保存溶液を得ることができる。
また、本発明によれば、一定量の粒子を効率良く、かつ精度良く分取することが可能な粒子の保存方法を提供することができる。
【図面の簡単な説明】
【0008】
【図1】微粒子の分散状態を説明するためのグラフである。
【図2】実施例の保存容器内に保存をしたビーズを用いて作製した、2−AB標識ウ シ由来IgG糖鎖を高速液体クロマトグラフィにより測定した結果を示すチャート図 である。
【図3】実施例1で用いたヒドラジドビーズを、上述した粒子保存容器内で保存する ことなく、直ぐに2−AB標識ウシ由来IgG糖鎖を高速液体クロマトグラフィによ り測定した結果を示すチャート図である。
【図4】実施例1で用いたヒドラジドビーズを含む粒子保存液の光透過度を測定した結果を示すチャート図である。
【発明を実施するための形態】
【0009】
以下、本発明の粒子保存溶液および粒子の保存方法について詳細に説明する。
本発明の粒子保存溶液は、生物由来物質を固定化するための粒子と、前記粒子を保存する保存液とを含む粒子保存溶液であって、前記粒子の比重(S1)と、前記保存液の比重(S2)との比重差が、0.4以下であることを特徴とする。
また、本発明の粒子の保存方法は、上述に記載の粒子保存溶液を用いることを特徴とする。
【0010】
(粒子保存溶液)
まず、粒子保存溶液について説明する。
本発明の粒子保存溶液は、生物由来物質を固定化するための粒子を保存するために用いるものである。このような粒子は、上述したように水溶液等の分散液として保存されることが多い。そして、使用される際には必要量を分取するという使用方法であるが、このような粒子を分散液中に均一に分散させるのは困難であり、使用毎に分取量が変化してしまうことがあった。本発明は、生物由来物質を固定化するための粒子に要求される課題を解決するためのものである。
【0011】
ここで、生物由来物質としては、例えばは糖鎖、タンパク質、DNA、RNA、脂質等を挙げることができる。
【0012】
本発明の粒子保存溶液は、前記粒子の平均比重(S1)と、前記保存液の比重(S2)との比重差が0.4以下であることを特徴とする。これにより、粒子保存液中に分散している粒子が沈降したり、浮遊したりしてくるのを抑制することができる。
前記比重差は、特に好ましくは0.2以下であり、より好ましくは0.1以下である。比重差が前記範囲内であると、分散している粒子が沈降または浮遊するまでの時間を長くすることができ、それによって試料を分取するさいのバラツキを低減することができる。
【0013】
このように、粒子の平均比重(S1)と、前記保存液の比重(S2)との比重差を、0.4以下とすることにより、粒子の分散性を向上することができる。具体的には、比重差を0.1〜0.4とした場合には、分散した粒子が沈降等するまでの時間を0.1〜0.5時間とすることができ、比重差を0.01〜0.1とした場合には、分散した粒子が沈降等するまでの時間を0.5〜1時間とすることができる。
【0014】
また、前記粒子保存溶液は、前記粒子の平均比重をS1とし、粒子の比重の標準偏差をσとし、保存液の比重をS2としたとき、S1−3σ<S2<S1+3σを満足するものであることが好ましい。これにより、粒子の比重にばらつきのあった場合でも粒子の分散性を向上することができる。
粒子の平均比重(S1)は、例えば比重瓶で測定し、標準偏差(σ)は密度勾配法により算出できる。
【0015】
このような粒子保存溶液に用いる(微)粒子としては、例えばシリカ粒子、金属粒子等の無機粒子、セファロース粒子、アガロース粒子、セルロース粒子、樹脂粒子等の有機粒子が挙げられる。これらの中でも有機粒子(特に、樹脂粒子)が好ましい。これにより、保存液との比重の調製を容易にすることができる。
具体的には、シリカ(微)粒子、高分子(微)粒子、金(微)粒子、セファロース(微)粒子、アガロース(微)粒子、セルロース(微)粒子等が挙げられる。これらの(微)粒子の中でも、表面に活性基としてアビジン、ビオチン、抗体、レクチン、カルボニル基、アミノ基、アミノオキシ基、ヒドラジド基、エステル基、マレイミド基およびチオール基のいずれか1種以上の活性基を有するものが好ましい。
【0016】
このような粒子の平均比重(S1)としては、特に限定されないが、0.6〜5.0であることが好ましく、より好ましくは0.67〜4.0であり、さらに好ましくは0.7〜3.0である。粒子の平均比重(S1)が前記範囲内であると、保存液との比重の調整を容易にすることができる。
このような平均比重は、例えば比重瓶を用いて評価することができる。
【0017】
また、前記粒子の平均粒子径は、特に限定されないが、0.1〜500μmであることが好ましく、特に10〜150μmであることが好ましい。平均粒子径が前記範囲内であると、(微)粒子の分散性に優れ、取り扱いが容易となる。
前記平均粒子径は、例えば粒度分布測定装置を用いて測定することができる。
【0018】
前記粒子保存溶液に用いる保存液としては、例えば水溶液、有機溶媒等が挙げられる。具体的には、水と無機塩の水溶液、水と有機溶媒の混合液、有機溶媒同士の混合液等が挙げられる。これらの中でも水と無機塩との水溶液が好ましい。これにより、溶液の蒸発による比重の変化を低減することができる。また、有機溶媒を用いることと比較すると環境への影響、人体への影響を低減することもできる。
【0019】
前記無機塩の水溶液としては、例えばセシウム塩、バリウム塩、ルビジウム塩、ストロンチウム塩、カリウム塩、カルシウム塩、ナトリウム塩、マグネシウム塩、リチウム塩、ベリリウム塩から選ばれる少なくとも一つを溶解させたものが好ましい。これにより、溶液の粘度を上昇させること無く使用することができる。
【0020】
前記無機塩の含有量は、目的とする比重に応じて決定され、特に限定されないが、水溶液中の質量パーセント濃度0.1〜90%が好ましく、特に質量パーセント濃度10〜60%が好ましい。含有量が前記範囲内であると、特に溶液の粘度を上昇させること無く使用することができ、扱いが容易ある。
【0021】
また、前記保存液は、2種以上の溶液を混合してなる混合溶液であっても良い。これにより、比重の調整する際の溶液選択の自由度を向上することができる。
2種以上の溶液の組み合わせとしては、例えば水とメタノール、水とエタノール、メタノールとクロロホルムが挙げられる。
【0022】
このような保存液を構成する溶液は、目的とする比重により適宜決定される。例えば、比重が1より大きい粒子を分散させるための保存液としては、水と無機塩の水溶液が好ましい。
一方、比重が1より小さい粒子を分散させるための保存液としては、水と有機溶媒の混合液、有機溶媒同士の混合液が好ましい。
【0023】
また、保存液を構成する溶液は、有機溶媒でも水溶液でも良いが、溶液の蒸発により比重が変化してしまう可能性を回避するために、沸点の高い有機溶媒あるいは水溶液であることが好ましい。具体的には、保存液の沸点が50℃以上であるものが好ましく、特に60℃以上であるものが好ましい。保存液の沸点が前記範囲内であれば、粒子を保存する過程での保存液の蒸発等により保存液の比重が変化するのを防止することができ、それによって粒子の分散状態を良好に維持できる。
【0024】
具体的に保存液の比重(S2)は、特に限定されないが、0.5〜5.0が好ましく、特に0.7〜3.0が好ましい。これにより、保存液の作製を容易にすることができる。
【0025】
上述したような前記粒子、前記保存液を用いて、前記粒子の平均比重(S1)と、前記保存液の比重(S2)との比重差が0.4以下であると、粒子が短時間で底に沈んでしまうこと防ぎ、長時間分散した状態を保つことにより、一定量の粒子を容器内に効率よく分取することが可能となる。
【0026】
(粒子の保存方法)
本発明の粒子の保存方法は、上述したような粒子保存液を用いることを特徴とする。これにより、粒子保存液中で粒子の沈降、浮遊するのを抑制することができる。すなわち、一度攪拌等により粒子を保存液中で分散させると、その分散状態を長く維持することができ、それによって粒子の正確な分取を可能とすることができるものである。
例えば、高分子(微)粒子を無機塩の水溶液に分散させて保存する保存方法等がある。
【0027】
このような粒子保存溶液を用いることにより、粒子が分散している状態を長く維持できるようになるので、不均一だった粒子の分散液の均一化を容易にできる。それによって、一定量の粒子を反応容器に分取することが容易になる。この際、従来から問題となっていた粒子の減少を最小限に抑えることが可能である。また、同時に複数個分の分取も可能である上、自動化にも向いているため作業の大幅な効率化も図ることもできる。
【0028】
(粒子分散状態の測定方法)
本発明の粒子の保存方法において、溶媒中の粒子が分散している状態を観察するには、簡便には、目視で観察し、沈殿物、すなわち、沈降した粒子の存在の有無により確認できる。
より詳細に、粒子の分散状態を確認する方法としては、粒子保存溶液に可視光線を照射し、その光透過率で粒子の分散状態を数値化することが可能である。これは、粒子が溶媒中に分散している状態においては、分散状態の粒子が障害物となり、照射した可視光線が透過せず、その分散粒子の濃度により光透過率が変わることを利用したもので、可視光線の分散状態に応じた可視光線の光透過率を示すことができる。
【0029】
さらに、この光透過率の経時変化を追跡することで、分散状態の変化を測定することが出来る。すなわち、光透過率が変化していくことは、粒子の分散状態が変わっていることを示し、例えば、分散している粒子が沈降すれば、保存容器上側の溶液において可視光線通過の障害物がなくなるので、光透過率が上昇していく結果となる。逆に容器下側の底面部に近い箇所では、粒子の沈降により、可視光線の障害物が増し、光透過度が下がる結果となる。
【0030】
具体的には、紫外可視分光光度計を用いて、セル中に粒子保存溶液の一部を移し、対照溶液として粒子を含まない保存溶液を用いて光透過率を測定することで分散状態を求めることが出来る。
【0031】
更に、一定量の粒子を反応容器に分取する場合に、粒子の分散状態が変化していないかを測定することも出来る。例えば、反応容器に分取後、各容器中の粒子分散液の光透過率を測定することで粒子の分取のバラツキを確認することができる。
また、分取の自動化の場合は、送液ライン中に透過光率測定のための窓を設け、それを使用して光透過率測定をすれば、分取時の粒子の分散状態を追跡することが可能で、より精度の高い分取が可能となる。
【実施例】
【0032】
以下、本発明を実施例および比較例に基づいて詳細に説明するが、本発明はこれに限定されるものではない。
【0033】
(実施例1)
1.保存液の調製
塩化セシウム(比重3.99、和光純薬、035−01952)2.43gを、水7.57mLに溶解させて、質量パーセント濃度24.3%の塩化セシウム水溶液(比重1.223)を得た。
【0034】
2.粒子保存溶液の調製
微粒子としてヒドラジドビーズ(ポリマー粒子、球状、50mg、ヒドラジド基保有、住友ベークライト社製、BS−45603、平均比重1.291)を、1.5mLチューブに量り取り、そして上述の保存液を500μL分注し、ボルテックスミキサーで攪拌して、粒子保存溶液を得た。この微粒子と、保存液との比重差は、0.068であった。
【0035】
(実施例2)
保存液として、以下のものを用いた以外は、実施例1と同様にした。
塩化セシウム(比重3.99、和光純薬、035−01952)3.63gを、水6.37mLに溶解させて、質量パーセント濃度36.3%の塩化セシウム水溶液(比重1.374)を得た。この微粒子と、保存液との比重差は、0.083であった。
【0036】
(実施例3)
保存液として、以下のものを用いた以外は、実施例1と同様にした。
塩化セシウム(比重3.99、和光純薬、035−01952)2.1gを、水7.9mLに溶解させて、質量パーセント濃度21%の塩化セシウム水溶液(比重1.187)を得た。この微粒子と、保存液との比重差は、0.104であった。
【0037】
(比較例1)
保存液としてメタノール(比重0.791)のものを用いた以外は、実施例1と同様にした。この微粒子と保存液との比重差は0.5であった。
【0038】
(比較例2)
保存液として、以下のものを用いた以外は、実施例1と同様にした。
塩化セシウム(比重3.99、和光純薬、035−01952)5.71gを、水4.29mLに溶解させて、質量パーセント濃度57.1%の塩化セシウム水溶液(比重1.748)を得た。この微粒子と、保存液との比重差は、0.457であった。
【0039】
各実施例および比較例で得られた粒子保存溶液について、以下の評価を行った。評価項目を内容と共に示す。得られた結果を、表1に示す。
【0040】
1.微粒子の分散状態(1)
ボルテックスミキサーで攪拌後における粒子保存溶液の微粒子の分散状態を、目視で評価した。各符号は、以下の通りである。
◎:0.5時間経過後も微粒子の沈殿、浮遊が無かった。
○:0.2時間以上、0.5時間未満で微粒子の沈殿、浮遊が無かった。
△:0.1時間以上、0.2時間未満で微粒子の沈殿、浮遊が無かった。
×:0.1時間未満に、微粒子の沈殿、浮遊が有った。
【0041】
2.微粒子の分散状態(2)
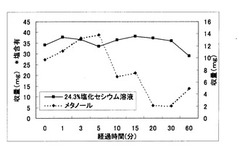
実施例1で得られた粒子保存溶液および比較例1で得られた粒子保存溶液を、それぞれボルテックスミキサーにて攪拌した。この攪拌直後から、1分後、3分後、5分後、10分後、15分後、20分後、30分後、60分後にそれぞれ100μLの粒子保存液を、重量があらかじめ測定してある1.5mLチューブに分注した。その後、凍結乾燥により1.5mLチューブ内の水を完全に除去し1.5mLチューブの重量を再測定した。1.5mLチューブ本体の重量との差から1.5mLチューブ内に分注された粒子および塩化セシウム量を算出し、それぞれ比較した。得られた結果を、図1に示す。
【0042】
図1に示すように、比較例1で得られた粒子保存溶液を用いた場合では数分後には収量が大きく変動しているのに対して、実施例1で得られた粒子保存溶液を用いた場合では、60分経過後も大きな変動が見られなかった。これより、本発明の粒子保存溶液を用いて粒子を保存することにより粒子の分散性が、より向上することが分かった。
【0043】
2.微粒子の分散状態(3)
実施例1で得られた粒子保存溶液および超純水に粒子を分散させたものの光透過率の継時変化を測定した。
具体的には、実施例1で得られた粒子保存液を保存液で10倍希釈したものを準備、また比較例1同様に粒子をメタノールで濃度が同じになるように希釈した溶液を準備した。各々の溶液を装置専用の測定用ガラスセルに移した。
測定は、多目的紫外可視分光光度計DU730(BECKMAN COULTER, Life Scienve UV/Vis Spectorometer)で測定した。測定時間は、粒子保存液は、0,5,10,15,30,40,50,60分、メタノール分散は、0, 0.25, 0.5,1,1.5,2,2.5,3,3.5,4,4.5,5分に測定した。対照は、それぞれの粒子を含まない溶液を用いた。得られた結果を図4に示す。
【0044】
図4に示すように、実施例1では、60分後においても光透過率は、ほとんど変化が見られない。一方、比較例1では、測定開始時から急激に光透過度が上昇し、5分で光透過度が90%を越える結果となった。実際に測定用ガラスセルを目視で確認すると、実施例1の溶液は、変化が見られないのに対し、比較例1ではセルの底面に明らかに粒子が沈降していることが確認された。本方法により、粒子保存液の粒子分散状態を確認することが可能であることが示された。
【0045】
3.粒子の性能確認
(A)微粒子の回収
次に、粒子保存溶液中の微粒子の反応に使用する新たな反応容器(フィルターカラム、住友ベークライト社製、BS−45603)を準備した。粒子保存溶液50μLを反応容器に添加した。卓上遠心機を用いて保存液を遠心除去した。さらに、微粒子の入った反応容器の内部に純水200μLを加え、卓上遠心機を用いて純粋を遠心除去した。これをさらに2回繰り返し粒子に付着した塩化セシウム塩を除去した。
【0046】
(B)試料の作製
ウシ免疫グロブリンG(ウシIgG)1mgを100mM(ミリモーラー)の重炭酸アンモニウム50μLに溶解させた後、120mM(ミリモーラー)のDTT(ジチオスレイトール)を5μL加え、60℃で30分間反応させた。反応終了後、123mM(ミリモーラー)のIAA(ヨードアセトアミド)10μLを加えて遮光下、室温で1時間反応させた。続いて400Uのトリプシンによってプロテアーゼ処理をし、タンパク質部分をペプチド断片化した。反応溶液を90℃で5分処理した後、5UのグリコシダーゼFによる処理を行って糖鎖をペプチドから遊離させ、予備処理済の生体試料を得た。
【0047】
(C)微粒子と生体試料の反応
微粒子が入ったフィルターカラムに、予備処理済の生体試料の懸濁物20μLおよび180μLの2%酢酸/アセトニトリル溶液を加え、80℃で1時間反応させ微粒子上のヒドラジド基に糖を固定させた。反応は開放系で行い、溶媒が完全に蒸発し微粒子が乾固した状態であることを目視で確認した。続いて、グアニジン溶液、水、メタノール、トリエチルアミン溶液にて微粒子を洗浄後、10%無水酢酸/メタノールを添加し、室温で30分間反応させ、未反応のヒドラジド基をキャッピングした。キャッピング後、メタノール、塩酸水溶液、水にて微粒子を洗浄した。微粒子の入ったフィルターカラムに、超純水20μLおよび2%酢酸/アセトニトリル溶液180μLを加え、70℃で1時間反応させ微粒子上の糖鎖を切り出した。反応は開放系で行い、溶媒が完全に蒸発し微粒子が乾固した状態であることを目視で確認した。
【0048】
(D)標識化工程
微粒子および切り出した糖鎖の入ったフィルターカラムに、2−アミノベンズアミド(2−AB)およびシアノ水素化ホウ素ナトリウムの終濃度がそれぞれ0.35M、1Mになるように30%酢酸/DMSO混合溶媒に溶解させて調整した溶液50μLを添加し、60℃で2時間反応させて、切り出した糖鎖を2−ABで標識化した。
【0049】
(E)余剰試薬除去工程
上述の溶液50μLを回収し、アセトニトリルで10倍に希釈した後、標識化した糖鎖を付属のクリーンアップカラムに吸着させた。アセトニトリル、アセトニトリル/水混合溶液(95:5)にてカラムを洗浄後、超純水50μLにて標識化した糖鎖を回収した。
【0050】
(F)標識化した糖鎖の検出
得られた標識化した糖鎖をHPLCにて測定した。アミドカラム(TSK−GEL Amide−80 4.6*250)を用いて励起波長330 nm、蛍光波長420 nmにて測定した。溶媒Aは50mMギ酸、25%アンモニア水にてpH4.4に調整したものを使用し、溶媒Bとしてアセトニトリルを使用し、溶媒A液20%(0min)→A液58%(158min)で送液した。カラム温度は30℃で流速は0.4mL/minとした。図2に示すように、ウシIgG糖鎖由来ピークが観察された。
これより、本発明の粒子保存容器を用いることにより、微粒子が損失せずに容器内に保存可能であることが示された。
【0051】
(参考例)
実施例1で用いたヒドラジドビーズを、上述した粒子保存容器内で保存することなく、直ぐに標識化糖鎖の検出を行った。得られた結果を、図3に示す。実線は、ウシIgG糖鎖由来ピークであった。
【0052】
参考例の結果で得られたウシIgG糖鎖由来ピークと、実施例1で得られたウシIgG糖鎖由来ピークに大きな相違は無かった。
これより、本発明の粒子保存溶液を用いて粒子を保存しても粒子表面の活性基は失活しないことが分かった。
【0053】
これらの結果により、本発明の微粒子保存溶液を用いることにより、不均一だった微粒子分散液を均一化させることができ、一定量の微粒子を反応容器に容易に分取することが可能となる。この際、従来問題となっていた微粒子の減少を最小限に抑えることが可能である。また、同時に複数個分の分取も可能である上、自動化にも向いているため作業の大幅な効率化も図れる。
【産業上の利用可能性】
【0054】
本発明の粒子保存溶液および粒子の保存方法は、抗体ビーズ、レクチンビーズ、アビジンビーズ、ビオチンビーズ、ヒドラジドビーズ等の(微)粒子を一定量任意の容器に分取するのに使用できる。また、本発明の粒子保存溶液は(微)粒子の分散性に優れているため、こまめに(微)粒子を攪拌する必要も無い。単純な操作で一定量の(微)粒子を分取可能なため、ロボットによる自動処理にも容易に対応が可能である。さらに、一連の操作により粒子の有する活性基等を破壊することもない。使用毎の(微)粒子量のばらつきや、活性基等の失活を心配することなく粒子を分取するのに適している。
【技術分野】
【0001】
本発明は、 粒子保存溶液および粒子の保存方法に関する。
【背景技術】
【0002】
抗体ビーズ、レクチンビーズ、アビジンビーズ、ビオチンビーズ、ヒドラジドビーズなど表面を活性化させた微粒子が多数市販されている。しかし、それらの大半は水溶液あるいは有機溶媒の分散液として保存し、使用時に必要量を分取するという使用方法である(例えば、特許文献1参照)。しかし、微粒子のような固体を液体中に均一に分散させるのは困難であり、使用毎に分取量が変化してしまう。そのため、自動で分取することが難しく、処理する検体数が多い場合は特に、分散液を反応容器に移すのに手間がかかるという欠点がある。
【0003】
この様な背景から、一定量の微粒子があらかじめ反応容器に封入された状態での提供または、一定量の微粒子を簡便に分取する手法の提供が求められる。カラムにあらかじめ一定量の微粒子が封入された状態で販売されている例もあるが、分散液での保存、乾燥状態での保存ともに容器の表面等に付着してしまうことで一部の微粒子を失ってしまう。特に、少量の微粒子を反応に用いるような系の場合、そのことが原因で結果にばらつきが生じやすくなってしまう。また、微粒子分散液から一定量の微粒子を分取する方法として、攪拌子を使用して微粒子分散液を攪拌させ、そこから一定量の分散液を分取する方法もあるが、攪拌速度を最適化するなどの工夫が必要で微粒子の偏りが生じやすいため、一定量の微粒子を得るのは難しい。そこで、一定量の微粒子を容易に分取可能な新しい手法が必要とされる。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特表2008−536821号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明の目的は、一定量の粒子を効率良く、かつ精度良く分取することが可能な粒子保存溶液に関する。
また、本発明の別の目的は、一定量の粒子を効率良く、かつ精度良く分取することが可能な粒子の保存方法に関する。
【課題を解決するための手段】
【0006】
このような目的は、下記(1)〜(11)に記載の本発明により達成される。
(1) 生物由来物質を固定化するための粒子と、前記粒子を保存する保存液とを含む粒子保存溶液であって、
前記粒子の平均比重(S1)と、前記保存液の比重(S2)との比重差が、0.4以下であることを特徴とする粒子保存溶液。
(2)前記保存液の比重(S2)が、0.5〜5である(1)に記載の粒子保存溶液。
(3)前記粒子の平均粒子径(r)は、0.1〜500μmである(1)または(2)に記載の粒子保存溶液。
(4)前記粒子の平均比重をS1とし、粒子の比重の標準偏差をσとし、保存液の比重をS2としたとき、
S1−3σ<S2<S1+3σ を満足する(1)ないし(3)のいずれかに記載の粒子保存溶液。
(5)前記保存液は、2種類以上の溶液を混合してなる混合溶液である(1)ないし(4)のいずれかに記載の粒子保存溶液。
(6)前記保存液は、無機塩の水溶液である(1)ないし(4)のいずれかに記載の粒子保存溶液。
(7)前記無機塩は、セシウム塩、バリウム塩、ルビジウム塩、ストロンチウム塩、カリウム塩、カルシウム塩、ナトリウム塩、マグネシウム塩、リチウム塩、ベリリウム塩から選ばれる少なくとも一つである(6)に記載の粒子保存溶液。
(8)前記無機塩の含有量は、前記水溶液中の0.1〜50重量/体積%である(6)または(7)に記載の粒子保存溶液。
(9)前記保存液の沸点が、50℃以上である(1)ないし(8)のいずれかに記載の粒子保存溶液。
(10)前記粒子は、樹脂粒子である(1)ないし(9)のいずれかに記載の粒子保存溶液。
(11)(1)ないし(10)のいずれかに記載の粒子保存溶液を用いることを特徴とする粒子の保存方法。
(12)(1)ないし(10)のいずれかに記載の粒子保存溶液で、該溶液中の粒子の分散を測定する方法であり、該溶液の可視光線の透過率を測定する粒子保存溶液の測定方法。
(13)(12)に記載の可視光線の透過率の測定において、透過率の時間変化を測定する保存溶液の測定方法。
【発明の効果】
【0007】
本発明によれば、一定量の粒子を効率良く、かつ精度良く分取することが可能な粒子保存溶液を得ることができる。
また、本発明によれば、一定量の粒子を効率良く、かつ精度良く分取することが可能な粒子の保存方法を提供することができる。
【図面の簡単な説明】
【0008】
【図1】微粒子の分散状態を説明するためのグラフである。
【図2】実施例の保存容器内に保存をしたビーズを用いて作製した、2−AB標識ウ シ由来IgG糖鎖を高速液体クロマトグラフィにより測定した結果を示すチャート図 である。
【図3】実施例1で用いたヒドラジドビーズを、上述した粒子保存容器内で保存する ことなく、直ぐに2−AB標識ウシ由来IgG糖鎖を高速液体クロマトグラフィによ り測定した結果を示すチャート図である。
【図4】実施例1で用いたヒドラジドビーズを含む粒子保存液の光透過度を測定した結果を示すチャート図である。
【発明を実施するための形態】
【0009】
以下、本発明の粒子保存溶液および粒子の保存方法について詳細に説明する。
本発明の粒子保存溶液は、生物由来物質を固定化するための粒子と、前記粒子を保存する保存液とを含む粒子保存溶液であって、前記粒子の比重(S1)と、前記保存液の比重(S2)との比重差が、0.4以下であることを特徴とする。
また、本発明の粒子の保存方法は、上述に記載の粒子保存溶液を用いることを特徴とする。
【0010】
(粒子保存溶液)
まず、粒子保存溶液について説明する。
本発明の粒子保存溶液は、生物由来物質を固定化するための粒子を保存するために用いるものである。このような粒子は、上述したように水溶液等の分散液として保存されることが多い。そして、使用される際には必要量を分取するという使用方法であるが、このような粒子を分散液中に均一に分散させるのは困難であり、使用毎に分取量が変化してしまうことがあった。本発明は、生物由来物質を固定化するための粒子に要求される課題を解決するためのものである。
【0011】
ここで、生物由来物質としては、例えばは糖鎖、タンパク質、DNA、RNA、脂質等を挙げることができる。
【0012】
本発明の粒子保存溶液は、前記粒子の平均比重(S1)と、前記保存液の比重(S2)との比重差が0.4以下であることを特徴とする。これにより、粒子保存液中に分散している粒子が沈降したり、浮遊したりしてくるのを抑制することができる。
前記比重差は、特に好ましくは0.2以下であり、より好ましくは0.1以下である。比重差が前記範囲内であると、分散している粒子が沈降または浮遊するまでの時間を長くすることができ、それによって試料を分取するさいのバラツキを低減することができる。
【0013】
このように、粒子の平均比重(S1)と、前記保存液の比重(S2)との比重差を、0.4以下とすることにより、粒子の分散性を向上することができる。具体的には、比重差を0.1〜0.4とした場合には、分散した粒子が沈降等するまでの時間を0.1〜0.5時間とすることができ、比重差を0.01〜0.1とした場合には、分散した粒子が沈降等するまでの時間を0.5〜1時間とすることができる。
【0014】
また、前記粒子保存溶液は、前記粒子の平均比重をS1とし、粒子の比重の標準偏差をσとし、保存液の比重をS2としたとき、S1−3σ<S2<S1+3σを満足するものであることが好ましい。これにより、粒子の比重にばらつきのあった場合でも粒子の分散性を向上することができる。
粒子の平均比重(S1)は、例えば比重瓶で測定し、標準偏差(σ)は密度勾配法により算出できる。
【0015】
このような粒子保存溶液に用いる(微)粒子としては、例えばシリカ粒子、金属粒子等の無機粒子、セファロース粒子、アガロース粒子、セルロース粒子、樹脂粒子等の有機粒子が挙げられる。これらの中でも有機粒子(特に、樹脂粒子)が好ましい。これにより、保存液との比重の調製を容易にすることができる。
具体的には、シリカ(微)粒子、高分子(微)粒子、金(微)粒子、セファロース(微)粒子、アガロース(微)粒子、セルロース(微)粒子等が挙げられる。これらの(微)粒子の中でも、表面に活性基としてアビジン、ビオチン、抗体、レクチン、カルボニル基、アミノ基、アミノオキシ基、ヒドラジド基、エステル基、マレイミド基およびチオール基のいずれか1種以上の活性基を有するものが好ましい。
【0016】
このような粒子の平均比重(S1)としては、特に限定されないが、0.6〜5.0であることが好ましく、より好ましくは0.67〜4.0であり、さらに好ましくは0.7〜3.0である。粒子の平均比重(S1)が前記範囲内であると、保存液との比重の調整を容易にすることができる。
このような平均比重は、例えば比重瓶を用いて評価することができる。
【0017】
また、前記粒子の平均粒子径は、特に限定されないが、0.1〜500μmであることが好ましく、特に10〜150μmであることが好ましい。平均粒子径が前記範囲内であると、(微)粒子の分散性に優れ、取り扱いが容易となる。
前記平均粒子径は、例えば粒度分布測定装置を用いて測定することができる。
【0018】
前記粒子保存溶液に用いる保存液としては、例えば水溶液、有機溶媒等が挙げられる。具体的には、水と無機塩の水溶液、水と有機溶媒の混合液、有機溶媒同士の混合液等が挙げられる。これらの中でも水と無機塩との水溶液が好ましい。これにより、溶液の蒸発による比重の変化を低減することができる。また、有機溶媒を用いることと比較すると環境への影響、人体への影響を低減することもできる。
【0019】
前記無機塩の水溶液としては、例えばセシウム塩、バリウム塩、ルビジウム塩、ストロンチウム塩、カリウム塩、カルシウム塩、ナトリウム塩、マグネシウム塩、リチウム塩、ベリリウム塩から選ばれる少なくとも一つを溶解させたものが好ましい。これにより、溶液の粘度を上昇させること無く使用することができる。
【0020】
前記無機塩の含有量は、目的とする比重に応じて決定され、特に限定されないが、水溶液中の質量パーセント濃度0.1〜90%が好ましく、特に質量パーセント濃度10〜60%が好ましい。含有量が前記範囲内であると、特に溶液の粘度を上昇させること無く使用することができ、扱いが容易ある。
【0021】
また、前記保存液は、2種以上の溶液を混合してなる混合溶液であっても良い。これにより、比重の調整する際の溶液選択の自由度を向上することができる。
2種以上の溶液の組み合わせとしては、例えば水とメタノール、水とエタノール、メタノールとクロロホルムが挙げられる。
【0022】
このような保存液を構成する溶液は、目的とする比重により適宜決定される。例えば、比重が1より大きい粒子を分散させるための保存液としては、水と無機塩の水溶液が好ましい。
一方、比重が1より小さい粒子を分散させるための保存液としては、水と有機溶媒の混合液、有機溶媒同士の混合液が好ましい。
【0023】
また、保存液を構成する溶液は、有機溶媒でも水溶液でも良いが、溶液の蒸発により比重が変化してしまう可能性を回避するために、沸点の高い有機溶媒あるいは水溶液であることが好ましい。具体的には、保存液の沸点が50℃以上であるものが好ましく、特に60℃以上であるものが好ましい。保存液の沸点が前記範囲内であれば、粒子を保存する過程での保存液の蒸発等により保存液の比重が変化するのを防止することができ、それによって粒子の分散状態を良好に維持できる。
【0024】
具体的に保存液の比重(S2)は、特に限定されないが、0.5〜5.0が好ましく、特に0.7〜3.0が好ましい。これにより、保存液の作製を容易にすることができる。
【0025】
上述したような前記粒子、前記保存液を用いて、前記粒子の平均比重(S1)と、前記保存液の比重(S2)との比重差が0.4以下であると、粒子が短時間で底に沈んでしまうこと防ぎ、長時間分散した状態を保つことにより、一定量の粒子を容器内に効率よく分取することが可能となる。
【0026】
(粒子の保存方法)
本発明の粒子の保存方法は、上述したような粒子保存液を用いることを特徴とする。これにより、粒子保存液中で粒子の沈降、浮遊するのを抑制することができる。すなわち、一度攪拌等により粒子を保存液中で分散させると、その分散状態を長く維持することができ、それによって粒子の正確な分取を可能とすることができるものである。
例えば、高分子(微)粒子を無機塩の水溶液に分散させて保存する保存方法等がある。
【0027】
このような粒子保存溶液を用いることにより、粒子が分散している状態を長く維持できるようになるので、不均一だった粒子の分散液の均一化を容易にできる。それによって、一定量の粒子を反応容器に分取することが容易になる。この際、従来から問題となっていた粒子の減少を最小限に抑えることが可能である。また、同時に複数個分の分取も可能である上、自動化にも向いているため作業の大幅な効率化も図ることもできる。
【0028】
(粒子分散状態の測定方法)
本発明の粒子の保存方法において、溶媒中の粒子が分散している状態を観察するには、簡便には、目視で観察し、沈殿物、すなわち、沈降した粒子の存在の有無により確認できる。
より詳細に、粒子の分散状態を確認する方法としては、粒子保存溶液に可視光線を照射し、その光透過率で粒子の分散状態を数値化することが可能である。これは、粒子が溶媒中に分散している状態においては、分散状態の粒子が障害物となり、照射した可視光線が透過せず、その分散粒子の濃度により光透過率が変わることを利用したもので、可視光線の分散状態に応じた可視光線の光透過率を示すことができる。
【0029】
さらに、この光透過率の経時変化を追跡することで、分散状態の変化を測定することが出来る。すなわち、光透過率が変化していくことは、粒子の分散状態が変わっていることを示し、例えば、分散している粒子が沈降すれば、保存容器上側の溶液において可視光線通過の障害物がなくなるので、光透過率が上昇していく結果となる。逆に容器下側の底面部に近い箇所では、粒子の沈降により、可視光線の障害物が増し、光透過度が下がる結果となる。
【0030】
具体的には、紫外可視分光光度計を用いて、セル中に粒子保存溶液の一部を移し、対照溶液として粒子を含まない保存溶液を用いて光透過率を測定することで分散状態を求めることが出来る。
【0031】
更に、一定量の粒子を反応容器に分取する場合に、粒子の分散状態が変化していないかを測定することも出来る。例えば、反応容器に分取後、各容器中の粒子分散液の光透過率を測定することで粒子の分取のバラツキを確認することができる。
また、分取の自動化の場合は、送液ライン中に透過光率測定のための窓を設け、それを使用して光透過率測定をすれば、分取時の粒子の分散状態を追跡することが可能で、より精度の高い分取が可能となる。
【実施例】
【0032】
以下、本発明を実施例および比較例に基づいて詳細に説明するが、本発明はこれに限定されるものではない。
【0033】
(実施例1)
1.保存液の調製
塩化セシウム(比重3.99、和光純薬、035−01952)2.43gを、水7.57mLに溶解させて、質量パーセント濃度24.3%の塩化セシウム水溶液(比重1.223)を得た。
【0034】
2.粒子保存溶液の調製
微粒子としてヒドラジドビーズ(ポリマー粒子、球状、50mg、ヒドラジド基保有、住友ベークライト社製、BS−45603、平均比重1.291)を、1.5mLチューブに量り取り、そして上述の保存液を500μL分注し、ボルテックスミキサーで攪拌して、粒子保存溶液を得た。この微粒子と、保存液との比重差は、0.068であった。
【0035】
(実施例2)
保存液として、以下のものを用いた以外は、実施例1と同様にした。
塩化セシウム(比重3.99、和光純薬、035−01952)3.63gを、水6.37mLに溶解させて、質量パーセント濃度36.3%の塩化セシウム水溶液(比重1.374)を得た。この微粒子と、保存液との比重差は、0.083であった。
【0036】
(実施例3)
保存液として、以下のものを用いた以外は、実施例1と同様にした。
塩化セシウム(比重3.99、和光純薬、035−01952)2.1gを、水7.9mLに溶解させて、質量パーセント濃度21%の塩化セシウム水溶液(比重1.187)を得た。この微粒子と、保存液との比重差は、0.104であった。
【0037】
(比較例1)
保存液としてメタノール(比重0.791)のものを用いた以外は、実施例1と同様にした。この微粒子と保存液との比重差は0.5であった。
【0038】
(比較例2)
保存液として、以下のものを用いた以外は、実施例1と同様にした。
塩化セシウム(比重3.99、和光純薬、035−01952)5.71gを、水4.29mLに溶解させて、質量パーセント濃度57.1%の塩化セシウム水溶液(比重1.748)を得た。この微粒子と、保存液との比重差は、0.457であった。
【0039】
各実施例および比較例で得られた粒子保存溶液について、以下の評価を行った。評価項目を内容と共に示す。得られた結果を、表1に示す。
【0040】
1.微粒子の分散状態(1)
ボルテックスミキサーで攪拌後における粒子保存溶液の微粒子の分散状態を、目視で評価した。各符号は、以下の通りである。
◎:0.5時間経過後も微粒子の沈殿、浮遊が無かった。
○:0.2時間以上、0.5時間未満で微粒子の沈殿、浮遊が無かった。
△:0.1時間以上、0.2時間未満で微粒子の沈殿、浮遊が無かった。
×:0.1時間未満に、微粒子の沈殿、浮遊が有った。
【0041】
2.微粒子の分散状態(2)
実施例1で得られた粒子保存溶液および比較例1で得られた粒子保存溶液を、それぞれボルテックスミキサーにて攪拌した。この攪拌直後から、1分後、3分後、5分後、10分後、15分後、20分後、30分後、60分後にそれぞれ100μLの粒子保存液を、重量があらかじめ測定してある1.5mLチューブに分注した。その後、凍結乾燥により1.5mLチューブ内の水を完全に除去し1.5mLチューブの重量を再測定した。1.5mLチューブ本体の重量との差から1.5mLチューブ内に分注された粒子および塩化セシウム量を算出し、それぞれ比較した。得られた結果を、図1に示す。
【0042】
図1に示すように、比較例1で得られた粒子保存溶液を用いた場合では数分後には収量が大きく変動しているのに対して、実施例1で得られた粒子保存溶液を用いた場合では、60分経過後も大きな変動が見られなかった。これより、本発明の粒子保存溶液を用いて粒子を保存することにより粒子の分散性が、より向上することが分かった。
【0043】
2.微粒子の分散状態(3)
実施例1で得られた粒子保存溶液および超純水に粒子を分散させたものの光透過率の継時変化を測定した。
具体的には、実施例1で得られた粒子保存液を保存液で10倍希釈したものを準備、また比較例1同様に粒子をメタノールで濃度が同じになるように希釈した溶液を準備した。各々の溶液を装置専用の測定用ガラスセルに移した。
測定は、多目的紫外可視分光光度計DU730(BECKMAN COULTER, Life Scienve UV/Vis Spectorometer)で測定した。測定時間は、粒子保存液は、0,5,10,15,30,40,50,60分、メタノール分散は、0, 0.25, 0.5,1,1.5,2,2.5,3,3.5,4,4.5,5分に測定した。対照は、それぞれの粒子を含まない溶液を用いた。得られた結果を図4に示す。
【0044】
図4に示すように、実施例1では、60分後においても光透過率は、ほとんど変化が見られない。一方、比較例1では、測定開始時から急激に光透過度が上昇し、5分で光透過度が90%を越える結果となった。実際に測定用ガラスセルを目視で確認すると、実施例1の溶液は、変化が見られないのに対し、比較例1ではセルの底面に明らかに粒子が沈降していることが確認された。本方法により、粒子保存液の粒子分散状態を確認することが可能であることが示された。
【0045】
3.粒子の性能確認
(A)微粒子の回収
次に、粒子保存溶液中の微粒子の反応に使用する新たな反応容器(フィルターカラム、住友ベークライト社製、BS−45603)を準備した。粒子保存溶液50μLを反応容器に添加した。卓上遠心機を用いて保存液を遠心除去した。さらに、微粒子の入った反応容器の内部に純水200μLを加え、卓上遠心機を用いて純粋を遠心除去した。これをさらに2回繰り返し粒子に付着した塩化セシウム塩を除去した。
【0046】
(B)試料の作製
ウシ免疫グロブリンG(ウシIgG)1mgを100mM(ミリモーラー)の重炭酸アンモニウム50μLに溶解させた後、120mM(ミリモーラー)のDTT(ジチオスレイトール)を5μL加え、60℃で30分間反応させた。反応終了後、123mM(ミリモーラー)のIAA(ヨードアセトアミド)10μLを加えて遮光下、室温で1時間反応させた。続いて400Uのトリプシンによってプロテアーゼ処理をし、タンパク質部分をペプチド断片化した。反応溶液を90℃で5分処理した後、5UのグリコシダーゼFによる処理を行って糖鎖をペプチドから遊離させ、予備処理済の生体試料を得た。
【0047】
(C)微粒子と生体試料の反応
微粒子が入ったフィルターカラムに、予備処理済の生体試料の懸濁物20μLおよび180μLの2%酢酸/アセトニトリル溶液を加え、80℃で1時間反応させ微粒子上のヒドラジド基に糖を固定させた。反応は開放系で行い、溶媒が完全に蒸発し微粒子が乾固した状態であることを目視で確認した。続いて、グアニジン溶液、水、メタノール、トリエチルアミン溶液にて微粒子を洗浄後、10%無水酢酸/メタノールを添加し、室温で30分間反応させ、未反応のヒドラジド基をキャッピングした。キャッピング後、メタノール、塩酸水溶液、水にて微粒子を洗浄した。微粒子の入ったフィルターカラムに、超純水20μLおよび2%酢酸/アセトニトリル溶液180μLを加え、70℃で1時間反応させ微粒子上の糖鎖を切り出した。反応は開放系で行い、溶媒が完全に蒸発し微粒子が乾固した状態であることを目視で確認した。
【0048】
(D)標識化工程
微粒子および切り出した糖鎖の入ったフィルターカラムに、2−アミノベンズアミド(2−AB)およびシアノ水素化ホウ素ナトリウムの終濃度がそれぞれ0.35M、1Mになるように30%酢酸/DMSO混合溶媒に溶解させて調整した溶液50μLを添加し、60℃で2時間反応させて、切り出した糖鎖を2−ABで標識化した。
【0049】
(E)余剰試薬除去工程
上述の溶液50μLを回収し、アセトニトリルで10倍に希釈した後、標識化した糖鎖を付属のクリーンアップカラムに吸着させた。アセトニトリル、アセトニトリル/水混合溶液(95:5)にてカラムを洗浄後、超純水50μLにて標識化した糖鎖を回収した。
【0050】
(F)標識化した糖鎖の検出
得られた標識化した糖鎖をHPLCにて測定した。アミドカラム(TSK−GEL Amide−80 4.6*250)を用いて励起波長330 nm、蛍光波長420 nmにて測定した。溶媒Aは50mMギ酸、25%アンモニア水にてpH4.4に調整したものを使用し、溶媒Bとしてアセトニトリルを使用し、溶媒A液20%(0min)→A液58%(158min)で送液した。カラム温度は30℃で流速は0.4mL/minとした。図2に示すように、ウシIgG糖鎖由来ピークが観察された。
これより、本発明の粒子保存容器を用いることにより、微粒子が損失せずに容器内に保存可能であることが示された。
【0051】
(参考例)
実施例1で用いたヒドラジドビーズを、上述した粒子保存容器内で保存することなく、直ぐに標識化糖鎖の検出を行った。得られた結果を、図3に示す。実線は、ウシIgG糖鎖由来ピークであった。
【0052】
参考例の結果で得られたウシIgG糖鎖由来ピークと、実施例1で得られたウシIgG糖鎖由来ピークに大きな相違は無かった。
これより、本発明の粒子保存溶液を用いて粒子を保存しても粒子表面の活性基は失活しないことが分かった。
【0053】
これらの結果により、本発明の微粒子保存溶液を用いることにより、不均一だった微粒子分散液を均一化させることができ、一定量の微粒子を反応容器に容易に分取することが可能となる。この際、従来問題となっていた微粒子の減少を最小限に抑えることが可能である。また、同時に複数個分の分取も可能である上、自動化にも向いているため作業の大幅な効率化も図れる。
【産業上の利用可能性】
【0054】
本発明の粒子保存溶液および粒子の保存方法は、抗体ビーズ、レクチンビーズ、アビジンビーズ、ビオチンビーズ、ヒドラジドビーズ等の(微)粒子を一定量任意の容器に分取するのに使用できる。また、本発明の粒子保存溶液は(微)粒子の分散性に優れているため、こまめに(微)粒子を攪拌する必要も無い。単純な操作で一定量の(微)粒子を分取可能なため、ロボットによる自動処理にも容易に対応が可能である。さらに、一連の操作により粒子の有する活性基等を破壊することもない。使用毎の(微)粒子量のばらつきや、活性基等の失活を心配することなく粒子を分取するのに適している。
【特許請求の範囲】
【請求項1】
生物由来物質を固定化するための粒子と、前記粒子を保存する保存液とを含む粒子保存溶液であって、
前記粒子の平均比重(S1)と、前記保存液の比重(S2)との比重差が、0.4以下であることを特徴とする粒子保存溶液。
【請求項2】
前記保存液の比重(S2)が、0.5〜5である請求項1に記載の粒子保存溶液。
【請求項3】
前記粒子の平均粒子径(r)は、0.1〜500μmである請求項1または2に記載の粒子保存溶液。
【請求項4】
前記粒子の平均比重をS1とし、粒子の比重の標準偏差をσとし、保存液の比重をS2としたとき、
S1−3σ<S2<S1+3σ を満足する請求項1ないし3のいずれかに記載の粒子保存溶液。
【請求項5】
前記保存液は、2種類以上の溶液を混合してなる混合溶液である請求項1ないし4のいずれかに記載の粒子保存溶液。
【請求項6】
前記保存液は、無機塩の水溶液である請求項1ないし4のいずれかに記載の粒子保存溶液。
【請求項7】
前記無機塩は、セシウム塩、バリウム塩、ルビジウム塩、ストロンチウム塩、カリウム塩、カルシウム塩、ナトリウム塩、マグネシウム塩、リチウム塩、ベリリウム塩から選ばれる少なくとも一つである請求項6に記載の粒子保存溶液。
【請求項8】
前記無機塩の含有量は、前記水溶液中の0.1〜50重量/体積%である請求項6または7に記載の粒子保存溶液。
【請求項9】
前記保存液の沸点が、50℃以上である請求項1ないし8のいずれかに記載の粒子保存溶液。
【請求項10】
前記粒子は、樹脂粒子である請求項1ないし9のいずれかに記載の粒子保存溶液。
【請求項11】
請求項1ないし10のいずれかに記載の粒子保存溶液を用いることを特徴とする粒子の保存方法。
【請求項12】
請求項1ないし10のいずれかに記載の粒子保存溶液で、該溶液中の粒子の分散を測定する方法であり、該溶液の可視光線の透過率を測定する粒子保存溶液の測定方法。
【請求項13】
請求項12に記載の可視光線の透過率の測定において、透過率の時間変化を測定する粒子保存溶液の測定方法。
【請求項1】
生物由来物質を固定化するための粒子と、前記粒子を保存する保存液とを含む粒子保存溶液であって、
前記粒子の平均比重(S1)と、前記保存液の比重(S2)との比重差が、0.4以下であることを特徴とする粒子保存溶液。
【請求項2】
前記保存液の比重(S2)が、0.5〜5である請求項1に記載の粒子保存溶液。
【請求項3】
前記粒子の平均粒子径(r)は、0.1〜500μmである請求項1または2に記載の粒子保存溶液。
【請求項4】
前記粒子の平均比重をS1とし、粒子の比重の標準偏差をσとし、保存液の比重をS2としたとき、
S1−3σ<S2<S1+3σ を満足する請求項1ないし3のいずれかに記載の粒子保存溶液。
【請求項5】
前記保存液は、2種類以上の溶液を混合してなる混合溶液である請求項1ないし4のいずれかに記載の粒子保存溶液。
【請求項6】
前記保存液は、無機塩の水溶液である請求項1ないし4のいずれかに記載の粒子保存溶液。
【請求項7】
前記無機塩は、セシウム塩、バリウム塩、ルビジウム塩、ストロンチウム塩、カリウム塩、カルシウム塩、ナトリウム塩、マグネシウム塩、リチウム塩、ベリリウム塩から選ばれる少なくとも一つである請求項6に記載の粒子保存溶液。
【請求項8】
前記無機塩の含有量は、前記水溶液中の0.1〜50重量/体積%である請求項6または7に記載の粒子保存溶液。
【請求項9】
前記保存液の沸点が、50℃以上である請求項1ないし8のいずれかに記載の粒子保存溶液。
【請求項10】
前記粒子は、樹脂粒子である請求項1ないし9のいずれかに記載の粒子保存溶液。
【請求項11】
請求項1ないし10のいずれかに記載の粒子保存溶液を用いることを特徴とする粒子の保存方法。
【請求項12】
請求項1ないし10のいずれかに記載の粒子保存溶液で、該溶液中の粒子の分散を測定する方法であり、該溶液の可視光線の透過率を測定する粒子保存溶液の測定方法。
【請求項13】
請求項12に記載の可視光線の透過率の測定において、透過率の時間変化を測定する粒子保存溶液の測定方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2011−102796(P2011−102796A)
【公開日】平成23年5月26日(2011.5.26)
【国際特許分類】
【出願番号】特願2010−228053(P2010−228053)
【出願日】平成22年10月8日(2010.10.8)
【出願人】(000002141)住友ベークライト株式会社 (2,927)
【Fターム(参考)】
【公開日】平成23年5月26日(2011.5.26)
【国際特許分類】
【出願日】平成22年10月8日(2010.10.8)
【出願人】(000002141)住友ベークライト株式会社 (2,927)
【Fターム(参考)】
[ Back to top ]

