粒子固定用構造体、粒子解析装置、及び解析方法
【課題】バックグラウンドノイズやクロストークノイズなどを低減し、多数の微粒子の光学的な観察を高感度且つ高精度に行うことを可能にする技術を提供する。
【解決手段】粒子固定用構造体14は、被検体粒子を構成する成分の存在を示す物質から発せられる光を検出するために該被検体粒子をそれぞれ保持する複数の保持孔9を有するものであり、平板状の透光性の基板15と、基板15の第1面上に配置され、複数の保持孔9が形成された保持部20と、基板15の第2面上に配置される遮光膜19と、を備え、保持孔9は、保持部20の上表面に開口し、かつ、基板15の第1面まで延在しており、遮光膜19は、複数の保持孔9に対応する位置に、基板15の第2面を露出させる複数の開口部9を有している。
【解決手段】粒子固定用構造体14は、被検体粒子を構成する成分の存在を示す物質から発せられる光を検出するために該被検体粒子をそれぞれ保持する複数の保持孔9を有するものであり、平板状の透光性の基板15と、基板15の第1面上に配置され、複数の保持孔9が形成された保持部20と、基板15の第2面上に配置される遮光膜19と、を備え、保持孔9は、保持部20の上表面に開口し、かつ、基板15の第1面まで延在しており、遮光膜19は、複数の保持孔9に対応する位置に、基板15の第2面を露出させる複数の開口部9を有している。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、被検体粒子を固定するための粒子固定用構造体、並びに、被検体粒子の解析装置及び解析方法に関する。
【背景技術】
【0002】
近年、生体試料(例えば細胞)などの微粒子を基板上に個別に規則正しく配列することにより、各粒子の性質や構造を個々に解析したり観察したりすることを可能とする技術が提案され、創薬、治療、検査、分析など様々な分野での応用が期待されている。特許文献1では、アレイ状に配置された微細孔(マイクロウエル)を備える基板の上に細胞懸濁液を添加してウエル内に細胞が沈むのを待った後、ウエルの外に残った細胞を洗い流す、という工程を繰り返し行うことで、各ウエルに細胞を1つずつ固定する方法が開示されている。また特許文献2には、上部電極と、多数の貫通孔が形成された絶縁体層を有する下部電極との間の空間に、微粒子を含む懸濁液を導入し、両電極間に交流電圧を印加することで、誘電泳動力により微粒子を貫通孔内に導入し固定する方法が開示されている。特許文献1,2のような方法により多数の微粒子が個別に固定された基板を作製することができれば、例えば、励起光照射による蛍光を観察することで個々の微粒子の解析を容易に且つ一括して行うことができるようになる。一例として、特許文献1では、蛍光標識したリンパ球を1つずつウエル内に固定し、抗原による刺激を加える前と後で蛍光強度の変化を観察することで、集団の中に極めて低い頻度で存在する抗原特異的リンパ球を同定する方法が提案されている。
【0003】
また、特許文献3には、表面に水酸基を導入可能な基体と、基体に達する複数のウエルが設けられた金属系膜と、金属系膜上に配置された架橋性の高分子膜とを備えるバイオチップ用基板が開示されている。ただし、特許文献3の基板は核酸を固定するためのものであり、細胞等の微粒子を固定するためのものではない。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特許第3723882号公報
【特許文献2】特開2007−296510号公報
【特許文献3】特開2007−78631号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
特許文献1、2のように基板上に配列された多数の微粒子の蛍光検出を一括して行う場合には、次のような問題が生ずる。第一に、励起光照射により発生する蛍光の中には、蛍光標識された微粒子から発生する蛍光(蛍光シグナル)以外に、基板自体から発生する自家蛍光も含まれる。これがバックグラウンドノイズとして影響し、蛍光シグナルの強度の検出精度を低下させる。また、測定装置の構成や測定条件によっては、蛍光以外にも、室内光などの外部からの光も同様にバックグラウンド光として検出される。第二に、微粒子同士の間隔が狭い場合には、隣の微粒子からの漏れ光(クロストークノイズ)による検出精度の低下も問題となる。第三に、長時間の励起光照射による蛍光退色防止のため、蛍光標識された生体試料から発生する蛍光強度の検出時間を短縮することも要求されている。
【0006】
そこで、本発明は、かかる従来の実状に鑑みて提案されたものであり、その目的は、バックグラウンドノイズやクロストークノイズなどを低減し、多数の微粒子の光学的な観察を高感度且つ高精度に行うことを可能にする技術を提供することにある。
【課題を解決するための手段】
【0007】
上記目的を達成するために、本発明は以下の構成を採用する。すなわち、本発明に係る粒子固定用構造体(以下単に「構造体」ともよぶ)は、被検体粒子を構成する成分の存在を示す物質により発せられる光を検出するために該被検体粒子をそれぞれ保持する複数の保持孔を有する粒子固定用構造体であって、平板状の透光性の基板と、前記基板の第1面上に配置され、前記複数の保持孔が形成された保持部と、前記基板の第1面とは反対側の第2面上に配置される遮光膜と、を備え、前記保持孔は、前記保持部の上表面に開口し、かつ、前記基板の第1面まで延在(到達)しており、前記遮光膜は、前記複数の保持孔に対応する位置に、前記基板の第2面を露出させる複数の開口部を有している、という構成を備える。ここで、「(基板の第2面上の)保持孔に対応する位置」とは、保持孔(もしくは保持孔の底部)を基板の第2面に垂直投影することで得られる仮想的な領域の位置(例えば当該領域の中心位置)として定義できる。なお、保持孔(もしくは保持孔の底部)を基板の第2面に垂直投影することで得られる仮想的な領域のことを「(基板の第2面上の)保持孔に対応する領域」ともよぶ。
【0008】
この構成によれば、基板の第2面の側から遮光膜の開口部及び基板を通して保持孔を観察することにより、例えば保持部自体の自家蛍光に起因するバックグラウンドノイズや隣接する保持孔からの漏れ光に起因するクロストークノイズなどの光ノイズを低減することができ、各保持孔内の観察対象物質により発せられる光のみを高感度かつ高精度に検出することが可能となる。そして、高感度かつ高精度の検出が可能であることから、検出時間の短縮を図る効果も期待できる。
【0009】
ここで、本発明の構造体が、前記保持部の上に前記被検体粒子を含む懸濁液を収容する収容部を更に備えており、前記保持孔が前記収容部と連通するように設けられていることが好ましい。これにより、各保持孔内への被検体粒子の導入を容易に行うことができる。なお、保持孔内へ被検体粒子を導入する方法としては、自然沈降(重力)を利用してもよいし、誘電泳動力を利用することもできるが、数秒程度の極めて短い時間で多数の保持孔に対し被検体粒子を導入できることから、誘電泳動力を利用する方法がより好適である。
【0010】
誘電泳動力を被検体粒子に作用させるには、収容部及び保持孔を懸濁液で満たした状態で、保持孔の部分に電気力線が集中するような交流電界をかければよい。かかる交流電界を印加するための構成として、例えば、前記基板の第1面上に、互いに異なる保持孔に対応する位置にそれぞれ配置される一対の電極が設けられ、前記保持部は絶縁体膜からなり、前記保持孔は、前記絶縁体膜の上表面から前記基板上の電極まで延在する、という構成を採用することができる。また、前記基板の第1面上に、前記保持孔に対応する位置に配置される第1の電極が設けられるとともに、前記保持部は絶縁体膜からなり、前記保持孔は、前記絶縁体膜の上表面から前記基板上の第1の電極まで延在し、前記保持部および前記収容部を挟んで前記第1の電極とは反対の側に第2の電極が設けられる、という構成を採用することもできる。いずれの構成の場合も、2つの電極の間に所定の波形を有する交流電圧を印加することで、懸濁液中の被検体粒子を保持孔内へと導入することが可能である。
【0011】
ここで、前記遮光膜は、基板の第2面のうち複数の保持孔に対応する領域以外の領域を全部覆っていることが好ましい。これにより保持孔以外の部分から発生する光ノイズを可及的に除去しつつ、保持孔から発せられる光シグナルを適切に検出することが可能となるからである。
【0012】
前記基板の第1面上に設けられた電極は透明電極であることが好ましい。これにより、保持孔から発せられる光を基板の第2面側から観察する際に、電極が妨げとならず、光の
検出強度の低下を防止できる。
【0013】
また本発明に係る粒子解析装置は、上述した粒子固定用構造体と、前記電極に誘電泳動力を発生させるための交流電圧を印加する電源と、前記電源からの電圧印加後に、前記粒子固定用構造体の保持孔に保持された前記被検体粒子を構成する成分の存在を示す物質により発せられる光を検出する検出部と、を備えることを特徴とする。
【0014】
また本発明に係る被検体粒子の解析方法は、上述した粒子固定用構造体上の保持孔に被検体粒子を固定し、固定された被検体粒子を構成する成分の存在を示す物質により発せられる光を検出することを特徴とする。ここで、前記被検体粒子を構成する成分の存在を示す物質は、後述する標識物質である。
【発明の効果】
【0015】
本発明によれば、バックグラウンドノイズやクロストークノイズなどを低減し、多数の微粒子の光学的な観察を高感度且つ高精度に行うことが可能となる。
【図面の簡単な説明】
【0016】
【図1】本発明の第1実施形態に係る構造体を説明するための図である。
【図2】図1の構造体の断面図である。
【図3】本発明の第2実施形態に係る構造体及び粒子固定装置を説明するための図である。
【図4】図3の構造体の断面図である。
【図5】本発明の第3実施形態に係る構造体及び粒子固定装置を説明するための図である。
【図6】本発明の第4実施形態に係る構造体及び粒子固定装置を説明するための図である。
【図7】図6の構造体の断面図である。
【図8】誘電泳動による粒子の固定方法を説明するための図である。
【図9】誘電泳動による粒子の固定方法を説明するための図である。
【図10】粒子の解析方法を説明するための図である。
【図11】本発明の装置を異常細胞の検出装置に適用した例を示す図である。
【図12A】実施例1の構造体の製造方法を説明するための図である。
【図12B】実施例1の構造体の製造方法を説明するための図である。
【図13A】実施例2の構造体の製造方法を説明するための図である。
【図13B】実施例2の構造体の製造方法を説明するための図である。
【図13C】実施例2の構造体の製造方法を説明するための図である。
【発明を実施するための形態】
【0017】
以下に図面を参照して、本発明の好適な実施の形態を例示的に詳しく説明する。ただし、以下の実施形態及び対応する図面に記載する部材の形状、寸法、材料などは本発明の目的を達成するための一具体例にすぎず、本発明の範囲をそれらの構成のみに限定する趣旨のものではない。
【0018】
<粒子固定用構造体の基本構造>
まず、本発明に係る粒子固定用構造体(以下単に「構造体」ともよぶ)の基本構造について説明する。
【0019】
粒子固定用構造体とは、検査対象となる多数の被検体粒子を個別に規則正しく配列し保持(固定)することにより、多数の被検体粒子の操作、観察、解析などを容易化するための部材である。本発明の構造体により固定可能な被検体粒子としては、生体試料系微粒子
、無機材料系微粒子(シリカ、ジルコニア、酸化ニッケルなど)、有機材料系微粒子(ポリスチレンなど)を例示できる。中でも、本発明は細胞やウイルス粒子に代表される生体試料系微粒子の固定に好ましく適用することができるため、以下の実施形態では主に生体試料系微粒子(以下、「生体試料」と記載することがある。)を例に挙げて説明を行う。
【0020】
(第1実施形態)
図1および図2に、第1実施形態に係る構造体を模式的に示す。図1(a)は構造体の平面図であり、図1(b)は構造体の層構造を説明するための分解斜視図である。また図2(a)は図1(a)のA−A断面図であり、図2(b)は構造体に生体試料(例えば細胞)が固定された状態を示している。
【0021】
図1および図2に示すように、構造体14は、平板状の透光性の基板15と、基板15の第1面(図中の上面)上に配置される保持部20と、基板15の第2面(図中の下面)上に配置される遮光膜19と、保持部20の上に生体試料を含む懸濁液が導入される空間(収容部ともよぶ)45を形成するためのスペーサー16とから構成されている。保持部20は、絶縁体膜18から成り、絶縁体膜18を貫通し基板15まで延在(到達)するように形成された複数の保持孔(貫通孔)9を有している。ここで、保持孔9は、基板15の第1面を底面とする有底筒状の孔であり、基板15の第1面から保持部20(絶縁体膜18)の膜厚方向に延びて、収容部45に対して開口するように形成されている。なお、説明及び図示の便宜から、図面にはいくつかの保持孔9しか記載されていないが、実際の構造体では数千から数百万あるいは数千万個の保持孔9が設けられている。一方、遮光膜19には、保持孔9に対応する位置にそれぞれ、基板15の第2面を露出させる開口部29が設けられている。すなわち、透光性の基板15を挟んで、保持孔9と開口部29とがちょうど対応する位置に配置されている。
【0022】
上記の構成によれば、例えば、スペーサー16に設けられた導入口24から生体試料を含む懸濁液を収容部45内に導入し、重力によって生体試料を保持孔9内に沈降させることで、図2(b)に示すように各々の保持孔9に対し生体試料2を固定することができる。そして、各保持孔9に生体試料2が固定された構造体14に対し、標識等の必要な操作を行った後、例えば、図2(b)の上側(収容部側)から励起光6を照射し、図2(b)の下側(基板側)から開口部29及び基板15を通して蛍光7を観察すると、絶縁体膜18の自家蛍光や隣接する保持孔9からの漏れ光が遮光膜19によって遮られる。したがって、バックグラウンドノイズやクロストークノイズなどの光ノイズを低減することができる。これにより、生体試料2に特異的に結合した標識物質(後述する)により発せられる微弱な光シグナルを高感度かつ高精度に検出することが可能となる。
【0023】
次に、粒子固定用構造体の他の実施形態について説明する。第1実施形態の構造体は重力の作用により微粒子を保持孔内に導入したのに対し、以下に述べる第2〜第4実施形態の構造体は誘電泳動力を主に利用して微粒子の保持孔内への導入を行う構成を採用している。
【0024】
(第2実施形態)
図3および図4は、第2実施形態に係る構造体及び粒子固定装置の構成を模式的に示している。図3は構造体の層構造を説明するための分解斜視図であり、図4は構造体の断面図である。なお、図4は、図1(a)のA−A線と同じ部分の断面を示している(以下の断面図も同様)。第2実施形態の構造体14は、基板15の保持部側の面に一対の透明電極22、23からなる櫛状電極21を有している。それぞれの電極22、23は、保持孔9の配列方向に沿って平行に配置される複数の帯状電極を有しており、一方の電極22の帯状電極と他方の電極23の帯状電極とが互い違いになるように配置されている。図4に示すように、それぞれの帯状電極は保持孔9に対応する位置に設けられ、各保持孔9の底
部に電極が露出している。各電極22、23は導電線3を介して交流電源4に接続されている。この構成において、収容部45内を生体試料を含む懸濁液で満たし、交流電源4から電極22、23の間に交流電圧を印加することにより、生体試料に誘電泳動力を作用させ、生体試料を電気力線の集中する保持孔9内へと導入し固定することができる。なお誘電泳動の詳細については後述する。
【0025】
(第3実施形態)
図5は、第3実施形態に係る構造体及び粒子固定装置を示している。図4に示した第2実施形態の構造体との違いは、スペーサー16の上に収容部45を覆う上蓋17を設けた点である。上蓋17を設けることにより、収容部45内に導入した生体試料を含む懸濁液の水分が蒸発することを防止したり、生体試料を含む懸濁液を導入口24から安定して収容部45内に供給できるという利点がある。懸濁液の供給が安定する理由は、上蓋17とスペーサー16の収容部45との間を流れる流体の流線が基板平面と平行に層流になりやすいからと考えられる。なお、第1実施形態の構造体においても、同様の効果を得るために上蓋を設けてもよい。一方で、第1実施形態や第2実施形態のように上蓋の無い構成も、部材点数削減による製造の簡易化ならびにコスト低減の効果が得られるとともに、保持孔9内に固定した生体試料のうちの任意のものをマイクロピペット等で採取するなどの操作を容易にできるという利点がある。従って、用途や目的に応じて上蓋を設けるか否かを選択すればよい。なお、上蓋を設けない実施形態や、上蓋を脱着可能に設ける実施形態では、スペーサー16に導入口24等を設けることなく、生体試料を含む懸濁液を収容部45内の上方向から直接導入し又は排出することができる。
【0026】
(第4実施形態)
図6および図7は、第4実施形態に係る構造体及び粒子固定装置を示している。図6は構造体の層構造を説明するための分解斜視図であり、図7は構造体の断面図である。第4実施形態の構造体14は、保持部20の下側と上側にそれぞれ下部電極基板36と上部電極基板35が配置された構造である。下部電極基板36は、上記実施形態で述べた基板15の第1面(すなわち、基板15と保持部20の間)に透明電極層を配置した構成であり、基板15は図6および図7から省略して描いている。この電極層は保持孔9の底部に露出するように形成されていればその形状は問わないが、図6のように基板の全面に電極層を設ける構成は製造プロセスの容易化の観点から好ましい形態である。一方、上部電極基板35については、下部電極基板36と同じように基板上に電極層を設けた構成でもよいし、導電性材料からなる板状部材を上部電極基板35として用いることもできる。なおこの実施形態では、上部電極基板35が、収容部45を覆う上蓋を兼ねている。この構成において、収容部45内を生体試料を含む懸濁液で満たし、電源4から上部電極基板35と下部電極基板36の間に交流電圧を印加することにより、生体試料に誘電泳動力を作用させ、生体試料を電気力線の集中する保持孔9内へと導入し固定することができる。
【0027】
上述した第2から第4実施形態に係る構造体においても、基板15の第2面上に遮光膜19を設けたことにより、第1実施形態で述べたときと同様、生体試料を光学的に観察する際に、バックグラウンドノイズやクロストークノイズなどの光ノイズを低減することができ、生体試料から発する微弱な光シグナルを高感度かつ高精度に検出することが可能となる。
【0028】
なお、収容部45を密閉可能な箱状の形態とし、かつ、生体試料を含有する懸濁液の比重を生体試料の比重以上として生体試料がその懸濁液中で上方向に浮上するようにする(生体試料の比重が大きい場合であっても、懸濁液の比重をそれ以上とすることは容易である。)場合、収容部45の上方に下向きに開口する保持孔9を有する保持部20を設ける構成とすることができる。これは、第3又は第4実施形態の構造体を上下逆転した構成の構造体である。ただし、生体試料の操作に重力をも利用することができること、固定化後
の生体試料の分別回収や抽出により生体試料から溶出した遺伝子の分別回収を考えると、当該操作を上部からの吸引等、極めて単純な操作で実施可能とするために、保持部20を収容部45の下側に配置することが好ましく、さらに収容部45の上蓋17や上部電極基板35はスペーサー16から取り外し可能な構成にしておくことが好ましい。
【0029】
<構成部材の説明>
次に、上述した粒子固定用構造体14の各構成部材について、詳しく説明する。
【0030】
(基板および電極)
透光性の基板15の材料としては、アクリル樹脂、エポキシ樹脂、酸化ケイ素を主成分とした合成石英(SiO2)、セラミックスなどが利用可能である。特に酸化ケイ素と酸化ホウ素を主成分とし、良好な加工性と低い熱膨張率を兼ね備えた、パイレックスガラス(登録商標)が好ましい部材として例示できる。
【0031】
また、基板表面に設けられる透明電極の材質は、導電性を有しており且つ化学的に安定な材料であればとくに制限はない。例えば、ZnO(酸化亜鉛)、SnO(酸化スズ)および、ITO(Indium Tin Oxide:酸化インジウムスズ)等の透明導電材料等を使用することができる。中でも、ITO電極は、その透明性や成膜性等の面で特に好ましい電極材料である。
【0032】
保持孔9内の標識物質を光学的に観察する方法には、「透過型」と「反射型」の2種類がある。透過型とは、保持孔9の底部と開口のうちの一方の側から光を照射し、その反対側から光を観察(検出)する方法であり、反射型とは、保持孔9の底部と開口のうちの一方の側から光を照射し、同じ側から光を観察(検出)する方法である。ここではいずれの方法も利用可能であるが、反射型の場合は、光照射手段と光検出手段の両方を構造体14に対して同じ側に設置しなければならないため、透過型に比較して装置構成の制約が生じる。それゆえ、装置構成の簡易化の観点からは、透過型のほうが有利である。また、上記実施形態では、保持部20の下側(基板側)に遮光膜19を配置しているため、保持部20の上側から観察するよりも、下側から(すなわち基板15を通して)光を観察するほうが、遮光膜19による光ノイズの低減効果が大きい。したがって、上記実施形態の構造体14では、基板15の下側から遮光膜19の開口部29と基板15を通して光を観察する構成が好ましい。なお、保持孔の数に等しい数の光検出手段を設けてもよいが、装置構成を簡略化してメンテナンスや操作性を向上するために、保持孔の数よりも少ない数の光検出手段を設け、これを適当なアクチュエータで駆動して各保持孔をスキャンニングする構成とすることが好ましい。あるいは、イメージスキャナのような光検出手段により、複数の保持孔の光を一括で検出することも好ましい。
【0033】
(遮光膜)
遮光膜19は、光検出用の複数の開口部(窓)29が設けられた遮光性の部材である。好ましくは、図2、図4、図5、図7等に示したように、遮光膜19を、基板15の第2面(下面)のうち保持孔9に対応する領域以外の領域を全部覆うように設けるとよい。また、遮光膜19の開口部29の大きさは、保持孔9に対応する領域と同じか、それよりも小さくすることが好ましい。これにより、保持孔以外の部分から生じる光ノイズを可及的に除去しつつ、保持孔9から発せられる光シグナルのみを開口部29を通して適切に検出することが可能となる。なお、遮光膜19の開口部29の形状、大きさ、位置、配列などは、保持部20の保持孔9の形状、大きさ、位置、配列などに応じて適宜設計すればよい。もっとも、前記した反射型による光学的観察を行う場合であって、保持孔9の開口側から光を照射し、同じ側で光を観察(検出)するのであれば、保持孔9(保持孔9が延在する基板表面部分)にも設けることができる。
【0034】
遮光膜19の材料としては、標識物質により発せられる波長の光(例えば可視光であれば、波長380nmから780nmの光)に対して十分な遮光性を有する材料であればよく、金属系材料、炭素系材料、セラミック、樹脂などを利用することができる。中でも、クロム(Cr)、チタン(Ti)、白金(Pt)、ニオブ(Nb)、タンタル(Ta)、タングステン(W)、アルミニウム(Al)、金(Au)等の金属、又は金属酸化物などの金属系材料が好適であり、特に遮光性が高く、基板15との密着性が高いクロム(Cr)が好ましい。遮光膜の厚さは、材料によって適宜設定することができるが、クロム等の金属系膜の場合、その膜厚は、50nmから10μmの範囲が好ましく、十分な遮光性が得られる100nm以上の膜厚が特に好ましい。他の金属系膜でも同様である。金属系膜の場合、一般的なフォトリソグラフィー及びエッチングにより、成膜及び孔の形成を行うことができる。セラミックの場合は、例えば、スプレーや貼り付け等で加工することが考えられる。また機械加工にて予め孔を形成した樹脂やフィルムを基板に貼り付けてもよい。
【0035】
(絶縁体膜)
保持部20の一部を絶縁体の材料で構成するとともに、保持孔9の底部に電極を露出させるのは、電極に交流電圧を印加した際に、保持孔9に対して電気力線を集中させ、生体試料を当該保持孔に移動させて固定するためである。なお、前述したように、保持孔内へ被検体粒子を導入するのに自然沈降(重力)のみを利用する場合は、電極を設ける必要がないため、絶縁体膜も不要である。
【0036】
絶縁体膜18の材料としては、絶縁性を有する材料、例えば、シリコーンゴム、レジスト、樹脂等の架橋性の高分子、セラミック、ガラス、撥水加工した紙などを利用することができる。以下、架橋性の高分子からなる絶縁体膜を高分子膜と記載することがある。絶縁体膜は、被検体粒子を絶縁体膜18に設けた保持孔9に引き寄せて固定することから、被検体粒子と親和性のある絶縁性の材料であることが好ましい。被検体粒子と親和性のある絶縁体膜とは、被検体粒子が親水性である場合には親水性の高分子膜が、被検体粒子が疎水性である場合には疎水性の絶縁体膜が好ましい。親和性の目安としては、一般的には、絶縁体膜の表面に前記被検体粒子に近い親和性を有する液体を滴下したときに形成される液滴と絶縁体膜の表面との接触角で示される(接触角が小さいほど液体と絶縁体膜の表面との親和性が高く、接触角が大きいほど液体と絶縁体膜の表面との親和性が低い)。親水性の比較的高い高分子膜としては、ポリエチレングリコール系の高分子等、あるいはガラスや酸化チタンがあり、疎水性の比較的高い高分子膜としては、エポキシ樹脂、ポリスチレン、ポリイミド、テフロン(登録商標)等の樹脂が例示できる。特に紫外線に対して感光性を付与したエポキシ樹脂が好ましく、更には高いアスペクト比で構造体を作製することが可能なSU-8 3000シリーズ(化薬マイクロケム社)が好ましい。
【0037】
なお、被検体粒子との親和性が低い絶縁体膜を用いざるを得ない場合であっても、絶縁体膜の表面を改質することによって絶縁体膜と被検体粒子との親和性を高めることができる。樹脂等の疎水性の高分子膜を親水化する方法としては、既知の方法である、プラズマ処理、タンパク質の物理吸着などによる修飾、或いはこれらの方法を任意に組み合わせた方法などを用いればよい。ここで、高分子膜表面のプラズマ処理とは、電子・イオン・ラジカルなどの活性種が存在する電気的に中性な電離気体(プラズマ)を高分子膜の表面に照射することにより、高分子膜の表面における有機汚染物の除去や化学結合状態を変化させ、高分子膜の表面を親水化する処理である。また、ここで、タンパク質の物理吸着などによる修飾であれば、例えばBSA(ウシ血清アルブミン)などのタンパク質含有溶液に高分子膜を数分から数時間浸漬することで、タンパク質を物理吸着させ、高分子膜の表面を親水化することができる。またポリエチレングリコールジアクリレート重合体などの親水性の高分子膜を疎水化する方法としては、シランカップリング剤を親水性の高分子表面に結合させる化学修飾による方法などを用いればよい。シランカップリング剤は有機物とケイ素から構成される化合物であり、分子中に親水性を示す反応基(水酸基、カルボキシ
ル基、アミノ基、スルホン基など)と疎水性を示す反応基(ビニル基、メチル基、エチル基、プロピル基など)の2種以上の異なった反応基を有している。このため、シランカップリング剤の希薄溶液に親水性の高分子膜を浸漬すれば、シランカップリング剤の親水性を示す反応基が親水性の材料の表面に化学的に結合し、疎水性を示す反応基が表面を覆うため、容易に疎水性の材料の表面を均一に疎水化することが可能である。
【0038】
なお、親水性又は疎水性の評価方法としては、以下の一般的な手法を用いることができる。すなわち、高分子膜表面に純水を滴下し、そのときに高分子膜の表面に形成される液滴と高分子膜の表面との接触角を測定することによって高分子膜の表面の親水性および疎水性を評価するのである。親水性および疎水性の厳密な定義は存在しないため、本発明においては、親水性を前記接触角が50°以下、好ましくは40°以下であると定義し、疎水性を前記接触角が50°より大きく、好ましくは60°より大きいと定義する。さらに、接触角の測定は、基板上に滴下した液滴の左右端点と頂点を結ぶ直線の、固体表面に対する角度から接触角を算出するθ/2法を用いる。
【0039】
(保持孔)
保持部20に保持孔(貫通孔)9を形成するためには、絶縁体膜18の種類に応じた種々の方法を採用することができる。例えば、保持孔9を形成するためにはレーザーを照射する方法や、保持孔9を形成するためのピンを有する金型を用いて保持部20を成形する方法などの既知の方法を用いることができる。また光硬化性樹脂などを用いる場合は、保持孔9に相当するパターンを描画した露光用フォトマスクを用いて一般的なフォトリソグラフィー(露光)とエッチング(現像)により保持孔9を形成することができる。金属系材料からなる遮光膜19へ保持孔を形成する場合、一部が選択的に除去された絶縁体膜をエッチングマスクとして用いて、遮光膜の一部を等方性のウェットエッチングにより選択的に除去する方法を採用できる。
【0040】
上記実施形態では、円筒形状の保持孔9を例示したが、保持孔9の形状はこれに限られない。例えば、保持孔9の平面(開口)形状としては、楕円形や多角形(角が丸みを帯びている多角形を含む)などでもよい。また、保持孔9の径(幅)が底部から開口(保持部20の上表面)に向かって段階的または連続的に大きくなる形状も好ましい。
【0041】
複数の保持孔9は、保持部20の面内に規則正しく配置する構成が好適であり、具体的には複数の保持孔9をアレイ状に配列することが好ましい。ここでアレイ状とは、厳密には保持孔が行と列の2次元的に等間隔に配置されていることを意味するが、本発明では保持孔が行方向(横方向)のみ、あるいは列方向(縦方向)のみに、1次元的に等間隔に配置されている構成もアレイ状と表現する。このように保持孔をアレイ状に配置することで、電極間に印加した電圧によって生じる電界がすべての保持孔にほぼ均等に生じることになり、すべての保持孔に対して同じように生体試料を誘導し固定することが可能となる。また生体試料がアレイ状に規則正しく配列されていると、各々の標識物質の光シグナルを個別に検出したり解析することが容易となるし、さらには、固定した全ての試料の中から特定の性質をもつ試料の数や割合などを定量的に評価したり、特異な光シグナルが検出された試料の基板上の位置(アドレス)を容易に特定したりすることも可能となるなどの利点もある。なお、光学的な検出を行った後に、基板上の特定のアドレスの試料を操作することを容易にするため、各保持孔から検出された光シグナルの情報と位置情報とを対応付けて記憶する記憶手段を設けることが好ましい。
【0042】
(スペーサー)
収容部45を構成するスペーサー16は、生体試料の懸濁液を保持するスペースを確保するためのものである。スペーサー16は、例えばガラス、セラミック、樹脂等の絶縁体を材料として構成しても良いし、上部電極基板35と下部電極基板36を電気的に導通し
ない構成であれば金属等の導電体を材料として構成しても良い。例えば、保持部20上に配置したスペーサーの型枠の中に急速硬化タイプの接着剤を流し込み硬化させることで、スペーサー16の成形と貼り合せを同時に行うことが可能である。また、別体で成形したスペーサー16を、接着剤で保持部20に接着したり、熱及び圧力を加えて保持部20に融着させることもできる。あるいは、PDMS(poly−dimethylsiloxane)やシリコンシートのような表面粘着性のある樹脂を用いてスペーサー16を作製し、これを圧着により保持部20と貼り合わせることもできる。収容部45は、スペーサーによって構成されるが、その形状は、第1乃至第4実施形態に示したような四角形である必要はなく、円形、楕円形、菱形等の種々の形状を採用し得る。またスペーサーには、懸濁液を導入し、排出するための導入口と排出口(24、25)を設けることができるが、収容部45の上方から直接懸濁液を導入する場合には導入口や排出口は不要である。また導入口と排出口は、第1乃至第4実施形態に示したように対向する位置に直線状に設ける必要はない。なお、例えばそれ自体絶縁性の箱を用意して、その内側底面に構造体を配置することにより、スペーサーを用いることなく収容部45を構成することができる。またこの形態では、例えば前記箱の内側底面に一対の電極のうちの一方を備えた構造体を配置するとともに、内側上面に対をなす他方の電極を配置し、又は、前記箱の上面自体を他方の電極とすることもできる。
【0043】
上記実施形態では、スペーサー16に導入流路及び該流路に連通する導入口24と、懸濁液を排出する排出流路及び該流路に連通する排出口25を設け、装置に供する生体試料懸濁液の供給と排出を迅速に実施可能としている。スペーサー16の寸法、形状およびスペーサーの内側の空間と厚みは、収容部に収容する懸濁液の量との関係で決定すれば良く、特に制限はないが、通常は生体試料懸濁液を数μLから数mL程度入れる容量があればよく、例えば、スペーサーのサイズが縦40mm×横40mm程度の場合、スペーサーの内側の空間は、縦20mm×横20mm程度であればよく、スペーサーの厚みは0.5から2.0mm程度であればよい。
【0044】
(交流電源)
第2から第4実施形態に示した粒子固定装置において、構造体14の一対の電極には、導電線3を介して交流電源4が接続される。交流電源4は、保持孔9に生体試料を移動させ、固定する電界を発生させるのに十分な電圧を電極間に印加できればよい。具体的には、ピーク電圧が1Vから20V程度で、周波数100kHzから3MHz程度の正弦波、矩形波、三角波、台形波等の波形の交流電圧を印加できる電源が例示できるが、中でも、生体試料を移動させ、1つの保持孔に1個の生体試料のみを固定し得る波形の交流電圧を電極間に印加することが特に好ましい。かかる波形の交流電圧としては、矩形波を使用することが好ましい。矩形波は、波形が正弦波、三角波、台形波である場合に比べて、瞬時に設定したピーク電圧に到達するため、生体試料を保持孔に向けて速やかに移動させることが可能となり、2個以上の生体試料が重なるように保持孔に入る確率を低くできる(1つの保持孔に1個の生体試料のみを固定し得る確率が高くなる)。生体試料は電気的にコンデンサーと見なすことができるが、矩形波のピーク電圧が変化しない間は、保持孔に捕捉された生体試料には電流が流れ難くなって電気力線が生じ難くなり、この結果、生体試料を固定した保持孔には誘電泳動力が発生し難くなる。従って、一度保持孔に生体試料が固定されると、別の生体試料が同一の保持孔に固定される確率は低くなり、代わりに電気力線が生じ誘電泳動力が発生している他の保持孔(生体試料が固定されていない、空の保持孔)に、順次、生体試料が固定される。
【0045】
なお、本発明の装置では、直流成分を有しない交流電圧を発生する電源を採用することが好ましい。直流成分を有する交流電圧を印加すると、直流成分により発生した静電気力(電気泳動力)により生体試料が特定の方向に偏った力を受けて移動し、誘電泳動力によって保持孔に固定し難くなるからである。また直流成分を有する交流電圧を印加すると、
生体試料を含有する懸濁液に含まれるイオンが電極表面で電気反応を生じて発熱し、それによって生体試料が熱運動を起こすため誘電泳動力によって動きを制御できなくなり、保持孔に移動させて固定することが困難になる。なお、直流成分を有する交流電圧とは、周波数デューティ比が50%でない電圧、オフセットを有する電圧、周期が極端に長い(例えば1秒以上)電圧などをいう。
【0046】
(保持孔の間隔及び寸法)
本発明の装置では、印加する交流電圧の波形を好ましくは矩形とすることにより、1つの保持孔に1個の生体試料のみを固定し得るようにするものであるが、かかる目的を達成するために、更に、保持孔の配置、寸法、形状を、1つの保持孔に1個の生体試料のみを固定し得るのに適した配置、寸法、形状とすることが好ましい。例えば配置に関しては、保持部の面上に保持孔をアレイ状に配置することが好ましいが、隣接する保持孔同士の間隔が狭すぎると1つの保持孔に複数の生体試料が固定されてしまう確率が高くなる、また両隣の保持孔内の生体試料懸濁液が混合したりクロストークノイズが発生したりするため、生体試料の解析に良い影響を与えない。逆に、隣接する保持孔同士の間隔が広い場合は隣接する保持孔の間(図9における56)に生体試料が残されてしまい、生体試料を固定できない保持孔が発生する確率が高くなる。そこで、保持孔の間隔及び寸法(直径、深さ)を固定しようとする生体試料の粒径に応じて設定するとよい。具体的には、隣接する保持孔同士の間隔を、固定しようとする生体試料の粒径の0.5倍以上20倍以下の範囲とすることが好ましい。また保持孔の直径及び深さは、いずれも生体試料の直径の1倍以上5倍以下の範囲にすることが好ましい。このようにすることで、保持孔の底面の電極面と生体試料に静電気力が発生し、生体試料は保持孔に確実に固定されるとともに、良好な観察を行うことができる。
【0047】
(生体試料)
好ましい被検体粒子は、細胞、ウイルス粒子、DNA、タンパク質等の生体試料である。
細胞は、誘電泳動により捕集することができる誘電体からなるものであれば特に制限はない。例えば、血液、リンパ液、髄液、喀痰、尿、便中の細胞(生細胞)や体内あるいは環境中に存在する微生物、原虫、また培養細胞など、その表面や内部に標識可能な物質(特定物質)を有するものが好ましい生体試料として例示できる。より具体的には、血液、リンパ液を通じて遠隔転移するがん細胞、例えば胃がん、大腸がん、食道がん、肝臓がん、肺がん、すい臓がん、膀胱がん、子宮がん(上皮性腫瘍)由来の細胞、及び、リンパ球、白血球などの血液細胞(リンパ腫、白血病)が挙げられる。また、がん細胞としては、細胞の表面にコラゲナーゼの様な特異的なタンパク質があり、該タンパク質ががん細胞周辺のコラーゲン(細胞外マトリックス)を溶解することにより浸潤して転移をするようながん細胞が例示できる。
【0048】
ウイルスとしては、ヘルペスウイルス、肝炎ウイルス、HIVウイルス(ヒト免疫不全ウイルス)、ATLウイルス(成人T細胞白血病ウイルス)等のウイルスが挙げられる。DNA、タンパク質としては、それぞれ長さ又は分子量が40kbp以上、10万Da以上、好ましくは100kbp
以上、50万Da以上であることが好ましい。また、生体試料としては、タンパク質、ペプチド、DNA、RNA、多糖類、脂質、ウイルス等を、これらの物質を捕捉できるように修飾された担体粒子に捕捉させた微粒子が挙げられる。担体粒子としては、誘電体からなるものであれば、特に制限されない。溶液中に多種のタンパク等が混在した状態で検出するよりも、微粒子上にタンパク質等を濃縮することができるため、検出感度の向上が期待される。また、タンパク質等ごとに特異的な微粒子を複数種用意すると、多検体検出が可能となる。タンパク質としては、各種腫瘍マーカー、例えばCEA(癌胎児性抗原、carcinoembryonic antigen。食道、胃、直腸等の消化器系の腫瘍マーカー)、CA19-9(carbohydrate antigen19-9。膵臓・胆道癌等の消化器系の腫瘍マーカー)、PSA(prostate specific antigen。前立腺特異的マーカー)等が挙げられる。
【0049】
また装置に供する生体試料懸濁液は、上記のような生体試料が誘電泳動で移動できる懸濁液であれば良い。例えば、マンニトールやグルコース、スクロース等の糖類の水溶液およびその水溶液に塩化カルシウムや塩化マグネシウムなどの電解質やBSA(ウシ血清アルブミン)等のタンパク質を含有した水溶液に解析する試料を含有させた懸濁液が好ましい生体試料懸濁液として例示できる。
【0050】
<誘電泳動及び粒子の解析>
次に、誘電泳動を利用した粒子の固定方法、並びに、固定した粒子の解析方法について、図8から図10を用いて説明する。なおここでは、第4実施形態(図7)の構造体及び固定装置を例に挙げて説明を行うが、他の実施形態の構造体及び固定装置の場合も同様の方法により粒子の固定及び解析を行うことができる。
【0051】
まず、図8に示すように、生体試料を含む懸濁液をスペーサー16の導入口24から注入し、収容部45及び保持孔9内を懸濁液で満たす。そして、交流電源4から前述した波形を有する交流電圧を印加すると、保持孔9に電気力線12が集中し、生体試料28に誘電泳動力26が作用する。これにより、生体試料28が電気力線12に沿って保持孔9に向かって移動し、1つの保持孔9に対して生体試料1つを導入し固定することができる。図8を用いて誘電泳動力の原理を説明する。交流電圧すなわち交流電界中に置かれた溶液の中の生体試料28すなわち細胞等の誘電体粒子には分極が生じ、正負の電荷が誘導される。ここで図8に示すように、下部電極基板36上の絶縁体膜18に設けられた保持孔9に、一様でない不均一な電界(図8に示す電気力線12)が与えられると、生体試料28は電界の集中する方向(電気力線12が密な方向)、すなわち保持孔9の方向へと引き寄せられる。これが誘電泳動力26である。一般に誘電泳動力は、粒子の体積、粒子と溶液の誘電率の差、不均一な電界の大きさの2乗に比例する。例えば、直径が5から10μm程度の粒子に対し、電界として周波数100kHzから3MHz、1×105から5×105V/mの交流電界を与えると、誘電泳動力が作用して粒子が電界の集中する方向に引き寄せられる。この場合、生体試料28は主に誘電泳動力、重力、電極からの静電気力によって保持孔9に誘導される。なお、収容部に供給される懸濁液中の生体試料の数に特に制限はないが、生体試料を有効に使用することを考慮すると、構造体の保持部に設けられた保持孔の数とおおむね同数とすることが望ましい。
【0052】
次に図9に示すように交流電圧を印加したまま、生体試料と結合する物質27で修飾された保持孔9の内側と生体試料28を結合する。生体試料と結合する物質27は、生体試料28と結合すれば特に制限はない。例えば、生体試料表面の特有の物質を認識する物質、細胞の脂質二重膜に結合する脂質オレイル基を有するBiocompatible A
nchor for Membrane(BAM)、生体試料と静電気的に結合する物質が例示できる。生体試料表面の特有の物質と、それに結合する分子の組合わせとしては、レセプター−リガンド、糖鎖−レクチン、抗原−抗体等が挙げられる。比較的短時間に生体試料と結合させることを考慮すると、生体試料表面と静電気的に結合する物質が好ましい生体試料と結合する物質として例示できる。このような物質としては、ポリ−L−リジン等のポリカチオン剤が挙げられる。
【0053】
また、生体試料と結合する物質として、各種がん細胞に汎用性のある(共通の、又はがん細胞間で特異的ではない)マーカー、例えばEpCAM(CD326、上皮特異抗原(ESA)、又は
ヒト上皮抗原(HEA)とも呼ばれる)と結合する物質を用いると、血液中等のがん細胞のみ
が固定され、がん細胞以外の細胞(血球細胞等)は固定されないため、洗浄を行うこと等によってよりがん細胞以外の細胞を保持孔から脱離させて、確実にがん細胞のみを固定し検出することができる。なお、後述するが、特定のがん細胞の検出のためには当該特定のがん細胞にのみ存在する特定物質を、標識物質を使用して検出することが好ましい。しか
し、例えば種々の広範ながん細胞を標的試料とし、生体試料中に標的試料が存在するか否かを知ることを目的としている場合、それらに汎用性のあるマーカーと結合する物質で保持孔の内側を修飾しておき、洗浄の後、細胞の有無を検出できれば良い。かかる場合には、例えば、保持孔の上方向から光を照射し、保持孔の下方向に照射した光が到達するか否か、つまり固定された細胞の影を検出するのみでも良い。
【0054】
さらに、保持孔以外の絶縁体膜上(例えば図9における56)に保持孔に固定したくない細胞を特異的に認識する物質(例えば当該細胞等に対する抗体)を配置すると、かかる細胞等が保持孔に入ることを阻止する、つまり、目的の細胞(保持孔に入った細胞)と、目的ではない細胞等(保持孔の外側の絶縁体膜上に固定された細胞)を選別することができる。
【0055】
また、保持孔にがん細胞に汎用性のある(共通の)マーカー(例えば抗原)と結合する物質(例えば、当該共通の抗原に特異的に結合する抗体)を配置しておき、誘電泳動力によってがん細胞を保持孔に固定した後、さらにがん細胞のうち、例えば、乳がん、肺がんなどに特異的に発現しているHER2(抗原)と結合する物質(HER2に対する抗体(抗HER2抗体))によって標識することで、固定されたがん細胞の種類を推定することができる。
【0056】
生体試料と結合する物質27による保持孔9の修飾方法は、保持孔9の内側と生体試料28が結合できれば特に制限はない。例えば、自己組織化単分子膜(Self-Assembled Monolayer, SAM膜)を利用し、保持孔底面の金属酸化膜等からなる電極にアミノ基などを持つ生体試料と結合する物質27を反応させることで保持孔内を特異的に修飾することができる。また生体試料28を保持孔9に捕捉後、生体試料と保持孔9の内側の両方に結合する物質27を含む溶液を収容部へ注入することで保持孔9の内側と生体試料28を結合することが可能である。なお、生体試料と結合する物質27を含む溶液の注入によって結合する場合は、結合反応後に生体試料28を懸濁する溶液、例えばマンニトールやグルコース、スクロース等の糖類の水溶液およびその水溶液に塩化カルシウムや塩化マグネシウムなどの電解質やBSA(ウシ血清アルブミン)等のタンパク質を含有した水溶液にて収容部の生体試料と結合する物質27を洗浄、除去することが好ましい。このように生体試料と結合する物質27によって保持孔9に捕捉された生体試料28は、交流電圧を印加しなくても保持孔9から脱離することはなくなる。
【0057】
続いて図10に示すように生体試料等の被検体粒子の解析に必要な試薬溶液を収容部へ注入する。被検体粒子の解析に用いる試薬は被検体粒子の表面または内部に存在する物質を光学的に検出することができれば特に制限はない。
【0058】
生体試料等の被検体粒子を構成する成分、例えば被検体粒子の表面又は内部に存在する物質(以下、「特定物質」と記載することがある。)は、被検体粒子のうち、特定の性質を有する粒子(以下、「標的試料」ということがある。)の表面又は内部に特異的に存在する物質である。標的試料に特異的に存在するとは、標的試料には存在し、かつ、標的試料以外の粒子には存在しないか、あるいは、標的試料以外の粒子よりも標的試料に多く存在することをいう。
【0059】
被検体粒子が細胞の場合は、特定物質としては抗原、レセプター、糖鎖、核酸等が挙げられる。抗原としては、腫瘍細胞上の抗原、主要組織適合抗原(MHC、ヒトの場合はHLA)等が挙げられる。腫瘍細胞上の抗原としては、EpCAM等が挙げられる。レセプターとして
は、ホルモンレセプター、Fcレセプター、ウイルスレセプター等が挙げられる。核酸としては、DNA及びRNAが挙げられる。腫瘍マーカーのようなタンパク質は、そのまま生体試料としてもよく、前記したように担体粒子に担持させてもよい。より具体的に、例えば標的試料が種々のがん細胞であるならば、各種がん細胞に汎用性のある(共通の)マーカー
が特定物質たり得る。また標的試料が乳がんや肺がんであるならば、これらのがんに特異的に発現しているHER2(抗原)が特定物質たり得る。
【0060】
前記のような特定物質は、特定物質の存在を示す物質、例えば特定物質に特異的に結合する物質を用いて標識することにより観察(検出)することができる。例えば、抗原には該抗原に対する抗体、レセプターにはそれに結合するリガンド、糖鎖にはレクチンが結合する。そこで、これらのような特定物質に特異的に結合する物質と光学的に検出可能なシグナルを発する物質とを結合して標識物質とする。もっとも、例えば特定物質が任意の物質とのみ結合又は反応し、その結果光学的に検出可能なシグナルが発せられるような場合は、当該任意の物質そのものを標識物質として使用することができる。
【0061】
本発明の特定物質を検出する標識物質31は、標的試料が検出できれば特に制限はない。標識物質は、被検体粒子を構成する成分の存在を示すことのできるあらゆる物質をさす。有用な検出可能な標識物質の代表的なものとして、蛍光、リン光、もしくは発光の性質に基づいて検出可能な物質を前記した抗体、リガンド、レクチン等の特定物質と特異的に結合可能な物質とを結合したものが例示できる。
【0062】
標識物質としては、標識物質自体、例えば蛍光、もしくはリン光を発するか、又は発光する物質、例えば蛍光色素等を特定物質と特異的に結合可能なものに結合したものが挙げられる。また、標識物質は、光を発する反応、例えば蛍光、もしくはリン光を発する物質を生成する反応、又は発光反応を触媒する物質を特定物質と特異的に結合可能なものに結合したものであってもよい。例えば蛍光色素としては、FITC(フルオレセインイソシアネート)、PE(フィコエリスリン)、ローダミン等が挙げられる。また、前記反応を触媒する物質としては、パーオキシダーゼ、β−ガラクトシダーゼ、アルカリフォスファターゼ、ルシフェラーゼ等が挙げられる。なお、例えば特定物質が任意の物質とのみ反応し、その反応の結果光学的に検出可能なシグナルが発せられるような場合は、当該任意の物質そのものを標識物質としても良い。
【0063】
また、蛍光、リン光、又は発光を阻害するクエンチャーと特定物質に特異的に結合する物質とを結合した標識物質の使用を例示することができる。この場合は、生体試料を、蛍光、リン光又は発光する物質で染色しておき、当該標識物質を更に反応させると、特定物質を有する生体試料が固定された保持孔からの蛍光、リン光又は発光がクエンチャーによって減少するため、この減少を検出すれば良い。なお、生体試料中の全細胞に汎用性の(共通の)マーカーに結合する物質と、蛍光、リン光又は発光する物質とを結合したものと前記標識物質を組み合わせて使用することが例示できる。
【0064】
標識物質は、前記した通り、それ自体が特定物質と結合又は反応するものであっても、特定物質に特異的に結合する物質と光学的に検出可能なシグナルを発する物質とを結合したものであっても良い。光学的に検出可能なシグナルを発する物質を特定物質と特異的に結合する物質と結合する場合は、両者を公知の化学的な方法等によって直接結合しても良いし、特定物質と特異的に結合する物質に対して結合する物質を介して間接的に結合しても良い。例えば、特定物質と特異的に結合する物質が抗体である場合は、抗体の調製に用いた動物のイムノグロブリンに対する抗体、又はプロテインAもしくはプロテインGとシグナルを発生する物質を結合することが挙げられる。また、特定物質に特異的に結合する物質とビオチンを結合しておき、シグナルを発生する物質をアビジン又はストレプトアビジンと結合しておくことも例示できる。この場合、シグナルを発生する物質と結合したアビジン又はストレプトアビジンは、特定物質に特異的に結合した物質と結合されたビオチンと結合し、結果的に(特定物質)−(特定物質に特異的に結合する物質)−(ビオチン)−(アビジン又はストレプトアビジン)−(シグナルを発生する物質)という複合体を形成することにより、特定物質は間接的に標識される。このような間接的な場合もまた、
本発明にいう、特定物質に包含される。
【0065】
特定物質が核酸である場合は、シグナルを発生する物質と直接又は間接的に結合した(又は結合し得る)、かつ、該核酸に結合するプローブを用いたハイブリダイゼーション、又は、シグナルを発生する物質と直接又は間接的に結合した(又は結合し得る)プライマーを用いた該核酸の増幅によって、該核酸を検出することができる。核酸の増幅は、それ自体公知の手法であるPCR法、LAMP法、RT−PCR法、NASBA法、TMA法又はTRC法等を利用することができる。TaqMan法は、5´末端を蛍光物質で修飾し、3´末端をクエンチャー物質で修飾したオリゴヌクレオチドをプローブとして利用する。このプローブは、蛍光物質とともに、クエンチャー物質が近傍にあるので、蛍光の発生は抑制されている。PCRの伸長反応のステップのときに、TaqDNAポリメラーゼのもつ5’→3’エキソヌクレアーゼ活性により、標的核酸にハイブリダイズしたTaqManプローブが分解されると、蛍光色素がプローブから遊離し、クエンチャーによる抑制が解除されて蛍光が発生する。核酸としては、DNA又はRNAが挙げられる。RNAを増幅する場合は、RNAを鋳型に逆転写反応を行い、生成したcDNAをPCR法により増幅すればよい(RT−PCR)。また、シグナルを発生する物質は、前記と同様、蛍光、リン光、又は発光を阻害するクエンチャーを組み合わせたものであってもよい。
【0066】
上記のように、増幅反応により生じた核酸に結合するプライマーも、本発明にいう、特定物質に特異的に結合する物質に包含される。
【0067】
標的試料である細胞をPCRにより検出する場合、PCR反応における加熱及び冷却は、サーマルサイクラーのヒートブロック上に粒子固定用構造体を載置して行ってもよく、本発明の生体試料解析装置にヒートブロックを設け、該ヒートブロック上で行ってもよい。
【0068】
標識物質により発せられる光、すなわち、標識物質から発せられる光、又は標識物質により触媒される反応によって発せられる光は、被検体粒子を構成する成分、すなわち特定物質の存在を示す。
【0069】
図11は、本発明の生体試料解析装置の応用例を示すものである。例えば癌などの異常細胞32の存在が疑われる懸濁液を生体試料解析装置に供し、細胞を保持孔に捕捉する。一方で当該検出の目的となる異常細胞32の表面または内部の特定物質を検出する標識物質を導入し、異常細胞を検出する。さらに、蛍光顕微鏡33にて検出された癌などの異常細胞を生体試料採取手段34としてマイクロピペットで採取し、詳細な生体試料の解析が可能である。
【0070】
上記では生体試料採取手段としてマイクロピペットを説明したが、生体試料採取手段は生体試料を採取することができれば特に制限はなく、マイクロピペット以外にも、電気浸透流を利用して精密に生体試料を採取可能な生体試料採取手段を用いることができる。
【0071】
本発明の生体試料解析装置の他の応用例として、生体試料を破砕するための破砕手段を備えていてもよい。破砕手段は、生体試料を破砕して生体試料に含まれる核酸を生体試料外部に溶出することができれば特に制限はない。例えば、一対の電極と該電極に直流電圧又は1ヘルツ程度の低い周波数の交流電圧を印加するための電源からなり、保持部の保持孔に固定された生体試料に電圧を印加する手段を例示することができる。生体試料が細胞壁を有さない細胞であれば、細胞膜に1ボルト程度の電圧を印加することにより、当該細胞を破砕することが可能である。なお当該手段における一対の電極としては、生体試料に誘電泳動力を作用させて保持部に移動させるための電極を兼用することができる。また例えば、前記保持部の保持孔に固定された生体試料を加熱する加熱手段を例示することがで
きる。数分程度、90℃の温度条件下におくことにより、生体試料を破砕することが可能である。また例えば、保持部の保持孔に固定された生体試料を振動する超音波発生手段を例示することができる。100から200ワットの出力で、20から40キロヘルツの振動を連続的に又は間欠的に与えることにより、生体試料を破砕することが可能である。例示した電圧を印加する手段、加熱手段そして超音波発生手段は択一的にしか利用できないものではく、例えば、加熱手段と超音波発生手段の両方を利用する、ということも可能である。
【0072】
破砕された生体試料から溶出した核酸をPCR法で増幅した後に検出する場合、まず、生体試料を保持部の保持孔に固定した後、例えば収容部にPCR反応を生じさせるためのプライマー、酵素、酵素基質等を含む反応液を供し、収容部に連通する保持孔に存在する溶液(生体細胞を懸濁するために使用した液)を反応液に置換する。PCR反応では保持孔に固定した生体試料から溶出した遺伝子を90℃程度にまで昇温するが、その時保持孔の内部で熱対流が起こり、保持孔内の生体試料由来の遺伝子が保持孔外へ拡散し、隣接する保持孔内の生体試料懸濁液を汚染する可能性があるため、溶液置換が完了した段階で保持孔にシリコンオイル等を滴下するとともに、PCR反応液の中に温度応答性高分子を添加してかかる熱対流を抑制することが好ましい。なお、生体試料をPCR反応のための反応液に懸濁して誘電泳動により保持孔に移動しようとすると、PCR反応のための反応液中に含まれる各種電解質のために電圧を印加すると過電流となり、発熱による熱対流が発生して生体試料を保持部分に移動して固定することが困難になるため、かかる溶液置換を行うことが好ましい。封止を行った後、前述した破砕を行って核酸の検出を行う。
【0073】
<効果>
上述した本発明の実施形態に係る構造体、並びにそれを用いた固定装置及び解析装置は、以下の効果を奏するものである。
【0074】
本実施形態の構造体及びそれを用いた固定装置は、保持部に設けた各保持孔に対して1つの粒子を速やかに固定することができる。また、複数の保持孔がアレイ状に配置されているため、複数の粒子を1つずつ分離してアレイ状に固定することができ、個々の粒子の解析を一括して行うことが容易となる。さらに、遮光膜を設けたことにより、バックグラウンドノイズやクロストークノイズなどの光ノイズを低減することができ、保持孔内の観察対象物質により発せられる光のみを高感度かつ高精度に検出することができる。そして高感度かつ高精度の光検出が可能であることから、検出時間の短縮を図ることも可能となる。
【0075】
<実施例>
以下、本発明を実施例に基づいて更に詳細に説明する。ただし、本発明は以下の実施例に限定されるものではない。
【0076】
(実施例1)
実施例1においては、図7に示す構造体及び固定装置を使用する。
【0077】
下部電極基板36を構成する透光性の基板15には、縦78mm×横56mm×厚さ1mmのガラス基板を用いる。スペーサー16は、保持部上に縦20mm×横20mm×厚さ1.5mmの収容部を形成するように、シリコンシートによって作製する。また、スペ
ーサー16には、生体試料を含む懸濁液を導入、排出するための導入口24と排出口25を設ける。
【0078】
複数の保持孔9を有する保持部(絶縁体膜18)は、図12Aから図12Bに示すフォトリソグラフィーとエッチングによる方法により、下部電極基板上に一体的に形成する。
まず、ガラス基板30の第1面にITO37を成膜し、反対側の第2面に、スパッタにより膜厚100nmのCr38を成膜する。次に、成膜したCrの上にスピンコーターを用いて1μmの膜厚になるようレジスト40を塗布し、1分自然乾燥後、ホットプレートを用いてプリベーク(95℃、3分)を行う。レジストにはエポキシ系のネガ型レジストを用いる。次に、縦30mm×横30mmのエリアに、直径φ8.5μmの微細孔を50μmの間隔で縦600個×横600個のアレイ状に並べたパターンを描いた露光用フォトマスク41を用いて、UV露光機にてレジスト40を露光42し、現像液43で現像する。露光時間と現像時間は、保持孔の深さがレジスト40の膜厚と等しい1μmになるように調整する。その後、ホットプレートを用いてポストベーク(180℃、30分)を行い、レジスト構造を固める。その後、30%硝酸二アンモニウムセリウム液49により、露出したCr膜を剥離して開口部29を形成し、開口部29の底面にガラス基板30が露出するようにする。次に、レジストをリムーバー54により剥離する。このCr膜38が、遮光膜となる。
【0079】
次に、図12Bに示すように、ITO37の成膜面上にスピンコーターを用いて5μmの膜厚になるようレジスト46を塗布し、1分自然乾燥後、ホットプレートを用いてプリベーク(105℃、15分)を行う。レジストにはポジ型のものを用いる。その後、開口部29が形成されたCr膜38をフォトマスクとして用い、UV露光機にてレジスト46を露光42し、現像液47で現像する。露光時間と現像時間は、孔の深さがレジスト46の膜厚と等しい5μmになるように調整し、孔9の底面にITO37が露出するようにする。現像後、ホットプレートを用いてポストベーク(180℃、30分)を行い、レジスト構造を固める。これにより、ITO37とガラス基板30からなる下部電極基板と、複数の保持孔9が形成された保持部(絶縁体膜)46と、保持孔9に対応する位置に開口部29が形成された遮光膜(Cr膜)38とを備える構造体44が得られる。
【0080】
このようにして作製した構造体上の保持部の上に、図7に示すようにスペーサー16を積層し圧着する。シリコンシートの表面は粘着性があるため、圧着することでスペーサー16と保持部(絶縁体膜19)とを貼り合わせることができる。スペーサー16の収容部の面積が縦20mm×横20mmであることから、この収容部内に存在する保持孔9の数は約16万個である。スペーサー16の上に上部電極基板35を配置し、上部電極基板35と下部電極基板36のそれぞれに導電線3を介して電源(信号発生器)4を接続する。
【0081】
生体試料には、マウス脾臓細胞(粒径約6μm)を用い、300mMの濃度のマンニトール水溶液に懸濁させ、2.7×105個/mLの密度になるように細胞懸濁液を調製す
る。
【0082】
続いて上記細胞懸濁液600μLをスペーサー16の導入口24よりシリンジを用いて注入し(導入細胞数:約16万個)、信号発生器により電圧20Vpp、周波数3MHzの矩形波交流電圧を電極間に印加する。これにより、2から3秒程度の極めて短い時間で、アレイ状に形成した複数の保持孔のそれぞれに1つずつ細胞を固定することができる。なお、「固定する」とは、保持孔に細胞が入ったことを意味し、以下の比較例でも同じ定義とする。このときの、1つの保持孔に概ね1つの細胞が入る生体試料固定率は約90%である。なお生体試料固定率とは、顕微鏡の視野に縦15個×横15個の225個の保持孔が見えるようにし、生体試料を導入して固定したときの、1個の生体試料が入った保持孔の数を225で割った値で定義する。生体試料固定率の算出方法は以下の実施例と比較例でも同じである。
【0083】
次に収容部へ2.5×10-4%濃度のポリ−L−リジンを600μL注入し、3分静
置後、電圧の印加を停止する。次に、リン酸緩衝液(pH7.2)を注入して収容部内のポリ−L−リジンを洗浄することで、保持孔内へ細胞を静電気的に結合することができる
。
【0084】
続いてマウス脾臓細胞集団中のB細胞を検出する。B細胞を検出するための標的となる特定物質はB細胞表面に存在するCD19分子とする。CD19分子は、B細胞表面レセプターであり、幹細胞の段階から最終的には形質細胞に分化するB系統細胞の分化全体を通して細胞において見出され、そのB系統細胞としては、プレB細胞、B細胞(ナイーブB細胞、抗原刺激性B細胞、メモリーB細胞、プラズマ細胞、およびBリンパ球を含む)および濾胞性樹状細胞が挙げられる。
【0085】
次に標識物質であるPE標識−CD19抗体(Miltenyi Biotec, Bergisch Gladbach, Germany)を600μL収容部へ送液し、抗原抗体反応によるB細胞の標識を行った後(4℃、10分)、リン酸緩衝液にて洗浄し、B細胞検出を実施する。標識されたB細胞は、蛍光顕微鏡(U−RFL−T/IX71、オ
リンパス、日本)を通じてCCDカメラにより観察する。これにより、標識を行う前の細胞の蛍光顕微鏡像と比較して、標識を行った後はB細胞表面の蛍光強度のみが増加し、B細胞を検出することができる。
【0086】
(実施例2)
実施例2においては、図4に示す構造体及び固定装置を使用する。
【0087】
透光性の基板15には、縦70mm×横40mm×厚さ1mmのガラス基板を用いる。スペーサー16は、縦40mm×横40mm×厚さ1.5mmのシリコンシートの中央を縦20mm×横20mmにくりぬいて作製する。また、図4に示すように、生体試料を含む懸濁液を導入、排出するための導入口24と排出口25をスペーサー16に設ける。複数の保持孔9を有する保持部(絶縁体膜18)と櫛状電極21、並びに、複数の開口部29を有する遮光膜19は、図13A〜図13Cに示すフォトリソグラフィーとエッチングによる方法によりガラス基板上に一体的に形成した。
【0088】
図13Aに示すように、ガラス基板30の片面に、スパッタにより膜厚100nmのCr8を成膜する。次に、成膜したCrの上にスピンコーターを用いて1μmの膜厚になるようレジスト40を塗布し、1分自然乾燥後、ホットプレートを用いてプリベーク(105℃、15分)を行う。レジストにはエポキシ系のネガ型のものを用いる。
【0089】
次に、縦30mm×横30mmのエリアに、直径φ8.5μmの微細孔を50μmの間隔で縦600個×横600個のアレイ状に並べたパターンを描いた露光用フォトマスク41を用いて、UV露光機にてレジスト40を露光42し、現像液43で現像する。露光時間と現像時間は、保持孔の深さがレジスト40の膜厚と等しい1μmになるように調整する。その後、ホットプレートを用いてポストベーク(180℃、30分)を行い、レジスト構造を固める。その後、30%硝酸二アンモニウムセリウム液49により、露出したCr膜を剥離して開口部29を形成し、開口部29の底面にガラス基板30が露出するようにする。次に、レジストをリムーバー54により剥離する。このCr膜38が、遮光膜となる。
【0090】
次に、図13Bに示すように、ガラス基板30のCr膜38とは反対側の面に、スパッタにより膜厚100nmのITO37を成膜する。成膜したITO37の上にスピンコーターを用いて1μmの膜厚になるようレジスト46を塗布し、1分自然乾燥後、ホットプレートを用いてプリベーク(105℃、15分)を行う。レジストにはポジ型のものを用いる。
【0091】
次に、縦30mm×横30mmのエリアに、幅10μmの帯状電極aと幅10μmの帯
状電極bを50μm間隔で形成した櫛状電極パターンを描いた露光用フォトマスク39を用いて、UV露光機にてレジスト46を露光42し、現像液47で現像する。露光時間と現像時間は、現像により剥離する膜厚がレジストの膜厚と等しい1μmになるように調整し、現像後、ITOエッチング液(ITO−Etchant,和光純薬工業)48により、露出したITO膜37を剥離する。次に、レジスト36をリムーバー55により剥離する。これにより、ガラス基板30のCr膜38とは反対側の面にITOの櫛状電極21が形成される。
【0092】
次に、図13Cに示すように、ITO37の成膜面上にスピンコーターを用いて5μmの膜厚になるようレジスト46を塗布し、1分自然乾燥後、ホットプレートを用いてプリベーク(95℃、3分)を行う。レジストにはポジ型のものを用いる。その後、開口部29が形成されたCr膜38をフォトマスクとして用い、UV露光機にてレジスト46を露光42し、現像液47で現像する。露光時間と現像時間は、孔の深さがレジスト46の膜厚と等しい5μmになるように調整し、孔9の底面に櫛状電極21が露出するようにする。現像後、ホットプレートを用いてポストベーク(180℃、30分)を行い、レジスト構造を固める。これにより、ITOの櫛状電極21とガラス基板30からなる電極基板と、複数の保持孔9が形成された保持部(絶縁体膜)46と、保持孔9に対応する位置に開口部29が形成された遮光膜(Cr膜)38とを備える構造体50が得られる。
【0093】
このようにして作製した構造体の保持部の上に、図4に示すようにスペーサー16を積層し圧着する。シリコンシートの表面は粘着性があるため、圧着することでスペーサー16と保持部(絶縁体膜19)とを貼り合わせることができる。スペーサー16の収容部の面積が縦20mm×横20mmであることから、この収容部内に存在する保持孔9の数は約16万個である。櫛状電極を構成する一対の電極のそれぞれに導電線3を介して電源(信号発生器)を接続する。
【0094】
生体試料には、マウス脾臓細胞(粒径約6μm)を用い、300mMの濃度のマンニトール水溶液に懸濁させ、2.7×105個/mLの密度になるように細胞懸濁液を調製す
る。
【0095】
続いて上記細胞懸濁液600μLをスペーサー16の導入口24よりシリンジを用いて注入し(導入細胞数:約16万個)、信号発生器により電圧20Vpp、周波数3MHzの矩形波交流電圧を電極間に印加する。これにより、2から3秒程度の極めて短い時間で、アレイ状に形成した複数の保持孔のそれぞれに1つずつ細胞を固定することができる。次に、収容部へ2.5×10-4%濃度のポリ−L−リジンを600μL注入し、3分静
置後、電圧の印加を停止する。次に、リン酸緩衝液(pH7.2)を注入して収容部内のポリ−L−リジンを洗浄することで、保持孔内へ細胞を静電気的に結合することができる。
【0096】
続いてマウス脾臓細胞集団中のB細胞を検出する。B細胞を検出するための標的となる特定物質はB細胞表面に存在するCD19分子とする。CD19分子は、B細胞表面レセプターであり、幹細胞の段階から最終的には形質細胞に分化するB系統細胞の分化全体を通して細胞において見出され、そのB系統細胞としては、プレB細胞、B細胞(ナイーブB細胞、抗原刺激性B細胞、メモリーB細胞、プラズマ細胞、およびBリンパ球を含む)および濾胞性樹状細胞が挙げられる。
【0097】
次に標識物質であるPE標識−CD19抗体(Miltenyi Biotec, Bergisch Gladbach, Germany)を600μL収容部へ送液し、抗原抗体反応によるB細胞の標識を行った後(4℃、10分)、リン酸緩衝液にて洗浄、B細胞検出を実施する。標識されたB細胞は、蛍光顕微鏡(U−RFL−T/IX71、オリ
ンパス、日本)を通じてCCDカメラにより観察する。これにより、標識を行う前の細胞の蛍光顕微鏡像と比較して、標識を行った後はB細胞表面の蛍光強度のみが増加し、B細胞を検出することができる。
【0098】
図11に示すように、生体試料採取手段34を設置した。生体試料採取手段には、電気浸透流を利用して精密に生体試料を採取可能なピペットを用いる。これにより、顕微鏡33で観察しながら、蛍光標識抗体にて検出したB細胞を採取する事ができる。
【0099】
(実施例3)
実施例1と同様の構造体及び固定装置を用いて、保持孔1つに固定された1つの標識細胞の検出精度を以下のとおり確認することができる。
【0100】
まずマウス脾臓細胞の一部をCellTracker Green CMFDA(Invitrogen)により染色する。検出する試料は、前記CellTracker Gr
een CMFDAにより染色した細胞と非染色のマウス脾臓細胞(粒径約6μm)を3
:7で混合した試料を用い、2.7×105個/mLの密度になるように細胞懸濁液を調
製する。
【0101】
続いて上記細胞懸濁液600μLをスペーサー16の導入口24よりシリンジを用いて注入し(導入細胞数:約16万個)、信号発生器により電圧20Vpp、周波数3MHzの矩形波交流電圧を電極間に印加し、複数の保持孔のそれぞれに1つずつ細胞を固定する。次に収容部へ2.5×10-4%濃度のポリ−L−リジンを600μL注入し、3分静
置後、電圧の印加を停止する。次に、リン酸緩衝液(pH7.2)を注入して収容部内のポリ−L−リジンを洗浄することで、保持孔内へ細胞を静電気的に結合する。
【0102】
CellTracker Green CMFDAにより染色した細胞は、蛍光顕微鏡(U−RFL−T/IX71、オリンパス、日本)を通じてCCDカメラにより観察する。
これにより、保持孔に固定された複数の脾臓細胞の中から、標識された細胞の蛍光を検出することができる。
【0103】
(比較例)
比較のため、遮光膜を設けていない構造体を用い、下記操作を行った。はじめに上記脾臓細胞懸濁液600μL(細胞数:約16万個)をスペーサーの導入口よりシリンジを用いて注入し、信号発生器により電圧20Vpp、周波数3MHzの矩形波交流電圧を電極間に印加したところ、2から3秒程度の極めて短い時間で、複数の保持孔のそれぞれに1つずつ細胞を固定することができた。
【0104】
次に収容部へ2.5×10-4%濃度のポリ−L−リジンを600μL注入し、3分静
置後、電圧の印加を停止した。次に、リン酸緩衝液(pH7.2)を注入して収容部内のポリ−L−リジンを洗浄することで、貫通孔内へ細胞を静電気的に結合することができた。
【0105】
続いてマウス脾臓細胞集団中のB細胞を検出した。実施例1と同様にB細胞を検出するための標的となる特定物質をB細胞表面に存在するCD19分子とし、標識物質であるPE標識−CD19抗体(Miltenyi Biotec, Bergisch Gladbach, Germany)によるB細胞の標識を行った(4℃、10分)。標識されたB細胞は、蛍光顕微鏡(U−RFL−T/IX71、オリンパス、日本)を通じてCCD
カメラにより観察した。その結果、保持孔周辺の絶縁体膜(高分子膜)からの蛍光散乱による光ノイズが大きく、保持孔内に固定されたB細胞表面の蛍光を精度良く検出することができなかった。
【符号の説明】
【0106】
2:生体試料
3:導電線
4:交流電源
9:保持孔
12:電気力線
14:粒子固定用構造体
15:基板
16:スペーサー
17:上蓋
18:絶縁体膜
19:遮光膜
20:保持部
21:櫛状電極
22:電極
23:電極
24:導入口
25:排出口
26:誘電泳動力
27:生体試料と結合する物質
28:生体試料
30:ガラス基板
31:標識物質
32:異常細胞
33:蛍光顕微鏡
34:生体試料採取手段
35:上部電極基板
36:下部電極基板
37:ITO
38:Cr
39:露光用フォトマスク(櫛状パターン)
40:レジスト(ネガ型)
41:露光用フォトマスク(微細孔パターン)
42:露光
43:現像液(ネガ型)
44:下部電極基板と保持部と遮光膜を備える構造体
45:収容部(空間)
46:レジスト(ポジ型)
47:現像液(ポジ型)
48:ITOエッチング液
49:硝酸アンモニウムセリウム液
50:櫛状電極基板と保持部と遮光膜を備える構造体
54:リムーバー(ネガ型レジスト用)
55:リムーバー(ポジ型レジスト用)
56:保持孔の間(絶縁体膜)
【技術分野】
【0001】
本発明は、被検体粒子を固定するための粒子固定用構造体、並びに、被検体粒子の解析装置及び解析方法に関する。
【背景技術】
【0002】
近年、生体試料(例えば細胞)などの微粒子を基板上に個別に規則正しく配列することにより、各粒子の性質や構造を個々に解析したり観察したりすることを可能とする技術が提案され、創薬、治療、検査、分析など様々な分野での応用が期待されている。特許文献1では、アレイ状に配置された微細孔(マイクロウエル)を備える基板の上に細胞懸濁液を添加してウエル内に細胞が沈むのを待った後、ウエルの外に残った細胞を洗い流す、という工程を繰り返し行うことで、各ウエルに細胞を1つずつ固定する方法が開示されている。また特許文献2には、上部電極と、多数の貫通孔が形成された絶縁体層を有する下部電極との間の空間に、微粒子を含む懸濁液を導入し、両電極間に交流電圧を印加することで、誘電泳動力により微粒子を貫通孔内に導入し固定する方法が開示されている。特許文献1,2のような方法により多数の微粒子が個別に固定された基板を作製することができれば、例えば、励起光照射による蛍光を観察することで個々の微粒子の解析を容易に且つ一括して行うことができるようになる。一例として、特許文献1では、蛍光標識したリンパ球を1つずつウエル内に固定し、抗原による刺激を加える前と後で蛍光強度の変化を観察することで、集団の中に極めて低い頻度で存在する抗原特異的リンパ球を同定する方法が提案されている。
【0003】
また、特許文献3には、表面に水酸基を導入可能な基体と、基体に達する複数のウエルが設けられた金属系膜と、金属系膜上に配置された架橋性の高分子膜とを備えるバイオチップ用基板が開示されている。ただし、特許文献3の基板は核酸を固定するためのものであり、細胞等の微粒子を固定するためのものではない。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特許第3723882号公報
【特許文献2】特開2007−296510号公報
【特許文献3】特開2007−78631号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
特許文献1、2のように基板上に配列された多数の微粒子の蛍光検出を一括して行う場合には、次のような問題が生ずる。第一に、励起光照射により発生する蛍光の中には、蛍光標識された微粒子から発生する蛍光(蛍光シグナル)以外に、基板自体から発生する自家蛍光も含まれる。これがバックグラウンドノイズとして影響し、蛍光シグナルの強度の検出精度を低下させる。また、測定装置の構成や測定条件によっては、蛍光以外にも、室内光などの外部からの光も同様にバックグラウンド光として検出される。第二に、微粒子同士の間隔が狭い場合には、隣の微粒子からの漏れ光(クロストークノイズ)による検出精度の低下も問題となる。第三に、長時間の励起光照射による蛍光退色防止のため、蛍光標識された生体試料から発生する蛍光強度の検出時間を短縮することも要求されている。
【0006】
そこで、本発明は、かかる従来の実状に鑑みて提案されたものであり、その目的は、バックグラウンドノイズやクロストークノイズなどを低減し、多数の微粒子の光学的な観察を高感度且つ高精度に行うことを可能にする技術を提供することにある。
【課題を解決するための手段】
【0007】
上記目的を達成するために、本発明は以下の構成を採用する。すなわち、本発明に係る粒子固定用構造体(以下単に「構造体」ともよぶ)は、被検体粒子を構成する成分の存在を示す物質により発せられる光を検出するために該被検体粒子をそれぞれ保持する複数の保持孔を有する粒子固定用構造体であって、平板状の透光性の基板と、前記基板の第1面上に配置され、前記複数の保持孔が形成された保持部と、前記基板の第1面とは反対側の第2面上に配置される遮光膜と、を備え、前記保持孔は、前記保持部の上表面に開口し、かつ、前記基板の第1面まで延在(到達)しており、前記遮光膜は、前記複数の保持孔に対応する位置に、前記基板の第2面を露出させる複数の開口部を有している、という構成を備える。ここで、「(基板の第2面上の)保持孔に対応する位置」とは、保持孔(もしくは保持孔の底部)を基板の第2面に垂直投影することで得られる仮想的な領域の位置(例えば当該領域の中心位置)として定義できる。なお、保持孔(もしくは保持孔の底部)を基板の第2面に垂直投影することで得られる仮想的な領域のことを「(基板の第2面上の)保持孔に対応する領域」ともよぶ。
【0008】
この構成によれば、基板の第2面の側から遮光膜の開口部及び基板を通して保持孔を観察することにより、例えば保持部自体の自家蛍光に起因するバックグラウンドノイズや隣接する保持孔からの漏れ光に起因するクロストークノイズなどの光ノイズを低減することができ、各保持孔内の観察対象物質により発せられる光のみを高感度かつ高精度に検出することが可能となる。そして、高感度かつ高精度の検出が可能であることから、検出時間の短縮を図る効果も期待できる。
【0009】
ここで、本発明の構造体が、前記保持部の上に前記被検体粒子を含む懸濁液を収容する収容部を更に備えており、前記保持孔が前記収容部と連通するように設けられていることが好ましい。これにより、各保持孔内への被検体粒子の導入を容易に行うことができる。なお、保持孔内へ被検体粒子を導入する方法としては、自然沈降(重力)を利用してもよいし、誘電泳動力を利用することもできるが、数秒程度の極めて短い時間で多数の保持孔に対し被検体粒子を導入できることから、誘電泳動力を利用する方法がより好適である。
【0010】
誘電泳動力を被検体粒子に作用させるには、収容部及び保持孔を懸濁液で満たした状態で、保持孔の部分に電気力線が集中するような交流電界をかければよい。かかる交流電界を印加するための構成として、例えば、前記基板の第1面上に、互いに異なる保持孔に対応する位置にそれぞれ配置される一対の電極が設けられ、前記保持部は絶縁体膜からなり、前記保持孔は、前記絶縁体膜の上表面から前記基板上の電極まで延在する、という構成を採用することができる。また、前記基板の第1面上に、前記保持孔に対応する位置に配置される第1の電極が設けられるとともに、前記保持部は絶縁体膜からなり、前記保持孔は、前記絶縁体膜の上表面から前記基板上の第1の電極まで延在し、前記保持部および前記収容部を挟んで前記第1の電極とは反対の側に第2の電極が設けられる、という構成を採用することもできる。いずれの構成の場合も、2つの電極の間に所定の波形を有する交流電圧を印加することで、懸濁液中の被検体粒子を保持孔内へと導入することが可能である。
【0011】
ここで、前記遮光膜は、基板の第2面のうち複数の保持孔に対応する領域以外の領域を全部覆っていることが好ましい。これにより保持孔以外の部分から発生する光ノイズを可及的に除去しつつ、保持孔から発せられる光シグナルを適切に検出することが可能となるからである。
【0012】
前記基板の第1面上に設けられた電極は透明電極であることが好ましい。これにより、保持孔から発せられる光を基板の第2面側から観察する際に、電極が妨げとならず、光の
検出強度の低下を防止できる。
【0013】
また本発明に係る粒子解析装置は、上述した粒子固定用構造体と、前記電極に誘電泳動力を発生させるための交流電圧を印加する電源と、前記電源からの電圧印加後に、前記粒子固定用構造体の保持孔に保持された前記被検体粒子を構成する成分の存在を示す物質により発せられる光を検出する検出部と、を備えることを特徴とする。
【0014】
また本発明に係る被検体粒子の解析方法は、上述した粒子固定用構造体上の保持孔に被検体粒子を固定し、固定された被検体粒子を構成する成分の存在を示す物質により発せられる光を検出することを特徴とする。ここで、前記被検体粒子を構成する成分の存在を示す物質は、後述する標識物質である。
【発明の効果】
【0015】
本発明によれば、バックグラウンドノイズやクロストークノイズなどを低減し、多数の微粒子の光学的な観察を高感度且つ高精度に行うことが可能となる。
【図面の簡単な説明】
【0016】
【図1】本発明の第1実施形態に係る構造体を説明するための図である。
【図2】図1の構造体の断面図である。
【図3】本発明の第2実施形態に係る構造体及び粒子固定装置を説明するための図である。
【図4】図3の構造体の断面図である。
【図5】本発明の第3実施形態に係る構造体及び粒子固定装置を説明するための図である。
【図6】本発明の第4実施形態に係る構造体及び粒子固定装置を説明するための図である。
【図7】図6の構造体の断面図である。
【図8】誘電泳動による粒子の固定方法を説明するための図である。
【図9】誘電泳動による粒子の固定方法を説明するための図である。
【図10】粒子の解析方法を説明するための図である。
【図11】本発明の装置を異常細胞の検出装置に適用した例を示す図である。
【図12A】実施例1の構造体の製造方法を説明するための図である。
【図12B】実施例1の構造体の製造方法を説明するための図である。
【図13A】実施例2の構造体の製造方法を説明するための図である。
【図13B】実施例2の構造体の製造方法を説明するための図である。
【図13C】実施例2の構造体の製造方法を説明するための図である。
【発明を実施するための形態】
【0017】
以下に図面を参照して、本発明の好適な実施の形態を例示的に詳しく説明する。ただし、以下の実施形態及び対応する図面に記載する部材の形状、寸法、材料などは本発明の目的を達成するための一具体例にすぎず、本発明の範囲をそれらの構成のみに限定する趣旨のものではない。
【0018】
<粒子固定用構造体の基本構造>
まず、本発明に係る粒子固定用構造体(以下単に「構造体」ともよぶ)の基本構造について説明する。
【0019】
粒子固定用構造体とは、検査対象となる多数の被検体粒子を個別に規則正しく配列し保持(固定)することにより、多数の被検体粒子の操作、観察、解析などを容易化するための部材である。本発明の構造体により固定可能な被検体粒子としては、生体試料系微粒子
、無機材料系微粒子(シリカ、ジルコニア、酸化ニッケルなど)、有機材料系微粒子(ポリスチレンなど)を例示できる。中でも、本発明は細胞やウイルス粒子に代表される生体試料系微粒子の固定に好ましく適用することができるため、以下の実施形態では主に生体試料系微粒子(以下、「生体試料」と記載することがある。)を例に挙げて説明を行う。
【0020】
(第1実施形態)
図1および図2に、第1実施形態に係る構造体を模式的に示す。図1(a)は構造体の平面図であり、図1(b)は構造体の層構造を説明するための分解斜視図である。また図2(a)は図1(a)のA−A断面図であり、図2(b)は構造体に生体試料(例えば細胞)が固定された状態を示している。
【0021】
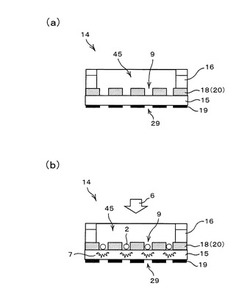
図1および図2に示すように、構造体14は、平板状の透光性の基板15と、基板15の第1面(図中の上面)上に配置される保持部20と、基板15の第2面(図中の下面)上に配置される遮光膜19と、保持部20の上に生体試料を含む懸濁液が導入される空間(収容部ともよぶ)45を形成するためのスペーサー16とから構成されている。保持部20は、絶縁体膜18から成り、絶縁体膜18を貫通し基板15まで延在(到達)するように形成された複数の保持孔(貫通孔)9を有している。ここで、保持孔9は、基板15の第1面を底面とする有底筒状の孔であり、基板15の第1面から保持部20(絶縁体膜18)の膜厚方向に延びて、収容部45に対して開口するように形成されている。なお、説明及び図示の便宜から、図面にはいくつかの保持孔9しか記載されていないが、実際の構造体では数千から数百万あるいは数千万個の保持孔9が設けられている。一方、遮光膜19には、保持孔9に対応する位置にそれぞれ、基板15の第2面を露出させる開口部29が設けられている。すなわち、透光性の基板15を挟んで、保持孔9と開口部29とがちょうど対応する位置に配置されている。
【0022】
上記の構成によれば、例えば、スペーサー16に設けられた導入口24から生体試料を含む懸濁液を収容部45内に導入し、重力によって生体試料を保持孔9内に沈降させることで、図2(b)に示すように各々の保持孔9に対し生体試料2を固定することができる。そして、各保持孔9に生体試料2が固定された構造体14に対し、標識等の必要な操作を行った後、例えば、図2(b)の上側(収容部側)から励起光6を照射し、図2(b)の下側(基板側)から開口部29及び基板15を通して蛍光7を観察すると、絶縁体膜18の自家蛍光や隣接する保持孔9からの漏れ光が遮光膜19によって遮られる。したがって、バックグラウンドノイズやクロストークノイズなどの光ノイズを低減することができる。これにより、生体試料2に特異的に結合した標識物質(後述する)により発せられる微弱な光シグナルを高感度かつ高精度に検出することが可能となる。
【0023】
次に、粒子固定用構造体の他の実施形態について説明する。第1実施形態の構造体は重力の作用により微粒子を保持孔内に導入したのに対し、以下に述べる第2〜第4実施形態の構造体は誘電泳動力を主に利用して微粒子の保持孔内への導入を行う構成を採用している。
【0024】
(第2実施形態)
図3および図4は、第2実施形態に係る構造体及び粒子固定装置の構成を模式的に示している。図3は構造体の層構造を説明するための分解斜視図であり、図4は構造体の断面図である。なお、図4は、図1(a)のA−A線と同じ部分の断面を示している(以下の断面図も同様)。第2実施形態の構造体14は、基板15の保持部側の面に一対の透明電極22、23からなる櫛状電極21を有している。それぞれの電極22、23は、保持孔9の配列方向に沿って平行に配置される複数の帯状電極を有しており、一方の電極22の帯状電極と他方の電極23の帯状電極とが互い違いになるように配置されている。図4に示すように、それぞれの帯状電極は保持孔9に対応する位置に設けられ、各保持孔9の底
部に電極が露出している。各電極22、23は導電線3を介して交流電源4に接続されている。この構成において、収容部45内を生体試料を含む懸濁液で満たし、交流電源4から電極22、23の間に交流電圧を印加することにより、生体試料に誘電泳動力を作用させ、生体試料を電気力線の集中する保持孔9内へと導入し固定することができる。なお誘電泳動の詳細については後述する。
【0025】
(第3実施形態)
図5は、第3実施形態に係る構造体及び粒子固定装置を示している。図4に示した第2実施形態の構造体との違いは、スペーサー16の上に収容部45を覆う上蓋17を設けた点である。上蓋17を設けることにより、収容部45内に導入した生体試料を含む懸濁液の水分が蒸発することを防止したり、生体試料を含む懸濁液を導入口24から安定して収容部45内に供給できるという利点がある。懸濁液の供給が安定する理由は、上蓋17とスペーサー16の収容部45との間を流れる流体の流線が基板平面と平行に層流になりやすいからと考えられる。なお、第1実施形態の構造体においても、同様の効果を得るために上蓋を設けてもよい。一方で、第1実施形態や第2実施形態のように上蓋の無い構成も、部材点数削減による製造の簡易化ならびにコスト低減の効果が得られるとともに、保持孔9内に固定した生体試料のうちの任意のものをマイクロピペット等で採取するなどの操作を容易にできるという利点がある。従って、用途や目的に応じて上蓋を設けるか否かを選択すればよい。なお、上蓋を設けない実施形態や、上蓋を脱着可能に設ける実施形態では、スペーサー16に導入口24等を設けることなく、生体試料を含む懸濁液を収容部45内の上方向から直接導入し又は排出することができる。
【0026】
(第4実施形態)
図6および図7は、第4実施形態に係る構造体及び粒子固定装置を示している。図6は構造体の層構造を説明するための分解斜視図であり、図7は構造体の断面図である。第4実施形態の構造体14は、保持部20の下側と上側にそれぞれ下部電極基板36と上部電極基板35が配置された構造である。下部電極基板36は、上記実施形態で述べた基板15の第1面(すなわち、基板15と保持部20の間)に透明電極層を配置した構成であり、基板15は図6および図7から省略して描いている。この電極層は保持孔9の底部に露出するように形成されていればその形状は問わないが、図6のように基板の全面に電極層を設ける構成は製造プロセスの容易化の観点から好ましい形態である。一方、上部電極基板35については、下部電極基板36と同じように基板上に電極層を設けた構成でもよいし、導電性材料からなる板状部材を上部電極基板35として用いることもできる。なおこの実施形態では、上部電極基板35が、収容部45を覆う上蓋を兼ねている。この構成において、収容部45内を生体試料を含む懸濁液で満たし、電源4から上部電極基板35と下部電極基板36の間に交流電圧を印加することにより、生体試料に誘電泳動力を作用させ、生体試料を電気力線の集中する保持孔9内へと導入し固定することができる。
【0027】
上述した第2から第4実施形態に係る構造体においても、基板15の第2面上に遮光膜19を設けたことにより、第1実施形態で述べたときと同様、生体試料を光学的に観察する際に、バックグラウンドノイズやクロストークノイズなどの光ノイズを低減することができ、生体試料から発する微弱な光シグナルを高感度かつ高精度に検出することが可能となる。
【0028】
なお、収容部45を密閉可能な箱状の形態とし、かつ、生体試料を含有する懸濁液の比重を生体試料の比重以上として生体試料がその懸濁液中で上方向に浮上するようにする(生体試料の比重が大きい場合であっても、懸濁液の比重をそれ以上とすることは容易である。)場合、収容部45の上方に下向きに開口する保持孔9を有する保持部20を設ける構成とすることができる。これは、第3又は第4実施形態の構造体を上下逆転した構成の構造体である。ただし、生体試料の操作に重力をも利用することができること、固定化後
の生体試料の分別回収や抽出により生体試料から溶出した遺伝子の分別回収を考えると、当該操作を上部からの吸引等、極めて単純な操作で実施可能とするために、保持部20を収容部45の下側に配置することが好ましく、さらに収容部45の上蓋17や上部電極基板35はスペーサー16から取り外し可能な構成にしておくことが好ましい。
【0029】
<構成部材の説明>
次に、上述した粒子固定用構造体14の各構成部材について、詳しく説明する。
【0030】
(基板および電極)
透光性の基板15の材料としては、アクリル樹脂、エポキシ樹脂、酸化ケイ素を主成分とした合成石英(SiO2)、セラミックスなどが利用可能である。特に酸化ケイ素と酸化ホウ素を主成分とし、良好な加工性と低い熱膨張率を兼ね備えた、パイレックスガラス(登録商標)が好ましい部材として例示できる。
【0031】
また、基板表面に設けられる透明電極の材質は、導電性を有しており且つ化学的に安定な材料であればとくに制限はない。例えば、ZnO(酸化亜鉛)、SnO(酸化スズ)および、ITO(Indium Tin Oxide:酸化インジウムスズ)等の透明導電材料等を使用することができる。中でも、ITO電極は、その透明性や成膜性等の面で特に好ましい電極材料である。
【0032】
保持孔9内の標識物質を光学的に観察する方法には、「透過型」と「反射型」の2種類がある。透過型とは、保持孔9の底部と開口のうちの一方の側から光を照射し、その反対側から光を観察(検出)する方法であり、反射型とは、保持孔9の底部と開口のうちの一方の側から光を照射し、同じ側から光を観察(検出)する方法である。ここではいずれの方法も利用可能であるが、反射型の場合は、光照射手段と光検出手段の両方を構造体14に対して同じ側に設置しなければならないため、透過型に比較して装置構成の制約が生じる。それゆえ、装置構成の簡易化の観点からは、透過型のほうが有利である。また、上記実施形態では、保持部20の下側(基板側)に遮光膜19を配置しているため、保持部20の上側から観察するよりも、下側から(すなわち基板15を通して)光を観察するほうが、遮光膜19による光ノイズの低減効果が大きい。したがって、上記実施形態の構造体14では、基板15の下側から遮光膜19の開口部29と基板15を通して光を観察する構成が好ましい。なお、保持孔の数に等しい数の光検出手段を設けてもよいが、装置構成を簡略化してメンテナンスや操作性を向上するために、保持孔の数よりも少ない数の光検出手段を設け、これを適当なアクチュエータで駆動して各保持孔をスキャンニングする構成とすることが好ましい。あるいは、イメージスキャナのような光検出手段により、複数の保持孔の光を一括で検出することも好ましい。
【0033】
(遮光膜)
遮光膜19は、光検出用の複数の開口部(窓)29が設けられた遮光性の部材である。好ましくは、図2、図4、図5、図7等に示したように、遮光膜19を、基板15の第2面(下面)のうち保持孔9に対応する領域以外の領域を全部覆うように設けるとよい。また、遮光膜19の開口部29の大きさは、保持孔9に対応する領域と同じか、それよりも小さくすることが好ましい。これにより、保持孔以外の部分から生じる光ノイズを可及的に除去しつつ、保持孔9から発せられる光シグナルのみを開口部29を通して適切に検出することが可能となる。なお、遮光膜19の開口部29の形状、大きさ、位置、配列などは、保持部20の保持孔9の形状、大きさ、位置、配列などに応じて適宜設計すればよい。もっとも、前記した反射型による光学的観察を行う場合であって、保持孔9の開口側から光を照射し、同じ側で光を観察(検出)するのであれば、保持孔9(保持孔9が延在する基板表面部分)にも設けることができる。
【0034】
遮光膜19の材料としては、標識物質により発せられる波長の光(例えば可視光であれば、波長380nmから780nmの光)に対して十分な遮光性を有する材料であればよく、金属系材料、炭素系材料、セラミック、樹脂などを利用することができる。中でも、クロム(Cr)、チタン(Ti)、白金(Pt)、ニオブ(Nb)、タンタル(Ta)、タングステン(W)、アルミニウム(Al)、金(Au)等の金属、又は金属酸化物などの金属系材料が好適であり、特に遮光性が高く、基板15との密着性が高いクロム(Cr)が好ましい。遮光膜の厚さは、材料によって適宜設定することができるが、クロム等の金属系膜の場合、その膜厚は、50nmから10μmの範囲が好ましく、十分な遮光性が得られる100nm以上の膜厚が特に好ましい。他の金属系膜でも同様である。金属系膜の場合、一般的なフォトリソグラフィー及びエッチングにより、成膜及び孔の形成を行うことができる。セラミックの場合は、例えば、スプレーや貼り付け等で加工することが考えられる。また機械加工にて予め孔を形成した樹脂やフィルムを基板に貼り付けてもよい。
【0035】
(絶縁体膜)
保持部20の一部を絶縁体の材料で構成するとともに、保持孔9の底部に電極を露出させるのは、電極に交流電圧を印加した際に、保持孔9に対して電気力線を集中させ、生体試料を当該保持孔に移動させて固定するためである。なお、前述したように、保持孔内へ被検体粒子を導入するのに自然沈降(重力)のみを利用する場合は、電極を設ける必要がないため、絶縁体膜も不要である。
【0036】
絶縁体膜18の材料としては、絶縁性を有する材料、例えば、シリコーンゴム、レジスト、樹脂等の架橋性の高分子、セラミック、ガラス、撥水加工した紙などを利用することができる。以下、架橋性の高分子からなる絶縁体膜を高分子膜と記載することがある。絶縁体膜は、被検体粒子を絶縁体膜18に設けた保持孔9に引き寄せて固定することから、被検体粒子と親和性のある絶縁性の材料であることが好ましい。被検体粒子と親和性のある絶縁体膜とは、被検体粒子が親水性である場合には親水性の高分子膜が、被検体粒子が疎水性である場合には疎水性の絶縁体膜が好ましい。親和性の目安としては、一般的には、絶縁体膜の表面に前記被検体粒子に近い親和性を有する液体を滴下したときに形成される液滴と絶縁体膜の表面との接触角で示される(接触角が小さいほど液体と絶縁体膜の表面との親和性が高く、接触角が大きいほど液体と絶縁体膜の表面との親和性が低い)。親水性の比較的高い高分子膜としては、ポリエチレングリコール系の高分子等、あるいはガラスや酸化チタンがあり、疎水性の比較的高い高分子膜としては、エポキシ樹脂、ポリスチレン、ポリイミド、テフロン(登録商標)等の樹脂が例示できる。特に紫外線に対して感光性を付与したエポキシ樹脂が好ましく、更には高いアスペクト比で構造体を作製することが可能なSU-8 3000シリーズ(化薬マイクロケム社)が好ましい。
【0037】
なお、被検体粒子との親和性が低い絶縁体膜を用いざるを得ない場合であっても、絶縁体膜の表面を改質することによって絶縁体膜と被検体粒子との親和性を高めることができる。樹脂等の疎水性の高分子膜を親水化する方法としては、既知の方法である、プラズマ処理、タンパク質の物理吸着などによる修飾、或いはこれらの方法を任意に組み合わせた方法などを用いればよい。ここで、高分子膜表面のプラズマ処理とは、電子・イオン・ラジカルなどの活性種が存在する電気的に中性な電離気体(プラズマ)を高分子膜の表面に照射することにより、高分子膜の表面における有機汚染物の除去や化学結合状態を変化させ、高分子膜の表面を親水化する処理である。また、ここで、タンパク質の物理吸着などによる修飾であれば、例えばBSA(ウシ血清アルブミン)などのタンパク質含有溶液に高分子膜を数分から数時間浸漬することで、タンパク質を物理吸着させ、高分子膜の表面を親水化することができる。またポリエチレングリコールジアクリレート重合体などの親水性の高分子膜を疎水化する方法としては、シランカップリング剤を親水性の高分子表面に結合させる化学修飾による方法などを用いればよい。シランカップリング剤は有機物とケイ素から構成される化合物であり、分子中に親水性を示す反応基(水酸基、カルボキシ
ル基、アミノ基、スルホン基など)と疎水性を示す反応基(ビニル基、メチル基、エチル基、プロピル基など)の2種以上の異なった反応基を有している。このため、シランカップリング剤の希薄溶液に親水性の高分子膜を浸漬すれば、シランカップリング剤の親水性を示す反応基が親水性の材料の表面に化学的に結合し、疎水性を示す反応基が表面を覆うため、容易に疎水性の材料の表面を均一に疎水化することが可能である。
【0038】
なお、親水性又は疎水性の評価方法としては、以下の一般的な手法を用いることができる。すなわち、高分子膜表面に純水を滴下し、そのときに高分子膜の表面に形成される液滴と高分子膜の表面との接触角を測定することによって高分子膜の表面の親水性および疎水性を評価するのである。親水性および疎水性の厳密な定義は存在しないため、本発明においては、親水性を前記接触角が50°以下、好ましくは40°以下であると定義し、疎水性を前記接触角が50°より大きく、好ましくは60°より大きいと定義する。さらに、接触角の測定は、基板上に滴下した液滴の左右端点と頂点を結ぶ直線の、固体表面に対する角度から接触角を算出するθ/2法を用いる。
【0039】
(保持孔)
保持部20に保持孔(貫通孔)9を形成するためには、絶縁体膜18の種類に応じた種々の方法を採用することができる。例えば、保持孔9を形成するためにはレーザーを照射する方法や、保持孔9を形成するためのピンを有する金型を用いて保持部20を成形する方法などの既知の方法を用いることができる。また光硬化性樹脂などを用いる場合は、保持孔9に相当するパターンを描画した露光用フォトマスクを用いて一般的なフォトリソグラフィー(露光)とエッチング(現像)により保持孔9を形成することができる。金属系材料からなる遮光膜19へ保持孔を形成する場合、一部が選択的に除去された絶縁体膜をエッチングマスクとして用いて、遮光膜の一部を等方性のウェットエッチングにより選択的に除去する方法を採用できる。
【0040】
上記実施形態では、円筒形状の保持孔9を例示したが、保持孔9の形状はこれに限られない。例えば、保持孔9の平面(開口)形状としては、楕円形や多角形(角が丸みを帯びている多角形を含む)などでもよい。また、保持孔9の径(幅)が底部から開口(保持部20の上表面)に向かって段階的または連続的に大きくなる形状も好ましい。
【0041】
複数の保持孔9は、保持部20の面内に規則正しく配置する構成が好適であり、具体的には複数の保持孔9をアレイ状に配列することが好ましい。ここでアレイ状とは、厳密には保持孔が行と列の2次元的に等間隔に配置されていることを意味するが、本発明では保持孔が行方向(横方向)のみ、あるいは列方向(縦方向)のみに、1次元的に等間隔に配置されている構成もアレイ状と表現する。このように保持孔をアレイ状に配置することで、電極間に印加した電圧によって生じる電界がすべての保持孔にほぼ均等に生じることになり、すべての保持孔に対して同じように生体試料を誘導し固定することが可能となる。また生体試料がアレイ状に規則正しく配列されていると、各々の標識物質の光シグナルを個別に検出したり解析することが容易となるし、さらには、固定した全ての試料の中から特定の性質をもつ試料の数や割合などを定量的に評価したり、特異な光シグナルが検出された試料の基板上の位置(アドレス)を容易に特定したりすることも可能となるなどの利点もある。なお、光学的な検出を行った後に、基板上の特定のアドレスの試料を操作することを容易にするため、各保持孔から検出された光シグナルの情報と位置情報とを対応付けて記憶する記憶手段を設けることが好ましい。
【0042】
(スペーサー)
収容部45を構成するスペーサー16は、生体試料の懸濁液を保持するスペースを確保するためのものである。スペーサー16は、例えばガラス、セラミック、樹脂等の絶縁体を材料として構成しても良いし、上部電極基板35と下部電極基板36を電気的に導通し
ない構成であれば金属等の導電体を材料として構成しても良い。例えば、保持部20上に配置したスペーサーの型枠の中に急速硬化タイプの接着剤を流し込み硬化させることで、スペーサー16の成形と貼り合せを同時に行うことが可能である。また、別体で成形したスペーサー16を、接着剤で保持部20に接着したり、熱及び圧力を加えて保持部20に融着させることもできる。あるいは、PDMS(poly−dimethylsiloxane)やシリコンシートのような表面粘着性のある樹脂を用いてスペーサー16を作製し、これを圧着により保持部20と貼り合わせることもできる。収容部45は、スペーサーによって構成されるが、その形状は、第1乃至第4実施形態に示したような四角形である必要はなく、円形、楕円形、菱形等の種々の形状を採用し得る。またスペーサーには、懸濁液を導入し、排出するための導入口と排出口(24、25)を設けることができるが、収容部45の上方から直接懸濁液を導入する場合には導入口や排出口は不要である。また導入口と排出口は、第1乃至第4実施形態に示したように対向する位置に直線状に設ける必要はない。なお、例えばそれ自体絶縁性の箱を用意して、その内側底面に構造体を配置することにより、スペーサーを用いることなく収容部45を構成することができる。またこの形態では、例えば前記箱の内側底面に一対の電極のうちの一方を備えた構造体を配置するとともに、内側上面に対をなす他方の電極を配置し、又は、前記箱の上面自体を他方の電極とすることもできる。
【0043】
上記実施形態では、スペーサー16に導入流路及び該流路に連通する導入口24と、懸濁液を排出する排出流路及び該流路に連通する排出口25を設け、装置に供する生体試料懸濁液の供給と排出を迅速に実施可能としている。スペーサー16の寸法、形状およびスペーサーの内側の空間と厚みは、収容部に収容する懸濁液の量との関係で決定すれば良く、特に制限はないが、通常は生体試料懸濁液を数μLから数mL程度入れる容量があればよく、例えば、スペーサーのサイズが縦40mm×横40mm程度の場合、スペーサーの内側の空間は、縦20mm×横20mm程度であればよく、スペーサーの厚みは0.5から2.0mm程度であればよい。
【0044】
(交流電源)
第2から第4実施形態に示した粒子固定装置において、構造体14の一対の電極には、導電線3を介して交流電源4が接続される。交流電源4は、保持孔9に生体試料を移動させ、固定する電界を発生させるのに十分な電圧を電極間に印加できればよい。具体的には、ピーク電圧が1Vから20V程度で、周波数100kHzから3MHz程度の正弦波、矩形波、三角波、台形波等の波形の交流電圧を印加できる電源が例示できるが、中でも、生体試料を移動させ、1つの保持孔に1個の生体試料のみを固定し得る波形の交流電圧を電極間に印加することが特に好ましい。かかる波形の交流電圧としては、矩形波を使用することが好ましい。矩形波は、波形が正弦波、三角波、台形波である場合に比べて、瞬時に設定したピーク電圧に到達するため、生体試料を保持孔に向けて速やかに移動させることが可能となり、2個以上の生体試料が重なるように保持孔に入る確率を低くできる(1つの保持孔に1個の生体試料のみを固定し得る確率が高くなる)。生体試料は電気的にコンデンサーと見なすことができるが、矩形波のピーク電圧が変化しない間は、保持孔に捕捉された生体試料には電流が流れ難くなって電気力線が生じ難くなり、この結果、生体試料を固定した保持孔には誘電泳動力が発生し難くなる。従って、一度保持孔に生体試料が固定されると、別の生体試料が同一の保持孔に固定される確率は低くなり、代わりに電気力線が生じ誘電泳動力が発生している他の保持孔(生体試料が固定されていない、空の保持孔)に、順次、生体試料が固定される。
【0045】
なお、本発明の装置では、直流成分を有しない交流電圧を発生する電源を採用することが好ましい。直流成分を有する交流電圧を印加すると、直流成分により発生した静電気力(電気泳動力)により生体試料が特定の方向に偏った力を受けて移動し、誘電泳動力によって保持孔に固定し難くなるからである。また直流成分を有する交流電圧を印加すると、
生体試料を含有する懸濁液に含まれるイオンが電極表面で電気反応を生じて発熱し、それによって生体試料が熱運動を起こすため誘電泳動力によって動きを制御できなくなり、保持孔に移動させて固定することが困難になる。なお、直流成分を有する交流電圧とは、周波数デューティ比が50%でない電圧、オフセットを有する電圧、周期が極端に長い(例えば1秒以上)電圧などをいう。
【0046】
(保持孔の間隔及び寸法)
本発明の装置では、印加する交流電圧の波形を好ましくは矩形とすることにより、1つの保持孔に1個の生体試料のみを固定し得るようにするものであるが、かかる目的を達成するために、更に、保持孔の配置、寸法、形状を、1つの保持孔に1個の生体試料のみを固定し得るのに適した配置、寸法、形状とすることが好ましい。例えば配置に関しては、保持部の面上に保持孔をアレイ状に配置することが好ましいが、隣接する保持孔同士の間隔が狭すぎると1つの保持孔に複数の生体試料が固定されてしまう確率が高くなる、また両隣の保持孔内の生体試料懸濁液が混合したりクロストークノイズが発生したりするため、生体試料の解析に良い影響を与えない。逆に、隣接する保持孔同士の間隔が広い場合は隣接する保持孔の間(図9における56)に生体試料が残されてしまい、生体試料を固定できない保持孔が発生する確率が高くなる。そこで、保持孔の間隔及び寸法(直径、深さ)を固定しようとする生体試料の粒径に応じて設定するとよい。具体的には、隣接する保持孔同士の間隔を、固定しようとする生体試料の粒径の0.5倍以上20倍以下の範囲とすることが好ましい。また保持孔の直径及び深さは、いずれも生体試料の直径の1倍以上5倍以下の範囲にすることが好ましい。このようにすることで、保持孔の底面の電極面と生体試料に静電気力が発生し、生体試料は保持孔に確実に固定されるとともに、良好な観察を行うことができる。
【0047】
(生体試料)
好ましい被検体粒子は、細胞、ウイルス粒子、DNA、タンパク質等の生体試料である。
細胞は、誘電泳動により捕集することができる誘電体からなるものであれば特に制限はない。例えば、血液、リンパ液、髄液、喀痰、尿、便中の細胞(生細胞)や体内あるいは環境中に存在する微生物、原虫、また培養細胞など、その表面や内部に標識可能な物質(特定物質)を有するものが好ましい生体試料として例示できる。より具体的には、血液、リンパ液を通じて遠隔転移するがん細胞、例えば胃がん、大腸がん、食道がん、肝臓がん、肺がん、すい臓がん、膀胱がん、子宮がん(上皮性腫瘍)由来の細胞、及び、リンパ球、白血球などの血液細胞(リンパ腫、白血病)が挙げられる。また、がん細胞としては、細胞の表面にコラゲナーゼの様な特異的なタンパク質があり、該タンパク質ががん細胞周辺のコラーゲン(細胞外マトリックス)を溶解することにより浸潤して転移をするようながん細胞が例示できる。
【0048】
ウイルスとしては、ヘルペスウイルス、肝炎ウイルス、HIVウイルス(ヒト免疫不全ウイルス)、ATLウイルス(成人T細胞白血病ウイルス)等のウイルスが挙げられる。DNA、タンパク質としては、それぞれ長さ又は分子量が40kbp以上、10万Da以上、好ましくは100kbp
以上、50万Da以上であることが好ましい。また、生体試料としては、タンパク質、ペプチド、DNA、RNA、多糖類、脂質、ウイルス等を、これらの物質を捕捉できるように修飾された担体粒子に捕捉させた微粒子が挙げられる。担体粒子としては、誘電体からなるものであれば、特に制限されない。溶液中に多種のタンパク等が混在した状態で検出するよりも、微粒子上にタンパク質等を濃縮することができるため、検出感度の向上が期待される。また、タンパク質等ごとに特異的な微粒子を複数種用意すると、多検体検出が可能となる。タンパク質としては、各種腫瘍マーカー、例えばCEA(癌胎児性抗原、carcinoembryonic antigen。食道、胃、直腸等の消化器系の腫瘍マーカー)、CA19-9(carbohydrate antigen19-9。膵臓・胆道癌等の消化器系の腫瘍マーカー)、PSA(prostate specific antigen。前立腺特異的マーカー)等が挙げられる。
【0049】
また装置に供する生体試料懸濁液は、上記のような生体試料が誘電泳動で移動できる懸濁液であれば良い。例えば、マンニトールやグルコース、スクロース等の糖類の水溶液およびその水溶液に塩化カルシウムや塩化マグネシウムなどの電解質やBSA(ウシ血清アルブミン)等のタンパク質を含有した水溶液に解析する試料を含有させた懸濁液が好ましい生体試料懸濁液として例示できる。
【0050】
<誘電泳動及び粒子の解析>
次に、誘電泳動を利用した粒子の固定方法、並びに、固定した粒子の解析方法について、図8から図10を用いて説明する。なおここでは、第4実施形態(図7)の構造体及び固定装置を例に挙げて説明を行うが、他の実施形態の構造体及び固定装置の場合も同様の方法により粒子の固定及び解析を行うことができる。
【0051】
まず、図8に示すように、生体試料を含む懸濁液をスペーサー16の導入口24から注入し、収容部45及び保持孔9内を懸濁液で満たす。そして、交流電源4から前述した波形を有する交流電圧を印加すると、保持孔9に電気力線12が集中し、生体試料28に誘電泳動力26が作用する。これにより、生体試料28が電気力線12に沿って保持孔9に向かって移動し、1つの保持孔9に対して生体試料1つを導入し固定することができる。図8を用いて誘電泳動力の原理を説明する。交流電圧すなわち交流電界中に置かれた溶液の中の生体試料28すなわち細胞等の誘電体粒子には分極が生じ、正負の電荷が誘導される。ここで図8に示すように、下部電極基板36上の絶縁体膜18に設けられた保持孔9に、一様でない不均一な電界(図8に示す電気力線12)が与えられると、生体試料28は電界の集中する方向(電気力線12が密な方向)、すなわち保持孔9の方向へと引き寄せられる。これが誘電泳動力26である。一般に誘電泳動力は、粒子の体積、粒子と溶液の誘電率の差、不均一な電界の大きさの2乗に比例する。例えば、直径が5から10μm程度の粒子に対し、電界として周波数100kHzから3MHz、1×105から5×105V/mの交流電界を与えると、誘電泳動力が作用して粒子が電界の集中する方向に引き寄せられる。この場合、生体試料28は主に誘電泳動力、重力、電極からの静電気力によって保持孔9に誘導される。なお、収容部に供給される懸濁液中の生体試料の数に特に制限はないが、生体試料を有効に使用することを考慮すると、構造体の保持部に設けられた保持孔の数とおおむね同数とすることが望ましい。
【0052】
次に図9に示すように交流電圧を印加したまま、生体試料と結合する物質27で修飾された保持孔9の内側と生体試料28を結合する。生体試料と結合する物質27は、生体試料28と結合すれば特に制限はない。例えば、生体試料表面の特有の物質を認識する物質、細胞の脂質二重膜に結合する脂質オレイル基を有するBiocompatible A
nchor for Membrane(BAM)、生体試料と静電気的に結合する物質が例示できる。生体試料表面の特有の物質と、それに結合する分子の組合わせとしては、レセプター−リガンド、糖鎖−レクチン、抗原−抗体等が挙げられる。比較的短時間に生体試料と結合させることを考慮すると、生体試料表面と静電気的に結合する物質が好ましい生体試料と結合する物質として例示できる。このような物質としては、ポリ−L−リジン等のポリカチオン剤が挙げられる。
【0053】
また、生体試料と結合する物質として、各種がん細胞に汎用性のある(共通の、又はがん細胞間で特異的ではない)マーカー、例えばEpCAM(CD326、上皮特異抗原(ESA)、又は
ヒト上皮抗原(HEA)とも呼ばれる)と結合する物質を用いると、血液中等のがん細胞のみ
が固定され、がん細胞以外の細胞(血球細胞等)は固定されないため、洗浄を行うこと等によってよりがん細胞以外の細胞を保持孔から脱離させて、確実にがん細胞のみを固定し検出することができる。なお、後述するが、特定のがん細胞の検出のためには当該特定のがん細胞にのみ存在する特定物質を、標識物質を使用して検出することが好ましい。しか
し、例えば種々の広範ながん細胞を標的試料とし、生体試料中に標的試料が存在するか否かを知ることを目的としている場合、それらに汎用性のあるマーカーと結合する物質で保持孔の内側を修飾しておき、洗浄の後、細胞の有無を検出できれば良い。かかる場合には、例えば、保持孔の上方向から光を照射し、保持孔の下方向に照射した光が到達するか否か、つまり固定された細胞の影を検出するのみでも良い。
【0054】
さらに、保持孔以外の絶縁体膜上(例えば図9における56)に保持孔に固定したくない細胞を特異的に認識する物質(例えば当該細胞等に対する抗体)を配置すると、かかる細胞等が保持孔に入ることを阻止する、つまり、目的の細胞(保持孔に入った細胞)と、目的ではない細胞等(保持孔の外側の絶縁体膜上に固定された細胞)を選別することができる。
【0055】
また、保持孔にがん細胞に汎用性のある(共通の)マーカー(例えば抗原)と結合する物質(例えば、当該共通の抗原に特異的に結合する抗体)を配置しておき、誘電泳動力によってがん細胞を保持孔に固定した後、さらにがん細胞のうち、例えば、乳がん、肺がんなどに特異的に発現しているHER2(抗原)と結合する物質(HER2に対する抗体(抗HER2抗体))によって標識することで、固定されたがん細胞の種類を推定することができる。
【0056】
生体試料と結合する物質27による保持孔9の修飾方法は、保持孔9の内側と生体試料28が結合できれば特に制限はない。例えば、自己組織化単分子膜(Self-Assembled Monolayer, SAM膜)を利用し、保持孔底面の金属酸化膜等からなる電極にアミノ基などを持つ生体試料と結合する物質27を反応させることで保持孔内を特異的に修飾することができる。また生体試料28を保持孔9に捕捉後、生体試料と保持孔9の内側の両方に結合する物質27を含む溶液を収容部へ注入することで保持孔9の内側と生体試料28を結合することが可能である。なお、生体試料と結合する物質27を含む溶液の注入によって結合する場合は、結合反応後に生体試料28を懸濁する溶液、例えばマンニトールやグルコース、スクロース等の糖類の水溶液およびその水溶液に塩化カルシウムや塩化マグネシウムなどの電解質やBSA(ウシ血清アルブミン)等のタンパク質を含有した水溶液にて収容部の生体試料と結合する物質27を洗浄、除去することが好ましい。このように生体試料と結合する物質27によって保持孔9に捕捉された生体試料28は、交流電圧を印加しなくても保持孔9から脱離することはなくなる。
【0057】
続いて図10に示すように生体試料等の被検体粒子の解析に必要な試薬溶液を収容部へ注入する。被検体粒子の解析に用いる試薬は被検体粒子の表面または内部に存在する物質を光学的に検出することができれば特に制限はない。
【0058】
生体試料等の被検体粒子を構成する成分、例えば被検体粒子の表面又は内部に存在する物質(以下、「特定物質」と記載することがある。)は、被検体粒子のうち、特定の性質を有する粒子(以下、「標的試料」ということがある。)の表面又は内部に特異的に存在する物質である。標的試料に特異的に存在するとは、標的試料には存在し、かつ、標的試料以外の粒子には存在しないか、あるいは、標的試料以外の粒子よりも標的試料に多く存在することをいう。
【0059】
被検体粒子が細胞の場合は、特定物質としては抗原、レセプター、糖鎖、核酸等が挙げられる。抗原としては、腫瘍細胞上の抗原、主要組織適合抗原(MHC、ヒトの場合はHLA)等が挙げられる。腫瘍細胞上の抗原としては、EpCAM等が挙げられる。レセプターとして
は、ホルモンレセプター、Fcレセプター、ウイルスレセプター等が挙げられる。核酸としては、DNA及びRNAが挙げられる。腫瘍マーカーのようなタンパク質は、そのまま生体試料としてもよく、前記したように担体粒子に担持させてもよい。より具体的に、例えば標的試料が種々のがん細胞であるならば、各種がん細胞に汎用性のある(共通の)マーカー
が特定物質たり得る。また標的試料が乳がんや肺がんであるならば、これらのがんに特異的に発現しているHER2(抗原)が特定物質たり得る。
【0060】
前記のような特定物質は、特定物質の存在を示す物質、例えば特定物質に特異的に結合する物質を用いて標識することにより観察(検出)することができる。例えば、抗原には該抗原に対する抗体、レセプターにはそれに結合するリガンド、糖鎖にはレクチンが結合する。そこで、これらのような特定物質に特異的に結合する物質と光学的に検出可能なシグナルを発する物質とを結合して標識物質とする。もっとも、例えば特定物質が任意の物質とのみ結合又は反応し、その結果光学的に検出可能なシグナルが発せられるような場合は、当該任意の物質そのものを標識物質として使用することができる。
【0061】
本発明の特定物質を検出する標識物質31は、標的試料が検出できれば特に制限はない。標識物質は、被検体粒子を構成する成分の存在を示すことのできるあらゆる物質をさす。有用な検出可能な標識物質の代表的なものとして、蛍光、リン光、もしくは発光の性質に基づいて検出可能な物質を前記した抗体、リガンド、レクチン等の特定物質と特異的に結合可能な物質とを結合したものが例示できる。
【0062】
標識物質としては、標識物質自体、例えば蛍光、もしくはリン光を発するか、又は発光する物質、例えば蛍光色素等を特定物質と特異的に結合可能なものに結合したものが挙げられる。また、標識物質は、光を発する反応、例えば蛍光、もしくはリン光を発する物質を生成する反応、又は発光反応を触媒する物質を特定物質と特異的に結合可能なものに結合したものであってもよい。例えば蛍光色素としては、FITC(フルオレセインイソシアネート)、PE(フィコエリスリン)、ローダミン等が挙げられる。また、前記反応を触媒する物質としては、パーオキシダーゼ、β−ガラクトシダーゼ、アルカリフォスファターゼ、ルシフェラーゼ等が挙げられる。なお、例えば特定物質が任意の物質とのみ反応し、その反応の結果光学的に検出可能なシグナルが発せられるような場合は、当該任意の物質そのものを標識物質としても良い。
【0063】
また、蛍光、リン光、又は発光を阻害するクエンチャーと特定物質に特異的に結合する物質とを結合した標識物質の使用を例示することができる。この場合は、生体試料を、蛍光、リン光又は発光する物質で染色しておき、当該標識物質を更に反応させると、特定物質を有する生体試料が固定された保持孔からの蛍光、リン光又は発光がクエンチャーによって減少するため、この減少を検出すれば良い。なお、生体試料中の全細胞に汎用性の(共通の)マーカーに結合する物質と、蛍光、リン光又は発光する物質とを結合したものと前記標識物質を組み合わせて使用することが例示できる。
【0064】
標識物質は、前記した通り、それ自体が特定物質と結合又は反応するものであっても、特定物質に特異的に結合する物質と光学的に検出可能なシグナルを発する物質とを結合したものであっても良い。光学的に検出可能なシグナルを発する物質を特定物質と特異的に結合する物質と結合する場合は、両者を公知の化学的な方法等によって直接結合しても良いし、特定物質と特異的に結合する物質に対して結合する物質を介して間接的に結合しても良い。例えば、特定物質と特異的に結合する物質が抗体である場合は、抗体の調製に用いた動物のイムノグロブリンに対する抗体、又はプロテインAもしくはプロテインGとシグナルを発生する物質を結合することが挙げられる。また、特定物質に特異的に結合する物質とビオチンを結合しておき、シグナルを発生する物質をアビジン又はストレプトアビジンと結合しておくことも例示できる。この場合、シグナルを発生する物質と結合したアビジン又はストレプトアビジンは、特定物質に特異的に結合した物質と結合されたビオチンと結合し、結果的に(特定物質)−(特定物質に特異的に結合する物質)−(ビオチン)−(アビジン又はストレプトアビジン)−(シグナルを発生する物質)という複合体を形成することにより、特定物質は間接的に標識される。このような間接的な場合もまた、
本発明にいう、特定物質に包含される。
【0065】
特定物質が核酸である場合は、シグナルを発生する物質と直接又は間接的に結合した(又は結合し得る)、かつ、該核酸に結合するプローブを用いたハイブリダイゼーション、又は、シグナルを発生する物質と直接又は間接的に結合した(又は結合し得る)プライマーを用いた該核酸の増幅によって、該核酸を検出することができる。核酸の増幅は、それ自体公知の手法であるPCR法、LAMP法、RT−PCR法、NASBA法、TMA法又はTRC法等を利用することができる。TaqMan法は、5´末端を蛍光物質で修飾し、3´末端をクエンチャー物質で修飾したオリゴヌクレオチドをプローブとして利用する。このプローブは、蛍光物質とともに、クエンチャー物質が近傍にあるので、蛍光の発生は抑制されている。PCRの伸長反応のステップのときに、TaqDNAポリメラーゼのもつ5’→3’エキソヌクレアーゼ活性により、標的核酸にハイブリダイズしたTaqManプローブが分解されると、蛍光色素がプローブから遊離し、クエンチャーによる抑制が解除されて蛍光が発生する。核酸としては、DNA又はRNAが挙げられる。RNAを増幅する場合は、RNAを鋳型に逆転写反応を行い、生成したcDNAをPCR法により増幅すればよい(RT−PCR)。また、シグナルを発生する物質は、前記と同様、蛍光、リン光、又は発光を阻害するクエンチャーを組み合わせたものであってもよい。
【0066】
上記のように、増幅反応により生じた核酸に結合するプライマーも、本発明にいう、特定物質に特異的に結合する物質に包含される。
【0067】
標的試料である細胞をPCRにより検出する場合、PCR反応における加熱及び冷却は、サーマルサイクラーのヒートブロック上に粒子固定用構造体を載置して行ってもよく、本発明の生体試料解析装置にヒートブロックを設け、該ヒートブロック上で行ってもよい。
【0068】
標識物質により発せられる光、すなわち、標識物質から発せられる光、又は標識物質により触媒される反応によって発せられる光は、被検体粒子を構成する成分、すなわち特定物質の存在を示す。
【0069】
図11は、本発明の生体試料解析装置の応用例を示すものである。例えば癌などの異常細胞32の存在が疑われる懸濁液を生体試料解析装置に供し、細胞を保持孔に捕捉する。一方で当該検出の目的となる異常細胞32の表面または内部の特定物質を検出する標識物質を導入し、異常細胞を検出する。さらに、蛍光顕微鏡33にて検出された癌などの異常細胞を生体試料採取手段34としてマイクロピペットで採取し、詳細な生体試料の解析が可能である。
【0070】
上記では生体試料採取手段としてマイクロピペットを説明したが、生体試料採取手段は生体試料を採取することができれば特に制限はなく、マイクロピペット以外にも、電気浸透流を利用して精密に生体試料を採取可能な生体試料採取手段を用いることができる。
【0071】
本発明の生体試料解析装置の他の応用例として、生体試料を破砕するための破砕手段を備えていてもよい。破砕手段は、生体試料を破砕して生体試料に含まれる核酸を生体試料外部に溶出することができれば特に制限はない。例えば、一対の電極と該電極に直流電圧又は1ヘルツ程度の低い周波数の交流電圧を印加するための電源からなり、保持部の保持孔に固定された生体試料に電圧を印加する手段を例示することができる。生体試料が細胞壁を有さない細胞であれば、細胞膜に1ボルト程度の電圧を印加することにより、当該細胞を破砕することが可能である。なお当該手段における一対の電極としては、生体試料に誘電泳動力を作用させて保持部に移動させるための電極を兼用することができる。また例えば、前記保持部の保持孔に固定された生体試料を加熱する加熱手段を例示することがで
きる。数分程度、90℃の温度条件下におくことにより、生体試料を破砕することが可能である。また例えば、保持部の保持孔に固定された生体試料を振動する超音波発生手段を例示することができる。100から200ワットの出力で、20から40キロヘルツの振動を連続的に又は間欠的に与えることにより、生体試料を破砕することが可能である。例示した電圧を印加する手段、加熱手段そして超音波発生手段は択一的にしか利用できないものではく、例えば、加熱手段と超音波発生手段の両方を利用する、ということも可能である。
【0072】
破砕された生体試料から溶出した核酸をPCR法で増幅した後に検出する場合、まず、生体試料を保持部の保持孔に固定した後、例えば収容部にPCR反応を生じさせるためのプライマー、酵素、酵素基質等を含む反応液を供し、収容部に連通する保持孔に存在する溶液(生体細胞を懸濁するために使用した液)を反応液に置換する。PCR反応では保持孔に固定した生体試料から溶出した遺伝子を90℃程度にまで昇温するが、その時保持孔の内部で熱対流が起こり、保持孔内の生体試料由来の遺伝子が保持孔外へ拡散し、隣接する保持孔内の生体試料懸濁液を汚染する可能性があるため、溶液置換が完了した段階で保持孔にシリコンオイル等を滴下するとともに、PCR反応液の中に温度応答性高分子を添加してかかる熱対流を抑制することが好ましい。なお、生体試料をPCR反応のための反応液に懸濁して誘電泳動により保持孔に移動しようとすると、PCR反応のための反応液中に含まれる各種電解質のために電圧を印加すると過電流となり、発熱による熱対流が発生して生体試料を保持部分に移動して固定することが困難になるため、かかる溶液置換を行うことが好ましい。封止を行った後、前述した破砕を行って核酸の検出を行う。
【0073】
<効果>
上述した本発明の実施形態に係る構造体、並びにそれを用いた固定装置及び解析装置は、以下の効果を奏するものである。
【0074】
本実施形態の構造体及びそれを用いた固定装置は、保持部に設けた各保持孔に対して1つの粒子を速やかに固定することができる。また、複数の保持孔がアレイ状に配置されているため、複数の粒子を1つずつ分離してアレイ状に固定することができ、個々の粒子の解析を一括して行うことが容易となる。さらに、遮光膜を設けたことにより、バックグラウンドノイズやクロストークノイズなどの光ノイズを低減することができ、保持孔内の観察対象物質により発せられる光のみを高感度かつ高精度に検出することができる。そして高感度かつ高精度の光検出が可能であることから、検出時間の短縮を図ることも可能となる。
【0075】
<実施例>
以下、本発明を実施例に基づいて更に詳細に説明する。ただし、本発明は以下の実施例に限定されるものではない。
【0076】
(実施例1)
実施例1においては、図7に示す構造体及び固定装置を使用する。
【0077】
下部電極基板36を構成する透光性の基板15には、縦78mm×横56mm×厚さ1mmのガラス基板を用いる。スペーサー16は、保持部上に縦20mm×横20mm×厚さ1.5mmの収容部を形成するように、シリコンシートによって作製する。また、スペ
ーサー16には、生体試料を含む懸濁液を導入、排出するための導入口24と排出口25を設ける。
【0078】
複数の保持孔9を有する保持部(絶縁体膜18)は、図12Aから図12Bに示すフォトリソグラフィーとエッチングによる方法により、下部電極基板上に一体的に形成する。
まず、ガラス基板30の第1面にITO37を成膜し、反対側の第2面に、スパッタにより膜厚100nmのCr38を成膜する。次に、成膜したCrの上にスピンコーターを用いて1μmの膜厚になるようレジスト40を塗布し、1分自然乾燥後、ホットプレートを用いてプリベーク(95℃、3分)を行う。レジストにはエポキシ系のネガ型レジストを用いる。次に、縦30mm×横30mmのエリアに、直径φ8.5μmの微細孔を50μmの間隔で縦600個×横600個のアレイ状に並べたパターンを描いた露光用フォトマスク41を用いて、UV露光機にてレジスト40を露光42し、現像液43で現像する。露光時間と現像時間は、保持孔の深さがレジスト40の膜厚と等しい1μmになるように調整する。その後、ホットプレートを用いてポストベーク(180℃、30分)を行い、レジスト構造を固める。その後、30%硝酸二アンモニウムセリウム液49により、露出したCr膜を剥離して開口部29を形成し、開口部29の底面にガラス基板30が露出するようにする。次に、レジストをリムーバー54により剥離する。このCr膜38が、遮光膜となる。
【0079】
次に、図12Bに示すように、ITO37の成膜面上にスピンコーターを用いて5μmの膜厚になるようレジスト46を塗布し、1分自然乾燥後、ホットプレートを用いてプリベーク(105℃、15分)を行う。レジストにはポジ型のものを用いる。その後、開口部29が形成されたCr膜38をフォトマスクとして用い、UV露光機にてレジスト46を露光42し、現像液47で現像する。露光時間と現像時間は、孔の深さがレジスト46の膜厚と等しい5μmになるように調整し、孔9の底面にITO37が露出するようにする。現像後、ホットプレートを用いてポストベーク(180℃、30分)を行い、レジスト構造を固める。これにより、ITO37とガラス基板30からなる下部電極基板と、複数の保持孔9が形成された保持部(絶縁体膜)46と、保持孔9に対応する位置に開口部29が形成された遮光膜(Cr膜)38とを備える構造体44が得られる。
【0080】
このようにして作製した構造体上の保持部の上に、図7に示すようにスペーサー16を積層し圧着する。シリコンシートの表面は粘着性があるため、圧着することでスペーサー16と保持部(絶縁体膜19)とを貼り合わせることができる。スペーサー16の収容部の面積が縦20mm×横20mmであることから、この収容部内に存在する保持孔9の数は約16万個である。スペーサー16の上に上部電極基板35を配置し、上部電極基板35と下部電極基板36のそれぞれに導電線3を介して電源(信号発生器)4を接続する。
【0081】
生体試料には、マウス脾臓細胞(粒径約6μm)を用い、300mMの濃度のマンニトール水溶液に懸濁させ、2.7×105個/mLの密度になるように細胞懸濁液を調製す
る。
【0082】
続いて上記細胞懸濁液600μLをスペーサー16の導入口24よりシリンジを用いて注入し(導入細胞数:約16万個)、信号発生器により電圧20Vpp、周波数3MHzの矩形波交流電圧を電極間に印加する。これにより、2から3秒程度の極めて短い時間で、アレイ状に形成した複数の保持孔のそれぞれに1つずつ細胞を固定することができる。なお、「固定する」とは、保持孔に細胞が入ったことを意味し、以下の比較例でも同じ定義とする。このときの、1つの保持孔に概ね1つの細胞が入る生体試料固定率は約90%である。なお生体試料固定率とは、顕微鏡の視野に縦15個×横15個の225個の保持孔が見えるようにし、生体試料を導入して固定したときの、1個の生体試料が入った保持孔の数を225で割った値で定義する。生体試料固定率の算出方法は以下の実施例と比較例でも同じである。
【0083】
次に収容部へ2.5×10-4%濃度のポリ−L−リジンを600μL注入し、3分静
置後、電圧の印加を停止する。次に、リン酸緩衝液(pH7.2)を注入して収容部内のポリ−L−リジンを洗浄することで、保持孔内へ細胞を静電気的に結合することができる
。
【0084】
続いてマウス脾臓細胞集団中のB細胞を検出する。B細胞を検出するための標的となる特定物質はB細胞表面に存在するCD19分子とする。CD19分子は、B細胞表面レセプターであり、幹細胞の段階から最終的には形質細胞に分化するB系統細胞の分化全体を通して細胞において見出され、そのB系統細胞としては、プレB細胞、B細胞(ナイーブB細胞、抗原刺激性B細胞、メモリーB細胞、プラズマ細胞、およびBリンパ球を含む)および濾胞性樹状細胞が挙げられる。
【0085】
次に標識物質であるPE標識−CD19抗体(Miltenyi Biotec, Bergisch Gladbach, Germany)を600μL収容部へ送液し、抗原抗体反応によるB細胞の標識を行った後(4℃、10分)、リン酸緩衝液にて洗浄し、B細胞検出を実施する。標識されたB細胞は、蛍光顕微鏡(U−RFL−T/IX71、オ
リンパス、日本)を通じてCCDカメラにより観察する。これにより、標識を行う前の細胞の蛍光顕微鏡像と比較して、標識を行った後はB細胞表面の蛍光強度のみが増加し、B細胞を検出することができる。
【0086】
(実施例2)
実施例2においては、図4に示す構造体及び固定装置を使用する。
【0087】
透光性の基板15には、縦70mm×横40mm×厚さ1mmのガラス基板を用いる。スペーサー16は、縦40mm×横40mm×厚さ1.5mmのシリコンシートの中央を縦20mm×横20mmにくりぬいて作製する。また、図4に示すように、生体試料を含む懸濁液を導入、排出するための導入口24と排出口25をスペーサー16に設ける。複数の保持孔9を有する保持部(絶縁体膜18)と櫛状電極21、並びに、複数の開口部29を有する遮光膜19は、図13A〜図13Cに示すフォトリソグラフィーとエッチングによる方法によりガラス基板上に一体的に形成した。
【0088】
図13Aに示すように、ガラス基板30の片面に、スパッタにより膜厚100nmのCr8を成膜する。次に、成膜したCrの上にスピンコーターを用いて1μmの膜厚になるようレジスト40を塗布し、1分自然乾燥後、ホットプレートを用いてプリベーク(105℃、15分)を行う。レジストにはエポキシ系のネガ型のものを用いる。
【0089】
次に、縦30mm×横30mmのエリアに、直径φ8.5μmの微細孔を50μmの間隔で縦600個×横600個のアレイ状に並べたパターンを描いた露光用フォトマスク41を用いて、UV露光機にてレジスト40を露光42し、現像液43で現像する。露光時間と現像時間は、保持孔の深さがレジスト40の膜厚と等しい1μmになるように調整する。その後、ホットプレートを用いてポストベーク(180℃、30分)を行い、レジスト構造を固める。その後、30%硝酸二アンモニウムセリウム液49により、露出したCr膜を剥離して開口部29を形成し、開口部29の底面にガラス基板30が露出するようにする。次に、レジストをリムーバー54により剥離する。このCr膜38が、遮光膜となる。
【0090】
次に、図13Bに示すように、ガラス基板30のCr膜38とは反対側の面に、スパッタにより膜厚100nmのITO37を成膜する。成膜したITO37の上にスピンコーターを用いて1μmの膜厚になるようレジスト46を塗布し、1分自然乾燥後、ホットプレートを用いてプリベーク(105℃、15分)を行う。レジストにはポジ型のものを用いる。
【0091】
次に、縦30mm×横30mmのエリアに、幅10μmの帯状電極aと幅10μmの帯
状電極bを50μm間隔で形成した櫛状電極パターンを描いた露光用フォトマスク39を用いて、UV露光機にてレジスト46を露光42し、現像液47で現像する。露光時間と現像時間は、現像により剥離する膜厚がレジストの膜厚と等しい1μmになるように調整し、現像後、ITOエッチング液(ITO−Etchant,和光純薬工業)48により、露出したITO膜37を剥離する。次に、レジスト36をリムーバー55により剥離する。これにより、ガラス基板30のCr膜38とは反対側の面にITOの櫛状電極21が形成される。
【0092】
次に、図13Cに示すように、ITO37の成膜面上にスピンコーターを用いて5μmの膜厚になるようレジスト46を塗布し、1分自然乾燥後、ホットプレートを用いてプリベーク(95℃、3分)を行う。レジストにはポジ型のものを用いる。その後、開口部29が形成されたCr膜38をフォトマスクとして用い、UV露光機にてレジスト46を露光42し、現像液47で現像する。露光時間と現像時間は、孔の深さがレジスト46の膜厚と等しい5μmになるように調整し、孔9の底面に櫛状電極21が露出するようにする。現像後、ホットプレートを用いてポストベーク(180℃、30分)を行い、レジスト構造を固める。これにより、ITOの櫛状電極21とガラス基板30からなる電極基板と、複数の保持孔9が形成された保持部(絶縁体膜)46と、保持孔9に対応する位置に開口部29が形成された遮光膜(Cr膜)38とを備える構造体50が得られる。
【0093】
このようにして作製した構造体の保持部の上に、図4に示すようにスペーサー16を積層し圧着する。シリコンシートの表面は粘着性があるため、圧着することでスペーサー16と保持部(絶縁体膜19)とを貼り合わせることができる。スペーサー16の収容部の面積が縦20mm×横20mmであることから、この収容部内に存在する保持孔9の数は約16万個である。櫛状電極を構成する一対の電極のそれぞれに導電線3を介して電源(信号発生器)を接続する。
【0094】
生体試料には、マウス脾臓細胞(粒径約6μm)を用い、300mMの濃度のマンニトール水溶液に懸濁させ、2.7×105個/mLの密度になるように細胞懸濁液を調製す
る。
【0095】
続いて上記細胞懸濁液600μLをスペーサー16の導入口24よりシリンジを用いて注入し(導入細胞数:約16万個)、信号発生器により電圧20Vpp、周波数3MHzの矩形波交流電圧を電極間に印加する。これにより、2から3秒程度の極めて短い時間で、アレイ状に形成した複数の保持孔のそれぞれに1つずつ細胞を固定することができる。次に、収容部へ2.5×10-4%濃度のポリ−L−リジンを600μL注入し、3分静
置後、電圧の印加を停止する。次に、リン酸緩衝液(pH7.2)を注入して収容部内のポリ−L−リジンを洗浄することで、保持孔内へ細胞を静電気的に結合することができる。
【0096】
続いてマウス脾臓細胞集団中のB細胞を検出する。B細胞を検出するための標的となる特定物質はB細胞表面に存在するCD19分子とする。CD19分子は、B細胞表面レセプターであり、幹細胞の段階から最終的には形質細胞に分化するB系統細胞の分化全体を通して細胞において見出され、そのB系統細胞としては、プレB細胞、B細胞(ナイーブB細胞、抗原刺激性B細胞、メモリーB細胞、プラズマ細胞、およびBリンパ球を含む)および濾胞性樹状細胞が挙げられる。
【0097】
次に標識物質であるPE標識−CD19抗体(Miltenyi Biotec, Bergisch Gladbach, Germany)を600μL収容部へ送液し、抗原抗体反応によるB細胞の標識を行った後(4℃、10分)、リン酸緩衝液にて洗浄、B細胞検出を実施する。標識されたB細胞は、蛍光顕微鏡(U−RFL−T/IX71、オリ
ンパス、日本)を通じてCCDカメラにより観察する。これにより、標識を行う前の細胞の蛍光顕微鏡像と比較して、標識を行った後はB細胞表面の蛍光強度のみが増加し、B細胞を検出することができる。
【0098】
図11に示すように、生体試料採取手段34を設置した。生体試料採取手段には、電気浸透流を利用して精密に生体試料を採取可能なピペットを用いる。これにより、顕微鏡33で観察しながら、蛍光標識抗体にて検出したB細胞を採取する事ができる。
【0099】
(実施例3)
実施例1と同様の構造体及び固定装置を用いて、保持孔1つに固定された1つの標識細胞の検出精度を以下のとおり確認することができる。
【0100】
まずマウス脾臓細胞の一部をCellTracker Green CMFDA(Invitrogen)により染色する。検出する試料は、前記CellTracker Gr
een CMFDAにより染色した細胞と非染色のマウス脾臓細胞(粒径約6μm)を3
:7で混合した試料を用い、2.7×105個/mLの密度になるように細胞懸濁液を調
製する。
【0101】
続いて上記細胞懸濁液600μLをスペーサー16の導入口24よりシリンジを用いて注入し(導入細胞数:約16万個)、信号発生器により電圧20Vpp、周波数3MHzの矩形波交流電圧を電極間に印加し、複数の保持孔のそれぞれに1つずつ細胞を固定する。次に収容部へ2.5×10-4%濃度のポリ−L−リジンを600μL注入し、3分静
置後、電圧の印加を停止する。次に、リン酸緩衝液(pH7.2)を注入して収容部内のポリ−L−リジンを洗浄することで、保持孔内へ細胞を静電気的に結合する。
【0102】
CellTracker Green CMFDAにより染色した細胞は、蛍光顕微鏡(U−RFL−T/IX71、オリンパス、日本)を通じてCCDカメラにより観察する。
これにより、保持孔に固定された複数の脾臓細胞の中から、標識された細胞の蛍光を検出することができる。
【0103】
(比較例)
比較のため、遮光膜を設けていない構造体を用い、下記操作を行った。はじめに上記脾臓細胞懸濁液600μL(細胞数:約16万個)をスペーサーの導入口よりシリンジを用いて注入し、信号発生器により電圧20Vpp、周波数3MHzの矩形波交流電圧を電極間に印加したところ、2から3秒程度の極めて短い時間で、複数の保持孔のそれぞれに1つずつ細胞を固定することができた。
【0104】
次に収容部へ2.5×10-4%濃度のポリ−L−リジンを600μL注入し、3分静
置後、電圧の印加を停止した。次に、リン酸緩衝液(pH7.2)を注入して収容部内のポリ−L−リジンを洗浄することで、貫通孔内へ細胞を静電気的に結合することができた。
【0105】
続いてマウス脾臓細胞集団中のB細胞を検出した。実施例1と同様にB細胞を検出するための標的となる特定物質をB細胞表面に存在するCD19分子とし、標識物質であるPE標識−CD19抗体(Miltenyi Biotec, Bergisch Gladbach, Germany)によるB細胞の標識を行った(4℃、10分)。標識されたB細胞は、蛍光顕微鏡(U−RFL−T/IX71、オリンパス、日本)を通じてCCD
カメラにより観察した。その結果、保持孔周辺の絶縁体膜(高分子膜)からの蛍光散乱による光ノイズが大きく、保持孔内に固定されたB細胞表面の蛍光を精度良く検出することができなかった。
【符号の説明】
【0106】
2:生体試料
3:導電線
4:交流電源
9:保持孔
12:電気力線
14:粒子固定用構造体
15:基板
16:スペーサー
17:上蓋
18:絶縁体膜
19:遮光膜
20:保持部
21:櫛状電極
22:電極
23:電極
24:導入口
25:排出口
26:誘電泳動力
27:生体試料と結合する物質
28:生体試料
30:ガラス基板
31:標識物質
32:異常細胞
33:蛍光顕微鏡
34:生体試料採取手段
35:上部電極基板
36:下部電極基板
37:ITO
38:Cr
39:露光用フォトマスク(櫛状パターン)
40:レジスト(ネガ型)
41:露光用フォトマスク(微細孔パターン)
42:露光
43:現像液(ネガ型)
44:下部電極基板と保持部と遮光膜を備える構造体
45:収容部(空間)
46:レジスト(ポジ型)
47:現像液(ポジ型)
48:ITOエッチング液
49:硝酸アンモニウムセリウム液
50:櫛状電極基板と保持部と遮光膜を備える構造体
54:リムーバー(ネガ型レジスト用)
55:リムーバー(ポジ型レジスト用)
56:保持孔の間(絶縁体膜)
【特許請求の範囲】
【請求項1】
被検体粒子を構成する成分の存在を示す物質により発せられる光を検出するために該被検体粒子をそれぞれ保持する複数の保持孔を有する粒子固定用構造体であって、
平板状の透光性の基板と、
前記基板の第1面上に配置され、前記複数の保持孔が形成された保持部と、
前記基板の前記第1面とは反対側の第2面上に配置される遮光膜と、を備え、
前記保持孔は、前記保持部の上表面に開口し、かつ、前記基板の第1面まで延在しており、
前記遮光膜は、前記複数の保持孔に対応する位置に、前記基板の第2面を露出させる複数の開口部を有している、
粒子固定用構造体。
【請求項2】
前記遮光膜は、前記基板の第2面のうち前記複数の保持孔に対応する領域以外の領域を全部覆っている、
請求項1に記載の粒子固定用構造体。
【請求項3】
前記保持部の上に配置され、前記被検体粒子を含む懸濁液を収容する収容部を、更に備え、
前記保持孔は、前記収容部と連通する、
請求項1又は請求項2に記載の粒子固定用構造体。
【請求項4】
前記基板の第1面上に、互いに異なる保持孔に対応する位置にそれぞれ配置される一対の電極が設けられ、
前記保持部は絶縁体膜からなり、前記保持孔は、前記絶縁体膜の上表面から前記基板上の電極まで延在する、
請求項1から請求項3の何れか一項に記載の粒子固定用構造体。
【請求項5】
前記基板の第1面上に、前記保持孔に対応する位置に配置される第1の電極が設けられるとともに、前記保持部は絶縁体膜からなり、前記保持孔は、前記絶縁体膜の上表面から前記基板上の第1の電極まで延在し、
前記保持部および前記収容部を挟んで前記第1の電極とは反対の側に第2の電極が設けられる、
請求項3に記載の粒子固定用構造体。
【請求項6】
前記基板の第1面上に設けられた電極は透明電極である、
請求項4又は請求項5に記載の粒子固定用構造体。
【請求項7】
請求項4から請求項6の何れか一項に記載の粒子固定用構造体と、
前記電極に誘電泳動力を発生させるための交流電圧を印加する電源と、
前記電源からの電圧印加後に、前記粒子固定用構造体の保持孔に保持された前記被検体粒子を構成する成分の存在を示す物質により発せられる光を検出する検出部と、
を備える、粒子解析装置。
【請求項8】
請求項1から請求項6の何れか一項に記載の粒子固定用構造体、又は請求項7に記載の粒子解析装置の粒子固定用構造体上の保持孔に被検体粒子を固定し、固定された被検体粒子を構成する成分の存在を示す物質により発せられる光を検出することを特徴とする、被検体粒子の解析方法。
【請求項9】
前記被検体粒子を構成する成分の存在を示す物質は、該成分に特異的に結合する標識物
質である、請求項8に記載の解析方法。
【請求項1】
被検体粒子を構成する成分の存在を示す物質により発せられる光を検出するために該被検体粒子をそれぞれ保持する複数の保持孔を有する粒子固定用構造体であって、
平板状の透光性の基板と、
前記基板の第1面上に配置され、前記複数の保持孔が形成された保持部と、
前記基板の前記第1面とは反対側の第2面上に配置される遮光膜と、を備え、
前記保持孔は、前記保持部の上表面に開口し、かつ、前記基板の第1面まで延在しており、
前記遮光膜は、前記複数の保持孔に対応する位置に、前記基板の第2面を露出させる複数の開口部を有している、
粒子固定用構造体。
【請求項2】
前記遮光膜は、前記基板の第2面のうち前記複数の保持孔に対応する領域以外の領域を全部覆っている、
請求項1に記載の粒子固定用構造体。
【請求項3】
前記保持部の上に配置され、前記被検体粒子を含む懸濁液を収容する収容部を、更に備え、
前記保持孔は、前記収容部と連通する、
請求項1又は請求項2に記載の粒子固定用構造体。
【請求項4】
前記基板の第1面上に、互いに異なる保持孔に対応する位置にそれぞれ配置される一対の電極が設けられ、
前記保持部は絶縁体膜からなり、前記保持孔は、前記絶縁体膜の上表面から前記基板上の電極まで延在する、
請求項1から請求項3の何れか一項に記載の粒子固定用構造体。
【請求項5】
前記基板の第1面上に、前記保持孔に対応する位置に配置される第1の電極が設けられるとともに、前記保持部は絶縁体膜からなり、前記保持孔は、前記絶縁体膜の上表面から前記基板上の第1の電極まで延在し、
前記保持部および前記収容部を挟んで前記第1の電極とは反対の側に第2の電極が設けられる、
請求項3に記載の粒子固定用構造体。
【請求項6】
前記基板の第1面上に設けられた電極は透明電極である、
請求項4又は請求項5に記載の粒子固定用構造体。
【請求項7】
請求項4から請求項6の何れか一項に記載の粒子固定用構造体と、
前記電極に誘電泳動力を発生させるための交流電圧を印加する電源と、
前記電源からの電圧印加後に、前記粒子固定用構造体の保持孔に保持された前記被検体粒子を構成する成分の存在を示す物質により発せられる光を検出する検出部と、
を備える、粒子解析装置。
【請求項8】
請求項1から請求項6の何れか一項に記載の粒子固定用構造体、又は請求項7に記載の粒子解析装置の粒子固定用構造体上の保持孔に被検体粒子を固定し、固定された被検体粒子を構成する成分の存在を示す物質により発せられる光を検出することを特徴とする、被検体粒子の解析方法。
【請求項9】
前記被検体粒子を構成する成分の存在を示す物質は、該成分に特異的に結合する標識物
質である、請求項8に記載の解析方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12A】


【図12B】


【図13A】


【図13B】


【図13C】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12A】


【図12B】


【図13A】


【図13B】


【図13C】


【公開番号】特開2012−13550(P2012−13550A)
【公開日】平成24年1月19日(2012.1.19)
【国際特許分類】
【出願番号】特願2010−150521(P2010−150521)
【出願日】平成22年6月30日(2010.6.30)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
【公開日】平成24年1月19日(2012.1.19)
【国際特許分類】
【出願日】平成22年6月30日(2010.6.30)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
[ Back to top ]

