粒子状アジュバントと免疫増強物質との組合せを含むインフルエンザワクチン
【課題】粒子状アジュバントと免疫増強物質との組合せを含むインフルエンザワクチンの提供。
【解決手段】不溶性粒子状アジュバントを含むインフルエンザワクチンは、主にTH2応答(IgG1)であるIgG応答を誘発することが見出されている。この応答は、組成物中に免疫増強物質を含むことによってTH1応答(IgG2a)へと移行され得る。したがって、本発明は、(i)インフルエンザウイルス抗原;と(ii)不溶性粒子状アジュバント;と(iii)免疫増強物質;とを含む免疫原性組成物を提供する。本発明はまた、(i)インフルエンザウイルス抗原;と(ii)不溶性粒子状アジュバント;と(iii)免疫増強物質;とを合わせる工程を包含する、免疫原性組成物を調製するための方法を提供する。
【解決手段】不溶性粒子状アジュバントを含むインフルエンザワクチンは、主にTH2応答(IgG1)であるIgG応答を誘発することが見出されている。この応答は、組成物中に免疫増強物質を含むことによってTH1応答(IgG2a)へと移行され得る。したがって、本発明は、(i)インフルエンザウイルス抗原;と(ii)不溶性粒子状アジュバント;と(iii)免疫増強物質;とを含む免疫原性組成物を提供する。本発明はまた、(i)インフルエンザウイルス抗原;と(ii)不溶性粒子状アジュバント;と(iii)免疫増強物質;とを合わせる工程を包含する、免疫原性組成物を調製するための方法を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
明細書中に引用されるすべての文書は、その全体が参考として援用される。
【0002】
(技術分野)
本発明は、インフルエンザウイルス感染を防御するためのアジュバントワクチン(adjuvanted vaccine)の分野にある。
【背景技術】
【0003】
(背景技術)
MF59水中油型エマルションアジュバント[非特許文献1]を使用するFLUADTM製品(Chiron Vaccines)を除いて、インフルエンザワクチンは、現在、一般的使用においてアジュバントを含まない。これらのワクチンは、参考文献2の第17章および第18章においてさらに詳細に記載される。それらのワクチンは、生ウイルス(live virus)または不活化ウイルスに基づき、そして不活化ワクチンは、全ウイルス(whole virus)、「スプリット」ウイルス(「split」virus)または精製された表面抗原(赤血球凝集素およびノイラミニダーゼを含む)に基づき得る。赤血球凝集素(HA)は、不活化インフルエンザワクチンにおける主要な免疫原であり、そしてワクチン用量は、HAレベルへの参照によって標準化され、そのワクチンは、代表的に、1株あたり約15μgのHAを含む。
【0004】
流行性のインフルエンザ感染において、多数の用量のインフルエンザワクチンが必要とされるが、多大な要求を満たすためにワクチンの供給を増大させることは、困難である。したがって、より多くのワクチン抗原を産生するよりも、1株あたりより低い量の抗原を使用すること、および減少した抗原用量を補うためにアジュバントを使用することが、提案されている。大流行間期に同じアプローチを使用すること(例えば、製造レベルを増大させることなく集団をより広く網羅することを可能にすること)がまた、提案されている。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Freyら、Vaccine、2003年、第21号、p.4234−7
【発明の概要】
【発明が解決しようとする課題】
【0006】
不溶性粒子状アジュバント[3](例えば、アルミニウム塩[4〜7]または微粒子[8])は、インフルエンザワクチンを改良するために提案されている。これらのアジュバントワクチンは、有用であるが、改良の余地が、存在し続ける。したがって、さらなるアジュバントインフルエンザワクチンおよび改良されたアジュバントインフルエンザワクチン(流行中における使用および大流行の間の使用の両方のため)、ならびにそれらの調製のための方法を提供することが、本発明の目的である。
【課題を解決するための手段】
【0007】
(発明の開示)
不溶性粒子状アジュバントを含むインフルエンザワクチンは、主にTH2応答(IgG1)であるIgG応答を誘発することが見出されている。この応答は、組成物中に免疫増強物質を含むことによってTH1応答(IgG2a)へと移行され得る。TH1型応答は、インフルエンザウイルスに対する異種サブタイプ免疫(heterosubtypic
immunity)を改良することが報告されている[9]。有利にも、上記免疫増強物質はまた、赤血球凝集力価および抗赤血球凝集素ELISA力価の上昇が見出されている。
【0008】
したがって、本発明は、(i)インフルエンザウイルス抗原;と(ii)不溶性粒子状アジュバント;と(iii)免疫増強物質;とを含む免疫原性組成物を提供する。
【0009】
本発明はまた、(i)インフルエンザウイルス抗原;と(ii)不溶性粒子状アジュバント;と(iii)免疫増強物質;とを合わせる工程を包含する、免疫原性組成物を調製するための方法を提供する。
【0010】
本発明は、(i)インフルエンザウイルス抗原を含む第1のキット成分;と(ii)不溶性粒子状アジュバントを含む第2のキット成分;とを備えるキットを提供し、(a)上記第1の成分または上記第2の成分は、免疫増強物質を含むか、あるいは(b)上記キットは、免疫増強物質を含む第3のキット成分を含むかのいずれかである。
例えば、本願発明は以下の項目を提供する。
(項目1)
(i)インフルエンザウイルス抗原;と(ii)不溶性粒子状アジュバント;と(iii)免疫増強物質;とを含む、免疫原性組成物。
(項目2)
前記インフルエンザウイルス抗原は、不活化ウイルスである、項目1に記載の組成物。
(項目3)
前記インフルエンザウイルス抗原は、全ウイルス、スプリットウイルス、または精製された表面抗原を含む、項目1に記載の組成物。
(項目4)
前記インフルエンザウイルス抗原は、H1、H2、H3、H5、H7またはH9のインフルエンザA型ウイルスサブタイプ由来である、項目1〜3のいずれかに記載の組成物。
(項目5)
前記インフルエンザウイルス抗原は、細胞培養物において増殖されたインフルエンザウイルスから調製される、項目1〜4のいずれかに記載の組成物。
(項目6)
前記インフルエンザウイルス抗原は、卵において増殖されたインフルエンザウイルスから調製される、項目1〜5のいずれかに記載の組成物。
(項目7)
前記組成物は、オボアルブミン、オボムコイドおよびニワトリDNAを含まない、項目1〜5のいずれか1項に記載の組成物。
(項目8)
前記組成物は、前記細胞培養物の宿主由来の10ng未満の細胞DNAを含む、項目5または項目7に記載の組成物。
(項目9)
前記組成物は、100ヌクレオチド以上である10ng未満のDNAを含む、項目5または項目7に記載の組成物。
(項目10)
前記組成物は、1ウイルス株あたり0.1μgと20μgとの間の赤血球凝集素を含む、項目1〜9のいずれかに記載の組成物。
(項目11)
前記不溶性粒子状アジュバントは、アルミニウム塩;カルシウム塩;および微粒子;からなる群より選択される、項目1〜10のいずれかに記載の組成物。
(項目12)
前記不溶性粒子状アジュバントは、水酸化アルミニウムを含む、項目11に記載の組成物。
(項目13)
前記不溶性粒子状アジュバントは、リン酸アルミニウムを含む、項目11または項目12に記載の組成物。
(項目14)
前記不溶性粒子状アジュバントは、リン酸カルシウムを含む、項目11に記載の組成物。
(項目15)
前記不溶性粒子状アジュバントは、ポリ(ラクチド−co−グリコリド)から作製された微粒子を含む、項目11に記載の組成物。
(項目16)
前記免疫増強物質は、ヒトTLR1、ヒトTLR2、ヒトTLR3、ヒトTLR4、ヒトTLR7、ヒトTLR8、および/またはヒトTLR9のうちの1つ以上のアゴニストである、項目1〜15のいずれかに記載の組成物。
(項目17)
前記免疫増強物質は、免疫刺激性オリゴヌクレオチドである、項目1〜16のいずれかに記載の組成物。
(項目18)
不溶性粒子状アジュバント;および(iii)免疫増強物質。
(項目19)
(i)インフルエンザウイルス抗原;と(ii)不溶性粒子状アジュバント;と(iii)免疫増強物質;とを合わせる工程を包含する、免疫原性組成物を調製するための方法。
(項目20)
(i)インフルエンザウイルス抗原を含む第1のキット成分;と(ii)不溶性粒子状アジュバントを含む第2のキット成分;とを備えるキットであって、(a)該第1の成分または該第2の成分は、免疫増強物質を含むか、あるいは(b)該キットは、免疫増強物質を含む第3のキット成分を含むかのいずれかである、キット。
【図面の簡単な説明】
【0011】
【図1】図1は、異なる組成物によって免疫感作されたマウスについてのLog10血清抗体力価(ELISA)を示す。図1は、H1N1を示す。
【図2】図2は、異なる組成物によって免疫感作されたマウスについてのLog10血清抗体力価(ELISA)を示す。図2は、H3N2を示す。
【図3】図3は、異なる組成物によって免疫感作されたマウスについてのLog10血清抗体力価(ELISA)を示す。図3は、インフルエンザB型を示す。
【図4】図4は、HI力価を示す。前景のバーは、群1〜3であり、そして後景のバーは、群4〜6である。
【図5】図5は、IgGについてのGMT(AU/ml)を示す。各対の左のバーは、IgG1を示す;右のバーは、IgG2aを示す。
【発明を実施するための形態】
【0012】
(インフルエンザウイルス抗原)
本発明の組成物は、インフルエンザウイルス抗原を含む。上記抗原は、代表的に、インフルエンザビリオンから調製されるが、その代わりとして、赤血球凝集素などの抗原が、組換え宿主(例えば、バキュロウイルスベクターを使用した昆虫細胞株)において発現され、そして精製された形態で使用され得る[10、11]。しかし、一般に、抗原は、ビリオン由来である。
【0013】
上記抗原は、生ウイルスの形態、またはより好ましくは、不活化ウイルスの形態をとり得る。ウイルスを不活化するための化学的手段としては、以下の因子の1種以上の有効量による処理が挙げられる:洗浄剤、ホルムアルデヒド、ホルマリン、β−プロピオラクトン、またはUV光。不活化のためのさらなる化学的手段としては、メチレンブルー、ソラレン、カルボキシフラーレン(C60)または任意のその組合せによる処理が挙げられる。ウイルス不活化の他の方法は、当該分野において公知である(例えば、第二級エチルアミン、アセチルエチレンイミン、またはγ線照射など)。INFLEXALTM製品は、全ビリオン不活化ワクチンである。
【0014】
不活化ウイルスが使用される場合、上記ワクチンは、全ウイルス、スプリットウイルス、または精製された表面抗原(赤血球凝集素を含み、そして通常は、ノイラミニダーゼをまた含む)を含み得る。
【0015】
ビリオンは、種々の方法によってウイルス含有流体から回収され得る。例えば、精製プロセスは、ビリオンを破壊するための洗浄剤を含む直線ショ糖勾配溶液を使用したゾーン遠心分離を含み得る。次いで、抗原は、必要に応じた希釈後に、透析濾過(diafiltration)によって精製され得る。
【0016】
スプリットビリオン(split virion)は、ビリオンを洗浄剤(例えば、エチルエーテル、ポリソルベート80、デオキシコール酸塩、トリ−N−ブチルホスフェート、Triton X−100、Triton N101、臭化セチルトリメチルアンモニウム、Tergitol NP9など)により処理(「Tween−エーテル」分解(splitting)プロセスを含む)してサブビリオン調製物を産生することによって得られる。インフルエンザウイルスを分解する方法は、当該分野において周知である(例えば、参考文献12〜17などを参照のこと)。ウイルスの分解は、代表的に、破壊する濃度の分解剤(splitting agent)によって全ウイルスを破壊または断片化する(感染性であっても非感染性であってもよい)ことによって行われる。上記破壊は、ウイルスタンパク質の完全または部分的な可溶化をもたらし、ウイルスの完全性を変化させる。好ましい分解剤は、非イオン性界面活性剤およびイオン性(例えば、カチオン性)界面活性剤(例えば、アルキルグリコシド、アルキルチオグリコシド、アシル糖(acyl sugar)、スルホベタイン、ベタイン、ポリオキシエチレンアルキルエーテル、N,N−ジアルキル−グルカミド(Glucamide)、Hecameg、アルキルフェノキシポリエトキシエタノール、第四級アンモニウム化合物、サルコシル、CTAB(臭化セチルトリメチルアンモニウム)、トリ−N−ブチルホスフェート、Cetavlon、ミリスチルトリメチルアンモニウム塩、リポフェクチン(lipofectin)、リポフェクタミン(lipofectamine)、およびDOT−MA、オクチル−またはノニルフェノキシポリオキシエタノール(例えば、Triton X−100またはTriton N101などのTriton界面活性剤)、ポリオキシエチレンソルビタンエステル(Tween界面活性剤)、ポリオキシエチレンエーテル、ポリオキシエチレンエステルなどである。1つの有用な分解手順は、デオキシコール酸ナトリウムおよびホルムアルデヒドの継続的な効果を使用し、そして分解は、(例えば、ショ糖密度勾配溶液における)最初のビリオン精製の間に行われ得る。したがって、分解プロセスは、ビリオン含有材料の清澄化(非ビリオン材料を除去するため)、回収されたビリオンの濃縮(例えば、CaHPO4吸着などの吸着方法を使用する)、非ビリオン材料からの全ビリオン分離、密度勾配遠心分離工程(例えば、デオキシコール酸ナトリウムなどの分解剤を含むショ糖勾配を使用する)において分解剤を使用したビリオンの分解、および所望されない物質を除去するためのその後の濾過(例えば、限外濾過)を含み得る。スプリットビリオンは、通常、リン酸ナトリウムによって緩衝化された等張塩化ナトリウム溶液に再懸濁され得る。BEGRIVACTM製品、FLUARIXTM製品、FLUZONETM製品およびFLUSHIELDTM製品は、スプリットワクチン(split vaccine)である。
【0017】
精製された表面抗原ワクチンは、インフルエンザ表面抗原の赤血球凝集素、および代表的には、ノイラミニダーゼをまた含む。精製された形態でこれらのタンパク質を調製するためのプロセスは、当該分野において周知である。FLUVIRINTM製品、AGRIPPALTM製品およびINFLUVACTM製品は、サブユニットワクチンである。
【0018】
インフルエンザ抗原はまた、ビロソームの形態で提供され得る[18]。
【0019】
上記インフルエンザウイルスは、弱毒化され得る。上記インフルエンザウイルスは、温度感受性であり得る。上記インフルエンザウイルスは、低温適応性であり得る。これらの3つの可能性は、特に、生ウイルスに適合する。
【0020】
ワクチンに使用するためのインフルエンザウイルス株は、季節により変化する。最近の大流行間期において、ワクチンは、代表的に、2種のインフルエンザA型株(H1N1およびH3N2)および1種のインフルエンザB型株を含み、そして三価ワクチンが、代表的である。本発明はまた、(特に、インフルエンザA型ウイルスの)H2サブタイプ株、H5サブタイプ株、H7サブタイプ株またはH9サブタイプ株などの流行株(すなわちワクチンのレシピエントおよび一般的なヒト集団が免疫学的にナイーブである株)に由来するウイルスを使用し得、そして流行株に対するインフルエンザワクチンは、一価であっても、流行株によって補充された通常の三価ワクチンに基づいてもよい。しかし、季節および上記ワクチンに含まれる抗原の性質に依存して、本発明は、赤血球凝集素サブタイプであるH1、H2、H3、H4、H5、H6、H7、H8、H9、H10、H11、H12、H13、H14、H15またはH16の1種以上を防御し得る。本発明は、インフルエンザA型ウイルスのNAサブタイプであるN1、N2、N3、N4、N5、N6、N7、N8またはN9の1種以上を防御し得る。
【0021】
上記組成物に通常含まれ得る他の株は、抗ウイルス療法に対して抵抗性(例えば、オセルタミビル[19]および/またはザナミビルに対して抵抗性)の株であり得、その株は、抵抗性の流行株を含む[20]。
【0022】
本発明のアジュバント添加組成物は、流行株に対して免疫感作するために特に有用である。流行の発生を引き起こす可能性をインフルエンザ株に与えるインフルエンザ株の特性は、以下である:(a)そのインフルエンザ株が、最近広まっているヒト株における赤血球凝集素と比較して新規の赤血球凝集素(すなわち、10年以上にわたってヒト集団において顕性でない赤血球凝集素(例えばH2))を含むか、またはヒト集団において以前に全く見出されていない(例えば、一般には鳥類集団においてのみ見出されているH5、H6またはH9)ことにより、ヒト集団がその株の赤血球凝集素に対して免疫学的にナイーブであること;(b)そのインフルエンザ株が、ヒト集団において水平伝播し得ること;および(c)そのインフルエンザ株が、ヒトに対して病原性であること。H5型赤血球凝集素を有するウイルスは、流行性インフルエンザ(例えば、H5N1株)に対する免疫感作のために好ましい。他の可能性のある株としては、H5N3、H9N2、H2N2、H7N1およびH7N7、および任意の他の顕在する潜在的な流行株が挙げられる。H5サブタイプにおいて、ウイルスは、HAクレード1、HAクレード1’、HAクレード2またはHAクレード3に分類され得[21]、クレード1およびクレード3は、特に、関連性がある。
【0023】
本発明の組成物は、インフルエンザA型ウイルスおよび/またはインフルエンザB型ウイルスを含む1種以上(例えば1種、2種、3種、4種またはそれ以上)のインフルエンザウイルス株由来の抗原を含み得る。ワクチンが、1種より多い株のインフルエンザを含む場合、それらの異なる株は、代表的に、別個に増殖され、かつそれらのウイルスが回収された後に混合され、そして抗原が、調製される。したがって、本発明のプロセスは、1種より多いインフルエンザ株由来の抗原を混合する工程を含み得る。
【0024】
上記インフルエンザウイルスは、リアソータント(reassortant)株であり得、そして逆方向遺伝学技術によって得ることができた。逆方向遺伝学技術[例えば、22〜26]は、プラスミドを使用してインビトロで調製される所望のゲノムセグメントを有するインフルエンザウイルスを可能にする。代表的に、それは、(a)例えば、polIプロモーターにより、所望のウイルスRNA分子をコードするDNA分子を発現すること、および(b)例えば、polIIプロモーターにより、ウイルスタンパク質をコードするDNA分子を発現することを含むことで、細胞における両方の型のDNAの発現が、完全なインタクト感染性ビリオンの構築を生じる。上記DNAは、好ましくは、全ての上記ウイルスRNAおよびウイルスタンパク質の全てを提供するが、そのRNAおよびタンパク質のいくつかを提供するためにヘルパーウイルスを使用することもまた、可能である。各ウイルスRNAを産生するために別個のプラスミドを使用するプラスミドベースの方法が、好ましく[27〜29]、そしてこれらの方法はまた、上記ウイルスタンパク質の全てまたはいくつか(例えば、PB1タンパク質、PB2タンパク質、PAタンパク質およびNPタンパク質だけ)を発現するためのプラスミドの使用を包含し、12種のプラスミドが、いくつかの方法において使用される。
【0025】
必要とされるプラスミドの数を減少させるために、最近のアプローチ[30]は、(ウイルスRNA合成のための)同じプラスミド上の複数のRNAポリメラーゼI転写カセット(例えば、1種、2種、3種、4種、5種、6種、7種または8種全てのインフルエンザA型vRNAセグメントをコードする配列)と、別のプラスミド上のRNAポリメラーゼIIプロモーターを有する複数のタンパク質コード領域(例えば、1種、2種、3種、4種、5種、6種、7種または8種全てのインフルエンザA型mRNA転写物をコードする配列)を合わせる。参考文献30の方法の好ましい局面は、以下を含む:(a)単一プラスミド上のPB1 mRNAコード領域、PB2 mRNAコード領域およびPA mRNAコード領域;および(b)単一プラスミド上の全8種のvRNAコードセグメント。1つのプラスミド上にNAセグメントおよびHAセグメントを含み、そして別のプラスミド上に6種の他のセグメントを含むこともまた、問題を容易にし得る。
【0026】
上記ウイルスRNAセグメントをコードするためにpolIプロモーターを使用する代わりに、バクテリオファージポリメラーゼプロモーターを使用することが、可能である[31]。例えば、SP6ポリメラーゼ、T3ポリメラーゼまたはT7ポリメラーゼのためのプロモーターが、慣用的に使用され得る。polIプロモーターの種特異性に起因して、バクテリオファージポリメラーゼプロモーターは、多くの細胞型(例えばMDCK)に関してより慣用的であり得るが、細胞はまた、外因性ポリメラーゼ酵素をコードするプラスミドによってトランスフェクトされる必要がある。
【0027】
他の技術において、単一の鋳型に由来して上記ウイルスRNAおよび発現可能なmRNAを同時にコードするために二重のpolIプロモーターおよびpolIIプロモーターを使用することが、可能である[32、33]。
【0028】
したがって、インフルエンザA型ウイルスは、特に、そのウイルスが卵において増殖される場合、A/PR/8/34ウイルス由来の1種以上のRNAセグメント(代表的に、6セグメントは、A/PR/8/34に由来し、上記HAセグメントおよびNセグメントは、ワクチン株に由来する、すなわち、6:2リアソータント)を含み得る。それはまた、ワクチン調製物のためのリアソータントウイルスを産生するために、A/WSN/33ウイルス由来の1種以上のRNAセグメント、または有用な任意の他のウイルス株の1種以上のRNAセグメントを含み得る。代表的に、上記株のゲノムは、通常、哺乳動物(例えば、ヒト)インフルエンザウイルスに由来する少なくとも1種のRNAセグメントを含むので、本発明は、ヒト同士の伝染が可能である株から防御する。それは、鳥インフルエンザウイルスに由来するNSセグメントを含み得る。
【0029】
上記抗原の供給源として使用されるウイルスは、卵(通常は、SPF卵)または細胞培養物のいずれかにおいて増殖され得る。インフルエンザウイルス増殖についての現在の標準的な方法は、有胚の鶏卵を使用し、そのウイルスは、その卵の内容物(尿膜腔液)から精製される。しかし、さらに最近、ウイルスは、動物細胞培養物において増殖され、そして速さおよび患者のアレルギーの理由に起因して、この増殖方法が、好ましい。卵ベースのウイルス増殖が使用される場合、1種以上のアミノ酸がウイルスと一緒に卵の尿膜の流体中に導入され得る[15]。
【0030】
細胞基質は、代表的に、哺乳動物細胞株である。適切な哺乳動物細胞の起源としては、ハムスター細胞、ウシ細胞、霊長類細胞(ヒト細胞およびサル細胞を含む)およびイヌ細胞が挙げられるが、これらに限定されない。腎細胞、線維芽細胞、網膜細胞、肺細胞などのような種々の細胞型が、使用され得る。適切なハムスター細胞の例は、BHK21またはHKCCの名前を有する細胞株である。適切なサル細胞は、例えば、アフリカミドリザル細胞(例えば、Vero細胞株のような腎細胞)である。適切なイヌ細胞は、例えば、MDCK細胞株のような腎細胞である。したがって、適切な細胞株としては、MDCK;CHO;293T;BHK;Vero;MRC−5;PER.C6;WI−38;などが挙げられるが、これらに限定されない。インフルエンザウイルスを増殖させるために好ましい哺乳動物細胞株としては、以下が挙げられる:Madin Darbyイヌ腎臓に由来するMDCK細胞[34〜37];アフリカミドリザル(Cercopithecus
aethiops)腎臓に由来するVero細胞[38〜40];またはヒト胚性網膜芽細胞に由来するPER.C6細胞[41]。これらの細胞株は、例えば、American Type Cell Culture(ATCC)コレクション[42]、Coriell Cell Repositories[43]、またはEuropean Collection of Cell Cultures(ECACC)から広範に入手可能である。例えば、ATCCは、カタログ番号CCL−81、CCL−81.2、CRL−1586およびCRL−1587の種々の異なるVero細胞を提供し、そしてATCCは、カタログ番号CCL−34のMDCK細胞を提供する。PER.C6は、寄託番号96022940においてECACCから入手可能である。あまり好ましくない哺乳動物細胞株の代替物として、ウイルスは、アヒル(例えば、アヒル網膜)または雌鶏(例えば、ニワトリ胚線維芽細胞(CEF))などに由来する細胞株を含む鳥類細胞株[例えば、参考文献44〜46]において増殖され得る。例としては、ニワトリ胚性幹細胞、EB45、EB14、およびEB14−074に由来するEBx細胞株[48]を含む鳥類胚性幹細胞[44、47]が挙げられる。
【0031】
ウイルスが哺乳動物細胞株において増殖された場合、上記組成物は、有益に、卵タンパク質(例えばオボアルブミンおよびオボムコイド)およびニワトリDNAを含まず、それによってアレルゲン性を減少させる。
【0032】
インフルエンザウイルスを増殖させるために最も好ましい細胞株は、MDCK細胞株である。元のMDCK細胞株は、CCL−34としてATCCから入手可能であるが、この細胞株の派生物もまた、使用され得る。例えば、参考文献34は、懸濁培養物における増殖に適合したMDCK細胞株(DSM ACC 2219として寄託された「MDCK 33016」)を開示する。同様に、参考文献49は、無血清培養の懸濁物において増殖するMDCK由来細胞株(FERM BP−7449として寄託された「B−702」)を開示する。参考文献50は、非腫瘍形成性MDCK細胞(「MDCK−S」(ATCC
PTA−6500)、「MDCK−SF101」(ATCC PTA−6501)、「MDCK−SF102」(ATCC PTA−6502)および「MDCK−SF103」(PTA−6503)を含む)を開示する。参考文献51は、感染に対して高い感受性を有するMDCK細胞株(「MDCK.5F1」細胞(ATCC CRL−12042)を含む)を開示する。任意のこれらのMDCK細胞株が、使用され得る。
【0033】
ウイルスが細胞株において増殖された場合、増殖のための培養物、およびまた、培養を開始するために使用されるウイルス接種物は、好ましくは、単純ヘルペスウイルス、RSウイルス、パラインフルエンザウイルス3型、SARSコロナウイルス、アデノウイルス、ライノウイルス、レオウイルス、ポリオーマウイルス、ビルナウイルス、サーコウイルス、および/またはパルボウイルスを含まない[52](すなわち、それらの培養物および接種物は、これらのウイルスについて試験され、そしてこれらのウイルスによる汚染についてネガティブな結果を得る)。単純ヘルペスウイルスが無いことは、特に好ましい。
【0034】
ウイルスが細胞株において増殖された場合、上記組成物は、好ましくは、1用量あたり10ng未満(好ましくは、1ng未満、およびより好ましくは、100pg未満)の残留宿主細胞DNAを含むが、微量の宿主細胞DNAが、存在し得る。一般に、上記宿主細胞DNA(それは、本発明の組成物から取り除くことが望ましい)は、100bpよりも長いDNAである。
【0035】
残留宿主細胞DNAの測定は、現在、生物製剤についての慣用的な管理要件(regulatory requirement)であり、そして当業者の通常の能力の範囲内である。DNAを測定するために使用されるアッセイは、代表的に、確認されたアッセイである[53、54]。確認されたアッセイの性能の特徴は、数学的項目および定量可能な項目において記載され得、そしてその考えられる誤差の供給源は、同定されている。上記アッセイは、一般に、正確度、精度、特異性などの特徴について試験された。一旦アッセイが、(例えば、宿主細胞DNAの既知の標準量に対して)較正され、そして試験された場合、定量的DNA測定は、慣用的に行われ得る。DNA定量についての以下の3つの主要な技術が、使用され得る:サザンブロットまたはスロットブロットなどのハイブリダイゼーション法[55];ThresholdTM Systemなどのイムノアッセイ法[56];および定量的PCR[57]。これらの方法は全て、当業者によく知られているが、各方法の正確な特徴は、目的とする宿主細胞に依存し得る(例えば、ハイブリダイゼーションのためのプローブの選択、増幅のためのプライマーおよび/またはプローブの選択など)。Molecular Devices製のThresholdTMシステムは、ピコグラムレベルの全DNAについての定量的アッセイであり、そして生物製剤中の混入したDNAのレベルをモニタリングするために使用されている[56]。代表的なアッセイは、ビオチン化ssDNA結合タンパク質と、ウレアーゼ結合体化抗ssDNA抗体と、DNAとの間における反応複合体の配列非特異的形成を包含する。全てのアッセイ成分は、上記製造業者から入手可能である完全なTotal DNA Assay Kitに含まれる。種々の商業的な製造業者は、残留宿主細胞DNAを検出するための定量的PCRアッセイを提供する(例えば、AppTecTM Laboratory Services、BioRelianceTM、Althea Technologiesなど)。ヒトウイルスワクチンの宿主細胞DNAの混入を測定することについての化学発光ハイブリダイゼーションアッセイと全DNA ThresholdTMシステムとの比較は、参考文献58に見出され得る。
【0036】
混入したDNAは、標準的な精製手順(例えば、クロマトグラフィーなど)を使用して、ワクチン調製の間に除去され得る。残留宿主細胞DNAの除去は、例えば、DNaseを使用することによるヌクレアーゼ処理によって増強され得る。宿主細胞DNAの混入を減少させるために好都合な方法は、参考文献59および60に開示され、その方法は、最初に、ウイルス増殖の間に使用され得るDNase(例えば、ベンゾナーゼ(Benzonase))を使用し、次いで、ビリオンの破壊の間に使用され得るカチオン性洗浄剤(例えばCTAB)を使用する、2工程の処理を含む。アルキル化剤(例えば、β−プロピオラクトン)による処理がまた、宿主細胞DNAを除去するために使用され得、そしてまた、有益に、ビリオンを不活化するために使用され得る[61]。
【0037】
0.25ml容量あたり<10ng(例えば<1ng、<100pg)の宿主細胞DNAを含むワクチンであるような、15μgの赤血球凝集素あたり<10ng(例えば、<1ng、<100pg)の宿主細胞DNAを含むワクチンが、好ましい。0.5ml容量あたり<10ng(例えば、<1ng、<100pg)の宿主細胞DNAを含むワクチンであるような、50μgの赤血球凝集素あたり<10ng(例えば、<1ng、<100pg)の宿主細胞DNAを含むワクチンが、より好ましい。
【0038】
任意の残留宿主細胞DNAの平均の長さは500bp未満(例えば、400bp未満、300bp未満、200bp未満、100bp未満など)であることが、好ましい。
【0039】
細胞株(例えば、MDCK細胞)における増殖について、ウイルスは、懸濁物における細胞[34、62、63]または付着培養(adherent culture)中の細胞において増殖され得る。懸濁培養のための1つの適切なMDCK細胞株は、MDCK 33016(DSM ACC 2219として寄託された)である。代替物として、マイクロキャリア培養(microcarrier culture)が、使用され得る。
【0040】
インフルエンザウイルス複製を補助する細胞株は、好ましくは、無血清培地および/またはタンパク質を含まない培地において増殖される。培地は、ヒト起源または動物起源の血清に由来する添加物が存在しない本発明の文脈において、無血清培地と称される。タンパク質を含まないことは、上記細胞の増殖がタンパク質、成長因子、他のタンパク質添加物および非血清タンパク質を排除して生じる培養を意味すると理解されるが、ウイルス増殖に必要であり得るトリプシンまたは他のプロテアーゼなどのタンパク質を必要に応じて含み得る。そのような培養物において増殖する細胞は、細胞自体のタンパク質をもちろん含む。
【0041】
インフルエンザウイルス複製を補助する細胞株は、好ましくは、例えば、ウイルス複製の間に、37℃未満(例えば、30〜36℃、または約30℃、31℃、32℃、33℃、34℃、35℃、36℃)で増殖される[64]。
【0042】
培養された細胞においてウイルスを増殖させるための方法は、一般に、その培養された細胞に培養されるべき株を接種する工程、ウイルス増殖(例えば、ウイルス力価または抗原発現によって決定される)のために所望の期間(例えば、接種の24時間後と168時間後との間)にわたって、感染された細胞を培養する工程、および増殖されたウイルスを回収する工程を包含する。上記培養された細胞は、1:500〜1:1、好ましくは、1:100〜1:5、より好ましくは、1:50〜1:10の細胞比まで、ウイルス(PFUまたはTCID50によって測定される)を接種される。上記ウイルスは、上記細胞の懸濁物に添加されるか、または上記細胞の単一層に適用され、そしてそのウイルスは、25℃〜40℃(好ましくは、28℃〜37℃)にて、少なくとも60分間(しかし通常は、300分未満(好ましくは、90分間と240分間との間))にわたってその細胞上に吸着される。上記感染された細胞の培養物(例えば、単一層)は、回収される培養上清のウイルス含量を増大させるために、凍結解凍または酵素作用のいずれかによって除去され得る。次いで、上記回収された流体は、凍結されて不活化または保存のいずれかが行われる。培養された細胞は、約0.0001〜10、好ましくは、0.002〜5、より好ましくは、0.001〜2の感染多重度(「m.o.i.」)にて感染され得る。よりさらに好ましくは、上記細胞は、約0.01のm.o.iにて感染される。感染された細胞は、感染後30時間〜60時間で回収され得る。好ましくは、上記細胞は、感染後34時間〜48時間で回収される。よりさらに好ましくは、上記細胞は、感染後38時間〜40時間で回収される。プロテアーゼ(代表的に、トリプシン)は、一般に、ウイルスの放出を可能にするために細胞培養の間に添加され、そしてそのプロテアーゼは、その培養の間の任意の適切な段階において添加され得る。
【0043】
赤血球凝集素(HA)は、不活化インフルエンザワクチン中の主要な免疫原であり、そしてワクチン用量は、代表的に、一次元放射状免疫拡散(SRID)アッセイによって測定されるようなHAレベルを参照することによって標準化される。ワクチンは、代表的に、1株あたり約15μgのHAを含むが、より低い用量がまた、例えば、小児のためかまたは流行性の状況において使用される。1/2(すなわち、1株あたり7.5μgのHA)、1/4および1/8のような分割量が、より高い用量(例えば、3×用量または9×用量[65、66])を有する場合に使用されている[6、7]。したがって、ワクチンは、1つのインフルエンザ株あたり0.1μgと150μgとの間のHA、好ましくは、0.1μgと50μgとの間(例えば、0.1μg〜20μg、0.1μg〜15μg、0.1μg〜10μg、0.1μg〜7.5μg、0.5μg〜5μgなど)のHAを含み得る。特定の用量は、例えば、1株あたり約45、約30、約15、約10、約7.5、約5、約3.8、約1.9、約1.5などを含む。これらのより低い用量は、本発明のようにアジュバントがワクチン中に存在する場合、最も有用である。
【0044】
生ワクチンについて、投薬量は、HA含量よりもむしろ50%組織培養感染量(TCID50)によって測定され、そして1株あたり106と108との間(好ましくは、106.5〜107.5の間)のTCID50が、代表的である。
【0045】
本発明で使用されるHAは、ウイルスにおいて見出されるような天然のHAであっても、改変されていてもよい。例えば、ウイルスを鳥類種において非常に病原性にする決定因子(例えば、HA1とHA2との切断部位周辺の超塩基性領域(hyper−basic region))を除去するためにHAを改変することが、公知である。なぜならば、これらの決定因子は、そうでなければウイルスが卵において増殖されることを妨げ得るからである。
【0046】
本発明のキットの抗原成分は、特に、スプリットワクチンまたは表面抗原ワクチンのために、洗浄剤(例えば、ポリオキシエチレンソルビタンエステル界面活性剤(「Tweens」として公知である)、オクトキシノール(例えば、オクトキシノール−9(Triton X−100)またはt−オクチルフェノキシポリエトキシエタノール)、臭化セチルトリメチルアンモニウム(「CTAB」)、またはデオキシコール酸ナトリウム)を含み得る。上記洗浄剤は、微量でのみ存在し得る。したがって、上記ワクチンは、各々1mg/ml未満のオクトキシノール−10、α−コハク酸水素トコフェロールおよびポリソルベート80を含み得る。残りの他の微量成分は、抗生物質(例えば、ネオマイシン、カナマイシン、ポリミキシンB)であり得る。
【0047】
不活化されている非全細胞ワクチン(例えば、ウイルス成分ワクチンまたは精製された表面抗原ワクチン)は、この抗原内に位置するさらなるT細胞エピトープからの利益を受けるために、マトリックスタンパク質を含み得る。したがって、赤血球凝集素およびノイラミニダーゼを含む非全細胞ワクチン(特に、スプリットワクチン)は、M1および/またはM2マトリックスタンパク質をさらに含み得る。マトリックスタンパク質が存在する場合、検出可能なレベルのM2マトリックスタンパク質を含むことが、好ましい。核タンパク質もまた、存在し得る。
【0048】
(不溶性粒子状アジュバント)
本発明の組成物およびキットは、不溶性粒子状アジュバントを含む。本発明に有用な適切な不溶性粒子状アジュバントの例としては、アルミニウム塩、カルシウム塩、および微粒子が挙げられるが、これらに限定されない。
【0049】
上記不溶性粒子状アジュバントは、代表的に、吸着剤として機能して、抗原およびアジュバントが使用される場合に、その抗原(例えば、赤血球凝集素)が、そのアジュバントに吸着される。しかし、微粒子について、その粒子表面上に上記抗原を吸着する代わりとして(または上記抗原を吸着することに加えて)、その抗原をその粒子の内部に封入することが、可能である。
【0050】
(アルミニウム塩)
適切なアルミニウム塩としては、水酸化アルミニウムおよびリン酸アルミニウムとして公知であるアジュバントが挙げられる。これらの名前は、慣習的であるが、便宜上のみに使用され、いずれも存在している実際の化合物の正確な説明でもない[例えば、参考文献67の第9章を参照のこと]。本発明は、アジュバントとして一般的に使用される任意の「水酸化物」アジュバントまたは「リン酸塩」アジュバントを使用し得る。
【0051】
「水酸化アルミニウム」として公知であるアジュバントは、代表的に、オキシ水酸化アルミニウム塩であり、それは、通常、少なくとも部分的に結晶性である。式AlO(OH)によって表され得るオキシ水酸化アルミニウムは、赤外(IR)分光学によって、特に、1070cm−1における吸収帯および3090〜3100cm−1における強力なショルダーの存在によって水酸化アルミニウムAl(OH)3のようなその他のアルミニウム化合物と区別され得る[参考文献67の第9章])。水酸化アルミニウムアジュバントの結晶化度の程度は、回折バンドの半価幅(WHH)に反映され、結晶性の低い粒子は、より小さい結晶サイズに起因して、より大きい線幅拡大を示す。WHHが増大する場合、表面積は、増大し、そしてより高いWHH値を有するアジュバントは、抗原吸着についてのより大きい能力を有することが見出されている。繊維状の形態学(例えば、透過型電子顕微鏡写真において見られるような)は、水酸化アルミニウムアジュバントに関して代表的である。水酸化アルミニウムアジュバントのpIは、代表的に、約11である(すなわち、そのアジュバント自体は、生理学的pHにて正の表面電荷を有する)。pH7.4において1mgのAl+++あたり1.8mg〜2.6mgの間の吸着力が、水酸化アルミニウムアジュバントについて報告されている。
【0052】
「リン酸アルミニウム」として公知であるアジュバントは、代表的に、ヒドロキシリン酸アルミニウムであり、それはまた、しばしば少量の硫酸塩(すなわち、ヒドロキシリン酸アルミニウムサルフェート)を含む。それらのアジュバントは、沈殿によって得られ得、そして沈殿の間の反応条件および濃度は、上記塩におけるヒドロキシルに対するリン酸の置換の程度に影響を及ぼす。ヒドロキシリン酸塩は、一般に、0.3と1.2との間のPO4/Alモル比を有する。ヒドロキシリン酸塩は、厳密なAlPO4からヒドロキシル基の存在によって区別され得る。例えば、3164cm−1におけるIRスペクトルバンド(例えば、200℃まで加熱される場合)は、構造的なヒドロキシルの存在を示す[参考文献67の第9章]。
【0053】
リン酸アルミニウムアジュバントのPO4/Al3+モル比は、一般に、0.3と1.2との間、好ましくは、0.8と1.2との間、そしてより好ましくは、0.95±0.1である。上記リン酸アルミニウムは、一般に、特にヒドロキシリン酸塩については特に非晶質である。代表的なアジュバントは、0.84と0.92との間のPO4/Alモル比を有する非晶質のヒドロキシリン酸アルミニウムであり、1mlあたり0.6mgのAl3+で含む。上記リン酸アルミニウムは、一般に、粒子状(例えば、透過型電子顕微鏡写真において見られるような板状の形態学)である。その粒子の代表的な直径は、任意の抗原吸着の後において0.5μm〜20μm(例えば、約5μm〜10μm)の範囲である。pH7.4において1mgのAl+++あたり0.7mg〜1.5mgの間のタンパク質を吸着する能力が、リン酸アルミニウムアジュバントについて報告されている。
【0054】
リン酸アルミニウムの荷電ゼロ点(PZC)は、ヒドロキシルに対するリン酸の置換の程度に逆に相関し、そしてこの置換の程度は、沈殿によって上記塩を調製するために使用される反応条件および濃度に依存して変動し得る。PZCはまた、溶液中の遊離リン酸イオンの濃度(より多いリン酸塩=より酸性のPZC)を変化させること、またはヒスチジン緩衝剤(PZCをより塩基性にする)などの緩衝剤を添加することによって変えられる。本発明に従って使用されるリン酸アルミニウムは、一般に、4.0と7.0との間、より好ましくは5.0と6.5との間(例えば、約5.7)のPZCを有する。
【0055】
本発明で使用されるアルミニウム塩の懸濁物は、緩衝剤(例えば、リン酸緩衝剤またはヒスチジン緩衝剤またはTris緩衝剤)を含み得るが、これは、常に必要であるとは限らない。上記懸濁物は、好ましくは、無菌であり、かつ発熱物質を含まない。懸濁物は、例えば、1.0mMと20mMとの間、好ましくは5mMと15mMとの間、そしてより好ましくは約10mMの濃度で存在する、遊離型の水性リン酸イオンを含み得る。上記懸濁物はまた、塩化ナトリウムを含み得る。
【0056】
本発明の1つの実施形態において、上記アジュバントは、水酸化アルミニウムおよびリン酸アルミニウムの両方の混合物を含む[6]。この場合において、水酸化アルミニウムよりも多いリン酸アルミニウム(例えば、少なくとも2:1(例えば、≧5:1、≧6:1、≧7:1、≧8:1、≧9:1など)の重量比)が、存在し得る。
【0057】
患者に対する投与のための組成物におけるAl+++の濃度は、好ましくは、10mg/ml未満(例えば、≦5mg/ml、≦4mg/ml、≦3mg/ml、≦2mg/ml、≦1mg/mlなど)である。好ましい範囲は、0.3mg/mlと1mg/mlとの間である。0.85mg/用量未満の最大量が、好ましい。
【0058】
(カルシウム塩)
種々のカルシウム塩のうち、一般に、リン酸カルシウムのみが、アジュバントとして使用される。リン酸カルシウムの種々のアジュバント形態が、報告されており、そして任意のこれらの形態が、本発明によって使用され得る:
水和リン酸カルシウムゲルアジュバントは、Superfos(Vedbaek,Denmark)から入手可能である。
【0059】
参考文献67の第8章は、1995年にリン酸カルシウムアジュバントを概説した。抗原は、その抗原の存在下における塩のその場での沈殿(in situ precipitation)または予め形成された塩への吸着のいずれかによって、リン酸カルシウムに吸着され得る。予め形成されたリン酸カルシウムゲルの商業的供給源は、言及される。詳細は、吸着力を含む上記アジュバントの物理化学的特徴に対する沈殿条件の効果について与えられる。
【0060】
参考文献68は、種々のリン酸カルシウムアジュバントの構造特性および吸着特性について報告する。厳密なCa3(PO4)2であるよりもむしろ、上記アジュバントは、式Ca10−x(HPO4)x(PO4)6−x(OH)2−xの非化学量論的なヒドロキシアパタイト、および5.5の荷電ゼロ点(PZC)を有するpH依存性の表面荷電であることが報告された。上記アジュバントは、約10nm×150nmの寸法を有する針様粒子、および約20〜30nmの直径を有する不規則に成形された板(plate)を形成し得る。
【0061】
参考文献69は、空の反応部位を含む反応性の非晶質リン酸カルシウムを開示し、その反応部位は、非晶質炭酸・リン酸カルシウムの炭酸プレ成分(pre−component)を、そのプレ成分の気体または蒸気の副産物への熱分解によって除去することによって得られた。
【0062】
参考文献70および71は、粒子状リン酸カルシウムアジュバント(「CAP」)を開示し、その粒子は、300〜4000nmの範囲の直径(ナノ粒子)を有し、そして球形状および平滑面を有する。参考文献72は、これらの粒子が粘膜免疫感作のために使用され得ることを開示する。
【0063】
粘膜免疫感作はまた、参考文献73に開示され、IgA抗体応答をもたらすために哺乳動物にワクチン接種するための方法は、上皮を横切る輸送に適したサイズの粒子状炭酸・リン酸カルシウムを使用する。
【0064】
参考文献74は、インビボで可溶性である複合粒子を開示し、そしてその複合粒子は、その表面上にコーティングされた約1.0〜2.0のCa/P比を有するリン酸カルシウム化合物を有するポリマー物質の粒子を含む。
【0065】
参考文献75は、ワクチンを吸着するためのリン酸カルシウムの注射可能な水性ゲルを開示し、Ca/Pの重量比が1.62〜1.85であり、かつ1リットルあたり0.07個のCa原子を含む場合にそのゲルの沈殿時間が10分間で20℃にて1〜20mmの間であるような割合で、カルシウムイオンおよびリン酸イオンが、合わせられる。
【0066】
リン酸カルシウムアジュバントのCa対Pのモル比は、例えば、1.35と1.83との間で変動し得る[参考文献67の第8章を参照のこと]。上記アジュバントの吸着特性は、沈殿の間に使用される条件に依存して変動することが見出されている(例えば、緩徐な混合は、迅速な混合によって形成されたアジュバントよりも低い吸着力を有するアジュバントを与えた)。
【0067】
Ca++として測定される本発明のワクチン中のリン酸カルシウムの量は、0.1mg/mlと10mg/mlとの間(例えば、0.5〜5mg/ml、好ましくは0.75〜3mg/ml、0.9〜1.5mg/mlまたは約1mg/ml)であり得る。
【0068】
上記リン酸カルシウムアジュバントは、抗原を吸着する能力を有する。所与の抗原について、その抗原の総量の少なくとも80重量%(例えば、85重量%以上、90重量%以上、92.5重量%以上、95重量%以上、97.5重量%以上、97.5重量%以上、98重量%以上、99重量%以上、99.5重量%以上など)が、吸着される。リン酸カルシウムアジュバントが不溶性である場合、吸着の程度は、従来通り、遠心分離を含む方法、およびその後の、固体物質または可溶性物質の一方(または両方)である抗原の量の決定によって測定され得る。吸着されていない抗原は、遠心分離後に溶液のままである。例えば、リン酸カルシウムアジュバントの吸着力は、参考文献76において、この方法によって測定された。1mgのCa++に対するジフテリアトキソイドおよび破傷風トキソイドの吸着は、(a)ジフテリアトキソイドレベルが100Lfを上回って上昇した場合、および(b)破傷風トキソイドレベルが25Lfを上回って上昇した場合に、不完全であった。
【0069】
吸着についてリン酸カルシウムアジュバントは、好ましくは、インフルエンザ抗原が添加される水性懸濁物の形態で使用される。上記カルシウム塩は、上記抗原を添加する前に、必要とされる濃度まで希釈され得る。
【0070】
(微粒子)
微粒子は、アジュバントとして使用するために所望されている(例えば、参考文献77および78を参照のこと)。
【0071】
好ましい微粒子は、生分解性でありかつ非毒性のポリマーから作製される。例えば、それらは、以下からなる群より選択されるポリマーから作製され得る:ポリ(α−ヒドロキシ酸)、ポリヒドロキシ酪酸、ポリカプロラクトン、ポリオルトエステル、ポリ無水物、およびポリシアノアクリレート。これらのポリマーのコポリマー(例えば、すなわち、D,L−ラクチドとカプロラクトンとのコポリマー)もまた、使用され得る。
【0072】
好ましいポリマーは、ポリ(α−ヒドロキシ酸)、より好ましくはポリ(L−ラクチド)、ポリ(D,L−ラクチド)およびポリ(D,L−ラクチド−co−グリコリド)からなる群より選択されるものである。最も好ましいポリマーは、「PLG」と称されるポリ(D,L−ラクチド−co−グリコリド)ポリマーである。好ましいポリ(D,L−ラクチド−co−グリコリド)ポリマーは、25:75〜75:25の範囲、より好ましくは、40:60〜60:40(例えば、約50:50)の範囲のラクチド/グリコリドモル比を有するものである。50%のD,L−ラクチドおよび50%のグリコリドを含む50:50のPLGポリマーは、迅速に再吸収するコポリマーを提供するが、75:25のPLGは、よりゆっくりと分解し、そして85:15および90:10は、増大したラクチド成分に起因して、よりさらにゆっくりと分解する。
【0073】
これらのポリマーは、種々の分子量で利用可能であり、そして所与の抗原に関して適切な分子量は、当業者によって容易に決定される。ポリラクチドについて、例えば、適切な分子量は、約2000〜5000のオーダーである。PLGについて、適切な分子量は、一般に、約10,000〜約200,000の範囲、好ましくは、約15,000〜約150,000の範囲、そして最も好ましくは、約50,000〜約100,000の範囲である。有用な範囲は、30,000ダルトン〜70,000ダルトンである。
【0074】
微粒子は、約100nm〜約150μmの範囲の直径、より好ましくは、約200nm〜約30μmの範囲の直径、そして最も好ましくは約500nm〜約10μmの範囲の直径を有し得る。それらの微粒子は、代表的に、実質的に球状である。
【0075】
微粒子は、種々の方法で作製され得る。例えば、二重エマルション/溶媒蒸発(double emulsion/solvent evaporation)技術が、公知であり、その技術は、ポリマー溶液の小滴からなる一次エマルションの形成を包含し、その一次エマルションは、次いで粒子安定剤/界面活性剤を含む連続した水相と混合される。より具体的には、水中油中水型(water−in−oil−in−water)(w/o/w)溶媒蒸発系が、参考文献79に記載されるように、上記微粒子を形成するために使用され得る。この技術において、特定のポリマーは、有機溶媒(例えば、酢酸エチル、ジメチルクロリド(塩化メチレンおよびジクロロメタンとも称される)、アセトニトリル、アセトン、クロロホルムなど)と合わせられる。上記ポリマーは、有機溶媒中の約2〜15%溶液、より好ましくは、約4〜10%溶液、そして最も好ましくは、6%溶液で提供される。上記ポリマー溶液は、例えば、ホモジナイザーを使用して乳化される。次いで、上記エマルションは、エマルション安定剤(例えば、ポリビニルアルコール(PVA)またはポリビニルピロリドン)のより大きい容量の水溶液と合わせられる。上記エマルション安定剤は、代表的に、約2〜15%溶液、より代表的に、約4〜10%溶液で提供される。次いで、その混合物は、安定なw/o/w二重エマルションを産生するためにホモジナイズされる。次いで、有機溶媒は、蒸発される。処方パラメータは、小さい(<5μm)微粒子および大きい(>30μm)微粒子の調製を可能にするために操作され得る。例えば、撹拌の減少は、内相の容量の増加をもたらすような、より大きい微粒子を生じる。粒径は、慣用的な方法によって決定され得る。
【0076】
二重エマルション技術を使用することと同様に、一重エマルション(single emulsion)技術もまた、使用され得る。微粒子はまた、噴霧乾燥およびコアセルベーションを使用して形成されても、気中懸濁被覆技術(例えば、パンコーティングおよびWursterコーティング)によって形成されてもよい。イオンゲル化(ionic gelation)もまた、使用され得る。
【0077】
調製の後、微粒子は、それらが、すなわち、さらなる使用のために凍結乾燥され得るように、保存され得る。
【0078】
調製された微粒子上に抗原を吸着させるための1つの方法は、以下の通りである。微粒子は、再度水和され、そして透析可能な洗浄剤を使用して微粒子の本質的に単一の懸濁物へと分散される。有用な洗浄剤としては、任意の種々のN−メチルグルカミド(MEGAとして公知である)(例えば、ヘプタノイル−N−メチルグルカミド(MEGA−7)、オクタノイル−Nメチルグルカミド(MEGA−8)、ノナノイル−N−メチルグルカミド(MEGA−9)、およびデカノイル−N−メチルグルカミド(MEGA−10));コール酸;コール酸ナトリウム;デオキシコール酸;デオキシコール酸ナトリウム;タウロコール酸;タウロコール酸ナトリウム;タウロデオキシコール酸;タウロデオキシコール酸ナトリウム;3[(3−コールアミドプロピル)ジメチルアンモニオ]−1−プロパン−サルフェート(CHAPS);3−[(3 コールアミドプロピル)ジメチルアンモニオ]−2−ヒドロキシ−1−プロパン−サルフェート(CHAPSO);N−ドデシル−N,N−ジメチル−3−アンモニオール(ammoniol)−プロパン−サルフェート(ZWITTERGENT 3−12);N,N−ビス−(3−Dグルコンアミドプロピル(Dgluconeamidopropyl))−デオキシコールアミド(DEOXY−BIGCHAP);Nオクチルグルコシド(Noctylglucoside);モノラウリル酸スクロース;グリココール酸/グリココール酸ナトリウム;ラウロサルコシン(ナトリウム塩);グリコデオキシコール酸/グリコデオキシコール酸ナトリウムが挙げられるが、これらに限定されない。一般に、洗浄剤 対 微粒子の約0.0156:1の比(w:w)、が使用され、より好ましくは、約0.625:1の比、よりさらに好ましくは、約0.25:1の比、そして最も好ましくは、約1:1〜2:1の比(洗浄剤 対 微粒子(w:w))が使用される。
【0079】
次いで、上記微粒子/洗浄剤混合物は、例えば、セラミック製の乳鉢および乳棒を使用して、滑らかなスラリーが形成されるまで、物理的にすり砕かれる。次いで、適切な水性緩衝剤(例えば、リン酸緩衝化生理食塩水(PBS)またはTris緩衝化生理食塩水)が、添加され、そして得られた混合物は、上記微粒子が十分に懸濁されるまで、超音波処理またはホモジナイズされる。次いで、目的の抗原が、上記微粒子懸濁物に添加され、そしてその系は、洗浄剤を除去するために透析される。上記ポリマー微粒子および洗浄剤系は、好ましくは、目的の抗原がその抗原の活性を依然として維持しつつその微粒子の表面に吸着するように選択される。表面に吸着した抗原を含む得られた微粒子は、結合していない抗原を含まないように洗浄され得、そして以下でさらに記載されるように、適切な緩衝剤処方物中の懸濁物として保存されても、適切な賦形剤と一緒に凍結乾燥されてもよい。
【0080】
微粒子は、必要に応じて、負に荷電した表面(例えば、SDSを用いる)または正に荷電した表面(例えば、カチオン性洗浄剤(例えば、CTAB)を用いる)を有するように処理され得る。表面特徴の変化は、吸着される抗原に従う吸着特徴を変化させ得る。
【0081】
(免疫増強物質)
本発明の組成物は、免疫増強物質を含み、そして免疫増強物質と不溶性粒子状アジュバントとの組合せは驚くほど有効な免疫原性組成物を与えることが、見出されている。
【0082】
好ましい免疫増強物質は、Toll様レセプター(TLR)のアゴニストである。例えば、それらは、ヒトTLR1タンパク質、ヒトTLR2タンパク質、ヒトTLR3タンパク質、ヒトTLR4タンパク質、ヒトTLR7タンパク質、ヒトTLR8タンパク質、および/またはヒトTLR9タンパク質のうちの1つ以上のアゴニストであり得る。好ましい薬剤は、TLR7のアゴニスト(例えば、イミダゾキノリン(imidazoquinilone))および/またはより好ましくは、TLR9のアゴニスト(例えば、CpGオリゴヌクレオチド)である。これらの免疫増強物質は、先天免疫経路を活性化するために有用である。
【0083】
代表的な免疫増強物質は、有機化合物であり、そしてそれらは、通常、ポリマーではない。それらは、2kDa未満(例えば、1800Da未満、1600Da未満、1400Da未満、1200Da未満、1000Da未満、800Da未満、600Da未満、500Da未満、400Da未満、300Da未満、または200Da未満)の分子量を有し得る。
【0084】
適切な免疫増強物質としては、以下が挙げられるが、これらに限定されない:
−免疫刺激性オリゴヌクレオチド(例えば、CpGモチーフ(リン酸結合によってグアノシンに結合された非メチル化シトシンを含むジヌクレオチド配列)または二本鎖RNAを含むもの、あるいはパリンドローム配列を含むオリゴヌクレオチド、あるいはポリ(dG)配列を含むオリゴヌクレオチド)。
−3−O−脱アシル化モノホスホリルリピドA(「MPLTM」としても公知である「3dMPL」)[80〜83]。
−イミダゾキノリン化合物(例えば、イミキモッド(Imiquimod)(「R837」)[84、85]、レシキモッド(Resiquimod)(「R−848」)[86]、およびそれらのアナログ;ならびにそれらの塩(例えば、塩酸塩)。免疫刺激性イミダゾキノリンについてのさらなる詳細は、参考文献87〜91に見出され得る。
−チオセミカルバゾン化合物(例えば、参考文献92に開示されるもの)。活性化合物についての処方、製造、およびスクリーニングの方法はまた、参考文献92に記載される。−トリプタントリン化合物(例えば、参考文献93に開示されるもの)。活性化合物についての処方、製造、およびスクリーニングの方法はまた、参考文献93に記載される。
−(a)イサトラビン(Isatorabine)(ANA−245;7−チア−8−オキソグアノシン):
【0085】
【化1】

などのヌクレオシドアナログ、およびそのプロドラッグ;(b)ANA975;(c)ANA−025−1;(d)ANA380;(e)参考文献94〜96に開示される化合物;(f)式:
【0086】
【化2】

を有する化合物(ここで、
R1およびR2は、各々独立して、H、ハロ、−NRaRb、−OH、C1−6アルコキシ、置換C1−6アルコキシ、ヘテロシクリル、置換ヘテロシクリル、C6−10アリール、置換C6−10アリール、C1−6アルキル、または置換C1−6アルキルであり;
R3は、存在しないか、H、C1−6アルキル、置換C1−6アルキル、C6−10アリール、置換C6−10アリール、ヘテロシクリル、または置換ヘテロシクリルであり;
R4およびR5は、各々独立して、H、ハロ、ヘテロシクリル、置換ヘテロシクリル、−C(O)−Rd、C1−6アルキル、置換C1−6アルキルであるか、または一緒に結合されてR4−5:
【0087】
【化3】

のような5員環を形成し、この結合は、
【0088】
【化4】

によって示される結合において達成され、X1およびX2は、各々独立して、N、C、O、またはSであり;
R8は、H、ハロ、−OH、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、−OH、−NRaRb、−(CH2)n−O−Rc、−O−(C1−6アルキル)、−S(O)pRe、または−C(O)−Rdであり;
R9は、H、C1−6アルキル、置換C1−6アルキル、ヘテロシクリル、置換ヘテロシクリルまたはR9aであり、R9aは、
【0089】
【化5】

であり、この結合は、
【0090】
【化6】

によって示される結合において達成され;
R10およびR11は、各々独立して、H、ハロ、C1−6アルコキシ、置換C1−6アルコキシ、−NRaRb、または−OHであり;
各々のRaおよびRbは、独立して、H、C1−6アルキル、置換C1−6アルキル、−C(O)Rd、C6−10アリールであり;
各Rcは、独立して、H、ホスフェート、ジホスフェート、トリホスフェート、C1−6アルキル、または置換C1−6アルキルであり;
各Rdは、独立して、H、ハロ、C1−6アルキル、置換C1−6アルキル、C1−6アルコキシ、置換C1−6アルコキシ、−NH2、−NH(C1−6アルキル)、−NH(置換C1−6アルキル)、−N(C1−6アルキル)2、−N(置換C1−6アルキル)2、C6−I0アリール、またはヘテロシクリルであり;
各Reは、独立して、H、C1−6アルキル、置換C1−6アルキル、C6−10アリール、置換C6−10アリール、ヘテロシクリル、または置換ヘテロシクリルであり;
各Rfは、独立して、H、C1−6アルキル、置換C1−6アルキル、−C(O)Rd、ホスフェート、ジホスフェート、またはトリホスフェートであり;
各nは、独立して、0、1、2、または3であり;
各pは、独立して、0、1、または2である);あるいは(g)(a)〜(f)のいずれかの薬学的に受容可能な塩、(a)〜(f)のいずれかの互変異性体、またはその互変異性体の薬学的に受容可能な塩。
−ロキソリビン(Loxoribine)(7−アリル−8−オキソグアノシン)[97]。
−ポリオキシドニウム(polyoxidonium)ポリマー[98、99]または他のN−酸化ポリエチレン−ピペラジン誘導体。
−参考文献100に開示される化合物。
−参考文献101に規定されるような、式I、IIまたはIII:
【0091】
【化7】

の化合物、あるいはその塩、例えば、「ER 803058」、「ER 803732」、「ER 804053」、「ER 804058」、「ER 804059」、「ER
804442」、「ER 804680」、「ER 804764」、「ER 804057」(以下に示される構造):
【0092】
【化8】

またはER−803022(以下に示される構造):
【0093】
【化9】

−アミノアルキルグルコサミニドグルコサミニドホスフェート誘導体(例えば、RC−529[102、103])。
−例えば、参考文献104および105に記載されるようなポリ[ジ(カルボキシレートフェノキシ(carboxylatophenoxy))ホスファゼン](「PCPP」)などのホスファゼン。
−TLR4アンタゴニストE5564[106、107]:
【0094】
【化10】

などの、ホスフェート含有非環式骨格に結合された脂質を含む化合物。
−ムラミルペプチド(例えば、N−アセチルムラミル−L−トレオニル−D−イソグルタミン(「thr−MDP」)、N−アセチル−ノルムラミル−L−アラニル−D−イソグルタミン(nor−MDP)、N−アセチルグルコサミニル−N−アセチルムラミル−L−Al−D−イソグル−L−Ala−ジパルミトキシ(dipalmitoxy)プロピルアミド(「DTP−DPP」、または「TheramideTM」)、N−アセチルムラミル−L−アラニル−D−イソグルタミニル−L−アラニン−2−(1’−2’ジパルミトイル−sn−グリセロ−3−ヒドロキシホスホリルオキシ)−エチルアミン(「MTP−PE」)。
−参考文献108に開示される化合物(アシルピペラジン化合物、インドールジオン化合物、テトラヒドライソキノリン(THIQ)化合物、ベンゾシクロジオン化合物、アミノアザビニル化合物、アミノベンゾイミダゾールキノリノン(ABIQ)化合物[109、110]、ヒドラフタラミド化合物、ベンゾフェノン化合物、イソキサゾール化合物、ステロール化合物、キナジリノン化合物、ピロール化合物[111]、アントラキノン化合物、キノキサリン化合物、トリアジン化合物、ピラゾロピリミジン(Pyrazalopyrimidine)化合物、およびベンザゾール(Benzazole)化合物[112]を含む)。
−メチルイノシン5’−モノホスフェート(「MIMP」)[113]。
−式:
【0095】
【化11】

を有するもの(Rは、水素、直鎖または分枝鎖であり、非置換または置換であり、不飽和または飽和である、アシル基、アルキル基(例えば、シクロアルキル基)、アルケニル基、アルキニル基およびアリール基、あるいはそれらの薬学的に受容可能な塩または誘導体からなる群より選択される)などのポリヒドロキシル化ピロリジン化合物[114]。例としては、カスアリン(casuarine)、カスアリン−6−α−D−グルコピラノース、3−エピ−カスアリン、7−エピ−カスアリン、3,7−ジエピ−カスアリンなどが挙げられるが、これらに限定されない。
−N2−メチル−1−(2−メチルプロピル)−1H−イミダゾ[4,5−c]キノリン−2,4−ジアミン;
N2,N2−ジメチル−1−(2−メチルプロピル)−1H−イミダゾ[4,5−c]キノリン−2,4−ジアミン;
N2−エチル−N2−メチル−1−(2−メチルプロピル)−1H−イミダゾ[4,5−c]キノリン−2,4−ジアミン;
N2−メチル−1−(2−メチルプロピル)−N2−プロピル−1H−イミダゾ[4,5−c]キノリン−2,4−ジアミン;
1−(2−メチルプロピル)−N2−プロピル−1H−イミダゾ[4,5−c]キノリン−2,4−ジアミン;
N2−ブチル−1−(2−メチルプロピル)−1H−イミダゾ[4,5−c]キノリン−254−ジアミン;
N2−ブチル−N2−メチル−1−(2−メチルプロピル)−1H−イミダゾ[4,5−c]キノリン−2,4−ジアミン;
N2−メチル−1−(2−メチルプロピル)−N2−ペンチル−1H−イミダゾ[4,5−c]キノリン−2,4−ジアミン;
N2−メチル−1−(2−メチルプロピル)−N2−プロプ−2−エニル−1H−イミダゾ[4,5−c]キノリン−2,4−ジアミン;
1−(2−メチルプロピル)−2−[(フェニルメチル)チオ]−1H−イミダゾ[4,5−c]キノリン−4−アミン;
1−(2−メチルプロピル)−2−(プロピルチオ)−1H−イミダゾ[4,5−c]キノリン−4−アミン;
2−[[4−アミノ−1−(2−メチルプロピル)−1H−イミダゾ[4,5−c]キノリン−2−イル](メチル)アミノ]エタノール;
2−[[4−アミノ−1−(2−メチルプロピル)−1H−イミダゾ[4,5−c]キノリン−2−イル](メチル)アミノ]エチルアセテート;
4−アミノ−1−(2−メチルプロピル)−1,3−ジヒドロ−2H−イミダゾ[4,5−c]キノリン−2−オン;
N2−ブチル−1−(2−メチルプロピル)−N4,N4−ビス(フェニルメチル)−1H−イミダゾ[4,5−c]キノリン−2,4−ジアミン;
N2−ブチル−N2−メチル−1−(2−メチルプロピル)−N4,N4−ビス(フェニルメチル)−1H−イミダゾ[4,5−c]キノリン−2,4−ジアミン;
N2−メチル−1−(2−メチルプロピル)−N4,N4−ビス(フェニルメチル)−1H−イミダゾ[4,5−c]キノリン−2,4−ジアミン;
N2,N2−ジメチル−1−(2−メチルプロピル)−N4,N4−ビス(フェニルメチル)−1H−イミダゾ[4,5−c]キノリン−2,4−ジアミン;
1−{4−アミノ−2−[メチル(プロピル)アミノ]−1H−イミダゾ[4,5−c]キノリン−1−イル}−2−メチルプロパン−2−オール;
1−[4−アミノ−2−(プロピルアミノ)−1H−イミダゾ[4,5−c]キノリン−1−イル]−2−メチルプロパン−2−オール;
N4,N4−ジベンジル−1−(2−メトキシ−2−メチルプロピル)−N2−プロピル−1H−イミダゾ[4,5−c]キノリン−2,4−ジアミン;
などの低分子免疫増強物質(SMIP)。
【0096】
上記免疫増強物質は、上記組成物に、その産生の間の種々の段階において添加され得る。例えば、上記免疫増強物質は、抗原組成物内にあり得、次いで、この混合物は、不溶性粒子状アジュバントに添加され得る。その代わりとして、上記免疫増強物質は、不溶性粒子状アジュバントと混合され得、次いで、この混合物は、上記抗原と混合され得る。
【0097】
上記免疫増強物質は、抗原などの別個の因子に結合体化され得る(例えば、CRM197)。低分子に対する結合体化技術の総説は、参考文献115に提供される。その代わりとして、上記免疫増強物質は、疎水性相互作用またはイオン性相互作用などによってさらなる因子と非共有結合され得る。
【0098】
2つの好ましい免疫増強物質は、(a)免疫刺激性オリゴヌクレオチド、および(b)3dMPLである。
【0099】
(免疫刺激性オリゴヌクレオチド)
免疫刺激性オリゴヌクレオチドは、ヌクレオチド改変/アナログ(例えば、ホスホロチオエート改変)を含み得、そして二本鎖であっても(dsRNAを除いて)一本鎖であってもよい。参考文献116、117および118は、可能なアナログ置換(例えば、2’−デオキシ−7−デアザグアノシンによるグアノシンの置換)を開示する。CpGオリゴヌクレオチドのアジュバント効果は、参考文献119〜124においてさらに考察される。上記CpG配列は、TLR9に関し得る(例えば、モチーフGTCGTTまたはTTCGTT)[125]。上記CpG配列は、Th1免疫応答の誘導について特異的であり得る(例えば、CpG−A ODN(オリゴデオキシヌクレオチド))か、またはその配列は、B細胞応答の誘導について、より特異的であり得る(例えば、CpG−B ODN)。CpG−A ODNおよびCpG−B ODNは、参考文献126〜128において考察される。好ましくは、上記CpGは、CpG−A ODNである。好ましくは、上記CpG オリゴヌクレオチドは、その5’末端がレセプター認識を達成可能であるように構築される。必要に応じて、2つのCpGオリゴヌクレオチド配列は、「イムノマー(immunomer)」を形成するようにそれらの3’末端において結合され得る。例えば、参考文献125および参考文献129〜131を参照のこと。有用なCpGアジュバントは、ProMuneTM(Coley Pharmaceutical Group,Inc.)としても公知であるCpG7909である。
【0100】
CpG配列を使用する代わりか、またはそれに加えて、TpG配列が、使用され得る[132]。これらのオリゴヌクレオチドは、非メチル化CpGモチーフを含まない可能性がある。
【0101】
上記免疫刺激性オリゴヌクレオチドは、ピリミジンが豊富であり得る。例えば、その免疫刺激性オリゴヌクレオチドは、1個より多くの連続したチミジンヌクレオチド(例えば、参考文献132に開示されるようなTTTT)を含み得るか、そして/または免疫刺激性オリゴヌクレオチドは、>25%(例えば、>35%、>40%、>50%、>60%、>80%など)のチミジンを含むヌクレオチド組成を有し得る。例えば、その免疫刺激性オリゴヌクレオチドは、1個より多くの連続したシトシンヌクレオチド(例えば、参考文献132に開示されるようなCCCC)を含み得るか、そして/またはその免疫刺激性オリゴヌクレオチドは、>25%(例えば、>35%、>40%、>50%、>60%、>80%など)のシトシンを含むヌクレオチド組成を有し得る。これらのオリゴヌクレオチドは、非メチル化CpGモチーフを含まない可能性がある。
【0102】
免疫刺激性オリゴヌクレオチドは、代表的に、少なくとも20個のヌクレオチドを含む。それらは、100個よりも少ないヌクレオチドを含み得る。
【0103】
(3dMPL)
3dMPL(3脱−O−アシル化モノホスホリルリピドAまたは3−O−脱アシル−4’−モノホスホリルリピドAとしても公知である)は、モノホスホリルリピドA中の還元末端グルコサミンの3位が脱アシル化されるアジュバントである。3dMPLは、Salmonella minnesotaのヘプトース欠損(heptoseless)変異体から調製され、そして化学的にリピドAに類似しているが、酸に不安定なホスホリル基および塩基に不安定なアシル基を欠いている。それは、単球/マクロファージ系統の細胞を活性化し、そして数種のサイトカインの放出を刺激する。3dMPLの調製は、最初に、参考文献133に記載された。
【0104】
3dMPLとアルミニウム塩との組合せは、既に公知である(例えば、リン酸アルミニウムとの組合せ[134]、または水酸化アルミニウムとの組合せ[135])。
【0105】
3dMPLは、それらのアシル化によって変動する(例えば、異なる長さであり得る3、4、5または6のアシル鎖を有する)関連分子の混合物の形態をとり得る。2つのグルコサミン(2−デオキシ−2−アミノ−グルコースとしても公知の)単糖は、それらの2位の炭素(すなわち、2位および2’位)でN−アシル化され、そしてまた3’位でO−アシル化されている。炭素2に結合する基は、式−NH−CO−CH2−CR1R1’を有する。炭素2’に結合する基は、式−NH−CO−CH2−CR2R2’を有する。炭素3’に結合する基は、式−O−CO−CH2−CR3R3’を有する。代表的な構造は以下:
【0106】
【化12】

である。
【0107】
基R1、R2およびR3は、各々独立して−(CH2)n−CH3である。nの値は、好ましくは、8〜16の間であり、より好ましくは、9〜12の間であり、そして最も好ましくは、10である。
【0108】
基R1’、R2’およびR3’は、各々独立して、(a)−H;(b)−OH;または(c)−O−CO−R4;であり得、ここでR4は−Hまたは−(CH2)m−CH3のいずれかであり、ここでmの値は、好ましくは、8〜16の間であり、そしてより好ましくは、10、12または14である。2位では、mは、好ましくは、14である。2’位では、mは、好ましくは、10である。3’位では、mは、好ましくは、12である。したがって、基R1’、R2’およびR3’は、好ましくは、ドデカン酸、テトラデカン酸またはヘキサデカン酸由来の−O−アシル基である。
【0109】
R1’、R2’およびR3’のすべてが−Hである場合、上記3dMPLは3つのアシル鎖のみを有する(2位、2’位および3’位の各々に1つ)。R1’、R2’およびR3’のうち2つのみが−Hである場合、上記3dMPLは4つのアシル鎖を有し得る。R1’、R2’およびR3’のうち1つのみが−Hである場合、上記3dMPLは5つのアシル鎖を有し得る。R1’、R2’およびR3’のいずれもが−Hではない場合、上記3dMPLは、6つのアシル鎖を有し得る。本発明に従って用いられる3dMPLアジュバントは、3〜6つのアシル鎖を備えたこれらの形態の混合物であり得るが、この混合物中に6つのアシル鎖をもつ3dMPLを含むことが好ましく、そして特に6つのアシル鎖形態が総3dMPLの少なくとも10重量%、例えば、20重量%以上、30重量%以上、40重量%以上、50重量%以上またはさらに多くを占めることが好ましい。6つのアシル鎖を備えた3dMPLは、最もアジュバント活性な形態であることが見出された。
【0110】
従って、本発明の組成物に含めるために3dMPLの最も好ましい形態は、
【0111】
【化13】

である。
【0112】
3dMPLが混合物の形態で使用される場合、本発明の組成物中の3dMPLの量または濃度に関する言及は、混合物中の合わせた3dMPL種をいう。
【0113】
水性条件では、3dMPLは、異なるサイズを備えた(例えば、直径<150nmまたは>500nmを備えた)ミセル凝集体または粒子を形成し得る。これらのいずれか、または両方は、本発明とともに使用され得、そしてより良好な粒子が通常のアッセイによって選択され得る。より小さな粒子(例えば、3dMPLの透明な水性懸濁物を与えるに十分小さい)が、より優れた活性[136]に起因して、本発明に従う使用に好ましい。好ましい粒子は、220nmより小さいか、より好ましくは200nmより小さいか、150nmより小さいか、あるいは120nmより小さい平均直径を有し、100nmより小さい平均直径を有しさえし得る。しかしながら、大部分の場合において、この平均直径は、50nmより小さくはない。これらの粒子は、濾過滅菌に適するほどに十分小さい。粒子直径は、通常の動的光散乱法の技法によって評価され得、平均粒子直径が明らかとなる。粒子がxnmの直径を有するといわれる場合、一般的にはおおよそこの平均の粒子の分布が存在するが、粒子の数で少なくとも50%(例えば、60%以上、70%以上、80%以上、90%以上、またはそれより多く)がx±25%の範囲内の直径を有する。
【0114】
実質的に全ての3dMPLは、好ましくは、上記エマルションの水相に位置する。
【0115】
ワクチン中の3dMPLの代表的な量は、10〜100μg/用量(例えば、約25μgまたは約50μg)である。
【0116】
(薬学的組成物)
本発明の組成物は、薬学的に受容可能である。それらの組成物は、抗原、アジュバントおよび免疫増強物質に加えて、成分を含み得る(例えば、それらの組成物は、代表的に、1つ以上の薬学的キャリアおよび/または賦形剤を含有する)。そのような成分の徹底的な考察は、参考文献137において入手可能である。
【0117】
上記組成物は、チオメルサールまたは2−フェノキシエタノールなどの保存剤を含み得る。しかし、上記ワクチンは実質的に水銀物質を含まない(すなわち、5μg/ml未満)(例えば、チオメルサールを含まない)べき[14、138]であることが、好ましい。水銀を含まないワクチンが、より好ましい。保存剤を含まないワクチンが、特に好ましい。
【0118】
張度を制御するために、生理的塩(例えば、ナトリウム塩)を含有することが好ましい。塩化ナトリウム(NaCl)が好ましく、その塩化ナトリウムは、1mg/mlと20mg/mlとの間で存在し得る。存在し得る他の塩としては、塩化カリウム、二水素リン酸カリウム、無水二ナトリウムリン酸塩、塩化マグネシウム、塩化カルシウムなどが挙げられる。
【0119】
組成物は、一般に200mOsm/kgと400mOsm/kgとの間、好ましくは240mOsm/kg〜360mOsm/kgの間の浸透圧モル濃度を有し、より好ましくは290〜310mOsm/kgの範囲内となる。浸透圧モル濃度は、ワクチン接種により引き起こされる痛みに対して影響を有しないことが以前に報告されている[139]が、この範囲に浸透圧モル濃度を維持することが、やはり好ましい。
【0120】
組成物は、1つ以上の緩衝剤を含有し得る。代表的な緩衝剤としては、以下が挙げられる:リン酸緩衝剤;Tris緩衝剤;ホウ酸緩衝剤;コハク酸緩衝剤;ヒスチジン緩衝剤;またはクエン酸緩衝剤。緩衝剤は、代表的に5〜20mMの範囲で含有される。
【0121】
組成物のpHは、一般に、5.0と8.1との間、より代表的には6.0と8.0との間、例えば、6.5と7.5との間、または7.0と7.8との間である。したがって、本発明の方法は、包装前にバルクワクチンのpHを調整する工程を包含し得る。
【0122】
上記組成物は、好ましくは、無菌である。上記組成物は、好ましくは、非発熱性である(例えば、1用量あたり<1EU(エンドトキシン単位、標準的な測定単位)、そして好ましくは1用量あたり<0.1EUを含む)。上記組成物は、好ましくは、グルテンを含まない。
【0123】
上記組成物は、単回免疫感作のための物質を含んでも、複数回免疫感作(すなわち、「複数回用量」キット)のための物質を含んでもよい。保存剤を含むことが、複数回用量の準備において好ましい。複数回用量組成物中に保存剤を含むことの代わりとして(またはそれに加えて)、その組成物は、物質を除去するための無菌のアダプターを有する容器中に含まれ得る。
【0124】
インフルエンザワクチンは、代表的に、約0.5mlの投薬容量で投与されるが、半用量(すなわち、約0.25ml)が、小児に投与され得る。
【0125】
組成物中の抗原、アジュバントおよび免疫増強物質は、代表的に、混合物中にある。本発明の組成物は、代表的に、水性形態である。
【0126】
組成物およびキットは、好ましくは、2℃と8℃との間にて保存される。それらは、凍結されるべきではない。それらは、理想的には、直接的な光から免れるべきである。
【0127】
(本発明のキット)
上述の通り、本発明の組成物は、送達時において即座に調製され得る。したがって、本発明は、混合のために調整された種々の成分を備えるキットを提供する。上記キットは、上記アジュバントおよび上記抗原が使用時まで別々に保持されることを可能にする。上記免疫増強物質は、これら2つのキット成分の一方に含まれても、第3のキット成分の部分であってもよい。
【0128】
上記成分は、上記キット内で、互いから物理的に分離した形態であり、そしてこの分離は、種々の手段で達成され得る。例えば、上記成分は、分離したバイアルなどの容器中にあり得る。次いで、上記2つのバイアルの内容物は、例えば、一方のバイアルの内容物を取り出し、そしてそれらを他方のバイアルに添加すること、または両方のバイアルの内容物を別々に取り出し、そしてそれらを第3の容器中で混合することによって混合され得る。
【0129】
好ましい構成(arrangement)において、キット成分のうちの一方は、注射器中にあり、そして他方は、バイアルなどの容器中にある。注射器(例えば、針を有する)が、その成分を混合のための第2の容器中に挿入するために使用され得、次いでその混合物は、その注射器中に引かれ得る。次いで、その注射器の混合された内容物は、代表的に、新規の滅菌針を通して患者に投与され得る。注射器中に1つの成分を包装することは、患者への投与のために別個の注射器を使用する必要性を排除する。
【0130】
別の好ましい構成において、上記2つのキット成分は、同じ注射器(例えば、二重室注射器(dual−chamber syringe)(例えば、参考文献140〜147などに開示されるもの))において、一緒であるが分離して保持される。その注射器が、作動される場合(例えば、患者に対する投与の間)、その2つの室の内容物は、混合される。この構成は、使用時における別個の混合工程に対する必要性を回避する。
【0131】
種々のキット成分の内容は、一般には全て、水性形態にある。いくつかの構成において、一方の成分(代表的に、アジュバント成分よりもむしろ抗原成分)は、乾燥形態(例えば、凍結乾燥された形態)であり、他方の成分は、水性形態である。上記2つの成分は、上記乾燥成分を再活性化し、そして患者に対する投与のための水性組成物を得るために混合され得る。凍結乾燥された成分は、代表的に、注射器よりもむしろバイアル内におかれる。乾燥された成分は、安定剤(例えば、乳糖、ショ糖またはマンニトール、およびそれらの混合物(例えば、乳糖/ショ糖混合物、ショ糖/マンニトール混合物)など)を含み得る。1つの可能な構成は、予め充填された注射器中の水性アジュバント成分およびバイアル中の凍結乾燥された抗原成分を使用する。
【0132】
(組成物またはキット成分の包装)
本発明の組成物(またはキット成分)に適した容器としては、バイアル、注射器(例えば、使い捨て可能な注射器)、点鼻スプレーなどが挙げられる。これらの容器は、無菌であるべきである。
【0133】
組成物/成分が、バイアル中におかれる場合、そのバイアルは、好ましくは、ガラス材料またはプラスチック材料から作製される。上記バイアルは、好ましくは、上記組成物がそのバイアルに添加される前に滅菌される。ラテックス感受性患者に関する懸案事項を回避するために、バイアルは、好ましくは、ラテックスを含まないストッパーによって密封され、そして全ての包装用物質中にラテックスが存在しないことが、好ましい。上記バイアルは、単回用量のワクチンを含み得るか、またはそのバイアルは、1つよりも多い用量(例えば10用量)を含み得る(「複数回用量」バイアル)。好ましいバイアルは、無色のガラスから作製される。
【0134】
バイアルは、予め充填された注射器がそのキャップ中に挿入され得るように適合したキャップ(例えば、Luerロック)を有し得、その注射器の内容物は、(例えば、その中の凍結乾燥された物質を再構成するために)そのバイアル中に排出され得、そしてそのバイアルの内容物は、その注射器中に戻され得る。上記バイアルから上記注射器を取り外した後、次いで針が、接続され得、そして組成物が、患者に投与され得る。上記キャップが、好ましくは、シールまたはカバーの内側に配置されて、そのシールまたはカバーは、そのキャップが接触され得る前に取り外される必要がある。バイアルは、特に、複数回用量バイアルに関して、その内容物の無菌的な取り出しを可能にするキャップを有し得る。
【0135】
成分が、注射器中に包装される場合、その注射器は、それに接続された針を有し得る。針が接続されない場合、別個の針が、組み立ておよび使用のために注射器とともに提供され得る。そのような針は、シースで覆う(sheathe)ことができる。安全針が、好ましい。1インチ23ゲージの針、1インチ25ゲージの針および5/8インチ25ゲージの針が、代表的である。注射器には、その上に内容物のロット番号、インフルエンザの時期および使用期限日がプリントされ得る剥ぎ取りラベルが提供され得、記録維持を容易にする。上記注射器中のプランジャーは、好ましくは、ストッパーを有し、プランジャーが吸引の間に偶発的に外れることを防ぐ。上記注射器は、ラテックスゴムキャップおよび/またはプランジャーを有し得る。使い捨て可能な注射器は、単回用量のワクチンを含む。上記注射器は、一般に、針の接続前に先端を密封するために先端キャップを有し、そしてその先端キャップは、好ましくは、ブチルゴムから作製される。上記注射器と針とが別個に包装される場合、その針は、好ましくは、ブチルゴムシールドが取り付けられる。好ましい注射器は、商標名「Tip−Lok」TMで市販されるものである。
【0136】
容器は、半用量の容量を示して、例えば、小児に対する送達を容易にするために、標識され得る。例えば、0.5ml用量を含む注射器は、0.25ml容量を示す標識を有し得る。
【0137】
ガラス容器(例えば、注射器またはバイアル)が使用される場合、ソーダ石灰ガラス製の容器よりもホウケイ酸ガラス製の容器を用いることが好ましい。
【0138】
キットまたは組成物は、上記ワクチンの詳細(例えば、投与のための指示書、ワクチン内の抗原の詳細など)を含む印刷物と一緒に(例えば、同じ箱中に)含まれ得る。その指示書はまた、警告、例えば、ワクチン接種の後のアナフィラキシー反応の場合、直ちに利用できるようにアドレナリンの溶液を準備しておくことなどを含み得る。
【0139】
(処置およびワクチンの投与の方法)
本発明の組成物は、ヒト患者への投与に適しており、そして本発明は、患者における免疫応答を惹起する方法を提供し、本発明の組成物をその患者に投与する工程を包含する。
【0140】
本発明はまた、医薬として使用するための本発明のキットまたは組成物を提供する。
【0141】
本発明はまた、患者における免疫応答を惹起するための医薬の製造における、(i)インフルエンザウイルス抗原;(ii)不溶性粒子状アジュバント;および(iii)免疫増強物質を提供する。
【0142】
これらの方法および使用によって惹起された免疫応答は、一般に、抗体応答(好ましくは、防御的な抗体応答)を含む。インフルエンザウイルスワクチン接種後の抗体応答、中和能力および防御を評価するための方法は、当該分野において周知である。ヒト研究は、ヒトインフルエンザウイルスの赤血球凝集素に対する抗体力価が防御と相関することを示している(約30〜40の血清サンプル赤血球凝集−抑制力価は、同種のウイルスによる感染に対する約50%の防御を与える)[148]。抗体応答は、代表的に、赤血球凝集抑制、マイクロ中和、一次元放射状免疫拡散(SRID)、および/または単純放射溶血(single radial hemolysis)(SRH)によって測定される。これらのアッセイ技術は、当該分野において周知である。
【0143】
本発明の組成物は、種々の手段で投与され得る。最も好ましい免疫感作経路は、筋肉内注射(例えば、腕または脚)によるものであるが、他の利用可能な経路としては、皮下注射、鼻腔内[149〜151]、経口[152]、皮内[153、154]、経皮(transcutaneous)、経皮(transdermal)[155]などが挙げられる。
【0144】
本発明に従って調製されるワクチンは、小児および成人の両方を処置するために使用され得る。インフルエンザワクチンは、最近、小児および成人の免疫感作における6月齢からの使用について推奨される。したがって、上記患者は、1歳未満、1〜5歳、5〜15歳、15〜55歳、または少なくとも55歳であり得る。上記ワクチンを受容するための好ましい患者は、高齢者(例えば、50歳以上、60歳以上、および好ましくは65歳以上)、若年者(例えば5歳以下)、入院患者、医療従事者、国軍および軍人、妊婦、慢性疾患患者、免疫不全患者、そのワクチンを受容する前の7日間において抗ウイルス化合物(例えば、リン酸オセルタミビルなどのオセルタミビルまたはザナミビル化合物;以下を参照のこと)を摂取している患者、および海外渡航者である。上記ワクチンは、これらの群に対してのみ適しているわけではないが、より一般的には集団において使用され得る。流行株に関して、全ての年齢群に対する投与が、好ましい。
【0145】
処置は、単回用量スケジュールまたは複数回用量スケジュールによるものであり得る。複数回用量は、一次免疫感作スケジュールおよび/または追加免疫感作スケジュールにおいて使用され得る。複数回用量スケジュールにおいて、種々の用量は、同じかまたは異なる経路(例えば、非経口によるプライム(prime)および粘膜によるブースト(boost)、粘膜によるプライムおよび非経口によるブーストなど)によって与えられ得る。1つより多い用量(代表的に、2用量)の投与は、特に、免疫学的にナイーブな患者において有用である(例えば、以前にインフルエンザワクチンを受容したことがない者のためか、または新規のHAサブタイプに対してワクチン接種するため(流行の発生において))。複数回用量は、代表的に、少なくとも1週間(例えば、約2週間、約3週間、約4週間、約6週間、約8週間、約10週間、約12週間、約16週間など)の間隔を空けて投与される。
【0146】
本発明の好ましい組成物は、効力に関してCPMP判定基準の1、2または3を満たす。成人(18〜60歳)において、これらの基準は、(1)70%以上のセロプロテクション(seroprotection);(2)40%以上のセロコンバージョン;および/または(3)2.5倍以上のGMT増加である。高齢者(>60歳)において、これらの判定基準は、(1)60%以上のセロプロテクション;(2)30%以上のセロコンバージョン;および/または(3)2倍以上のGMT増加である。これらの判定基準は、少なくとも50人の患者による非盲検研究に基づく。
【0147】
本発明のワクチンは、他のワクチン(麻疹ワクチン、流行耳下腺炎ワクチン、風疹ワクチン、MMRワクチン、水痘ワクチン、MMRVワクチン、ジフテリアワクチン、破傷風ワクチン、百日咳ワクチン、DTPワクチン、結合体化b型H.influenzaeワクチン、不活性化ポリオウイルスワクチン、B型肝炎ウイルスワクチン、髄膜炎菌結合体ワクチン(例えば、四価A−C−W135−Yワクチン)、RSウイルスワクチン、肺炎球菌結合体ワクチンなど)と実質的に同時(例えば、医療専門家またはワクチン接種センターへの同一の医学的な対診または診察の間)に患者に対して投与され得る。肺炎球菌ワクチンおよび/または髄膜炎菌ワクチンと実質的に同時の投与は、特に、高齢患者において有用である。
【0148】
同様に、本発明のワクチンは、抗ウイルス化合物、および特に、インフルエンザウイルスに対して活性な抗ウイルス化合物(例えば、オセルタミビルおよび/またはザナミビル)と実質的に同時(例えば、医療専門家による同一の医学的な対診または診察の間)に患者に対して投与され得る。これらの抗ウイルス剤としては、ノイラミニダーゼインヒビター(例えば、(3R,4R,5S)−4−アセチルアミノ−5−アミノ−3(1−エチルプロポキシ)−1−シクロヘキセン−1−カルボン酸、または5−(アセチルアミノ)−4−[(アミノイミノメチル)−アミノ]−2,6−アンヒドロ−3,4,5−トリデオキシ−D−グリセロ−D−ガラクトノン−2−エノン酸(そのエステル(例えば、エチルエステル)およびその塩(例えば、リン酸塩)を含む))が挙げられる。好ましい抗ウイルス剤は、(3R,4R,5S)−4−アセチルアミノ−5−アミノ−3(1−エチルプロポキシ)−1−シクロヘキセン−1−カルボン酸,エチルエステル,ホスフェート(1:1)(リン酸オセルタミビル(TAMIFLUTM)としても公知である)である。
【0149】
(一般)
用語「含む(comprising)」は、「含有する(including)」および「からなる」を包含し、例えば、Xを「含む」組成物は、専らXからなり得るか、またはさらなる何かを含有し得る(例えば、X+Y)。
【0150】
語「実質的に」は、「完全に」を排除せず、例えば、Yを「実質的に含まない」組成物は、Yを完全に含まなくても良い。必要である場合、語「実質的に」は、本発明の定義から省略され得る。
【0151】
数値xに関する用語「約」は、例えば、x±10%を意味する。
【0152】
詳細に述べられていなければ、2つ以上の成分を混合する工程を含むプロセスは、混合の任意の特定の順序を要求しない。したがって、成分は任意の順序で混合され得る。3つの成分が存在するとき、そのときは、2つの成分が互いと組み合わされ得、そして次にこの組み合わせが、第3の成分と組み合わされ得るなどである。
【0153】
動物(および特にウシ)材料が細胞の培養に使用される場合、それらを、伝染性海綿状脳症(TSE)のない、および特にウシ海綿状脳症(BSE)のない供給源から取得しなければならない。総合的に、動物に由来する材料の完全な非存在下で細胞を培養することが、好ましい。
【0154】
化合物が、組成物の部分として投与される場合、その化合物は、代替的に、適切なプロドラッグによって置換され得る。
【0155】
細胞基質が、リアソータント手順または逆方向遺伝学手順のために使用される場合、それは、好ましくは、例えば、Ph Eur総論(general chapter)5.2.3にあるようなヒトワクチン生産における使用について承認されているものである。
【実施例】
【0156】
(本発明を実施するための様式)
インフルエンザウイルス株Wyoming H3N2(A)、New−Caledonia H1N1(A)およびJiangsu(B)を、MDCK細胞において個別に増殖させた。三価表面糖タンパク質ワクチンを、調製し、そしてそれを使用して、1株あたり0.1μgのHAにて0日目および28日目に免疫ナイーブBalb/Cマウスを免疫感作(筋肉内)した。動物を、42日目に採血し、そして種々の抗体アッセイを、その血液を用いて行った:HI力価;ELISAによって測定した抗HA応答。IgG応答を、IgG1またはIgG2aとして分類した。
【0157】
以下の3種の不溶性粒子状アジュバントを、試験した:(i)1mg/mlで使用され、かつ5mMヒスチジン緩衝剤を含む水酸化アルミニウム;(ii)1mg/mlで使用され、かつ5mMヒスチジン緩衝剤を含むリン酸カルシウム;または(iii)ポリ(ラクチドco−グリコリド)50:50コポリマー組成物から形成される微粒子(固有粘度0.4(「PLG」))。
【0158】
以下の2種の免疫増強物質を、試験した:(a)ホスホロチオエート骨格を有する免疫刺激性CpG ODN(10μg/用量);または(b)R−848。
【0159】
したがって、12の動物群が存在した。
【0160】
【化14】

Al−H処方物について、三価抗原を、3μg/mlの抗原、5mMのヒスチジン緩衝剤(pH6.5)および9mg/mlの塩化ナトリウムにおいて、1mg/mlの水酸化アルミニウムに対して4℃にて一晩吸着させた。
【0161】
Ca−P処方物について、リン酸カルシウム懸濁物を、粒径を減少させるために20mmプローブを使用して15,000rpmにて3分間にわたってホモジナイズした。次いで、上記抗原を、1mg/mlのCa−P、3μg/mlの抗原、5mMヒスチジン緩衝剤(pH6.5)および9mg/mlの塩化ナトリウムにおいて、上記ホモジナイズした懸濁物に対して4℃にて一晩吸着させた。
【0162】
PLG微粒子を、溶媒蒸発法によって調製した。簡単にいうと、微粒子を、2.5mlのリン酸緩衝化生理食塩水(PBS)を含む塩化メチレン中の10mlの6%(w/v)ポリマー溶液を、10mmプローブを使用してホモジナイズすることによって調製した。そうして形成された油中水型エマルションを、次いで、DSSを含む50mlの蒸留水に添加し、そしてその混合物を、20mmプローブを用いて5分間にわたって非常に速い速度にて氷浴中でホモジナイズした。この手順は、水中油中水型エマルションの形成を生じ、その水中油中水型エマルションを、1000rpmにて12時間にわたって室温で撹拌した。上記塩化メチレンを、放置して蒸発させた。得られた微粒子のサイズ分布を、粒径分析器によって決定した。ゼータ電位を、Malvern Zeta分析器によって測定した。抗原を、0.03%(w/w)の負荷(load)において、100mgの空PLG微粒子を含む懸濁物を30μgの三価インフルエンザ抗原と一緒にインキュベートすることによって吸着させた。濃縮したヒスチジン緩衝溶液を、10mlの総容量において10mMの最終濃度(pH6.2)になるまで添加した。その懸濁物を、実験室のロッカー(lab rocker)において4℃にて一晩混合した。1mLを、吸着効率の決定のために使用するときに取り出した。3.6μgの三価抗原を含むアリコートを、小さいガラスバイアル中におき、そして再構成の際に、それぞれ、4.5%および1.5%の最終濃度を達成するマンニトールおよびショ糖と一緒に、−50℃かつ90×10−3mBarにて凍結乾燥した。
【0163】
上記3種のアジュバントに対するタンパク質吸着の効率を、以下の通りに決定した:PLG/FCC、Al−H/FCCまたはCa−P/FCCの1mlアリコートを、一晩のインキュベーション工程の後に取り出した。遠心分離後、上清中に残存する結合していないタンパク質の量を、ゲル濾過クロマトグラフィーによって測定した。本質的に、100μlの上清を、Waters 2690/432機器を備えたTSK3000SWXLに注入した。直線の検量線を、三価抗原によって確立し、そしてその上清に存在するタンパク質の量を、算出した。次いで、結合していないタンパク質の総量を、最初に添加したタンパク質の総量から減算し、そしてその差を、実際の負荷効率を算出するために使用した。
【0164】
Al−H処方物およびCa−P処方物からの抗原抽出のために、アリコートを、15〜20分間にわたって5000rpmにて遠心分離した。各サンプル由来の上清を、ペレットを乱すことなく除去した。上記抗原を置換するために、脱着緩衝剤(0.25MのNa2HPO4+0.15MのEDTA)を、各ペレットに添加し、そして穏やかに動揺させながら2〜3時間にわたって室温にてインキュベートした。抽出された抗原を、遠心分離によって送達系から分離した。
【0165】
PLG微粒子からの抗原抽出のために、PBSを、0.05%のオクチル−β−グルコシドと一緒に添加し、穏やかな動揺運動のもとで1〜2時間にわたって室温にてインキュベートした。抽出されたFCC抗原を含む上清を、遠心分離によってペレットから分離した。
【0166】
抗原特異的抗体を、ELISAによって決定した。HA特異的IgGの滴定を、最後の免疫感作の2週間後に、個々の血清に対して行った。Maxisorp 96ウェル平底プレートを、リン酸緩衝化生理食塩水(pH7.4)(PBS)中のH1N1、H2N3またはBによって0.2μg/ウェルで27〜30℃にて一晩コーティングした。上記コーティングしたウェルを、300μlの3% PVPを用いて1時間にわたって室温にてブロックした。そのプレートを、PBS(pH7.4)、0.1% BSAおよび0.05% Tween−20を用いて洗浄し、軽打(tap)し、そして乾燥した。血清サンプルおよび血清標準を、最初に、希釈緩衝液(PBS(pH7.4)、1% BSA、0.05% Tween−20)によって1:5,000〜1:20,000に希釈し、次いで、コーティング−ブロックしたプレートに移し、ここで、サンプルを、同じ緩衝液を用いて3倍に連続希釈した。抗原特異的IgGを、アルカリホスファターゼ結合体化ヤギ抗マウスIgGで明らかにした。抗体力価を、免疫感作前の血清において得られた平均光学濃度(OD)の平均+5×標準偏差(SD)よりも高いODを与えるELISA力価の対数として示した。上記力価を、並行してアッセイした参照血清に関して正規化した。
【0167】
抗体をまた、第1の免疫感作の2週間後(post 1)および第2の免疫感作の2週間後(post 2)に採取した個々の血清に対してV字形状の96ウェルマイクロタイタープレートにおいて行った、赤血球凝集抑制アッセイによって決定した。簡単にいうと、25μLの2倍に連続希釈したサンプルを、25μLの株特異的インフルエンザ抗原(4赤血球凝集単位(haemagglutinating unit)を含む全ウイルス)と一緒に60分間にわたって室温にてインキュベートする。成体の雄鶏から得た赤血球の0.5%(v/v)懸濁物を、添加し、そしてその混合物を、さらに60分間にわたってインキュベートする。反応を、目視検査によって追跡する:赤色の点の形成は、ポジティブな反応(抑制)を示し、そして細胞の拡散した斑は、ネガティブな反応(赤血球凝集)を示す。上記力価は、最後の完全な凝集抑制が生じる血清希釈度として規定される。上記抗体濃度は、上記力価の逆数値に対応する。
【0168】
図1〜3は、12個の群についての抗HA ELISA応答を示す。群1と群4との比較は、水酸化アルミニウムに対するCpGの添加がHA力価を上昇させることを示す。同様に、CpGは、上記リン酸カルシウムアジュバント(群2および5)および上記PLGアジュバント(群3および6)に添加した場合、HA力価を上昇させる。
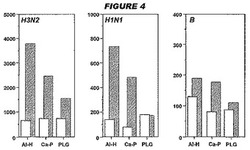
【0169】
図4は、群1〜6についてのHI力価を示す。CpGの添加は、HI力価を増強する。
【0170】
免疫応答がTH1型のものであるかまたはTH2型のものであるかを見るために、HA特異的IgGを、IgG1(TH2)またはIgG2a(TH1)として細分類した。図5は、この分析の結果を示す。単独の粒子状抗原(群1、2および3)は、IgG2aをほとんど示さない。しかし、CpGを添加する場合、顕著なIgG2a応答が、見られ(群4、5および6)、IgG2aは、群5(CpG+CaP)において優勢になった。したがって、上記不溶性粒子状アジュバントに対する免疫増強物質(例えば、CpG)の添加は、TH2型応答からTH1型応答への移行をもたらす。TH1型応答は、インフルエンザウイルスに対する異種サブタイプ免疫を改良することが報告されている[9]ので、不溶性粒子状アジュバントを含む公知のインフルエンザワクチンは、免疫増強物質の添加によって改良され得る。
【0171】
本発明は例示のみによって記載され、そして改変は本発明の範囲および精神の中にあるままでもなされ得ることが、理解される。
【0172】
(参考文献(その内容は、本明細書によって参考として援用される))
【0173】
【化15】

【0174】
【化16】

【0175】
【化17−1】

[90]米国特許第4689338号、同第4929624号、同第5238944号、同第5266575号、同第5268376号、同第5346905号、同第5352784号、同第5389640号、同第5395937号、同第5482936号、同第5494916号、同第5525612号、同第6083505号、同第6440992号、同第6627640号、同第6656938号、同第6660735号、同第6660747号、同第6664260号、同第6664264号、同第6664265号、同第6667312号、同第6670372号、同第6677347号、同第6677348号、同第6677349号、同第6683088号、同第6703402号、同第6743920号、同第6800624号、同第6809203号、同第6888000号および同第6924293号.
【0176】
【化17−2】

【0177】
【化18】

【技術分野】
【0001】
明細書中に引用されるすべての文書は、その全体が参考として援用される。
【0002】
(技術分野)
本発明は、インフルエンザウイルス感染を防御するためのアジュバントワクチン(adjuvanted vaccine)の分野にある。
【背景技術】
【0003】
(背景技術)
MF59水中油型エマルションアジュバント[非特許文献1]を使用するFLUADTM製品(Chiron Vaccines)を除いて、インフルエンザワクチンは、現在、一般的使用においてアジュバントを含まない。これらのワクチンは、参考文献2の第17章および第18章においてさらに詳細に記載される。それらのワクチンは、生ウイルス(live virus)または不活化ウイルスに基づき、そして不活化ワクチンは、全ウイルス(whole virus)、「スプリット」ウイルス(「split」virus)または精製された表面抗原(赤血球凝集素およびノイラミニダーゼを含む)に基づき得る。赤血球凝集素(HA)は、不活化インフルエンザワクチンにおける主要な免疫原であり、そしてワクチン用量は、HAレベルへの参照によって標準化され、そのワクチンは、代表的に、1株あたり約15μgのHAを含む。
【0004】
流行性のインフルエンザ感染において、多数の用量のインフルエンザワクチンが必要とされるが、多大な要求を満たすためにワクチンの供給を増大させることは、困難である。したがって、より多くのワクチン抗原を産生するよりも、1株あたりより低い量の抗原を使用すること、および減少した抗原用量を補うためにアジュバントを使用することが、提案されている。大流行間期に同じアプローチを使用すること(例えば、製造レベルを増大させることなく集団をより広く網羅することを可能にすること)がまた、提案されている。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Freyら、Vaccine、2003年、第21号、p.4234−7
【発明の概要】
【発明が解決しようとする課題】
【0006】
不溶性粒子状アジュバント[3](例えば、アルミニウム塩[4〜7]または微粒子[8])は、インフルエンザワクチンを改良するために提案されている。これらのアジュバントワクチンは、有用であるが、改良の余地が、存在し続ける。したがって、さらなるアジュバントインフルエンザワクチンおよび改良されたアジュバントインフルエンザワクチン(流行中における使用および大流行の間の使用の両方のため)、ならびにそれらの調製のための方法を提供することが、本発明の目的である。
【課題を解決するための手段】
【0007】
(発明の開示)
不溶性粒子状アジュバントを含むインフルエンザワクチンは、主にTH2応答(IgG1)であるIgG応答を誘発することが見出されている。この応答は、組成物中に免疫増強物質を含むことによってTH1応答(IgG2a)へと移行され得る。TH1型応答は、インフルエンザウイルスに対する異種サブタイプ免疫(heterosubtypic
immunity)を改良することが報告されている[9]。有利にも、上記免疫増強物質はまた、赤血球凝集力価および抗赤血球凝集素ELISA力価の上昇が見出されている。
【0008】
したがって、本発明は、(i)インフルエンザウイルス抗原;と(ii)不溶性粒子状アジュバント;と(iii)免疫増強物質;とを含む免疫原性組成物を提供する。
【0009】
本発明はまた、(i)インフルエンザウイルス抗原;と(ii)不溶性粒子状アジュバント;と(iii)免疫増強物質;とを合わせる工程を包含する、免疫原性組成物を調製するための方法を提供する。
【0010】
本発明は、(i)インフルエンザウイルス抗原を含む第1のキット成分;と(ii)不溶性粒子状アジュバントを含む第2のキット成分;とを備えるキットを提供し、(a)上記第1の成分または上記第2の成分は、免疫増強物質を含むか、あるいは(b)上記キットは、免疫増強物質を含む第3のキット成分を含むかのいずれかである。
例えば、本願発明は以下の項目を提供する。
(項目1)
(i)インフルエンザウイルス抗原;と(ii)不溶性粒子状アジュバント;と(iii)免疫増強物質;とを含む、免疫原性組成物。
(項目2)
前記インフルエンザウイルス抗原は、不活化ウイルスである、項目1に記載の組成物。
(項目3)
前記インフルエンザウイルス抗原は、全ウイルス、スプリットウイルス、または精製された表面抗原を含む、項目1に記載の組成物。
(項目4)
前記インフルエンザウイルス抗原は、H1、H2、H3、H5、H7またはH9のインフルエンザA型ウイルスサブタイプ由来である、項目1〜3のいずれかに記載の組成物。
(項目5)
前記インフルエンザウイルス抗原は、細胞培養物において増殖されたインフルエンザウイルスから調製される、項目1〜4のいずれかに記載の組成物。
(項目6)
前記インフルエンザウイルス抗原は、卵において増殖されたインフルエンザウイルスから調製される、項目1〜5のいずれかに記載の組成物。
(項目7)
前記組成物は、オボアルブミン、オボムコイドおよびニワトリDNAを含まない、項目1〜5のいずれか1項に記載の組成物。
(項目8)
前記組成物は、前記細胞培養物の宿主由来の10ng未満の細胞DNAを含む、項目5または項目7に記載の組成物。
(項目9)
前記組成物は、100ヌクレオチド以上である10ng未満のDNAを含む、項目5または項目7に記載の組成物。
(項目10)
前記組成物は、1ウイルス株あたり0.1μgと20μgとの間の赤血球凝集素を含む、項目1〜9のいずれかに記載の組成物。
(項目11)
前記不溶性粒子状アジュバントは、アルミニウム塩;カルシウム塩;および微粒子;からなる群より選択される、項目1〜10のいずれかに記載の組成物。
(項目12)
前記不溶性粒子状アジュバントは、水酸化アルミニウムを含む、項目11に記載の組成物。
(項目13)
前記不溶性粒子状アジュバントは、リン酸アルミニウムを含む、項目11または項目12に記載の組成物。
(項目14)
前記不溶性粒子状アジュバントは、リン酸カルシウムを含む、項目11に記載の組成物。
(項目15)
前記不溶性粒子状アジュバントは、ポリ(ラクチド−co−グリコリド)から作製された微粒子を含む、項目11に記載の組成物。
(項目16)
前記免疫増強物質は、ヒトTLR1、ヒトTLR2、ヒトTLR3、ヒトTLR4、ヒトTLR7、ヒトTLR8、および/またはヒトTLR9のうちの1つ以上のアゴニストである、項目1〜15のいずれかに記載の組成物。
(項目17)
前記免疫増強物質は、免疫刺激性オリゴヌクレオチドである、項目1〜16のいずれかに記載の組成物。
(項目18)
不溶性粒子状アジュバント;および(iii)免疫増強物質。
(項目19)
(i)インフルエンザウイルス抗原;と(ii)不溶性粒子状アジュバント;と(iii)免疫増強物質;とを合わせる工程を包含する、免疫原性組成物を調製するための方法。
(項目20)
(i)インフルエンザウイルス抗原を含む第1のキット成分;と(ii)不溶性粒子状アジュバントを含む第2のキット成分;とを備えるキットであって、(a)該第1の成分または該第2の成分は、免疫増強物質を含むか、あるいは(b)該キットは、免疫増強物質を含む第3のキット成分を含むかのいずれかである、キット。
【図面の簡単な説明】
【0011】
【図1】図1は、異なる組成物によって免疫感作されたマウスについてのLog10血清抗体力価(ELISA)を示す。図1は、H1N1を示す。
【図2】図2は、異なる組成物によって免疫感作されたマウスについてのLog10血清抗体力価(ELISA)を示す。図2は、H3N2を示す。
【図3】図3は、異なる組成物によって免疫感作されたマウスについてのLog10血清抗体力価(ELISA)を示す。図3は、インフルエンザB型を示す。
【図4】図4は、HI力価を示す。前景のバーは、群1〜3であり、そして後景のバーは、群4〜6である。
【図5】図5は、IgGについてのGMT(AU/ml)を示す。各対の左のバーは、IgG1を示す;右のバーは、IgG2aを示す。
【発明を実施するための形態】
【0012】
(インフルエンザウイルス抗原)
本発明の組成物は、インフルエンザウイルス抗原を含む。上記抗原は、代表的に、インフルエンザビリオンから調製されるが、その代わりとして、赤血球凝集素などの抗原が、組換え宿主(例えば、バキュロウイルスベクターを使用した昆虫細胞株)において発現され、そして精製された形態で使用され得る[10、11]。しかし、一般に、抗原は、ビリオン由来である。
【0013】
上記抗原は、生ウイルスの形態、またはより好ましくは、不活化ウイルスの形態をとり得る。ウイルスを不活化するための化学的手段としては、以下の因子の1種以上の有効量による処理が挙げられる:洗浄剤、ホルムアルデヒド、ホルマリン、β−プロピオラクトン、またはUV光。不活化のためのさらなる化学的手段としては、メチレンブルー、ソラレン、カルボキシフラーレン(C60)または任意のその組合せによる処理が挙げられる。ウイルス不活化の他の方法は、当該分野において公知である(例えば、第二級エチルアミン、アセチルエチレンイミン、またはγ線照射など)。INFLEXALTM製品は、全ビリオン不活化ワクチンである。
【0014】
不活化ウイルスが使用される場合、上記ワクチンは、全ウイルス、スプリットウイルス、または精製された表面抗原(赤血球凝集素を含み、そして通常は、ノイラミニダーゼをまた含む)を含み得る。
【0015】
ビリオンは、種々の方法によってウイルス含有流体から回収され得る。例えば、精製プロセスは、ビリオンを破壊するための洗浄剤を含む直線ショ糖勾配溶液を使用したゾーン遠心分離を含み得る。次いで、抗原は、必要に応じた希釈後に、透析濾過(diafiltration)によって精製され得る。
【0016】
スプリットビリオン(split virion)は、ビリオンを洗浄剤(例えば、エチルエーテル、ポリソルベート80、デオキシコール酸塩、トリ−N−ブチルホスフェート、Triton X−100、Triton N101、臭化セチルトリメチルアンモニウム、Tergitol NP9など)により処理(「Tween−エーテル」分解(splitting)プロセスを含む)してサブビリオン調製物を産生することによって得られる。インフルエンザウイルスを分解する方法は、当該分野において周知である(例えば、参考文献12〜17などを参照のこと)。ウイルスの分解は、代表的に、破壊する濃度の分解剤(splitting agent)によって全ウイルスを破壊または断片化する(感染性であっても非感染性であってもよい)ことによって行われる。上記破壊は、ウイルスタンパク質の完全または部分的な可溶化をもたらし、ウイルスの完全性を変化させる。好ましい分解剤は、非イオン性界面活性剤およびイオン性(例えば、カチオン性)界面活性剤(例えば、アルキルグリコシド、アルキルチオグリコシド、アシル糖(acyl sugar)、スルホベタイン、ベタイン、ポリオキシエチレンアルキルエーテル、N,N−ジアルキル−グルカミド(Glucamide)、Hecameg、アルキルフェノキシポリエトキシエタノール、第四級アンモニウム化合物、サルコシル、CTAB(臭化セチルトリメチルアンモニウム)、トリ−N−ブチルホスフェート、Cetavlon、ミリスチルトリメチルアンモニウム塩、リポフェクチン(lipofectin)、リポフェクタミン(lipofectamine)、およびDOT−MA、オクチル−またはノニルフェノキシポリオキシエタノール(例えば、Triton X−100またはTriton N101などのTriton界面活性剤)、ポリオキシエチレンソルビタンエステル(Tween界面活性剤)、ポリオキシエチレンエーテル、ポリオキシエチレンエステルなどである。1つの有用な分解手順は、デオキシコール酸ナトリウムおよびホルムアルデヒドの継続的な効果を使用し、そして分解は、(例えば、ショ糖密度勾配溶液における)最初のビリオン精製の間に行われ得る。したがって、分解プロセスは、ビリオン含有材料の清澄化(非ビリオン材料を除去するため)、回収されたビリオンの濃縮(例えば、CaHPO4吸着などの吸着方法を使用する)、非ビリオン材料からの全ビリオン分離、密度勾配遠心分離工程(例えば、デオキシコール酸ナトリウムなどの分解剤を含むショ糖勾配を使用する)において分解剤を使用したビリオンの分解、および所望されない物質を除去するためのその後の濾過(例えば、限外濾過)を含み得る。スプリットビリオンは、通常、リン酸ナトリウムによって緩衝化された等張塩化ナトリウム溶液に再懸濁され得る。BEGRIVACTM製品、FLUARIXTM製品、FLUZONETM製品およびFLUSHIELDTM製品は、スプリットワクチン(split vaccine)である。
【0017】
精製された表面抗原ワクチンは、インフルエンザ表面抗原の赤血球凝集素、および代表的には、ノイラミニダーゼをまた含む。精製された形態でこれらのタンパク質を調製するためのプロセスは、当該分野において周知である。FLUVIRINTM製品、AGRIPPALTM製品およびINFLUVACTM製品は、サブユニットワクチンである。
【0018】
インフルエンザ抗原はまた、ビロソームの形態で提供され得る[18]。
【0019】
上記インフルエンザウイルスは、弱毒化され得る。上記インフルエンザウイルスは、温度感受性であり得る。上記インフルエンザウイルスは、低温適応性であり得る。これらの3つの可能性は、特に、生ウイルスに適合する。
【0020】
ワクチンに使用するためのインフルエンザウイルス株は、季節により変化する。最近の大流行間期において、ワクチンは、代表的に、2種のインフルエンザA型株(H1N1およびH3N2)および1種のインフルエンザB型株を含み、そして三価ワクチンが、代表的である。本発明はまた、(特に、インフルエンザA型ウイルスの)H2サブタイプ株、H5サブタイプ株、H7サブタイプ株またはH9サブタイプ株などの流行株(すなわちワクチンのレシピエントおよび一般的なヒト集団が免疫学的にナイーブである株)に由来するウイルスを使用し得、そして流行株に対するインフルエンザワクチンは、一価であっても、流行株によって補充された通常の三価ワクチンに基づいてもよい。しかし、季節および上記ワクチンに含まれる抗原の性質に依存して、本発明は、赤血球凝集素サブタイプであるH1、H2、H3、H4、H5、H6、H7、H8、H9、H10、H11、H12、H13、H14、H15またはH16の1種以上を防御し得る。本発明は、インフルエンザA型ウイルスのNAサブタイプであるN1、N2、N3、N4、N5、N6、N7、N8またはN9の1種以上を防御し得る。
【0021】
上記組成物に通常含まれ得る他の株は、抗ウイルス療法に対して抵抗性(例えば、オセルタミビル[19]および/またはザナミビルに対して抵抗性)の株であり得、その株は、抵抗性の流行株を含む[20]。
【0022】
本発明のアジュバント添加組成物は、流行株に対して免疫感作するために特に有用である。流行の発生を引き起こす可能性をインフルエンザ株に与えるインフルエンザ株の特性は、以下である:(a)そのインフルエンザ株が、最近広まっているヒト株における赤血球凝集素と比較して新規の赤血球凝集素(すなわち、10年以上にわたってヒト集団において顕性でない赤血球凝集素(例えばH2))を含むか、またはヒト集団において以前に全く見出されていない(例えば、一般には鳥類集団においてのみ見出されているH5、H6またはH9)ことにより、ヒト集団がその株の赤血球凝集素に対して免疫学的にナイーブであること;(b)そのインフルエンザ株が、ヒト集団において水平伝播し得ること;および(c)そのインフルエンザ株が、ヒトに対して病原性であること。H5型赤血球凝集素を有するウイルスは、流行性インフルエンザ(例えば、H5N1株)に対する免疫感作のために好ましい。他の可能性のある株としては、H5N3、H9N2、H2N2、H7N1およびH7N7、および任意の他の顕在する潜在的な流行株が挙げられる。H5サブタイプにおいて、ウイルスは、HAクレード1、HAクレード1’、HAクレード2またはHAクレード3に分類され得[21]、クレード1およびクレード3は、特に、関連性がある。
【0023】
本発明の組成物は、インフルエンザA型ウイルスおよび/またはインフルエンザB型ウイルスを含む1種以上(例えば1種、2種、3種、4種またはそれ以上)のインフルエンザウイルス株由来の抗原を含み得る。ワクチンが、1種より多い株のインフルエンザを含む場合、それらの異なる株は、代表的に、別個に増殖され、かつそれらのウイルスが回収された後に混合され、そして抗原が、調製される。したがって、本発明のプロセスは、1種より多いインフルエンザ株由来の抗原を混合する工程を含み得る。
【0024】
上記インフルエンザウイルスは、リアソータント(reassortant)株であり得、そして逆方向遺伝学技術によって得ることができた。逆方向遺伝学技術[例えば、22〜26]は、プラスミドを使用してインビトロで調製される所望のゲノムセグメントを有するインフルエンザウイルスを可能にする。代表的に、それは、(a)例えば、polIプロモーターにより、所望のウイルスRNA分子をコードするDNA分子を発現すること、および(b)例えば、polIIプロモーターにより、ウイルスタンパク質をコードするDNA分子を発現することを含むことで、細胞における両方の型のDNAの発現が、完全なインタクト感染性ビリオンの構築を生じる。上記DNAは、好ましくは、全ての上記ウイルスRNAおよびウイルスタンパク質の全てを提供するが、そのRNAおよびタンパク質のいくつかを提供するためにヘルパーウイルスを使用することもまた、可能である。各ウイルスRNAを産生するために別個のプラスミドを使用するプラスミドベースの方法が、好ましく[27〜29]、そしてこれらの方法はまた、上記ウイルスタンパク質の全てまたはいくつか(例えば、PB1タンパク質、PB2タンパク質、PAタンパク質およびNPタンパク質だけ)を発現するためのプラスミドの使用を包含し、12種のプラスミドが、いくつかの方法において使用される。
【0025】
必要とされるプラスミドの数を減少させるために、最近のアプローチ[30]は、(ウイルスRNA合成のための)同じプラスミド上の複数のRNAポリメラーゼI転写カセット(例えば、1種、2種、3種、4種、5種、6種、7種または8種全てのインフルエンザA型vRNAセグメントをコードする配列)と、別のプラスミド上のRNAポリメラーゼIIプロモーターを有する複数のタンパク質コード領域(例えば、1種、2種、3種、4種、5種、6種、7種または8種全てのインフルエンザA型mRNA転写物をコードする配列)を合わせる。参考文献30の方法の好ましい局面は、以下を含む:(a)単一プラスミド上のPB1 mRNAコード領域、PB2 mRNAコード領域およびPA mRNAコード領域;および(b)単一プラスミド上の全8種のvRNAコードセグメント。1つのプラスミド上にNAセグメントおよびHAセグメントを含み、そして別のプラスミド上に6種の他のセグメントを含むこともまた、問題を容易にし得る。
【0026】
上記ウイルスRNAセグメントをコードするためにpolIプロモーターを使用する代わりに、バクテリオファージポリメラーゼプロモーターを使用することが、可能である[31]。例えば、SP6ポリメラーゼ、T3ポリメラーゼまたはT7ポリメラーゼのためのプロモーターが、慣用的に使用され得る。polIプロモーターの種特異性に起因して、バクテリオファージポリメラーゼプロモーターは、多くの細胞型(例えばMDCK)に関してより慣用的であり得るが、細胞はまた、外因性ポリメラーゼ酵素をコードするプラスミドによってトランスフェクトされる必要がある。
【0027】
他の技術において、単一の鋳型に由来して上記ウイルスRNAおよび発現可能なmRNAを同時にコードするために二重のpolIプロモーターおよびpolIIプロモーターを使用することが、可能である[32、33]。
【0028】
したがって、インフルエンザA型ウイルスは、特に、そのウイルスが卵において増殖される場合、A/PR/8/34ウイルス由来の1種以上のRNAセグメント(代表的に、6セグメントは、A/PR/8/34に由来し、上記HAセグメントおよびNセグメントは、ワクチン株に由来する、すなわち、6:2リアソータント)を含み得る。それはまた、ワクチン調製物のためのリアソータントウイルスを産生するために、A/WSN/33ウイルス由来の1種以上のRNAセグメント、または有用な任意の他のウイルス株の1種以上のRNAセグメントを含み得る。代表的に、上記株のゲノムは、通常、哺乳動物(例えば、ヒト)インフルエンザウイルスに由来する少なくとも1種のRNAセグメントを含むので、本発明は、ヒト同士の伝染が可能である株から防御する。それは、鳥インフルエンザウイルスに由来するNSセグメントを含み得る。
【0029】
上記抗原の供給源として使用されるウイルスは、卵(通常は、SPF卵)または細胞培養物のいずれかにおいて増殖され得る。インフルエンザウイルス増殖についての現在の標準的な方法は、有胚の鶏卵を使用し、そのウイルスは、その卵の内容物(尿膜腔液)から精製される。しかし、さらに最近、ウイルスは、動物細胞培養物において増殖され、そして速さおよび患者のアレルギーの理由に起因して、この増殖方法が、好ましい。卵ベースのウイルス増殖が使用される場合、1種以上のアミノ酸がウイルスと一緒に卵の尿膜の流体中に導入され得る[15]。
【0030】
細胞基質は、代表的に、哺乳動物細胞株である。適切な哺乳動物細胞の起源としては、ハムスター細胞、ウシ細胞、霊長類細胞(ヒト細胞およびサル細胞を含む)およびイヌ細胞が挙げられるが、これらに限定されない。腎細胞、線維芽細胞、網膜細胞、肺細胞などのような種々の細胞型が、使用され得る。適切なハムスター細胞の例は、BHK21またはHKCCの名前を有する細胞株である。適切なサル細胞は、例えば、アフリカミドリザル細胞(例えば、Vero細胞株のような腎細胞)である。適切なイヌ細胞は、例えば、MDCK細胞株のような腎細胞である。したがって、適切な細胞株としては、MDCK;CHO;293T;BHK;Vero;MRC−5;PER.C6;WI−38;などが挙げられるが、これらに限定されない。インフルエンザウイルスを増殖させるために好ましい哺乳動物細胞株としては、以下が挙げられる:Madin Darbyイヌ腎臓に由来するMDCK細胞[34〜37];アフリカミドリザル(Cercopithecus
aethiops)腎臓に由来するVero細胞[38〜40];またはヒト胚性網膜芽細胞に由来するPER.C6細胞[41]。これらの細胞株は、例えば、American Type Cell Culture(ATCC)コレクション[42]、Coriell Cell Repositories[43]、またはEuropean Collection of Cell Cultures(ECACC)から広範に入手可能である。例えば、ATCCは、カタログ番号CCL−81、CCL−81.2、CRL−1586およびCRL−1587の種々の異なるVero細胞を提供し、そしてATCCは、カタログ番号CCL−34のMDCK細胞を提供する。PER.C6は、寄託番号96022940においてECACCから入手可能である。あまり好ましくない哺乳動物細胞株の代替物として、ウイルスは、アヒル(例えば、アヒル網膜)または雌鶏(例えば、ニワトリ胚線維芽細胞(CEF))などに由来する細胞株を含む鳥類細胞株[例えば、参考文献44〜46]において増殖され得る。例としては、ニワトリ胚性幹細胞、EB45、EB14、およびEB14−074に由来するEBx細胞株[48]を含む鳥類胚性幹細胞[44、47]が挙げられる。
【0031】
ウイルスが哺乳動物細胞株において増殖された場合、上記組成物は、有益に、卵タンパク質(例えばオボアルブミンおよびオボムコイド)およびニワトリDNAを含まず、それによってアレルゲン性を減少させる。
【0032】
インフルエンザウイルスを増殖させるために最も好ましい細胞株は、MDCK細胞株である。元のMDCK細胞株は、CCL−34としてATCCから入手可能であるが、この細胞株の派生物もまた、使用され得る。例えば、参考文献34は、懸濁培養物における増殖に適合したMDCK細胞株(DSM ACC 2219として寄託された「MDCK 33016」)を開示する。同様に、参考文献49は、無血清培養の懸濁物において増殖するMDCK由来細胞株(FERM BP−7449として寄託された「B−702」)を開示する。参考文献50は、非腫瘍形成性MDCK細胞(「MDCK−S」(ATCC
PTA−6500)、「MDCK−SF101」(ATCC PTA−6501)、「MDCK−SF102」(ATCC PTA−6502)および「MDCK−SF103」(PTA−6503)を含む)を開示する。参考文献51は、感染に対して高い感受性を有するMDCK細胞株(「MDCK.5F1」細胞(ATCC CRL−12042)を含む)を開示する。任意のこれらのMDCK細胞株が、使用され得る。
【0033】
ウイルスが細胞株において増殖された場合、増殖のための培養物、およびまた、培養を開始するために使用されるウイルス接種物は、好ましくは、単純ヘルペスウイルス、RSウイルス、パラインフルエンザウイルス3型、SARSコロナウイルス、アデノウイルス、ライノウイルス、レオウイルス、ポリオーマウイルス、ビルナウイルス、サーコウイルス、および/またはパルボウイルスを含まない[52](すなわち、それらの培養物および接種物は、これらのウイルスについて試験され、そしてこれらのウイルスによる汚染についてネガティブな結果を得る)。単純ヘルペスウイルスが無いことは、特に好ましい。
【0034】
ウイルスが細胞株において増殖された場合、上記組成物は、好ましくは、1用量あたり10ng未満(好ましくは、1ng未満、およびより好ましくは、100pg未満)の残留宿主細胞DNAを含むが、微量の宿主細胞DNAが、存在し得る。一般に、上記宿主細胞DNA(それは、本発明の組成物から取り除くことが望ましい)は、100bpよりも長いDNAである。
【0035】
残留宿主細胞DNAの測定は、現在、生物製剤についての慣用的な管理要件(regulatory requirement)であり、そして当業者の通常の能力の範囲内である。DNAを測定するために使用されるアッセイは、代表的に、確認されたアッセイである[53、54]。確認されたアッセイの性能の特徴は、数学的項目および定量可能な項目において記載され得、そしてその考えられる誤差の供給源は、同定されている。上記アッセイは、一般に、正確度、精度、特異性などの特徴について試験された。一旦アッセイが、(例えば、宿主細胞DNAの既知の標準量に対して)較正され、そして試験された場合、定量的DNA測定は、慣用的に行われ得る。DNA定量についての以下の3つの主要な技術が、使用され得る:サザンブロットまたはスロットブロットなどのハイブリダイゼーション法[55];ThresholdTM Systemなどのイムノアッセイ法[56];および定量的PCR[57]。これらの方法は全て、当業者によく知られているが、各方法の正確な特徴は、目的とする宿主細胞に依存し得る(例えば、ハイブリダイゼーションのためのプローブの選択、増幅のためのプライマーおよび/またはプローブの選択など)。Molecular Devices製のThresholdTMシステムは、ピコグラムレベルの全DNAについての定量的アッセイであり、そして生物製剤中の混入したDNAのレベルをモニタリングするために使用されている[56]。代表的なアッセイは、ビオチン化ssDNA結合タンパク質と、ウレアーゼ結合体化抗ssDNA抗体と、DNAとの間における反応複合体の配列非特異的形成を包含する。全てのアッセイ成分は、上記製造業者から入手可能である完全なTotal DNA Assay Kitに含まれる。種々の商業的な製造業者は、残留宿主細胞DNAを検出するための定量的PCRアッセイを提供する(例えば、AppTecTM Laboratory Services、BioRelianceTM、Althea Technologiesなど)。ヒトウイルスワクチンの宿主細胞DNAの混入を測定することについての化学発光ハイブリダイゼーションアッセイと全DNA ThresholdTMシステムとの比較は、参考文献58に見出され得る。
【0036】
混入したDNAは、標準的な精製手順(例えば、クロマトグラフィーなど)を使用して、ワクチン調製の間に除去され得る。残留宿主細胞DNAの除去は、例えば、DNaseを使用することによるヌクレアーゼ処理によって増強され得る。宿主細胞DNAの混入を減少させるために好都合な方法は、参考文献59および60に開示され、その方法は、最初に、ウイルス増殖の間に使用され得るDNase(例えば、ベンゾナーゼ(Benzonase))を使用し、次いで、ビリオンの破壊の間に使用され得るカチオン性洗浄剤(例えばCTAB)を使用する、2工程の処理を含む。アルキル化剤(例えば、β−プロピオラクトン)による処理がまた、宿主細胞DNAを除去するために使用され得、そしてまた、有益に、ビリオンを不活化するために使用され得る[61]。
【0037】
0.25ml容量あたり<10ng(例えば<1ng、<100pg)の宿主細胞DNAを含むワクチンであるような、15μgの赤血球凝集素あたり<10ng(例えば、<1ng、<100pg)の宿主細胞DNAを含むワクチンが、好ましい。0.5ml容量あたり<10ng(例えば、<1ng、<100pg)の宿主細胞DNAを含むワクチンであるような、50μgの赤血球凝集素あたり<10ng(例えば、<1ng、<100pg)の宿主細胞DNAを含むワクチンが、より好ましい。
【0038】
任意の残留宿主細胞DNAの平均の長さは500bp未満(例えば、400bp未満、300bp未満、200bp未満、100bp未満など)であることが、好ましい。
【0039】
細胞株(例えば、MDCK細胞)における増殖について、ウイルスは、懸濁物における細胞[34、62、63]または付着培養(adherent culture)中の細胞において増殖され得る。懸濁培養のための1つの適切なMDCK細胞株は、MDCK 33016(DSM ACC 2219として寄託された)である。代替物として、マイクロキャリア培養(microcarrier culture)が、使用され得る。
【0040】
インフルエンザウイルス複製を補助する細胞株は、好ましくは、無血清培地および/またはタンパク質を含まない培地において増殖される。培地は、ヒト起源または動物起源の血清に由来する添加物が存在しない本発明の文脈において、無血清培地と称される。タンパク質を含まないことは、上記細胞の増殖がタンパク質、成長因子、他のタンパク質添加物および非血清タンパク質を排除して生じる培養を意味すると理解されるが、ウイルス増殖に必要であり得るトリプシンまたは他のプロテアーゼなどのタンパク質を必要に応じて含み得る。そのような培養物において増殖する細胞は、細胞自体のタンパク質をもちろん含む。
【0041】
インフルエンザウイルス複製を補助する細胞株は、好ましくは、例えば、ウイルス複製の間に、37℃未満(例えば、30〜36℃、または約30℃、31℃、32℃、33℃、34℃、35℃、36℃)で増殖される[64]。
【0042】
培養された細胞においてウイルスを増殖させるための方法は、一般に、その培養された細胞に培養されるべき株を接種する工程、ウイルス増殖(例えば、ウイルス力価または抗原発現によって決定される)のために所望の期間(例えば、接種の24時間後と168時間後との間)にわたって、感染された細胞を培養する工程、および増殖されたウイルスを回収する工程を包含する。上記培養された細胞は、1:500〜1:1、好ましくは、1:100〜1:5、より好ましくは、1:50〜1:10の細胞比まで、ウイルス(PFUまたはTCID50によって測定される)を接種される。上記ウイルスは、上記細胞の懸濁物に添加されるか、または上記細胞の単一層に適用され、そしてそのウイルスは、25℃〜40℃(好ましくは、28℃〜37℃)にて、少なくとも60分間(しかし通常は、300分未満(好ましくは、90分間と240分間との間))にわたってその細胞上に吸着される。上記感染された細胞の培養物(例えば、単一層)は、回収される培養上清のウイルス含量を増大させるために、凍結解凍または酵素作用のいずれかによって除去され得る。次いで、上記回収された流体は、凍結されて不活化または保存のいずれかが行われる。培養された細胞は、約0.0001〜10、好ましくは、0.002〜5、より好ましくは、0.001〜2の感染多重度(「m.o.i.」)にて感染され得る。よりさらに好ましくは、上記細胞は、約0.01のm.o.iにて感染される。感染された細胞は、感染後30時間〜60時間で回収され得る。好ましくは、上記細胞は、感染後34時間〜48時間で回収される。よりさらに好ましくは、上記細胞は、感染後38時間〜40時間で回収される。プロテアーゼ(代表的に、トリプシン)は、一般に、ウイルスの放出を可能にするために細胞培養の間に添加され、そしてそのプロテアーゼは、その培養の間の任意の適切な段階において添加され得る。
【0043】
赤血球凝集素(HA)は、不活化インフルエンザワクチン中の主要な免疫原であり、そしてワクチン用量は、代表的に、一次元放射状免疫拡散(SRID)アッセイによって測定されるようなHAレベルを参照することによって標準化される。ワクチンは、代表的に、1株あたり約15μgのHAを含むが、より低い用量がまた、例えば、小児のためかまたは流行性の状況において使用される。1/2(すなわち、1株あたり7.5μgのHA)、1/4および1/8のような分割量が、より高い用量(例えば、3×用量または9×用量[65、66])を有する場合に使用されている[6、7]。したがって、ワクチンは、1つのインフルエンザ株あたり0.1μgと150μgとの間のHA、好ましくは、0.1μgと50μgとの間(例えば、0.1μg〜20μg、0.1μg〜15μg、0.1μg〜10μg、0.1μg〜7.5μg、0.5μg〜5μgなど)のHAを含み得る。特定の用量は、例えば、1株あたり約45、約30、約15、約10、約7.5、約5、約3.8、約1.9、約1.5などを含む。これらのより低い用量は、本発明のようにアジュバントがワクチン中に存在する場合、最も有用である。
【0044】
生ワクチンについて、投薬量は、HA含量よりもむしろ50%組織培養感染量(TCID50)によって測定され、そして1株あたり106と108との間(好ましくは、106.5〜107.5の間)のTCID50が、代表的である。
【0045】
本発明で使用されるHAは、ウイルスにおいて見出されるような天然のHAであっても、改変されていてもよい。例えば、ウイルスを鳥類種において非常に病原性にする決定因子(例えば、HA1とHA2との切断部位周辺の超塩基性領域(hyper−basic region))を除去するためにHAを改変することが、公知である。なぜならば、これらの決定因子は、そうでなければウイルスが卵において増殖されることを妨げ得るからである。
【0046】
本発明のキットの抗原成分は、特に、スプリットワクチンまたは表面抗原ワクチンのために、洗浄剤(例えば、ポリオキシエチレンソルビタンエステル界面活性剤(「Tweens」として公知である)、オクトキシノール(例えば、オクトキシノール−9(Triton X−100)またはt−オクチルフェノキシポリエトキシエタノール)、臭化セチルトリメチルアンモニウム(「CTAB」)、またはデオキシコール酸ナトリウム)を含み得る。上記洗浄剤は、微量でのみ存在し得る。したがって、上記ワクチンは、各々1mg/ml未満のオクトキシノール−10、α−コハク酸水素トコフェロールおよびポリソルベート80を含み得る。残りの他の微量成分は、抗生物質(例えば、ネオマイシン、カナマイシン、ポリミキシンB)であり得る。
【0047】
不活化されている非全細胞ワクチン(例えば、ウイルス成分ワクチンまたは精製された表面抗原ワクチン)は、この抗原内に位置するさらなるT細胞エピトープからの利益を受けるために、マトリックスタンパク質を含み得る。したがって、赤血球凝集素およびノイラミニダーゼを含む非全細胞ワクチン(特に、スプリットワクチン)は、M1および/またはM2マトリックスタンパク質をさらに含み得る。マトリックスタンパク質が存在する場合、検出可能なレベルのM2マトリックスタンパク質を含むことが、好ましい。核タンパク質もまた、存在し得る。
【0048】
(不溶性粒子状アジュバント)
本発明の組成物およびキットは、不溶性粒子状アジュバントを含む。本発明に有用な適切な不溶性粒子状アジュバントの例としては、アルミニウム塩、カルシウム塩、および微粒子が挙げられるが、これらに限定されない。
【0049】
上記不溶性粒子状アジュバントは、代表的に、吸着剤として機能して、抗原およびアジュバントが使用される場合に、その抗原(例えば、赤血球凝集素)が、そのアジュバントに吸着される。しかし、微粒子について、その粒子表面上に上記抗原を吸着する代わりとして(または上記抗原を吸着することに加えて)、その抗原をその粒子の内部に封入することが、可能である。
【0050】
(アルミニウム塩)
適切なアルミニウム塩としては、水酸化アルミニウムおよびリン酸アルミニウムとして公知であるアジュバントが挙げられる。これらの名前は、慣習的であるが、便宜上のみに使用され、いずれも存在している実際の化合物の正確な説明でもない[例えば、参考文献67の第9章を参照のこと]。本発明は、アジュバントとして一般的に使用される任意の「水酸化物」アジュバントまたは「リン酸塩」アジュバントを使用し得る。
【0051】
「水酸化アルミニウム」として公知であるアジュバントは、代表的に、オキシ水酸化アルミニウム塩であり、それは、通常、少なくとも部分的に結晶性である。式AlO(OH)によって表され得るオキシ水酸化アルミニウムは、赤外(IR)分光学によって、特に、1070cm−1における吸収帯および3090〜3100cm−1における強力なショルダーの存在によって水酸化アルミニウムAl(OH)3のようなその他のアルミニウム化合物と区別され得る[参考文献67の第9章])。水酸化アルミニウムアジュバントの結晶化度の程度は、回折バンドの半価幅(WHH)に反映され、結晶性の低い粒子は、より小さい結晶サイズに起因して、より大きい線幅拡大を示す。WHHが増大する場合、表面積は、増大し、そしてより高いWHH値を有するアジュバントは、抗原吸着についてのより大きい能力を有することが見出されている。繊維状の形態学(例えば、透過型電子顕微鏡写真において見られるような)は、水酸化アルミニウムアジュバントに関して代表的である。水酸化アルミニウムアジュバントのpIは、代表的に、約11である(すなわち、そのアジュバント自体は、生理学的pHにて正の表面電荷を有する)。pH7.4において1mgのAl+++あたり1.8mg〜2.6mgの間の吸着力が、水酸化アルミニウムアジュバントについて報告されている。
【0052】
「リン酸アルミニウム」として公知であるアジュバントは、代表的に、ヒドロキシリン酸アルミニウムであり、それはまた、しばしば少量の硫酸塩(すなわち、ヒドロキシリン酸アルミニウムサルフェート)を含む。それらのアジュバントは、沈殿によって得られ得、そして沈殿の間の反応条件および濃度は、上記塩におけるヒドロキシルに対するリン酸の置換の程度に影響を及ぼす。ヒドロキシリン酸塩は、一般に、0.3と1.2との間のPO4/Alモル比を有する。ヒドロキシリン酸塩は、厳密なAlPO4からヒドロキシル基の存在によって区別され得る。例えば、3164cm−1におけるIRスペクトルバンド(例えば、200℃まで加熱される場合)は、構造的なヒドロキシルの存在を示す[参考文献67の第9章]。
【0053】
リン酸アルミニウムアジュバントのPO4/Al3+モル比は、一般に、0.3と1.2との間、好ましくは、0.8と1.2との間、そしてより好ましくは、0.95±0.1である。上記リン酸アルミニウムは、一般に、特にヒドロキシリン酸塩については特に非晶質である。代表的なアジュバントは、0.84と0.92との間のPO4/Alモル比を有する非晶質のヒドロキシリン酸アルミニウムであり、1mlあたり0.6mgのAl3+で含む。上記リン酸アルミニウムは、一般に、粒子状(例えば、透過型電子顕微鏡写真において見られるような板状の形態学)である。その粒子の代表的な直径は、任意の抗原吸着の後において0.5μm〜20μm(例えば、約5μm〜10μm)の範囲である。pH7.4において1mgのAl+++あたり0.7mg〜1.5mgの間のタンパク質を吸着する能力が、リン酸アルミニウムアジュバントについて報告されている。
【0054】
リン酸アルミニウムの荷電ゼロ点(PZC)は、ヒドロキシルに対するリン酸の置換の程度に逆に相関し、そしてこの置換の程度は、沈殿によって上記塩を調製するために使用される反応条件および濃度に依存して変動し得る。PZCはまた、溶液中の遊離リン酸イオンの濃度(より多いリン酸塩=より酸性のPZC)を変化させること、またはヒスチジン緩衝剤(PZCをより塩基性にする)などの緩衝剤を添加することによって変えられる。本発明に従って使用されるリン酸アルミニウムは、一般に、4.0と7.0との間、より好ましくは5.0と6.5との間(例えば、約5.7)のPZCを有する。
【0055】
本発明で使用されるアルミニウム塩の懸濁物は、緩衝剤(例えば、リン酸緩衝剤またはヒスチジン緩衝剤またはTris緩衝剤)を含み得るが、これは、常に必要であるとは限らない。上記懸濁物は、好ましくは、無菌であり、かつ発熱物質を含まない。懸濁物は、例えば、1.0mMと20mMとの間、好ましくは5mMと15mMとの間、そしてより好ましくは約10mMの濃度で存在する、遊離型の水性リン酸イオンを含み得る。上記懸濁物はまた、塩化ナトリウムを含み得る。
【0056】
本発明の1つの実施形態において、上記アジュバントは、水酸化アルミニウムおよびリン酸アルミニウムの両方の混合物を含む[6]。この場合において、水酸化アルミニウムよりも多いリン酸アルミニウム(例えば、少なくとも2:1(例えば、≧5:1、≧6:1、≧7:1、≧8:1、≧9:1など)の重量比)が、存在し得る。
【0057】
患者に対する投与のための組成物におけるAl+++の濃度は、好ましくは、10mg/ml未満(例えば、≦5mg/ml、≦4mg/ml、≦3mg/ml、≦2mg/ml、≦1mg/mlなど)である。好ましい範囲は、0.3mg/mlと1mg/mlとの間である。0.85mg/用量未満の最大量が、好ましい。
【0058】
(カルシウム塩)
種々のカルシウム塩のうち、一般に、リン酸カルシウムのみが、アジュバントとして使用される。リン酸カルシウムの種々のアジュバント形態が、報告されており、そして任意のこれらの形態が、本発明によって使用され得る:
水和リン酸カルシウムゲルアジュバントは、Superfos(Vedbaek,Denmark)から入手可能である。
【0059】
参考文献67の第8章は、1995年にリン酸カルシウムアジュバントを概説した。抗原は、その抗原の存在下における塩のその場での沈殿(in situ precipitation)または予め形成された塩への吸着のいずれかによって、リン酸カルシウムに吸着され得る。予め形成されたリン酸カルシウムゲルの商業的供給源は、言及される。詳細は、吸着力を含む上記アジュバントの物理化学的特徴に対する沈殿条件の効果について与えられる。
【0060】
参考文献68は、種々のリン酸カルシウムアジュバントの構造特性および吸着特性について報告する。厳密なCa3(PO4)2であるよりもむしろ、上記アジュバントは、式Ca10−x(HPO4)x(PO4)6−x(OH)2−xの非化学量論的なヒドロキシアパタイト、および5.5の荷電ゼロ点(PZC)を有するpH依存性の表面荷電であることが報告された。上記アジュバントは、約10nm×150nmの寸法を有する針様粒子、および約20〜30nmの直径を有する不規則に成形された板(plate)を形成し得る。
【0061】
参考文献69は、空の反応部位を含む反応性の非晶質リン酸カルシウムを開示し、その反応部位は、非晶質炭酸・リン酸カルシウムの炭酸プレ成分(pre−component)を、そのプレ成分の気体または蒸気の副産物への熱分解によって除去することによって得られた。
【0062】
参考文献70および71は、粒子状リン酸カルシウムアジュバント(「CAP」)を開示し、その粒子は、300〜4000nmの範囲の直径(ナノ粒子)を有し、そして球形状および平滑面を有する。参考文献72は、これらの粒子が粘膜免疫感作のために使用され得ることを開示する。
【0063】
粘膜免疫感作はまた、参考文献73に開示され、IgA抗体応答をもたらすために哺乳動物にワクチン接種するための方法は、上皮を横切る輸送に適したサイズの粒子状炭酸・リン酸カルシウムを使用する。
【0064】
参考文献74は、インビボで可溶性である複合粒子を開示し、そしてその複合粒子は、その表面上にコーティングされた約1.0〜2.0のCa/P比を有するリン酸カルシウム化合物を有するポリマー物質の粒子を含む。
【0065】
参考文献75は、ワクチンを吸着するためのリン酸カルシウムの注射可能な水性ゲルを開示し、Ca/Pの重量比が1.62〜1.85であり、かつ1リットルあたり0.07個のCa原子を含む場合にそのゲルの沈殿時間が10分間で20℃にて1〜20mmの間であるような割合で、カルシウムイオンおよびリン酸イオンが、合わせられる。
【0066】
リン酸カルシウムアジュバントのCa対Pのモル比は、例えば、1.35と1.83との間で変動し得る[参考文献67の第8章を参照のこと]。上記アジュバントの吸着特性は、沈殿の間に使用される条件に依存して変動することが見出されている(例えば、緩徐な混合は、迅速な混合によって形成されたアジュバントよりも低い吸着力を有するアジュバントを与えた)。
【0067】
Ca++として測定される本発明のワクチン中のリン酸カルシウムの量は、0.1mg/mlと10mg/mlとの間(例えば、0.5〜5mg/ml、好ましくは0.75〜3mg/ml、0.9〜1.5mg/mlまたは約1mg/ml)であり得る。
【0068】
上記リン酸カルシウムアジュバントは、抗原を吸着する能力を有する。所与の抗原について、その抗原の総量の少なくとも80重量%(例えば、85重量%以上、90重量%以上、92.5重量%以上、95重量%以上、97.5重量%以上、97.5重量%以上、98重量%以上、99重量%以上、99.5重量%以上など)が、吸着される。リン酸カルシウムアジュバントが不溶性である場合、吸着の程度は、従来通り、遠心分離を含む方法、およびその後の、固体物質または可溶性物質の一方(または両方)である抗原の量の決定によって測定され得る。吸着されていない抗原は、遠心分離後に溶液のままである。例えば、リン酸カルシウムアジュバントの吸着力は、参考文献76において、この方法によって測定された。1mgのCa++に対するジフテリアトキソイドおよび破傷風トキソイドの吸着は、(a)ジフテリアトキソイドレベルが100Lfを上回って上昇した場合、および(b)破傷風トキソイドレベルが25Lfを上回って上昇した場合に、不完全であった。
【0069】
吸着についてリン酸カルシウムアジュバントは、好ましくは、インフルエンザ抗原が添加される水性懸濁物の形態で使用される。上記カルシウム塩は、上記抗原を添加する前に、必要とされる濃度まで希釈され得る。
【0070】
(微粒子)
微粒子は、アジュバントとして使用するために所望されている(例えば、参考文献77および78を参照のこと)。
【0071】
好ましい微粒子は、生分解性でありかつ非毒性のポリマーから作製される。例えば、それらは、以下からなる群より選択されるポリマーから作製され得る:ポリ(α−ヒドロキシ酸)、ポリヒドロキシ酪酸、ポリカプロラクトン、ポリオルトエステル、ポリ無水物、およびポリシアノアクリレート。これらのポリマーのコポリマー(例えば、すなわち、D,L−ラクチドとカプロラクトンとのコポリマー)もまた、使用され得る。
【0072】
好ましいポリマーは、ポリ(α−ヒドロキシ酸)、より好ましくはポリ(L−ラクチド)、ポリ(D,L−ラクチド)およびポリ(D,L−ラクチド−co−グリコリド)からなる群より選択されるものである。最も好ましいポリマーは、「PLG」と称されるポリ(D,L−ラクチド−co−グリコリド)ポリマーである。好ましいポリ(D,L−ラクチド−co−グリコリド)ポリマーは、25:75〜75:25の範囲、より好ましくは、40:60〜60:40(例えば、約50:50)の範囲のラクチド/グリコリドモル比を有するものである。50%のD,L−ラクチドおよび50%のグリコリドを含む50:50のPLGポリマーは、迅速に再吸収するコポリマーを提供するが、75:25のPLGは、よりゆっくりと分解し、そして85:15および90:10は、増大したラクチド成分に起因して、よりさらにゆっくりと分解する。
【0073】
これらのポリマーは、種々の分子量で利用可能であり、そして所与の抗原に関して適切な分子量は、当業者によって容易に決定される。ポリラクチドについて、例えば、適切な分子量は、約2000〜5000のオーダーである。PLGについて、適切な分子量は、一般に、約10,000〜約200,000の範囲、好ましくは、約15,000〜約150,000の範囲、そして最も好ましくは、約50,000〜約100,000の範囲である。有用な範囲は、30,000ダルトン〜70,000ダルトンである。
【0074】
微粒子は、約100nm〜約150μmの範囲の直径、より好ましくは、約200nm〜約30μmの範囲の直径、そして最も好ましくは約500nm〜約10μmの範囲の直径を有し得る。それらの微粒子は、代表的に、実質的に球状である。
【0075】
微粒子は、種々の方法で作製され得る。例えば、二重エマルション/溶媒蒸発(double emulsion/solvent evaporation)技術が、公知であり、その技術は、ポリマー溶液の小滴からなる一次エマルションの形成を包含し、その一次エマルションは、次いで粒子安定剤/界面活性剤を含む連続した水相と混合される。より具体的には、水中油中水型(water−in−oil−in−water)(w/o/w)溶媒蒸発系が、参考文献79に記載されるように、上記微粒子を形成するために使用され得る。この技術において、特定のポリマーは、有機溶媒(例えば、酢酸エチル、ジメチルクロリド(塩化メチレンおよびジクロロメタンとも称される)、アセトニトリル、アセトン、クロロホルムなど)と合わせられる。上記ポリマーは、有機溶媒中の約2〜15%溶液、より好ましくは、約4〜10%溶液、そして最も好ましくは、6%溶液で提供される。上記ポリマー溶液は、例えば、ホモジナイザーを使用して乳化される。次いで、上記エマルションは、エマルション安定剤(例えば、ポリビニルアルコール(PVA)またはポリビニルピロリドン)のより大きい容量の水溶液と合わせられる。上記エマルション安定剤は、代表的に、約2〜15%溶液、より代表的に、約4〜10%溶液で提供される。次いで、その混合物は、安定なw/o/w二重エマルションを産生するためにホモジナイズされる。次いで、有機溶媒は、蒸発される。処方パラメータは、小さい(<5μm)微粒子および大きい(>30μm)微粒子の調製を可能にするために操作され得る。例えば、撹拌の減少は、内相の容量の増加をもたらすような、より大きい微粒子を生じる。粒径は、慣用的な方法によって決定され得る。
【0076】
二重エマルション技術を使用することと同様に、一重エマルション(single emulsion)技術もまた、使用され得る。微粒子はまた、噴霧乾燥およびコアセルベーションを使用して形成されても、気中懸濁被覆技術(例えば、パンコーティングおよびWursterコーティング)によって形成されてもよい。イオンゲル化(ionic gelation)もまた、使用され得る。
【0077】
調製の後、微粒子は、それらが、すなわち、さらなる使用のために凍結乾燥され得るように、保存され得る。
【0078】
調製された微粒子上に抗原を吸着させるための1つの方法は、以下の通りである。微粒子は、再度水和され、そして透析可能な洗浄剤を使用して微粒子の本質的に単一の懸濁物へと分散される。有用な洗浄剤としては、任意の種々のN−メチルグルカミド(MEGAとして公知である)(例えば、ヘプタノイル−N−メチルグルカミド(MEGA−7)、オクタノイル−Nメチルグルカミド(MEGA−8)、ノナノイル−N−メチルグルカミド(MEGA−9)、およびデカノイル−N−メチルグルカミド(MEGA−10));コール酸;コール酸ナトリウム;デオキシコール酸;デオキシコール酸ナトリウム;タウロコール酸;タウロコール酸ナトリウム;タウロデオキシコール酸;タウロデオキシコール酸ナトリウム;3[(3−コールアミドプロピル)ジメチルアンモニオ]−1−プロパン−サルフェート(CHAPS);3−[(3 コールアミドプロピル)ジメチルアンモニオ]−2−ヒドロキシ−1−プロパン−サルフェート(CHAPSO);N−ドデシル−N,N−ジメチル−3−アンモニオール(ammoniol)−プロパン−サルフェート(ZWITTERGENT 3−12);N,N−ビス−(3−Dグルコンアミドプロピル(Dgluconeamidopropyl))−デオキシコールアミド(DEOXY−BIGCHAP);Nオクチルグルコシド(Noctylglucoside);モノラウリル酸スクロース;グリココール酸/グリココール酸ナトリウム;ラウロサルコシン(ナトリウム塩);グリコデオキシコール酸/グリコデオキシコール酸ナトリウムが挙げられるが、これらに限定されない。一般に、洗浄剤 対 微粒子の約0.0156:1の比(w:w)、が使用され、より好ましくは、約0.625:1の比、よりさらに好ましくは、約0.25:1の比、そして最も好ましくは、約1:1〜2:1の比(洗浄剤 対 微粒子(w:w))が使用される。
【0079】
次いで、上記微粒子/洗浄剤混合物は、例えば、セラミック製の乳鉢および乳棒を使用して、滑らかなスラリーが形成されるまで、物理的にすり砕かれる。次いで、適切な水性緩衝剤(例えば、リン酸緩衝化生理食塩水(PBS)またはTris緩衝化生理食塩水)が、添加され、そして得られた混合物は、上記微粒子が十分に懸濁されるまで、超音波処理またはホモジナイズされる。次いで、目的の抗原が、上記微粒子懸濁物に添加され、そしてその系は、洗浄剤を除去するために透析される。上記ポリマー微粒子および洗浄剤系は、好ましくは、目的の抗原がその抗原の活性を依然として維持しつつその微粒子の表面に吸着するように選択される。表面に吸着した抗原を含む得られた微粒子は、結合していない抗原を含まないように洗浄され得、そして以下でさらに記載されるように、適切な緩衝剤処方物中の懸濁物として保存されても、適切な賦形剤と一緒に凍結乾燥されてもよい。
【0080】
微粒子は、必要に応じて、負に荷電した表面(例えば、SDSを用いる)または正に荷電した表面(例えば、カチオン性洗浄剤(例えば、CTAB)を用いる)を有するように処理され得る。表面特徴の変化は、吸着される抗原に従う吸着特徴を変化させ得る。
【0081】
(免疫増強物質)
本発明の組成物は、免疫増強物質を含み、そして免疫増強物質と不溶性粒子状アジュバントとの組合せは驚くほど有効な免疫原性組成物を与えることが、見出されている。
【0082】
好ましい免疫増強物質は、Toll様レセプター(TLR)のアゴニストである。例えば、それらは、ヒトTLR1タンパク質、ヒトTLR2タンパク質、ヒトTLR3タンパク質、ヒトTLR4タンパク質、ヒトTLR7タンパク質、ヒトTLR8タンパク質、および/またはヒトTLR9タンパク質のうちの1つ以上のアゴニストであり得る。好ましい薬剤は、TLR7のアゴニスト(例えば、イミダゾキノリン(imidazoquinilone))および/またはより好ましくは、TLR9のアゴニスト(例えば、CpGオリゴヌクレオチド)である。これらの免疫増強物質は、先天免疫経路を活性化するために有用である。
【0083】
代表的な免疫増強物質は、有機化合物であり、そしてそれらは、通常、ポリマーではない。それらは、2kDa未満(例えば、1800Da未満、1600Da未満、1400Da未満、1200Da未満、1000Da未満、800Da未満、600Da未満、500Da未満、400Da未満、300Da未満、または200Da未満)の分子量を有し得る。
【0084】
適切な免疫増強物質としては、以下が挙げられるが、これらに限定されない:
−免疫刺激性オリゴヌクレオチド(例えば、CpGモチーフ(リン酸結合によってグアノシンに結合された非メチル化シトシンを含むジヌクレオチド配列)または二本鎖RNAを含むもの、あるいはパリンドローム配列を含むオリゴヌクレオチド、あるいはポリ(dG)配列を含むオリゴヌクレオチド)。
−3−O−脱アシル化モノホスホリルリピドA(「MPLTM」としても公知である「3dMPL」)[80〜83]。
−イミダゾキノリン化合物(例えば、イミキモッド(Imiquimod)(「R837」)[84、85]、レシキモッド(Resiquimod)(「R−848」)[86]、およびそれらのアナログ;ならびにそれらの塩(例えば、塩酸塩)。免疫刺激性イミダゾキノリンについてのさらなる詳細は、参考文献87〜91に見出され得る。
−チオセミカルバゾン化合物(例えば、参考文献92に開示されるもの)。活性化合物についての処方、製造、およびスクリーニングの方法はまた、参考文献92に記載される。−トリプタントリン化合物(例えば、参考文献93に開示されるもの)。活性化合物についての処方、製造、およびスクリーニングの方法はまた、参考文献93に記載される。
−(a)イサトラビン(Isatorabine)(ANA−245;7−チア−8−オキソグアノシン):
【0085】
【化1】

などのヌクレオシドアナログ、およびそのプロドラッグ;(b)ANA975;(c)ANA−025−1;(d)ANA380;(e)参考文献94〜96に開示される化合物;(f)式:
【0086】
【化2】

を有する化合物(ここで、
R1およびR2は、各々独立して、H、ハロ、−NRaRb、−OH、C1−6アルコキシ、置換C1−6アルコキシ、ヘテロシクリル、置換ヘテロシクリル、C6−10アリール、置換C6−10アリール、C1−6アルキル、または置換C1−6アルキルであり;
R3は、存在しないか、H、C1−6アルキル、置換C1−6アルキル、C6−10アリール、置換C6−10アリール、ヘテロシクリル、または置換ヘテロシクリルであり;
R4およびR5は、各々独立して、H、ハロ、ヘテロシクリル、置換ヘテロシクリル、−C(O)−Rd、C1−6アルキル、置換C1−6アルキルであるか、または一緒に結合されてR4−5:
【0087】
【化3】

のような5員環を形成し、この結合は、
【0088】
【化4】

によって示される結合において達成され、X1およびX2は、各々独立して、N、C、O、またはSであり;
R8は、H、ハロ、−OH、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、−OH、−NRaRb、−(CH2)n−O−Rc、−O−(C1−6アルキル)、−S(O)pRe、または−C(O)−Rdであり;
R9は、H、C1−6アルキル、置換C1−6アルキル、ヘテロシクリル、置換ヘテロシクリルまたはR9aであり、R9aは、
【0089】
【化5】

であり、この結合は、
【0090】
【化6】

によって示される結合において達成され;
R10およびR11は、各々独立して、H、ハロ、C1−6アルコキシ、置換C1−6アルコキシ、−NRaRb、または−OHであり;
各々のRaおよびRbは、独立して、H、C1−6アルキル、置換C1−6アルキル、−C(O)Rd、C6−10アリールであり;
各Rcは、独立して、H、ホスフェート、ジホスフェート、トリホスフェート、C1−6アルキル、または置換C1−6アルキルであり;
各Rdは、独立して、H、ハロ、C1−6アルキル、置換C1−6アルキル、C1−6アルコキシ、置換C1−6アルコキシ、−NH2、−NH(C1−6アルキル)、−NH(置換C1−6アルキル)、−N(C1−6アルキル)2、−N(置換C1−6アルキル)2、C6−I0アリール、またはヘテロシクリルであり;
各Reは、独立して、H、C1−6アルキル、置換C1−6アルキル、C6−10アリール、置換C6−10アリール、ヘテロシクリル、または置換ヘテロシクリルであり;
各Rfは、独立して、H、C1−6アルキル、置換C1−6アルキル、−C(O)Rd、ホスフェート、ジホスフェート、またはトリホスフェートであり;
各nは、独立して、0、1、2、または3であり;
各pは、独立して、0、1、または2である);あるいは(g)(a)〜(f)のいずれかの薬学的に受容可能な塩、(a)〜(f)のいずれかの互変異性体、またはその互変異性体の薬学的に受容可能な塩。
−ロキソリビン(Loxoribine)(7−アリル−8−オキソグアノシン)[97]。
−ポリオキシドニウム(polyoxidonium)ポリマー[98、99]または他のN−酸化ポリエチレン−ピペラジン誘導体。
−参考文献100に開示される化合物。
−参考文献101に規定されるような、式I、IIまたはIII:
【0091】
【化7】

の化合物、あるいはその塩、例えば、「ER 803058」、「ER 803732」、「ER 804053」、「ER 804058」、「ER 804059」、「ER
804442」、「ER 804680」、「ER 804764」、「ER 804057」(以下に示される構造):
【0092】
【化8】

またはER−803022(以下に示される構造):
【0093】
【化9】

−アミノアルキルグルコサミニドグルコサミニドホスフェート誘導体(例えば、RC−529[102、103])。
−例えば、参考文献104および105に記載されるようなポリ[ジ(カルボキシレートフェノキシ(carboxylatophenoxy))ホスファゼン](「PCPP」)などのホスファゼン。
−TLR4アンタゴニストE5564[106、107]:
【0094】
【化10】

などの、ホスフェート含有非環式骨格に結合された脂質を含む化合物。
−ムラミルペプチド(例えば、N−アセチルムラミル−L−トレオニル−D−イソグルタミン(「thr−MDP」)、N−アセチル−ノルムラミル−L−アラニル−D−イソグルタミン(nor−MDP)、N−アセチルグルコサミニル−N−アセチルムラミル−L−Al−D−イソグル−L−Ala−ジパルミトキシ(dipalmitoxy)プロピルアミド(「DTP−DPP」、または「TheramideTM」)、N−アセチルムラミル−L−アラニル−D−イソグルタミニル−L−アラニン−2−(1’−2’ジパルミトイル−sn−グリセロ−3−ヒドロキシホスホリルオキシ)−エチルアミン(「MTP−PE」)。
−参考文献108に開示される化合物(アシルピペラジン化合物、インドールジオン化合物、テトラヒドライソキノリン(THIQ)化合物、ベンゾシクロジオン化合物、アミノアザビニル化合物、アミノベンゾイミダゾールキノリノン(ABIQ)化合物[109、110]、ヒドラフタラミド化合物、ベンゾフェノン化合物、イソキサゾール化合物、ステロール化合物、キナジリノン化合物、ピロール化合物[111]、アントラキノン化合物、キノキサリン化合物、トリアジン化合物、ピラゾロピリミジン(Pyrazalopyrimidine)化合物、およびベンザゾール(Benzazole)化合物[112]を含む)。
−メチルイノシン5’−モノホスフェート(「MIMP」)[113]。
−式:
【0095】
【化11】

を有するもの(Rは、水素、直鎖または分枝鎖であり、非置換または置換であり、不飽和または飽和である、アシル基、アルキル基(例えば、シクロアルキル基)、アルケニル基、アルキニル基およびアリール基、あるいはそれらの薬学的に受容可能な塩または誘導体からなる群より選択される)などのポリヒドロキシル化ピロリジン化合物[114]。例としては、カスアリン(casuarine)、カスアリン−6−α−D−グルコピラノース、3−エピ−カスアリン、7−エピ−カスアリン、3,7−ジエピ−カスアリンなどが挙げられるが、これらに限定されない。
−N2−メチル−1−(2−メチルプロピル)−1H−イミダゾ[4,5−c]キノリン−2,4−ジアミン;
N2,N2−ジメチル−1−(2−メチルプロピル)−1H−イミダゾ[4,5−c]キノリン−2,4−ジアミン;
N2−エチル−N2−メチル−1−(2−メチルプロピル)−1H−イミダゾ[4,5−c]キノリン−2,4−ジアミン;
N2−メチル−1−(2−メチルプロピル)−N2−プロピル−1H−イミダゾ[4,5−c]キノリン−2,4−ジアミン;
1−(2−メチルプロピル)−N2−プロピル−1H−イミダゾ[4,5−c]キノリン−2,4−ジアミン;
N2−ブチル−1−(2−メチルプロピル)−1H−イミダゾ[4,5−c]キノリン−254−ジアミン;
N2−ブチル−N2−メチル−1−(2−メチルプロピル)−1H−イミダゾ[4,5−c]キノリン−2,4−ジアミン;
N2−メチル−1−(2−メチルプロピル)−N2−ペンチル−1H−イミダゾ[4,5−c]キノリン−2,4−ジアミン;
N2−メチル−1−(2−メチルプロピル)−N2−プロプ−2−エニル−1H−イミダゾ[4,5−c]キノリン−2,4−ジアミン;
1−(2−メチルプロピル)−2−[(フェニルメチル)チオ]−1H−イミダゾ[4,5−c]キノリン−4−アミン;
1−(2−メチルプロピル)−2−(プロピルチオ)−1H−イミダゾ[4,5−c]キノリン−4−アミン;
2−[[4−アミノ−1−(2−メチルプロピル)−1H−イミダゾ[4,5−c]キノリン−2−イル](メチル)アミノ]エタノール;
2−[[4−アミノ−1−(2−メチルプロピル)−1H−イミダゾ[4,5−c]キノリン−2−イル](メチル)アミノ]エチルアセテート;
4−アミノ−1−(2−メチルプロピル)−1,3−ジヒドロ−2H−イミダゾ[4,5−c]キノリン−2−オン;
N2−ブチル−1−(2−メチルプロピル)−N4,N4−ビス(フェニルメチル)−1H−イミダゾ[4,5−c]キノリン−2,4−ジアミン;
N2−ブチル−N2−メチル−1−(2−メチルプロピル)−N4,N4−ビス(フェニルメチル)−1H−イミダゾ[4,5−c]キノリン−2,4−ジアミン;
N2−メチル−1−(2−メチルプロピル)−N4,N4−ビス(フェニルメチル)−1H−イミダゾ[4,5−c]キノリン−2,4−ジアミン;
N2,N2−ジメチル−1−(2−メチルプロピル)−N4,N4−ビス(フェニルメチル)−1H−イミダゾ[4,5−c]キノリン−2,4−ジアミン;
1−{4−アミノ−2−[メチル(プロピル)アミノ]−1H−イミダゾ[4,5−c]キノリン−1−イル}−2−メチルプロパン−2−オール;
1−[4−アミノ−2−(プロピルアミノ)−1H−イミダゾ[4,5−c]キノリン−1−イル]−2−メチルプロパン−2−オール;
N4,N4−ジベンジル−1−(2−メトキシ−2−メチルプロピル)−N2−プロピル−1H−イミダゾ[4,5−c]キノリン−2,4−ジアミン;
などの低分子免疫増強物質(SMIP)。
【0096】
上記免疫増強物質は、上記組成物に、その産生の間の種々の段階において添加され得る。例えば、上記免疫増強物質は、抗原組成物内にあり得、次いで、この混合物は、不溶性粒子状アジュバントに添加され得る。その代わりとして、上記免疫増強物質は、不溶性粒子状アジュバントと混合され得、次いで、この混合物は、上記抗原と混合され得る。
【0097】
上記免疫増強物質は、抗原などの別個の因子に結合体化され得る(例えば、CRM197)。低分子に対する結合体化技術の総説は、参考文献115に提供される。その代わりとして、上記免疫増強物質は、疎水性相互作用またはイオン性相互作用などによってさらなる因子と非共有結合され得る。
【0098】
2つの好ましい免疫増強物質は、(a)免疫刺激性オリゴヌクレオチド、および(b)3dMPLである。
【0099】
(免疫刺激性オリゴヌクレオチド)
免疫刺激性オリゴヌクレオチドは、ヌクレオチド改変/アナログ(例えば、ホスホロチオエート改変)を含み得、そして二本鎖であっても(dsRNAを除いて)一本鎖であってもよい。参考文献116、117および118は、可能なアナログ置換(例えば、2’−デオキシ−7−デアザグアノシンによるグアノシンの置換)を開示する。CpGオリゴヌクレオチドのアジュバント効果は、参考文献119〜124においてさらに考察される。上記CpG配列は、TLR9に関し得る(例えば、モチーフGTCGTTまたはTTCGTT)[125]。上記CpG配列は、Th1免疫応答の誘導について特異的であり得る(例えば、CpG−A ODN(オリゴデオキシヌクレオチド))か、またはその配列は、B細胞応答の誘導について、より特異的であり得る(例えば、CpG−B ODN)。CpG−A ODNおよびCpG−B ODNは、参考文献126〜128において考察される。好ましくは、上記CpGは、CpG−A ODNである。好ましくは、上記CpG オリゴヌクレオチドは、その5’末端がレセプター認識を達成可能であるように構築される。必要に応じて、2つのCpGオリゴヌクレオチド配列は、「イムノマー(immunomer)」を形成するようにそれらの3’末端において結合され得る。例えば、参考文献125および参考文献129〜131を参照のこと。有用なCpGアジュバントは、ProMuneTM(Coley Pharmaceutical Group,Inc.)としても公知であるCpG7909である。
【0100】
CpG配列を使用する代わりか、またはそれに加えて、TpG配列が、使用され得る[132]。これらのオリゴヌクレオチドは、非メチル化CpGモチーフを含まない可能性がある。
【0101】
上記免疫刺激性オリゴヌクレオチドは、ピリミジンが豊富であり得る。例えば、その免疫刺激性オリゴヌクレオチドは、1個より多くの連続したチミジンヌクレオチド(例えば、参考文献132に開示されるようなTTTT)を含み得るか、そして/または免疫刺激性オリゴヌクレオチドは、>25%(例えば、>35%、>40%、>50%、>60%、>80%など)のチミジンを含むヌクレオチド組成を有し得る。例えば、その免疫刺激性オリゴヌクレオチドは、1個より多くの連続したシトシンヌクレオチド(例えば、参考文献132に開示されるようなCCCC)を含み得るか、そして/またはその免疫刺激性オリゴヌクレオチドは、>25%(例えば、>35%、>40%、>50%、>60%、>80%など)のシトシンを含むヌクレオチド組成を有し得る。これらのオリゴヌクレオチドは、非メチル化CpGモチーフを含まない可能性がある。
【0102】
免疫刺激性オリゴヌクレオチドは、代表的に、少なくとも20個のヌクレオチドを含む。それらは、100個よりも少ないヌクレオチドを含み得る。
【0103】
(3dMPL)
3dMPL(3脱−O−アシル化モノホスホリルリピドAまたは3−O−脱アシル−4’−モノホスホリルリピドAとしても公知である)は、モノホスホリルリピドA中の還元末端グルコサミンの3位が脱アシル化されるアジュバントである。3dMPLは、Salmonella minnesotaのヘプトース欠損(heptoseless)変異体から調製され、そして化学的にリピドAに類似しているが、酸に不安定なホスホリル基および塩基に不安定なアシル基を欠いている。それは、単球/マクロファージ系統の細胞を活性化し、そして数種のサイトカインの放出を刺激する。3dMPLの調製は、最初に、参考文献133に記載された。
【0104】
3dMPLとアルミニウム塩との組合せは、既に公知である(例えば、リン酸アルミニウムとの組合せ[134]、または水酸化アルミニウムとの組合せ[135])。
【0105】
3dMPLは、それらのアシル化によって変動する(例えば、異なる長さであり得る3、4、5または6のアシル鎖を有する)関連分子の混合物の形態をとり得る。2つのグルコサミン(2−デオキシ−2−アミノ−グルコースとしても公知の)単糖は、それらの2位の炭素(すなわち、2位および2’位)でN−アシル化され、そしてまた3’位でO−アシル化されている。炭素2に結合する基は、式−NH−CO−CH2−CR1R1’を有する。炭素2’に結合する基は、式−NH−CO−CH2−CR2R2’を有する。炭素3’に結合する基は、式−O−CO−CH2−CR3R3’を有する。代表的な構造は以下:
【0106】
【化12】

である。
【0107】
基R1、R2およびR3は、各々独立して−(CH2)n−CH3である。nの値は、好ましくは、8〜16の間であり、より好ましくは、9〜12の間であり、そして最も好ましくは、10である。
【0108】
基R1’、R2’およびR3’は、各々独立して、(a)−H;(b)−OH;または(c)−O−CO−R4;であり得、ここでR4は−Hまたは−(CH2)m−CH3のいずれかであり、ここでmの値は、好ましくは、8〜16の間であり、そしてより好ましくは、10、12または14である。2位では、mは、好ましくは、14である。2’位では、mは、好ましくは、10である。3’位では、mは、好ましくは、12である。したがって、基R1’、R2’およびR3’は、好ましくは、ドデカン酸、テトラデカン酸またはヘキサデカン酸由来の−O−アシル基である。
【0109】
R1’、R2’およびR3’のすべてが−Hである場合、上記3dMPLは3つのアシル鎖のみを有する(2位、2’位および3’位の各々に1つ)。R1’、R2’およびR3’のうち2つのみが−Hである場合、上記3dMPLは4つのアシル鎖を有し得る。R1’、R2’およびR3’のうち1つのみが−Hである場合、上記3dMPLは5つのアシル鎖を有し得る。R1’、R2’およびR3’のいずれもが−Hではない場合、上記3dMPLは、6つのアシル鎖を有し得る。本発明に従って用いられる3dMPLアジュバントは、3〜6つのアシル鎖を備えたこれらの形態の混合物であり得るが、この混合物中に6つのアシル鎖をもつ3dMPLを含むことが好ましく、そして特に6つのアシル鎖形態が総3dMPLの少なくとも10重量%、例えば、20重量%以上、30重量%以上、40重量%以上、50重量%以上またはさらに多くを占めることが好ましい。6つのアシル鎖を備えた3dMPLは、最もアジュバント活性な形態であることが見出された。
【0110】
従って、本発明の組成物に含めるために3dMPLの最も好ましい形態は、
【0111】
【化13】

である。
【0112】
3dMPLが混合物の形態で使用される場合、本発明の組成物中の3dMPLの量または濃度に関する言及は、混合物中の合わせた3dMPL種をいう。
【0113】
水性条件では、3dMPLは、異なるサイズを備えた(例えば、直径<150nmまたは>500nmを備えた)ミセル凝集体または粒子を形成し得る。これらのいずれか、または両方は、本発明とともに使用され得、そしてより良好な粒子が通常のアッセイによって選択され得る。より小さな粒子(例えば、3dMPLの透明な水性懸濁物を与えるに十分小さい)が、より優れた活性[136]に起因して、本発明に従う使用に好ましい。好ましい粒子は、220nmより小さいか、より好ましくは200nmより小さいか、150nmより小さいか、あるいは120nmより小さい平均直径を有し、100nmより小さい平均直径を有しさえし得る。しかしながら、大部分の場合において、この平均直径は、50nmより小さくはない。これらの粒子は、濾過滅菌に適するほどに十分小さい。粒子直径は、通常の動的光散乱法の技法によって評価され得、平均粒子直径が明らかとなる。粒子がxnmの直径を有するといわれる場合、一般的にはおおよそこの平均の粒子の分布が存在するが、粒子の数で少なくとも50%(例えば、60%以上、70%以上、80%以上、90%以上、またはそれより多く)がx±25%の範囲内の直径を有する。
【0114】
実質的に全ての3dMPLは、好ましくは、上記エマルションの水相に位置する。
【0115】
ワクチン中の3dMPLの代表的な量は、10〜100μg/用量(例えば、約25μgまたは約50μg)である。
【0116】
(薬学的組成物)
本発明の組成物は、薬学的に受容可能である。それらの組成物は、抗原、アジュバントおよび免疫増強物質に加えて、成分を含み得る(例えば、それらの組成物は、代表的に、1つ以上の薬学的キャリアおよび/または賦形剤を含有する)。そのような成分の徹底的な考察は、参考文献137において入手可能である。
【0117】
上記組成物は、チオメルサールまたは2−フェノキシエタノールなどの保存剤を含み得る。しかし、上記ワクチンは実質的に水銀物質を含まない(すなわち、5μg/ml未満)(例えば、チオメルサールを含まない)べき[14、138]であることが、好ましい。水銀を含まないワクチンが、より好ましい。保存剤を含まないワクチンが、特に好ましい。
【0118】
張度を制御するために、生理的塩(例えば、ナトリウム塩)を含有することが好ましい。塩化ナトリウム(NaCl)が好ましく、その塩化ナトリウムは、1mg/mlと20mg/mlとの間で存在し得る。存在し得る他の塩としては、塩化カリウム、二水素リン酸カリウム、無水二ナトリウムリン酸塩、塩化マグネシウム、塩化カルシウムなどが挙げられる。
【0119】
組成物は、一般に200mOsm/kgと400mOsm/kgとの間、好ましくは240mOsm/kg〜360mOsm/kgの間の浸透圧モル濃度を有し、より好ましくは290〜310mOsm/kgの範囲内となる。浸透圧モル濃度は、ワクチン接種により引き起こされる痛みに対して影響を有しないことが以前に報告されている[139]が、この範囲に浸透圧モル濃度を維持することが、やはり好ましい。
【0120】
組成物は、1つ以上の緩衝剤を含有し得る。代表的な緩衝剤としては、以下が挙げられる:リン酸緩衝剤;Tris緩衝剤;ホウ酸緩衝剤;コハク酸緩衝剤;ヒスチジン緩衝剤;またはクエン酸緩衝剤。緩衝剤は、代表的に5〜20mMの範囲で含有される。
【0121】
組成物のpHは、一般に、5.0と8.1との間、より代表的には6.0と8.0との間、例えば、6.5と7.5との間、または7.0と7.8との間である。したがって、本発明の方法は、包装前にバルクワクチンのpHを調整する工程を包含し得る。
【0122】
上記組成物は、好ましくは、無菌である。上記組成物は、好ましくは、非発熱性である(例えば、1用量あたり<1EU(エンドトキシン単位、標準的な測定単位)、そして好ましくは1用量あたり<0.1EUを含む)。上記組成物は、好ましくは、グルテンを含まない。
【0123】
上記組成物は、単回免疫感作のための物質を含んでも、複数回免疫感作(すなわち、「複数回用量」キット)のための物質を含んでもよい。保存剤を含むことが、複数回用量の準備において好ましい。複数回用量組成物中に保存剤を含むことの代わりとして(またはそれに加えて)、その組成物は、物質を除去するための無菌のアダプターを有する容器中に含まれ得る。
【0124】
インフルエンザワクチンは、代表的に、約0.5mlの投薬容量で投与されるが、半用量(すなわち、約0.25ml)が、小児に投与され得る。
【0125】
組成物中の抗原、アジュバントおよび免疫増強物質は、代表的に、混合物中にある。本発明の組成物は、代表的に、水性形態である。
【0126】
組成物およびキットは、好ましくは、2℃と8℃との間にて保存される。それらは、凍結されるべきではない。それらは、理想的には、直接的な光から免れるべきである。
【0127】
(本発明のキット)
上述の通り、本発明の組成物は、送達時において即座に調製され得る。したがって、本発明は、混合のために調整された種々の成分を備えるキットを提供する。上記キットは、上記アジュバントおよび上記抗原が使用時まで別々に保持されることを可能にする。上記免疫増強物質は、これら2つのキット成分の一方に含まれても、第3のキット成分の部分であってもよい。
【0128】
上記成分は、上記キット内で、互いから物理的に分離した形態であり、そしてこの分離は、種々の手段で達成され得る。例えば、上記成分は、分離したバイアルなどの容器中にあり得る。次いで、上記2つのバイアルの内容物は、例えば、一方のバイアルの内容物を取り出し、そしてそれらを他方のバイアルに添加すること、または両方のバイアルの内容物を別々に取り出し、そしてそれらを第3の容器中で混合することによって混合され得る。
【0129】
好ましい構成(arrangement)において、キット成分のうちの一方は、注射器中にあり、そして他方は、バイアルなどの容器中にある。注射器(例えば、針を有する)が、その成分を混合のための第2の容器中に挿入するために使用され得、次いでその混合物は、その注射器中に引かれ得る。次いで、その注射器の混合された内容物は、代表的に、新規の滅菌針を通して患者に投与され得る。注射器中に1つの成分を包装することは、患者への投与のために別個の注射器を使用する必要性を排除する。
【0130】
別の好ましい構成において、上記2つのキット成分は、同じ注射器(例えば、二重室注射器(dual−chamber syringe)(例えば、参考文献140〜147などに開示されるもの))において、一緒であるが分離して保持される。その注射器が、作動される場合(例えば、患者に対する投与の間)、その2つの室の内容物は、混合される。この構成は、使用時における別個の混合工程に対する必要性を回避する。
【0131】
種々のキット成分の内容は、一般には全て、水性形態にある。いくつかの構成において、一方の成分(代表的に、アジュバント成分よりもむしろ抗原成分)は、乾燥形態(例えば、凍結乾燥された形態)であり、他方の成分は、水性形態である。上記2つの成分は、上記乾燥成分を再活性化し、そして患者に対する投与のための水性組成物を得るために混合され得る。凍結乾燥された成分は、代表的に、注射器よりもむしろバイアル内におかれる。乾燥された成分は、安定剤(例えば、乳糖、ショ糖またはマンニトール、およびそれらの混合物(例えば、乳糖/ショ糖混合物、ショ糖/マンニトール混合物)など)を含み得る。1つの可能な構成は、予め充填された注射器中の水性アジュバント成分およびバイアル中の凍結乾燥された抗原成分を使用する。
【0132】
(組成物またはキット成分の包装)
本発明の組成物(またはキット成分)に適した容器としては、バイアル、注射器(例えば、使い捨て可能な注射器)、点鼻スプレーなどが挙げられる。これらの容器は、無菌であるべきである。
【0133】
組成物/成分が、バイアル中におかれる場合、そのバイアルは、好ましくは、ガラス材料またはプラスチック材料から作製される。上記バイアルは、好ましくは、上記組成物がそのバイアルに添加される前に滅菌される。ラテックス感受性患者に関する懸案事項を回避するために、バイアルは、好ましくは、ラテックスを含まないストッパーによって密封され、そして全ての包装用物質中にラテックスが存在しないことが、好ましい。上記バイアルは、単回用量のワクチンを含み得るか、またはそのバイアルは、1つよりも多い用量(例えば10用量)を含み得る(「複数回用量」バイアル)。好ましいバイアルは、無色のガラスから作製される。
【0134】
バイアルは、予め充填された注射器がそのキャップ中に挿入され得るように適合したキャップ(例えば、Luerロック)を有し得、その注射器の内容物は、(例えば、その中の凍結乾燥された物質を再構成するために)そのバイアル中に排出され得、そしてそのバイアルの内容物は、その注射器中に戻され得る。上記バイアルから上記注射器を取り外した後、次いで針が、接続され得、そして組成物が、患者に投与され得る。上記キャップが、好ましくは、シールまたはカバーの内側に配置されて、そのシールまたはカバーは、そのキャップが接触され得る前に取り外される必要がある。バイアルは、特に、複数回用量バイアルに関して、その内容物の無菌的な取り出しを可能にするキャップを有し得る。
【0135】
成分が、注射器中に包装される場合、その注射器は、それに接続された針を有し得る。針が接続されない場合、別個の針が、組み立ておよび使用のために注射器とともに提供され得る。そのような針は、シースで覆う(sheathe)ことができる。安全針が、好ましい。1インチ23ゲージの針、1インチ25ゲージの針および5/8インチ25ゲージの針が、代表的である。注射器には、その上に内容物のロット番号、インフルエンザの時期および使用期限日がプリントされ得る剥ぎ取りラベルが提供され得、記録維持を容易にする。上記注射器中のプランジャーは、好ましくは、ストッパーを有し、プランジャーが吸引の間に偶発的に外れることを防ぐ。上記注射器は、ラテックスゴムキャップおよび/またはプランジャーを有し得る。使い捨て可能な注射器は、単回用量のワクチンを含む。上記注射器は、一般に、針の接続前に先端を密封するために先端キャップを有し、そしてその先端キャップは、好ましくは、ブチルゴムから作製される。上記注射器と針とが別個に包装される場合、その針は、好ましくは、ブチルゴムシールドが取り付けられる。好ましい注射器は、商標名「Tip−Lok」TMで市販されるものである。
【0136】
容器は、半用量の容量を示して、例えば、小児に対する送達を容易にするために、標識され得る。例えば、0.5ml用量を含む注射器は、0.25ml容量を示す標識を有し得る。
【0137】
ガラス容器(例えば、注射器またはバイアル)が使用される場合、ソーダ石灰ガラス製の容器よりもホウケイ酸ガラス製の容器を用いることが好ましい。
【0138】
キットまたは組成物は、上記ワクチンの詳細(例えば、投与のための指示書、ワクチン内の抗原の詳細など)を含む印刷物と一緒に(例えば、同じ箱中に)含まれ得る。その指示書はまた、警告、例えば、ワクチン接種の後のアナフィラキシー反応の場合、直ちに利用できるようにアドレナリンの溶液を準備しておくことなどを含み得る。
【0139】
(処置およびワクチンの投与の方法)
本発明の組成物は、ヒト患者への投与に適しており、そして本発明は、患者における免疫応答を惹起する方法を提供し、本発明の組成物をその患者に投与する工程を包含する。
【0140】
本発明はまた、医薬として使用するための本発明のキットまたは組成物を提供する。
【0141】
本発明はまた、患者における免疫応答を惹起するための医薬の製造における、(i)インフルエンザウイルス抗原;(ii)不溶性粒子状アジュバント;および(iii)免疫増強物質を提供する。
【0142】
これらの方法および使用によって惹起された免疫応答は、一般に、抗体応答(好ましくは、防御的な抗体応答)を含む。インフルエンザウイルスワクチン接種後の抗体応答、中和能力および防御を評価するための方法は、当該分野において周知である。ヒト研究は、ヒトインフルエンザウイルスの赤血球凝集素に対する抗体力価が防御と相関することを示している(約30〜40の血清サンプル赤血球凝集−抑制力価は、同種のウイルスによる感染に対する約50%の防御を与える)[148]。抗体応答は、代表的に、赤血球凝集抑制、マイクロ中和、一次元放射状免疫拡散(SRID)、および/または単純放射溶血(single radial hemolysis)(SRH)によって測定される。これらのアッセイ技術は、当該分野において周知である。
【0143】
本発明の組成物は、種々の手段で投与され得る。最も好ましい免疫感作経路は、筋肉内注射(例えば、腕または脚)によるものであるが、他の利用可能な経路としては、皮下注射、鼻腔内[149〜151]、経口[152]、皮内[153、154]、経皮(transcutaneous)、経皮(transdermal)[155]などが挙げられる。
【0144】
本発明に従って調製されるワクチンは、小児および成人の両方を処置するために使用され得る。インフルエンザワクチンは、最近、小児および成人の免疫感作における6月齢からの使用について推奨される。したがって、上記患者は、1歳未満、1〜5歳、5〜15歳、15〜55歳、または少なくとも55歳であり得る。上記ワクチンを受容するための好ましい患者は、高齢者(例えば、50歳以上、60歳以上、および好ましくは65歳以上)、若年者(例えば5歳以下)、入院患者、医療従事者、国軍および軍人、妊婦、慢性疾患患者、免疫不全患者、そのワクチンを受容する前の7日間において抗ウイルス化合物(例えば、リン酸オセルタミビルなどのオセルタミビルまたはザナミビル化合物;以下を参照のこと)を摂取している患者、および海外渡航者である。上記ワクチンは、これらの群に対してのみ適しているわけではないが、より一般的には集団において使用され得る。流行株に関して、全ての年齢群に対する投与が、好ましい。
【0145】
処置は、単回用量スケジュールまたは複数回用量スケジュールによるものであり得る。複数回用量は、一次免疫感作スケジュールおよび/または追加免疫感作スケジュールにおいて使用され得る。複数回用量スケジュールにおいて、種々の用量は、同じかまたは異なる経路(例えば、非経口によるプライム(prime)および粘膜によるブースト(boost)、粘膜によるプライムおよび非経口によるブーストなど)によって与えられ得る。1つより多い用量(代表的に、2用量)の投与は、特に、免疫学的にナイーブな患者において有用である(例えば、以前にインフルエンザワクチンを受容したことがない者のためか、または新規のHAサブタイプに対してワクチン接種するため(流行の発生において))。複数回用量は、代表的に、少なくとも1週間(例えば、約2週間、約3週間、約4週間、約6週間、約8週間、約10週間、約12週間、約16週間など)の間隔を空けて投与される。
【0146】
本発明の好ましい組成物は、効力に関してCPMP判定基準の1、2または3を満たす。成人(18〜60歳)において、これらの基準は、(1)70%以上のセロプロテクション(seroprotection);(2)40%以上のセロコンバージョン;および/または(3)2.5倍以上のGMT増加である。高齢者(>60歳)において、これらの判定基準は、(1)60%以上のセロプロテクション;(2)30%以上のセロコンバージョン;および/または(3)2倍以上のGMT増加である。これらの判定基準は、少なくとも50人の患者による非盲検研究に基づく。
【0147】
本発明のワクチンは、他のワクチン(麻疹ワクチン、流行耳下腺炎ワクチン、風疹ワクチン、MMRワクチン、水痘ワクチン、MMRVワクチン、ジフテリアワクチン、破傷風ワクチン、百日咳ワクチン、DTPワクチン、結合体化b型H.influenzaeワクチン、不活性化ポリオウイルスワクチン、B型肝炎ウイルスワクチン、髄膜炎菌結合体ワクチン(例えば、四価A−C−W135−Yワクチン)、RSウイルスワクチン、肺炎球菌結合体ワクチンなど)と実質的に同時(例えば、医療専門家またはワクチン接種センターへの同一の医学的な対診または診察の間)に患者に対して投与され得る。肺炎球菌ワクチンおよび/または髄膜炎菌ワクチンと実質的に同時の投与は、特に、高齢患者において有用である。
【0148】
同様に、本発明のワクチンは、抗ウイルス化合物、および特に、インフルエンザウイルスに対して活性な抗ウイルス化合物(例えば、オセルタミビルおよび/またはザナミビル)と実質的に同時(例えば、医療専門家による同一の医学的な対診または診察の間)に患者に対して投与され得る。これらの抗ウイルス剤としては、ノイラミニダーゼインヒビター(例えば、(3R,4R,5S)−4−アセチルアミノ−5−アミノ−3(1−エチルプロポキシ)−1−シクロヘキセン−1−カルボン酸、または5−(アセチルアミノ)−4−[(アミノイミノメチル)−アミノ]−2,6−アンヒドロ−3,4,5−トリデオキシ−D−グリセロ−D−ガラクトノン−2−エノン酸(そのエステル(例えば、エチルエステル)およびその塩(例えば、リン酸塩)を含む))が挙げられる。好ましい抗ウイルス剤は、(3R,4R,5S)−4−アセチルアミノ−5−アミノ−3(1−エチルプロポキシ)−1−シクロヘキセン−1−カルボン酸,エチルエステル,ホスフェート(1:1)(リン酸オセルタミビル(TAMIFLUTM)としても公知である)である。
【0149】
(一般)
用語「含む(comprising)」は、「含有する(including)」および「からなる」を包含し、例えば、Xを「含む」組成物は、専らXからなり得るか、またはさらなる何かを含有し得る(例えば、X+Y)。
【0150】
語「実質的に」は、「完全に」を排除せず、例えば、Yを「実質的に含まない」組成物は、Yを完全に含まなくても良い。必要である場合、語「実質的に」は、本発明の定義から省略され得る。
【0151】
数値xに関する用語「約」は、例えば、x±10%を意味する。
【0152】
詳細に述べられていなければ、2つ以上の成分を混合する工程を含むプロセスは、混合の任意の特定の順序を要求しない。したがって、成分は任意の順序で混合され得る。3つの成分が存在するとき、そのときは、2つの成分が互いと組み合わされ得、そして次にこの組み合わせが、第3の成分と組み合わされ得るなどである。
【0153】
動物(および特にウシ)材料が細胞の培養に使用される場合、それらを、伝染性海綿状脳症(TSE)のない、および特にウシ海綿状脳症(BSE)のない供給源から取得しなければならない。総合的に、動物に由来する材料の完全な非存在下で細胞を培養することが、好ましい。
【0154】
化合物が、組成物の部分として投与される場合、その化合物は、代替的に、適切なプロドラッグによって置換され得る。
【0155】
細胞基質が、リアソータント手順または逆方向遺伝学手順のために使用される場合、それは、好ましくは、例えば、Ph Eur総論(general chapter)5.2.3にあるようなヒトワクチン生産における使用について承認されているものである。
【実施例】
【0156】
(本発明を実施するための様式)
インフルエンザウイルス株Wyoming H3N2(A)、New−Caledonia H1N1(A)およびJiangsu(B)を、MDCK細胞において個別に増殖させた。三価表面糖タンパク質ワクチンを、調製し、そしてそれを使用して、1株あたり0.1μgのHAにて0日目および28日目に免疫ナイーブBalb/Cマウスを免疫感作(筋肉内)した。動物を、42日目に採血し、そして種々の抗体アッセイを、その血液を用いて行った:HI力価;ELISAによって測定した抗HA応答。IgG応答を、IgG1またはIgG2aとして分類した。
【0157】
以下の3種の不溶性粒子状アジュバントを、試験した:(i)1mg/mlで使用され、かつ5mMヒスチジン緩衝剤を含む水酸化アルミニウム;(ii)1mg/mlで使用され、かつ5mMヒスチジン緩衝剤を含むリン酸カルシウム;または(iii)ポリ(ラクチドco−グリコリド)50:50コポリマー組成物から形成される微粒子(固有粘度0.4(「PLG」))。
【0158】
以下の2種の免疫増強物質を、試験した:(a)ホスホロチオエート骨格を有する免疫刺激性CpG ODN(10μg/用量);または(b)R−848。
【0159】
したがって、12の動物群が存在した。
【0160】
【化14】

Al−H処方物について、三価抗原を、3μg/mlの抗原、5mMのヒスチジン緩衝剤(pH6.5)および9mg/mlの塩化ナトリウムにおいて、1mg/mlの水酸化アルミニウムに対して4℃にて一晩吸着させた。
【0161】
Ca−P処方物について、リン酸カルシウム懸濁物を、粒径を減少させるために20mmプローブを使用して15,000rpmにて3分間にわたってホモジナイズした。次いで、上記抗原を、1mg/mlのCa−P、3μg/mlの抗原、5mMヒスチジン緩衝剤(pH6.5)および9mg/mlの塩化ナトリウムにおいて、上記ホモジナイズした懸濁物に対して4℃にて一晩吸着させた。
【0162】
PLG微粒子を、溶媒蒸発法によって調製した。簡単にいうと、微粒子を、2.5mlのリン酸緩衝化生理食塩水(PBS)を含む塩化メチレン中の10mlの6%(w/v)ポリマー溶液を、10mmプローブを使用してホモジナイズすることによって調製した。そうして形成された油中水型エマルションを、次いで、DSSを含む50mlの蒸留水に添加し、そしてその混合物を、20mmプローブを用いて5分間にわたって非常に速い速度にて氷浴中でホモジナイズした。この手順は、水中油中水型エマルションの形成を生じ、その水中油中水型エマルションを、1000rpmにて12時間にわたって室温で撹拌した。上記塩化メチレンを、放置して蒸発させた。得られた微粒子のサイズ分布を、粒径分析器によって決定した。ゼータ電位を、Malvern Zeta分析器によって測定した。抗原を、0.03%(w/w)の負荷(load)において、100mgの空PLG微粒子を含む懸濁物を30μgの三価インフルエンザ抗原と一緒にインキュベートすることによって吸着させた。濃縮したヒスチジン緩衝溶液を、10mlの総容量において10mMの最終濃度(pH6.2)になるまで添加した。その懸濁物を、実験室のロッカー(lab rocker)において4℃にて一晩混合した。1mLを、吸着効率の決定のために使用するときに取り出した。3.6μgの三価抗原を含むアリコートを、小さいガラスバイアル中におき、そして再構成の際に、それぞれ、4.5%および1.5%の最終濃度を達成するマンニトールおよびショ糖と一緒に、−50℃かつ90×10−3mBarにて凍結乾燥した。
【0163】
上記3種のアジュバントに対するタンパク質吸着の効率を、以下の通りに決定した:PLG/FCC、Al−H/FCCまたはCa−P/FCCの1mlアリコートを、一晩のインキュベーション工程の後に取り出した。遠心分離後、上清中に残存する結合していないタンパク質の量を、ゲル濾過クロマトグラフィーによって測定した。本質的に、100μlの上清を、Waters 2690/432機器を備えたTSK3000SWXLに注入した。直線の検量線を、三価抗原によって確立し、そしてその上清に存在するタンパク質の量を、算出した。次いで、結合していないタンパク質の総量を、最初に添加したタンパク質の総量から減算し、そしてその差を、実際の負荷効率を算出するために使用した。
【0164】
Al−H処方物およびCa−P処方物からの抗原抽出のために、アリコートを、15〜20分間にわたって5000rpmにて遠心分離した。各サンプル由来の上清を、ペレットを乱すことなく除去した。上記抗原を置換するために、脱着緩衝剤(0.25MのNa2HPO4+0.15MのEDTA)を、各ペレットに添加し、そして穏やかに動揺させながら2〜3時間にわたって室温にてインキュベートした。抽出された抗原を、遠心分離によって送達系から分離した。
【0165】
PLG微粒子からの抗原抽出のために、PBSを、0.05%のオクチル−β−グルコシドと一緒に添加し、穏やかな動揺運動のもとで1〜2時間にわたって室温にてインキュベートした。抽出されたFCC抗原を含む上清を、遠心分離によってペレットから分離した。
【0166】
抗原特異的抗体を、ELISAによって決定した。HA特異的IgGの滴定を、最後の免疫感作の2週間後に、個々の血清に対して行った。Maxisorp 96ウェル平底プレートを、リン酸緩衝化生理食塩水(pH7.4)(PBS)中のH1N1、H2N3またはBによって0.2μg/ウェルで27〜30℃にて一晩コーティングした。上記コーティングしたウェルを、300μlの3% PVPを用いて1時間にわたって室温にてブロックした。そのプレートを、PBS(pH7.4)、0.1% BSAおよび0.05% Tween−20を用いて洗浄し、軽打(tap)し、そして乾燥した。血清サンプルおよび血清標準を、最初に、希釈緩衝液(PBS(pH7.4)、1% BSA、0.05% Tween−20)によって1:5,000〜1:20,000に希釈し、次いで、コーティング−ブロックしたプレートに移し、ここで、サンプルを、同じ緩衝液を用いて3倍に連続希釈した。抗原特異的IgGを、アルカリホスファターゼ結合体化ヤギ抗マウスIgGで明らかにした。抗体力価を、免疫感作前の血清において得られた平均光学濃度(OD)の平均+5×標準偏差(SD)よりも高いODを与えるELISA力価の対数として示した。上記力価を、並行してアッセイした参照血清に関して正規化した。
【0167】
抗体をまた、第1の免疫感作の2週間後(post 1)および第2の免疫感作の2週間後(post 2)に採取した個々の血清に対してV字形状の96ウェルマイクロタイタープレートにおいて行った、赤血球凝集抑制アッセイによって決定した。簡単にいうと、25μLの2倍に連続希釈したサンプルを、25μLの株特異的インフルエンザ抗原(4赤血球凝集単位(haemagglutinating unit)を含む全ウイルス)と一緒に60分間にわたって室温にてインキュベートする。成体の雄鶏から得た赤血球の0.5%(v/v)懸濁物を、添加し、そしてその混合物を、さらに60分間にわたってインキュベートする。反応を、目視検査によって追跡する:赤色の点の形成は、ポジティブな反応(抑制)を示し、そして細胞の拡散した斑は、ネガティブな反応(赤血球凝集)を示す。上記力価は、最後の完全な凝集抑制が生じる血清希釈度として規定される。上記抗体濃度は、上記力価の逆数値に対応する。
【0168】
図1〜3は、12個の群についての抗HA ELISA応答を示す。群1と群4との比較は、水酸化アルミニウムに対するCpGの添加がHA力価を上昇させることを示す。同様に、CpGは、上記リン酸カルシウムアジュバント(群2および5)および上記PLGアジュバント(群3および6)に添加した場合、HA力価を上昇させる。
【0169】
図4は、群1〜6についてのHI力価を示す。CpGの添加は、HI力価を増強する。
【0170】
免疫応答がTH1型のものであるかまたはTH2型のものであるかを見るために、HA特異的IgGを、IgG1(TH2)またはIgG2a(TH1)として細分類した。図5は、この分析の結果を示す。単独の粒子状抗原(群1、2および3)は、IgG2aをほとんど示さない。しかし、CpGを添加する場合、顕著なIgG2a応答が、見られ(群4、5および6)、IgG2aは、群5(CpG+CaP)において優勢になった。したがって、上記不溶性粒子状アジュバントに対する免疫増強物質(例えば、CpG)の添加は、TH2型応答からTH1型応答への移行をもたらす。TH1型応答は、インフルエンザウイルスに対する異種サブタイプ免疫を改良することが報告されている[9]ので、不溶性粒子状アジュバントを含む公知のインフルエンザワクチンは、免疫増強物質の添加によって改良され得る。
【0171】
本発明は例示のみによって記載され、そして改変は本発明の範囲および精神の中にあるままでもなされ得ることが、理解される。
【0172】
(参考文献(その内容は、本明細書によって参考として援用される))
【0173】
【化15】

【0174】
【化16】

【0175】
【化17−1】

[90]米国特許第4689338号、同第4929624号、同第5238944号、同第5266575号、同第5268376号、同第5346905号、同第5352784号、同第5389640号、同第5395937号、同第5482936号、同第5494916号、同第5525612号、同第6083505号、同第6440992号、同第6627640号、同第6656938号、同第6660735号、同第6660747号、同第6664260号、同第6664264号、同第6664265号、同第6667312号、同第6670372号、同第6677347号、同第6677348号、同第6677349号、同第6683088号、同第6703402号、同第6743920号、同第6800624号、同第6809203号、同第6888000号および同第6924293号.
【0176】
【化17−2】

【0177】
【化18】

【特許請求の範囲】
【請求項1】
本願明細書に記載された発明。
【請求項1】
本願明細書に記載された発明。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2012−140470(P2012−140470A)
【公開日】平成24年7月26日(2012.7.26)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−99673(P2012−99673)
【出願日】平成24年4月25日(2012.4.25)
【分割の表示】特願2008−538420(P2008−538420)の分割
【原出願日】平成18年11月6日(2006.11.6)
【出願人】(507238285)ノバルティス ヴァクシンズ アンド ダイアグノスティクス エスアールエル (35)
【Fターム(参考)】
【公開日】平成24年7月26日(2012.7.26)
【国際特許分類】
【出願番号】特願2012−99673(P2012−99673)
【出願日】平成24年4月25日(2012.4.25)
【分割の表示】特願2008−538420(P2008−538420)の分割
【原出願日】平成18年11月6日(2006.11.6)
【出願人】(507238285)ノバルティス ヴァクシンズ アンド ダイアグノスティクス エスアールエル (35)
【Fターム(参考)】
[ Back to top ]

