粒子状物質浄化装置
【課題】連続的に粒子状物質を燃焼させて除去でき、排圧の上昇を防止できる粒子状物質除去装置を提供する。
【解決手段】一般式(A’1−xA’’x)1−α(B’1−yB’’y)1−βOz(A’はLa、Nd、Gd、Yのうちの1種以上の金属であり、A’’はSr、Ca、Ba、Ce、Prのうちの1種以上の金属であり、B’とB’’とはMn、Co、Ti、Fe、Ni、Cu、Alのうちの1種の金属であって互いに異なり、0.15≦α≦0.9、0.1≦β≦0.9、0≦x≦1、0≦y≦1、1<z)で表される複合金属酸化物を含む酸素吸蔵材料を備える。B’がMnであり、A’がLaであり、A’’がSrである。酸素吸蔵材料は、酸処理されており、複合金属酸化物と単体金属酸化物との複合材料である。酸素吸蔵材料は、セラミックス製多孔質体4,5,6に担持され、該多孔質体4,5,6は上流から下流に向かって気孔率が減少する。
【解決手段】一般式(A’1−xA’’x)1−α(B’1−yB’’y)1−βOz(A’はLa、Nd、Gd、Yのうちの1種以上の金属であり、A’’はSr、Ca、Ba、Ce、Prのうちの1種以上の金属であり、B’とB’’とはMn、Co、Ti、Fe、Ni、Cu、Alのうちの1種の金属であって互いに異なり、0.15≦α≦0.9、0.1≦β≦0.9、0≦x≦1、0≦y≦1、1<z)で表される複合金属酸化物を含む酸素吸蔵材料を備える。B’がMnであり、A’がLaであり、A’’がSrである。酸素吸蔵材料は、酸処理されており、複合金属酸化物と単体金属酸化物との複合材料である。酸素吸蔵材料は、セラミックス製多孔質体4,5,6に担持され、該多孔質体4,5,6は上流から下流に向かって気孔率が減少する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ディーゼル機関等の内燃機関から排出される粒子状物質を浄化する粒子状物質浄化装置に関するものである。
【背景技術】
【0002】
従来、ディーゼル機関等の内燃機関から排出される一酸化炭素(CO)、炭化水素(HC)、酸化窒素(NOx)等の有害ガスを浄化するためにペロブスカイト型の複合金属酸化物を用いることが知られている。前記ペロブスカイト型の複合金属酸化物は、例えば、酸化窒素還元触媒として、セラミックス製多孔質体等からなるフィルターに担持させて用いられる(例えば特許文献1、2参照)。
【0003】
一方、ディーゼル機関等の内燃機関からは、前記有害ガスと共に、カーボン、煤、炭化水素(HC)等からなる粒子状物質(パーティキュレート)も排出されている。前記粒子状物質は、大気汚染の主要原因とされ、発ガン性、喘息との因果関係等の有害性が指摘されている。前記粒子状物質は、例えば、セラミックス製多孔質体等からなるフィルターにより捕集された後、該フィルター上で燃焼せしめられることにより除去することができる。
【0004】
しかしながら、前記粒子状物質は、空気中で燃焼させるためには500〜600℃の高温とする必要があるため、前記フィルターにより捕集するときには該フィルターの目詰まりを生じて、排圧が高くなりやすいという不都合がある。
【特許文献1】特許第2620624号公報
【特許文献2】特開2002−301320号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、かかる不都合を解消して、連続的に粒子状物質を燃焼させて除去することができ、排圧の上昇を防止することができる粒子状物質除去装置を提供することを目的とする。
【課題を解決するための手段】
【0006】
かかる目的を達成するために、本発明の粒子状物質浄化装置は、内燃機関から排出される粒子状物質を燃焼させて浄化する装置において、一般式(A’1−xA’’x)1−α(B’1−yB’’y)1−βOz(A’はLa、Nd、Gd、Yからなる群から選択される1種以上の金属であり、A’’はSr、Ca、Ba、Ce、Prからなる群から選択される1種以上の金属であり、B’とB’’とはMn、Co、Ti、Fe、Ni、Cu、Alからなる群から選択される1種の金属であって互いに異なり、0.15≦α≦0.9、0.1≦β≦0.9、0≦x≦1、0≦y≦1、1<z)で表される複合金属酸化物を含む酸素吸蔵材料を備えることを特徴とする。
【0007】
前記複合金属酸化物は、ペロブスカイト型化合物に属し、前記一般式で表される特定の組成を備えることにより、酸素を吸蔵する特性を備えている。そこで、本発明の粒子状物質浄化装置は、前記複合金属酸化物を含む前記酸素吸蔵材料を備えることにより、ディーゼル機関等の内燃機関から排出される前記粒子状物質を燃焼させて浄化する際に、該複合金属酸化物が吸蔵する酸素を放出させることにより、該粒子状物質の燃焼温度を低下させることができる。
【0008】
この結果、本発明の粒子状物質浄化装置によれば、比較的低温で連続的に前記粒子状物質を燃焼させて除去することができ、排圧の上昇を防止することができる。
【0009】
前記複合金属酸化物は、酸素を吸蔵するために、前記一般式におけるα、β、x、y、zが前記範囲にある必要があり、α、β、x、y、zが前記範囲を外れるときには、酸素を吸蔵する特性が十分に得られないことがある。
【0010】
また、前記複合金属酸化物は、酸素を吸蔵するために、前記一般式におけるB’がMnであると共に、A’がLaであり、A’’がSrであることが好ましい。
【0011】
また、前記酸素吸蔵材料は、酸処理されていることが好ましい。前記酸素吸蔵材料は、前記酸処理により、さらに酸素を吸蔵する特性が向上する。
【0012】
また、前記酸素吸蔵材料は、単体金属酸化物を含み、前記複合金属酸化物と該単体金属酸化物との複合材料となっていることにより、さらに酸素を吸蔵する特性が向上する。前記単体金属酸化物としては、例えば、B’aOb(B’は前記一般式と同義であり、1≦a、1≦b)で表される化合物等を挙げることができる。
【0013】
さらに、前記酸素吸蔵材料は、セラミックス製多孔質体に担持されており、該セラミックス製多孔質体は前記内燃機関から排出される粒子状物質の流れの上流から下流に向かって気孔率が減少することが好ましい。本発明の粒子状物質浄化装置は、前記セラミックス製多孔質体の気孔率が、前記粒子状物質の流れの上流から下流に向かって減少するようにされていることにより、該粒子状物質を該セラミックス製多孔質体に無理なく流通せしめることができ、排圧の上昇を避けることができる。前記セラミックス製多孔質体の気孔率が、前記粒子状物質の流れの上流から下流に向かって連続的に減少する構成としてもよいが、段階的に減少する構成とすることにより、装置構成を簡単にすることができる。
【発明を実施するための最良の形態】
【0014】
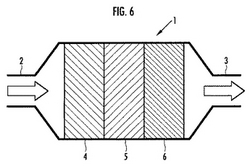
次に、添付の図面を参照しながら本発明の実施の形態についてさらに詳しく説明する。図1は本実施形態の粒子状物質浄化装置に用いる酸素吸蔵材料の酸素放出量を示すグラフであり、図2は前記酸素吸蔵材料の触媒活性を示すグラフであり、図3は前記酸素吸蔵材料の酸化性能を示すグラフである。また、図4、図5は前記酸素吸蔵材料の中性子線回折スペクトルを示すグラフであり、図6は本実施形態の粒子状物質浄化装置の一構成例を示す説明的断面図である。
【0015】
本実施形態の粒子状物質浄化装置は、例えば、ディーゼル機関の排気中に含まれるカーボン、煤、炭化水素(HC)等からなる粒子状物質を燃焼させて浄化する装置であり、一般式(A’1−xA’’x)1−α(B’1−yB’’y)1−βOzで表される複合金属酸化物を含む酸素吸蔵材料を備えている。
【0016】
前記複合金属酸化物はペロブスカイト型と呼ばれる化合物に属し、酸素を吸蔵すると共に、温度に応じて吸蔵した酸素を放出する特性を備えている。尚、本明細書では、前記特性を「酸素を吸蔵する特性」と略記する。
【0017】
前記複合金属酸化物は、酸素を吸蔵する特性を備えるために、前記一般式において、A’はLa、Nd、Gd、Yからなる群から選択される1種以上の金属であることが必要であり、A’’はSr、Ca、Ba、Ce、Prからなる群から選択される1種以上の金属であることが必要であり、B’とB’’とはMn、Co、Ti、Fe、Ni、Cu、Alからなる群から選択される1種の金属であって互いに異なっていることが必要である。また、前記複合金属酸化物は、前記一般式において、αは0.15≦α≦0.9の範囲にあり、βは0.1≦β≦0.9の範囲にあり、xは0≦x≦1の範囲にあり、yは0≦y≦1の範囲にあり、zは1<zの範囲にあることが必要である。
【0018】
前記酸素を吸蔵する特性を備えるペロブスカイト型複合金属酸化物として、例えば、La1−αMn1−βOzで表される化合物、(La1−xSrx)1−αMn1−βOzで表される化合物等を挙げることができる。
【0019】
前記複合金属酸化物を得るには、まず、前記化合物を構成する金属の炭酸塩または硝酸塩を、目的の複合金属酸化物を構成する金属のモル比に対応する化学量論比で混合し、粉砕した後、得られた混合物にリンゴ酸等の酸と水とを加えてスラリー状にしたものを、例えば50〜80℃の範囲の温度で1〜3時間反応させ、複合リンゴ酸塩を得る。次に、前記複合リンゴ酸塩を200〜400℃の範囲の温度で1〜2時間仮焼した後、700〜1500℃の範囲の温度で1〜10時間焼成することにより、目的の複合金属酸化物を得る。
【0020】
前記複合金属酸化物は、さらに酸処理を施すことにより、酸素を吸蔵する特性を向上させることができる。前記酸処理は、例えば、前記複合金属酸化物を室温で1Mの硝酸に10〜20分間浸漬することにより行う。
【0021】
また、前記酸素吸蔵材料は、前記複合金属酸化物と共にさらに単体金属酸化物を含み、前記複合金属酸化物と単体金属酸化物との複合材料となっていてもよい。前記単体金属酸化物としては、B’aOb(B’は前記一般式と同義であり、1≦a、1≦b)で表される化合物等を挙げることができ、例えば、前記複合金属酸化物La1−αMn1−βOz、(La1−xSrx)1−αMn1−βOzに対するMnaObを挙げることができる。前記複合金属酸化物と単体金属酸化物との複合材料は、該複合金属酸化物を700〜1000℃の範囲の温度に加熱して、構造の一部を変化させることにより得ることができる。
【0022】
本実施形態の粒子状物質浄化装置は、例えば、図6に示すように、円筒状の本体1と、本体1の両端に設けられ、本体1よりも小径の導入部2と、排出部3とを備え、本体1には、前記酸素吸蔵材料がセラミックスフォーム等のセラミックス製多孔質体4,5,6に担持されて配設されている。セラミックス製多孔質体4,5,6は、例えばコージェライト等のアルミナ系セラミックスからなり、前記粒子状物質を含む排気流の上流側になる導入部2側から、下流側になる排出部3に向かって、段階的に気孔率が減少するようにされている。即ち、セラミックス製多孔質体4,5,6の気孔率をそれぞれa,b,cとすると、a>b>cの順になっている。
【0023】
本実施形態の粒子状物質浄化装置では、導入部2から導入された排気流に含まれる前記粒子状物質をセラミックス製多孔質体4,5,6で捕集し、該粒子状物質をセラミックス製多孔質体4,5,6に担持されている前記酸素吸蔵材料の触媒作用により燃焼させて浄化する。このとき、前記酸素吸蔵材料からは酸素が放出されるので、前記粒子状物質の燃焼を比較的低温で行うことができる。
【0024】
また、セラミックス製多孔質体4,5,6は、前述のように、導入部2側から排出部3に向かって段階的に気孔率が減少するように構成されているので、前記排気流を導入したときに前記粒子状物質によるセラミックス製多孔質体4,5,6の目詰まりが生じにくい。従って、本実施形態の粒子状物質浄化装置によれば、前記排気流を無理なく流通せしめることができ、排圧の上昇を避けることができる。
【0025】
次に、実施例を示す。
【実施例1】
【0026】
本実施例では、まず、ランタン(La)の炭酸塩または硝酸塩と、マンガン(Mn)の炭酸塩または硝酸塩とを、La:Mn=1:1(モル比)となるように混合して粉砕した。次に、得られた混合物100重量部に対して、リンゴ酸200重量部と純水300重量部とを加えて75℃で1時間反応させることによりスラリーを得た。次に、前記スラリーを120℃で2時間加熱して脱水し、複合リンゴ酸塩を得た。そして、前記複合リンゴ酸塩を大気中、250℃で1時間仮焼した後、800℃で1時間焼成することにより、複合金属酸化物としてLaMnO3粉末を得た。
【0027】
次に、本実施例で得られた複合金属酸化物(LaMnO3)を酸素吸蔵材料とし、昇温脱離ガス分析装置(株式会社エスコ製)を用いて、10−5Paの減圧下、室温から900℃まで、10℃/分の昇温速度で昇温したときの該酸素吸蔵材料の酸素放出量を測定した。結果を図1に示す。
【0028】
次に、本実施例で得られた複合金属酸化物(LaMnO3)と、γ−アルミナと、純水とを、複合金属酸化物:γ−アルミナ:純水=2:5:10の重量比となるように秤量し、アルミナボールを用いて4時間、粉砕混合した。得られた混合物をハニカム状のコージェライト担体に塗布し、大気中、600℃で5時間焼成することにより、該担体に前記複合金属酸化物を酸素吸蔵材料として担持させた。
【0029】
次に、前記複合金属酸化物を担持させたハニカム状のコージェライト担体に、プロパン(C3H8)1000ppm、酸素0.5%を含み残部が窒素からなる反応評価ガスを流通せしめ、プロパンの分解量を前記酸素吸蔵材料による浄化率として測定し、該酸素吸蔵材料の触媒活性を評価した。結果を図2に示す。
【0030】
次に、本実施例で得られた複合金属酸化物(LaMnO3)を酸素吸蔵材料とし、該酸素吸蔵材料と、粒子状物質のモデルとしてのカーボンブラックとを、酸素吸蔵材料:カーボンブラック=1:1の重量比となるように秤量し、メノウ乳鉢で5分間混合して混合物を得た。次に、熱分析装置(株式会社リガク製)を用い、大気中、室温から800℃まで、10℃/分の昇温速度で昇温して、前記混合物の熱分析を行い、前記酸素吸蔵材料によるカーボンブラックの酸化性能を評価した。結果を図3に示す。尚、比較のため、前記カーボンブラックのみについても、本実施例と全く同一にして熱分析を行った。結果を図3に併せて示す。
【実施例2】
【0031】
本実施例では、まず、ランタン(La)の炭酸塩または硝酸塩と、ストロンチウム(Sr)の炭酸塩または硝酸塩と、マンガン(Mn)の炭酸塩または硝酸塩とを、La:Sr:Mn=2:8:10(モル比)となるように混合して粉砕した。次に、得られた混合物100重量部に対して、リンゴ酸200重量部と純水300重量部とを加えて75℃で1時間反応させることによりスラリーを得た。次に、前記スラリーを120℃で2時間加熱して脱水し、複合リンゴ酸塩を得た。そして、前記複合リンゴ酸塩を大気中、250℃で1時間仮焼した後、800℃で1時間焼成することにより、複合金属酸化物としてLa0.2Sr0.8MnO3粉末を得た。
【0032】
次に、本実施例で得られた複合金属酸化物(La0.2Sr0.8MnO3)を酸素吸蔵材料として用いた以外は、実施例1と全く同一にして、該酸素吸蔵材料の酸素放出量を測定した。結果を図1に示す。
【0033】
次に、本実施例で得られた複合金属酸化物(La0.2Sr0.8MnO3)を酸素吸蔵材料として用いた以外は、実施例1と全く同一にして、該酸素吸蔵材料による浄化率を測定し、該酸素吸蔵材料の触媒活性を評価した。結果を図2に示す。
【0034】
次に、本実施例で得られた複合金属酸化物(La0.2Sr0.8MnO3)を酸素吸蔵材料として用いた以外は、実施例1と全く同一にして、該酸素吸蔵材料の熱分析を行い、該酸素吸蔵材料によるカーボンブラックの酸化性能を評価した。結果を図3に示す。
【実施例3】
【0035】
本実施例では、まず、ランタン(La)の炭酸塩または硝酸塩と、ストロンチウム(Sr)の炭酸塩または硝酸塩と、マンガン(Mn)の炭酸塩または硝酸塩とを、La:Sr:Mn=1:1:2(モル比)となるように混合して粉砕した。次に、得られた混合物100重量部に対して、リンゴ酸200重量部と純水300重量部とを加えて75℃で1時間反応させることによりスラリーを得た。次に、前記スラリーを120℃で2時間加熱して脱水し、複合リンゴ酸塩を得た。次に、前記複合リンゴ酸塩を大気中、250℃で1時間仮焼した後、800℃で1時間焼成した。そして、前記焼成により得られた焼成物を、室温で1M−硝酸に10分間浸漬する酸処理を施すことにより、複合金属酸化物としてLa0.2Sr0.2MnO3粉末を得た。
【0036】
次に、本実施例で得られた複合金属酸化物(La0.2Sr0.2MnO3)を酸素吸蔵材料として用いた以外は、実施例1と全く同一にして、該酸素吸蔵材料の酸素放出量を測定した。結果を図1に示す。
【0037】
次に、本実施例で得られた複合金属酸化物(La0.2Sr0.2MnO3)を酸素吸蔵材料として用いた以外は、実施例1と全く同一にして、該酸素吸蔵材料による浄化率を測定し、該酸素吸蔵材料の触媒活性を評価した。結果を図2に示す。
【0038】
次に、本実施例で得られた複合金属酸化物(La0.2Sr0.2MnO3)を酸素吸蔵材料として用いた以外は、実施例1と全く同一にして、該酸素吸蔵材料の熱分析を行い、該酸素吸蔵材料によるカーボンブラックの酸化性能を評価した。結果を図3に示す。
【0039】
図1から、実施例1の酸素吸蔵材料は、200℃で酸素を放出し始め、500℃に至るまで放出量が増加し続け、500〜900℃の範囲では常に一定の量の酸素を放出しており、酸素吸蔵材料として有効であることが明らかである。
【0040】
また、実施例2の酸素吸蔵材料は、200℃で酸素を放出し始め、500℃に至るまで放出量が増加し続けていることが明らかである。また、実施例3の酸素吸蔵材料は、200℃で酸素を放出し始め、500℃に至るまで放出量が増加し続け、500〜900℃の範囲では常に一定の量の酸素を放出していることが明らかである。
【0041】
さらに、図1から、実施例2、3の酸素吸蔵材料は、実施例1の酸素吸蔵材料よりも酸素放出量が多く、特に実施例3の酸素吸蔵材料は、実施例1の酸素吸蔵材料の約3倍の酸素放出量を示しており、いずれも酸素吸蔵材料として有効であることが明らかである。
【0042】
次に、図2から、実施例1〜3の酸素吸蔵材料は、いずれもプロパンの分解に触媒活性を示し、特に実施例3の酸素吸蔵材料は該触媒活性が高く、いずれも酸化触媒として有効であることが明らかである。
【0043】
次に、図3から、カーボンブラック単体では、酸化反応は500℃で開始され、620℃でピークを示すのに対し、実施例1の酸素吸蔵材料が共存すると前記酸化反応はより低温の300℃で開始され、580℃でピークを示すことから、該酸素吸蔵材料は粒子状物質の酸化触媒として有効であることが明らかである。
【0044】
また、実施例2の酸素吸蔵材料が共存すると前記酸化反応は300℃で開始され、さらに低温の550℃でピークを示すことから、該酸素吸蔵材料は粒子状物質の酸化触媒として有効であることが明らかである。また、実施例3の酸素吸蔵材料が共存すると前記酸化反応は300℃で開始され、さらに低温の520℃でピークを示し、該酸素吸蔵材料は粒子状物質の酸化触媒として特に有効であることが明らかである。
【実施例4】
【0045】
本実施例では、まず、実施例3で得られた複合金属酸化物(La0.2Sr0.2MnO3)を含む酸素吸蔵材料の室温における中性子回折スペクトルを測定した。結果を図4に示す。図4から、前記酸素吸蔵材料は、室温では、La0.2Sr0.2MnO3相60重量%の他、Mn2O3相37重量%、Mn3O4相3重量%を含む複合材料となっていることが明らかである。
【0046】
次に、前記酸素吸蔵材料の900℃における中性子回折スペクトルを測定した。結果を図5に示す。図5から、前記酸素吸蔵材料は、900℃では、La0.2Sr0.2MnO3相60重量%の他、Mn3O4相40重量%を含む複合材料となっており、室温での状態に比較して酸化物の構造変化が生じていることが明らかである。
【0047】
図4、図5から、実施例3で得られた複合金属酸化物(La0.2Sr0.2MnO3)を含む酸素吸蔵材料が、図1に示すように大きな酸素放出量を示す理由は、加熱による前記酸化物の構造変化によるものと考えられる。
【実施例5】
【0048】
本実施例では、図6に示すように、円筒状の本体1と、本体1の両端に設けられ、本体1よりも小径の導入部2と、排出部3とを備える粒子状物質浄化装置において、本体1に、実施例3の酸素吸蔵材料がセラミックスフォーム4,5,6に担持されて配設されている。セラミックスフォーム4,5,6は、コージェライトからなる多孔質体である。本実施例では、セラミックスフォーム4は平均孔径3.2mm、気孔率90%、比表面積5.0m2/gであり、セラミックスフォーム5は平均孔径1.7mm、気孔率70%、比表面積10.0m2/gであり、セラミックスフォーム6は平均孔径1.2mm、気孔率40%、比表面積12.0m2/gであって、導入部2から排出部3に向かって段階的に気孔率が小さくなるように構成されている。
【0049】
本実施例の粒子状物質浄化装置に、ディーゼル機関の排気流を導入したところ、セラミックスフォーム4,5,6における粒子状物質の浄化率は、それぞれ、セラミックスフォーム4が5%、セラミックスフォーム5が22%、セラミックスフォーム6が35%と、下流(排出部3側)に行くほど高くなり、排圧を上昇させることなく、前記粒子状物質の浄化を行うことができた。
【図面の簡単な説明】
【0050】
【図1】本発明の粒子状物質浄化装置に用いる酸素吸蔵材料の酸素放出量を示すグラフ。
【図2】本発明の粒子状物質浄化装置に用いる酸素吸蔵材料の触媒活性を示すグラフ。
【図3】本発明の粒子状物質浄化装置に用いる酸素吸蔵材料の酸化性能を示すグラフ。
【図4】本発明の粒子状物質浄化装置に用いる酸素吸蔵材料の中性子線回折スペクトルを示すグラフ。
【図5】本発明の粒子状物質浄化装置に用いる酸素吸蔵材料の中性子線回折スペクトルを示すグラフ。
【図6】本発明の粒子状物質浄化装置の一構成例を示す説明的断面図。
【符号の説明】
【0051】
1…粒子状物質浄化装置本体、 2…導入部、 3…排出部、 4,5,6…セラミックス製多孔質体。
【技術分野】
【0001】
本発明は、ディーゼル機関等の内燃機関から排出される粒子状物質を浄化する粒子状物質浄化装置に関するものである。
【背景技術】
【0002】
従来、ディーゼル機関等の内燃機関から排出される一酸化炭素(CO)、炭化水素(HC)、酸化窒素(NOx)等の有害ガスを浄化するためにペロブスカイト型の複合金属酸化物を用いることが知られている。前記ペロブスカイト型の複合金属酸化物は、例えば、酸化窒素還元触媒として、セラミックス製多孔質体等からなるフィルターに担持させて用いられる(例えば特許文献1、2参照)。
【0003】
一方、ディーゼル機関等の内燃機関からは、前記有害ガスと共に、カーボン、煤、炭化水素(HC)等からなる粒子状物質(パーティキュレート)も排出されている。前記粒子状物質は、大気汚染の主要原因とされ、発ガン性、喘息との因果関係等の有害性が指摘されている。前記粒子状物質は、例えば、セラミックス製多孔質体等からなるフィルターにより捕集された後、該フィルター上で燃焼せしめられることにより除去することができる。
【0004】
しかしながら、前記粒子状物質は、空気中で燃焼させるためには500〜600℃の高温とする必要があるため、前記フィルターにより捕集するときには該フィルターの目詰まりを生じて、排圧が高くなりやすいという不都合がある。
【特許文献1】特許第2620624号公報
【特許文献2】特開2002−301320号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、かかる不都合を解消して、連続的に粒子状物質を燃焼させて除去することができ、排圧の上昇を防止することができる粒子状物質除去装置を提供することを目的とする。
【課題を解決するための手段】
【0006】
かかる目的を達成するために、本発明の粒子状物質浄化装置は、内燃機関から排出される粒子状物質を燃焼させて浄化する装置において、一般式(A’1−xA’’x)1−α(B’1−yB’’y)1−βOz(A’はLa、Nd、Gd、Yからなる群から選択される1種以上の金属であり、A’’はSr、Ca、Ba、Ce、Prからなる群から選択される1種以上の金属であり、B’とB’’とはMn、Co、Ti、Fe、Ni、Cu、Alからなる群から選択される1種の金属であって互いに異なり、0.15≦α≦0.9、0.1≦β≦0.9、0≦x≦1、0≦y≦1、1<z)で表される複合金属酸化物を含む酸素吸蔵材料を備えることを特徴とする。
【0007】
前記複合金属酸化物は、ペロブスカイト型化合物に属し、前記一般式で表される特定の組成を備えることにより、酸素を吸蔵する特性を備えている。そこで、本発明の粒子状物質浄化装置は、前記複合金属酸化物を含む前記酸素吸蔵材料を備えることにより、ディーゼル機関等の内燃機関から排出される前記粒子状物質を燃焼させて浄化する際に、該複合金属酸化物が吸蔵する酸素を放出させることにより、該粒子状物質の燃焼温度を低下させることができる。
【0008】
この結果、本発明の粒子状物質浄化装置によれば、比較的低温で連続的に前記粒子状物質を燃焼させて除去することができ、排圧の上昇を防止することができる。
【0009】
前記複合金属酸化物は、酸素を吸蔵するために、前記一般式におけるα、β、x、y、zが前記範囲にある必要があり、α、β、x、y、zが前記範囲を外れるときには、酸素を吸蔵する特性が十分に得られないことがある。
【0010】
また、前記複合金属酸化物は、酸素を吸蔵するために、前記一般式におけるB’がMnであると共に、A’がLaであり、A’’がSrであることが好ましい。
【0011】
また、前記酸素吸蔵材料は、酸処理されていることが好ましい。前記酸素吸蔵材料は、前記酸処理により、さらに酸素を吸蔵する特性が向上する。
【0012】
また、前記酸素吸蔵材料は、単体金属酸化物を含み、前記複合金属酸化物と該単体金属酸化物との複合材料となっていることにより、さらに酸素を吸蔵する特性が向上する。前記単体金属酸化物としては、例えば、B’aOb(B’は前記一般式と同義であり、1≦a、1≦b)で表される化合物等を挙げることができる。
【0013】
さらに、前記酸素吸蔵材料は、セラミックス製多孔質体に担持されており、該セラミックス製多孔質体は前記内燃機関から排出される粒子状物質の流れの上流から下流に向かって気孔率が減少することが好ましい。本発明の粒子状物質浄化装置は、前記セラミックス製多孔質体の気孔率が、前記粒子状物質の流れの上流から下流に向かって減少するようにされていることにより、該粒子状物質を該セラミックス製多孔質体に無理なく流通せしめることができ、排圧の上昇を避けることができる。前記セラミックス製多孔質体の気孔率が、前記粒子状物質の流れの上流から下流に向かって連続的に減少する構成としてもよいが、段階的に減少する構成とすることにより、装置構成を簡単にすることができる。
【発明を実施するための最良の形態】
【0014】
次に、添付の図面を参照しながら本発明の実施の形態についてさらに詳しく説明する。図1は本実施形態の粒子状物質浄化装置に用いる酸素吸蔵材料の酸素放出量を示すグラフであり、図2は前記酸素吸蔵材料の触媒活性を示すグラフであり、図3は前記酸素吸蔵材料の酸化性能を示すグラフである。また、図4、図5は前記酸素吸蔵材料の中性子線回折スペクトルを示すグラフであり、図6は本実施形態の粒子状物質浄化装置の一構成例を示す説明的断面図である。
【0015】
本実施形態の粒子状物質浄化装置は、例えば、ディーゼル機関の排気中に含まれるカーボン、煤、炭化水素(HC)等からなる粒子状物質を燃焼させて浄化する装置であり、一般式(A’1−xA’’x)1−α(B’1−yB’’y)1−βOzで表される複合金属酸化物を含む酸素吸蔵材料を備えている。
【0016】
前記複合金属酸化物はペロブスカイト型と呼ばれる化合物に属し、酸素を吸蔵すると共に、温度に応じて吸蔵した酸素を放出する特性を備えている。尚、本明細書では、前記特性を「酸素を吸蔵する特性」と略記する。
【0017】
前記複合金属酸化物は、酸素を吸蔵する特性を備えるために、前記一般式において、A’はLa、Nd、Gd、Yからなる群から選択される1種以上の金属であることが必要であり、A’’はSr、Ca、Ba、Ce、Prからなる群から選択される1種以上の金属であることが必要であり、B’とB’’とはMn、Co、Ti、Fe、Ni、Cu、Alからなる群から選択される1種の金属であって互いに異なっていることが必要である。また、前記複合金属酸化物は、前記一般式において、αは0.15≦α≦0.9の範囲にあり、βは0.1≦β≦0.9の範囲にあり、xは0≦x≦1の範囲にあり、yは0≦y≦1の範囲にあり、zは1<zの範囲にあることが必要である。
【0018】
前記酸素を吸蔵する特性を備えるペロブスカイト型複合金属酸化物として、例えば、La1−αMn1−βOzで表される化合物、(La1−xSrx)1−αMn1−βOzで表される化合物等を挙げることができる。
【0019】
前記複合金属酸化物を得るには、まず、前記化合物を構成する金属の炭酸塩または硝酸塩を、目的の複合金属酸化物を構成する金属のモル比に対応する化学量論比で混合し、粉砕した後、得られた混合物にリンゴ酸等の酸と水とを加えてスラリー状にしたものを、例えば50〜80℃の範囲の温度で1〜3時間反応させ、複合リンゴ酸塩を得る。次に、前記複合リンゴ酸塩を200〜400℃の範囲の温度で1〜2時間仮焼した後、700〜1500℃の範囲の温度で1〜10時間焼成することにより、目的の複合金属酸化物を得る。
【0020】
前記複合金属酸化物は、さらに酸処理を施すことにより、酸素を吸蔵する特性を向上させることができる。前記酸処理は、例えば、前記複合金属酸化物を室温で1Mの硝酸に10〜20分間浸漬することにより行う。
【0021】
また、前記酸素吸蔵材料は、前記複合金属酸化物と共にさらに単体金属酸化物を含み、前記複合金属酸化物と単体金属酸化物との複合材料となっていてもよい。前記単体金属酸化物としては、B’aOb(B’は前記一般式と同義であり、1≦a、1≦b)で表される化合物等を挙げることができ、例えば、前記複合金属酸化物La1−αMn1−βOz、(La1−xSrx)1−αMn1−βOzに対するMnaObを挙げることができる。前記複合金属酸化物と単体金属酸化物との複合材料は、該複合金属酸化物を700〜1000℃の範囲の温度に加熱して、構造の一部を変化させることにより得ることができる。
【0022】
本実施形態の粒子状物質浄化装置は、例えば、図6に示すように、円筒状の本体1と、本体1の両端に設けられ、本体1よりも小径の導入部2と、排出部3とを備え、本体1には、前記酸素吸蔵材料がセラミックスフォーム等のセラミックス製多孔質体4,5,6に担持されて配設されている。セラミックス製多孔質体4,5,6は、例えばコージェライト等のアルミナ系セラミックスからなり、前記粒子状物質を含む排気流の上流側になる導入部2側から、下流側になる排出部3に向かって、段階的に気孔率が減少するようにされている。即ち、セラミックス製多孔質体4,5,6の気孔率をそれぞれa,b,cとすると、a>b>cの順になっている。
【0023】
本実施形態の粒子状物質浄化装置では、導入部2から導入された排気流に含まれる前記粒子状物質をセラミックス製多孔質体4,5,6で捕集し、該粒子状物質をセラミックス製多孔質体4,5,6に担持されている前記酸素吸蔵材料の触媒作用により燃焼させて浄化する。このとき、前記酸素吸蔵材料からは酸素が放出されるので、前記粒子状物質の燃焼を比較的低温で行うことができる。
【0024】
また、セラミックス製多孔質体4,5,6は、前述のように、導入部2側から排出部3に向かって段階的に気孔率が減少するように構成されているので、前記排気流を導入したときに前記粒子状物質によるセラミックス製多孔質体4,5,6の目詰まりが生じにくい。従って、本実施形態の粒子状物質浄化装置によれば、前記排気流を無理なく流通せしめることができ、排圧の上昇を避けることができる。
【0025】
次に、実施例を示す。
【実施例1】
【0026】
本実施例では、まず、ランタン(La)の炭酸塩または硝酸塩と、マンガン(Mn)の炭酸塩または硝酸塩とを、La:Mn=1:1(モル比)となるように混合して粉砕した。次に、得られた混合物100重量部に対して、リンゴ酸200重量部と純水300重量部とを加えて75℃で1時間反応させることによりスラリーを得た。次に、前記スラリーを120℃で2時間加熱して脱水し、複合リンゴ酸塩を得た。そして、前記複合リンゴ酸塩を大気中、250℃で1時間仮焼した後、800℃で1時間焼成することにより、複合金属酸化物としてLaMnO3粉末を得た。
【0027】
次に、本実施例で得られた複合金属酸化物(LaMnO3)を酸素吸蔵材料とし、昇温脱離ガス分析装置(株式会社エスコ製)を用いて、10−5Paの減圧下、室温から900℃まで、10℃/分の昇温速度で昇温したときの該酸素吸蔵材料の酸素放出量を測定した。結果を図1に示す。
【0028】
次に、本実施例で得られた複合金属酸化物(LaMnO3)と、γ−アルミナと、純水とを、複合金属酸化物:γ−アルミナ:純水=2:5:10の重量比となるように秤量し、アルミナボールを用いて4時間、粉砕混合した。得られた混合物をハニカム状のコージェライト担体に塗布し、大気中、600℃で5時間焼成することにより、該担体に前記複合金属酸化物を酸素吸蔵材料として担持させた。
【0029】
次に、前記複合金属酸化物を担持させたハニカム状のコージェライト担体に、プロパン(C3H8)1000ppm、酸素0.5%を含み残部が窒素からなる反応評価ガスを流通せしめ、プロパンの分解量を前記酸素吸蔵材料による浄化率として測定し、該酸素吸蔵材料の触媒活性を評価した。結果を図2に示す。
【0030】
次に、本実施例で得られた複合金属酸化物(LaMnO3)を酸素吸蔵材料とし、該酸素吸蔵材料と、粒子状物質のモデルとしてのカーボンブラックとを、酸素吸蔵材料:カーボンブラック=1:1の重量比となるように秤量し、メノウ乳鉢で5分間混合して混合物を得た。次に、熱分析装置(株式会社リガク製)を用い、大気中、室温から800℃まで、10℃/分の昇温速度で昇温して、前記混合物の熱分析を行い、前記酸素吸蔵材料によるカーボンブラックの酸化性能を評価した。結果を図3に示す。尚、比較のため、前記カーボンブラックのみについても、本実施例と全く同一にして熱分析を行った。結果を図3に併せて示す。
【実施例2】
【0031】
本実施例では、まず、ランタン(La)の炭酸塩または硝酸塩と、ストロンチウム(Sr)の炭酸塩または硝酸塩と、マンガン(Mn)の炭酸塩または硝酸塩とを、La:Sr:Mn=2:8:10(モル比)となるように混合して粉砕した。次に、得られた混合物100重量部に対して、リンゴ酸200重量部と純水300重量部とを加えて75℃で1時間反応させることによりスラリーを得た。次に、前記スラリーを120℃で2時間加熱して脱水し、複合リンゴ酸塩を得た。そして、前記複合リンゴ酸塩を大気中、250℃で1時間仮焼した後、800℃で1時間焼成することにより、複合金属酸化物としてLa0.2Sr0.8MnO3粉末を得た。
【0032】
次に、本実施例で得られた複合金属酸化物(La0.2Sr0.8MnO3)を酸素吸蔵材料として用いた以外は、実施例1と全く同一にして、該酸素吸蔵材料の酸素放出量を測定した。結果を図1に示す。
【0033】
次に、本実施例で得られた複合金属酸化物(La0.2Sr0.8MnO3)を酸素吸蔵材料として用いた以外は、実施例1と全く同一にして、該酸素吸蔵材料による浄化率を測定し、該酸素吸蔵材料の触媒活性を評価した。結果を図2に示す。
【0034】
次に、本実施例で得られた複合金属酸化物(La0.2Sr0.8MnO3)を酸素吸蔵材料として用いた以外は、実施例1と全く同一にして、該酸素吸蔵材料の熱分析を行い、該酸素吸蔵材料によるカーボンブラックの酸化性能を評価した。結果を図3に示す。
【実施例3】
【0035】
本実施例では、まず、ランタン(La)の炭酸塩または硝酸塩と、ストロンチウム(Sr)の炭酸塩または硝酸塩と、マンガン(Mn)の炭酸塩または硝酸塩とを、La:Sr:Mn=1:1:2(モル比)となるように混合して粉砕した。次に、得られた混合物100重量部に対して、リンゴ酸200重量部と純水300重量部とを加えて75℃で1時間反応させることによりスラリーを得た。次に、前記スラリーを120℃で2時間加熱して脱水し、複合リンゴ酸塩を得た。次に、前記複合リンゴ酸塩を大気中、250℃で1時間仮焼した後、800℃で1時間焼成した。そして、前記焼成により得られた焼成物を、室温で1M−硝酸に10分間浸漬する酸処理を施すことにより、複合金属酸化物としてLa0.2Sr0.2MnO3粉末を得た。
【0036】
次に、本実施例で得られた複合金属酸化物(La0.2Sr0.2MnO3)を酸素吸蔵材料として用いた以外は、実施例1と全く同一にして、該酸素吸蔵材料の酸素放出量を測定した。結果を図1に示す。
【0037】
次に、本実施例で得られた複合金属酸化物(La0.2Sr0.2MnO3)を酸素吸蔵材料として用いた以外は、実施例1と全く同一にして、該酸素吸蔵材料による浄化率を測定し、該酸素吸蔵材料の触媒活性を評価した。結果を図2に示す。
【0038】
次に、本実施例で得られた複合金属酸化物(La0.2Sr0.2MnO3)を酸素吸蔵材料として用いた以外は、実施例1と全く同一にして、該酸素吸蔵材料の熱分析を行い、該酸素吸蔵材料によるカーボンブラックの酸化性能を評価した。結果を図3に示す。
【0039】
図1から、実施例1の酸素吸蔵材料は、200℃で酸素を放出し始め、500℃に至るまで放出量が増加し続け、500〜900℃の範囲では常に一定の量の酸素を放出しており、酸素吸蔵材料として有効であることが明らかである。
【0040】
また、実施例2の酸素吸蔵材料は、200℃で酸素を放出し始め、500℃に至るまで放出量が増加し続けていることが明らかである。また、実施例3の酸素吸蔵材料は、200℃で酸素を放出し始め、500℃に至るまで放出量が増加し続け、500〜900℃の範囲では常に一定の量の酸素を放出していることが明らかである。
【0041】
さらに、図1から、実施例2、3の酸素吸蔵材料は、実施例1の酸素吸蔵材料よりも酸素放出量が多く、特に実施例3の酸素吸蔵材料は、実施例1の酸素吸蔵材料の約3倍の酸素放出量を示しており、いずれも酸素吸蔵材料として有効であることが明らかである。
【0042】
次に、図2から、実施例1〜3の酸素吸蔵材料は、いずれもプロパンの分解に触媒活性を示し、特に実施例3の酸素吸蔵材料は該触媒活性が高く、いずれも酸化触媒として有効であることが明らかである。
【0043】
次に、図3から、カーボンブラック単体では、酸化反応は500℃で開始され、620℃でピークを示すのに対し、実施例1の酸素吸蔵材料が共存すると前記酸化反応はより低温の300℃で開始され、580℃でピークを示すことから、該酸素吸蔵材料は粒子状物質の酸化触媒として有効であることが明らかである。
【0044】
また、実施例2の酸素吸蔵材料が共存すると前記酸化反応は300℃で開始され、さらに低温の550℃でピークを示すことから、該酸素吸蔵材料は粒子状物質の酸化触媒として有効であることが明らかである。また、実施例3の酸素吸蔵材料が共存すると前記酸化反応は300℃で開始され、さらに低温の520℃でピークを示し、該酸素吸蔵材料は粒子状物質の酸化触媒として特に有効であることが明らかである。
【実施例4】
【0045】
本実施例では、まず、実施例3で得られた複合金属酸化物(La0.2Sr0.2MnO3)を含む酸素吸蔵材料の室温における中性子回折スペクトルを測定した。結果を図4に示す。図4から、前記酸素吸蔵材料は、室温では、La0.2Sr0.2MnO3相60重量%の他、Mn2O3相37重量%、Mn3O4相3重量%を含む複合材料となっていることが明らかである。
【0046】
次に、前記酸素吸蔵材料の900℃における中性子回折スペクトルを測定した。結果を図5に示す。図5から、前記酸素吸蔵材料は、900℃では、La0.2Sr0.2MnO3相60重量%の他、Mn3O4相40重量%を含む複合材料となっており、室温での状態に比較して酸化物の構造変化が生じていることが明らかである。
【0047】
図4、図5から、実施例3で得られた複合金属酸化物(La0.2Sr0.2MnO3)を含む酸素吸蔵材料が、図1に示すように大きな酸素放出量を示す理由は、加熱による前記酸化物の構造変化によるものと考えられる。
【実施例5】
【0048】
本実施例では、図6に示すように、円筒状の本体1と、本体1の両端に設けられ、本体1よりも小径の導入部2と、排出部3とを備える粒子状物質浄化装置において、本体1に、実施例3の酸素吸蔵材料がセラミックスフォーム4,5,6に担持されて配設されている。セラミックスフォーム4,5,6は、コージェライトからなる多孔質体である。本実施例では、セラミックスフォーム4は平均孔径3.2mm、気孔率90%、比表面積5.0m2/gであり、セラミックスフォーム5は平均孔径1.7mm、気孔率70%、比表面積10.0m2/gであり、セラミックスフォーム6は平均孔径1.2mm、気孔率40%、比表面積12.0m2/gであって、導入部2から排出部3に向かって段階的に気孔率が小さくなるように構成されている。
【0049】
本実施例の粒子状物質浄化装置に、ディーゼル機関の排気流を導入したところ、セラミックスフォーム4,5,6における粒子状物質の浄化率は、それぞれ、セラミックスフォーム4が5%、セラミックスフォーム5が22%、セラミックスフォーム6が35%と、下流(排出部3側)に行くほど高くなり、排圧を上昇させることなく、前記粒子状物質の浄化を行うことができた。
【図面の簡単な説明】
【0050】
【図1】本発明の粒子状物質浄化装置に用いる酸素吸蔵材料の酸素放出量を示すグラフ。
【図2】本発明の粒子状物質浄化装置に用いる酸素吸蔵材料の触媒活性を示すグラフ。
【図3】本発明の粒子状物質浄化装置に用いる酸素吸蔵材料の酸化性能を示すグラフ。
【図4】本発明の粒子状物質浄化装置に用いる酸素吸蔵材料の中性子線回折スペクトルを示すグラフ。
【図5】本発明の粒子状物質浄化装置に用いる酸素吸蔵材料の中性子線回折スペクトルを示すグラフ。
【図6】本発明の粒子状物質浄化装置の一構成例を示す説明的断面図。
【符号の説明】
【0051】
1…粒子状物質浄化装置本体、 2…導入部、 3…排出部、 4,5,6…セラミックス製多孔質体。
【特許請求の範囲】
【請求項1】
内燃機関から排出される粒子状物質を燃焼させて浄化する装置において、
一般式(A’1−xA’’x)1−α(B’1−yB’’y)1−βOz(A’はLa、Nd、Gd、Yからなる群から選択される1種以上の金属であり、A’’はSr、Ca、Ba、Ce、Prからなる群から選択される1種以上の金属であり、B’とB’’とはMn、Co、Ti、Fe、Ni、Cu、Alからなる群から選択される1種の金属であって互いに異なり、0.15≦α≦0.9、0.1≦β≦0.9、0≦x≦1、0≦y≦1、1<z)で表される複合金属酸化物を含む酸素吸蔵材料を備えることを特徴とする粒子状物質浄化装置。
【請求項2】
前記複合金属酸化物は、前記一般式におけるB’がMnであることを特徴とする請求項1記載の粒子状物質浄化装置。
【請求項3】
前記複合金属酸化物は、前記一般式におけるA’がLaであり、A’’がSrであることを特徴とする請求項1または請求項2記載の粒子状物質浄化装置。
【請求項4】
前記酸素吸蔵材料は、酸処理されていることを特徴とする請求項1乃至請求項3のいずれか1項記載の粒子状物質浄化装置。
【請求項5】
前記酸素吸蔵材料は、前記複合金属酸化物と単体金属酸化物との複合材料であることを特徴とする請求項1乃至請求項4のいずれか1項記載の粒子状物質浄化装置。
【請求項6】
前記酸素吸蔵材料は、セラミックス製多孔質体に担持されており、該セラミックス製多孔質体は前記内燃機関から排出される粒子状物質の流れの上流から下流に向かって気孔率が減少することを特徴とする粒子状物質浄化装置。
【請求項1】
内燃機関から排出される粒子状物質を燃焼させて浄化する装置において、
一般式(A’1−xA’’x)1−α(B’1−yB’’y)1−βOz(A’はLa、Nd、Gd、Yからなる群から選択される1種以上の金属であり、A’’はSr、Ca、Ba、Ce、Prからなる群から選択される1種以上の金属であり、B’とB’’とはMn、Co、Ti、Fe、Ni、Cu、Alからなる群から選択される1種の金属であって互いに異なり、0.15≦α≦0.9、0.1≦β≦0.9、0≦x≦1、0≦y≦1、1<z)で表される複合金属酸化物を含む酸素吸蔵材料を備えることを特徴とする粒子状物質浄化装置。
【請求項2】
前記複合金属酸化物は、前記一般式におけるB’がMnであることを特徴とする請求項1記載の粒子状物質浄化装置。
【請求項3】
前記複合金属酸化物は、前記一般式におけるA’がLaであり、A’’がSrであることを特徴とする請求項1または請求項2記載の粒子状物質浄化装置。
【請求項4】
前記酸素吸蔵材料は、酸処理されていることを特徴とする請求項1乃至請求項3のいずれか1項記載の粒子状物質浄化装置。
【請求項5】
前記酸素吸蔵材料は、前記複合金属酸化物と単体金属酸化物との複合材料であることを特徴とする請求項1乃至請求項4のいずれか1項記載の粒子状物質浄化装置。
【請求項6】
前記酸素吸蔵材料は、セラミックス製多孔質体に担持されており、該セラミックス製多孔質体は前記内燃機関から排出される粒子状物質の流れの上流から下流に向かって気孔率が減少することを特徴とする粒子状物質浄化装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2006−175304(P2006−175304A)
【公開日】平成18年7月6日(2006.7.6)
【国際特許分類】
【出願番号】特願2004−368775(P2004−368775)
【出願日】平成16年12月21日(2004.12.21)
【出願人】(000005326)本田技研工業株式会社 (23,863)
【Fターム(参考)】
【公開日】平成18年7月6日(2006.7.6)
【国際特許分類】
【出願日】平成16年12月21日(2004.12.21)
【出願人】(000005326)本田技研工業株式会社 (23,863)
【Fターム(参考)】
[ Back to top ]

