粘膜表面への改良された薬物供給
【課題】鼻孔の粘膜表面へ、全身に作用する治療薬を投与するための改良された医薬製剤の提供。
【解決手段】鼻孔の粘膜表面に投与するための、単一成分のスプレー又は単一成分の液体自由流れシステムの形態である医薬製剤であって、全身に作用する治療薬と、エステル化度35%未満のペクチンと、水性キャリアと、から成り、カルシウムイオンを99.9%より大きい割合で有さず、投与部位においてゲル化する医薬製剤。該治療薬としては、ニコチン、シュウ酸ヒオスチン、リグノカイン、ナラトリプタン、プロプラノロール、アポモルヒネ、フェンタニル、又はフェクソフェナジンであることが好ましい。
【解決手段】鼻孔の粘膜表面に投与するための、単一成分のスプレー又は単一成分の液体自由流れシステムの形態である医薬製剤であって、全身に作用する治療薬と、エステル化度35%未満のペクチンと、水性キャリアと、から成り、カルシウムイオンを99.9%より大きい割合で有さず、投与部位においてゲル化する医薬製剤。該治療薬としては、ニコチン、シュウ酸ヒオスチン、リグノカイン、ナラトリプタン、プロプラノロール、アポモルヒネ、フェンタニル、又はフェクソフェナジンであることが好ましい。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、粘膜表面、例えば、鼻、目、膣、直腸、および、咽喉の奥(back of the throat)などへの薬物供給のための改良されたシステムに関するものである。
【背景技術】
【0002】
粘膜への治療薬の投与は、先行技術によってよく知られている。
【0003】
鼻の病気の局所的な治療のための薬物、鼻のワクチン(nasal vaccines)および体循環(system circulation)に対する薬物を含む様々な薬物が鼻に投与されてもよい。鼻は程良い表面積と優れた血液供給機能(blood supply)を有するので、ある脂質親和体薬物(lipophilic drugs)、例えば、ニコチンやプロプラノロールなどが血液中に素早く吸収される。その結果として、静脈注射に見られる同様な生物学的有用性(bioavailability)が生じる。例えば、界面活性剤(surfactants)、粉末、例えば、微結晶性セルロース、ゲル状のマイクロスフェア(gelling microspherers)(例、デンプン)、および、生物学的粘着性ポリマー(bioadhesive polymer)であるチトサン(chitosan)などの増強剤(enhancing agents)を使用することによって吸収が改善されるけれども、多くの極性薬物(polar drugs)がほとんど吸収されない。これらのシステムの例が先行技術によってよく知られており、"Inhalation Delivery of Therapeutic Peptides and Proteins", Adjei and Gupta (eds.) Marcel Dekker Inc., New York (1997) 135-184の中でIllumとFisherによって論評されている。
【0004】
同様の方法で、病気(例 HIV)の予防法(prophylaxis)と同様に、全身性の効果(systemic effect)または病気(特に、感染症、例えば、カンジダ症や細菌性膣炎(bacterial vaginitis))の局所的な治療のために、治療薬、例えば、薬物やワクチンなどを膣腔(vaginal cavity)へ供給することは有用である。避妊薬や殺精子薬(spermicidal agent)を供給するために、局所的に作用する製剤(locally acting formulations)が使用されてもよい。
【0005】
局所的な効果(local effect)を達成するために、または、全身の活動性(systemic activity)のために、目および直腸の粘膜へ薬物が投与されてもよい。
【0006】
もし、比較的長い間、鼻に投与された製剤が局所的な効果を引き起こす薬物、ワクチンまたはDNAを鼻の中に維持させることができたなら、改善された効率の点から相当な利点が得られることが期待される。以前、従事者はこの目的のために様々な戦略(strategies)を使用してきた。
【0007】
例えば、Illumらは、例えばデンプンなどの材料に基づいた生分解性の(biodegradable)マイクロスフェアが、約10分から15分であるクリアランス(clearance)の通常の半減期と比較して、数時間までクリアランスを遅らすことができることが分かった(Illum et al, Int. J. Pharm., 39 (1986) 189-199)。驚くことに、鼻腔の中における上皮細胞のタイト結合(tight junction)の完全性(integrity)に影響を与えることによって、そのようなシステムが吸収度を改善することが分かった。それゆえ、このシステムによって全身に(systemically)薬物を最適に作用させることが期待される。
【0008】
同様に、Illumらは、生物学的粘着材料(bioadhesive material)であるチトサンが、薬物吸収度の増加につれて粘膜繊毛クリアランス(mucociliary clearance)を変更することができることが分かった。(Illum et al, Pharm Res., (1994) 1186-1189)。
【0009】
扱いが容易であることと投与が容易であることから、鼻への薬物投与に適合するような溶液スプレーシステムであって、さらに、鼻腔内で長時間維持するためのそのようなシステムを介して投与されるべき薬物に適合するような簡易な溶液スプレーシステムを利用できるようにすることがもっとも有益である。当業者は、この目的のために、製剤方法(formulation methods)、例えば、環境反応ゲル(environmentally-responsive gels)の使用と同様に、繊毛の活動に対する直接的な効果によって粘膜繊毛クリアランスを減少させる薬物学的な試薬(pharmacological agents)、例えば、コカインの使用を含む様々な戦略を予測するかもしれない。
【0010】
環境の変化に反応してゲル化する液体は当業者に知られている。環境的変化とは、温度、pH、イオン強度、あるいは、これらのファクターの組み合わせである。これらすべてのシステムの例は、従来の技術文献の中から見つけだすことができる(例えば、Proceed. Intern. Symp. Control Rel., 24, 335 (1997)の中でPottsらによって記載されたゲルムド(Gelmed)からのスマートなヒドロゲル(smart hydrogel)を参照)。しかしながら、例えば、刺激、不快感(例、冷たい溶液の投与)、粘膜へのダメージ、体循環内への薬物吸収度の不要な増大などの要因から、これらの大多数は人間の鼻への使用に適さないことが分かった。また、多くは、行政の認可(regulatory approval)がないため、利用できない。
【0011】
要するに、投与が容易な液状である単一剤の鼻供給システム(single component nasal delivery system)を提供すること、特に、投与者に対して使用可能で、鼻組織(nasal tissues)に接触するときに鼻の中でゲル化する単一剤の鼻供給システムを提供すること、および、局所的にまたは全身に効く薬品(治療薬)の吸収特性を修正することが相当大きな利点を与える。また、患者に対して容易に受け入れられ、局所的な効果を引き起こすための薬品が体循環中に吸収されることを強めず(それが副作用を引き起こすとき)、規制当局(regulatory authorities)に認可された物質を有するシステムを提供することが望ましい。
【0012】
当業者は、局所的なリンパ系組織への改良されたワクチン供給や、上皮細胞の移入(transfection)のための改良されたDNA供給のためのドラッグデリバリーと同様に、膣腔、直腸、目、咽喉の奥に影響を及ぼす状態に対する改良された治療のためのドラッグデリバリーに関して解決されるべき同様な問題があることを認識する。
【0013】
例えば、膣の感染病(vaginal infections)に対する治療のための薬物や、膣加湿剤(vaginal moisturising agents)(特に、閉経後の状態に有用である)として機能する無薬物製剤(drug free formulations)は、膣腔の中でよく広がり、長い間保持されるべきである。しかしながら、数日間膣腔内で保持されるべきいわゆる生物学的粘着性製剤(bioadhesive formulations)は素早く放出される可能性があり、投与量の80パーセント以上が2時間以内に膣から離れてしまうことが報告された(Brown et al, 14, 1073 (1997))。したがって、単純な液体(simple liquid)として膣へ挿入されることができ、局所的な環境状況下で強い保持力を与えるためにゲル化する単一剤の液体組成物を提供することは有利なことになるだろう。
【0014】
直腸浣腸(rectal enemas)の場合、もし液体浣腸(liquid enema)が一旦注入されると確実に局所的な環境に密着し早く放出することを抑制するようにゲルを形成するならば、このことは最大の有利点となる。
【0015】
同様な問題は、目への投与についても、液体製剤(liquid formulations)が素早く目から鼻涙管へきれいに排出されるという点で同一視されるであろう。目に投与されるときにゲル化する単一剤の液体組成物は、目の感染病や伝染病(eye infections and inflammation)などの状況に対する治療にとって有利に働くだろう。
【0016】
ペクチンは、すべての緑色陸上植物の一次細胞壁から発見された物質である。それらは、α−1,4−結合ポリガラクツロン酸(a-1,4-linked polygalacturonic acid)のように均一な多糖類バックボーン(polysaccharide backbone)を有する不均質物質(heterogeneous materials)である。例えば、キシロース、ガラクトース、ラムノース、アラビノースのような様々な中性糖(neutral sugars)がペクチン中で同一化(identified)されている。
【0017】
ペクチンのゲル化特性に影響を及ぼすことが知られているペクチンの臨界特性(critical property)は、ガラクツロン酸単位体(galacturonic acid units)がエステル化するまでの範囲である。自然界で発見されたペクチンのエステル化度(degree of esterification)(DE)が相当異なることがありうる(60から90%まで)。この用語DEは当業者によってよく理解され、エステル化されたカルボキシル基の総数のパーセンテージとして、または、ペクチンのメトキシルの含量(methoxyl content)として表される。各々の理論最大値は、それぞれ100%と16%である。ここで使われているDEは、エステル化されたカルボキシル基の総数について言及している。低DEペクチン(すなわち、エステル化が50%未満であるペクチン)は、大抵、抽出されたペクチンの脱エステル化(deesterification)によって作製され、普通、ベンチスケール(bench scale)では、酵素的方法(enzymatic process)によって、また、工業スケール(industrial scale)では、アルコール不均一性媒質(alcoholic heterogeneous medium)の中で酸またはアンモニアで処理することによって作製される。低メトキシル化度(DM;45%未満)であるペクチンに関して、ゲル化特性は、DMとペクチンの分子量に依存していることが知られている。低メトキシルペクチンのゲル化に関する化学(the chemistry of low methoxyl pectin gelation)は、"The Chemistry and Technology of Pectin", Academic Press, New York, pp. 109-118, (1991)の中でAxelosとThibaultによって記述されている。
【0018】
様々な従来技術文献の中で、生物学的粘着性ゲル化材料(bioadhesive and gelling material)として、ペクチンの潜在的な使用について議論されている。Smartら、J. Pherm. Pharmacol. 36, 295 (1984)によってなされた様々な材料の粘液への粘着性に関する研究の中で、ペクチンは試験管内の(in vitro)試験で粘着性が低いことが示されている。ペクチンを含む粘膜(mucus membrane)に付着可能なタブレットはEP306454に記述されている。Oechsleinら(Int. J. Pharm., 139, (1994), 25-32)は、ソマトスタチン類似体ペプチドオクトレオチド(somatostatin analogue peptide octreotide)の鼻からの吸収を強めるための様々な粉末製剤の潜在力を記載している。ペクチン(タイプFPA)粉末は使用され、生理食塩水中に投与された薬物と比べて、薬物の絶対的な生物学的有用性(absolute bioavailability)の増加を引き起こす。これら文献にも、低DEペクチンを含む溶液製剤の使用、または、鼻の分泌物に接触することでゲル化するペクチンについて記述されていない。
【0019】
ペクチンは、さらに、粘膜付着性眼科用材料(mucoadhesive ophthalmic material)として、Chetoniら(Bull. Chem. Farm., 135, 147 (1996))によって研究されている。パッチ(patches)として口膜(oral mucosa)へ投与するためのペクチンを有する薬物の塩錯体が、World Meet. Pharm. Biopharm. Pharm. Technol., (1995), p. 839, APGI, Parisの中で、Burgalassiらによって記載されている。PopoviciとSzasz (in "Buccal and Nasal Administration as Alternatives to Parenteral Administration", Minutes of a European Symposium (1992), Duchene, D., Ed., Sante, Paris, France. P. 292-6)は、セルロースとペクチンとマグネシウムの形をした二価カチオンとを含む粘膜付着性ヒドロゲル(mucoadhesive hydrogels)を記述している。粘膜表面に接触することでゲル化する溶液として低DEペクチンを使用することは、これら文献のいずれにも記載されていない。
【0020】
米国特許第4,826,683号には、植物性オイル、ロカイ汁(aloe vera)、亜鉛、ビタミンC、ビタミンA、ビタミンE、ビタミンB6、ビオチンおよびフルーツペクチン(fruit pectin)を含む鼻のうっ血除去剤(nasal decongestant)が記載されている。フルーツペクチンの含有量は1リットルあたり最大2gである。商号"Cetro"でGeneral Foodsによって供給される可溶化フルーツペクチンが好ましい。日本国特許第62236862号には、えい糸性水溶性ポリマー(spinnable water soluble polymer)と、多糖類、タンパク質、または、ビニルポリマーの混合物から成り立っている人工的な粘液が記載されている。ペクチンの種類は特定されていないけれども、ペクチンは適当な多糖類としてリストされている。
【0021】
米国特許第5,147,648号(欧州特許第289512号)には、別々に加えたとき、粘膜を治療するためのゲルを形成することができる少なくとも2つの成分から作られた薬学的な製剤(pharmaceutical formulation)が記載されている。この2つの成分は粘膜の同じエリアに別々に加えられる。これらの成分は、同時にまたは続けて加えられてもよい。ゲル形成溶液成分のうち一方がカルシウム塩(例えば、グルコン酸カルシウム(calcium gluconate))を含み、他方がペクチンを含んでもよい。この従来技術文献では、いったん粘膜に接触するとゲル化する別々に加えられるカルシウムイオン溶液がない状態で、ペクチンを有する溶液が単一剤として投与されてもよいことが暗示されていない。
【0022】
米国特許第5,318,780号には、フィルム形成ポリマー(例えば、ペクチン)とイオン多糖類(ionic polysaccharide)である2つの成分を含み、その混合物を対イオン(counter-ion)と接触させることによって生体内で(in situ)ゲル化する水性の製薬溶剤(aqueous pharmaceutical vehicles)が記載されている。例えばペクチンのようなポリガラクツロン酸は、角膜シールドを保護する角膜のマスティス(corneal mastis protective corneal shields)として目に投与されるための典型的で有用なポリマーを広範囲にわたって列挙しているリストの中に言及されている。ペクチン溶液を単独で使用する例、および、低DEペクチン(pectins with a low DE)または粘膜に接触することでゲル化するペクチンを使用する例は記載されていない。
【0023】
向イオン性ゲル化(ionotropic gelation)によるペクチンビード(pectin beads)の作製は、AydinとAkburfa (1996) Int. J. Pharm., 137, 133-136によって開示されている。
【発明の概要】
【発明が解決しようとする課題】
【0024】
要するに、粘膜表面に投与されるべき薬学的なシステム(pharmaceutical system)の中で以前に使用されているペクチンに関して、すべてのペクチンが、カルシウムイオンの存在によってゲル化することは先行技術の中で知られているけれども、生理学的濃度(physiological concentrations)をはるかに越えた高レベルのカルシウムが必要であることが今まで理解されてきた。このことは、前もって形成されたゲルの形で、または、生体内でゲルを生成するために外因性カルシウム(exogenous calcium)の添加前または添加後に投与されるペクチンシステム(pectin systems)の利用が必要とされてきた。低DEペクチンを有する液体(特に、溶液)がそれ自体で(as such)投与されてもよいことも、その液体が粘膜に投与されたとき、または、投与された直後にゲル化してもよいことも、上述の従来技術文献のうちいずれにも開示されていなく、暗示もされていない。さらに、そのようなゲル化特性に関するペクチンのDEの重要性は、これら従来技術文献のうちいずれにも言及されていない。
【課題を解決するための手段】
【0025】
我々は、驚くことに、あるペクチン材料、すなわち、低DEペクチン材料が単一剤、単純な液体製剤(すなわち、水性キャリア(aqueous carrier))の形で投与されてもよいことが分かった。その液体製剤は、鼻、直腸、膣腔、目、咽喉の奥の粘膜に投与されるとき、ゲル化し、または、ゲル化するように簡単に構成することできる。また、我々は、驚くことに、生理学的に許容されるpH値で、はるかに減少したカルシウム濃度、すなわち、膣内腔(vaginal lumen)、直腸腔(rectal cavity)および目からの涙(tear fluid of the eye)と同様に鼻の分泌物の中から生理学的に発見されたカルシウムによって、ゲル化が起こりうることが分かった。
【図面の簡単な説明】
【0026】
【図1】低DEペクチンを有する製剤の形でサケカルシトニン(salmon calcitonin)がヒツジの鼻腔内に(intranasally)投与されたとき、サケカルシトニンの体内吸収(systemic uptake)の効果を示す。
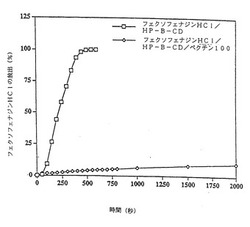
【図2】HP−β−CDおよびHP−β−CD/ペクチン100溶液から擬似鼻電解液(simulated nasal electrolyte solution)へのフェクソフェナジンHClの累計放出/拡散値(cumulative release/diffusion of fexofenadine HCl)を示す。
【発明を実施するための形態】
【0027】
本発明の第一の側面によると、治療薬と、低DEペクチンと、水性キャリアとを有し、投与部位でゲル化し、または、ゲル化するように構成可能である粘膜表面に投与するための提供された単一剤の液体薬学的組成物(single component liquid pharmaceutical composition)がある。
【0028】
我々は、特に、そのような組成物が、外来的に(extraneously)(すなわち、別々におよび/または独立に)加えられた(同時に、または、続けて)カルシウム(または他の二価金属)イオン溶液が存在しない状態で、粘膜表面に投与されたとき、または、投与された直後に投与部位でゲル化し、または、ゲル化するように構成することができることが分かった。治療薬と、低DEペクチンと、水性キャリアとを有し、直接粘膜表面へ投与するための提供された単一剤の液体薬学的組成物があり、その組成物は、同じ部位に投与された二価金属イオンの外来的な源(extraneous source)(例えば、溶液)が存在しない状態で、投与部位でゲル化するように構成可能である。
【0029】
本発明のさらなる側面によると、粘膜表面に投与するための液体薬学的組成物を有し、キットが外来的に前記表面に加えられるべき二価金属イオン溶液を有していないという条件で、前記組成物は、治療薬と、低DEペクチンと、水性キャリアとを有する提供されたパーツキット(kit of parts)がある。
【0030】
特に、粘膜表面に投与するための液体薬学的組成物を有し、その組成物は、治療薬と、低DEペクチンと、水性キャリアとを有し、パーツキットはパッケージされ(packaged)、さらに、そのパーツキットには二価金属イオンの外来的な源が存在しない状態で前記表面に前記組成物を投与するための説明書(instructions)が与えられている提供されたパーツキットがある。
【0031】
治療薬と、低DEペクチンと、水性キャリアとを有し、単一剤として投与されるもの、または、投与されるべきもので、さらに、二価金属イオンの外来的な源が存在しない状態でゲル化し、または、ゲル化するように構成する粘膜表面に投与するためのその液体薬学的組成物は、以下、”発明の組成物(the compositions of the invention)”と呼ばれる。
【0032】
我々は、粘膜への投与時に流動体(mobile fluid)の形で存在する組成物のことを”液体”組成物という。発明の組成物は、ペクチンと治療薬を含む溶液、懸濁液(suspension)、または、乳濁液(emulsion)を有する水性製剤(aqueous formulation)の形で水の中に存在する。発明の組成物は、投与時に、または、投与直後(例えば、5分以内に)にゲル化し、または、ゲル化するように構成され、固体または半固体ゲル材料を形成する。ここで、ゲルは、投与部位での維持効果(retaining effect)を提供することに適している。
【0033】
我々は、例えば、"The Chemistry and Technology of Pectin", Academic Press, New York (1991), p. 192の中でWalterの記事に記載されているように、エステル化したガラクツロン酸単位体(galacturonic acid units)のパーセンテージを”エステル化度(DE)”という。我々は、ガラクツロン酸単位体の50%未満、好ましくは、35%未満がエステル化されたペクチンを”低DE”という。
【0034】
我々は、二価金属イオンの”外来的な源”に、そのようなイオンの別々な、および/または、独立した(すなわち、外来的な)源を含める。粘膜に発明の組成物が投与されることによって生じるゲルの中に存在するイオンは、組成物から、および、組成物が投与されるべき患者の体の分泌物から得られたものではない(例えば、鼻の分泌物、涙などから得られた内因性イオン(endogenous ions))。言及されるであろう二価金属イオンは、カルシウムイオンを含む。
【0035】
本発明のさらなる側面によると、治療薬と、低DEペクチンと、水性キャリアとを有する液体組成物を、哺乳類患者(mammalian patient)の粘膜表面に、二価金属イオンの溶液をその表面に外来的に投与しない状態で投与することによって取得可能な、医薬ゲル組成物(pharmaceutical gel composition)が提供される。
【0036】
粘膜表面に接触するときに形成されるゲルは、内因性二価金属イオン(endogenous divalent metal ions)(すなわち、体の分泌物から直接得られるイオン)のみを含み、外来性二価金属イオン(extraneous divalent metal ions)(すなわち、外来的な源から得られるイオン)を含まないだろう。本発明のさらなる側面によると、医薬ゲル組成物が提供され、当該ゲルは治療薬と低DEペクチンとを有し、且つ、前記ゲルは、前記治療薬とペクチンとを水性キャリア中に含む液体組成物を適用することにより得ることができ、また、前記ゲルは、前記液体組成物が投与される前、同時に、または、後に、前記粘膜表面に投与された外来の二価金属イオンを実質的に有さない。
【0037】
発明の組成物がそのようなイオンの外来的な源とともに加えられていないので、二価イオンを“実質的に有さない”とは、97%より大きく、好ましくは99%より大きく、さらに好ましくは99.9%より大きく、特に99.99%より大きい割合で有さないことを意味する。
【0038】
例えば、"Industrial Gums", Academic Press, New York (1993) p. 257の中のRollinによる記事に記載されているような技術、または、上記に記載されているような公知技術に従って、低DEペクチンは、公知の源(source)から得られ、または、高DEペクチン(例えば、Sigma Fine Chemicalsから得られるであろう)の脱エステル化によって得ることができる。低DEペクチンは、例えば、スレンディッドタイプ100(slendid type 100)とスレンディッドタイプ110(slendid type 110)として知られている市販材料(commercial material)としてのコペンハーゲンペクチンA/S(Copenhagen Pectin A/S)から得られるだろう。これらペクチンは柑橘類の皮から抽出され、サッカロースを加えることで標準化される。標準化工程は、上述の記事中にRollinによって記載されている。DEは、双方のペクチンで50%未満であり、タイプ100で約10%であり、タイプ110で約35%である。さらに、使用されるであろう材料は、GENUペクチンタイプ LM 1912 CSと、Pomosinペクチンタイプ LM 12 CGとLM 18 CGを含む。
【0039】
発明の組成物は、公知技術に従って溶液、懸濁液、または、乳濁液を形成するために、水溶系(aqueous system)中に低DEペクチンと治療薬とを溶解するか、または、分散することによって、作製されてもよい。例えば、治療薬は、従来の作製されたペクチン水溶液の中に溶解されてもよいし、または、水溶系の中に懸濁液として、または、懸濁液を形成するために加えてもよい。ここで、薬物粒子(drug particles)は、100ミクロン未満の大きさであり、好ましくは、1から20ミクロンの大きさである。あるいはまた、薬物は適切な油性溶剤(oily vehicle)、例えば、植物性オイルの中に溶解され、または、懸濁され、その後、乳濁液を形成するためにペクチン水溶液の中で分散されてもよい。このように開発されたこの種の水性製剤が、投与量や薬物の物理的特徴(characteristics)や特性(properties)(例えば、溶解度、塩基度など)と同様に治療されるべき粘膜に依存することは、当業者にとって認識されるであろう。
【0040】
発明の組成物中の低DEペクチンの濃度は、ペクチンの性質(nature)、他の成分の存在、その組成物のゲル化特性(gelation properties)に影響を及ぼす他の要因(下記参照)に依存するが、1g/Lから100g/Lまでがよいし、好ましくは、1g/Lから50g/Lまでがよいし、さらに好ましくは、2g/Lから10g/Lまでがよいし、特に、5g/Lから10g/Lまでがよい。
【0041】
発明の組成物は、局所的な治療のための鼻への薬物供給に関する重大な問題、すなわち、速い粘膜繊毛クリアランス機構(rapid mucociliary clearance mechanism)の予防の目的で使用されてもよい。堆積された物質を鼻の前部(the front of the nose)から喉へと取り除くこの自然なプロセスは、約10から20分のハーフタイム(half-time)で鼻から物質を取り除くことができる。そのようなクリアランス速度(clearance rate)が、サッカリンクリアランステスト(saccharin clearance test)またはガンマシンチグラフィー(gamma scintigraphy)を使って容易に人体で測定されることができる(Aspden et al, J. Pharm. Sci., 86, 509 (1997); Illum et al, Int. J. Pharm., 39 (1987) 189-199)。
【0042】
発明の組成物は、先行技術によって知られた粘膜への薬物供給と比較したとき、比較的長い期間、粘膜表面で局所的に効く治療薬を維持するために使用されてもよい。もし、治療薬が容易に吸収されるならば、吸収を遅らせてもよい。従って、薬物の保持が必要である投与部位に薬物をさらに保持させる。
【0043】
発明の組成物の中で使用される治療薬は、例えば、鼻炎、ウィルス性感染などの状態を局所的に治療するために使用される鼻への投与のための薬物と同様に、うっ血除去としてはたらく薬物を含む。発明の組成物は、鼻に関連したリンパ系組織(nose associated lymphoid tissue)へのワクチンの供給を改良する方法として、および、鼻の上皮細胞へ移入するためのよりよいDNAの提供(presentation)のために使用されてもよい。
【0044】
発明の組成物の中での使用および粘膜表面の局所的な治療に適した治療薬の以下のリストが例証として用意され、さらに、それは排他的なものでない:抗ウィルス薬剤(antiviral agents)、例えば、ICAM−1、ピロバディル(pirovadir)、アシクロヴィル(acyclovir)、ブロモビニルデオキウリジン(bromovinyldeoxyuridine)、α、βおよびγ−インターフェロン(a, band g-interferon)、ジドブジン(zidovudine);うっ血除去剤、例えば、オキシメタザリン(oxymetazaline);抗アレルギー薬剤(anti-allergic agents)、例えば、クロモグリシン酸ナトリウム、および、ブデソニド(sodium cromoglycate and budesonide);スレロイド(steroids)、例えば、フルチカゾン(fluticazone);ワクチン、例えば、DNA、インフルエンザ、百日咳(pertussis)、嚢尾虫(measles)、ジフテリアワクチン(diphtheria vaccines);抗菌性物質(antibacterial agents);抗真菌薬(antifungal agents)、例えば、アンホテリシン(amphotericin)、ナイスタチン(nystatin);避妊および/または殺精子剤(contraceptive and/or spermicidal agents);抗体、特に子供の体内へのRSV感染の治療のための抗体;HIVに対する予防薬;抗ヒスタミン薬(antihistamines)、例えば、ジフェニルヒドラミン塩酸塩(diphenhydramine hydrochloride);遺伝子(genes)。
【0045】
上述の治療薬の組み合わせもまた使用されてもよい。
【0046】
発明の組成物は、大循環(general circulation)への輸送速度を変えるか、または、容易に吸収可能な薬物の吸収を遅くするかの一方によって、系統的に作用するような容易に吸収可能な薬物のためのプラズマレベル対時間のグラフを制御する(すなわち、よりフラットなグラフを与える)ために使用されてもよい。このことは、例えば、高ピークプラズマレベルからの副作用が避けられるとき、重要なものとなりうる。
【0047】
発明の組成物は、アポモルヒネ(apomorphine)、ニコチン(nicotine)、ヒオスチンシュウ酸塩(hyoscine hydrobromide)、リグノカイン(lignocaine)、フェンタニル(fentanyl)、ナラトリプタン(naratriptan)、フェロモン(pheromones)およびプロプラノロール(propranolol)を含むがこれらに限定されない粘膜に投与された薬物の系統的な吸収の変更のために使用されてもよい。
【0048】
上述の治療薬の組み合わせもまた使用されてもよい。
【0049】
疑問を避けるために、用語”治療薬”とは、ここでは、病気の治療および予防に使用するために適した試薬を含む。
【0050】
発明の組成物は、使用される治療薬に依存する哺乳類患者に、病気/状態を治療/予防するために使用されてもよい。上記について、言及されるであろう局所的に作用する系統的な薬物、病気/状態のすべてを網羅していない目録には、例の治療薬が有効であることが知られている病気/状態が含まれ、さらに、マーチンデール(Martindale) "The Extra Pharmacopoeia", 31st Edition, Royal Pharmaceutical Society (1996)の中で例の薬物に対する特に掲載されている病気/状態が含まれる。
【0051】
好ましくは、薬物はニコチンとアポモルヒネを含む。
【0052】
発明の組成物の中で使用されている治療薬の量は、使用される薬と治療されるべき病気とに依存するが、0.01から40%w/wの範囲内であればよい。しかしながら、当業者にとって、治療薬の適切な投与量が容易に非発明的に(non-inventively)決定されることは明らかである。例えば、投与量の概算は、投与量の0.1から90%が吸収されると仮定して、公知である注射可能な生成物(injectable products)から算定されることができる。適切な単一ユニットの投与量(single unit doses)は、使用される治療薬と投与ルートに依存するが、10μgから500mgの範囲内にある。適切な1日の投与量は、使用される治療薬と投与ルートに依存するが、10μgから1g/日の範囲内にある。
【0053】
薬物と、低DEペクチンとを有する多くの組成物は、投与部位に投与される時点で、すなわち、関連した粘膜表面に接触するとき、または、接触する直後(例えば、5分以内に)にゲル化するであろう。しかしながら、いくつかの製剤の中で、使用される薬物および/またはペクチンの性質(nature)によって、組成物が接触時または接触直後(例えば、1分以内に)にゲル化するように構成されることが要求されてもよい。このことは、当業者にとって公知である技術を介して容易に達成されるであろう。
【0054】
例えば、ペクチンの濃度を、水性製剤が粘膜表面に接触するとすぐにゲル化するように選択してもよい。
【0055】
さらに、ゲル化工程を助けるために一価イオンを付加することを必要としてもよい(例えば、等張性(isotonicity)を供給するためだけでなく、液体製剤をゲル化するように構成するために、単純一価電解液(simple monovalent electrolytes) 、例えば、NaClが加えられてもよい)。
【0056】
また、水性製剤の中の薬物の量と性質はゲル化特性に影響を及ぼしてもよい。例えば、弱塩基(例えば、ニコチン)である薬物や、ペクチンのようなアニオン材料(anionic materials)とともに可逆錯体(reversible complexes)を形成することが知られている薬物を含むある薬物を高レベルに添加することによって、ペクチン分子上の負電荷の好ましくは30%が、さらに好ましくは50%が、最も好ましくは60%が結合しない(uncomplexed)ように薬物とペクチンとの比率の変化が要求されてもよい。
【0057】
あるいはまた、例えば、ショ糖の形をした糖は、ゲル化を助けるために、製剤に加えられてもよい。非イオン化多糖類(non-ionic polysaccharides)(例えば、ヒドロキシプロピルメチルセルロース(hydroxypropyl methyl cellulose))もまた使用されてもよい。
【0058】
組成物のpHがゲル化特性に影響を及ぼすことが分かった。組成物のゲル化特性および治療薬の特性を考慮すると、発明の組成物のpHは2から9、さらに好ましくは3から8、最も好ましくは4から7がよい。例えば、一般的に、我々は、ペクチンのDEが低いほど組成物がゲル化するpHが低いことが分かった。pHは、当業者にとって公知である技術、例えば、薬学的に許容される緩衝試薬(buffering agents)、特に低イオン強度の緩衝試薬の添加によって調整されてもよい。"The Chemistry and Technology of Pectin", Academic Press, New York, pp. 109-118, (1991)の中で、AxelosとThibaultは、低DEペクチン溶液のゲル化特性がpHとイオン強度に対して幾分敏感にする方法について述べている。
【0059】
ゲル化するように発明の組成物を構成するために使用可能な上述の技術は、通常のルーチン実験(routine experimentation)の中で当業者によって研究され、および、決定されてもよい。ゲル化特性に影響を及ぼすために、これらの技術の組み合わせもまた使用されてもよい。
【0060】
組成物は、薬物と相互作用を起こすこと、例えば、包有物(inclusion)または塩橋錯体(salt-bridge complexes)を形成することが知られている試薬だけでなく、例えば、防腐剤(preservatives)(例えば、メタ重硫酸ナトリウム(sodium metabisulphate)などの低濃度物質)、安定剤(stabilisers)、香味料(flavouring agents)、吸収強化剤(absorption enhancers)、例えば、胆汁酸塩(bile salts)、ホスファチド(phospholipids)などの薬学的付形剤(pharmaceutical excipients)の形で他の添加物を含み、そして、例えば、サイクロデキストリン(cyclodextrins)やイオン交換樹脂(ion exchange resins)など形成されたゲルから鼻腔の中で制御された放出(controlled release)を促進してもよい。発明の組成物に加えられてもよい付加的な薬学的に許容される付形剤は、例えばグリセロールなどの試薬を含む。
【0061】
本発明のさらなる側面によると、水性キャリアの中で治療薬とペクチンとを一緒に混合する工程を有する発明の組成物の提供された作製方法がある。
【0062】
発明の組成物は、当業者にとって公知であるすべての技術に従い、さらに、当業者にとって公知であるすべての供給装置を介して、適切な投与量で投与されてもよい。例えば、鼻への供給のために、好ましくは、発明の組成物は、例えば、フェイファー調節投与ポンプ(Pfeiffer metered dose pump)またはヴァロア調節投与ポンプ(Valois metered dose pump)などのスプレー装置を介して、または、液体自由流れシステム(liquid free flow system)(例えば、鼻の滴剤(nasal drops))を介して投与される。膣や直腸への投与(注入)のために、シリンジタイプの投与器(syringe-type applicator)が使用されてもよいし、適当なノズルが取り付けられたプラスティックアンプルでもよい。ここで、アンプルの内容物は、わずかな圧力を加えることで膣または直腸の表面に供給されることができる。咽喉の奥に発明の組成物を供給するための適切なシステムは、当業者にとって公知であるスプレー装置を含む。目に発明の組成物を供給するための適切なシステムは、当業者にとって公知である液体自由流れシステムを含む(例えば、目薬)。
【0063】
発明の組成物は、二価金属イオンの外来的な源を有する付加的な成分がない状態において、単一剤でかつ単純液体製剤の形で、当業者にとって公知である装置を使うことにより、容易に粘膜表面に投与されてもよいという利点を有する。発明の組成物は、さらに、生理学的に許容されるpHで、膣内腔、直腸腔および目からの涙と同様に鼻の分泌物の中で生理的に発見される内因性カルシウム(endogenous calcium)(のみ)が存在する状態で、粘膜に接触するとき、または、接触する直後にゲル化するという利点を有する。
【0064】
発明の組成物は、粘膜表面で局所的に作用する薬物(locally-acting drug)を維持するために、または、体循環(systemic circulation)への薬物吸収を制御するために使用されてもよいという利点も有する。
【0065】
発明の組成物は、患者に対して容易に受け入れられ、さらに、規制当局に認可された物質を有してもよいという利点も有する。
【0066】
本発明のさらなる側面によると、患者の粘膜表面に二価金属イオン溶液を外来的に投与しない状態で、治療薬と、低DEペクチンと、水性キャリアとを有する液体薬学的組成物を前記表面に投与する工程を有し、前記組成物は、投与部位でゲル化しまたはゲル化するように構成された提供された患者の治療方法がある。
【0067】
患者の粘膜表面に二価金属イオン溶液を外来的に投与しない状態で、病気に対して効果がある治療薬を含む発明の組成物を、治療を必要とする患者の前記表面に投与する工程を有する提供された病気の治療または予防方法がある。
【実施例】
【0068】
本発明は、決して制限されないが、図面を参照にしながら次の例によって説明される。
【0069】
例1
低DEペクチンが鼻腔の擬似状況下でゲル化するが、一方高DEペクチンがゲル化しないことの実証
【0070】
材料:
ペクチン、エステル化(esterified)、カリウム塩(potassium salt)(DE:31%;ロット番号22H0548;Sigma)
ペクチン、エステル化、カリウム塩(DE:67%;ロット番号74H1093;Sigma)
ペクチン、エステル化(DE:93%;ロット番号125H0123;Sigma)
ペクチン、スレンディッドタイプ100(ロット番号620970;Hercules;デンマーク)
ペクチン、スレンディッドタイプ110(ロット番号626790;Hercules;デンマーク)
ペクチン、GENUタイプLM12CG(ロット番号G63481;Pomosin GmbH;Hercules;ドイツ)
ペクチン、GENUタイプLM18CG(ロット番号G63484;Pomosin GmbH;Hercules;ドイツ)
塩化ナトリウム(BDH)
塩化カリウム(BDH)
脱水塩化カルシウム(Calcium chloride dehydrate)(Sigma)
【0071】
擬似鼻電解(SNES)液が調製され、次の成分から構成された:
塩化ナトリウム 8.77g/L
塩化カリウム 2.98g/L
脱水塩化カルシウム 0.59g/L
【0072】
SNESが2倍の濃度(strength)に調製された:
【0073】
塩化ナトリウム3.508g、塩化カリウム1.192gおよび脱水塩化カルシウム0.236gがそれぞれ3つの秤量ボート(weighing boats)で秤量され、そして、
溶解され、そして、200mLメスフラスコに移し替えられた。
薬品が溶解するまで、溶液がマグネティクスターラーで撹拌された。
水が容積(volume)に加えられた。
【0074】
20g/Lペクチン溶液の調製
それぞれのタイプのペクチン1gが100mL瓶で秤量された。
超純水(ultrapure water)がそれぞれの瓶に加えられた。
ペクチンが溶解するまで、含有物がマグネティクスターラーで撹拌され、そして、
溶液のpHが測定され、0.1M水酸化ナトリウム溶液でpH4またはpH6.5に調整された。
【0075】
異なる濃度(2から10g/Lまで)でSNESとペクチンとを含む様々な製剤の調製
【0076】
終濃度2,3,4,5,6,7,8,9および10g/Lを得るために、正確に20g/Lのペクチン溶液が一連の10mLねじキャップ式ガラス管(a series of 10 mL screw capped glass tubes)で計量された。
【0077】
まず総容積2.5mLを得るために正確な容積を持つ水が加えられ、その後、2倍の濃度のSNES2.5mLが加えられた。
管が15分間氷水浴で冷却された。
相状態(phase state)および流動特性(flow property)を検査するために、試験管が傾けられた。
再び相状態および流動特性を検査するために、管が力強く振られた。
【0078】
結果
結果が表1に示されている:
【0079】
1. pH値4および6.5において、ペクチンの終濃度が>2g/Lであったとき、ペクチンタイプ100および110が擬似鼻電解液でゲル化し、終濃度が>4g/Lであったとき、強力なゲルを形成した。ゲルは透明でかつ均質であった。ゲルの強度は、系内のペクチン濃度の増加に伴って増加した。
【0080】
2. ペクチンタイプLM12CGおよびLM18CGが、それぞれ終ペクチン濃度4g/Lと6g/L(pH4)および4g/L(pH6.5)でゲル化した。これら2種類のペクチンは、pH6.5でさらにそれぞれ6g/L、8g/Lより高い濃度で固体ゲル(solid gels)を形成したのみであった。
【0081】
3. 31%のDEであるペクチン(Sigma)が>2g/Lの濃度でゲル化し、>4g/Lの濃度で固体ゲルを形成した。67%および93%のペクチンは、10g/Lまでの濃度でさらにpH4およびpH6.5で固体ゲルを形成しなかった。
【0082】
【表1−1】

【表1−2】

【0083】
例2
低DEペクチンから調製された鼻の薬物製剤
【0084】
ニコチン(弱塩基)およびクロモリンナトリウム(cromolyn sodium)(クロモグリシン酸ナトリウム;弱酸)の形で薬物を含む製剤が調剤された。ペクチン製剤が、スレンディッド100とスレンディッド110を使用することによってペクチン濃度10mg/mLで調製された。製剤が擬似鼻電解液と一緒に混合された(例1にあるような調製方法)。製剤が鼻の供給装置(フェイファー調節投与ポンプ)に充填され、さらに、スプレー特性が目視検査によって評価された。
【0085】
鼻電解液内の製剤のゲル化は、目視検査によって、溶液、ゲルまたは固体というように評価され、同様に、流動特性が振動前後に評価された。表2に記載されている結果から、製剤に弱酸(クロモリンナトリウム)が含まれていたとき、鼻電解液の中でゲル化が起こったことが示されている。製剤に高レベルの弱塩基(ニコチン)が含まれていたとき、その後ゲル化は起こらなかった。
【0086】
出願人は、この相違点の理由として、イオン化されたニコチンがペクチン分子の電荷を帯びたカルボニル基と相互作用を起こし、それによって低エステル化ペクチンのゲル化特性に影響を与えているだろうと信じている。従って、この相互作用を考慮すれば、弱塩基薬物を用いることで、当業者はペクチン濃度を調整することが可能になる(上述参照)。
【0087】
【表2】

【0088】
例3
低DEペクチンを含む鼻の製剤が吸収されにくい薬物の体内吸収を高めないことの実証
【0089】
薬物を局所に供給することに関して、薬物の作用部位、すなわち、鼻、直腸および膣腔で薬物を維持することは重要である。このような場合、製剤は薬物の吸収を強めてはならない。いくつかの生物的粘着性ゲル化製剤(bioadhesive gelling formulations)が体内吸収を増加させているであろうことが知られている。それゆえ、低DEペクチンが典型的な極性薬物であるサケカルシトニン(S−CT)の鼻からの吸収を(全身に(systemically))高めないことを実証するために、動物モデルで実験が行われた。
【0090】
ヒツジ
体重が知られている8頭のメスの交雑種のヒツジがこの研究に使われた。ヒツジの平均体重は約60kgであった。ヒツジの体重が測定され、ヒツジには1から8までのラベルが付与された。フロースイッチ(flowswitch)が取り付けられた内在セカロンカニューレ(in-dwelling Secalon cannula)が研究の一日目にそれぞれの動物の外頸静脈の一つにおよそ15cmにわたって配置された。必要ならばいつでも、ヘパリン化(heparinised)(25IU/mL)0.9%食塩水でカニューレを流すことによってカニューレが明白な(patent)状態に保たれた。このカニューレは、研究期間中それぞれの動物の頸静脈の中に内在したままにしており、研究完了時に取り除かれた。
【0091】
サケカルシトニン(S−CT)製剤の調製
2つのS−CT製剤が調製された。それぞれの製剤には、0.01mL/kgの容積に20IU/kgの服用量で投与するのに十分な物質である2000IU/mLのS−CTが含まれていた。ヒツジはランダムに4頭の2つのグループに分けられ、それぞれのグループには異なるS−CT製剤が投与された。
【0092】
投与グループ(dose groups)の概略
製剤 S−CT チトサンG210 ペクチンスレンディッド100
(IU/kg) (mg/kg) (mg/kg)
I 20 − −
II 20 − 0.1
【0093】
投与前に、2.25mg/kgの割合でケタミンベタラー(Ketamine Vetalar)(登録商標)の静脈投与(100mg/mL注入)が施されることによって、ヒツジが鎮静された。鼻腔内投与が0.01mL/kgの割合で実行された。投与量が、それぞれの鼻孔の間で等しく分けられた。投与のために、1mL注射器からの適切な容積を持つ溶液の供給前に、青色線臍カニューレ(blueline umbilical cannula)が深さ10cmにわたってヒツジの鼻孔に挿入された。
【0094】
血液のサンプリング
4mLの血液サンプルが、S−CT投与15,5分前および投与後5,15,30,45,60,90,120,150,180,240,300,360,420,480分にカニューレ挿入された(cannulated)ヒツジの頸静脈から採取された。これらは、4mLのヘパリン添加管(heparinised tubes)で静かに混合され、血漿分離(plasma separation)前に砕かれた氷上で保冷された。血漿が、10分間、4℃で、約3000rpmの遠心分離によって分離された。それぞれの血漿サンプルが、約1mLの2等分に分けられ、−20℃で保存された。血漿サンプルの1セットがカルシウム分析に使用された。
【0095】
カルシウム分析
血漿カルシウム分析が、ノッティンガム大学クイーンズメディカルセンター臨床化学部(Clinical Chemistry Department, Queens Medical Centre, University of Nottingham)によって行われた。この結果から、製剤Iおよび
IIにおける血漿カルシウムレベル(plasma calcium levels)がとても類似しており、さらに、製剤中のペクチンの存在が典型的な薬物の全身性生物学的有用性(systemic bioavailability)の増加を招かなかったことが示された。
【0096】
例4
フェクソフェナジン塩酸の制御された放出(Controlled Release)に関する擬似鼻電解液−ペクチンゲル化系(Gelling System)
【0097】
製剤の調製
製剤1 10mg/mL フェクソフェナジンHCl/100mg/mL HP−β−CD:
2gのHP−β−CDが、20mLメスフラスコ中で18から19mLの水に溶解された。フェクソフェナジン200mgが溶液に加えられ、薬物が溶解するまで撹拌された。溶液のpHが4.0に調整され、その後、溶液は水で一定の容積にされた。
【0098】
製剤2 10mg/mL フェクソフェナジンHCl/100mg/mL HP−β−CD/10mg/mL ペクチン100:
50mgのペクチン100(スレンディッドタイプ100, Hercules, デンマーク)が、5mLメスフラスコ中で5mLの製剤1に溶解された。
【0099】
放出/拡散試験
フランツ拡散セル装置(Franz diffusion cell apparatus)が閉ループ配列に設置され、パラメーターが次のように列挙された:
媒介液:擬似鼻電解液
温度:37℃
膜:硝酸セルロース、0.45μm孔径
閉ループ配列の容積:8.8mL
マグネティクスターラーの撹拌スピード:4
ぜん動性ポンプ流速:1(マスターフレックスL/Sth14シリコン管(Masterflex L/Sth 14 silicone tubing)が取り付けられたコールパーマーマスターフレックスぜん動性ポンプ(the Cole-Parmer Masterflex peristaltic pump)、形式7518−60)
サンプルの容積:0.4mL(4mgのフェクソフェナジンHClを含有しており、媒介液中の薬物の最大濃度が約450μg/mLになるだろう。)
波長:260nm
【0100】
結果
結果が図2に示されている。(グラフ上のすべての点は、2点の平均値を表す。)
【0101】
拡散実験の間に達した製剤1(制御)の最大UV吸光度は、それぞれの選択された時間点(time point)での放出率を計算するために100%放出として使用された。
【0102】
この結果から、2つの製剤の放出特性に明らかな違いが示された。
【技術分野】
【0001】
本発明は、粘膜表面、例えば、鼻、目、膣、直腸、および、咽喉の奥(back of the throat)などへの薬物供給のための改良されたシステムに関するものである。
【背景技術】
【0002】
粘膜への治療薬の投与は、先行技術によってよく知られている。
【0003】
鼻の病気の局所的な治療のための薬物、鼻のワクチン(nasal vaccines)および体循環(system circulation)に対する薬物を含む様々な薬物が鼻に投与されてもよい。鼻は程良い表面積と優れた血液供給機能(blood supply)を有するので、ある脂質親和体薬物(lipophilic drugs)、例えば、ニコチンやプロプラノロールなどが血液中に素早く吸収される。その結果として、静脈注射に見られる同様な生物学的有用性(bioavailability)が生じる。例えば、界面活性剤(surfactants)、粉末、例えば、微結晶性セルロース、ゲル状のマイクロスフェア(gelling microspherers)(例、デンプン)、および、生物学的粘着性ポリマー(bioadhesive polymer)であるチトサン(chitosan)などの増強剤(enhancing agents)を使用することによって吸収が改善されるけれども、多くの極性薬物(polar drugs)がほとんど吸収されない。これらのシステムの例が先行技術によってよく知られており、"Inhalation Delivery of Therapeutic Peptides and Proteins", Adjei and Gupta (eds.) Marcel Dekker Inc., New York (1997) 135-184の中でIllumとFisherによって論評されている。
【0004】
同様の方法で、病気(例 HIV)の予防法(prophylaxis)と同様に、全身性の効果(systemic effect)または病気(特に、感染症、例えば、カンジダ症や細菌性膣炎(bacterial vaginitis))の局所的な治療のために、治療薬、例えば、薬物やワクチンなどを膣腔(vaginal cavity)へ供給することは有用である。避妊薬や殺精子薬(spermicidal agent)を供給するために、局所的に作用する製剤(locally acting formulations)が使用されてもよい。
【0005】
局所的な効果(local effect)を達成するために、または、全身の活動性(systemic activity)のために、目および直腸の粘膜へ薬物が投与されてもよい。
【0006】
もし、比較的長い間、鼻に投与された製剤が局所的な効果を引き起こす薬物、ワクチンまたはDNAを鼻の中に維持させることができたなら、改善された効率の点から相当な利点が得られることが期待される。以前、従事者はこの目的のために様々な戦略(strategies)を使用してきた。
【0007】
例えば、Illumらは、例えばデンプンなどの材料に基づいた生分解性の(biodegradable)マイクロスフェアが、約10分から15分であるクリアランス(clearance)の通常の半減期と比較して、数時間までクリアランスを遅らすことができることが分かった(Illum et al, Int. J. Pharm., 39 (1986) 189-199)。驚くことに、鼻腔の中における上皮細胞のタイト結合(tight junction)の完全性(integrity)に影響を与えることによって、そのようなシステムが吸収度を改善することが分かった。それゆえ、このシステムによって全身に(systemically)薬物を最適に作用させることが期待される。
【0008】
同様に、Illumらは、生物学的粘着材料(bioadhesive material)であるチトサンが、薬物吸収度の増加につれて粘膜繊毛クリアランス(mucociliary clearance)を変更することができることが分かった。(Illum et al, Pharm Res., (1994) 1186-1189)。
【0009】
扱いが容易であることと投与が容易であることから、鼻への薬物投与に適合するような溶液スプレーシステムであって、さらに、鼻腔内で長時間維持するためのそのようなシステムを介して投与されるべき薬物に適合するような簡易な溶液スプレーシステムを利用できるようにすることがもっとも有益である。当業者は、この目的のために、製剤方法(formulation methods)、例えば、環境反応ゲル(environmentally-responsive gels)の使用と同様に、繊毛の活動に対する直接的な効果によって粘膜繊毛クリアランスを減少させる薬物学的な試薬(pharmacological agents)、例えば、コカインの使用を含む様々な戦略を予測するかもしれない。
【0010】
環境の変化に反応してゲル化する液体は当業者に知られている。環境的変化とは、温度、pH、イオン強度、あるいは、これらのファクターの組み合わせである。これらすべてのシステムの例は、従来の技術文献の中から見つけだすことができる(例えば、Proceed. Intern. Symp. Control Rel., 24, 335 (1997)の中でPottsらによって記載されたゲルムド(Gelmed)からのスマートなヒドロゲル(smart hydrogel)を参照)。しかしながら、例えば、刺激、不快感(例、冷たい溶液の投与)、粘膜へのダメージ、体循環内への薬物吸収度の不要な増大などの要因から、これらの大多数は人間の鼻への使用に適さないことが分かった。また、多くは、行政の認可(regulatory approval)がないため、利用できない。
【0011】
要するに、投与が容易な液状である単一剤の鼻供給システム(single component nasal delivery system)を提供すること、特に、投与者に対して使用可能で、鼻組織(nasal tissues)に接触するときに鼻の中でゲル化する単一剤の鼻供給システムを提供すること、および、局所的にまたは全身に効く薬品(治療薬)の吸収特性を修正することが相当大きな利点を与える。また、患者に対して容易に受け入れられ、局所的な効果を引き起こすための薬品が体循環中に吸収されることを強めず(それが副作用を引き起こすとき)、規制当局(regulatory authorities)に認可された物質を有するシステムを提供することが望ましい。
【0012】
当業者は、局所的なリンパ系組織への改良されたワクチン供給や、上皮細胞の移入(transfection)のための改良されたDNA供給のためのドラッグデリバリーと同様に、膣腔、直腸、目、咽喉の奥に影響を及ぼす状態に対する改良された治療のためのドラッグデリバリーに関して解決されるべき同様な問題があることを認識する。
【0013】
例えば、膣の感染病(vaginal infections)に対する治療のための薬物や、膣加湿剤(vaginal moisturising agents)(特に、閉経後の状態に有用である)として機能する無薬物製剤(drug free formulations)は、膣腔の中でよく広がり、長い間保持されるべきである。しかしながら、数日間膣腔内で保持されるべきいわゆる生物学的粘着性製剤(bioadhesive formulations)は素早く放出される可能性があり、投与量の80パーセント以上が2時間以内に膣から離れてしまうことが報告された(Brown et al, 14, 1073 (1997))。したがって、単純な液体(simple liquid)として膣へ挿入されることができ、局所的な環境状況下で強い保持力を与えるためにゲル化する単一剤の液体組成物を提供することは有利なことになるだろう。
【0014】
直腸浣腸(rectal enemas)の場合、もし液体浣腸(liquid enema)が一旦注入されると確実に局所的な環境に密着し早く放出することを抑制するようにゲルを形成するならば、このことは最大の有利点となる。
【0015】
同様な問題は、目への投与についても、液体製剤(liquid formulations)が素早く目から鼻涙管へきれいに排出されるという点で同一視されるであろう。目に投与されるときにゲル化する単一剤の液体組成物は、目の感染病や伝染病(eye infections and inflammation)などの状況に対する治療にとって有利に働くだろう。
【0016】
ペクチンは、すべての緑色陸上植物の一次細胞壁から発見された物質である。それらは、α−1,4−結合ポリガラクツロン酸(a-1,4-linked polygalacturonic acid)のように均一な多糖類バックボーン(polysaccharide backbone)を有する不均質物質(heterogeneous materials)である。例えば、キシロース、ガラクトース、ラムノース、アラビノースのような様々な中性糖(neutral sugars)がペクチン中で同一化(identified)されている。
【0017】
ペクチンのゲル化特性に影響を及ぼすことが知られているペクチンの臨界特性(critical property)は、ガラクツロン酸単位体(galacturonic acid units)がエステル化するまでの範囲である。自然界で発見されたペクチンのエステル化度(degree of esterification)(DE)が相当異なることがありうる(60から90%まで)。この用語DEは当業者によってよく理解され、エステル化されたカルボキシル基の総数のパーセンテージとして、または、ペクチンのメトキシルの含量(methoxyl content)として表される。各々の理論最大値は、それぞれ100%と16%である。ここで使われているDEは、エステル化されたカルボキシル基の総数について言及している。低DEペクチン(すなわち、エステル化が50%未満であるペクチン)は、大抵、抽出されたペクチンの脱エステル化(deesterification)によって作製され、普通、ベンチスケール(bench scale)では、酵素的方法(enzymatic process)によって、また、工業スケール(industrial scale)では、アルコール不均一性媒質(alcoholic heterogeneous medium)の中で酸またはアンモニアで処理することによって作製される。低メトキシル化度(DM;45%未満)であるペクチンに関して、ゲル化特性は、DMとペクチンの分子量に依存していることが知られている。低メトキシルペクチンのゲル化に関する化学(the chemistry of low methoxyl pectin gelation)は、"The Chemistry and Technology of Pectin", Academic Press, New York, pp. 109-118, (1991)の中でAxelosとThibaultによって記述されている。
【0018】
様々な従来技術文献の中で、生物学的粘着性ゲル化材料(bioadhesive and gelling material)として、ペクチンの潜在的な使用について議論されている。Smartら、J. Pherm. Pharmacol. 36, 295 (1984)によってなされた様々な材料の粘液への粘着性に関する研究の中で、ペクチンは試験管内の(in vitro)試験で粘着性が低いことが示されている。ペクチンを含む粘膜(mucus membrane)に付着可能なタブレットはEP306454に記述されている。Oechsleinら(Int. J. Pharm., 139, (1994), 25-32)は、ソマトスタチン類似体ペプチドオクトレオチド(somatostatin analogue peptide octreotide)の鼻からの吸収を強めるための様々な粉末製剤の潜在力を記載している。ペクチン(タイプFPA)粉末は使用され、生理食塩水中に投与された薬物と比べて、薬物の絶対的な生物学的有用性(absolute bioavailability)の増加を引き起こす。これら文献にも、低DEペクチンを含む溶液製剤の使用、または、鼻の分泌物に接触することでゲル化するペクチンについて記述されていない。
【0019】
ペクチンは、さらに、粘膜付着性眼科用材料(mucoadhesive ophthalmic material)として、Chetoniら(Bull. Chem. Farm., 135, 147 (1996))によって研究されている。パッチ(patches)として口膜(oral mucosa)へ投与するためのペクチンを有する薬物の塩錯体が、World Meet. Pharm. Biopharm. Pharm. Technol., (1995), p. 839, APGI, Parisの中で、Burgalassiらによって記載されている。PopoviciとSzasz (in "Buccal and Nasal Administration as Alternatives to Parenteral Administration", Minutes of a European Symposium (1992), Duchene, D., Ed., Sante, Paris, France. P. 292-6)は、セルロースとペクチンとマグネシウムの形をした二価カチオンとを含む粘膜付着性ヒドロゲル(mucoadhesive hydrogels)を記述している。粘膜表面に接触することでゲル化する溶液として低DEペクチンを使用することは、これら文献のいずれにも記載されていない。
【0020】
米国特許第4,826,683号には、植物性オイル、ロカイ汁(aloe vera)、亜鉛、ビタミンC、ビタミンA、ビタミンE、ビタミンB6、ビオチンおよびフルーツペクチン(fruit pectin)を含む鼻のうっ血除去剤(nasal decongestant)が記載されている。フルーツペクチンの含有量は1リットルあたり最大2gである。商号"Cetro"でGeneral Foodsによって供給される可溶化フルーツペクチンが好ましい。日本国特許第62236862号には、えい糸性水溶性ポリマー(spinnable water soluble polymer)と、多糖類、タンパク質、または、ビニルポリマーの混合物から成り立っている人工的な粘液が記載されている。ペクチンの種類は特定されていないけれども、ペクチンは適当な多糖類としてリストされている。
【0021】
米国特許第5,147,648号(欧州特許第289512号)には、別々に加えたとき、粘膜を治療するためのゲルを形成することができる少なくとも2つの成分から作られた薬学的な製剤(pharmaceutical formulation)が記載されている。この2つの成分は粘膜の同じエリアに別々に加えられる。これらの成分は、同時にまたは続けて加えられてもよい。ゲル形成溶液成分のうち一方がカルシウム塩(例えば、グルコン酸カルシウム(calcium gluconate))を含み、他方がペクチンを含んでもよい。この従来技術文献では、いったん粘膜に接触するとゲル化する別々に加えられるカルシウムイオン溶液がない状態で、ペクチンを有する溶液が単一剤として投与されてもよいことが暗示されていない。
【0022】
米国特許第5,318,780号には、フィルム形成ポリマー(例えば、ペクチン)とイオン多糖類(ionic polysaccharide)である2つの成分を含み、その混合物を対イオン(counter-ion)と接触させることによって生体内で(in situ)ゲル化する水性の製薬溶剤(aqueous pharmaceutical vehicles)が記載されている。例えばペクチンのようなポリガラクツロン酸は、角膜シールドを保護する角膜のマスティス(corneal mastis protective corneal shields)として目に投与されるための典型的で有用なポリマーを広範囲にわたって列挙しているリストの中に言及されている。ペクチン溶液を単独で使用する例、および、低DEペクチン(pectins with a low DE)または粘膜に接触することでゲル化するペクチンを使用する例は記載されていない。
【0023】
向イオン性ゲル化(ionotropic gelation)によるペクチンビード(pectin beads)の作製は、AydinとAkburfa (1996) Int. J. Pharm., 137, 133-136によって開示されている。
【発明の概要】
【発明が解決しようとする課題】
【0024】
要するに、粘膜表面に投与されるべき薬学的なシステム(pharmaceutical system)の中で以前に使用されているペクチンに関して、すべてのペクチンが、カルシウムイオンの存在によってゲル化することは先行技術の中で知られているけれども、生理学的濃度(physiological concentrations)をはるかに越えた高レベルのカルシウムが必要であることが今まで理解されてきた。このことは、前もって形成されたゲルの形で、または、生体内でゲルを生成するために外因性カルシウム(exogenous calcium)の添加前または添加後に投与されるペクチンシステム(pectin systems)の利用が必要とされてきた。低DEペクチンを有する液体(特に、溶液)がそれ自体で(as such)投与されてもよいことも、その液体が粘膜に投与されたとき、または、投与された直後にゲル化してもよいことも、上述の従来技術文献のうちいずれにも開示されていなく、暗示もされていない。さらに、そのようなゲル化特性に関するペクチンのDEの重要性は、これら従来技術文献のうちいずれにも言及されていない。
【課題を解決するための手段】
【0025】
我々は、驚くことに、あるペクチン材料、すなわち、低DEペクチン材料が単一剤、単純な液体製剤(すなわち、水性キャリア(aqueous carrier))の形で投与されてもよいことが分かった。その液体製剤は、鼻、直腸、膣腔、目、咽喉の奥の粘膜に投与されるとき、ゲル化し、または、ゲル化するように簡単に構成することできる。また、我々は、驚くことに、生理学的に許容されるpH値で、はるかに減少したカルシウム濃度、すなわち、膣内腔(vaginal lumen)、直腸腔(rectal cavity)および目からの涙(tear fluid of the eye)と同様に鼻の分泌物の中から生理学的に発見されたカルシウムによって、ゲル化が起こりうることが分かった。
【図面の簡単な説明】
【0026】
【図1】低DEペクチンを有する製剤の形でサケカルシトニン(salmon calcitonin)がヒツジの鼻腔内に(intranasally)投与されたとき、サケカルシトニンの体内吸収(systemic uptake)の効果を示す。
【図2】HP−β−CDおよびHP−β−CD/ペクチン100溶液から擬似鼻電解液(simulated nasal electrolyte solution)へのフェクソフェナジンHClの累計放出/拡散値(cumulative release/diffusion of fexofenadine HCl)を示す。
【発明を実施するための形態】
【0027】
本発明の第一の側面によると、治療薬と、低DEペクチンと、水性キャリアとを有し、投与部位でゲル化し、または、ゲル化するように構成可能である粘膜表面に投与するための提供された単一剤の液体薬学的組成物(single component liquid pharmaceutical composition)がある。
【0028】
我々は、特に、そのような組成物が、外来的に(extraneously)(すなわち、別々におよび/または独立に)加えられた(同時に、または、続けて)カルシウム(または他の二価金属)イオン溶液が存在しない状態で、粘膜表面に投与されたとき、または、投与された直後に投与部位でゲル化し、または、ゲル化するように構成することができることが分かった。治療薬と、低DEペクチンと、水性キャリアとを有し、直接粘膜表面へ投与するための提供された単一剤の液体薬学的組成物があり、その組成物は、同じ部位に投与された二価金属イオンの外来的な源(extraneous source)(例えば、溶液)が存在しない状態で、投与部位でゲル化するように構成可能である。
【0029】
本発明のさらなる側面によると、粘膜表面に投与するための液体薬学的組成物を有し、キットが外来的に前記表面に加えられるべき二価金属イオン溶液を有していないという条件で、前記組成物は、治療薬と、低DEペクチンと、水性キャリアとを有する提供されたパーツキット(kit of parts)がある。
【0030】
特に、粘膜表面に投与するための液体薬学的組成物を有し、その組成物は、治療薬と、低DEペクチンと、水性キャリアとを有し、パーツキットはパッケージされ(packaged)、さらに、そのパーツキットには二価金属イオンの外来的な源が存在しない状態で前記表面に前記組成物を投与するための説明書(instructions)が与えられている提供されたパーツキットがある。
【0031】
治療薬と、低DEペクチンと、水性キャリアとを有し、単一剤として投与されるもの、または、投与されるべきもので、さらに、二価金属イオンの外来的な源が存在しない状態でゲル化し、または、ゲル化するように構成する粘膜表面に投与するためのその液体薬学的組成物は、以下、”発明の組成物(the compositions of the invention)”と呼ばれる。
【0032】
我々は、粘膜への投与時に流動体(mobile fluid)の形で存在する組成物のことを”液体”組成物という。発明の組成物は、ペクチンと治療薬を含む溶液、懸濁液(suspension)、または、乳濁液(emulsion)を有する水性製剤(aqueous formulation)の形で水の中に存在する。発明の組成物は、投与時に、または、投与直後(例えば、5分以内に)にゲル化し、または、ゲル化するように構成され、固体または半固体ゲル材料を形成する。ここで、ゲルは、投与部位での維持効果(retaining effect)を提供することに適している。
【0033】
我々は、例えば、"The Chemistry and Technology of Pectin", Academic Press, New York (1991), p. 192の中でWalterの記事に記載されているように、エステル化したガラクツロン酸単位体(galacturonic acid units)のパーセンテージを”エステル化度(DE)”という。我々は、ガラクツロン酸単位体の50%未満、好ましくは、35%未満がエステル化されたペクチンを”低DE”という。
【0034】
我々は、二価金属イオンの”外来的な源”に、そのようなイオンの別々な、および/または、独立した(すなわち、外来的な)源を含める。粘膜に発明の組成物が投与されることによって生じるゲルの中に存在するイオンは、組成物から、および、組成物が投与されるべき患者の体の分泌物から得られたものではない(例えば、鼻の分泌物、涙などから得られた内因性イオン(endogenous ions))。言及されるであろう二価金属イオンは、カルシウムイオンを含む。
【0035】
本発明のさらなる側面によると、治療薬と、低DEペクチンと、水性キャリアとを有する液体組成物を、哺乳類患者(mammalian patient)の粘膜表面に、二価金属イオンの溶液をその表面に外来的に投与しない状態で投与することによって取得可能な、医薬ゲル組成物(pharmaceutical gel composition)が提供される。
【0036】
粘膜表面に接触するときに形成されるゲルは、内因性二価金属イオン(endogenous divalent metal ions)(すなわち、体の分泌物から直接得られるイオン)のみを含み、外来性二価金属イオン(extraneous divalent metal ions)(すなわち、外来的な源から得られるイオン)を含まないだろう。本発明のさらなる側面によると、医薬ゲル組成物が提供され、当該ゲルは治療薬と低DEペクチンとを有し、且つ、前記ゲルは、前記治療薬とペクチンとを水性キャリア中に含む液体組成物を適用することにより得ることができ、また、前記ゲルは、前記液体組成物が投与される前、同時に、または、後に、前記粘膜表面に投与された外来の二価金属イオンを実質的に有さない。
【0037】
発明の組成物がそのようなイオンの外来的な源とともに加えられていないので、二価イオンを“実質的に有さない”とは、97%より大きく、好ましくは99%より大きく、さらに好ましくは99.9%より大きく、特に99.99%より大きい割合で有さないことを意味する。
【0038】
例えば、"Industrial Gums", Academic Press, New York (1993) p. 257の中のRollinによる記事に記載されているような技術、または、上記に記載されているような公知技術に従って、低DEペクチンは、公知の源(source)から得られ、または、高DEペクチン(例えば、Sigma Fine Chemicalsから得られるであろう)の脱エステル化によって得ることができる。低DEペクチンは、例えば、スレンディッドタイプ100(slendid type 100)とスレンディッドタイプ110(slendid type 110)として知られている市販材料(commercial material)としてのコペンハーゲンペクチンA/S(Copenhagen Pectin A/S)から得られるだろう。これらペクチンは柑橘類の皮から抽出され、サッカロースを加えることで標準化される。標準化工程は、上述の記事中にRollinによって記載されている。DEは、双方のペクチンで50%未満であり、タイプ100で約10%であり、タイプ110で約35%である。さらに、使用されるであろう材料は、GENUペクチンタイプ LM 1912 CSと、Pomosinペクチンタイプ LM 12 CGとLM 18 CGを含む。
【0039】
発明の組成物は、公知技術に従って溶液、懸濁液、または、乳濁液を形成するために、水溶系(aqueous system)中に低DEペクチンと治療薬とを溶解するか、または、分散することによって、作製されてもよい。例えば、治療薬は、従来の作製されたペクチン水溶液の中に溶解されてもよいし、または、水溶系の中に懸濁液として、または、懸濁液を形成するために加えてもよい。ここで、薬物粒子(drug particles)は、100ミクロン未満の大きさであり、好ましくは、1から20ミクロンの大きさである。あるいはまた、薬物は適切な油性溶剤(oily vehicle)、例えば、植物性オイルの中に溶解され、または、懸濁され、その後、乳濁液を形成するためにペクチン水溶液の中で分散されてもよい。このように開発されたこの種の水性製剤が、投与量や薬物の物理的特徴(characteristics)や特性(properties)(例えば、溶解度、塩基度など)と同様に治療されるべき粘膜に依存することは、当業者にとって認識されるであろう。
【0040】
発明の組成物中の低DEペクチンの濃度は、ペクチンの性質(nature)、他の成分の存在、その組成物のゲル化特性(gelation properties)に影響を及ぼす他の要因(下記参照)に依存するが、1g/Lから100g/Lまでがよいし、好ましくは、1g/Lから50g/Lまでがよいし、さらに好ましくは、2g/Lから10g/Lまでがよいし、特に、5g/Lから10g/Lまでがよい。
【0041】
発明の組成物は、局所的な治療のための鼻への薬物供給に関する重大な問題、すなわち、速い粘膜繊毛クリアランス機構(rapid mucociliary clearance mechanism)の予防の目的で使用されてもよい。堆積された物質を鼻の前部(the front of the nose)から喉へと取り除くこの自然なプロセスは、約10から20分のハーフタイム(half-time)で鼻から物質を取り除くことができる。そのようなクリアランス速度(clearance rate)が、サッカリンクリアランステスト(saccharin clearance test)またはガンマシンチグラフィー(gamma scintigraphy)を使って容易に人体で測定されることができる(Aspden et al, J. Pharm. Sci., 86, 509 (1997); Illum et al, Int. J. Pharm., 39 (1987) 189-199)。
【0042】
発明の組成物は、先行技術によって知られた粘膜への薬物供給と比較したとき、比較的長い期間、粘膜表面で局所的に効く治療薬を維持するために使用されてもよい。もし、治療薬が容易に吸収されるならば、吸収を遅らせてもよい。従って、薬物の保持が必要である投与部位に薬物をさらに保持させる。
【0043】
発明の組成物の中で使用される治療薬は、例えば、鼻炎、ウィルス性感染などの状態を局所的に治療するために使用される鼻への投与のための薬物と同様に、うっ血除去としてはたらく薬物を含む。発明の組成物は、鼻に関連したリンパ系組織(nose associated lymphoid tissue)へのワクチンの供給を改良する方法として、および、鼻の上皮細胞へ移入するためのよりよいDNAの提供(presentation)のために使用されてもよい。
【0044】
発明の組成物の中での使用および粘膜表面の局所的な治療に適した治療薬の以下のリストが例証として用意され、さらに、それは排他的なものでない:抗ウィルス薬剤(antiviral agents)、例えば、ICAM−1、ピロバディル(pirovadir)、アシクロヴィル(acyclovir)、ブロモビニルデオキウリジン(bromovinyldeoxyuridine)、α、βおよびγ−インターフェロン(a, band g-interferon)、ジドブジン(zidovudine);うっ血除去剤、例えば、オキシメタザリン(oxymetazaline);抗アレルギー薬剤(anti-allergic agents)、例えば、クロモグリシン酸ナトリウム、および、ブデソニド(sodium cromoglycate and budesonide);スレロイド(steroids)、例えば、フルチカゾン(fluticazone);ワクチン、例えば、DNA、インフルエンザ、百日咳(pertussis)、嚢尾虫(measles)、ジフテリアワクチン(diphtheria vaccines);抗菌性物質(antibacterial agents);抗真菌薬(antifungal agents)、例えば、アンホテリシン(amphotericin)、ナイスタチン(nystatin);避妊および/または殺精子剤(contraceptive and/or spermicidal agents);抗体、特に子供の体内へのRSV感染の治療のための抗体;HIVに対する予防薬;抗ヒスタミン薬(antihistamines)、例えば、ジフェニルヒドラミン塩酸塩(diphenhydramine hydrochloride);遺伝子(genes)。
【0045】
上述の治療薬の組み合わせもまた使用されてもよい。
【0046】
発明の組成物は、大循環(general circulation)への輸送速度を変えるか、または、容易に吸収可能な薬物の吸収を遅くするかの一方によって、系統的に作用するような容易に吸収可能な薬物のためのプラズマレベル対時間のグラフを制御する(すなわち、よりフラットなグラフを与える)ために使用されてもよい。このことは、例えば、高ピークプラズマレベルからの副作用が避けられるとき、重要なものとなりうる。
【0047】
発明の組成物は、アポモルヒネ(apomorphine)、ニコチン(nicotine)、ヒオスチンシュウ酸塩(hyoscine hydrobromide)、リグノカイン(lignocaine)、フェンタニル(fentanyl)、ナラトリプタン(naratriptan)、フェロモン(pheromones)およびプロプラノロール(propranolol)を含むがこれらに限定されない粘膜に投与された薬物の系統的な吸収の変更のために使用されてもよい。
【0048】
上述の治療薬の組み合わせもまた使用されてもよい。
【0049】
疑問を避けるために、用語”治療薬”とは、ここでは、病気の治療および予防に使用するために適した試薬を含む。
【0050】
発明の組成物は、使用される治療薬に依存する哺乳類患者に、病気/状態を治療/予防するために使用されてもよい。上記について、言及されるであろう局所的に作用する系統的な薬物、病気/状態のすべてを網羅していない目録には、例の治療薬が有効であることが知られている病気/状態が含まれ、さらに、マーチンデール(Martindale) "The Extra Pharmacopoeia", 31st Edition, Royal Pharmaceutical Society (1996)の中で例の薬物に対する特に掲載されている病気/状態が含まれる。
【0051】
好ましくは、薬物はニコチンとアポモルヒネを含む。
【0052】
発明の組成物の中で使用されている治療薬の量は、使用される薬と治療されるべき病気とに依存するが、0.01から40%w/wの範囲内であればよい。しかしながら、当業者にとって、治療薬の適切な投与量が容易に非発明的に(non-inventively)決定されることは明らかである。例えば、投与量の概算は、投与量の0.1から90%が吸収されると仮定して、公知である注射可能な生成物(injectable products)から算定されることができる。適切な単一ユニットの投与量(single unit doses)は、使用される治療薬と投与ルートに依存するが、10μgから500mgの範囲内にある。適切な1日の投与量は、使用される治療薬と投与ルートに依存するが、10μgから1g/日の範囲内にある。
【0053】
薬物と、低DEペクチンとを有する多くの組成物は、投与部位に投与される時点で、すなわち、関連した粘膜表面に接触するとき、または、接触する直後(例えば、5分以内に)にゲル化するであろう。しかしながら、いくつかの製剤の中で、使用される薬物および/またはペクチンの性質(nature)によって、組成物が接触時または接触直後(例えば、1分以内に)にゲル化するように構成されることが要求されてもよい。このことは、当業者にとって公知である技術を介して容易に達成されるであろう。
【0054】
例えば、ペクチンの濃度を、水性製剤が粘膜表面に接触するとすぐにゲル化するように選択してもよい。
【0055】
さらに、ゲル化工程を助けるために一価イオンを付加することを必要としてもよい(例えば、等張性(isotonicity)を供給するためだけでなく、液体製剤をゲル化するように構成するために、単純一価電解液(simple monovalent electrolytes) 、例えば、NaClが加えられてもよい)。
【0056】
また、水性製剤の中の薬物の量と性質はゲル化特性に影響を及ぼしてもよい。例えば、弱塩基(例えば、ニコチン)である薬物や、ペクチンのようなアニオン材料(anionic materials)とともに可逆錯体(reversible complexes)を形成することが知られている薬物を含むある薬物を高レベルに添加することによって、ペクチン分子上の負電荷の好ましくは30%が、さらに好ましくは50%が、最も好ましくは60%が結合しない(uncomplexed)ように薬物とペクチンとの比率の変化が要求されてもよい。
【0057】
あるいはまた、例えば、ショ糖の形をした糖は、ゲル化を助けるために、製剤に加えられてもよい。非イオン化多糖類(non-ionic polysaccharides)(例えば、ヒドロキシプロピルメチルセルロース(hydroxypropyl methyl cellulose))もまた使用されてもよい。
【0058】
組成物のpHがゲル化特性に影響を及ぼすことが分かった。組成物のゲル化特性および治療薬の特性を考慮すると、発明の組成物のpHは2から9、さらに好ましくは3から8、最も好ましくは4から7がよい。例えば、一般的に、我々は、ペクチンのDEが低いほど組成物がゲル化するpHが低いことが分かった。pHは、当業者にとって公知である技術、例えば、薬学的に許容される緩衝試薬(buffering agents)、特に低イオン強度の緩衝試薬の添加によって調整されてもよい。"The Chemistry and Technology of Pectin", Academic Press, New York, pp. 109-118, (1991)の中で、AxelosとThibaultは、低DEペクチン溶液のゲル化特性がpHとイオン強度に対して幾分敏感にする方法について述べている。
【0059】
ゲル化するように発明の組成物を構成するために使用可能な上述の技術は、通常のルーチン実験(routine experimentation)の中で当業者によって研究され、および、決定されてもよい。ゲル化特性に影響を及ぼすために、これらの技術の組み合わせもまた使用されてもよい。
【0060】
組成物は、薬物と相互作用を起こすこと、例えば、包有物(inclusion)または塩橋錯体(salt-bridge complexes)を形成することが知られている試薬だけでなく、例えば、防腐剤(preservatives)(例えば、メタ重硫酸ナトリウム(sodium metabisulphate)などの低濃度物質)、安定剤(stabilisers)、香味料(flavouring agents)、吸収強化剤(absorption enhancers)、例えば、胆汁酸塩(bile salts)、ホスファチド(phospholipids)などの薬学的付形剤(pharmaceutical excipients)の形で他の添加物を含み、そして、例えば、サイクロデキストリン(cyclodextrins)やイオン交換樹脂(ion exchange resins)など形成されたゲルから鼻腔の中で制御された放出(controlled release)を促進してもよい。発明の組成物に加えられてもよい付加的な薬学的に許容される付形剤は、例えばグリセロールなどの試薬を含む。
【0061】
本発明のさらなる側面によると、水性キャリアの中で治療薬とペクチンとを一緒に混合する工程を有する発明の組成物の提供された作製方法がある。
【0062】
発明の組成物は、当業者にとって公知であるすべての技術に従い、さらに、当業者にとって公知であるすべての供給装置を介して、適切な投与量で投与されてもよい。例えば、鼻への供給のために、好ましくは、発明の組成物は、例えば、フェイファー調節投与ポンプ(Pfeiffer metered dose pump)またはヴァロア調節投与ポンプ(Valois metered dose pump)などのスプレー装置を介して、または、液体自由流れシステム(liquid free flow system)(例えば、鼻の滴剤(nasal drops))を介して投与される。膣や直腸への投与(注入)のために、シリンジタイプの投与器(syringe-type applicator)が使用されてもよいし、適当なノズルが取り付けられたプラスティックアンプルでもよい。ここで、アンプルの内容物は、わずかな圧力を加えることで膣または直腸の表面に供給されることができる。咽喉の奥に発明の組成物を供給するための適切なシステムは、当業者にとって公知であるスプレー装置を含む。目に発明の組成物を供給するための適切なシステムは、当業者にとって公知である液体自由流れシステムを含む(例えば、目薬)。
【0063】
発明の組成物は、二価金属イオンの外来的な源を有する付加的な成分がない状態において、単一剤でかつ単純液体製剤の形で、当業者にとって公知である装置を使うことにより、容易に粘膜表面に投与されてもよいという利点を有する。発明の組成物は、さらに、生理学的に許容されるpHで、膣内腔、直腸腔および目からの涙と同様に鼻の分泌物の中で生理的に発見される内因性カルシウム(endogenous calcium)(のみ)が存在する状態で、粘膜に接触するとき、または、接触する直後にゲル化するという利点を有する。
【0064】
発明の組成物は、粘膜表面で局所的に作用する薬物(locally-acting drug)を維持するために、または、体循環(systemic circulation)への薬物吸収を制御するために使用されてもよいという利点も有する。
【0065】
発明の組成物は、患者に対して容易に受け入れられ、さらに、規制当局に認可された物質を有してもよいという利点も有する。
【0066】
本発明のさらなる側面によると、患者の粘膜表面に二価金属イオン溶液を外来的に投与しない状態で、治療薬と、低DEペクチンと、水性キャリアとを有する液体薬学的組成物を前記表面に投与する工程を有し、前記組成物は、投与部位でゲル化しまたはゲル化するように構成された提供された患者の治療方法がある。
【0067】
患者の粘膜表面に二価金属イオン溶液を外来的に投与しない状態で、病気に対して効果がある治療薬を含む発明の組成物を、治療を必要とする患者の前記表面に投与する工程を有する提供された病気の治療または予防方法がある。
【実施例】
【0068】
本発明は、決して制限されないが、図面を参照にしながら次の例によって説明される。
【0069】
例1
低DEペクチンが鼻腔の擬似状況下でゲル化するが、一方高DEペクチンがゲル化しないことの実証
【0070】
材料:
ペクチン、エステル化(esterified)、カリウム塩(potassium salt)(DE:31%;ロット番号22H0548;Sigma)
ペクチン、エステル化、カリウム塩(DE:67%;ロット番号74H1093;Sigma)
ペクチン、エステル化(DE:93%;ロット番号125H0123;Sigma)
ペクチン、スレンディッドタイプ100(ロット番号620970;Hercules;デンマーク)
ペクチン、スレンディッドタイプ110(ロット番号626790;Hercules;デンマーク)
ペクチン、GENUタイプLM12CG(ロット番号G63481;Pomosin GmbH;Hercules;ドイツ)
ペクチン、GENUタイプLM18CG(ロット番号G63484;Pomosin GmbH;Hercules;ドイツ)
塩化ナトリウム(BDH)
塩化カリウム(BDH)
脱水塩化カルシウム(Calcium chloride dehydrate)(Sigma)
【0071】
擬似鼻電解(SNES)液が調製され、次の成分から構成された:
塩化ナトリウム 8.77g/L
塩化カリウム 2.98g/L
脱水塩化カルシウム 0.59g/L
【0072】
SNESが2倍の濃度(strength)に調製された:
【0073】
塩化ナトリウム3.508g、塩化カリウム1.192gおよび脱水塩化カルシウム0.236gがそれぞれ3つの秤量ボート(weighing boats)で秤量され、そして、
溶解され、そして、200mLメスフラスコに移し替えられた。
薬品が溶解するまで、溶液がマグネティクスターラーで撹拌された。
水が容積(volume)に加えられた。
【0074】
20g/Lペクチン溶液の調製
それぞれのタイプのペクチン1gが100mL瓶で秤量された。
超純水(ultrapure water)がそれぞれの瓶に加えられた。
ペクチンが溶解するまで、含有物がマグネティクスターラーで撹拌され、そして、
溶液のpHが測定され、0.1M水酸化ナトリウム溶液でpH4またはpH6.5に調整された。
【0075】
異なる濃度(2から10g/Lまで)でSNESとペクチンとを含む様々な製剤の調製
【0076】
終濃度2,3,4,5,6,7,8,9および10g/Lを得るために、正確に20g/Lのペクチン溶液が一連の10mLねじキャップ式ガラス管(a series of 10 mL screw capped glass tubes)で計量された。
【0077】
まず総容積2.5mLを得るために正確な容積を持つ水が加えられ、その後、2倍の濃度のSNES2.5mLが加えられた。
管が15分間氷水浴で冷却された。
相状態(phase state)および流動特性(flow property)を検査するために、試験管が傾けられた。
再び相状態および流動特性を検査するために、管が力強く振られた。
【0078】
結果
結果が表1に示されている:
【0079】
1. pH値4および6.5において、ペクチンの終濃度が>2g/Lであったとき、ペクチンタイプ100および110が擬似鼻電解液でゲル化し、終濃度が>4g/Lであったとき、強力なゲルを形成した。ゲルは透明でかつ均質であった。ゲルの強度は、系内のペクチン濃度の増加に伴って増加した。
【0080】
2. ペクチンタイプLM12CGおよびLM18CGが、それぞれ終ペクチン濃度4g/Lと6g/L(pH4)および4g/L(pH6.5)でゲル化した。これら2種類のペクチンは、pH6.5でさらにそれぞれ6g/L、8g/Lより高い濃度で固体ゲル(solid gels)を形成したのみであった。
【0081】
3. 31%のDEであるペクチン(Sigma)が>2g/Lの濃度でゲル化し、>4g/Lの濃度で固体ゲルを形成した。67%および93%のペクチンは、10g/Lまでの濃度でさらにpH4およびpH6.5で固体ゲルを形成しなかった。
【0082】
【表1−1】

【表1−2】

【0083】
例2
低DEペクチンから調製された鼻の薬物製剤
【0084】
ニコチン(弱塩基)およびクロモリンナトリウム(cromolyn sodium)(クロモグリシン酸ナトリウム;弱酸)の形で薬物を含む製剤が調剤された。ペクチン製剤が、スレンディッド100とスレンディッド110を使用することによってペクチン濃度10mg/mLで調製された。製剤が擬似鼻電解液と一緒に混合された(例1にあるような調製方法)。製剤が鼻の供給装置(フェイファー調節投与ポンプ)に充填され、さらに、スプレー特性が目視検査によって評価された。
【0085】
鼻電解液内の製剤のゲル化は、目視検査によって、溶液、ゲルまたは固体というように評価され、同様に、流動特性が振動前後に評価された。表2に記載されている結果から、製剤に弱酸(クロモリンナトリウム)が含まれていたとき、鼻電解液の中でゲル化が起こったことが示されている。製剤に高レベルの弱塩基(ニコチン)が含まれていたとき、その後ゲル化は起こらなかった。
【0086】
出願人は、この相違点の理由として、イオン化されたニコチンがペクチン分子の電荷を帯びたカルボニル基と相互作用を起こし、それによって低エステル化ペクチンのゲル化特性に影響を与えているだろうと信じている。従って、この相互作用を考慮すれば、弱塩基薬物を用いることで、当業者はペクチン濃度を調整することが可能になる(上述参照)。
【0087】
【表2】

【0088】
例3
低DEペクチンを含む鼻の製剤が吸収されにくい薬物の体内吸収を高めないことの実証
【0089】
薬物を局所に供給することに関して、薬物の作用部位、すなわち、鼻、直腸および膣腔で薬物を維持することは重要である。このような場合、製剤は薬物の吸収を強めてはならない。いくつかの生物的粘着性ゲル化製剤(bioadhesive gelling formulations)が体内吸収を増加させているであろうことが知られている。それゆえ、低DEペクチンが典型的な極性薬物であるサケカルシトニン(S−CT)の鼻からの吸収を(全身に(systemically))高めないことを実証するために、動物モデルで実験が行われた。
【0090】
ヒツジ
体重が知られている8頭のメスの交雑種のヒツジがこの研究に使われた。ヒツジの平均体重は約60kgであった。ヒツジの体重が測定され、ヒツジには1から8までのラベルが付与された。フロースイッチ(flowswitch)が取り付けられた内在セカロンカニューレ(in-dwelling Secalon cannula)が研究の一日目にそれぞれの動物の外頸静脈の一つにおよそ15cmにわたって配置された。必要ならばいつでも、ヘパリン化(heparinised)(25IU/mL)0.9%食塩水でカニューレを流すことによってカニューレが明白な(patent)状態に保たれた。このカニューレは、研究期間中それぞれの動物の頸静脈の中に内在したままにしており、研究完了時に取り除かれた。
【0091】
サケカルシトニン(S−CT)製剤の調製
2つのS−CT製剤が調製された。それぞれの製剤には、0.01mL/kgの容積に20IU/kgの服用量で投与するのに十分な物質である2000IU/mLのS−CTが含まれていた。ヒツジはランダムに4頭の2つのグループに分けられ、それぞれのグループには異なるS−CT製剤が投与された。
【0092】
投与グループ(dose groups)の概略
製剤 S−CT チトサンG210 ペクチンスレンディッド100
(IU/kg) (mg/kg) (mg/kg)
I 20 − −
II 20 − 0.1
【0093】
投与前に、2.25mg/kgの割合でケタミンベタラー(Ketamine Vetalar)(登録商標)の静脈投与(100mg/mL注入)が施されることによって、ヒツジが鎮静された。鼻腔内投与が0.01mL/kgの割合で実行された。投与量が、それぞれの鼻孔の間で等しく分けられた。投与のために、1mL注射器からの適切な容積を持つ溶液の供給前に、青色線臍カニューレ(blueline umbilical cannula)が深さ10cmにわたってヒツジの鼻孔に挿入された。
【0094】
血液のサンプリング
4mLの血液サンプルが、S−CT投与15,5分前および投与後5,15,30,45,60,90,120,150,180,240,300,360,420,480分にカニューレ挿入された(cannulated)ヒツジの頸静脈から採取された。これらは、4mLのヘパリン添加管(heparinised tubes)で静かに混合され、血漿分離(plasma separation)前に砕かれた氷上で保冷された。血漿が、10分間、4℃で、約3000rpmの遠心分離によって分離された。それぞれの血漿サンプルが、約1mLの2等分に分けられ、−20℃で保存された。血漿サンプルの1セットがカルシウム分析に使用された。
【0095】
カルシウム分析
血漿カルシウム分析が、ノッティンガム大学クイーンズメディカルセンター臨床化学部(Clinical Chemistry Department, Queens Medical Centre, University of Nottingham)によって行われた。この結果から、製剤Iおよび
IIにおける血漿カルシウムレベル(plasma calcium levels)がとても類似しており、さらに、製剤中のペクチンの存在が典型的な薬物の全身性生物学的有用性(systemic bioavailability)の増加を招かなかったことが示された。
【0096】
例4
フェクソフェナジン塩酸の制御された放出(Controlled Release)に関する擬似鼻電解液−ペクチンゲル化系(Gelling System)
【0097】
製剤の調製
製剤1 10mg/mL フェクソフェナジンHCl/100mg/mL HP−β−CD:
2gのHP−β−CDが、20mLメスフラスコ中で18から19mLの水に溶解された。フェクソフェナジン200mgが溶液に加えられ、薬物が溶解するまで撹拌された。溶液のpHが4.0に調整され、その後、溶液は水で一定の容積にされた。
【0098】
製剤2 10mg/mL フェクソフェナジンHCl/100mg/mL HP−β−CD/10mg/mL ペクチン100:
50mgのペクチン100(スレンディッドタイプ100, Hercules, デンマーク)が、5mLメスフラスコ中で5mLの製剤1に溶解された。
【0099】
放出/拡散試験
フランツ拡散セル装置(Franz diffusion cell apparatus)が閉ループ配列に設置され、パラメーターが次のように列挙された:
媒介液:擬似鼻電解液
温度:37℃
膜:硝酸セルロース、0.45μm孔径
閉ループ配列の容積:8.8mL
マグネティクスターラーの撹拌スピード:4
ぜん動性ポンプ流速:1(マスターフレックスL/Sth14シリコン管(Masterflex L/Sth 14 silicone tubing)が取り付けられたコールパーマーマスターフレックスぜん動性ポンプ(the Cole-Parmer Masterflex peristaltic pump)、形式7518−60)
サンプルの容積:0.4mL(4mgのフェクソフェナジンHClを含有しており、媒介液中の薬物の最大濃度が約450μg/mLになるだろう。)
波長:260nm
【0100】
結果
結果が図2に示されている。(グラフ上のすべての点は、2点の平均値を表す。)
【0101】
拡散実験の間に達した製剤1(制御)の最大UV吸光度は、それぞれの選択された時間点(time point)での放出率を計算するために100%放出として使用された。
【0102】
この結果から、2つの製剤の放出特性に明らかな違いが示された。
【特許請求の範囲】
【請求項1】
治療薬と、低エステル化度ペクチンと、水性キャリアとを有し、投与部位でゲル化し、または、ゲル化するように構成可能である粘膜表面に投与するための単一剤の液体医薬組成物。
【請求項2】
前記粘膜表面は鼻腔である請求項1記載の組成物。
【請求項3】
前記粘膜表面は膣である請求項1記載の組成物。
【請求項4】
前記粘膜表面は直腸である請求項1記載の組成物。
【請求項5】
前記粘膜表面は咽喉の奥である請求項1記載の組成物。
【請求項6】
前記粘膜表面は目である請求項1記載の組成物。
【請求項7】
スプレーまたは液体自由流れシステムで投与される先行する請求項のうちいずれかに記載の組成物。
【請求項8】
前記エステル化度が50%未満である先行する請求項のうちいずれかに記載の組成物。
【請求項9】
前記組成物中のペクチン濃度が1から100g/Lまでである先行する請求項のうちいずれかに記載の組成物。
【請求項10】
前記組成物のpHが2から9までである先行する請求項のうちいずれかに記載の組成物。
【請求項11】
鼻または膣への抗ウィルス薬剤の供給に使用されるための請求項1から3または7から10のうちいずれかに記載の組成物。
【請求項12】
鼻、直腸または膣へのワクチンの供給に使用されるための請求項1から4または7から10のうちいずれかに記載の組成物。
【請求項13】
うっ血除去剤の供給に使用されるための請求項1,2または7から10のうちいずれかに記載の組成物。
【請求項14】
避妊薬剤の供給に使用されるための請求項1,3または7から10のうちいずれかに記載の組成物。
【請求項15】
膣潤滑薬剤として使用されるための請求項1,3,7から12または14のうちいずれかに記載の組成物。
【請求項16】
抗アレルギー薬剤の供給に使用されるための請求項1から10のうちいずれかに記載の組成物。
【請求項17】
生物学的に許容される服用形態で請求項1から16のうちいずれかによる組成物を有する製剤であって、粘膜表面に投与するのに適した形態である生物学的製剤。
【請求項18】
スプレーまたは液体自由流れシステムの形態である請求項17記載の製剤。
【請求項19】
鼻、膣、直腸、咽喉の奥または目への治療薬の供給手段としての請求項1から16のうちいずれかに記載の組成物または請求項17または18記載の製剤の使用。
【請求項20】
粘膜表面に投与するための液体薬学的組成物を有し、前記組成物は、治療薬と、低エステル化度ペクチンと、水性キャリアとを有し、パーツキットが外来的に前記表面に加えられるべき二価金属イオン溶液を有していないという条件で、前記組成物は投与部位でゲル化しまたはゲル化するように構成された前記パーツキット。
【請求項21】
粘膜表面に投与するための液体薬学的組成物を有し、その組成物は、治療薬と、低エステル化度ペクチンと、水性キャリアとを有し、その組成物が投与部位でゲル化し、または、ゲル化するように構成され、パーツキットはパッケージされ、さらに、そのパーツキットには二価金属イオンの外来的な源が存在しない状態で前記表面に前記組成物を投与するための説明書が与えられている前記パーツキット。
【請求項22】
請求項1から16のうちいずれかに記載の組成物、または、請求項17または請求項18記載の製剤を有し、パーツキットはパッケージされ、さらに、そのパーツキットには二価金属イオンの外来的な源がない状態で粘膜表面に前記組成物を投与するための説明書が与えられている前記パーツキット。
【請求項23】
治療薬と、低エステル化度ペクチンと、水性キャリアとを有する液体組成物を、哺乳類患者の粘膜表面に、二価金属イオンの溶液がその表面に外来的に投与しない状態で投与することによって取得可能な、医薬ゲル組成物。
【請求項24】
治療薬と低エステル化度ペクチンとを有する医薬ゲル組成物であって、当該ゲルは、前記治療薬とペクチンを水性キャリア中に有する液体組成物を粘膜表面に投与することによって得られ、且つ、前記ゲルは、前記液体組成物の粘膜表面への適用と同時あるいは前に前記粘膜表面に適用された外来の二価金属イオンを実質的に有さない、医薬ゲル組成物。
【請求項25】
二価金属イオンの溶液を哺乳類の粘膜表面に外来的に投与しない状態で、請求項1から16のうちいずれかに記載の組成物、請求項17または請求項18記載の製剤、または、請求項20から22のうちいずれかに記載のキットの組成物を前記哺乳類の粘膜表面へ投与することによって取得可能な医薬ゲル組成物。
【請求項26】
患者の粘膜表面に二価金属イオン溶液を外来的に投与しない状態で、治療薬と、低エステル化度ペクチンと、水性キャリアとを有する液体薬学的組成物を前記表面に投与する工程を有し、前記組成物は、投与部位でゲル化しまたはゲル化するように構成された患者の治療方法。
【請求項27】
患者の粘膜表面に二価金属イオン溶液を外来的に投与しない状態で、病気に対して効果がある治療薬と、低エステル化度ペクチンと、水性キャリアとを有する液体薬学的組成物を、治療を必要とする患者の前記表面に投与する工程を有し、前記組成物は、投与された部位でゲル化しまたはゲル化するように構成された病気の治療または予防方法。
【請求項28】
鼻、目、直腸、咽喉の奥または膣へ液体製剤中の治療薬を供給する方法であって、請求項1から16のうちいずれか記載の組成物中に存在する試薬を供給する工程を有する方法。
【請求項29】
請求項1から16のうちいずれか記載の組成物を哺乳類患者に投与する工程を有する哺乳類患者の治療方法。
【請求項30】
請求項1から16のうちいずれか記載の組成物を粘膜表面に投与する工程を有する哺乳類の前記粘膜表面に治療薬を供給するための方法。
【請求項31】
鼻、膣、直腸、咽喉の奥または目への治療薬の供給手段としての請求項1から16のうちいずれか記載の組成物、請求項17または請求項18記載の製剤、または、請求項20から22のうちいずれか記載のキットの使用。
【請求項32】
鼻、膣、直腸、咽喉の奥または目に治療薬を供給するための薬剤の製造中における請求項1から16のうちいずれか記載の組成物の使用。
【請求項33】
病気に対して効果がある治療薬を含む組成物を、患者の粘膜表面に二価金属イオン溶液を外来的に投与しない状態で、治療または予防を必要とする患者の前記表面に投与する工程を有する前記治療または予防のための薬剤の製造中における請求項1から16のうちいずれかに記載の組成物の使用。
【請求項34】
粘膜表面に治療を供給するための単一剤液体組成物の製造中における低エステル化度ペクチンの使用。
【請求項35】
請求項26から30のうちいずれかに記載の治療方法の中で使用するための薬剤の製造中における請求項1から16のうちいずれかに記載の組成物の使用。
【請求項36】
治療薬と、低エステル化度ペクチンと、水性キャリアとを有する組成物であって、前記組成物がパッケージされ、さらに、患者の治療に使用するために提供され、前記治療は、患者の粘膜表面に二価金属イオン溶液を外来的に投与しない状態で、前記組成物を前記表面に投与する工程を有する前記組成物。
【請求項37】
患者の粘膜表面に二価金属イオン溶液を外来的に投与しない状態で、水性液体薬学的組成物を患者の前記表面に投与する工程を有する前記患者の治療のための前記水性液体薬学的組成物の製造中における低エステル化度ペクチンの使用。
【請求項38】
治療薬とペクチンとを水性キャリア中で一緒に混合する工程を有する請求項1から16のうちいずれかに記載の組成物、請求項17または請求項18記載の製剤の組成物、または、請求項20から22のうちいずれかに記載のキットの作製方法。
【請求項39】
請求項38記載の方法によって取得可能な製品。
【請求項1】
治療薬と、低エステル化度ペクチンと、水性キャリアとを有し、投与部位でゲル化し、または、ゲル化するように構成可能である粘膜表面に投与するための単一剤の液体医薬組成物。
【請求項2】
前記粘膜表面は鼻腔である請求項1記載の組成物。
【請求項3】
前記粘膜表面は膣である請求項1記載の組成物。
【請求項4】
前記粘膜表面は直腸である請求項1記載の組成物。
【請求項5】
前記粘膜表面は咽喉の奥である請求項1記載の組成物。
【請求項6】
前記粘膜表面は目である請求項1記載の組成物。
【請求項7】
スプレーまたは液体自由流れシステムで投与される先行する請求項のうちいずれかに記載の組成物。
【請求項8】
前記エステル化度が50%未満である先行する請求項のうちいずれかに記載の組成物。
【請求項9】
前記組成物中のペクチン濃度が1から100g/Lまでである先行する請求項のうちいずれかに記載の組成物。
【請求項10】
前記組成物のpHが2から9までである先行する請求項のうちいずれかに記載の組成物。
【請求項11】
鼻または膣への抗ウィルス薬剤の供給に使用されるための請求項1から3または7から10のうちいずれかに記載の組成物。
【請求項12】
鼻、直腸または膣へのワクチンの供給に使用されるための請求項1から4または7から10のうちいずれかに記載の組成物。
【請求項13】
うっ血除去剤の供給に使用されるための請求項1,2または7から10のうちいずれかに記載の組成物。
【請求項14】
避妊薬剤の供給に使用されるための請求項1,3または7から10のうちいずれかに記載の組成物。
【請求項15】
膣潤滑薬剤として使用されるための請求項1,3,7から12または14のうちいずれかに記載の組成物。
【請求項16】
抗アレルギー薬剤の供給に使用されるための請求項1から10のうちいずれかに記載の組成物。
【請求項17】
生物学的に許容される服用形態で請求項1から16のうちいずれかによる組成物を有する製剤であって、粘膜表面に投与するのに適した形態である生物学的製剤。
【請求項18】
スプレーまたは液体自由流れシステムの形態である請求項17記載の製剤。
【請求項19】
鼻、膣、直腸、咽喉の奥または目への治療薬の供給手段としての請求項1から16のうちいずれかに記載の組成物または請求項17または18記載の製剤の使用。
【請求項20】
粘膜表面に投与するための液体薬学的組成物を有し、前記組成物は、治療薬と、低エステル化度ペクチンと、水性キャリアとを有し、パーツキットが外来的に前記表面に加えられるべき二価金属イオン溶液を有していないという条件で、前記組成物は投与部位でゲル化しまたはゲル化するように構成された前記パーツキット。
【請求項21】
粘膜表面に投与するための液体薬学的組成物を有し、その組成物は、治療薬と、低エステル化度ペクチンと、水性キャリアとを有し、その組成物が投与部位でゲル化し、または、ゲル化するように構成され、パーツキットはパッケージされ、さらに、そのパーツキットには二価金属イオンの外来的な源が存在しない状態で前記表面に前記組成物を投与するための説明書が与えられている前記パーツキット。
【請求項22】
請求項1から16のうちいずれかに記載の組成物、または、請求項17または請求項18記載の製剤を有し、パーツキットはパッケージされ、さらに、そのパーツキットには二価金属イオンの外来的な源がない状態で粘膜表面に前記組成物を投与するための説明書が与えられている前記パーツキット。
【請求項23】
治療薬と、低エステル化度ペクチンと、水性キャリアとを有する液体組成物を、哺乳類患者の粘膜表面に、二価金属イオンの溶液がその表面に外来的に投与しない状態で投与することによって取得可能な、医薬ゲル組成物。
【請求項24】
治療薬と低エステル化度ペクチンとを有する医薬ゲル組成物であって、当該ゲルは、前記治療薬とペクチンを水性キャリア中に有する液体組成物を粘膜表面に投与することによって得られ、且つ、前記ゲルは、前記液体組成物の粘膜表面への適用と同時あるいは前に前記粘膜表面に適用された外来の二価金属イオンを実質的に有さない、医薬ゲル組成物。
【請求項25】
二価金属イオンの溶液を哺乳類の粘膜表面に外来的に投与しない状態で、請求項1から16のうちいずれかに記載の組成物、請求項17または請求項18記載の製剤、または、請求項20から22のうちいずれかに記載のキットの組成物を前記哺乳類の粘膜表面へ投与することによって取得可能な医薬ゲル組成物。
【請求項26】
患者の粘膜表面に二価金属イオン溶液を外来的に投与しない状態で、治療薬と、低エステル化度ペクチンと、水性キャリアとを有する液体薬学的組成物を前記表面に投与する工程を有し、前記組成物は、投与部位でゲル化しまたはゲル化するように構成された患者の治療方法。
【請求項27】
患者の粘膜表面に二価金属イオン溶液を外来的に投与しない状態で、病気に対して効果がある治療薬と、低エステル化度ペクチンと、水性キャリアとを有する液体薬学的組成物を、治療を必要とする患者の前記表面に投与する工程を有し、前記組成物は、投与された部位でゲル化しまたはゲル化するように構成された病気の治療または予防方法。
【請求項28】
鼻、目、直腸、咽喉の奥または膣へ液体製剤中の治療薬を供給する方法であって、請求項1から16のうちいずれか記載の組成物中に存在する試薬を供給する工程を有する方法。
【請求項29】
請求項1から16のうちいずれか記載の組成物を哺乳類患者に投与する工程を有する哺乳類患者の治療方法。
【請求項30】
請求項1から16のうちいずれか記載の組成物を粘膜表面に投与する工程を有する哺乳類の前記粘膜表面に治療薬を供給するための方法。
【請求項31】
鼻、膣、直腸、咽喉の奥または目への治療薬の供給手段としての請求項1から16のうちいずれか記載の組成物、請求項17または請求項18記載の製剤、または、請求項20から22のうちいずれか記載のキットの使用。
【請求項32】
鼻、膣、直腸、咽喉の奥または目に治療薬を供給するための薬剤の製造中における請求項1から16のうちいずれか記載の組成物の使用。
【請求項33】
病気に対して効果がある治療薬を含む組成物を、患者の粘膜表面に二価金属イオン溶液を外来的に投与しない状態で、治療または予防を必要とする患者の前記表面に投与する工程を有する前記治療または予防のための薬剤の製造中における請求項1から16のうちいずれかに記載の組成物の使用。
【請求項34】
粘膜表面に治療を供給するための単一剤液体組成物の製造中における低エステル化度ペクチンの使用。
【請求項35】
請求項26から30のうちいずれかに記載の治療方法の中で使用するための薬剤の製造中における請求項1から16のうちいずれかに記載の組成物の使用。
【請求項36】
治療薬と、低エステル化度ペクチンと、水性キャリアとを有する組成物であって、前記組成物がパッケージされ、さらに、患者の治療に使用するために提供され、前記治療は、患者の粘膜表面に二価金属イオン溶液を外来的に投与しない状態で、前記組成物を前記表面に投与する工程を有する前記組成物。
【請求項37】
患者の粘膜表面に二価金属イオン溶液を外来的に投与しない状態で、水性液体薬学的組成物を患者の前記表面に投与する工程を有する前記患者の治療のための前記水性液体薬学的組成物の製造中における低エステル化度ペクチンの使用。
【請求項38】
治療薬とペクチンとを水性キャリア中で一緒に混合する工程を有する請求項1から16のうちいずれかに記載の組成物、請求項17または請求項18記載の製剤の組成物、または、請求項20から22のうちいずれかに記載のキットの作製方法。
【請求項39】
請求項38記載の方法によって取得可能な製品。
【図1】


【図2】




【図2】


【公開番号】特開2010−280695(P2010−280695A)
【公開日】平成22年12月16日(2010.12.16)
【国際特許分類】
【出願番号】特願2010−175973(P2010−175973)
【出願日】平成22年8月5日(2010.8.5)
【分割の表示】特願2008−257989(P2008−257989)の分割
【原出願日】平成10年4月20日(1998.4.20)
【出願人】(505260176)アルキメデス ディヴェロプメント リミテッド (8)
【Fターム(参考)】
【公開日】平成22年12月16日(2010.12.16)
【国際特許分類】
【出願日】平成22年8月5日(2010.8.5)
【分割の表示】特願2008−257989(P2008−257989)の分割
【原出願日】平成10年4月20日(1998.4.20)
【出願人】(505260176)アルキメデス ディヴェロプメント リミテッド (8)
【Fターム(参考)】
[ Back to top ]

