糖の製造方法、エタノールの製造方法、及び乳酸の製造方法
【課題】酵素糖化を効率的に行うことができ、糖の生産効率、エタノールの生産効率、及び乳酸の生産効率を向上させることが可能な、糖の製造方法、エタノールの製造方法、及び乳酸の製造方法を提供すること。
【解決手段】(A)セルロースI型を含むバイオマス原料を、アンモニア及び有機アミンの少なくともいずれかを含む処理剤で処理することにより、改質バイオマス原料を得る工程、(B)前記改質バイオマス原料を粉砕することにより、酵素糖化用原料を得る工程、及び、(C)前記酵素糖化用原料を、セルラーゼ及びヘミセルラーゼを用いて酵素糖化させ、糖を得る工程、を含む糖の製造方法である。
【解決手段】(A)セルロースI型を含むバイオマス原料を、アンモニア及び有機アミンの少なくともいずれかを含む処理剤で処理することにより、改質バイオマス原料を得る工程、(B)前記改質バイオマス原料を粉砕することにより、酵素糖化用原料を得る工程、及び、(C)前記酵素糖化用原料を、セルラーゼ及びヘミセルラーゼを用いて酵素糖化させ、糖を得る工程、を含む糖の製造方法である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、バイオマス原料を利用した、糖の製造方法、エタノールの製造方法、及び乳酸の製造方法に関する。
【背景技術】
【0002】
近年、地球温暖化対策の一環で、化石燃料の代替燃料として、木質バイオマスや草本バイオマス等のセルロースを含む植物資源からエタノールを製造し、各種燃料や化学原料として利用しようとする試みが広く行われている。
【0003】
バイオマス原料からのエタノールの製造は、例えば、収集したバイオマス原料を、糖化工程において糖に分解した後、発酵工程において酵母等の微生物を用いてエタノールに変換することにより行うことができる。
一方、環境負荷低減の観点から、生分解性ポリマーの利用が増加しており、その原料のひとつとして乳酸が使用されている。この乳酸も、前記のバイオマス原料を糖化し、更にこれを発酵することにより得ることができる。
【0004】
前記糖化は、従来より、濃硫酸や濃塩酸等の強酸を用いて行われることが多かったが、環境負荷低減の観点から、これらの強酸の使用量を少なくすることが望まれている。
そこで、近年は、濃硫酸や濃塩酸等の強酸による糖化に代わる手段として、酵素を用いたバイオマス原料の糖化が広く研究されている。酵素による糖化は、環境に対する影響の観点から望ましい手段であるが、この酵素糖化のためには、酵素を作用させ易くする目的から、予めバイオマス原料に対して前処理を行うことが必要となる。このバイオマス原料の前処理方法として様々な方法が知られているが、これらの中でも、希硫酸、加圧熱水等による蒸煮処理などが一般的である(例えば、特許文献1〜4参照)。
また、バイオマス原料を物理的手段により微細に粉砕することにより、化学的、生物化学的反応性が向上することや、バイオマス原料をアンモニアあるいは有機アミンを用いて前処理することにより、その化学的、生物化学的反応性が向上することが知られている(例えば、特許文献5参照)。
【0005】
しかし、これらの従来技術を用いても、硫酸の使用が好ましくないこと、及びバイオマス原料にこれらの前処理を行い、得られた処理物を酵素糖化に供する場合では、所望の程度の酵素糖化効率を得るためには該前処理を多段で行う必要があることや、200℃以上の高温にしなければならない等の問題があった。また、粉砕のみにより充分な酵素糖化効率を得ようとすると、粉砕工程に多大なエネルギーを要するためコストがかかる上、前記前処理されたバイオマスであっても、その酵素糖化効率は未だ充分満足できるものではなかった。
更に、既に実用化されているデンプンの酵素糖化に必要なアミラーゼ添加量と比較して、セルロースを糖化するために必要なセルラーゼの添加量は著しく多く、糖変換コストの増大が問題となっている。
【0006】
したがって、より酵素糖化効率を高めることのできる酵素糖化技術の開発、及び、前記酵素糖化に適したバイオマス原料の前処理技術の開発が、未だ望まれているのが現状である。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2006−075007号公報
【特許文献2】特開2004−121055号公報
【特許文献3】特表2002−541355号公報
【特許文献4】特開2002−159954号公報
【特許文献5】欧州特許公開第77287号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は、従来における前記諸問題を解決し、以下の目的を達成することを課題とする。即ち、本発明は、酵素糖化を効率的に行うことができ、そのため、糖の生産効率、エタノールの生産効率、及び乳酸の生産効率を向上させることが可能な、糖の製造方法、エタノールの製造方法、及び乳酸の製造方法を提供することを目的とする。
【課題を解決するための手段】
【0009】
前記課題を解決するため、本発明者らは鋭意検討した結果、以下のような知見を得た。即ち、天然型セルロースであるセルロースI型を含むバイオマス原料を、アンモニア及び有機アミンの少なくともいずれかを含む処理剤で処理することにより得られる改質バイオマス原料を、更に粉砕した後に、セルラーゼ及びヘミセルラーゼを併用して酵素糖化することにより、酵素糖化を効率的に行うことができ、したがって、糖の生産効率、エタノールの生産効率、及び乳酸の生産効率を格段に向上させることができるという知見である。
【0010】
なお、本発明者らは以前に、天然型セルロースであるセルロースI型よりも低い結晶密度を有するセルロース(例えば、セルロースIIII型)を酵素糖化の対象物として用いることにより、酵素糖化を効率的に行うことができること、及び、セルロースI型を含むバイオマス原料を、アンモニア、特に超臨界アンモニアで処理することにより、セルロースIIII型を含む酵素糖化用セルロースを効率的に得ることができることを特許出願している(特開2008−161125号公報参照。)。
【0011】
バイオマス原料を、アンモニア及び有機アミンの少なくともいずれかを含む処理剤で処理し、更に粉砕した後に、セルラーゼ及びヘミセルラーゼを用いて酵素糖化することにより、バイオマス原料の酵素糖化効率を格段に向上させることができることは、従来知られておらず、本発明者らによる新たな知見である。
【0012】
本発明は、本発明者らによる前記知見に基づくものであり、前記課題を解決するための手段としては、以下の通りである。即ち、
<1> (A)セルロースI型を含むバイオマス原料を、アンモニア及び有機アミンの少なくともいずれかを含む処理剤で処理することにより、改質バイオマス原料を得る工程、
(B)前記改質バイオマス原料を粉砕することにより、酵素糖化用原料を得る工程、及び、
(C)前記酵素糖化用原料を、セルラーゼ及びヘミセルラーゼを用いて酵素糖化させ、糖を得る工程、
を含むことを特徴とする糖の製造方法である。
<2> 工程(A)において用いる処理剤が、アンモニアである前記<1>に記載の糖の製造方法である。
<3> セルロースI型を含むバイオマス原料が、木質バイオマス及び草本バイオマスの少なくともいずれかである前記<1>から<2>のいずれかに記載の糖の製造方法である。
<4> ヘミセルラーゼがキシラナーゼである前記<1>から<3>のいずれかに記載の糖の製造方法である。
<5> ヘミセルラーゼとセルラーゼとの質量比(ヘミセルラーゼ/セルラーゼ)が、0.001〜0.5である前記<1>から<4>のいずれかに記載の糖の製造方法である。
<6> 工程(C)において、セロビアーゼを更に用いて酵素糖化させる前記<1>から<5>のいずれかに記載の糖の製造方法である。
<7> 前記<1>から<6>のいずれかに記載の糖の製造方法により得られた糖を、発酵させて、エタノールを得ることを特徴とするエタノールの製造方法である。
<8> 前記<1>から<6>のいずれかに記載の糖の製造方法により得られた糖を、発酵させて、乳酸を得ることを特徴とする乳酸の製造方法である。
【発明の効果】
【0013】
本発明によれば、従来における前記諸問題を解決し、前記目的を達成することができ、酵素糖化を効率的に行うことができ、そのため、糖の生産効率、エタノールの生産効率、及び乳酸の生産効率を向上させることが可能な、糖の製造方法、エタノールの製造方法、及び乳酸の製造方法を提供することができる。
【図面の簡単な説明】
【0014】
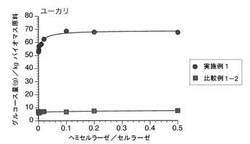
【図1】図1は、ユーカリをアンモニア処理後、ヘミセルラーゼ及びセルラーゼを用いて酵素糖化することにより産生したグルコース量(●:実施例1)、及びユーカリをアンモニア処理せずヘミセルラーゼ及びセルラーゼを用いて酵素糖化することにより産生したグルコース量(■:比較例1−2)を示す図である。縦軸は、1kgのバイオマス原料から得られるグルコース量(g)を表し、横軸は、ヘミセルラーゼと、セルラーゼとの質量比(ヘミセルラーゼ/セルラーゼ)を表す。
【図2】図2は、エゾノキヌヤナギをアンモニア処理後、ヘミセルラーゼ及びセルラーゼを用いて酵素糖化することにより産生したグルコース量(●:実施例2)、及びエゾノキヌヤナギをアンモニア処理せずヘミセルラーゼ及びセルラーゼを用いて酵素糖化することにより産生したグルコース量(■:比較例2−2)を示す図である。縦軸は、1kgのバイオマス原料から得られるグルコース量(g)を表し、横軸は、ヘミセルラーゼと、セルラーゼとの質量比(ヘミセルラーゼ/セルラーゼ)を表す。
【図3】図3は、サトウキビバガスをアンモニア処理後、ヘミセルラーゼ及びセルラーゼを用いて酵素糖化することにより産生したグルコース量(●:実施例3)、及びサトウキビバガスをアンモニア処理せずヘミセルラーゼ及びセルラーゼを用いて酵素糖化することにより産生したグルコース量(■:比較例3−2)を示す図である。縦軸は、1kgのバイオマス原料から得られるグルコース量(g)を表し、横軸は、ヘミセルラーゼと、セルラーゼとの質量比(ヘミセルラーゼ/セルラーゼ)を表す。
【図4】図4は、スイッチグラスをアンモニア処理後、ヘミセルラーゼ及びセルラーゼを用いて酵素糖化することにより産生したグルコース量(●:実施例4)、及びスイッチグラスをアンモニア処理せずヘミセルラーゼ及びセルラーゼを用いて酵素糖化することにより産生したグルコース量(■:比較例4−2)を示す図である。縦軸は、1kgのバイオマス原料から得られるグルコース量(g)を表し、横軸は、ヘミセルラーゼと、セルラーゼとの質量比(ヘミセルラーゼ/セルラーゼ)を表す。
【発明を実施するための形態】
【0015】
(糖の製造方法)
本発明の糖の製造方法は、(A)セルロースI型を含むバイオマス原料を、アンモニア及び有機アミンの少なくともいずれかを含む処理剤で処理することにより、改質バイオマス原料を得る工程、(B)前記改質バイオマス原料を粉砕することにより、酵素糖化用原料を得る工程、及び、(C)前記酵素糖化用原料を、セルラーゼ及びヘミセルラーゼを用いて酵素糖化させ、糖を得る工程、を含み、必要に応じて更にその他の工程を含む。
【0016】
<工程(A)>
前記工程(A)は、セルロースI型を含むバイオマス原料を、アンモニア及び有機アミンの少なくともいずれかを含む処理剤で処理することにより、改質バイオマス原料を得る工程である。
【0017】
−セルロースI型を含むバイオマス原料−
前記セルロースI型を含むバイオマス原料としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、農業や林業等の生産活動に伴う残渣として得られる「廃棄物系バイオマス」や、エネルギー等を得る目的で意図的に栽培して得られる「資源作物系バイオマス」などが挙げられる。これらは、1種単独で使用してもよく、2種以上を併用してもよい。
【0018】
前記「廃棄物系バイオマス」としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、製紙業等の過程で排出される黒液、チップ廃材等の産業廃棄物、農林・畜産業の過程で排出される廃棄物、モミ殻、牛糞等の副産物、ごみ、廃食油等の一般廃棄物などが挙げられる。
【0019】
前記「資源作物系バイオマス」としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、サトウキビ、トウモロコシ等の食物としても栽培される糖質乃至デンプン系作物、セルロース類の利用を目的として栽培される、ユーカリ、ポプラ、アカシア、ヤナギ、スギ、コナラ、ブナ、キリ、カエデ、クワ、クス、シイノキ、ナラ、カツラ、カバ、スギ、ヒノキ、マツ、ツガ、モミ、ヒバ等の木質バイオマス、スイッチグラス、ネピアグラス、エリアンサス、ミスカンサス、ススキ、サトウキビバガス、ソルガムバガス、イネワラ、ムギワラ、オオムギ、ジョンソングラス、コーンストーバー等の草本バイオマスなどが挙げられる。
【0020】
前記アンモニア及び有機アミンの少なくともいずれかを含む処理剤による処理において、前記セルロースI型を含むバイオマス原料の状態としては、特に制限はなく、目的に応じて適宜選択することができ、収集されたものをそのままの状態で使用してもよく、裁断、粉砕等により適宜ある程度以下の大きさにした状態で使用してもよい。これらの中でも、裁断、粉砕した状態が好ましい。
【0021】
前記バイオマス原料の大きさとしては、特に制限はなく、目的に応じて適宜選択することができるが、通過するメッシュの目開きとして、5mm以下が好ましく、3mm以下がより好ましく、2mm以下が更に好ましい。前記メッシュの目開きの大きさが、5mmを超えると、前記処理剤による処理が不十分となることがある。一方、前記メッシュの目開きの大きさが、前記更に好ましい範囲内であると、処理時間が短縮できる、使用する処理剤の量を少なくできる等の点で有利である。なお、以下、前記の収集したバイオマス原料を裁断、粉砕する工程を「粗粉砕」と称することがある。
【0022】
前記粗粉砕を予め行うことにより、アンモニア及び有機アミンの少なくともいずれかを含む処理剤による処理が効率的に進行し、また改質バイオマス原料を粉砕する際に、より微細な、酵素糖化効率に優れる微粉末状の酵素糖化用原料を効率的に得ることができる。
前記粗粉砕に用いる粉砕機としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、ウィレーミル、カッターミル、ハンマーミル、ピンミルなどが挙げられる。
【0023】
−アンモニア及び有機アミンの少なくともいずれかによる処理−
前記セルロースI型を含むバイオマス原料を、処理剤としてアンモニアを用いた処理を行う場合、その方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、前記セルロースI型を含むバイオマス原料と、アンモニアとを、圧力容器内に導入し、前記圧力容器内を所望の圧力及び温度に設定して、所望の時間処理することにより行う方法などが挙げられる。
前記アンモニアは、液相であっても、気相であっても、また超臨界状態であってもよい。アンモニアによる処理により、バイオマス原料中のセルロースI型の少なくとも一部がより酵素糖化効率の高いセルロースIIII型へと変態するが、その変態効率を向上する観点からは、液体アンモニア又は超臨界状態のアンモニアが適する。しかし、目標とする糖化率、消費エネルギー等を勘案し、それぞれに適した条件での処理を選択することができる。
アンモニアによる処理の条件としても、特に制限はなく、目的に応じて適宜選択することができるが、温度が−35℃〜140℃、圧力が0MPa〜12.5MPaが好ましい。
【0024】
前記セルロースI型を含むバイオマスを、処理剤として有機アミンを用いた処理を行う場合、使用する有機アミンとしては、特に制限はなく、目的に応じて適宜選択することができ、例えば、エチレンジアン、モノメチルアミン、モノエチルアミンなどが挙げられる。これらの中でも、エチレンジアミンが好ましい。
前記有機アミンにより前記セルロースI型を含むバイオマスを処理する処理温度や圧力等の条件としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、前記アンモニアによる処理と同様の条件などが挙げられる。
【0025】
本発明においては、セルロースI型からセルロースIIII型への変態の効率、処理後の処理剤の除去の容易さ等の観点から、処理剤としてはアンモニアを用いることが好ましい。
【0026】
前記アンモニア及び有機アミンの少なくともいずれかを含む処理剤による処理の時間としては、特に制限はなく、用いる前記セルロースI型を含むバイオマス原料の量や、前記処理圧力、処理温度等に応じて、適宜選択することができるが、10分間〜10時間が好ましく、30分間〜8時間がより好ましく、30分間〜5時間が特に好ましい。前記処理時間が、10分間未満であると、処理が不十分となり、糖の生産効率が低下することがあり、10時間を超えると、処理効率が飽和することがあるため全体として非効率となることがある。一方、前記処理時間が、前記より好ましい範囲内であると、前記バイオマス原料を効率よく処理することができ、糖の生産効率が向上する点で有利である。
【0027】
前記アンモニア及び有機アミンの少なくともいずれかを含む処理剤による処理時の、前記アンモニア及び有機アミンの少なくともいずれかの使用量としては、特に制限はなく、目的に応じて適宜選択することができるが、前記セルロースI型を含むバイオマス原料1gに対して、10mg〜300gが好ましく、100mg〜150gがより好ましく、1g〜50gが特に好ましい。前記アンモニア及び有機アミンの少なくともいずれかの使用量が、前記セルロースI型を含むバイオマス原料1gに対して、10mg未満であると、処理が不十分となることがあり、300gを超えると、処理の効率が悪くなることがある。一方、その使用量が、前記特に好ましい範囲内であると、処理時間が短縮できる、使用する処理剤の量を少なくできる等の点で有利である。
【0028】
前記アンモニア及び有機アミンの少なくともいずれかを含む処理剤による処理時には、少なくとも前記処理剤がアンモニア及び有機アミンの少なくともいずれかを含んでいれば、更にその他の化合物を組み合わせて使用してもよく、前記その他の化合物としては、例えば、二酸化炭素、窒素、エチレン、メタン、エタン、プロパン、ブタン、ペンタン、ヘキサン、トルエン、ベンゼン、フェノール、ジオキサン、キシレン、アセトン、クロロホルム、四塩化炭素、エタノール、メタノール、プロパノール、ブタノールなどが挙げられる。これらは、1種単独で使用してもよく、2種以上を併用してもよい。
なお、前記その他の化合物としては、水は使用しないことが好ましい。前記水を使用すると、得られたセルロースIIII型が、セルロースI型に戻ってしまう場合がある。
【0029】
−改質バイオマス原料−
本発明における「改質バイオマス原料」とは、セルロースI型を含むバイオマス原料を、アンモニア及び有機アミンの少なくともいずれかを含む処理剤により処理したものを意味するが、バイオマス原料中に含まれるセルロースI型の少なくとも一部がセルロースIIII型へと変態したものであることが好ましい。
【0030】
前記アンモニア及び有機アミンの少なくともいずれかを含む処理剤による処理により、改質バイオマス原料を得ることができる。前記処理により、前記バイオマス原料に含まれるセルロースI型の少なくとも一部を、より結晶密度の低いセルロースIIII型へと変態させることができる。セルロースIIII型は、その結晶密度の低さから、酵素が作用し易い点で有利である。
【0031】
更に、前記処理により、前記バイオマス原料に含まれるヘミセルロースの一部分は、オリゴ糖程度にまで分解され、水に可溶となる。これにより、前記バイオマス原料を、前記処理することにより、前記バイオマス原料に含まれるセルロースI型やヘミセルロースを、それぞれセルロースIIII型やヘミセルロース由来のオリゴ糖といった、より酵素が作用し易い状態へと変化させることができ、酵素糖化効率を向上させることが可能となる。
また、前記処理により、バイオマス原料におけるアセチル基やフェルロイル基等のエステル結合による修飾が取り除かれ、バイオマス原料中の残存するヘミセルロースに酵素が作用しやすくなることにより、更に糖の生産効率が向上するものと推察される。
【0032】
前記改質バイオマス原料は、セルロースIIII型を含むことが好ましく、その割合に制限はないが、セルロースIIII型が多い程、優れた酵素糖化効率が得られる点で好ましい。
また、前記改質バイオマス原料は、前記セルロースIIII型以外にも、例えば、セルロースI型(セルロースIα型、セルロースIβ型)や、その他の成分、例えば、ヘミセルロース、リグニン等が含まれていてもよい。ただし、酵素糖化の効率向上の観点から、リグニンは含まれない、あるいはその含有量が小さいことが好ましい。
【0033】
前記改質バイオマス原料において、前記セルロースI型の少なくとも一部が前記セルロースIIII型へと変換されたことを確認する方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、X線回折、FT−IR、固体NMR等の分析法などが挙げられる。
【0034】
なお、前記改質バイオマス原料において、セルロースは、その分子構造の間に、他の化合物を有していてもよい。例えば、改質バイオマス原料は、前述のとおり、天然型セルロースであるセルロースI型を含むバイオマス原料を、アンモニア及び有機アミンの少なくともいずれかを含む処理剤で処理することにより得ることができるが、その処理工程で生成する、セルロースとアンモニア及び有機アミンの少なくともいずれかとの複合体(以下、「セルロース・アンモニア等複合体」と称することがある。)の状態であってもよい。
しかし、前記セルロース・アンモニア等複合体は、酵素糖化時におけるpHの調整が困難であり、また、水の作用を受けることによりセルロースI型に戻ってしまう性質を有することなどから、酵素糖化時には、前記セルロース・アンモニア等複合体からアンモニア及び有機アミンの少なくともいずれかを除去した状態の、改質バイオマス原料を使用することが好ましい。
【0035】
<工程(B)>
前記工程(B)は、前記工程(A)により得られた改質バイオマス原料を粉砕することにより、酵素糖化用原料を得る工程である。
【0036】
−粉砕−
工程(B)において、前記工程(A)により得られた改質バイオマス原料を粉砕する。
前記改質バイオマス原料の粉砕を行う方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、平臼、遊星型ボールミル、振動ボールミル、ビーズミル、ジェットミル等の粉砕機を用いて行う方法などが挙げられる。これらの中でも、前記粉砕機としては、微細な、酵素糖化効率に優れる微粉末状の酵素糖化用原料を、比較的低エネルギーにて得ることができる点で、平臼が好ましい。
前記粉砕により、前記改質バイオマス原料を、本発明の酵素糖化用原料とすることができる。前記改質バイオマス原料を、粉砕することにより、より酵素糖化効率を向上させることが可能となる。
【0037】
前記粉砕を行う条件としては、特に制限はなく、粉砕機の種類、バイオマス原料の種類、得ようとする粉砕物の平均粒径等によって適宜選択することができる。
粉砕機として平臼を用いる場合は、粉砕されたバイオマス原料が臼から排出されるため、粉砕を更に行う場合には、排出された粉砕物を回収し、再度臼に供給することとなり、更にこれを複数回繰り返してもよい。その場合、粉砕を行う回数としては、特に制限はなく、用いる粉砕機の種類や、粉砕1回あたりの時間、負荷されるエネルギー等に応じて適宜選択することができるが、2回以上繰り返して行うことが、より微細な、酵素糖化効率に優れる微粉末状の酵素糖化用原料を得ることができる点で有利である。
前記粉砕は、回数を重ねるごとに、より微細な、酵素糖化効率に優れる微粉末状の酵素糖化用原料を得ることができる点で有利であるが、回数を重ねすぎても、それ以上の微粉化や酵素糖化効率の向上は望めず、全体として非効率となる点で、4回以下が好ましい。
【0038】
−酵素糖化用原料−
本発明において「酵素糖化用原料」とは、前記改質バイオマス原料を、粉砕処理したものをいう。前記改質バイオマス原料を粉砕することにより、より酵素糖化効率を向上させることが可能となる。
前記粉砕により得られる前記酵素糖化用原料の粒子の大きさとしては、特に制限はなく、また使用するバイオマス原料の種類によって好ましい大きさが変化することから、一概に限定することはできないが、その平均粒径としては、5μm〜80μmが好ましく、5μm〜50μmがより好ましく、5μm〜30μmが更に好ましい。前記酵素糖化用原料の平均粒径が、5μm未満である場合、平均粒径を5μm未満にするために粉砕に多大なエネルギー及び時間を要し、経済合理性を失することとなる。また、前記平均粒径が、80μmを超えると、酵素糖化効率が充分に向上しないことがある。一方、前記酵素糖化用原料の平均粒径が、前記更に好ましい範囲内であると、粉砕に要するエネルギー及び時間と、酵素糖化効率とのバランスの点で有利である。
なお、本発明における前記酵素糖化用原料の平均粒径としては、レーザー回折錯乱法により測定して得られるメジアン径を採用する。ここでメジアン径とは、その粒径以上の粒径を有する粒子と、その粒径以下の粒径を有する粒子との累計体積が同一となる粒径をいう。
【0039】
前記改質バイオマスの粉砕により得られた酵素糖化用原料は、例えば、そのまま、後述する工程(C)の酵素糖化に供してもよいし、適宜その他の工程を経た後、後述する工程(C)の酵素糖化に供してもよい。
【0040】
<工程(C)>
前記工程(C)は、前記工程(B)により得られた酵素糖化用原料を、セルラーゼ及びヘミセルラーゼを用いて酵素糖化させ、糖を得る工程である。
前記糖の製造方法において、セルラーゼと、ヘミセルラーゼとを併用することにより、糖の生産効率を格段に向上させることができる点で有利である。ここで、「併用」とは、セルラーゼ及びヘミセルラーゼを前記酵素糖化原料に同時に作用させることをいう。
【0041】
−酵素糖化−
前記酵素糖化を行う方法としては、セルラーゼ及びヘミセルラーゼを併用する限り、特に制限はなく、目的に応じて適宜選択することができる。
前記セルラーゼは、セルロースのβ−1,4−グリカンのグリコシド結合を加水分解する酵素の総称である。
また、前記ヘミセルラーゼは、ヘミセルロースのグリコシド結合を加水分解する酵素の総称である。
【0042】
前記セルラーゼとしては、特に制限はなく、バイオマス原料の種類などに応じて適宜選択することができ、例えば、国際生化学分子生物学連合により付されたEC(Enzyme Commission numbers)番号で、EC 3.2.1.4(エンドグルカナーゼ)、EC 3.2.1.91(セロビオヒドロラーゼ)などが挙げられる。これらは、1種単独で使用してもよく、2種以上を併用してもよい。
【0043】
前記ヘミセルラーゼとしては、特に制限はなく、目的に応じて適宜選択することができ、例えば、キシラナーゼ(EC 3.2.1.8又はEC 3.2.1.136)、マンナナーゼ(EC 3.2.1.78)、β−キシロシダーゼ(EC 3.2.1.37)、β−マンノシダーゼ(EC 3.2.1.25)、α−グルクロニダーゼ(EC 3.2.1.139)、α−アラビノフラノシダーゼ(EC 3.2.1.55)、α−ガラクトシダーゼ(EC 3.2.1.22)、アセチルキシランエステラーゼ(EC 3.1.1.72)、フェルロイルエステラーゼ(EC 3.1.1.73)、などが挙げられ、β−グルカナーゼ(EC 3.2.1.6)、ペクチナーゼ(EC 3.2.1.15)などを含んでいてもよい。これらは、1種単独で使用してもよく、2種以上を併用してもよいが、前記ヘミセルラーゼは、バイオマス原料の主成分などに応じて適宜選択することが好ましい。例えば、キシランを主成分とするバイオマス原料を用いる場合はキシラナーゼを、グルコマンナンを主成分とするバイオマス原料を用いる場合はマンナナーゼを含むことが好ましい(福島和彦、船田良、杉山淳司、高部圭司、梅澤俊明、山本浩之編、「木質の形成」、海青社、Tenkanen M., Biotechnology and Appllied Biochemistry, 1998, 27, 19−24, “Action of Trichoderma reesei and Aspergillus oryzae esterases in the deacetylation of hemicelluloses.”参照)。
【0044】
セルラーゼ及びヘミセルラーゼの入手方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、動物、植物、微生物等から得る方法など挙げられる。また、市販のセルラーゼ製剤やヘミセルラーゼ製剤を用いてもよい。
【0045】
前記セルラーゼ及びヘミセルラーゼを産生する微生物としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、トリコデルマ(Trichoderma)属、アクレモニウム属(Acremonium)属、アスペルギルス(Aspergillus)属、ファネロケエテ(Phanerochaete)属、トラメテス属(Trametes)、フーミコラ(Humicola)属、バチルス(Bacillus)属、オーレオバシディウム(Aureobasidium)属、サーモマイセス(Thermomyces)属等に属する微生物などが挙げられる。これらは、1種単独で使用してもよく、2種以上を併用してもよい。
【0046】
前記酵素糖化の際のセルラーゼ及びヘミセルラーゼの合計使用量としては、特に制限はなく、目的に応じて適宜選択することができるが、前記酵素糖化用原料1gに対して、0.001mg〜100mgが好ましく、0.01mg〜10mgがより好ましく、0.1mg〜1mgが更に好ましい。前記酵素の使用量が、前記酵素糖化用原料1gに対して、0.001mg未満であると、酵素糖化が不十分となることがあり、100mgを超えると、糖化阻害が起こることがある。一方、前記酵素の使用量が、前記更に好ましい範囲内であると、酵素添加量に対して得られる糖の量が多い点で有利である。
【0047】
前記酵素糖化の際のセルラーゼ及びヘミセルラーゼのそれぞれの使用量としては、特に制限はなく、目的に応じて適宜選択することができるが、ヘミセルラーゼとセルラーゼとの質量比(ヘミセルラーゼ/セルラーゼ)が、0.001〜0.5が好ましく、0.01〜0.2がより好ましい。前記質量比が、0.001未満であると、充分な量のグルコースを得ることができないことがあり、0.5を超えると、ヘミセルラーゼの添加量を増やしても得られるグルコース量が増えないためコスト的に不利である。一方、前記質量比が、前記好ましい範囲内であると、酵素添加量に対して得られる糖の量が多い点で有利である。
【0048】
前記酵素糖化において用いる酵素としては、セルラーゼ及びヘミセルラーゼを用いる限り、特に制限はなく、例えば、セロビアーゼ(EC 3.2.1.21)等のその他の酵素を更に併用してもよい。
前記酵素糖化の際に、前記その他の酵素を用いる場合、その使用量としては、特に制限はなく、目的に応じて適宜選択することができるが、前記その他の酵素とセルラーゼとの質量比(その他の酵素/セルラーゼ)が、0.01〜2が好ましく、0.1〜1.0がより好ましい。
【0049】
前記酵素糖化の際の温度としては、特に制限はなく、目的に応じて適宜選択することができるが、例えば、10℃〜70℃が好ましく、20℃〜60℃がより好ましく、30℃〜50℃が更に好ましい。前記温度が、10℃未満であると、酵素糖化が十分に進行しないことがあり、70℃を超えると、酵素が失活することがある。一方、前記温度が、前記更に好ましい範囲内であると、酵素添加量に対して得られる糖の量が多い点で有利である。
【0050】
前記酵素糖化を行う時間としては、特に制限はなく、目的に応じて適宜選択することができるが、1時間〜96時間が好ましく、2時間〜72時間がより好ましい。前記時間が、1時間未満であると、酵素糖化が充分に進行しないことがあり、96時間を超えると、酵素が失活することがあり、また糖の製造効率の観点から好ましくない。一方、前記時間が、前記更に好ましい範囲内であると、酵素添加量に対して得られる糖の量が多い点で有利である。
【0051】
前記酵素糖化の際のpHとしては、特に制限はなく、目的に応じて適宜選択することができるが、3.0〜8.0が好ましく、3.5〜7.0がより好ましく、4.0〜6.0が更に好ましい。前記pHが、3.0未満又は8.0を超えると、酵素が失活することがある。一方、前記pHが、前記更に好ましい範囲内であると、酵素添加量に対して得られる糖の量が多い点で有利である。
【0052】
−糖−
前記酵素糖化により、例えば、前記工程(B)で得られた酵素糖化用原料に含まれるセルロースIIII型由来の糖、前記セルロースI型由来の糖、ヘミセルロース由来の糖などを含む糖液を得ることができる。
前記セルロースIIII型由来の糖及び前記セルロースI型由来の糖としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、グルコースなどが挙げられる。
前記へミセルロース由来の糖としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、キシロース、アラビノース等の五炭糖、グルコース、ガラクトース、マンノース等の六炭糖などが挙げられる。
前記糖液は、例えば、そのまま後述する本発明のエタノールの製造方法や本発明の乳酸の製造方法に供してもよいし、後述するその他の工程を経て、後述する本発明のエタノールの製造方法や本発明の乳酸の製造方法に供してもよい。
【0053】
<その他の工程>
前記その他の工程としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、前記(A)工程における前記セルロース・アンモニア等複合体からアンモニア及び有機アミンの少なくともいずれかを除去する除去工程、前記(B)工程における酵素糖化用原料を、前記酵素糖化に適切となるようなpHに調整する第1のpH調整工程、前記(C)工程における前記糖液を、後述する各発酵工程に適切となるようなpHに調整する、第2のpH調整工程などが挙げられる。
【0054】
−除去工程−
前記除去工程は、前記工程(A)において、前記改質バイオマス原料が前記セルロース・アンモニア等複合体である場合、前記アンモニア及び有機アミンの少なくともいずれかによる処理の後に、前記セルロース・アンモニア等複合体から、アンモニア及び有機アミンの少なくともいずれかを除去する除去工程である。
前記アンモニア及び有機アミンの少なくともいずれかの除去方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、前記アンモニア及び有機アミンの少なくともいずれかによる処理後、得られた前記セルロース・アンモニア等複合体を含む改質バイオマス原料を、メタノール、エタノール、アセトン等で洗浄する方法、減圧乾燥する方法、処理剤の沸点以上の温度で乾燥させる方法などが挙げられる。
前記処理剤としてアンモニアを用いる場合、その除去方法としては、有機溶媒を使用せず、安全性に優れる点で、アンモニアの沸点以上の温度(例えば、常温〜50℃)で、常圧又は減圧下に乾燥させる方法が好ましい。
【0055】
−第1のpH調整工程、第2のpH調整工程−
前記第1のpH調整工程は、前記(B)工程における酵素糖化用原料を、前記酵素糖化に適切となるようなpHに調整する工程である。
前記第2のpH調整工程は、前記(C)工程における前記糖液を、後述するエタノールの製造方法や、乳酸の製造方法における各発酵工程に適切となるようなpHに調整する工程である。
前記pH調製を行う方法としては、特に制限はなく、公知の方法の中目的に応じて適宜選択することができる。
前記pH調製に用いる試薬としても、特に制限はなく、目的に応じて適宜選択することができ、例えば、塩酸、硫酸、ギ酸等の酸、水酸化ナトリウム、水酸化カリウム等のアルカリなどが挙げられる。
【0056】
<用途>
前記糖の製造方法により得られた糖は、環境に優しい燃料を産出することを目的としたバイオマス原料からのエタノール製造、食料には供し得ないバイオマス原料を利用した乳酸の製造、環境に優しい生分解性プラスチックの製造などに好適に利用可能である。
【0057】
(エタノールの製造方法)
本発明のエタノールの製造方法は、本発明の前記糖の製造方法により得られた糖を、発酵させて、エタノールを得る工程(発酵工程)を含み、必要に応じて更にその他の工程を含む。
【0058】
<発酵工程(アルコール発酵工程)>
前記エタノールの製造方法において、前記糖を発酵させる方法としては、特に制限はなく、目的に応じて適宜選択することができるが、前記糖を含む溶液に酵母等のアルコール発酵微生物を添加して、アルコール発酵を行わせる方法が好ましい。
【0059】
前記酵母としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、サッカロマイセス属酵母などが挙げられる。前記酵母は、天然酵母であってもよいし、遺伝子組み換え酵母であってもよい。
【0060】
前記エタノール発酵微生物の具体的な例としては、サッカロマイセス・セルビシエ(Saccharomyces cerevisiae)、クルイベロマイセス・フラジリス(Kluyveromyces fragilis)、クルイベロマイセス・ラクティス(K.lactis)、クルイベロマイセス・マルキシアヌス(K.marxianus)、ピキア・スティピティス(Pichia stipitis)、ピキア・パストリス(P.pastoris)、パチソレン・タンノフィルス(Pachysolen tannophilus)、カンジダ・グラビラータ(Candida Glabrata)等の酵母又はこれらの遺伝子組換え体;ザイモモナズ・モビリス(Zymomonas mobilis)、サイモバクター・パルメ(Zymobacter palmae)、クロストリジウム・サーモセラム(Clostridium thermocellum)、クロストリジウム・ルジュングダーリ(C.ljungdahlii)等の細菌又はこれらの遺伝子組換え体などが挙げられる。これらは、1種単独で使用してもよく、2種以上を併用してもよい。
【0061】
前記発酵の際の、前記酵母の使用量、発酵温度、pH、発酵時間等の条件としては、特に制限はなく、アルコール発酵に供する糖の量、使用する酵母の種類等に応じて、適宜選択することができる。
【0062】
<その他の工程>
前記その他の工程としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、前記発酵工程により得られたエタノールを分離精製する工程などが挙げられる。
前記分離精製の方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、蒸留などが挙げられる。
【0063】
<用途>
前記エタノールの製造方法により得られたエタノールは、例えば、燃料用エタノール、工業用エタノールなどとして好適に利用可能である。
前記エタノールはバイオマス原料から得ることができるので、前記バイオマス原料となる植物を生産できる限りは再生産が可能であり、また、前記植物は栽培時に大気中の二酸化炭素を吸収するため、前記エタノールを燃焼させて二酸化炭素が発生したとしても、大気中の二酸化炭素濃度を増加させることにはならない。したがって、前記エタノールは、地球温暖化防止に望ましいエネルギー源ということができる。また、このようなエタノールは、近年特に、ガソリンに混合し、環境に優しい自動車燃料として使用することが期待されている。
【0064】
本発明の糖の製造方法により得られる糖を、前記エタノールを産生する酵母等に代えて、それぞれ目的とするアルコール類を産生する微生物を使用して発酵させることにより、エタノール以外のアルコール類を製造することもできる。例えば、アセトン・ブタノール菌を使用した発酵を行うことにより、ブタノールを製造することができる。
【0065】
(乳酸の製造方法)
本発明の乳酸の製造方法は、本発明の前記糖の製造方法により得られた糖を、発酵させて、乳酸を得る工程(発酵工程)を含み、必要に応じて更にその他の工程を含む。
【0066】
<発酵工程(乳酸発酵工程)>
前記乳酸の製造方法において、前記糖を発酵させる方法としては、特に制限はなく、目的に応じて適宜選択することができるが、前記糖を含む溶液に乳酸菌等の乳酸発酵微生物を添加して、乳酸発酵を行わせる方法が好ましい。
【0067】
前記乳酸菌としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、ラクトバチルス・マニホティヴォランス(Lactobacillus manihotivorans)、ラクトバチルス・プランタラム(Lactobacillus plantarum)、ストレプトコッカス・サーモフィルス(Streptococcus thermophilus)、ラクトバチルス・ブルガリカス(Lactobacillus bulgaricus)などが挙げられる。これらは、1種単独で使用してもよく、2種以上を併用してもよい。
前記乳酸菌は、天然の乳酸菌であってもよいし、遺伝子組み換え乳酸菌であってもよい。
【0068】
前記発酵の際の、前記乳酸菌の使用量、発酵温度、pH、発酵時間等の条件としては、特に制限はなく、乳酸発酵に供する糖の量、使用する乳酸菌の種類等に応じて、適宜選択することができる。
【0069】
<その他の工程>
前記その他の工程としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、前記発酵工程により得られた乳酸を分離精製する工程などが挙げられる。前記分離精製の方法としては、特に制限はなく、目的に応じて適宜選択することができる。
【0070】
<用途>
前記乳酸の製造方法により得られた乳酸は、例えば、化学的に重合させて、ポリ乳酸を製造することに好適に利用可能である。現在は、トウモロコシ等のデンプンから製造されることが多い乳酸を、食料には供し得ないセルロースを含むバイオマス原料から生産可能になることが望ましく、前記乳酸の製造方法によれば、このようなセルロースを含むバイオマス原料からの効率的なポリ乳酸の製造を可能にすることができる。
【0071】
本発明の糖の製造方法により得られる糖を、前記乳酸菌に代えて、それぞれ目的とする有機酸を産生する微生物を使用して発酵させることにより、乳酸以外の有機酸、例えば、クエン酸、コハク酸、リンゴ酸、シュウ酸等を製造することもできる。
【実施例】
【0072】
以下に本発明の実施例及び比較例を挙げて本発明を具体的に説明するが、本発明はこれらの実施例に何ら限定されるものではない。
【0073】
(実施例1)
<バイオマス原料>
セルロースI型を含むバイオマス原料として、ユーカリを使用した。
【0074】
<粗粉砕処理>
用意したユーカリを、ウィレーミルを用い、目標平均粒径を200μmとして、粗粉砕したユーカリを得た。
【0075】
<アンモニア処理>
粗粉砕したユーカリを、以下の操作により、超臨界状態のアンモニアによる処理に供した。
60℃のオーブンで24時間乾燥させた粗粉砕ユーカリの試料4gを、内容積120mLのポータブルリアクターTVS−N2型(耐圧硝子工業株式会社製:以下、単に「容器」と称することがある。)に入れて密閉し、冷却装置にて容器を−13℃に冷却しながら、30分間、圧力0.5MPaにてアンモニアを流入させた。その後、PC−V型のヒーター(耐圧硝子工業株式会社製)を容器に取り付け、140℃にて1時間の加熱及び加圧処理を行った。この時容器内の圧力が、アンモニアが超臨界状態となる11MPa以上になっていることを確認した。処理後、容器内を大気圧とすることで、アンモニアを除去し、温度を室温まで冷却して容器内の固形物試料を回収した。該試料を密封せずに一晩おいてアンモニアを十分蒸散させ、アンモニア処理物1を得た。
【0076】
<粉砕処理>
セラミック製平臼、家庭用臼式お茶粉末器(商品名:まるごと緑茶 EU6820、パナソニック株式会社製)を使用し、アンモニア処理物1を2g用い、目盛り「細かい」の設定にて1回当り10分間、3回繰り返して粉砕した。
【0077】
<酵素糖化反応>
アンモニア処理物1を粉砕した試料について、以下の操作により、酵素糖化反応を行った。
内容積1.5mLのマイクロチューブに、精秤した前記試料10mgを取り、表1に示す組成となるように、50mM 酢酸緩衝液(pH4.5)を用いて酵素糖化反応液1〜8を調製した。なお、セルラーゼとしては、Trichoderma菌由来セルラーゼ製剤(商品名:Celluclast(登録商標) 1.5L、ノボザイムズ社製;セロビオヒドロラーゼ(EC 3.2.1.91)と、エンドグルカナーゼ(EC 3.2.1.4)との混合物)及びAspergillus菌由来セロビアーゼ製剤(商品名:Novozym(登録商標) 188(EC 3.2.1.21)、ノボザイムズ社製)を用いた。また、ヘミセルラーゼとしては、Trichoderma菌由来キシラナーゼ製剤(EC 3.2.1.8)(シグマアルドリッチ社製)を用いた。
なお、表1に記載の値は、全て純分換算である。
【0078】
【表1】

【0079】
酵素糖化反応液1〜8を37℃の恒温室にて回転振とう機(15回転/分間)を用い24時間転倒振とうしてそれぞれ酵素糖化反応を行った。反応後の溶液を遠心分離し、得られた上澄み液中のグルコース濃度を、GOD−POD法(グルコースオキシダーゼ−ペルオキシダーゼ法)によるグルコースキット(商品名:グルコースCIIテストワコー、和光純薬工業株式会社製)を用いて測定し、実施例1のバイオマス原料1kg当たりのグルコース量(g)を算出した。結果を図1に示す。
【0080】
(比較例1−1)
実施例1のアンモニア処理物1を粉砕した試料を用い、実施例1の酵素糖化反応における酵素糖化反応液1〜8を、以下の方法で調製した酵素糖化反応液9に代えたこと以外は、実施例1と同一の操作により、比較例1−1のバイオマス原料1kg当たりのグルコース量(g)を算出した。
【0081】
酵素糖化反応液9は、実施例1で調製した酵素糖化反応液1〜8において、Trichoderma菌由来キシラナーゼ製剤を添加しないこと以外は、酵素糖化反応液1〜8と同一の操作にて調製した。
即ち、内容積1.5mLのマイクロチューブに、精秤した試料10mgを取り、試料濃度1%(wt/vol)、酵素として、Trichoderma菌由来セルラーゼ製剤(商品名:Celluclast(登録商標) 1.5L、ノボザイムズ社製)及びAspergillus菌由来セロビアーゼ製剤(商品名:Novozym(登録商標) 188、ノボザイムズ社製)を各酵素濃度0.01%(wt/vol)、合計0.02%(wt/vol)の酵素濃度となるように、50mM 酢酸緩衝液(pH4.5)を用いて酵素糖化反応液9を調製した。
【0082】
(比較例1−2)
実施例1で用いた粗粉砕したユーカリを、アンモニア処理することなく、実施例1におけるアンモニア処理後の試料を粉砕した操作と同一の操作にて粉砕を行った。
次いで、実施例1において、アンモニア処理物1を粉砕した試料に代えて、前記アンモニア処理することなく粉砕した試料を用いたこと以外は、実施例1と同一の操作により酵素糖化反応を行い、比較例1−2のバイオマス原料1kg当たりのグルコース量(g)を算出した。結果を図1に示す。
【0083】
(比較例1−3)
比較例1−2のアンモニア処理することなく粉砕した試料を用い、比較例1−2の酵素糖化反応における酵素糖化反応液1〜8に代えて、酵素糖化反応液9を用いたこと以外は、比較例1−2と同一の操作により、比較例1−3のバイオマス原料1kg当たりのグルコース量(g)を算出した。
【0084】
(実施例2)
実施例1において、バイオマス原料として用いたユーカリに代えて、エゾノキヌヤナギを使用したこと以外は、実施例1と同一の操作にて、粗粉砕処理、アンモニア処理、粉砕処理、及び酵素糖化反応を行い、実施例1と同一の操作により実施例2のバイオマス原料1kg当たりのグルコース量(g)を算出した。結果を図2に示す。
なお、実施例2においてアンモニア処理した処理物を「アンモニア処理物2」と称することがある。
【0085】
(比較例2−1)
実施例2のアンモニア処理物2を粉砕した試料を用い、実施例2の酵素糖化反応における酵素糖化反応液1〜8に代えて、酵素糖化反応液9を用いたこと以外は、実施例2と同一の操作により、比較例2−1のバイオマス原料1kg当たりのグルコース量(g)を算出した。
【0086】
(比較例2−2)
実施例2で用いた粗粉砕したエゾノキヌヤナギを、アンモニア処理することなく、実施例2におけるアンモニア処理後の試料を粉砕した操作と同一の操作にて粉砕を行った。
次いで、実施例2において、アンモニア処理物2を粉砕した試料に代えて、前記アンモニア処理することなく粉砕した試料を用いたこと以外は、実施例2と同一の操作により酵素糖化反応を行い、比較例2−2のバイオマス原料1kg当たりのグルコース量(g)を算出した。結果を図2に示す。
【0087】
(比較例2−3)
比較例2−2のアンモニア処理することなく粉砕した試料を用い、比較例2−2の酵素糖化反応における酵素糖化反応液1〜8に代えて、酵素糖化反応液9を用いたこと以外は、比較例2−2と同一の操作により、比較例2−3のバイオマス原料1kg当たりのグルコース量(g)を算出した。
【0088】
(実施例3)
実施例1において、バイオマス原料として用いたユーカリに代えて、サトウキビバガスを使用したこと以外は、実施例1と同一の操作にて、粗粉砕処理、アンモニア処理、粉砕処理、及び酵素糖化反応を行い、実施例1と同一の操作により実施例3のバイオマス原料1kg当たりのグルコース量(g)を算出した。結果を図3に示す。
なお、実施例3においてアンモニア処理した処理物を「アンモニア処理物3」と称することがある。
【0089】
(比較例3−1)
実施例3のアンモニア処理物3を粉砕した試料を用い、実施例3の酵素糖化反応における酵素糖化反応液1〜8に代えて、酵素糖化反応液9を用いたこと以外は、実施例3と同一の操作により、比較例3−1のバイオマス原料1kg当たりのグルコース量(g)を算出した。
【0090】
(比較例3−2)
実施例3で用いた粗粉砕したエゾノキヌヤナギを、アンモニア処理することなく、実施例3におけるアンモニア処理後の試料を粉砕した操作と同一の操作にて粉砕を行った。
次いで、実施例3において、アンモニア処理物3を粉砕した試料に代えて、前記アンモニア処理することなく粉砕した試料を用いたこと以外は、実施例3と同一の操作により酵素糖化反応を行い、比較例3−2のバイオマス原料1kg当たりのグルコース量(g)を算出した。結果を図3に示す。
【0091】
(比較例3−3)
比較例3−2のアンモニア処理することなく粉砕した試料を用い、比較例3−2の酵素糖化反応における酵素糖化反応液1〜8に代えて、酵素糖化反応液9を用いたこと以外は、比較例3−2と同一の操作により、比較例3−3のバイオマス原料1kg当たりのグルコース量(g)を算出した。
【0092】
(実施例4)
実施例1において、バイオマス原料として用いたユーカリに代えて、スイッチグラスを使用したこと以外は、実施例1と同一の操作にて、粗粉砕処理、アンモニア処理、粉砕処理、及び酵素糖化反応を行い、実施例1と同一の操作により実施例4のバイオマス原料1kg当たりのグルコース量(g)を算出した。結果を図4に示す。
なお、実施例4においてアンモニア処理した処理物を「アンモニア処理物4」と称することがある。
【0093】
(比較例4−1)
実施例4のアンモニア処理物4を粉砕した試料を用い、実施例4の酵素糖化反応における酵素糖化反応液1〜8に代えて、酵素糖化反応液9を用いたこと以外は、実施例4と同一の操作により、比較例4−1のバイオマス原料1kg当たりのグルコース量(g)を算出した。
【0094】
(比較例4−2)
実施例4で用いた粗粉砕したスイッチグラスを、アンモニア処理することなく、実施例4におけるアンモニア処理後の試料を粉砕した操作と同一の操作にて粉砕を行った。
次いで、実施例4において、アンモニア処理物4を粉砕した試料に代えて、前記アンモニア処理することなく粉砕した試料を用いたこと以外は、実施例4と同一の操作により酵素糖化反応を行い、比較例4−2のバイオマス原料1kg当たりのグルコース量(g)を算出した。結果を図4に示す。
【0095】
(比較例4−3)
比較例4−2のアンモニア処理することなく粉砕した試料を用い、比較例4−2の酵素糖化反応における酵素糖化反応液1〜8に代えて、酵素糖化反応液9を用いたこと以外は、比較例4−2と同一の操作により、比較例4−3のバイオマス原料1kg当たりのグルコース量(g)を算出した。
【0096】
実施例1〜4及び比較例1−1〜4−3において算出した、バイオマス原料1kg当たりのグルコース量(g)のうち、各酵素糖化反応において、酵素糖化反応液8(ヘミセルラーゼ/セルラーゼ=0.5)又は酵素糖化反応液9(セルラーゼ単独)を用いた場合のグルコース量を表2に示す。
また、酵素糖化反応を、酵素糖化反応液8(ヘミセルラーゼ/セルラーゼ=0.5)を用いて行った場合のバイオマス1kg当たりのグルコース量を「(a)」、酵素糖化反応液9(セルラーゼ単独)を用いて行った場合のバイオマス1kg当たりのグルコース量を「(b)」とし、セルラーゼ単独で酵素糖化反応を行った場合と比較して、セルラーゼとヘミセルラーゼとの併用により増加したグルコースの増加量を下記計算式(1)より算出した。
更に、酵素糖化反応は酵素糖化反応液8(ヘミセルラーゼ/セルラーゼ=0.5)を用いて行い、酵素糖化反応の前処理として、アンモニア処理を行った場合のバイオマス1kg当たりのグルコース量を「(c)」、アンモニア処理を行わなかった場合のバイオマス1kg当たりのグルコース量を「(d)」とし、アンモニア処理を行わなかった場合と比較して、アンモニア処理を行った場合に増加したグルコース増加量を下記計算式(2)より算出した。
セルラーゼ及びヘミセルラーゼの併用によるグルコースの増加量(g)=(a)−(b) ・・・計算式(1)
アンモニア処理の有無によるグルコース増加量(g)=(c)−(d) ・・・計算式(2)
【0097】
【表2】

【0098】
表2の結果から、セルラーゼ単独で酵素糖化反応を行った場合、及び、アンモニア処理を行わなかった場合と比較して、バイオマス原料をアンモニア処理した後に、更に粉砕し、セルラーゼ及びヘミセルラーゼを同時に作用させて酵素糖化反応を行うことにより酵素糖化効率が格段に向上することが示された。
また、図1〜図4の結果から、セルラーゼとヘミセルラーゼとの併用において、セルラーゼに対するヘミセルラーゼの質量比が高い程、産生されるグルコース量が多いことが示された。
【産業上の利用可能性】
【0099】
本発明の糖の製造方法、エタノールの製造方法、及び乳酸の製造方法によれば、糖の生産効率、エタノールの生産効率、及び乳酸の生産効率を格段に向上させることができる。したがって、本発明の糖の製造方法、エタノールの製造方法、及び乳酸の製造方法は、例えば、近年注目されている、環境に優しい燃料を産出することを目的としたバイオマス原料からのエタノール製造、また、環境に優しい生分解性プラスチックの製造などに好適に利用可能である。
【技術分野】
【0001】
本発明は、バイオマス原料を利用した、糖の製造方法、エタノールの製造方法、及び乳酸の製造方法に関する。
【背景技術】
【0002】
近年、地球温暖化対策の一環で、化石燃料の代替燃料として、木質バイオマスや草本バイオマス等のセルロースを含む植物資源からエタノールを製造し、各種燃料や化学原料として利用しようとする試みが広く行われている。
【0003】
バイオマス原料からのエタノールの製造は、例えば、収集したバイオマス原料を、糖化工程において糖に分解した後、発酵工程において酵母等の微生物を用いてエタノールに変換することにより行うことができる。
一方、環境負荷低減の観点から、生分解性ポリマーの利用が増加しており、その原料のひとつとして乳酸が使用されている。この乳酸も、前記のバイオマス原料を糖化し、更にこれを発酵することにより得ることができる。
【0004】
前記糖化は、従来より、濃硫酸や濃塩酸等の強酸を用いて行われることが多かったが、環境負荷低減の観点から、これらの強酸の使用量を少なくすることが望まれている。
そこで、近年は、濃硫酸や濃塩酸等の強酸による糖化に代わる手段として、酵素を用いたバイオマス原料の糖化が広く研究されている。酵素による糖化は、環境に対する影響の観点から望ましい手段であるが、この酵素糖化のためには、酵素を作用させ易くする目的から、予めバイオマス原料に対して前処理を行うことが必要となる。このバイオマス原料の前処理方法として様々な方法が知られているが、これらの中でも、希硫酸、加圧熱水等による蒸煮処理などが一般的である(例えば、特許文献1〜4参照)。
また、バイオマス原料を物理的手段により微細に粉砕することにより、化学的、生物化学的反応性が向上することや、バイオマス原料をアンモニアあるいは有機アミンを用いて前処理することにより、その化学的、生物化学的反応性が向上することが知られている(例えば、特許文献5参照)。
【0005】
しかし、これらの従来技術を用いても、硫酸の使用が好ましくないこと、及びバイオマス原料にこれらの前処理を行い、得られた処理物を酵素糖化に供する場合では、所望の程度の酵素糖化効率を得るためには該前処理を多段で行う必要があることや、200℃以上の高温にしなければならない等の問題があった。また、粉砕のみにより充分な酵素糖化効率を得ようとすると、粉砕工程に多大なエネルギーを要するためコストがかかる上、前記前処理されたバイオマスであっても、その酵素糖化効率は未だ充分満足できるものではなかった。
更に、既に実用化されているデンプンの酵素糖化に必要なアミラーゼ添加量と比較して、セルロースを糖化するために必要なセルラーゼの添加量は著しく多く、糖変換コストの増大が問題となっている。
【0006】
したがって、より酵素糖化効率を高めることのできる酵素糖化技術の開発、及び、前記酵素糖化に適したバイオマス原料の前処理技術の開発が、未だ望まれているのが現状である。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2006−075007号公報
【特許文献2】特開2004−121055号公報
【特許文献3】特表2002−541355号公報
【特許文献4】特開2002−159954号公報
【特許文献5】欧州特許公開第77287号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は、従来における前記諸問題を解決し、以下の目的を達成することを課題とする。即ち、本発明は、酵素糖化を効率的に行うことができ、そのため、糖の生産効率、エタノールの生産効率、及び乳酸の生産効率を向上させることが可能な、糖の製造方法、エタノールの製造方法、及び乳酸の製造方法を提供することを目的とする。
【課題を解決するための手段】
【0009】
前記課題を解決するため、本発明者らは鋭意検討した結果、以下のような知見を得た。即ち、天然型セルロースであるセルロースI型を含むバイオマス原料を、アンモニア及び有機アミンの少なくともいずれかを含む処理剤で処理することにより得られる改質バイオマス原料を、更に粉砕した後に、セルラーゼ及びヘミセルラーゼを併用して酵素糖化することにより、酵素糖化を効率的に行うことができ、したがって、糖の生産効率、エタノールの生産効率、及び乳酸の生産効率を格段に向上させることができるという知見である。
【0010】
なお、本発明者らは以前に、天然型セルロースであるセルロースI型よりも低い結晶密度を有するセルロース(例えば、セルロースIIII型)を酵素糖化の対象物として用いることにより、酵素糖化を効率的に行うことができること、及び、セルロースI型を含むバイオマス原料を、アンモニア、特に超臨界アンモニアで処理することにより、セルロースIIII型を含む酵素糖化用セルロースを効率的に得ることができることを特許出願している(特開2008−161125号公報参照。)。
【0011】
バイオマス原料を、アンモニア及び有機アミンの少なくともいずれかを含む処理剤で処理し、更に粉砕した後に、セルラーゼ及びヘミセルラーゼを用いて酵素糖化することにより、バイオマス原料の酵素糖化効率を格段に向上させることができることは、従来知られておらず、本発明者らによる新たな知見である。
【0012】
本発明は、本発明者らによる前記知見に基づくものであり、前記課題を解決するための手段としては、以下の通りである。即ち、
<1> (A)セルロースI型を含むバイオマス原料を、アンモニア及び有機アミンの少なくともいずれかを含む処理剤で処理することにより、改質バイオマス原料を得る工程、
(B)前記改質バイオマス原料を粉砕することにより、酵素糖化用原料を得る工程、及び、
(C)前記酵素糖化用原料を、セルラーゼ及びヘミセルラーゼを用いて酵素糖化させ、糖を得る工程、
を含むことを特徴とする糖の製造方法である。
<2> 工程(A)において用いる処理剤が、アンモニアである前記<1>に記載の糖の製造方法である。
<3> セルロースI型を含むバイオマス原料が、木質バイオマス及び草本バイオマスの少なくともいずれかである前記<1>から<2>のいずれかに記載の糖の製造方法である。
<4> ヘミセルラーゼがキシラナーゼである前記<1>から<3>のいずれかに記載の糖の製造方法である。
<5> ヘミセルラーゼとセルラーゼとの質量比(ヘミセルラーゼ/セルラーゼ)が、0.001〜0.5である前記<1>から<4>のいずれかに記載の糖の製造方法である。
<6> 工程(C)において、セロビアーゼを更に用いて酵素糖化させる前記<1>から<5>のいずれかに記載の糖の製造方法である。
<7> 前記<1>から<6>のいずれかに記載の糖の製造方法により得られた糖を、発酵させて、エタノールを得ることを特徴とするエタノールの製造方法である。
<8> 前記<1>から<6>のいずれかに記載の糖の製造方法により得られた糖を、発酵させて、乳酸を得ることを特徴とする乳酸の製造方法である。
【発明の効果】
【0013】
本発明によれば、従来における前記諸問題を解決し、前記目的を達成することができ、酵素糖化を効率的に行うことができ、そのため、糖の生産効率、エタノールの生産効率、及び乳酸の生産効率を向上させることが可能な、糖の製造方法、エタノールの製造方法、及び乳酸の製造方法を提供することができる。
【図面の簡単な説明】
【0014】
【図1】図1は、ユーカリをアンモニア処理後、ヘミセルラーゼ及びセルラーゼを用いて酵素糖化することにより産生したグルコース量(●:実施例1)、及びユーカリをアンモニア処理せずヘミセルラーゼ及びセルラーゼを用いて酵素糖化することにより産生したグルコース量(■:比較例1−2)を示す図である。縦軸は、1kgのバイオマス原料から得られるグルコース量(g)を表し、横軸は、ヘミセルラーゼと、セルラーゼとの質量比(ヘミセルラーゼ/セルラーゼ)を表す。
【図2】図2は、エゾノキヌヤナギをアンモニア処理後、ヘミセルラーゼ及びセルラーゼを用いて酵素糖化することにより産生したグルコース量(●:実施例2)、及びエゾノキヌヤナギをアンモニア処理せずヘミセルラーゼ及びセルラーゼを用いて酵素糖化することにより産生したグルコース量(■:比較例2−2)を示す図である。縦軸は、1kgのバイオマス原料から得られるグルコース量(g)を表し、横軸は、ヘミセルラーゼと、セルラーゼとの質量比(ヘミセルラーゼ/セルラーゼ)を表す。
【図3】図3は、サトウキビバガスをアンモニア処理後、ヘミセルラーゼ及びセルラーゼを用いて酵素糖化することにより産生したグルコース量(●:実施例3)、及びサトウキビバガスをアンモニア処理せずヘミセルラーゼ及びセルラーゼを用いて酵素糖化することにより産生したグルコース量(■:比較例3−2)を示す図である。縦軸は、1kgのバイオマス原料から得られるグルコース量(g)を表し、横軸は、ヘミセルラーゼと、セルラーゼとの質量比(ヘミセルラーゼ/セルラーゼ)を表す。
【図4】図4は、スイッチグラスをアンモニア処理後、ヘミセルラーゼ及びセルラーゼを用いて酵素糖化することにより産生したグルコース量(●:実施例4)、及びスイッチグラスをアンモニア処理せずヘミセルラーゼ及びセルラーゼを用いて酵素糖化することにより産生したグルコース量(■:比較例4−2)を示す図である。縦軸は、1kgのバイオマス原料から得られるグルコース量(g)を表し、横軸は、ヘミセルラーゼと、セルラーゼとの質量比(ヘミセルラーゼ/セルラーゼ)を表す。
【発明を実施するための形態】
【0015】
(糖の製造方法)
本発明の糖の製造方法は、(A)セルロースI型を含むバイオマス原料を、アンモニア及び有機アミンの少なくともいずれかを含む処理剤で処理することにより、改質バイオマス原料を得る工程、(B)前記改質バイオマス原料を粉砕することにより、酵素糖化用原料を得る工程、及び、(C)前記酵素糖化用原料を、セルラーゼ及びヘミセルラーゼを用いて酵素糖化させ、糖を得る工程、を含み、必要に応じて更にその他の工程を含む。
【0016】
<工程(A)>
前記工程(A)は、セルロースI型を含むバイオマス原料を、アンモニア及び有機アミンの少なくともいずれかを含む処理剤で処理することにより、改質バイオマス原料を得る工程である。
【0017】
−セルロースI型を含むバイオマス原料−
前記セルロースI型を含むバイオマス原料としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、農業や林業等の生産活動に伴う残渣として得られる「廃棄物系バイオマス」や、エネルギー等を得る目的で意図的に栽培して得られる「資源作物系バイオマス」などが挙げられる。これらは、1種単独で使用してもよく、2種以上を併用してもよい。
【0018】
前記「廃棄物系バイオマス」としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、製紙業等の過程で排出される黒液、チップ廃材等の産業廃棄物、農林・畜産業の過程で排出される廃棄物、モミ殻、牛糞等の副産物、ごみ、廃食油等の一般廃棄物などが挙げられる。
【0019】
前記「資源作物系バイオマス」としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、サトウキビ、トウモロコシ等の食物としても栽培される糖質乃至デンプン系作物、セルロース類の利用を目的として栽培される、ユーカリ、ポプラ、アカシア、ヤナギ、スギ、コナラ、ブナ、キリ、カエデ、クワ、クス、シイノキ、ナラ、カツラ、カバ、スギ、ヒノキ、マツ、ツガ、モミ、ヒバ等の木質バイオマス、スイッチグラス、ネピアグラス、エリアンサス、ミスカンサス、ススキ、サトウキビバガス、ソルガムバガス、イネワラ、ムギワラ、オオムギ、ジョンソングラス、コーンストーバー等の草本バイオマスなどが挙げられる。
【0020】
前記アンモニア及び有機アミンの少なくともいずれかを含む処理剤による処理において、前記セルロースI型を含むバイオマス原料の状態としては、特に制限はなく、目的に応じて適宜選択することができ、収集されたものをそのままの状態で使用してもよく、裁断、粉砕等により適宜ある程度以下の大きさにした状態で使用してもよい。これらの中でも、裁断、粉砕した状態が好ましい。
【0021】
前記バイオマス原料の大きさとしては、特に制限はなく、目的に応じて適宜選択することができるが、通過するメッシュの目開きとして、5mm以下が好ましく、3mm以下がより好ましく、2mm以下が更に好ましい。前記メッシュの目開きの大きさが、5mmを超えると、前記処理剤による処理が不十分となることがある。一方、前記メッシュの目開きの大きさが、前記更に好ましい範囲内であると、処理時間が短縮できる、使用する処理剤の量を少なくできる等の点で有利である。なお、以下、前記の収集したバイオマス原料を裁断、粉砕する工程を「粗粉砕」と称することがある。
【0022】
前記粗粉砕を予め行うことにより、アンモニア及び有機アミンの少なくともいずれかを含む処理剤による処理が効率的に進行し、また改質バイオマス原料を粉砕する際に、より微細な、酵素糖化効率に優れる微粉末状の酵素糖化用原料を効率的に得ることができる。
前記粗粉砕に用いる粉砕機としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、ウィレーミル、カッターミル、ハンマーミル、ピンミルなどが挙げられる。
【0023】
−アンモニア及び有機アミンの少なくともいずれかによる処理−
前記セルロースI型を含むバイオマス原料を、処理剤としてアンモニアを用いた処理を行う場合、その方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、前記セルロースI型を含むバイオマス原料と、アンモニアとを、圧力容器内に導入し、前記圧力容器内を所望の圧力及び温度に設定して、所望の時間処理することにより行う方法などが挙げられる。
前記アンモニアは、液相であっても、気相であっても、また超臨界状態であってもよい。アンモニアによる処理により、バイオマス原料中のセルロースI型の少なくとも一部がより酵素糖化効率の高いセルロースIIII型へと変態するが、その変態効率を向上する観点からは、液体アンモニア又は超臨界状態のアンモニアが適する。しかし、目標とする糖化率、消費エネルギー等を勘案し、それぞれに適した条件での処理を選択することができる。
アンモニアによる処理の条件としても、特に制限はなく、目的に応じて適宜選択することができるが、温度が−35℃〜140℃、圧力が0MPa〜12.5MPaが好ましい。
【0024】
前記セルロースI型を含むバイオマスを、処理剤として有機アミンを用いた処理を行う場合、使用する有機アミンとしては、特に制限はなく、目的に応じて適宜選択することができ、例えば、エチレンジアン、モノメチルアミン、モノエチルアミンなどが挙げられる。これらの中でも、エチレンジアミンが好ましい。
前記有機アミンにより前記セルロースI型を含むバイオマスを処理する処理温度や圧力等の条件としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、前記アンモニアによる処理と同様の条件などが挙げられる。
【0025】
本発明においては、セルロースI型からセルロースIIII型への変態の効率、処理後の処理剤の除去の容易さ等の観点から、処理剤としてはアンモニアを用いることが好ましい。
【0026】
前記アンモニア及び有機アミンの少なくともいずれかを含む処理剤による処理の時間としては、特に制限はなく、用いる前記セルロースI型を含むバイオマス原料の量や、前記処理圧力、処理温度等に応じて、適宜選択することができるが、10分間〜10時間が好ましく、30分間〜8時間がより好ましく、30分間〜5時間が特に好ましい。前記処理時間が、10分間未満であると、処理が不十分となり、糖の生産効率が低下することがあり、10時間を超えると、処理効率が飽和することがあるため全体として非効率となることがある。一方、前記処理時間が、前記より好ましい範囲内であると、前記バイオマス原料を効率よく処理することができ、糖の生産効率が向上する点で有利である。
【0027】
前記アンモニア及び有機アミンの少なくともいずれかを含む処理剤による処理時の、前記アンモニア及び有機アミンの少なくともいずれかの使用量としては、特に制限はなく、目的に応じて適宜選択することができるが、前記セルロースI型を含むバイオマス原料1gに対して、10mg〜300gが好ましく、100mg〜150gがより好ましく、1g〜50gが特に好ましい。前記アンモニア及び有機アミンの少なくともいずれかの使用量が、前記セルロースI型を含むバイオマス原料1gに対して、10mg未満であると、処理が不十分となることがあり、300gを超えると、処理の効率が悪くなることがある。一方、その使用量が、前記特に好ましい範囲内であると、処理時間が短縮できる、使用する処理剤の量を少なくできる等の点で有利である。
【0028】
前記アンモニア及び有機アミンの少なくともいずれかを含む処理剤による処理時には、少なくとも前記処理剤がアンモニア及び有機アミンの少なくともいずれかを含んでいれば、更にその他の化合物を組み合わせて使用してもよく、前記その他の化合物としては、例えば、二酸化炭素、窒素、エチレン、メタン、エタン、プロパン、ブタン、ペンタン、ヘキサン、トルエン、ベンゼン、フェノール、ジオキサン、キシレン、アセトン、クロロホルム、四塩化炭素、エタノール、メタノール、プロパノール、ブタノールなどが挙げられる。これらは、1種単独で使用してもよく、2種以上を併用してもよい。
なお、前記その他の化合物としては、水は使用しないことが好ましい。前記水を使用すると、得られたセルロースIIII型が、セルロースI型に戻ってしまう場合がある。
【0029】
−改質バイオマス原料−
本発明における「改質バイオマス原料」とは、セルロースI型を含むバイオマス原料を、アンモニア及び有機アミンの少なくともいずれかを含む処理剤により処理したものを意味するが、バイオマス原料中に含まれるセルロースI型の少なくとも一部がセルロースIIII型へと変態したものであることが好ましい。
【0030】
前記アンモニア及び有機アミンの少なくともいずれかを含む処理剤による処理により、改質バイオマス原料を得ることができる。前記処理により、前記バイオマス原料に含まれるセルロースI型の少なくとも一部を、より結晶密度の低いセルロースIIII型へと変態させることができる。セルロースIIII型は、その結晶密度の低さから、酵素が作用し易い点で有利である。
【0031】
更に、前記処理により、前記バイオマス原料に含まれるヘミセルロースの一部分は、オリゴ糖程度にまで分解され、水に可溶となる。これにより、前記バイオマス原料を、前記処理することにより、前記バイオマス原料に含まれるセルロースI型やヘミセルロースを、それぞれセルロースIIII型やヘミセルロース由来のオリゴ糖といった、より酵素が作用し易い状態へと変化させることができ、酵素糖化効率を向上させることが可能となる。
また、前記処理により、バイオマス原料におけるアセチル基やフェルロイル基等のエステル結合による修飾が取り除かれ、バイオマス原料中の残存するヘミセルロースに酵素が作用しやすくなることにより、更に糖の生産効率が向上するものと推察される。
【0032】
前記改質バイオマス原料は、セルロースIIII型を含むことが好ましく、その割合に制限はないが、セルロースIIII型が多い程、優れた酵素糖化効率が得られる点で好ましい。
また、前記改質バイオマス原料は、前記セルロースIIII型以外にも、例えば、セルロースI型(セルロースIα型、セルロースIβ型)や、その他の成分、例えば、ヘミセルロース、リグニン等が含まれていてもよい。ただし、酵素糖化の効率向上の観点から、リグニンは含まれない、あるいはその含有量が小さいことが好ましい。
【0033】
前記改質バイオマス原料において、前記セルロースI型の少なくとも一部が前記セルロースIIII型へと変換されたことを確認する方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、X線回折、FT−IR、固体NMR等の分析法などが挙げられる。
【0034】
なお、前記改質バイオマス原料において、セルロースは、その分子構造の間に、他の化合物を有していてもよい。例えば、改質バイオマス原料は、前述のとおり、天然型セルロースであるセルロースI型を含むバイオマス原料を、アンモニア及び有機アミンの少なくともいずれかを含む処理剤で処理することにより得ることができるが、その処理工程で生成する、セルロースとアンモニア及び有機アミンの少なくともいずれかとの複合体(以下、「セルロース・アンモニア等複合体」と称することがある。)の状態であってもよい。
しかし、前記セルロース・アンモニア等複合体は、酵素糖化時におけるpHの調整が困難であり、また、水の作用を受けることによりセルロースI型に戻ってしまう性質を有することなどから、酵素糖化時には、前記セルロース・アンモニア等複合体からアンモニア及び有機アミンの少なくともいずれかを除去した状態の、改質バイオマス原料を使用することが好ましい。
【0035】
<工程(B)>
前記工程(B)は、前記工程(A)により得られた改質バイオマス原料を粉砕することにより、酵素糖化用原料を得る工程である。
【0036】
−粉砕−
工程(B)において、前記工程(A)により得られた改質バイオマス原料を粉砕する。
前記改質バイオマス原料の粉砕を行う方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、平臼、遊星型ボールミル、振動ボールミル、ビーズミル、ジェットミル等の粉砕機を用いて行う方法などが挙げられる。これらの中でも、前記粉砕機としては、微細な、酵素糖化効率に優れる微粉末状の酵素糖化用原料を、比較的低エネルギーにて得ることができる点で、平臼が好ましい。
前記粉砕により、前記改質バイオマス原料を、本発明の酵素糖化用原料とすることができる。前記改質バイオマス原料を、粉砕することにより、より酵素糖化効率を向上させることが可能となる。
【0037】
前記粉砕を行う条件としては、特に制限はなく、粉砕機の種類、バイオマス原料の種類、得ようとする粉砕物の平均粒径等によって適宜選択することができる。
粉砕機として平臼を用いる場合は、粉砕されたバイオマス原料が臼から排出されるため、粉砕を更に行う場合には、排出された粉砕物を回収し、再度臼に供給することとなり、更にこれを複数回繰り返してもよい。その場合、粉砕を行う回数としては、特に制限はなく、用いる粉砕機の種類や、粉砕1回あたりの時間、負荷されるエネルギー等に応じて適宜選択することができるが、2回以上繰り返して行うことが、より微細な、酵素糖化効率に優れる微粉末状の酵素糖化用原料を得ることができる点で有利である。
前記粉砕は、回数を重ねるごとに、より微細な、酵素糖化効率に優れる微粉末状の酵素糖化用原料を得ることができる点で有利であるが、回数を重ねすぎても、それ以上の微粉化や酵素糖化効率の向上は望めず、全体として非効率となる点で、4回以下が好ましい。
【0038】
−酵素糖化用原料−
本発明において「酵素糖化用原料」とは、前記改質バイオマス原料を、粉砕処理したものをいう。前記改質バイオマス原料を粉砕することにより、より酵素糖化効率を向上させることが可能となる。
前記粉砕により得られる前記酵素糖化用原料の粒子の大きさとしては、特に制限はなく、また使用するバイオマス原料の種類によって好ましい大きさが変化することから、一概に限定することはできないが、その平均粒径としては、5μm〜80μmが好ましく、5μm〜50μmがより好ましく、5μm〜30μmが更に好ましい。前記酵素糖化用原料の平均粒径が、5μm未満である場合、平均粒径を5μm未満にするために粉砕に多大なエネルギー及び時間を要し、経済合理性を失することとなる。また、前記平均粒径が、80μmを超えると、酵素糖化効率が充分に向上しないことがある。一方、前記酵素糖化用原料の平均粒径が、前記更に好ましい範囲内であると、粉砕に要するエネルギー及び時間と、酵素糖化効率とのバランスの点で有利である。
なお、本発明における前記酵素糖化用原料の平均粒径としては、レーザー回折錯乱法により測定して得られるメジアン径を採用する。ここでメジアン径とは、その粒径以上の粒径を有する粒子と、その粒径以下の粒径を有する粒子との累計体積が同一となる粒径をいう。
【0039】
前記改質バイオマスの粉砕により得られた酵素糖化用原料は、例えば、そのまま、後述する工程(C)の酵素糖化に供してもよいし、適宜その他の工程を経た後、後述する工程(C)の酵素糖化に供してもよい。
【0040】
<工程(C)>
前記工程(C)は、前記工程(B)により得られた酵素糖化用原料を、セルラーゼ及びヘミセルラーゼを用いて酵素糖化させ、糖を得る工程である。
前記糖の製造方法において、セルラーゼと、ヘミセルラーゼとを併用することにより、糖の生産効率を格段に向上させることができる点で有利である。ここで、「併用」とは、セルラーゼ及びヘミセルラーゼを前記酵素糖化原料に同時に作用させることをいう。
【0041】
−酵素糖化−
前記酵素糖化を行う方法としては、セルラーゼ及びヘミセルラーゼを併用する限り、特に制限はなく、目的に応じて適宜選択することができる。
前記セルラーゼは、セルロースのβ−1,4−グリカンのグリコシド結合を加水分解する酵素の総称である。
また、前記ヘミセルラーゼは、ヘミセルロースのグリコシド結合を加水分解する酵素の総称である。
【0042】
前記セルラーゼとしては、特に制限はなく、バイオマス原料の種類などに応じて適宜選択することができ、例えば、国際生化学分子生物学連合により付されたEC(Enzyme Commission numbers)番号で、EC 3.2.1.4(エンドグルカナーゼ)、EC 3.2.1.91(セロビオヒドロラーゼ)などが挙げられる。これらは、1種単独で使用してもよく、2種以上を併用してもよい。
【0043】
前記ヘミセルラーゼとしては、特に制限はなく、目的に応じて適宜選択することができ、例えば、キシラナーゼ(EC 3.2.1.8又はEC 3.2.1.136)、マンナナーゼ(EC 3.2.1.78)、β−キシロシダーゼ(EC 3.2.1.37)、β−マンノシダーゼ(EC 3.2.1.25)、α−グルクロニダーゼ(EC 3.2.1.139)、α−アラビノフラノシダーゼ(EC 3.2.1.55)、α−ガラクトシダーゼ(EC 3.2.1.22)、アセチルキシランエステラーゼ(EC 3.1.1.72)、フェルロイルエステラーゼ(EC 3.1.1.73)、などが挙げられ、β−グルカナーゼ(EC 3.2.1.6)、ペクチナーゼ(EC 3.2.1.15)などを含んでいてもよい。これらは、1種単独で使用してもよく、2種以上を併用してもよいが、前記ヘミセルラーゼは、バイオマス原料の主成分などに応じて適宜選択することが好ましい。例えば、キシランを主成分とするバイオマス原料を用いる場合はキシラナーゼを、グルコマンナンを主成分とするバイオマス原料を用いる場合はマンナナーゼを含むことが好ましい(福島和彦、船田良、杉山淳司、高部圭司、梅澤俊明、山本浩之編、「木質の形成」、海青社、Tenkanen M., Biotechnology and Appllied Biochemistry, 1998, 27, 19−24, “Action of Trichoderma reesei and Aspergillus oryzae esterases in the deacetylation of hemicelluloses.”参照)。
【0044】
セルラーゼ及びヘミセルラーゼの入手方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、動物、植物、微生物等から得る方法など挙げられる。また、市販のセルラーゼ製剤やヘミセルラーゼ製剤を用いてもよい。
【0045】
前記セルラーゼ及びヘミセルラーゼを産生する微生物としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、トリコデルマ(Trichoderma)属、アクレモニウム属(Acremonium)属、アスペルギルス(Aspergillus)属、ファネロケエテ(Phanerochaete)属、トラメテス属(Trametes)、フーミコラ(Humicola)属、バチルス(Bacillus)属、オーレオバシディウム(Aureobasidium)属、サーモマイセス(Thermomyces)属等に属する微生物などが挙げられる。これらは、1種単独で使用してもよく、2種以上を併用してもよい。
【0046】
前記酵素糖化の際のセルラーゼ及びヘミセルラーゼの合計使用量としては、特に制限はなく、目的に応じて適宜選択することができるが、前記酵素糖化用原料1gに対して、0.001mg〜100mgが好ましく、0.01mg〜10mgがより好ましく、0.1mg〜1mgが更に好ましい。前記酵素の使用量が、前記酵素糖化用原料1gに対して、0.001mg未満であると、酵素糖化が不十分となることがあり、100mgを超えると、糖化阻害が起こることがある。一方、前記酵素の使用量が、前記更に好ましい範囲内であると、酵素添加量に対して得られる糖の量が多い点で有利である。
【0047】
前記酵素糖化の際のセルラーゼ及びヘミセルラーゼのそれぞれの使用量としては、特に制限はなく、目的に応じて適宜選択することができるが、ヘミセルラーゼとセルラーゼとの質量比(ヘミセルラーゼ/セルラーゼ)が、0.001〜0.5が好ましく、0.01〜0.2がより好ましい。前記質量比が、0.001未満であると、充分な量のグルコースを得ることができないことがあり、0.5を超えると、ヘミセルラーゼの添加量を増やしても得られるグルコース量が増えないためコスト的に不利である。一方、前記質量比が、前記好ましい範囲内であると、酵素添加量に対して得られる糖の量が多い点で有利である。
【0048】
前記酵素糖化において用いる酵素としては、セルラーゼ及びヘミセルラーゼを用いる限り、特に制限はなく、例えば、セロビアーゼ(EC 3.2.1.21)等のその他の酵素を更に併用してもよい。
前記酵素糖化の際に、前記その他の酵素を用いる場合、その使用量としては、特に制限はなく、目的に応じて適宜選択することができるが、前記その他の酵素とセルラーゼとの質量比(その他の酵素/セルラーゼ)が、0.01〜2が好ましく、0.1〜1.0がより好ましい。
【0049】
前記酵素糖化の際の温度としては、特に制限はなく、目的に応じて適宜選択することができるが、例えば、10℃〜70℃が好ましく、20℃〜60℃がより好ましく、30℃〜50℃が更に好ましい。前記温度が、10℃未満であると、酵素糖化が十分に進行しないことがあり、70℃を超えると、酵素が失活することがある。一方、前記温度が、前記更に好ましい範囲内であると、酵素添加量に対して得られる糖の量が多い点で有利である。
【0050】
前記酵素糖化を行う時間としては、特に制限はなく、目的に応じて適宜選択することができるが、1時間〜96時間が好ましく、2時間〜72時間がより好ましい。前記時間が、1時間未満であると、酵素糖化が充分に進行しないことがあり、96時間を超えると、酵素が失活することがあり、また糖の製造効率の観点から好ましくない。一方、前記時間が、前記更に好ましい範囲内であると、酵素添加量に対して得られる糖の量が多い点で有利である。
【0051】
前記酵素糖化の際のpHとしては、特に制限はなく、目的に応じて適宜選択することができるが、3.0〜8.0が好ましく、3.5〜7.0がより好ましく、4.0〜6.0が更に好ましい。前記pHが、3.0未満又は8.0を超えると、酵素が失活することがある。一方、前記pHが、前記更に好ましい範囲内であると、酵素添加量に対して得られる糖の量が多い点で有利である。
【0052】
−糖−
前記酵素糖化により、例えば、前記工程(B)で得られた酵素糖化用原料に含まれるセルロースIIII型由来の糖、前記セルロースI型由来の糖、ヘミセルロース由来の糖などを含む糖液を得ることができる。
前記セルロースIIII型由来の糖及び前記セルロースI型由来の糖としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、グルコースなどが挙げられる。
前記へミセルロース由来の糖としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、キシロース、アラビノース等の五炭糖、グルコース、ガラクトース、マンノース等の六炭糖などが挙げられる。
前記糖液は、例えば、そのまま後述する本発明のエタノールの製造方法や本発明の乳酸の製造方法に供してもよいし、後述するその他の工程を経て、後述する本発明のエタノールの製造方法や本発明の乳酸の製造方法に供してもよい。
【0053】
<その他の工程>
前記その他の工程としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、前記(A)工程における前記セルロース・アンモニア等複合体からアンモニア及び有機アミンの少なくともいずれかを除去する除去工程、前記(B)工程における酵素糖化用原料を、前記酵素糖化に適切となるようなpHに調整する第1のpH調整工程、前記(C)工程における前記糖液を、後述する各発酵工程に適切となるようなpHに調整する、第2のpH調整工程などが挙げられる。
【0054】
−除去工程−
前記除去工程は、前記工程(A)において、前記改質バイオマス原料が前記セルロース・アンモニア等複合体である場合、前記アンモニア及び有機アミンの少なくともいずれかによる処理の後に、前記セルロース・アンモニア等複合体から、アンモニア及び有機アミンの少なくともいずれかを除去する除去工程である。
前記アンモニア及び有機アミンの少なくともいずれかの除去方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、前記アンモニア及び有機アミンの少なくともいずれかによる処理後、得られた前記セルロース・アンモニア等複合体を含む改質バイオマス原料を、メタノール、エタノール、アセトン等で洗浄する方法、減圧乾燥する方法、処理剤の沸点以上の温度で乾燥させる方法などが挙げられる。
前記処理剤としてアンモニアを用いる場合、その除去方法としては、有機溶媒を使用せず、安全性に優れる点で、アンモニアの沸点以上の温度(例えば、常温〜50℃)で、常圧又は減圧下に乾燥させる方法が好ましい。
【0055】
−第1のpH調整工程、第2のpH調整工程−
前記第1のpH調整工程は、前記(B)工程における酵素糖化用原料を、前記酵素糖化に適切となるようなpHに調整する工程である。
前記第2のpH調整工程は、前記(C)工程における前記糖液を、後述するエタノールの製造方法や、乳酸の製造方法における各発酵工程に適切となるようなpHに調整する工程である。
前記pH調製を行う方法としては、特に制限はなく、公知の方法の中目的に応じて適宜選択することができる。
前記pH調製に用いる試薬としても、特に制限はなく、目的に応じて適宜選択することができ、例えば、塩酸、硫酸、ギ酸等の酸、水酸化ナトリウム、水酸化カリウム等のアルカリなどが挙げられる。
【0056】
<用途>
前記糖の製造方法により得られた糖は、環境に優しい燃料を産出することを目的としたバイオマス原料からのエタノール製造、食料には供し得ないバイオマス原料を利用した乳酸の製造、環境に優しい生分解性プラスチックの製造などに好適に利用可能である。
【0057】
(エタノールの製造方法)
本発明のエタノールの製造方法は、本発明の前記糖の製造方法により得られた糖を、発酵させて、エタノールを得る工程(発酵工程)を含み、必要に応じて更にその他の工程を含む。
【0058】
<発酵工程(アルコール発酵工程)>
前記エタノールの製造方法において、前記糖を発酵させる方法としては、特に制限はなく、目的に応じて適宜選択することができるが、前記糖を含む溶液に酵母等のアルコール発酵微生物を添加して、アルコール発酵を行わせる方法が好ましい。
【0059】
前記酵母としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、サッカロマイセス属酵母などが挙げられる。前記酵母は、天然酵母であってもよいし、遺伝子組み換え酵母であってもよい。
【0060】
前記エタノール発酵微生物の具体的な例としては、サッカロマイセス・セルビシエ(Saccharomyces cerevisiae)、クルイベロマイセス・フラジリス(Kluyveromyces fragilis)、クルイベロマイセス・ラクティス(K.lactis)、クルイベロマイセス・マルキシアヌス(K.marxianus)、ピキア・スティピティス(Pichia stipitis)、ピキア・パストリス(P.pastoris)、パチソレン・タンノフィルス(Pachysolen tannophilus)、カンジダ・グラビラータ(Candida Glabrata)等の酵母又はこれらの遺伝子組換え体;ザイモモナズ・モビリス(Zymomonas mobilis)、サイモバクター・パルメ(Zymobacter palmae)、クロストリジウム・サーモセラム(Clostridium thermocellum)、クロストリジウム・ルジュングダーリ(C.ljungdahlii)等の細菌又はこれらの遺伝子組換え体などが挙げられる。これらは、1種単独で使用してもよく、2種以上を併用してもよい。
【0061】
前記発酵の際の、前記酵母の使用量、発酵温度、pH、発酵時間等の条件としては、特に制限はなく、アルコール発酵に供する糖の量、使用する酵母の種類等に応じて、適宜選択することができる。
【0062】
<その他の工程>
前記その他の工程としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、前記発酵工程により得られたエタノールを分離精製する工程などが挙げられる。
前記分離精製の方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、蒸留などが挙げられる。
【0063】
<用途>
前記エタノールの製造方法により得られたエタノールは、例えば、燃料用エタノール、工業用エタノールなどとして好適に利用可能である。
前記エタノールはバイオマス原料から得ることができるので、前記バイオマス原料となる植物を生産できる限りは再生産が可能であり、また、前記植物は栽培時に大気中の二酸化炭素を吸収するため、前記エタノールを燃焼させて二酸化炭素が発生したとしても、大気中の二酸化炭素濃度を増加させることにはならない。したがって、前記エタノールは、地球温暖化防止に望ましいエネルギー源ということができる。また、このようなエタノールは、近年特に、ガソリンに混合し、環境に優しい自動車燃料として使用することが期待されている。
【0064】
本発明の糖の製造方法により得られる糖を、前記エタノールを産生する酵母等に代えて、それぞれ目的とするアルコール類を産生する微生物を使用して発酵させることにより、エタノール以外のアルコール類を製造することもできる。例えば、アセトン・ブタノール菌を使用した発酵を行うことにより、ブタノールを製造することができる。
【0065】
(乳酸の製造方法)
本発明の乳酸の製造方法は、本発明の前記糖の製造方法により得られた糖を、発酵させて、乳酸を得る工程(発酵工程)を含み、必要に応じて更にその他の工程を含む。
【0066】
<発酵工程(乳酸発酵工程)>
前記乳酸の製造方法において、前記糖を発酵させる方法としては、特に制限はなく、目的に応じて適宜選択することができるが、前記糖を含む溶液に乳酸菌等の乳酸発酵微生物を添加して、乳酸発酵を行わせる方法が好ましい。
【0067】
前記乳酸菌としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、ラクトバチルス・マニホティヴォランス(Lactobacillus manihotivorans)、ラクトバチルス・プランタラム(Lactobacillus plantarum)、ストレプトコッカス・サーモフィルス(Streptococcus thermophilus)、ラクトバチルス・ブルガリカス(Lactobacillus bulgaricus)などが挙げられる。これらは、1種単独で使用してもよく、2種以上を併用してもよい。
前記乳酸菌は、天然の乳酸菌であってもよいし、遺伝子組み換え乳酸菌であってもよい。
【0068】
前記発酵の際の、前記乳酸菌の使用量、発酵温度、pH、発酵時間等の条件としては、特に制限はなく、乳酸発酵に供する糖の量、使用する乳酸菌の種類等に応じて、適宜選択することができる。
【0069】
<その他の工程>
前記その他の工程としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、前記発酵工程により得られた乳酸を分離精製する工程などが挙げられる。前記分離精製の方法としては、特に制限はなく、目的に応じて適宜選択することができる。
【0070】
<用途>
前記乳酸の製造方法により得られた乳酸は、例えば、化学的に重合させて、ポリ乳酸を製造することに好適に利用可能である。現在は、トウモロコシ等のデンプンから製造されることが多い乳酸を、食料には供し得ないセルロースを含むバイオマス原料から生産可能になることが望ましく、前記乳酸の製造方法によれば、このようなセルロースを含むバイオマス原料からの効率的なポリ乳酸の製造を可能にすることができる。
【0071】
本発明の糖の製造方法により得られる糖を、前記乳酸菌に代えて、それぞれ目的とする有機酸を産生する微生物を使用して発酵させることにより、乳酸以外の有機酸、例えば、クエン酸、コハク酸、リンゴ酸、シュウ酸等を製造することもできる。
【実施例】
【0072】
以下に本発明の実施例及び比較例を挙げて本発明を具体的に説明するが、本発明はこれらの実施例に何ら限定されるものではない。
【0073】
(実施例1)
<バイオマス原料>
セルロースI型を含むバイオマス原料として、ユーカリを使用した。
【0074】
<粗粉砕処理>
用意したユーカリを、ウィレーミルを用い、目標平均粒径を200μmとして、粗粉砕したユーカリを得た。
【0075】
<アンモニア処理>
粗粉砕したユーカリを、以下の操作により、超臨界状態のアンモニアによる処理に供した。
60℃のオーブンで24時間乾燥させた粗粉砕ユーカリの試料4gを、内容積120mLのポータブルリアクターTVS−N2型(耐圧硝子工業株式会社製:以下、単に「容器」と称することがある。)に入れて密閉し、冷却装置にて容器を−13℃に冷却しながら、30分間、圧力0.5MPaにてアンモニアを流入させた。その後、PC−V型のヒーター(耐圧硝子工業株式会社製)を容器に取り付け、140℃にて1時間の加熱及び加圧処理を行った。この時容器内の圧力が、アンモニアが超臨界状態となる11MPa以上になっていることを確認した。処理後、容器内を大気圧とすることで、アンモニアを除去し、温度を室温まで冷却して容器内の固形物試料を回収した。該試料を密封せずに一晩おいてアンモニアを十分蒸散させ、アンモニア処理物1を得た。
【0076】
<粉砕処理>
セラミック製平臼、家庭用臼式お茶粉末器(商品名:まるごと緑茶 EU6820、パナソニック株式会社製)を使用し、アンモニア処理物1を2g用い、目盛り「細かい」の設定にて1回当り10分間、3回繰り返して粉砕した。
【0077】
<酵素糖化反応>
アンモニア処理物1を粉砕した試料について、以下の操作により、酵素糖化反応を行った。
内容積1.5mLのマイクロチューブに、精秤した前記試料10mgを取り、表1に示す組成となるように、50mM 酢酸緩衝液(pH4.5)を用いて酵素糖化反応液1〜8を調製した。なお、セルラーゼとしては、Trichoderma菌由来セルラーゼ製剤(商品名:Celluclast(登録商標) 1.5L、ノボザイムズ社製;セロビオヒドロラーゼ(EC 3.2.1.91)と、エンドグルカナーゼ(EC 3.2.1.4)との混合物)及びAspergillus菌由来セロビアーゼ製剤(商品名:Novozym(登録商標) 188(EC 3.2.1.21)、ノボザイムズ社製)を用いた。また、ヘミセルラーゼとしては、Trichoderma菌由来キシラナーゼ製剤(EC 3.2.1.8)(シグマアルドリッチ社製)を用いた。
なお、表1に記載の値は、全て純分換算である。
【0078】
【表1】

【0079】
酵素糖化反応液1〜8を37℃の恒温室にて回転振とう機(15回転/分間)を用い24時間転倒振とうしてそれぞれ酵素糖化反応を行った。反応後の溶液を遠心分離し、得られた上澄み液中のグルコース濃度を、GOD−POD法(グルコースオキシダーゼ−ペルオキシダーゼ法)によるグルコースキット(商品名:グルコースCIIテストワコー、和光純薬工業株式会社製)を用いて測定し、実施例1のバイオマス原料1kg当たりのグルコース量(g)を算出した。結果を図1に示す。
【0080】
(比較例1−1)
実施例1のアンモニア処理物1を粉砕した試料を用い、実施例1の酵素糖化反応における酵素糖化反応液1〜8を、以下の方法で調製した酵素糖化反応液9に代えたこと以外は、実施例1と同一の操作により、比較例1−1のバイオマス原料1kg当たりのグルコース量(g)を算出した。
【0081】
酵素糖化反応液9は、実施例1で調製した酵素糖化反応液1〜8において、Trichoderma菌由来キシラナーゼ製剤を添加しないこと以外は、酵素糖化反応液1〜8と同一の操作にて調製した。
即ち、内容積1.5mLのマイクロチューブに、精秤した試料10mgを取り、試料濃度1%(wt/vol)、酵素として、Trichoderma菌由来セルラーゼ製剤(商品名:Celluclast(登録商標) 1.5L、ノボザイムズ社製)及びAspergillus菌由来セロビアーゼ製剤(商品名:Novozym(登録商標) 188、ノボザイムズ社製)を各酵素濃度0.01%(wt/vol)、合計0.02%(wt/vol)の酵素濃度となるように、50mM 酢酸緩衝液(pH4.5)を用いて酵素糖化反応液9を調製した。
【0082】
(比較例1−2)
実施例1で用いた粗粉砕したユーカリを、アンモニア処理することなく、実施例1におけるアンモニア処理後の試料を粉砕した操作と同一の操作にて粉砕を行った。
次いで、実施例1において、アンモニア処理物1を粉砕した試料に代えて、前記アンモニア処理することなく粉砕した試料を用いたこと以外は、実施例1と同一の操作により酵素糖化反応を行い、比較例1−2のバイオマス原料1kg当たりのグルコース量(g)を算出した。結果を図1に示す。
【0083】
(比較例1−3)
比較例1−2のアンモニア処理することなく粉砕した試料を用い、比較例1−2の酵素糖化反応における酵素糖化反応液1〜8に代えて、酵素糖化反応液9を用いたこと以外は、比較例1−2と同一の操作により、比較例1−3のバイオマス原料1kg当たりのグルコース量(g)を算出した。
【0084】
(実施例2)
実施例1において、バイオマス原料として用いたユーカリに代えて、エゾノキヌヤナギを使用したこと以外は、実施例1と同一の操作にて、粗粉砕処理、アンモニア処理、粉砕処理、及び酵素糖化反応を行い、実施例1と同一の操作により実施例2のバイオマス原料1kg当たりのグルコース量(g)を算出した。結果を図2に示す。
なお、実施例2においてアンモニア処理した処理物を「アンモニア処理物2」と称することがある。
【0085】
(比較例2−1)
実施例2のアンモニア処理物2を粉砕した試料を用い、実施例2の酵素糖化反応における酵素糖化反応液1〜8に代えて、酵素糖化反応液9を用いたこと以外は、実施例2と同一の操作により、比較例2−1のバイオマス原料1kg当たりのグルコース量(g)を算出した。
【0086】
(比較例2−2)
実施例2で用いた粗粉砕したエゾノキヌヤナギを、アンモニア処理することなく、実施例2におけるアンモニア処理後の試料を粉砕した操作と同一の操作にて粉砕を行った。
次いで、実施例2において、アンモニア処理物2を粉砕した試料に代えて、前記アンモニア処理することなく粉砕した試料を用いたこと以外は、実施例2と同一の操作により酵素糖化反応を行い、比較例2−2のバイオマス原料1kg当たりのグルコース量(g)を算出した。結果を図2に示す。
【0087】
(比較例2−3)
比較例2−2のアンモニア処理することなく粉砕した試料を用い、比較例2−2の酵素糖化反応における酵素糖化反応液1〜8に代えて、酵素糖化反応液9を用いたこと以外は、比較例2−2と同一の操作により、比較例2−3のバイオマス原料1kg当たりのグルコース量(g)を算出した。
【0088】
(実施例3)
実施例1において、バイオマス原料として用いたユーカリに代えて、サトウキビバガスを使用したこと以外は、実施例1と同一の操作にて、粗粉砕処理、アンモニア処理、粉砕処理、及び酵素糖化反応を行い、実施例1と同一の操作により実施例3のバイオマス原料1kg当たりのグルコース量(g)を算出した。結果を図3に示す。
なお、実施例3においてアンモニア処理した処理物を「アンモニア処理物3」と称することがある。
【0089】
(比較例3−1)
実施例3のアンモニア処理物3を粉砕した試料を用い、実施例3の酵素糖化反応における酵素糖化反応液1〜8に代えて、酵素糖化反応液9を用いたこと以外は、実施例3と同一の操作により、比較例3−1のバイオマス原料1kg当たりのグルコース量(g)を算出した。
【0090】
(比較例3−2)
実施例3で用いた粗粉砕したエゾノキヌヤナギを、アンモニア処理することなく、実施例3におけるアンモニア処理後の試料を粉砕した操作と同一の操作にて粉砕を行った。
次いで、実施例3において、アンモニア処理物3を粉砕した試料に代えて、前記アンモニア処理することなく粉砕した試料を用いたこと以外は、実施例3と同一の操作により酵素糖化反応を行い、比較例3−2のバイオマス原料1kg当たりのグルコース量(g)を算出した。結果を図3に示す。
【0091】
(比較例3−3)
比較例3−2のアンモニア処理することなく粉砕した試料を用い、比較例3−2の酵素糖化反応における酵素糖化反応液1〜8に代えて、酵素糖化反応液9を用いたこと以外は、比較例3−2と同一の操作により、比較例3−3のバイオマス原料1kg当たりのグルコース量(g)を算出した。
【0092】
(実施例4)
実施例1において、バイオマス原料として用いたユーカリに代えて、スイッチグラスを使用したこと以外は、実施例1と同一の操作にて、粗粉砕処理、アンモニア処理、粉砕処理、及び酵素糖化反応を行い、実施例1と同一の操作により実施例4のバイオマス原料1kg当たりのグルコース量(g)を算出した。結果を図4に示す。
なお、実施例4においてアンモニア処理した処理物を「アンモニア処理物4」と称することがある。
【0093】
(比較例4−1)
実施例4のアンモニア処理物4を粉砕した試料を用い、実施例4の酵素糖化反応における酵素糖化反応液1〜8に代えて、酵素糖化反応液9を用いたこと以外は、実施例4と同一の操作により、比較例4−1のバイオマス原料1kg当たりのグルコース量(g)を算出した。
【0094】
(比較例4−2)
実施例4で用いた粗粉砕したスイッチグラスを、アンモニア処理することなく、実施例4におけるアンモニア処理後の試料を粉砕した操作と同一の操作にて粉砕を行った。
次いで、実施例4において、アンモニア処理物4を粉砕した試料に代えて、前記アンモニア処理することなく粉砕した試料を用いたこと以外は、実施例4と同一の操作により酵素糖化反応を行い、比較例4−2のバイオマス原料1kg当たりのグルコース量(g)を算出した。結果を図4に示す。
【0095】
(比較例4−3)
比較例4−2のアンモニア処理することなく粉砕した試料を用い、比較例4−2の酵素糖化反応における酵素糖化反応液1〜8に代えて、酵素糖化反応液9を用いたこと以外は、比較例4−2と同一の操作により、比較例4−3のバイオマス原料1kg当たりのグルコース量(g)を算出した。
【0096】
実施例1〜4及び比較例1−1〜4−3において算出した、バイオマス原料1kg当たりのグルコース量(g)のうち、各酵素糖化反応において、酵素糖化反応液8(ヘミセルラーゼ/セルラーゼ=0.5)又は酵素糖化反応液9(セルラーゼ単独)を用いた場合のグルコース量を表2に示す。
また、酵素糖化反応を、酵素糖化反応液8(ヘミセルラーゼ/セルラーゼ=0.5)を用いて行った場合のバイオマス1kg当たりのグルコース量を「(a)」、酵素糖化反応液9(セルラーゼ単独)を用いて行った場合のバイオマス1kg当たりのグルコース量を「(b)」とし、セルラーゼ単独で酵素糖化反応を行った場合と比較して、セルラーゼとヘミセルラーゼとの併用により増加したグルコースの増加量を下記計算式(1)より算出した。
更に、酵素糖化反応は酵素糖化反応液8(ヘミセルラーゼ/セルラーゼ=0.5)を用いて行い、酵素糖化反応の前処理として、アンモニア処理を行った場合のバイオマス1kg当たりのグルコース量を「(c)」、アンモニア処理を行わなかった場合のバイオマス1kg当たりのグルコース量を「(d)」とし、アンモニア処理を行わなかった場合と比較して、アンモニア処理を行った場合に増加したグルコース増加量を下記計算式(2)より算出した。
セルラーゼ及びヘミセルラーゼの併用によるグルコースの増加量(g)=(a)−(b) ・・・計算式(1)
アンモニア処理の有無によるグルコース増加量(g)=(c)−(d) ・・・計算式(2)
【0097】
【表2】

【0098】
表2の結果から、セルラーゼ単独で酵素糖化反応を行った場合、及び、アンモニア処理を行わなかった場合と比較して、バイオマス原料をアンモニア処理した後に、更に粉砕し、セルラーゼ及びヘミセルラーゼを同時に作用させて酵素糖化反応を行うことにより酵素糖化効率が格段に向上することが示された。
また、図1〜図4の結果から、セルラーゼとヘミセルラーゼとの併用において、セルラーゼに対するヘミセルラーゼの質量比が高い程、産生されるグルコース量が多いことが示された。
【産業上の利用可能性】
【0099】
本発明の糖の製造方法、エタノールの製造方法、及び乳酸の製造方法によれば、糖の生産効率、エタノールの生産効率、及び乳酸の生産効率を格段に向上させることができる。したがって、本発明の糖の製造方法、エタノールの製造方法、及び乳酸の製造方法は、例えば、近年注目されている、環境に優しい燃料を産出することを目的としたバイオマス原料からのエタノール製造、また、環境に優しい生分解性プラスチックの製造などに好適に利用可能である。
【特許請求の範囲】
【請求項1】
(A)セルロースI型を含むバイオマス原料を、アンモニア及び有機アミンの少なくともいずれかを含む処理剤で処理することにより、改質バイオマス原料を得る工程、
(B)前記改質バイオマス原料を粉砕することにより、酵素糖化用原料を得る工程、及び、
(C)前記酵素糖化用原料を、セルラーゼ及びヘミセルラーゼを用いて酵素糖化させ、糖を得る工程、
を含むことを特徴とする糖の製造方法。
【請求項2】
工程(A)において用いる処理剤が、アンモニアである請求項1に記載の糖の製造方法。
【請求項3】
セルロースI型を含むバイオマス原料が、木質バイオマス及び草本バイオマスの少なくともいずれかである請求項1から2のいずれかに記載の糖の製造方法。
【請求項4】
ヘミセルラーゼとセルラーゼとの質量比(ヘミセルラーゼ/セルラーゼ)が、0.001〜0.5である請求項1から3のいずれかに記載の糖の製造方法。
【請求項5】
請求項1から4のいずれかに記載の糖の製造方法により得られた糖を、発酵させて、エタノールを得ることを特徴とするエタノールの製造方法。
【請求項6】
請求項1から4のいずれかに記載の糖の製造方法により得られた糖を、発酵させて、乳酸を得ることを特徴とする乳酸の製造方法。
【請求項1】
(A)セルロースI型を含むバイオマス原料を、アンモニア及び有機アミンの少なくともいずれかを含む処理剤で処理することにより、改質バイオマス原料を得る工程、
(B)前記改質バイオマス原料を粉砕することにより、酵素糖化用原料を得る工程、及び、
(C)前記酵素糖化用原料を、セルラーゼ及びヘミセルラーゼを用いて酵素糖化させ、糖を得る工程、
を含むことを特徴とする糖の製造方法。
【請求項2】
工程(A)において用いる処理剤が、アンモニアである請求項1に記載の糖の製造方法。
【請求項3】
セルロースI型を含むバイオマス原料が、木質バイオマス及び草本バイオマスの少なくともいずれかである請求項1から2のいずれかに記載の糖の製造方法。
【請求項4】
ヘミセルラーゼとセルラーゼとの質量比(ヘミセルラーゼ/セルラーゼ)が、0.001〜0.5である請求項1から3のいずれかに記載の糖の製造方法。
【請求項5】
請求項1から4のいずれかに記載の糖の製造方法により得られた糖を、発酵させて、エタノールを得ることを特徴とするエタノールの製造方法。
【請求項6】
請求項1から4のいずれかに記載の糖の製造方法により得られた糖を、発酵させて、乳酸を得ることを特徴とする乳酸の製造方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2011−160753(P2011−160753A)
【公開日】平成23年8月25日(2011.8.25)
【国際特許分類】
【出願番号】特願2010−29016(P2010−29016)
【出願日】平成22年2月12日(2010.2.12)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
【公開日】平成23年8月25日(2011.8.25)
【国際特許分類】
【出願日】平成22年2月12日(2010.2.12)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
[ Back to top ]

