糖ペプチド又は糖タンパク質の質量分析用液体マトリックス
【課題】糖ペプチド又は糖タンパク質を感度良く分析することができる質量分析用マトリックスを提供する。
【解決手段】3−アミノキノリンイオンとp−クマル酸イオンとを含むイオン液体である、糖ペプチド又は糖タンパク質の質量分析用マトリックス。好ましくは、3−アミノキノリンとp−クマル酸とを5:1〜20:1のモル比で混合して調製したものであり、混合されるべきp−クマル酸が99%以上の純度を有するものであり、リン酸アンモニウムを添加剤として用いるものであり、酸性糖を含む糖ペプチド又は糖タンパク質の測定のために用いられるものである。
【解決手段】3−アミノキノリンイオンとp−クマル酸イオンとを含むイオン液体である、糖ペプチド又は糖タンパク質の質量分析用マトリックス。好ましくは、3−アミノキノリンとp−クマル酸とを5:1〜20:1のモル比で混合して調製したものであり、混合されるべきp−クマル酸が99%以上の純度を有するものであり、リン酸アンモニウムを添加剤として用いるものであり、酸性糖を含む糖ペプチド又は糖タンパク質の測定のために用いられるものである。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、医療、制約、及びライフサイエンス分野に属する。本発明は、MALDI−MS(マトリックス支援レーザー脱離イオン化質量分析)アプリケーションに関する。より具体的には、本発明は、質量分析における糖ペプチド用又は糖タンパク質用液体マトリックスに関する。
【背景技術】
【0002】
特開2008−261824号公報(特許文献1)に、アミン(1,1,3,3−テトラメチルグアニジン)のイオンとp−クマル酸のイオンとを含むイオン液体(TMG/CA)をマトリックスとして用い、糖鎖を分析対象としたMALDI質量分析を行うことが記載されている。
【0003】
特開2009−257844号公報には、ペプチド用液体マトリックスである3-AQ/CHCA(3−アミノキノリンイオンとα−シアノ−4−ヒドロキシケイ皮酸とを含むイオン液体)と、糖鎖用液体マトリックスであるTMG/CA(1,1,3,3−テトラメチルグアニジンイオンとp−クマル酸イオンとを含むイオン液体)とを互いに混合して調製した混合液体マトリックスを用い、ペプチドと糖鎖との混合試料又はペプチドと糖ペプチドとの混合試料を分析対象としたMALDI質量分析を行うことが記載されている。より具体的には、ターゲットプレート上に前記の混合液体マトリックスと前記の混合試料との混合液滴を調製し、溶媒を除去するとともに、3-AQ/CHCAとTMG/CAとが分離して局在化した質量分析用スポットを形成し、スポットの中心部に局在したエリアにおいては3-AQ/CHCAによってイオン化されたペプチドを検出する一方、同じスポットの別の箇所である辺縁部に局在したエリアにおいてはTMG/CAによってイオン化された糖鎖又は糖ペプチドを検出することが記載されている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2008−261824号公報
【特許文献2】特開2009−257844号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
翻訳後修飾(post-translational modification (PTM))、とりわけ疾患関連炭化水素の質量分析法の改善が大いに望まれている。しかしながら、糖ペプチドに適当なマトリックスが不足しており、従来のマトリックスを用いた方法では糖ペプチドの分析感度が低いという問題がある。
本発明の目的は、糖ペプチド又は糖タンパク質を感度良く分析することができる質量分析用マトリックスを提供することにある。
【課題を解決するための手段】
【0006】
本発明者らは、鋭意検討の結果、3−アミノキノリンイオンとp−クマル酸イオンとを含むイオン液体が上記本発明の目的を達成し、且つシアル酸の脱離を抑制するという予期せぬ効果を生じさせることを見出し、本発明を完成するに至った。
【0007】
本発明は、以下の発明を含む。
(1)
3−アミノキノリンイオンとp−クマル酸イオンとを含むイオン液体である、糖ペプチド又は糖タンパク質の質量分析用液体マトリックス。
(2)
3−アミノキノリンとp−クマル酸とを5:1〜20:1のモル比で混合して調製したものである、(1)に記載の液体マトリックス。
(3)
前記混合されるべきp−クマル酸が99%以上の純度を有するものである、(2)
に記載の液体マトリックス。
(4)
リン酸アンモニウムを添加剤として用いる、(1)〜(3)のいずれかに記載の液体マトリックス。
(5)
酸性糖を含む糖ペプチド又は糖タンパク質を測定するために用いられる、(1)〜(4)のいずれかに記載の液体マトリックス。
(6)
前記酸性糖がシアル酸である、(5)に記載の液体マトリックス。
【発明の効果】
【0008】
本発明により、糖ペプチド及び糖タンパク質を感度良く分析することができる質量分析用マトリックスを提供することができる。
本発明により、シアル酸などの酸性糖を含む糖ペプチド及び糖タンパク質の分析において、酸性部位の脱落を抑制することができる。
【図面の簡単な説明】
【0009】
【図1】実施例で測定対象として用いた糖ペプチドGP1の構造を示す。
【図2】参考例3で得られた、3-AQ/CHCAを用いた場合のGP1の多段階質量分析によるマススペクトル(ポジティブモード)を示す。
【図3】実施例1で得られた、本発明の液体マトリックス3-AQ/CAを用いた場合のGP1のマススペクトル(ポジティブモード及びネガティブモード)を、DHBを用いた場合と比較して示す。
【図4】実施例3で得られた、本発明の液体マトリックス3-AQ/pCAを用いた場合のGP1(10amol)のマススペクトル(ネガティブモード)を示す。
【図5】実施例3で得られた、本発明の液体マトリックス3-AQ/pCAを用いた場合のGP1(10fmol)のマススペクトル(ポジティブモード及びネガティブモード)を、DHBを用いた場合と比較して示す。
【発明を実施するための形態】
【0010】
[1.液体マトリックス]
本発明は、質量分析用マトリックスとしてのイオン液体(すなわち液体マトリックス)である。イオン液体は、室温で液体の状態で存在し、その実態は塩である物質をいう。具体的には、アミンのイオンと酸性基含有物質のイオンとからなるものが挙げられる。本発明における液体マトリックスは、3−アミノキノリンイオンとp−クマル酸イオンとを含むイオン液体(3−AQ/CA)である。
【0011】
[2.測定対象]
本発明の液体マトリックスは、糖ペプチドの測定に用いられる。本発明においては、糖ペプチドには糖タンパク質も含まれる。本発明の液体マトリックスは、酸性糖を含む糖ペプチドの測定に用いられることが好ましい。酸性糖としては、硫酸基やカルボキシル基などの酸性基を有する糖であればよく、一例としてシアル酸が挙げられる。例えば、従来のマトリックスを用いてシアル酸を含む糖ペプチドを質量分析する場合、シアル酸が脱落することが通常であるが、本発明の液体マトリックスを用いてシアル酸を含む糖ペプチドを質量分析すると、シアル酸の脱落を抑制することができる。シアル酸以外の酸性糖を含む場合も同様である。
【0012】
[3.液体マトリックスの調製]
液体マトリックスの調製方法としては特に限定されるものではない。具体的な調製方法としては従来からのイオン液体の調製法に準じることができる。
例えば、もっとも簡便な調製法の一つとしては、イオン液体を構成するアミンイオンの由来元となるアミン類(具体的には3−アミノキノリン)と、酸性基含有物質イオンの由来元となる酸物質(具体的にはp−クマル酸)とを混合して反応させる方法が挙げられる。
【0013】
双方の物質を反応させるためには、p−クマル酸を3−アミノキノリンに加えても良いし、3−アミノキノリンをp−クマル酸に加えてもよい。双方の物質の反応は、溶媒中で行うことができる。そのため、3−アミノキノリン及びp−クマル酸の少なくとも一方を予め溶液として調製して、p−クマル酸を3−アミノキノリン溶液に加えてもよいし、3−アミノキノリンをp−クマル酸溶液に加えてもよい。或いは、溶媒に3−アミノキノリン及びp−クマル酸を同時に加えてもよい。
双方の物質の混合は、常温下で行うことができる。
【0014】
互いに反応させるべき3−アミノキノリンとp−クマル酸との比は、特に限定されないが、例えば、3−アミノキノリンとp−クマル酸とを、5:1〜20:1のモル比で混合
することができる。S/N比を考慮した場合、7:1〜9:1のモル比で混合することがより好ましい場合がある。
溶媒中どのような濃度で双方の物質を反応させるかについては、当業者が適宜決定すればよい。
【0015】
溶媒中で反応させた場合は、反応後、溶媒を除去することができる。溶媒の除去は、留去、好ましくは減圧下における留去によって行うことができる。溶媒の除去を行った後、液状の物質をイオン液体として得ることができる。
一方、反応に用いた溶媒を、マトリックス溶媒としても用いることができる場合は、溶媒を除去しなくともよい。
【0016】
通常試薬として販売されているp−クマル酸は、厳密に測定すると純度が96%程度であることが多い。本発明においては、通常試薬として販売されているp−クマル酸を精製するなどにより、99%以上、好ましくは99.8%以上の純度を有するものを用いることが、分析感度向上の観点から好ましい。市販のp−クマル酸を精製して用いる場合、精製方法としては特に限定されず、当業者が適宜精製方法を選択することができる。例えば、蒸留、再結晶などによって精製を行うことができる。p−クマル酸の純度の測定方法としては、高速液体クロマトグラフィー(HPLC)や、核磁気共鳴(NMR)などが挙げられる。
【0017】
[4.質量分析用スポットの形成]
本発明の液体マトリックスの使用においては、質量分析用プレート上に、液体マトリックスと糖ペプチド又は糖タンパク質とを含む混合溶液の液滴が形成され、溶媒が除去される(蒸発する)ことによって、レーザーが照射されるべき質量分析用スポットが形成される。
【0018】
液体マトリックスと糖ペプチド又は糖タンパク質とは、最終的に質量分析用プレート上で液滴を形成した時点で混合溶液の態様になっていればよい。液体マトリックスと糖ペプチド又は糖タンパク質とを含む混合溶液の液滴は、プレミックス(pre-mix)法又はオンターゲットミックス(on-target mix)法によって調製することができるが、プレミックス法によって調製されることが好ましい。
プレミックス法は、液体マトリックスと糖ペプチド又は糖タンパク質とを含む混合溶液を予め調製し、その混合溶液を質量分析用プレート上に滴下することによって、混合溶液の液滴を得る方法である。混合溶液は、液体マトリックス溶液と糖ペプチド溶液又は糖タンパク質溶液とを混合することによって得ることができる。それぞれの溶液は、例えば同体積混合することができる。
一方、オンターゲットミックス法は、液体マトリックス溶液と糖ペプチド溶液又は糖タンパク質溶液とを別々に調製し、それぞれを質量分析用プレート上の同じ位置に重ねて滴下することによって、混合溶液の液滴を得る方法である。
【0019】
溶媒としては、従来より用いられてきた溶媒を特に限定することなく用いることができる。例えば、アセトニトリル、メタノ−ル、エタノ−ルなどの有機溶剤を水中に含む水溶液が用いられうる。この水溶液中の有機溶剤の濃度は、例えば10〜90体積%、好ましくは30〜80体積%、更に好ましくは33〜75体積%、一例として50体積%である。
【0020】
液体マトリックスと糖ペプチド又は糖タンパク質との混合溶液の液滴中に含まれる液体マトリックスの量は、例えば、1nmol〜10μmol/μL、好ましくは10nmol〜1μmol/μLでありうる。一方、混合溶液の液滴中に含まれる糖ペプチド又は糖タンパク質の量は特に限定されないが、例えば、混合液滴1個あたり1amol〜10pmolとなるような量で許容される。
【0021】
本発明の液体マトリックスには、リン酸アンモニウムを添加剤として用いることが、分析感度向上の観点から好ましい。リン酸アンモニウムは、最終的に液体マトリックスと混合されればよく、例えば上記のマトリックス溶媒に溶解させて用いることができる。リン酸アンモニウムは、液体マトリックスと糖ペプチド又は糖タンパク質との混合溶液の液滴中、0.0.1mM〜100mM、好ましくは0.1〜10mM、一例として1mMの濃度で含まれるように用いられるとよい。
【0022】
なお、1個の質量分析用スポットを得るために使用する混合溶液の液滴は、0.1〜10μL、例えば1μLでありうる。
【0023】
質量分析用プレートとしては、通常MALDI質量分析に使用されるステンレス鋼ターゲットプレートなどや、化学的或いは物理的に表面処理がなされたターゲットプレートなど、さまざまなものを使用することができる。好ましくは、混合溶液から溶媒を効率的に除去し且つ良好な液体マトリックス−糖ペプチド(又は液体マトリックス−糖タンパク質)混合質量分析用スポットを得るために、中心部が親水性、辺縁部が疎水性となるように化学的表面処理されたウェルが形成されているものを用いることが好ましい。また、研磨処理や鏡面仕上げなど、処理プレート表面の表面粗さを所望の程度にする物理的表面処理がなされたものを用いることが好ましい。
【0024】
本発明の液体マトリックスを用いて使用される質量分析装置としては、MALDIイオン源と組み合わされたものであれば特に限定されない。例えば、MALDI-IT(マトリックス支援レーザー脱離イオン化−イオントラップ)型質量分析装置、MALDI-TOF(マトリックス支援レ−ザ−脱離イオン化-飛行時間)型質量分析装置、MALDI-IT-TOF(マトリックス支援レーザー脱離イオン化−イオントラップ−飛行時間)型質量分析装置、MALDI-QIT-TOF(マトリックス支援レ−ザ−脱離イオン化-四重極イオントラップ-飛行時間)型質量分析装置、MALDI-FTICR(マトリックス支援レーザー脱離イオン化−フーリエ変換イオンサイクロトロン共鳴)型質量分析装置などが挙げられる。
【実施例】
【0025】
以下に実施例を示し、本発明を具体的に説明するが、本発明は下記の実施例に制限されるものではない。
実施例においては、実験例1〜3において調製された液体マトリックスを用いた。実験例1では、リン酸アンモニウム不含且つ未精製p−クマル酸(CA)使用の3−AQ/CAを調製し、実験例2では、リン酸アンモニウム含有且つ未精製p−クマル酸(CA)の3−AQ/CAを調製し、実験例3では、リン酸アンモニウム含有且つ精製クマル酸(pCA)使用の3−AQ/pCAを調製した。
【0026】
[実験例1:3−AQ/CA溶液の調製]
3−アミノキノリン(3-AQ) 100nmol/μLを50(v/v)%アセトニトリル(ACN)水溶液中に含む3-AQ溶液と、p−クマル酸(CA) 100nmol/μLを50(v/v)%アセトニトリル(ACN)水溶液中に含むCA溶液とを混合することによって、3-AQ/CA溶液を調製した。あるいは、3−アミノキノリン(3-AQ) 100nmol/μLを100%メタノ−ル(MeOH)中に含む3-AQ溶液と、p−クマル酸(CA) 100nmol/μLを100%メタノ−ル(MeOH)中に含むCA溶液とを混合後、メタノ−ルを揮発させ、50(v/v)%アセトニトリル(ACN)水溶液中に溶解することによって、3-AQ/CA溶液を調製した。
なお、CAは、純度表示「>98%」(シグマ−アルドリッチ)のものを用いた(実際に純度を測定した結果、純度は96%であった)。
3-AQ溶液とCA溶液との混合比は、例えば1:1、3:1、又は9:1 (v/v)であった。
【0027】
上記調製法のほかに、3-AQをCAと例えば1:1、3:1、又は9:1(mol/mol)で混合し、50(v/v)%アセトニトリル(ACN)水溶液中に溶解させることによって3-AQ/CA溶液を調製してもよい。
【0028】
【化1】

【0029】
[実験例2:3−AQ/CA溶液(リン酸アンモニウム含有)の調製]
3−アミノキノリン(3-AQ) 100nmol/μL及びリン酸アンモニウム 2mMを50(v/v)%アセトニトリル(ACN)水溶液中に含む3-AQ溶液と、p−クマル酸(CA) 100nmol/μL及びリン酸アンモニウム 2mMを50(v/v)%アセトニトリル(ACN)水溶液中に含むCA溶液とを混合することによって、3-AQ/CA溶液(リン酸アンモニウム含有)を調製した。あるいは、3−アミノキノリン(3-AQ) 100nmol/μLを100%メタノ−ル(MeOH)中に含む3-AQ溶液と、p−クマル酸(CA) 100nmol/μLを100%メタノ−ル(MeOH)中に含むCA溶液とを混合後、メタノ−ルを揮発させ、リン酸アンモニウム 2mMを含む50(v/v)%アセトニトリル(ACN)水溶液中に溶解することによって、3-AQ/CA溶液(リン酸アンモニウム含有)を調製した。
【0030】
なお、CAは、純度表示「>98%」(シグマ−アルドリッチ)のものを用いた(実際に純度を測定した結果、純度は96%であった)。
3-AQ溶液とCA溶液との混合比は、例えば5:1、6:1、7:1、8:1、9:1、12:1、15:1、又は20:1 (v/v)であった。
【0031】
上記調製法のほかに、3-AQをCAと例えば5:1、6:1、7:1、8:1、9:1、12:1、15:1、又は20:1 (mol/mol)で混合し、リン酸アンモニウム 2mM 含有50(v/v)%アセトニトリル(ACN)水溶液中に溶解させることによって3-AQ/CA溶液(リン酸アンモニウム含有)を調製してもよい。
【0032】
[実験例3:3−AQ/pCA(リン酸アンモニウム含有、精製CA使用)溶液の調製]
3−アミノキノリン(3-AQ) 100nmol/μL及びリン酸アンモニウム 2mMを50(v/v)%アセトニトリル(ACN)水溶液中に含む3-AQ溶液と、精製p−クマル酸(pCA) 100nmol/μL及びリン酸アンモニウム 2mMを50(v/v)%アセトニトリル(ACN)水溶液中に含むpCA溶液とを混合することによって、3-AQ/pCA溶液(リン酸アンモニウム含有、精製CA使用)を調製した。
なお、pCAは、株式会社同仁化学研究所又は株式会社ナード研究所によって精製されたものを用いた(純度は99%以上、例えば99.8%以上であった)。
3-AQ溶液とpCA溶液との混合比は、例えば9:1(v/v)であった。
【0033】
上記調製法のほかに、3-AQをpCAと例えば9:1(mol/mol)で混合し、リン酸アンモニウム 2mM 含有50(v/v)%アセトニトリル(ACN)水溶液中に溶解させることによって3-AQ/pCA溶液(リン酸アンモニウム含有、精製CA使用)を調製してもよい。
【0034】
[参考例1:従来の液体マトリックス(3−AQ/CHCA等)溶液の調製]
(3−AQ/CHCA)
10 mg のα−シアノ−4−ヒドロキシケイ皮酸(CHCA)(再結晶、LaserBio labs)を、20mMリン酸アンモニウムを含有するアセトニトリル50(v/v)%水溶液600μLに溶解させ、CHCA溶液を得た。20mgの3−アミノキノリン(3-AQ)(≧99.0%、Fluka)をCHCA溶液150μLに溶解させ、さらに10倍希釈することによって、3-AQ/CHCA溶液を得た。
【0035】
(DHBB、CHCAB、G2CHCA、G3CA、GCA、IMTBA/DHB、及びDIEA/DHB)
DHBB(n-butylamine/DHB)、CHCAB (Fluka, 67336)(n-butylamine/CHCA)、G2CHCA(1,1,3,3-tetramethyl guanidine(TMG)/CHCA)、G3CA(TMG/ p-coumaric acid)、GCA、(TMG/ p-coumaric acid)、IMTBA/DHB(N-isopropyl-N-methyl-tertbutylamine/
DHB)、及びDIEA/DHB(N,N-diisopropylethylamine/DHB)については、市販のものを用いるか、上記3−AQ/CHCA、3−AQ/CA又は3−AQ/pCAの調製法に準じるか、或いは次の文献:Mank, M.; Stahl, B.; Boehm, G. Anal. Chem. 2004, 76, 2938-2950.(DHBB及びCHCABの場合)、Laremore, T. N.; Murugesan, S.; Park, T.-J.; Avci, F. Y.; Zagorevski, D. V.; Linhardt, R. J. Anal. Chem. 2006, 78, 1774-1779.(G2CHCAの場合)、Fukuyama, Y.; Nakaya, S.; Yamazaki, Y.; Tanaka, K. Anal. Chem. 2008, 80, 2171-2179.(G3CA及びGCAの場合)、及びCrank, J. A.; Armstrong, D. W. J. Am. Soc. Mass Spectrom. 2009, 20, 1790-1800.(IMTBA/DHB及びDIEA/DHBの場合)を参考にすることにより、適宜液体マトリックス溶液を調製した。
【0036】
[参考例2:DHB溶液の調製]
(600μm μFocus MALDI plateTM (Hudson Surface Technology, Inc. USA)用)
1mgの2,5−ジヒドロキシ安息香酸(DHB)(再結晶、LaserBio labs)をアセトニトリル50(v/v)%水溶液1mLに溶解させた。このようにして得られたDHB溶液は、測定に用いられた際、予めGP1溶液と混合し、その後、混合溶液を600μm μFocus MALDI plateTM上に滴下した(pre-mix法)。
【0037】
(sample plate 2.8mm ring×384 wellTM(SUS plate, 島津製作所)用)
10 mgの2,5−ジヒドロキシ安息香酸(DHB)をアセトニトリル50(v/v)%水溶液1mLに溶解させた。このようにして得られたDHB溶液は、測定に用いられた際、GP1溶液と混合されることなく、GP1溶液とは別々にsample plate 2.8mm ring×384 wellTM上の同じウェルに滴下された。両溶液は、プレート上(ウェル内)で互いに混合されることにより混合溶液となった(on-target mix法)。
【0038】
[参考例3:従来の液体マトリックス及びDHBを用いた糖ペプチド分析]
参考例1の液体マトリックス溶液及び参考例2の固体マトリックス(DHB)溶液を用いて、トランスフェリンから単離された糖ペプチドGP1(モノアイソトピック質量:3680.5)の質量分析を行った。図1に、GP1の構造を模式的に示す。
【0039】
2a〜200fmol/μLの糖ペプチドGP1を30(v/v)%アセトニトリル(ACN)−0.05(v/v)%トリフルオロ酢酸(TFA)水溶液中に含むGP1溶液を、前記ACN-TFA水溶液を用いた段階希釈により調製した。
参考例1で得られた液体マトリックス溶液及び参考例2で得られたDHB溶液のそれぞれと、上記GP1溶液とを、1:1(v/v)で混合し、混合溶液を得た(pre-mix法)。
上記混合溶液を、MALDI濃縮プレート(μFocus MALDI plate TM 600μm (Hudson Surface Technology, Inc. USA))上のそれぞれのウェル(well)に1μLずつ滴下した。
AXIMA Resonance(Shimadzu/Kratos, UK)のhigh massモード、ポジティブ(positive)及びネガティブ(negative)モードで計測を行った。
【0040】
なお、液体マトリックスを使用した例においては、液体マトリックス−GP1混合溶液中のリン酸アンモニウムの濃度は、1mMであった。
【0041】
MS計測の結果得られたGP1の検出限界を下記表に示す。表に示された中では、液体マトリックス3-AQ/CHCAを用いた場合が最も高感度の測定が可能であることが確認された。さらに、3-AQ/CHCAを用いた場合のGP1の多段階質量分析結果(ポジティブモード)を図2に示す。これらの結果が示すように、従来、ペプチド用マトリックスとして知られていた3-AQ/CHCAは、この参考例の条件下において使用されることによって、糖ペプチドの高感度測定が可能であること、及び、MSで高感度測定が可能であれば多段階MSの高感度測定(すなわち糖鎖配列及びペプチド配列の同定)も可能であることが確認された。
【0042】
【表1】

【0043】
[実施例1:3−AQ/CA(リン酸アンモニウム不含)を用いた糖ペプチド分析]
実験例1で調製された本発明の液体マトリックス(3-AQ/CA(リン酸アンモニウム不含))溶液を用いて、トランスフェリンから単離された糖ペプチドGP1(図1、モノアイソトピック質量:3680.5)の質量分析を行った。
【0044】
2a〜200fmol/μLの糖ペプチドGP1を30(v/v)%アセトニトリル(ACN)−0.05(v/v)%トリフルオロ酢酸(TFA)水溶液中に含むGP1溶液を、前記ACN-TFA水溶液を用いた段階希釈により調製した。
実験例1で得られた3-AQ/CA溶液(3-AQとCAとの比が1:1、3;1、及び9:1であるもの)それぞれと、上記GP1溶液とを、1:1(v/v)で混合し、混合溶液を得た(pre-mix法)。
上記混合溶液を、MALDI濃縮プレート(μFocus MALDI plate TM 600μm (Hudson Surface Technology, Inc. USA))上のそれぞれのウェル(well)に1μLずつ滴下した。
AXIMA Resonance(Shimadzu/Kratos, UK)のhigh massモード、ポジティブ(positive)及びネガティブ(negative)モードで計測を行った。
【0045】
計測の結果得られた3-AQ/CAの使用によるGP1の検出限界を下記表に示す。表に示されるように、本発明の液体マトリックス3-AQ/CHCAが、糖ペプチド検出用マトリックスとして有用な感度を達成したことが確認された。なお、S/N比を考慮した場合、3-AQとCAとの比が9:1である場合が、ポジティブ及びネガティブの両モードにおいて最も高感度であった。
【0046】
【表2】

【0047】
さらに、本発明の液体マトリックスによる計測の結果得られたマススペクトル(ポジティブモード及びネガティブモード)を、DHBを用いた場合と比較して図3に示す。図3に示されるように、本発明の液体マトリックス3-AQ/CAは、シアロ糖脱離を抑制する効果を明確に示した。
【0048】
[実施例2:3−AQ/CA(リン酸アンモニウム含有)を用いた糖ペプチド分析]
実験例2で調製された本発明の液体マトリックス(3-AQ/CA(リン酸アンモニウム含有))溶液を用いて、実施例1と同様の操作を行うことによって、トランスフェリンから単離された糖ペプチドGP1(図1、モノアイソトピック質量:3680.5)の質量分析を行った。
なお、本実施例において得られた3-AQ/CA溶液とGP1溶液との混合溶液中のリン酸アンモニウム濃度は、1mMであった。
【0049】
計測の結果得られた3-AQ/CA(リン酸アンモニウム含有)の使用によるGP1の検出限界を下記表に示す。表に示されるように、本発明の液体マトリックス3-AQ/CAは、リン酸アンモニウムを添加剤として併用することにより、添加剤をしない場合に比べてより高感度に糖ペプチドを検出できることが確認された。なお、S/N比を考慮した場合、3-AQとCAとの比が7:1〜9:1である場合が、ポジティブ及びネガティブの両モードにおいてとりわけ好適であった。
【0050】
【表3】

【0051】
また、GP1の検出限界について、上記の3-AQとCAとの比が9:1である態様を、参考例1の従来の液体マトリックス3-AQ/CHCA(リン酸アンモニウム使用)を使用した態様と参考例2の固体マトリックスDHBを使用した態様(いずれも参考例3に相当)と比較して下記表に示す。
【0052】
【表4】

【0053】
また、本実施例においても、実施例1と同様に本発明の液体マトリックスによるシアロ糖脱離抑制効果を確認した。すなわち、本発明の液体マトリックスを用いた測定によると、DHBを用いた場合に比べ、シアロ糖の脱離を抑制する効果が明確に示された。なお3-AQ/CHCAを用いた場合は、DHBと同様にシアロ糖脱離が起こった。あるいはシアロ糖脱離が若干抑制される現象が確認される場合もあったが、本発明のマトリックスを用いた場合ほどの明確なシアロ糖脱離抑制効果はなかった。
【0054】
なお、本発明の液体マトリックス3-AQ/CAは、3-AQ/CHCAと同等の高感度測定が可能であることから、参考例3と同様に、多段階MSの高感度測定も可能である。
【0055】
[実施例3:3−AQ/pCA(リン酸アンモニウム含有、精製CA使用)を用いた糖ペプチド分析]
実験例3で調製された本発明の液体マトリックス3−AQ/pCA(リン酸アンモニウム含有、精製CA使用)溶液を用いて、実施例2と同様の操作を行うことによって、トランスフェリンから単離された糖ペプチドGP1(図1、モノアイソトピック質量:3680.5)の質量分析を行った。
【0056】
計測の結果得られた3-AQ/pCA(リン酸アンモニウム含有、精製CA使用)の使用によるGP1の検出限界を下記表に示す。下記表においては、3-AQ/CA(リン酸アンモニウム含有、未精製CA使用)を使用した実施例2の態様と、DHBを使用した態様と比較して示した。
表に示されるように、本発明の液体マトリックスは、その調製の際に精製したCAを使用することで、ポジティブ及びネガティブの両モードにおいて、従来のマトリックスより高感度の糖ペプチド検出を可能にしたことが確認された。
【0057】
【表5】

【0058】
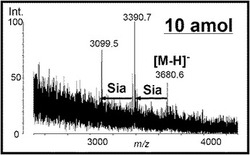
さらに、3-AQ/pCAを用いた計測の結果得られたマススペクトルを図4(GP1が10amolである場合;ネガティブモード)及び図5(GP1が10fmolである場合;ポジティブモード及びネガティブモード)に示す。図5については、DHBをマトリックスに用いた場合と比較して示した。
図4及び図5が示すように、本実施例においても、実施例1及び2と同様、本発明の液体マトリックスによるシアロ糖鎖(Sia)脱離抑制効果が確認された。
【0059】
なお、本発明の液体マトリックス3-AQ/pCA(精製CA使用)は、3-AQ/CHCAより高感度測定が可能であることから、参考例3よりも高感度に多段階MSの測定が可能である。
【技術分野】
【0001】
本発明は、医療、制約、及びライフサイエンス分野に属する。本発明は、MALDI−MS(マトリックス支援レーザー脱離イオン化質量分析)アプリケーションに関する。より具体的には、本発明は、質量分析における糖ペプチド用又は糖タンパク質用液体マトリックスに関する。
【背景技術】
【0002】
特開2008−261824号公報(特許文献1)に、アミン(1,1,3,3−テトラメチルグアニジン)のイオンとp−クマル酸のイオンとを含むイオン液体(TMG/CA)をマトリックスとして用い、糖鎖を分析対象としたMALDI質量分析を行うことが記載されている。
【0003】
特開2009−257844号公報には、ペプチド用液体マトリックスである3-AQ/CHCA(3−アミノキノリンイオンとα−シアノ−4−ヒドロキシケイ皮酸とを含むイオン液体)と、糖鎖用液体マトリックスであるTMG/CA(1,1,3,3−テトラメチルグアニジンイオンとp−クマル酸イオンとを含むイオン液体)とを互いに混合して調製した混合液体マトリックスを用い、ペプチドと糖鎖との混合試料又はペプチドと糖ペプチドとの混合試料を分析対象としたMALDI質量分析を行うことが記載されている。より具体的には、ターゲットプレート上に前記の混合液体マトリックスと前記の混合試料との混合液滴を調製し、溶媒を除去するとともに、3-AQ/CHCAとTMG/CAとが分離して局在化した質量分析用スポットを形成し、スポットの中心部に局在したエリアにおいては3-AQ/CHCAによってイオン化されたペプチドを検出する一方、同じスポットの別の箇所である辺縁部に局在したエリアにおいてはTMG/CAによってイオン化された糖鎖又は糖ペプチドを検出することが記載されている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2008−261824号公報
【特許文献2】特開2009−257844号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
翻訳後修飾(post-translational modification (PTM))、とりわけ疾患関連炭化水素の質量分析法の改善が大いに望まれている。しかしながら、糖ペプチドに適当なマトリックスが不足しており、従来のマトリックスを用いた方法では糖ペプチドの分析感度が低いという問題がある。
本発明の目的は、糖ペプチド又は糖タンパク質を感度良く分析することができる質量分析用マトリックスを提供することにある。
【課題を解決するための手段】
【0006】
本発明者らは、鋭意検討の結果、3−アミノキノリンイオンとp−クマル酸イオンとを含むイオン液体が上記本発明の目的を達成し、且つシアル酸の脱離を抑制するという予期せぬ効果を生じさせることを見出し、本発明を完成するに至った。
【0007】
本発明は、以下の発明を含む。
(1)
3−アミノキノリンイオンとp−クマル酸イオンとを含むイオン液体である、糖ペプチド又は糖タンパク質の質量分析用液体マトリックス。
(2)
3−アミノキノリンとp−クマル酸とを5:1〜20:1のモル比で混合して調製したものである、(1)に記載の液体マトリックス。
(3)
前記混合されるべきp−クマル酸が99%以上の純度を有するものである、(2)
に記載の液体マトリックス。
(4)
リン酸アンモニウムを添加剤として用いる、(1)〜(3)のいずれかに記載の液体マトリックス。
(5)
酸性糖を含む糖ペプチド又は糖タンパク質を測定するために用いられる、(1)〜(4)のいずれかに記載の液体マトリックス。
(6)
前記酸性糖がシアル酸である、(5)に記載の液体マトリックス。
【発明の効果】
【0008】
本発明により、糖ペプチド及び糖タンパク質を感度良く分析することができる質量分析用マトリックスを提供することができる。
本発明により、シアル酸などの酸性糖を含む糖ペプチド及び糖タンパク質の分析において、酸性部位の脱落を抑制することができる。
【図面の簡単な説明】
【0009】
【図1】実施例で測定対象として用いた糖ペプチドGP1の構造を示す。
【図2】参考例3で得られた、3-AQ/CHCAを用いた場合のGP1の多段階質量分析によるマススペクトル(ポジティブモード)を示す。
【図3】実施例1で得られた、本発明の液体マトリックス3-AQ/CAを用いた場合のGP1のマススペクトル(ポジティブモード及びネガティブモード)を、DHBを用いた場合と比較して示す。
【図4】実施例3で得られた、本発明の液体マトリックス3-AQ/pCAを用いた場合のGP1(10amol)のマススペクトル(ネガティブモード)を示す。
【図5】実施例3で得られた、本発明の液体マトリックス3-AQ/pCAを用いた場合のGP1(10fmol)のマススペクトル(ポジティブモード及びネガティブモード)を、DHBを用いた場合と比較して示す。
【発明を実施するための形態】
【0010】
[1.液体マトリックス]
本発明は、質量分析用マトリックスとしてのイオン液体(すなわち液体マトリックス)である。イオン液体は、室温で液体の状態で存在し、その実態は塩である物質をいう。具体的には、アミンのイオンと酸性基含有物質のイオンとからなるものが挙げられる。本発明における液体マトリックスは、3−アミノキノリンイオンとp−クマル酸イオンとを含むイオン液体(3−AQ/CA)である。
【0011】
[2.測定対象]
本発明の液体マトリックスは、糖ペプチドの測定に用いられる。本発明においては、糖ペプチドには糖タンパク質も含まれる。本発明の液体マトリックスは、酸性糖を含む糖ペプチドの測定に用いられることが好ましい。酸性糖としては、硫酸基やカルボキシル基などの酸性基を有する糖であればよく、一例としてシアル酸が挙げられる。例えば、従来のマトリックスを用いてシアル酸を含む糖ペプチドを質量分析する場合、シアル酸が脱落することが通常であるが、本発明の液体マトリックスを用いてシアル酸を含む糖ペプチドを質量分析すると、シアル酸の脱落を抑制することができる。シアル酸以外の酸性糖を含む場合も同様である。
【0012】
[3.液体マトリックスの調製]
液体マトリックスの調製方法としては特に限定されるものではない。具体的な調製方法としては従来からのイオン液体の調製法に準じることができる。
例えば、もっとも簡便な調製法の一つとしては、イオン液体を構成するアミンイオンの由来元となるアミン類(具体的には3−アミノキノリン)と、酸性基含有物質イオンの由来元となる酸物質(具体的にはp−クマル酸)とを混合して反応させる方法が挙げられる。
【0013】
双方の物質を反応させるためには、p−クマル酸を3−アミノキノリンに加えても良いし、3−アミノキノリンをp−クマル酸に加えてもよい。双方の物質の反応は、溶媒中で行うことができる。そのため、3−アミノキノリン及びp−クマル酸の少なくとも一方を予め溶液として調製して、p−クマル酸を3−アミノキノリン溶液に加えてもよいし、3−アミノキノリンをp−クマル酸溶液に加えてもよい。或いは、溶媒に3−アミノキノリン及びp−クマル酸を同時に加えてもよい。
双方の物質の混合は、常温下で行うことができる。
【0014】
互いに反応させるべき3−アミノキノリンとp−クマル酸との比は、特に限定されないが、例えば、3−アミノキノリンとp−クマル酸とを、5:1〜20:1のモル比で混合
することができる。S/N比を考慮した場合、7:1〜9:1のモル比で混合することがより好ましい場合がある。
溶媒中どのような濃度で双方の物質を反応させるかについては、当業者が適宜決定すればよい。
【0015】
溶媒中で反応させた場合は、反応後、溶媒を除去することができる。溶媒の除去は、留去、好ましくは減圧下における留去によって行うことができる。溶媒の除去を行った後、液状の物質をイオン液体として得ることができる。
一方、反応に用いた溶媒を、マトリックス溶媒としても用いることができる場合は、溶媒を除去しなくともよい。
【0016】
通常試薬として販売されているp−クマル酸は、厳密に測定すると純度が96%程度であることが多い。本発明においては、通常試薬として販売されているp−クマル酸を精製するなどにより、99%以上、好ましくは99.8%以上の純度を有するものを用いることが、分析感度向上の観点から好ましい。市販のp−クマル酸を精製して用いる場合、精製方法としては特に限定されず、当業者が適宜精製方法を選択することができる。例えば、蒸留、再結晶などによって精製を行うことができる。p−クマル酸の純度の測定方法としては、高速液体クロマトグラフィー(HPLC)や、核磁気共鳴(NMR)などが挙げられる。
【0017】
[4.質量分析用スポットの形成]
本発明の液体マトリックスの使用においては、質量分析用プレート上に、液体マトリックスと糖ペプチド又は糖タンパク質とを含む混合溶液の液滴が形成され、溶媒が除去される(蒸発する)ことによって、レーザーが照射されるべき質量分析用スポットが形成される。
【0018】
液体マトリックスと糖ペプチド又は糖タンパク質とは、最終的に質量分析用プレート上で液滴を形成した時点で混合溶液の態様になっていればよい。液体マトリックスと糖ペプチド又は糖タンパク質とを含む混合溶液の液滴は、プレミックス(pre-mix)法又はオンターゲットミックス(on-target mix)法によって調製することができるが、プレミックス法によって調製されることが好ましい。
プレミックス法は、液体マトリックスと糖ペプチド又は糖タンパク質とを含む混合溶液を予め調製し、その混合溶液を質量分析用プレート上に滴下することによって、混合溶液の液滴を得る方法である。混合溶液は、液体マトリックス溶液と糖ペプチド溶液又は糖タンパク質溶液とを混合することによって得ることができる。それぞれの溶液は、例えば同体積混合することができる。
一方、オンターゲットミックス法は、液体マトリックス溶液と糖ペプチド溶液又は糖タンパク質溶液とを別々に調製し、それぞれを質量分析用プレート上の同じ位置に重ねて滴下することによって、混合溶液の液滴を得る方法である。
【0019】
溶媒としては、従来より用いられてきた溶媒を特に限定することなく用いることができる。例えば、アセトニトリル、メタノ−ル、エタノ−ルなどの有機溶剤を水中に含む水溶液が用いられうる。この水溶液中の有機溶剤の濃度は、例えば10〜90体積%、好ましくは30〜80体積%、更に好ましくは33〜75体積%、一例として50体積%である。
【0020】
液体マトリックスと糖ペプチド又は糖タンパク質との混合溶液の液滴中に含まれる液体マトリックスの量は、例えば、1nmol〜10μmol/μL、好ましくは10nmol〜1μmol/μLでありうる。一方、混合溶液の液滴中に含まれる糖ペプチド又は糖タンパク質の量は特に限定されないが、例えば、混合液滴1個あたり1amol〜10pmolとなるような量で許容される。
【0021】
本発明の液体マトリックスには、リン酸アンモニウムを添加剤として用いることが、分析感度向上の観点から好ましい。リン酸アンモニウムは、最終的に液体マトリックスと混合されればよく、例えば上記のマトリックス溶媒に溶解させて用いることができる。リン酸アンモニウムは、液体マトリックスと糖ペプチド又は糖タンパク質との混合溶液の液滴中、0.0.1mM〜100mM、好ましくは0.1〜10mM、一例として1mMの濃度で含まれるように用いられるとよい。
【0022】
なお、1個の質量分析用スポットを得るために使用する混合溶液の液滴は、0.1〜10μL、例えば1μLでありうる。
【0023】
質量分析用プレートとしては、通常MALDI質量分析に使用されるステンレス鋼ターゲットプレートなどや、化学的或いは物理的に表面処理がなされたターゲットプレートなど、さまざまなものを使用することができる。好ましくは、混合溶液から溶媒を効率的に除去し且つ良好な液体マトリックス−糖ペプチド(又は液体マトリックス−糖タンパク質)混合質量分析用スポットを得るために、中心部が親水性、辺縁部が疎水性となるように化学的表面処理されたウェルが形成されているものを用いることが好ましい。また、研磨処理や鏡面仕上げなど、処理プレート表面の表面粗さを所望の程度にする物理的表面処理がなされたものを用いることが好ましい。
【0024】
本発明の液体マトリックスを用いて使用される質量分析装置としては、MALDIイオン源と組み合わされたものであれば特に限定されない。例えば、MALDI-IT(マトリックス支援レーザー脱離イオン化−イオントラップ)型質量分析装置、MALDI-TOF(マトリックス支援レ−ザ−脱離イオン化-飛行時間)型質量分析装置、MALDI-IT-TOF(マトリックス支援レーザー脱離イオン化−イオントラップ−飛行時間)型質量分析装置、MALDI-QIT-TOF(マトリックス支援レ−ザ−脱離イオン化-四重極イオントラップ-飛行時間)型質量分析装置、MALDI-FTICR(マトリックス支援レーザー脱離イオン化−フーリエ変換イオンサイクロトロン共鳴)型質量分析装置などが挙げられる。
【実施例】
【0025】
以下に実施例を示し、本発明を具体的に説明するが、本発明は下記の実施例に制限されるものではない。
実施例においては、実験例1〜3において調製された液体マトリックスを用いた。実験例1では、リン酸アンモニウム不含且つ未精製p−クマル酸(CA)使用の3−AQ/CAを調製し、実験例2では、リン酸アンモニウム含有且つ未精製p−クマル酸(CA)の3−AQ/CAを調製し、実験例3では、リン酸アンモニウム含有且つ精製クマル酸(pCA)使用の3−AQ/pCAを調製した。
【0026】
[実験例1:3−AQ/CA溶液の調製]
3−アミノキノリン(3-AQ) 100nmol/μLを50(v/v)%アセトニトリル(ACN)水溶液中に含む3-AQ溶液と、p−クマル酸(CA) 100nmol/μLを50(v/v)%アセトニトリル(ACN)水溶液中に含むCA溶液とを混合することによって、3-AQ/CA溶液を調製した。あるいは、3−アミノキノリン(3-AQ) 100nmol/μLを100%メタノ−ル(MeOH)中に含む3-AQ溶液と、p−クマル酸(CA) 100nmol/μLを100%メタノ−ル(MeOH)中に含むCA溶液とを混合後、メタノ−ルを揮発させ、50(v/v)%アセトニトリル(ACN)水溶液中に溶解することによって、3-AQ/CA溶液を調製した。
なお、CAは、純度表示「>98%」(シグマ−アルドリッチ)のものを用いた(実際に純度を測定した結果、純度は96%であった)。
3-AQ溶液とCA溶液との混合比は、例えば1:1、3:1、又は9:1 (v/v)であった。
【0027】
上記調製法のほかに、3-AQをCAと例えば1:1、3:1、又は9:1(mol/mol)で混合し、50(v/v)%アセトニトリル(ACN)水溶液中に溶解させることによって3-AQ/CA溶液を調製してもよい。
【0028】
【化1】

【0029】
[実験例2:3−AQ/CA溶液(リン酸アンモニウム含有)の調製]
3−アミノキノリン(3-AQ) 100nmol/μL及びリン酸アンモニウム 2mMを50(v/v)%アセトニトリル(ACN)水溶液中に含む3-AQ溶液と、p−クマル酸(CA) 100nmol/μL及びリン酸アンモニウム 2mMを50(v/v)%アセトニトリル(ACN)水溶液中に含むCA溶液とを混合することによって、3-AQ/CA溶液(リン酸アンモニウム含有)を調製した。あるいは、3−アミノキノリン(3-AQ) 100nmol/μLを100%メタノ−ル(MeOH)中に含む3-AQ溶液と、p−クマル酸(CA) 100nmol/μLを100%メタノ−ル(MeOH)中に含むCA溶液とを混合後、メタノ−ルを揮発させ、リン酸アンモニウム 2mMを含む50(v/v)%アセトニトリル(ACN)水溶液中に溶解することによって、3-AQ/CA溶液(リン酸アンモニウム含有)を調製した。
【0030】
なお、CAは、純度表示「>98%」(シグマ−アルドリッチ)のものを用いた(実際に純度を測定した結果、純度は96%であった)。
3-AQ溶液とCA溶液との混合比は、例えば5:1、6:1、7:1、8:1、9:1、12:1、15:1、又は20:1 (v/v)であった。
【0031】
上記調製法のほかに、3-AQをCAと例えば5:1、6:1、7:1、8:1、9:1、12:1、15:1、又は20:1 (mol/mol)で混合し、リン酸アンモニウム 2mM 含有50(v/v)%アセトニトリル(ACN)水溶液中に溶解させることによって3-AQ/CA溶液(リン酸アンモニウム含有)を調製してもよい。
【0032】
[実験例3:3−AQ/pCA(リン酸アンモニウム含有、精製CA使用)溶液の調製]
3−アミノキノリン(3-AQ) 100nmol/μL及びリン酸アンモニウム 2mMを50(v/v)%アセトニトリル(ACN)水溶液中に含む3-AQ溶液と、精製p−クマル酸(pCA) 100nmol/μL及びリン酸アンモニウム 2mMを50(v/v)%アセトニトリル(ACN)水溶液中に含むpCA溶液とを混合することによって、3-AQ/pCA溶液(リン酸アンモニウム含有、精製CA使用)を調製した。
なお、pCAは、株式会社同仁化学研究所又は株式会社ナード研究所によって精製されたものを用いた(純度は99%以上、例えば99.8%以上であった)。
3-AQ溶液とpCA溶液との混合比は、例えば9:1(v/v)であった。
【0033】
上記調製法のほかに、3-AQをpCAと例えば9:1(mol/mol)で混合し、リン酸アンモニウム 2mM 含有50(v/v)%アセトニトリル(ACN)水溶液中に溶解させることによって3-AQ/pCA溶液(リン酸アンモニウム含有、精製CA使用)を調製してもよい。
【0034】
[参考例1:従来の液体マトリックス(3−AQ/CHCA等)溶液の調製]
(3−AQ/CHCA)
10 mg のα−シアノ−4−ヒドロキシケイ皮酸(CHCA)(再結晶、LaserBio labs)を、20mMリン酸アンモニウムを含有するアセトニトリル50(v/v)%水溶液600μLに溶解させ、CHCA溶液を得た。20mgの3−アミノキノリン(3-AQ)(≧99.0%、Fluka)をCHCA溶液150μLに溶解させ、さらに10倍希釈することによって、3-AQ/CHCA溶液を得た。
【0035】
(DHBB、CHCAB、G2CHCA、G3CA、GCA、IMTBA/DHB、及びDIEA/DHB)
DHBB(n-butylamine/DHB)、CHCAB (Fluka, 67336)(n-butylamine/CHCA)、G2CHCA(1,1,3,3-tetramethyl guanidine(TMG)/CHCA)、G3CA(TMG/ p-coumaric acid)、GCA、(TMG/ p-coumaric acid)、IMTBA/DHB(N-isopropyl-N-methyl-tertbutylamine/
DHB)、及びDIEA/DHB(N,N-diisopropylethylamine/DHB)については、市販のものを用いるか、上記3−AQ/CHCA、3−AQ/CA又は3−AQ/pCAの調製法に準じるか、或いは次の文献:Mank, M.; Stahl, B.; Boehm, G. Anal. Chem. 2004, 76, 2938-2950.(DHBB及びCHCABの場合)、Laremore, T. N.; Murugesan, S.; Park, T.-J.; Avci, F. Y.; Zagorevski, D. V.; Linhardt, R. J. Anal. Chem. 2006, 78, 1774-1779.(G2CHCAの場合)、Fukuyama, Y.; Nakaya, S.; Yamazaki, Y.; Tanaka, K. Anal. Chem. 2008, 80, 2171-2179.(G3CA及びGCAの場合)、及びCrank, J. A.; Armstrong, D. W. J. Am. Soc. Mass Spectrom. 2009, 20, 1790-1800.(IMTBA/DHB及びDIEA/DHBの場合)を参考にすることにより、適宜液体マトリックス溶液を調製した。
【0036】
[参考例2:DHB溶液の調製]
(600μm μFocus MALDI plateTM (Hudson Surface Technology, Inc. USA)用)
1mgの2,5−ジヒドロキシ安息香酸(DHB)(再結晶、LaserBio labs)をアセトニトリル50(v/v)%水溶液1mLに溶解させた。このようにして得られたDHB溶液は、測定に用いられた際、予めGP1溶液と混合し、その後、混合溶液を600μm μFocus MALDI plateTM上に滴下した(pre-mix法)。
【0037】
(sample plate 2.8mm ring×384 wellTM(SUS plate, 島津製作所)用)
10 mgの2,5−ジヒドロキシ安息香酸(DHB)をアセトニトリル50(v/v)%水溶液1mLに溶解させた。このようにして得られたDHB溶液は、測定に用いられた際、GP1溶液と混合されることなく、GP1溶液とは別々にsample plate 2.8mm ring×384 wellTM上の同じウェルに滴下された。両溶液は、プレート上(ウェル内)で互いに混合されることにより混合溶液となった(on-target mix法)。
【0038】
[参考例3:従来の液体マトリックス及びDHBを用いた糖ペプチド分析]
参考例1の液体マトリックス溶液及び参考例2の固体マトリックス(DHB)溶液を用いて、トランスフェリンから単離された糖ペプチドGP1(モノアイソトピック質量:3680.5)の質量分析を行った。図1に、GP1の構造を模式的に示す。
【0039】
2a〜200fmol/μLの糖ペプチドGP1を30(v/v)%アセトニトリル(ACN)−0.05(v/v)%トリフルオロ酢酸(TFA)水溶液中に含むGP1溶液を、前記ACN-TFA水溶液を用いた段階希釈により調製した。
参考例1で得られた液体マトリックス溶液及び参考例2で得られたDHB溶液のそれぞれと、上記GP1溶液とを、1:1(v/v)で混合し、混合溶液を得た(pre-mix法)。
上記混合溶液を、MALDI濃縮プレート(μFocus MALDI plate TM 600μm (Hudson Surface Technology, Inc. USA))上のそれぞれのウェル(well)に1μLずつ滴下した。
AXIMA Resonance(Shimadzu/Kratos, UK)のhigh massモード、ポジティブ(positive)及びネガティブ(negative)モードで計測を行った。
【0040】
なお、液体マトリックスを使用した例においては、液体マトリックス−GP1混合溶液中のリン酸アンモニウムの濃度は、1mMであった。
【0041】
MS計測の結果得られたGP1の検出限界を下記表に示す。表に示された中では、液体マトリックス3-AQ/CHCAを用いた場合が最も高感度の測定が可能であることが確認された。さらに、3-AQ/CHCAを用いた場合のGP1の多段階質量分析結果(ポジティブモード)を図2に示す。これらの結果が示すように、従来、ペプチド用マトリックスとして知られていた3-AQ/CHCAは、この参考例の条件下において使用されることによって、糖ペプチドの高感度測定が可能であること、及び、MSで高感度測定が可能であれば多段階MSの高感度測定(すなわち糖鎖配列及びペプチド配列の同定)も可能であることが確認された。
【0042】
【表1】

【0043】
[実施例1:3−AQ/CA(リン酸アンモニウム不含)を用いた糖ペプチド分析]
実験例1で調製された本発明の液体マトリックス(3-AQ/CA(リン酸アンモニウム不含))溶液を用いて、トランスフェリンから単離された糖ペプチドGP1(図1、モノアイソトピック質量:3680.5)の質量分析を行った。
【0044】
2a〜200fmol/μLの糖ペプチドGP1を30(v/v)%アセトニトリル(ACN)−0.05(v/v)%トリフルオロ酢酸(TFA)水溶液中に含むGP1溶液を、前記ACN-TFA水溶液を用いた段階希釈により調製した。
実験例1で得られた3-AQ/CA溶液(3-AQとCAとの比が1:1、3;1、及び9:1であるもの)それぞれと、上記GP1溶液とを、1:1(v/v)で混合し、混合溶液を得た(pre-mix法)。
上記混合溶液を、MALDI濃縮プレート(μFocus MALDI plate TM 600μm (Hudson Surface Technology, Inc. USA))上のそれぞれのウェル(well)に1μLずつ滴下した。
AXIMA Resonance(Shimadzu/Kratos, UK)のhigh massモード、ポジティブ(positive)及びネガティブ(negative)モードで計測を行った。
【0045】
計測の結果得られた3-AQ/CAの使用によるGP1の検出限界を下記表に示す。表に示されるように、本発明の液体マトリックス3-AQ/CHCAが、糖ペプチド検出用マトリックスとして有用な感度を達成したことが確認された。なお、S/N比を考慮した場合、3-AQとCAとの比が9:1である場合が、ポジティブ及びネガティブの両モードにおいて最も高感度であった。
【0046】
【表2】

【0047】
さらに、本発明の液体マトリックスによる計測の結果得られたマススペクトル(ポジティブモード及びネガティブモード)を、DHBを用いた場合と比較して図3に示す。図3に示されるように、本発明の液体マトリックス3-AQ/CAは、シアロ糖脱離を抑制する効果を明確に示した。
【0048】
[実施例2:3−AQ/CA(リン酸アンモニウム含有)を用いた糖ペプチド分析]
実験例2で調製された本発明の液体マトリックス(3-AQ/CA(リン酸アンモニウム含有))溶液を用いて、実施例1と同様の操作を行うことによって、トランスフェリンから単離された糖ペプチドGP1(図1、モノアイソトピック質量:3680.5)の質量分析を行った。
なお、本実施例において得られた3-AQ/CA溶液とGP1溶液との混合溶液中のリン酸アンモニウム濃度は、1mMであった。
【0049】
計測の結果得られた3-AQ/CA(リン酸アンモニウム含有)の使用によるGP1の検出限界を下記表に示す。表に示されるように、本発明の液体マトリックス3-AQ/CAは、リン酸アンモニウムを添加剤として併用することにより、添加剤をしない場合に比べてより高感度に糖ペプチドを検出できることが確認された。なお、S/N比を考慮した場合、3-AQとCAとの比が7:1〜9:1である場合が、ポジティブ及びネガティブの両モードにおいてとりわけ好適であった。
【0050】
【表3】

【0051】
また、GP1の検出限界について、上記の3-AQとCAとの比が9:1である態様を、参考例1の従来の液体マトリックス3-AQ/CHCA(リン酸アンモニウム使用)を使用した態様と参考例2の固体マトリックスDHBを使用した態様(いずれも参考例3に相当)と比較して下記表に示す。
【0052】
【表4】

【0053】
また、本実施例においても、実施例1と同様に本発明の液体マトリックスによるシアロ糖脱離抑制効果を確認した。すなわち、本発明の液体マトリックスを用いた測定によると、DHBを用いた場合に比べ、シアロ糖の脱離を抑制する効果が明確に示された。なお3-AQ/CHCAを用いた場合は、DHBと同様にシアロ糖脱離が起こった。あるいはシアロ糖脱離が若干抑制される現象が確認される場合もあったが、本発明のマトリックスを用いた場合ほどの明確なシアロ糖脱離抑制効果はなかった。
【0054】
なお、本発明の液体マトリックス3-AQ/CAは、3-AQ/CHCAと同等の高感度測定が可能であることから、参考例3と同様に、多段階MSの高感度測定も可能である。
【0055】
[実施例3:3−AQ/pCA(リン酸アンモニウム含有、精製CA使用)を用いた糖ペプチド分析]
実験例3で調製された本発明の液体マトリックス3−AQ/pCA(リン酸アンモニウム含有、精製CA使用)溶液を用いて、実施例2と同様の操作を行うことによって、トランスフェリンから単離された糖ペプチドGP1(図1、モノアイソトピック質量:3680.5)の質量分析を行った。
【0056】
計測の結果得られた3-AQ/pCA(リン酸アンモニウム含有、精製CA使用)の使用によるGP1の検出限界を下記表に示す。下記表においては、3-AQ/CA(リン酸アンモニウム含有、未精製CA使用)を使用した実施例2の態様と、DHBを使用した態様と比較して示した。
表に示されるように、本発明の液体マトリックスは、その調製の際に精製したCAを使用することで、ポジティブ及びネガティブの両モードにおいて、従来のマトリックスより高感度の糖ペプチド検出を可能にしたことが確認された。
【0057】
【表5】

【0058】
さらに、3-AQ/pCAを用いた計測の結果得られたマススペクトルを図4(GP1が10amolである場合;ネガティブモード)及び図5(GP1が10fmolである場合;ポジティブモード及びネガティブモード)に示す。図5については、DHBをマトリックスに用いた場合と比較して示した。
図4及び図5が示すように、本実施例においても、実施例1及び2と同様、本発明の液体マトリックスによるシアロ糖鎖(Sia)脱離抑制効果が確認された。
【0059】
なお、本発明の液体マトリックス3-AQ/pCA(精製CA使用)は、3-AQ/CHCAより高感度測定が可能であることから、参考例3よりも高感度に多段階MSの測定が可能である。
【特許請求の範囲】
【請求項1】
3−アミノキノリンイオンとp−クマル酸イオンとを含むイオン液体である、糖ペプチド又は糖タンパク質の質量分析用液体マトリックス。
【請求項2】
3−アミノキノリンとp−クマル酸とを5:1〜20:1のモル比で混合して調製したものである、請求項1に記載の液体マトリックス。
【請求項3】
前記混合されるべきp−クマル酸が99%以上の純度を有するものである、請求項2に記載の液体マトリックス。
【請求項4】
リン酸アンモニウムを添加剤として用いる、請求項1〜3のいずれか1項に記載の液体マトリックス。
【請求項5】
酸性糖を含む糖ペプチド又は糖タンパク質を測定するために用いられる、請求項1〜4のいずれか1項に記載の液体マトリックス。
【請求項6】
前記酸性糖がシアル酸である、請求項5に記載の液体マトリックス。
【請求項1】
3−アミノキノリンイオンとp−クマル酸イオンとを含むイオン液体である、糖ペプチド又は糖タンパク質の質量分析用液体マトリックス。
【請求項2】
3−アミノキノリンとp−クマル酸とを5:1〜20:1のモル比で混合して調製したものである、請求項1に記載の液体マトリックス。
【請求項3】
前記混合されるべきp−クマル酸が99%以上の純度を有するものである、請求項2に記載の液体マトリックス。
【請求項4】
リン酸アンモニウムを添加剤として用いる、請求項1〜3のいずれか1項に記載の液体マトリックス。
【請求項5】
酸性糖を含む糖ペプチド又は糖タンパク質を測定するために用いられる、請求項1〜4のいずれか1項に記載の液体マトリックス。
【請求項6】
前記酸性糖がシアル酸である、請求項5に記載の液体マトリックス。
【図3】


【図4】


【図5】


【図1】


【図2】




【図4】


【図5】


【図1】


【図2】


【公開番号】特開2012−251914(P2012−251914A)
【公開日】平成24年12月20日(2012.12.20)
【国際特許分類】
【出願番号】特願2011−125862(P2011−125862)
【出願日】平成23年6月3日(2011.6.3)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2011年4月15日 ASMS(American Society for Mass Spectrometry)の59th ASMS Conference on Mass Spectrometryのウェブサイトhttp://www.asms.org/tabid/225/type/searchresults/Default.aspxを通じて発表
【出願人】(000001993)株式会社島津製作所 (3,708)
【Fターム(参考)】
【公開日】平成24年12月20日(2012.12.20)
【国際特許分類】
【出願日】平成23年6月3日(2011.6.3)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2011年4月15日 ASMS(American Society for Mass Spectrometry)の59th ASMS Conference on Mass Spectrometryのウェブサイトhttp://www.asms.org/tabid/225/type/searchresults/Default.aspxを通じて発表
【出願人】(000001993)株式会社島津製作所 (3,708)
【Fターム(参考)】
[ Back to top ]

