糖ペプチド解析方法及び解析装置
【課題】N末端アミノ酸残基がグルタミンやカルバミドメチル化したシステインである場合、優先的な環化によってNH3やH2Oが脱離するためにm/zずれが生じてペプチド同定が困難になる。本発明はこのようなN-結合型糖ペプチドに対しても高い精度でペプチドを同定することを目的とする。
【解決手段】MS2スペクトルに現れる糖鎖組成を示すピーク列についてデノボシーケンス処理を実施する際に、そのピークの1つとMS2プリカーサとの質量電荷比差からNH3又はH2O脱離によるm/zずれの有無を推定する(S4、S5)。さらに、MS2スペクトル上のN-結合型糖ペプチドに特徴的なトリプレットピークとMS1スペクトル上のトリプレットピークとの質量電荷比差からも同様のm/zずれの有無を推定する(S6、S7)。N末端アミノ酸残基の環化ありと判断されたならば、それをデータベース検索の際の検索条件の1つとすることでペプチドの同定精度を高める。
【解決手段】MS2スペクトルに現れる糖鎖組成を示すピーク列についてデノボシーケンス処理を実施する際に、そのピークの1つとMS2プリカーサとの質量電荷比差からNH3又はH2O脱離によるm/zずれの有無を推定する(S4、S5)。さらに、MS2スペクトル上のN-結合型糖ペプチドに特徴的なトリプレットピークとMS1スペクトル上のトリプレットピークとの質量電荷比差からも同様のm/zずれの有無を推定する(S6、S7)。N末端アミノ酸残基の環化ありと判断されたならば、それをデータベース検索の際の検索条件の1つとすることでペプチドの同定精度を高める。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、糖鎖修飾を受けたタンパク質又はペプチドの構造を質量分析を用いて解析する解析方法、及び該方法を利用した解析装置に関する。
【背景技術】
【0002】
生体を構成するタンパク質の半分以上は糖鎖修飾を受けていると言われており、糖鎖修飾はタンパク質の構造や機能の調節に重要な役割を果たしている。また、近年の研究により、免疫疾患などの各種疾患と糖鎖構造異常や糖化異常との関連性も明らかになってきている。こうしたことから、糖タンパク質や糖ペプチドの構造解析は、生命科学や医療、医薬品開発など様々な分野において非常に重要になっている。近年の質量分析装置の性能向上により、質量分析、特に多段階の解離操作を伴うMSn分析はタンパク質解析における主要な手法の1つになっているものの、一般に、糖タンパク質の解析は修飾を受けていないタンパク質の解析に比べてかなり困難であり、その解析手法は未だ研究途上である。
【0003】
糖タンパク質の解析において取得したい情報は主に、ペプチドのアミノ酸配列、糖鎖構造、及び糖鎖結合部位である。従来一般的な糖タンパク質解析手法は次のとおりである(非特許文献1参照)。
【0004】
まず目的の糖タンパク質を酵素消化することにより糖ペプチドを含む被検試料を調製し、この被検試料に対するMS(=MS1)分析を実行してMS1スペクトルを取得する。このMS1スペクトルに現れているピークに対し所定の基準に従って糖ペプチド由来であると推定されるピークを選定し、そのピークに対応したイオンをプリカーサイオンとして被検試料に対するMS/MS(=MS2)分析を実行してMS2スペクトルを取得する。
【0005】
N-結合型糖ペプチドの場合、MS2スペクトルには所定の質量電荷比間隔で並ぶ3つのピーク(以下、「トリプレットピーク」という)が特徴的に現れる。具体的には、低質量電荷比側から、全ての糖鎖が脱離したペプチドイオン、糖HexNAcの環開裂により生じた0,2X(83Da)付加ペプチドイオン、HexNAc(203Da)付加ペプチドイオン、に対応する3本のピークである。そこで一般的には、このトリプレットイオンをプリカーサイオンとしてMS3分析を行うことによりペプチド及び糖鎖結合部位を同定する。また、このトリプレットピークと質量電荷比の一致するトリプレットピークがMS1スペクトル中に見られた場合には、一致したイオンをそれぞれ疑似的なMS3プリカーサイオンとして選択し MS2分析(擬似MS3分析)を行うことも、高感度で迅速なペプチド及び糖鎖結合部位同定を目的として行われている。
【0006】
またN-結合型糖ペプチドのMS2スペクトルに対し、上述のトリプレットピークからMS2プリカーサイオンまでの間において糖のニュートラルロスにより得られたプロダクトイオン列をデノボ(de novo)シーケンシングにより帰属することによって、MS2プリカーサイオンの糖鎖組成を調べることも行われている。具体的な手法としては、カナダ国バイオインフォマティクス・ソリューションズ(Bioinformatic Solutions)社が提供するピークス(PEAKSTM)などの解析ソフトウエアが知られている。
【0007】
ところで、非特許文献2〜4などによれば、N末端にグルタミン(Gln)やグルタミン酸(Glu)、カルバミドメチル化したシステイン(Cys)が位置するペプチドについて衝突誘起解離(CID)を伴うMS2分析を行うと、マトリクス支援脱離レーザイオン化(MALDI)質量分析でよく観測される1価イオンにおいてはN末端の環化に由来するアンモニア(NH3)又は水(H2O)のニュートラルロス(−17Da又は−18Da)が生じ、しかもこのニュートラルロスはペプチドの主鎖におけるどのアミノ酸の開裂に比べても優先的に生じることが知られている。
【0008】
糖ペプチドのMS2スペクトルでは糖又はアミノ酸からのNH3やH2Oのニュートラルロスが頻繁に観測されるが、一般に、NH3やH2Oのニュートラルロスが生じた箇所を事前に特定することは困難である。そのため、NH3やH2Oのニュートラルロスにより生じたプロダクトイオンをMS3分析のプリカーサイオンとして選択してMS3スペクトルを取得しても、タンパク質データベースを用いたデータベース検索の検索条件として適切な修飾条件を設定することができず、ペプチドの同定精度を上げることは困難である。また、糖ペプチドに対する糖のニュートラルロスで生じたプロダクトイオンに基づいて糖鎖組成や糖鎖構造を推定する際に、プロダクトイオンからのNH3やH2Oの脱離を仮定したとしても、糖鎖組成や糖鎖構造の推定誤りがしばしば発生してしまう。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】中家、「複合糖質解析−質量分析計の有用性−」、島津評論、島津評論編集部、第66巻、第3・4号、2010年3月31日、p.173-184
【非特許文献2】バルドウィン(Baldwin)、ほか5名、「タンデム・マス・スペクトロメトリ・オブ・ペプタイズ・ウィズ・エヌ-ターミナル・グルタミン・スタディーズ・オン・ア・プリオン・プロテイン・ペプタイド(Tandem Mass Spectrometry of Peptides with N-Terminal Glutamine Studies on a Prion Protein Peptide)」、ジャーナル・オブ・アメリカン・ソサイエティ・フォー・マス・スペクトロメトリ(J. Am. Soc. Mass Spectrom.)、1990年、1、p.258-264
【非特許文献3】ネタ(Neta)、ほか4名、「デハイドレイション・バーサス・デアミネイション・オブ・エヌ-ターミナル・グルタミン・イン・コリジョン-インデュースド・ディソシエイション・オブ・ア・プロトネイテッド・ペプタイズ(Dehydration Versus Deamination of N-Terminal Glutamine in Collision-Induced Dissociation of Protonated Peptides)」、ジャーナル・オブ・アメリカン・ソサイエティ・フォー・マス・スペクトロメトリ(J. Am. Soc. Mass Spectrom.)、2007年、18、p.27-36
【非特許文献4】ハリソン(Harrison)、「フラグメンテイション・リアクションズ・オブ・プロトネイテッド・ペプタイズ・コンテイニング・グルタミン・オア・グルタミン・アシッド(Fragmentation reactions of protonated peptides containing glutamine or glutamic acid)」、ジャーナル・オブ・アメリカン・ソサイエティ・フォー・マス・スペクトロメトリ(J. Am. Soc. Mass Spectrom.)、2003年、38、p.174-187
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明は上記課題に鑑みて成されたものであり、その目的とするところは、糖ペプチドのN末端アミノ酸残基に環化による質量電荷比ずれが発生したような場合であっても、MSn分析結果に基づくペプチド同定の精度を向上させることができる糖ペプチド解析方法及び解析装置を提供することである。
【課題を解決するための手段】
【0011】
上述のように、糖ペプチドのMS2分析において配列依存的なN末端の環化が優先的に生じたと推定される場合には、MS2スペクトルにおいて質量電荷比ずれの生じたトリプレットピークを構成する少なくとも1つのイオンをプリカーサイオンとして選択した上でMS3分析を実行してMS3スペクトルを取得し、N末端配列にグルタミン酸(Glu)、グルタミン(Gln)又はカルバミドメチル化したシステイン(Cys)が存在すると仮定してデータベース検索を行い、ペプチドを同定したほうが効率的であると考えられる。また、MS2スペクトル解析においても、ペプチドのN末端において環化が生じたことが推定される場合には、糖ペプチドから糖のニュートラルロスで生じたプロダクトイオンについて、ペプチドのN末端アミノ酸残基においてNH3又はH2Oの脱離による質量電荷比ずれが生じたものとした上で当該プロダクトイオンの帰属を試みることで、糖鎖組成や糖鎖構造に関する正確な情報を得られる可能性を高めることができると考えられる。こうしたことから、本願発明者は、MS2分析結果から配列依存的な環化が生じたか否かを効果的に且つ高い精度で判別した上で、そうした特定の環化が生じている場合には、それを条件としたペプチド同定や糖鎖構造解析を行うことに想到した。
【0012】
上記課題を解決するために成された第1発明は、nが1〜3であるMSn分析を実行可能な質量分析装置を利用して、被検試料中のN-結合型糖ペプチドの構造を解析する糖ペプチド解析方法であって、
a)被検試料をMS1分析して得られたMS1スペクトルに現れる糖ペプチド由来のイオンをプリカーサイオンとして選定するMS2プリカーサ選定ステップと、
b)前記被検試料に対し前記MS2プリカーサ選定ステップにおいて選定されたプリカーサイオンに関するMS2分析を実行してMS2スペクトルを取得するMS2分析実行ステップと、
c)前記MS2スペクトル上で特定質量電荷比の差を有して並ぶプロダクトトイオンピーク列に対しデノボシーケンス処理を適用して各ピークに対応したプロダクトイオンの帰属を行いつつ、該デノボシーケンンス処理により帰属されたピークのうち最も大きな質量電荷比をもつプロダクトイオンとプリカーサイオンとの質量電荷比の差に生じる特定の質量電荷比ずれを検出することにより、N末端の特定アミノ酸残基の環化の存在を推定するN末端環化検出ステップと、
d)N-結合型糖ペプチドのMS2スペクトルに特徴的に観測されるトリプレットピークを前記MS2分析実行ステップで取得されたMS2スペクトル上で検出し、該トリプレットピークを構成する少なくとも1つのイオンをMS3分析のプリカーサイオンとして選定するMS3プリカーサ選定ステップと、
e)前記被検試料に対し前記MS3プリカーサ選定ステップにおいて選定されたプリカーサイオンに関するMS3分析を実行してMS3スペクトルを取得するMS3分析実行ステップと、
f)前記N末端環化検出ステップにおいてN末端の特定アミノ酸残基の環化が存在すると推定された場合にN末端特定アミノ酸残基の環化を修飾条件とし、前記MS3分析実行ステップにより取得されたMS3スペクトルにおいて検出されるイオンピークの情報に基づくデータベース検索を実行して、目的とする糖ペプチドのペプチドを同定する同定処理ステップと、
を有することを特徴としている。
【0013】
また上記課題を解決するために成された第2発明は、上記第1発明に係る糖ペプチド解析方法を具現化する装置であって、nが1〜3であるMSn分析を実行可能な質量分析装置を利用して、被検試料中のN-結合型糖ペプチドの構造を解析する糖ペプチド解析装置において、
a)被検試料に対しMS1分析を実行してMS1スペクトルを取得するべく前記質量分析装置の動作を制御するMS1分析実行制御手段と
b)前記MS1スペクトルに現れる糖ペプチド由来のイオンをプリカーサイオンとして選定するMS2プリカーサ選定手段と、
c)前記被検試料に対し前記MS2プリカーサ選定手段により選定されたプリカーサイオンに関するMS2分析を実行してMS2スペクトルを取得するべく前記質量分析装置の動作を制御するMS2分析実行制御手段と、
d)前記MS2スペクトル上で特定質量電荷比の差を有して並ぶプロダクトトイオンピーク列に対しデノボシーケンス処理を適用して各ピークに対応したプロダクトイオンの帰属を行いつつ、該デノボシーケンンス処理により帰属されたピークのうち最も大きな質量電荷比をもつプロダクトイオンとプリカーサイオンとの質量電荷比の差に生じる特定の質量電荷比ずれを検出することにより、N末端の特定アミノ酸残基の環化の存在を推定するN末端環化検出手段と、
e)N-結合型糖ペプチドのMS2スペクトルに特徴的に観測されるトリプレットピークを被検試料に対して取得された前記MS2スペクトル上で検出し、該トリプレットピークを構成する少なくとも1つのイオンをMS3分析のプリカーサイオンとして選定するMS3プリカーサ選定手段と、
f)前記被検試料に対し前記MS3プリカーサ選定手段により選定されたプリカーサイオンに関するMS3分析を実行してMS3スペクトルを取得するべく前記質量分析装置の動作を制御するMS3分析実行制御手段と、
g)前記N末端環化検出手段においてN末端の特定アミノ酸残基の環化が存在すると推定された場合にN末端特定アミノ酸残基の環化を修飾条件とし、被検試料に対して取得された前記MS3スペクトルにおいて検出されるイオンピークの情報に基づくデータベース検索を実行して、目的とする糖ペプチドのペプチドを同定する同定処理手段と、
を備えることを特徴としている。
【0014】
第1発明に係る糖ペプチド解析方法において、N末端環化検出ステップでは、例えば、MS2スペクトル上でトリプレットピークのうちの1本のピーク、例えば最も質量電荷比が大きいイオンピークを開始点としMS2プリカーサイオンピークを終了点として、その間に存在するプロダクトトイオンピーク列について隣接するピーク間の質量電荷比の差を順次調べ、その質量電荷比差に相当する糖の脱離成分をデノボシーケンス処理により数理的に推定することで各ピークに対応したプロダクトイオン又はニュートラルロスの帰属を行ってゆき、帰属できたプロダクトイオンのうち最も大きな質量電荷比をもつプロダクトイオンピークを得る。CID等の解離操作の過程でN末端の環化によるNH3やH2Oなどのニュートラルロスが生じると、MS2プリカーサイオンピークと該最も大きな質量電荷比をもつプロダクトイオンとの間の質量電荷比の差に相当する糖のニュートラルロスが見つからず帰属ができなくなる。一方、MS2プリカーサイオンに対して特定の質量電荷比差Δm(17Da又は18Da)だけ低質量電荷比側にシフトした仮想MS2プリカーサイオンをデノボシーケンス処理の終了点として糖のニュートラルロスの帰属が可能であれば、即ち、上記最も大きな質量電荷比をもつプロダクトイオンを仮想MS2プリカーサイオンからの糖のニュートラルロスとして帰属することができれば、これは糖ではなく、ペプチドイオンにおけるN末端の特定アミノ酸残基の環化による質量電荷比ずれである可能性が高いと推定する。
【0015】
このようにしてN末端特定アミノ酸残基の環化が生じていることが高い確度で推定できたならば、MS3スペクトルのピーク情報を利用してデータベース検索によりペプチドを同定する際に、N末端特定アミノ酸残基の環化を検索のための修飾条件の1つとして設定すればよい。これにより、データベース検索の検索範囲がかなり絞り込まれるため、ペプチド同定の精度向上を図ることができる。また、N末端環化検出ステップでは、トリプレットピークとMS2プリカーサイオンピークとの間でN末端特定アミノ酸残基の環化の存在を仮定したニュートラルロスの帰属が実施されるので、糖鎖組成や糖鎖構造の推定精度も向上させることができる。
【0016】
なお、上記N-結合型糖ペプチドのMS2スペクトルに特徴的に観測されるトリプレットピークとは、典型的には、質量電荷比が小さい方から83Da、120Daの質量電荷比差で並ぶ3つのピークである。この3つのピークは、全ての糖鎖が脱離したペプチドイオン、糖HexNAcの環開裂により生じた0,2X(83Da)付加ペプチドイオン、HexNAc付加ペプチドイオンに相当する。
【0017】
また、糖ペプチドをMS1分析する際には、インソース分解等により擬似MS2分析が行われてしまい、MS1スペクトルに上記のような特定の質量電荷比差をもったトリプレットピークが観測されることがある。こうした場合、一般的にMS1スペクトルに現れるトリプレットピークの強度はMS2スペクトルに現れるトリプレットピークの強度よりも大きい。そこで、MS1スペクトルに現れるトリプレットピークを擬似MS3プリカーサイオンとして選定し、該プリカーサイオンに関するMS2分析(擬似MS3分析)を実行することで擬似MS3スペクトルを取得し、この擬似MS3スペクトルのピーク情報を通常のMS3スペクトルのピーク情報と同じようにデータベース検索に供することにより、より精度の高いペプチド同定が行える可能性がある。
【0018】
即ち、第1発明に係る糖ペプチド解析方法は、好ましくは、
前記MS2スペクトル上で検出されたトリプレットピークに対し前記N末端環化検出ステップで求まった特定の質量電荷比ずれを加えたトリプレットピークが、前記MS1スペクトル中に検出されるか否かを判別し、トリプレットピークが検出された場合にこれを疑似的なMS3プリカーサイオンとして選定する疑似MS3プリカーサ選定ステップと、
前記被検試料に対し前記擬似MS3プリカーサ選定ステップにおいて選定された擬似MS3プリカーサイオンに関する擬似MS3分析を実行して擬似MS3スペクトルを取得する擬似MS3分析実行ステップと、をさらに有し、
前記同定処理ステップでは、前記N末端環化検出ステップにおいてN末端の特定アミノ酸残基の環化が存在すると推定された場合にN末端特定アミノ酸残基の環化を修飾条件とし、前記擬似MS3分析実行ステップにより取得された擬似MS3スペクトルにおいて検出されるイオンピークの情報に基づくデータベース検索を実行して、目的とする糖ペプチドのペプチドを同定するようにするとよい。
【0019】
また、第1発明に係る糖ペプチド解析方法及び第2発明に係る糖ペプチド解析装置において実施されるN末端特定アミノ酸残基環化の推定処理は十分に高い推定精度を有しているものの、さらに別の観点からの推定を加えることにより、その推定精度を一層高めることが可能である。
【0020】
具体的な一実施態様として、第1発明に係る糖ペプチド解析方法において、前記N末端環化検出ステップは、帰属された少なくとも1つのプロダクトイオンとプリカーサイオンとの質量電荷比の差に生じる特定の質量電荷比ずれを検出したのに加え、前記MS2スペクトル上で検出されたトリプレットピークと、該トリプレットピークと同一の質量電荷比差をもって前記MS1スペクトル上で検出されるトリプレットピークとの質量電荷比の差が特定の値、例えば17Da又は18Daである場合に、N末端の特定アミノ酸残基の環化が存在すると推定するとよい。なお、同様のトリプレットピークが複数組存在する場合には、例えばトリプレットピークの強度の総和が最大になるものを選べばよい。
【0021】
また別の実施態様として、第1発明に係る糖ペプチド解析方法において、前記N末端環化検出ステップは、前記同定処理ステップにおいて実行される、N末端特定アミノ酸残基の環化を修飾条件としたデータベース検索の結果、環化したペプチドが所定の条件の下で一致した場合に、N末端の特定アミノ酸残基の環化が存在すると推定するようにしてもよい。
【0022】
なお、N末端環化検出ステップにおいてN末端特定アミノ酸残基の環化が存在しないと判断された場合には、従来から知られている手法によりペプチド同定や糖鎖組成の推定を実行すればよい。
【0023】
もちろん、第1発明に係る糖ペプチド解析方法におけるN末端環化検出ステップで、帰属された少なくとも1つのプロダクトイオンとプリカーサイオンとの質量電荷比の差に生じる特定の質量電荷比ずれを検出することによりN末端の特定アミノ酸残基の環化の存在を推定していたのに代えて、MS2スペクトル上で検出されたトリプレットピークと、該トリプレットピークと同一の質量電荷比差をもって前記MS1スペクトル上で検出されるトリプレットピークとの質量電荷比の差が特定の値、例えば17Da又は18Daである場合に、N末端の特定アミノ酸残基の環化が存在すると推定するようにしてもよい。
即ち、第1発明に関連した他の態様は、nが1〜3であるMSn分析を実行可能な質量分析装置を利用して、被検試料中のN-結合型糖ペプチドの構造を解析する糖ペプチド解析方法であって、
a)被検試料をMS1分析して得られたMS1スペクトルに現れる糖ペプチド由来のイオンをプリカーサイオンとして選定するMS2プリカーサ選定ステップと、
b)前記被検試料に対し前記MS2プリカーサ選定ステップにおいて選定されたプリカーサイオンに関するMS2分析を実行してMS2スペクトルを取得するMS2分析実行ステップと、
c)N-結合型糖ペプチドのMS2スペクトルに特徴的に観測されるトリプレットピークを前記MS2分析実行ステップで取得されたMS2スペクトル上で検出するとともに、該トリプレットピークと同一の質量電荷比差をもつトリプレットピークを前記MS1スペクトル上で検出し、それら2つのトリプレットピークの質量電荷比の差が特定の値であるか否かを調べることにより、N末端の特定アミノ酸残基の環化の存在を推定するN末端環化検出ステップと、
d)前記MS2スペクトル上で検出された前記トリプレットピークを構成する少なくとも1つのイオンをMS3分析のプリカーサイオンとして選定するMS3プリカーサ選定ステップと、
e)前記被検試料に対し前記MS3プリカーサ選定ステップにおいて選定されたプリカーサイオンに関するMS3分析を実行してMS3スペクトルを取得するMS3分析実行ステップと、
f)前記N末端環化検出ステップにおいてN末端の特定アミノ酸残基の環化が存在すると推定された場合にN末端特定アミノ酸残基の環化を修飾条件とし、前記MS3分析実行ステップにより取得されたMS3スペクトルにおいて検出されるイオンピークの情報に基づくデータベース検索を実行して、目的とする糖ペプチドのペプチドを同定する同定処理ステップと、
を有するものとすることができる。また、この解析方法の態様又はこの方法を具現化する装置も、十分に高い精度でN末端特定アミノ酸残基環化の有無を推定することが可能であるから、第1発明及び第2発明とほぼ同様の効果を達成し得る。
【発明の効果】
【0024】
第1発明に係る糖ペプチド解析方法及び第2発明に係る糖ペプチド解析装置によれば、分析しようとしている糖ペプチドがN末端にグルタミン、グルタミン酸、カルバミドメチル化システインなど特定のアミノ酸残基を有するものであり、CIDによってそのアミノ酸残基に環化による質量電荷比ずれが発生するような場合であっても、高い精度でペプチドを同定したり糖鎖組成・糖鎖構造を推定したりすることができる。
【図面の簡単な説明】
【0025】
【図1】本発明に係る糖ペプチド解析方法を実施する糖ペプチド解析システムの一実施例の全体構成図。
【図2】本実施例の糖ペプチド解析システムにおいて実施される糖ペプチド解析処理手順を示すフローチャート。
【図3】図2に示した糖ペプチド解析処理を説明するための概念図。
【図4】図2に示した糖ペプチド解析処理を説明するための概念図。
【図5】MS/MSイオンサーチの検索条件設定画面の一例を示す図。
【発明を実施するための形態】
【0026】
以下、本発明に係る糖ペプチド解析方法を実施する糖ペプチド解析システムの一実施例について、添付図面を参照して説明する。図1は本実施例の糖ペプチド解析システムの全体構成図、図2は本システムにおける糖ペプチド解析の処理手順を示すフローチャート、図3及び図4は図2に示した糖ペプチド解析処理を説明するための概念図である。
【0027】
本実施例の糖ペプチド解析システムは、大別して、質量分析部1と、コンピュータを中心に構成される制御・処理部2と、から成る。質量分析部1はマトリクス支援レーザ脱離イオン化四重極イオントラップ飛行時間型質量分析装置(MALDI−QIT−TOFMS)であり、分析対象である試料中の分子や原子をイオン化するMALDI法によるイオン化部10と、発生したイオンを一時的に捕捉し、質量電荷比m/zに応じたイオンの選別と衝突誘起解離(CID)によるイオンの解離とを実行可能な3次元四重極型のイオントラップ11と、そのイオントラップ11から出射された各種イオンを質量電荷比に応じて分離して検出する飛行時間型質量分析器(TOFMS)12と、を含む。飛行時間型質量分析器12は、リフレクトロン電極により発生する電場によりイオンを折返し飛行させる飛行空間13と、該飛行空間13を飛行する間に質量電荷比に応じて時間的に分離されたイオンを順次検出するイオン検出器14と、を含む。
【0028】
ここではイオン化部10はMALDIイオン源であるが、イオン化法はこれに限るものではなく、例えばESIなどを用いてもよい。ただし、インソース分解などにより糖鎖からシアル酸や硫酸基などが脱離することを利用してMS1スペクトル上で目的とする糖ペプチド由来のイオンを検出する場合には、インソース分解などが起こり易いイオン化法を採用する必要があり、その目的ではMALDI法やそれ以外のレーザ照射を利用したイオン化法が好適である。
【0029】
制御・処理部2は、質量分析部1の各部を制御する分析制御部3、イオン検出器14から得られる検出信号を処理するデータ処理部20、ユーザが検索条件を入力設定したりスペクトル解析のために必要な各種操作を行ったりするための入力部5や検索条件入力設定画面を表示したり同定結果を表示したりするための表示部6が接続され、システム全体を統括的に制御する制御部4、を含む。データ処理部20は、検出信号に基づいてMSnスペクトルを作成するスペクトル作成部21、MSnスペクトルを解析して例えば特定のピークを抽出する等のデータ処理を実行するスペクトル解析部22、MSnスペクトルから収集されたピーク情報に対しデノボシーケンスによる処理を実行するデノボ配列解析処理部23、ペプチドのアミノ酸配列を推定するための同定用情報が予め登録された同定用データベース(DB)25、そのデータベース25を用いてピークリストに一致する可能性の高いペプチドの検索を行うデータベース検索部24、などを機能ブロックとして含む。このデータベース検索部24の機能は、例えば英国マトリックス・サイエンス社が提供するマスコット(Mascot)に含まれるMS/MSイオンサーチと名付けられた検索エンジンを利用することができる。また、デノボ配列解析処理部23の機能は、例えば上述したピークス(PEAKSTM)などのソフトウエアを利用することができる。
【0030】
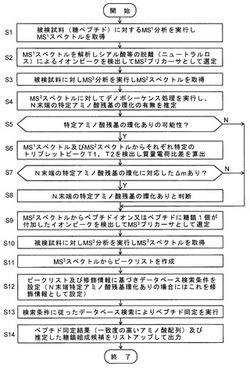
次に、本実施例の糖ペプチド解析システムにおける特徴的なN-結合型糖ペプチド解析方法について、図2のフローチャートに沿って説明する。
【0031】
分析者は目的とするタンパク質を適宜の酵素(例えばトリプシン酵素)により消化し、糖ペプチドを含む被検試料を調製する。分析制御部3の制御の下に、質量分析部1により上記被検試料に対するMS1分析が実行されると、スペクトル作成部21はMS1分析により得られたデータに基づいてMS1スペクトルを作成する(ステップS1)。
【0032】
スペクトル解析部22は、ステップS1で作成されたMS1スペクトルからシアル酸等の糖鎖のニュートラルロスによって発現しているプロダクトイオンピークを見つけ、このプロダクトイオンをMS2分析のためのプリカーサイオンとして選定する(ステップS2)。
【0033】
次に、分析制御部3の制御の下に、質量分析部1により被検試料に対してステップS2で選定されたプリカーサイオンについてのMS2分析がそれぞれ実行されると、スペクトル作成部21はMS2スペクトルを作成する(ステップS3)。より詳しく述べると、イオン化部10において被検試料から生成された各種イオンは一旦イオントラップ11に捕捉され、イオントラップ11においてプリカーサイオンの質量電荷比を持つイオンのみが選別された後にCIDによる1回の解離操作がなされる。それによって生成された各種プロダクトイオンはイオントラップ11から一斉に出射されて飛行時間型質量分析器12により質量分析され、それにより得られる検出信号に基づいてスペクトル作成部21はMS2スペクトルを作成する。
【0034】
図3に示す例では、(a)に示したMS1スペクトル上でm/z=M1のイオンピークがプリカーサイオンとして選定され、それに対してMS2分析が実施された結果、(b)に示したMS2スペクトルが得られている。前述のように、被検試料に含まれるN-結合型糖ペプチドが、N末端にグルタミン、グルタミン酸、カルバミドメチル化システインなど特定のアミノ酸残基が位置するものであった場合、ステップS3のCIDの過程でN末端の特定アミノ酸残基の環化が優先的に生じ、そのためにNH3やH2Oのニュートラルロスが発生する。その結果、MS2スペクトルに出現する糖のニュートラルロスにより生じた各プロダクトイオンピークは全体的にNH3又はH2Oのニュートラルロスの分だけ、つまり17Da又は18Daだけ低質量電荷比方向にシフトすることになる。これら優先的な環化は糖ペプチドにおいては糖のニュートラルロスと同時に発生し、特にN末端アミノ酸残基がグルタミン(Gln)である場合に顕著に、上述のトリプレットピークを構成するイオンを含む糖鎖のニュートラルロスで得られたプロダクトイオン全てにおいて、低質量電荷比側への17Daの質量電荷比ずれが生じることを本発明者は確認している。
【0035】
続いて、スペクトル解析部22及びデノボ配列解析処理部23はMS2スペクトルに現れているピークを解析し、そのピーク情報に基づくデノボシーケンス処理を実行することにより、MS2スペクトル中のピークを、CID等の解離作用により糖が中性的に(電荷を変えずに)脱離して生じたプロダクトイオンとして帰属する。そして、その帰属結果を利用してN末端アミノ酸残基の環化に特有の質量電荷比ずれが存在するか否かを推定する(ステップS4)。
【0036】
具体的には、まず、N-結合型糖ペプチドのMS2スペクトルに特徴的に現れるトリプレットピーク(質量電荷比差が低質量電荷比側から83Da、120Daで並ぶ3本のピーク)を探索する。トリプレットピークの候補が複数組存在した場合には、例えばイオンピーク強度の高い組から順に候補を表示部6の画面上に表示し、例えば分析者がそのうちの1組のトリプレットピークを入力部5により選択すればよい。トリプレットピークが検出されたならば、そのトリプレットピークの中の質量電荷比が最大であるピークを開始点とし、MS2分析のプリカーサイオンの質量電荷比M1を終了点として、イオンピーク列の中の隣接する2本のピークの質量電荷比差、つまり糖鎖のニュートラルロスにより生じたプロダクトイオンを順次帰属してゆく(図3(b)参照)。なお、帰属できないピークについては、例えば1本であれば飛ばす等の適宜のアルゴリズムを採ることができる。
【0037】
そうして順にプロダクトイオンの帰属を実施してゆき、帰属できたプロダクトイオンのうち最も質量電荷比の大きいプロダクトイオンピークを得る。該最も質量電荷比の大きいプロダクトイオンピークとMS2分析のプリカーサイオンとの間に糖のニュートラルロスを帰属できず、且つ、そのMS2分析のプリカーサイオンの質量電荷比M1に対してΔm((17Da又は18Da) のニュートラルロスを仮定した(つまりは質量電荷比がM1−Δmである)仮想的なMS2プリカーサイオンに対して糖のニュートラルロスの帰属が可能であった場合、即ち、その最も大きな質量電荷比をもつプロダクトイオンを仮想MS2プリカーサイオンからの糖のニュートラルロスとして帰属することが可能であった場合に、N末端のアミノ酸残基の環化に特有の質量電荷比ずれがあると推定する(ステップS5でY)。
【0038】
なお、MS2スペクトル上でトリプレットピークが検出できなかった場合には、ここでは分析対象外であるO-結合型糖ペプチドである可能性が高いが、該糖ペプチドの糖鎖組成を推定したい場合には、MS2プリカーサイオンから質量電荷比が低くなる方向に向かってデノボシーケンス処理により糖鎖組成推定を実行すればよい。
【0039】
また、ステップS4の処理は実質的に糖鎖組成を推定することに相当するから、ここで得られた帰属情報に基づいて糖鎖組成や糖鎖構造を推定することも可能である。
【0040】
ステップS5でN末端のアミノ酸残基の環化ありと推定された場合にはステップS6へと進み、上記ステップS4とは別の観点で、具体的にはMS2スペクトル上で観測される特定のトリプレットピークとMS1スペクト上で観測される特定のトリプレットピークとの質量電荷比の差に基づいて、N末端アミノ酸残基の環化の有無を確認する。
【0041】
即ち、スペクトル解析部22は、ステップS1で取得されたMS1スペクトルにおいて、上述した、質量電荷比差が低質量電荷比側から83Da、120Daで並ぶ3本のピークからなるトリプレットピークを探索する。そして、このMS1スペクトル上のトリプレットピークT1とステップS4において検出されたMS2スペクトル上のトリプレットピークT2との質量電荷比の差Δmを求め、この差がNH3又はH2Oの脱離に相当する17Da又は18Daである場合には、糖鎖ではなくペプチドイオンに対してN末端の特定アミノ酸残基の環化による質量電荷比ずれがあると推定する(ステップS7でY)。その場合、ステップS4とステップS6との2つの異なる推定において共に同じ結果が得られたことになるから、この時点でN末端のアミノ酸残基の環化が存在すると判断する(ステップS8)。
【0042】
ステップS4又はステップS6のいずれかにおいて、ペプチドのN末端のアミノ酸残基の環化に対応した質量電荷比ずれとは整合しない結果が出た場合には、ステップS5、S7でNと判定され、ステップS8をパスしてステップS9へと進む。したがって、この場合には、ペプチドのN末端のアミノ酸残基の環化は存在しないものと結論付けられる。
【0043】
ステップS9へ進むと、スペクトル解析部22は、ステップS3で取得されたMS2スペクトルについて、上記ステップS4で抽出されたトリプレットピークにそれぞれ対応するイオン、つまり、全ての糖鎖が脱離したペプチドに帰属されるプロダクトイオン、1個の糖鎖が付加したHexNAc環開裂断片による修飾を受けたペプチドに由来するプロダクトイオン、及び、HexNAcによる修飾を受けたペプチドに由来するプロダクトイオンのいずれかをMS3分析のプリカーサイオンとして選定する。
【0044】
なお、ステップS6において図4に示すようにMS1スペクトル上にトリプレットピークが検出されており、そのトリプレットピークを構成するいずれかのイオンのイオン強度が対応するMS2スペクトル上のトリプレットピークを構成する1つのイオンのイオン強度よりも大きい場合には、そのMS1スペクトル上のトリプレットピークに対応するイオンを擬似MS3分析のプリカーサイオンとして選定するようにしてもよい。これは、インソース分解が顕著に現れる場合には、MS1スペクトルは実質的にはMS2スペクトルと同等の擬似MS2スペクトルであり、擬似MS3プリカーサイオンについての擬似MS3分析を実施したほうがMS3スペクトルよりもイオン強度の高い擬似MS3スペクトルが得られる可能性が高いためである。
【0045】
選定されたプリカーサイオンの情報は分析制御部3に送られ、分析制御部3の制御の下に、そのプリカーサイオンに関するMS3分析(又は擬似MS3分析)が質量分析部1において実行され、それによって取得されたデータに基づいてスペクトル作成部21はMS3スペクトル(又は擬似MS3スペクトル)を作成する(ステップS10)。
【0046】
次いで、スペクトル解析部22は作成されたMS3スペクトル(又は擬似MS3スペクトル)から、有意なつまりはノイズピーク等を除去したピークの情報を収集してピークリストを作成する(ステップS11)。その後、データベース検索部24はステップS11で作成されたピークリストと既知の又は推定に基づく修飾情報に基づき、後述するペプチド同定のためのデータベース検索の検索条件を設定する(ステップS12)。ステップS8においてN末端アミノ酸残基の環化が存在すると判断されている場合には、それを修飾条件の1つとして設定する。具体的には、後述するようにMS/MSイオンサーチの検索設定の際のバリアブル・モディフィケイションとして「Gln->Pyro-Glu(N-term Q)」などを設定すればよい。また、デノボシーケンス処理の結果等により、特定の糖又は糖の開裂断片による修飾が存在することが判明していれば、それを修飾条件として加えればよい。
【0047】
データベース検索部24はステップS12において設定された検索条件に従って、同定用データベース25に登録されているペプチドのアミノ酸配列のピークパターンとの照合によるデータベース検索を実行する(ステップS13)。データベース検索として例えば上記MS/MSイオンサーチ法を用いることができるが、データベース検索法はこれに限るものではなく、周知の他の方法を用いてもよい。
【0048】
例えばMS/MSイオンサーチ法によるデータベース検索では、既知のペプチドとのピークパターンの一致度を示す指標(スコア)が計算されるから、そのスコアが高く、且つ、指定した修飾を受けているものを、候補として例えばスコア順にリストアップする。また、ステップS4においてデノボシーケンス処理により推定された糖鎖組成の候補もリストアップする。そして、そのリストアップされたものを同定結果として表示部6の画面上に表示して分析者に提示する(ステップS14)。
【0049】
本実施例の糖ペプチド解析システムでは、N-結合型糖ペプチドのN末端のアミノ酸残基がグルタミンやグルタミン酸、カルバミドメチル化したシステインである場合に、そのアミノ酸残基の環化によってNH3やH2Oが脱離してしまっても、そうした優先的な脱離が生じたことをMS2スペクトルの段階で検出し、ペプチドのN末端にそうした特定のアミノ酸残基が存在することを条件としたデータベース検索によりペプチド同定を行うことができる。したがって、N-結合型糖ペプチドにおけるペプチド同定の精度を向上させることができる。
【0050】
なお、上記実施例では、ステップS4によるN末端アミノ酸残基の環化の有無の推定に加え、ステップS6において別の手法によるN末端アミノ酸残基の環化の有無の推定を行うことで、その推定の信頼度を高めているが、本願発明者の検討によれば、多くの場合、ステップS4による推定だけでも十分に高い信頼度で以てN末端アミノ酸残基の環化の有無を判断することができる。したがって、ステップS6、S7の処理を省いても、実際上問題はない。
【0051】
また、ステップS6、S7の処理を省く代わりに、MS2スペクトルから収集したピーク情報に対してデータベース検索を試み、その結果によってN末端アミノ酸残基の環化の有無を判断する処理をフローに加えるようにしてもよい。ここでは、データベース検索にMS/MSイオンサーチを用いるものとする。
【0052】
図5はMS/MSイオンサーチの検索条件設定画面の一例である。設定すべき主な検索条件として、照合に使用するデータベース(Database)、タンパク質の分解に使用した消化酵素の種類(エンザイム:Enzyme)、確定的に起こる修飾の種類(フィックスド・モディフィケイション:Fixed modification)、起こる可能性のある(非確定的な)修飾の種類(バリアブル・モディフィケイション:Variable modification)、質量分析の精度の許容値(MS/MS tol.)などがある。上述したようなN末端アミノ酸残基の環化はバリアブル・モディフィケイションとして指定することが可能である。図5中に示した「Gln->Pyro-Glu(N-term Q)」は、N末端のグルタミン(Q)残基が環化されてピログルタミン酸(Pyro-Glutamic acid)になる場合を、「Glu->Pyro-Glu (N-term E)」は、N末端グルタミン酸(E)残基が環化されてピログルタミン酸になる場合を示す(「MASCOT Server 修飾の定義方法 3」、インターネット<URL : http://www.matrixscience.jp/pdf/jap_mod_file.pdf>参照)。この他、N末端のカルバミドメチル化システイン(C)が環化されてピロカルバミドメチル化システイン(Pyro-carbamidomethyl cystein)になる場合として「Pyro-carbamidomethyl(N-term C)」を、バリアブル・モディフィケイションとして指定することが可能である。
【0053】
そこで、スペクトル解析部22は、ステップS3で取得したMS2スペクトルからピークを収集してピークリストを作成し、データベース検索部24はこのピークリストに対しバリアブル・モディフィケイションとして「Gln->Pyro-Glu(N-term Q)」や「Glu->Pyro-Glu(N-term E)」、「Pyro-carbamidomethyl(N-term C)」などを指定した上でデータベース検索を実行する。そしてその結果、環化したペプチドが一定の条件でヒットするか否かを確認する。例えば、N末端のアミノ酸残基が環化したグルタミン又はグルタミン酸であるペプチドが最も高いスコアでヒットしたならば、バリアブル・モディフィケイションとして指定した条件が適切である、即ち、MS2スペクトルにおいてN末端のアミノ酸残基の環化によってNH3又はH2Oの脱離が生じているものと判断する。ステップS5でYと判定され、さらに上記のようなMS2スペクトルに対するデータベース検索の結果でもN末端のアミノ酸残基の環化が生じていると判定されたならば、ステップS9に進んでMS3分析を実行すればよい。このようにしても、N末端アミノ酸残基の環化の有無の推定が高い信頼性を以てなされるので、ペプチド同定の精度を高めることができる。
【0054】
なお、上記実施例は本発明の一例にすぎず、本発明の趣旨の範囲で適宜変形、修正、追加等を行っても本願特許請求の範囲に包含されることは当然である。
【符号の説明】
【0055】
1…質量分析部
10…イオン化部
11…イオントラップ
12…飛行時間型質量分析器
13…飛行空間
14…イオン検出器
2…制御・処理部
20…データ処理部
21…スペクトル作成部
22…スペクトル解析部
23…デノボ配列解析処理部
24…データベース検索部
25…同定用データベース
3…分析制御部
4…制御部
5…入力部
6…表示部
【技術分野】
【0001】
本発明は、糖鎖修飾を受けたタンパク質又はペプチドの構造を質量分析を用いて解析する解析方法、及び該方法を利用した解析装置に関する。
【背景技術】
【0002】
生体を構成するタンパク質の半分以上は糖鎖修飾を受けていると言われており、糖鎖修飾はタンパク質の構造や機能の調節に重要な役割を果たしている。また、近年の研究により、免疫疾患などの各種疾患と糖鎖構造異常や糖化異常との関連性も明らかになってきている。こうしたことから、糖タンパク質や糖ペプチドの構造解析は、生命科学や医療、医薬品開発など様々な分野において非常に重要になっている。近年の質量分析装置の性能向上により、質量分析、特に多段階の解離操作を伴うMSn分析はタンパク質解析における主要な手法の1つになっているものの、一般に、糖タンパク質の解析は修飾を受けていないタンパク質の解析に比べてかなり困難であり、その解析手法は未だ研究途上である。
【0003】
糖タンパク質の解析において取得したい情報は主に、ペプチドのアミノ酸配列、糖鎖構造、及び糖鎖結合部位である。従来一般的な糖タンパク質解析手法は次のとおりである(非特許文献1参照)。
【0004】
まず目的の糖タンパク質を酵素消化することにより糖ペプチドを含む被検試料を調製し、この被検試料に対するMS(=MS1)分析を実行してMS1スペクトルを取得する。このMS1スペクトルに現れているピークに対し所定の基準に従って糖ペプチド由来であると推定されるピークを選定し、そのピークに対応したイオンをプリカーサイオンとして被検試料に対するMS/MS(=MS2)分析を実行してMS2スペクトルを取得する。
【0005】
N-結合型糖ペプチドの場合、MS2スペクトルには所定の質量電荷比間隔で並ぶ3つのピーク(以下、「トリプレットピーク」という)が特徴的に現れる。具体的には、低質量電荷比側から、全ての糖鎖が脱離したペプチドイオン、糖HexNAcの環開裂により生じた0,2X(83Da)付加ペプチドイオン、HexNAc(203Da)付加ペプチドイオン、に対応する3本のピークである。そこで一般的には、このトリプレットイオンをプリカーサイオンとしてMS3分析を行うことによりペプチド及び糖鎖結合部位を同定する。また、このトリプレットピークと質量電荷比の一致するトリプレットピークがMS1スペクトル中に見られた場合には、一致したイオンをそれぞれ疑似的なMS3プリカーサイオンとして選択し MS2分析(擬似MS3分析)を行うことも、高感度で迅速なペプチド及び糖鎖結合部位同定を目的として行われている。
【0006】
またN-結合型糖ペプチドのMS2スペクトルに対し、上述のトリプレットピークからMS2プリカーサイオンまでの間において糖のニュートラルロスにより得られたプロダクトイオン列をデノボ(de novo)シーケンシングにより帰属することによって、MS2プリカーサイオンの糖鎖組成を調べることも行われている。具体的な手法としては、カナダ国バイオインフォマティクス・ソリューションズ(Bioinformatic Solutions)社が提供するピークス(PEAKSTM)などの解析ソフトウエアが知られている。
【0007】
ところで、非特許文献2〜4などによれば、N末端にグルタミン(Gln)やグルタミン酸(Glu)、カルバミドメチル化したシステイン(Cys)が位置するペプチドについて衝突誘起解離(CID)を伴うMS2分析を行うと、マトリクス支援脱離レーザイオン化(MALDI)質量分析でよく観測される1価イオンにおいてはN末端の環化に由来するアンモニア(NH3)又は水(H2O)のニュートラルロス(−17Da又は−18Da)が生じ、しかもこのニュートラルロスはペプチドの主鎖におけるどのアミノ酸の開裂に比べても優先的に生じることが知られている。
【0008】
糖ペプチドのMS2スペクトルでは糖又はアミノ酸からのNH3やH2Oのニュートラルロスが頻繁に観測されるが、一般に、NH3やH2Oのニュートラルロスが生じた箇所を事前に特定することは困難である。そのため、NH3やH2Oのニュートラルロスにより生じたプロダクトイオンをMS3分析のプリカーサイオンとして選択してMS3スペクトルを取得しても、タンパク質データベースを用いたデータベース検索の検索条件として適切な修飾条件を設定することができず、ペプチドの同定精度を上げることは困難である。また、糖ペプチドに対する糖のニュートラルロスで生じたプロダクトイオンに基づいて糖鎖組成や糖鎖構造を推定する際に、プロダクトイオンからのNH3やH2Oの脱離を仮定したとしても、糖鎖組成や糖鎖構造の推定誤りがしばしば発生してしまう。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】中家、「複合糖質解析−質量分析計の有用性−」、島津評論、島津評論編集部、第66巻、第3・4号、2010年3月31日、p.173-184
【非特許文献2】バルドウィン(Baldwin)、ほか5名、「タンデム・マス・スペクトロメトリ・オブ・ペプタイズ・ウィズ・エヌ-ターミナル・グルタミン・スタディーズ・オン・ア・プリオン・プロテイン・ペプタイド(Tandem Mass Spectrometry of Peptides with N-Terminal Glutamine Studies on a Prion Protein Peptide)」、ジャーナル・オブ・アメリカン・ソサイエティ・フォー・マス・スペクトロメトリ(J. Am. Soc. Mass Spectrom.)、1990年、1、p.258-264
【非特許文献3】ネタ(Neta)、ほか4名、「デハイドレイション・バーサス・デアミネイション・オブ・エヌ-ターミナル・グルタミン・イン・コリジョン-インデュースド・ディソシエイション・オブ・ア・プロトネイテッド・ペプタイズ(Dehydration Versus Deamination of N-Terminal Glutamine in Collision-Induced Dissociation of Protonated Peptides)」、ジャーナル・オブ・アメリカン・ソサイエティ・フォー・マス・スペクトロメトリ(J. Am. Soc. Mass Spectrom.)、2007年、18、p.27-36
【非特許文献4】ハリソン(Harrison)、「フラグメンテイション・リアクションズ・オブ・プロトネイテッド・ペプタイズ・コンテイニング・グルタミン・オア・グルタミン・アシッド(Fragmentation reactions of protonated peptides containing glutamine or glutamic acid)」、ジャーナル・オブ・アメリカン・ソサイエティ・フォー・マス・スペクトロメトリ(J. Am. Soc. Mass Spectrom.)、2003年、38、p.174-187
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明は上記課題に鑑みて成されたものであり、その目的とするところは、糖ペプチドのN末端アミノ酸残基に環化による質量電荷比ずれが発生したような場合であっても、MSn分析結果に基づくペプチド同定の精度を向上させることができる糖ペプチド解析方法及び解析装置を提供することである。
【課題を解決するための手段】
【0011】
上述のように、糖ペプチドのMS2分析において配列依存的なN末端の環化が優先的に生じたと推定される場合には、MS2スペクトルにおいて質量電荷比ずれの生じたトリプレットピークを構成する少なくとも1つのイオンをプリカーサイオンとして選択した上でMS3分析を実行してMS3スペクトルを取得し、N末端配列にグルタミン酸(Glu)、グルタミン(Gln)又はカルバミドメチル化したシステイン(Cys)が存在すると仮定してデータベース検索を行い、ペプチドを同定したほうが効率的であると考えられる。また、MS2スペクトル解析においても、ペプチドのN末端において環化が生じたことが推定される場合には、糖ペプチドから糖のニュートラルロスで生じたプロダクトイオンについて、ペプチドのN末端アミノ酸残基においてNH3又はH2Oの脱離による質量電荷比ずれが生じたものとした上で当該プロダクトイオンの帰属を試みることで、糖鎖組成や糖鎖構造に関する正確な情報を得られる可能性を高めることができると考えられる。こうしたことから、本願発明者は、MS2分析結果から配列依存的な環化が生じたか否かを効果的に且つ高い精度で判別した上で、そうした特定の環化が生じている場合には、それを条件としたペプチド同定や糖鎖構造解析を行うことに想到した。
【0012】
上記課題を解決するために成された第1発明は、nが1〜3であるMSn分析を実行可能な質量分析装置を利用して、被検試料中のN-結合型糖ペプチドの構造を解析する糖ペプチド解析方法であって、
a)被検試料をMS1分析して得られたMS1スペクトルに現れる糖ペプチド由来のイオンをプリカーサイオンとして選定するMS2プリカーサ選定ステップと、
b)前記被検試料に対し前記MS2プリカーサ選定ステップにおいて選定されたプリカーサイオンに関するMS2分析を実行してMS2スペクトルを取得するMS2分析実行ステップと、
c)前記MS2スペクトル上で特定質量電荷比の差を有して並ぶプロダクトトイオンピーク列に対しデノボシーケンス処理を適用して各ピークに対応したプロダクトイオンの帰属を行いつつ、該デノボシーケンンス処理により帰属されたピークのうち最も大きな質量電荷比をもつプロダクトイオンとプリカーサイオンとの質量電荷比の差に生じる特定の質量電荷比ずれを検出することにより、N末端の特定アミノ酸残基の環化の存在を推定するN末端環化検出ステップと、
d)N-結合型糖ペプチドのMS2スペクトルに特徴的に観測されるトリプレットピークを前記MS2分析実行ステップで取得されたMS2スペクトル上で検出し、該トリプレットピークを構成する少なくとも1つのイオンをMS3分析のプリカーサイオンとして選定するMS3プリカーサ選定ステップと、
e)前記被検試料に対し前記MS3プリカーサ選定ステップにおいて選定されたプリカーサイオンに関するMS3分析を実行してMS3スペクトルを取得するMS3分析実行ステップと、
f)前記N末端環化検出ステップにおいてN末端の特定アミノ酸残基の環化が存在すると推定された場合にN末端特定アミノ酸残基の環化を修飾条件とし、前記MS3分析実行ステップにより取得されたMS3スペクトルにおいて検出されるイオンピークの情報に基づくデータベース検索を実行して、目的とする糖ペプチドのペプチドを同定する同定処理ステップと、
を有することを特徴としている。
【0013】
また上記課題を解決するために成された第2発明は、上記第1発明に係る糖ペプチド解析方法を具現化する装置であって、nが1〜3であるMSn分析を実行可能な質量分析装置を利用して、被検試料中のN-結合型糖ペプチドの構造を解析する糖ペプチド解析装置において、
a)被検試料に対しMS1分析を実行してMS1スペクトルを取得するべく前記質量分析装置の動作を制御するMS1分析実行制御手段と
b)前記MS1スペクトルに現れる糖ペプチド由来のイオンをプリカーサイオンとして選定するMS2プリカーサ選定手段と、
c)前記被検試料に対し前記MS2プリカーサ選定手段により選定されたプリカーサイオンに関するMS2分析を実行してMS2スペクトルを取得するべく前記質量分析装置の動作を制御するMS2分析実行制御手段と、
d)前記MS2スペクトル上で特定質量電荷比の差を有して並ぶプロダクトトイオンピーク列に対しデノボシーケンス処理を適用して各ピークに対応したプロダクトイオンの帰属を行いつつ、該デノボシーケンンス処理により帰属されたピークのうち最も大きな質量電荷比をもつプロダクトイオンとプリカーサイオンとの質量電荷比の差に生じる特定の質量電荷比ずれを検出することにより、N末端の特定アミノ酸残基の環化の存在を推定するN末端環化検出手段と、
e)N-結合型糖ペプチドのMS2スペクトルに特徴的に観測されるトリプレットピークを被検試料に対して取得された前記MS2スペクトル上で検出し、該トリプレットピークを構成する少なくとも1つのイオンをMS3分析のプリカーサイオンとして選定するMS3プリカーサ選定手段と、
f)前記被検試料に対し前記MS3プリカーサ選定手段により選定されたプリカーサイオンに関するMS3分析を実行してMS3スペクトルを取得するべく前記質量分析装置の動作を制御するMS3分析実行制御手段と、
g)前記N末端環化検出手段においてN末端の特定アミノ酸残基の環化が存在すると推定された場合にN末端特定アミノ酸残基の環化を修飾条件とし、被検試料に対して取得された前記MS3スペクトルにおいて検出されるイオンピークの情報に基づくデータベース検索を実行して、目的とする糖ペプチドのペプチドを同定する同定処理手段と、
を備えることを特徴としている。
【0014】
第1発明に係る糖ペプチド解析方法において、N末端環化検出ステップでは、例えば、MS2スペクトル上でトリプレットピークのうちの1本のピーク、例えば最も質量電荷比が大きいイオンピークを開始点としMS2プリカーサイオンピークを終了点として、その間に存在するプロダクトトイオンピーク列について隣接するピーク間の質量電荷比の差を順次調べ、その質量電荷比差に相当する糖の脱離成分をデノボシーケンス処理により数理的に推定することで各ピークに対応したプロダクトイオン又はニュートラルロスの帰属を行ってゆき、帰属できたプロダクトイオンのうち最も大きな質量電荷比をもつプロダクトイオンピークを得る。CID等の解離操作の過程でN末端の環化によるNH3やH2Oなどのニュートラルロスが生じると、MS2プリカーサイオンピークと該最も大きな質量電荷比をもつプロダクトイオンとの間の質量電荷比の差に相当する糖のニュートラルロスが見つからず帰属ができなくなる。一方、MS2プリカーサイオンに対して特定の質量電荷比差Δm(17Da又は18Da)だけ低質量電荷比側にシフトした仮想MS2プリカーサイオンをデノボシーケンス処理の終了点として糖のニュートラルロスの帰属が可能であれば、即ち、上記最も大きな質量電荷比をもつプロダクトイオンを仮想MS2プリカーサイオンからの糖のニュートラルロスとして帰属することができれば、これは糖ではなく、ペプチドイオンにおけるN末端の特定アミノ酸残基の環化による質量電荷比ずれである可能性が高いと推定する。
【0015】
このようにしてN末端特定アミノ酸残基の環化が生じていることが高い確度で推定できたならば、MS3スペクトルのピーク情報を利用してデータベース検索によりペプチドを同定する際に、N末端特定アミノ酸残基の環化を検索のための修飾条件の1つとして設定すればよい。これにより、データベース検索の検索範囲がかなり絞り込まれるため、ペプチド同定の精度向上を図ることができる。また、N末端環化検出ステップでは、トリプレットピークとMS2プリカーサイオンピークとの間でN末端特定アミノ酸残基の環化の存在を仮定したニュートラルロスの帰属が実施されるので、糖鎖組成や糖鎖構造の推定精度も向上させることができる。
【0016】
なお、上記N-結合型糖ペプチドのMS2スペクトルに特徴的に観測されるトリプレットピークとは、典型的には、質量電荷比が小さい方から83Da、120Daの質量電荷比差で並ぶ3つのピークである。この3つのピークは、全ての糖鎖が脱離したペプチドイオン、糖HexNAcの環開裂により生じた0,2X(83Da)付加ペプチドイオン、HexNAc付加ペプチドイオンに相当する。
【0017】
また、糖ペプチドをMS1分析する際には、インソース分解等により擬似MS2分析が行われてしまい、MS1スペクトルに上記のような特定の質量電荷比差をもったトリプレットピークが観測されることがある。こうした場合、一般的にMS1スペクトルに現れるトリプレットピークの強度はMS2スペクトルに現れるトリプレットピークの強度よりも大きい。そこで、MS1スペクトルに現れるトリプレットピークを擬似MS3プリカーサイオンとして選定し、該プリカーサイオンに関するMS2分析(擬似MS3分析)を実行することで擬似MS3スペクトルを取得し、この擬似MS3スペクトルのピーク情報を通常のMS3スペクトルのピーク情報と同じようにデータベース検索に供することにより、より精度の高いペプチド同定が行える可能性がある。
【0018】
即ち、第1発明に係る糖ペプチド解析方法は、好ましくは、
前記MS2スペクトル上で検出されたトリプレットピークに対し前記N末端環化検出ステップで求まった特定の質量電荷比ずれを加えたトリプレットピークが、前記MS1スペクトル中に検出されるか否かを判別し、トリプレットピークが検出された場合にこれを疑似的なMS3プリカーサイオンとして選定する疑似MS3プリカーサ選定ステップと、
前記被検試料に対し前記擬似MS3プリカーサ選定ステップにおいて選定された擬似MS3プリカーサイオンに関する擬似MS3分析を実行して擬似MS3スペクトルを取得する擬似MS3分析実行ステップと、をさらに有し、
前記同定処理ステップでは、前記N末端環化検出ステップにおいてN末端の特定アミノ酸残基の環化が存在すると推定された場合にN末端特定アミノ酸残基の環化を修飾条件とし、前記擬似MS3分析実行ステップにより取得された擬似MS3スペクトルにおいて検出されるイオンピークの情報に基づくデータベース検索を実行して、目的とする糖ペプチドのペプチドを同定するようにするとよい。
【0019】
また、第1発明に係る糖ペプチド解析方法及び第2発明に係る糖ペプチド解析装置において実施されるN末端特定アミノ酸残基環化の推定処理は十分に高い推定精度を有しているものの、さらに別の観点からの推定を加えることにより、その推定精度を一層高めることが可能である。
【0020】
具体的な一実施態様として、第1発明に係る糖ペプチド解析方法において、前記N末端環化検出ステップは、帰属された少なくとも1つのプロダクトイオンとプリカーサイオンとの質量電荷比の差に生じる特定の質量電荷比ずれを検出したのに加え、前記MS2スペクトル上で検出されたトリプレットピークと、該トリプレットピークと同一の質量電荷比差をもって前記MS1スペクトル上で検出されるトリプレットピークとの質量電荷比の差が特定の値、例えば17Da又は18Daである場合に、N末端の特定アミノ酸残基の環化が存在すると推定するとよい。なお、同様のトリプレットピークが複数組存在する場合には、例えばトリプレットピークの強度の総和が最大になるものを選べばよい。
【0021】
また別の実施態様として、第1発明に係る糖ペプチド解析方法において、前記N末端環化検出ステップは、前記同定処理ステップにおいて実行される、N末端特定アミノ酸残基の環化を修飾条件としたデータベース検索の結果、環化したペプチドが所定の条件の下で一致した場合に、N末端の特定アミノ酸残基の環化が存在すると推定するようにしてもよい。
【0022】
なお、N末端環化検出ステップにおいてN末端特定アミノ酸残基の環化が存在しないと判断された場合には、従来から知られている手法によりペプチド同定や糖鎖組成の推定を実行すればよい。
【0023】
もちろん、第1発明に係る糖ペプチド解析方法におけるN末端環化検出ステップで、帰属された少なくとも1つのプロダクトイオンとプリカーサイオンとの質量電荷比の差に生じる特定の質量電荷比ずれを検出することによりN末端の特定アミノ酸残基の環化の存在を推定していたのに代えて、MS2スペクトル上で検出されたトリプレットピークと、該トリプレットピークと同一の質量電荷比差をもって前記MS1スペクトル上で検出されるトリプレットピークとの質量電荷比の差が特定の値、例えば17Da又は18Daである場合に、N末端の特定アミノ酸残基の環化が存在すると推定するようにしてもよい。
即ち、第1発明に関連した他の態様は、nが1〜3であるMSn分析を実行可能な質量分析装置を利用して、被検試料中のN-結合型糖ペプチドの構造を解析する糖ペプチド解析方法であって、
a)被検試料をMS1分析して得られたMS1スペクトルに現れる糖ペプチド由来のイオンをプリカーサイオンとして選定するMS2プリカーサ選定ステップと、
b)前記被検試料に対し前記MS2プリカーサ選定ステップにおいて選定されたプリカーサイオンに関するMS2分析を実行してMS2スペクトルを取得するMS2分析実行ステップと、
c)N-結合型糖ペプチドのMS2スペクトルに特徴的に観測されるトリプレットピークを前記MS2分析実行ステップで取得されたMS2スペクトル上で検出するとともに、該トリプレットピークと同一の質量電荷比差をもつトリプレットピークを前記MS1スペクトル上で検出し、それら2つのトリプレットピークの質量電荷比の差が特定の値であるか否かを調べることにより、N末端の特定アミノ酸残基の環化の存在を推定するN末端環化検出ステップと、
d)前記MS2スペクトル上で検出された前記トリプレットピークを構成する少なくとも1つのイオンをMS3分析のプリカーサイオンとして選定するMS3プリカーサ選定ステップと、
e)前記被検試料に対し前記MS3プリカーサ選定ステップにおいて選定されたプリカーサイオンに関するMS3分析を実行してMS3スペクトルを取得するMS3分析実行ステップと、
f)前記N末端環化検出ステップにおいてN末端の特定アミノ酸残基の環化が存在すると推定された場合にN末端特定アミノ酸残基の環化を修飾条件とし、前記MS3分析実行ステップにより取得されたMS3スペクトルにおいて検出されるイオンピークの情報に基づくデータベース検索を実行して、目的とする糖ペプチドのペプチドを同定する同定処理ステップと、
を有するものとすることができる。また、この解析方法の態様又はこの方法を具現化する装置も、十分に高い精度でN末端特定アミノ酸残基環化の有無を推定することが可能であるから、第1発明及び第2発明とほぼ同様の効果を達成し得る。
【発明の効果】
【0024】
第1発明に係る糖ペプチド解析方法及び第2発明に係る糖ペプチド解析装置によれば、分析しようとしている糖ペプチドがN末端にグルタミン、グルタミン酸、カルバミドメチル化システインなど特定のアミノ酸残基を有するものであり、CIDによってそのアミノ酸残基に環化による質量電荷比ずれが発生するような場合であっても、高い精度でペプチドを同定したり糖鎖組成・糖鎖構造を推定したりすることができる。
【図面の簡単な説明】
【0025】
【図1】本発明に係る糖ペプチド解析方法を実施する糖ペプチド解析システムの一実施例の全体構成図。
【図2】本実施例の糖ペプチド解析システムにおいて実施される糖ペプチド解析処理手順を示すフローチャート。
【図3】図2に示した糖ペプチド解析処理を説明するための概念図。
【図4】図2に示した糖ペプチド解析処理を説明するための概念図。
【図5】MS/MSイオンサーチの検索条件設定画面の一例を示す図。
【発明を実施するための形態】
【0026】
以下、本発明に係る糖ペプチド解析方法を実施する糖ペプチド解析システムの一実施例について、添付図面を参照して説明する。図1は本実施例の糖ペプチド解析システムの全体構成図、図2は本システムにおける糖ペプチド解析の処理手順を示すフローチャート、図3及び図4は図2に示した糖ペプチド解析処理を説明するための概念図である。
【0027】
本実施例の糖ペプチド解析システムは、大別して、質量分析部1と、コンピュータを中心に構成される制御・処理部2と、から成る。質量分析部1はマトリクス支援レーザ脱離イオン化四重極イオントラップ飛行時間型質量分析装置(MALDI−QIT−TOFMS)であり、分析対象である試料中の分子や原子をイオン化するMALDI法によるイオン化部10と、発生したイオンを一時的に捕捉し、質量電荷比m/zに応じたイオンの選別と衝突誘起解離(CID)によるイオンの解離とを実行可能な3次元四重極型のイオントラップ11と、そのイオントラップ11から出射された各種イオンを質量電荷比に応じて分離して検出する飛行時間型質量分析器(TOFMS)12と、を含む。飛行時間型質量分析器12は、リフレクトロン電極により発生する電場によりイオンを折返し飛行させる飛行空間13と、該飛行空間13を飛行する間に質量電荷比に応じて時間的に分離されたイオンを順次検出するイオン検出器14と、を含む。
【0028】
ここではイオン化部10はMALDIイオン源であるが、イオン化法はこれに限るものではなく、例えばESIなどを用いてもよい。ただし、インソース分解などにより糖鎖からシアル酸や硫酸基などが脱離することを利用してMS1スペクトル上で目的とする糖ペプチド由来のイオンを検出する場合には、インソース分解などが起こり易いイオン化法を採用する必要があり、その目的ではMALDI法やそれ以外のレーザ照射を利用したイオン化法が好適である。
【0029】
制御・処理部2は、質量分析部1の各部を制御する分析制御部3、イオン検出器14から得られる検出信号を処理するデータ処理部20、ユーザが検索条件を入力設定したりスペクトル解析のために必要な各種操作を行ったりするための入力部5や検索条件入力設定画面を表示したり同定結果を表示したりするための表示部6が接続され、システム全体を統括的に制御する制御部4、を含む。データ処理部20は、検出信号に基づいてMSnスペクトルを作成するスペクトル作成部21、MSnスペクトルを解析して例えば特定のピークを抽出する等のデータ処理を実行するスペクトル解析部22、MSnスペクトルから収集されたピーク情報に対しデノボシーケンスによる処理を実行するデノボ配列解析処理部23、ペプチドのアミノ酸配列を推定するための同定用情報が予め登録された同定用データベース(DB)25、そのデータベース25を用いてピークリストに一致する可能性の高いペプチドの検索を行うデータベース検索部24、などを機能ブロックとして含む。このデータベース検索部24の機能は、例えば英国マトリックス・サイエンス社が提供するマスコット(Mascot)に含まれるMS/MSイオンサーチと名付けられた検索エンジンを利用することができる。また、デノボ配列解析処理部23の機能は、例えば上述したピークス(PEAKSTM)などのソフトウエアを利用することができる。
【0030】
次に、本実施例の糖ペプチド解析システムにおける特徴的なN-結合型糖ペプチド解析方法について、図2のフローチャートに沿って説明する。
【0031】
分析者は目的とするタンパク質を適宜の酵素(例えばトリプシン酵素)により消化し、糖ペプチドを含む被検試料を調製する。分析制御部3の制御の下に、質量分析部1により上記被検試料に対するMS1分析が実行されると、スペクトル作成部21はMS1分析により得られたデータに基づいてMS1スペクトルを作成する(ステップS1)。
【0032】
スペクトル解析部22は、ステップS1で作成されたMS1スペクトルからシアル酸等の糖鎖のニュートラルロスによって発現しているプロダクトイオンピークを見つけ、このプロダクトイオンをMS2分析のためのプリカーサイオンとして選定する(ステップS2)。
【0033】
次に、分析制御部3の制御の下に、質量分析部1により被検試料に対してステップS2で選定されたプリカーサイオンについてのMS2分析がそれぞれ実行されると、スペクトル作成部21はMS2スペクトルを作成する(ステップS3)。より詳しく述べると、イオン化部10において被検試料から生成された各種イオンは一旦イオントラップ11に捕捉され、イオントラップ11においてプリカーサイオンの質量電荷比を持つイオンのみが選別された後にCIDによる1回の解離操作がなされる。それによって生成された各種プロダクトイオンはイオントラップ11から一斉に出射されて飛行時間型質量分析器12により質量分析され、それにより得られる検出信号に基づいてスペクトル作成部21はMS2スペクトルを作成する。
【0034】
図3に示す例では、(a)に示したMS1スペクトル上でm/z=M1のイオンピークがプリカーサイオンとして選定され、それに対してMS2分析が実施された結果、(b)に示したMS2スペクトルが得られている。前述のように、被検試料に含まれるN-結合型糖ペプチドが、N末端にグルタミン、グルタミン酸、カルバミドメチル化システインなど特定のアミノ酸残基が位置するものであった場合、ステップS3のCIDの過程でN末端の特定アミノ酸残基の環化が優先的に生じ、そのためにNH3やH2Oのニュートラルロスが発生する。その結果、MS2スペクトルに出現する糖のニュートラルロスにより生じた各プロダクトイオンピークは全体的にNH3又はH2Oのニュートラルロスの分だけ、つまり17Da又は18Daだけ低質量電荷比方向にシフトすることになる。これら優先的な環化は糖ペプチドにおいては糖のニュートラルロスと同時に発生し、特にN末端アミノ酸残基がグルタミン(Gln)である場合に顕著に、上述のトリプレットピークを構成するイオンを含む糖鎖のニュートラルロスで得られたプロダクトイオン全てにおいて、低質量電荷比側への17Daの質量電荷比ずれが生じることを本発明者は確認している。
【0035】
続いて、スペクトル解析部22及びデノボ配列解析処理部23はMS2スペクトルに現れているピークを解析し、そのピーク情報に基づくデノボシーケンス処理を実行することにより、MS2スペクトル中のピークを、CID等の解離作用により糖が中性的に(電荷を変えずに)脱離して生じたプロダクトイオンとして帰属する。そして、その帰属結果を利用してN末端アミノ酸残基の環化に特有の質量電荷比ずれが存在するか否かを推定する(ステップS4)。
【0036】
具体的には、まず、N-結合型糖ペプチドのMS2スペクトルに特徴的に現れるトリプレットピーク(質量電荷比差が低質量電荷比側から83Da、120Daで並ぶ3本のピーク)を探索する。トリプレットピークの候補が複数組存在した場合には、例えばイオンピーク強度の高い組から順に候補を表示部6の画面上に表示し、例えば分析者がそのうちの1組のトリプレットピークを入力部5により選択すればよい。トリプレットピークが検出されたならば、そのトリプレットピークの中の質量電荷比が最大であるピークを開始点とし、MS2分析のプリカーサイオンの質量電荷比M1を終了点として、イオンピーク列の中の隣接する2本のピークの質量電荷比差、つまり糖鎖のニュートラルロスにより生じたプロダクトイオンを順次帰属してゆく(図3(b)参照)。なお、帰属できないピークについては、例えば1本であれば飛ばす等の適宜のアルゴリズムを採ることができる。
【0037】
そうして順にプロダクトイオンの帰属を実施してゆき、帰属できたプロダクトイオンのうち最も質量電荷比の大きいプロダクトイオンピークを得る。該最も質量電荷比の大きいプロダクトイオンピークとMS2分析のプリカーサイオンとの間に糖のニュートラルロスを帰属できず、且つ、そのMS2分析のプリカーサイオンの質量電荷比M1に対してΔm((17Da又は18Da) のニュートラルロスを仮定した(つまりは質量電荷比がM1−Δmである)仮想的なMS2プリカーサイオンに対して糖のニュートラルロスの帰属が可能であった場合、即ち、その最も大きな質量電荷比をもつプロダクトイオンを仮想MS2プリカーサイオンからの糖のニュートラルロスとして帰属することが可能であった場合に、N末端のアミノ酸残基の環化に特有の質量電荷比ずれがあると推定する(ステップS5でY)。
【0038】
なお、MS2スペクトル上でトリプレットピークが検出できなかった場合には、ここでは分析対象外であるO-結合型糖ペプチドである可能性が高いが、該糖ペプチドの糖鎖組成を推定したい場合には、MS2プリカーサイオンから質量電荷比が低くなる方向に向かってデノボシーケンス処理により糖鎖組成推定を実行すればよい。
【0039】
また、ステップS4の処理は実質的に糖鎖組成を推定することに相当するから、ここで得られた帰属情報に基づいて糖鎖組成や糖鎖構造を推定することも可能である。
【0040】
ステップS5でN末端のアミノ酸残基の環化ありと推定された場合にはステップS6へと進み、上記ステップS4とは別の観点で、具体的にはMS2スペクトル上で観測される特定のトリプレットピークとMS1スペクト上で観測される特定のトリプレットピークとの質量電荷比の差に基づいて、N末端アミノ酸残基の環化の有無を確認する。
【0041】
即ち、スペクトル解析部22は、ステップS1で取得されたMS1スペクトルにおいて、上述した、質量電荷比差が低質量電荷比側から83Da、120Daで並ぶ3本のピークからなるトリプレットピークを探索する。そして、このMS1スペクトル上のトリプレットピークT1とステップS4において検出されたMS2スペクトル上のトリプレットピークT2との質量電荷比の差Δmを求め、この差がNH3又はH2Oの脱離に相当する17Da又は18Daである場合には、糖鎖ではなくペプチドイオンに対してN末端の特定アミノ酸残基の環化による質量電荷比ずれがあると推定する(ステップS7でY)。その場合、ステップS4とステップS6との2つの異なる推定において共に同じ結果が得られたことになるから、この時点でN末端のアミノ酸残基の環化が存在すると判断する(ステップS8)。
【0042】
ステップS4又はステップS6のいずれかにおいて、ペプチドのN末端のアミノ酸残基の環化に対応した質量電荷比ずれとは整合しない結果が出た場合には、ステップS5、S7でNと判定され、ステップS8をパスしてステップS9へと進む。したがって、この場合には、ペプチドのN末端のアミノ酸残基の環化は存在しないものと結論付けられる。
【0043】
ステップS9へ進むと、スペクトル解析部22は、ステップS3で取得されたMS2スペクトルについて、上記ステップS4で抽出されたトリプレットピークにそれぞれ対応するイオン、つまり、全ての糖鎖が脱離したペプチドに帰属されるプロダクトイオン、1個の糖鎖が付加したHexNAc環開裂断片による修飾を受けたペプチドに由来するプロダクトイオン、及び、HexNAcによる修飾を受けたペプチドに由来するプロダクトイオンのいずれかをMS3分析のプリカーサイオンとして選定する。
【0044】
なお、ステップS6において図4に示すようにMS1スペクトル上にトリプレットピークが検出されており、そのトリプレットピークを構成するいずれかのイオンのイオン強度が対応するMS2スペクトル上のトリプレットピークを構成する1つのイオンのイオン強度よりも大きい場合には、そのMS1スペクトル上のトリプレットピークに対応するイオンを擬似MS3分析のプリカーサイオンとして選定するようにしてもよい。これは、インソース分解が顕著に現れる場合には、MS1スペクトルは実質的にはMS2スペクトルと同等の擬似MS2スペクトルであり、擬似MS3プリカーサイオンについての擬似MS3分析を実施したほうがMS3スペクトルよりもイオン強度の高い擬似MS3スペクトルが得られる可能性が高いためである。
【0045】
選定されたプリカーサイオンの情報は分析制御部3に送られ、分析制御部3の制御の下に、そのプリカーサイオンに関するMS3分析(又は擬似MS3分析)が質量分析部1において実行され、それによって取得されたデータに基づいてスペクトル作成部21はMS3スペクトル(又は擬似MS3スペクトル)を作成する(ステップS10)。
【0046】
次いで、スペクトル解析部22は作成されたMS3スペクトル(又は擬似MS3スペクトル)から、有意なつまりはノイズピーク等を除去したピークの情報を収集してピークリストを作成する(ステップS11)。その後、データベース検索部24はステップS11で作成されたピークリストと既知の又は推定に基づく修飾情報に基づき、後述するペプチド同定のためのデータベース検索の検索条件を設定する(ステップS12)。ステップS8においてN末端アミノ酸残基の環化が存在すると判断されている場合には、それを修飾条件の1つとして設定する。具体的には、後述するようにMS/MSイオンサーチの検索設定の際のバリアブル・モディフィケイションとして「Gln->Pyro-Glu(N-term Q)」などを設定すればよい。また、デノボシーケンス処理の結果等により、特定の糖又は糖の開裂断片による修飾が存在することが判明していれば、それを修飾条件として加えればよい。
【0047】
データベース検索部24はステップS12において設定された検索条件に従って、同定用データベース25に登録されているペプチドのアミノ酸配列のピークパターンとの照合によるデータベース検索を実行する(ステップS13)。データベース検索として例えば上記MS/MSイオンサーチ法を用いることができるが、データベース検索法はこれに限るものではなく、周知の他の方法を用いてもよい。
【0048】
例えばMS/MSイオンサーチ法によるデータベース検索では、既知のペプチドとのピークパターンの一致度を示す指標(スコア)が計算されるから、そのスコアが高く、且つ、指定した修飾を受けているものを、候補として例えばスコア順にリストアップする。また、ステップS4においてデノボシーケンス処理により推定された糖鎖組成の候補もリストアップする。そして、そのリストアップされたものを同定結果として表示部6の画面上に表示して分析者に提示する(ステップS14)。
【0049】
本実施例の糖ペプチド解析システムでは、N-結合型糖ペプチドのN末端のアミノ酸残基がグルタミンやグルタミン酸、カルバミドメチル化したシステインである場合に、そのアミノ酸残基の環化によってNH3やH2Oが脱離してしまっても、そうした優先的な脱離が生じたことをMS2スペクトルの段階で検出し、ペプチドのN末端にそうした特定のアミノ酸残基が存在することを条件としたデータベース検索によりペプチド同定を行うことができる。したがって、N-結合型糖ペプチドにおけるペプチド同定の精度を向上させることができる。
【0050】
なお、上記実施例では、ステップS4によるN末端アミノ酸残基の環化の有無の推定に加え、ステップS6において別の手法によるN末端アミノ酸残基の環化の有無の推定を行うことで、その推定の信頼度を高めているが、本願発明者の検討によれば、多くの場合、ステップS4による推定だけでも十分に高い信頼度で以てN末端アミノ酸残基の環化の有無を判断することができる。したがって、ステップS6、S7の処理を省いても、実際上問題はない。
【0051】
また、ステップS6、S7の処理を省く代わりに、MS2スペクトルから収集したピーク情報に対してデータベース検索を試み、その結果によってN末端アミノ酸残基の環化の有無を判断する処理をフローに加えるようにしてもよい。ここでは、データベース検索にMS/MSイオンサーチを用いるものとする。
【0052】
図5はMS/MSイオンサーチの検索条件設定画面の一例である。設定すべき主な検索条件として、照合に使用するデータベース(Database)、タンパク質の分解に使用した消化酵素の種類(エンザイム:Enzyme)、確定的に起こる修飾の種類(フィックスド・モディフィケイション:Fixed modification)、起こる可能性のある(非確定的な)修飾の種類(バリアブル・モディフィケイション:Variable modification)、質量分析の精度の許容値(MS/MS tol.)などがある。上述したようなN末端アミノ酸残基の環化はバリアブル・モディフィケイションとして指定することが可能である。図5中に示した「Gln->Pyro-Glu(N-term Q)」は、N末端のグルタミン(Q)残基が環化されてピログルタミン酸(Pyro-Glutamic acid)になる場合を、「Glu->Pyro-Glu (N-term E)」は、N末端グルタミン酸(E)残基が環化されてピログルタミン酸になる場合を示す(「MASCOT Server 修飾の定義方法 3」、インターネット<URL : http://www.matrixscience.jp/pdf/jap_mod_file.pdf>参照)。この他、N末端のカルバミドメチル化システイン(C)が環化されてピロカルバミドメチル化システイン(Pyro-carbamidomethyl cystein)になる場合として「Pyro-carbamidomethyl(N-term C)」を、バリアブル・モディフィケイションとして指定することが可能である。
【0053】
そこで、スペクトル解析部22は、ステップS3で取得したMS2スペクトルからピークを収集してピークリストを作成し、データベース検索部24はこのピークリストに対しバリアブル・モディフィケイションとして「Gln->Pyro-Glu(N-term Q)」や「Glu->Pyro-Glu(N-term E)」、「Pyro-carbamidomethyl(N-term C)」などを指定した上でデータベース検索を実行する。そしてその結果、環化したペプチドが一定の条件でヒットするか否かを確認する。例えば、N末端のアミノ酸残基が環化したグルタミン又はグルタミン酸であるペプチドが最も高いスコアでヒットしたならば、バリアブル・モディフィケイションとして指定した条件が適切である、即ち、MS2スペクトルにおいてN末端のアミノ酸残基の環化によってNH3又はH2Oの脱離が生じているものと判断する。ステップS5でYと判定され、さらに上記のようなMS2スペクトルに対するデータベース検索の結果でもN末端のアミノ酸残基の環化が生じていると判定されたならば、ステップS9に進んでMS3分析を実行すればよい。このようにしても、N末端アミノ酸残基の環化の有無の推定が高い信頼性を以てなされるので、ペプチド同定の精度を高めることができる。
【0054】
なお、上記実施例は本発明の一例にすぎず、本発明の趣旨の範囲で適宜変形、修正、追加等を行っても本願特許請求の範囲に包含されることは当然である。
【符号の説明】
【0055】
1…質量分析部
10…イオン化部
11…イオントラップ
12…飛行時間型質量分析器
13…飛行空間
14…イオン検出器
2…制御・処理部
20…データ処理部
21…スペクトル作成部
22…スペクトル解析部
23…デノボ配列解析処理部
24…データベース検索部
25…同定用データベース
3…分析制御部
4…制御部
5…入力部
6…表示部
【特許請求の範囲】
【請求項1】
nが1〜3であるMSn分析を実行可能な質量分析装置を利用して、被検試料中のN-結合型糖ペプチドの構造を解析する糖ペプチド解析方法であって、
a)被検試料をMS1分析して得られたMS1スペクトルに現れる糖ペプチド由来のイオンをプリカーサイオンとして選定するMS2プリカーサ選定ステップと、
b)前記被検試料に対し前記MS2プリカーサ選定ステップにおいて選定されたプリカーサイオンに関するMS2分析を実行してMS2スペクトルを取得するMS2分析実行ステップと、
c)前記MS2スペクトル上で特定質量電荷比の差を有して並ぶプロダクトトイオンピーク列に対しデノボシーケンス処理を適用して各ピークに対応したプロダクトイオンの帰属を行いつつ、該デノボシーケンンス処理により帰属されたピークのうち最も大きな質量電荷比をもつプロダクトイオンとプリカーサイオンとの質量電荷比の差に生じる特定の質量電荷比ずれを検出することにより、N末端の特定アミノ酸残基の環化の存在を推定するN末端環化検出ステップと、
d)N-結合型糖ペプチドのMS2スペクトルに特徴的に観測されるトリプレットピークを前記MS2分析実行ステップで取得されたMS2スペクトル上で検出し、該トリプレットピークを構成する少なくとも1つのイオンをMS3分析のプリカーサイオンとして選定するMS3プリカーサ選定ステップと、
e)前記被検試料に対し前記MS3プリカーサ選定ステップにおいて選定されたプリカーサイオンに関するMS3分析を実行してMS3スペクトルを取得するMS3分析実行ステップと、
f)前記N末端環化検出ステップにおいてN末端の特定アミノ酸残基の環化が存在すると推定された場合にN末端特定アミノ酸残基の環化を修飾条件とし、前記MS3分析実行ステップにより取得されたMS3スペクトルにおいて検出されるイオンピークの情報に基づくデータベース検索を実行して、目的とする糖ペプチドのペプチドを同定する同定処理ステップと、
を有することを特徴とする糖ペプチド解析方法。
【請求項2】
請求項1に記載の糖ペプチド解析方法であって、
前記MS2スペクトル上で検出されたトリプレットピークに対し前記N末端環化検出ステップで求まった特定の質量電荷比ずれを加えたトリプレットピークが、前記MS1スペクトル中に検出されるか否かを判別し、トリプレットピークが検出された場合にこれを疑似的なMS3プリカーサイオンとして選定する疑似MS3プリカーサ選定ステップと、
前記被検試料に対し前記擬似MS3プリカーサ選定ステップにおいて選定された擬似MS3プリカーサイオンに関する擬似MS3分析を実行して擬似MS3スペクトルを取得する擬似MS3分析実行ステップと、をさらに有し、
前記同定処理ステップでは、前記N末端環化検出ステップにおいてN末端の特定アミノ酸残基の環化が存在すると推定された場合にN末端特定アミノ酸残基の環化を修飾条件とし、前記擬似MS3分析実行ステップにより取得された擬似MS3スペクトルにおいて検出されるイオンピークの情報に基づくデータベース検索を実行して、目的とする糖ペプチドのペプチドを同定することを特徴とする糖ペプチド解析方法。
【請求項3】
請求項1又は2に記載の糖ペプチド解析方法であって、
前記N末端環化検出ステップは、帰属された少なくとも1つのプロダクトイオンとプリカーサイオンとの質量電荷比の差に生じる特定の質量電荷比ずれを検出したのに加え、前記MS2スペクトル上で検出されたトリプレットピークと、該トリプレットピークと同一の質量電荷比差をもって前記MS1スペクトル上で検出されるトリプレットピークとの質量電荷比の差が特定の値である場合に、N末端の特定アミノ酸残基の環化が存在すると推定することを特徴とする糖ペプチド解析方法。
【請求項4】
請求項1又は2に記載の糖ペプチド解析方法であって、
前記N末端環化検出ステップは、前記同定処理ステップにおいて実行される、N末端特定アミノ酸残基の環化を修飾条件としたデータベース検索の結果、環化したペプチドが所定の条件の下で一致した場合に、N末端の特定アミノ酸残基の環化が存在すると推定することを特徴とする糖ペプチド解析方法。
【請求項5】
nが1〜3であるMSn分析を実行可能な質量分析装置を利用して、被検試料中のN-結合型糖ペプチドの構造を解析する糖ペプチド解析装置において、
a)被検試料に対しMS1分析を実行してMS1スペクトルを取得するべく前記質量分析装置の動作を制御するMS1分析実行制御手段と
b)前記MS1スペクトルに現れる糖ペプチド由来のイオンをプリカーサイオンとして選定するMS2プリカーサ選定手段と、
c)前記被検試料に対し前記MS2プリカーサ選定手段により選定されたプリカーサイオンに関するMS2分析を実行してMS2スペクトルを取得するべく前記質量分析装置の動作を制御するMS2分析実行制御手段と、
d)前記MS2スペクトル上で特定質量電荷比の差を有して並ぶプロダクトトイオンピーク列に対しデノボシーケンス処理を適用して各ピークに対応したプロダクトイオンの帰属を行いつつ、該デノボシーケンンス処理により帰属されたピークのうち最も大きな質量電荷比をもつプロダクトイオンとプリカーサイオンとの質量電荷比の差に生じる特定の質量電荷比ずれを検出することにより、N末端の特定アミノ酸残基の環化の存在を推定するN末端環化検出手段と、
e)N-結合型糖ペプチドのMS2スペクトルに特徴的に観測されるトリプレットピークを被検試料に対して取得された前記MS2スペクトル上で検出し、該トリプレットピークを構成する少なくとも1つのイオンをMS3分析のプリカーサイオンとして選定するMS3プリカーサ選定手段と、
f)前記被検試料に対し前記MS3プリカーサ選定手段により選定されたプリカーサイオンに関するMS3分析を実行してMS3スペクトルを取得するべく前記質量分析装置の動作を制御するMS3分析実行制御手段と、
g)前記N末端環化検出手段においてN末端の特定アミノ酸残基の環化が存在すると推定された場合にN末端特定アミノ酸残基の環化を修飾条件とし、被検試料に対して取得された前記MS3スペクトルにおいて検出されるイオンピークの情報に基づくデータベース検索を実行して、目的とする糖ペプチドのペプチドを同定する同定処理手段と、
を備えることを特徴とする糖ペプチド解析装置。
【請求項1】
nが1〜3であるMSn分析を実行可能な質量分析装置を利用して、被検試料中のN-結合型糖ペプチドの構造を解析する糖ペプチド解析方法であって、
a)被検試料をMS1分析して得られたMS1スペクトルに現れる糖ペプチド由来のイオンをプリカーサイオンとして選定するMS2プリカーサ選定ステップと、
b)前記被検試料に対し前記MS2プリカーサ選定ステップにおいて選定されたプリカーサイオンに関するMS2分析を実行してMS2スペクトルを取得するMS2分析実行ステップと、
c)前記MS2スペクトル上で特定質量電荷比の差を有して並ぶプロダクトトイオンピーク列に対しデノボシーケンス処理を適用して各ピークに対応したプロダクトイオンの帰属を行いつつ、該デノボシーケンンス処理により帰属されたピークのうち最も大きな質量電荷比をもつプロダクトイオンとプリカーサイオンとの質量電荷比の差に生じる特定の質量電荷比ずれを検出することにより、N末端の特定アミノ酸残基の環化の存在を推定するN末端環化検出ステップと、
d)N-結合型糖ペプチドのMS2スペクトルに特徴的に観測されるトリプレットピークを前記MS2分析実行ステップで取得されたMS2スペクトル上で検出し、該トリプレットピークを構成する少なくとも1つのイオンをMS3分析のプリカーサイオンとして選定するMS3プリカーサ選定ステップと、
e)前記被検試料に対し前記MS3プリカーサ選定ステップにおいて選定されたプリカーサイオンに関するMS3分析を実行してMS3スペクトルを取得するMS3分析実行ステップと、
f)前記N末端環化検出ステップにおいてN末端の特定アミノ酸残基の環化が存在すると推定された場合にN末端特定アミノ酸残基の環化を修飾条件とし、前記MS3分析実行ステップにより取得されたMS3スペクトルにおいて検出されるイオンピークの情報に基づくデータベース検索を実行して、目的とする糖ペプチドのペプチドを同定する同定処理ステップと、
を有することを特徴とする糖ペプチド解析方法。
【請求項2】
請求項1に記載の糖ペプチド解析方法であって、
前記MS2スペクトル上で検出されたトリプレットピークに対し前記N末端環化検出ステップで求まった特定の質量電荷比ずれを加えたトリプレットピークが、前記MS1スペクトル中に検出されるか否かを判別し、トリプレットピークが検出された場合にこれを疑似的なMS3プリカーサイオンとして選定する疑似MS3プリカーサ選定ステップと、
前記被検試料に対し前記擬似MS3プリカーサ選定ステップにおいて選定された擬似MS3プリカーサイオンに関する擬似MS3分析を実行して擬似MS3スペクトルを取得する擬似MS3分析実行ステップと、をさらに有し、
前記同定処理ステップでは、前記N末端環化検出ステップにおいてN末端の特定アミノ酸残基の環化が存在すると推定された場合にN末端特定アミノ酸残基の環化を修飾条件とし、前記擬似MS3分析実行ステップにより取得された擬似MS3スペクトルにおいて検出されるイオンピークの情報に基づくデータベース検索を実行して、目的とする糖ペプチドのペプチドを同定することを特徴とする糖ペプチド解析方法。
【請求項3】
請求項1又は2に記載の糖ペプチド解析方法であって、
前記N末端環化検出ステップは、帰属された少なくとも1つのプロダクトイオンとプリカーサイオンとの質量電荷比の差に生じる特定の質量電荷比ずれを検出したのに加え、前記MS2スペクトル上で検出されたトリプレットピークと、該トリプレットピークと同一の質量電荷比差をもって前記MS1スペクトル上で検出されるトリプレットピークとの質量電荷比の差が特定の値である場合に、N末端の特定アミノ酸残基の環化が存在すると推定することを特徴とする糖ペプチド解析方法。
【請求項4】
請求項1又は2に記載の糖ペプチド解析方法であって、
前記N末端環化検出ステップは、前記同定処理ステップにおいて実行される、N末端特定アミノ酸残基の環化を修飾条件としたデータベース検索の結果、環化したペプチドが所定の条件の下で一致した場合に、N末端の特定アミノ酸残基の環化が存在すると推定することを特徴とする糖ペプチド解析方法。
【請求項5】
nが1〜3であるMSn分析を実行可能な質量分析装置を利用して、被検試料中のN-結合型糖ペプチドの構造を解析する糖ペプチド解析装置において、
a)被検試料に対しMS1分析を実行してMS1スペクトルを取得するべく前記質量分析装置の動作を制御するMS1分析実行制御手段と
b)前記MS1スペクトルに現れる糖ペプチド由来のイオンをプリカーサイオンとして選定するMS2プリカーサ選定手段と、
c)前記被検試料に対し前記MS2プリカーサ選定手段により選定されたプリカーサイオンに関するMS2分析を実行してMS2スペクトルを取得するべく前記質量分析装置の動作を制御するMS2分析実行制御手段と、
d)前記MS2スペクトル上で特定質量電荷比の差を有して並ぶプロダクトトイオンピーク列に対しデノボシーケンス処理を適用して各ピークに対応したプロダクトイオンの帰属を行いつつ、該デノボシーケンンス処理により帰属されたピークのうち最も大きな質量電荷比をもつプロダクトイオンとプリカーサイオンとの質量電荷比の差に生じる特定の質量電荷比ずれを検出することにより、N末端の特定アミノ酸残基の環化の存在を推定するN末端環化検出手段と、
e)N-結合型糖ペプチドのMS2スペクトルに特徴的に観測されるトリプレットピークを被検試料に対して取得された前記MS2スペクトル上で検出し、該トリプレットピークを構成する少なくとも1つのイオンをMS3分析のプリカーサイオンとして選定するMS3プリカーサ選定手段と、
f)前記被検試料に対し前記MS3プリカーサ選定手段により選定されたプリカーサイオンに関するMS3分析を実行してMS3スペクトルを取得するべく前記質量分析装置の動作を制御するMS3分析実行制御手段と、
g)前記N末端環化検出手段においてN末端の特定アミノ酸残基の環化が存在すると推定された場合にN末端特定アミノ酸残基の環化を修飾条件とし、被検試料に対して取得された前記MS3スペクトルにおいて検出されるイオンピークの情報に基づくデータベース検索を実行して、目的とする糖ペプチドのペプチドを同定する同定処理手段と、
を備えることを特徴とする糖ペプチド解析装置。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2012−220365(P2012−220365A)
【公開日】平成24年11月12日(2012.11.12)
【国際特許分類】
【出願番号】特願2011−87311(P2011−87311)
【出願日】平成23年4月11日(2011.4.11)
【出願人】(000001993)株式会社島津製作所 (3,708)
【Fターム(参考)】
【公開日】平成24年11月12日(2012.11.12)
【国際特許分類】
【出願日】平成23年4月11日(2011.4.11)
【出願人】(000001993)株式会社島津製作所 (3,708)
【Fターム(参考)】
[ Back to top ]

