糖修飾核酸と貴金属のコンジュゲート
【課題】オリゴヌクレオチドの標的細胞または組織への効果的なデリバリーの可能なナノ粒子の提供。
【解決手段】金ナノ粒子に結合したオリゴヌクレオチド最末端に糖残基を担持したコンジュゲート。式(I)MeNP(−thio−L1−nuc−L2−carb)p(I)式中、MeNPは金または銀等の貴金属ナノ粒子を表し、thio−L1は貴金属ナノ粒子表面とチオール基(1または2以上)の相互作用により当該表面に−thio−L1−nuc−L2−carb鎖を結合できる硫黄原子を1個または2個以上含有する基または部分(moiety)を表し、nucは一本鎖もしくは二本鎖−オリゴ−もしくはポリヌクレオチドを表し、L2は直接結合またはリンカーを表し、carbは糖残基を表し、そしてpは5〜100000の整数を表す、で表される糖修飾核酸と貴金属ナノ粒子のコンジュゲート。
【解決手段】金ナノ粒子に結合したオリゴヌクレオチド最末端に糖残基を担持したコンジュゲート。式(I)MeNP(−thio−L1−nuc−L2−carb)p(I)式中、MeNPは金または銀等の貴金属ナノ粒子を表し、thio−L1は貴金属ナノ粒子表面とチオール基(1または2以上)の相互作用により当該表面に−thio−L1−nuc−L2−carb鎖を結合できる硫黄原子を1個または2個以上含有する基または部分(moiety)を表し、nucは一本鎖もしくは二本鎖−オリゴ−もしくはポリヌクレオチドを表し、L2は直接結合またはリンカーを表し、carbは糖残基を表し、そしてpは5〜100000の整数を表す、で表される糖修飾核酸と貴金属ナノ粒子のコンジュゲート。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は糖修飾核酸と貴金属のコンジュゲートに関し、特に、糖修飾核酸と金ナノ粒子のコンジュゲートに関する。
【背景技術】
【0002】
次世代の医薬品としてアンチセンス、アプタマー、siRNAなどの核酸医薬品が期待されており、既に眼科領域では製品化されている。今後、これら核酸医薬を様々な部位への疾患に適用させることが望まれている。このために解決すべき課題としては核酸を構成するオリゴヌクレオチドの不安定性及びそれぞれの疾患に適した有効なデリバリー方法の開発が挙げられる。近年ではオリゴ−もしくはポリヌクレオチドの安定性及び安全性の向上を目的として、ヌクレオチドに様々な化学修飾が施され、臨床の場で用いられている。さらにカチオン性のポリマー及びリポソームにオリゴヌクレオチドを内包させることで、全身投与系での臨床試験も行われ始めた。
【0003】
これらの手法の中、アニオン性分子である核酸をカチオン性のミセルやリポソームを用いて核酸内包ナノ粒子として核酸をデリバリーする手法は遺伝子導入に広く用いられている手法である。しかし、オリゴヌクレオチドを運ぶ際には核酸分子が短いため静電相互作用が弱く生体内でナノ粒子が崩壊してしまい効果的なデリバリーが困難である。また、カチオン性の分子は炎症反応を引き起こすことが知られており、毒性の問題もある。カチオン性の粒子を用いる以外の手法として、金粒子上にオリゴヌクレオチドを結合させ、オリゴヌクレオチドをデリバリーする報告がある(例えば、非特許文献1、非特許文献2、非特許文献3参照)。
【0004】
非特許文献1では、チオール化したオリゴヌクレオチド(siRNA)をポリ(エチレングリコール)−block−ポリ(2−(N,N−ジメチルアミノ)エチルメタクリレートと共に金ナノ粒子上に結合させた構築物を用いることによりsiRNAをin vitroにおいて細胞内へデリバリーすることに成功したことが記載されている。この構築物はポリ(エチレングリコール)−block−ポリ(2−(N,N−ジメチルアミノ)エチルメタクリレートの存在により構築物全体及びsiRNAの生理条件下での優れた安定性が達成されることが示唆されている。非特許文献2及び3では、それぞれ、生理食塩水中及び血清中で安定性を示す金ナノ粒子とオリゴヌクレオチドのコンプレックスまたはコンジュゲート(RNA−Au NP)が記載されている。前者は、オリゴヌクレオチド(アンチセンスオリゴヌクレオチド)を3’末端に導入したアルキルチオールまたは2つの環状ジスルフィド(two cyclic disulfide)を介して金ナノ粒子に結合させており、後者は、オリゴヌクレオチド(siRNA)をそのセンス鎖の3’末端に導入したオリゴエチレングリコール−チオールを介して金ナノ粒子に結合させている。後者のRNA−Au NPは、10%血清中で対応する二本鎖RNAに比べて6倍大きい半減期を有することも非特許文献3には記載されている。
【0005】
他方、二本鎖ポリヌクレオチドコンプレックスを安定化または不安定化するポリヌクレオチドと結合する化合物を同定する方法において使用するものとして、オリゴヌクレオチドを結合した機能化ナノ粒子が提案されている(特許文献1)。これらのナノ粒子は、オリゴヌクレオチドの3’−または5’−末端に導入したアルカンチオール、アルカンジスルフィドまたは環状ジスルフィドを介して金表面にオリゴヌクレオチドを結合して作製されている。また、かようなオリゴヌクレオチドに使用環境下(生物学的流体中等)での安定性を付与する目的でヌクレオチド間の結合を改変したり、ヌクレオチドの糖残基を修飾したり、することも記載されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】US 2009/0221095 A1
【非特許文献】
【0007】
【非特許文献1】Oishi et.al.Chemistry Letters(2006)35,1046−1047
【非特許文献2】Nathaniel et.al.Science(2006)312,1027−1030
【非特許文献3】Giljohann et.al.J.Am.Chem.Soc(2009)131,2027−2073
【発明の概要】
【発明が解決しようとする課題】
【0008】
従来技術文献によると、siRNA等のオリゴヌクレオチドが結合した金粒子またはこのような金粒子に固定化されているsiRNAのオリゴヌクレオチドが血清中である程度安定であり、細胞外ヌクレア−ゼに一定の抵抗性を示すことが示唆されている。しかし、未だ、細胞外の生理学的環境下でより安定性の高いオリゴヌクレオチドを担持するコンジュゲートまたはコンプレックスについてのニーズは依然として存在する。したがって、本発明の目的は、例えば、標的とする特定の細胞または組織にオリゴ−もしくはポリヌクレオチドをデリバリーできる新たなオリゴ−もしくはポリヌクレオチドと適当な担体のコンジュゲートまたはコンプレックスを提供することにある。
【課題を解決するための手段】
【0009】
本発明者等は、固相合成法を利用して核酸の糖修飾を簡易に実施できる方法を開発し、先に特願2009−160887明細書に開示した。この方法で合成した糖修飾オリゴヌクレオチドをチオール化した後、導入したチオール基と金ナノ粒子表面との相互作用により糖修飾オリゴヌクレオチド結合金ナノ粒子のコンジュゲートを作製したところ、血清中等の細胞外の生理学的環境下で安定なナノ粒子コンジュゲートを提供できることを見出した。さらに、このようなオリゴヌクレオチドの安定性は、金に代え銀などの貴金属ナノ粒子を用い場合も同様である。
【0010】
したがって、上記課題は、一般式(I)
MeNP(−thio−L1−nuc−L2−carb)p (I)
で表される糖修飾核酸と貴金属ナノ粒子のコンジュゲートを提供することにより解決できる。
【0011】
上記式中、MeNPは金または銀等の貴金属ナノ粒子を表し、
thio−L1は貴金属ナノ粒子表面とチオール基(1または2以上)の相互作用により当該表面に−thio−L1−nuc−L2−carb鎖を結合できる硫黄原子を1個または2個以上含有する基または部分(moiety)を表し、
nucは一本鎖もしくは二本鎖−オリゴ−もしくはポリヌクレオチドを表し、
L2は直接結合またはリンカーを表し、
carbは糖残基もしくはオリゴ糖鎖を表し、そして
pは5〜100000の整数を表す。
【発明の効果】
【0012】
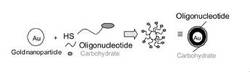
このような一般式(I)で表されるコンジュゲートは、本発明を解釈する上で理論により何ら拘束されるものでないが、水、リン酸緩衝化生理食塩水(PBS)または血液中等の水性媒体中で最外殻に糖残基を持ったナノ粒子を形成するものと理解される。このようなナノ粒子は、−thio−L1−nuc−L2−carb鎖が密集して、例えば金粒子に結合する場合には、あたかも、コア部分(金粒子)−オリゴヌクレオチド部分−糖残基もしくはオリゴ糖鎖部分の三層が静電相互作用でなく、それぞれ共有結合乃至配位結合で結合された構造の新規ナノ粒子を提供する(概念図を図1に示す。)。これらのナノ粒子は最外殻の糖残基もしくはオリゴ糖鎖の存在により、最外殻に糖残基もしくはオリゴ糖鎖を持っていないオリゴヌクレオチド結合金ナノ粒子に比べ、血清等の生体外または生体内環境下での安定性が有意に向上する。さらに、糖残基もしくはオリゴ糖鎖がクラスター状に最外殻層に提示されるため、このクラスター化した糖残基もしくはオリゴ糖鎖と成体組織の相互作用を通して、組織特異的な様式で当該コンジュゲートをデリバリーすることが可能になる。また、理論により拘束されるものでないが、このような安定性は、オリゴヌクレオチドが金ナノ粒子に結合していることと相俟って糖残基の存在がオリゴヌクレオチドに対する周囲環境の化学的もしくは物理的作用による影響を低減し、また、ヌクレア−ゼによる分解に対する抵抗性をオリゴヌクレオチドに付与するものと理解される。したがって、本発明によれば、化学的もしくは物理的に、また、酵素分解性に対して不安定なオリゴヌクレオチドですら安定に標的細胞または組織にデリバリーすることが可能になる。しかも、特定の細胞または組織に標的指向性を有することが知られている糖もしくはオリゴ糖の糖残基もしくはオリゴ糖鎖を最外殻に有するナノ粒子は、向上した標的指向性を示す可能性もある。例えば、ガラクトースを粒子上に多数提示すると肝臓に効率的に取り込まれることが知られており肝臓への特異的なデリバリーへの展開が期待できる。また白血球はシアリルルイスXを表面に多数有しており、血液中を循環している事に寄与している。また悪性腫瘍が転移する際には細胞表面の糖残基が転移先の組織と相互作用することで転移を可能にしていることがわかっている。これらの系に見られるように粒子上に適当な糖残基を提示すると有益な様々な生物学的活性が期待できる。
【図面の簡単な説明】
【0013】
【図1】糖鎖を最外殻に有するナノ粒子の構築方法及び糖鎖を3’末端、チオール基を5’末端に持つオリゴ核酸の概念図である。
【図2】実施例3で構築し、測定したナノ粒子の粒経のグラフ表示である。黒丸の付した実線は糖を最外殻に有する粒子の結果であり、単なる実線は核酸がむき出しになった比較の粒子。
【図3】実施例4におけるナノ粒子の血清中での安定性試験(2週間後の凝集)の結果のグラフ表示である。黒丸の付した実線は糖を最外殻に有する粒子の結果であり、単なる実線は核酸がむき出しになった比較の粒子の結果である。
【図4】実施例4におけるナノ粒子の血清中での安定性試験のUV−Visの測定結果のグラフ表示である。実線が実験開始前の両粒子についての測定結果であり、細い破線は糖を最外殻に有する粒子の結果であり、太い破線は核酸のむき出しになった比較の粒子の結果である。
【図5】実施例5における糖修飾核酸金ナノ粒子と糖未修飾核酸金ナノ粒子のラット初代肝細胞への取込み挙動を表すグラフ表示である。
【図6】実施例6におけるガラストースによるコンペティションアッセイの結果を表すグラフ表示である。
【発明の詳細な記述】
【0014】
以下、本発明を規定する略号または用語についてより具体的に説明する。
【0015】
金または銀等の貴金属ナノ粒子は、金ナノ粒子が好ましく用いられるので、説明を簡潔にするために専ら金ナノ粒子について説明する。金ナノ粒子の形状は、球、または立方晶
系、正方晶系、斜方晶系(8面体もしくは12面体)、単斜方晶系、六方晶系等の晶系にみられる形状またはこれら形状のほぼ80%(各面の長軸または短軸の長さがそれぞれ最大でも20%変化した)が保持された形状の粒子が挙げられる(特定形状の金ナノ粒子の調製方法は、例えば、Wenxin Niu,et al.,J.Am.Chem.Soc(2009)131,697−703参照)。これらの粒子のサイズは、当該技術分野でナノ粒子のカテゴリーに入ると認識されるものである限り限定されるものでないが、例えば、異なる複数の方向から投射した際にできる影の面積から常法に従って球状の粒子に換算した場合に、平均直径が2nm〜500nm、好ましくは、4nm〜250nm、より好ましくは4nm〜100nm、特に好ましくは4nm〜60nmである。また、同様に限定されるものでないが、斜方(直方)体の場合には、短軸(1または2)が2nm〜50nmであり、長軸(1または2)が10〜500nmであるサイズを有する粒子を用いることができる。このような形状及びサイズを持つナノ粒子のいくらかは市販のされており(例えば、BBInternationalのホームページ(http://www.britishbiocell.co.uk/products/goldreagents.asp?navid=2)参照)、市販されていない場合には、非特許文献2または非特許文献3中で引用された文献に記載の方法に準じて容易に入手できる。
【0016】
thioについて定義する、硫黄を1個または2個以上含有する基または部分としては、また、非特許文献1〜3のいずれかにおいてオリゴヌクレオチドをチオール化する際に用いられている、2つの環状ジスルフィド(two cyclic jisurufides(DTPA))、アルキルチオール足場形成(anchoring)基(例えば、−S−C1−C12−アルキレン−の場合、−C1−C12−アルキレン−が−L1−に相当する)等及び下式の()nで表される部分を挙げることができる。
【0017】
【化1】

【0018】
上記の繰り返し数について規定するnはGlen research社の化合物DTAP(Catalog No.10−1937−90)を用いると整数1〜10が選択可能である。
【0019】
nucについて定義する、一本鎖もしくは二本鎖−オリゴ−もしくはポリヌクレオチドにいうヌクレオチドは、核酸(DNAまたはRNA)を構成するヌクレオチドを意味し、5〜100、5〜80、5〜70、5〜60、5〜40、5〜35、5〜30、5〜25、5〜20、5〜15、または5〜10個のヌクレオチドからなるものであることができる。機能上、アンチセンス、アプタマー、siRNA、マイクロRNA等に分類できるオリゴヌクレオチド、さらにこれらのオリゴヌクレオチドを鎖内またはいずれかの末端に含むポリヌクレオチドであることもできる。限定されるものでないが、これらのオリゴ−もしくはポリ−ヌクレオチドは、VEGF(Vascular endothelial growth factor)、Survivin等の遺伝子を標的にしたものであることができる。また、本明細書では核酸とオリゴ−もしくはポリヌクレオチドを交換可能な
概念で用いる場合もある。
【0020】
上記L1とnucとの結合は、ヌクレオチドの3’末端のヒドロキシル基とのエーテル結合もしくはエステル結合またはリン酸残基とのリン酸ジエステル結合またはチオリン酸エステル結合であるか、あるいはまたヌクレオチドの5’末端のHOCH2−とのエーテル結合もしくはエステル結合またはリン酸残基とのリン酸ジエステル結合またはチオリン酸エステル結合であることができる。
【0021】
L2について定義する直接結合またはリンカーにいう、リンカーは、以下の構造式中に含まれる結合を形成することができる。
【0022】
(a)群:
下記式のいずれかに示される後述する部分
【0023】
【化2】

【0024】
上式中、L2に該当する部分は、R1及びR2を除いた部分であり、R1及びR2は、いずれか一方がL1に結合する一般式(I)のnuc部分に相当し、他方が一般式(I)のcarbに相当するものであり、L3及びL4は、相互に独立して、C1−C6−アルキレンまたは−CH2CH2(OCH2CH2)q−(ここで、qは1〜12の整数である)であるか、または存在し得る場合には直接結合であり、かつ、R1またはR2がnuc部分に相当する場合には、L3及びL4は、相互に独立して、L1とnucの結合する3’もしくは5’末端に対して、それぞれnucの逆の5’末端のHOCH2−とエーテル結合もしくはエステル結合、リン酸残基とリン酸ジエステル結合またはチオリン酸エステル結合を形成するか、または3’末端のヒドロキシル基とエーテル結合もしくはエステル結合、リン酸残基とリン酸ジエステル結合またはチオリン酸エステル結合を形成し、あるいはまた、
R1またはR2がcarbに相当する場合には、L3及びL4は、相互に独立して、carbとエーテルまたはエステル結合を形成できる。
【0025】
(b)群:
下記式(I−a)で示される後述部分
【0026】
【化3】

【0027】
で表される糖修飾核酸において、
上式中、L2に該当する部分は、−O−Nuc及びCarbが除かれた部分である。
【0028】
上式中、−O−Nucは一般式(I)のnuc部分に相当し、Carbは一般式(I)のcarbに相当し、nucとL2は、L1とnucの結合する3’もしくは5’末端に対して、それぞれnucの逆の5’末端のHOCH2−とエーテル結合もしくはエステル結合、リン酸残基とリン酸ジエステル結合またはチオリン酸エステル結合を形成するか、もしくは3’末端のヒドロキシル基とエーテル結合もしくはエステル結合、リン酸残基とリン酸ジエステル結合またはチオリン酸エステル結合を形成し、carbとL2の結合はエーテル結合である。
【0029】
上式中、
(i)A及びBはいずれか一方が、水素原子、HOOC−(CH2)2−COO−、HOOC−(CH2)3−COO−またはHOOC−CH2−O−CH2−COO−を表し、他方は水素原子、ヒドロキシル基または保護されたヒドロキシル基を表し、ここで、保護基はハロゲン原子1〜3個により置換されていてもよい直鎖もしくは分岐のC1−C6アルキルカルボニル基、メトキシにより置換されていてもよいベンジルオキシ基、アリルオキシ基、トリ−直鎖もしくは分岐のC1−C6アルキルシリルオキシ基、フェニルカルボニルオキシ基、ピバロエートエステル基、レブリネートエステル基を表す。あるいはまた、
(ii)A及びBは相互に独立して、ヒドロキシル基、または保護されたヒドロキシル基を表し、ここで、保護基はハロゲン原子1〜3個により置換されていてもよい直鎖もしくは分岐のC1−C6アルキルカルボニル基、メトキシにより置換されていてもよいベンジルオキシ基、アリルオキシ基、トリ−直鎖もしくは分岐のC1−C6アルキルシリルオキシ基、フェニルカルボニルオキシ基、ピバロエートエステル基、レブリネートエステル基を表し、あるいはまた
(iii)A及びBは一緒になって、単結合を表す。
【0030】
a、b及びcは、相互に独立して、0〜3の整数を表し、あるいはまたcの付された結合〔式中の(>)c部分〕は存在していなくてもよく、ただし、a、b及びcは全体で3〜7員環を形成するものとして定義されており、mは0〜12の整数を表し、そしてnは0〜12の整数を表す。
【0031】
(c)群
下記式(I−c)
【0032】
【化4】

【0033】
で表される糖修飾核酸において
上式中、L2に該当する部分は、R1及びR2を除いた部分であり、L5は、C1−C6−アルキレンまたは−CH2CH2(OCH2CH2)q−(ここで、qは1〜12の整数である)であり、R1及びR2は、いずれか一方がL1に結合する一般式(I)のnuc部分に相当し、他方が一般式(I)のcarbに相当するものであり、かつ、R1またはR2がnuc部分に相当する場合には、L5は、L1とnucの結合する3’もしくは5’末端に対して、それぞれnucの逆の5’末端のHOCH2−とエーテル結合もしくはエステル結合、リン酸残基とリン酸ジエステル結合またはチオリン酸エステル結合を形成するか、または3’末端のヒドロキシル基とエーテル結合もしくはエステル結合、リン酸残基とリン酸ジエステル結合またはチオリン酸エステル結合を形成し、あるいはまた、R1またはR2がcarbに相当する場合には、L5は、相互に独立して、carbとエーテルまたはエステル結合を形成できる。
【0034】
上記一般式(I)の貴金属ナノ粒子に結合する鎖(−thio−L1−nuc−L2−carb)の数をあらわすpは、当該ナノ粒子のサイズにより大きく変動し、整数5〜100000、好ましくは、10〜5000、より好ましくは10〜3600である。例えば、オリゴ−もしくはポリオリゴヌクレオチドの細胞または組織へのデリバリー用としては、平均直径が4nm〜60nmものもが特に好ましいが、このような粒子を対象とすると、上記のpは、限定されるものでないが、20〜3600であり、例えば、平均直径が4〜17nmである場合には、pは40〜300であることができる。このような数は、それ自体公知の方法で確認できるが、例えば後述する実施例に記載の方法によるのが簡便である。
【0035】
本発明に関して、糖残基もしくはオリゴ糖鎖またはリン酸残基という場合には、リン酸基または糖のヒドロキシル基の1つから水素原子が除去された状態にある基を意味する。このような糖残基もしくはオリゴ糖鎖の起源となる糖としては、各種ペントース、ヘキソース、ヘプトース、ウロン酸、デオキシ糖、アミノ糖、アミノウロン酸、ケトース、及びこれらの糖の2〜15個からなる直鎖または分岐オリゴ糖を挙げることができる。より具体的には、エリトロース、トレオース、リボース、アラビノース、キシロース、リキソース、アロース、アルトロース、グルコース、マンノース、グロース、イドース、ガラクトース、タロース、エリトルロース、リブロース、キシルロース、プシコース、フルクトース、ソルボース、タガトース、セドヘプツロース、2−デオキシリボース、2−デオキシグルコース、キノボース、テベトース、ラムノース、フコース、ジギノース、ジギタロース、ジギトキソース、シマロース、アベクォース、アスカリロース、コリトース、パラトース、チベロース、グルコサミン、マンノサミン、ガラクトサミン、フコサミン、キノボサミン、ラムノサミン、ノジリマイシン、アピオース、ストレプトース、エバロース、ハマメロース、ノイラミン酸、ムラミン酸、N−アセチルグルコサミン、N−アセチルノイラミン酸、N−グライコリルノイラミン酸、N−アセチルガラクトサミン、α,α−トレハロース、β,β−トレハロース、α,β−トレハロース、トレハロサミン、コウジビオース、ニゲロース、マルトース、マルチトール、マルツロース、イソマルトース、イソマルツロース、パラチノース、ソホロース、ラミナラビオース、セロビオース、セロビオン酸、ゲンチオビオース、ガラクトスクロース、ラクトース、ラクトサミン、ラクトースジアミン、ラクトビオン酸、ラクチトール、ラクツロース、メリビオース、ネオラクトース、プリメベロース、ルチノース、シラビオース、スクラロース、スクロース、ツラノース、ビシアノース、ヒアロビウロン酸、セロトリオース、カコトリオース、ゲンチアノース、イソマルトトリオース、イソパノース、マルトトリオース、マンニノトリオース、メレジトース、パノース、プランテオース、ラフィノース、ソラトリオース、ウンベリフェロース、リコテトラオース、マルトテトラオース、スタキオース、マルトペンタオース、ベルバスコース、マルトヘキサオース、α−シクロデキストリン、β−シクロデキストリン、γ−シクロデキストリン、δ−シクロデキストリン、グリコーゲン、アミロース、アミ
ロペクチン、デキストリン、グルカン、キチン質、フラクトオリゴ糖、ガラクトオリゴ糖、マンナンオリゴ糖、シアリルルイスA抗原、シアリルルイスX抗原、好ましくはグルコース、マンノース、ガラクトース、フルクトース、フコース、グルコサミン、ガラクトサミン、N−アセチルグルコサミン、N−アセチルノイラミン酸、N−グライコリルノイラミン酸、N−アセチルガラクトサミン、α,α−トレハロース、β,β−トレハロース、α,β−トレハロース、マルトース、ラクトース、マルトトリオース、シアリルルイスA抗原、シアリルルイスX抗原を糖残基もしくはオリゴ糖鎖の起源として挙げることができる。
【0036】
上記の結合様式の代表例は、下記の式で表すことができる。
【0037】
【化5】

【0038】
なお、本明細書では、糖残基と糖鎖は互換可能な概念で用いている。
【0039】
上記(b)群のリンカーは、本発明者等が先に特願2009−160887に開示したものであり、固相合成法の利用により核酸(オリゴ−もしくはポリヌクレオチド)の糖修飾物を簡易に行うことのできる方法で利用されるものであり、本発明の好ましいリンカーといえる。
【0040】
(b)群のリンカーを含む式(I−a)で表される糖修飾核酸のオリゴ−もしくはポリヌクレオチドの3’末端または5’末端にHr−thio−L1−(ここで、rは整数1または2以上の整数であり、−thio−L1及びL1とオリゴ−もしくはポリヌクレオチドとの結合様式は上述したとおりである)を導入することにより、上記式(I)のコンジュゲートを提供することができる。一方、(a)群の糖修飾核酸は、それ自体公知の方法で提供できる。
【0041】
本発明の好ましい態様である(b)群のリンカーを有する糖修飾核酸を提供でき下記式(I−b)で表される代表的な配糖体の製造について、以下により具体的に説明する。
【0042】
【化6】

【0043】
上記式中、
R1は、フェニル環がメトキシにより置換されていてもよいベンジル基、フェニル環がメトキシにより置換されていてもよいベンズヒドリル基またはフェニル環がメトキシ、により置換されていてもよいトリチル基(例えば、モノメトキシトリチル基、ジメトキシトリチル基)、アセタール(例えば、テトラヒドロピラニル)、アリル、トリ−直鎖もしくは分岐のC1−C6アルキルシリル、ハロゲン原子1〜3個により置換されていてもよい直鎖もしくは分岐のC1−C6アルキルカルボニル基、を表し、
R2、R3、R4およびR5は、相互に独立して、保護されたヒドロキシル基を表し、ここで、保護基はハロゲン原子1〜3個により置換されていてもよい直鎖もしくは分岐のC1−C6アルキルカルボニル基、メトキシにより置換されていてもよいベンジルオキシ基、アリルオキシ基、トリ−直鎖もしくは分岐のC1−C6アルキルシリルオキシ基、フェニルカルボニルオキシ基、ピバロエートエステル基、レブリネートエステル基を表し、あるいはまた(alternatively)
R2はメトキシにより置換されていてもよいベンジルオキシ基、アリルオキシ基、トリ−直鎖もしくは分岐のC1−C6アルキルシリルオキシ基、フェニルカルボニルオキシ基、ピバロエートエステル基、レブリネートエステル基、アセチルアミノ基、アリルオキシカルボニルアミノ基、トリクロロエチルオキシカルボニルアミノ基、N−フタルイミノ基を表してもよく、あるいはまた
R4とR5は一緒になって、環状アセタールである、イソプロピリデンアセタール、ベンジリデンアセタール、シリルアセタール(例えば、1,3−(1,1,3,3−テトライソプロピルジシロキサニリデン)を形成する原子団を表してもよい、
a、b及びcは、相互に独立して、0〜3の整数を表し、あるいはまた
cの付された結合〔式中の(>)c部分〕は存在しなくてもよく、
ただし、a、b及びcは全体で3〜7員環を形成するように定義されており、
mは0〜12の整数を表し、そしてnは0〜12の整数を表す。
(i)A及びBはいずれか一方が、HOOC−(CH2)2−COO−、HOOC−(CH2)3−COO−またはHOOC−CH2−O−CH2−COO−を表し、他方は上記R2、R3、R4及びR5について定義したのと同じ保護されたヒドロキシ基を表し、または
(ii)A及びBは相互に独立して、ヒドロキシル基、または上記R2、R3、R4及びR5について定義したのと同じ保護されたヒドロキシ基を表し、または
(iii)A及びBは一緒になって、単結合を表す。
【0044】
上記の各基の定義は、限定されるものでないが、より詳細には、次の意味を有する。
フェニル環がメトキシにより置換されていてもよいという場合の、メトキシは、好ましくは、フェニル環が結合するメチル基に対しパラ(para−)位に結合している。
直鎖もしくは分岐のC1−C6アルキルは、限定されるものでないが、メチル、エチル、n−プロピル、iso−プロピル、n−ブチル、sec−ブチル、t−ブチル、ペンチル、ヘキシルを表す。これらのアルキルがハロゲン原子により置換されている場合のハロゲンは、フッ素、塩素、臭素、好ましくは、塩素を挙げることができる。したがって、保護されたヒドロキシル基のうちの典型的な好ましい基は、アセチル基、クロロアセチル基、イソプロピルカルボニル基、等である。
R2は上記のような保護されたヒドロキシル基であることができるが、メトキシにより置換(パラ位において)されていてもよいベンジルオキシ基、アリルオキシ基、トリ−直鎖もしくは分岐のC1−C6アルキルシリルオキシ(例えば、トリメチルシリルオキシ、ジメチルt−ブチルシリル)基、フェニルカルボニルオキシ基、アセチルアミノ基、アリルオキシカルボニルアミノ基、トリクロロエチルオキシカルボニルアミノ基、N−フタルイミノ基、であることができる。
R4とR5も、上記のような保護されたヒドロキシル基であることができるが、一緒になって、環状アセタールである、イソプロピリデンアセタール、ベンジリデンアセタール、シリルアセタール(例えば、1,3−(1,1,3,3−テトライソプロピルジシロキサニリデン)を形成する原子団(イソプロピルメチレンジオキシ、ベンジルメチレンジオキシ、)であることができる。
【0045】
a、b及びcは、相互に独立して、0〜3の整数を表し、あるいはまたcの付された結合〔式中の(>)c部分〕は存在しなくてもよくとの定義に該当するものの具体的な組み合わせの例は、限定されるものでないが、a=b=c=0、a=b=0でccの付された結合が存在しておらず、a=b=1でcの付された結合が存在しておらず、a=b=0でc=1、a=1でb=c=0、a=b=1でc=0、a=3でb=0でcの付された結合が存在しておらず、a=1でb=2でcの付された結合が存在しておらず、a=b=0でc=2、a=c=1でb=0、a=b=1でc=1、及びa=b=0でc=3であるものを挙げることができる。これらの中、a=b=c=0、a=b=1でcの付された結合が存在しておらず、a=b=0でc=1、a=b=1でc=0、a=b=0でc=2の組み合わせが好ましく、a=b=1でcの付された結合が存在しておらず、a=b=0でc=1、a=b=1でc=0、の組み合わせが特に好ましい。
【0046】
また、ヒドロキシル基が保護された糖残基の代表例は下記式で表すことができる。
【0047】
【化7】

【0048】
Ac、ClAc、Bnの構造を以下に示す。
【0049】
【化8】

【0050】
さらに、説明を簡潔にするために、限定されるものでないが、本発明の特定の配糖体の製造例について説明する反応スキームを下記に示す。
【0051】
【化9】

【0052】
化合物1は既知の合成方法(Bioorganic & Medical Chemistry Letters(2003)2529)により合成できる。上記反応スキーム中の反応条件は、後述する製造例において具体的に説明する。
【0053】
このような反応スキーム及びそれに準ずる反応スキームに従い製造できる配糖体は、上述したとおり核酸(アンチセンス、アプタマー、siRNA等)の修飾、特に、固相合成法を利用する修飾に都合よく用いることができる。固相合成法は、当該技術分野で周知の核酸の固相化学合成に用いられている反応条件、反応試薬、操作法等に従って実施できる。このような固相合成に用いる固体支持体は、当該技術分野で公知のものが使用できる。かような固体支持体は、架橋ポリスチレンをベースとするもの、多孔質ガラスビーズ等であることができ、市販されている種々多様な固体支持体を利用できる。
【0054】
上記の式(I−b)で表される配糖体及びそれを利用する糖修飾核酸のより詳細な製造例は、上記の特願2009−160887明細書を参照できるが、当該明細書の内容はここに引用することにより、本明細書の内容に組み込まれる。
【実施例】
【0055】
以下に、本発明の特定の実施態様についてさらに具体的に説明する。
【0056】
実施例1:糖で3’末端に修飾した核酸の核酸合成機での合成
(1)上記反応スキームに記載された配糖体(化合物8:式中、Acはアセチル基であり、DMTrはジメトキシトリチルチル基である)を担持させたCPG(controlled pore glass)(20mg)を核酸合成機の反応カラム(グレンリサーチ社製)に入れてホスホロアミダイト法で核酸を合成した。合成した核酸は5’dTdTdTdTdTdTdTdTdTdT−galactose−3’であり合成後、アンモニア/エタノール(3/1)で55℃において6時間反応させ脱保護及び切り出しを行った。Sep−Pakカラム(Waters製)で精製した後、MALDI−TOF−MSで分子量を解析したところ、3365に目的分子量が得られた。
(2)上記で合成した核酸は以下に示す配列の核酸である:
RNA1:5’−GGA CCA CCG CAU CUC UAC AdTdT−3’RNA2:5’−GGA CCA CCG CAU CUC UAC AdTdT−gal−3’
RNA3:5’−UGU AGA GAU GCG GUG GUC CdTdT−3’RNA4:5’−UGU AGA GAU GCG GUG GUC CdTdT−gal−3’
ここで、RNA1及びRNA3は二本鎖にした場合、Survivinに対するsiRNAであり、RNA2、RNA4はそれぞれ3’末端にガラクトースで修飾したものである。
【0057】
実施例2:糖修飾核酸のチオール化
(1)上記の実施例1によりガラクトースを固定化した固相(20mg、0.2μmol)及びGlen research社の5’−Thiol−Modifer C6(Catalog NO.10−1926−90)を用いて核酸の5’末端にチオ−ル基を導入しさらに核酸の3’末端にガラクトースを導入した核酸を合成した。合成した核酸は5’TrS−(CH2)6−dTdTdTdTdTdTdTdTdTdTdTdTdTdTdTdTdTdTdTdT−galactose−3’である(式中、Trはトリチル基である)。合成後、アンモニア水:エタノール(3:1)中の55℃下で4時間反応させ、脱保護及び固相から切り出しを行った。脱保護後、Sep−Pac C18で精製し、さらにポリアクリルアミドゲル電気泳動により精製を行った。MALD1−TOF−MSで分子量を解析したところ、6845に目的分子量が得られた。精製した核酸を硝酸銀(1mM)により室温で5分間処理し、その後ジチオトレイトール(1.5mM)により室温で1時間処理することでチオールを保護しているトリチル基を脱保護した。脱保護した核酸はPD−10カラム(GEヘルスケア)により精製し、凍結乾燥した。MALDI−TOF−MSで分子量を解析したところ、6603に目的分子量が得られた。
(2)同様に、コントロールとして、ガラストールで修飾していない核酸5’TrS−(CH2)6−dTdTdTdTdTdTdTdTdTdTdTdTdTdTdTdTdTdTdTdT−3’(式中、Trはトリチル基である)も合成した。
【0058】
実施例3:核酸と金粒子の結合
【0059】
【化10】

【0060】
(1)粒径5nmの金粒子(BBInternational社製)660μLにチオール核酸2nmolを加え脱イオン水中で24時間静置し反応させた。24時間後1M NaCl水溶液を用いてNaCl濃度を0.3Mにしさらに24時間静置して反応させた。反応後、遠心(14000rpm、20分)により金粒子を沈殿させて上澄み液を除去し未反応の核酸を除去した。得られた沈殿物にPBS溶液を1ml加え、遠心(14000rpm、20分)により金粒子を沈殿させて洗浄を行った。この洗浄操作を合計三回行い核酸が結合した金粒子を得た。
(2)上記(1)同様に操作するが、スケールアップして当該金粒子を得た。具体的には、粒径15nmの金粒子(BBInternational社製)6.6mLに、それぞれ、20nmolのガラストース修飾チオール核酸及びガラストース未修飾チオール核酸を加え脱イオン水中で24時間静置し反応させた。24時間後1M NaCl水溶液を用いてNaCl濃度を0.3Mにしさらに24時間静置して反応させた。反応後、遠心(14000rpm、20分)により金粒子を沈殿させて上澄み液を除去し未反応の核酸を除去した。得られた沈殿物にPBS溶液を1ml加え、遠心(14000rpm、20分)により金粒子を沈殿させて洗浄を行った。この洗浄操作を合計三回行い核酸が結合した金粒子を得た。
【0061】
得られた核酸修飾金ナノ粒子上の核酸の数は、以下のようにして求めることができる。例えば、上記(1)で得られた核酸修飾金ナノ粒子を10mMのジチオトレイトール中により室温で8時間反応させ、その後金粒子から放出された核酸の濃度をOliGreen(インビトロジェン社)により定量した。その結果、1個の金粒子あたり110本の核酸が結合していることが確認された。
【0062】
上記1により構築した粒子の大きさを(ゼータサイザー、Malvern社製)により測定した結果を図2に示す。コントロールとして糖を提示していない核酸を金粒子に結合させた系も構築した。共に30nm程度の粒径であることが確認された。
【0063】
実施例4:核酸結合金ナノ粒子の安定性試験
次に糖−オリゴ核酸コンジュゲート及びコントロールとなる未糖修飾オリゴ核酸を金粒子に結合させたナノ粒子(金粒子0.2pmol)を10%血清が存在する培地に加え37℃のインキュベーターで2週間放置し、ナノ粒子の安定性を見た。結果を図3に示す。図3から核酸がむき出しになっている従来のナノ粒子では血清中で不安定であり粒径が大きくなっているが、糖鎖を最外殻に有するナノ粒子は血清中で安定であり粒径がほとんど変化していないことがわかる。
【0064】
また、UV−Visの測定結果を図4に示す。この図から、金ナノ粒子は凝集すると長波長側に吸収がシフトすることがわかっている。UV−Visの結果より糖鎖を最外殻に提示したナノ粒子はシフト幅が小さくナノ粒子が血清中で安定化していることがわかる。
【0065】
実施例5:ガラクトース修飾金ナノ粒子と未修飾金ナノ粒子のラット初代肝細胞への取り込み試験
8週齢のラットを解剖し初代肝細胞を得てコラーゲンコートされた96wellプレート2x104個/wellの濃度で播種した。播種後24時間後にガラクトース修飾核酸を結合させた金粒子及びガラクトース未修飾核酸を結合させた金粒子を1nmolの濃度になるように細胞に添加し、0.5、1、3、5、12時間後に細胞を回収し、細胞に取り込まれている金粒子の数をICP−MSにより解析した。結果を図5に示す。図5の結果より、ガラクトースを修飾した金ナノ粒子は未修飾の金ナノ粒子よりも高効率でラット初代肝細胞に取り込まれている事が確認できる。
【0066】
つまり、ガラクトース修飾核酸を結合させた金粒子ガラクトースをクラスター状に最外殻層に提示しているため、粒子が安定化し、レセプターを介した選択的な取り込みにより、高効率で細胞に取り込まれている。
【0067】
実施例6:ガラクトースによるコンペティションアッセイ
ガラクトースを修飾金ナノ粒子の高効率な取り込みがアシアログリコプロテインレセプター(Asialoglycoprotein receptor)を介したものである事を確認するため、ガラクトースによるコンペティションアッセイを行った。8週齢のラットを解剖し初代肝細胞を得てコラーゲンコートされた96wellプレート2x104個/wellの濃度で播種した。播種後24時間後にガラクトース修飾核酸を結合させた金粒子を1nmolの濃度になるように細胞に添加し、30分後に細胞を回収し、細胞に取り込まれている金粒子の数をICP−MSにより解析した。コンペティションアッセイにはガラクトース修飾核酸を結合させた金粒子を加える30分前に培地中にガラクトースを40mMの濃度で加え解析した。結果を図6に示す。ガラクトース修飾した金ナノ粒子の肝細胞への取り込みが、ガラクトースを培地に添加する事で阻害されている事から、この粒子はアシアログリコプロテインレセプターを介して取り込まれていることが判明した。
【産業上の利用可能性】
【0068】
本発明では、糖鎖を最外殻に持つオリゴ核酸医薬用のナノ粒子が提供される。この糖鎖により細胞外の生理学的な環境下でオリゴ核酸が安定化され、かつ、機能化されたナノ粒子は次世代の医薬品として注目の集まっている核酸医薬品の開発に大きく貢献するものであると考える。したがって、本発明は核酸医薬品の製造業で利用できる。
【技術分野】
【0001】
本発明は糖修飾核酸と貴金属のコンジュゲートに関し、特に、糖修飾核酸と金ナノ粒子のコンジュゲートに関する。
【背景技術】
【0002】
次世代の医薬品としてアンチセンス、アプタマー、siRNAなどの核酸医薬品が期待されており、既に眼科領域では製品化されている。今後、これら核酸医薬を様々な部位への疾患に適用させることが望まれている。このために解決すべき課題としては核酸を構成するオリゴヌクレオチドの不安定性及びそれぞれの疾患に適した有効なデリバリー方法の開発が挙げられる。近年ではオリゴ−もしくはポリヌクレオチドの安定性及び安全性の向上を目的として、ヌクレオチドに様々な化学修飾が施され、臨床の場で用いられている。さらにカチオン性のポリマー及びリポソームにオリゴヌクレオチドを内包させることで、全身投与系での臨床試験も行われ始めた。
【0003】
これらの手法の中、アニオン性分子である核酸をカチオン性のミセルやリポソームを用いて核酸内包ナノ粒子として核酸をデリバリーする手法は遺伝子導入に広く用いられている手法である。しかし、オリゴヌクレオチドを運ぶ際には核酸分子が短いため静電相互作用が弱く生体内でナノ粒子が崩壊してしまい効果的なデリバリーが困難である。また、カチオン性の分子は炎症反応を引き起こすことが知られており、毒性の問題もある。カチオン性の粒子を用いる以外の手法として、金粒子上にオリゴヌクレオチドを結合させ、オリゴヌクレオチドをデリバリーする報告がある(例えば、非特許文献1、非特許文献2、非特許文献3参照)。
【0004】
非特許文献1では、チオール化したオリゴヌクレオチド(siRNA)をポリ(エチレングリコール)−block−ポリ(2−(N,N−ジメチルアミノ)エチルメタクリレートと共に金ナノ粒子上に結合させた構築物を用いることによりsiRNAをin vitroにおいて細胞内へデリバリーすることに成功したことが記載されている。この構築物はポリ(エチレングリコール)−block−ポリ(2−(N,N−ジメチルアミノ)エチルメタクリレートの存在により構築物全体及びsiRNAの生理条件下での優れた安定性が達成されることが示唆されている。非特許文献2及び3では、それぞれ、生理食塩水中及び血清中で安定性を示す金ナノ粒子とオリゴヌクレオチドのコンプレックスまたはコンジュゲート(RNA−Au NP)が記載されている。前者は、オリゴヌクレオチド(アンチセンスオリゴヌクレオチド)を3’末端に導入したアルキルチオールまたは2つの環状ジスルフィド(two cyclic disulfide)を介して金ナノ粒子に結合させており、後者は、オリゴヌクレオチド(siRNA)をそのセンス鎖の3’末端に導入したオリゴエチレングリコール−チオールを介して金ナノ粒子に結合させている。後者のRNA−Au NPは、10%血清中で対応する二本鎖RNAに比べて6倍大きい半減期を有することも非特許文献3には記載されている。
【0005】
他方、二本鎖ポリヌクレオチドコンプレックスを安定化または不安定化するポリヌクレオチドと結合する化合物を同定する方法において使用するものとして、オリゴヌクレオチドを結合した機能化ナノ粒子が提案されている(特許文献1)。これらのナノ粒子は、オリゴヌクレオチドの3’−または5’−末端に導入したアルカンチオール、アルカンジスルフィドまたは環状ジスルフィドを介して金表面にオリゴヌクレオチドを結合して作製されている。また、かようなオリゴヌクレオチドに使用環境下(生物学的流体中等)での安定性を付与する目的でヌクレオチド間の結合を改変したり、ヌクレオチドの糖残基を修飾したり、することも記載されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】US 2009/0221095 A1
【非特許文献】
【0007】
【非特許文献1】Oishi et.al.Chemistry Letters(2006)35,1046−1047
【非特許文献2】Nathaniel et.al.Science(2006)312,1027−1030
【非特許文献3】Giljohann et.al.J.Am.Chem.Soc(2009)131,2027−2073
【発明の概要】
【発明が解決しようとする課題】
【0008】
従来技術文献によると、siRNA等のオリゴヌクレオチドが結合した金粒子またはこのような金粒子に固定化されているsiRNAのオリゴヌクレオチドが血清中である程度安定であり、細胞外ヌクレア−ゼに一定の抵抗性を示すことが示唆されている。しかし、未だ、細胞外の生理学的環境下でより安定性の高いオリゴヌクレオチドを担持するコンジュゲートまたはコンプレックスについてのニーズは依然として存在する。したがって、本発明の目的は、例えば、標的とする特定の細胞または組織にオリゴ−もしくはポリヌクレオチドをデリバリーできる新たなオリゴ−もしくはポリヌクレオチドと適当な担体のコンジュゲートまたはコンプレックスを提供することにある。
【課題を解決するための手段】
【0009】
本発明者等は、固相合成法を利用して核酸の糖修飾を簡易に実施できる方法を開発し、先に特願2009−160887明細書に開示した。この方法で合成した糖修飾オリゴヌクレオチドをチオール化した後、導入したチオール基と金ナノ粒子表面との相互作用により糖修飾オリゴヌクレオチド結合金ナノ粒子のコンジュゲートを作製したところ、血清中等の細胞外の生理学的環境下で安定なナノ粒子コンジュゲートを提供できることを見出した。さらに、このようなオリゴヌクレオチドの安定性は、金に代え銀などの貴金属ナノ粒子を用い場合も同様である。
【0010】
したがって、上記課題は、一般式(I)
MeNP(−thio−L1−nuc−L2−carb)p (I)
で表される糖修飾核酸と貴金属ナノ粒子のコンジュゲートを提供することにより解決できる。
【0011】
上記式中、MeNPは金または銀等の貴金属ナノ粒子を表し、
thio−L1は貴金属ナノ粒子表面とチオール基(1または2以上)の相互作用により当該表面に−thio−L1−nuc−L2−carb鎖を結合できる硫黄原子を1個または2個以上含有する基または部分(moiety)を表し、
nucは一本鎖もしくは二本鎖−オリゴ−もしくはポリヌクレオチドを表し、
L2は直接結合またはリンカーを表し、
carbは糖残基もしくはオリゴ糖鎖を表し、そして
pは5〜100000の整数を表す。
【発明の効果】
【0012】
このような一般式(I)で表されるコンジュゲートは、本発明を解釈する上で理論により何ら拘束されるものでないが、水、リン酸緩衝化生理食塩水(PBS)または血液中等の水性媒体中で最外殻に糖残基を持ったナノ粒子を形成するものと理解される。このようなナノ粒子は、−thio−L1−nuc−L2−carb鎖が密集して、例えば金粒子に結合する場合には、あたかも、コア部分(金粒子)−オリゴヌクレオチド部分−糖残基もしくはオリゴ糖鎖部分の三層が静電相互作用でなく、それぞれ共有結合乃至配位結合で結合された構造の新規ナノ粒子を提供する(概念図を図1に示す。)。これらのナノ粒子は最外殻の糖残基もしくはオリゴ糖鎖の存在により、最外殻に糖残基もしくはオリゴ糖鎖を持っていないオリゴヌクレオチド結合金ナノ粒子に比べ、血清等の生体外または生体内環境下での安定性が有意に向上する。さらに、糖残基もしくはオリゴ糖鎖がクラスター状に最外殻層に提示されるため、このクラスター化した糖残基もしくはオリゴ糖鎖と成体組織の相互作用を通して、組織特異的な様式で当該コンジュゲートをデリバリーすることが可能になる。また、理論により拘束されるものでないが、このような安定性は、オリゴヌクレオチドが金ナノ粒子に結合していることと相俟って糖残基の存在がオリゴヌクレオチドに対する周囲環境の化学的もしくは物理的作用による影響を低減し、また、ヌクレア−ゼによる分解に対する抵抗性をオリゴヌクレオチドに付与するものと理解される。したがって、本発明によれば、化学的もしくは物理的に、また、酵素分解性に対して不安定なオリゴヌクレオチドですら安定に標的細胞または組織にデリバリーすることが可能になる。しかも、特定の細胞または組織に標的指向性を有することが知られている糖もしくはオリゴ糖の糖残基もしくはオリゴ糖鎖を最外殻に有するナノ粒子は、向上した標的指向性を示す可能性もある。例えば、ガラクトースを粒子上に多数提示すると肝臓に効率的に取り込まれることが知られており肝臓への特異的なデリバリーへの展開が期待できる。また白血球はシアリルルイスXを表面に多数有しており、血液中を循環している事に寄与している。また悪性腫瘍が転移する際には細胞表面の糖残基が転移先の組織と相互作用することで転移を可能にしていることがわかっている。これらの系に見られるように粒子上に適当な糖残基を提示すると有益な様々な生物学的活性が期待できる。
【図面の簡単な説明】
【0013】
【図1】糖鎖を最外殻に有するナノ粒子の構築方法及び糖鎖を3’末端、チオール基を5’末端に持つオリゴ核酸の概念図である。
【図2】実施例3で構築し、測定したナノ粒子の粒経のグラフ表示である。黒丸の付した実線は糖を最外殻に有する粒子の結果であり、単なる実線は核酸がむき出しになった比較の粒子。
【図3】実施例4におけるナノ粒子の血清中での安定性試験(2週間後の凝集)の結果のグラフ表示である。黒丸の付した実線は糖を最外殻に有する粒子の結果であり、単なる実線は核酸がむき出しになった比較の粒子の結果である。
【図4】実施例4におけるナノ粒子の血清中での安定性試験のUV−Visの測定結果のグラフ表示である。実線が実験開始前の両粒子についての測定結果であり、細い破線は糖を最外殻に有する粒子の結果であり、太い破線は核酸のむき出しになった比較の粒子の結果である。
【図5】実施例5における糖修飾核酸金ナノ粒子と糖未修飾核酸金ナノ粒子のラット初代肝細胞への取込み挙動を表すグラフ表示である。
【図6】実施例6におけるガラストースによるコンペティションアッセイの結果を表すグラフ表示である。
【発明の詳細な記述】
【0014】
以下、本発明を規定する略号または用語についてより具体的に説明する。
【0015】
金または銀等の貴金属ナノ粒子は、金ナノ粒子が好ましく用いられるので、説明を簡潔にするために専ら金ナノ粒子について説明する。金ナノ粒子の形状は、球、または立方晶
系、正方晶系、斜方晶系(8面体もしくは12面体)、単斜方晶系、六方晶系等の晶系にみられる形状またはこれら形状のほぼ80%(各面の長軸または短軸の長さがそれぞれ最大でも20%変化した)が保持された形状の粒子が挙げられる(特定形状の金ナノ粒子の調製方法は、例えば、Wenxin Niu,et al.,J.Am.Chem.Soc(2009)131,697−703参照)。これらの粒子のサイズは、当該技術分野でナノ粒子のカテゴリーに入ると認識されるものである限り限定されるものでないが、例えば、異なる複数の方向から投射した際にできる影の面積から常法に従って球状の粒子に換算した場合に、平均直径が2nm〜500nm、好ましくは、4nm〜250nm、より好ましくは4nm〜100nm、特に好ましくは4nm〜60nmである。また、同様に限定されるものでないが、斜方(直方)体の場合には、短軸(1または2)が2nm〜50nmであり、長軸(1または2)が10〜500nmであるサイズを有する粒子を用いることができる。このような形状及びサイズを持つナノ粒子のいくらかは市販のされており(例えば、BBInternationalのホームページ(http://www.britishbiocell.co.uk/products/goldreagents.asp?navid=2)参照)、市販されていない場合には、非特許文献2または非特許文献3中で引用された文献に記載の方法に準じて容易に入手できる。
【0016】
thioについて定義する、硫黄を1個または2個以上含有する基または部分としては、また、非特許文献1〜3のいずれかにおいてオリゴヌクレオチドをチオール化する際に用いられている、2つの環状ジスルフィド(two cyclic jisurufides(DTPA))、アルキルチオール足場形成(anchoring)基(例えば、−S−C1−C12−アルキレン−の場合、−C1−C12−アルキレン−が−L1−に相当する)等及び下式の()nで表される部分を挙げることができる。
【0017】
【化1】

【0018】
上記の繰り返し数について規定するnはGlen research社の化合物DTAP(Catalog No.10−1937−90)を用いると整数1〜10が選択可能である。
【0019】
nucについて定義する、一本鎖もしくは二本鎖−オリゴ−もしくはポリヌクレオチドにいうヌクレオチドは、核酸(DNAまたはRNA)を構成するヌクレオチドを意味し、5〜100、5〜80、5〜70、5〜60、5〜40、5〜35、5〜30、5〜25、5〜20、5〜15、または5〜10個のヌクレオチドからなるものであることができる。機能上、アンチセンス、アプタマー、siRNA、マイクロRNA等に分類できるオリゴヌクレオチド、さらにこれらのオリゴヌクレオチドを鎖内またはいずれかの末端に含むポリヌクレオチドであることもできる。限定されるものでないが、これらのオリゴ−もしくはポリ−ヌクレオチドは、VEGF(Vascular endothelial growth factor)、Survivin等の遺伝子を標的にしたものであることができる。また、本明細書では核酸とオリゴ−もしくはポリヌクレオチドを交換可能な
概念で用いる場合もある。
【0020】
上記L1とnucとの結合は、ヌクレオチドの3’末端のヒドロキシル基とのエーテル結合もしくはエステル結合またはリン酸残基とのリン酸ジエステル結合またはチオリン酸エステル結合であるか、あるいはまたヌクレオチドの5’末端のHOCH2−とのエーテル結合もしくはエステル結合またはリン酸残基とのリン酸ジエステル結合またはチオリン酸エステル結合であることができる。
【0021】
L2について定義する直接結合またはリンカーにいう、リンカーは、以下の構造式中に含まれる結合を形成することができる。
【0022】
(a)群:
下記式のいずれかに示される後述する部分
【0023】
【化2】

【0024】
上式中、L2に該当する部分は、R1及びR2を除いた部分であり、R1及びR2は、いずれか一方がL1に結合する一般式(I)のnuc部分に相当し、他方が一般式(I)のcarbに相当するものであり、L3及びL4は、相互に独立して、C1−C6−アルキレンまたは−CH2CH2(OCH2CH2)q−(ここで、qは1〜12の整数である)であるか、または存在し得る場合には直接結合であり、かつ、R1またはR2がnuc部分に相当する場合には、L3及びL4は、相互に独立して、L1とnucの結合する3’もしくは5’末端に対して、それぞれnucの逆の5’末端のHOCH2−とエーテル結合もしくはエステル結合、リン酸残基とリン酸ジエステル結合またはチオリン酸エステル結合を形成するか、または3’末端のヒドロキシル基とエーテル結合もしくはエステル結合、リン酸残基とリン酸ジエステル結合またはチオリン酸エステル結合を形成し、あるいはまた、
R1またはR2がcarbに相当する場合には、L3及びL4は、相互に独立して、carbとエーテルまたはエステル結合を形成できる。
【0025】
(b)群:
下記式(I−a)で示される後述部分
【0026】
【化3】

【0027】
で表される糖修飾核酸において、
上式中、L2に該当する部分は、−O−Nuc及びCarbが除かれた部分である。
【0028】
上式中、−O−Nucは一般式(I)のnuc部分に相当し、Carbは一般式(I)のcarbに相当し、nucとL2は、L1とnucの結合する3’もしくは5’末端に対して、それぞれnucの逆の5’末端のHOCH2−とエーテル結合もしくはエステル結合、リン酸残基とリン酸ジエステル結合またはチオリン酸エステル結合を形成するか、もしくは3’末端のヒドロキシル基とエーテル結合もしくはエステル結合、リン酸残基とリン酸ジエステル結合またはチオリン酸エステル結合を形成し、carbとL2の結合はエーテル結合である。
【0029】
上式中、
(i)A及びBはいずれか一方が、水素原子、HOOC−(CH2)2−COO−、HOOC−(CH2)3−COO−またはHOOC−CH2−O−CH2−COO−を表し、他方は水素原子、ヒドロキシル基または保護されたヒドロキシル基を表し、ここで、保護基はハロゲン原子1〜3個により置換されていてもよい直鎖もしくは分岐のC1−C6アルキルカルボニル基、メトキシにより置換されていてもよいベンジルオキシ基、アリルオキシ基、トリ−直鎖もしくは分岐のC1−C6アルキルシリルオキシ基、フェニルカルボニルオキシ基、ピバロエートエステル基、レブリネートエステル基を表す。あるいはまた、
(ii)A及びBは相互に独立して、ヒドロキシル基、または保護されたヒドロキシル基を表し、ここで、保護基はハロゲン原子1〜3個により置換されていてもよい直鎖もしくは分岐のC1−C6アルキルカルボニル基、メトキシにより置換されていてもよいベンジルオキシ基、アリルオキシ基、トリ−直鎖もしくは分岐のC1−C6アルキルシリルオキシ基、フェニルカルボニルオキシ基、ピバロエートエステル基、レブリネートエステル基を表し、あるいはまた
(iii)A及びBは一緒になって、単結合を表す。
【0030】
a、b及びcは、相互に独立して、0〜3の整数を表し、あるいはまたcの付された結合〔式中の(>)c部分〕は存在していなくてもよく、ただし、a、b及びcは全体で3〜7員環を形成するものとして定義されており、mは0〜12の整数を表し、そしてnは0〜12の整数を表す。
【0031】
(c)群
下記式(I−c)
【0032】
【化4】

【0033】
で表される糖修飾核酸において
上式中、L2に該当する部分は、R1及びR2を除いた部分であり、L5は、C1−C6−アルキレンまたは−CH2CH2(OCH2CH2)q−(ここで、qは1〜12の整数である)であり、R1及びR2は、いずれか一方がL1に結合する一般式(I)のnuc部分に相当し、他方が一般式(I)のcarbに相当するものであり、かつ、R1またはR2がnuc部分に相当する場合には、L5は、L1とnucの結合する3’もしくは5’末端に対して、それぞれnucの逆の5’末端のHOCH2−とエーテル結合もしくはエステル結合、リン酸残基とリン酸ジエステル結合またはチオリン酸エステル結合を形成するか、または3’末端のヒドロキシル基とエーテル結合もしくはエステル結合、リン酸残基とリン酸ジエステル結合またはチオリン酸エステル結合を形成し、あるいはまた、R1またはR2がcarbに相当する場合には、L5は、相互に独立して、carbとエーテルまたはエステル結合を形成できる。
【0034】
上記一般式(I)の貴金属ナノ粒子に結合する鎖(−thio−L1−nuc−L2−carb)の数をあらわすpは、当該ナノ粒子のサイズにより大きく変動し、整数5〜100000、好ましくは、10〜5000、より好ましくは10〜3600である。例えば、オリゴ−もしくはポリオリゴヌクレオチドの細胞または組織へのデリバリー用としては、平均直径が4nm〜60nmものもが特に好ましいが、このような粒子を対象とすると、上記のpは、限定されるものでないが、20〜3600であり、例えば、平均直径が4〜17nmである場合には、pは40〜300であることができる。このような数は、それ自体公知の方法で確認できるが、例えば後述する実施例に記載の方法によるのが簡便である。
【0035】
本発明に関して、糖残基もしくはオリゴ糖鎖またはリン酸残基という場合には、リン酸基または糖のヒドロキシル基の1つから水素原子が除去された状態にある基を意味する。このような糖残基もしくはオリゴ糖鎖の起源となる糖としては、各種ペントース、ヘキソース、ヘプトース、ウロン酸、デオキシ糖、アミノ糖、アミノウロン酸、ケトース、及びこれらの糖の2〜15個からなる直鎖または分岐オリゴ糖を挙げることができる。より具体的には、エリトロース、トレオース、リボース、アラビノース、キシロース、リキソース、アロース、アルトロース、グルコース、マンノース、グロース、イドース、ガラクトース、タロース、エリトルロース、リブロース、キシルロース、プシコース、フルクトース、ソルボース、タガトース、セドヘプツロース、2−デオキシリボース、2−デオキシグルコース、キノボース、テベトース、ラムノース、フコース、ジギノース、ジギタロース、ジギトキソース、シマロース、アベクォース、アスカリロース、コリトース、パラトース、チベロース、グルコサミン、マンノサミン、ガラクトサミン、フコサミン、キノボサミン、ラムノサミン、ノジリマイシン、アピオース、ストレプトース、エバロース、ハマメロース、ノイラミン酸、ムラミン酸、N−アセチルグルコサミン、N−アセチルノイラミン酸、N−グライコリルノイラミン酸、N−アセチルガラクトサミン、α,α−トレハロース、β,β−トレハロース、α,β−トレハロース、トレハロサミン、コウジビオース、ニゲロース、マルトース、マルチトール、マルツロース、イソマルトース、イソマルツロース、パラチノース、ソホロース、ラミナラビオース、セロビオース、セロビオン酸、ゲンチオビオース、ガラクトスクロース、ラクトース、ラクトサミン、ラクトースジアミン、ラクトビオン酸、ラクチトール、ラクツロース、メリビオース、ネオラクトース、プリメベロース、ルチノース、シラビオース、スクラロース、スクロース、ツラノース、ビシアノース、ヒアロビウロン酸、セロトリオース、カコトリオース、ゲンチアノース、イソマルトトリオース、イソパノース、マルトトリオース、マンニノトリオース、メレジトース、パノース、プランテオース、ラフィノース、ソラトリオース、ウンベリフェロース、リコテトラオース、マルトテトラオース、スタキオース、マルトペンタオース、ベルバスコース、マルトヘキサオース、α−シクロデキストリン、β−シクロデキストリン、γ−シクロデキストリン、δ−シクロデキストリン、グリコーゲン、アミロース、アミ
ロペクチン、デキストリン、グルカン、キチン質、フラクトオリゴ糖、ガラクトオリゴ糖、マンナンオリゴ糖、シアリルルイスA抗原、シアリルルイスX抗原、好ましくはグルコース、マンノース、ガラクトース、フルクトース、フコース、グルコサミン、ガラクトサミン、N−アセチルグルコサミン、N−アセチルノイラミン酸、N−グライコリルノイラミン酸、N−アセチルガラクトサミン、α,α−トレハロース、β,β−トレハロース、α,β−トレハロース、マルトース、ラクトース、マルトトリオース、シアリルルイスA抗原、シアリルルイスX抗原を糖残基もしくはオリゴ糖鎖の起源として挙げることができる。
【0036】
上記の結合様式の代表例は、下記の式で表すことができる。
【0037】
【化5】

【0038】
なお、本明細書では、糖残基と糖鎖は互換可能な概念で用いている。
【0039】
上記(b)群のリンカーは、本発明者等が先に特願2009−160887に開示したものであり、固相合成法の利用により核酸(オリゴ−もしくはポリヌクレオチド)の糖修飾物を簡易に行うことのできる方法で利用されるものであり、本発明の好ましいリンカーといえる。
【0040】
(b)群のリンカーを含む式(I−a)で表される糖修飾核酸のオリゴ−もしくはポリヌクレオチドの3’末端または5’末端にHr−thio−L1−(ここで、rは整数1または2以上の整数であり、−thio−L1及びL1とオリゴ−もしくはポリヌクレオチドとの結合様式は上述したとおりである)を導入することにより、上記式(I)のコンジュゲートを提供することができる。一方、(a)群の糖修飾核酸は、それ自体公知の方法で提供できる。
【0041】
本発明の好ましい態様である(b)群のリンカーを有する糖修飾核酸を提供でき下記式(I−b)で表される代表的な配糖体の製造について、以下により具体的に説明する。
【0042】
【化6】

【0043】
上記式中、
R1は、フェニル環がメトキシにより置換されていてもよいベンジル基、フェニル環がメトキシにより置換されていてもよいベンズヒドリル基またはフェニル環がメトキシ、により置換されていてもよいトリチル基(例えば、モノメトキシトリチル基、ジメトキシトリチル基)、アセタール(例えば、テトラヒドロピラニル)、アリル、トリ−直鎖もしくは分岐のC1−C6アルキルシリル、ハロゲン原子1〜3個により置換されていてもよい直鎖もしくは分岐のC1−C6アルキルカルボニル基、を表し、
R2、R3、R4およびR5は、相互に独立して、保護されたヒドロキシル基を表し、ここで、保護基はハロゲン原子1〜3個により置換されていてもよい直鎖もしくは分岐のC1−C6アルキルカルボニル基、メトキシにより置換されていてもよいベンジルオキシ基、アリルオキシ基、トリ−直鎖もしくは分岐のC1−C6アルキルシリルオキシ基、フェニルカルボニルオキシ基、ピバロエートエステル基、レブリネートエステル基を表し、あるいはまた(alternatively)
R2はメトキシにより置換されていてもよいベンジルオキシ基、アリルオキシ基、トリ−直鎖もしくは分岐のC1−C6アルキルシリルオキシ基、フェニルカルボニルオキシ基、ピバロエートエステル基、レブリネートエステル基、アセチルアミノ基、アリルオキシカルボニルアミノ基、トリクロロエチルオキシカルボニルアミノ基、N−フタルイミノ基を表してもよく、あるいはまた
R4とR5は一緒になって、環状アセタールである、イソプロピリデンアセタール、ベンジリデンアセタール、シリルアセタール(例えば、1,3−(1,1,3,3−テトライソプロピルジシロキサニリデン)を形成する原子団を表してもよい、
a、b及びcは、相互に独立して、0〜3の整数を表し、あるいはまた
cの付された結合〔式中の(>)c部分〕は存在しなくてもよく、
ただし、a、b及びcは全体で3〜7員環を形成するように定義されており、
mは0〜12の整数を表し、そしてnは0〜12の整数を表す。
(i)A及びBはいずれか一方が、HOOC−(CH2)2−COO−、HOOC−(CH2)3−COO−またはHOOC−CH2−O−CH2−COO−を表し、他方は上記R2、R3、R4及びR5について定義したのと同じ保護されたヒドロキシ基を表し、または
(ii)A及びBは相互に独立して、ヒドロキシル基、または上記R2、R3、R4及びR5について定義したのと同じ保護されたヒドロキシ基を表し、または
(iii)A及びBは一緒になって、単結合を表す。
【0044】
上記の各基の定義は、限定されるものでないが、より詳細には、次の意味を有する。
フェニル環がメトキシにより置換されていてもよいという場合の、メトキシは、好ましくは、フェニル環が結合するメチル基に対しパラ(para−)位に結合している。
直鎖もしくは分岐のC1−C6アルキルは、限定されるものでないが、メチル、エチル、n−プロピル、iso−プロピル、n−ブチル、sec−ブチル、t−ブチル、ペンチル、ヘキシルを表す。これらのアルキルがハロゲン原子により置換されている場合のハロゲンは、フッ素、塩素、臭素、好ましくは、塩素を挙げることができる。したがって、保護されたヒドロキシル基のうちの典型的な好ましい基は、アセチル基、クロロアセチル基、イソプロピルカルボニル基、等である。
R2は上記のような保護されたヒドロキシル基であることができるが、メトキシにより置換(パラ位において)されていてもよいベンジルオキシ基、アリルオキシ基、トリ−直鎖もしくは分岐のC1−C6アルキルシリルオキシ(例えば、トリメチルシリルオキシ、ジメチルt−ブチルシリル)基、フェニルカルボニルオキシ基、アセチルアミノ基、アリルオキシカルボニルアミノ基、トリクロロエチルオキシカルボニルアミノ基、N−フタルイミノ基、であることができる。
R4とR5も、上記のような保護されたヒドロキシル基であることができるが、一緒になって、環状アセタールである、イソプロピリデンアセタール、ベンジリデンアセタール、シリルアセタール(例えば、1,3−(1,1,3,3−テトライソプロピルジシロキサニリデン)を形成する原子団(イソプロピルメチレンジオキシ、ベンジルメチレンジオキシ、)であることができる。
【0045】
a、b及びcは、相互に独立して、0〜3の整数を表し、あるいはまたcの付された結合〔式中の(>)c部分〕は存在しなくてもよくとの定義に該当するものの具体的な組み合わせの例は、限定されるものでないが、a=b=c=0、a=b=0でccの付された結合が存在しておらず、a=b=1でcの付された結合が存在しておらず、a=b=0でc=1、a=1でb=c=0、a=b=1でc=0、a=3でb=0でcの付された結合が存在しておらず、a=1でb=2でcの付された結合が存在しておらず、a=b=0でc=2、a=c=1でb=0、a=b=1でc=1、及びa=b=0でc=3であるものを挙げることができる。これらの中、a=b=c=0、a=b=1でcの付された結合が存在しておらず、a=b=0でc=1、a=b=1でc=0、a=b=0でc=2の組み合わせが好ましく、a=b=1でcの付された結合が存在しておらず、a=b=0でc=1、a=b=1でc=0、の組み合わせが特に好ましい。
【0046】
また、ヒドロキシル基が保護された糖残基の代表例は下記式で表すことができる。
【0047】
【化7】

【0048】
Ac、ClAc、Bnの構造を以下に示す。
【0049】
【化8】

【0050】
さらに、説明を簡潔にするために、限定されるものでないが、本発明の特定の配糖体の製造例について説明する反応スキームを下記に示す。
【0051】
【化9】

【0052】
化合物1は既知の合成方法(Bioorganic & Medical Chemistry Letters(2003)2529)により合成できる。上記反応スキーム中の反応条件は、後述する製造例において具体的に説明する。
【0053】
このような反応スキーム及びそれに準ずる反応スキームに従い製造できる配糖体は、上述したとおり核酸(アンチセンス、アプタマー、siRNA等)の修飾、特に、固相合成法を利用する修飾に都合よく用いることができる。固相合成法は、当該技術分野で周知の核酸の固相化学合成に用いられている反応条件、反応試薬、操作法等に従って実施できる。このような固相合成に用いる固体支持体は、当該技術分野で公知のものが使用できる。かような固体支持体は、架橋ポリスチレンをベースとするもの、多孔質ガラスビーズ等であることができ、市販されている種々多様な固体支持体を利用できる。
【0054】
上記の式(I−b)で表される配糖体及びそれを利用する糖修飾核酸のより詳細な製造例は、上記の特願2009−160887明細書を参照できるが、当該明細書の内容はここに引用することにより、本明細書の内容に組み込まれる。
【実施例】
【0055】
以下に、本発明の特定の実施態様についてさらに具体的に説明する。
【0056】
実施例1:糖で3’末端に修飾した核酸の核酸合成機での合成
(1)上記反応スキームに記載された配糖体(化合物8:式中、Acはアセチル基であり、DMTrはジメトキシトリチルチル基である)を担持させたCPG(controlled pore glass)(20mg)を核酸合成機の反応カラム(グレンリサーチ社製)に入れてホスホロアミダイト法で核酸を合成した。合成した核酸は5’dTdTdTdTdTdTdTdTdTdT−galactose−3’であり合成後、アンモニア/エタノール(3/1)で55℃において6時間反応させ脱保護及び切り出しを行った。Sep−Pakカラム(Waters製)で精製した後、MALDI−TOF−MSで分子量を解析したところ、3365に目的分子量が得られた。
(2)上記で合成した核酸は以下に示す配列の核酸である:
RNA1:5’−GGA CCA CCG CAU CUC UAC AdTdT−3’RNA2:5’−GGA CCA CCG CAU CUC UAC AdTdT−gal−3’
RNA3:5’−UGU AGA GAU GCG GUG GUC CdTdT−3’RNA4:5’−UGU AGA GAU GCG GUG GUC CdTdT−gal−3’
ここで、RNA1及びRNA3は二本鎖にした場合、Survivinに対するsiRNAであり、RNA2、RNA4はそれぞれ3’末端にガラクトースで修飾したものである。
【0057】
実施例2:糖修飾核酸のチオール化
(1)上記の実施例1によりガラクトースを固定化した固相(20mg、0.2μmol)及びGlen research社の5’−Thiol−Modifer C6(Catalog NO.10−1926−90)を用いて核酸の5’末端にチオ−ル基を導入しさらに核酸の3’末端にガラクトースを導入した核酸を合成した。合成した核酸は5’TrS−(CH2)6−dTdTdTdTdTdTdTdTdTdTdTdTdTdTdTdTdTdTdTdT−galactose−3’である(式中、Trはトリチル基である)。合成後、アンモニア水:エタノール(3:1)中の55℃下で4時間反応させ、脱保護及び固相から切り出しを行った。脱保護後、Sep−Pac C18で精製し、さらにポリアクリルアミドゲル電気泳動により精製を行った。MALD1−TOF−MSで分子量を解析したところ、6845に目的分子量が得られた。精製した核酸を硝酸銀(1mM)により室温で5分間処理し、その後ジチオトレイトール(1.5mM)により室温で1時間処理することでチオールを保護しているトリチル基を脱保護した。脱保護した核酸はPD−10カラム(GEヘルスケア)により精製し、凍結乾燥した。MALDI−TOF−MSで分子量を解析したところ、6603に目的分子量が得られた。
(2)同様に、コントロールとして、ガラストールで修飾していない核酸5’TrS−(CH2)6−dTdTdTdTdTdTdTdTdTdTdTdTdTdTdTdTdTdTdTdT−3’(式中、Trはトリチル基である)も合成した。
【0058】
実施例3:核酸と金粒子の結合
【0059】
【化10】

【0060】
(1)粒径5nmの金粒子(BBInternational社製)660μLにチオール核酸2nmolを加え脱イオン水中で24時間静置し反応させた。24時間後1M NaCl水溶液を用いてNaCl濃度を0.3Mにしさらに24時間静置して反応させた。反応後、遠心(14000rpm、20分)により金粒子を沈殿させて上澄み液を除去し未反応の核酸を除去した。得られた沈殿物にPBS溶液を1ml加え、遠心(14000rpm、20分)により金粒子を沈殿させて洗浄を行った。この洗浄操作を合計三回行い核酸が結合した金粒子を得た。
(2)上記(1)同様に操作するが、スケールアップして当該金粒子を得た。具体的には、粒径15nmの金粒子(BBInternational社製)6.6mLに、それぞれ、20nmolのガラストース修飾チオール核酸及びガラストース未修飾チオール核酸を加え脱イオン水中で24時間静置し反応させた。24時間後1M NaCl水溶液を用いてNaCl濃度を0.3Mにしさらに24時間静置して反応させた。反応後、遠心(14000rpm、20分)により金粒子を沈殿させて上澄み液を除去し未反応の核酸を除去した。得られた沈殿物にPBS溶液を1ml加え、遠心(14000rpm、20分)により金粒子を沈殿させて洗浄を行った。この洗浄操作を合計三回行い核酸が結合した金粒子を得た。
【0061】
得られた核酸修飾金ナノ粒子上の核酸の数は、以下のようにして求めることができる。例えば、上記(1)で得られた核酸修飾金ナノ粒子を10mMのジチオトレイトール中により室温で8時間反応させ、その後金粒子から放出された核酸の濃度をOliGreen(インビトロジェン社)により定量した。その結果、1個の金粒子あたり110本の核酸が結合していることが確認された。
【0062】
上記1により構築した粒子の大きさを(ゼータサイザー、Malvern社製)により測定した結果を図2に示す。コントロールとして糖を提示していない核酸を金粒子に結合させた系も構築した。共に30nm程度の粒径であることが確認された。
【0063】
実施例4:核酸結合金ナノ粒子の安定性試験
次に糖−オリゴ核酸コンジュゲート及びコントロールとなる未糖修飾オリゴ核酸を金粒子に結合させたナノ粒子(金粒子0.2pmol)を10%血清が存在する培地に加え37℃のインキュベーターで2週間放置し、ナノ粒子の安定性を見た。結果を図3に示す。図3から核酸がむき出しになっている従来のナノ粒子では血清中で不安定であり粒径が大きくなっているが、糖鎖を最外殻に有するナノ粒子は血清中で安定であり粒径がほとんど変化していないことがわかる。
【0064】
また、UV−Visの測定結果を図4に示す。この図から、金ナノ粒子は凝集すると長波長側に吸収がシフトすることがわかっている。UV−Visの結果より糖鎖を最外殻に提示したナノ粒子はシフト幅が小さくナノ粒子が血清中で安定化していることがわかる。
【0065】
実施例5:ガラクトース修飾金ナノ粒子と未修飾金ナノ粒子のラット初代肝細胞への取り込み試験
8週齢のラットを解剖し初代肝細胞を得てコラーゲンコートされた96wellプレート2x104個/wellの濃度で播種した。播種後24時間後にガラクトース修飾核酸を結合させた金粒子及びガラクトース未修飾核酸を結合させた金粒子を1nmolの濃度になるように細胞に添加し、0.5、1、3、5、12時間後に細胞を回収し、細胞に取り込まれている金粒子の数をICP−MSにより解析した。結果を図5に示す。図5の結果より、ガラクトースを修飾した金ナノ粒子は未修飾の金ナノ粒子よりも高効率でラット初代肝細胞に取り込まれている事が確認できる。
【0066】
つまり、ガラクトース修飾核酸を結合させた金粒子ガラクトースをクラスター状に最外殻層に提示しているため、粒子が安定化し、レセプターを介した選択的な取り込みにより、高効率で細胞に取り込まれている。
【0067】
実施例6:ガラクトースによるコンペティションアッセイ
ガラクトースを修飾金ナノ粒子の高効率な取り込みがアシアログリコプロテインレセプター(Asialoglycoprotein receptor)を介したものである事を確認するため、ガラクトースによるコンペティションアッセイを行った。8週齢のラットを解剖し初代肝細胞を得てコラーゲンコートされた96wellプレート2x104個/wellの濃度で播種した。播種後24時間後にガラクトース修飾核酸を結合させた金粒子を1nmolの濃度になるように細胞に添加し、30分後に細胞を回収し、細胞に取り込まれている金粒子の数をICP−MSにより解析した。コンペティションアッセイにはガラクトース修飾核酸を結合させた金粒子を加える30分前に培地中にガラクトースを40mMの濃度で加え解析した。結果を図6に示す。ガラクトース修飾した金ナノ粒子の肝細胞への取り込みが、ガラクトースを培地に添加する事で阻害されている事から、この粒子はアシアログリコプロテインレセプターを介して取り込まれていることが判明した。
【産業上の利用可能性】
【0068】
本発明では、糖鎖を最外殻に持つオリゴ核酸医薬用のナノ粒子が提供される。この糖鎖により細胞外の生理学的な環境下でオリゴ核酸が安定化され、かつ、機能化されたナノ粒子は次世代の医薬品として注目の集まっている核酸医薬品の開発に大きく貢献するものであると考える。したがって、本発明は核酸医薬品の製造業で利用できる。
【特許請求の範囲】
【請求項1】
一般式(I)
MeNP(−thio−L1−nuc−L2−carb)p (I)
上記式中、MeNPは金または銀等の貴金属ナノ粒子を表し、
thio−L1は貴金属ナノ粒子表面とチオール基(1または2以上)の相互作用により当該表面に−thio−L1−nuc−L2−carb鎖を結合できる硫黄原子を1個または2個以上含有する基または部分(moiety)を表し、
nucは一本鎖もしくは二本鎖−オリゴ−もしくはポリヌクレオチドを表し、
L2は直接結合またはリンカーを表し、
carbは糖残基を表し、そして
pは5〜100000の整数を表す、
で表される糖修飾核酸と貴金属ナノ粒子のコンジュゲート。
【請求項2】
L2のリンカーが、下記式で示されるいずれかに由来する部分である請求項1に記載のコンジュゲート。
(a)
【化1】

上式中、L2に該当する部分は、R1及びR2を除いた部分であり、R1及びR2は、いずれか一方がL1に結合する一般式(I)のnuc部分に相当し、他方が一般式(I)のcarbに相当するものであり、L3及びL4は、相互に独立して、C1−C6−アルキレンまたは−CH2CH2(OCH2CH2)q−(ここで、qは1〜12の整数である)であるか、または存在し得る場合には直接結合であり、かつ、R1またはR2がnuc部分に相当する場合には、L3及びL4は、相互に独立して、L1とnucの結合する3’もしくは5’末端に対して、それぞれnucの逆の5’末端のHOCH2−とエーテル結合もしくはエステル結合、リン酸残基とリン酸ジエステル結合またはチオリン酸エステル結合を形成するか、または3’末端のヒドロキシル基とエーテル結合もしくはエステル結合、リン酸残基とリン酸ジエステル結合またはチオリン酸エステル結合を形成し、あるいはまた、
R1またはR2がcarbに相当する場合には、L3及びL4は、相互に独立して、carbとエーテルまたはエステル結合を形成できる、
(b)
【化2】

上式中、L2に該当する部分は、−O−Nuc及びCarbが除かれた部分であり、
−O−Nucは一般式(I)のnuc部分に相当し、Carbは一般式(I)のcarbに相当し、nucとL2は、L1とnucの結合する3’もしくは5’末端に対して、それぞれnucの逆の5’末端のHOCH2−とエーテル結合もしくはエステル結合、リン酸残基とリン酸ジエステル結合またはチオリン酸エステル結合を形成するか、もしくは3’末端のヒドロキシル基とエーテル結合もしくはエステル結合、リン酸残基とリン酸ジエステル結合またはチオリン酸エステル結合を形成し、carbとL2の結合はエーテル結合であり、
(i)A及びBはいずれか一方が、水素原子、HOOC−(CH2)2−COO−、HOOC−(CH2)3−COO−またはHOOC−CH2−O−CH2−COO−を表し、他方は水素原子、ヒドロキシル基または保護されたヒドロキシル基を表し、ここで、保護基はハロゲン原子1〜3個により置換されていてもよい直鎖もしくは分岐のC1−C6アルキルカルボニル基、メトキシにより置換されていてもよいベンジルオキシ基、アリルオキシ基、トリ−直鎖もしくは分岐のC1−C6アルキルシリルオキシ基、フェニルカルボニルオキシ基、ピバロエートエステル基、レブリネートエステル基を表す、あるいはまた、
(ii)A及びBは相互に独立して、ヒドロキシル基、または保護されたヒドロキシル基を表し、ここで、保護基はハロゲン原子1〜3個により置換されていてもよい直鎖もしくは分岐のC1−C6アルキルカルボニル基、メトキシにより置換されていてもよいベンジルオキシ基、アリルオキシ基、トリ−直鎖もしくは分岐のC1−C6アルキルシリルオキシ基、フェニルカルボニルオキシ基、ピバロエートエステル基、レブリネートエステル基を表し、あるいはまた
(iii)A及びBは一緒になって、単結合を表す。
a、b及びcは、相互に独立して、0〜3の整数を表し、あるいはまたcの付された結合〔式中の(>)c部分〕は存在しなくてもよく、ただし、a、b及びcは全体で3〜7員環を形成するものとして定義されており、mは0〜12の整数を表し、そしてnは0〜12の整数を表す、
(c)下記式(I−c)
【化3】

上式中、L2に該当する部分は、R1及びR2を除いた部分であり、L5は、C1−C6−アルキレンまたは−CH2CH2(OCH2CH2)q−(ここで、qは1〜12の整数である)であり、R1及びR2は、いずれか一方がL1に結合する一般式(I)のnuc部分に相当し、他方が一般式(I)のcarbに相当するものであり、かつ、R1またはR2がnuc部分に相当する場合には、L5は、L1とnucの結合する3’もしくは5’末端に対して、それぞれnucの逆の5’末端のHOCH2−とエーテル結合もしくはエステル結合、リン酸残基とリン酸ジエステル結合またはチオリン酸エステル結合を形成するか、または3’末端のヒドロキシル基とエーテル結合もしくはエステル結合、リン酸残基とリン酸ジエステル結合またはチオリン酸エステル結合を形成し、あるいはまた、R1またはR2がcarbに相当する場合には、L5は、相互に独立して、carbと
エーテルまたはエステル結合を形成できる。
【請求項3】
請求項2に記載のコンジュゲートであって、
MeNPが金であり、
−thio−L1が、−S−C1−C12−アルキレンである、上記コンジュゲート。
【請求項4】
請求項2に記載のコンジュゲートであって、糖残基が、エリトロース、トレオース、リボース、アラビノース、キシロース、リキソース、アロース、アルトロース、グルコース、マンノース、グロース、イドース、ガラクトース、タロース、エリトルロース、リブロース、キシルロース、プシコース、フルクトース、ソルボース、タガトース、セドヘプツロース、2−デオキシリボース、2−デオキシグルコース、キノボース、テベトース、ラムノース、フコース、ジギノース、ジギタロース、ジギトキソース、シマロース、アベクォース、アスカリロース、コリトース、パラトース、チベロース、グルコサミン、マンノサミン、ガラクトサミン、フコサミン、キノボサミン、ラムノサミン、ノジリマイシン、アピオース、ストレプトース、エバロース、ハマメロース、ノイラミン酸、ムラミン酸、N−アセチルグルコサミン、N−アセチルノイラミン酸、N−グライコリルノイラミン酸、N−アセチルガラクトサミン、α,α−トレハロース、β,β−トレハロース、α,β−トレハロース、トレハロサミン、コウジビオース、ニゲロース、マルトース、マルチトール、マルツロース、イソマルトース、イソマルツロース、パラチノース、ソホロース、ラミナラビオース、セロビオース、セロビオン酸、ゲンチオビオース、ガラクトスクロース、ラクトース、ラクトサミン、ラクトースジアミン、ラクトビオン酸、ラクチトール、ラクツロース、メリビオース、ネオラクトース、プリメベロース、ルチノース、シラビオース、スクラロース、スクロース、ツラノース、ビシアノース、ヒアロビウロン酸、セロトリオース、カコトリオース、ゲンチアノース、イソマルトトリオース、イソパノース、マルトトリオース、マンニノトリオース、メレジトース、パノース、プランテオース、ラフィノース、ソラトリオース、ウンベリフェロース、リコテトラオース、マルトテトラオース、スタキオース、マルトペンタオース、ベルバスコース、マルトヘキサオース、α−シクロデキストリン、β−シクロデキストリン、γ−シクロデキストリン、δ−シクロデキストリン、グリコーゲン、アミロース、アミロペクチン、デキストリン、グルカン、キチン質、フラクトオリゴ糖、ガラクトオリゴ糖、マンナンオリゴ糖、シアリルルイスA抗原、シアリルルイスX抗原、好ましくはグルコース、マンノース、ガラクトース、フルクトース、フコース、グルコサミン、ガラクトサミン、N−アセチルグルコサミン、N−アセチルノイラミン酸、N−グライコリルノイラミン酸、N−アセチルガラクトサミン、α,α−トレハロース、β,β−トレハロース、α,β−トレハロース、マルトース、ラクトース、マルトトリオース、シアリルルイスA抗原及びシアリルルイスX抗原よりなる群から選ばれる糖に由来する、上記コンジュゲート。
【請求項1】
一般式(I)
MeNP(−thio−L1−nuc−L2−carb)p (I)
上記式中、MeNPは金または銀等の貴金属ナノ粒子を表し、
thio−L1は貴金属ナノ粒子表面とチオール基(1または2以上)の相互作用により当該表面に−thio−L1−nuc−L2−carb鎖を結合できる硫黄原子を1個または2個以上含有する基または部分(moiety)を表し、
nucは一本鎖もしくは二本鎖−オリゴ−もしくはポリヌクレオチドを表し、
L2は直接結合またはリンカーを表し、
carbは糖残基を表し、そして
pは5〜100000の整数を表す、
で表される糖修飾核酸と貴金属ナノ粒子のコンジュゲート。
【請求項2】
L2のリンカーが、下記式で示されるいずれかに由来する部分である請求項1に記載のコンジュゲート。
(a)
【化1】

上式中、L2に該当する部分は、R1及びR2を除いた部分であり、R1及びR2は、いずれか一方がL1に結合する一般式(I)のnuc部分に相当し、他方が一般式(I)のcarbに相当するものであり、L3及びL4は、相互に独立して、C1−C6−アルキレンまたは−CH2CH2(OCH2CH2)q−(ここで、qは1〜12の整数である)であるか、または存在し得る場合には直接結合であり、かつ、R1またはR2がnuc部分に相当する場合には、L3及びL4は、相互に独立して、L1とnucの結合する3’もしくは5’末端に対して、それぞれnucの逆の5’末端のHOCH2−とエーテル結合もしくはエステル結合、リン酸残基とリン酸ジエステル結合またはチオリン酸エステル結合を形成するか、または3’末端のヒドロキシル基とエーテル結合もしくはエステル結合、リン酸残基とリン酸ジエステル結合またはチオリン酸エステル結合を形成し、あるいはまた、
R1またはR2がcarbに相当する場合には、L3及びL4は、相互に独立して、carbとエーテルまたはエステル結合を形成できる、
(b)
【化2】

上式中、L2に該当する部分は、−O−Nuc及びCarbが除かれた部分であり、
−O−Nucは一般式(I)のnuc部分に相当し、Carbは一般式(I)のcarbに相当し、nucとL2は、L1とnucの結合する3’もしくは5’末端に対して、それぞれnucの逆の5’末端のHOCH2−とエーテル結合もしくはエステル結合、リン酸残基とリン酸ジエステル結合またはチオリン酸エステル結合を形成するか、もしくは3’末端のヒドロキシル基とエーテル結合もしくはエステル結合、リン酸残基とリン酸ジエステル結合またはチオリン酸エステル結合を形成し、carbとL2の結合はエーテル結合であり、
(i)A及びBはいずれか一方が、水素原子、HOOC−(CH2)2−COO−、HOOC−(CH2)3−COO−またはHOOC−CH2−O−CH2−COO−を表し、他方は水素原子、ヒドロキシル基または保護されたヒドロキシル基を表し、ここで、保護基はハロゲン原子1〜3個により置換されていてもよい直鎖もしくは分岐のC1−C6アルキルカルボニル基、メトキシにより置換されていてもよいベンジルオキシ基、アリルオキシ基、トリ−直鎖もしくは分岐のC1−C6アルキルシリルオキシ基、フェニルカルボニルオキシ基、ピバロエートエステル基、レブリネートエステル基を表す、あるいはまた、
(ii)A及びBは相互に独立して、ヒドロキシル基、または保護されたヒドロキシル基を表し、ここで、保護基はハロゲン原子1〜3個により置換されていてもよい直鎖もしくは分岐のC1−C6アルキルカルボニル基、メトキシにより置換されていてもよいベンジルオキシ基、アリルオキシ基、トリ−直鎖もしくは分岐のC1−C6アルキルシリルオキシ基、フェニルカルボニルオキシ基、ピバロエートエステル基、レブリネートエステル基を表し、あるいはまた
(iii)A及びBは一緒になって、単結合を表す。
a、b及びcは、相互に独立して、0〜3の整数を表し、あるいはまたcの付された結合〔式中の(>)c部分〕は存在しなくてもよく、ただし、a、b及びcは全体で3〜7員環を形成するものとして定義されており、mは0〜12の整数を表し、そしてnは0〜12の整数を表す、
(c)下記式(I−c)
【化3】

上式中、L2に該当する部分は、R1及びR2を除いた部分であり、L5は、C1−C6−アルキレンまたは−CH2CH2(OCH2CH2)q−(ここで、qは1〜12の整数である)であり、R1及びR2は、いずれか一方がL1に結合する一般式(I)のnuc部分に相当し、他方が一般式(I)のcarbに相当するものであり、かつ、R1またはR2がnuc部分に相当する場合には、L5は、L1とnucの結合する3’もしくは5’末端に対して、それぞれnucの逆の5’末端のHOCH2−とエーテル結合もしくはエステル結合、リン酸残基とリン酸ジエステル結合またはチオリン酸エステル結合を形成するか、または3’末端のヒドロキシル基とエーテル結合もしくはエステル結合、リン酸残基とリン酸ジエステル結合またはチオリン酸エステル結合を形成し、あるいはまた、R1またはR2がcarbに相当する場合には、L5は、相互に独立して、carbと
エーテルまたはエステル結合を形成できる。
【請求項3】
請求項2に記載のコンジュゲートであって、
MeNPが金であり、
−thio−L1が、−S−C1−C12−アルキレンである、上記コンジュゲート。
【請求項4】
請求項2に記載のコンジュゲートであって、糖残基が、エリトロース、トレオース、リボース、アラビノース、キシロース、リキソース、アロース、アルトロース、グルコース、マンノース、グロース、イドース、ガラクトース、タロース、エリトルロース、リブロース、キシルロース、プシコース、フルクトース、ソルボース、タガトース、セドヘプツロース、2−デオキシリボース、2−デオキシグルコース、キノボース、テベトース、ラムノース、フコース、ジギノース、ジギタロース、ジギトキソース、シマロース、アベクォース、アスカリロース、コリトース、パラトース、チベロース、グルコサミン、マンノサミン、ガラクトサミン、フコサミン、キノボサミン、ラムノサミン、ノジリマイシン、アピオース、ストレプトース、エバロース、ハマメロース、ノイラミン酸、ムラミン酸、N−アセチルグルコサミン、N−アセチルノイラミン酸、N−グライコリルノイラミン酸、N−アセチルガラクトサミン、α,α−トレハロース、β,β−トレハロース、α,β−トレハロース、トレハロサミン、コウジビオース、ニゲロース、マルトース、マルチトール、マルツロース、イソマルトース、イソマルツロース、パラチノース、ソホロース、ラミナラビオース、セロビオース、セロビオン酸、ゲンチオビオース、ガラクトスクロース、ラクトース、ラクトサミン、ラクトースジアミン、ラクトビオン酸、ラクチトール、ラクツロース、メリビオース、ネオラクトース、プリメベロース、ルチノース、シラビオース、スクラロース、スクロース、ツラノース、ビシアノース、ヒアロビウロン酸、セロトリオース、カコトリオース、ゲンチアノース、イソマルトトリオース、イソパノース、マルトトリオース、マンニノトリオース、メレジトース、パノース、プランテオース、ラフィノース、ソラトリオース、ウンベリフェロース、リコテトラオース、マルトテトラオース、スタキオース、マルトペンタオース、ベルバスコース、マルトヘキサオース、α−シクロデキストリン、β−シクロデキストリン、γ−シクロデキストリン、δ−シクロデキストリン、グリコーゲン、アミロース、アミロペクチン、デキストリン、グルカン、キチン質、フラクトオリゴ糖、ガラクトオリゴ糖、マンナンオリゴ糖、シアリルルイスA抗原、シアリルルイスX抗原、好ましくはグルコース、マンノース、ガラクトース、フルクトース、フコース、グルコサミン、ガラクトサミン、N−アセチルグルコサミン、N−アセチルノイラミン酸、N−グライコリルノイラミン酸、N−アセチルガラクトサミン、α,α−トレハロース、β,β−トレハロース、α,β−トレハロース、マルトース、ラクトース、マルトトリオース、シアリルルイスA抗原及びシアリルルイスX抗原よりなる群から選ばれる糖に由来する、上記コンジュゲート。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2011−236194(P2011−236194A)
【公開日】平成23年11月24日(2011.11.24)
【国際特許分類】
【出願番号】特願2010−260461(P2010−260461)
【出願日】平成22年11月22日(2010.11.22)
【出願人】(504171134)国立大学法人 筑波大学 (510)
【Fターム(参考)】
【公開日】平成23年11月24日(2011.11.24)
【国際特許分類】
【出願日】平成22年11月22日(2010.11.22)
【出願人】(504171134)国立大学法人 筑波大学 (510)
【Fターム(参考)】
[ Back to top ]

