糖化アミンを測定するための試料の前処理方法および糖化アミンの測定方法
【課題】糖化アミンを測定対象物とする試料の前処理方法を提供し、信頼性に優れた糖化アミンの測定を可能にする。
【解決手段】試料中の糖化アミノ酸にフルクトシルアミノ酸オキシダーゼ(FAOD)を作用させて分解した後、さらに前記試料中の測定対象物である糖化アミンにFAODを作用させて、その酸化還元反応を測定することにより糖化アミンの量を測定する。糖化アミノ酸に作用させるFAODと糖化アミンに作用させるFAODとは、同じ基質特異性でも異なる基質特異性でもよい。同じFAODを使用する場合は、糖化アミノ酸にFAODを作用させて分解した後、プロテアーゼによって前記FAODを失活させると共に前記糖化アミンを分解し、この分解物に、さらに同じFAODを添加して作用させ、その酸化還元反応を測定する。
【解決手段】試料中の糖化アミノ酸にフルクトシルアミノ酸オキシダーゼ(FAOD)を作用させて分解した後、さらに前記試料中の測定対象物である糖化アミンにFAODを作用させて、その酸化還元反応を測定することにより糖化アミンの量を測定する。糖化アミノ酸に作用させるFAODと糖化アミンに作用させるFAODとは、同じ基質特異性でも異なる基質特異性でもよい。同じFAODを使用する場合は、糖化アミノ酸にFAODを作用させて分解した後、プロテアーゼによって前記FAODを失活させると共に前記糖化アミンを分解し、この分解物に、さらに同じFAODを添加して作用させ、その酸化還元反応を測定する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、糖化アミンを測定するための試料の前処理方法および糖化アミンの測定方法に関する。
【背景技術】
【0002】
従来から、酸化還元反応を利用して、試料中の測定対象物の量を測定することが広く実施されており、生化学分析や臨床検査等における糖化アミン(糖化タンパク質、糖化ペプチド、糖化アミノ酸等)の測定にも適用されている。
【0003】
特に、血液中の糖化タンパク質、その中でも赤血球中の糖化ヘモグロビンは、生体血糖値の過去の履歴を反映しているため、糖尿病診断や治療等における重要な指標とされている。このような赤血球中の糖化タンパク質は、前記酸化還元反応を用いて、例えば、以下に示すようにして測定されている。
【0004】
まず、赤血球を溶血させた試料を調製し、この溶血試料にフルクトシルアミノ酸オキシダーゼ(以下、「FAOD」という)を添加し、糖化タンパク質の糖化部分に作用させて酸化還元反応により過酸化水素を発生させる。この過酸化水素量は、前記糖化タンパク質量に対応する。そして、この試料に、ペルオキシダーゼ(以下、「POD」という)および酸化により発色する還元剤を添加し、前記PODを触媒として前記過酸化水素と前記還元剤との間で酸化還元反応させる。前記反応により前記還元剤を発色させ、この発色を測定することにより前記過酸化水素量が測定でき、この結果、赤血球中の糖化タンパク質量を知ることができる。
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、このような酸化還元反応を用いた糖化タンパク質の測定方法において、例えば、実際に試料中に含まれる糖化タンパク質に対応する以上の過酸化水素が発生するという問題があった。また、患者によっては、一時的に糖化タンパク質の測定値が急激に増加し、信頼性ある測定が行えないという問題もあった。このため、前記測定方法において、さらなる測定精度の向上が求められている。また、前記酸化還元反応を用いた測定方法には限られず、例えば、抗原抗体反応を用いた糖化アミン測定方法においても、同様に測定精度の向上が求められている。
【0006】
そこで、本発明は、糖化アミンを測定するための試料の前処理方法の提供であって、これにより、信頼性に優れた糖化アミンの測定を可能にすることを目的とする。
【課題を解決するための手段】
【0007】
前記目的を達成するために、本発明の前処理方法は、糖化アミンを測定対象とする試料の前処理方法であって、前記試料中に測定対象の糖化アミンとは別に存在する糖化アミノ酸または糖化ペプチドを除去することを目的として、前記別に存在する糖化アミノ酸または糖化ペプチドにFAODを作用させて分解する方法である。
【0008】
なお、前記FAODは、一般名称であり、その基質としては糖化アミノ酸には限られず、例えば、糖化ペプチドにも作用する。また、本発明において「糖化ペプチド」とは、FAODが作用する長さのペプチドをいい、アミノ酸残基数が、例えば、2〜6の範囲のものをいう。これに伴い、本発明においては、FAODが作用しない長さの糖化ペプチドおよび糖化タンパク質を併せて「糖化タンパク質」という。そして、測定対象の前記糖化アミンとしては、例えば、糖化タンパク質、糖化ペプチド、糖化アミノ酸が含まれる。
【発明の効果】
【0009】
本発明者らは、測定精度の向上を図るべく鋭意研究を行った結果、以下の事を突き止めた。つまり、全血中には、本来、測定対象物である糖化アミンの他に、測定対象物以外の遊離の糖化アミノ酸や糖化ペプチドが存在しており、前記FAODは、このような糖化アミノ酸や糖化ペプチドに対しても作用する。このため、前述のようなFAODを用いた糖化アミンの測定を行った場合、測定対象の糖化アミンとFAODとの酸化還元反応だけでなく、測定対象以外の糖化アミノ酸や糖化ペプチドとFAODとの酸化還元反応も生じてしまい、見かけ上、測定対象物の測定値が増加してしまうのである。さらに、同じ患者の全血試料について、全く同じ条件で前記測定方法により測定を行った場合でも、患者によっては採血時が異なると測定値が著しく変動するという前述の問題に関しても、以下の事を突き止めた。すなわち、この問題は、主に点滴等を受けた患者に見られる現象であり、このように測定値が変動するのは、点滴等の成分として、例えば、グルコース等の糖類や各種アミノ酸が含まれると、これらの外来成分から糖化アミノ酸が生成され、一過的に糖化アミノ酸が増加するためであることを突き止めたのである。このような現象は、前記酸化還元反応による測定においてだけでなく、例えば、前記抗原抗体反応を用いた測定方法においても、同様に生じていた。そこで、全血試料中に、恒常的な糖化アミノ酸や糖化ペプチド、一過性の外来糖化アミノ酸等といった測定対象物以外の糖化物が存在しても、本発明のように、試料に対して、予め、測定対象物以外の糖化アミノ酸や糖化ペプチドに分解用FAODを作用させて分解する前処理を行えば、前述のような見かけ上の測定値の向上が抑制されることを、本発明者らが初めて見出したのである。これによって、測定精度が向上でき、さらに、例えば、点滴を受けたか否かに関わらず、いつでも採血を行うことができるため、患者の負担も低減できる。このような試料の前処理方法を、例えば、前述のような糖化ヘモグロビンの測定において適用すれば、糖化ヘモグロビンの糖尿病診断の指標としての信頼性も増し、臨床医療等の分野において有用な方法となる。
【図面の簡単な説明】
【0010】
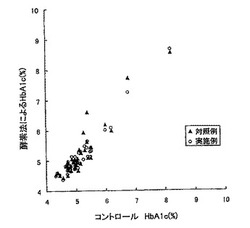
【図1】図1は、本発明の測定方法の一実施例において、FAODを用いた測定方法によるHbA1c量と、自動分析装置によるHbA1c量との相関関係を示すグラフである。
【発明を実施するための形態】
【0011】
つぎに、本発明の測定方法は、試料中の糖化アミンにFAODを作用させて、その酸化還元反応を測定することにより糖化アミンの量を測定する方法であって、前記試料中の糖化アミンとは別に存在する糖化アミノ酸または糖化ペプチドを除去することを目的として、前記酸化還元反応に先立ち、予め、前記試料を前記本発明の前処理方法によって処理して、前記糖化アミノ酸または糖化ペプチドを分解する方法である。
【0012】
前述のような理由から、このような測定方法によれば、測定精度を向上できる。以下、本発明において、前記糖化アミノ酸や糖化ペプチドを分解するためのFAODを「分解用FAOD」といい、前記糖化アミンに作用させる測定のためのFAODを「測定用FAOD」という。また、測定対象の糖化アミンとは別に存在する糖化アミノ酸および糖化ペプチドを、以下、「非測定対象糖化物」ともいう。
【0013】
本発明の測定方法としては、例えば、前記非測定対象糖化物と前記測定対象糖化アミンとに、異なる基質特異性のFAODを使用する第1の測定方法と、同じFAODを使用する第2の測定方法とがあげられる。
【0014】
なお、FAODには、後述するように、例えば、α−アミノ基の糖化部分に作用するもの、リジンやアルギニン等のアミノ酸残基の側鎖アミノ基の糖化部分に作用するもの、および前記両方の糖化部分に作用するもの等があり、その基質特異性はFAODの種類により様々である。そして、糖化アミンの測定において、前記α−アミノ基の糖化部分、前記側鎖アミノ基の糖化部分または両方の糖化部分のいずれにFAODを作用させても、その量を測定することが可能である。
【0015】
本発明の第1の測定方法としては、前記非測定対象糖化物に作用させる分解用FAODと、測定対象糖化アミンに作用させる測定用FAODとが、異なる基質特異性を有することが好ましい。これによれば、分解用FAODによって前記非測定対象糖化物の糖化部分を分解し、糖化アミンについては、前記分解用FAODが作用していない糖化部分に、さらに異なる基質特異性の測定用FAODを作用させることができるため、前記非測定対象糖化物の影響を受けず、測定精度を向上できるからである。
【0016】
具体的には、例えば、非測定対象物は、α−アミノ基が糖化されており、測定対象糖化アミンは、α−アミノ基糖化部分および側鎖アミノ基が糖化されている場合、前記分解用FAODは、糖化されたα−アミノ基に特異的に作用し、前記測定用FAODは、糖化されたα−アミノ基および糖化されたアミノ酸残基側鎖に特異的に作用する酵素であることが好ましい。前記測定用FAODは、α−アミノ基糖化部分および側鎖アミノ基糖化部分の両方に作用するため、従来の方法であれば、前述のようにα−アミノ基が糖化された非測定対象糖化物にも作用していた。しかし、本発明においては、前記非測定対象糖化物の糖化部分は、予め、前記糖化α−アミノ基に特異的に作用する分解用FAODによって分解されているため、これに測定用FAODが作用することはなく、見かけ上の測定値の増加が抑制されて精度が向上する。また、測定用FAODは、前述のようにα−アミノ基糖化部分および側鎖アミノ基糖化部分の両方に作用するため、糖化アミンのα−アミノ基糖化部分も分解用FAODにより分解されており、糖化アミンの側鎖アミノ基糖化部分のみに測定用FAODを作用させることができる。このため、特に側鎖アミノ基の糖化量に特徴がある糖化アミンの測定に、有用な方法といえる。このような糖化アミンとしては、例えば、ε−糖化リジン、糖化アルブミン等があげられる。
【0017】
このように異なるFAODを用いる場合、前記非測定対象糖化物にFAODを作用させる前または作用させた後に、糖化アミンをプロテアーゼで分解し、この糖化アミン分解物に、前記測定用FAODを作用させて前記酸化還元反応を行うことが好ましい。糖化アミンを分解するのは、測定対象物が糖化タンパク質の場合、FAODは前記糖化タンパク質には作用し難く、前述のような糖化ペプチドや糖化アミノ酸に作用するからであり、また、前記糖化ペプチドよりも糖化アミノ酸により一層作用し易いからである。また、プロテアーゼ処理の順序が、非測定対象糖化物の分解処理の前後で制限されないのは、測定用FAODは、前述のように分解用FAODとは異なる糖化部分に作用できるため、糖化アミンの測定自体には影響を受けないからである。また、測定対象が糖化ペプチドの場合も、さらに短い糖化ペプチドや糖化アミノ酸に分解すれば、より一層FAODが作用し易いため、プロテアーゼ処理を施すことが好ましい。
【0018】
なお、本発明において「非測定対象糖化物である糖化アミノ酸および糖化ペプチド」とは、特に示さない限り、分解処理前から試料中に含まれるものをいい、例えば、測定対象物である糖化タンパク質や糖化ペプチドのプロテアーゼ分解物は含まない。
【0019】
つぎに、本発明の第2の測定方法としては、非測定対象糖化物に分解用FAODを作用させた後、測定対象の糖化アミンをプロテアーゼで分解し、さらに前記分解用FAODと同じFAODを添加して、前記プロテアーゼ分解物に作用させて前記酸化還元反応を行うことが好ましい。このような方法は、例えば、被測定対象糖化物が糖化アミノ酸であって、測定糖化アミンが糖化タンパク質や糖化ペプチドの場合に有用である。
【0020】
具体的には、前記プロテアーゼにより、前記分解用FAODを失活させることが好ましい。前述のように、FAODは、糖化タンパク質には作用し難く、また、糖化ペプチドよりも糖化アミノ酸により一層作用し易いという性質を有している。このため、非測定対象糖化物が糖化アミノ酸である場合、例えば、分解用FAODを添加しても、酵素の反応速度論から、糖化アミノ酸を分解する処理時間においては、糖化タンパク質には作用せず、糖化ペプチドにもあまり作用し難いといえる。しかし、続くプロテアーゼ処理の間も前記分解用FAODの活性が残存していると、プロテアーゼ処理と併行して、プロテアーゼによる糖化タンパク質分解物(糖化ペプチドや糖化アミノ酸)や糖化ペプチド分解物(より短い糖化ペプチドや糖化アミノ酸)に前記分解用FAODが作用してしまう。このため、後に測定用FAODを添加しても、すでに前記糖化タンパク質分解物等の一部には分解用FAODが作用した状態となり、反対に測定精度が低下するおそれがある。したがって、前述のように糖化タンパク質等を分解するためのプロテアーゼ処理によって、同時に残存する前記分解用FAODを失活させれば、プロテアーゼ処理による糖化タンパク質分解物等は、前記分解用FAODとは未反応のままで維持され、続いて添加する測定用FAODと反応することができる。このため測定精度も向上するのである。
【0021】
なお、この他に、例えば、測定対象物が糖化タンパク質であり、非測定対象糖化物が糖化ペプチドであってもよい。分解用FAODを糖化ペプチドに作用させでも、その際に、糖化タンパク質には作用しないからである。
【0022】
一方、前述のようにプロテアーゼ処理で分解用FAODを失活させなくとも、例えば、前記分解用FAODの添加量と、測定用FAODの添加量とを調整することによっても、高精度な測定を実現することもできる。この場合、例えば、前記分解用FAOD(A)と測定用FAOD(B)の添加割合(活性比A:B)を、A:B=1:10〜1:50,000の範囲に設定することが好ましい。このような添加割合であれば、プロテアーゼ処理を行う際に、前記分解用FAODが残存しても、酵素の反応速度論の点から、糖化タンパク質はもちろんのこと、非測定対象糖化物である糖化アミノ酸に比べて測定糖化アミンである糖化ペプチドには作用し難いからである。また、非測定対象糖化物が糖化ペプチドであり、測定糖化アミンが糖化タンパク質の場合も同様である。
【0023】
本発明の測定方法において、前記プロテアーゼとしては、例えば、メタロプロテアーゼ、ブロメライン、パパイン、トリプシン、プロテアーゼK、ズブチリシンおよびアミノペプチダーゼからなる群から選択された少なくとも一つのプロテアーゼが使用できるが、特に制限されない。
【0024】
また、測定対象物が、後述のような糖化ヘモグロビンである場合は、前記プロテアーゼは、糖化ヘモグロビンを選択的に分解するプロテアーゼであって、メタロプロテアーゼ、ブロメライン、パパイン、ブタ膵臓由来トリプシンおよびBacillus subtillis由来のプロテアーゼからなる群から選択された少なくとも一つのプロテアーゼであることが好ましく、より好ましくはメタロプロテアーゼ、Bacillus subtillis由来のプロテアーゼであり、特に好ましくはメタロプロテアーゼである。このようなプロテアーゼを作用させれば、糖化ヘモグロビン以外の糖化タンパク質は分解され難いため、前記他の糖化タンパク質にはFAODも作用し難く、糖化ヘモグロビンのみの測定が可能になる。
【0025】
本発明において、測定試料は特に制限されず、例えば、全血、血漿、血清、血球、尿、髄液等の生体試料や、ジュース等の飲料水、醤油、ソース等の食品類等の試料に対しても、本発明の測定方法を適用できる。この中でも、例えば、前記全血、血漿、血清、血球などの血液試料やその他の生体試料に有用である。
【0026】
また、例えば、前記全血試料が外来の糖化アミノ酸等を含んでいても、高精度な測定が可能である。例えば、前述のように外来の糖化アミノ酸は一過性のものであるが、全血中に含まれる間は著しく糖化タンパク質等の測定値に影響を与える。しかし、本発明によればそのような影響も回避できるからである。
【0027】
前記全血試料は、特に制限されないが、本発明の測定方法は、例えば、点滴後の患者から採取した全血試料に対して有用である。前述のように、特に点滴後の試料に、生成された外来アミノ酸による測定値の変動がみられるからである。
【0028】
本発明の測定方法において、測定対象物としては、酸化還元反応を利用するものであれば特に制限されない。例えば、全血中成分、赤血球内成分、血漿中成分、血清中成分、尿成分、髄液成分等があげられるが、好ましくは赤血球内成分である。例えば、前記赤血球成分を測定する場合、全血をそのまま溶血させたものを試料としてもよいし、全血から赤血球を分離して、前記赤血球を溶血させたものを試料として用いてもよい。
【0029】
本発明の測定方法において、前記測定対象物の糖化アミンとしては、前述のように糖化タンパク質、糖化ペプチド、糖化アミノ酸等が含まれる。具体的には、例えば、糖化ヘモグロビン、糖化アルブミン等の糖化タンパク質等があげられる。なお、赤血球成分である糖化ヘモグロビンを測定する場合は、例えば、全血をそのまま溶血させたものを試料としてもよいし、全血から赤血球を分離して、前記赤血球を溶血させたものを試料として用いてもよい。
【0030】
本発明の測定方法において使用するFAODは、下記式(1)に示す反応を触媒するFAODであることが好ましく、例えば、α−アミノ基が糖化された糖化アミンに特異的に作用するFAOD(以下、「FAOD−α」という)、アミノ酸側鎖のアミノ基が糖化された糖化アミンに特異的に作用するFAOD(以下、「FAOD−S」という)、α−アミノ基が糖化された糖化アミンおよびアミノ酸側鎖のアミノ基が糖化された糖化アミンのいずれにも特異的に作用するFAOD(以下、「FAOD−αS」という)等があげられる。
【0031】
R1−CO−CH2−NH−R2 + H2O + O2
→ R1−CO−CHO + NH2−R2 + H2O2 …(1)
前記式(1)において、R1は、水酸基もしくは糖化反応前の糖に由来する残基(糖残基)を意味する。前記糖残基(R1)は、反応前の糖がアルドースの場合はアルドース残基であり、反応前の糖がケトースの場合、ケトース残基である。例えば、反応前の糖がグルコースの場合は、アマドリ転位により、反応後の構造はフルクトース構造をとるが、この場合、糖残基(R1)は、グルコース残基(アルドース残基)となる。この糖残基(R1)は、例えば、
−[CH(OH)]n−CH2OH
で示すことができ、nは、0〜6の整数である。
前記式(1)において、R2は、特に制限されないが、糖化アミンが糖化アミノ酸または糖化ペプチドの場合、α−アミノ基が糖化されている場合と、それ以外のアミノ基(アミノ酸側鎖のアミノ基)が糖化されている場合とで異なる。
前記式(1)において、α−アミノ基が糖化されている場合、R2は、下記式(2)で示すアミノ酸残基またはペプチド残基である。この場合に前記式(1)の反応を特異的に触媒するのが前記FAOD−αおよびFAOD−αSである。
−CHR3−CO−R4 …(2)
前記式(2)において、R3はアミノ酸側鎖基を示し、R4は水酸基、アミノ酸残基またはペプチド残基を示し、例えば、下記式(3)で示すことができる。下記式(3)において、nは、0以上の整数であり、R3は、前述と同様に、アミノ酸側鎖基を示し、アミノ酸側鎖基は全て同一でも、異なっていても良い。
−(NH−CR3H−CO)n−OH …(3)
また、前記式(1)において、α−アミノ基以外のアミノ基が糖化されている(アミノ酸側鎖基が糖化されている)場合、R2は下記式(4)で示すことができる。この場合に前記式(1)の反応を特異的に触媒するのが前記FAOD−SおよびFAOD−αSである。
−R5−CH(NH−R6)−CO−R7 …(4)
前記式(4)において、R5は、アミノ酸側鎖基のうち、糖化されたアミノ基以外の部分を示す。例えば、糖化されたアミノ酸がリジンの場合、R5は
−CH2−CH2−CH2−CH2−
であり、
例えば、糖化されたアミノ酸がアルギニンの場合、R5は、
−CH2−CH2−CH2−NH−CH(NH2)−
である。
また、前記式(4)において、R6は、水素、アミノ酸残基またはペプチド残基であり、例えば、下記式(5)で示すことができる。なお、下記式(5)において、nは0以上の整数であり、R3は、前述と同様にアミノ酸側鎖基を示し、アミノ酸側鎖基は全て同一でも、異なっていても良い。
−(CO−CR3H−NH)n−H …(5)
また、前記式(4)において、R7は、水酸基、アミノ酸残基またはペプチド残基であり、例えば、下記式(6)で示すことができる。なお、下記式(6)において、nは0以上の整数であり、R3は、前述と同様にアミノ酸側鎖基を示し、アミノ酸側鎖基は全て同一でも、異なっていても良い。
−(NH−CHR3−CO)n−OH …(6)
【0032】
前記糖化α−アミノ基に特異的に作用するFAOD−αとしては、例えば、市販の商品名フルクトシル−アミノ酸オキシダーゼ(FAOX−E)(キッコーマン社製)、ペニシリウム属由来FAOD(特開平8−336386公報)等があげられる。前記糖化されたアミノ酸側鎖に特異的に作用するFAOD−Sとしては、例えば、フサリウム属由来FAOD(日本生物工学会大会 平成12年度 「Fusarium oxysporum 由来アミノ酸オキシダーゼの基質特異性の変換;藤原真紀 他」)等があげられる。また、前記糖化α−アミノ基および糖化アミノ酸側鎖基の両方に作用するFAOD−αSとしては、例えば、市販の商品名FOD(旭化成社製)、ギベレラ属由来FAOD(特開平8−154672号公報)、フサリウム属由来FAOD(特開平7−289253号公報)、アスペルギルス属由来FAOD(WO99/20039号)等があげられる。
【0033】
つぎに、本発明の測定方法について、非測定対象糖化物として糖化アミノ酸を含む全血試料を用いて、血球由来の糖化タンパク質を測定する例をあげて説明する。なお、本発明において「非測定対象糖化物である糖化アミノ酸」は、特に示さない限り、測定前から試料中に含まれるものをいい、例えば、測定対象物である糖化タンパク質のプロテアーゼ分解物は含まない。
【0034】
(第1の実施形態)
この実施形態は、前記糖化アミノ酸の分解にFAOD−αを使用し、糖化タンパク質の測定にFAOD−αSを用いた前記第1の測定方法の一例である。
【0035】
まず、全血を溶血して溶血試料を調製する。この溶血方法は、特に制限されず、例えば、界面活性剤を用いる方法、超音波による方法、浸透圧の差を利用する方法、凍結溶解による方法等が使用できる。この中でも、操作の簡便性等の理由から、界面活性剤を用いる方法が好ましい。
【0036】
前記界面活性剤としては、例えば、ポリオキシエチレン−p−t−オクチルフェニル エーテル(Triton系界面活性剤等)、ポリオキシエチレン ソルビタン アルキル エステル(Tween系界面活性剤等)、ポリオキシエチレン アルキル エーテル(Brij系界面活性剤等)等の非イオン性界面活性剤が使用でき、具体的には、例えば、商品名TritonX−100、商品名Tween−20、商品名Brij35等があげられる。前記界面活性剤による処理条件は、通常、処理溶液中の血球濃度が1〜10体積%の場合、前記処理溶液中の濃度が0.1〜1重量%になるように前記界面活性剤を添加し、室温で5秒〜1分程度攪拌すればよい。
【0037】
また、前記浸透圧の差を利用する場合は、例えば、全血の体積に対し2〜100倍体積量の精製水を添加して溶血させる。
【0038】
つぎに、前記溶血試料に対し、プロテアーゼ処理を行う。このプロテアーゼ処理によって糖化タンパク質を分解し、後述するFAODが作用し易いようにする。前記プロテアーゼの種類は、特に制限されず、前述のようなプロテアーゼK、ズブチリシン、トリプシン、アミノペプチダーゼ、パパイン、メタロプロテイナーゼ等が使用できる。前記プロテアーゼ処理は、通常、緩衝液中で行われ、その処理条件は、使用するプロテアーゼの種類、測定対象の糖化タンパク質の種類およびその濃度等により適宜決定される。
【0039】
プロテアーゼとしてトリプシンを用いて、前記試料を処理する場合、例えば、反応液中のプロテアーゼ濃度100〜6,000U/L、反応液中の血球濃度0.2〜5体積%、反応温度20〜50℃、反応時間10分〜20時間、pH6〜9の範囲である。この処理は、通常、緩衝液中で行われ、使用できる緩衝液は特に制限されないが、例えば、トリス塩酸緩衝液、リン酸緩衝液、EPPS緩衝液、PIPES緩衝液等である。
【0040】
つぎに、前記プロテアーゼ処理した溶血試料を、前記式(1)の反応、具体的には下記式(7)の反応を触媒するFAOD−αで処理する。
R1−CO−CH2−NH−CHR3−COOH + H2O + O2
→ R1−CO−CHO + NH2−CHR3−COOH + H2O2 …(7)
前記式(7)において、R1は前述と同様の糖残基を示し、R3は前述と同様にアミノ酸側鎖を示す。
【0041】
この処理によって、前記溶血試料に含まれるα−アミノ基が糖化された糖化アミノ酸、および前記糖化タンパク質分解物のうちα−アミノ基の糖化部分が分解される。
【0042】
なお、前記FAOD−α処理によっては、糖化アミノ酸の中でも側鎖アミノ基が糖化されたものは分解されずに残存する。しかし、この側鎖が糖化されたアミノ酸の糖化アミノ酸全体に対する割合と、糖化タンパク質における糖化された側鎖アミノ基を有するアミノ酸残基に対する割合から考えても、残存する糖化アミノ酸の影響は小さく、測定精度は十分に向上するといえる。
【0043】
処理条件としては、例えば、反応液中のFAOD−α濃度10〜5000U/L、反応液中の血球濃度0.5〜20体積%、反応温度20〜50℃、反応時間1分〜1時間、pH6〜9の範囲である。この処理は、通常、緩衝液中で行われ、前記プロテアーゼ処理と同様の緩衝液が使用できる。
【0044】
つぎに、前記FAOD−α処理した前記溶血試料を、さらにFAOD−αSで処理する。このFAOD−αSは、前述のように、糖化されたα−アミノ基および糖化された側鎖アミノ基の両方に作用する。しかし、糖化タンパク質分解物は、予め、分解用FAOD−αによって処理されているため、糖化された側鎖アミノ基のみに測定用FAOD−αSを作用させることができる。
【0045】
このFAOD−αS処理は、前記プロテアーゼ処理と同様に緩衝液中で行うことが好ましく、前記緩衝液としては、特に制限されず、前記プロテアーゼ処理と同様の緩衝液が使用できる。
【0046】
処理条件としては、例えば、反応液中のFAOD−αS濃度10〜30,000U/L、反応液中の血球濃度0.1〜5体積%、反応温度20〜50℃、反応時間1分〜1時間、pH6〜9の範囲である。
【0047】
つぎに、前記FAOD−αS処理で生成した過酸化水素を、PODおよび前記発色性基質を用いてさらに酸化還元反応によって測定する。
【0048】
前記発色性基質としては、例えば、N−(カルボキシメチルアミノカルボニル)−4,4’−ビス(ジメチルアミノ)ジフェニルアミンナトリウム、オルトフェニレンジアミン(OPD)、トリンダー試薬と4−アミノアンチピリンとを組み合せた基質等があげられる。前記トリンダー試薬としては、例えば、フェノール、フェノール誘導体、アニリン誘導体、ナフトール、ナフトール誘導体、ナフチルアミン、ナフチルアミン誘導体等があげられる。また、前記アミノアンチピリンの他に、アミノアンチピリン誘導体、バニリンジアミンスルホン酸、メチルベンズチアゾリノンヒドラゾン(MBTH)、スルホン化メチルベンズチアゾリノンヒドラゾン(SMBTH)等も使用できる。このような発色性基質の中でも、特に好ましくは、前述のように、N−(カルボキシメチルアミノカルボニル)−4,4’−ビス(ジメチルアミノ)ジフェニルアミンナトリウムである。
【0049】
前記酸化還元反応は、通常、緩衝液中で行われ、その条件は、前記生成した過酸化水素の濃度等により適宜決定される。通常、反応液中のPOD濃度10〜100,000 IU/L、発色性基質濃度0.005〜30mmol/L、反応温度15〜37℃、反応時間0.1〜30分、pH5〜9である。また、前記緩衝液は、特に制限されず、例えば、前記プロテアーゼ処理およびFAOD処理等と同様の緩衝液等が使用できる。
【0050】
前記酸化還元反応において、例えば、前記発色性基質を用いた場合、前記反応液の発色程度(吸光度)を分光光度計で測定することにより、過酸化水素の量を測定できる。そして、例えば、この過酸化水素濃度と検量線等とを用いて、試料中の糖化タンパク質の量を求めることができる。本実施形態においては、アミノ酸残基の側鎖アミノ基の糖化量によって、糖化タンパク質の量や糖化量を測定することとなる。
【0051】
なお、はじめに添加した分解用FAOD−αによって生成した過酸化水素は、血液試料(溶血試料)に存在するカタラーゼによって消失するため、FAOD−αSにより生成した測定対象物由来の過酸化水素の測定には影響を及ぼすことはない。また、別途カタラーゼを添加して消去させてもよい。このように前記カタラーゼにより過酸化水素を消去した場合、後に行うFAOD−αS処理で生成する過酸化水素までもが消去されることを防ぐために、FAOD−αSの添加と共に、過剰量のPODおよび発色性基質を添加することが好ましい。この場合、PODは、前記カタラーゼの添加量(U)に対し、例えば、5〜100倍の活性(U)量を添加することが好ましい。
【0052】
前記過酸化水素量は、前記POD等を用いた酵素的手法の他に、例えば、電気的手法により測定することもできる。
【0053】
この測定において、前記プロテアーゼ処理は、前述のように前記分解用FAOD−α処理の前には限られず、例えば、前記FAOD−α処理の後に行ってもよい。前記プロテアーゼ処理は、前述のように、FAODを作用し易くするために行うが、前記FAOD−αは糖化アミノ酸の分解を目的として行うため、FAOD−α処理前にプロテアーゼによって糖化タンパク質が分解されていなくても、本発明の効果は十分に得ることができるからである。
【0054】
また、例えば、非測定対象糖化物が、α−アミノ基が糖化された糖化アミノ酸であって、測定対象糖化アミンが、α−アミノ基が糖化された糖化タンパク質である場合等にも本実施形態の測定方法が適用できる。この場合は、分解用FAODが糖化タンパク質に作用し難くても、例えば、残存した分解用FAODがプロテアーゼ処理によるプロテアーゼ分解物に作用してしまうことが考えられるため、例えば、後述する第2の実施形態のように残存するFAODをプロテアーゼ分解により失活させたり、第3の実施形態のように分解用FAODと測定用FAODの添加割合を調整することが好ましい。
【0055】
(第2の実施形態)
この実施形態は、非測定対象糖化物である糖化アミノ酸の分解と測定対象である糖化タンパク質の測定に、同じFAODを用いた前記第2の測定方法の一例である。FAODとしては、特に制限されず、例えば、FAOD−α、FAOD−S、FAOD−αSのいずれを用いてもよい。
【0056】
前記第1の実施形態と同様にして溶血試料を調製し、この溶血試料に分解用FAODを添加する。
【0057】
処理条件としては、例えば、反応液中のFAOD濃度10〜5000U/L、反応液中の血球濃度0.5〜20体積%、反応温度20〜50℃、反応時間1分〜1時間、pH6〜9の範囲である。この処理は、通常、緩衝液中で行われ、前述と同様の緩衝液が使用できる。
【0058】
つぎに、FAOD処理した試料に対しプロテアーゼ処理を行う。このプロテアーゼ処理の第1の目的は、前述と同様に、血球由来の糖化タンパク質を分解し、後の工程でさらに添加する測定用FAODを作用し易くするためである。そして、第2の目的は、前記分解用FAODを消化して失活させるためである。
【0059】
FAODは、糖化タンパク質に作用し難く、糖化アミノ酸に作用し易いため、前記分解用FAOD処理では、試料中の糖化アミノ酸がまず分解される。しかし、この分解用FAODが残っている状態で、前記糖化タンパク質をプロテアーゼ処理すると、残存するFAODと糖化タンパク質分解物の糖化部分とが反応してしまい、正確な測定ができないという問題がある。したがって、この残存するFAODをプロテアーゼで失活させ、前記糖化タンパク質分解物との反応を防止ればよい。このためには、はじめに添加した分解用FAODを速やかに失活させ、かつ、糖化タンパク質を分解できるだけのプロテアーゼを添加する必要がある。
【0060】
前記プロテアーゼとしては、特に制限されず、前述と同様のものが使用できる。また、その処理条件は、例えば、使用するプロテアーゼの種類、糖化タンパク質の種類やその濃度、分解用FAODの種類やその量等に応じて適宜決定される。
【0061】
プロテアーゼ処理の反応溶液におけるプロテアーゼの添加量は、分解用FAOD 100U/Lに対して、例えば、1〜1000,000KU/Lの範囲であり、好ましくは10〜300,000KU/Lの範囲であり、より好ましくは100〜100,000KU/Lの範囲である。
【0062】
具体的に、プロテアーゼとしてトリプシンを用いて、前記試料を処理する場合、例えば、反応液中のプロテアーゼ濃度1000〜30,000KU/L、反応液中の血球濃度0.2〜5体積%、反応液中のFAOD濃度10〜1000U/L、反応温度20〜50℃、反応時間10分〜20時間、pH6〜9の範囲である。
【0063】
つぎに、前記プロテアーゼ処理により得られた糖化タンパク質分解物に、分解用FAODと同じFAODを、再度測定用FAODとして添加して処理する。この測定用FAODは、前記プロテアーゼによって失活するおそれがあるため、十分量添加する必要がある。
【0064】
この測定用FAOD処理も、前述と同様に緩衝液中で行うことが好ましく、前記緩衝液としては、特に制限されず、前記プロテアーゼ処理と同様の緩衝液が使用できる。
【0065】
測定用FAOD処理の反応溶液における測定用FAODの添加量は、プロテアーゼ10,000KU/Lに対して、例えば、10〜1000,000U/Lの範囲であり、好ましくは100〜200,000U/Lの範囲であり、より好ましくは500〜50,000U/Lの範囲である。
【0066】
具体的な処理条件としては、例えば、反応液中のFAOD濃度500〜20,000U/L、反応液中のプロテアーゼ濃度100〜30,000KU/L、反応液中の血球濃度0.01〜1体積%、反応温度15〜40℃、反応時間1分〜1時間、pH6〜9の範囲である。
【0067】
このような実施形態によれば、糖化アミノ酸の分解と糖化タンパク質の測定に使用するFAODが同じであっても、前記糖化アミノ酸の影響を受けることなく、高い精度で測定が可能である。
【0068】
(第3の実施形態)
この実施形態は、非測定対象糖化物である糖化アミノ酸の分解と測定対象である糖化タンパク質の測定に、同じFAODを用いた例である。但し、この実施形態は、前記第2の実施形態とは異なり、分解用FAODを、プロテアーゼによって必ずしも失活させる必要がない。酵素には基質特異性があるため、プロテアーゼとFAODとの組み合わせによっては、FAODをプロテアーゼで失活させ難い場合がある。このような場合に本実施形態の方法が有効になる。なお、はじめに添加した分解用FAODが、プロテアーゼにより生成した糖化タンパク質分解物と反応すると、測定精度を向上できないため、以下に示すように、FAODの添加割合を調整することが重要となる。
【0069】
まず、前記第1の実施形態と同様にして溶血試料を調製し、この溶血試料に分解用FAODを添加する。
【0070】
分解用FAODは、プロテアーゼで失活させ難い場合、活性が残存しても、プロテアーゼ処理の間に、生成した糖化タンパク質分解物に作用しない範囲で添加する必要がある。なお、FAODは、糖化タンパク質に作用し難く、糖化ペプチドよりも糖化アミノ酸により一層作用し易いという性質を有するため、例えば、糖化アミノ酸のみに作用する程度の添加量であり、かつ反応時間とすることが好ましい。
【0071】
FAOD処理の条件としては、例えば、反応液中のFAOD濃度10〜5000U/L、反応液中の血球濃度0.2〜20体積%、反応温度20〜50℃、反応時間1分〜1時間、pH6〜9の範囲である。この処理は、通常、緩衝液中で行われ、前述と同様の緩衝液が使用できる。
【0072】
つぎに、前記FAOD処理した試料に対しプロテアーゼ処理を行う。この実施形態は、前述のように、プロテアーゼが前記FAODに作用し難い場合の例であるため、プロテアーゼの添加量は特に制限されない。
【0073】
前記プロテアーゼとしては、特に制限されず、前述と同様のものが使用できる。その処理条件は、前述と同様に、使用するプロテアーゼの種類、測定対象の糖化タンパク質の種類およびその濃度、はじめに添加したFAODの種類およびその濃度、使用するプロテアーゼのFAODに対する基質特異性等により適宜決定される。
【0074】
このような実施形態に該当するFAODとプロテアーゼの組み合わせとしては、例えば、商品名FOD(旭化成社製)と商品名トヨチーム(東洋紡社製)、前記ギベレラ属由来FAODと商品名プロテナーゼK(ロッシュ社製)の組み合わせ等があげられる。
【0075】
プロテアーゼとしてトリプシンを用いて、前記試料を処理する場合、例えば、反応液中のプロテアーゼ濃度100〜6000U/L、反応液中の血球濃度0.2〜5体積%、反応液中のFAOD濃度0.1〜100U/L、反応温度20〜50℃、反応時間10分〜20時間、pH6〜9の範囲である。
【0076】
続いて、前記プロテアーゼ処理により得られた分解物に、再度同じFAODを測定用FAODとして添加する。
【0077】
この測定用FAOD処理も、前述と同様に緩衝液中で行うことが好ましく、前記緩衝液としては、特に制限されず、前記プロテアーゼ処理と同様の緩衝液が使用できる。
【0078】
このように、本実施形態においては、分解用FAOD(A)と測定用FAOD(B)の添加割合(活性比A:B)を、例えば、前述のように1:50,000〜1:10の範囲、好ましくは1:5000〜1:25の範囲、より好ましくは1:500〜1:50の範囲にする。このように設定すれば、前記第2の実施形態と異なり前記分解用FAODは反応液中に残存するが、この残存したFAODの反応速度は非常に遅いため、プロテアーゼ処理工程において、測定に影響を与える程度に、生成した糖化タンパク質分解物に残存FAODが作用することはない。
【0079】
処理条件としては、例えば、反応液中のFAOD濃度500〜20,000U/L、反応液中のプロテアーゼ濃度100〜30,000KU/L、反応液中の血球濃度0.01〜1体積%、反応温度15〜40℃、反応時間1分〜1時間、pH6〜9の範囲である。
【実施例】
【0080】
(実施例1および比較例1)
患者に、アミノ酸およびブドウ糖を含む点滴を行い、1時間後、血液を採取した。その血液を遠心分離(1000g、10分間)して血球と血漿とに分離し、前記血球画分0.006mL、前記血漿画分0.006mLおよび下記溶血試薬A 0.45mLとを混合して、前記血球を溶血させて溶血試料を調製した。
【0081】
(溶血試薬A:pH8.5)
商品名TAPS(同仁化学社製) 140mmol/L
グリシンアミド(ナカライテスク社製) 60mmol/L
ポリオキシエチレンラウリルエーテル(ナカライテスク社製) 24g/L
【0082】
前記溶血試料に下記各種FAOD溶液(濃度200KU/L)0.0023mLを25℃で添加し、37℃で40分間インキュベートを行った。なお、下記(1)ペニシリウム属由来FAODは、糖化されたα−アミノ基に特異的に作用し、(2)アスペルギルス属由来FAODは、糖化されたα−アミノ基および糖化されたε−アミノ基に特異的に作用し、(3)FAOX−Eは、糖化されたα−アミノ基に特異的に作用するFAODである。
【0083】
(使用したFAOD)
(1)前記ペニシリウム属由来FAOD(特開平8−336386公報)
(2)前記アスペルギルス属由来FAOD(WO99/20039号)
(3)商品名FAOX−E(キッコーマン社製、以下同じ)
【0084】
つぎに、前記FAODを添加した溶血試料0.01mLに精製水0.01mLを添加し、さらに下記プロテアーゼ試薬0.065mLを添加して37℃で5分間インキュベートした。続いて、下記発色試薬0.045mLを添加して37℃で3分間インキュベートし、反応液の吸光度(波長751nm)を測定装置(商品名JCA BM−8、日本電子社製)によって測定した。なお、比較例としては、前記溶血試料に、前記各種FAODに代えて精製水を添加した以外は、前記実施例と同様にして測定を行った。また、コントロールとしては、前記血球に、前記血漿に代えて精製水を添加した以外は、前記実施例と同様にして測定を行った。これらの結果を下記表1に示す。
【0085】
(プロテアーゼ試薬:pH6.5)
MOPS(同仁化学社製) 5mmol/L
テトラゾリウム化合物(商品名WST−3、同仁化学社製) 2mmol/L
NaN3(ナカライテスク社製) 0.05g/L
CaCl2(ナカライテスク社製) 5mmol/L
NaCl(ナカライテスク社製) 300mmol/L
メタロプロテアーゼ 3g/L
【0086】
(発色試薬)
ギベレラ属由来FAOD(特開平8−154672号公報) 26KU/L
POD(東洋紡社製) 77.6KU/L
発色基質(商品名DA−64、和光純薬工業社製) 0.052mmol/L
Tris−HCl緩衝液(pH6.9) 200mmol/L
【0087】
【表1】

【0088】
前記表1に示すように、比較例1では、血漿中に含まれる糖化アミノ酸も発色試薬に含まれるFAODと反応してしまうため、血球中の糖化タンパクのみを測定したコントロールよりも高い吸光度となった。これに対して、実施例1は、血漿中の糖化アミノ酸を予めFAODで処理しているため、前記糖化タンパク質を正確に測定することができ、コントロールとの相関も高かった。これは、発色試薬に含有されたFAODを、血球由来の糖化タンパク質分解物のみに作用させることができたからである。
【0089】
(実施例2および比較例2)
前記実施例1と同様に点滴後の血液を採血し、これを静置した。そして、自然沈降した血球を回収し、この血球画分0.01mLに下記溶血試薬B 0.3mLを添加して溶血試料を調製した。この溶血試料のHb濃度およびHbA1c濃度を、前記自動分析装置により分析した。なお、前記血球は自然沈降により回収しているため、前記血球画分は血漿成分を含んでいる。
【0090】
(溶血試薬B:pH8.5)
商品名TAPS(同仁化学社製) 140mmol/L
グリシンアミド(ナカライテスク社製) 60mmol/L
ポリオキシエチレンラウリルエーテル(ナカライテスク社製) 24g/L
商品名FAOX−E(キッコーマン社製、以下同じ) 1KU/L
【0091】
前記溶血試料0.01mLに精製水0.01mLおよび前記プロテアーゼ試薬0.065mLを添加して37℃でインキュベートした。そして、インキュベート開始から4.5分後における571nmの吸光度を測定し、これをHb濃度を示す吸光度とした。続いて、インキュベート開始から5分後に、実施例1と同じ発色試薬0.045mLを添加して37℃で3分間インキュベートし、さらに3分間反応させた後の751nmにおける吸光度を前記自動分析装置により測定し、HbA1c濃度を示す吸光度とした。
【0092】
そして、予め作成したHb濃度(g/L)またはHbA1c濃度(g/L)と、吸光度との関係を示す検量線に、測定したそれぞれの吸光度を代入してHbA1c濃度およびHb濃度を求め、下記式からHbA1c%を算出した。
HbA1c(%)=(HbA1c濃度/Hb濃度)×100
【0093】
なお、前記検量線は、以下に示す方法で作成した。まず、HbA1c濃度およびHb濃度が既知である種々濃度の標準液について、自動測定器(商品名HA−8150:アークレイ株式会社)を用いてHbA1c濃度とHb濃度とを測定した。一方、前記各標準液について、前記実施例と同様の測定方法により、Hb濃度およびHbA1c濃度に相当する吸光度の測定を行った。そして、前記自動測定器による測定値と前記吸光度から一次回帰式を作成し、これを検量線とした。
【0094】
比較例2としては、前記血球に、前記溶血試薬Bの代わりに、商品名FAOX−Eを含有しない前記溶血試薬Aを添加した以外は、前記実施例2と同様にして測定を行った。
【0095】
また、コントロールとしては、自然沈降により回収した前記血球画分0.05mLに、下記自動測定器HA−8150専用希釈液2.5mLを添加して溶血させたものを、溶血試料とした。そして、この溶血試料におけるHbA1c濃度(%)を、前記自動測定器(商品名HA−8150:アークレイ株式会社)により測定した値を使用した。
【0096】
以上の結果を図1に示す。同図は、酵素法により測定した実施例2および比較例2のHbA1c(%)と、コントロールの自動分析によるHbA1c(%)との関係を示すグラフである。同図において、実施例は、相関式、「y=1.079x−0.409」、相関係数「0.967」であり、比較例は、相関式、「y=1.124x−0.559」、相関係数「0.931」であった。
【0097】
図1に示すように、実施例2によれば、血漿中に含まれる外来の糖化アミノ酸は、はじめのFAOD処理(溶血試薬B中のFAOD)によって分解されており、この処理によって発生する過酸化水素も試料中のカタラーゼによって消失している。このため、後で添加するFAODによる酸化還元反応においては、血球の糖化タンパク質由来の過酸化水素のみが発生し、血漿を添加せずに自動分析により測定したコントロールの値と非常に近い値が得られ、その相関係数(0.967)も非常に高かった。一方、比較例2においては、血漿中に含まれる糖化アミノ酸についても、糖化タンパク質に作用させるためのFAODが反応するため、発生する過酸化水素の量も、糖化タンパク質により生じる過酸化水素の量よりも多くなる。このため、比較例のHbA1c(%)は、コントロールのHbA1c(%)よりも高い値となり、コントロールとの相関関係も実施例2に比べて低い結果となった(相関係数0.931)。
【産業上の利用可能性】
【0098】
以上のように、本発明の試料の前処理方法によれば、試料中に含まれる非測定対象糖化物である糖化ペプチドや糖化アミノ酸を分解除去できるため、このような前処理済み試料について糖化アミンの測定を行えば、前記非測定対象糖化物による影響を回避できるため、優れた測定精度となる。このため、例えば、採血前に点滴を受けた患者の血液であって、一過性の外来糖化アミノ酸等を含む場合であっても、その影響を回避できる。このような方法を、例えば、赤血球中の糖化ヘモグロビンの測定の際に適用すれば、従来よりも測定精度が向上し、糖尿病診断等の指標物質としての重要性がさらに向上する。
【技術分野】
【0001】
本発明は、糖化アミンを測定するための試料の前処理方法および糖化アミンの測定方法に関する。
【背景技術】
【0002】
従来から、酸化還元反応を利用して、試料中の測定対象物の量を測定することが広く実施されており、生化学分析や臨床検査等における糖化アミン(糖化タンパク質、糖化ペプチド、糖化アミノ酸等)の測定にも適用されている。
【0003】
特に、血液中の糖化タンパク質、その中でも赤血球中の糖化ヘモグロビンは、生体血糖値の過去の履歴を反映しているため、糖尿病診断や治療等における重要な指標とされている。このような赤血球中の糖化タンパク質は、前記酸化還元反応を用いて、例えば、以下に示すようにして測定されている。
【0004】
まず、赤血球を溶血させた試料を調製し、この溶血試料にフルクトシルアミノ酸オキシダーゼ(以下、「FAOD」という)を添加し、糖化タンパク質の糖化部分に作用させて酸化還元反応により過酸化水素を発生させる。この過酸化水素量は、前記糖化タンパク質量に対応する。そして、この試料に、ペルオキシダーゼ(以下、「POD」という)および酸化により発色する還元剤を添加し、前記PODを触媒として前記過酸化水素と前記還元剤との間で酸化還元反応させる。前記反応により前記還元剤を発色させ、この発色を測定することにより前記過酸化水素量が測定でき、この結果、赤血球中の糖化タンパク質量を知ることができる。
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、このような酸化還元反応を用いた糖化タンパク質の測定方法において、例えば、実際に試料中に含まれる糖化タンパク質に対応する以上の過酸化水素が発生するという問題があった。また、患者によっては、一時的に糖化タンパク質の測定値が急激に増加し、信頼性ある測定が行えないという問題もあった。このため、前記測定方法において、さらなる測定精度の向上が求められている。また、前記酸化還元反応を用いた測定方法には限られず、例えば、抗原抗体反応を用いた糖化アミン測定方法においても、同様に測定精度の向上が求められている。
【0006】
そこで、本発明は、糖化アミンを測定するための試料の前処理方法の提供であって、これにより、信頼性に優れた糖化アミンの測定を可能にすることを目的とする。
【課題を解決するための手段】
【0007】
前記目的を達成するために、本発明の前処理方法は、糖化アミンを測定対象とする試料の前処理方法であって、前記試料中に測定対象の糖化アミンとは別に存在する糖化アミノ酸または糖化ペプチドを除去することを目的として、前記別に存在する糖化アミノ酸または糖化ペプチドにFAODを作用させて分解する方法である。
【0008】
なお、前記FAODは、一般名称であり、その基質としては糖化アミノ酸には限られず、例えば、糖化ペプチドにも作用する。また、本発明において「糖化ペプチド」とは、FAODが作用する長さのペプチドをいい、アミノ酸残基数が、例えば、2〜6の範囲のものをいう。これに伴い、本発明においては、FAODが作用しない長さの糖化ペプチドおよび糖化タンパク質を併せて「糖化タンパク質」という。そして、測定対象の前記糖化アミンとしては、例えば、糖化タンパク質、糖化ペプチド、糖化アミノ酸が含まれる。
【発明の効果】
【0009】
本発明者らは、測定精度の向上を図るべく鋭意研究を行った結果、以下の事を突き止めた。つまり、全血中には、本来、測定対象物である糖化アミンの他に、測定対象物以外の遊離の糖化アミノ酸や糖化ペプチドが存在しており、前記FAODは、このような糖化アミノ酸や糖化ペプチドに対しても作用する。このため、前述のようなFAODを用いた糖化アミンの測定を行った場合、測定対象の糖化アミンとFAODとの酸化還元反応だけでなく、測定対象以外の糖化アミノ酸や糖化ペプチドとFAODとの酸化還元反応も生じてしまい、見かけ上、測定対象物の測定値が増加してしまうのである。さらに、同じ患者の全血試料について、全く同じ条件で前記測定方法により測定を行った場合でも、患者によっては採血時が異なると測定値が著しく変動するという前述の問題に関しても、以下の事を突き止めた。すなわち、この問題は、主に点滴等を受けた患者に見られる現象であり、このように測定値が変動するのは、点滴等の成分として、例えば、グルコース等の糖類や各種アミノ酸が含まれると、これらの外来成分から糖化アミノ酸が生成され、一過的に糖化アミノ酸が増加するためであることを突き止めたのである。このような現象は、前記酸化還元反応による測定においてだけでなく、例えば、前記抗原抗体反応を用いた測定方法においても、同様に生じていた。そこで、全血試料中に、恒常的な糖化アミノ酸や糖化ペプチド、一過性の外来糖化アミノ酸等といった測定対象物以外の糖化物が存在しても、本発明のように、試料に対して、予め、測定対象物以外の糖化アミノ酸や糖化ペプチドに分解用FAODを作用させて分解する前処理を行えば、前述のような見かけ上の測定値の向上が抑制されることを、本発明者らが初めて見出したのである。これによって、測定精度が向上でき、さらに、例えば、点滴を受けたか否かに関わらず、いつでも採血を行うことができるため、患者の負担も低減できる。このような試料の前処理方法を、例えば、前述のような糖化ヘモグロビンの測定において適用すれば、糖化ヘモグロビンの糖尿病診断の指標としての信頼性も増し、臨床医療等の分野において有用な方法となる。
【図面の簡単な説明】
【0010】
【図1】図1は、本発明の測定方法の一実施例において、FAODを用いた測定方法によるHbA1c量と、自動分析装置によるHbA1c量との相関関係を示すグラフである。
【発明を実施するための形態】
【0011】
つぎに、本発明の測定方法は、試料中の糖化アミンにFAODを作用させて、その酸化還元反応を測定することにより糖化アミンの量を測定する方法であって、前記試料中の糖化アミンとは別に存在する糖化アミノ酸または糖化ペプチドを除去することを目的として、前記酸化還元反応に先立ち、予め、前記試料を前記本発明の前処理方法によって処理して、前記糖化アミノ酸または糖化ペプチドを分解する方法である。
【0012】
前述のような理由から、このような測定方法によれば、測定精度を向上できる。以下、本発明において、前記糖化アミノ酸や糖化ペプチドを分解するためのFAODを「分解用FAOD」といい、前記糖化アミンに作用させる測定のためのFAODを「測定用FAOD」という。また、測定対象の糖化アミンとは別に存在する糖化アミノ酸および糖化ペプチドを、以下、「非測定対象糖化物」ともいう。
【0013】
本発明の測定方法としては、例えば、前記非測定対象糖化物と前記測定対象糖化アミンとに、異なる基質特異性のFAODを使用する第1の測定方法と、同じFAODを使用する第2の測定方法とがあげられる。
【0014】
なお、FAODには、後述するように、例えば、α−アミノ基の糖化部分に作用するもの、リジンやアルギニン等のアミノ酸残基の側鎖アミノ基の糖化部分に作用するもの、および前記両方の糖化部分に作用するもの等があり、その基質特異性はFAODの種類により様々である。そして、糖化アミンの測定において、前記α−アミノ基の糖化部分、前記側鎖アミノ基の糖化部分または両方の糖化部分のいずれにFAODを作用させても、その量を測定することが可能である。
【0015】
本発明の第1の測定方法としては、前記非測定対象糖化物に作用させる分解用FAODと、測定対象糖化アミンに作用させる測定用FAODとが、異なる基質特異性を有することが好ましい。これによれば、分解用FAODによって前記非測定対象糖化物の糖化部分を分解し、糖化アミンについては、前記分解用FAODが作用していない糖化部分に、さらに異なる基質特異性の測定用FAODを作用させることができるため、前記非測定対象糖化物の影響を受けず、測定精度を向上できるからである。
【0016】
具体的には、例えば、非測定対象物は、α−アミノ基が糖化されており、測定対象糖化アミンは、α−アミノ基糖化部分および側鎖アミノ基が糖化されている場合、前記分解用FAODは、糖化されたα−アミノ基に特異的に作用し、前記測定用FAODは、糖化されたα−アミノ基および糖化されたアミノ酸残基側鎖に特異的に作用する酵素であることが好ましい。前記測定用FAODは、α−アミノ基糖化部分および側鎖アミノ基糖化部分の両方に作用するため、従来の方法であれば、前述のようにα−アミノ基が糖化された非測定対象糖化物にも作用していた。しかし、本発明においては、前記非測定対象糖化物の糖化部分は、予め、前記糖化α−アミノ基に特異的に作用する分解用FAODによって分解されているため、これに測定用FAODが作用することはなく、見かけ上の測定値の増加が抑制されて精度が向上する。また、測定用FAODは、前述のようにα−アミノ基糖化部分および側鎖アミノ基糖化部分の両方に作用するため、糖化アミンのα−アミノ基糖化部分も分解用FAODにより分解されており、糖化アミンの側鎖アミノ基糖化部分のみに測定用FAODを作用させることができる。このため、特に側鎖アミノ基の糖化量に特徴がある糖化アミンの測定に、有用な方法といえる。このような糖化アミンとしては、例えば、ε−糖化リジン、糖化アルブミン等があげられる。
【0017】
このように異なるFAODを用いる場合、前記非測定対象糖化物にFAODを作用させる前または作用させた後に、糖化アミンをプロテアーゼで分解し、この糖化アミン分解物に、前記測定用FAODを作用させて前記酸化還元反応を行うことが好ましい。糖化アミンを分解するのは、測定対象物が糖化タンパク質の場合、FAODは前記糖化タンパク質には作用し難く、前述のような糖化ペプチドや糖化アミノ酸に作用するからであり、また、前記糖化ペプチドよりも糖化アミノ酸により一層作用し易いからである。また、プロテアーゼ処理の順序が、非測定対象糖化物の分解処理の前後で制限されないのは、測定用FAODは、前述のように分解用FAODとは異なる糖化部分に作用できるため、糖化アミンの測定自体には影響を受けないからである。また、測定対象が糖化ペプチドの場合も、さらに短い糖化ペプチドや糖化アミノ酸に分解すれば、より一層FAODが作用し易いため、プロテアーゼ処理を施すことが好ましい。
【0018】
なお、本発明において「非測定対象糖化物である糖化アミノ酸および糖化ペプチド」とは、特に示さない限り、分解処理前から試料中に含まれるものをいい、例えば、測定対象物である糖化タンパク質や糖化ペプチドのプロテアーゼ分解物は含まない。
【0019】
つぎに、本発明の第2の測定方法としては、非測定対象糖化物に分解用FAODを作用させた後、測定対象の糖化アミンをプロテアーゼで分解し、さらに前記分解用FAODと同じFAODを添加して、前記プロテアーゼ分解物に作用させて前記酸化還元反応を行うことが好ましい。このような方法は、例えば、被測定対象糖化物が糖化アミノ酸であって、測定糖化アミンが糖化タンパク質や糖化ペプチドの場合に有用である。
【0020】
具体的には、前記プロテアーゼにより、前記分解用FAODを失活させることが好ましい。前述のように、FAODは、糖化タンパク質には作用し難く、また、糖化ペプチドよりも糖化アミノ酸により一層作用し易いという性質を有している。このため、非測定対象糖化物が糖化アミノ酸である場合、例えば、分解用FAODを添加しても、酵素の反応速度論から、糖化アミノ酸を分解する処理時間においては、糖化タンパク質には作用せず、糖化ペプチドにもあまり作用し難いといえる。しかし、続くプロテアーゼ処理の間も前記分解用FAODの活性が残存していると、プロテアーゼ処理と併行して、プロテアーゼによる糖化タンパク質分解物(糖化ペプチドや糖化アミノ酸)や糖化ペプチド分解物(より短い糖化ペプチドや糖化アミノ酸)に前記分解用FAODが作用してしまう。このため、後に測定用FAODを添加しても、すでに前記糖化タンパク質分解物等の一部には分解用FAODが作用した状態となり、反対に測定精度が低下するおそれがある。したがって、前述のように糖化タンパク質等を分解するためのプロテアーゼ処理によって、同時に残存する前記分解用FAODを失活させれば、プロテアーゼ処理による糖化タンパク質分解物等は、前記分解用FAODとは未反応のままで維持され、続いて添加する測定用FAODと反応することができる。このため測定精度も向上するのである。
【0021】
なお、この他に、例えば、測定対象物が糖化タンパク質であり、非測定対象糖化物が糖化ペプチドであってもよい。分解用FAODを糖化ペプチドに作用させでも、その際に、糖化タンパク質には作用しないからである。
【0022】
一方、前述のようにプロテアーゼ処理で分解用FAODを失活させなくとも、例えば、前記分解用FAODの添加量と、測定用FAODの添加量とを調整することによっても、高精度な測定を実現することもできる。この場合、例えば、前記分解用FAOD(A)と測定用FAOD(B)の添加割合(活性比A:B)を、A:B=1:10〜1:50,000の範囲に設定することが好ましい。このような添加割合であれば、プロテアーゼ処理を行う際に、前記分解用FAODが残存しても、酵素の反応速度論の点から、糖化タンパク質はもちろんのこと、非測定対象糖化物である糖化アミノ酸に比べて測定糖化アミンである糖化ペプチドには作用し難いからである。また、非測定対象糖化物が糖化ペプチドであり、測定糖化アミンが糖化タンパク質の場合も同様である。
【0023】
本発明の測定方法において、前記プロテアーゼとしては、例えば、メタロプロテアーゼ、ブロメライン、パパイン、トリプシン、プロテアーゼK、ズブチリシンおよびアミノペプチダーゼからなる群から選択された少なくとも一つのプロテアーゼが使用できるが、特に制限されない。
【0024】
また、測定対象物が、後述のような糖化ヘモグロビンである場合は、前記プロテアーゼは、糖化ヘモグロビンを選択的に分解するプロテアーゼであって、メタロプロテアーゼ、ブロメライン、パパイン、ブタ膵臓由来トリプシンおよびBacillus subtillis由来のプロテアーゼからなる群から選択された少なくとも一つのプロテアーゼであることが好ましく、より好ましくはメタロプロテアーゼ、Bacillus subtillis由来のプロテアーゼであり、特に好ましくはメタロプロテアーゼである。このようなプロテアーゼを作用させれば、糖化ヘモグロビン以外の糖化タンパク質は分解され難いため、前記他の糖化タンパク質にはFAODも作用し難く、糖化ヘモグロビンのみの測定が可能になる。
【0025】
本発明において、測定試料は特に制限されず、例えば、全血、血漿、血清、血球、尿、髄液等の生体試料や、ジュース等の飲料水、醤油、ソース等の食品類等の試料に対しても、本発明の測定方法を適用できる。この中でも、例えば、前記全血、血漿、血清、血球などの血液試料やその他の生体試料に有用である。
【0026】
また、例えば、前記全血試料が外来の糖化アミノ酸等を含んでいても、高精度な測定が可能である。例えば、前述のように外来の糖化アミノ酸は一過性のものであるが、全血中に含まれる間は著しく糖化タンパク質等の測定値に影響を与える。しかし、本発明によればそのような影響も回避できるからである。
【0027】
前記全血試料は、特に制限されないが、本発明の測定方法は、例えば、点滴後の患者から採取した全血試料に対して有用である。前述のように、特に点滴後の試料に、生成された外来アミノ酸による測定値の変動がみられるからである。
【0028】
本発明の測定方法において、測定対象物としては、酸化還元反応を利用するものであれば特に制限されない。例えば、全血中成分、赤血球内成分、血漿中成分、血清中成分、尿成分、髄液成分等があげられるが、好ましくは赤血球内成分である。例えば、前記赤血球成分を測定する場合、全血をそのまま溶血させたものを試料としてもよいし、全血から赤血球を分離して、前記赤血球を溶血させたものを試料として用いてもよい。
【0029】
本発明の測定方法において、前記測定対象物の糖化アミンとしては、前述のように糖化タンパク質、糖化ペプチド、糖化アミノ酸等が含まれる。具体的には、例えば、糖化ヘモグロビン、糖化アルブミン等の糖化タンパク質等があげられる。なお、赤血球成分である糖化ヘモグロビンを測定する場合は、例えば、全血をそのまま溶血させたものを試料としてもよいし、全血から赤血球を分離して、前記赤血球を溶血させたものを試料として用いてもよい。
【0030】
本発明の測定方法において使用するFAODは、下記式(1)に示す反応を触媒するFAODであることが好ましく、例えば、α−アミノ基が糖化された糖化アミンに特異的に作用するFAOD(以下、「FAOD−α」という)、アミノ酸側鎖のアミノ基が糖化された糖化アミンに特異的に作用するFAOD(以下、「FAOD−S」という)、α−アミノ基が糖化された糖化アミンおよびアミノ酸側鎖のアミノ基が糖化された糖化アミンのいずれにも特異的に作用するFAOD(以下、「FAOD−αS」という)等があげられる。
【0031】
R1−CO−CH2−NH−R2 + H2O + O2
→ R1−CO−CHO + NH2−R2 + H2O2 …(1)
前記式(1)において、R1は、水酸基もしくは糖化反応前の糖に由来する残基(糖残基)を意味する。前記糖残基(R1)は、反応前の糖がアルドースの場合はアルドース残基であり、反応前の糖がケトースの場合、ケトース残基である。例えば、反応前の糖がグルコースの場合は、アマドリ転位により、反応後の構造はフルクトース構造をとるが、この場合、糖残基(R1)は、グルコース残基(アルドース残基)となる。この糖残基(R1)は、例えば、
−[CH(OH)]n−CH2OH
で示すことができ、nは、0〜6の整数である。
前記式(1)において、R2は、特に制限されないが、糖化アミンが糖化アミノ酸または糖化ペプチドの場合、α−アミノ基が糖化されている場合と、それ以外のアミノ基(アミノ酸側鎖のアミノ基)が糖化されている場合とで異なる。
前記式(1)において、α−アミノ基が糖化されている場合、R2は、下記式(2)で示すアミノ酸残基またはペプチド残基である。この場合に前記式(1)の反応を特異的に触媒するのが前記FAOD−αおよびFAOD−αSである。
−CHR3−CO−R4 …(2)
前記式(2)において、R3はアミノ酸側鎖基を示し、R4は水酸基、アミノ酸残基またはペプチド残基を示し、例えば、下記式(3)で示すことができる。下記式(3)において、nは、0以上の整数であり、R3は、前述と同様に、アミノ酸側鎖基を示し、アミノ酸側鎖基は全て同一でも、異なっていても良い。
−(NH−CR3H−CO)n−OH …(3)
また、前記式(1)において、α−アミノ基以外のアミノ基が糖化されている(アミノ酸側鎖基が糖化されている)場合、R2は下記式(4)で示すことができる。この場合に前記式(1)の反応を特異的に触媒するのが前記FAOD−SおよびFAOD−αSである。
−R5−CH(NH−R6)−CO−R7 …(4)
前記式(4)において、R5は、アミノ酸側鎖基のうち、糖化されたアミノ基以外の部分を示す。例えば、糖化されたアミノ酸がリジンの場合、R5は
−CH2−CH2−CH2−CH2−
であり、
例えば、糖化されたアミノ酸がアルギニンの場合、R5は、
−CH2−CH2−CH2−NH−CH(NH2)−
である。
また、前記式(4)において、R6は、水素、アミノ酸残基またはペプチド残基であり、例えば、下記式(5)で示すことができる。なお、下記式(5)において、nは0以上の整数であり、R3は、前述と同様にアミノ酸側鎖基を示し、アミノ酸側鎖基は全て同一でも、異なっていても良い。
−(CO−CR3H−NH)n−H …(5)
また、前記式(4)において、R7は、水酸基、アミノ酸残基またはペプチド残基であり、例えば、下記式(6)で示すことができる。なお、下記式(6)において、nは0以上の整数であり、R3は、前述と同様にアミノ酸側鎖基を示し、アミノ酸側鎖基は全て同一でも、異なっていても良い。
−(NH−CHR3−CO)n−OH …(6)
【0032】
前記糖化α−アミノ基に特異的に作用するFAOD−αとしては、例えば、市販の商品名フルクトシル−アミノ酸オキシダーゼ(FAOX−E)(キッコーマン社製)、ペニシリウム属由来FAOD(特開平8−336386公報)等があげられる。前記糖化されたアミノ酸側鎖に特異的に作用するFAOD−Sとしては、例えば、フサリウム属由来FAOD(日本生物工学会大会 平成12年度 「Fusarium oxysporum 由来アミノ酸オキシダーゼの基質特異性の変換;藤原真紀 他」)等があげられる。また、前記糖化α−アミノ基および糖化アミノ酸側鎖基の両方に作用するFAOD−αSとしては、例えば、市販の商品名FOD(旭化成社製)、ギベレラ属由来FAOD(特開平8−154672号公報)、フサリウム属由来FAOD(特開平7−289253号公報)、アスペルギルス属由来FAOD(WO99/20039号)等があげられる。
【0033】
つぎに、本発明の測定方法について、非測定対象糖化物として糖化アミノ酸を含む全血試料を用いて、血球由来の糖化タンパク質を測定する例をあげて説明する。なお、本発明において「非測定対象糖化物である糖化アミノ酸」は、特に示さない限り、測定前から試料中に含まれるものをいい、例えば、測定対象物である糖化タンパク質のプロテアーゼ分解物は含まない。
【0034】
(第1の実施形態)
この実施形態は、前記糖化アミノ酸の分解にFAOD−αを使用し、糖化タンパク質の測定にFAOD−αSを用いた前記第1の測定方法の一例である。
【0035】
まず、全血を溶血して溶血試料を調製する。この溶血方法は、特に制限されず、例えば、界面活性剤を用いる方法、超音波による方法、浸透圧の差を利用する方法、凍結溶解による方法等が使用できる。この中でも、操作の簡便性等の理由から、界面活性剤を用いる方法が好ましい。
【0036】
前記界面活性剤としては、例えば、ポリオキシエチレン−p−t−オクチルフェニル エーテル(Triton系界面活性剤等)、ポリオキシエチレン ソルビタン アルキル エステル(Tween系界面活性剤等)、ポリオキシエチレン アルキル エーテル(Brij系界面活性剤等)等の非イオン性界面活性剤が使用でき、具体的には、例えば、商品名TritonX−100、商品名Tween−20、商品名Brij35等があげられる。前記界面活性剤による処理条件は、通常、処理溶液中の血球濃度が1〜10体積%の場合、前記処理溶液中の濃度が0.1〜1重量%になるように前記界面活性剤を添加し、室温で5秒〜1分程度攪拌すればよい。
【0037】
また、前記浸透圧の差を利用する場合は、例えば、全血の体積に対し2〜100倍体積量の精製水を添加して溶血させる。
【0038】
つぎに、前記溶血試料に対し、プロテアーゼ処理を行う。このプロテアーゼ処理によって糖化タンパク質を分解し、後述するFAODが作用し易いようにする。前記プロテアーゼの種類は、特に制限されず、前述のようなプロテアーゼK、ズブチリシン、トリプシン、アミノペプチダーゼ、パパイン、メタロプロテイナーゼ等が使用できる。前記プロテアーゼ処理は、通常、緩衝液中で行われ、その処理条件は、使用するプロテアーゼの種類、測定対象の糖化タンパク質の種類およびその濃度等により適宜決定される。
【0039】
プロテアーゼとしてトリプシンを用いて、前記試料を処理する場合、例えば、反応液中のプロテアーゼ濃度100〜6,000U/L、反応液中の血球濃度0.2〜5体積%、反応温度20〜50℃、反応時間10分〜20時間、pH6〜9の範囲である。この処理は、通常、緩衝液中で行われ、使用できる緩衝液は特に制限されないが、例えば、トリス塩酸緩衝液、リン酸緩衝液、EPPS緩衝液、PIPES緩衝液等である。
【0040】
つぎに、前記プロテアーゼ処理した溶血試料を、前記式(1)の反応、具体的には下記式(7)の反応を触媒するFAOD−αで処理する。
R1−CO−CH2−NH−CHR3−COOH + H2O + O2
→ R1−CO−CHO + NH2−CHR3−COOH + H2O2 …(7)
前記式(7)において、R1は前述と同様の糖残基を示し、R3は前述と同様にアミノ酸側鎖を示す。
【0041】
この処理によって、前記溶血試料に含まれるα−アミノ基が糖化された糖化アミノ酸、および前記糖化タンパク質分解物のうちα−アミノ基の糖化部分が分解される。
【0042】
なお、前記FAOD−α処理によっては、糖化アミノ酸の中でも側鎖アミノ基が糖化されたものは分解されずに残存する。しかし、この側鎖が糖化されたアミノ酸の糖化アミノ酸全体に対する割合と、糖化タンパク質における糖化された側鎖アミノ基を有するアミノ酸残基に対する割合から考えても、残存する糖化アミノ酸の影響は小さく、測定精度は十分に向上するといえる。
【0043】
処理条件としては、例えば、反応液中のFAOD−α濃度10〜5000U/L、反応液中の血球濃度0.5〜20体積%、反応温度20〜50℃、反応時間1分〜1時間、pH6〜9の範囲である。この処理は、通常、緩衝液中で行われ、前記プロテアーゼ処理と同様の緩衝液が使用できる。
【0044】
つぎに、前記FAOD−α処理した前記溶血試料を、さらにFAOD−αSで処理する。このFAOD−αSは、前述のように、糖化されたα−アミノ基および糖化された側鎖アミノ基の両方に作用する。しかし、糖化タンパク質分解物は、予め、分解用FAOD−αによって処理されているため、糖化された側鎖アミノ基のみに測定用FAOD−αSを作用させることができる。
【0045】
このFAOD−αS処理は、前記プロテアーゼ処理と同様に緩衝液中で行うことが好ましく、前記緩衝液としては、特に制限されず、前記プロテアーゼ処理と同様の緩衝液が使用できる。
【0046】
処理条件としては、例えば、反応液中のFAOD−αS濃度10〜30,000U/L、反応液中の血球濃度0.1〜5体積%、反応温度20〜50℃、反応時間1分〜1時間、pH6〜9の範囲である。
【0047】
つぎに、前記FAOD−αS処理で生成した過酸化水素を、PODおよび前記発色性基質を用いてさらに酸化還元反応によって測定する。
【0048】
前記発色性基質としては、例えば、N−(カルボキシメチルアミノカルボニル)−4,4’−ビス(ジメチルアミノ)ジフェニルアミンナトリウム、オルトフェニレンジアミン(OPD)、トリンダー試薬と4−アミノアンチピリンとを組み合せた基質等があげられる。前記トリンダー試薬としては、例えば、フェノール、フェノール誘導体、アニリン誘導体、ナフトール、ナフトール誘導体、ナフチルアミン、ナフチルアミン誘導体等があげられる。また、前記アミノアンチピリンの他に、アミノアンチピリン誘導体、バニリンジアミンスルホン酸、メチルベンズチアゾリノンヒドラゾン(MBTH)、スルホン化メチルベンズチアゾリノンヒドラゾン(SMBTH)等も使用できる。このような発色性基質の中でも、特に好ましくは、前述のように、N−(カルボキシメチルアミノカルボニル)−4,4’−ビス(ジメチルアミノ)ジフェニルアミンナトリウムである。
【0049】
前記酸化還元反応は、通常、緩衝液中で行われ、その条件は、前記生成した過酸化水素の濃度等により適宜決定される。通常、反応液中のPOD濃度10〜100,000 IU/L、発色性基質濃度0.005〜30mmol/L、反応温度15〜37℃、反応時間0.1〜30分、pH5〜9である。また、前記緩衝液は、特に制限されず、例えば、前記プロテアーゼ処理およびFAOD処理等と同様の緩衝液等が使用できる。
【0050】
前記酸化還元反応において、例えば、前記発色性基質を用いた場合、前記反応液の発色程度(吸光度)を分光光度計で測定することにより、過酸化水素の量を測定できる。そして、例えば、この過酸化水素濃度と検量線等とを用いて、試料中の糖化タンパク質の量を求めることができる。本実施形態においては、アミノ酸残基の側鎖アミノ基の糖化量によって、糖化タンパク質の量や糖化量を測定することとなる。
【0051】
なお、はじめに添加した分解用FAOD−αによって生成した過酸化水素は、血液試料(溶血試料)に存在するカタラーゼによって消失するため、FAOD−αSにより生成した測定対象物由来の過酸化水素の測定には影響を及ぼすことはない。また、別途カタラーゼを添加して消去させてもよい。このように前記カタラーゼにより過酸化水素を消去した場合、後に行うFAOD−αS処理で生成する過酸化水素までもが消去されることを防ぐために、FAOD−αSの添加と共に、過剰量のPODおよび発色性基質を添加することが好ましい。この場合、PODは、前記カタラーゼの添加量(U)に対し、例えば、5〜100倍の活性(U)量を添加することが好ましい。
【0052】
前記過酸化水素量は、前記POD等を用いた酵素的手法の他に、例えば、電気的手法により測定することもできる。
【0053】
この測定において、前記プロテアーゼ処理は、前述のように前記分解用FAOD−α処理の前には限られず、例えば、前記FAOD−α処理の後に行ってもよい。前記プロテアーゼ処理は、前述のように、FAODを作用し易くするために行うが、前記FAOD−αは糖化アミノ酸の分解を目的として行うため、FAOD−α処理前にプロテアーゼによって糖化タンパク質が分解されていなくても、本発明の効果は十分に得ることができるからである。
【0054】
また、例えば、非測定対象糖化物が、α−アミノ基が糖化された糖化アミノ酸であって、測定対象糖化アミンが、α−アミノ基が糖化された糖化タンパク質である場合等にも本実施形態の測定方法が適用できる。この場合は、分解用FAODが糖化タンパク質に作用し難くても、例えば、残存した分解用FAODがプロテアーゼ処理によるプロテアーゼ分解物に作用してしまうことが考えられるため、例えば、後述する第2の実施形態のように残存するFAODをプロテアーゼ分解により失活させたり、第3の実施形態のように分解用FAODと測定用FAODの添加割合を調整することが好ましい。
【0055】
(第2の実施形態)
この実施形態は、非測定対象糖化物である糖化アミノ酸の分解と測定対象である糖化タンパク質の測定に、同じFAODを用いた前記第2の測定方法の一例である。FAODとしては、特に制限されず、例えば、FAOD−α、FAOD−S、FAOD−αSのいずれを用いてもよい。
【0056】
前記第1の実施形態と同様にして溶血試料を調製し、この溶血試料に分解用FAODを添加する。
【0057】
処理条件としては、例えば、反応液中のFAOD濃度10〜5000U/L、反応液中の血球濃度0.5〜20体積%、反応温度20〜50℃、反応時間1分〜1時間、pH6〜9の範囲である。この処理は、通常、緩衝液中で行われ、前述と同様の緩衝液が使用できる。
【0058】
つぎに、FAOD処理した試料に対しプロテアーゼ処理を行う。このプロテアーゼ処理の第1の目的は、前述と同様に、血球由来の糖化タンパク質を分解し、後の工程でさらに添加する測定用FAODを作用し易くするためである。そして、第2の目的は、前記分解用FAODを消化して失活させるためである。
【0059】
FAODは、糖化タンパク質に作用し難く、糖化アミノ酸に作用し易いため、前記分解用FAOD処理では、試料中の糖化アミノ酸がまず分解される。しかし、この分解用FAODが残っている状態で、前記糖化タンパク質をプロテアーゼ処理すると、残存するFAODと糖化タンパク質分解物の糖化部分とが反応してしまい、正確な測定ができないという問題がある。したがって、この残存するFAODをプロテアーゼで失活させ、前記糖化タンパク質分解物との反応を防止ればよい。このためには、はじめに添加した分解用FAODを速やかに失活させ、かつ、糖化タンパク質を分解できるだけのプロテアーゼを添加する必要がある。
【0060】
前記プロテアーゼとしては、特に制限されず、前述と同様のものが使用できる。また、その処理条件は、例えば、使用するプロテアーゼの種類、糖化タンパク質の種類やその濃度、分解用FAODの種類やその量等に応じて適宜決定される。
【0061】
プロテアーゼ処理の反応溶液におけるプロテアーゼの添加量は、分解用FAOD 100U/Lに対して、例えば、1〜1000,000KU/Lの範囲であり、好ましくは10〜300,000KU/Lの範囲であり、より好ましくは100〜100,000KU/Lの範囲である。
【0062】
具体的に、プロテアーゼとしてトリプシンを用いて、前記試料を処理する場合、例えば、反応液中のプロテアーゼ濃度1000〜30,000KU/L、反応液中の血球濃度0.2〜5体積%、反応液中のFAOD濃度10〜1000U/L、反応温度20〜50℃、反応時間10分〜20時間、pH6〜9の範囲である。
【0063】
つぎに、前記プロテアーゼ処理により得られた糖化タンパク質分解物に、分解用FAODと同じFAODを、再度測定用FAODとして添加して処理する。この測定用FAODは、前記プロテアーゼによって失活するおそれがあるため、十分量添加する必要がある。
【0064】
この測定用FAOD処理も、前述と同様に緩衝液中で行うことが好ましく、前記緩衝液としては、特に制限されず、前記プロテアーゼ処理と同様の緩衝液が使用できる。
【0065】
測定用FAOD処理の反応溶液における測定用FAODの添加量は、プロテアーゼ10,000KU/Lに対して、例えば、10〜1000,000U/Lの範囲であり、好ましくは100〜200,000U/Lの範囲であり、より好ましくは500〜50,000U/Lの範囲である。
【0066】
具体的な処理条件としては、例えば、反応液中のFAOD濃度500〜20,000U/L、反応液中のプロテアーゼ濃度100〜30,000KU/L、反応液中の血球濃度0.01〜1体積%、反応温度15〜40℃、反応時間1分〜1時間、pH6〜9の範囲である。
【0067】
このような実施形態によれば、糖化アミノ酸の分解と糖化タンパク質の測定に使用するFAODが同じであっても、前記糖化アミノ酸の影響を受けることなく、高い精度で測定が可能である。
【0068】
(第3の実施形態)
この実施形態は、非測定対象糖化物である糖化アミノ酸の分解と測定対象である糖化タンパク質の測定に、同じFAODを用いた例である。但し、この実施形態は、前記第2の実施形態とは異なり、分解用FAODを、プロテアーゼによって必ずしも失活させる必要がない。酵素には基質特異性があるため、プロテアーゼとFAODとの組み合わせによっては、FAODをプロテアーゼで失活させ難い場合がある。このような場合に本実施形態の方法が有効になる。なお、はじめに添加した分解用FAODが、プロテアーゼにより生成した糖化タンパク質分解物と反応すると、測定精度を向上できないため、以下に示すように、FAODの添加割合を調整することが重要となる。
【0069】
まず、前記第1の実施形態と同様にして溶血試料を調製し、この溶血試料に分解用FAODを添加する。
【0070】
分解用FAODは、プロテアーゼで失活させ難い場合、活性が残存しても、プロテアーゼ処理の間に、生成した糖化タンパク質分解物に作用しない範囲で添加する必要がある。なお、FAODは、糖化タンパク質に作用し難く、糖化ペプチドよりも糖化アミノ酸により一層作用し易いという性質を有するため、例えば、糖化アミノ酸のみに作用する程度の添加量であり、かつ反応時間とすることが好ましい。
【0071】
FAOD処理の条件としては、例えば、反応液中のFAOD濃度10〜5000U/L、反応液中の血球濃度0.2〜20体積%、反応温度20〜50℃、反応時間1分〜1時間、pH6〜9の範囲である。この処理は、通常、緩衝液中で行われ、前述と同様の緩衝液が使用できる。
【0072】
つぎに、前記FAOD処理した試料に対しプロテアーゼ処理を行う。この実施形態は、前述のように、プロテアーゼが前記FAODに作用し難い場合の例であるため、プロテアーゼの添加量は特に制限されない。
【0073】
前記プロテアーゼとしては、特に制限されず、前述と同様のものが使用できる。その処理条件は、前述と同様に、使用するプロテアーゼの種類、測定対象の糖化タンパク質の種類およびその濃度、はじめに添加したFAODの種類およびその濃度、使用するプロテアーゼのFAODに対する基質特異性等により適宜決定される。
【0074】
このような実施形態に該当するFAODとプロテアーゼの組み合わせとしては、例えば、商品名FOD(旭化成社製)と商品名トヨチーム(東洋紡社製)、前記ギベレラ属由来FAODと商品名プロテナーゼK(ロッシュ社製)の組み合わせ等があげられる。
【0075】
プロテアーゼとしてトリプシンを用いて、前記試料を処理する場合、例えば、反応液中のプロテアーゼ濃度100〜6000U/L、反応液中の血球濃度0.2〜5体積%、反応液中のFAOD濃度0.1〜100U/L、反応温度20〜50℃、反応時間10分〜20時間、pH6〜9の範囲である。
【0076】
続いて、前記プロテアーゼ処理により得られた分解物に、再度同じFAODを測定用FAODとして添加する。
【0077】
この測定用FAOD処理も、前述と同様に緩衝液中で行うことが好ましく、前記緩衝液としては、特に制限されず、前記プロテアーゼ処理と同様の緩衝液が使用できる。
【0078】
このように、本実施形態においては、分解用FAOD(A)と測定用FAOD(B)の添加割合(活性比A:B)を、例えば、前述のように1:50,000〜1:10の範囲、好ましくは1:5000〜1:25の範囲、より好ましくは1:500〜1:50の範囲にする。このように設定すれば、前記第2の実施形態と異なり前記分解用FAODは反応液中に残存するが、この残存したFAODの反応速度は非常に遅いため、プロテアーゼ処理工程において、測定に影響を与える程度に、生成した糖化タンパク質分解物に残存FAODが作用することはない。
【0079】
処理条件としては、例えば、反応液中のFAOD濃度500〜20,000U/L、反応液中のプロテアーゼ濃度100〜30,000KU/L、反応液中の血球濃度0.01〜1体積%、反応温度15〜40℃、反応時間1分〜1時間、pH6〜9の範囲である。
【実施例】
【0080】
(実施例1および比較例1)
患者に、アミノ酸およびブドウ糖を含む点滴を行い、1時間後、血液を採取した。その血液を遠心分離(1000g、10分間)して血球と血漿とに分離し、前記血球画分0.006mL、前記血漿画分0.006mLおよび下記溶血試薬A 0.45mLとを混合して、前記血球を溶血させて溶血試料を調製した。
【0081】
(溶血試薬A:pH8.5)
商品名TAPS(同仁化学社製) 140mmol/L
グリシンアミド(ナカライテスク社製) 60mmol/L
ポリオキシエチレンラウリルエーテル(ナカライテスク社製) 24g/L
【0082】
前記溶血試料に下記各種FAOD溶液(濃度200KU/L)0.0023mLを25℃で添加し、37℃で40分間インキュベートを行った。なお、下記(1)ペニシリウム属由来FAODは、糖化されたα−アミノ基に特異的に作用し、(2)アスペルギルス属由来FAODは、糖化されたα−アミノ基および糖化されたε−アミノ基に特異的に作用し、(3)FAOX−Eは、糖化されたα−アミノ基に特異的に作用するFAODである。
【0083】
(使用したFAOD)
(1)前記ペニシリウム属由来FAOD(特開平8−336386公報)
(2)前記アスペルギルス属由来FAOD(WO99/20039号)
(3)商品名FAOX−E(キッコーマン社製、以下同じ)
【0084】
つぎに、前記FAODを添加した溶血試料0.01mLに精製水0.01mLを添加し、さらに下記プロテアーゼ試薬0.065mLを添加して37℃で5分間インキュベートした。続いて、下記発色試薬0.045mLを添加して37℃で3分間インキュベートし、反応液の吸光度(波長751nm)を測定装置(商品名JCA BM−8、日本電子社製)によって測定した。なお、比較例としては、前記溶血試料に、前記各種FAODに代えて精製水を添加した以外は、前記実施例と同様にして測定を行った。また、コントロールとしては、前記血球に、前記血漿に代えて精製水を添加した以外は、前記実施例と同様にして測定を行った。これらの結果を下記表1に示す。
【0085】
(プロテアーゼ試薬:pH6.5)
MOPS(同仁化学社製) 5mmol/L
テトラゾリウム化合物(商品名WST−3、同仁化学社製) 2mmol/L
NaN3(ナカライテスク社製) 0.05g/L
CaCl2(ナカライテスク社製) 5mmol/L
NaCl(ナカライテスク社製) 300mmol/L
メタロプロテアーゼ 3g/L
【0086】
(発色試薬)
ギベレラ属由来FAOD(特開平8−154672号公報) 26KU/L
POD(東洋紡社製) 77.6KU/L
発色基質(商品名DA−64、和光純薬工業社製) 0.052mmol/L
Tris−HCl緩衝液(pH6.9) 200mmol/L
【0087】
【表1】

【0088】
前記表1に示すように、比較例1では、血漿中に含まれる糖化アミノ酸も発色試薬に含まれるFAODと反応してしまうため、血球中の糖化タンパクのみを測定したコントロールよりも高い吸光度となった。これに対して、実施例1は、血漿中の糖化アミノ酸を予めFAODで処理しているため、前記糖化タンパク質を正確に測定することができ、コントロールとの相関も高かった。これは、発色試薬に含有されたFAODを、血球由来の糖化タンパク質分解物のみに作用させることができたからである。
【0089】
(実施例2および比較例2)
前記実施例1と同様に点滴後の血液を採血し、これを静置した。そして、自然沈降した血球を回収し、この血球画分0.01mLに下記溶血試薬B 0.3mLを添加して溶血試料を調製した。この溶血試料のHb濃度およびHbA1c濃度を、前記自動分析装置により分析した。なお、前記血球は自然沈降により回収しているため、前記血球画分は血漿成分を含んでいる。
【0090】
(溶血試薬B:pH8.5)
商品名TAPS(同仁化学社製) 140mmol/L
グリシンアミド(ナカライテスク社製) 60mmol/L
ポリオキシエチレンラウリルエーテル(ナカライテスク社製) 24g/L
商品名FAOX−E(キッコーマン社製、以下同じ) 1KU/L
【0091】
前記溶血試料0.01mLに精製水0.01mLおよび前記プロテアーゼ試薬0.065mLを添加して37℃でインキュベートした。そして、インキュベート開始から4.5分後における571nmの吸光度を測定し、これをHb濃度を示す吸光度とした。続いて、インキュベート開始から5分後に、実施例1と同じ発色試薬0.045mLを添加して37℃で3分間インキュベートし、さらに3分間反応させた後の751nmにおける吸光度を前記自動分析装置により測定し、HbA1c濃度を示す吸光度とした。
【0092】
そして、予め作成したHb濃度(g/L)またはHbA1c濃度(g/L)と、吸光度との関係を示す検量線に、測定したそれぞれの吸光度を代入してHbA1c濃度およびHb濃度を求め、下記式からHbA1c%を算出した。
HbA1c(%)=(HbA1c濃度/Hb濃度)×100
【0093】
なお、前記検量線は、以下に示す方法で作成した。まず、HbA1c濃度およびHb濃度が既知である種々濃度の標準液について、自動測定器(商品名HA−8150:アークレイ株式会社)を用いてHbA1c濃度とHb濃度とを測定した。一方、前記各標準液について、前記実施例と同様の測定方法により、Hb濃度およびHbA1c濃度に相当する吸光度の測定を行った。そして、前記自動測定器による測定値と前記吸光度から一次回帰式を作成し、これを検量線とした。
【0094】
比較例2としては、前記血球に、前記溶血試薬Bの代わりに、商品名FAOX−Eを含有しない前記溶血試薬Aを添加した以外は、前記実施例2と同様にして測定を行った。
【0095】
また、コントロールとしては、自然沈降により回収した前記血球画分0.05mLに、下記自動測定器HA−8150専用希釈液2.5mLを添加して溶血させたものを、溶血試料とした。そして、この溶血試料におけるHbA1c濃度(%)を、前記自動測定器(商品名HA−8150:アークレイ株式会社)により測定した値を使用した。
【0096】
以上の結果を図1に示す。同図は、酵素法により測定した実施例2および比較例2のHbA1c(%)と、コントロールの自動分析によるHbA1c(%)との関係を示すグラフである。同図において、実施例は、相関式、「y=1.079x−0.409」、相関係数「0.967」であり、比較例は、相関式、「y=1.124x−0.559」、相関係数「0.931」であった。
【0097】
図1に示すように、実施例2によれば、血漿中に含まれる外来の糖化アミノ酸は、はじめのFAOD処理(溶血試薬B中のFAOD)によって分解されており、この処理によって発生する過酸化水素も試料中のカタラーゼによって消失している。このため、後で添加するFAODによる酸化還元反応においては、血球の糖化タンパク質由来の過酸化水素のみが発生し、血漿を添加せずに自動分析により測定したコントロールの値と非常に近い値が得られ、その相関係数(0.967)も非常に高かった。一方、比較例2においては、血漿中に含まれる糖化アミノ酸についても、糖化タンパク質に作用させるためのFAODが反応するため、発生する過酸化水素の量も、糖化タンパク質により生じる過酸化水素の量よりも多くなる。このため、比較例のHbA1c(%)は、コントロールのHbA1c(%)よりも高い値となり、コントロールとの相関関係も実施例2に比べて低い結果となった(相関係数0.931)。
【産業上の利用可能性】
【0098】
以上のように、本発明の試料の前処理方法によれば、試料中に含まれる非測定対象糖化物である糖化ペプチドや糖化アミノ酸を分解除去できるため、このような前処理済み試料について糖化アミンの測定を行えば、前記非測定対象糖化物による影響を回避できるため、優れた測定精度となる。このため、例えば、採血前に点滴を受けた患者の血液であって、一過性の外来糖化アミノ酸等を含む場合であっても、その影響を回避できる。このような方法を、例えば、赤血球中の糖化ヘモグロビンの測定の際に適用すれば、従来よりも測定精度が向上し、糖尿病診断等の指標物質としての重要性がさらに向上する。
【特許請求の範囲】
【請求項1】
糖化アミンを測定対象とする試料の前処理方法であって、前記試料中に測定対象の糖化アミンとは別に存在する糖化アミノ酸または糖化ペプチドを除去することを目的として、前記糖化アミノ酸または糖化ペプチドにフルクトシルアミノ酸オキシダーゼを作用させて分解する試料の前処理方法。
【請求項2】
2試料中の糖化アミンに、フルクトシルアミノ酸オキシダーゼを作用させて、その酸化還元反応を測定することにより糖化アミンの量を測定する方法であって、前記試料中に測定対象の糖化アミンとは別に存在する糖化アミノ酸または糖化ペプチドを除去することを目的として、前記酸化還元反応に先立ち、予め、前記試料を請求の範囲1記載の前処理方法によって処理して前記糖化アミノ酸または糖化ペプチドを分解する測定方法。
【請求項3】
測定対象の糖化アミンとは別に存在する糖化アミノ酸または糖化ペプチドに作用させるフルクトシルアミノ酸オキシダーゼと、糖化アミンに作用させるフルクトシルアミノ酸オキシダーゼとが、異なる基質特異性である請求の範囲2記載の測定方法。
【請求項4】
測定対象の糖化アミンとは別に存在する糖化アミノ酸または糖化ペプチドに作用させるフルクトシルアミノ酸オキシダーゼが、糖化されたα−アミノ基に特異的に作用し、糖化アミンに作用させるフルクトシルアミノ酸オキシダーゼが、糖化されたα−アミノ基および糖化されたアミノ酸残基側鎖に特異的に作用する請求の範囲3記載の測定方法。
【請求項5】
測定対象の糖化アミンとは別に存在する糖化アミノ酸または糖化ペプチドにフルクトシルアミノ酸オキシダーゼを作用させる前または作用させた後に、糖化アミンをプロテアーゼで分解し、この分解物に、前記糖化アミンに作用させるフルクトシルアミノ酸オキシダーゼを作用させて前記酸化還元反応を行う請求の範囲3または4記載の測定方法。
【請求項6】
測定対象の糖化アミンとは別に存在する糖化アミノ酸が、α−アミノ基が糖化された糖化アミノ酸であり、測定対象の糖化アミンが、α−アミノ基およびアミノ酸残基側鎖が糖化された糖化タンパク質または糖化ペプチドである請求の範囲4または5記載の測定方法。
【請求項7】
糖化アミノ酸または糖化ペプチドにフルクトシルアミノ酸オキシダーゼを作用させた後、糖化アミンをプロテアーゼで分解し、さらに前記糖化アミノ酸または糖化ペプチドに作用させたのと同じフルクトシルアミノ酸オキシダーゼを添加して、これを前記プロテアーゼによる糖化アミン分解物に作用させて前記酸化還元反応を行う請求の範囲2記載の測定方法。
【請求項8】
プロテアーゼにより、糖化アミノ酸または糖化ペプチドに作用させたフルクトシルアミノ酸オキシダーゼを失活させる請求の範囲7記載の測定方法。
【請求項9】
糖化アミノ酸または糖化ペプチドに作用させるフルクトシルアミノ酸オキシダーゼ(A)と糖化アミンの分解物に作用させるフルクトシルアミノ酸オキシダーゼ(B)の添加割合(活性比A:B)が、A:B=1:10〜1:50,000の範囲である請求の範囲7記載の測定方法。
【請求項10】
測定対象の糖化アミンとは別に存在する糖化アミノ酸または糖化ペプチドの糖化部位が、α−アミノ基であり、測定対象の糖化アミンが糖化タンパク質であって、その糖化部分がα−アミノ基である請求の範囲7〜9のいずれか一項に記載の測定方法。
【請求項11】
糖化アミンが、糖化アミノ酸、糖化ペプチドおよび糖化タンパク質からなる群から選択された少なくとも一つの物質である請求の範囲2〜10のいずれか一項に記載の測定方法。
【請求項12】
糖化タンパク質が、糖化ヘモグロビンである請求の範囲11記載の測定方法。
【請求項13】
プロテアーゼが、メタロプロテアーゼ、ブロメライン、パパイン、トリプシン、プロテアーゼK、ズブチリシンおよびアミノペプチダーゼからなる群から選択された少なくとも一つのプロテアーゼである請求の範囲5〜12のいずれか一項に記載の測定方法。
【請求項14】
プロテアーゼが、糖化ヘモグロビンを選択的に分解するプロテアーゼであって、メタロプロテアーゼ、ブロメライン、パパイン、ブタ膵臓由来トリプシンおよびBacillus subtillis由来のプロテアーゼからなる群から選択された少なくとも一つのプロテアーゼである請求の範囲13記載の測定方法。
【請求項15】
試料が、全血、結晶、血清、血球、尿および髄液からなる群から選択された少なくとも一つの生体試料である請求項2〜14のいずれか一項に記載の測定方法。
【請求項16】
試料が、点滴後の患者から採取した全血試料である請求の範囲15記載の測定方法。
【請求項17】
測定対象の糖化アミンとは別に存在する糖化アミノ酸が、外来の糖化アミノ酸を含む請求の範囲2〜16のいずれか一項に記載の測定方法。
【請求項1】
糖化アミンを測定対象とする試料の前処理方法であって、前記試料中に測定対象の糖化アミンとは別に存在する糖化アミノ酸または糖化ペプチドを除去することを目的として、前記糖化アミノ酸または糖化ペプチドにフルクトシルアミノ酸オキシダーゼを作用させて分解する試料の前処理方法。
【請求項2】
2試料中の糖化アミンに、フルクトシルアミノ酸オキシダーゼを作用させて、その酸化還元反応を測定することにより糖化アミンの量を測定する方法であって、前記試料中に測定対象の糖化アミンとは別に存在する糖化アミノ酸または糖化ペプチドを除去することを目的として、前記酸化還元反応に先立ち、予め、前記試料を請求の範囲1記載の前処理方法によって処理して前記糖化アミノ酸または糖化ペプチドを分解する測定方法。
【請求項3】
測定対象の糖化アミンとは別に存在する糖化アミノ酸または糖化ペプチドに作用させるフルクトシルアミノ酸オキシダーゼと、糖化アミンに作用させるフルクトシルアミノ酸オキシダーゼとが、異なる基質特異性である請求の範囲2記載の測定方法。
【請求項4】
測定対象の糖化アミンとは別に存在する糖化アミノ酸または糖化ペプチドに作用させるフルクトシルアミノ酸オキシダーゼが、糖化されたα−アミノ基に特異的に作用し、糖化アミンに作用させるフルクトシルアミノ酸オキシダーゼが、糖化されたα−アミノ基および糖化されたアミノ酸残基側鎖に特異的に作用する請求の範囲3記載の測定方法。
【請求項5】
測定対象の糖化アミンとは別に存在する糖化アミノ酸または糖化ペプチドにフルクトシルアミノ酸オキシダーゼを作用させる前または作用させた後に、糖化アミンをプロテアーゼで分解し、この分解物に、前記糖化アミンに作用させるフルクトシルアミノ酸オキシダーゼを作用させて前記酸化還元反応を行う請求の範囲3または4記載の測定方法。
【請求項6】
測定対象の糖化アミンとは別に存在する糖化アミノ酸が、α−アミノ基が糖化された糖化アミノ酸であり、測定対象の糖化アミンが、α−アミノ基およびアミノ酸残基側鎖が糖化された糖化タンパク質または糖化ペプチドである請求の範囲4または5記載の測定方法。
【請求項7】
糖化アミノ酸または糖化ペプチドにフルクトシルアミノ酸オキシダーゼを作用させた後、糖化アミンをプロテアーゼで分解し、さらに前記糖化アミノ酸または糖化ペプチドに作用させたのと同じフルクトシルアミノ酸オキシダーゼを添加して、これを前記プロテアーゼによる糖化アミン分解物に作用させて前記酸化還元反応を行う請求の範囲2記載の測定方法。
【請求項8】
プロテアーゼにより、糖化アミノ酸または糖化ペプチドに作用させたフルクトシルアミノ酸オキシダーゼを失活させる請求の範囲7記載の測定方法。
【請求項9】
糖化アミノ酸または糖化ペプチドに作用させるフルクトシルアミノ酸オキシダーゼ(A)と糖化アミンの分解物に作用させるフルクトシルアミノ酸オキシダーゼ(B)の添加割合(活性比A:B)が、A:B=1:10〜1:50,000の範囲である請求の範囲7記載の測定方法。
【請求項10】
測定対象の糖化アミンとは別に存在する糖化アミノ酸または糖化ペプチドの糖化部位が、α−アミノ基であり、測定対象の糖化アミンが糖化タンパク質であって、その糖化部分がα−アミノ基である請求の範囲7〜9のいずれか一項に記載の測定方法。
【請求項11】
糖化アミンが、糖化アミノ酸、糖化ペプチドおよび糖化タンパク質からなる群から選択された少なくとも一つの物質である請求の範囲2〜10のいずれか一項に記載の測定方法。
【請求項12】
糖化タンパク質が、糖化ヘモグロビンである請求の範囲11記載の測定方法。
【請求項13】
プロテアーゼが、メタロプロテアーゼ、ブロメライン、パパイン、トリプシン、プロテアーゼK、ズブチリシンおよびアミノペプチダーゼからなる群から選択された少なくとも一つのプロテアーゼである請求の範囲5〜12のいずれか一項に記載の測定方法。
【請求項14】
プロテアーゼが、糖化ヘモグロビンを選択的に分解するプロテアーゼであって、メタロプロテアーゼ、ブロメライン、パパイン、ブタ膵臓由来トリプシンおよびBacillus subtillis由来のプロテアーゼからなる群から選択された少なくとも一つのプロテアーゼである請求の範囲13記載の測定方法。
【請求項15】
試料が、全血、結晶、血清、血球、尿および髄液からなる群から選択された少なくとも一つの生体試料である請求項2〜14のいずれか一項に記載の測定方法。
【請求項16】
試料が、点滴後の患者から採取した全血試料である請求の範囲15記載の測定方法。
【請求項17】
測定対象の糖化アミンとは別に存在する糖化アミノ酸が、外来の糖化アミノ酸を含む請求の範囲2〜16のいずれか一項に記載の測定方法。
【図1】




【公開番号】特開2010−110333(P2010−110333A)
【公開日】平成22年5月20日(2010.5.20)
【国際特許分類】
【出願番号】特願2010−28817(P2010−28817)
【出願日】平成22年2月12日(2010.2.12)
【分割の表示】特願2007−165326(P2007−165326)の分割
【原出願日】平成14年10月9日(2002.10.9)
【出願人】(000141897)アークレイ株式会社 (288)
【Fターム(参考)】
【公開日】平成22年5月20日(2010.5.20)
【国際特許分類】
【出願日】平成22年2月12日(2010.2.12)
【分割の表示】特願2007−165326(P2007−165326)の分割
【原出願日】平成14年10月9日(2002.10.9)
【出願人】(000141897)アークレイ株式会社 (288)
【Fターム(参考)】
[ Back to top ]

