糖尿病及び脂質障害の治療のためのクロマンカルボン酸誘導体
【課題】糖尿病及び脂質障害の治療のためのクロマンカルボン酸誘導体を提供する。
【解決手段】本発明は、インシュリン非依存性糖尿病(II型糖尿病)及びそれに関連する血管疾患、同様に、肥満症及び脂質障害の治療及びコントロールのために有用な3−クロマンカルボン酸誘導体及びそれらの医薬的に許容される塩及びプロドラッグに関する。
【解決手段】本発明は、インシュリン非依存性糖尿病(II型糖尿病)及びそれに関連する血管疾患、同様に、肥満症及び脂質障害の治療及びコントロールのために有用な3−クロマンカルボン酸誘導体及びそれらの医薬的に許容される塩及びプロドラッグに関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、インシュリン非依存性糖尿病(II型糖尿病)及びそれに関連する血管疾患、同様に、肥満症及び脂質障害の治療及びコントロールのために有用な3−クロマンカルボン酸誘導体及びそれらの医薬的に許容される塩及びプロドラッグに関する。
【背景技術】
【0002】
糖尿病は、種々の理由による体のホメオスタシスの機能不良に由来して、血漿中のグルコース濃度が正常範囲(空腹状態において>126mg/dL)を超えて維持される疾患又は高血糖症を指す。米国内だけで、人口の6.2%(1700万人)が、冠状動脈性心臓病、脳卒中、高血圧、神経障害、腎症、網膜症のようなマクロ血管疾患及び微小血管疾患に関連する多くの合併症を有する糖尿病にかかっている。米国糖尿病学会により、糖尿病を持つ成人の心臓疾患による死亡率及び脳卒中の危険性が2ないし4倍であることが示された。毎年、糖尿病のために12000ないし24000人が失明しており、30000人が下肢を失っている。血中グルコース濃度のコントロールは、糖尿病に関連する病的状態及び合併症を顕著に減少する。
【0003】
糖尿病には二つの型(タイプ)が存在する。I型は体がβ細胞の破壊のためインシュリ
ンを産生することができない疾患であり、II型は、体が体内のインシュリン抵抗性の増大によりインシュリンを十分に利用できない疾患である。糖尿病患者の90%以上がII型である。
【0004】
グリブリド及びグリメピリドのようなスルホニルウレア剤の投与は、膵臓のβ細胞を刺激して、インシュリン抵抗性を埋め合わせる、更なるインシュリンを産生する。これらのインシュリン分泌促進薬の長期使用は、結果として最終的にβ細胞の終局的枯渇と更なる抵抗性の誘導を引き起こす。インシュリンの一時的な過剰による急性低血糖症は、これらの薬剤のもう一つの副作用である。
メトフォルミンやフェノフォルミンのようなビグアニドはある程度までインシュリン感受性を増強させるが、副作用として乳酸アシドーシス、嘔吐及び下痢が報告されている。
【0005】
TDZ(チアゾリジンジオン)タイプの薬剤が最近、該市場に追加された。これらは、脂肪細胞の分化と、エネルギーの蓄積及び消費に関与する遺伝子の調節のために重要であるPPARγ、ペルオキシゾーム増殖剤応答性受容体γ、の活性化によりインシュリン感受性を増強させることが知られている。TDZ薬剤は顕著にインシュリン感受性を増強し、低血糖症の発生を取り除くが、その一部は重篤な肝毒性問題を有し、そして、レズリン(Rezulin)は、2000年に米国市場から撤収された。現在、研究者は、チアゾリジンジオン官能基に関連する肝毒性活性を回避するために、非TDZ系薬剤を活発に模索している。
【0006】
PPARαは、脂肪酸のβ酸化に関与すると報告されている。クロフィブレートやフェノフィブレートのようなPPARαのリガンドは、顕著にトリグリセリド及びLDLを減少させることが知られている。多くの糖尿病患者は、合併症を悪化する肥満症、異常脂質血症、アテローム性動脈硬化症及び高LDL濃度を伴っているため、血糖異常及び異常脂質血症を同時に直しえるPPARα及びPPARγのデュアルアゴニストを発見するための試みがなされている。例として、JTT−501(H.シンカイ等、Drugs Future、1
999年、24頁)、2−メチル−2{4−[2−(5−メチル−2−アリールオキサゾール−4−イル)エトキシ]フェノキシ}プロピオン酸(ダウン(Dawn)A.ブルークス(Brooks)等、J.Med.Chem.、2001年、44巻、2061−4頁)及び3−[4−(2
−カルバゾール−9−イル−エトキシ)−フェニル]−2−エトキシ−プロピオン酸(P.ソルバーグ(Sauerberg)等、J.Med.Chem.、2001年、44巻、2061−4頁)が挙げられる。
【非特許文献1】H.シンカイ等、Drugs Future、1999年、24頁
【非特許文献2】ダウン(Dawn)A.ブルークス(Brooks)等、J.Med.Chem.、2001年、44巻、2061−4頁
【非特許文献3】P.ソルバーグ(Sauerberg)等、J.Med.Chem.、2001年、44巻、2061−4頁
【発明の開示】
【0007】
発明の概要
本発明は、血糖、インシュリン及び脂肪酸を低下するのに効果的であるにも拘らず、典型的なPPARα及びPPARγ類の構造に属さない新しい分類の化合物である、式Iの一般式で表される化合物に関する。式Iの一般式で表される化合物は、現行の薬剤及び候補物質を超える有利な効果を有する新しい分類の薬剤としての可能性を有する。
【0008】
本発明は、式Iで表される新規なクロマン−3−カルボン酸及びその誘導体又はそれらの薬学的に許容される塩及びプロドラッグに関する。
【化1】

ここで、R1、R1´、R2、R3、R3´、R4、R5、R6、R7、m、n、W、Y及びそ
の不斉特性は、以下で定義された通りである。本発明はまた、式Iで表される化合物の有効量を医薬的に許容されるキャリア又は賦形剤と混合して含有する医薬組成物を含む。本発明は糖尿病及びその関連する代謝性疾患の治療、コントロール及び予防において有用である医薬的に活性な化合物の新しいクラスを提供するため、技術の進歩をもたらすものである。
【0009】
生物学的検定法において、式Iで表される化合物はdb/db及びob/obマウスにおいてグルコース、インシュリン、遊離脂肪酸の顕著な減少を示し、そのため、ヒトにおいて同様の効果を発揮することが期待されるが、それは、糖尿病、肥満症、アテローム性動脈硬化症、血管炎症及びそれらの関連疾患の治療、コントロール及び予防のために適用し得るものである。
【図面の簡単な説明】
【0010】
【図1】図1はインシュリン100nMの存在下の2−デオキシ−D−グルコース取り込みにおける本発明の化合物(50μM)の効果を示したものである。
【図2】図2はインシュリン100nMの存在下の、本発明化合物の0ないし100μMの範囲の用量依存様式における2−デオキシ−D−グルコース取り込みでの本発明の化合物の効果を示したものである。
【図3】図3は本発明化合物の50μMの存在下におけるインシュリンの0.1ないし1,000nMの範囲の用量依存様式における2−デオキシ−D−グルコース取り込みでの本発明の化合物の効果を示したものである。
【発明を実施するための最良の形態】
【0011】
本発明の詳細な説明
【化2】

ここに示す分類の化合物は、種々の抗糖尿病性化合物に観られる、1,3−チアゾリジンジオン部分を含まず、またα−アルコキシ/アリールオキシ酢酸構造も含まない。しかし、それは、ob/ob及びdb/dbマウスにおいて強力な血中グルコース低下効果を示す。それらは、同様に優れた脂肪酸低下効果を示す。これらの化合物は糖尿病又は高血糖症、神経障害、腎症、網膜症、肥満症のようなその関連疾患及び同様に、高脂血症又はアテローム性動脈硬化症、炎症性疾病のようなその関連疾患の治療及びコントロールのための優れた可能性を有する。本発明は、式Iで表される構造を有する化合物及びその医薬的に許容される塩、医薬的に許容されるキャリアにおける式Iで表される化合物の混合物並びにこれらの化合物のプロドラッグを含む。
【0012】
式Iで表される化合物において、R1、R1´、R2、R3及びR3´は独立して、H、炭
素原子数1ないし7のアルキル基、炭素原子数2ないし7のアルケニル基、炭素原子数2ないし7のアルキニル基、−Ar及びハロゲン原子{ここで、アルキル基、アルケニル基及びアルキニル基は直鎖若しくは分岐しており、及び(a)1ないし7個のハロゲン原子及び/又は(b)(i)1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基及び(ii)ハロゲン原子、炭素原子数1ないし5のアルキル基及び直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし3個の基で任意に置換されたフェニル基から独立して選択された1ないし3個の基で任意に置換され;
【0013】
Arはアリール基、ヘテロアリール基及びベンゾヘテロ環{ここで、アリール基、ヘテロアリール基及びベンゾヘテロ環は、ハロゲン原子、炭素原子数1ないし5のアルキル基、炭素原子数2ないし5のアルケニル基、炭素原子数2ないし5のアルキニル基、−O炭素原子数1ないし5のアルキル基、−O炭素原子数2ないし5のアルケニル基、−O炭素原子数2ないし5のアルキニル基、−SOx炭素原子数1ないし5のアルキル基、−SOxNRaRb、−SOxフェニル基、−C(O)炭素原子数1ないし3のアルキル基及び−C(
O)NRaRb(それぞれの場合において、各アルキル基、アルケニル基及びアルキニル基は直鎖若しくは分岐しており、及び(a)1ないし7個のハロゲン原子及び/又は(b)(i)1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基及び(ii)ハロゲン原子、炭素原子数1ないし5のアルキル基及び直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし3個の基で任意に置換されたフェニル基から独立して選択された1ないし3個の基で任意に置換され;
【0014】
xは1又は2から選択され、アリール基は、炭素環式6ないし10員の単環性又は2環性
の芳香族環系であり、ヘテロアリール基は環の周囲にN、S、Oから独立して選択される1ないし4個のヘテロ原子を有する5又は6員の飽和の又は部分的に不飽和の単環性のヘテロ環(ここで、Nは所望によりNRaであり得、及びSは所望によりSO又はSO2であり得る。)であり、ベンゾヘテロ環は、飽和の、部分的に不飽和の又は芳香族性の5又は6員のヘテロ環(ここで、該ヘテロ環は環の周囲にN、S、Oから独立して選択される1ないし3個のヘテロ原子を含み、Nは所望によりNRaであり得、及びSは所望によりS
O又はSO2であり得る。)及びベンゼン環を含み;
【0015】
Ra及びRbは、H、炭素原子数1ないし5のアルキル基、炭素原子数2ないし5のアルケニル基、炭素原子数2ないし5のアルキニル基、−C(O)炭素原子数1ないし5のアルキル基、−C(O)炭素原子数2ないし5のアルケニル基、−C(O)炭素原子数2ないし5のアルキニル基、SO1-2炭素原子数1ないし5のアルキル基、SO1-2フェニル基、ハロゲン原子及びフェニル基(ここで、全ての場合、アルキル基、アルケニル基及びアルキニル基は直鎖若しくは分岐しており、及び(a)1ないし7個のハロゲン原子及び/又は(b)(i)1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基及び(ii)ハロゲン原子、炭素原子数1ないし5のアルキル基及び直鎖若しくは分岐し、1ないし5個のハロゲン原子(ここで、ハロゲン原子はフッ素原子、塩素原子、臭素原子及びヨウ素原子から選択される。)で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし3個の基で任意に置換されたフェニル基から独立して選択された1ないし3個の基で任意に置換される。)からなる群より選択される。)から独立して選択された1ないし5個の置換基で、どの場合も任意に置換されている。)からなる群より選択される。}から選択され;
m及びnは独立して0又は1ないし6の整数から選択され;
【0016】
R4及びR5は独立して、H、ハロゲン原子、炭素原子数1ないし7のアルキル基、炭素原子数2ないし7のアルケニル基、炭素原子数2ないし7のアルキニル基、−OH、−O炭素原子数1ないし5のアルキル基、−O炭素原子数2ないし5のアルケニル基、−O炭素原子数2ないし5のアルキニル基、−C(O)炭素原子数1ないし5のアルキル基、−C(O)炭素原子数2ないし5のアルケニル基、−C(O)炭素原子数2ないし5のアルキニル基、−C(O)O炭素原子数1ないし5のアルキル基、−C(O)O炭素原子数2ないし5のアルケニル基、−C(O)O炭素原子数2ないし5のアルキニル基、Ar、−OAr、−C(O)Ar、−炭素原子数3ないし8のシクロアルキル基、−O炭素原子数3ないし8のシクロアルキル基、SOx炭素原子数1ないし5のアルキル基、−SOxNRa
Rb、−SOxAr及び−C(O)NRaRb(それぞれの場合において、各アルキル基、アルケニル基及びアルキニル基は直鎖若しくは分岐しており、及び(a)1ないし5個のハロゲン原子及び/又は(b)直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし2個の基で任意に置換される。)から選択され;
【0017】
Yは−O、−CRaRb、−NRa、−SO及び−SO2(式中、Ra及びRbは、H、炭素原子数1ないし5のアルキル基、炭素原子数2ないし5のアルケニル基、炭素原子数2ないし5のアルキニル基、−C(O)炭素原子数1ないし5のアルキル基、−C(O)炭素原子数2ないし5のアルケニル基、−C(O)炭素原子数2ないし5のアルキニル基、SO1-2炭素原子数1ないし5のアルキル基、SO1-2フェニル基、ハロゲン原子及びフェニル基(ここで、全ての場合、アルキル基、アルケニル基及びアルキニル基は直鎖若しくは分岐しており、及び(a)1ないし7個のハロゲン原子及び/又は(b)(i)1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基及び(ii)ハロゲン原子、炭素原子数1ないし5のアルキル基及び直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし3個の基で任意に置換されたフェニル基から独立して選択された
1ないし3個の基で任意に置換される。)からなる群より選択される。)から選択され;
【0018】
R6及びR7は独立して、H、炭素原子数1ないし7のアルキル基、炭素原子数2ないし7のアルケニル基、炭素原子数2ないし7のアルキニル基及びAr(ここで、それぞれの場合において、アルキル基、アルケニル基及びアルキニル基は直鎖若しくは分岐しており、及び(a)1ないし5個のハロゲン原子及び/又は(b)直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし2個の基で任意に置換され、Arはアリール基、ヘテロアリール基及びベンゾヘテロ環(ここで、アリール基、ヘテロアリール基及びベンゾヘテロ環は、ハロゲン原子、炭素原子数1ないし5のアルキル基、炭素原子数2ないし5のアルケニル基、炭素原子数2ないし5のアルキニル基、−O炭素原子数1ないし5のアルキル基、−O炭素原子数2ないし5のアルケニル基、−O炭素原子数2ないし5のアルキニル基、−SOx炭素原子数1ないし5のアルキル基、−SOxNRaRb、−SOxフェニル基、−C
(O)炭素原子数1ないし3のアルキル基及び−C(O)NRaRb(それぞれの場合において、アルキル基、アルケニル基及びアルキニル基は直鎖若しくは分岐しており、及び(a)1ないし7個のハロゲン原子及び/又は(b)(i)1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基及び(ii)ハロゲン原子、炭素原子数1ないし5のアルキル基及び直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし3個の基で任意に置換されたフェニル基から独立して選択された1ないし3個の基で任意に置換され、Ra及びRbは上記と同様であり、及びXは1ないし2の整数から選択される。)から独立して選択された1ないし5個の置換基で、どの場合も任意に置換されている。)からなる群より選択される。)から選択され;及び
【0019】
Wは、−ORa、−NRaRb、−NRaSO2Rb(式中、Ra及びRbは独立して、H、炭素原子数1ないし4のアルキル基及びアリール基(ここで、全ての場合、アルキル基は直鎖若しくは分岐しており、及び(a)1ないし7個のハロゲン原子及び/又は(b)(i)1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基及び(ii)ハロゲン原子、炭素原子数1ないし5のアルキル基及び直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし3個の基で任意に置換されたフェニル基から独立して選択された1ないし3個の基で任意に置換される。)からなる群より選択される。)からなる群より選択される。
【0020】
本発明に従うC3位の立体配置の化合物は、(S)、(R)又は(S)/(R)混合物
を含む。好ましくは、R1、R1´、R2、R3、R3´、R4及びR5は独立して、H、Cl
、Br、F、−O炭素原子数1ないし4のアルキル基及び炭素原子数1ないし4のアルキル基からなる群より選択され、前記アルキル基は直鎖又は分岐鎖であり、1ないし3個のハロゲン原子で任意に置換される。より好ましくは、R1、R1´、R2、R3、R3´、R4及びR5は全て水素原子である。
【0021】
以下の説明は式Iにより包含される基の定義である。
用語“アルキル基”は1ないし7個の炭素原子を有する直鎖又は分岐鎖の炭化水素を意味し、例えば、他に定義されない限り、メチル基、エチル基、n−プロピル基、n−ブチル基、第二ブチル基、イソブチル基、第三ブチル基、n−ペンチル基、n−ヘキシル基等を含む。
【0022】
用語“ハロゲン原子”は、フッ素原子、塩素原子、臭素原子及びヨウ素原子を含む;より好ましいハロゲン原子は、フッ素原子及び塩素原子である。
【0023】
用語“アルケニル基”は少なくとも1つの炭素−炭素二重結合を含む炭素鎖を意味し、それは直鎖若しくは分岐鎖又はそれらの組合せであり得る。アルケニル基の例としては、ビニル基、アリル基、イソプレニル基、ブテニル基、ペンテニル基、ヘキセニル基、ヘプテニル基等を含む。
【0024】
用語“アルキニル基”は1つの炭素−炭素三重結合を含む炭素鎖を意味し、それは直鎖若しくは分岐鎖又はそれらの組合せであり得る。アルキニル基の例としては、アセチレニル基、アリル基、プロパルギル基、3−メチル−1−ペンチニル基等を含む。
【0025】
用語“アリール基”は炭素環のみを含む単環又は2環性の芳香環を意味する。
ここで、置換基を有するアリール基は、6ないし10員の単環性の又は2環性の環系である。アリール基の例としては、フェニル基及びナフチル基、同様に、インダニル基、インデニル基及びテトラヒドロナフチル基を含む。フェニル基が最も好ましい。該用語にはまた、単環性シクロアルキル基又は単環性ヘテロ環基に縮合したアリール基も記載し得る。
【0026】
用語“ヘテロ環”は、他に定義されない限り、N、S及びOから選択される少なくとも1個のヘテロ原子を含む完全に又は部分的に飽和された単環性又は多環性の環系を意味し、該環のそれぞれは、3ないし10個の原子を有する。ヘテロ環基に縮合したアリール基の例としては、2,3−ジヒドロベンゾフラニル基、ジヒドロベンゾピラニル基等を含む。ヘテロ環の例としては、テトラヒドロフラン、ピペラジン、テトラヒドロピラン及びモルフィンを含む。
【0027】
用語“ヘテロアリール基”はそれぞれの環が5ないし6個の原子を含む、環の周囲にN、O及びS(SO及びSO2を含む。)から選択される1ないし4個の環へテロ原子を含
む単環、2環又は3環性の芳香環を意味する。ヘテロアリール基の例としては、ピロリル基、イソキサゾリル基、イソチアゾリル基、ピラゾリル基、ピリジル基、オキサゾリル基、オキサジアゾリル基、チアジアゾリル基、チアゾリル基、イミダゾリル基、トリアゾリル基、テトラゾリル基、フラニル基、トラジニル基、チエニル基、ピリミジル基、ピリダザニル基、ピラジニル基、ベンズイソキサゾリル基、ベンズオキサジリル基、ベンゾチアゾリル基、ベンズイミダゾリル基、ベンゾフラニル基、ベンゾチオフェニル基、キノリル基、インドリル基、イソキノリル基、ジベンゾフラン等を含む。
【0028】
用語“組成物”は活性成分及びキャリアを構成する不活性成分を含む生成物、並びに、如何なる2種若しくはそれ以上の前記成分の組合せ、複合若しくは凝集からの又は1種若しくはそれ以上の前記成分の解離からの又は1種若しくはそれ以上の前記成分の他のタイプの反応若しくは相互作用からの、直接的若しくは間接的な結果として得られる如何なる生成物を包含することを意図する。従って、本発明の組成物は本発明の化合物及び医薬的に許容されるキャリアを混合することにより製造される如何なる組成物をも包含する。
【0029】
用語“医薬的に許容される塩”は無機若しくは有機塩基又は有機塩基及び無機若しくは有機酸を含む医薬的に許容される非毒性の塩基又は酸から生成される塩を意味する。無機塩基から誘導される塩は、アルミニウム、アンモニウム、カルシウム、銅、鉄、リチウム、マグネシウム、マンガン、カリウム、ナトリウム、亜鉛等を含む。特に好ましいものは、アンモニウム、カルシウム、マグネシウム、カリウム及びナトリウムの塩である。医薬的に許容される有機非毒性塩基から誘導された塩は、1級、2級、3級アミンの塩、アルギニン、ベタイン、カフェイン、コリン等のような天然由来の置換アミンを含む置換アミンの塩を含む。本発明の化合物が塩基性の場合、塩は、無機及び有機酸を含む医薬的に許容される非毒性の酸から生成されうる。そのような酸としては、酢酸、ベンゼンスルホン酸、安息香酸、カンファースルホン酸、クエン酸、フマル酸、グルコン酸、グルタミン酸
、塩酸、臭化水素酸、乳酸、マレイン酸、リンゴ酸、マンデル酸、メタンスルホン酸、粘液酸、硝酸、パモン酸、リン酸、コハク酸、硫酸、酒石酸、p−トルエンスルホン酸等を含む。特に好ましくは、クエン酸、臭化水素酸、塩酸、マレイン酸、リン酸、硫酸及び酒石酸が挙げられる。
ここで用いられる、式Iで表される化合物の参照例は、その医薬的に許容される塩をも含むことを意図すると理解できる。
【0030】
合成方法
一つの態様において、本発明の化合物は以下のようにして生成することができる:
クロマン−3−カルボン酸部分はスキーム1に記載されるように2−ヒドロキシ−4−ベンジロキシベンズアルデヒドから出発して合成される。
【化3】

環化は炭酸カリウムの存在下、155℃において、NMP中で達成され、その後の水素化はt−ブチル7−ヒドロキシ−クロマン−3−カルボン酸エステルを与える。ブチル7−ヒドロキシ−クロマン−3−カルボン酸エステルは、光延反応又はウイリアムソンのエーテル合成の何れかにより、種々の“左”側分子に連結される。t−ブチル基はその後、脱保護されてカルボン酸(1)を与え、これらの酸は更に対応するアミド又はスルホンアミド化合物へ変性される。ホモカルボン酸(14)はカルボン酸官能基をメシレートにし、その後のメシレートのシアニドによる求核置換及び加水分解により合成される。
【0031】
これらの化合物はグルコース及び遊離脂肪酸の低下において有効である。これらの化合物はまた、ITT(インシュリン負荷試験)及びOGTT(経口グルコース負荷試験)に
おいてインシュリン及びグルコース量の顕著な減少(AUC)を示すが、これらはインシュリン感受性化合物で観察される典型的な現象である。これらの化合物はヒトにおけるインシュリン非依存性糖尿病(NIDDM)及び腎症、神経障害及び網膜症のようなその関連する合併症の治療及びコントロールにおいて、同様に、肥満症及び高脂血症、異常脂質血症、高コレステロール血症、高トリグリセリド血症、アテローム性動脈硬化症のようなその関連疾患の治療及びコントロールにおいて有効であることが期待される。
【0032】
代謝物−プロドラッグ
本発明はまた、クレームされた化合物の活性代謝物を含む。患者に投与されたとき、又は患者に投与された後に、クレームされた化合物へ変換される化合物であるプロドラッグもまた、クレームされた活性化合物の範囲内に含まれる。本発明のカルボン酸のプロドラッグの非限定の例は、カルボン酸基のエステル、例えば直鎖又は分岐鎖であり得る炭素原子数1ないし6のエステル又は患者に投与された後、より容易に加水分解され易くする官能基を有するエステルであり得る。同様に、1級及び2級アミン及び種々の置換アミンのアミドもまた含まれる。
【0033】
投与及び投与量範囲
全ての好適な投与経路が、本発明の化合物の有効量を、哺乳動物、特にヒトへ提供するために使用される。例えば、経口、直腸、局所、非経口、眼内、経肺、経鼻等が使用される。投与形態は錠剤、トローチ剤、分散剤、懸濁液、溶液、カプセル、クリーム、軟膏、エアロゾル等を含む。好ましくは、式Iで表される化合物は経口で投与される。
【0034】
使用される活性成分の有効投与量は使用される特定の化合物、投与形態、治療される病気及び治療される病気の重症度に依存して変化する。そのような投与量は当業者により容易に確定され得る。糖尿病及び/又は高血糖症又は高トリグリセリド血症又は他の疾患を治療又は予防する際、式Iで表される化合物が指示されると、本発明の化合物が患者の体
重1kgあたり約0.1mgないし100mgの1日投与量で投与され、好ましくは1日1回又は分割された用量で2−6回/日として与えられ、又は持続放出形態において投与される場合、通常、好結果が得られる。より大きな哺乳類のためには、総1日投与量は約1mgないし1g、好ましくは約1ないし50mgである。70kgの成人の場合、総1日投与量は通常、約7mgないし350mgとなる。この用量は任意の治療反応をもたらすために調整され得る。
【0035】
医薬組成物
本発明のもう一つの観点として式Iで表される化合物及び医薬的に許容されるキャリア
を含む医薬組成物を提供する。前述のような、経口、経鼻、非経口等のような投与の種々の形態のために、式Iで表される化合物、その塩及び/又はそのプロドラッグは慣用の医
薬品配合技術に従う医薬キャリアの混合物中に活性成分として組み合わせることができる。該キャリアは、投与形態に依存して変化し、水、グリコール、油、アルコール、香料、保存剤、着色剤、甘味料等のような多様なキャリアから選択され得る。キャリアはまた、ハード及びソフトカプセル錠のために、澱粉、糖、セルロース、結合剤等及び懸濁液のために水、アルコール、グリセロール、セルロース、油等を含む。
【0036】
併用療法
式Iで表される化合物は、最適な医薬特性を更に高め得る他の薬剤と併用して使用し得る。併用療法は、前述の目的疾患の有効性を更に高めるために、又は、症状のより広範囲をカバーするために、又は、毒性を低下させるために、又は、薬物速度論的特性を高めるために使用され得る。好ましい効果は、糖尿病疾患に伴う疾患及び合併症の治療及びコントロールのための有効性の増強である。式Iで表される化合物と併用して、及び別々に或いは同一の医薬組成物中で投与され得る他の活性成分の例は、限定されないが、以下を含
む:
(a)(i)メトフォルミン及びフェンフォルミンのようなビグアニド、(ii)ピオグリタゾン、ロシグリタゾン及びエングリタゾンのようなPPARγアゴニスト(iii)プロテインチロシンフォスファターゼ−1B(PTP−1B)阻害剤、及び(iv)ジペプチジルペプチダーゼIV阻害剤を含むインシュリン感受性改善剤;
(b)インシュリン及びインシュリン様物質;
(c)トルブタミド及びグリブリドのようなスルホニルウレア;
(d)α−グリコシダーゼ阻害剤;
(e)HMG−CoA還元酵素阻害剤(ロバスタチン、プラバスタチン、フルバスタチン、アトロバスタチン、イタバスタチン、リバスタチン、シンバスタチン及び他のスタチン)のようなコレステロール低下剤;
(f)フェンフルラミン及びデクスフェンフルラミンのような抗肥満化合物;
(g)MBX−102のようなシクロオキシナーゼ−2(COX−2)阻害剤;及び
(h)オルリスタットのようなリパーゼ阻害剤。
【0037】
好ましくは、哺乳類患者におけるアテローム性動脈硬化症を治療、予防又はコントロールするために、式Iで表される化合物の有効量及びロバスタチン、プラバスタチン、フルバスタチン、アトロバスタチン、イタバスタチン及びリバスタチンを含むスタチンのようなHMG−CoA還元酵素阻害剤の有効量が投与され得る。
【0038】
本発明は更に、上述の何れかの化合物及び医薬的に許容されるキャリアを含む医薬的に許容される組成物を含む。
【実施例】
【0039】
以下の実施例は、本発明の化合物の製造方法を含む本発明を提示するために提供され、いかなる方法によっても本発明を限定しないものと解釈される。本発明の範囲は添付のクレームにおいて定義される。
実施例
本発明の化合物の具体例は、以下に名前で列挙された、実施例1ないし14として提供され、それらの構造は表1に示される。
表1.本発明の化合物の具体例
【表1】

【0040】
実施例1
7−[2−(5−メチル−2−フェニル−4−オキサゾリル)エトキシ]クロマン−3−カルボン酸の製造
【化4】

工程A:下式を有する第三ブチル7−(ベンジロキシ)−2H−クロメン−3−カルボキシレートの製造
【化5】

NMP(30mL)中の4−ベンジロキシ−2−ヒドロキシベンズアルデヒド(11.41g、50mmol)の撹拌溶液に、K2CO3(13.0g、100mmol)を添加し、N2雰囲気下で155℃に加熱した。t−ブチルアクリレート(36.5mL、25
0mmol)を4つに分割した(10、10、10及び6.5mL)。最初の10mLを反応混合物に添加し、155℃で加熱した。残りは2時間間隔の後に添加し、反応混合物は全体で8時間加熱した。反応混合物を室温に冷却し、水(150mL)を添加した。生成物は150mLのエーテルで抽出した。エーテル層を水で2回洗い、乾燥した。エーテル層は50%のヘキサンで希釈し、シリカのパッド(長さ3インチ、直径4インチ)で濾過した。該シリカを50%エーテル/ヘキサン混合液で洗い、溶媒をエバポレートして生成物を淡黄色固体(13g、77%)として得た。
1H NMR:(300MHz、CDCl3):δ7.43−7.38(m、5H)、7.06(d、1H)、6.57(d、1H)、6.50(s、1H)、5.07(s、2H)、4.95(s、2H)、1.48(s、9H).
【0041】
工程B:下式を有する第三ブチル7−ヒドロキシクロマン−3−カルボキシレートの製造
【化6】

第三ブチル7−(ベンジロキシ)−2H−クロメン−3−カルボキシレート(13g)を、水素化瓶中で酢酸エチル(15mL)及びメタノール(5mL)に溶解した。Pd−C(10%)(1g)を添加し、反応混合物を1晩、水素化(H2、70psi及び室温
(RT))した。反応が完結した後、触媒を濾過し、酢酸エチル100mLで洗った。溶媒をエバポレートし、粗生成物をカラムクロマトグラフィー及び酢酸エチルヘキサン混合液を用いて精製し、純粋な生成物6gを得た(2工程の総収率48.3%)。
1H NMR:(300MHz、CDCl3):δ6.95(d、1H)、6.42(d、1H)、6.35(s、1H)、4.63(s、1H)、4.43−4.38(m、1H)、4.10−4.03(m、1H)、2.96−2.86(m、3H)、1.49(s、9H).
Mass m/z:251.2(M+H)
【0042】
工程C:下式を有する第三ブチル7−[2−(5−メチル−2−フェニル−4−オキサゾリル)エトキシ]クロマン−3−カルボキシレートの製造
【化7】

CH3CN(20mL)中の、第三ブチル7−ヒドロキシクロマン−3−カルボキシレ
ート(2.5g、10mmol)の撹拌溶液にK2CO3(4.1g)及び2−(5−メチル−2−フェニル−1,3−オキサゾール−4−イル)エチルメタンスルホネート(3.7g)を添加し、反応混合物を1晩還流下で加熱した。反応混合物を室温まで冷却し、100mLのジエチルエーテルで希釈した。希釈された溶液をシリカのパッドで濾過し、シリカを更にエーテルで洗った。該エーテル溶液をエバポレートして乾固し、シリカクロマトグラフィーを用いて精製した。生成物を白色固体として単離した(2.8g、64.3%)。
1H NMR:(300MHz、CDCl3):δ7.99(d、2H)、7.45−7.43(m、3H)、6.94(d、1H)、6.48(d、1H)、6.40(s、1H)、4.41(t、2H)、4.20(t、2H)、4.08−4.02(m、1H)、3.00−2.92(m、5H)、2.93(s、3H)、1.48(s、9H).
【0043】
工程D:7−[2−(5−メチル−2−フェニル−4−オキサゾリル)エトキシ]クロマン−3−カルボン酸の製造
第三ブチル7−[2−(5−メチル−2−フェニル−4−オキサゾリル)エトキシ]クロマン−3−カルボキシレート(5.2g、11.95mmol)を蟻酸25mL中に溶解し、60℃で12時間加熱した。蟻酸を真空ポンプで除去し、エーテル(25mL)を加え、10分間加熱した。結果として得られた懸濁液を−20℃で1時間冷却し、濾過した。固体生成物を20mLのジエチルエーテルで洗い、乾燥することにより、白色粉末として化合物7−[2−(5−メチル−2−フェニル−4−オキサゾリル)エトキシ]クロマン−3−カルボン酸を得た(3.8g、84%)。
1H NMR:(300MHz、CDCl3):δ8.03−8.00(m、2H)、7.99−7.48(m、3H)、6.98(d、1H)、6.50(d、1H)、6.41(s、1H)、4.42(d、1H)、4.22−4.12(m、3H)、3.60−3.20(brs、1H)、3.09−3.02(m、5H)、2.43(s、3H).
Mass m/z:380.1(M+H)
【0044】
実施例2
7-[2-(5-メチル-2-フェニル-(4-フェニル)フェニル-4-オキサゾリル)エトキシ]ク
ロマン-3-カルボン酸の製造
【化8】

工程A:第三ブチル7-[2-(5-メチル-2-(4-フェニル)フェニル-4-オキサゾリル)エ
トキシ]クロマン-3-カルボキシレートの製造
トルエン(10mL)中の第三ブチル7-ヒドロキシクロマン-3-カルボキシレート(500mg、2mmol)、トリフェニルホスフィン(786.8mg、3mmol)及び2-(5-メチル-2-(4-フェニル)フェニル-1,3-オキサゾール-4-イル)エタノール(672m
g、2.4mmol)の攪拌溶液に窒素雰囲気下で10分間、ジエチルアゾジカルボキシ
レート(372.4mg、3mmol)でゆっくり処理した。添加完了後、反応混合物を6
0℃で8時間加熱した。トルエンを真空下で除去し、残留物を20%酢酸エチル及びヘキサンを溶出液として使用してシリカのカラムクロマトグラフィーにより精製し、生成物を得た(550mg、55%)。
1H NMR:(300MHz、CDCl3):δ8.07(d、2H)、7.71-7.65(m
、4H)、7.49-7.37(m、3H)、6.96(t、1H)、6.43(d、1H)、6.35(s、1H)、4.42(d、1H)、4.22(t、2H)、4.04(t、1H)、3.02-2.90(m、5H)、2.42(s、3H)、1.48(s、9H)
【0045】
工程B:
前工程から得られた第三ブチルエステル(250mg、0.48mmol)をHCO2H(5mL)に溶解し、40℃で7時間加熱した。溶媒を真空ポンプで除去し、残留物を分取
用高速液体クロマトグラフィーで精製した(190mg、87%)。
1H NMR:(300MHz、CDCl3):δ10.17(brs、1H)、8.10(d、2H)、7.75(d、2H)、7.67(d、2H)、7.53-7.43(m、4H)、6.97(d、1H)、6.43(d、1H)、6.39(s、1H)、4.39(d、1H)、4.23-4.10(m、3H)、3.12-2.99(m、5H)、2.48(s、3H)
Mass m/z:456.1(M+H)
【0046】
実施例3
7-[2-(5-メチル-2-(4-フルオロ)フェニル)-4-オキサゾリル)エトキシ]クロマン-3-カルボン酸の製造
【化9】

工程A:第三ブチル7-[2-(5-メチル-2-(4-フルオロ)フェニル)-4-オキサゾリル)エトキシ]クロマン-3-カルボキシレートの製造
トルエン(10mL)中の第三ブチル7-ヒドロキシクロマン-3-カルボキシレート(750mg、3mmol)、トリフェニルホスフィン(864mg、3.3mmol)及び2-(
5-メチル-2-(4-フルオロ)フェニル-1,3-オキサゾール-4-イル)エタノール(752mg、3.3mmol)の攪拌溶液を、窒素雰囲気下で10分間ジエチルアゾジカルボキ
シレート(574.5mg、3.3mmol)でゆっくり処理した。添加完了後、反応混合
物を60℃で17時間加熱した。トルエンを真空下で除去し、残留物を20%酢酸エチル及びヘキサンを溶出液として使用してシリカのカラムクロマトグラフィーにより精製し、生成物を得た(510mg、36%)。
1H NMR:(300MHz、CDCl3):δ8.01-7.96(m、2H)、7.15(d
、2H)、6.97(d、1H)、6.48(d、1H)、6.41(s、1H)、4.40(d、1H)、4.20(t、2H)、4.04(t、1H)、2.99-2.88(m、5H)、2.39(s、3H)、1.48(s、9H)
【0047】
工程B:
前工程から得られた第三ブチルエステル(250mg、0.55mmol)をHCO2H(5mL)に溶解し40℃で6時間加熱した。溶媒を真空ポンプで除去し、残留物を分取用
高速液体クロマトグラフィーで精製した(197mg、90%)。
1H NMR:(300MHz、CDCl3):δ8.01-7.97(m、2H)、7.14(t
、2H)、6.98(d、1H)、6.51(d、1H)、6.43(s、1H)、4.41(d、1H)、4.21-4.11(m、3H)、3.06-2.95(m、5H)、2.39(s、3H)
Mass m/z:398.2(M+H)
【0048】
実施例4
7-[2-(5-メチル-2-チエン-2-イル-1,3-オキサゾール-4-イル)エトキシ]クロマ
ン-3-カルボン酸の製造
【化10】

工程A:第三ブチル7-[2-(5-メチル-2-チエン-2-イル-1,3-オキサゾール-4-イ
ル)エトキシ]クロマン-3-カルボン酸の製造
2-(5-メチル-2-チエン-2-イル-1,3-オキサゾール-4-イル)エチルメタンスルホネート(947mg、3.3mmol)、第三ブチル7-ヒドロキシクロマン-3-カルボキ
シレート(750mg、3mmol)及び炭酸カリウム(1.24g、9mmol)をCH3
CN中で混合し、N2雰囲気下で一晩還流させた。反応完了(TLC)後、反応混合物を室
温まで冷却しジエチルエーテル30mLで希釈し小さいシリカパッドを通して通過させた。シリカをエーテル100mLで洗浄し、エーテル溶液を蒸発させ生成物を得、これを酢酸エチル及びヘキサンを溶出液に使用するシリカのカラムクロマトグラフィーにより精製した(699mg、53%)。
1H NMR:(300MHz、CDCl3):δ7.60(d、1H)、7.39(t、1H)、
7.11(d、1H)、6.96(d、1H)、6.47(d、1H)、6.40(s、1H)、4.40(d、1H)、4.21-4.16(m、3H)、4.04(t、1H)、2.98-2.93(m、5H)、2.38(s、3H)、1.48(s、9H)。
【0049】
工程B:7-[2-(5-メチル-2-チエン-2-イル-1,3-オキサゾール-4-イル)エトキシ]クロマン-3-カルボン酸の製造
前工程から得られた第三ブチルエステル(400mg、0.9mmol)を前述の実施例1の工程Dにおける手順により、遊離酸に転換した(320mg、91%)。
1H NMR:(300MHz、DMSO-D6):δ7.74(d、1H)、7.61(d、1H)、7.18(d、1H)、6.99(d、1H)、6.45(d、1H)、6.33(s、1H)、4.30(d、1H)、4.14-4.05(m、3H)、2.95-2.85(m、5H)
、2.34(s、3H)。
Mass m/z:386.2(M+H)
【0050】
実施例5
7-[2,5ジフェニル-4-オキサゾリル]エトキシ]クロマン-3-カルボン酸の製造
【化11】

工程A:第三ブチル7-[2,5ジフェニル-4-オキサゾリル]エトキシ]クロマン-3-カルボキシレートの製造
トルエン(15mL)中の第三ブチル7-ヒドロキシクロマン-3-カルボキシレート(750mg、3mmol)、トリフェニルホスフィン(1.1g、4.5mmol)及び2,5-ジフェニル-(1,3-オキサゾール-4-イル)エタノール(946mg、3.6mmol)の攪拌溶液を、窒素雰囲気下で10分間ジエチルアゾジカルボキシレート(783mg、4
.5mmol)でゆっくり処理した。添加完了後、反応混合物を60℃で19時間加熱し
た。トルエンを真空下で除去し、残留物を20%酢酸エチル及びヘキサンを溶出液に使用するシリカのカラムクロマトグラフィーにより精製し、生成物を得た(450mg、29
.4%)。
1H NMR:(300MHz、CDCl3):δ8.12(d、2H)、7.82(d、2H)、
7.53-7.36(m、6H)、6.97(d、1H)、6.48(d、1H)、6.43(s、1H)、4.41-4.4=32(m、3H)、4.03(t、1H)、3.31(t、2H)、2.96−2.86(m、3H)、1.48(s、9H)
【0051】
工程B:7-[2,5ジフェニル-4-オキサゾリル)エトキシ]クロマン-3-カルボン酸の製造
前工程から得られた第三ブチルエステル(300mg、0.58mmol)を前述の実施
例1の工程Dにおける手順により、遊離酸に転換した(210mg、81%)。
1H NMR:(300MHz、CDCl3):δ8.11(d、2H)、7.81(d、2H)、
7.52-7.36(m、6H)、6.97(d、1H)、6.51(d、1H)、6.45(s、1H)、4.44‐4.35(m、3H)、4.17(t、1H)、3.32(t、2H)、
3.06‐2.96(m、3H)
Mass m/z:442.2(M+H)
【0052】
実施例6
7-[(2-フェニル-5-メチル-1,3-オキサゾール-4-イル)メトキシ]クロマン-3-カルボン酸の製造
【化12】

工程A:第三ブチル-7-[(2-フェニル-5-メチル-1,3-オキサゾール-4-イル)メトキシ]クロマン-3-カルボキシレートの製造
4-(クロロメチル)-5-メチル-2-フェニル-1,3-オキサゾール(103.5mg、0.5mmol)及び炭酸カリウム(138.4mg、1mmol)の攪拌溶液に第三ブチル
7-ヒドロキシクロマン-3-カルボキシレート(125mg、0.5mmol)を添加し、
反応混合物を室温で48時間攪拌した。水(50mL)を添加し、沈殿した生成物をジエチルエーテル25mLで抽出した。エーテル層を水(25mL)で2回洗浄し、乾燥した。溶媒をエバポレートし、淡黄色粘性物質として生成物を得た(150mg、36%)。
1H NMR:(300MHz、CDCl3):δ8.02(d、2H)、7.54(s、3H)、
7.02(d、1H)、6.55(d、1H)、6.48(s、1H)、5.04(s、2H)、4.41(d、1H)、4.40(t、1H)、3.02-2.80(m、3H)、2.50(s、3H)
【0053】
工程B:7-[(2-フェニル-5-メチル-1,3-オキサゾール-4-イル)メトキシ]クロマン-3-カルボン酸の製造
前工程から得られた第三ブチルエステル(100mg、0.24mmol)を前述の実施例1の工程Dにおける手順により、遊離酸に転換した(76mg、88%)。
1H NMR:(300MHz、CDCl3):δ8.04(d、2H)、7.48-7.47(m
、3H)、7.02(d、1H)、6.60(d、1H)、6.52(s、1H)、4.96(s、2H)、4.43(d、1H)、3.99(t、1H)、3.80-3.50(brs、1H)、3.08‐2.80(m、3H)、2.47(s、3H)
Mass m/z:366.0(M+H)
【0054】
実施例7
7-[3-(5-メチル-2-フェニル-4-オキサゾリル)プロポキシ]クロマン-3-カルボン酸
の製造
【化13】

工程A:第三ブチル-7-[3-(5-メチル-2-フェニル-4-オキサゾリル)プロポキシ]クロマン-3-カルボキシレートの製造
CH3CN(10mL)中の第三ブチル7-ヒドロキシクロマン-3-カルボキシレート(2
50mg、1mmol)の攪拌溶液にK2CO3(414mg)及び3-(5-メチル-2-フェニル-1,3-オキサゾール-4-イル)プロピルメタンスルホネート(325mg)を添加し、
反応混合物を一晩還流下で加熱した。反応混合物を室温まで冷却し、ジエチルエーテル30mLで希釈した。希釈された溶液をシリカパッドを通じて通過させ、シリカを更なるエーテルで洗浄した。エーテル溶液をエバポレートして乾固し、シリカクロマトグラフィーを用いて精製した。生成物は白色固体として単離された(397mg、88%)。
1H NMR:(300MHz、CDCl3):δ8.05(d、2H)、7.55(t、2H)、
6.98(d、1H)、6.46(d、1H)、6.37(s、1H)、4.40(d、1H)、4.06(t、1H)、3.93(t、2H)、2.96‐2.85(m、5H)、2.37(
s、3H)、2.20‐2.12(m、2H)、1.46(s、9H)
【0055】
工程B:7-[3-(5-メチル-2-フェニル-4-オキサゾリル)プロポキシ]クロマン-3-カ
ルボン酸の製造
前工程から得られた第三ブチルエステル(100mg、0.22mmol)を前述の実施例1の工程Dにおける手順により、遊離酸に転換した(89mg、100%)。
1H NMR:(300MHz、CDCl3):δ8.00(d、2H)、7.44(t、3H)、
6.98(d、1H)、6.51(d、1H)、6.41(s、1H)、4.42(d、1H)、4.15(t、1H)、3.95(t、2H)、3.07‐3.03(m、3H)、2.71(
t、2H)、2.71(s、3H)、2.14(p、2H)
Mass (m/z):394.2(M+H)
【0056】
実施例8
7-[(2-フェニル-5-メチル-1,3-オキサゾール-4-イル)メトキシ]N-(フェニルスルホニル)クロマン-3-カルボキサミドの製造
【化14】

ベンゼンスルホンアミド(760mg、5mmol)、ジメチルアミノピリジン(134
mg、1.1mmol)及び7-[2-(5-メチル-2-フェニル-4-オキサゾール)エトキシ]クロマン-3-カルボン酸(379mg、1mmol)の攪拌溶液にジイソプロピルカルボジイミド(0.234ml、1.5mmol)を添加し、反応混合物をジクロロメタン(5m
L)中で一晩室温で攪拌した。CH2Cl2を除去し、残留物をアセトン(5ml)に溶解し
、濾過した。濾液を分取用LCMSにより直接精製した(189mg、36.4%)。
1H NMR:(300MHz、CDCl3):δ8.84(brs、1H)、7.99-7.97(m、5H)、7.66‐7.44(m、5H)、6.89(d、1H)、6.50(d、1H)、6.40(s、1H)、4.29‐4.06(m、4H)、3.03‐2.85(m、5H)、2.41(s、3H)
Mass (m/z):519.0(M+H)
【0057】
実施例9
7-[(2-フェニル-5-メチル-1,3-オキサゾール-4-イル)メトキシ]N-(メチルスルホニル)クロマン-3-カルボキサミドの製造
【化15】

メタンスルホンアミド(475mg、5mmol)、ジメチルアミノピリジン(134m
g、1.1mmol)及び7-[2-(5-メチル-2-フェニル-4-オキサゾリル)エトキシ]クロマン-3-カルボン酸(379mg、1mmol)の攪拌溶液にジイソプロピルカルボジイミド(0.234mL、1.5mmol)を添加し、反応混合物をジクロロメタン(5mL)中で一晩室温で攪拌した。CH2Cl2を除去し、残留物をアセトン(5ml)に溶解し、濾過した。濾液を分取用LCMSにより直接精製した(260mg、57%)。
1H NMR:(300MHz、CDCl3):δ8.27(s、1H)、8.01(d、2H)、
7.47(t、3H)、6.99(d、1H)、6.53(d、1H)、6.43(s、1H)、4.33‐4.20(m、4H)、3.30(s、3H)、3.07‐2.94(m、5H)、2.43(s、3H)。
Mass m/z:457.0(M+H)
【0058】
実施例10
7-[(2-(4-ブロモフェニル)-5-メチル-1,3-オキサゾール-4-イル)メトキシ]クロ
マン-3-カルボン酸の製造
【化16】

工程A:第三ブチル-7-[(2-(4-ブロモフェニル)-5-メチル-1,3-オキサゾール-4-イル)メトキシ]クロマン-3-カルボキシレートの製造
第三ブチル7-ヒドロキシクロマン-3-カルボキシレート(1.1g、4.4mmol)
及び炭酸カリウム(1.1g、8mmol)の攪拌懸濁液に2-(4-ブロモフェニル)-4-(
クロロメチル)-5-メチル-1,3-オキサゾール(1.14g、4mmol)を添加し、反
応混合物を60℃で一晩攪拌した。反応完了後、水(40ml)を添加し、沈殿した生成物を酢酸エチル(60ml)で抽出した。有機層を水50mlで2回洗浄し乾燥した。乾燥された溶液をエバポレートし、褐色固体として生成物を得た(1.55g、77.4%)。
1H NMR:(300MHz、CDCl3):δ7.90(d、2H)、7.59(d、2H)、
7.00(d、1H)、6.54(d、1H)、6.51(s、1H)、4.94(s、2H)、4.42(d、1H)、4.07(t、1H)、2.95-2.75(m、3H)、2.45(s、3H)、1.49(s、9H)
【0059】
工程B:7-[(2-(4-ブロモフェニル)-5-メチル-1,3-オキサゾール-4-イル)メトキシ]クロマン-3-カルボン酸の製造
前工程から得られた第三ブチルエステル(500mg、1mmol)を前述の実施例1の工程Dにおける手順により、遊離酸に転換した(389mg、86%)。
1H NMR:(300MHz、CDCl3):δ7.90(d、2H)、7.62(d、2H)、
7.02(d、1H)、6.59(t、1H)、6.51(s、1H)、4.96(s、2H)、4.44(dd、1H)、4.12(t、1H)、3.32(brs、1H)、3.06‐3.01(m、3H)、2.46(s、3H)。
Mass m/z:445.8(M+H)
【0060】
実施例11
7-[(2-(4-フェニル)-フェニル)-5-メチル-1,3-オキサゾール-4-イル]メトキシ]
クロマン-3-カルボン酸の製造
【化17】

工程A:第三ブチル-7-[(2-(4-フェニル)-フェニル)-5-メチル-1,3-オキサゾール-4-イル)メトキシ]-クロマン-3-カルボキシレートの製造
1-プロパノール(3mL)中の第三ブチル-7-[(2-(4-ブロモフェニル)-5-メチル-1,3-オキサゾール-4-イル)メトキシ]クロマン-3-カルボキシレート(501mg、1mmol)、トリフェニルホスフィン(4.7mg、0.018mmol)、酢酸パラジウム(II)(1.3mg、0.006mmol)及びフェニルボロン酸(130mg、1.1mmol)の攪拌溶液に水1mL中のNa2CO3(137mg、1.3mmol)を添加した。
反応混合物を窒素雰囲気下で4時間還流した。反応完了後、水及びプロパノールを除去し、残留物を酢酸エチル50mLに溶解した。酢酸エチル溶液を水(100mL)で洗浄した後、乾燥した。酢酸エチルをエバポレートし、生成物を黒色固体として得た(400mg
、80.4%)。
1H NMR:(300MHz、CDCl3):δ8.11(d、2H)、7.72‐7.66(m、4H)、7.50(t、1H)、7.42(d、1H)、7.02(d、1H)、6.60(d、1H)、6.53(s、1H)、4.97(s、1H)、4.44(t、1H)、4.08(t、1H)、2.95‐2.91(m、3H)、2.47(s、3H)、1.42(s、9H)
【0061】
工程B:7-[(2-(4-フェニル)-フェニル)-5-メチル-1,3-オキサゾール-4-イル)メトキシ]クロマン-3-カルボン酸の製造
前工程から得られた第三ブチルエステル(250mg、0.5mmol)を前述の実施例1の工程Dにおける手順により、遊離酸に転換した(170mg、77%)。
1H NMR:(300MHz、DMSO-D6):δ8.03(d、2H)、7.84(d、1H)、7.75(d、2H)、7.53(t、3H)、7.42(d、1H)、7.03(d、1H)、6.56(d、1H)、6.48(s、1H)、4.94(s、2H)、4.30(s、1H)、4.11(t、1H)、3.03‐2.89(m、3H)、2.46(s、3H)
Mass m/z:442.2(M+H)
【0062】
実施例12
メチル7-[2-(5-メチル-2-フェニル-4-オキサゾリル)エトキシ]クロマン-3-カルボ
キシレートの製造
【化18】

7-[2-(5-メチル-2-フェニル-4-オキサゾリル)エトキシ]クロマン-3-カルボン酸(189.5mg、0.5mmol)の攪拌溶液をMeOH(10mL)に懸濁させた。SO
Cl2(0.5mL)を5分かけて滴下して加えた。結果として得られた溶液を一晩攪拌し
た。MeOHをエバポレートし、生成物をCH2Cl2(25mL)に溶解した。該溶液を飽和NaHCO3(10mL)で洗浄し、乾燥及びエバポレートして、淡黄色固体としてメチ
ルエステルを得た(139mg、71%)。
1H NMR:(300MHz、CDCl3):δ8.00(d、2H)、7.46(t、3H)、
6.98(d、1H)、6.49(d、1H)、6.41(s、1H)、4.43(t、1H)、4.23‐4.11(m、3H)、3.76(s、3H)、3.04‐2.95(m、5H)、2.40(s、3H)
Mass m/z:394.3(M+H)
【0063】
実施例13
7-[2-(5-メチル-2-フェニル-4-オキサゾリル)エトキシ]クロマン-3-カルボン酸ア
ミドの製造
【化19】

7-[2-(5-メチル-2-フェニル-4-オキサゾリル)エトキシ]クロマン-3-カルボン酸(189.5mg、0.5mmol)をCH2Cl2(5mL)に溶解し、チオニルクロリド(0.109mL、1.5mmol)を窒素雰囲気下で添加した。結果として得られた懸濁液
を全ての酸が溶解されるまで攪拌した(2時間)。溶媒酸をロータリーエバポレーターにて除去し、残留物をTHF5mLに溶解した。NH3(35%水溶液、5ml)を添加し4時
間攪拌した。THFをエバポレートした後、残留物は水(10mL)とEtOAc(20m
L)に分配された。有機層を飽和NaHCO35mLで洗浄し、Na2SO4で乾燥した。EtOAcをエバポレートし、白色固体として生成物を得た(160mg、85%)。
1H NMR:(300MHz、CDCl3):δ8.05(d、2H)、7.63‐7.46(m
、3H)、6.96(d、1H)、6.49(d、1H)、6.42(s、1H)、5.77(brs、1H)、5.44(brs、1H)、4.38‐4.14(m、4H)、3.10‐2
.81(m、5H)、2.07(s、3H)
Mass m/z:379(M+H)
【0064】
実施例14
[7-[2-(5-メチル-2-フェニル-オキサゾール-4-イル)-エトキシ]-クロマン-3-イル]-酢酸の製造
【化20】

工程A:[7-[2-(5-メチル-2-フェニル-オキサゾール-4-イル)-エトキシ]クロマン-
3-イル]アセトニトリルの製造
【化21】

THF中の7-[2-(5-メチル-2-フェニル-4-オキサゾリル)エトキシ]クロマン-3-
カルボン酸(908mg、2.40mmol、1.0当量)の攪拌溶液にボラン-THF(THF中に1M、2.63mL、1.1当量)を-5℃で滴下して加えた。4時間後、更なるボラン-THF(THF中に1M、2.63mL、1.1当量)を反応混合物に室温で添加
し、一晩攪拌した。メタノール(2mL)を反応混合物に添加し溶媒を真空下でエバポレートした。残留物をEtOAcに溶解し飽和NaHCO3で洗浄し、続いて飽和食塩水で洗
浄した。混合されたEtOAc層を乾燥し(Na2SO4)、濾過し濃縮してアルコールを得た(884mg)。
Mass m/z:366.0(M+H)
【0065】
MC(10mL)に溶解されたアルコール(140mg、0.38mmol、1.0当量)の攪拌溶液にトリエチルアミン(0.08mL、0.58mmol、1.5当量)を5℃で添加した後、メタンスルホニルクロリド(0.036mL、0.46mmol、1.2当
量)を添加した。室温で1時間攪拌後、反応を水(5mL)で停止し、反応混合物をMC(20mL x 2)で抽出した。混合された有機層を乾燥し(Na2SO4)、濾過して真空下
で濃縮し粗メシレート(180mg)を得た。
Mass m/z:444.0(M+H)
【0066】
無水DMSO(5mL)に溶解されたメシレート(134mg、0.30mmol、1.
0当量)の溶液をNaCN(103mg、7当量)と混合し、80℃で3時間攪拌した。反
応混合物をEt2O(50mL)で希釈し、飽和食塩水(50mL)で洗浄した。有機層を乾
燥し(Na2SO4)、真空下濃縮した。残留物をカラム-クロマトグラフィー(hex:E
tOAc=7:3)で精製し生成物68mg(61%)を得た。
Mass m/z:375(M+H)
【0067】
工程B:[[7-[2-(5-メチル-2-フェニル-オキサゾール-4-イル)-エトキシ]-クロマン
-3-イル]-酢酸の製造
[7-[2-(5-メチル-2-フェニル-オキサゾール-4-イル)-エトキシ]クロマン-3-イル]アセトニトリル(68mg、0.18mmol、1.0当量)の攪拌溶液を10%NaO
H3mLに懸濁させ、続いて更なるNaOH(1g)を添加した。反応混合物を一晩還流し、1N HClでpH=5に酸性化した。混合物をEtOAcで抽出し、真空下で濃縮し
た。残留物を逆相の分取用液体クロマトグラフィー(C-18カラム、直径50mm×長さ150mm、CH3CN(0.1%TFA):10分で15ないし100%、25mL/分)を用いて精製した。カルボン酸化合物を含有する画分を凍結乾燥して白色固体として生成物を得た(9mg、23%)。
1H NMR:(300MHz、CDCl3):δ8.0(m、2H)、7.45(d、2H)、6
.90(d、1H)、6.40(m、4H)、4.35(m、3H)、3.90(m、1H)、3.00(m、3H)、2.50(m、7H)。
Mass m/z:394.1(M+H)
【0068】
実施例15:生物学的アッセイ
インシュリン抵抗性はII型糖尿病の基本的な病因的因子である。末梢段階におけるインシュリン抵抗性状態は障害されたグルコース利用を引き起こすが、これは更に、先述の高血糖症、高インシュリン血症、異常脂質血症、肥満症等のような広範囲の他の病態生理学的疾病と連関している。式Iで表される化合物は以下に記載されるように、グルコース取り込み(3T3-L1脂肪細胞)、血糖低下(db/db)、経口グルコース負荷及びインシュリン耐性(高脂肪食ラット)のための試験を行った。
【0069】
a)グルコース輸送アッセイ
3T3-L1繊維芽細胞(American Type Culture
Colletion)をプレートに接着し、10%FBS、10μg/mLペ
ニシリン及びストレプトマイシンが添加されたダルベッコ変法イーグル培地(Dulbe
cco's modified Eagle's medium)(DMEM;4,500mg/Lグルコース、HyClone)で5%CO2の雰囲気下で37℃でコンフレント後
2日間培養した。その次に標準プロトコルを利用して脂肪細胞(adipocyte)分化を誘導した。48時間後、分化培地を10%FBSが添加されたDMEMを含有する維持培地に交替した。上記維持培地は細胞が実験に使用されるまで3日間毎に取り替えた。グルコース輸送活性はインシュリンの存在または非在下で測定され、そのプロトコルはKletzien、RF等(1992)Molecular Pharmacology 41:393-398から修正されたものであった。つまり、分化された3T3-L1脂肪細胞
はビヒクル(DMSO)、インシュリン(100nM)単独、試験化合物(50μM)単独及びインシュリン(100nM) + 試験化合物(50μM))で48時間培養した。培地は化合
物の存在下で一日に2回取り替えた。グルコース取り込みは2-デオキシ-D-[1-3H]
グルコースを標識として使用し、各化合物で90分培養後測定された。50μMの試験化合物及び100nMのインシュリンの個別処理はグルコース輸送において増加をみせた。しかし、グルコース輸送活性は図1に示した通り、100nMのインシュリンの存在下で50μMの試験化合物の添加により著しく増加しており、これはこの化合物の相乗効果を示すものである。
表2.分化された3T3-L1脂肪細胞の2-デオキシ-D-グルコース取り込みにおける式Iで表されるの化合物の効果
【表2】

*インシュリン100nMを使用、2-デオキシ-D-グルコース取り込みにおけるインシュリンの効果は4.0倍未満
【0070】
一連の化合物において、最も優れた結果の一つは7-[2-(5-メチル-2-フェニル-4-
オキサゾリル)-エトキシ]-クロマン-3-カルボン酸(実施例1)により得られた。この化合物は100nMのインシュリン存在下において、0-100μMの範囲で、用量-依存的なグルコース取り込みを示した(図2)。明らかに、実施例1の化合物は、それ自体では3T3-L1脂肪細胞における基礎グルコース取り込みを活性化せず(実施例1の化合物0.1ないし100μMに対して1,850ないし2,213cpm)、ビヒクルコントロール
と同様のレベル(1,841cpm)に維持されるが、これは該化合物の感受性増強活性を証明する。同様に、実施例1の化合物(50μM)の存在は、インシュリン0.1-1,0
00nMの範囲において、用量依存的にインシュリンのグルコース取り込みを更に増強する(図3)が、これは更に3T3-L1脂肪細胞における該化合物のインシュリン感受性改
善効果を評価するものである。
【0071】
b)血糖低下の効力試験(db/dbマウス)
本試験に使用されたマウスはジャクソンラボラトリー(Jackson Laboratories)(Bar Harbor、ME)により開発されたII型糖尿病の標準モデルであった。雄、8週齢db/dbマウスを標準実験室条件でワイヤ底ハンギングケージ
においてケージ当たり6匹で飼育した。マウスは通常食(Purina Rodent
Chow)及び水を自由に摂取するようにした。11ないし12週齢に、マウスは群間で
のグルコース適合のために尾から採血された(群当たりn=6)。次に群分けされたマウスはビヒクル(CMC)または式Iで表される化合物(30mg/kg/d)を7日間経口投与された。式Iで表される化合物を30mg/kg/dで0.5%CMC + H2O中の0.2
%Tween80における懸濁液として投与した。新たなサスペンションを8日間投与のため製造し冷蔵庫に保管した。該サスペンションを毎朝強制経口投与で投与した。対照群にはビヒクル(投与量10mL/kg)を投与した。血糖濃度は4日目及び8日目に基礎及
び投与後3時間でモニターされた。採血のために、マウスを固定台に置き、尾に傷を与え血液滴を得た。血糖濃度は、グルコメータによる分析のためにグルコース試験紙上に血液滴を置くことにより、又は、YSI(Yellow Spring Instrumen
ts、OH)分析器において10μL血漿サンプルを使用することの何れかにより決定さ
れた。結果は絶対血糖濃度(mg/dL)及びビヒクル処理された対象群に比較して達成さ
れた減少である%減少で表現された。300mg/dL以上の血糖を有する動物が試験に
使用された。統計学的有意性(p<0.05)はビヒクル処理された動物における適切なサンプルに対して与えられた。7日目において、マウスは18時間一晩絶食させ、グルコース濃度のチェックのため尾から採血した後、試験化合物(30mg/kg/d)を投与した。2時間後、血液試料を採りラットに10%グルコース水溶液(10mL/kg)を経口投与
し、血糖を、投与後15、30、60、90及び120分にモニターした。血液試料を遠心分離し、血漿試料を採取して、インシュリン、Tg及びFFAを分析した。
表3.db/dbマウスにおける式1で表される化合物の血糖低下効果
【表3】

実施例1及び2の化合物は0.5%CMCビヒクル中に溶解しなかったと考えられる。しかし、実施例1の化合物のマイクロエマルジョンはdb/dbマウスにおいて114%(8日、5mg/kg)に効果を増加した(データ未提示)。
【0072】
c)経口グルコース負荷試験
経口グルコース負荷試験(OGTT)が、9日間にわたり、実施例1及び2の化合物の30mg/kg/d投与後のdb/dbマウス及び高脂肪(HF)ラットにおける双方で行われ
た。OGTT及びITT試験のために、Sprague‐Dawleyラットが6週間にわたり高脂肪(HF)食(脂肪から60%カロリー)を給餌することにより作成された。試験の前に、これらは血糖濃度を基準にして取り合わせて群分けされた。その結果を下記の表4に示した。
表4.実施例1及び2の化合物を用いるOGTT処理中の血糖濃度におけるAUC
【表4】

【0073】
d)インシュリン負荷試験(ITT)
インシュリン負荷試験(ITT)は、OGTT試験動物と同様の方法で作成されたHFラットで行われた。試験日にラットは試験化合物(30mg/kg)を経口投与され、2時間
後にラットは食塩水における0.1%BSA溶液中のインシュリン(0.25U/kg、i.p.)を投与された。ラットの血糖は投与後15、30、60、120分に測定された
。
表5.実施例1及び2の化合物を用いるITT処理中の血糖濃度におけるAUC
【表5】

実施例1及び2の化合物はSTZラットにおける血糖低下効果のために試験され、これは血糖を減少させなかった(データ未提示)が、これは更に、実施例1及び2の化合物がインシュリン様物質ではなくインシュリン感受性改善薬として作用することを裏付けるものである。
【技術分野】
【0001】
本発明は、インシュリン非依存性糖尿病(II型糖尿病)及びそれに関連する血管疾患、同様に、肥満症及び脂質障害の治療及びコントロールのために有用な3−クロマンカルボン酸誘導体及びそれらの医薬的に許容される塩及びプロドラッグに関する。
【背景技術】
【0002】
糖尿病は、種々の理由による体のホメオスタシスの機能不良に由来して、血漿中のグルコース濃度が正常範囲(空腹状態において>126mg/dL)を超えて維持される疾患又は高血糖症を指す。米国内だけで、人口の6.2%(1700万人)が、冠状動脈性心臓病、脳卒中、高血圧、神経障害、腎症、網膜症のようなマクロ血管疾患及び微小血管疾患に関連する多くの合併症を有する糖尿病にかかっている。米国糖尿病学会により、糖尿病を持つ成人の心臓疾患による死亡率及び脳卒中の危険性が2ないし4倍であることが示された。毎年、糖尿病のために12000ないし24000人が失明しており、30000人が下肢を失っている。血中グルコース濃度のコントロールは、糖尿病に関連する病的状態及び合併症を顕著に減少する。
【0003】
糖尿病には二つの型(タイプ)が存在する。I型は体がβ細胞の破壊のためインシュリ
ンを産生することができない疾患であり、II型は、体が体内のインシュリン抵抗性の増大によりインシュリンを十分に利用できない疾患である。糖尿病患者の90%以上がII型である。
【0004】
グリブリド及びグリメピリドのようなスルホニルウレア剤の投与は、膵臓のβ細胞を刺激して、インシュリン抵抗性を埋め合わせる、更なるインシュリンを産生する。これらのインシュリン分泌促進薬の長期使用は、結果として最終的にβ細胞の終局的枯渇と更なる抵抗性の誘導を引き起こす。インシュリンの一時的な過剰による急性低血糖症は、これらの薬剤のもう一つの副作用である。
メトフォルミンやフェノフォルミンのようなビグアニドはある程度までインシュリン感受性を増強させるが、副作用として乳酸アシドーシス、嘔吐及び下痢が報告されている。
【0005】
TDZ(チアゾリジンジオン)タイプの薬剤が最近、該市場に追加された。これらは、脂肪細胞の分化と、エネルギーの蓄積及び消費に関与する遺伝子の調節のために重要であるPPARγ、ペルオキシゾーム増殖剤応答性受容体γ、の活性化によりインシュリン感受性を増強させることが知られている。TDZ薬剤は顕著にインシュリン感受性を増強し、低血糖症の発生を取り除くが、その一部は重篤な肝毒性問題を有し、そして、レズリン(Rezulin)は、2000年に米国市場から撤収された。現在、研究者は、チアゾリジンジオン官能基に関連する肝毒性活性を回避するために、非TDZ系薬剤を活発に模索している。
【0006】
PPARαは、脂肪酸のβ酸化に関与すると報告されている。クロフィブレートやフェノフィブレートのようなPPARαのリガンドは、顕著にトリグリセリド及びLDLを減少させることが知られている。多くの糖尿病患者は、合併症を悪化する肥満症、異常脂質血症、アテローム性動脈硬化症及び高LDL濃度を伴っているため、血糖異常及び異常脂質血症を同時に直しえるPPARα及びPPARγのデュアルアゴニストを発見するための試みがなされている。例として、JTT−501(H.シンカイ等、Drugs Future、1
999年、24頁)、2−メチル−2{4−[2−(5−メチル−2−アリールオキサゾール−4−イル)エトキシ]フェノキシ}プロピオン酸(ダウン(Dawn)A.ブルークス(Brooks)等、J.Med.Chem.、2001年、44巻、2061−4頁)及び3−[4−(2
−カルバゾール−9−イル−エトキシ)−フェニル]−2−エトキシ−プロピオン酸(P.ソルバーグ(Sauerberg)等、J.Med.Chem.、2001年、44巻、2061−4頁)が挙げられる。
【非特許文献1】H.シンカイ等、Drugs Future、1999年、24頁
【非特許文献2】ダウン(Dawn)A.ブルークス(Brooks)等、J.Med.Chem.、2001年、44巻、2061−4頁
【非特許文献3】P.ソルバーグ(Sauerberg)等、J.Med.Chem.、2001年、44巻、2061−4頁
【発明の開示】
【0007】
発明の概要
本発明は、血糖、インシュリン及び脂肪酸を低下するのに効果的であるにも拘らず、典型的なPPARα及びPPARγ類の構造に属さない新しい分類の化合物である、式Iの一般式で表される化合物に関する。式Iの一般式で表される化合物は、現行の薬剤及び候補物質を超える有利な効果を有する新しい分類の薬剤としての可能性を有する。
【0008】
本発明は、式Iで表される新規なクロマン−3−カルボン酸及びその誘導体又はそれらの薬学的に許容される塩及びプロドラッグに関する。
【化1】

ここで、R1、R1´、R2、R3、R3´、R4、R5、R6、R7、m、n、W、Y及びそ
の不斉特性は、以下で定義された通りである。本発明はまた、式Iで表される化合物の有効量を医薬的に許容されるキャリア又は賦形剤と混合して含有する医薬組成物を含む。本発明は糖尿病及びその関連する代謝性疾患の治療、コントロール及び予防において有用である医薬的に活性な化合物の新しいクラスを提供するため、技術の進歩をもたらすものである。
【0009】
生物学的検定法において、式Iで表される化合物はdb/db及びob/obマウスにおいてグルコース、インシュリン、遊離脂肪酸の顕著な減少を示し、そのため、ヒトにおいて同様の効果を発揮することが期待されるが、それは、糖尿病、肥満症、アテローム性動脈硬化症、血管炎症及びそれらの関連疾患の治療、コントロール及び予防のために適用し得るものである。
【図面の簡単な説明】
【0010】
【図1】図1はインシュリン100nMの存在下の2−デオキシ−D−グルコース取り込みにおける本発明の化合物(50μM)の効果を示したものである。
【図2】図2はインシュリン100nMの存在下の、本発明化合物の0ないし100μMの範囲の用量依存様式における2−デオキシ−D−グルコース取り込みでの本発明の化合物の効果を示したものである。
【図3】図3は本発明化合物の50μMの存在下におけるインシュリンの0.1ないし1,000nMの範囲の用量依存様式における2−デオキシ−D−グルコース取り込みでの本発明の化合物の効果を示したものである。
【発明を実施するための最良の形態】
【0011】
本発明の詳細な説明
【化2】

ここに示す分類の化合物は、種々の抗糖尿病性化合物に観られる、1,3−チアゾリジンジオン部分を含まず、またα−アルコキシ/アリールオキシ酢酸構造も含まない。しかし、それは、ob/ob及びdb/dbマウスにおいて強力な血中グルコース低下効果を示す。それらは、同様に優れた脂肪酸低下効果を示す。これらの化合物は糖尿病又は高血糖症、神経障害、腎症、網膜症、肥満症のようなその関連疾患及び同様に、高脂血症又はアテローム性動脈硬化症、炎症性疾病のようなその関連疾患の治療及びコントロールのための優れた可能性を有する。本発明は、式Iで表される構造を有する化合物及びその医薬的に許容される塩、医薬的に許容されるキャリアにおける式Iで表される化合物の混合物並びにこれらの化合物のプロドラッグを含む。
【0012】
式Iで表される化合物において、R1、R1´、R2、R3及びR3´は独立して、H、炭
素原子数1ないし7のアルキル基、炭素原子数2ないし7のアルケニル基、炭素原子数2ないし7のアルキニル基、−Ar及びハロゲン原子{ここで、アルキル基、アルケニル基及びアルキニル基は直鎖若しくは分岐しており、及び(a)1ないし7個のハロゲン原子及び/又は(b)(i)1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基及び(ii)ハロゲン原子、炭素原子数1ないし5のアルキル基及び直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし3個の基で任意に置換されたフェニル基から独立して選択された1ないし3個の基で任意に置換され;
【0013】
Arはアリール基、ヘテロアリール基及びベンゾヘテロ環{ここで、アリール基、ヘテロアリール基及びベンゾヘテロ環は、ハロゲン原子、炭素原子数1ないし5のアルキル基、炭素原子数2ないし5のアルケニル基、炭素原子数2ないし5のアルキニル基、−O炭素原子数1ないし5のアルキル基、−O炭素原子数2ないし5のアルケニル基、−O炭素原子数2ないし5のアルキニル基、−SOx炭素原子数1ないし5のアルキル基、−SOxNRaRb、−SOxフェニル基、−C(O)炭素原子数1ないし3のアルキル基及び−C(
O)NRaRb(それぞれの場合において、各アルキル基、アルケニル基及びアルキニル基は直鎖若しくは分岐しており、及び(a)1ないし7個のハロゲン原子及び/又は(b)(i)1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基及び(ii)ハロゲン原子、炭素原子数1ないし5のアルキル基及び直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし3個の基で任意に置換されたフェニル基から独立して選択された1ないし3個の基で任意に置換され;
【0014】
xは1又は2から選択され、アリール基は、炭素環式6ないし10員の単環性又は2環性
の芳香族環系であり、ヘテロアリール基は環の周囲にN、S、Oから独立して選択される1ないし4個のヘテロ原子を有する5又は6員の飽和の又は部分的に不飽和の単環性のヘテロ環(ここで、Nは所望によりNRaであり得、及びSは所望によりSO又はSO2であり得る。)であり、ベンゾヘテロ環は、飽和の、部分的に不飽和の又は芳香族性の5又は6員のヘテロ環(ここで、該ヘテロ環は環の周囲にN、S、Oから独立して選択される1ないし3個のヘテロ原子を含み、Nは所望によりNRaであり得、及びSは所望によりS
O又はSO2であり得る。)及びベンゼン環を含み;
【0015】
Ra及びRbは、H、炭素原子数1ないし5のアルキル基、炭素原子数2ないし5のアルケニル基、炭素原子数2ないし5のアルキニル基、−C(O)炭素原子数1ないし5のアルキル基、−C(O)炭素原子数2ないし5のアルケニル基、−C(O)炭素原子数2ないし5のアルキニル基、SO1-2炭素原子数1ないし5のアルキル基、SO1-2フェニル基、ハロゲン原子及びフェニル基(ここで、全ての場合、アルキル基、アルケニル基及びアルキニル基は直鎖若しくは分岐しており、及び(a)1ないし7個のハロゲン原子及び/又は(b)(i)1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基及び(ii)ハロゲン原子、炭素原子数1ないし5のアルキル基及び直鎖若しくは分岐し、1ないし5個のハロゲン原子(ここで、ハロゲン原子はフッ素原子、塩素原子、臭素原子及びヨウ素原子から選択される。)で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし3個の基で任意に置換されたフェニル基から独立して選択された1ないし3個の基で任意に置換される。)からなる群より選択される。)から独立して選択された1ないし5個の置換基で、どの場合も任意に置換されている。)からなる群より選択される。}から選択され;
m及びnは独立して0又は1ないし6の整数から選択され;
【0016】
R4及びR5は独立して、H、ハロゲン原子、炭素原子数1ないし7のアルキル基、炭素原子数2ないし7のアルケニル基、炭素原子数2ないし7のアルキニル基、−OH、−O炭素原子数1ないし5のアルキル基、−O炭素原子数2ないし5のアルケニル基、−O炭素原子数2ないし5のアルキニル基、−C(O)炭素原子数1ないし5のアルキル基、−C(O)炭素原子数2ないし5のアルケニル基、−C(O)炭素原子数2ないし5のアルキニル基、−C(O)O炭素原子数1ないし5のアルキル基、−C(O)O炭素原子数2ないし5のアルケニル基、−C(O)O炭素原子数2ないし5のアルキニル基、Ar、−OAr、−C(O)Ar、−炭素原子数3ないし8のシクロアルキル基、−O炭素原子数3ないし8のシクロアルキル基、SOx炭素原子数1ないし5のアルキル基、−SOxNRa
Rb、−SOxAr及び−C(O)NRaRb(それぞれの場合において、各アルキル基、アルケニル基及びアルキニル基は直鎖若しくは分岐しており、及び(a)1ないし5個のハロゲン原子及び/又は(b)直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし2個の基で任意に置換される。)から選択され;
【0017】
Yは−O、−CRaRb、−NRa、−SO及び−SO2(式中、Ra及びRbは、H、炭素原子数1ないし5のアルキル基、炭素原子数2ないし5のアルケニル基、炭素原子数2ないし5のアルキニル基、−C(O)炭素原子数1ないし5のアルキル基、−C(O)炭素原子数2ないし5のアルケニル基、−C(O)炭素原子数2ないし5のアルキニル基、SO1-2炭素原子数1ないし5のアルキル基、SO1-2フェニル基、ハロゲン原子及びフェニル基(ここで、全ての場合、アルキル基、アルケニル基及びアルキニル基は直鎖若しくは分岐しており、及び(a)1ないし7個のハロゲン原子及び/又は(b)(i)1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基及び(ii)ハロゲン原子、炭素原子数1ないし5のアルキル基及び直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし3個の基で任意に置換されたフェニル基から独立して選択された
1ないし3個の基で任意に置換される。)からなる群より選択される。)から選択され;
【0018】
R6及びR7は独立して、H、炭素原子数1ないし7のアルキル基、炭素原子数2ないし7のアルケニル基、炭素原子数2ないし7のアルキニル基及びAr(ここで、それぞれの場合において、アルキル基、アルケニル基及びアルキニル基は直鎖若しくは分岐しており、及び(a)1ないし5個のハロゲン原子及び/又は(b)直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし2個の基で任意に置換され、Arはアリール基、ヘテロアリール基及びベンゾヘテロ環(ここで、アリール基、ヘテロアリール基及びベンゾヘテロ環は、ハロゲン原子、炭素原子数1ないし5のアルキル基、炭素原子数2ないし5のアルケニル基、炭素原子数2ないし5のアルキニル基、−O炭素原子数1ないし5のアルキル基、−O炭素原子数2ないし5のアルケニル基、−O炭素原子数2ないし5のアルキニル基、−SOx炭素原子数1ないし5のアルキル基、−SOxNRaRb、−SOxフェニル基、−C
(O)炭素原子数1ないし3のアルキル基及び−C(O)NRaRb(それぞれの場合において、アルキル基、アルケニル基及びアルキニル基は直鎖若しくは分岐しており、及び(a)1ないし7個のハロゲン原子及び/又は(b)(i)1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基及び(ii)ハロゲン原子、炭素原子数1ないし5のアルキル基及び直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし3個の基で任意に置換されたフェニル基から独立して選択された1ないし3個の基で任意に置換され、Ra及びRbは上記と同様であり、及びXは1ないし2の整数から選択される。)から独立して選択された1ないし5個の置換基で、どの場合も任意に置換されている。)からなる群より選択される。)から選択され;及び
【0019】
Wは、−ORa、−NRaRb、−NRaSO2Rb(式中、Ra及びRbは独立して、H、炭素原子数1ないし4のアルキル基及びアリール基(ここで、全ての場合、アルキル基は直鎖若しくは分岐しており、及び(a)1ないし7個のハロゲン原子及び/又は(b)(i)1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基及び(ii)ハロゲン原子、炭素原子数1ないし5のアルキル基及び直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし3個の基で任意に置換されたフェニル基から独立して選択された1ないし3個の基で任意に置換される。)からなる群より選択される。)からなる群より選択される。
【0020】
本発明に従うC3位の立体配置の化合物は、(S)、(R)又は(S)/(R)混合物
を含む。好ましくは、R1、R1´、R2、R3、R3´、R4及びR5は独立して、H、Cl
、Br、F、−O炭素原子数1ないし4のアルキル基及び炭素原子数1ないし4のアルキル基からなる群より選択され、前記アルキル基は直鎖又は分岐鎖であり、1ないし3個のハロゲン原子で任意に置換される。より好ましくは、R1、R1´、R2、R3、R3´、R4及びR5は全て水素原子である。
【0021】
以下の説明は式Iにより包含される基の定義である。
用語“アルキル基”は1ないし7個の炭素原子を有する直鎖又は分岐鎖の炭化水素を意味し、例えば、他に定義されない限り、メチル基、エチル基、n−プロピル基、n−ブチル基、第二ブチル基、イソブチル基、第三ブチル基、n−ペンチル基、n−ヘキシル基等を含む。
【0022】
用語“ハロゲン原子”は、フッ素原子、塩素原子、臭素原子及びヨウ素原子を含む;より好ましいハロゲン原子は、フッ素原子及び塩素原子である。
【0023】
用語“アルケニル基”は少なくとも1つの炭素−炭素二重結合を含む炭素鎖を意味し、それは直鎖若しくは分岐鎖又はそれらの組合せであり得る。アルケニル基の例としては、ビニル基、アリル基、イソプレニル基、ブテニル基、ペンテニル基、ヘキセニル基、ヘプテニル基等を含む。
【0024】
用語“アルキニル基”は1つの炭素−炭素三重結合を含む炭素鎖を意味し、それは直鎖若しくは分岐鎖又はそれらの組合せであり得る。アルキニル基の例としては、アセチレニル基、アリル基、プロパルギル基、3−メチル−1−ペンチニル基等を含む。
【0025】
用語“アリール基”は炭素環のみを含む単環又は2環性の芳香環を意味する。
ここで、置換基を有するアリール基は、6ないし10員の単環性の又は2環性の環系である。アリール基の例としては、フェニル基及びナフチル基、同様に、インダニル基、インデニル基及びテトラヒドロナフチル基を含む。フェニル基が最も好ましい。該用語にはまた、単環性シクロアルキル基又は単環性ヘテロ環基に縮合したアリール基も記載し得る。
【0026】
用語“ヘテロ環”は、他に定義されない限り、N、S及びOから選択される少なくとも1個のヘテロ原子を含む完全に又は部分的に飽和された単環性又は多環性の環系を意味し、該環のそれぞれは、3ないし10個の原子を有する。ヘテロ環基に縮合したアリール基の例としては、2,3−ジヒドロベンゾフラニル基、ジヒドロベンゾピラニル基等を含む。ヘテロ環の例としては、テトラヒドロフラン、ピペラジン、テトラヒドロピラン及びモルフィンを含む。
【0027】
用語“ヘテロアリール基”はそれぞれの環が5ないし6個の原子を含む、環の周囲にN、O及びS(SO及びSO2を含む。)から選択される1ないし4個の環へテロ原子を含
む単環、2環又は3環性の芳香環を意味する。ヘテロアリール基の例としては、ピロリル基、イソキサゾリル基、イソチアゾリル基、ピラゾリル基、ピリジル基、オキサゾリル基、オキサジアゾリル基、チアジアゾリル基、チアゾリル基、イミダゾリル基、トリアゾリル基、テトラゾリル基、フラニル基、トラジニル基、チエニル基、ピリミジル基、ピリダザニル基、ピラジニル基、ベンズイソキサゾリル基、ベンズオキサジリル基、ベンゾチアゾリル基、ベンズイミダゾリル基、ベンゾフラニル基、ベンゾチオフェニル基、キノリル基、インドリル基、イソキノリル基、ジベンゾフラン等を含む。
【0028】
用語“組成物”は活性成分及びキャリアを構成する不活性成分を含む生成物、並びに、如何なる2種若しくはそれ以上の前記成分の組合せ、複合若しくは凝集からの又は1種若しくはそれ以上の前記成分の解離からの又は1種若しくはそれ以上の前記成分の他のタイプの反応若しくは相互作用からの、直接的若しくは間接的な結果として得られる如何なる生成物を包含することを意図する。従って、本発明の組成物は本発明の化合物及び医薬的に許容されるキャリアを混合することにより製造される如何なる組成物をも包含する。
【0029】
用語“医薬的に許容される塩”は無機若しくは有機塩基又は有機塩基及び無機若しくは有機酸を含む医薬的に許容される非毒性の塩基又は酸から生成される塩を意味する。無機塩基から誘導される塩は、アルミニウム、アンモニウム、カルシウム、銅、鉄、リチウム、マグネシウム、マンガン、カリウム、ナトリウム、亜鉛等を含む。特に好ましいものは、アンモニウム、カルシウム、マグネシウム、カリウム及びナトリウムの塩である。医薬的に許容される有機非毒性塩基から誘導された塩は、1級、2級、3級アミンの塩、アルギニン、ベタイン、カフェイン、コリン等のような天然由来の置換アミンを含む置換アミンの塩を含む。本発明の化合物が塩基性の場合、塩は、無機及び有機酸を含む医薬的に許容される非毒性の酸から生成されうる。そのような酸としては、酢酸、ベンゼンスルホン酸、安息香酸、カンファースルホン酸、クエン酸、フマル酸、グルコン酸、グルタミン酸
、塩酸、臭化水素酸、乳酸、マレイン酸、リンゴ酸、マンデル酸、メタンスルホン酸、粘液酸、硝酸、パモン酸、リン酸、コハク酸、硫酸、酒石酸、p−トルエンスルホン酸等を含む。特に好ましくは、クエン酸、臭化水素酸、塩酸、マレイン酸、リン酸、硫酸及び酒石酸が挙げられる。
ここで用いられる、式Iで表される化合物の参照例は、その医薬的に許容される塩をも含むことを意図すると理解できる。
【0030】
合成方法
一つの態様において、本発明の化合物は以下のようにして生成することができる:
クロマン−3−カルボン酸部分はスキーム1に記載されるように2−ヒドロキシ−4−ベンジロキシベンズアルデヒドから出発して合成される。
【化3】

環化は炭酸カリウムの存在下、155℃において、NMP中で達成され、その後の水素化はt−ブチル7−ヒドロキシ−クロマン−3−カルボン酸エステルを与える。ブチル7−ヒドロキシ−クロマン−3−カルボン酸エステルは、光延反応又はウイリアムソンのエーテル合成の何れかにより、種々の“左”側分子に連結される。t−ブチル基はその後、脱保護されてカルボン酸(1)を与え、これらの酸は更に対応するアミド又はスルホンアミド化合物へ変性される。ホモカルボン酸(14)はカルボン酸官能基をメシレートにし、その後のメシレートのシアニドによる求核置換及び加水分解により合成される。
【0031】
これらの化合物はグルコース及び遊離脂肪酸の低下において有効である。これらの化合物はまた、ITT(インシュリン負荷試験)及びOGTT(経口グルコース負荷試験)に
おいてインシュリン及びグルコース量の顕著な減少(AUC)を示すが、これらはインシュリン感受性化合物で観察される典型的な現象である。これらの化合物はヒトにおけるインシュリン非依存性糖尿病(NIDDM)及び腎症、神経障害及び網膜症のようなその関連する合併症の治療及びコントロールにおいて、同様に、肥満症及び高脂血症、異常脂質血症、高コレステロール血症、高トリグリセリド血症、アテローム性動脈硬化症のようなその関連疾患の治療及びコントロールにおいて有効であることが期待される。
【0032】
代謝物−プロドラッグ
本発明はまた、クレームされた化合物の活性代謝物を含む。患者に投与されたとき、又は患者に投与された後に、クレームされた化合物へ変換される化合物であるプロドラッグもまた、クレームされた活性化合物の範囲内に含まれる。本発明のカルボン酸のプロドラッグの非限定の例は、カルボン酸基のエステル、例えば直鎖又は分岐鎖であり得る炭素原子数1ないし6のエステル又は患者に投与された後、より容易に加水分解され易くする官能基を有するエステルであり得る。同様に、1級及び2級アミン及び種々の置換アミンのアミドもまた含まれる。
【0033】
投与及び投与量範囲
全ての好適な投与経路が、本発明の化合物の有効量を、哺乳動物、特にヒトへ提供するために使用される。例えば、経口、直腸、局所、非経口、眼内、経肺、経鼻等が使用される。投与形態は錠剤、トローチ剤、分散剤、懸濁液、溶液、カプセル、クリーム、軟膏、エアロゾル等を含む。好ましくは、式Iで表される化合物は経口で投与される。
【0034】
使用される活性成分の有効投与量は使用される特定の化合物、投与形態、治療される病気及び治療される病気の重症度に依存して変化する。そのような投与量は当業者により容易に確定され得る。糖尿病及び/又は高血糖症又は高トリグリセリド血症又は他の疾患を治療又は予防する際、式Iで表される化合物が指示されると、本発明の化合物が患者の体
重1kgあたり約0.1mgないし100mgの1日投与量で投与され、好ましくは1日1回又は分割された用量で2−6回/日として与えられ、又は持続放出形態において投与される場合、通常、好結果が得られる。より大きな哺乳類のためには、総1日投与量は約1mgないし1g、好ましくは約1ないし50mgである。70kgの成人の場合、総1日投与量は通常、約7mgないし350mgとなる。この用量は任意の治療反応をもたらすために調整され得る。
【0035】
医薬組成物
本発明のもう一つの観点として式Iで表される化合物及び医薬的に許容されるキャリア
を含む医薬組成物を提供する。前述のような、経口、経鼻、非経口等のような投与の種々の形態のために、式Iで表される化合物、その塩及び/又はそのプロドラッグは慣用の医
薬品配合技術に従う医薬キャリアの混合物中に活性成分として組み合わせることができる。該キャリアは、投与形態に依存して変化し、水、グリコール、油、アルコール、香料、保存剤、着色剤、甘味料等のような多様なキャリアから選択され得る。キャリアはまた、ハード及びソフトカプセル錠のために、澱粉、糖、セルロース、結合剤等及び懸濁液のために水、アルコール、グリセロール、セルロース、油等を含む。
【0036】
併用療法
式Iで表される化合物は、最適な医薬特性を更に高め得る他の薬剤と併用して使用し得る。併用療法は、前述の目的疾患の有効性を更に高めるために、又は、症状のより広範囲をカバーするために、又は、毒性を低下させるために、又は、薬物速度論的特性を高めるために使用され得る。好ましい効果は、糖尿病疾患に伴う疾患及び合併症の治療及びコントロールのための有効性の増強である。式Iで表される化合物と併用して、及び別々に或いは同一の医薬組成物中で投与され得る他の活性成分の例は、限定されないが、以下を含
む:
(a)(i)メトフォルミン及びフェンフォルミンのようなビグアニド、(ii)ピオグリタゾン、ロシグリタゾン及びエングリタゾンのようなPPARγアゴニスト(iii)プロテインチロシンフォスファターゼ−1B(PTP−1B)阻害剤、及び(iv)ジペプチジルペプチダーゼIV阻害剤を含むインシュリン感受性改善剤;
(b)インシュリン及びインシュリン様物質;
(c)トルブタミド及びグリブリドのようなスルホニルウレア;
(d)α−グリコシダーゼ阻害剤;
(e)HMG−CoA還元酵素阻害剤(ロバスタチン、プラバスタチン、フルバスタチン、アトロバスタチン、イタバスタチン、リバスタチン、シンバスタチン及び他のスタチン)のようなコレステロール低下剤;
(f)フェンフルラミン及びデクスフェンフルラミンのような抗肥満化合物;
(g)MBX−102のようなシクロオキシナーゼ−2(COX−2)阻害剤;及び
(h)オルリスタットのようなリパーゼ阻害剤。
【0037】
好ましくは、哺乳類患者におけるアテローム性動脈硬化症を治療、予防又はコントロールするために、式Iで表される化合物の有効量及びロバスタチン、プラバスタチン、フルバスタチン、アトロバスタチン、イタバスタチン及びリバスタチンを含むスタチンのようなHMG−CoA還元酵素阻害剤の有効量が投与され得る。
【0038】
本発明は更に、上述の何れかの化合物及び医薬的に許容されるキャリアを含む医薬的に許容される組成物を含む。
【実施例】
【0039】
以下の実施例は、本発明の化合物の製造方法を含む本発明を提示するために提供され、いかなる方法によっても本発明を限定しないものと解釈される。本発明の範囲は添付のクレームにおいて定義される。
実施例
本発明の化合物の具体例は、以下に名前で列挙された、実施例1ないし14として提供され、それらの構造は表1に示される。
表1.本発明の化合物の具体例
【表1】

【0040】
実施例1
7−[2−(5−メチル−2−フェニル−4−オキサゾリル)エトキシ]クロマン−3−カルボン酸の製造
【化4】

工程A:下式を有する第三ブチル7−(ベンジロキシ)−2H−クロメン−3−カルボキシレートの製造
【化5】

NMP(30mL)中の4−ベンジロキシ−2−ヒドロキシベンズアルデヒド(11.41g、50mmol)の撹拌溶液に、K2CO3(13.0g、100mmol)を添加し、N2雰囲気下で155℃に加熱した。t−ブチルアクリレート(36.5mL、25
0mmol)を4つに分割した(10、10、10及び6.5mL)。最初の10mLを反応混合物に添加し、155℃で加熱した。残りは2時間間隔の後に添加し、反応混合物は全体で8時間加熱した。反応混合物を室温に冷却し、水(150mL)を添加した。生成物は150mLのエーテルで抽出した。エーテル層を水で2回洗い、乾燥した。エーテル層は50%のヘキサンで希釈し、シリカのパッド(長さ3インチ、直径4インチ)で濾過した。該シリカを50%エーテル/ヘキサン混合液で洗い、溶媒をエバポレートして生成物を淡黄色固体(13g、77%)として得た。
1H NMR:(300MHz、CDCl3):δ7.43−7.38(m、5H)、7.06(d、1H)、6.57(d、1H)、6.50(s、1H)、5.07(s、2H)、4.95(s、2H)、1.48(s、9H).
【0041】
工程B:下式を有する第三ブチル7−ヒドロキシクロマン−3−カルボキシレートの製造
【化6】

第三ブチル7−(ベンジロキシ)−2H−クロメン−3−カルボキシレート(13g)を、水素化瓶中で酢酸エチル(15mL)及びメタノール(5mL)に溶解した。Pd−C(10%)(1g)を添加し、反応混合物を1晩、水素化(H2、70psi及び室温
(RT))した。反応が完結した後、触媒を濾過し、酢酸エチル100mLで洗った。溶媒をエバポレートし、粗生成物をカラムクロマトグラフィー及び酢酸エチルヘキサン混合液を用いて精製し、純粋な生成物6gを得た(2工程の総収率48.3%)。
1H NMR:(300MHz、CDCl3):δ6.95(d、1H)、6.42(d、1H)、6.35(s、1H)、4.63(s、1H)、4.43−4.38(m、1H)、4.10−4.03(m、1H)、2.96−2.86(m、3H)、1.49(s、9H).
Mass m/z:251.2(M+H)
【0042】
工程C:下式を有する第三ブチル7−[2−(5−メチル−2−フェニル−4−オキサゾリル)エトキシ]クロマン−3−カルボキシレートの製造
【化7】

CH3CN(20mL)中の、第三ブチル7−ヒドロキシクロマン−3−カルボキシレ
ート(2.5g、10mmol)の撹拌溶液にK2CO3(4.1g)及び2−(5−メチル−2−フェニル−1,3−オキサゾール−4−イル)エチルメタンスルホネート(3.7g)を添加し、反応混合物を1晩還流下で加熱した。反応混合物を室温まで冷却し、100mLのジエチルエーテルで希釈した。希釈された溶液をシリカのパッドで濾過し、シリカを更にエーテルで洗った。該エーテル溶液をエバポレートして乾固し、シリカクロマトグラフィーを用いて精製した。生成物を白色固体として単離した(2.8g、64.3%)。
1H NMR:(300MHz、CDCl3):δ7.99(d、2H)、7.45−7.43(m、3H)、6.94(d、1H)、6.48(d、1H)、6.40(s、1H)、4.41(t、2H)、4.20(t、2H)、4.08−4.02(m、1H)、3.00−2.92(m、5H)、2.93(s、3H)、1.48(s、9H).
【0043】
工程D:7−[2−(5−メチル−2−フェニル−4−オキサゾリル)エトキシ]クロマン−3−カルボン酸の製造
第三ブチル7−[2−(5−メチル−2−フェニル−4−オキサゾリル)エトキシ]クロマン−3−カルボキシレート(5.2g、11.95mmol)を蟻酸25mL中に溶解し、60℃で12時間加熱した。蟻酸を真空ポンプで除去し、エーテル(25mL)を加え、10分間加熱した。結果として得られた懸濁液を−20℃で1時間冷却し、濾過した。固体生成物を20mLのジエチルエーテルで洗い、乾燥することにより、白色粉末として化合物7−[2−(5−メチル−2−フェニル−4−オキサゾリル)エトキシ]クロマン−3−カルボン酸を得た(3.8g、84%)。
1H NMR:(300MHz、CDCl3):δ8.03−8.00(m、2H)、7.99−7.48(m、3H)、6.98(d、1H)、6.50(d、1H)、6.41(s、1H)、4.42(d、1H)、4.22−4.12(m、3H)、3.60−3.20(brs、1H)、3.09−3.02(m、5H)、2.43(s、3H).
Mass m/z:380.1(M+H)
【0044】
実施例2
7-[2-(5-メチル-2-フェニル-(4-フェニル)フェニル-4-オキサゾリル)エトキシ]ク
ロマン-3-カルボン酸の製造
【化8】

工程A:第三ブチル7-[2-(5-メチル-2-(4-フェニル)フェニル-4-オキサゾリル)エ
トキシ]クロマン-3-カルボキシレートの製造
トルエン(10mL)中の第三ブチル7-ヒドロキシクロマン-3-カルボキシレート(500mg、2mmol)、トリフェニルホスフィン(786.8mg、3mmol)及び2-(5-メチル-2-(4-フェニル)フェニル-1,3-オキサゾール-4-イル)エタノール(672m
g、2.4mmol)の攪拌溶液に窒素雰囲気下で10分間、ジエチルアゾジカルボキシ
レート(372.4mg、3mmol)でゆっくり処理した。添加完了後、反応混合物を6
0℃で8時間加熱した。トルエンを真空下で除去し、残留物を20%酢酸エチル及びヘキサンを溶出液として使用してシリカのカラムクロマトグラフィーにより精製し、生成物を得た(550mg、55%)。
1H NMR:(300MHz、CDCl3):δ8.07(d、2H)、7.71-7.65(m
、4H)、7.49-7.37(m、3H)、6.96(t、1H)、6.43(d、1H)、6.35(s、1H)、4.42(d、1H)、4.22(t、2H)、4.04(t、1H)、3.02-2.90(m、5H)、2.42(s、3H)、1.48(s、9H)
【0045】
工程B:
前工程から得られた第三ブチルエステル(250mg、0.48mmol)をHCO2H(5mL)に溶解し、40℃で7時間加熱した。溶媒を真空ポンプで除去し、残留物を分取
用高速液体クロマトグラフィーで精製した(190mg、87%)。
1H NMR:(300MHz、CDCl3):δ10.17(brs、1H)、8.10(d、2H)、7.75(d、2H)、7.67(d、2H)、7.53-7.43(m、4H)、6.97(d、1H)、6.43(d、1H)、6.39(s、1H)、4.39(d、1H)、4.23-4.10(m、3H)、3.12-2.99(m、5H)、2.48(s、3H)
Mass m/z:456.1(M+H)
【0046】
実施例3
7-[2-(5-メチル-2-(4-フルオロ)フェニル)-4-オキサゾリル)エトキシ]クロマン-3-カルボン酸の製造
【化9】

工程A:第三ブチル7-[2-(5-メチル-2-(4-フルオロ)フェニル)-4-オキサゾリル)エトキシ]クロマン-3-カルボキシレートの製造
トルエン(10mL)中の第三ブチル7-ヒドロキシクロマン-3-カルボキシレート(750mg、3mmol)、トリフェニルホスフィン(864mg、3.3mmol)及び2-(
5-メチル-2-(4-フルオロ)フェニル-1,3-オキサゾール-4-イル)エタノール(752mg、3.3mmol)の攪拌溶液を、窒素雰囲気下で10分間ジエチルアゾジカルボキ
シレート(574.5mg、3.3mmol)でゆっくり処理した。添加完了後、反応混合
物を60℃で17時間加熱した。トルエンを真空下で除去し、残留物を20%酢酸エチル及びヘキサンを溶出液として使用してシリカのカラムクロマトグラフィーにより精製し、生成物を得た(510mg、36%)。
1H NMR:(300MHz、CDCl3):δ8.01-7.96(m、2H)、7.15(d
、2H)、6.97(d、1H)、6.48(d、1H)、6.41(s、1H)、4.40(d、1H)、4.20(t、2H)、4.04(t、1H)、2.99-2.88(m、5H)、2.39(s、3H)、1.48(s、9H)
【0047】
工程B:
前工程から得られた第三ブチルエステル(250mg、0.55mmol)をHCO2H(5mL)に溶解し40℃で6時間加熱した。溶媒を真空ポンプで除去し、残留物を分取用
高速液体クロマトグラフィーで精製した(197mg、90%)。
1H NMR:(300MHz、CDCl3):δ8.01-7.97(m、2H)、7.14(t
、2H)、6.98(d、1H)、6.51(d、1H)、6.43(s、1H)、4.41(d、1H)、4.21-4.11(m、3H)、3.06-2.95(m、5H)、2.39(s、3H)
Mass m/z:398.2(M+H)
【0048】
実施例4
7-[2-(5-メチル-2-チエン-2-イル-1,3-オキサゾール-4-イル)エトキシ]クロマ
ン-3-カルボン酸の製造
【化10】

工程A:第三ブチル7-[2-(5-メチル-2-チエン-2-イル-1,3-オキサゾール-4-イ
ル)エトキシ]クロマン-3-カルボン酸の製造
2-(5-メチル-2-チエン-2-イル-1,3-オキサゾール-4-イル)エチルメタンスルホネート(947mg、3.3mmol)、第三ブチル7-ヒドロキシクロマン-3-カルボキ
シレート(750mg、3mmol)及び炭酸カリウム(1.24g、9mmol)をCH3
CN中で混合し、N2雰囲気下で一晩還流させた。反応完了(TLC)後、反応混合物を室
温まで冷却しジエチルエーテル30mLで希釈し小さいシリカパッドを通して通過させた。シリカをエーテル100mLで洗浄し、エーテル溶液を蒸発させ生成物を得、これを酢酸エチル及びヘキサンを溶出液に使用するシリカのカラムクロマトグラフィーにより精製した(699mg、53%)。
1H NMR:(300MHz、CDCl3):δ7.60(d、1H)、7.39(t、1H)、
7.11(d、1H)、6.96(d、1H)、6.47(d、1H)、6.40(s、1H)、4.40(d、1H)、4.21-4.16(m、3H)、4.04(t、1H)、2.98-2.93(m、5H)、2.38(s、3H)、1.48(s、9H)。
【0049】
工程B:7-[2-(5-メチル-2-チエン-2-イル-1,3-オキサゾール-4-イル)エトキシ]クロマン-3-カルボン酸の製造
前工程から得られた第三ブチルエステル(400mg、0.9mmol)を前述の実施例1の工程Dにおける手順により、遊離酸に転換した(320mg、91%)。
1H NMR:(300MHz、DMSO-D6):δ7.74(d、1H)、7.61(d、1H)、7.18(d、1H)、6.99(d、1H)、6.45(d、1H)、6.33(s、1H)、4.30(d、1H)、4.14-4.05(m、3H)、2.95-2.85(m、5H)
、2.34(s、3H)。
Mass m/z:386.2(M+H)
【0050】
実施例5
7-[2,5ジフェニル-4-オキサゾリル]エトキシ]クロマン-3-カルボン酸の製造
【化11】

工程A:第三ブチル7-[2,5ジフェニル-4-オキサゾリル]エトキシ]クロマン-3-カルボキシレートの製造
トルエン(15mL)中の第三ブチル7-ヒドロキシクロマン-3-カルボキシレート(750mg、3mmol)、トリフェニルホスフィン(1.1g、4.5mmol)及び2,5-ジフェニル-(1,3-オキサゾール-4-イル)エタノール(946mg、3.6mmol)の攪拌溶液を、窒素雰囲気下で10分間ジエチルアゾジカルボキシレート(783mg、4
.5mmol)でゆっくり処理した。添加完了後、反応混合物を60℃で19時間加熱し
た。トルエンを真空下で除去し、残留物を20%酢酸エチル及びヘキサンを溶出液に使用するシリカのカラムクロマトグラフィーにより精製し、生成物を得た(450mg、29
.4%)。
1H NMR:(300MHz、CDCl3):δ8.12(d、2H)、7.82(d、2H)、
7.53-7.36(m、6H)、6.97(d、1H)、6.48(d、1H)、6.43(s、1H)、4.41-4.4=32(m、3H)、4.03(t、1H)、3.31(t、2H)、2.96−2.86(m、3H)、1.48(s、9H)
【0051】
工程B:7-[2,5ジフェニル-4-オキサゾリル)エトキシ]クロマン-3-カルボン酸の製造
前工程から得られた第三ブチルエステル(300mg、0.58mmol)を前述の実施
例1の工程Dにおける手順により、遊離酸に転換した(210mg、81%)。
1H NMR:(300MHz、CDCl3):δ8.11(d、2H)、7.81(d、2H)、
7.52-7.36(m、6H)、6.97(d、1H)、6.51(d、1H)、6.45(s、1H)、4.44‐4.35(m、3H)、4.17(t、1H)、3.32(t、2H)、
3.06‐2.96(m、3H)
Mass m/z:442.2(M+H)
【0052】
実施例6
7-[(2-フェニル-5-メチル-1,3-オキサゾール-4-イル)メトキシ]クロマン-3-カルボン酸の製造
【化12】

工程A:第三ブチル-7-[(2-フェニル-5-メチル-1,3-オキサゾール-4-イル)メトキシ]クロマン-3-カルボキシレートの製造
4-(クロロメチル)-5-メチル-2-フェニル-1,3-オキサゾール(103.5mg、0.5mmol)及び炭酸カリウム(138.4mg、1mmol)の攪拌溶液に第三ブチル
7-ヒドロキシクロマン-3-カルボキシレート(125mg、0.5mmol)を添加し、
反応混合物を室温で48時間攪拌した。水(50mL)を添加し、沈殿した生成物をジエチルエーテル25mLで抽出した。エーテル層を水(25mL)で2回洗浄し、乾燥した。溶媒をエバポレートし、淡黄色粘性物質として生成物を得た(150mg、36%)。
1H NMR:(300MHz、CDCl3):δ8.02(d、2H)、7.54(s、3H)、
7.02(d、1H)、6.55(d、1H)、6.48(s、1H)、5.04(s、2H)、4.41(d、1H)、4.40(t、1H)、3.02-2.80(m、3H)、2.50(s、3H)
【0053】
工程B:7-[(2-フェニル-5-メチル-1,3-オキサゾール-4-イル)メトキシ]クロマン-3-カルボン酸の製造
前工程から得られた第三ブチルエステル(100mg、0.24mmol)を前述の実施例1の工程Dにおける手順により、遊離酸に転換した(76mg、88%)。
1H NMR:(300MHz、CDCl3):δ8.04(d、2H)、7.48-7.47(m
、3H)、7.02(d、1H)、6.60(d、1H)、6.52(s、1H)、4.96(s、2H)、4.43(d、1H)、3.99(t、1H)、3.80-3.50(brs、1H)、3.08‐2.80(m、3H)、2.47(s、3H)
Mass m/z:366.0(M+H)
【0054】
実施例7
7-[3-(5-メチル-2-フェニル-4-オキサゾリル)プロポキシ]クロマン-3-カルボン酸
の製造
【化13】

工程A:第三ブチル-7-[3-(5-メチル-2-フェニル-4-オキサゾリル)プロポキシ]クロマン-3-カルボキシレートの製造
CH3CN(10mL)中の第三ブチル7-ヒドロキシクロマン-3-カルボキシレート(2
50mg、1mmol)の攪拌溶液にK2CO3(414mg)及び3-(5-メチル-2-フェニル-1,3-オキサゾール-4-イル)プロピルメタンスルホネート(325mg)を添加し、
反応混合物を一晩還流下で加熱した。反応混合物を室温まで冷却し、ジエチルエーテル30mLで希釈した。希釈された溶液をシリカパッドを通じて通過させ、シリカを更なるエーテルで洗浄した。エーテル溶液をエバポレートして乾固し、シリカクロマトグラフィーを用いて精製した。生成物は白色固体として単離された(397mg、88%)。
1H NMR:(300MHz、CDCl3):δ8.05(d、2H)、7.55(t、2H)、
6.98(d、1H)、6.46(d、1H)、6.37(s、1H)、4.40(d、1H)、4.06(t、1H)、3.93(t、2H)、2.96‐2.85(m、5H)、2.37(
s、3H)、2.20‐2.12(m、2H)、1.46(s、9H)
【0055】
工程B:7-[3-(5-メチル-2-フェニル-4-オキサゾリル)プロポキシ]クロマン-3-カ
ルボン酸の製造
前工程から得られた第三ブチルエステル(100mg、0.22mmol)を前述の実施例1の工程Dにおける手順により、遊離酸に転換した(89mg、100%)。
1H NMR:(300MHz、CDCl3):δ8.00(d、2H)、7.44(t、3H)、
6.98(d、1H)、6.51(d、1H)、6.41(s、1H)、4.42(d、1H)、4.15(t、1H)、3.95(t、2H)、3.07‐3.03(m、3H)、2.71(
t、2H)、2.71(s、3H)、2.14(p、2H)
Mass (m/z):394.2(M+H)
【0056】
実施例8
7-[(2-フェニル-5-メチル-1,3-オキサゾール-4-イル)メトキシ]N-(フェニルスルホニル)クロマン-3-カルボキサミドの製造
【化14】

ベンゼンスルホンアミド(760mg、5mmol)、ジメチルアミノピリジン(134
mg、1.1mmol)及び7-[2-(5-メチル-2-フェニル-4-オキサゾール)エトキシ]クロマン-3-カルボン酸(379mg、1mmol)の攪拌溶液にジイソプロピルカルボジイミド(0.234ml、1.5mmol)を添加し、反応混合物をジクロロメタン(5m
L)中で一晩室温で攪拌した。CH2Cl2を除去し、残留物をアセトン(5ml)に溶解し
、濾過した。濾液を分取用LCMSにより直接精製した(189mg、36.4%)。
1H NMR:(300MHz、CDCl3):δ8.84(brs、1H)、7.99-7.97(m、5H)、7.66‐7.44(m、5H)、6.89(d、1H)、6.50(d、1H)、6.40(s、1H)、4.29‐4.06(m、4H)、3.03‐2.85(m、5H)、2.41(s、3H)
Mass (m/z):519.0(M+H)
【0057】
実施例9
7-[(2-フェニル-5-メチル-1,3-オキサゾール-4-イル)メトキシ]N-(メチルスルホニル)クロマン-3-カルボキサミドの製造
【化15】

メタンスルホンアミド(475mg、5mmol)、ジメチルアミノピリジン(134m
g、1.1mmol)及び7-[2-(5-メチル-2-フェニル-4-オキサゾリル)エトキシ]クロマン-3-カルボン酸(379mg、1mmol)の攪拌溶液にジイソプロピルカルボジイミド(0.234mL、1.5mmol)を添加し、反応混合物をジクロロメタン(5mL)中で一晩室温で攪拌した。CH2Cl2を除去し、残留物をアセトン(5ml)に溶解し、濾過した。濾液を分取用LCMSにより直接精製した(260mg、57%)。
1H NMR:(300MHz、CDCl3):δ8.27(s、1H)、8.01(d、2H)、
7.47(t、3H)、6.99(d、1H)、6.53(d、1H)、6.43(s、1H)、4.33‐4.20(m、4H)、3.30(s、3H)、3.07‐2.94(m、5H)、2.43(s、3H)。
Mass m/z:457.0(M+H)
【0058】
実施例10
7-[(2-(4-ブロモフェニル)-5-メチル-1,3-オキサゾール-4-イル)メトキシ]クロ
マン-3-カルボン酸の製造
【化16】

工程A:第三ブチル-7-[(2-(4-ブロモフェニル)-5-メチル-1,3-オキサゾール-4-イル)メトキシ]クロマン-3-カルボキシレートの製造
第三ブチル7-ヒドロキシクロマン-3-カルボキシレート(1.1g、4.4mmol)
及び炭酸カリウム(1.1g、8mmol)の攪拌懸濁液に2-(4-ブロモフェニル)-4-(
クロロメチル)-5-メチル-1,3-オキサゾール(1.14g、4mmol)を添加し、反
応混合物を60℃で一晩攪拌した。反応完了後、水(40ml)を添加し、沈殿した生成物を酢酸エチル(60ml)で抽出した。有機層を水50mlで2回洗浄し乾燥した。乾燥された溶液をエバポレートし、褐色固体として生成物を得た(1.55g、77.4%)。
1H NMR:(300MHz、CDCl3):δ7.90(d、2H)、7.59(d、2H)、
7.00(d、1H)、6.54(d、1H)、6.51(s、1H)、4.94(s、2H)、4.42(d、1H)、4.07(t、1H)、2.95-2.75(m、3H)、2.45(s、3H)、1.49(s、9H)
【0059】
工程B:7-[(2-(4-ブロモフェニル)-5-メチル-1,3-オキサゾール-4-イル)メトキシ]クロマン-3-カルボン酸の製造
前工程から得られた第三ブチルエステル(500mg、1mmol)を前述の実施例1の工程Dにおける手順により、遊離酸に転換した(389mg、86%)。
1H NMR:(300MHz、CDCl3):δ7.90(d、2H)、7.62(d、2H)、
7.02(d、1H)、6.59(t、1H)、6.51(s、1H)、4.96(s、2H)、4.44(dd、1H)、4.12(t、1H)、3.32(brs、1H)、3.06‐3.01(m、3H)、2.46(s、3H)。
Mass m/z:445.8(M+H)
【0060】
実施例11
7-[(2-(4-フェニル)-フェニル)-5-メチル-1,3-オキサゾール-4-イル]メトキシ]
クロマン-3-カルボン酸の製造
【化17】

工程A:第三ブチル-7-[(2-(4-フェニル)-フェニル)-5-メチル-1,3-オキサゾール-4-イル)メトキシ]-クロマン-3-カルボキシレートの製造
1-プロパノール(3mL)中の第三ブチル-7-[(2-(4-ブロモフェニル)-5-メチル-1,3-オキサゾール-4-イル)メトキシ]クロマン-3-カルボキシレート(501mg、1mmol)、トリフェニルホスフィン(4.7mg、0.018mmol)、酢酸パラジウム(II)(1.3mg、0.006mmol)及びフェニルボロン酸(130mg、1.1mmol)の攪拌溶液に水1mL中のNa2CO3(137mg、1.3mmol)を添加した。
反応混合物を窒素雰囲気下で4時間還流した。反応完了後、水及びプロパノールを除去し、残留物を酢酸エチル50mLに溶解した。酢酸エチル溶液を水(100mL)で洗浄した後、乾燥した。酢酸エチルをエバポレートし、生成物を黒色固体として得た(400mg
、80.4%)。
1H NMR:(300MHz、CDCl3):δ8.11(d、2H)、7.72‐7.66(m、4H)、7.50(t、1H)、7.42(d、1H)、7.02(d、1H)、6.60(d、1H)、6.53(s、1H)、4.97(s、1H)、4.44(t、1H)、4.08(t、1H)、2.95‐2.91(m、3H)、2.47(s、3H)、1.42(s、9H)
【0061】
工程B:7-[(2-(4-フェニル)-フェニル)-5-メチル-1,3-オキサゾール-4-イル)メトキシ]クロマン-3-カルボン酸の製造
前工程から得られた第三ブチルエステル(250mg、0.5mmol)を前述の実施例1の工程Dにおける手順により、遊離酸に転換した(170mg、77%)。
1H NMR:(300MHz、DMSO-D6):δ8.03(d、2H)、7.84(d、1H)、7.75(d、2H)、7.53(t、3H)、7.42(d、1H)、7.03(d、1H)、6.56(d、1H)、6.48(s、1H)、4.94(s、2H)、4.30(s、1H)、4.11(t、1H)、3.03‐2.89(m、3H)、2.46(s、3H)
Mass m/z:442.2(M+H)
【0062】
実施例12
メチル7-[2-(5-メチル-2-フェニル-4-オキサゾリル)エトキシ]クロマン-3-カルボ
キシレートの製造
【化18】

7-[2-(5-メチル-2-フェニル-4-オキサゾリル)エトキシ]クロマン-3-カルボン酸(189.5mg、0.5mmol)の攪拌溶液をMeOH(10mL)に懸濁させた。SO
Cl2(0.5mL)を5分かけて滴下して加えた。結果として得られた溶液を一晩攪拌し
た。MeOHをエバポレートし、生成物をCH2Cl2(25mL)に溶解した。該溶液を飽和NaHCO3(10mL)で洗浄し、乾燥及びエバポレートして、淡黄色固体としてメチ
ルエステルを得た(139mg、71%)。
1H NMR:(300MHz、CDCl3):δ8.00(d、2H)、7.46(t、3H)、
6.98(d、1H)、6.49(d、1H)、6.41(s、1H)、4.43(t、1H)、4.23‐4.11(m、3H)、3.76(s、3H)、3.04‐2.95(m、5H)、2.40(s、3H)
Mass m/z:394.3(M+H)
【0063】
実施例13
7-[2-(5-メチル-2-フェニル-4-オキサゾリル)エトキシ]クロマン-3-カルボン酸ア
ミドの製造
【化19】

7-[2-(5-メチル-2-フェニル-4-オキサゾリル)エトキシ]クロマン-3-カルボン酸(189.5mg、0.5mmol)をCH2Cl2(5mL)に溶解し、チオニルクロリド(0.109mL、1.5mmol)を窒素雰囲気下で添加した。結果として得られた懸濁液
を全ての酸が溶解されるまで攪拌した(2時間)。溶媒酸をロータリーエバポレーターにて除去し、残留物をTHF5mLに溶解した。NH3(35%水溶液、5ml)を添加し4時
間攪拌した。THFをエバポレートした後、残留物は水(10mL)とEtOAc(20m
L)に分配された。有機層を飽和NaHCO35mLで洗浄し、Na2SO4で乾燥した。EtOAcをエバポレートし、白色固体として生成物を得た(160mg、85%)。
1H NMR:(300MHz、CDCl3):δ8.05(d、2H)、7.63‐7.46(m
、3H)、6.96(d、1H)、6.49(d、1H)、6.42(s、1H)、5.77(brs、1H)、5.44(brs、1H)、4.38‐4.14(m、4H)、3.10‐2
.81(m、5H)、2.07(s、3H)
Mass m/z:379(M+H)
【0064】
実施例14
[7-[2-(5-メチル-2-フェニル-オキサゾール-4-イル)-エトキシ]-クロマン-3-イル]-酢酸の製造
【化20】

工程A:[7-[2-(5-メチル-2-フェニル-オキサゾール-4-イル)-エトキシ]クロマン-
3-イル]アセトニトリルの製造
【化21】

THF中の7-[2-(5-メチル-2-フェニル-4-オキサゾリル)エトキシ]クロマン-3-
カルボン酸(908mg、2.40mmol、1.0当量)の攪拌溶液にボラン-THF(THF中に1M、2.63mL、1.1当量)を-5℃で滴下して加えた。4時間後、更なるボラン-THF(THF中に1M、2.63mL、1.1当量)を反応混合物に室温で添加
し、一晩攪拌した。メタノール(2mL)を反応混合物に添加し溶媒を真空下でエバポレートした。残留物をEtOAcに溶解し飽和NaHCO3で洗浄し、続いて飽和食塩水で洗
浄した。混合されたEtOAc層を乾燥し(Na2SO4)、濾過し濃縮してアルコールを得た(884mg)。
Mass m/z:366.0(M+H)
【0065】
MC(10mL)に溶解されたアルコール(140mg、0.38mmol、1.0当量)の攪拌溶液にトリエチルアミン(0.08mL、0.58mmol、1.5当量)を5℃で添加した後、メタンスルホニルクロリド(0.036mL、0.46mmol、1.2当
量)を添加した。室温で1時間攪拌後、反応を水(5mL)で停止し、反応混合物をMC(20mL x 2)で抽出した。混合された有機層を乾燥し(Na2SO4)、濾過して真空下
で濃縮し粗メシレート(180mg)を得た。
Mass m/z:444.0(M+H)
【0066】
無水DMSO(5mL)に溶解されたメシレート(134mg、0.30mmol、1.
0当量)の溶液をNaCN(103mg、7当量)と混合し、80℃で3時間攪拌した。反
応混合物をEt2O(50mL)で希釈し、飽和食塩水(50mL)で洗浄した。有機層を乾
燥し(Na2SO4)、真空下濃縮した。残留物をカラム-クロマトグラフィー(hex:E
tOAc=7:3)で精製し生成物68mg(61%)を得た。
Mass m/z:375(M+H)
【0067】
工程B:[[7-[2-(5-メチル-2-フェニル-オキサゾール-4-イル)-エトキシ]-クロマン
-3-イル]-酢酸の製造
[7-[2-(5-メチル-2-フェニル-オキサゾール-4-イル)-エトキシ]クロマン-3-イル]アセトニトリル(68mg、0.18mmol、1.0当量)の攪拌溶液を10%NaO
H3mLに懸濁させ、続いて更なるNaOH(1g)を添加した。反応混合物を一晩還流し、1N HClでpH=5に酸性化した。混合物をEtOAcで抽出し、真空下で濃縮し
た。残留物を逆相の分取用液体クロマトグラフィー(C-18カラム、直径50mm×長さ150mm、CH3CN(0.1%TFA):10分で15ないし100%、25mL/分)を用いて精製した。カルボン酸化合物を含有する画分を凍結乾燥して白色固体として生成物を得た(9mg、23%)。
1H NMR:(300MHz、CDCl3):δ8.0(m、2H)、7.45(d、2H)、6
.90(d、1H)、6.40(m、4H)、4.35(m、3H)、3.90(m、1H)、3.00(m、3H)、2.50(m、7H)。
Mass m/z:394.1(M+H)
【0068】
実施例15:生物学的アッセイ
インシュリン抵抗性はII型糖尿病の基本的な病因的因子である。末梢段階におけるインシュリン抵抗性状態は障害されたグルコース利用を引き起こすが、これは更に、先述の高血糖症、高インシュリン血症、異常脂質血症、肥満症等のような広範囲の他の病態生理学的疾病と連関している。式Iで表される化合物は以下に記載されるように、グルコース取り込み(3T3-L1脂肪細胞)、血糖低下(db/db)、経口グルコース負荷及びインシュリン耐性(高脂肪食ラット)のための試験を行った。
【0069】
a)グルコース輸送アッセイ
3T3-L1繊維芽細胞(American Type Culture
Colletion)をプレートに接着し、10%FBS、10μg/mLペ
ニシリン及びストレプトマイシンが添加されたダルベッコ変法イーグル培地(Dulbe
cco's modified Eagle's medium)(DMEM;4,500mg/Lグルコース、HyClone)で5%CO2の雰囲気下で37℃でコンフレント後
2日間培養した。その次に標準プロトコルを利用して脂肪細胞(adipocyte)分化を誘導した。48時間後、分化培地を10%FBSが添加されたDMEMを含有する維持培地に交替した。上記維持培地は細胞が実験に使用されるまで3日間毎に取り替えた。グルコース輸送活性はインシュリンの存在または非在下で測定され、そのプロトコルはKletzien、RF等(1992)Molecular Pharmacology 41:393-398から修正されたものであった。つまり、分化された3T3-L1脂肪細胞
はビヒクル(DMSO)、インシュリン(100nM)単独、試験化合物(50μM)単独及びインシュリン(100nM) + 試験化合物(50μM))で48時間培養した。培地は化合
物の存在下で一日に2回取り替えた。グルコース取り込みは2-デオキシ-D-[1-3H]
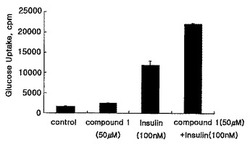
グルコースを標識として使用し、各化合物で90分培養後測定された。50μMの試験化合物及び100nMのインシュリンの個別処理はグルコース輸送において増加をみせた。しかし、グルコース輸送活性は図1に示した通り、100nMのインシュリンの存在下で50μMの試験化合物の添加により著しく増加しており、これはこの化合物の相乗効果を示すものである。
表2.分化された3T3-L1脂肪細胞の2-デオキシ-D-グルコース取り込みにおける式Iで表されるの化合物の効果
【表2】

*インシュリン100nMを使用、2-デオキシ-D-グルコース取り込みにおけるインシュリンの効果は4.0倍未満
【0070】
一連の化合物において、最も優れた結果の一つは7-[2-(5-メチル-2-フェニル-4-
オキサゾリル)-エトキシ]-クロマン-3-カルボン酸(実施例1)により得られた。この化合物は100nMのインシュリン存在下において、0-100μMの範囲で、用量-依存的なグルコース取り込みを示した(図2)。明らかに、実施例1の化合物は、それ自体では3T3-L1脂肪細胞における基礎グルコース取り込みを活性化せず(実施例1の化合物0.1ないし100μMに対して1,850ないし2,213cpm)、ビヒクルコントロール
と同様のレベル(1,841cpm)に維持されるが、これは該化合物の感受性増強活性を証明する。同様に、実施例1の化合物(50μM)の存在は、インシュリン0.1-1,0
00nMの範囲において、用量依存的にインシュリンのグルコース取り込みを更に増強する(図3)が、これは更に3T3-L1脂肪細胞における該化合物のインシュリン感受性改
善効果を評価するものである。
【0071】
b)血糖低下の効力試験(db/dbマウス)
本試験に使用されたマウスはジャクソンラボラトリー(Jackson Laboratories)(Bar Harbor、ME)により開発されたII型糖尿病の標準モデルであった。雄、8週齢db/dbマウスを標準実験室条件でワイヤ底ハンギングケージ
においてケージ当たり6匹で飼育した。マウスは通常食(Purina Rodent
Chow)及び水を自由に摂取するようにした。11ないし12週齢に、マウスは群間で
のグルコース適合のために尾から採血された(群当たりn=6)。次に群分けされたマウスはビヒクル(CMC)または式Iで表される化合物(30mg/kg/d)を7日間経口投与された。式Iで表される化合物を30mg/kg/dで0.5%CMC + H2O中の0.2
%Tween80における懸濁液として投与した。新たなサスペンションを8日間投与のため製造し冷蔵庫に保管した。該サスペンションを毎朝強制経口投与で投与した。対照群にはビヒクル(投与量10mL/kg)を投与した。血糖濃度は4日目及び8日目に基礎及
び投与後3時間でモニターされた。採血のために、マウスを固定台に置き、尾に傷を与え血液滴を得た。血糖濃度は、グルコメータによる分析のためにグルコース試験紙上に血液滴を置くことにより、又は、YSI(Yellow Spring Instrumen
ts、OH)分析器において10μL血漿サンプルを使用することの何れかにより決定さ
れた。結果は絶対血糖濃度(mg/dL)及びビヒクル処理された対象群に比較して達成さ
れた減少である%減少で表現された。300mg/dL以上の血糖を有する動物が試験に
使用された。統計学的有意性(p<0.05)はビヒクル処理された動物における適切なサンプルに対して与えられた。7日目において、マウスは18時間一晩絶食させ、グルコース濃度のチェックのため尾から採血した後、試験化合物(30mg/kg/d)を投与した。2時間後、血液試料を採りラットに10%グルコース水溶液(10mL/kg)を経口投与
し、血糖を、投与後15、30、60、90及び120分にモニターした。血液試料を遠心分離し、血漿試料を採取して、インシュリン、Tg及びFFAを分析した。
表3.db/dbマウスにおける式1で表される化合物の血糖低下効果
【表3】

実施例1及び2の化合物は0.5%CMCビヒクル中に溶解しなかったと考えられる。しかし、実施例1の化合物のマイクロエマルジョンはdb/dbマウスにおいて114%(8日、5mg/kg)に効果を増加した(データ未提示)。
【0072】
c)経口グルコース負荷試験
経口グルコース負荷試験(OGTT)が、9日間にわたり、実施例1及び2の化合物の30mg/kg/d投与後のdb/dbマウス及び高脂肪(HF)ラットにおける双方で行われ
た。OGTT及びITT試験のために、Sprague‐Dawleyラットが6週間にわたり高脂肪(HF)食(脂肪から60%カロリー)を給餌することにより作成された。試験の前に、これらは血糖濃度を基準にして取り合わせて群分けされた。その結果を下記の表4に示した。
表4.実施例1及び2の化合物を用いるOGTT処理中の血糖濃度におけるAUC
【表4】

【0073】
d)インシュリン負荷試験(ITT)
インシュリン負荷試験(ITT)は、OGTT試験動物と同様の方法で作成されたHFラットで行われた。試験日にラットは試験化合物(30mg/kg)を経口投与され、2時間
後にラットは食塩水における0.1%BSA溶液中のインシュリン(0.25U/kg、i.p.)を投与された。ラットの血糖は投与後15、30、60、120分に測定された
。
表5.実施例1及び2の化合物を用いるITT処理中の血糖濃度におけるAUC
【表5】

実施例1及び2の化合物はSTZラットにおける血糖低下効果のために試験され、これは血糖を減少させなかった(データ未提示)が、これは更に、実施例1及び2の化合物がインシュリン様物質ではなくインシュリン感受性改善薬として作用することを裏付けるものである。
【特許請求の範囲】
【請求項1】
式I
【化1】

[式中、R1、R1´、R2、R3及びR3´は独立して、H、炭素原子数1ないし7のアル
キル基、炭素原子数2ないし7のアルケニル基、炭素原子数2ないし7のアルキニル基、−Ar及びハロゲン原子{ここで、アルキル基、アルケニル基及びアルキニル基は直鎖若しくは分岐しており、及び(a)1ないし7個のハロゲン原子及び/又は(b)(i)1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基及び(ii)ハロゲン原子、炭素原子数1ないし5のアルキル基及び直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし3個の基で任意に置換されたフェニル基から独立して選択された1ないし3個の基で任意に置換され;
Arはアリール基、ヘテロアリール基及びベンゾヘテロ環(ここで、アリール基、ヘテロアリール基及びベンゾヘテロ環は、ハロゲン原子、炭素原子数1ないし5のアルキル基、炭素原子数2ないし5のアルケニル基、炭素原子数2ないし5のアルキニル基、−O炭素原子数1ないし5のアルキル基、−O炭素原子数2ないし5のアルケニル基、−O炭素原子数2ないし5のアルキニル基、−SOx炭素原子数1ないし5のアルキル基、−SOxNRaRb、−SOxフェニル基、−C(O)炭素原子数1ないし3のアルキル基及び−C(
O)NRaRb(それぞれの場合において、各アルキル基、アルケニル基及びアルキニル基は直鎖、分岐を有する直鎖若しくは分岐しており、及び(a)1ないし7個のハロゲン原子及び/又は(b)(i)1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基及び(ii)ハロゲン原子、炭素原子数1ないし5のアルキル基及び直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし3個の基で任意に置換されたフェニル基から独立して選択された1ないし3個の基で任意に置換され;
xは1又は2から選択され、アリール基は、炭素環式6ないし10員の単環性又は2環性の芳香族環系であり、ヘテロアリール基は環の周囲にN、S、Oから独立して選択される1ないし4個のヘテロ原子を有する5又は6員の飽和の又は部分的に不飽和の単環性のヘテロ環(ここで、Nは所望によりNRaであり得、及びSは所望によりSO又はSO2であり得る。)であり、ベンゾヘテロ環は、飽和の、部分的に不飽和の又は芳香族性の5又は6員のヘテロ環(ここで、該ヘテロ環は環の周囲にN、S、Oから独立して選択される1ないし3個のヘテロ原子を含み、Nは所望によりNRaであり得、及びSは所望によりS
O又はSO2であり得る。)及びベンゼン環を含み;
Ra及びRbは、H、炭素原子数1ないし5のアルキル基、炭素原子数2ないし5のアルケニル基、炭素原子数2ないし5のアルキニル基、−C(O)炭素原子数1ないし5のアルキル基、−C(O)炭素原子数2ないし5のアルケニル基、−C(O)炭素原子数2ないし5のアルキニル基、SO1-2炭素原子数1ないし5のアルキル基、SO1-2フェニル基、ハロゲン原子及びフェニル基(ここで、全ての場合、アルキル基、アルケニル基及びアル
キニル基は直鎖若しくは分岐しており、及び(a)1ないし7個のハロゲン原子及び/又は(b)(i)1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基及び(ii)ハロゲン原子、炭素原子数1ないし5のアルキル基及び直鎖若しくは分岐し、1ないし5個のハロゲン原子(ここで、ハロゲン原子はフッ素原子、塩素原子、臭素原子及びヨウ素原子から選択される。)で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし3個の基で任意に置換されたフェニル基から独立して選択された1ないし3個の基で任意に置換される。)からなる群より選択される。)から独立して選択された1ないし5個の置換基で、どの場合も任意に置換されている。)からなる群より選択される。}から選択され;
m及びnは独立して0又は1ないし6の整数から選択され;
R4及びR5は独立して、H、ハロゲン原子、炭素原子数1ないし7のアルキル基、炭素原子数2ないし7のアルケニル基、炭素原子数2ないし7のアルキニル基、−OH、−O炭素原子数1ないし5のアルキル基、−O炭素原子数2ないし5のアルケニル基、−O炭素原子数2ないし5のアルキニル基、−C(O)炭素原子数1ないし5のアルキル基、−C(O)炭素原子数2ないし5のアルケニル基、−C(O)炭素原子数2ないし5のアルキニル基、−C(O)O炭素原子数1ないし5のアルキル基、−C(O)O炭素原子数2ないし5のアルケニル基、−C(O)O炭素原子数2ないし5のアルキニル基、Ar、−OAr、−C(O)Ar、−炭素原子数3ないし8のシクロアルキル基、−O炭素原子数3ないし8のシクロアルキル基、SOx炭素原子数1ないし5のアルキル基、−SOxNRa
Rb、−SOxAr及び−C(O)NRaRb(それぞれの場合において、各アルキル基、アルケニル基及びアルキニル基は直鎖若しくは分岐しており、及び(a)1ないし5個のハロゲン原子及び/又は(b)直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし2個の基で任意に置換される。)から選択され;
Yは−O、−CRaRb、−NRa、−SO及び−SO2(式中、Ra及びRbは、H、炭素原子数1ないし5のアルキル基、炭素原子数2ないし5のアルケニル基、炭素原子数2ないし5のアルキニル基、−C(O)炭素原子数1ないし5のアルキル基、−C(O)炭素原子数2ないし5のアルケニル基、−C(O)炭素原子数2ないし5のアルキニル基、SO1-2炭素原子数1ないし5のアルキル基、SO1-2フェニル基、ハロゲン原子及びフェニル基(ここで、全ての場合、アルキル基、アルケニル基及びアルキニル基は直鎖若しくは分岐しており、及び(a)1ないし7個のハロゲン原子及び/又は(b)(i)1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基及び(ii)ハロゲン原子、炭素原子数1ないし5のアルキル基及び直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし3個の基で任意に置換されたフェニル基から独立して選択された1ないし3個の基で任意に置換される。)からなる群より選択される。)から選択され;R6及びR7は独立して、H、炭素原子数1ないし7のアルキル基、炭素原子数2ないし7のアルケニル基、炭素原子数2ないし7のアルキニル基及びAr(ここで、それぞれの場合において、アルキル基、アルケニル基及びアルキニル基は直鎖若しくは分岐しており、及び(a)1ないし5個のハロゲン原子及び/又は(b)直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし2個の基で任意に置換され、Arはアリール基、ヘテロアリール基及びベンゾヘテロ環(ここで、アリール基、ヘテロアリール基及びベンゾヘテロ環は、ハロゲン原子、炭素原子数1ないし5のアルキル基、炭素原子数2ないし5のアルケニル基、炭素原子数2ないし5のアルキニル基、−O炭素原子数1ないし5のアルキル基、−O炭素原子数2ないし5のアルケニル基、−O炭素原子数2ないし5のアルキニル基、−SOx炭素原子数1ないし5のアルキル基、−SOxNRaRb、−SOxフェニル基、−C
(O)炭素原子数1ないし3のアルキル基及び−C(O)NRaRb(それぞれの場合において、アルキル基、アルケニル基及びアルキニル基は直鎖若しくは分岐しており、及び(a)1ないし7個のハロゲン原子及び/又は(b)(i)1ないし5個のハロゲン原子で
任意に置換された−O炭素原子数1ないし3のアルキル基及び(ii)ハロゲン原子、炭素原子数1ないし5のアルキル基及び直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし3個の基で任意に置換されたフェニル基から独立して選択された1ないし3個の基で任意に置換され、Ra及びRbは上記と同様であり、及びXは1ないし2の整数から選択される。)から独立して選択された1ないし5個の置換基で、どの場合も任意に置換されている。)からなる群より選択される。)から選択され;及び
Wは、−ORa、−NRaRb、−NRaSO2Rb(式中、Ra及びRbは独立して、H、炭素原子数1ないし4のアルキル基及びアリール基(ここで、全ての場合、アルキル基は直鎖若しくは分岐しており、及び(a)1ないし7個のハロゲン原子及び/又は(b)(i)1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基及び(ii)ハロゲン原子、炭素原子数1ないし5のアルキル基及び直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし3個の基で任意に置換されたフェニル基から独立して選択された1ないし3個の基で任意に置換される。)からなる群より選択される。)からなる群より選択される。]で表される化合物及びその医薬的に許容される塩。
【請求項2】
C3位の立体配置が(S)、(R)又は(S)/(R)混合物である請求項1に記載の式
Iで表される化合物。
【請求項3】
R1、R1´、R2、R3、R3´、R4及びR5は独立して、H、Cl、Br、F、−O炭素
原子数1ないし4のアルキル基及び炭素原子数1ないし4のアルキル基からなる群より選択され、前記アルキル基は直鎖又は分岐鎖であり、1ないし3個のハロゲン原子で任意に置換される請求項1に記載の式Iで表される化合物。
【請求項4】
R1、R1´、R2、R3、R3´、R4及びR5は全て水素原子である請求項1に記載の式I
で表される化合物。
【請求項5】
nが0、1又は2である請求項1に記載の式Iで表される化合物。
【請求項6】
YがO又はSO2である請求項1に記載の式Iで表される化合物。
【請求項7】
mが1、2、3又は4である請求項1に記載の式Iで表される化合物。
【請求項8】
R6がH、Me及びPhからなる群より選択される請求項1に記載の式Iで表される化合
物。
【請求項9】
R7がH、Me、Et、Ph、2−チオフェニル基、ビフェニル基からなる群より選択さ
れ、前記Ph、チオフェニル基及びビフェニル基が1ないし3個のハロゲン原子で置換される請求項1に記載の式Iで表される化合物。
【請求項10】
Wが、哺乳類の成体への投与の間又は投与の後に、生理条件下で容易に脱離してカルボン酸を生産する基であり、前記Wが−ORa、−NRRaRb(式中、Ra及びRbはMe及び
Etである。)から選択される請求項1に記載の式Iで表される化合物。
【請求項11】
クロマン環のC3位の立体化学がRである請求項1ないし10の何れか1項に記載の化合
物。
【請求項12】
クロマン環のC3位の立体化学がSである請求項1ないし10の何れか1項に記載の化合
物。
【請求項13】
式Iで表される化合物が以下に示す構造から選択される請求項1ないし10の何れか1項に記載の化合物。
【化2】

【化3】

【化4】

【請求項14】
クロマン環のC3位の立体化学がRである請求項13に記載の化合物。
【請求項15】
クロマン環のC3位の立体化学がSである請求項13に記載の化合物。
【請求項16】
C3位の立体配置が(S)/(R)混合物である請求項13に記載の化合物。
【請求項17】
以下
【化5】

に示すように、R1、R1´、R2、R3、R3´、R4及びR5は全て水素原子であり、R6はメチル基であり、R7はフェニル基であり、mは2であり、nは0であり、Wは−OHで
あり、クロマン環のC3位はRである請求項1ないし10の何れか1項に記載の化合物。
【請求項18】
以下
【化6】

に示すように、R1、R1´、R2、R3、R3´、R4及びR5は全て水素原子であり、R6はメチル基であり、R7はフェニル基であり、mは2であり、nは0であり、Wは−OHで
あり、クロマン環のC3位はSである請求項1ないし10の何れか1項に記載の化合物。
【請求項19】
カルボン酸基が、その分子を医薬的に許容される塩分子にするために種々のタイプの対カチオンを伴うアニオンとして存在し、ここで対カチオンがNa、K、ビグアニド、アルギニン、リジン及びヒスチジンから選択される請求項13に記載の化合物。
【請求項20】
請求項1ないし10の何れか1項に記載の式Iで表される化合物又はそれらのプロドラッグの有効量、及び医薬的に許容されるキャリアを含有する医薬組成物。
【請求項21】
請求項13ないし16の何れか1項に記載の化合物又はそれらのプロドラッグの有効量、及び医薬的に許容されるキャリアを含有する医薬組成物。
【請求項22】
請求項17ないし18の何れか1項に記載の化合物又はそれらのプロドラッグの有効量、及び医薬的に許容されるキャリアを含有する医薬組成物。
【請求項23】
インシュリン非依存性糖尿病(II型)を治療、コントロール又は予防を必要とする哺乳類患者における該治療、コントロール又は予防方法であって、請求項1に記載の化合物の治療的有効量を前記患者へ投与することからなる方法。
【請求項24】
高血糖症を治療、コントロール又は予防を必要とする哺乳類患者における該治療、コントロール又は予防方法であって、請求項1に記載の化合物の治療的有効量を前記患者へ投与することからなる方法。
【請求項25】
脂質障害、高脂血症又は低HDLを治療、コントロール又は予防を必要とする哺乳類患者における該治療、コントロール又は予防方法であって、請求項1に記載の化合物の治療的有効量を前記患者へ投与することからなる方法。
【請求項26】
肥満症を治療、コントロール又は予防を必要とする哺乳類患者における該治療、コントロール又は予防方法であって、請求項1に記載の化合物の治療的有効量を前記患者へ投与することからなる方法。
【請求項27】
高コレステロール血症を治療、コントロール又は予防を必要とする哺乳類患者における該治療、コントロール又は予防方法であって、請求項1に記載の化合物の治療的有効量を前記患者へ投与することからなる方法。
【請求項28】
高トリグリセリド血症を治療、コントロール又は予防を必要とする哺乳類患者における該治療、コントロール又は予防方法であって、請求項1に記載の化合物の治療的有効量を前記患者へ投与することからなる方法。
【請求項29】
異常脂質血症及び/又は低HDLコレステロール血症を治療、コントロール又は予防を必
要とする哺乳類患者における該治療、コントロール又は予防方法であって、請求項1に記載の化合物の治療的有効量を前記患者へ投与することからなる方法。
【請求項30】
アテローム性動脈硬化症を治療、コントロール又は予防を必要とする哺乳類患者における該治療、コントロール又は予防方法であって、請求項1に記載の化合物の治療的有効量を前記患者へ投与することからなる方法。
【請求項31】
インシュリン抵抗性が要因である(1)インシュリン非依存性糖尿病(NIDDM)、(2)高血糖症、(3)耐糖能異常、(4)インシュリン抵抗性、(5)肥満症、(6)脂質障害、(7)異常脂質血症、(8)高リポタンパク血症、(9)高トリグリセリド血症、(10)高コレステロール血症、(11)低HDL濃度、(12)高LDL濃度、(13)アテローム性動脈硬化症、(14)網膜症、(15)神経障害、(16)腎症、(17)シンドロームX、及び他の障害からなる群より選択される一つ又はそれ以上の疾患、障害又は病気を治療、コントロール又は予防する方法であって、該方法は、請求項1に記載の化合物の有効量を投与することからなる方法。
【請求項32】
インシュリン抵抗性が要因である、請求項31に記載の群より選択される一つ又はそれ以上の疾患、障害又は病気を治療、コントロール又は予防する方法であって、該方法は、請求項1に記載の化合物の有効量、及び
(a)(i)メトフォルミン及びフェンフォルミンのようなビグアニド、(ii)ピオグリタゾン、ロシグリタゾン及びエングリタゾンのようなPPARγアゴニスト(iii)プロテインチロシンフォスファターゼ−1B(PTP−1B)阻害剤、及び(iv)ジペプチジルペプチダーゼIV阻害剤、を含むインシュリン感受性改善剤;
(b)インシュリン及びインシュリン様物質;
(c)トルブタミド及びグリブリドのようなスルホニルウレア;
(d)α−グリコシダーゼ阻害剤;
(e)HMG−CoA還元酵素阻害剤のようなコレステロール低下剤;
(f)フェンフルラミン及びデクスフェンフルラミンのような抗肥満化合物;
(g)MBX−102のようなシクロオキシナーゼ−2(COX−2)阻害剤;及び
(h)オルリスタットのようなリパーゼ阻害剤
からなる群より選択される一つ又はそれ以上の化合物の有効量を投与することからなる方法。
【請求項33】
アテローム性動脈硬化症を治療、予防又はコントロールを必要とする哺乳類患者における該治療、予防又はコントロール方法であって、請求項1に記載の化合物の有効量及びHMG−CoA還元酵素阻害剤の有効量を前記患者へ投与することからなる方法。
【請求項34】
HMG−CoA還元酵素阻害剤がスタチンである請求項33に記載の方法。
【請求項35】
スタチンが、ロバスタチン、プラバスタチン、フルバスタチン、アトロバスタチン、イタバスタチン及びリバスタチンからなる群より選択される請求項33に記載の方法。
【請求項1】
式I
【化1】

[式中、R1、R1´、R2、R3及びR3´は独立して、H、炭素原子数1ないし7のアル
キル基、炭素原子数2ないし7のアルケニル基、炭素原子数2ないし7のアルキニル基、−Ar及びハロゲン原子{ここで、アルキル基、アルケニル基及びアルキニル基は直鎖若しくは分岐しており、及び(a)1ないし7個のハロゲン原子及び/又は(b)(i)1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基及び(ii)ハロゲン原子、炭素原子数1ないし5のアルキル基及び直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし3個の基で任意に置換されたフェニル基から独立して選択された1ないし3個の基で任意に置換され;
Arはアリール基、ヘテロアリール基及びベンゾヘテロ環(ここで、アリール基、ヘテロアリール基及びベンゾヘテロ環は、ハロゲン原子、炭素原子数1ないし5のアルキル基、炭素原子数2ないし5のアルケニル基、炭素原子数2ないし5のアルキニル基、−O炭素原子数1ないし5のアルキル基、−O炭素原子数2ないし5のアルケニル基、−O炭素原子数2ないし5のアルキニル基、−SOx炭素原子数1ないし5のアルキル基、−SOxNRaRb、−SOxフェニル基、−C(O)炭素原子数1ないし3のアルキル基及び−C(
O)NRaRb(それぞれの場合において、各アルキル基、アルケニル基及びアルキニル基は直鎖、分岐を有する直鎖若しくは分岐しており、及び(a)1ないし7個のハロゲン原子及び/又は(b)(i)1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基及び(ii)ハロゲン原子、炭素原子数1ないし5のアルキル基及び直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし3個の基で任意に置換されたフェニル基から独立して選択された1ないし3個の基で任意に置換され;
xは1又は2から選択され、アリール基は、炭素環式6ないし10員の単環性又は2環性の芳香族環系であり、ヘテロアリール基は環の周囲にN、S、Oから独立して選択される1ないし4個のヘテロ原子を有する5又は6員の飽和の又は部分的に不飽和の単環性のヘテロ環(ここで、Nは所望によりNRaであり得、及びSは所望によりSO又はSO2であり得る。)であり、ベンゾヘテロ環は、飽和の、部分的に不飽和の又は芳香族性の5又は6員のヘテロ環(ここで、該ヘテロ環は環の周囲にN、S、Oから独立して選択される1ないし3個のヘテロ原子を含み、Nは所望によりNRaであり得、及びSは所望によりS
O又はSO2であり得る。)及びベンゼン環を含み;
Ra及びRbは、H、炭素原子数1ないし5のアルキル基、炭素原子数2ないし5のアルケニル基、炭素原子数2ないし5のアルキニル基、−C(O)炭素原子数1ないし5のアルキル基、−C(O)炭素原子数2ないし5のアルケニル基、−C(O)炭素原子数2ないし5のアルキニル基、SO1-2炭素原子数1ないし5のアルキル基、SO1-2フェニル基、ハロゲン原子及びフェニル基(ここで、全ての場合、アルキル基、アルケニル基及びアル
キニル基は直鎖若しくは分岐しており、及び(a)1ないし7個のハロゲン原子及び/又は(b)(i)1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基及び(ii)ハロゲン原子、炭素原子数1ないし5のアルキル基及び直鎖若しくは分岐し、1ないし5個のハロゲン原子(ここで、ハロゲン原子はフッ素原子、塩素原子、臭素原子及びヨウ素原子から選択される。)で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし3個の基で任意に置換されたフェニル基から独立して選択された1ないし3個の基で任意に置換される。)からなる群より選択される。)から独立して選択された1ないし5個の置換基で、どの場合も任意に置換されている。)からなる群より選択される。}から選択され;
m及びnは独立して0又は1ないし6の整数から選択され;
R4及びR5は独立して、H、ハロゲン原子、炭素原子数1ないし7のアルキル基、炭素原子数2ないし7のアルケニル基、炭素原子数2ないし7のアルキニル基、−OH、−O炭素原子数1ないし5のアルキル基、−O炭素原子数2ないし5のアルケニル基、−O炭素原子数2ないし5のアルキニル基、−C(O)炭素原子数1ないし5のアルキル基、−C(O)炭素原子数2ないし5のアルケニル基、−C(O)炭素原子数2ないし5のアルキニル基、−C(O)O炭素原子数1ないし5のアルキル基、−C(O)O炭素原子数2ないし5のアルケニル基、−C(O)O炭素原子数2ないし5のアルキニル基、Ar、−OAr、−C(O)Ar、−炭素原子数3ないし8のシクロアルキル基、−O炭素原子数3ないし8のシクロアルキル基、SOx炭素原子数1ないし5のアルキル基、−SOxNRa
Rb、−SOxAr及び−C(O)NRaRb(それぞれの場合において、各アルキル基、アルケニル基及びアルキニル基は直鎖若しくは分岐しており、及び(a)1ないし5個のハロゲン原子及び/又は(b)直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし2個の基で任意に置換される。)から選択され;
Yは−O、−CRaRb、−NRa、−SO及び−SO2(式中、Ra及びRbは、H、炭素原子数1ないし5のアルキル基、炭素原子数2ないし5のアルケニル基、炭素原子数2ないし5のアルキニル基、−C(O)炭素原子数1ないし5のアルキル基、−C(O)炭素原子数2ないし5のアルケニル基、−C(O)炭素原子数2ないし5のアルキニル基、SO1-2炭素原子数1ないし5のアルキル基、SO1-2フェニル基、ハロゲン原子及びフェニル基(ここで、全ての場合、アルキル基、アルケニル基及びアルキニル基は直鎖若しくは分岐しており、及び(a)1ないし7個のハロゲン原子及び/又は(b)(i)1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基及び(ii)ハロゲン原子、炭素原子数1ないし5のアルキル基及び直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし3個の基で任意に置換されたフェニル基から独立して選択された1ないし3個の基で任意に置換される。)からなる群より選択される。)から選択され;R6及びR7は独立して、H、炭素原子数1ないし7のアルキル基、炭素原子数2ないし7のアルケニル基、炭素原子数2ないし7のアルキニル基及びAr(ここで、それぞれの場合において、アルキル基、アルケニル基及びアルキニル基は直鎖若しくは分岐しており、及び(a)1ないし5個のハロゲン原子及び/又は(b)直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし2個の基で任意に置換され、Arはアリール基、ヘテロアリール基及びベンゾヘテロ環(ここで、アリール基、ヘテロアリール基及びベンゾヘテロ環は、ハロゲン原子、炭素原子数1ないし5のアルキル基、炭素原子数2ないし5のアルケニル基、炭素原子数2ないし5のアルキニル基、−O炭素原子数1ないし5のアルキル基、−O炭素原子数2ないし5のアルケニル基、−O炭素原子数2ないし5のアルキニル基、−SOx炭素原子数1ないし5のアルキル基、−SOxNRaRb、−SOxフェニル基、−C
(O)炭素原子数1ないし3のアルキル基及び−C(O)NRaRb(それぞれの場合において、アルキル基、アルケニル基及びアルキニル基は直鎖若しくは分岐しており、及び(a)1ないし7個のハロゲン原子及び/又は(b)(i)1ないし5個のハロゲン原子で
任意に置換された−O炭素原子数1ないし3のアルキル基及び(ii)ハロゲン原子、炭素原子数1ないし5のアルキル基及び直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし3個の基で任意に置換されたフェニル基から独立して選択された1ないし3個の基で任意に置換され、Ra及びRbは上記と同様であり、及びXは1ないし2の整数から選択される。)から独立して選択された1ないし5個の置換基で、どの場合も任意に置換されている。)からなる群より選択される。)から選択され;及び
Wは、−ORa、−NRaRb、−NRaSO2Rb(式中、Ra及びRbは独立して、H、炭素原子数1ないし4のアルキル基及びアリール基(ここで、全ての場合、アルキル基は直鎖若しくは分岐しており、及び(a)1ないし7個のハロゲン原子及び/又は(b)(i)1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基及び(ii)ハロゲン原子、炭素原子数1ないし5のアルキル基及び直鎖若しくは分岐し、1ないし5個のハロゲン原子で任意に置換された−O炭素原子数1ないし3のアルキル基から独立して選択された1ないし3個の基で任意に置換されたフェニル基から独立して選択された1ないし3個の基で任意に置換される。)からなる群より選択される。)からなる群より選択される。]で表される化合物及びその医薬的に許容される塩。
【請求項2】
C3位の立体配置が(S)、(R)又は(S)/(R)混合物である請求項1に記載の式
Iで表される化合物。
【請求項3】
R1、R1´、R2、R3、R3´、R4及びR5は独立して、H、Cl、Br、F、−O炭素
原子数1ないし4のアルキル基及び炭素原子数1ないし4のアルキル基からなる群より選択され、前記アルキル基は直鎖又は分岐鎖であり、1ないし3個のハロゲン原子で任意に置換される請求項1に記載の式Iで表される化合物。
【請求項4】
R1、R1´、R2、R3、R3´、R4及びR5は全て水素原子である請求項1に記載の式I
で表される化合物。
【請求項5】
nが0、1又は2である請求項1に記載の式Iで表される化合物。
【請求項6】
YがO又はSO2である請求項1に記載の式Iで表される化合物。
【請求項7】
mが1、2、3又は4である請求項1に記載の式Iで表される化合物。
【請求項8】
R6がH、Me及びPhからなる群より選択される請求項1に記載の式Iで表される化合
物。
【請求項9】
R7がH、Me、Et、Ph、2−チオフェニル基、ビフェニル基からなる群より選択さ
れ、前記Ph、チオフェニル基及びビフェニル基が1ないし3個のハロゲン原子で置換される請求項1に記載の式Iで表される化合物。
【請求項10】
Wが、哺乳類の成体への投与の間又は投与の後に、生理条件下で容易に脱離してカルボン酸を生産する基であり、前記Wが−ORa、−NRRaRb(式中、Ra及びRbはMe及び
Etである。)から選択される請求項1に記載の式Iで表される化合物。
【請求項11】
クロマン環のC3位の立体化学がRである請求項1ないし10の何れか1項に記載の化合
物。
【請求項12】
クロマン環のC3位の立体化学がSである請求項1ないし10の何れか1項に記載の化合
物。
【請求項13】
式Iで表される化合物が以下に示す構造から選択される請求項1ないし10の何れか1項に記載の化合物。
【化2】

【化3】

【化4】

【請求項14】
クロマン環のC3位の立体化学がRである請求項13に記載の化合物。
【請求項15】
クロマン環のC3位の立体化学がSである請求項13に記載の化合物。
【請求項16】
C3位の立体配置が(S)/(R)混合物である請求項13に記載の化合物。
【請求項17】
以下
【化5】

に示すように、R1、R1´、R2、R3、R3´、R4及びR5は全て水素原子であり、R6はメチル基であり、R7はフェニル基であり、mは2であり、nは0であり、Wは−OHで
あり、クロマン環のC3位はRである請求項1ないし10の何れか1項に記載の化合物。
【請求項18】
以下
【化6】

に示すように、R1、R1´、R2、R3、R3´、R4及びR5は全て水素原子であり、R6はメチル基であり、R7はフェニル基であり、mは2であり、nは0であり、Wは−OHで
あり、クロマン環のC3位はSである請求項1ないし10の何れか1項に記載の化合物。
【請求項19】
カルボン酸基が、その分子を医薬的に許容される塩分子にするために種々のタイプの対カチオンを伴うアニオンとして存在し、ここで対カチオンがNa、K、ビグアニド、アルギニン、リジン及びヒスチジンから選択される請求項13に記載の化合物。
【請求項20】
請求項1ないし10の何れか1項に記載の式Iで表される化合物又はそれらのプロドラッグの有効量、及び医薬的に許容されるキャリアを含有する医薬組成物。
【請求項21】
請求項13ないし16の何れか1項に記載の化合物又はそれらのプロドラッグの有効量、及び医薬的に許容されるキャリアを含有する医薬組成物。
【請求項22】
請求項17ないし18の何れか1項に記載の化合物又はそれらのプロドラッグの有効量、及び医薬的に許容されるキャリアを含有する医薬組成物。
【請求項23】
インシュリン非依存性糖尿病(II型)を治療、コントロール又は予防を必要とする哺乳類患者における該治療、コントロール又は予防方法であって、請求項1に記載の化合物の治療的有効量を前記患者へ投与することからなる方法。
【請求項24】
高血糖症を治療、コントロール又は予防を必要とする哺乳類患者における該治療、コントロール又は予防方法であって、請求項1に記載の化合物の治療的有効量を前記患者へ投与することからなる方法。
【請求項25】
脂質障害、高脂血症又は低HDLを治療、コントロール又は予防を必要とする哺乳類患者における該治療、コントロール又は予防方法であって、請求項1に記載の化合物の治療的有効量を前記患者へ投与することからなる方法。
【請求項26】
肥満症を治療、コントロール又は予防を必要とする哺乳類患者における該治療、コントロール又は予防方法であって、請求項1に記載の化合物の治療的有効量を前記患者へ投与することからなる方法。
【請求項27】
高コレステロール血症を治療、コントロール又は予防を必要とする哺乳類患者における該治療、コントロール又は予防方法であって、請求項1に記載の化合物の治療的有効量を前記患者へ投与することからなる方法。
【請求項28】
高トリグリセリド血症を治療、コントロール又は予防を必要とする哺乳類患者における該治療、コントロール又は予防方法であって、請求項1に記載の化合物の治療的有効量を前記患者へ投与することからなる方法。
【請求項29】
異常脂質血症及び/又は低HDLコレステロール血症を治療、コントロール又は予防を必
要とする哺乳類患者における該治療、コントロール又は予防方法であって、請求項1に記載の化合物の治療的有効量を前記患者へ投与することからなる方法。
【請求項30】
アテローム性動脈硬化症を治療、コントロール又は予防を必要とする哺乳類患者における該治療、コントロール又は予防方法であって、請求項1に記載の化合物の治療的有効量を前記患者へ投与することからなる方法。
【請求項31】
インシュリン抵抗性が要因である(1)インシュリン非依存性糖尿病(NIDDM)、(2)高血糖症、(3)耐糖能異常、(4)インシュリン抵抗性、(5)肥満症、(6)脂質障害、(7)異常脂質血症、(8)高リポタンパク血症、(9)高トリグリセリド血症、(10)高コレステロール血症、(11)低HDL濃度、(12)高LDL濃度、(13)アテローム性動脈硬化症、(14)網膜症、(15)神経障害、(16)腎症、(17)シンドロームX、及び他の障害からなる群より選択される一つ又はそれ以上の疾患、障害又は病気を治療、コントロール又は予防する方法であって、該方法は、請求項1に記載の化合物の有効量を投与することからなる方法。
【請求項32】
インシュリン抵抗性が要因である、請求項31に記載の群より選択される一つ又はそれ以上の疾患、障害又は病気を治療、コントロール又は予防する方法であって、該方法は、請求項1に記載の化合物の有効量、及び
(a)(i)メトフォルミン及びフェンフォルミンのようなビグアニド、(ii)ピオグリタゾン、ロシグリタゾン及びエングリタゾンのようなPPARγアゴニスト(iii)プロテインチロシンフォスファターゼ−1B(PTP−1B)阻害剤、及び(iv)ジペプチジルペプチダーゼIV阻害剤、を含むインシュリン感受性改善剤;
(b)インシュリン及びインシュリン様物質;
(c)トルブタミド及びグリブリドのようなスルホニルウレア;
(d)α−グリコシダーゼ阻害剤;
(e)HMG−CoA還元酵素阻害剤のようなコレステロール低下剤;
(f)フェンフルラミン及びデクスフェンフルラミンのような抗肥満化合物;
(g)MBX−102のようなシクロオキシナーゼ−2(COX−2)阻害剤;及び
(h)オルリスタットのようなリパーゼ阻害剤
からなる群より選択される一つ又はそれ以上の化合物の有効量を投与することからなる方法。
【請求項33】
アテローム性動脈硬化症を治療、予防又はコントロールを必要とする哺乳類患者における該治療、予防又はコントロール方法であって、請求項1に記載の化合物の有効量及びHMG−CoA還元酵素阻害剤の有効量を前記患者へ投与することからなる方法。
【請求項34】
HMG−CoA還元酵素阻害剤がスタチンである請求項33に記載の方法。
【請求項35】
スタチンが、ロバスタチン、プラバスタチン、フルバスタチン、アトロバスタチン、イタバスタチン及びリバスタチンからなる群より選択される請求項33に記載の方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公表番号】特表2007−503431(P2007−503431A)
【公表日】平成19年2月22日(2007.2.22)
【国際特許分類】
【出願番号】特願2006−524579(P2006−524579)
【出願日】平成16年8月27日(2004.8.27)
【国際出願番号】PCT/KR2004/002155
【国際公開番号】WO2005/021540
【国際公開日】平成17年3月10日(2005.3.10)
【出願人】(303024622)エスケー コーポレイション (28)
【Fターム(参考)】
【公表日】平成19年2月22日(2007.2.22)
【国際特許分類】
【出願日】平成16年8月27日(2004.8.27)
【国際出願番号】PCT/KR2004/002155
【国際公開番号】WO2005/021540
【国際公開日】平成17年3月10日(2005.3.10)
【出願人】(303024622)エスケー コーポレイション (28)
【Fターム(参考)】
[ Back to top ]

