糖尿病合併症検査用試薬
【課題】被験者の尿や血液等の体液を接触させて活性測定を行うという簡単な操作で、糖尿病患者の体液に含まれるマーカーの特定や追跡をしなくても、糖尿病性腎症を発症しているか否か、発症している場合に進行度合いは第1期〜第4期のいずれなのかを判別することができるとともに、第1期〜第4期の治療の有効性の検討や人工透析をいつ頃導入することになるか等の病状の進行予測を精密化させ、医師の診断支援に極めて有効な糖尿病合併症検査用試薬を提供する。
【解決手段】本発明は、3個のアミノ酸が結合した基質ペプチドが4種以上組み合わせられている。
【解決手段】本発明は、3個のアミノ酸が結合した基質ペプチドが4種以上組み合わせられている。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、糖尿病の合併症、特に糖尿病性腎症の検査や進行度の管理に有効な糖尿病合併症検査用試薬に関するものである。
【背景技術】
【0002】
近年、糖尿病や糖尿病合併症の発症検査のためのマーカーが見出されている。
例えば、糖尿病合併症の診断に有効なマーカーとして「N末端がカルボキシル化されたヘモグロビン(特許文献1)」や「特定のピリジニウム化合物(特許文献2)」が開示されている。また、血中と尿中のクレアチニン濃度を測定し、糖尿病性腎症による腎機能の低下度を検査する方法も知られている。
【特許文献1】特許第3542245号公報
【特許文献2】特許第3205899号公報
【発明の開示】
【発明が解決しようとする課題】
【0003】
しかしながら上記従来の技術においては、以下のような課題を有していた。
(1)(特許文献1)、(特許文献2)に開示の技術や、クレアチニン濃度の測定による検査方法は、いずれも、カルボキシル化されたヘモグロビン,特定のピリジニウム化合物,クレアチニンのような特定物質を指標として、その特定物質が体液中にどの程度存在するかを測定して、糖尿病による腎臓等の臓器の機能低下を判断するものである。そのため、糖尿病による臓器の機能低下が、これらの特定物質の濃度変化として現れない場合は、糖尿病や糖尿病合併症の発症や進行度合いを検知することができないという課題を有していた。
(2)糖尿病性腎症は、第1期(腎症前期)、第2期(早期腎症)、第3期(顕性腎症)、第4期(腎不全期)と進行し、腎機能が廃絶し透析療法期に至る。血中と尿中のクレアチニン濃度を測定する方法は、主に第4期の検査で用いられており、クレアチニンは透析を導入するか否かを判断するマーカーである。そのため、クレアチニンを用いる方法では、透析を導入するか否かを判断するだけで、第1期〜第4期に至るまでの病状の進行度は全く判断することができず、そのため第1期〜第4期に至る間に施される血糖コントロール、血圧管理及び治療が有効か否かを判断することもできないという課題を有していた。
(3)糖尿病性腎症が第3期まで進行すると、腎機能は急激に低下するため腎症の進行を完全に防止することは困難になる。そのため、第1期〜第3期の病状の進行度の管理がたいへん重要である。しかしながら、この間の病状の進行度管理を行う技術は皆無であった。
(4)尿や血漿中にはタンパク質分解酵素活性を示す物質(以下、酵素という。)が含まれていることが以前から良く知られている。尿中に含まれる酵素としては、ウロキナーゼやユリナリーカリクレインが知られている。また、腎機能の低下によって未知の酵素が漏出することも考えられる。しかし、個々の酵素の活性や存在量、安定性等を個別に解析することは困難なため、これらの酵素を腎機能マーカーとして捉えることはできなかった。
【0004】
本発明は上記従来の課題を解決するもので、被験者の尿や血液等の体液を接触させて活性測定を行うという簡単な操作で、糖尿病患者の体液に含まれるマーカーの特定や追跡をしなくても、糖尿病性腎症を発症しているか否か、発症している場合に進行度合いは第1期〜第4期のいずれなのかを判別することができるとともに、第1期〜第4期の治療の有効性の検討や人工透析をいつ頃導入することになるか等の病状の進行予測を精密化させ、医師の診断支援に極めて有効な糖尿病合併症検査用試薬を提供することを目的とする。
【課題を解決するための手段】
【0005】
上記従来の課題を解決するために本発明の糖尿病合併症検査用試薬は、以下の構成を有している。
本発明の請求項1に記載の糖尿病合併症検査用試薬は、3個のアミノ酸が結合した基質ペプチドが4種以上組み合わせられた構成を有している。
この構成により、以下のような作用が得られる。
(1)尿や血液等の体液には各種の酵素が分泌されており、体液に分泌される酵素の量や種類は、糖尿病の発症や糖尿病性腎症の進行によって常に変化している。本発明者らは、3個のアミノ酸が結合した4種以上の基質ペプチドを用い、体液の酵素活性全体を一括して評価し、それを腎機能障害と関連付けることにより、マーカーを特定しなくても、体液中に存在する酵素の種類,個々の存在量や活性強度に関わらず、糖尿病性腎症の発症や進行度合いを判別できることを見出した。これにより、被験者の尿や血液等の体液を接触させて活性測定を行うという簡単な操作で、糖尿病性腎症を発症しているか否か、発症している場合に進行度合いは第1期〜第4期のいずれなのかを判別することができるとともに、第1期〜第4期の治療の有効性の検討や人工透析をいつ頃導入することになるか等の病状の進行予測の精密化が可能となる。
(2)尿に分泌される酵素、血液に分泌される酵素はそれぞれ異なるため、基質ペプチドの組み合わせによって、体液の種類に応じた活性検出を行うことができ応用性に優れる。
(3)基質ペプチドはペプチド合成機等を用いて容易に製造できるため、生産性に優れる。
【0006】
ここで、アミノ酸としては、天然に存在するタンパク質中に通常見出されるL−アミノ酸を用いることができる。
基質ペプチドは、固相法や液相法の通常のペプチド合成法を用いて合成することができる。また、目的とするアミノ酸配列のC末端側からN末端側へ逐次伸長していく逐次伸長法や、複数の短いペプチド断片を合成しペプチド断片間のカップリングにより伸長させる断片縮合法等を用いることができる。また、ペプチド合成機を用いて9−フルオレニルメチルオキシカルボニル(Fmoc)アミノ酸やt−ブチルオキシカルボニル(Boc)アミノ酸等を導入して合成することもできる。さらに、プロテアーゼを用いてペプチド結合を生成したり、遺伝子工学を利用したりして合成することもできる。
【0007】
糖尿病の検査を行う際には、基質ペプチドの各々に被験者の尿や血液等の体液や体液の培養液等の検体液を接触させ、検体液中の酵素と反応させることにより酵素の活性測定を行う。検体液は生体試料(血液等)をそのまま、あるいはフィルタや遠心分離等で血球成分等を除去したものを用いることができる。また、生体試料を基に酵素が活性を発現するような条件設定(pH調整、活性剤導入など)を行ったものを使用することもできる。pH調整剤としては、Tris−HCl,Hepes−KOH等の緩衝剤を反応バッファーとして添加することができる。また、酵素活性の発現に必要な塩類や活性保護剤を添加することもできる。
【0008】
活性測定の方法としては、公知の種々の方法を用いることができる。例えば、基質ペプチドの減少量を特定波長の吸光度で測定する方法、基質ペプチドや反応生成物を化学試薬で発色させて測定する方法、その他放射能、比色、蛍光、発光等を利用して測定する方法を用いることもできる。
酵素活性の測定は、反応の時間経過を追跡し反応初速度や変化量を求めるのが好ましい。反応時間の経過につれて反応速度が漸減するからである。
【0009】
糖尿病合併症の検査や進行度管理は、始めに、糖尿病にかかっているが糖尿病性腎症は発症していない患者の尿等の検体液、糖尿病性腎症を発症している患者の検体液を、複数種の基質ペプチドの各々と反応させて酵素活性を測定し、判別分析等の公知の手法によって、糖尿病性腎症を発症しているグループと発症していないグループに判別する基準(判別関数)を予め設定しておく。判別関数を得るには、線形手法、非線形手法のいずれも用いることができる。
次に、未知の被験者の検体液を、判別関数を設定したときに用いたのと同じ種類の基質ペプチドの各々と反応させて酵素活性を測定し、未知の被験者が、予め設定したグループのいずれに属するのかを判別することで、糖尿病性腎症の発症や進行度を判断することができる。
また、データをSOM(自己組織化マップ)解析により二次元マップ化すると視覚化し易くなり、マップ上に糖尿病性腎症の進行の度合いに応じて複数のグループに分類できるため、未知の被験者が病状の進行度合い(第1期〜第4期)を把握し易くなり、人工透析をいつ頃導入することになるか等の病状の進行予測を視覚的に行うことができる。
なお、得られた酵素活性データは、SOM以外の種々の非線形分類法や非線形要因解析法により解析し、糖尿病の合併症の検査や進行度管理を行うことができる。
【0010】
基質ペプチドの組み合わせとしては、4種以上8種以下好ましくは4種以上6種以下が好適に用いられる。酵素活性の測定や解析を比較的容易に行うことができ、さらに判別精度に優れるからである。組み合わせが4種より少なくなるにつれ、判別精度が低下する傾向がみられる。6種を超えると酵素活性の測定や解析が煩雑になる傾向がみられ、8種を超えると、この傾向が著しくなるため好ましくない。
【0011】
本発明の請求項2に記載の発明は、請求項1に記載の糖尿病検出用試薬であって、前記基質ペプチドの4種の組み合わせが、(a)Leu-Val-Tyr, His-Glu-Lys, Glu-Lys-Lys, Thr-Arg-Ala, (b)Leu-Gly-Arg, Gly-Arg-Ile, Gly-Arg-Thr, Gly-Arg-Gly, (c)Asn-Pro-Arg, Asp-Gly-Arg, Arg-Arg-Gln, Pro-Leu-Gly又はAla-Lys-Ser, (d) Gln-Arg-Arg, His-Leu-Lys, Glu-Lys-Gly, Ala-Arg-Ser, (e) Val-Leu-Lys, Gly-Arg-Ile, Ala-Lys-Ser, Gly-Arg-Gly, (f) Val-Val-Arg, Val-Pro-Arg, Thr-Arg-Val, Asn-Lys-Tyr, (g) Gly-Arg-Ile, Gly-Arg-Thr, Phe-Lys-Ile, Ala-Lys-Ser, (h) Ala-Pro-Phe, Leu-Leu-Glu, Leu-Val-Tyr, Val-Leu-Lys, (i) Thr-Arg-Ala, Pro-Val-Arg, Gln-Arg-Ile, Leu-Met-Lys, (j) Val-Val-Arg, Pro-Val-Arg, Gln-Arg-Ile, Leu-Met-Lys, (k) Ser-Pro-Arg, Lys-Arg-Lys, Lys-Arg-Asp, Ser-Arg-Leu, (l) His-Leu-Lys, Lys-Arg-Lys, Lys-Arg-Asp, Ser-Arg-Leuのいずれかである構成を有している。
この構成により、請求項1で得られる作用に加え、以下のような作用が得られる。
(1)(a)Leu-Val-Tyr, His-Glu-Lys, Glu-Lys-Lys, Thr-Arg-Ala, (b)Leu-Gly-Arg, Gly-Arg-Ile, Gly-Arg-Thr, Gly-Arg-Gly, (c)Asn-Pro-Arg, Asp-Gly-Arg, Arg-Arg-Gln, Pro-Leu-Gly又はAla-Lys-Ser, (d) Gln-Arg-Arg, His-Leu-Lys, Glu-Lys-Gly, Ala-Arg-Ser, (e) Val-Leu-Lys, Gly-Arg-Ile, Ala-Lys-Ser, Gly-Arg-Gly, (f) Val-Val-Arg, Val-Pro-Arg, Thr-Arg-Val, Asn-Lys-Tyr, (g) Gly-Arg-Ile, Gly-Arg-Thr, Phe-Lys-Ile, Ala-Lys-Ser, (h) Ala-Pro-Phe, Leu-Leu-Glu, Leu-Val-Tyr, Val-Leu-Lys, (i) Thr-Arg-Ala, Pro-Val-Arg, Gln-Arg-Ile, Leu-Met-Lys, (j) Val-Val-Arg, Pro-Val-Arg, Gln-Arg-Ile, Leu-Met-Lys, (k) Ser-Pro-Arg, Lys-Arg-Lys, Lys-Arg-Asp, Ser-Arg-Leu, (l) His-Leu-Lys, Lys-Arg-Lys, Lys-Arg-Asp, Ser-Arg-Leuのいずれかの基質ペプチドの組み合わせを、糖尿病患者の尿又は血漿より得た検体液と接触させ、検体液の酵素活性を測定して得られた計測データを解析することにより、ほぼ100%の正判別率が得られることが確認された。これにより、糖尿病性腎症の検体を正確にグループ分けできることがわかった。従って、未知の被験者から採取した尿又は血漿の酵素活性を、これらの基質ペプチドを用いて測定し、設定された判別式を適用することにより、未知の被験者の糖尿病性腎症の進行度を判別することができる。
【0012】
糖尿病合併症検査用試薬は、(a)〜(l)の配列の4種の基質ペプチドを、別々の化合物としたものを用いることができる。また、基質ペプチドを伸長させて、1乃至3種の化合物としたものも用いることができる。なお、4種の基質ペプチドを別々の化合物としたものが好適である。測定結果の解析が容易で、精度も向上させることができるからである。なお、尿を検体液とする場合には、(a)、(h)〜(l)の基質ペプチドが適している。また、血液(血漿)を検体液とする場合には、(b)〜(g)の基質ペプチドが適している。
基質ペプチドは、酵素特異性を有しない任意のペプチド又はその他の化合物や分子を結合させることもできる。また、一端を不溶性の担体に結合させたものを用いることもできる。
【0013】
本発明の請求項3に記載の発明は、請求項1又は2に記載の糖尿病検出用試薬であって、前記基質ペプチドの一方の末端に結合した第1蛍光基を備えた構成を有している。
この構成により、請求項1又は2で得られる作用に加え、以下のような作用が得られる。
(1)尿中や血中の酵素によって基質ペプチドが切断されると、その前後において第1蛍光基の性質が変わり、蛍光波長や蛍光強度が変化するので、これを指標として酵素活性を検出することができる。
(2)尿や血液の検体液を接触反応させた後、検体液の蛍光強度等を測定するだけで酵素活性を検出することができるので、測定時間を短縮化することができ作業性を高め測定効率を高めることができ、また検出感度と測定精度を高めることができる。
【0014】
ここで、第1蛍光基としては、酵素によって基質ペプチドが切断される前後において蛍光基の性質が変わり、蛍光波長や蛍光強度に変化が生じるものが用いられる。基質ペプチドが不溶性の担体に結合している場合は、濃度消光現象に由来して蛍光波長や蛍光強度の変化が生じる蛍光基も用いられる。濃度消光現象とは、蛍光基が担体上で互いに近接しているときと尿や血液の検体液中に遊離して蛍光基間の距離が離れているときとで蛍光波長や蛍光強度が変化する現象をいう。
このような第1蛍光基としては、例えば、4−メチルクマリル−7−アミド(MCA)、7−アミノ−4−カルボキシメチルクマリン(ACC)、α−ナフチルアミド、α−ナフチルエステル、フルオレセイン、希土類錯体又はそれらの誘導体等が用いられる。
これにより、担体から遊離した第1蛍光基の蛍光波長や蛍光強度は、遊離前の第1蛍光基のものとは異なるので、特定波長領域における蛍光強度を指標として、酵素による切断量を測定することができる。
【0015】
なお、第1蛍光基は、フルオレセイン又はフルオレセインイソチオシアネート(FITC)等のフルオレセイン誘導体を用いるのが好ましい。フルオレセインは525nm前後の蛍光を発するので、薬等に含まれる蛍光物質の蛍光波長と区別することができ、薬やビタミン剤等を服用している被験者の尿もそのまま検体液として用いることができ汎用性に優れるからである。薬やビタミン剤等を服用している被験者の尿中には薬等に含まれる雑多な蛍光物質が出るが、これらの蛍光物質は蛍光波長が400nm付近のものが多いため、尿を検体液としてそのまま用いる場合、薬等に含まれる蛍光物質の蛍光と酵素活性によって検体液内に遊離した第1蛍光基の蛍光とを区別できないのである。
【0016】
検体液の蛍光測定は、蛍光分光光度計を用いる方法の他、発光ダイオード等の発光素子からの光を蛍光基の励起波長を通過するフィルタを通して検体液に照射し、検体液の蛍光を検出することができる位置に配置したCCD等の受光素子で蛍光強度等を測定する方法を用いることもできる。
【0017】
本発明の請求項4に記載の発明は、請求項1又は2に記載の糖尿病合併症検査用試薬であって、前記基質ペプチドの一方の末端に結合した第2蛍光基と、前記基質ペプチドの他方の末端に結合した消光基と、を備えた構成を有している。
この構成により、請求項1又は2に記載の作用に加え、以下のような作用が得られる。
(1)酵素によって基質ペプチドが切断されると、消光基と第2蛍光基との距離が離れることによって第2蛍光基の蛍光スペクトルが変化するので、このスペクトル変化を酵素活性の測定指標にすることができ、これにより、蛍光強度等の変化を指標として酵素活性を検出することができる。
(2)尿や血液の検体液を接触反応させた後、検体液の蛍光強度等を測定するだけで酵素活性を検出することができるので、測定時間を短縮化することができ作業性を高め測定効率を高めることができ、また検出感度と測定精度を高めることができる。
【0018】
ここで、消光基としては、第2蛍光基の蛍光励起波長に相当する光を吸収する物質、第2蛍光基との間のゆるい結合により無発光複合体を形成する物質、第2蛍光基と蛍光共鳴エネルギー移動が起こる物質等が用いられる。
蛍光共鳴エネルギー移動とは、第2蛍光基と消光基が距離的に近い位置に存在するとき、消光基(アクセプター)の励起スペクトルと第2蛍光基(ドナー)の蛍光スペクトルとが重なりをもつ場合、第2蛍光基の励起波長のエネルギーを当てると消光基が励起エネルギーを奪い、本来観察されるはずの第2蛍光基の蛍光が減衰する現象をいう。
【0019】
第2蛍光基や消光基としては、蛍光共鳴エネルギー移動が起こるドナーとアクセプターの組合せを用いることができる。例えば、第2蛍光基の蛍光波長と重なる波長域に吸収帯をもつ原子団である消光基等が用いられる。具体的には、(7−メトキシクマリン−4−イル)アセチル(MOAc),アントラニロイルベンジル(ABz),N−メチルアントラニル酸(Nma)等とジニトロフェニル(Dnp)の組合せ、DabsylとEDANS(5−(2'-アミノエチル)アミノナフタレン−1−スルホン酸)の組合せ、トリプトファン(Trp)と5−ジメチルアミノ−1−ナフタレンスルホン酸(Dns)の組合せ、カルボキシジクロロフルオレセイン(CDCF)とカルボキシメチルローダミン(CTMR)の組合せ、カルボキシジクロロフルオレセイン(CDCF)とカルボキシX−ローダミン(CXR)の組合せ、ルシファーイエロー(LY)とカルボキシメチルローダミン(CTMR)の組合せ等が用いられる。
【0020】
消光基は、基質ペプチドと直接結合させてもよいし、ペプチド又はその他の化合物や分子が結合した原子団を介して基質ペプチドと結合させてもよい。
なお、基質ペプチドと原子団の結合、原子団と消光基との結合は、酵素によって切断されないアミド結合,エステル結合,エーテル結合,チオエーテル結合,ウレタン結合等が用いられる。消光基が酵素によって切断されて基質ペプチドから遊離することでも第2蛍光基の蛍光スペクトルに変化が生じるが、基質ペプチドのアミノ酸配列に依存した酵素活性は検出できないからである。
【0021】
基質ペプチドに結合した第2蛍光基と消光基の結合部間の長さは、100Å以下であることが望ましい。第2蛍光基と消光基との結合部間の距離が長くなるにつれ蛍光強度等の変化が小さくなる傾向がみられ、100Åより長くなるとこの傾向が著しく蛍光強度の変化が著しく小さくなり感度が低下するからである。
【発明の効果】
【0022】
以上のように、本発明の糖尿病合併症検査用試薬によれば、以下のような有利な効果が得られる。
請求項1に記載の発明によれば、
(1)体液に分泌される複数の酵素の活性の測定を、複数の基質を用いて行い、その結果を分析することにより、糖尿病性腎症の発症や進行度合いを判別できるため、被験者の尿や血液等の体液を接触させて活性測定を行うという簡単な操作で、糖尿病性腎症を発症しているか否か、発症している場合に進行度合いは第1期〜第4期のいずれなのかを判別することができるとともに、第1期〜第4期の治療の有効性の検討や人工透析をいつ頃導入することになるか等の病状の進行予測の精密化が可能な糖尿病合併症検査用試薬を提供できる。
(2)尿に分泌される酵素、血液に分泌される酵素はそれぞれ異なるため、基質ペプチドの組合せによって、体液の種類に応じた活性検出を行うことができ応用性に優れた糖尿病合併症検査用試薬を提供できる。
(3)基質ペプチドはペプチド合成機等を用いて容易に製造できるため、生産性に優れた糖尿病合併症検査用試薬を提供できる。
【0023】
請求項2に記載の発明によれば、請求項1の効果に加え、
(1)糖尿病患者の尿又は血漿より得た検体液と接触させ、検体液の酵素活性を測定して得られた計測データを解析することにより、糖尿病性腎症の検体を正確にグループ分けできるので、未知の被験者から採取した尿又は血漿の酵素活性を、これらの基質ペプチドを用いて測定し、設定された判別式を適用することにより、未知の被験者の糖尿病性腎症の進行度を判別することができる糖尿病合併症検査用試薬を提供できる。
【0024】
請求項3に記載の発明によれば、請求項1又は2の効果に加え、
(1)尿や血液の検体液を接触反応させた後、検体液の蛍光強度等を測定するだけで酵素活性を検出することができるので、測定時間を短縮化することができ作業性を高め測定効率を高めることができるとともに、検出感度と測定精度に優れた糖尿病合併症検査用試薬を提供できる。
【0025】
請求項4の発明によれば、請求項1又は2の効果に加え、
(2)尿や血液の検体液を接触反応させた後、検体液の蛍光強度等を測定するだけで酵素活性を検出することができるので、測定時間を短縮化することができ作業性を高め測定効率を高めることができるとともに、検出感度と測定精度に優れた糖尿病合併症検査用試薬を提供できる。
【発明を実施するための最良の形態】
【0026】
以下、本発明を実施するための最良の形態を、図面を参照しながら説明する。
(実施の形態1)
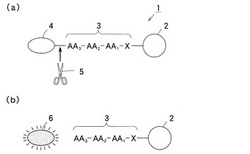
図1は本発明の実施の形態1における糖尿病合併症検査用試薬の酵素活性検出原理を示す模式図である。
図中、1は実施の形態1における糖尿病合併症検査用試薬、2はハロゲン化炭化水素類,エステル類等の溶媒に不溶性の合成樹脂(ポリスチレン等)製(PEGA等)やガラス製等で略球状や多面体状等に形成された担体、Xは担体2に結合された酵素特異性を有さない化合物、3は化合物Xがアミノ酸AA1に結合したAA3−AA2−AA1のアミノ酸配列を有する基質ペプチド、4は基質ペプチド3のN末端に結合し基質ペプチド3が後述する酵素5によって切断される前後において、蛍光波長や蛍光強度に変化が生じる蛍光基の1種である4−メチルクマリル−7−アミド(MCA),フルオレセインイソチオシアネート(FITC)等の第1蛍光基、5は第1蛍光基4と基質ペプチド3とのペプチド結合や基質ペプチド3を特定の切断部位で選択的に切断する検体液中の基質特異性を有する酵素、6は酵素5によって基質ペプチド3が切断されたことにより遊離し蛍光波長等が変化した第1蛍光基である。
【0027】
以上のように構成された糖尿病合併症検査用試薬1は、基質ペプチド3をC末端から伸長していく固相法等の通常のペプチド合成法、目的とするアミノ酸配列のC末端側からN末端側へ逐次伸長していく逐次伸長法、複数の短いペプチド断片を合成しペプチド断片間のカップリングにより伸長させる断片縮合法、ペプチド合成機を用いてFmoc法、Boc法等を導入して合成する方法等を用いて合成することができる。
【0028】
以上のように構成された実施の形態1における糖尿病合併症検査用試薬について、以下その酵素活性の検出原理を説明する。
図1(a)に示す糖尿病合併症検査用試薬1の4−メチルクマリル−7−アミド(MCA),フルオレセインイソチオシアネート(FITC)等の第1蛍光基4は特定波長領域において非蛍光物質であり、また担体2の表面に高密度に存在しているときは濃度消光により蛍光強度が弱い。この糖尿病合併症検査用試薬1に酵素5を含む検体液を接触させ反応させると、第1蛍光基4と基質ペプチド3との間のペプチド結合や基質ペプチド3を特定の切断部位で選択的に切断する。
基質ペプチド3と遊離した第1蛍光基6は7−アミノ−メチルクマリン(AMC)等の蛍光物質となったり、担体2から離れることで濃度消光の効果が減少し、第1蛍光基6の蛍光波長又は該特定波長領域における蛍光強度は、基質ペプチド3と結合した第1蛍光基4とは異なるので、検体液の蛍光強度等の変化を指標として酵素活性を検出することができる(図1(b)参照)。
【0029】
糖尿病合併症の検査や進行度管理は、始めに、糖尿病にかかっているが糖尿病性腎症は発症していない患者の血液等の体液、糖尿病性腎症を発症している患者の体液を、アミノ酸配列が異なる4種類以上の基質ペプチド3が組み合わせられた糖尿病合併症検査用試薬1の各々と反応させて酵素活性を測定し、判別分析等の公知の手法によって、体液の酵素活性全体を一括して評価し、糖尿病性腎症を発症しているグループと発症していないグループに判別する基準(判別関数)をマハラノビスの距離をベースとした非線形手法等によって予め設定しておく。糖尿病性腎症の第1期〜第4期の患者を判別する各々の判別関数を、予めデータベース化して設定しておくことができる。
次に、未知の被験者の体液を、判別関数を設定したときと同じ種類の基質ペプチド3が組み合わせられた糖尿病合併症検査用試薬1の各々と反応させて酵素活性を測定し、未知の被験者が、予め設定したグループのいずれに属するのかを判別することで、糖尿病性腎症を発症しているのか否か、合併症の進行度等を簡便に判断することができる。
【0030】
以上のように、実施の形態1における糖尿病合併症検査用試薬は構成されているので、以下のような作用が得られる。
(1)被験者の体液を接触させて活性測定を行うという簡単な操作で、糖尿病性腎症を発症しているか否か、発症している場合に進行度合いはどの程度なのかを判別することができるとともに、治療の有効性の検討や人工透析をいつ頃導入することになるか等の病状の進行予測の精密化が可能になる。
(2)尿や血液等の体液の種類に応じて、基質ペプチド3の組合せを変えて酵素活性を測定することで、体液の種類に応じた活性検出を行うことができ応用性に優れる。
(3)基質ペプチドはペプチド合成機等を用いて容易に製造できるため、生産性に優れる。
【0031】
なお、本実施の形態においては、基質ペプチド3が担体2に結合した糖尿病合併症検査用試薬1を説明したが、担体2に結合したものを必ずしも用いる必要はなく、特定のアミノ酸配列を有する基質ペプチドが含まれていれば、凍結乾燥された粉末の状態や溶液の状態で供給されるものを用いることもできる。
また、糖尿病合併症検査用試薬1が基質ペプチド3を1種類ずつ有し、それを4以上組み合わせた場合について説明したが、基質ペプチド3の2種類以上を組み合わせて結合して伸長させた基質ペプチドを用いる場合もある。この場合も、糖尿病合併症検査用試薬の蛍光測定により酵素活性を評価し、糖尿病性腎症の第1期〜第4期の患者を判別する各々の判別関数によりグループ化することで、同様の作用が得られる。
【0032】
(実施の形態2)
図2は本発明の実施の形態2における糖尿病合併症検査用試薬の酵素活性検出原理を示す模式図である。なお、実施の形態1と同様のものは、同じ符号を付して説明を省略する。
図中、10は実施の形態2における糖尿病合併症検査用試薬、11は後述する検体液中の酵素14の切断部位を含むAA3−AA2−AA1のアミノ酸配列を有する基質ペプチドである。Y,Zは任意のアミノ酸残基等の原子団を示しており、本実施の形態においては、端部の原子団Yが担体2と結合している。
12は基質ペプチド11に結合した原子団Yと結合するジニトロフェニル(Dnp),5−ジメチルアミノ−1−ナフタレンスルホン酸(Dns)等の消光基、13は基質ペプチド11の他端に導入され消光基12と蛍光共鳴エネルギー移動がみられる(7−メトキシクマリン−4−イル)アセチル(MOAc),トリプトファン(Trp)等の第2蛍光基である。消光基12と第2蛍光基13は互いに蛍光に影響を及ぼす相互作用がみられる距離(100Å以下)で結合している。14は検体液中に存在する酵素、15は基質ペプチド11が酵素14の基質特異性によって特定の切断部位で切断され遊離されたことにより蛍光波長等が変化した第2蛍光基である。
【0033】
以上のように構成された実施の形態2における糖尿病合併症検査用試薬について、以下その酵素活性の検出原理を説明する。
図2(a)に示す糖尿病合併症検査用試薬10の消光基12と第2蛍光基13は、互いに蛍光に影響を及ぼす相互作用がみられる距離で結合しているので、消光基12の吸収スペクトルと第2蛍光基13の蛍光スペクトルとが重なりをもち、第2蛍光基13の励起波長のエネルギーを当てると本来観察されるはずの第2蛍光基13の蛍光の減衰が観察される。
糖尿病合併症検査用試薬10に酵素14を含む検体液を接触させ反応させると、基質特異性を有する酵素14は、基質ペプチド11を切断する。
第2蛍光基13が担体2から遊離すると、第2蛍光基13と消光基12との間で蛍光に影響を及ぼす相互作用がみられなくなるので、検体液に第2蛍光基13の励起波長のエネルギーを当てると、検体液との接触前には観察されなかった第2蛍光基15の蛍光波長が観察されるようになり、酵素14の反応前の蛍光波長とは異なるため、蛍光強度等の変化を指標として酵素活性を検出することができる(図2(b)参照)。
なお、糖尿病合併症の検査や進行度管理の方法は、実施の形態1で説明したものと同様なので説明を省略する。
【0034】
以上のように実施の形態2における糖尿病合併症検査用試薬は構成されているので、実施の形態1に記載の作用に加え、以下のような作用が得られる。
(1)消光基12と第2蛍光基13を選択することにより、第2蛍光基13の蛍光波長を可視部領域に設定することが可能になるので、市販のCCDカメラ等の可視光検出装置を用いて測定することが可能になり汎用性に優れる。
【0035】
本実施の形態においても、必ずしも基質ペプチド11を担体2に結合させる必要はなく、特定のアミノ酸配列を有する基質ペプチド11が含まれていれば、凍結乾燥された粉末の状態や溶液の状態で供給されるものを用いることもできる。
また、糖尿病合併症検査用試薬10が基質ペプチド11を1種類ずつ有し、それを4以上組み合わせた場合について説明したが、基質ペプチド11の2種類以上を組み合わせて結合して伸長させた基質ペプチドを用いる場合もある。この場合も、糖尿病合併症検査用試薬の蛍光測定により酵素活性を評価し、糖尿病性腎症の第1期〜第4期の患者を判別する各々の判別関数によりグループ化することで、同様の作用が得られる。
【実施例】
【0036】
以下、本発明を実施例により具体的に説明する。なお、本発明はこれらの実施例に限定されるものではない。
なお、本実施例で説明するアミノ酸、ペプチド、保護基、溶媒等は、当該技術分野で慣用されている略号又はIUPAC-IUBの命名委員会で採用された略号を使用している。例えば、以下の略号を使用している。例えば、FITC:Fluorescein-4-isothiocyanate isomer-I(フルオレセインイソチオシアネート) 、DMF:N,N−ジメチルホルムアミド、DIEA:N,N−ジイソプロピルエチルアミン、DCM:ジクロロメタン、i-PrOH:2-プロパノール、MeOH:メタノール、Lys(Dnp):(2S)-2-amino-6-(2,4-dinitrophenylamino)hexanoic acid、TFA:トリフルオロ酢酸。
(実施例1)
実施例1では、糖尿病合併症検査用試薬としてのペプチジル蛍光基結合球状担体を合成し、次に尿より得た検体液の活性測定を行った。以下、その方法について説明する。
<ペプチジル蛍光基結合球状担体の合成>
担体としては球状の市販のNH2-PEGA-resin(渡辺化学工業製、粒径約0.1mm)を用いた。Peptide synthesizer (Model 433A, Applied Biosystems) を用いてNH2-PEGA Resin (0.5 g, 25μmol) に、Lys(Dnp)、AA1、AA2、AA3、βAlaの5つのアミノ酸を順に導入した。なお、AA1、AA2、AA3は表1に示すアミノ酸である。その後、プラスチックベッセルに担体を入れ、DMFを加えて担体を膨潤させた。DMFを吸引除去した後、少量のDMFに溶解させた FITC (30μmol, 12 mg), DMF (2 ml) 及びDIEA (25μmol, 4.4μl) を加え、室温で3時間振とうした。反応液を吸引除去した後、DMF (2 ml, 2回)、 DCM (2 ml, 2回)、i-PrOH (2 ml, 2回)、DMF (2 ml, 2回)、MeOH (2 ml, 2回)、エーテル (2 ml, 2回) の順で担体を洗浄した。その後、フェノール (75 mg)、1,2-エタンジチオール (25μl)、チオアニソール(50μl)、蒸留水(50μl) 及びTFA (2 ml) の混合溶液と3時間反応させた。反応液を吸引除去後、DCM (2 ml, 2回)、 DMF (2 ml, 2回)、20%ピペリジン / DMF (2 ml, 2回)、DMF (2 ml, 2回)、i-PrOH (2 ml, 2回)、DMF (2 ml, 2回)、蒸留水(2 ml, 2回)、エーテル (2 ml,1回) の順で担体を洗浄し減圧乾燥することによって、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表1のNo1〜No4)を有する糖尿病合併症検査用試薬(配列表の配列番号1〜4)を得た。
【0037】
【表1】

【0038】
<酵素活性の測定>
No1〜No4の糖尿病合併症検査用試薬の各々1 mg に、0.01% Tween 20を含有する20 mM Tris-HCl バッファ(pH 8.0, NaCl 100mM, CaCl250 mM) 190 μl を加え、糖尿病性腎症対象者(第4期)(A群)5名並びに糖尿病性腎症非対象者(第1期)(B群)5名の尿より得た検体液を同量ずつ加え、測定時間ごとにサンプルから10 μlとり、バッファを190 μl加えて96ウェルプレートに移し、蛍光値をPerkin Elmer社製Wallac 1420 ARVO sx プレートリーダーにより測定した(測定時間0.1秒)。検体液を加えてから10分後の蛍光値の変化量(検体液を加える前の蛍光値と検体液を加えてから10分後の蛍光値との差) (励起波長485 nm、蛍光波長535 nm)を、表2に示す。
【0039】
【表2】

【0040】
まず、表2に示すA群、B群の分散共分散行列の等質性について解析したところ、等質とはみなされないことがわかった。そこで、マハラノビスの距離をベースとした非線形(二次)判別分析法を用いて解析した。解析結果より得られた判別得点を表3に示す。
【0041】
【表3】

【0042】
表3に示す判別得点から、表4に示すように正判別率100%を得た。
【0043】
【表4】

【0044】
以上の計測データを解析し2次判別関数を求め、判別式を作成した。
以上説明したように、本実施例の糖尿病合併症検査用試薬を糖尿病患者の尿より得た検体液と接触させ、検体液の酵素活性を測定して得られた測定値を判別分析により解析した結果、正判別率は100%と極めて高いことが確認された。このことは、本実施例の糖尿病合併症検査用試薬を用いることにより、糖尿病性腎症の検体を極めて正確にグループ分けできることを示している。
従って、未知の被験者から採取した尿の検体液の酵素活性を、本実施例の糖尿病合併症検査用試薬を用いて測定し、設定された判別式を適用することにより、未知の被験者の糖尿病性腎症の進行度を判別可能であることが明らかである。
なお、本実施例においては、糖尿病性腎症第1期と第4期の検体について正確に判別できることを示したが、第1期〜第4期の検体数を増やすことにより、同様の方法で糖尿病性腎症の第1期〜第4期の進行度管理を行うこともできる。
【0045】
また、本実施例においては、フルオレセインイソチオシアネート(FITC)からなる第2蛍光基が一端に結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合した基質ペプチドを有する糖尿病合併症検査用試薬を合成して、これと接触させた検体液の蛍光変化を測定した場合について説明したが、第2蛍光基として(7−メトキシクマリン−4−イル)アセチル(MOAc)等を用いた場合も、同様の結果が得られることを確認した。
また、PEGA resin等の担体が一端に、FITC等の第1蛍光基が他端に結合した基質ペプチドを有する糖尿病合併症検査用試薬を用いた場合も、これと接触させた検体液の蛍光変化を測定し酵素活性を検出することで、糖尿病の合併症の検査や進行度管理に利用できることを確認した。
【0046】
(実施例2)
実施例1と同様にして、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表5のNo5〜No8)を有する糖尿病合併症検査用試薬(配列表の配列番号5〜8)を得た。
【0047】
【表5】

【0048】
<酵素活性の測定>
No5〜No8の糖尿病合併症検査用試薬の各々1 mg に、0.01% Tween 20を含有する20 mM Tris-HCl バッファ(pH 8.0, NaCl 100mM, CaCl250 mM) 190 μl を加え、糖尿病性腎症対象者(第4期)(A群)5名並びに糖尿病性腎症非対象者(第1期)(B群)5名の血液(血漿)より得た検体液を同量ずつ加え、測定時間ごとにサンプルから10 μlとり、バッファを190 μl加えて96ウェルプレートに移し、蛍光値をPerkin Elmer社製Wallac 1420 ARVO sx プレートリーダーにより測定した(測定時間0.1秒)。検体液を加えてから10分後の蛍光値の変化量(検体液を加える前の蛍光値と検体液を加えてから10分後の蛍光値との差) (励起波長485 nm、蛍光波長535 nm)を、表6に示す。
【0049】
【表6】

【0050】
表6に示すA群、B群の分散共分散行列について、実施例1と同様に、マハラノビスの距離をベースとした非線形(二次)判別分析法を用いて解析した。解析結果より得られた判別得点を表7に示す。
【0051】
【表7】

【0052】
表7に示す判別得点から、表8に示すように80%以上の正判別率を得た。
【0053】
【表8】

【0054】
以上の計測データを解析し2次判別関数を求め、判別式を作成した。
以上説明したように、本実施例の糖尿病合併症検査用試薬を糖尿病患者の血漿より得た検体液と接触させ、検体液の酵素活性を測定して得られた計測データを解析することにより、正判別率は極めて高いことが確認された。検体数が増加すれば、さらに正判別率が上昇することが期待される。このことは、本実施例の糖尿病合併症検査用試薬を用いることにより、糖尿病性腎症の検体を極めて正確にグループ分けできることを示している。
従って、未知の被験者から採取した血漿の検体液の酵素活性を、本実施例の糖尿病合併症検査用試薬を用いて測定し、設定された判別式を適用することにより、未知の被験者の糖尿病性腎症の進行度を判別可能であることが明らかである。
【0055】
(実施例3)
実施例1と同様にして、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表9のNo9〜No12)を有する糖尿病合併症検査用試薬(配列表の配列番号9〜12)を得た。
【0056】
【表9】

【0057】
<酵素活性の測定>
No9〜No12の糖尿病合併症検査用試薬の各々1 mg を用い、実施例2と同様にして、血液(血漿)より得た検体液を加えたときの蛍光値の変化量を測定した。その結果を表10に示す。
【0058】
【表10】

【0059】
表10に示すA群、B群の分散共分散行列について、実施例1と同様に、マハラノビスの距離をベースとした非線形(二次)判別分析法を用いて解析した。解析結果より得られた判別得点を表11に示す。
【0060】
【表11】

【0061】
表11に示す判別得点から、表12に示すように正判別率100%を得た。この結果、本実施例の糖尿病合併症検査用試薬を用いることにより、糖尿病性腎症の検体を極めて正確にグループ分けできることが確認された。
【0062】
【表12】

【0063】
(実施例4)
実施例1と同様にして、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表13のNo9〜No11,No13)を有する糖尿病合併症検査用試薬(配列表の配列番号9〜11、配列番号13)を得た。
【0064】
【表13】

【0065】
<酵素活性の測定>
No9〜No11,No13の糖尿病合併症検査用試薬の各々1 mg を用い、実施例2と同様にして、血液(血漿)より得た検体液を加えたときの蛍光値の変化量を測定した。その結果を表14に示す。
【0066】
【表14】

【0067】
表14に示すA群、B群の分散共分散行列について、実施例1と同様に、マハラノビスの距離をベースとした非線形(二次)判別分析法を用いて解析した。解析結果より得られた判別得点を表15に示す。
【0068】
【表15】

【0069】
表15に示す判別得点から、表16に示すように正判別率100%を得た。この結果、本実施例の糖尿病合併症検査用試薬を用いることにより、糖尿病性腎症の検体を極めて正確にグループ分けできることが確認された。
【0070】
【表16】

【0071】
(実施例5)
実施例1と同様にして、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表17のNo8〜No13)を有する糖尿病合併症検査用試薬(配列表の配列番号8〜13)を得た。
【0072】
【表17】

【0073】
<酵素活性の測定>
No8〜No13の糖尿病合併症検査用試薬の各々1 mg を用い、実施例2と同様にして、血液(血漿)より得た検体液を加えたときの蛍光値の変化量を測定した。その結果を表18に示す。
【0074】
【表18】

【0075】
表18に示すA群、B群の分散共分散行列について、マハラノビスの距離をベースとし、両群の分散共分散行列が等質であると仮定して、(2次項を除外して)線形判別関数を導いた。解析結果より得られた判別得点を表19に示す。
【0076】
【表19】

【0077】
表19に示す判別得点から、表20に示すように正判別率100%を得た。一般に、検体数が増加すれば両群の類似性が上昇するため、線形解析が可能となることが期待される。本実施例の糖尿病合併症検査用試薬を用い、線形解析を行うことにより、糖尿病性腎症の検体を極めて正確にグループ分けできることが確認された。
【0078】
【表20】

【0079】
(実施例6)
実施例1と同様にして、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表21のNo17,19,21,23)を有する糖尿病合併症検査用試薬(配列表の配列番号17,19,21,23)を得た。
【0080】
【表21】

【0081】
<酵素活性の測定>
No17,19,21,23の糖尿病合併症検査用試薬の各々1 mg を用い、実施例2と同様にして、血液(血漿)より得た検体液を加えたときの蛍光値の変化量を測定した。その結果を表22に示す。
【0082】
【表22】

【0083】
表22に示すA群、B群の分散共分散行列について、実施例1と同様に、マハラノビスの距離をベースとした非線形(二次)判別分析法を用いて解析した。解析結果より得られた判別得点を表23に示す。
【0084】
【表23】

【0085】
表23に示す判別得点から、表24に示すように正判別率100%を得た。この結果、本実施例の糖尿病合併症検査用試薬を用いることにより、糖尿病性腎症の検体を極めて正確にグループ分けできることが確認された。
【0086】
【表24】

【0087】
(実施例7)
実施例1と同様にして、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表25のNo6,8,13,14)を有する糖尿病合併症検査用試薬(配列表の配列番号6,8,13,14)を得た。
【0088】
【表25】

【0089】
<酵素活性の測定>
No6,8,13,14の糖尿病合併症検査用試薬の各々1 mg を用い、実施例2と同様にして、血液(血漿)より得た検体液を加えたときの蛍光値の変化量を測定した。その結果を表26に示す。
【0090】
【表26】

【0091】
表26に示すA群、B群の分散共分散行列について、実施例1と同様に、マハラノビスの距離をベースとした非線形(二次)判別分析法を用いて解析した。解析結果より得られた判別得点を表27に示す。
【0092】
【表27】

【0093】
表27に示す判別得点から、表28に示すように正判別率100%を得た。この結果、本実施例の糖尿病合併症検査用試薬を用いることにより、糖尿病性腎症の検体を極めて正確にグループ分けできることが確認された。
【0094】
【表28】

【0095】
(実施例8)
実施例1と同様にして、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表29のNo15,16,18,22)を有する糖尿病合併症検査用試薬(配列表の配列番号15,16,18,22)を得た。
【0096】
【表29】

【0097】
<酵素活性の測定>
No15,16,18,22の糖尿病合併症検査用試薬の各々1 mg を用い、実施例2と同様にして、血液(血漿)より得た検体液を加えたときの蛍光値の変化量を測定した。その結果を表30に示す。
【0098】
【表30】

【0099】
表30に示すA群、B群の分散共分散行列について、実施例1と同様に、マハラノビスの距離をベースとした非線形(二次)判別分析法を用いて解析した。解析結果より得られた判別得点を表31に示す。
【0100】
【表31】

【0101】
表31に示す判別得点から、表32に示すように正判別率100%を得た。この結果、本実施例の糖尿病合併症検査用試薬を用いることにより、糖尿病性腎症の検体を極めて正確にグループ分けできることが確認された。
【0102】
【表32】

【0103】
(実施例9)
実施例1と同様にして、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表33のNo6,7,13,20)を有する糖尿病合併症検査用試薬(配列表の配列番号6,7,13,20)を得た。
【0104】
【表33】

【0105】
<酵素活性の測定>
No6,7,13,20の糖尿病合併症検査用試薬の各々1 mg を用い、実施例2と同様にして、血液(血漿)より得た検体液を加えたときの蛍光値の変化量を測定した。その結果を表34に示す。
【0106】
【表34】

【0107】
表34に示すA群、B群の分散共分散行列について、実施例1と同様に、マハラノビスの距離をベースとした非線形(二次)判別分析法を用いて解析した。解析結果より得られた判別得点を表35に示す。
【0108】
【表35】

【0109】
表35に示す判別得点から、表36に示すように正判別率100%を得た。この結果、本実施例の糖尿病合併症検査用試薬を用いることにより、糖尿病性腎症の検体を極めて正確にグループ分けできることが確認された。
【0110】
【表36】

【0111】
(実施例10)
実施例1と同様にして、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表37のNo24,25,1,14)を有する糖尿病合併症検査用試薬(配列表の配列番号24,25,1,14)を得た。
【0112】
【表37】

【0113】
<酵素活性の測定>
No24,25,1,14の糖尿病合併症検査用試薬の各々1 mg を用い、実施例1と同様にして、尿より得た検体液を加えたときの蛍光値の変化量を測定した。その結果を表38に示す。
【0114】
【表38】

【0115】
表38に示すA群、B群の分散共分散行列について、実施例1と同様に、マハラノビスの距離をベースとした非線形(二次)判別分析法を用いて解析した。解析結果より得られた判別得点を表39に示す。
【0116】
【表39】

【0117】
表39に示す判別得点から、表40に示すように正判別率100%を得た。この結果、本実施例の糖尿病合併症検査用試薬を用いることにより、糖尿病性腎症の検体を極めて正確にグループ分けできることが確認された。
【0118】
【表40】

【0119】
(実施例11)
実施例1と同様にして、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表41のNo4,26,27,28)を有する糖尿病合併症検査用試薬(配列表の配列番号4,26,27,28)を得た。
【0120】
【表41】

【0121】
<酵素活性の測定>
No4,26,27,28の糖尿病合併症検査用試薬の各々1 mg を用い、実施例1と同様にして、尿より得た検体液を加えたときの蛍光値の変化量を測定した。その結果を表42に示す。
【0122】
【表42】

【0123】
表42に示すA群、B群の分散共分散行列について、実施例1と同様に、マハラノビスの距離をベースとした非線形(二次)判別分析法を用いて解析した。解析結果より得られた判別得点を表43に示す。
【0124】
【表43】

【0125】
表43に示す判別得点から、表44に示すように正判別率100%を得た。この結果、本実施例の糖尿病合併症検査用試薬を用いることにより、糖尿病性腎症の検体を極めて正確にグループ分けできることが確認された。
【0126】
【表44】

【0127】
(実施例12)
実施例1と同様にして、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表45のNo15,26,27,28)を有する糖尿病合併症検査用試薬(配列表の配列番号15,26,27,28)を得た。
【0128】
【表45】

【0129】
<酵素活性の測定>
No15,26,27,28の糖尿病合併症検査用試薬の各々1 mg を用い、実施例1と同様にして、尿より得た検体液を加えたときの蛍光値の変化量を測定した。その結果を表46に示す。
【0130】
【表46】

【0131】
表46に示すA群、B群の分散共分散行列について、実施例1と同様に、マハラノビスの距離をベースとした非線形(二次)判別分析法を用いて解析した。解析結果より得られた判別得点を表47に示す。
【0132】
【表47】

【0133】
表47に示す判別得点から、表48に示すように正判別率100%を得た。この結果、本実施例の糖尿病合併症検査用試薬を用いることにより、糖尿病性腎症の検体を極めて正確にグループ分けできることが確認された。
【0134】
【表48】

【0135】
(実施例13)
実施例1と同様にして、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表49のNo29,30,31,32)を有する糖尿病合併症検査用試薬(配列表の配列番号29,30,31,32)を得た。
【0136】
【表49】

【0137】
<酵素活性の測定>
No29,30,31,32の糖尿病合併症検査用試薬の各々1 mg を用い、実施例1と同様にして、尿より得た検体液を加えたときの蛍光値の変化量を測定した。その結果を表50に示す。
【0138】
【表50】

【0139】
表50に示すA群、B群の分散共分散行列について、実施例1と同様に、マハラノビスの距離をベースとした非線形(二次)判別分析法を用いて解析した。解析結果より得られた判別得点を表51に示す。
【0140】
【表51】

【0141】
表51に示す判別得点から、表52に示すように正判別率100%を得た。この結果、本実施例の糖尿病合併症検査用試薬を用いることにより、糖尿病性腎症の検体を極めて正確にグループ分けできることが確認された。
【0142】
【表52】

【0143】
(実施例14)
実施例1と同様にして、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表53のNo19,30,31,32)を有する糖尿病合併症検査用試薬(配列表の配列番号19,30,31,32)を得た。
【0144】
【表53】

【0145】
<酵素活性の測定>
No19,30,31,32の糖尿病合併症検査用試薬の各々1 mg を用い、実施例1と同様にして、尿より得た検体液を加えたときの蛍光値の変化量を測定した。その結果を表54に示す。
【0146】
【表54】

【0147】
表54に示すA群、B群の分散共分散行列について、実施例1と同様に、マハラノビスの距離をベースとした非線形(二次)判別分析法を用いて解析した。解析結果より得られた判別得点を表55に示す。
【0148】
【表55】

【0149】
表55に示す判別得点から、表56に示すように正判別率100%を得た。この結果、本実施例の糖尿病合併症検査用試薬を用いることにより、糖尿病性腎症の検体を極めて正確にグループ分けできることが確認された。
【0150】
【表56】

【産業上の利用可能性】
【0151】
本発明は、糖尿病の合併症、特に糖尿病性腎症の検査や進行度の管理に有効な糖尿病合併症検査用試薬に関し、被験者の尿や血液等の体液を接触させて活性測定を行うという簡単な操作で、糖尿病患者の体液に含まれるマーカーの特定や追跡をしなくても、糖尿病性腎症を発症しているか否か、発症している場合に進行度合いは第1期〜第4期のいずれなのかを判別することができるとともに、第1期〜第4期の治療の有効性の検討や人工透析をいつ頃導入することになるか等の病状の進行予測を精密化でき、医師による糖尿病診断の支援に極めて有効な糖尿病合併症検査用試薬を提供できる。
【図面の簡単な説明】
【0152】
【図1】実施の形態1における糖尿病合併症検査用試薬の酵素活性検出原理を示す模式図
【図2】実施の形態2における糖尿病合併症検査用試薬の酵素活性検出原理を示す模式図
【符号の説明】
【0153】
1 糖尿病合併症検査用試薬
2 担体
3 基質ペプチド
4,6 第1蛍光基
5 酵素
10 糖尿病合併症検査用試薬
11 基質ペプチド
12 消光基
13,15 第2蛍光基
14 酵素
【技術分野】
【0001】
本発明は、糖尿病の合併症、特に糖尿病性腎症の検査や進行度の管理に有効な糖尿病合併症検査用試薬に関するものである。
【背景技術】
【0002】
近年、糖尿病や糖尿病合併症の発症検査のためのマーカーが見出されている。
例えば、糖尿病合併症の診断に有効なマーカーとして「N末端がカルボキシル化されたヘモグロビン(特許文献1)」や「特定のピリジニウム化合物(特許文献2)」が開示されている。また、血中と尿中のクレアチニン濃度を測定し、糖尿病性腎症による腎機能の低下度を検査する方法も知られている。
【特許文献1】特許第3542245号公報
【特許文献2】特許第3205899号公報
【発明の開示】
【発明が解決しようとする課題】
【0003】
しかしながら上記従来の技術においては、以下のような課題を有していた。
(1)(特許文献1)、(特許文献2)に開示の技術や、クレアチニン濃度の測定による検査方法は、いずれも、カルボキシル化されたヘモグロビン,特定のピリジニウム化合物,クレアチニンのような特定物質を指標として、その特定物質が体液中にどの程度存在するかを測定して、糖尿病による腎臓等の臓器の機能低下を判断するものである。そのため、糖尿病による臓器の機能低下が、これらの特定物質の濃度変化として現れない場合は、糖尿病や糖尿病合併症の発症や進行度合いを検知することができないという課題を有していた。
(2)糖尿病性腎症は、第1期(腎症前期)、第2期(早期腎症)、第3期(顕性腎症)、第4期(腎不全期)と進行し、腎機能が廃絶し透析療法期に至る。血中と尿中のクレアチニン濃度を測定する方法は、主に第4期の検査で用いられており、クレアチニンは透析を導入するか否かを判断するマーカーである。そのため、クレアチニンを用いる方法では、透析を導入するか否かを判断するだけで、第1期〜第4期に至るまでの病状の進行度は全く判断することができず、そのため第1期〜第4期に至る間に施される血糖コントロール、血圧管理及び治療が有効か否かを判断することもできないという課題を有していた。
(3)糖尿病性腎症が第3期まで進行すると、腎機能は急激に低下するため腎症の進行を完全に防止することは困難になる。そのため、第1期〜第3期の病状の進行度の管理がたいへん重要である。しかしながら、この間の病状の進行度管理を行う技術は皆無であった。
(4)尿や血漿中にはタンパク質分解酵素活性を示す物質(以下、酵素という。)が含まれていることが以前から良く知られている。尿中に含まれる酵素としては、ウロキナーゼやユリナリーカリクレインが知られている。また、腎機能の低下によって未知の酵素が漏出することも考えられる。しかし、個々の酵素の活性や存在量、安定性等を個別に解析することは困難なため、これらの酵素を腎機能マーカーとして捉えることはできなかった。
【0004】
本発明は上記従来の課題を解決するもので、被験者の尿や血液等の体液を接触させて活性測定を行うという簡単な操作で、糖尿病患者の体液に含まれるマーカーの特定や追跡をしなくても、糖尿病性腎症を発症しているか否か、発症している場合に進行度合いは第1期〜第4期のいずれなのかを判別することができるとともに、第1期〜第4期の治療の有効性の検討や人工透析をいつ頃導入することになるか等の病状の進行予測を精密化させ、医師の診断支援に極めて有効な糖尿病合併症検査用試薬を提供することを目的とする。
【課題を解決するための手段】
【0005】
上記従来の課題を解決するために本発明の糖尿病合併症検査用試薬は、以下の構成を有している。
本発明の請求項1に記載の糖尿病合併症検査用試薬は、3個のアミノ酸が結合した基質ペプチドが4種以上組み合わせられた構成を有している。
この構成により、以下のような作用が得られる。
(1)尿や血液等の体液には各種の酵素が分泌されており、体液に分泌される酵素の量や種類は、糖尿病の発症や糖尿病性腎症の進行によって常に変化している。本発明者らは、3個のアミノ酸が結合した4種以上の基質ペプチドを用い、体液の酵素活性全体を一括して評価し、それを腎機能障害と関連付けることにより、マーカーを特定しなくても、体液中に存在する酵素の種類,個々の存在量や活性強度に関わらず、糖尿病性腎症の発症や進行度合いを判別できることを見出した。これにより、被験者の尿や血液等の体液を接触させて活性測定を行うという簡単な操作で、糖尿病性腎症を発症しているか否か、発症している場合に進行度合いは第1期〜第4期のいずれなのかを判別することができるとともに、第1期〜第4期の治療の有効性の検討や人工透析をいつ頃導入することになるか等の病状の進行予測の精密化が可能となる。
(2)尿に分泌される酵素、血液に分泌される酵素はそれぞれ異なるため、基質ペプチドの組み合わせによって、体液の種類に応じた活性検出を行うことができ応用性に優れる。
(3)基質ペプチドはペプチド合成機等を用いて容易に製造できるため、生産性に優れる。
【0006】
ここで、アミノ酸としては、天然に存在するタンパク質中に通常見出されるL−アミノ酸を用いることができる。
基質ペプチドは、固相法や液相法の通常のペプチド合成法を用いて合成することができる。また、目的とするアミノ酸配列のC末端側からN末端側へ逐次伸長していく逐次伸長法や、複数の短いペプチド断片を合成しペプチド断片間のカップリングにより伸長させる断片縮合法等を用いることができる。また、ペプチド合成機を用いて9−フルオレニルメチルオキシカルボニル(Fmoc)アミノ酸やt−ブチルオキシカルボニル(Boc)アミノ酸等を導入して合成することもできる。さらに、プロテアーゼを用いてペプチド結合を生成したり、遺伝子工学を利用したりして合成することもできる。
【0007】
糖尿病の検査を行う際には、基質ペプチドの各々に被験者の尿や血液等の体液や体液の培養液等の検体液を接触させ、検体液中の酵素と反応させることにより酵素の活性測定を行う。検体液は生体試料(血液等)をそのまま、あるいはフィルタや遠心分離等で血球成分等を除去したものを用いることができる。また、生体試料を基に酵素が活性を発現するような条件設定(pH調整、活性剤導入など)を行ったものを使用することもできる。pH調整剤としては、Tris−HCl,Hepes−KOH等の緩衝剤を反応バッファーとして添加することができる。また、酵素活性の発現に必要な塩類や活性保護剤を添加することもできる。
【0008】
活性測定の方法としては、公知の種々の方法を用いることができる。例えば、基質ペプチドの減少量を特定波長の吸光度で測定する方法、基質ペプチドや反応生成物を化学試薬で発色させて測定する方法、その他放射能、比色、蛍光、発光等を利用して測定する方法を用いることもできる。
酵素活性の測定は、反応の時間経過を追跡し反応初速度や変化量を求めるのが好ましい。反応時間の経過につれて反応速度が漸減するからである。
【0009】
糖尿病合併症の検査や進行度管理は、始めに、糖尿病にかかっているが糖尿病性腎症は発症していない患者の尿等の検体液、糖尿病性腎症を発症している患者の検体液を、複数種の基質ペプチドの各々と反応させて酵素活性を測定し、判別分析等の公知の手法によって、糖尿病性腎症を発症しているグループと発症していないグループに判別する基準(判別関数)を予め設定しておく。判別関数を得るには、線形手法、非線形手法のいずれも用いることができる。
次に、未知の被験者の検体液を、判別関数を設定したときに用いたのと同じ種類の基質ペプチドの各々と反応させて酵素活性を測定し、未知の被験者が、予め設定したグループのいずれに属するのかを判別することで、糖尿病性腎症の発症や進行度を判断することができる。
また、データをSOM(自己組織化マップ)解析により二次元マップ化すると視覚化し易くなり、マップ上に糖尿病性腎症の進行の度合いに応じて複数のグループに分類できるため、未知の被験者が病状の進行度合い(第1期〜第4期)を把握し易くなり、人工透析をいつ頃導入することになるか等の病状の進行予測を視覚的に行うことができる。
なお、得られた酵素活性データは、SOM以外の種々の非線形分類法や非線形要因解析法により解析し、糖尿病の合併症の検査や進行度管理を行うことができる。
【0010】
基質ペプチドの組み合わせとしては、4種以上8種以下好ましくは4種以上6種以下が好適に用いられる。酵素活性の測定や解析を比較的容易に行うことができ、さらに判別精度に優れるからである。組み合わせが4種より少なくなるにつれ、判別精度が低下する傾向がみられる。6種を超えると酵素活性の測定や解析が煩雑になる傾向がみられ、8種を超えると、この傾向が著しくなるため好ましくない。
【0011】
本発明の請求項2に記載の発明は、請求項1に記載の糖尿病検出用試薬であって、前記基質ペプチドの4種の組み合わせが、(a)Leu-Val-Tyr, His-Glu-Lys, Glu-Lys-Lys, Thr-Arg-Ala, (b)Leu-Gly-Arg, Gly-Arg-Ile, Gly-Arg-Thr, Gly-Arg-Gly, (c)Asn-Pro-Arg, Asp-Gly-Arg, Arg-Arg-Gln, Pro-Leu-Gly又はAla-Lys-Ser, (d) Gln-Arg-Arg, His-Leu-Lys, Glu-Lys-Gly, Ala-Arg-Ser, (e) Val-Leu-Lys, Gly-Arg-Ile, Ala-Lys-Ser, Gly-Arg-Gly, (f) Val-Val-Arg, Val-Pro-Arg, Thr-Arg-Val, Asn-Lys-Tyr, (g) Gly-Arg-Ile, Gly-Arg-Thr, Phe-Lys-Ile, Ala-Lys-Ser, (h) Ala-Pro-Phe, Leu-Leu-Glu, Leu-Val-Tyr, Val-Leu-Lys, (i) Thr-Arg-Ala, Pro-Val-Arg, Gln-Arg-Ile, Leu-Met-Lys, (j) Val-Val-Arg, Pro-Val-Arg, Gln-Arg-Ile, Leu-Met-Lys, (k) Ser-Pro-Arg, Lys-Arg-Lys, Lys-Arg-Asp, Ser-Arg-Leu, (l) His-Leu-Lys, Lys-Arg-Lys, Lys-Arg-Asp, Ser-Arg-Leuのいずれかである構成を有している。
この構成により、請求項1で得られる作用に加え、以下のような作用が得られる。
(1)(a)Leu-Val-Tyr, His-Glu-Lys, Glu-Lys-Lys, Thr-Arg-Ala, (b)Leu-Gly-Arg, Gly-Arg-Ile, Gly-Arg-Thr, Gly-Arg-Gly, (c)Asn-Pro-Arg, Asp-Gly-Arg, Arg-Arg-Gln, Pro-Leu-Gly又はAla-Lys-Ser, (d) Gln-Arg-Arg, His-Leu-Lys, Glu-Lys-Gly, Ala-Arg-Ser, (e) Val-Leu-Lys, Gly-Arg-Ile, Ala-Lys-Ser, Gly-Arg-Gly, (f) Val-Val-Arg, Val-Pro-Arg, Thr-Arg-Val, Asn-Lys-Tyr, (g) Gly-Arg-Ile, Gly-Arg-Thr, Phe-Lys-Ile, Ala-Lys-Ser, (h) Ala-Pro-Phe, Leu-Leu-Glu, Leu-Val-Tyr, Val-Leu-Lys, (i) Thr-Arg-Ala, Pro-Val-Arg, Gln-Arg-Ile, Leu-Met-Lys, (j) Val-Val-Arg, Pro-Val-Arg, Gln-Arg-Ile, Leu-Met-Lys, (k) Ser-Pro-Arg, Lys-Arg-Lys, Lys-Arg-Asp, Ser-Arg-Leu, (l) His-Leu-Lys, Lys-Arg-Lys, Lys-Arg-Asp, Ser-Arg-Leuのいずれかの基質ペプチドの組み合わせを、糖尿病患者の尿又は血漿より得た検体液と接触させ、検体液の酵素活性を測定して得られた計測データを解析することにより、ほぼ100%の正判別率が得られることが確認された。これにより、糖尿病性腎症の検体を正確にグループ分けできることがわかった。従って、未知の被験者から採取した尿又は血漿の酵素活性を、これらの基質ペプチドを用いて測定し、設定された判別式を適用することにより、未知の被験者の糖尿病性腎症の進行度を判別することができる。
【0012】
糖尿病合併症検査用試薬は、(a)〜(l)の配列の4種の基質ペプチドを、別々の化合物としたものを用いることができる。また、基質ペプチドを伸長させて、1乃至3種の化合物としたものも用いることができる。なお、4種の基質ペプチドを別々の化合物としたものが好適である。測定結果の解析が容易で、精度も向上させることができるからである。なお、尿を検体液とする場合には、(a)、(h)〜(l)の基質ペプチドが適している。また、血液(血漿)を検体液とする場合には、(b)〜(g)の基質ペプチドが適している。
基質ペプチドは、酵素特異性を有しない任意のペプチド又はその他の化合物や分子を結合させることもできる。また、一端を不溶性の担体に結合させたものを用いることもできる。
【0013】
本発明の請求項3に記載の発明は、請求項1又は2に記載の糖尿病検出用試薬であって、前記基質ペプチドの一方の末端に結合した第1蛍光基を備えた構成を有している。
この構成により、請求項1又は2で得られる作用に加え、以下のような作用が得られる。
(1)尿中や血中の酵素によって基質ペプチドが切断されると、その前後において第1蛍光基の性質が変わり、蛍光波長や蛍光強度が変化するので、これを指標として酵素活性を検出することができる。
(2)尿や血液の検体液を接触反応させた後、検体液の蛍光強度等を測定するだけで酵素活性を検出することができるので、測定時間を短縮化することができ作業性を高め測定効率を高めることができ、また検出感度と測定精度を高めることができる。
【0014】
ここで、第1蛍光基としては、酵素によって基質ペプチドが切断される前後において蛍光基の性質が変わり、蛍光波長や蛍光強度に変化が生じるものが用いられる。基質ペプチドが不溶性の担体に結合している場合は、濃度消光現象に由来して蛍光波長や蛍光強度の変化が生じる蛍光基も用いられる。濃度消光現象とは、蛍光基が担体上で互いに近接しているときと尿や血液の検体液中に遊離して蛍光基間の距離が離れているときとで蛍光波長や蛍光強度が変化する現象をいう。
このような第1蛍光基としては、例えば、4−メチルクマリル−7−アミド(MCA)、7−アミノ−4−カルボキシメチルクマリン(ACC)、α−ナフチルアミド、α−ナフチルエステル、フルオレセイン、希土類錯体又はそれらの誘導体等が用いられる。
これにより、担体から遊離した第1蛍光基の蛍光波長や蛍光強度は、遊離前の第1蛍光基のものとは異なるので、特定波長領域における蛍光強度を指標として、酵素による切断量を測定することができる。
【0015】
なお、第1蛍光基は、フルオレセイン又はフルオレセインイソチオシアネート(FITC)等のフルオレセイン誘導体を用いるのが好ましい。フルオレセインは525nm前後の蛍光を発するので、薬等に含まれる蛍光物質の蛍光波長と区別することができ、薬やビタミン剤等を服用している被験者の尿もそのまま検体液として用いることができ汎用性に優れるからである。薬やビタミン剤等を服用している被験者の尿中には薬等に含まれる雑多な蛍光物質が出るが、これらの蛍光物質は蛍光波長が400nm付近のものが多いため、尿を検体液としてそのまま用いる場合、薬等に含まれる蛍光物質の蛍光と酵素活性によって検体液内に遊離した第1蛍光基の蛍光とを区別できないのである。
【0016】
検体液の蛍光測定は、蛍光分光光度計を用いる方法の他、発光ダイオード等の発光素子からの光を蛍光基の励起波長を通過するフィルタを通して検体液に照射し、検体液の蛍光を検出することができる位置に配置したCCD等の受光素子で蛍光強度等を測定する方法を用いることもできる。
【0017】
本発明の請求項4に記載の発明は、請求項1又は2に記載の糖尿病合併症検査用試薬であって、前記基質ペプチドの一方の末端に結合した第2蛍光基と、前記基質ペプチドの他方の末端に結合した消光基と、を備えた構成を有している。
この構成により、請求項1又は2に記載の作用に加え、以下のような作用が得られる。
(1)酵素によって基質ペプチドが切断されると、消光基と第2蛍光基との距離が離れることによって第2蛍光基の蛍光スペクトルが変化するので、このスペクトル変化を酵素活性の測定指標にすることができ、これにより、蛍光強度等の変化を指標として酵素活性を検出することができる。
(2)尿や血液の検体液を接触反応させた後、検体液の蛍光強度等を測定するだけで酵素活性を検出することができるので、測定時間を短縮化することができ作業性を高め測定効率を高めることができ、また検出感度と測定精度を高めることができる。
【0018】
ここで、消光基としては、第2蛍光基の蛍光励起波長に相当する光を吸収する物質、第2蛍光基との間のゆるい結合により無発光複合体を形成する物質、第2蛍光基と蛍光共鳴エネルギー移動が起こる物質等が用いられる。
蛍光共鳴エネルギー移動とは、第2蛍光基と消光基が距離的に近い位置に存在するとき、消光基(アクセプター)の励起スペクトルと第2蛍光基(ドナー)の蛍光スペクトルとが重なりをもつ場合、第2蛍光基の励起波長のエネルギーを当てると消光基が励起エネルギーを奪い、本来観察されるはずの第2蛍光基の蛍光が減衰する現象をいう。
【0019】
第2蛍光基や消光基としては、蛍光共鳴エネルギー移動が起こるドナーとアクセプターの組合せを用いることができる。例えば、第2蛍光基の蛍光波長と重なる波長域に吸収帯をもつ原子団である消光基等が用いられる。具体的には、(7−メトキシクマリン−4−イル)アセチル(MOAc),アントラニロイルベンジル(ABz),N−メチルアントラニル酸(Nma)等とジニトロフェニル(Dnp)の組合せ、DabsylとEDANS(5−(2'-アミノエチル)アミノナフタレン−1−スルホン酸)の組合せ、トリプトファン(Trp)と5−ジメチルアミノ−1−ナフタレンスルホン酸(Dns)の組合せ、カルボキシジクロロフルオレセイン(CDCF)とカルボキシメチルローダミン(CTMR)の組合せ、カルボキシジクロロフルオレセイン(CDCF)とカルボキシX−ローダミン(CXR)の組合せ、ルシファーイエロー(LY)とカルボキシメチルローダミン(CTMR)の組合せ等が用いられる。
【0020】
消光基は、基質ペプチドと直接結合させてもよいし、ペプチド又はその他の化合物や分子が結合した原子団を介して基質ペプチドと結合させてもよい。
なお、基質ペプチドと原子団の結合、原子団と消光基との結合は、酵素によって切断されないアミド結合,エステル結合,エーテル結合,チオエーテル結合,ウレタン結合等が用いられる。消光基が酵素によって切断されて基質ペプチドから遊離することでも第2蛍光基の蛍光スペクトルに変化が生じるが、基質ペプチドのアミノ酸配列に依存した酵素活性は検出できないからである。
【0021】
基質ペプチドに結合した第2蛍光基と消光基の結合部間の長さは、100Å以下であることが望ましい。第2蛍光基と消光基との結合部間の距離が長くなるにつれ蛍光強度等の変化が小さくなる傾向がみられ、100Åより長くなるとこの傾向が著しく蛍光強度の変化が著しく小さくなり感度が低下するからである。
【発明の効果】
【0022】
以上のように、本発明の糖尿病合併症検査用試薬によれば、以下のような有利な効果が得られる。
請求項1に記載の発明によれば、
(1)体液に分泌される複数の酵素の活性の測定を、複数の基質を用いて行い、その結果を分析することにより、糖尿病性腎症の発症や進行度合いを判別できるため、被験者の尿や血液等の体液を接触させて活性測定を行うという簡単な操作で、糖尿病性腎症を発症しているか否か、発症している場合に進行度合いは第1期〜第4期のいずれなのかを判別することができるとともに、第1期〜第4期の治療の有効性の検討や人工透析をいつ頃導入することになるか等の病状の進行予測の精密化が可能な糖尿病合併症検査用試薬を提供できる。
(2)尿に分泌される酵素、血液に分泌される酵素はそれぞれ異なるため、基質ペプチドの組合せによって、体液の種類に応じた活性検出を行うことができ応用性に優れた糖尿病合併症検査用試薬を提供できる。
(3)基質ペプチドはペプチド合成機等を用いて容易に製造できるため、生産性に優れた糖尿病合併症検査用試薬を提供できる。
【0023】
請求項2に記載の発明によれば、請求項1の効果に加え、
(1)糖尿病患者の尿又は血漿より得た検体液と接触させ、検体液の酵素活性を測定して得られた計測データを解析することにより、糖尿病性腎症の検体を正確にグループ分けできるので、未知の被験者から採取した尿又は血漿の酵素活性を、これらの基質ペプチドを用いて測定し、設定された判別式を適用することにより、未知の被験者の糖尿病性腎症の進行度を判別することができる糖尿病合併症検査用試薬を提供できる。
【0024】
請求項3に記載の発明によれば、請求項1又は2の効果に加え、
(1)尿や血液の検体液を接触反応させた後、検体液の蛍光強度等を測定するだけで酵素活性を検出することができるので、測定時間を短縮化することができ作業性を高め測定効率を高めることができるとともに、検出感度と測定精度に優れた糖尿病合併症検査用試薬を提供できる。
【0025】
請求項4の発明によれば、請求項1又は2の効果に加え、
(2)尿や血液の検体液を接触反応させた後、検体液の蛍光強度等を測定するだけで酵素活性を検出することができるので、測定時間を短縮化することができ作業性を高め測定効率を高めることができるとともに、検出感度と測定精度に優れた糖尿病合併症検査用試薬を提供できる。
【発明を実施するための最良の形態】
【0026】
以下、本発明を実施するための最良の形態を、図面を参照しながら説明する。
(実施の形態1)
図1は本発明の実施の形態1における糖尿病合併症検査用試薬の酵素活性検出原理を示す模式図である。
図中、1は実施の形態1における糖尿病合併症検査用試薬、2はハロゲン化炭化水素類,エステル類等の溶媒に不溶性の合成樹脂(ポリスチレン等)製(PEGA等)やガラス製等で略球状や多面体状等に形成された担体、Xは担体2に結合された酵素特異性を有さない化合物、3は化合物Xがアミノ酸AA1に結合したAA3−AA2−AA1のアミノ酸配列を有する基質ペプチド、4は基質ペプチド3のN末端に結合し基質ペプチド3が後述する酵素5によって切断される前後において、蛍光波長や蛍光強度に変化が生じる蛍光基の1種である4−メチルクマリル−7−アミド(MCA),フルオレセインイソチオシアネート(FITC)等の第1蛍光基、5は第1蛍光基4と基質ペプチド3とのペプチド結合や基質ペプチド3を特定の切断部位で選択的に切断する検体液中の基質特異性を有する酵素、6は酵素5によって基質ペプチド3が切断されたことにより遊離し蛍光波長等が変化した第1蛍光基である。
【0027】
以上のように構成された糖尿病合併症検査用試薬1は、基質ペプチド3をC末端から伸長していく固相法等の通常のペプチド合成法、目的とするアミノ酸配列のC末端側からN末端側へ逐次伸長していく逐次伸長法、複数の短いペプチド断片を合成しペプチド断片間のカップリングにより伸長させる断片縮合法、ペプチド合成機を用いてFmoc法、Boc法等を導入して合成する方法等を用いて合成することができる。
【0028】
以上のように構成された実施の形態1における糖尿病合併症検査用試薬について、以下その酵素活性の検出原理を説明する。
図1(a)に示す糖尿病合併症検査用試薬1の4−メチルクマリル−7−アミド(MCA),フルオレセインイソチオシアネート(FITC)等の第1蛍光基4は特定波長領域において非蛍光物質であり、また担体2の表面に高密度に存在しているときは濃度消光により蛍光強度が弱い。この糖尿病合併症検査用試薬1に酵素5を含む検体液を接触させ反応させると、第1蛍光基4と基質ペプチド3との間のペプチド結合や基質ペプチド3を特定の切断部位で選択的に切断する。
基質ペプチド3と遊離した第1蛍光基6は7−アミノ−メチルクマリン(AMC)等の蛍光物質となったり、担体2から離れることで濃度消光の効果が減少し、第1蛍光基6の蛍光波長又は該特定波長領域における蛍光強度は、基質ペプチド3と結合した第1蛍光基4とは異なるので、検体液の蛍光強度等の変化を指標として酵素活性を検出することができる(図1(b)参照)。
【0029】
糖尿病合併症の検査や進行度管理は、始めに、糖尿病にかかっているが糖尿病性腎症は発症していない患者の血液等の体液、糖尿病性腎症を発症している患者の体液を、アミノ酸配列が異なる4種類以上の基質ペプチド3が組み合わせられた糖尿病合併症検査用試薬1の各々と反応させて酵素活性を測定し、判別分析等の公知の手法によって、体液の酵素活性全体を一括して評価し、糖尿病性腎症を発症しているグループと発症していないグループに判別する基準(判別関数)をマハラノビスの距離をベースとした非線形手法等によって予め設定しておく。糖尿病性腎症の第1期〜第4期の患者を判別する各々の判別関数を、予めデータベース化して設定しておくことができる。
次に、未知の被験者の体液を、判別関数を設定したときと同じ種類の基質ペプチド3が組み合わせられた糖尿病合併症検査用試薬1の各々と反応させて酵素活性を測定し、未知の被験者が、予め設定したグループのいずれに属するのかを判別することで、糖尿病性腎症を発症しているのか否か、合併症の進行度等を簡便に判断することができる。
【0030】
以上のように、実施の形態1における糖尿病合併症検査用試薬は構成されているので、以下のような作用が得られる。
(1)被験者の体液を接触させて活性測定を行うという簡単な操作で、糖尿病性腎症を発症しているか否か、発症している場合に進行度合いはどの程度なのかを判別することができるとともに、治療の有効性の検討や人工透析をいつ頃導入することになるか等の病状の進行予測の精密化が可能になる。
(2)尿や血液等の体液の種類に応じて、基質ペプチド3の組合せを変えて酵素活性を測定することで、体液の種類に応じた活性検出を行うことができ応用性に優れる。
(3)基質ペプチドはペプチド合成機等を用いて容易に製造できるため、生産性に優れる。
【0031】
なお、本実施の形態においては、基質ペプチド3が担体2に結合した糖尿病合併症検査用試薬1を説明したが、担体2に結合したものを必ずしも用いる必要はなく、特定のアミノ酸配列を有する基質ペプチドが含まれていれば、凍結乾燥された粉末の状態や溶液の状態で供給されるものを用いることもできる。
また、糖尿病合併症検査用試薬1が基質ペプチド3を1種類ずつ有し、それを4以上組み合わせた場合について説明したが、基質ペプチド3の2種類以上を組み合わせて結合して伸長させた基質ペプチドを用いる場合もある。この場合も、糖尿病合併症検査用試薬の蛍光測定により酵素活性を評価し、糖尿病性腎症の第1期〜第4期の患者を判別する各々の判別関数によりグループ化することで、同様の作用が得られる。
【0032】
(実施の形態2)
図2は本発明の実施の形態2における糖尿病合併症検査用試薬の酵素活性検出原理を示す模式図である。なお、実施の形態1と同様のものは、同じ符号を付して説明を省略する。
図中、10は実施の形態2における糖尿病合併症検査用試薬、11は後述する検体液中の酵素14の切断部位を含むAA3−AA2−AA1のアミノ酸配列を有する基質ペプチドである。Y,Zは任意のアミノ酸残基等の原子団を示しており、本実施の形態においては、端部の原子団Yが担体2と結合している。
12は基質ペプチド11に結合した原子団Yと結合するジニトロフェニル(Dnp),5−ジメチルアミノ−1−ナフタレンスルホン酸(Dns)等の消光基、13は基質ペプチド11の他端に導入され消光基12と蛍光共鳴エネルギー移動がみられる(7−メトキシクマリン−4−イル)アセチル(MOAc),トリプトファン(Trp)等の第2蛍光基である。消光基12と第2蛍光基13は互いに蛍光に影響を及ぼす相互作用がみられる距離(100Å以下)で結合している。14は検体液中に存在する酵素、15は基質ペプチド11が酵素14の基質特異性によって特定の切断部位で切断され遊離されたことにより蛍光波長等が変化した第2蛍光基である。
【0033】
以上のように構成された実施の形態2における糖尿病合併症検査用試薬について、以下その酵素活性の検出原理を説明する。
図2(a)に示す糖尿病合併症検査用試薬10の消光基12と第2蛍光基13は、互いに蛍光に影響を及ぼす相互作用がみられる距離で結合しているので、消光基12の吸収スペクトルと第2蛍光基13の蛍光スペクトルとが重なりをもち、第2蛍光基13の励起波長のエネルギーを当てると本来観察されるはずの第2蛍光基13の蛍光の減衰が観察される。
糖尿病合併症検査用試薬10に酵素14を含む検体液を接触させ反応させると、基質特異性を有する酵素14は、基質ペプチド11を切断する。
第2蛍光基13が担体2から遊離すると、第2蛍光基13と消光基12との間で蛍光に影響を及ぼす相互作用がみられなくなるので、検体液に第2蛍光基13の励起波長のエネルギーを当てると、検体液との接触前には観察されなかった第2蛍光基15の蛍光波長が観察されるようになり、酵素14の反応前の蛍光波長とは異なるため、蛍光強度等の変化を指標として酵素活性を検出することができる(図2(b)参照)。
なお、糖尿病合併症の検査や進行度管理の方法は、実施の形態1で説明したものと同様なので説明を省略する。
【0034】
以上のように実施の形態2における糖尿病合併症検査用試薬は構成されているので、実施の形態1に記載の作用に加え、以下のような作用が得られる。
(1)消光基12と第2蛍光基13を選択することにより、第2蛍光基13の蛍光波長を可視部領域に設定することが可能になるので、市販のCCDカメラ等の可視光検出装置を用いて測定することが可能になり汎用性に優れる。
【0035】
本実施の形態においても、必ずしも基質ペプチド11を担体2に結合させる必要はなく、特定のアミノ酸配列を有する基質ペプチド11が含まれていれば、凍結乾燥された粉末の状態や溶液の状態で供給されるものを用いることもできる。
また、糖尿病合併症検査用試薬10が基質ペプチド11を1種類ずつ有し、それを4以上組み合わせた場合について説明したが、基質ペプチド11の2種類以上を組み合わせて結合して伸長させた基質ペプチドを用いる場合もある。この場合も、糖尿病合併症検査用試薬の蛍光測定により酵素活性を評価し、糖尿病性腎症の第1期〜第4期の患者を判別する各々の判別関数によりグループ化することで、同様の作用が得られる。
【実施例】
【0036】
以下、本発明を実施例により具体的に説明する。なお、本発明はこれらの実施例に限定されるものではない。
なお、本実施例で説明するアミノ酸、ペプチド、保護基、溶媒等は、当該技術分野で慣用されている略号又はIUPAC-IUBの命名委員会で採用された略号を使用している。例えば、以下の略号を使用している。例えば、FITC:Fluorescein-4-isothiocyanate isomer-I(フルオレセインイソチオシアネート) 、DMF:N,N−ジメチルホルムアミド、DIEA:N,N−ジイソプロピルエチルアミン、DCM:ジクロロメタン、i-PrOH:2-プロパノール、MeOH:メタノール、Lys(Dnp):(2S)-2-amino-6-(2,4-dinitrophenylamino)hexanoic acid、TFA:トリフルオロ酢酸。
(実施例1)
実施例1では、糖尿病合併症検査用試薬としてのペプチジル蛍光基結合球状担体を合成し、次に尿より得た検体液の活性測定を行った。以下、その方法について説明する。
<ペプチジル蛍光基結合球状担体の合成>
担体としては球状の市販のNH2-PEGA-resin(渡辺化学工業製、粒径約0.1mm)を用いた。Peptide synthesizer (Model 433A, Applied Biosystems) を用いてNH2-PEGA Resin (0.5 g, 25μmol) に、Lys(Dnp)、AA1、AA2、AA3、βAlaの5つのアミノ酸を順に導入した。なお、AA1、AA2、AA3は表1に示すアミノ酸である。その後、プラスチックベッセルに担体を入れ、DMFを加えて担体を膨潤させた。DMFを吸引除去した後、少量のDMFに溶解させた FITC (30μmol, 12 mg), DMF (2 ml) 及びDIEA (25μmol, 4.4μl) を加え、室温で3時間振とうした。反応液を吸引除去した後、DMF (2 ml, 2回)、 DCM (2 ml, 2回)、i-PrOH (2 ml, 2回)、DMF (2 ml, 2回)、MeOH (2 ml, 2回)、エーテル (2 ml, 2回) の順で担体を洗浄した。その後、フェノール (75 mg)、1,2-エタンジチオール (25μl)、チオアニソール(50μl)、蒸留水(50μl) 及びTFA (2 ml) の混合溶液と3時間反応させた。反応液を吸引除去後、DCM (2 ml, 2回)、 DMF (2 ml, 2回)、20%ピペリジン / DMF (2 ml, 2回)、DMF (2 ml, 2回)、i-PrOH (2 ml, 2回)、DMF (2 ml, 2回)、蒸留水(2 ml, 2回)、エーテル (2 ml,1回) の順で担体を洗浄し減圧乾燥することによって、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表1のNo1〜No4)を有する糖尿病合併症検査用試薬(配列表の配列番号1〜4)を得た。
【0037】
【表1】

【0038】
<酵素活性の測定>
No1〜No4の糖尿病合併症検査用試薬の各々1 mg に、0.01% Tween 20を含有する20 mM Tris-HCl バッファ(pH 8.0, NaCl 100mM, CaCl250 mM) 190 μl を加え、糖尿病性腎症対象者(第4期)(A群)5名並びに糖尿病性腎症非対象者(第1期)(B群)5名の尿より得た検体液を同量ずつ加え、測定時間ごとにサンプルから10 μlとり、バッファを190 μl加えて96ウェルプレートに移し、蛍光値をPerkin Elmer社製Wallac 1420 ARVO sx プレートリーダーにより測定した(測定時間0.1秒)。検体液を加えてから10分後の蛍光値の変化量(検体液を加える前の蛍光値と検体液を加えてから10分後の蛍光値との差) (励起波長485 nm、蛍光波長535 nm)を、表2に示す。
【0039】
【表2】

【0040】
まず、表2に示すA群、B群の分散共分散行列の等質性について解析したところ、等質とはみなされないことがわかった。そこで、マハラノビスの距離をベースとした非線形(二次)判別分析法を用いて解析した。解析結果より得られた判別得点を表3に示す。
【0041】
【表3】

【0042】
表3に示す判別得点から、表4に示すように正判別率100%を得た。
【0043】
【表4】

【0044】
以上の計測データを解析し2次判別関数を求め、判別式を作成した。
以上説明したように、本実施例の糖尿病合併症検査用試薬を糖尿病患者の尿より得た検体液と接触させ、検体液の酵素活性を測定して得られた測定値を判別分析により解析した結果、正判別率は100%と極めて高いことが確認された。このことは、本実施例の糖尿病合併症検査用試薬を用いることにより、糖尿病性腎症の検体を極めて正確にグループ分けできることを示している。
従って、未知の被験者から採取した尿の検体液の酵素活性を、本実施例の糖尿病合併症検査用試薬を用いて測定し、設定された判別式を適用することにより、未知の被験者の糖尿病性腎症の進行度を判別可能であることが明らかである。
なお、本実施例においては、糖尿病性腎症第1期と第4期の検体について正確に判別できることを示したが、第1期〜第4期の検体数を増やすことにより、同様の方法で糖尿病性腎症の第1期〜第4期の進行度管理を行うこともできる。
【0045】
また、本実施例においては、フルオレセインイソチオシアネート(FITC)からなる第2蛍光基が一端に結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合した基質ペプチドを有する糖尿病合併症検査用試薬を合成して、これと接触させた検体液の蛍光変化を測定した場合について説明したが、第2蛍光基として(7−メトキシクマリン−4−イル)アセチル(MOAc)等を用いた場合も、同様の結果が得られることを確認した。
また、PEGA resin等の担体が一端に、FITC等の第1蛍光基が他端に結合した基質ペプチドを有する糖尿病合併症検査用試薬を用いた場合も、これと接触させた検体液の蛍光変化を測定し酵素活性を検出することで、糖尿病の合併症の検査や進行度管理に利用できることを確認した。
【0046】
(実施例2)
実施例1と同様にして、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表5のNo5〜No8)を有する糖尿病合併症検査用試薬(配列表の配列番号5〜8)を得た。
【0047】
【表5】

【0048】
<酵素活性の測定>
No5〜No8の糖尿病合併症検査用試薬の各々1 mg に、0.01% Tween 20を含有する20 mM Tris-HCl バッファ(pH 8.0, NaCl 100mM, CaCl250 mM) 190 μl を加え、糖尿病性腎症対象者(第4期)(A群)5名並びに糖尿病性腎症非対象者(第1期)(B群)5名の血液(血漿)より得た検体液を同量ずつ加え、測定時間ごとにサンプルから10 μlとり、バッファを190 μl加えて96ウェルプレートに移し、蛍光値をPerkin Elmer社製Wallac 1420 ARVO sx プレートリーダーにより測定した(測定時間0.1秒)。検体液を加えてから10分後の蛍光値の変化量(検体液を加える前の蛍光値と検体液を加えてから10分後の蛍光値との差) (励起波長485 nm、蛍光波長535 nm)を、表6に示す。
【0049】
【表6】

【0050】
表6に示すA群、B群の分散共分散行列について、実施例1と同様に、マハラノビスの距離をベースとした非線形(二次)判別分析法を用いて解析した。解析結果より得られた判別得点を表7に示す。
【0051】
【表7】

【0052】
表7に示す判別得点から、表8に示すように80%以上の正判別率を得た。
【0053】
【表8】

【0054】
以上の計測データを解析し2次判別関数を求め、判別式を作成した。
以上説明したように、本実施例の糖尿病合併症検査用試薬を糖尿病患者の血漿より得た検体液と接触させ、検体液の酵素活性を測定して得られた計測データを解析することにより、正判別率は極めて高いことが確認された。検体数が増加すれば、さらに正判別率が上昇することが期待される。このことは、本実施例の糖尿病合併症検査用試薬を用いることにより、糖尿病性腎症の検体を極めて正確にグループ分けできることを示している。
従って、未知の被験者から採取した血漿の検体液の酵素活性を、本実施例の糖尿病合併症検査用試薬を用いて測定し、設定された判別式を適用することにより、未知の被験者の糖尿病性腎症の進行度を判別可能であることが明らかである。
【0055】
(実施例3)
実施例1と同様にして、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表9のNo9〜No12)を有する糖尿病合併症検査用試薬(配列表の配列番号9〜12)を得た。
【0056】
【表9】

【0057】
<酵素活性の測定>
No9〜No12の糖尿病合併症検査用試薬の各々1 mg を用い、実施例2と同様にして、血液(血漿)より得た検体液を加えたときの蛍光値の変化量を測定した。その結果を表10に示す。
【0058】
【表10】

【0059】
表10に示すA群、B群の分散共分散行列について、実施例1と同様に、マハラノビスの距離をベースとした非線形(二次)判別分析法を用いて解析した。解析結果より得られた判別得点を表11に示す。
【0060】
【表11】

【0061】
表11に示す判別得点から、表12に示すように正判別率100%を得た。この結果、本実施例の糖尿病合併症検査用試薬を用いることにより、糖尿病性腎症の検体を極めて正確にグループ分けできることが確認された。
【0062】
【表12】

【0063】
(実施例4)
実施例1と同様にして、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表13のNo9〜No11,No13)を有する糖尿病合併症検査用試薬(配列表の配列番号9〜11、配列番号13)を得た。
【0064】
【表13】

【0065】
<酵素活性の測定>
No9〜No11,No13の糖尿病合併症検査用試薬の各々1 mg を用い、実施例2と同様にして、血液(血漿)より得た検体液を加えたときの蛍光値の変化量を測定した。その結果を表14に示す。
【0066】
【表14】

【0067】
表14に示すA群、B群の分散共分散行列について、実施例1と同様に、マハラノビスの距離をベースとした非線形(二次)判別分析法を用いて解析した。解析結果より得られた判別得点を表15に示す。
【0068】
【表15】

【0069】
表15に示す判別得点から、表16に示すように正判別率100%を得た。この結果、本実施例の糖尿病合併症検査用試薬を用いることにより、糖尿病性腎症の検体を極めて正確にグループ分けできることが確認された。
【0070】
【表16】

【0071】
(実施例5)
実施例1と同様にして、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表17のNo8〜No13)を有する糖尿病合併症検査用試薬(配列表の配列番号8〜13)を得た。
【0072】
【表17】

【0073】
<酵素活性の測定>
No8〜No13の糖尿病合併症検査用試薬の各々1 mg を用い、実施例2と同様にして、血液(血漿)より得た検体液を加えたときの蛍光値の変化量を測定した。その結果を表18に示す。
【0074】
【表18】

【0075】
表18に示すA群、B群の分散共分散行列について、マハラノビスの距離をベースとし、両群の分散共分散行列が等質であると仮定して、(2次項を除外して)線形判別関数を導いた。解析結果より得られた判別得点を表19に示す。
【0076】
【表19】

【0077】
表19に示す判別得点から、表20に示すように正判別率100%を得た。一般に、検体数が増加すれば両群の類似性が上昇するため、線形解析が可能となることが期待される。本実施例の糖尿病合併症検査用試薬を用い、線形解析を行うことにより、糖尿病性腎症の検体を極めて正確にグループ分けできることが確認された。
【0078】
【表20】

【0079】
(実施例6)
実施例1と同様にして、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表21のNo17,19,21,23)を有する糖尿病合併症検査用試薬(配列表の配列番号17,19,21,23)を得た。
【0080】
【表21】

【0081】
<酵素活性の測定>
No17,19,21,23の糖尿病合併症検査用試薬の各々1 mg を用い、実施例2と同様にして、血液(血漿)より得た検体液を加えたときの蛍光値の変化量を測定した。その結果を表22に示す。
【0082】
【表22】

【0083】
表22に示すA群、B群の分散共分散行列について、実施例1と同様に、マハラノビスの距離をベースとした非線形(二次)判別分析法を用いて解析した。解析結果より得られた判別得点を表23に示す。
【0084】
【表23】

【0085】
表23に示す判別得点から、表24に示すように正判別率100%を得た。この結果、本実施例の糖尿病合併症検査用試薬を用いることにより、糖尿病性腎症の検体を極めて正確にグループ分けできることが確認された。
【0086】
【表24】

【0087】
(実施例7)
実施例1と同様にして、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表25のNo6,8,13,14)を有する糖尿病合併症検査用試薬(配列表の配列番号6,8,13,14)を得た。
【0088】
【表25】

【0089】
<酵素活性の測定>
No6,8,13,14の糖尿病合併症検査用試薬の各々1 mg を用い、実施例2と同様にして、血液(血漿)より得た検体液を加えたときの蛍光値の変化量を測定した。その結果を表26に示す。
【0090】
【表26】

【0091】
表26に示すA群、B群の分散共分散行列について、実施例1と同様に、マハラノビスの距離をベースとした非線形(二次)判別分析法を用いて解析した。解析結果より得られた判別得点を表27に示す。
【0092】
【表27】

【0093】
表27に示す判別得点から、表28に示すように正判別率100%を得た。この結果、本実施例の糖尿病合併症検査用試薬を用いることにより、糖尿病性腎症の検体を極めて正確にグループ分けできることが確認された。
【0094】
【表28】

【0095】
(実施例8)
実施例1と同様にして、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表29のNo15,16,18,22)を有する糖尿病合併症検査用試薬(配列表の配列番号15,16,18,22)を得た。
【0096】
【表29】

【0097】
<酵素活性の測定>
No15,16,18,22の糖尿病合併症検査用試薬の各々1 mg を用い、実施例2と同様にして、血液(血漿)より得た検体液を加えたときの蛍光値の変化量を測定した。その結果を表30に示す。
【0098】
【表30】

【0099】
表30に示すA群、B群の分散共分散行列について、実施例1と同様に、マハラノビスの距離をベースとした非線形(二次)判別分析法を用いて解析した。解析結果より得られた判別得点を表31に示す。
【0100】
【表31】

【0101】
表31に示す判別得点から、表32に示すように正判別率100%を得た。この結果、本実施例の糖尿病合併症検査用試薬を用いることにより、糖尿病性腎症の検体を極めて正確にグループ分けできることが確認された。
【0102】
【表32】

【0103】
(実施例9)
実施例1と同様にして、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表33のNo6,7,13,20)を有する糖尿病合併症検査用試薬(配列表の配列番号6,7,13,20)を得た。
【0104】
【表33】

【0105】
<酵素活性の測定>
No6,7,13,20の糖尿病合併症検査用試薬の各々1 mg を用い、実施例2と同様にして、血液(血漿)より得た検体液を加えたときの蛍光値の変化量を測定した。その結果を表34に示す。
【0106】
【表34】

【0107】
表34に示すA群、B群の分散共分散行列について、実施例1と同様に、マハラノビスの距離をベースとした非線形(二次)判別分析法を用いて解析した。解析結果より得られた判別得点を表35に示す。
【0108】
【表35】

【0109】
表35に示す判別得点から、表36に示すように正判別率100%を得た。この結果、本実施例の糖尿病合併症検査用試薬を用いることにより、糖尿病性腎症の検体を極めて正確にグループ分けできることが確認された。
【0110】
【表36】

【0111】
(実施例10)
実施例1と同様にして、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表37のNo24,25,1,14)を有する糖尿病合併症検査用試薬(配列表の配列番号24,25,1,14)を得た。
【0112】
【表37】

【0113】
<酵素活性の測定>
No24,25,1,14の糖尿病合併症検査用試薬の各々1 mg を用い、実施例1と同様にして、尿より得た検体液を加えたときの蛍光値の変化量を測定した。その結果を表38に示す。
【0114】
【表38】

【0115】
表38に示すA群、B群の分散共分散行列について、実施例1と同様に、マハラノビスの距離をベースとした非線形(二次)判別分析法を用いて解析した。解析結果より得られた判別得点を表39に示す。
【0116】
【表39】

【0117】
表39に示す判別得点から、表40に示すように正判別率100%を得た。この結果、本実施例の糖尿病合併症検査用試薬を用いることにより、糖尿病性腎症の検体を極めて正確にグループ分けできることが確認された。
【0118】
【表40】

【0119】
(実施例11)
実施例1と同様にして、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表41のNo4,26,27,28)を有する糖尿病合併症検査用試薬(配列表の配列番号4,26,27,28)を得た。
【0120】
【表41】

【0121】
<酵素活性の測定>
No4,26,27,28の糖尿病合併症検査用試薬の各々1 mg を用い、実施例1と同様にして、尿より得た検体液を加えたときの蛍光値の変化量を測定した。その結果を表42に示す。
【0122】
【表42】

【0123】
表42に示すA群、B群の分散共分散行列について、実施例1と同様に、マハラノビスの距離をベースとした非線形(二次)判別分析法を用いて解析した。解析結果より得られた判別得点を表43に示す。
【0124】
【表43】

【0125】
表43に示す判別得点から、表44に示すように正判別率100%を得た。この結果、本実施例の糖尿病合併症検査用試薬を用いることにより、糖尿病性腎症の検体を極めて正確にグループ分けできることが確認された。
【0126】
【表44】

【0127】
(実施例12)
実施例1と同様にして、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表45のNo15,26,27,28)を有する糖尿病合併症検査用試薬(配列表の配列番号15,26,27,28)を得た。
【0128】
【表45】

【0129】
<酵素活性の測定>
No15,26,27,28の糖尿病合併症検査用試薬の各々1 mg を用い、実施例1と同様にして、尿より得た検体液を加えたときの蛍光値の変化量を測定した。その結果を表46に示す。
【0130】
【表46】

【0131】
表46に示すA群、B群の分散共分散行列について、実施例1と同様に、マハラノビスの距離をベースとした非線形(二次)判別分析法を用いて解析した。解析結果より得られた判別得点を表47に示す。
【0132】
【表47】

【0133】
表47に示す判別得点から、表48に示すように正判別率100%を得た。この結果、本実施例の糖尿病合併症検査用試薬を用いることにより、糖尿病性腎症の検体を極めて正確にグループ分けできることが確認された。
【0134】
【表48】

【0135】
(実施例13)
実施例1と同様にして、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表49のNo29,30,31,32)を有する糖尿病合併症検査用試薬(配列表の配列番号29,30,31,32)を得た。
【0136】
【表49】

【0137】
<酵素活性の測定>
No29,30,31,32の糖尿病合併症検査用試薬の各々1 mg を用い、実施例1と同様にして、尿より得た検体液を加えたときの蛍光値の変化量を測定した。その結果を表50に示す。
【0138】
【表50】

【0139】
表50に示すA群、B群の分散共分散行列について、実施例1と同様に、マハラノビスの距離をベースとした非線形(二次)判別分析法を用いて解析した。解析結果より得られた判別得点を表51に示す。
【0140】
【表51】

【0141】
表51に示す判別得点から、表52に示すように正判別率100%を得た。この結果、本実施例の糖尿病合併症検査用試薬を用いることにより、糖尿病性腎症の検体を極めて正確にグループ分けできることが確認された。
【0142】
【表52】

【0143】
(実施例14)
実施例1と同様にして、FITCからなる第2蛍光基が一端のβアラニンに結合し、ジニトロフェニル(Dnp)からなる消光基が他端のリジンに結合したβAla-AA3-AA2-AA1-Lysからなる基質ペプチド(表53のNo19,30,31,32)を有する糖尿病合併症検査用試薬(配列表の配列番号19,30,31,32)を得た。
【0144】
【表53】

【0145】
<酵素活性の測定>
No19,30,31,32の糖尿病合併症検査用試薬の各々1 mg を用い、実施例1と同様にして、尿より得た検体液を加えたときの蛍光値の変化量を測定した。その結果を表54に示す。
【0146】
【表54】

【0147】
表54に示すA群、B群の分散共分散行列について、実施例1と同様に、マハラノビスの距離をベースとした非線形(二次)判別分析法を用いて解析した。解析結果より得られた判別得点を表55に示す。
【0148】
【表55】

【0149】
表55に示す判別得点から、表56に示すように正判別率100%を得た。この結果、本実施例の糖尿病合併症検査用試薬を用いることにより、糖尿病性腎症の検体を極めて正確にグループ分けできることが確認された。
【0150】
【表56】

【産業上の利用可能性】
【0151】
本発明は、糖尿病の合併症、特に糖尿病性腎症の検査や進行度の管理に有効な糖尿病合併症検査用試薬に関し、被験者の尿や血液等の体液を接触させて活性測定を行うという簡単な操作で、糖尿病患者の体液に含まれるマーカーの特定や追跡をしなくても、糖尿病性腎症を発症しているか否か、発症している場合に進行度合いは第1期〜第4期のいずれなのかを判別することができるとともに、第1期〜第4期の治療の有効性の検討や人工透析をいつ頃導入することになるか等の病状の進行予測を精密化でき、医師による糖尿病診断の支援に極めて有効な糖尿病合併症検査用試薬を提供できる。
【図面の簡単な説明】
【0152】
【図1】実施の形態1における糖尿病合併症検査用試薬の酵素活性検出原理を示す模式図
【図2】実施の形態2における糖尿病合併症検査用試薬の酵素活性検出原理を示す模式図
【符号の説明】
【0153】
1 糖尿病合併症検査用試薬
2 担体
3 基質ペプチド
4,6 第1蛍光基
5 酵素
10 糖尿病合併症検査用試薬
11 基質ペプチド
12 消光基
13,15 第2蛍光基
14 酵素
【特許請求の範囲】
【請求項1】
3個のアミノ酸が結合した基質ペプチドが4種以上組み合わせられていることを特徴とする糖尿病合併症検査用試薬。
【請求項2】
前記基質ペプチドの4種の組み合わせが、(a)Leu-Val-Tyr, His-Glu-Lys, Glu-Lys-Lys, Thr-Arg-Ala, (b)Leu-Gly-Arg, Gly-Arg-Ile, Gly-Arg-Thr, Gly-Arg-Gly, (c)Asn-Pro-Arg, Asp-Gly-Arg, Arg-Arg-Gln, Pro-Leu-Gly又はAla-Lys-Ser, (d) Gln-Arg-Arg, His-Leu-Lys, Glu-Lys-Gly, Ala-Arg-Ser, (e) Val-Leu-Lys, Gly-Arg-Ile, Ala-Lys-Ser, Gly-Arg-Gly, (f) Val-Val-Arg, Val-Pro-Arg, Thr-Arg-Val, Asn-Lys-Tyr, (g) Gly-Arg-Ile, Gly-Arg-Thr, Phe-Lys-Ile, Ala-Lys-Ser, (h) Ala-Pro-Phe, Leu-Leu-Glu, Leu-Val-Tyr, Val-Leu-Lys, (i) Thr-Arg-Ala, Pro-Val-Arg, Gln-Arg-Ile, Leu-Met-Lys, (j) Val-Val-Arg, Pro-Val-Arg, Gln-Arg-Ile, Leu-Met-Lys, (k) Ser-Pro-Arg, Lys-Arg-Lys, Lys-Arg-Asp, Ser-Arg-Leu, (l) His-Leu-Lys, Lys-Arg-Lys, Lys-Arg-Asp, Ser-Arg-Leuのいずれかであることを特徴とする請求項1に記載の糖尿病合併症検査用試薬。
【請求項3】
前記基質ペプチドの一方の末端に結合した第1蛍光基を備えていることを特徴とする請求項1又は2に記載の糖尿病合併症検査用試薬。
【請求項4】
前記基質ペプチドの一方の末端に結合した第2蛍光基と、前記基質ペプチドの他方の末端に結合した消光基と、を備えていることを特徴とする請求項1又は2に記載の糖尿病合併症検査用試薬。
【請求項1】
3個のアミノ酸が結合した基質ペプチドが4種以上組み合わせられていることを特徴とする糖尿病合併症検査用試薬。
【請求項2】
前記基質ペプチドの4種の組み合わせが、(a)Leu-Val-Tyr, His-Glu-Lys, Glu-Lys-Lys, Thr-Arg-Ala, (b)Leu-Gly-Arg, Gly-Arg-Ile, Gly-Arg-Thr, Gly-Arg-Gly, (c)Asn-Pro-Arg, Asp-Gly-Arg, Arg-Arg-Gln, Pro-Leu-Gly又はAla-Lys-Ser, (d) Gln-Arg-Arg, His-Leu-Lys, Glu-Lys-Gly, Ala-Arg-Ser, (e) Val-Leu-Lys, Gly-Arg-Ile, Ala-Lys-Ser, Gly-Arg-Gly, (f) Val-Val-Arg, Val-Pro-Arg, Thr-Arg-Val, Asn-Lys-Tyr, (g) Gly-Arg-Ile, Gly-Arg-Thr, Phe-Lys-Ile, Ala-Lys-Ser, (h) Ala-Pro-Phe, Leu-Leu-Glu, Leu-Val-Tyr, Val-Leu-Lys, (i) Thr-Arg-Ala, Pro-Val-Arg, Gln-Arg-Ile, Leu-Met-Lys, (j) Val-Val-Arg, Pro-Val-Arg, Gln-Arg-Ile, Leu-Met-Lys, (k) Ser-Pro-Arg, Lys-Arg-Lys, Lys-Arg-Asp, Ser-Arg-Leu, (l) His-Leu-Lys, Lys-Arg-Lys, Lys-Arg-Asp, Ser-Arg-Leuのいずれかであることを特徴とする請求項1に記載の糖尿病合併症検査用試薬。
【請求項3】
前記基質ペプチドの一方の末端に結合した第1蛍光基を備えていることを特徴とする請求項1又は2に記載の糖尿病合併症検査用試薬。
【請求項4】
前記基質ペプチドの一方の末端に結合した第2蛍光基と、前記基質ペプチドの他方の末端に結合した消光基と、を備えていることを特徴とする請求項1又は2に記載の糖尿病合併症検査用試薬。
【図1】


【図2】




【図2】


【公開番号】特開2008−271963(P2008−271963A)
【公開日】平成20年11月13日(2008.11.13)
【国際特許分類】
【出願番号】特願2008−90821(P2008−90821)
【出願日】平成20年3月31日(2008.3.31)
【出願人】(504174135)国立大学法人九州工業大学 (489)
【Fターム(参考)】
【公開日】平成20年11月13日(2008.11.13)
【国際特許分類】
【出願日】平成20年3月31日(2008.3.31)
【出願人】(504174135)国立大学法人九州工業大学 (489)
【Fターム(参考)】
[ Back to top ]

