糖尿病患者における使用のためのナトリウム−グルコース共輸送体1及び2の阻害剤としての6−ベンジルフェニル−2−サルファテトラヒドロピラン−3,4,5−トリオール誘導体
患者、特に2型糖尿病を患う患者の心血管及び/又は代謝の健康を改善する方法、並びに該方法において有用な化合物及び医薬組成物が開示される。
【発明の詳細な説明】
【技術分野】
【0001】
1. 発明の分野
本発明は、患者、特に2型糖尿病を患う患者の心血管及び/又は代謝の健康を改善する方法、並びに該方法において有用な化合物及び医薬組成物に関する。
【背景技術】
【0002】
2. 背景
2型真性糖尿病(T2DM)は、血清グルコースの上昇を特徴とする障害である。この疾患を患う患者において血清グルコースを低減させる方法の1つは、腎臓におけるグルコース再吸収を阻害することによるものである。グルコースはおよそ8g/hの速度で糸球体を通って濾過されて、ナトリウム−グルコース共輸送体(SGLT)を介して近位尿細管でほぼ完全に再吸収されるため、腎臓はグルコースの全体的な制御において重要な役割を果たす(非特許文献1)。ナトリウム−グルコース共輸送体2(SGLT2)は、14個の膜貫通ドメインSGLTのうちの1つであり、糸球体で濾過されるグルコースの大部分を再吸収することに関与する。したがって、SGLT2の阻害は、T2DMを治療するための合理的なアプローチである(同上)。
【0003】
多数のSGLT2阻害剤が報告されている。例えば、特許文献1、特許文献2及び特許文献3を参照されたい。それらのうちの1つであるダパグリフロジンは、T2DM患者へ投与され、有望な結果をもたらしてきた。特に、14日間の研究において化合物に対して無作為化した患者は、プラセボと比較して空腹時血漿レベルの低減及び耐糖能の改善を示した(非特許文献1、513頁)。12週間の研究では、化合物に対して無作為化した患者は、プラセボと比較して、ヘモグロビンA1cの改善、或る程度の体重減少、及び収縮期血圧の或る程度の改善を示した(非特許文献2)。
【0004】
SGLT2の阻害剤の発見及び開発を対象とする製薬上の努力のほとんどは、「SGLT2輸送体に対して選択的な阻害剤を考案することに焦点が当てられてきた」(非特許文献3)。これは、機能的SGLT2遺伝子を欠いているヒトが、高い尿グルコース排泄を示すことは別として、通常の生活を送っているようである一方で、SGLT1遺伝子突然変異を有するヒトがグルコース−ガラクトース吸収不良に苦しんでいるという事実に少なくとも部分的に基づいているようである(同上)。ヒト腎臓でのみ発現されるSGLT2と異なり、SGLT1は、小腸及び心臓でも発現される(同上)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】米国特許第6,414,126号
【特許文献2】米国特許第6,555,519号
【特許文献3】米国特許第7,393,836号
【非特許文献】
【0006】
【非特許文献1】Komoroski, B., et al., Clin Pharmacol Ther. 85(5):513-9(2009)
【非特許文献2】List, J.F., et al., Diabetes Care. 32(4):650-7(2009)
【非特許文献3】Washburn, W.N., Expert Opin. Ther. Patents 19(11):1485,1499,1486(2009)
【発明の概要】
【0007】
3. 発明の概要
本発明は部分的に、患者の心血管及び/又は代謝の健康を改善する方法であって、安全かつ有効な量の、式I:
【化1】

の構造も有する(その様々な置換基が本明細書中で定義される)ナトリウム−グルコース共輸送体1及び2の二重阻害剤(「二重SGLT1/2阻害剤」)又はそれらの薬学的に許容される塩を、それを必要とする患者へ投与することを含む、患者の心血管及び/又は代謝の健康を改善する方法に関する。特定の実施の形態では、患者は、抗糖尿病剤、抗高血糖症剤、抗高脂血症剤/脂質低下剤、抗肥満症剤、抗高血圧剤又は食欲抑制薬のような別の治療剤を同時に服用している。
【0008】
本発明の1つの実施の形態では、投与は、患者の血漿グルコースの減少をもたらす。1つの実施の形態では、投与は、患者における経口耐糖能の改善をもたらす。1つの実施の形態では、投与は、患者の食後血漿グルコースレベルを低下させる。1つの実施の形態では、投与は、患者の血漿フルクトサミンレベルを低下させる。1つの実施の形態では、投与は、患者のHbA1cレベルを低下させる。1つの実施の形態では、投与は、患者の血圧(例えば、収縮期血圧及び拡張期血圧)を低減させる。1つの実施の形態では、投与は、患者のトリグリセリドレベルを低減させる。
【0009】
本発明の特定の実施の形態では、二重SGLT1/2阻害剤は、式:
【化2】

(式中、R1Aはそれぞれ独立して、水素、アルキル、アリール又は複素環であり、R6はそれぞれ独立して、水素、ヒドロキシル、アミノ、アルキル、アリール、シアノ、ハロゲン、ヘテロアルキル、複素環、ニトロ、C≡CR6A、OR6A、SR6A、SOR6A、SO2R6A、C(O)R6A、CO2R6A、CO2H、CON(R6A)(R6A)、CONH(R6A)、CONH2、NHC(O)R6A、又はNHSO2R6Aであり、R6Aはそれぞれ独立して、アルキル、アリール又は複素環であり、R7はそれぞれ独立して、水素、ヒドロキシル、アミノ、アルキル、アリール、シアノ、ハロゲン、ヘテロアルキル、複素環、ニトロ、C≡CR7A、OR7A、SR7A、SOR7A、SO2R7A、C(O)R7A、CO2R7A、CO2H、CON(R7A)(R7A)、CONH(R7A)、CONH2、NHC(O)R7A、又はNHSO2R7Aであり、R7Aはそれぞれ独立して、アルキル、アリール又は複素環であり、mは1〜4であり、nは1〜3であり、pは0〜2であり、各アルキル、アリール、ヘテロアルキル又は複素環は、アルコキシ、アミノ、シアノ、ハロ、ヒドロキシル又はニトロのうちの1つ又は複数で必要に応じて置換される)
の化合物、又はその薬学的に許容される塩である。
【0010】
特定の実施の形態では、安全かつ有効な量は、300mg/日、又はそれ未満(例えば、250mg/日、200mg/日、150mg/日、100mg/日若しくは50mg/日、又はそれ未満)である。特定の患者は、糖尿病患者又は前糖尿病患者である。
【0011】
4. 図面の簡単な説明
本発明の或る特定の態様は、図面を参照して理解することができる。図面は、無作為化二重盲検プラセボ対照第2a相臨床試験(150mg及び300mgの用量の本発明の化合物を、2型真性糖尿病を患う患者に1日1回経口投与した)から得られた結果を提示する。
【図面の簡単な説明】
【0012】
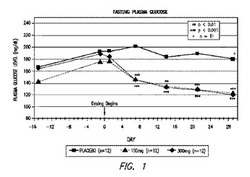
【図1】研究の間のプラセボ群、並びに150mg/日及び300mg/日の治療群における患者の血漿グルコースレベルを示す図である。
【図2】研究の間に施された耐糖能試験における各群の平均結果を示す図である。
【図3】研究の間の各群の平均グルコース血漿レベルの曲線下面積(AUC)を示す図である。
【図4】各群の平均恒常性モデル評価(HOMA)値の結果を示す図である。測定値は、研究が始まる前に、及び27日目に再度得た。
【図5】研究の間の各群の平均食後グルコースレベルの測定値を提示する図である。
【図6】研究の間の各群の平均血漿フルクトサミンレベルの測定値を提示する図である。
【図7】研究の間のヘモグロビンA1cレベルの各群の平均パーセントの変化を提示する図である。
【図8】ベースラインと比較した、研究の28日目に測定した場合の各群の平均拡張期血圧の変化を示す図である。
【図9】ベースラインと比較した、研究の28日目に測定した場合の各群の平均収縮期血圧の変化を示す図である。
【図10】ベースラインと比較した、研究の28日目に測定した場合の各群の平均動脈圧の変化を示す図である。
【発明を実施するための形態】
【0013】
5. 詳細な説明
本発明は、無作為化二重盲検プラセボ対照第2a相臨床試験(150mg/日及び300mg/日の用量の二重SGLT1/2阻害剤が、2型真性糖尿病を患う患者に投与された)から得られた、本明細書中で提示される知見に部分的に基づいている。二重SGLT1/2阻害剤は、構造:
【化3】

を有する(2S,3R,4R,5S,6R)−2−(4−クロロ−3−(4−エトキシベンジル)フェニル)−6−(メチルチオ)テトラヒドロ−2H−ピラン−3,4,5−トリオールであった。
【0014】
特にダパグリフロジンのような選択的SGLT2阻害剤に関して報告される結果と比較した場合の、臨床研究の知見の驚くべき性質は、SGLT2及びSGLT1の両方を阻害する化合物の能力に起因すると考えられる。SGLT1の阻害は、グルカゴン様ペプチド−1(GLP−1)レベルの増大に関連付けられている。例えば、Moriya, R. , et al., Am J Physiol Endocrinol Metab 297: E1358-E1365(2009)を参照されたい。GLP−1レベルの増大は、糖尿病患者における既知の利益であり、シタグリプチン、ビルダグリプチン及びサクサグリプチンを含む多数の既知の糖尿病薬は、GLP−1分解に関与する酵素(DPP−4)を阻害することによって機能する。
【0015】
5.1. 定義
特に明示のない限り、「アルケニル」という用語は、2〜20(例えば、2〜10又は2〜6)個の炭素原子を有し、少なくとも1つの炭素−炭素二重結合を含む直鎖、分岐鎖及び/又は環式の炭化水素を意味する。代表的なアルケニル部分としては、ビニル、アリル、1−ブテニル、2−ブテニル、イソブチレニル、1−ペンテニル、2−ペンテニル、3−メチル−1−ブテニル、2−メチル−2−ブテニル、2,3−ジメチル−2−ブテニル、1−ヘキセニル、2−ヘキセニル、3−ヘキセニル、1−ヘプテニル、2−ヘプテニル、3−ヘプテニル、1−オクテニル、2−オクテニル、3−オクテニル、1−ノネニル、2−ノネニル、3−ノネニル、1−デセニル、2−デセニル及び3−デセニルが挙げられる。
【0016】
特に明示のない限り、「アルコキシ」という用語は、−O−アルキル基を意味する。アルコキシ基の例としては、−OCH3、−OCH2CH3、−O(CH2)2CH3、−O(CH2)3CH3、−O(CH2)4CH3及び−O(CH2)5CH3が挙げられるが、これらに限定されない。
【0017】
特に明示のない限り、「アルキル」という用語は、1〜20(例えば、1〜10又は1〜4)個の炭素原子を有する直鎖、分岐鎖及び/又は環式(「シクロアルキル」)の炭化水素を意味する。1個〜4個の炭素を有するアルキル部分は「低級アルキル」と称される。アルキル基の例としては、メチル、エチル、プロピル、イソプロピル、n−ブチル、t−ブチル、イソブチル、ペンチル、ヘキシル、イソヘキシル、ヘプチル、4,4−ジメチルペンチル、オクチル(octyl)、2,2,4−トリメチルペンチル、ノニル、デシル、ウンデシル及びドデシルが挙げられるが、これらに限定されない。シクロアルキル部分は単環式又は多環式であってもよく、例としてはシクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル及びアダマンチルが挙げられる。アルキル部分の更なる例は直鎖部分、分岐鎖部分及び/又は環式部分(例えば、1−エチル−4−メチル−シクロヘキシル)を有する。「アルキル」という用語は飽和炭化水素、並びにアルケニル部分及びアルキニル部分を含む。
【0018】
特に明示のない限り、「アルキルアリール」又は「アルキル−アリール」という用語は、アリール部分と結合したアルキル部分を意味する。
【0019】
特に明示のない限り、「アルキルヘテロアリール」又は「アルキル−ヘテロアリール」という用語は、ヘテロアリール部分と結合したアルキル部分を意味する。
【0020】
特に明示のない限り、「アルキル複素環」又は「アルキル−複素環」という用語は、複素環部分と結合したアルキル部分を意味する。
【0021】
特に明示のない限り、「アルキニル」という用語は、2〜20(例えば、2〜20又は2〜6)個の炭素原子を有し、少なくとも1つの炭素−炭素三重結合を含む直鎖、分岐鎖又は環式の炭化水素を意味する。代表的なアルキニル部分としては、アセチレニル、プロピニル、1−ブチニル、2−ブチニル、1−ペンチニル、2−ペンチニル、3−メチル−1−ブチニル、4−ペンチニル、1−ヘキシニル、2−ヘキシニル、5−ヘキシニル、1−ヘプチニル、2−ヘプチニル、6−ヘプチニル、1−オクチニル、2−オクチニル、7−オクチニル、1−ノニニル、2−ノニニル、8−ノニニル、1−デシニル、2−デシニル及び9−デシニルが挙げられる。
【0022】
特に明示のない限り、「アリール」という用語は、炭素原子及び水素原子から構成される芳香環、又は芳香族若しくは部分芳香族の環系を意味する。アリール部分はともに結合又は融合した複数の環を含んでいてもよい。アリール部分の例としては、アントラセニル、アズレニル、ビフェニル、フルオレニル、インダン、インデニル、ナフチル、フェナントレニル、フェニル、1,2,3,4−テトラヒドロ−ナフタレン及びトリルが挙げられるが、これらに限定されない。
【0023】
特に明示のない限り、「アリールアルキル」又は「アリール−アルキル」という用語は、アルキル部分と結合したアリール部分を意味する。
【0024】
特に明示のない限り、「二重SGLT1/2阻害剤」という用語は、約75、50又は25未満のSGLT1 IC50対SGLT2 IC50の比を有する化合物を表す。
【0025】
特に明示のない限り、「ハロゲン」及び「ハロ」という用語は、フッ素、塩素、臭素及びヨウ素を包含する。
【0026】
特に明示のない限り、「ヘテロアルキル」という用語は、炭素原子のうちの少なくとも1つがヘテロ原子(例えば、N、O又はS)で置き換えられたアルキル部分(例えば、直鎖、分岐鎖又は環式)を表す。
【0027】
特に明示のない限り、「ヘテロアリール」という用語は、炭素原子のうちの少なくとも1つがヘテロ原子(例えば、N、O又はS)で置き換えられたアリール部分を意味する。例としては、アクリジニル、ベンゾイミダゾリル、ベンゾフラニル、ベンゾイソチアゾリル、ベンゾイソオキサゾリル、ベンゾキナゾリニル、ベンゾチアゾリル、ベンズオキサゾリル、フリル、イミダゾリル、インドリル、イソチアゾリル、イソオキサゾリル、オキサジアゾリル、オキサゾリル、フタラジニル、ピラジニル、ピラゾリル、ピリダジニル、ピリジル、ピリミジニル、ピリミジル、ピロリル、キナゾリニル、キノリニル、テトラゾリル、チアゾリル及びトリアジニルが挙げられるが、これらに限定されない。
【0028】
特に明示のない限り、「ヘテロアリールアルキル」又は「ヘテロアリール−アルキル」という用語は、アルキル部分と結合したヘテロアリール部分を意味する。
【0029】
特に明示のない限り、「複素環」という用語は、炭素、水素及び少なくとも1つのヘテロ原子(例えば、N、O又はS)から構成される芳香族、部分芳香族、又は非芳香族の単環式又は多環式の環又は環系を表す。複素環は、ともに融合又は結合した複数(すなわち2つ以上)の環を含み得る。複素環はヘテロアリールを含む。例としては、ベンゾ[1,3]ジオキソリル、2,3−ジヒドロ−ベンゾ[1,4]ジオキシニル、シンノリニル、フラニル、ヒダントイニル、モルホリニル、オキセタニル、オキシラニル、ピペラジニル、ピペリジニル、ピロリジノニル、ピロリジニル、テトラヒドロフラニル、テトラヒドロピラニル、テトラヒドロピリジニル、テトラヒドロピリミジニル、テトラヒドロチオフェニル、テトラヒドロチオピラニル及びバレロラクタミルが挙げられるが、これらに限定されない。
【0030】
特に明示のない限り、「複素環アルキル」又は「複素環−アルキル」という用語は、アルキル部分と結合した複素環部分を表す。
【0031】
特に明示のない限り、「ヘテロシクロアルキル」という用語は、非芳香族の複素環を表す。
【0032】
特に明示のない限り、「ヘテロシクロアルキルアルキル」又は「ヘテロシクロアルキル−アルキル」という用語は、アルキル部分と結合したヘテロシクロアルキル部分を表す。
【0033】
特に明示のない限り、「管理する(manage)」、「管理すること(managing)」及び「管理(management)」という用語は、特定の疾患若しくは障害に既に罹患した患者において疾患若しくは障害の再発を予防すること、及び/又は疾患若しくは障害に罹患している患者が寛解期にある時間を延長させることを包含する。この用語は、疾患若しくは障害の閾値、発症及び/若しくは継続期間を調節すること、又は患者の疾患若しくは障害に対する応答の仕方を変えることを包含する。
【0034】
特に明示のない限り、「薬学的に許容される塩」という用語は、薬学的に許容される非毒性の酸又は塩基(無機酸及び無機塩基並びに有機酸及び有機塩基を含む)から調製される塩を表す。好適な薬学的に許容される塩基付加塩としては、アルミニウム、カルシウム、リチウム、マグネシウム、カリウム、ナトリウム及び亜鉛から生成される金属塩、又はリジン、N,N’−ジベンジルエチレンジアミン、クロロプロカイン、コリン、ジエタノールアミン、エチレンジアミン、メグルミン(N−メチルグルカミン)及びプロカインから生成される有機塩が挙げられるが、これらに限定されない。好適な非毒性の酸としては、酢酸、アルギン酸、アントラニル酸、ベンゼンスルホン酸、安息香酸、カンファースルホン酸、クエン酸、エテンスルホン酸、ギ酸、フマル酸、フロ酸、ガラクツロン酸、グルコン酸、グルクロン酸、グルタミン酸、グリコール酸、臭化水素酸、塩酸、イセチオン酸、乳酸、マレイン酸、リンゴ酸、マンデル酸、メタンスルホン酸、ムチン酸、硝酸、パモン酸、パントテン酸、フェニル酢酸、リン酸、プロピオン酸、サリチル酸、ステアリン酸、コハク酸、スルファニル酸、硫酸、酒石酸及びp−トルエンスルホン酸等の無機酸及び有機酸が挙げられるが、これらに限定されない。具体的な非毒性酸としては、塩酸、臭化水素酸、リン酸、硫酸及びメタンスルホン酸が挙げられる。したがって、具体的な塩の例としては、塩酸塩及びメシル酸塩が挙げられる。他のものも当該技術分野において既知である。例えば、Remington's Pharmaceutical Sciences(第18版、Mack Publishing, Easton PA: 1990)、及びRemington: The Science and Practice of Pharmacy(第19版、Mack Publishing, Easton PA: 1995)を参照されたい。
【0035】
特に明示のない限り、「予防する(prevent)」、「予防すること(preventing)」及び「予防(prevention)」という用語は、患者が特定の疾患又は障害に罹患し始める前に行う処置であって、疾患又は障害の重症度を抑制するか又は低減させる、処置を意図する。換言すると、この用語は予防法を包含する。
【0036】
特に明示のない限り、化合物の「予防的に有効な量」は、疾患若しくは病態、若しくは疾患若しくは病態に関連する1つ若しくは複数の症状を予防するのに、又はその再発を予防するのに十分な量である。化合物の「予防的に有効な量」は、単独で又は他の作用剤と組み合わせて、疾患の予防において予防的利点をもたらす治療剤の量を意味する。「予防的に有効な量」という用語は、予防法を全体的に改善するか、又は別の予防剤の予防的な有効性を高める量を包含し得る。
【0037】
特に明示のない限り、「SGLT1 IC50」という用語は、以下の実施例に記載のin vitroでのヒトSGLT1阻害アッセイを使用して決定した化合物のIC50である。
【0038】
特に明示のない限り、「SGLT2 IC50」という用語は、以下の実施例に記載のin vitroでのヒトSGLT2阻害アッセイを使用して決定した化合物のIC50である。
【0039】
特に明示のない限り、「置換される」という用語は、化学的な構造又は部分を説明するために使用する場合、水素原子の1つ又は複数が、アルコール、アルデヒド、アルコキシ、アルカノイルオキシ、アルコキシカルボニル、アルケニル、アルキル(例えば、メチル、エチル、プロピル、t−ブチル)、アルキニル、アルキルカルボニルオキシ(−OC(O)アルキル)、アミド(−C(O)NH−アルキル−又は−アルキルNHC(O)アルキル)、アミジニル(−C(NH)NH−アルキル又は−C(NR)NH2)、アミン(アルキルアミノ、アリールアミノ、アリールアルキルアミノ等の第1級、第2級及び第3級のアミン)、アロイル、アリール、アリールオキシ、アゾ、カルバモイル(−NHC(O)O−アルキル−又は−OC(O)NH−アルキル)、カルバミル(例えば、CONH2並びにCONH−アルキル、CONH−アリール及びCONH−アリールアルキル)、カルボニル、カルボキシル、カルボン酸、カルボン酸無水物、カルボン酸塩化物、シアノ、エステル、エポキシド、エーテル(例えば、メトキシ、エトキシ)、グアニジノ、ハロ、ハロアルキル(例えば、−CCl3、−CF3、−C(CF3)3)、ヘテロアルキル、ヘミアセタール、イミン(第1級及び第2級)、イソシアネート、イソチオシアネート、ケトン、ニトリル、ニトロ、酸素(すなわち、オキソ基をもたらす)、ホスホジエステル、スルフィド、スルホンアミド(例えば、SO2NH2)、スルホン、スルホニル(アルキルスルホニル、アリールスルホニル及びアリールアルキルスルホニルを含む)、スルホキシド、チオール(例えば、スルフヒドリル、チオエーテル)並びに尿素(−NHCONH−アルキル−)等の(しかし、これらに限定されない)原子、化学的部分又は官能基で置換される、その構造又は部分の誘導体を表す。特定の実施形態では、置換されるという用語は、水素原子の1つ又は複数が、アルコール、アルコキシ、アルキル(例えば、メチル、エチル、プロピル、t−ブチル)、アミド(−C(O)NH−アルキル−又は−アルキルNHC(O)アルキル)、アミジニル(−C(NH)NH−アルキル又は−C(NR)NH2)、アミン(アルキルアミノ、アリールアミノ、アリールアルキルアミノ等の第1級、第2級及び第3級のアミン)、アリール、カルバモイル(−NHC(O)O−アルキル−又は−OC(O)NH−アルキル)、カルバミル(例えば、CONH2並びにCONH−アルキル、CONH−アリール及びCONH−アリールアルキル)、ハロ、ハロアルキル(例えば、−CCl3、−CF3、−C(CF3)3)、ヘテロアルキル、イミン(第1級及び第2級)、イソシアネート、イソチオシアネート、チオール(例えば、スルフィドリル、チオエーテル)又は尿素(−NHCONH−アルキル−)で置換される、その構造又は部分の誘導体を表す。
【0040】
特に明示のない限り、化合物の「治療的に有効な量」は、疾患若しくは病態の治療若しくは管理において治療的利点をもたらすのに、又は疾患若しくは病態に関連した1つ若しくは複数の症状を遅延させる若しくは最小限に抑えるのに十分な量である。化合物の「治療的に有効な量」は、疾患又は病態の治療又は管理に治療的利点をもたらす、単独の又は他の療法と組み合わせた治療剤の量を意味する。「治療的に有効な量」という用語は、療法を全体的に改善するか、疾患若しくは病態の症状若しくは原因を低減させる若しくは回避するか、又は別の治療剤の治療的な有効性を高める量を包含し得る。
【0041】
特に明示のない限り、「治療する(treat)」、「治療すること(treating)」及び「治療(treatment)」という用語は、患者が特定の疾患又は障害に罹患している間に行う処置であって、疾患若しくは障害の重症度を低減させるか、又は疾患若しくは障害の進行を遅延若しくは減速させる、処置を意図する。
【0042】
特に明示のない限り、「挙げられる(含む)(include)」という用語は、「挙げられる(含む)が、これらに限定されない」と同じ意味を有し、「挙げられる(含む)(includes)」という用語は、「挙げられる(含む)が、これらに限定されない」と同じ意味を有する。同様に、「等の(such as)」という用語は、「等の(しかし、これらに限定されない)」という用語と同じ意味を有する。
【0043】
特に明示のない限り、一連の名詞の直前にくる1つ又は複数の形容詞は、それぞれの名詞を修飾するものとして解釈される。例えば、「必要に応じて置換されるアルキル、アリール又はヘテロアリール」という語句は、「必要に応じて置換されるアルキル、必要に応じて置換されるアリール、又は必要に応じて置換されるヘテロアリール」と同じ意味を有する。
【0044】
より大きい化合物の一部分を形成する化学的部分は、単一分子として存在する場合に一般的に与えられる名称、又はそのラジカルに一般的に与えられる名称を使用して本明細書に記載されることがあることに留意すべきである。例えば、「ピリジン」及び「ピリジル」という用語には、他の化学的部分と結合した部分を記載するのに使用する場合に、同じ意味が与えられる。したがって、「XOH(式中、Xはピリジルである)」及び「XOH(式中、Xはピリジンである)」という2つの語句には同じ意味が与えられ、化合物ピリジン−2−オール、ピリジン−3−オール及びピリジン−4−オールを包含する。
【0045】
或る構造又は或る構造の一部分の立体化学が例えば太線又は破線で示されない場合、その構造又はその構造の一部分はその全ての立体異性体を包含すると解釈されることにも留意すべきである。さらに、満たされていない原子価を有することが図で示された任意の原子はこの原子価を満たすのに十分な水素原子と結合していると推測される。さらに、一本の破線と平行した一本の実線で示された化学結合は、原子価が許容する場合、単結合及び二重結合の両方(例えば、芳香族結合)を包含する。
【0046】
5.2 化合物
本発明は部分的に、式:
【化4】

(式中、Aは、必要に応じて置換されるアリール、シクロアルキル又は複素環であり、Xは、O、S又はNR3であり、XがOである場合はR1はOR1A、SR1A、SOR1A、SO2R1A又はN(R1A)2であり、XがSである場合はR1は水素、OR1A、SR1A、SOR1A又はSO2R1Aであり、XがNR3である場合はR1はOR1A、SR1A、SOR1A、SO2R1A又はR1Aであり、R1Aはそれぞれ独立して、水素又は必要に応じて置換されるアルキル、アリール若しくは複素環であり、R2は、フルオロ又はOR2Aであり、R2A、R2B及びR2Cはそれぞれ独立して、水素、必要に応じて置換されるアルキル、C(O)アルキル、C(O)アリール又はアリールであり、R3は水素、C(O)R3A、CO2R3A、CON(R3B)2又は必要に応じて置換されるアルキル、アリール若しくは複素環であり、R3Aはそれぞれ独立して、必要に応じて置換されるアルキル又はアリールであり、R3Bはそれぞれ独立して、水素又は必要に応じて置換されるアルキル若しくはアリールである)の化合物及びそれらの薬学的に許容される塩を含む組成物、並びに該化合物及び塩を使用する方法に関する。これらの化合物は、当該技術分野で既知の方法によって調製することができる。例えば、米国特許出願公開第20080113922号及び同第20080221164号を参照されたい。
【0047】
特定の化合物は、式:
【化5】

の化合物である。
【0048】
幾つかの化合物は、式:
【化6】

の化合物である。
【0049】
幾つかの化合物は、式:
【化7】

の化合物である。
【0050】
本発明の一実施形態は、式:
【化8】

(式中、Aは、必要に応じて置換されるアリール、シクロアルキル又は複素環であり、Bは、必要に応じて置換されるアリール、シクロアルキル又は複素環であり、Xは、O、S又はNR3であり、Yは、O、S、SO、SO2、NR4、(C(R5)2)p、(C(R5)2)q−C(O)−(C(R5)2)q、(C(R5)2)q−C(O)O−(C(R5)2)q、(C(R5)2)q−OC(O)−(C(R5)2)q、(C(R5)2)q−C(O)NR4−(C(R5)2)q、(C(R5)2)q−NR4C(O)−(C(R5)2)q、又は(C(R5)2)q−NR4C(O)NR4−(C(R5)2)qであり、XがOである場合はR1はOR1A、SR1A、SOR1A、SO2R1A又はN(R1A)2であり、XがSである場合はR1は水素、OR1A、SR1A、SOR1A又はSO2R1Aであり、XがNR3である場合はR1はOR1A、SR1A、SOR1A、SO2R1A又はR1Aであり、R1Aはそれぞれ独立して、水素又は必要に応じて置換されるアルキル、アリール若しくは複素環であり、R2は、フルオロ又はOR2Aであり、R2A、R2B及びR2Cはそれぞれ独立して、水素、必要に応じて置換されるアルキル、C(O)アルキル、C(O)アリール又はアリールであり、R3は水素、C(O)R3A、CO2R3A、CON(R3B)2又は必要に応じて置換されるアルキル、アリール若しくは複素環であり、R3Aはそれぞれ独立して、必要に応じて置換されるアルキル又はアリールであり、R3Bはそれぞれ独立して、水素又は必要に応じて置換されるアルキル若しくはアリールであり、R4はそれぞれ独立して、水素又は必要に応じて置換されるアルキルであり、R5はそれぞれ独立して、水素、ヒドロキシル、ハロゲン、アミノ、シアノ、OR5A、SR5A又は必要に応じて置換されるアルキルであり、R5Aはそれぞれ独立して、必要に応じて置換されるアルキルであり、pは0〜3であり、qはそれぞれ独立して、0〜2である)
の化合物及びそれらの薬学的に許容される塩を包含する。
【0051】
特定の化合物は、式:
【化9】

の化合物である。
【0052】
幾つかの化合物は、式:
【化10】

の化合物である。
【0053】
幾つかの化合物は、式:
【化11】

の化合物である。
【0054】
幾つかの化合物は、式:
【化12】

(式中、R6はそれぞれ独立して、水素、ヒドロキシル、ハロゲン、アミノ、シアノ、ニトロ、C≡CR6A、OR6A、SR6A、SOR6A、SO2R6A、C(O)R6A、CO2R6A、CO2H、CON(R6A)(R6A)、CONH(R6A)、CONH2、NHC(O)R6A、NHSO2R6A又は必要に応じて置換されるアルキル、アリール若しくは複素環であり、R6Aはそれぞれ独立して、必要に応じて置換されるアルキル、アリール又は複素環であり、R7はそれぞれ独立して、水素、ヒドロキシル、ハロゲン、アミノ、シアノ、ニトロ、C≡CR7A、OR7A、SR7A、SOR7A、SO2R7A、C(O)R7A、CO2R7A、CO2H、CON(R7A)(R7A)、CONH(R7A)、CONH2、NHC(O)R7A、NHSO2R7A又は必要に応じて置換されるアルキル、アリール若しくは複素環であり、R7Aはそれぞれ独立して、必要に応じて置換されるアルキル、アリール又は複素環であり、mは1〜3であり、nは1〜3である)
の化合物である。
【0055】
幾つかの化合物は、式:
【化13】

の化合物である。
【0056】
幾つかの化合物は、式:
【化14】

の化合物である。
【0057】
幾つかの化合物は、式:
【化15】

の化合物である。
【0058】
本発明の一実施形態は、式:
【化16】

(式中、Aは、必要に応じて置換されるアリール、シクロアルキル又は複素環であり、Xは、O又はNR3であり、R2は、フルオロ又はOR2Aであり、R2A、R2B及びR2Cはそれぞれ独立して、水素、必要に応じて置換されるアルキル、C(O)アルキル、C(O)アリール又はアリールであり、R3は、水素又は必要に応じて置換されるアルキル、アリール若しくは複素環であり、R8は、水素又はC(O)R8Aであり、R8Aは、水素又は必要に応じて置換されるアルキル、アルコキシ若しくはアリールであり、R9A及びR9Bはそれぞれ独立して、OR9C若しくはSR9Cであるか、又は一緒にO、S若しくはNR9Cをもたらし、R9Cはそれぞれ独立して、必要に応じて置換されるアルキル、アリール又は複素環である)
の化合物及びそれらの薬学的に許容される塩を包含する。
【0059】
本明細書中に開示される様々な式に関して、適用可能であれば、本発明の特定の化合物は、Aが必要に応じて置換される6員のアリール又は複素環であるようなものである。他の場合では、Aは、必要に応じて置換される5員複素環である。幾つかの場合では、Aは、必要に応じて置換される融合二環式複素環である。
【0060】
幾つかの場合では、Bは、必要に応じて置換される6員のアリール又は複素環である。他の場合では、Bは、必要に応じて置換される5員複素環である。他の場合では、Bは、必要に応じて置換される融合二環式複素環である。
【0061】
幾つかの場合では、XはOである。他の場合では、XはSである。他の場合では、XはNR3である。
【0062】
幾つかの場合では、Yは(C(R4)2)pであり、例えば、pは1である。幾つかの場合では、Yは、(C(R5)2)q−C(O)−(C(R5)2)qであり、例えば、qはそれぞれ独立して、0又は1である。
【0063】
幾つかの場合では、R1はOR1Aである。他の場合では、R1はSR1Aである。他の場合では、R1はSOR1Aである。他の場合では、R1はSO2R1Aである。他の場合では、R1はN(R1A)2である。他の場合では、R1は水素である。他の場合では、R1はR1Aである。
【0064】
幾つかの場合では、R1Aは水素である。他の場合では、R1Aは、必要に応じて置換されるアルキル(例えば、必要に応じて置換される低級アルキル)である。
【0065】
幾つかの場合では、R2はフルオロである。他の場合では、R2はOR2Aである。
【0066】
幾つかの場合では、R2Aは水素である。
【0067】
幾つかの場合では、R2Bは水素である。
【0068】
幾つかの場合では、R2Cは水素である。
【0069】
幾つかの場合では、R3は水素である。他の場合では、R3は必要に応じて置換される低級アルキル(例えば、必要に応じて置換されるメチル)である。
【0070】
幾つかの場合では、R4は、水素又は必要に応じて置換される低級アルキルである。
【0071】
幾つかの場合では、R5はそれぞれ、水素又は必要に応じて置換される低級アルキル(例えば、メチル、エチル、CF3)である。
【0072】
幾つかの場合では、R6は、水素、ヒドロキシル、ハロゲン、OR6A又は必要に応じて置換される低級アルキル(例えば、必要に応じてハロゲン化されるメチル、エチル又はイソプロピル)である。幾つかの場合では、R6は水素である。幾つかの場合では、R6はハロゲン(例えば、クロロ)である。幾つかの場合では、R6はヒドロキシルである。幾つかの場合では、R6はOR6A(例えば、メトキシ、エトキシ)である。幾つかの場合では、R6は必要に応じて置換されるメチル(例えば、CF3)である。
【0073】
幾つかの場合では、R7は、水素、C≡CR7A、OR7A又は必要に応じて置換される低級アルキル(例えば、必要に応じてハロゲン化されるメチル、エチル又はイソプロピル)である。幾つかの場合では、R7は水素である。幾つかの場合では、R7はC≡CR7Aであり、R7Aは例えば、必要に応じて置換される(例えば、低級アルキル又はハロゲンで)単環式アリール又は複素環である。幾つかの場合では、R7は、OR7A(例えば、メトキシ、エトキシ)である。幾つかの場合では、R7はアセチレニル又は必要に応じて置換されるメチル若しくはエチルである。
【0074】
本発明の特定の化合物は、式:
【化17】

の化合物である。
【0075】
他の化合物は、式:
【化18】

の化合物である。
【0076】
他の化合物は、式:
【化19】

の化合物である。
【0077】
他の化合物は、式:
【化20】

の化合物である。
【0078】
他の化合物は、式:
【化21】

の化合物である。
【0079】
他の化合物は、式:
【化22】

の化合物である。
【0080】
式I(a)〜式I(d)の特定の化合物では、XはOである。他の場合では、XはSである。他の場合では、XはNR3であり、R3は例えば、水素である。式I(a)〜式I(f)の特定の化合物では、R1Aは水素である。他の場合では、R1Aは、必要に応じて置換されるメチル又はエチルである。
【0081】
本発明の特定の化合物としては、以下のものが挙げられる:
(2S,3R,4R,5S,6R)−2−(4−クロロ−3−(4−エトキシベンジル)フェニル)−6−(メチルチオ)テトラヒドロ−2H−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−(4−クロロ−3−(4−エトキシベンジル)フェニル)−6−(メチルスルホニル)−テトラヒドロ−2H−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(3S,4R,5R,6S)−6−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−テトラヒドロ−ピラン−2,3,4,5−テトラオール;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−エトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−イソプロポキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−イソプロポキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
N−{(2S,3S,4R,5R,6S)−6−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−テトラヒドロ−ピラン−2−イル}−N−プロピル−アセトアミド;
(2R,3S,4S,5S)−5−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−2,3,4,5−テトラヒドロキシ−ペンタナールオキシム;
(3S,4R,5R,6S)−6−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−テトラヒドロ−ピラン−2−オンオキシム;
(2S,3R,4R,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−5−フルオロ−6−メトキシ−テトラヒドロ−ピラン−3,4−ジオール;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−ヒドロキシ−ベンジル)−フェニル]−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4S,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3S,4S,5R)−2−[4−クロロ−3−(4−ヒドロキシ−ベンジル)−フェニル]−ピペリジン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−エタンスルフィニル−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−エタンスルホニル−テトラヒドロ−ピラン−3,4,5−トリオール;
酢酸(2R,3S,4R,5S,6S)−4,5−ジアセトキシ−6−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−2−メチルスルファニル−テトラヒドロ−ピラン−3−イルエステル;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−メタンスルホニル−テトラヒドロ−ピラン−3,4,5−トリオール;
1−{(2S,3S,4S,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−ピペリジン−1−イル}−エタノン;
(2S,3S,4S,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−ピペリジン−1−カルボン酸メチルエステル;
(2S,3S,4S,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−ピペリジン−1−カルボン酸アリルアミド;
(2S,3S,4S,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−1−メチル−ピペリジン−3,4,5−トリオール;
(2S,3S,4R,5R,6R)−2−[3−(4−エトキシ−ベンジル)−フェニル]−6−ヒドロキシメチル−1−メチル−ピペリジン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−(4−クロロ−3−(4−エトキシベンジル)フェニル)−6−メトキシテトラヒドロ−2H−チオピラン−3,4,5−トリオール;
(2S,3S,4R,5R,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−ヒドロキシメチル−ピペリジン−3,4,5−トリオール;
(2S,3S,4R,5R,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−ヒドロキシメチル−1−メチル−ピペリジン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[3−(4−エトキシ−ベンジル)−フェニル]−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(2−ヒドロキシ−エトキシ)−テトラヒドロ−ピラン−3,4,5−トリオール;
(3S,4R,5R,6S)−2−ベンジルオキシ−6−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−(4’−エトキシ−ビフェニル−3−イル)−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(2,2,2−トリフルオロ−エトキシ)−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(2−メトキシ−エトキシ)−テトラヒドロ−ピラン−3,4,5−トリオール
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(2−ジメチルアミノ−エトキシ)−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−プロピルスルファニル−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−イミダゾール−1−イル−テトラヒドロ−ピラン−3,4,5−トリオール;
{(3S,4R,5R,6S)−6−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−テトラヒドロ−ピラン−2−イルオキシ}−酢酸メチルエステル;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(4−メチル−ピペリジン−1−イル)−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(5−メチル−チアゾール−2−イルアミノ)−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−フェノキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
N−{(2S,3S,4R,5R,6S)−6−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−テトラヒドロ−ピラン−2−イル}−N−メチル−アセトアミド;
酢酸(2S,3S,4R,5S,6S)−4,5−ジアセトキシ−6−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−2−メトキシ−テトラヒドロ−ピラン−3−イルエステル;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−エトキシ−フェノキシ)−フェニル]−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−メトキシ−フェニルスルファニル)−フェニル]−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−メトキシ−ベンゼンスルフィニル)−フェニル]−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(3−ヒドロキシ−プロポキシ)−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(2−ヒドロキシ−エチルスルファニル)−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(2−メルカプト−エトキシ)−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(2,3−ジヒドロキシ−プロポキシ)−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−{4−クロロ−3−[4−(2−メトキシ−エトキシ)−ベンジル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−エチルスルファニル−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−メチルスルファニル−テトラヒドロ−ピラン−3,4,5−トリオール;
[2−クロロ−5−((2S,3R,4R,5S,6S)−3,4,5−トリヒドロキシ−6−メトキシ−テトラヒドロ−ピラン−2−イル)−フェニル]−(4−エトキシ−フェニル)−メタノン;
(2S,3R,4R,5S,6S)−2−{4−クロロ−3−[(4−エトキシ−フェニル)−ヒドロキシ−メチル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[3−(4−エトキシ−ベンジル)−4−メチル−フェニル]−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−{4−クロロ−3−[4−(2−メチルスルファニル−エトキシ)−ベンジル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−{4−クロロ−3−[4−(ピリジン−4−イルオキシ)−ベンジル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6S)−2−(4−クロロ−3−{(4−エトキシ−フェニル)−[(Z)−プロピルイミノ]−メチル}−フェニル)−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−{4−クロロ−3−[4−(チアゾール−2−イルオキシ)−ベンジル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−{4−クロロ−3−[4−(ピリミジン−5−イルオキシ)−ベンジル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−{4−クロロ−3−[4−(2,6−ジメトキシ−ピリミジン−4−イルオキシ)−ベンジル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
2−{(2R,3S,4R,5R,6S)−6−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−テトラヒドロ−ピラン−2−イルスルファニル}−アセトアミド;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(フラン−2−イルメチルスルファニル)−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6S)−2−{4−クロロ−3−[(4−エトキシ−フェニル)−イミノ−メチル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6S)−2−{3−[(4−エトキシ−フェニル)−ヒドロキシ−メチル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3S,4S,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−ピペリジン−1−カルボン酸ベンジルエステル;
(2S,3S,4S,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−ピペリジン−1−カルボン酸アリルアミド;
N−(2−{(2R,3S,4R,5R,6S)−6−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−テトラヒドロ−ピラン−2−イルスルファニル}−エチル)−アセトアミド;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(2,2,2−トリフルオロ−エチルスルファニル)−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6S)−2−{4−クロロ−3−[1−(4−エトキシ−フェニル)−1−ヒドロキシ−エチル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
ジメチル−チオカルバミン酸O−{4−[2−クロロ−5−((2S,3R,4R,5S)−3,4,5−トリヒドロキシ−6−メトキシ−テトラヒドロ−ピラン−2−イル)−ベンジル]−フェニル}エステル;
(2S,3R,4R,5S,6S)−2−{3−[1−(4−エトキシ−フェニル)−エチル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
ジエチル−ジチオカルバミン酸(2R,3S,4R,5R,6S)−6−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−テトラヒドロ−ピラン−2−イルエステル;
(2S,3R,4R,5S,6S)−2−(4−クロロ−3−{4−[(R)−(テトラヒドロ−フラン−3−イル)オキシ]−ベンジル}−フェニル)−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−エタンスルフィニル−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−{4−クロロ−3−[4−((S)−1−メチル−ピロリジン−3−イルオキシ)−ベンジル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−{4−クロロ−3−[4−(テトラヒドロ−ピラン−4−イルオキシ)−ベンジル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−(4−クロロ−3−{4−ヒドロキシ−3−[1−(2−メチルアミノ−エチル)−アリル]−ベンジル}−フェニル)−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−{4−クロロ−3−[4−(1−メチル−ピペリジン−4−イルオキシ)−ベンジル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−メタンスルフィニル−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3S,4S,5R)−1−ベンジル−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−ピペリジン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−{3−[4−(2−ベンジルオキシ−エトキシ)−ベンジル]−4−クロロ−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−{3−[4−(2−ヒドロキシ−エトキシ)−ベンジル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−{4−クロロ−3−[4−(2−ヒドロキシ−エトキシ)−ベンジル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
2−{(2S,3S,4S,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−ピペリジン−1−イル}−アセトアミド;
(2S,3S,4S,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−1−イソブチル−ピペリジン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(2−メチル−テトラヒドロ−フラン−3−イルスルファニル)−テトラヒドロ−ピラン−3,4,5−トリオール;
(R)−2−アミノ−3−{(2R,3S,4R,5R,6S)−6−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−テトラヒドロ−ピラン−2−イルスルファニル}−プロピオン酸;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−シクロペンチルスルファニル−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−シクロヘキシルスルファニル−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(3−メチル−ブチルスルファニル)−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[3−(4−エトキシ−ベンジル)−フェニル]−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
1−{(2S,3S,4S,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−ピペリジン−1−イル}−エタノン;
(2S,3S,4S,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−ピペリジン−1−カルボン酸ベンジルエステル;
(2S,3S,4S,5R)−1−ベンジル−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−ピペリジン−3,4,5−トリオール;
2−{(2S,3S,4S,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−ピペリジン−1−イル}−アセトアミド;
(2S,3S,4S,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−1−イソブチル−ピペリジン−3,4,5−トリオール;
(3S,4R,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−ヒドロキシメチル−ピペリジン−3,4,5−トリオール;
及びそれらの薬学的に許容される塩。
【0082】
5.3. 使用方法
本発明は、患者の心血管及び/又は代謝の健康を改善する方法であって、安全かつ有効な量の本発明の二重SGLT1/2阻害剤(すなわち、二重SGLT1/2阻害剤でもある上記5.2節において開示される化合物)を、それを必要とする患者へ投与することを含む、患者の心血管及び/又は代謝の健康を改善する方法を包含する。
【0083】
かかる改善を必要とする患者としては、アテローム動脈硬化症、心血管疾患、糖尿病(1型及び2型)、血液濃縮に関連した障害(例えば、血色素症、真性赤血球増加症)、高血糖症、高血圧、低マグネシウム血症、低ナトリウム血症、脂質障害、肥満症、腎不全(例えば、ステージ1、ステージ2又はステージ3の腎不全)及びX症候群のような疾患又は障害を患う者が挙げられる。特定の患者は、2型真性糖尿病を患っているか、又は2型真性糖尿病を患うリスクがある。
【0084】
本発明の一実施形態では、投与は、患者の空腹時血漿グルコースレベルの(例えば、約50mg/dl、55mg/gl又は60mg/dlを超える)減少をもたらす。一実施形態では、投与は、患者における経口耐糖能の改善をもたらす。一実施形態では、投与は、患者の食後血漿グルコースレベルを低下させる。一実施形態では、投与は、患者の血漿フルクトサミンレベルを(例えば、約30μmol/l、40μmol/l又は50μmol/lよりも多く)低下させる。一実施形態では、投与は、4週間の治療の後に患者のHbA1cレベルを(例えば、約1.0パーセント、1.1パーセント又は1.2パーセントよりも多く)低下させる。一実施形態では、投与は、患者の血圧(例えば、収縮期血圧及び拡張期血圧)を低減させる。一実施形態では、投与は、患者のトリグリセリドレベルを低減させる。
【0085】
特定の実施形態では、患者は、別の治療剤を同時に服用している。他の治療剤としては、抗糖尿病剤、抗高血糖症剤、抗高脂血症剤/脂質低下剤、抗肥満症剤、抗高血圧剤及び食欲抑制薬を含む上述の障害の治療に有用な既知の治療剤が挙げられる。
【0086】
適切な抗糖尿病剤の例としては、ビグアニド(例えば、メトホルミン、フェンホルミン)、グルコシダーゼ阻害剤(例えば、アカルボース、ミグリトール)、インスリン(インスリン分泌促進物質及びインスリン感作物質を含む)、メグリチニド(例えば、レパグリニド)、スルホニル尿素(例えば、グリメピリド、グリブリド、グリクラジド、クロルプロパミド及びグリピジド)、ビグアニド/グリブリドの組合せ(例えば、グルコバンス)、チアゾリジンジオン(例えば、トログリタゾン、ロシグリタゾン及びピオグリタゾン)、PPAR−αアゴニスト、PPAR−γアゴニスト、PPARα/γ二重アゴニスト、グリコーゲンホスホリラーゼ阻害剤、脂肪酸結合タンパク質(aP2)の阻害剤、グルカゴン様ペプチド−1(GLP−1)又はGLP−1受容体の他のアゴニスト、及びジペプチジルペプチダーゼIV(DPP4)阻害剤が挙げられる。
【0087】
メグリチニドの例としては、ナテグリニド(Novartis)及びKAD1229(PF/Kissei)が挙げられる。
【0088】
チアゾリジンジオンの例としては、MitsubishiのMCC−555(米国特許第5,594,016号に開示)、Glaxo-WelcomeのGL−262570、エングリタゾン(CP−68722、Pfizer)、ダルグリタゾン(CP−86325、Pfizer)、イサグリタゾン(MIT/J&J)、JTT−501(JPNT/P&U)、L−895645(Merck)、R−119702(Sankyo/WL)、NN−2344(Dr.Reddy/NN)又はYM−440(Yamanouchi)が挙げられる。
【0089】
PPAR−αアゴニスト、PPAR−γアゴニスト及びPPARα/γ二重アゴニストの例としては、ムラグリチザル(muraglitizar)、ペリグリタザル(peliglitazar)、AR−H039242(Astra/Zeneca)、GW−409544(Glaxo-Wellcome)、GW−501516(Glaxo-Wellcome)、KRP297(Kyorin Merck)、並びにMurakami et al, 、Diabetes 47, 1841-1847(1998)、国際公開第01/21602号及び米国特許第6,653,314号に開示されるものが挙げられる。
【0090】
aP2阻害剤の例としては、米国特許出願第09/391,053号(1999年9月7日に出願された)及び米国特許出願第09/519,079号(2000年5月6日に出願された)に開示されるもの(本明細書中で記述されるような投与量を用いる)が挙げられる。
【0091】
DPP4阻害剤の例としては、シタグリプチン(Janiuvia(商標)、Merck)、ビルダグリプチン(Galvus(商標)、Novartis)、サクサグリプチン(Onglyza(商標)、BMS−477118)、リナグリプチン(BI−1356)、デュトグリプチン(dutogliptin)(PHX1149T)、ゲミグリプチン(LG Life Sciences)、アログリプチン(SYR−322、武田)、国際公開第99/38501号、国際公開第99/46272号、国際公開第99/67279号(PROBIODRUG)、国際公開第99/67278号(PROBIODRUG)及び国際公開第99/61431号(PROBIODRUG)に開示されるもの、Hughes et al, Biochemistry, 38(36), 11597-11603, 1999により開示されるようなNVP−DPP728A(1−[[[2−[(5−シアノピリジン−2−イル)アミノ]エチル]アミノ]アセチル]−2−シアノ−(S)−ピロリジン(Novartis)、TSL−225(トリプトフィル−1,2,3,4−テトラヒドロイソキノリン−3−カルボン酸(Yamada et al, Bioorg. & Med. Chem. Lett. 8 (1998) 1537-1540によって開示)、Ashworth et al, Bioorg. & Med. Chem. Lett., Vol.6, No.22, pp 1163-1166及び2745-2748 (1996)により開示されるような2−シアノピロリジド及び4−シアノピロリジド、米国特許出願第10/899,641号、国際公開第01/868603号及び米国特許第6,395,767号に開示される化合物(上述の参照文献で記述されるような投与量を用いる)が挙げられる。
【0092】
抗高血糖症剤の例としては、グルカゴン様ペプチド−1(GLP−1)、GLP−1(1〜36)アミド、GLP−1(7〜36)アミド、GLP−1(7〜37)(米国特許第5,614,492号に開示されるような)、エクセナチド(Amylin/Lilly)、LY−315902(Lilly)、リラグルチド(NovoNordisk)、ZP−10(Zealand Pharmaceuticals A/S)、CJC−1131(Conjuchem Inc)、及び国際公開第03/033671号に開示される化合物が挙げられる。
【0093】
抗高脂血症剤/脂質低下剤の例としては、MTP阻害剤、HMG CoAレダクターゼ阻害剤、スクアレンシンテターゼ阻害剤、フィブリン酸誘導体、ACAT阻害剤、リポキシゲナーゼ阻害剤、コレステロール吸収阻害剤、Na+/胆汁酸共輸送体阻害剤、LDL受容体活性の上方調節因子、胆汁酸捕捉剤、コレステロールエステル転送タンパク質(例えば、CP−529414(Pfizer)及びJTT−705(Akros Pharma)のようなCETP阻害剤)並びにニコチン酸及びその誘導体が挙げられる。
【0094】
MTP阻害剤の例としては、米国特許第5,595,872号、米国特許第5,739,135号、米国特許第5,712,279号、米国特許第5,760,246号、米国特許第5,827,875号、米国特許第5,885,983号及び米国特許第5,962,440号に開示されるものが挙げられる。
【0095】
HMG CoAレダクターゼ阻害剤の例としては、米国特許第3,983,140号に開示されるようなメバスタチン及び関連化合物、米国特許第4,231,938号に開示されるようなロバスタチン(メビノリン)及び関連化合物、米国特許第4,346,227号に開示されるようなプラバスタチン及び関連化合物、米国特許第4,448,784号及び同第4,450,171号に開示されるようなシムバスタチン及び関連化合物が挙げられる。本明細書中で用いられ得る他のHMG CoAレダクターゼ阻害剤としては、米国特許第5,354,772号に開示されるフルバスタチン、米国特許第5,006,530号及び同第5,177,080号に開示されるようなセリバスタチン、米国特許第4,681,893号、同第5,273,995号、同第5,385,929号及び同第5,686,104号に開示されるようなアトルバスタチン、米国特許第5,011,930号に開示されるようなアタバスタチン(Nissan/Sankyoのニスバスタチン(NK−104))、米国特許第5,260,440号に開示されるようなビサスタチン(Shionogi-Astra/Zeneca(ZD−4522))、及び米国特許第5,753,675号に開示される関連スタチン化合物、米国特許第4,613,610号に開示されるようなメバロノラクトン誘導体のピラゾール類縁体、PCT出願(国際公開第86/03488号)に開示されるようなメバロノラクトン誘導体のインデン類縁体、米国特許第4,647,576号に開示されるような6−[2−(置換−ピロール−1−イル)−アルキル)ピラン−2−オン及びその誘導体、SearleのSC−45355(3−置換ペンタン二酸誘導体)ジクロロアセテート、PCT出願(国際公開第86/07054号)に開示されるようなメバロノラクトンのイミダゾール類縁体、仏国特許第2,596,393号に開示されるような3−カルボキシ−2−ヒドロキシ−プロパン−リン酸誘導体、欧州特許出願第0221025号に開示されるような2,3−二置換ピロール、フラン及びチオフェン誘導体、米国特許第4,686,237号に開示されるようなメバロノラクトンのナフチル類縁体、米国特許第4,499,289号に開示されるようなオクタヒドロナフタレン、欧州特許出願公開第0142146号に開示されるようなメビノリン(ロバスタチン)のケト類縁体、並びに米国特許第5,506,219号及び同第5,691,322号に開示されるようなキノリン及びピリジン誘導体が挙げられるが、これらに限定されない。
【0096】
抗高脂血症剤の例としては、プラバスタチン、ロバスタチン、シムバスタチン、アトルバスタチン、フルバスタチン、セリバスタチン、アタバスタチン及びZD−4522が挙げられる。
【0097】
HMG CoAレダクターゼを阻害するのに有用なホスフィン酸化合物の例としては、英国特許第2205837号に開示されるものが挙げられる。
【0098】
スクアレンシンテターゼ阻害剤の例としては、米国特許第5,712,396号に開示されるα−ホスホノ−スルホネート、Biller et al., J. Med. Chem. 1988, Vol.31, No.10, pp 1869-1871により開示されるもの(イソプレノイド(ホスフィニル−メチル)ホスホネートを含む)、並びに例えば米国特許第4,871,721号及び同第4,924,024号並びにBiller, S.A., et al., Current Pharmaceutical Design, 2, 1-40 (1996)に開示されるような他の既知のスクアレンシンテターゼ阻害剤が挙げられる。
【0099】
本明細書における使用に適した更なるスクアレンシンテターゼ阻害剤の例としては、P. Ortiz de Montellano et al., J. Med. Chem., 1977, 20, 243-249により開示されるテルペノイドピロホスフェート、Corey and Volante, J. Am. Chem. Soc. 1976, 98, 1291-1293により開示されるようなファルネシルジホスフェート類縁体A及びプレスクアレンピロホスフェート(PSQ−PP)類縁体、McClard, R.W. et al., J.A.C.S., 1987, 109, 5544により報告されるホスフィニルホスホネート、並びにCapson, T.L., PhD dissertation, June, 1987, Dept. Med. Chem. U of Utah, Abstract, Table of Contents, pp 16, 17, 40-43, 48-51, Summaryにより報告されるシクロプロパンが挙げられる。
【0100】
本発明の化合物と組み合わせて用いられ得るフィブリン酸誘導体の例としては、フェノフィブレート、ゲムフィブロジル、クロフィブレート、ベザフィブレート、シプロフィブレート、クリノフィブレート等、プロブコール及び関連化合物(米国特許第3,674,836号に開示されるような)(プロブコール及びゲムフィブロジルが好ましい)、コレスチラミン、コレスチポール及びDEAE−セファデックス(セコレックス、ポリセキシド)のような胆汁酸捕捉剤、並びにリポスタビル(Rhone-Poulenc)、Eisai E−5050(N置換エタノールアミン誘導体)、イマニキシル(HOE−402)、テトラヒドロリプスタチン(THL)、イスチグマスタニルホスホリルコリン(SPC、Roche)、アミノシクロデキストリン(田辺製薬)、味の素のAJ−814(アズレン誘導体)、メリナミド(住友)、Sandozの58−035、American CyanamidのCL−277,082及びCL−283,546(二置換尿素誘導体)、ニコチン酸、アシピモックス、アシフラン、ネオマイシン、p−アミノサリチル酸、アスピリン、ポリ(ジアリルメチルアミン)誘導体(米国特許第4,759,923号に開示されるような)、第4級アミンポリ(ジアリルジメチルアンモニウムクロリド)及びイオネン(米国特許第4,027,009号に開示されるような)並びに他の既知の血清コレステロール低下剤が挙げられる。
【0101】
本発明の化合物と組み合わせて用いられ得るACAT阻害剤の例としては、Drug of the Future 24, 9-15 (1999)(アバシミブ);Nicolosi et al., Atherosclerosis(Shannon, Irel). (1998), 137(1), 77-85;Ghiselli, Giancarlo, Cardiovasc. Drug Rev. (1998), 16(1), 16-30;Smith, C., et al., Bioorg. Med. Chem. Lett. (1996), 6(1), 47-50;Krause et al., Editor(s): Ruffolo, Robert R., Jr.;Hollinger, Mannfred A., Inflammation: Mediators Pathways (1995), 173-98, Publisher: CRC, Boca Raton, Fla;Sliskovic et al., Curr. Med. Chem. (1994), 1(3), 204-25;Stout et al., Chemtracts: Org. Chem. (1995), 8(6), 359-62に開示されるもの、又はTS−962(大正製薬株式会社)が挙げられる。
【0102】
抗高脂血症剤の例としては、MD−700(大正製薬株式会社)及びLY295427(Eli Lilly)のようなLD2受容体活性の上方調節因子が挙げられる。
【0103】
コレステロール吸収阻害剤の例としては、SCH48461(Schering-Plough)並びにAtherosclerosis 115, 45-63 (1995)及びJ. Med. Chem. 41, 973 (1998)に開示されるものが挙げられる。
【0104】
回腸Na+/胆汁酸共輸送体阻害剤の例としては、Drugs of the Future, 24, 425-430 (1999)に開示されるような化合物が挙げられる。
【0105】
リポキシゲナーゼ阻害剤の例としては、15−リポキシゲナーゼ(15−LO)阻害剤、例えば国際公開第97/12615号に開示されるようなベンゾイミダゾール誘導体、国際公開第97/12613号に開示されるような15−LO阻害剤、国際公開第96/38144号に開示されるようなイソチアゾロン、並びにSendobry et al., Brit. J. Pharmacology (1997) 120, 1199-1206及びCornicelli et al., Current Pharmaceutical Design, 1999, 5, 11-20に開示されるような15−LO阻害剤が挙げられる。
【0106】
本発明の化合物と組み合わせて使用するのに適した抗高血圧剤の例としては、βアドレナリン遮断薬、カルシウムチャネル遮断薬(L型及びT型、例えば、ジルチアゼム、ベラパミル、ニフェジピン、アムロジピン及びミベフラジル)、利尿薬(例えば、クロロチアジド、ヒドロクロロチアジド、フルメチアジド、ヒドロフルメチアジド、ベンドロフルメチアジド、メチルクロロチアジド、トリクロロメチアジド、ポリチアジド、ベンズチアジド、エタクリン酸トリクリナフェン、クロルタリドン、フロセミド、ムソリミン、ブメタミド、トリアムテン(triamterene)、アミロリド、スピロノラクトン)、レニン阻害剤、ACE阻害剤(例えば、カプトプリル、ゾフェノプリル、フォシノプリル、エナラプリル、セラノプリル、シラゾプリル、デラプリル、ペントプリル、キナプリル、ラミプリル、リシノプリル)、AT−1受容体アンタゴニスト(例えば、ロサルタン、イルベサルタン、バルサルタン)、ET受容体アンタゴニスト(例えば、シタクスセンタン、アトルセンタン並びに米国特許第5,612,359号及び同第6,043,265号に開示される化合物)、二重ET/AIIアンタゴニスト(例えば、国際公開第00/01389号に開示される化合物)、中性エンドペプチダーゼ(NEP)阻害剤、バソペプチダーゼ(vasopeptidase)阻害剤(二重NEP−ACE阻害剤)(例えば、オマパトリラト及びゲモパトリラト)及びニトレートが挙げられる。
【0107】
抗肥満症剤の例としては、β3アドレナリンアゴニスト、リパーゼ阻害剤、セロトニン(及びドーパミン)再取込み阻害剤、甲状腺受容体β薬、5HT2Cアゴニスト(例えば、Arena APD−356);MCHR1アンタゴニスト(例えば、SynapticのSNAP−7941及びTakedaのT−226926)、メラノコルチン受容体(MC4R)アゴニスト、メラニン凝集ホルモン受容体(MCHR)アンタゴニスト(例えば、SynapticのSNAP−7941及びTakedaのT−226926)、ゲラニン受容体モジュレータ、オレキシンアンタゴニスト、CCKアゴニスト、NPY1又はNPY5アンタゴニスト、NPY2及びNPY4モジュレータ、コルチコトロピン放出因子アゴニスト、ヒスタミン受容体−3(H3)モジュレータ、11−β−HSD−1阻害剤、アジノペクチン受容体モジュレータ、モノアミン再取込み阻害剤又は放出剤、毛様体神経栄養因子(CNTF、例えばRegeneronによるAXOKINE)、BDNF(脳由来神経栄養因子)、レプチン及びレプチン受容体モジュレータ、カンナビノイド−1受容体アンタゴニスト(例えば、SR−141716(Sanofi)又はSLV−319(Solvay))及び/又は食欲低下(anorectic)剤が挙げられる。
【0108】
β3アドレナリンアゴニストの例としては、AJ9677(Takeda/Dainippon)、L750355(Merck)若しくはCP331648(Pfizer)又は米国特許第5,541,204号、同第5,770,615号、同第5,491,134号、同第5,776,983号及び同第5,488,064号に開示されるような他の既知のβ3アゴニストが挙げられる。
【0109】
リパーゼ阻害剤の例としては、オルリスタット及びATL−962(Alizyme)が挙げられる。
【0110】
セロトニン(及びドーパミン)再取込み阻害剤(又はセロトニン受容体アゴニスト)の例としては、BVT−933(Biovitrum)、シブトラミン、トピラメート(Johnson & Johnson)及びアキソキン(Regeneron)が挙げられる。
【0111】
甲状腺受容体β化合物の例としては、国際公開第97/21993号(U. Cal SF)、国際公開第99/00353号(KaroBio)及び英国特許第98/284425号(KaroBio)に開示されるもののような甲状腺受容体リガンドが挙げられる。
【0112】
モノアミン再取込み阻害剤の例としては、フェンフルラミン、デクスフェンフルラミン、フルボキサミン、フルオキセチン、パロキセチン、セルトラリン、クロルフェンテルミン、クロフォレックス、クロルテルミン、ピシロレックス、シブトラミン、デキサムフェタミン、フェンテルミン、フェニルプロパノールアミン及びマジンドールが挙げられる。
【0113】
食欲低下剤の例としては、デキサムフェタミン、フェンテルミン、フェニルプロパノールアミン及びマジンドールが挙げられる。
【0114】
5.4. 医薬配合物
本発明は、5.3節で上述したもののような1つ又は複数の第2の活性成分と任意に組み合わせて、1つ又は複数の本発明の二重SGLT1/2阻害剤を含む医薬組成物を包含する。
【0115】
或る特定の医薬組成物は、患者への経口投与に適した単回単位剤形である。経口投与に好適な別々の剤形は、錠剤(例えば、チュアブル錠)、カプレット、カプセル及び液体(例えば、香味付与したシロップ)を含む。このような剤形は所定量の活性成分を含有し、当業者に既知の製薬法によって調製することができる。例えば、Remington's Pharmaceutical Sciences、第18版、(Mack Publishing, Easton PA: 1990)を参照されたい。
【0116】
典型的な経口剤形は、従来の薬学的配合技法に従い、密接な混和物中で活性成分(複数の場合もあり)を少なくとも1つの賦形剤と組み合わせることによって調製する。その投与のしやすさのため、錠剤及びカプセルが最も有益な経口単位剤形である。所望に応じて、錠剤は、標準的な水性又は非水性の技法によってコーティングすることができる。このような剤形は、従来の製薬法により調製することができる。一般に、医薬組成物及び剤形は、活性成分を液体担体、微粉固体担体、又はその両方と均一かつ密接に混和し、次に生成物を必要に応じて所望の形状に成形することによって調製する。崩壊剤は、固体剤形に組み込み、迅速な溶解を容易にすることができる。また、滑沢剤を組み込んで、剤形(例えば、錠剤)の製造を容易にすることができる。
【実施例】
【0117】
6.実施例
6.1 in vitroでのヒトSGLT2阻害アッセイ
ヒトナトリウム/グルコース共輸送体2型(SGLT2:アクセッション番号P31639、GI:400337)を、哺乳動物発現用のpIRESpuro2ベクターへクローニングした(構築物:HA−SGLT2−pIRESpuro2)。
【0118】
HEK293細胞を、ヒトHA−SGLT2−pIRESpuro2ベクターでトランスフェクトして、バルクの安定な細胞株を、0.5μg/mlのピューロマイシンの存在下で選択した。ヒトHA−SGLT2細胞は、10%FBS、1%GPS及び0.5μg/mlのピューロマイシンを含有するDMEM培地中で維持した。
【0119】
ヒトHA−SGLT2を発現するHEK293細胞を、10%FBS、1%GPS及び0.5μg/mlのピューロマイシンを含有するDMEM培地中で384ウェルプレートに播種して(30000個の細胞/ウェル)、続いて37℃、5%CO2で一晩インキュベートした。次に、細胞を取込み緩衝液(140mMのNaCl、2mMのKCl、1mMのCaCl2、1mMのMgCl2、10mMのHEPES、5mMのTris、1mg/mlのウシ血清アルブミン(BSA)、pH7.3)で洗浄した。試験化合物を含む又は含まない取込み緩衝液20マイクロリットルを細胞へ添加した。続いて、14C−AMGを含有する取込み緩衝液(100nCi)20マイクロリットルを細胞へ添加した。細胞プレートを37℃、5%CO2で1時間〜2時間インキュベートした。細胞を取込み緩衝液で洗浄した後、シンチレーション液を添加して(40マイクロリットル/ウェル)、14C−AMG取込みを、シンチレーションコールター(TopCoulter NXT;Packard Instruments)を使用して放射能を計数することにより測定した。
【0120】
6.2 in vitroでのヒトSGLT1阻害アッセイ
ヒトナトリウム/グルコース共輸送体1型(SGLT1:アクセッション番号NP_000334、GI:4507031)を、哺乳動物発現用のpIRESpuro2ベクターへクローニングした(構築物:HA−SGLT1−pIRESpuro2)。
【0121】
HEK293細胞を、ヒトHA−SGLT1−pIRESpuro2ベクターでトランスフェクトして、バルクの安定な細胞株を、0.5μg/mlのピューロマイシンの存在下で選択した。ヒトHA−SGLT1細胞は、10%FBS、1%GPS及び0.5μg/mlのピューロマイシンを含有するDMEM培地中で維持した。
【0122】
ヒトHA−SGLT1を発現するHEK293細胞を、10%FBS、1%GPS及び0.5μg/mlのピューロマイシンを含有するDMEM培地中で384ウェルプレートに播種して(30000個の細胞/ウェル)、続いて37℃、5%CO2で一晩インキュベートした。次に、細胞を取込み緩衝液(140mMのNaCl、2mMのKCl、1mMのCaCl2、1mMのMgCl2、10mMのHEPES、5mMのTris、1mg/mlのウシ血清アルブミン(BSA)、pH7.3)で洗浄した。試験化合物を含む又は含まない取込み緩衝液20マイクロリットルを細胞へ添加した。続いて、14C−AMGを含有する取込み緩衝液(100nCi)20マイクロリットルを細胞へ添加した。細胞プレートを37℃、5%CO2で1時間〜2時間インキュベートした。細胞を取込み緩衝液で洗浄した後、シンチレーション液を添加して(40マイクロリットル/ウェル)、14C−AMG取込みを、シンチレーションコールター(TopCoulter NXT;Packard Instruments)を使用して放射能を計数することにより測定した。
【0123】
6.3 (2S,3R,4R,5S,6R)−2−(4−クロロ−3−(4−エトキシベンジル)フェニル)−6−(メチルチオ)テトラヒドロ−2H−ピラン−3,4,5−トリオールの薬理
2型真性糖尿病を患う患者(n=36)に、1日1回、150mg若しくは300mgとして与えられる(2S,3R,4R,5S,6R)−2−(4−クロロ−3−(4−エトキシベンジル)フェニル)−6−(メチルチオ)テトラヒドロ−2H−ピラン−3,4,5−トリオールの2つの経口用量のうちの1つ、又は適合するプラセボを28日間与えた。予備データにより、プラセボと比較した場合に両方の用量レベルに関して、28日間の投薬期間にわたって重大かつ持続的な糖尿が示された。有害事象は概して穏やかであり、全ての用量群(プラセボを含む)にわたって均一に分布しており、用量制限毒性の証拠は観察されなかった。
【0124】
この研究では、メトホルミンを服用中の患者は、0日目の16日前にその薬物を取りやめて、最初の投薬日を開始した。図1に示されるように、プラセボ群並びに150mg/日及び300mg/日の治療群における患者の空腹時血漿グルコースレベルは、その期間中、増大した。治療後、両方の治療群における患者が、空腹時血漿グルコースレベルの迅速な統計学的に有意な減少を示し、4週目で、プラセボに関する15.1mg/dlと比較して、それぞれ150mg及び300mgの用量群において53.4mg/dl及び65.9mg/dlの低減を伴った。とりわけ、300mgの用量群における患者の実質的なパーセント(42%)は、プラセボと比較して、4週間の投薬で105mg/dl未満の空腹時血漿グルコースレベルを達成した(p=0.0037)。
【0125】
研究の間にわたって、患者の耐糖能を従来の様式で試験した。図2に示されるように、両方の治療群における患者が、プラセボ群における患者よりも高い耐糖能を示した。
【0126】
図3は、患者の平均グルコース血漿レベルの曲線下面積(AUC)を示す。ちょうど1日の治療後に、150mg/日及び300mg/日の両方の治療群が、それらの平均血漿グルコースAUCにおいて統計学的に有意な減少を示した。
【0127】
図4に示されるように、150mg/日及び300mg/日の治療群に対して無作為化した患者が、プラセボと比較して改善されたインスリン感受性を示した。この図は、群の恒常性モデル評価(HOMA)値の概要を提供する。
【0128】
図5に示されるように、両方の治療群における患者が、プラセボと比較して、食後グルコースレベルの迅速な統計学的に有意な減少を示した。
【0129】
フルクトサミン(糖化アルブミン)は多くの場合、血糖の短期制御を評価するのに測定される。図6は、患者の平均血漿フルクトサミンレベルに対する化合物の影響を示す。
【0130】
図7は、糖化ヘモグロビン(ヘモグロビンA1c;HbA1c)レベルにおける患者の平均パーセント変化を示す。HbA1cは、長期間にわたって平均血漿グルコース濃度を特定するのに主として使用されるヘモグロビンの形態である。150mg/日及び300mg/日の治療群に対して無作為化された患者が、それらの平均HbA1cレベルの著しい減少を示した。ちょうど4週間の投薬後に、平均パーセントHbA1cは、プラセボ群における0.49と比較して、150mg用量群では1.15(p=0.036)、及び300mg用量群では1.25(p=0.017)だけ有意に低減した。HbA1cレベルは、両方の用量群における患者の半分に関して7%以下に低減し、ベースラインレベルは、それぞれ150mg群、300mg群及びプラセボ群に関して、8.22%、8.50%及び8.20%であった。
【0131】
驚くべきことに、150mg/日及び300mg/日の治療群における患者はまた、プラセボと比較して、28日間の投薬の後に平均拡張期血圧及び収縮期血圧を減少させた。図8及び図9を参照されたい。また、図10に示されるように、両方の治療群における患者の平均動脈圧もまた減少した。
【0132】
以下で表1に示されるように、化合物の投与はまた、患者の血清トリグリセリドレベルを低下させて、また体重減少をもたらすことが見出された:
【0133】
【表1】

【0134】
これらの結果により、4週の治療期間内で、化合物の投与を受けた患者は、血糖パラメータの改善に関連付けられる血圧制御、減量及びトリグリセリドレベルの改善を示したことが実証される。
【0135】
上で引用した全ての刊行物(例えば、特許及び特許出願)はその全体が、参照により本明細書中に援用される。
【技術分野】
【0001】
1. 発明の分野
本発明は、患者、特に2型糖尿病を患う患者の心血管及び/又は代謝の健康を改善する方法、並びに該方法において有用な化合物及び医薬組成物に関する。
【背景技術】
【0002】
2. 背景
2型真性糖尿病(T2DM)は、血清グルコースの上昇を特徴とする障害である。この疾患を患う患者において血清グルコースを低減させる方法の1つは、腎臓におけるグルコース再吸収を阻害することによるものである。グルコースはおよそ8g/hの速度で糸球体を通って濾過されて、ナトリウム−グルコース共輸送体(SGLT)を介して近位尿細管でほぼ完全に再吸収されるため、腎臓はグルコースの全体的な制御において重要な役割を果たす(非特許文献1)。ナトリウム−グルコース共輸送体2(SGLT2)は、14個の膜貫通ドメインSGLTのうちの1つであり、糸球体で濾過されるグルコースの大部分を再吸収することに関与する。したがって、SGLT2の阻害は、T2DMを治療するための合理的なアプローチである(同上)。
【0003】
多数のSGLT2阻害剤が報告されている。例えば、特許文献1、特許文献2及び特許文献3を参照されたい。それらのうちの1つであるダパグリフロジンは、T2DM患者へ投与され、有望な結果をもたらしてきた。特に、14日間の研究において化合物に対して無作為化した患者は、プラセボと比較して空腹時血漿レベルの低減及び耐糖能の改善を示した(非特許文献1、513頁)。12週間の研究では、化合物に対して無作為化した患者は、プラセボと比較して、ヘモグロビンA1cの改善、或る程度の体重減少、及び収縮期血圧の或る程度の改善を示した(非特許文献2)。
【0004】
SGLT2の阻害剤の発見及び開発を対象とする製薬上の努力のほとんどは、「SGLT2輸送体に対して選択的な阻害剤を考案することに焦点が当てられてきた」(非特許文献3)。これは、機能的SGLT2遺伝子を欠いているヒトが、高い尿グルコース排泄を示すことは別として、通常の生活を送っているようである一方で、SGLT1遺伝子突然変異を有するヒトがグルコース−ガラクトース吸収不良に苦しんでいるという事実に少なくとも部分的に基づいているようである(同上)。ヒト腎臓でのみ発現されるSGLT2と異なり、SGLT1は、小腸及び心臓でも発現される(同上)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】米国特許第6,414,126号
【特許文献2】米国特許第6,555,519号
【特許文献3】米国特許第7,393,836号
【非特許文献】
【0006】
【非特許文献1】Komoroski, B., et al., Clin Pharmacol Ther. 85(5):513-9(2009)
【非特許文献2】List, J.F., et al., Diabetes Care. 32(4):650-7(2009)
【非特許文献3】Washburn, W.N., Expert Opin. Ther. Patents 19(11):1485,1499,1486(2009)
【発明の概要】
【0007】
3. 発明の概要
本発明は部分的に、患者の心血管及び/又は代謝の健康を改善する方法であって、安全かつ有効な量の、式I:
【化1】

の構造も有する(その様々な置換基が本明細書中で定義される)ナトリウム−グルコース共輸送体1及び2の二重阻害剤(「二重SGLT1/2阻害剤」)又はそれらの薬学的に許容される塩を、それを必要とする患者へ投与することを含む、患者の心血管及び/又は代謝の健康を改善する方法に関する。特定の実施の形態では、患者は、抗糖尿病剤、抗高血糖症剤、抗高脂血症剤/脂質低下剤、抗肥満症剤、抗高血圧剤又は食欲抑制薬のような別の治療剤を同時に服用している。
【0008】
本発明の1つの実施の形態では、投与は、患者の血漿グルコースの減少をもたらす。1つの実施の形態では、投与は、患者における経口耐糖能の改善をもたらす。1つの実施の形態では、投与は、患者の食後血漿グルコースレベルを低下させる。1つの実施の形態では、投与は、患者の血漿フルクトサミンレベルを低下させる。1つの実施の形態では、投与は、患者のHbA1cレベルを低下させる。1つの実施の形態では、投与は、患者の血圧(例えば、収縮期血圧及び拡張期血圧)を低減させる。1つの実施の形態では、投与は、患者のトリグリセリドレベルを低減させる。
【0009】
本発明の特定の実施の形態では、二重SGLT1/2阻害剤は、式:
【化2】

(式中、R1Aはそれぞれ独立して、水素、アルキル、アリール又は複素環であり、R6はそれぞれ独立して、水素、ヒドロキシル、アミノ、アルキル、アリール、シアノ、ハロゲン、ヘテロアルキル、複素環、ニトロ、C≡CR6A、OR6A、SR6A、SOR6A、SO2R6A、C(O)R6A、CO2R6A、CO2H、CON(R6A)(R6A)、CONH(R6A)、CONH2、NHC(O)R6A、又はNHSO2R6Aであり、R6Aはそれぞれ独立して、アルキル、アリール又は複素環であり、R7はそれぞれ独立して、水素、ヒドロキシル、アミノ、アルキル、アリール、シアノ、ハロゲン、ヘテロアルキル、複素環、ニトロ、C≡CR7A、OR7A、SR7A、SOR7A、SO2R7A、C(O)R7A、CO2R7A、CO2H、CON(R7A)(R7A)、CONH(R7A)、CONH2、NHC(O)R7A、又はNHSO2R7Aであり、R7Aはそれぞれ独立して、アルキル、アリール又は複素環であり、mは1〜4であり、nは1〜3であり、pは0〜2であり、各アルキル、アリール、ヘテロアルキル又は複素環は、アルコキシ、アミノ、シアノ、ハロ、ヒドロキシル又はニトロのうちの1つ又は複数で必要に応じて置換される)
の化合物、又はその薬学的に許容される塩である。
【0010】
特定の実施の形態では、安全かつ有効な量は、300mg/日、又はそれ未満(例えば、250mg/日、200mg/日、150mg/日、100mg/日若しくは50mg/日、又はそれ未満)である。特定の患者は、糖尿病患者又は前糖尿病患者である。
【0011】
4. 図面の簡単な説明
本発明の或る特定の態様は、図面を参照して理解することができる。図面は、無作為化二重盲検プラセボ対照第2a相臨床試験(150mg及び300mgの用量の本発明の化合物を、2型真性糖尿病を患う患者に1日1回経口投与した)から得られた結果を提示する。
【図面の簡単な説明】
【0012】
【図1】研究の間のプラセボ群、並びに150mg/日及び300mg/日の治療群における患者の血漿グルコースレベルを示す図である。
【図2】研究の間に施された耐糖能試験における各群の平均結果を示す図である。
【図3】研究の間の各群の平均グルコース血漿レベルの曲線下面積(AUC)を示す図である。
【図4】各群の平均恒常性モデル評価(HOMA)値の結果を示す図である。測定値は、研究が始まる前に、及び27日目に再度得た。
【図5】研究の間の各群の平均食後グルコースレベルの測定値を提示する図である。
【図6】研究の間の各群の平均血漿フルクトサミンレベルの測定値を提示する図である。
【図7】研究の間のヘモグロビンA1cレベルの各群の平均パーセントの変化を提示する図である。
【図8】ベースラインと比較した、研究の28日目に測定した場合の各群の平均拡張期血圧の変化を示す図である。
【図9】ベースラインと比較した、研究の28日目に測定した場合の各群の平均収縮期血圧の変化を示す図である。
【図10】ベースラインと比較した、研究の28日目に測定した場合の各群の平均動脈圧の変化を示す図である。
【発明を実施するための形態】
【0013】
5. 詳細な説明
本発明は、無作為化二重盲検プラセボ対照第2a相臨床試験(150mg/日及び300mg/日の用量の二重SGLT1/2阻害剤が、2型真性糖尿病を患う患者に投与された)から得られた、本明細書中で提示される知見に部分的に基づいている。二重SGLT1/2阻害剤は、構造:
【化3】

を有する(2S,3R,4R,5S,6R)−2−(4−クロロ−3−(4−エトキシベンジル)フェニル)−6−(メチルチオ)テトラヒドロ−2H−ピラン−3,4,5−トリオールであった。
【0014】
特にダパグリフロジンのような選択的SGLT2阻害剤に関して報告される結果と比較した場合の、臨床研究の知見の驚くべき性質は、SGLT2及びSGLT1の両方を阻害する化合物の能力に起因すると考えられる。SGLT1の阻害は、グルカゴン様ペプチド−1(GLP−1)レベルの増大に関連付けられている。例えば、Moriya, R. , et al., Am J Physiol Endocrinol Metab 297: E1358-E1365(2009)を参照されたい。GLP−1レベルの増大は、糖尿病患者における既知の利益であり、シタグリプチン、ビルダグリプチン及びサクサグリプチンを含む多数の既知の糖尿病薬は、GLP−1分解に関与する酵素(DPP−4)を阻害することによって機能する。
【0015】
5.1. 定義
特に明示のない限り、「アルケニル」という用語は、2〜20(例えば、2〜10又は2〜6)個の炭素原子を有し、少なくとも1つの炭素−炭素二重結合を含む直鎖、分岐鎖及び/又は環式の炭化水素を意味する。代表的なアルケニル部分としては、ビニル、アリル、1−ブテニル、2−ブテニル、イソブチレニル、1−ペンテニル、2−ペンテニル、3−メチル−1−ブテニル、2−メチル−2−ブテニル、2,3−ジメチル−2−ブテニル、1−ヘキセニル、2−ヘキセニル、3−ヘキセニル、1−ヘプテニル、2−ヘプテニル、3−ヘプテニル、1−オクテニル、2−オクテニル、3−オクテニル、1−ノネニル、2−ノネニル、3−ノネニル、1−デセニル、2−デセニル及び3−デセニルが挙げられる。
【0016】
特に明示のない限り、「アルコキシ」という用語は、−O−アルキル基を意味する。アルコキシ基の例としては、−OCH3、−OCH2CH3、−O(CH2)2CH3、−O(CH2)3CH3、−O(CH2)4CH3及び−O(CH2)5CH3が挙げられるが、これらに限定されない。
【0017】
特に明示のない限り、「アルキル」という用語は、1〜20(例えば、1〜10又は1〜4)個の炭素原子を有する直鎖、分岐鎖及び/又は環式(「シクロアルキル」)の炭化水素を意味する。1個〜4個の炭素を有するアルキル部分は「低級アルキル」と称される。アルキル基の例としては、メチル、エチル、プロピル、イソプロピル、n−ブチル、t−ブチル、イソブチル、ペンチル、ヘキシル、イソヘキシル、ヘプチル、4,4−ジメチルペンチル、オクチル(octyl)、2,2,4−トリメチルペンチル、ノニル、デシル、ウンデシル及びドデシルが挙げられるが、これらに限定されない。シクロアルキル部分は単環式又は多環式であってもよく、例としてはシクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル及びアダマンチルが挙げられる。アルキル部分の更なる例は直鎖部分、分岐鎖部分及び/又は環式部分(例えば、1−エチル−4−メチル−シクロヘキシル)を有する。「アルキル」という用語は飽和炭化水素、並びにアルケニル部分及びアルキニル部分を含む。
【0018】
特に明示のない限り、「アルキルアリール」又は「アルキル−アリール」という用語は、アリール部分と結合したアルキル部分を意味する。
【0019】
特に明示のない限り、「アルキルヘテロアリール」又は「アルキル−ヘテロアリール」という用語は、ヘテロアリール部分と結合したアルキル部分を意味する。
【0020】
特に明示のない限り、「アルキル複素環」又は「アルキル−複素環」という用語は、複素環部分と結合したアルキル部分を意味する。
【0021】
特に明示のない限り、「アルキニル」という用語は、2〜20(例えば、2〜20又は2〜6)個の炭素原子を有し、少なくとも1つの炭素−炭素三重結合を含む直鎖、分岐鎖又は環式の炭化水素を意味する。代表的なアルキニル部分としては、アセチレニル、プロピニル、1−ブチニル、2−ブチニル、1−ペンチニル、2−ペンチニル、3−メチル−1−ブチニル、4−ペンチニル、1−ヘキシニル、2−ヘキシニル、5−ヘキシニル、1−ヘプチニル、2−ヘプチニル、6−ヘプチニル、1−オクチニル、2−オクチニル、7−オクチニル、1−ノニニル、2−ノニニル、8−ノニニル、1−デシニル、2−デシニル及び9−デシニルが挙げられる。
【0022】
特に明示のない限り、「アリール」という用語は、炭素原子及び水素原子から構成される芳香環、又は芳香族若しくは部分芳香族の環系を意味する。アリール部分はともに結合又は融合した複数の環を含んでいてもよい。アリール部分の例としては、アントラセニル、アズレニル、ビフェニル、フルオレニル、インダン、インデニル、ナフチル、フェナントレニル、フェニル、1,2,3,4−テトラヒドロ−ナフタレン及びトリルが挙げられるが、これらに限定されない。
【0023】
特に明示のない限り、「アリールアルキル」又は「アリール−アルキル」という用語は、アルキル部分と結合したアリール部分を意味する。
【0024】
特に明示のない限り、「二重SGLT1/2阻害剤」という用語は、約75、50又は25未満のSGLT1 IC50対SGLT2 IC50の比を有する化合物を表す。
【0025】
特に明示のない限り、「ハロゲン」及び「ハロ」という用語は、フッ素、塩素、臭素及びヨウ素を包含する。
【0026】
特に明示のない限り、「ヘテロアルキル」という用語は、炭素原子のうちの少なくとも1つがヘテロ原子(例えば、N、O又はS)で置き換えられたアルキル部分(例えば、直鎖、分岐鎖又は環式)を表す。
【0027】
特に明示のない限り、「ヘテロアリール」という用語は、炭素原子のうちの少なくとも1つがヘテロ原子(例えば、N、O又はS)で置き換えられたアリール部分を意味する。例としては、アクリジニル、ベンゾイミダゾリル、ベンゾフラニル、ベンゾイソチアゾリル、ベンゾイソオキサゾリル、ベンゾキナゾリニル、ベンゾチアゾリル、ベンズオキサゾリル、フリル、イミダゾリル、インドリル、イソチアゾリル、イソオキサゾリル、オキサジアゾリル、オキサゾリル、フタラジニル、ピラジニル、ピラゾリル、ピリダジニル、ピリジル、ピリミジニル、ピリミジル、ピロリル、キナゾリニル、キノリニル、テトラゾリル、チアゾリル及びトリアジニルが挙げられるが、これらに限定されない。
【0028】
特に明示のない限り、「ヘテロアリールアルキル」又は「ヘテロアリール−アルキル」という用語は、アルキル部分と結合したヘテロアリール部分を意味する。
【0029】
特に明示のない限り、「複素環」という用語は、炭素、水素及び少なくとも1つのヘテロ原子(例えば、N、O又はS)から構成される芳香族、部分芳香族、又は非芳香族の単環式又は多環式の環又は環系を表す。複素環は、ともに融合又は結合した複数(すなわち2つ以上)の環を含み得る。複素環はヘテロアリールを含む。例としては、ベンゾ[1,3]ジオキソリル、2,3−ジヒドロ−ベンゾ[1,4]ジオキシニル、シンノリニル、フラニル、ヒダントイニル、モルホリニル、オキセタニル、オキシラニル、ピペラジニル、ピペリジニル、ピロリジノニル、ピロリジニル、テトラヒドロフラニル、テトラヒドロピラニル、テトラヒドロピリジニル、テトラヒドロピリミジニル、テトラヒドロチオフェニル、テトラヒドロチオピラニル及びバレロラクタミルが挙げられるが、これらに限定されない。
【0030】
特に明示のない限り、「複素環アルキル」又は「複素環−アルキル」という用語は、アルキル部分と結合した複素環部分を表す。
【0031】
特に明示のない限り、「ヘテロシクロアルキル」という用語は、非芳香族の複素環を表す。
【0032】
特に明示のない限り、「ヘテロシクロアルキルアルキル」又は「ヘテロシクロアルキル−アルキル」という用語は、アルキル部分と結合したヘテロシクロアルキル部分を表す。
【0033】
特に明示のない限り、「管理する(manage)」、「管理すること(managing)」及び「管理(management)」という用語は、特定の疾患若しくは障害に既に罹患した患者において疾患若しくは障害の再発を予防すること、及び/又は疾患若しくは障害に罹患している患者が寛解期にある時間を延長させることを包含する。この用語は、疾患若しくは障害の閾値、発症及び/若しくは継続期間を調節すること、又は患者の疾患若しくは障害に対する応答の仕方を変えることを包含する。
【0034】
特に明示のない限り、「薬学的に許容される塩」という用語は、薬学的に許容される非毒性の酸又は塩基(無機酸及び無機塩基並びに有機酸及び有機塩基を含む)から調製される塩を表す。好適な薬学的に許容される塩基付加塩としては、アルミニウム、カルシウム、リチウム、マグネシウム、カリウム、ナトリウム及び亜鉛から生成される金属塩、又はリジン、N,N’−ジベンジルエチレンジアミン、クロロプロカイン、コリン、ジエタノールアミン、エチレンジアミン、メグルミン(N−メチルグルカミン)及びプロカインから生成される有機塩が挙げられるが、これらに限定されない。好適な非毒性の酸としては、酢酸、アルギン酸、アントラニル酸、ベンゼンスルホン酸、安息香酸、カンファースルホン酸、クエン酸、エテンスルホン酸、ギ酸、フマル酸、フロ酸、ガラクツロン酸、グルコン酸、グルクロン酸、グルタミン酸、グリコール酸、臭化水素酸、塩酸、イセチオン酸、乳酸、マレイン酸、リンゴ酸、マンデル酸、メタンスルホン酸、ムチン酸、硝酸、パモン酸、パントテン酸、フェニル酢酸、リン酸、プロピオン酸、サリチル酸、ステアリン酸、コハク酸、スルファニル酸、硫酸、酒石酸及びp−トルエンスルホン酸等の無機酸及び有機酸が挙げられるが、これらに限定されない。具体的な非毒性酸としては、塩酸、臭化水素酸、リン酸、硫酸及びメタンスルホン酸が挙げられる。したがって、具体的な塩の例としては、塩酸塩及びメシル酸塩が挙げられる。他のものも当該技術分野において既知である。例えば、Remington's Pharmaceutical Sciences(第18版、Mack Publishing, Easton PA: 1990)、及びRemington: The Science and Practice of Pharmacy(第19版、Mack Publishing, Easton PA: 1995)を参照されたい。
【0035】
特に明示のない限り、「予防する(prevent)」、「予防すること(preventing)」及び「予防(prevention)」という用語は、患者が特定の疾患又は障害に罹患し始める前に行う処置であって、疾患又は障害の重症度を抑制するか又は低減させる、処置を意図する。換言すると、この用語は予防法を包含する。
【0036】
特に明示のない限り、化合物の「予防的に有効な量」は、疾患若しくは病態、若しくは疾患若しくは病態に関連する1つ若しくは複数の症状を予防するのに、又はその再発を予防するのに十分な量である。化合物の「予防的に有効な量」は、単独で又は他の作用剤と組み合わせて、疾患の予防において予防的利点をもたらす治療剤の量を意味する。「予防的に有効な量」という用語は、予防法を全体的に改善するか、又は別の予防剤の予防的な有効性を高める量を包含し得る。
【0037】
特に明示のない限り、「SGLT1 IC50」という用語は、以下の実施例に記載のin vitroでのヒトSGLT1阻害アッセイを使用して決定した化合物のIC50である。
【0038】
特に明示のない限り、「SGLT2 IC50」という用語は、以下の実施例に記載のin vitroでのヒトSGLT2阻害アッセイを使用して決定した化合物のIC50である。
【0039】
特に明示のない限り、「置換される」という用語は、化学的な構造又は部分を説明するために使用する場合、水素原子の1つ又は複数が、アルコール、アルデヒド、アルコキシ、アルカノイルオキシ、アルコキシカルボニル、アルケニル、アルキル(例えば、メチル、エチル、プロピル、t−ブチル)、アルキニル、アルキルカルボニルオキシ(−OC(O)アルキル)、アミド(−C(O)NH−アルキル−又は−アルキルNHC(O)アルキル)、アミジニル(−C(NH)NH−アルキル又は−C(NR)NH2)、アミン(アルキルアミノ、アリールアミノ、アリールアルキルアミノ等の第1級、第2級及び第3級のアミン)、アロイル、アリール、アリールオキシ、アゾ、カルバモイル(−NHC(O)O−アルキル−又は−OC(O)NH−アルキル)、カルバミル(例えば、CONH2並びにCONH−アルキル、CONH−アリール及びCONH−アリールアルキル)、カルボニル、カルボキシル、カルボン酸、カルボン酸無水物、カルボン酸塩化物、シアノ、エステル、エポキシド、エーテル(例えば、メトキシ、エトキシ)、グアニジノ、ハロ、ハロアルキル(例えば、−CCl3、−CF3、−C(CF3)3)、ヘテロアルキル、ヘミアセタール、イミン(第1級及び第2級)、イソシアネート、イソチオシアネート、ケトン、ニトリル、ニトロ、酸素(すなわち、オキソ基をもたらす)、ホスホジエステル、スルフィド、スルホンアミド(例えば、SO2NH2)、スルホン、スルホニル(アルキルスルホニル、アリールスルホニル及びアリールアルキルスルホニルを含む)、スルホキシド、チオール(例えば、スルフヒドリル、チオエーテル)並びに尿素(−NHCONH−アルキル−)等の(しかし、これらに限定されない)原子、化学的部分又は官能基で置換される、その構造又は部分の誘導体を表す。特定の実施形態では、置換されるという用語は、水素原子の1つ又は複数が、アルコール、アルコキシ、アルキル(例えば、メチル、エチル、プロピル、t−ブチル)、アミド(−C(O)NH−アルキル−又は−アルキルNHC(O)アルキル)、アミジニル(−C(NH)NH−アルキル又は−C(NR)NH2)、アミン(アルキルアミノ、アリールアミノ、アリールアルキルアミノ等の第1級、第2級及び第3級のアミン)、アリール、カルバモイル(−NHC(O)O−アルキル−又は−OC(O)NH−アルキル)、カルバミル(例えば、CONH2並びにCONH−アルキル、CONH−アリール及びCONH−アリールアルキル)、ハロ、ハロアルキル(例えば、−CCl3、−CF3、−C(CF3)3)、ヘテロアルキル、イミン(第1級及び第2級)、イソシアネート、イソチオシアネート、チオール(例えば、スルフィドリル、チオエーテル)又は尿素(−NHCONH−アルキル−)で置換される、その構造又は部分の誘導体を表す。
【0040】
特に明示のない限り、化合物の「治療的に有効な量」は、疾患若しくは病態の治療若しくは管理において治療的利点をもたらすのに、又は疾患若しくは病態に関連した1つ若しくは複数の症状を遅延させる若しくは最小限に抑えるのに十分な量である。化合物の「治療的に有効な量」は、疾患又は病態の治療又は管理に治療的利点をもたらす、単独の又は他の療法と組み合わせた治療剤の量を意味する。「治療的に有効な量」という用語は、療法を全体的に改善するか、疾患若しくは病態の症状若しくは原因を低減させる若しくは回避するか、又は別の治療剤の治療的な有効性を高める量を包含し得る。
【0041】
特に明示のない限り、「治療する(treat)」、「治療すること(treating)」及び「治療(treatment)」という用語は、患者が特定の疾患又は障害に罹患している間に行う処置であって、疾患若しくは障害の重症度を低減させるか、又は疾患若しくは障害の進行を遅延若しくは減速させる、処置を意図する。
【0042】
特に明示のない限り、「挙げられる(含む)(include)」という用語は、「挙げられる(含む)が、これらに限定されない」と同じ意味を有し、「挙げられる(含む)(includes)」という用語は、「挙げられる(含む)が、これらに限定されない」と同じ意味を有する。同様に、「等の(such as)」という用語は、「等の(しかし、これらに限定されない)」という用語と同じ意味を有する。
【0043】
特に明示のない限り、一連の名詞の直前にくる1つ又は複数の形容詞は、それぞれの名詞を修飾するものとして解釈される。例えば、「必要に応じて置換されるアルキル、アリール又はヘテロアリール」という語句は、「必要に応じて置換されるアルキル、必要に応じて置換されるアリール、又は必要に応じて置換されるヘテロアリール」と同じ意味を有する。
【0044】
より大きい化合物の一部分を形成する化学的部分は、単一分子として存在する場合に一般的に与えられる名称、又はそのラジカルに一般的に与えられる名称を使用して本明細書に記載されることがあることに留意すべきである。例えば、「ピリジン」及び「ピリジル」という用語には、他の化学的部分と結合した部分を記載するのに使用する場合に、同じ意味が与えられる。したがって、「XOH(式中、Xはピリジルである)」及び「XOH(式中、Xはピリジンである)」という2つの語句には同じ意味が与えられ、化合物ピリジン−2−オール、ピリジン−3−オール及びピリジン−4−オールを包含する。
【0045】
或る構造又は或る構造の一部分の立体化学が例えば太線又は破線で示されない場合、その構造又はその構造の一部分はその全ての立体異性体を包含すると解釈されることにも留意すべきである。さらに、満たされていない原子価を有することが図で示された任意の原子はこの原子価を満たすのに十分な水素原子と結合していると推測される。さらに、一本の破線と平行した一本の実線で示された化学結合は、原子価が許容する場合、単結合及び二重結合の両方(例えば、芳香族結合)を包含する。
【0046】
5.2 化合物
本発明は部分的に、式:
【化4】

(式中、Aは、必要に応じて置換されるアリール、シクロアルキル又は複素環であり、Xは、O、S又はNR3であり、XがOである場合はR1はOR1A、SR1A、SOR1A、SO2R1A又はN(R1A)2であり、XがSである場合はR1は水素、OR1A、SR1A、SOR1A又はSO2R1Aであり、XがNR3である場合はR1はOR1A、SR1A、SOR1A、SO2R1A又はR1Aであり、R1Aはそれぞれ独立して、水素又は必要に応じて置換されるアルキル、アリール若しくは複素環であり、R2は、フルオロ又はOR2Aであり、R2A、R2B及びR2Cはそれぞれ独立して、水素、必要に応じて置換されるアルキル、C(O)アルキル、C(O)アリール又はアリールであり、R3は水素、C(O)R3A、CO2R3A、CON(R3B)2又は必要に応じて置換されるアルキル、アリール若しくは複素環であり、R3Aはそれぞれ独立して、必要に応じて置換されるアルキル又はアリールであり、R3Bはそれぞれ独立して、水素又は必要に応じて置換されるアルキル若しくはアリールである)の化合物及びそれらの薬学的に許容される塩を含む組成物、並びに該化合物及び塩を使用する方法に関する。これらの化合物は、当該技術分野で既知の方法によって調製することができる。例えば、米国特許出願公開第20080113922号及び同第20080221164号を参照されたい。
【0047】
特定の化合物は、式:
【化5】

の化合物である。
【0048】
幾つかの化合物は、式:
【化6】

の化合物である。
【0049】
幾つかの化合物は、式:
【化7】

の化合物である。
【0050】
本発明の一実施形態は、式:
【化8】

(式中、Aは、必要に応じて置換されるアリール、シクロアルキル又は複素環であり、Bは、必要に応じて置換されるアリール、シクロアルキル又は複素環であり、Xは、O、S又はNR3であり、Yは、O、S、SO、SO2、NR4、(C(R5)2)p、(C(R5)2)q−C(O)−(C(R5)2)q、(C(R5)2)q−C(O)O−(C(R5)2)q、(C(R5)2)q−OC(O)−(C(R5)2)q、(C(R5)2)q−C(O)NR4−(C(R5)2)q、(C(R5)2)q−NR4C(O)−(C(R5)2)q、又は(C(R5)2)q−NR4C(O)NR4−(C(R5)2)qであり、XがOである場合はR1はOR1A、SR1A、SOR1A、SO2R1A又はN(R1A)2であり、XがSである場合はR1は水素、OR1A、SR1A、SOR1A又はSO2R1Aであり、XがNR3である場合はR1はOR1A、SR1A、SOR1A、SO2R1A又はR1Aであり、R1Aはそれぞれ独立して、水素又は必要に応じて置換されるアルキル、アリール若しくは複素環であり、R2は、フルオロ又はOR2Aであり、R2A、R2B及びR2Cはそれぞれ独立して、水素、必要に応じて置換されるアルキル、C(O)アルキル、C(O)アリール又はアリールであり、R3は水素、C(O)R3A、CO2R3A、CON(R3B)2又は必要に応じて置換されるアルキル、アリール若しくは複素環であり、R3Aはそれぞれ独立して、必要に応じて置換されるアルキル又はアリールであり、R3Bはそれぞれ独立して、水素又は必要に応じて置換されるアルキル若しくはアリールであり、R4はそれぞれ独立して、水素又は必要に応じて置換されるアルキルであり、R5はそれぞれ独立して、水素、ヒドロキシル、ハロゲン、アミノ、シアノ、OR5A、SR5A又は必要に応じて置換されるアルキルであり、R5Aはそれぞれ独立して、必要に応じて置換されるアルキルであり、pは0〜3であり、qはそれぞれ独立して、0〜2である)
の化合物及びそれらの薬学的に許容される塩を包含する。
【0051】
特定の化合物は、式:
【化9】

の化合物である。
【0052】
幾つかの化合物は、式:
【化10】

の化合物である。
【0053】
幾つかの化合物は、式:
【化11】

の化合物である。
【0054】
幾つかの化合物は、式:
【化12】

(式中、R6はそれぞれ独立して、水素、ヒドロキシル、ハロゲン、アミノ、シアノ、ニトロ、C≡CR6A、OR6A、SR6A、SOR6A、SO2R6A、C(O)R6A、CO2R6A、CO2H、CON(R6A)(R6A)、CONH(R6A)、CONH2、NHC(O)R6A、NHSO2R6A又は必要に応じて置換されるアルキル、アリール若しくは複素環であり、R6Aはそれぞれ独立して、必要に応じて置換されるアルキル、アリール又は複素環であり、R7はそれぞれ独立して、水素、ヒドロキシル、ハロゲン、アミノ、シアノ、ニトロ、C≡CR7A、OR7A、SR7A、SOR7A、SO2R7A、C(O)R7A、CO2R7A、CO2H、CON(R7A)(R7A)、CONH(R7A)、CONH2、NHC(O)R7A、NHSO2R7A又は必要に応じて置換されるアルキル、アリール若しくは複素環であり、R7Aはそれぞれ独立して、必要に応じて置換されるアルキル、アリール又は複素環であり、mは1〜3であり、nは1〜3である)
の化合物である。
【0055】
幾つかの化合物は、式:
【化13】

の化合物である。
【0056】
幾つかの化合物は、式:
【化14】

の化合物である。
【0057】
幾つかの化合物は、式:
【化15】

の化合物である。
【0058】
本発明の一実施形態は、式:
【化16】

(式中、Aは、必要に応じて置換されるアリール、シクロアルキル又は複素環であり、Xは、O又はNR3であり、R2は、フルオロ又はOR2Aであり、R2A、R2B及びR2Cはそれぞれ独立して、水素、必要に応じて置換されるアルキル、C(O)アルキル、C(O)アリール又はアリールであり、R3は、水素又は必要に応じて置換されるアルキル、アリール若しくは複素環であり、R8は、水素又はC(O)R8Aであり、R8Aは、水素又は必要に応じて置換されるアルキル、アルコキシ若しくはアリールであり、R9A及びR9Bはそれぞれ独立して、OR9C若しくはSR9Cであるか、又は一緒にO、S若しくはNR9Cをもたらし、R9Cはそれぞれ独立して、必要に応じて置換されるアルキル、アリール又は複素環である)
の化合物及びそれらの薬学的に許容される塩を包含する。
【0059】
本明細書中に開示される様々な式に関して、適用可能であれば、本発明の特定の化合物は、Aが必要に応じて置換される6員のアリール又は複素環であるようなものである。他の場合では、Aは、必要に応じて置換される5員複素環である。幾つかの場合では、Aは、必要に応じて置換される融合二環式複素環である。
【0060】
幾つかの場合では、Bは、必要に応じて置換される6員のアリール又は複素環である。他の場合では、Bは、必要に応じて置換される5員複素環である。他の場合では、Bは、必要に応じて置換される融合二環式複素環である。
【0061】
幾つかの場合では、XはOである。他の場合では、XはSである。他の場合では、XはNR3である。
【0062】
幾つかの場合では、Yは(C(R4)2)pであり、例えば、pは1である。幾つかの場合では、Yは、(C(R5)2)q−C(O)−(C(R5)2)qであり、例えば、qはそれぞれ独立して、0又は1である。
【0063】
幾つかの場合では、R1はOR1Aである。他の場合では、R1はSR1Aである。他の場合では、R1はSOR1Aである。他の場合では、R1はSO2R1Aである。他の場合では、R1はN(R1A)2である。他の場合では、R1は水素である。他の場合では、R1はR1Aである。
【0064】
幾つかの場合では、R1Aは水素である。他の場合では、R1Aは、必要に応じて置換されるアルキル(例えば、必要に応じて置換される低級アルキル)である。
【0065】
幾つかの場合では、R2はフルオロである。他の場合では、R2はOR2Aである。
【0066】
幾つかの場合では、R2Aは水素である。
【0067】
幾つかの場合では、R2Bは水素である。
【0068】
幾つかの場合では、R2Cは水素である。
【0069】
幾つかの場合では、R3は水素である。他の場合では、R3は必要に応じて置換される低級アルキル(例えば、必要に応じて置換されるメチル)である。
【0070】
幾つかの場合では、R4は、水素又は必要に応じて置換される低級アルキルである。
【0071】
幾つかの場合では、R5はそれぞれ、水素又は必要に応じて置換される低級アルキル(例えば、メチル、エチル、CF3)である。
【0072】
幾つかの場合では、R6は、水素、ヒドロキシル、ハロゲン、OR6A又は必要に応じて置換される低級アルキル(例えば、必要に応じてハロゲン化されるメチル、エチル又はイソプロピル)である。幾つかの場合では、R6は水素である。幾つかの場合では、R6はハロゲン(例えば、クロロ)である。幾つかの場合では、R6はヒドロキシルである。幾つかの場合では、R6はOR6A(例えば、メトキシ、エトキシ)である。幾つかの場合では、R6は必要に応じて置換されるメチル(例えば、CF3)である。
【0073】
幾つかの場合では、R7は、水素、C≡CR7A、OR7A又は必要に応じて置換される低級アルキル(例えば、必要に応じてハロゲン化されるメチル、エチル又はイソプロピル)である。幾つかの場合では、R7は水素である。幾つかの場合では、R7はC≡CR7Aであり、R7Aは例えば、必要に応じて置換される(例えば、低級アルキル又はハロゲンで)単環式アリール又は複素環である。幾つかの場合では、R7は、OR7A(例えば、メトキシ、エトキシ)である。幾つかの場合では、R7はアセチレニル又は必要に応じて置換されるメチル若しくはエチルである。
【0074】
本発明の特定の化合物は、式:
【化17】

の化合物である。
【0075】
他の化合物は、式:
【化18】

の化合物である。
【0076】
他の化合物は、式:
【化19】

の化合物である。
【0077】
他の化合物は、式:
【化20】

の化合物である。
【0078】
他の化合物は、式:
【化21】

の化合物である。
【0079】
他の化合物は、式:
【化22】

の化合物である。
【0080】
式I(a)〜式I(d)の特定の化合物では、XはOである。他の場合では、XはSである。他の場合では、XはNR3であり、R3は例えば、水素である。式I(a)〜式I(f)の特定の化合物では、R1Aは水素である。他の場合では、R1Aは、必要に応じて置換されるメチル又はエチルである。
【0081】
本発明の特定の化合物としては、以下のものが挙げられる:
(2S,3R,4R,5S,6R)−2−(4−クロロ−3−(4−エトキシベンジル)フェニル)−6−(メチルチオ)テトラヒドロ−2H−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−(4−クロロ−3−(4−エトキシベンジル)フェニル)−6−(メチルスルホニル)−テトラヒドロ−2H−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(3S,4R,5R,6S)−6−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−テトラヒドロ−ピラン−2,3,4,5−テトラオール;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−エトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−イソプロポキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−イソプロポキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
N−{(2S,3S,4R,5R,6S)−6−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−テトラヒドロ−ピラン−2−イル}−N−プロピル−アセトアミド;
(2R,3S,4S,5S)−5−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−2,3,4,5−テトラヒドロキシ−ペンタナールオキシム;
(3S,4R,5R,6S)−6−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−テトラヒドロ−ピラン−2−オンオキシム;
(2S,3R,4R,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−5−フルオロ−6−メトキシ−テトラヒドロ−ピラン−3,4−ジオール;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−ヒドロキシ−ベンジル)−フェニル]−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4S,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3S,4S,5R)−2−[4−クロロ−3−(4−ヒドロキシ−ベンジル)−フェニル]−ピペリジン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−エタンスルフィニル−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−エタンスルホニル−テトラヒドロ−ピラン−3,4,5−トリオール;
酢酸(2R,3S,4R,5S,6S)−4,5−ジアセトキシ−6−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−2−メチルスルファニル−テトラヒドロ−ピラン−3−イルエステル;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−メタンスルホニル−テトラヒドロ−ピラン−3,4,5−トリオール;
1−{(2S,3S,4S,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−ピペリジン−1−イル}−エタノン;
(2S,3S,4S,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−ピペリジン−1−カルボン酸メチルエステル;
(2S,3S,4S,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−ピペリジン−1−カルボン酸アリルアミド;
(2S,3S,4S,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−1−メチル−ピペリジン−3,4,5−トリオール;
(2S,3S,4R,5R,6R)−2−[3−(4−エトキシ−ベンジル)−フェニル]−6−ヒドロキシメチル−1−メチル−ピペリジン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−(4−クロロ−3−(4−エトキシベンジル)フェニル)−6−メトキシテトラヒドロ−2H−チオピラン−3,4,5−トリオール;
(2S,3S,4R,5R,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−ヒドロキシメチル−ピペリジン−3,4,5−トリオール;
(2S,3S,4R,5R,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−ヒドロキシメチル−1−メチル−ピペリジン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[3−(4−エトキシ−ベンジル)−フェニル]−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(2−ヒドロキシ−エトキシ)−テトラヒドロ−ピラン−3,4,5−トリオール;
(3S,4R,5R,6S)−2−ベンジルオキシ−6−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−(4’−エトキシ−ビフェニル−3−イル)−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(2,2,2−トリフルオロ−エトキシ)−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(2−メトキシ−エトキシ)−テトラヒドロ−ピラン−3,4,5−トリオール
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(2−ジメチルアミノ−エトキシ)−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−プロピルスルファニル−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−イミダゾール−1−イル−テトラヒドロ−ピラン−3,4,5−トリオール;
{(3S,4R,5R,6S)−6−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−テトラヒドロ−ピラン−2−イルオキシ}−酢酸メチルエステル;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(4−メチル−ピペリジン−1−イル)−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(5−メチル−チアゾール−2−イルアミノ)−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−フェノキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
N−{(2S,3S,4R,5R,6S)−6−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−テトラヒドロ−ピラン−2−イル}−N−メチル−アセトアミド;
酢酸(2S,3S,4R,5S,6S)−4,5−ジアセトキシ−6−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−2−メトキシ−テトラヒドロ−ピラン−3−イルエステル;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−エトキシ−フェノキシ)−フェニル]−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−メトキシ−フェニルスルファニル)−フェニル]−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−メトキシ−ベンゼンスルフィニル)−フェニル]−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(3−ヒドロキシ−プロポキシ)−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(2−ヒドロキシ−エチルスルファニル)−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(2−メルカプト−エトキシ)−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(2,3−ジヒドロキシ−プロポキシ)−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−{4−クロロ−3−[4−(2−メトキシ−エトキシ)−ベンジル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−エチルスルファニル−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−メチルスルファニル−テトラヒドロ−ピラン−3,4,5−トリオール;
[2−クロロ−5−((2S,3R,4R,5S,6S)−3,4,5−トリヒドロキシ−6−メトキシ−テトラヒドロ−ピラン−2−イル)−フェニル]−(4−エトキシ−フェニル)−メタノン;
(2S,3R,4R,5S,6S)−2−{4−クロロ−3−[(4−エトキシ−フェニル)−ヒドロキシ−メチル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[3−(4−エトキシ−ベンジル)−4−メチル−フェニル]−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−{4−クロロ−3−[4−(2−メチルスルファニル−エトキシ)−ベンジル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−{4−クロロ−3−[4−(ピリジン−4−イルオキシ)−ベンジル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6S)−2−(4−クロロ−3−{(4−エトキシ−フェニル)−[(Z)−プロピルイミノ]−メチル}−フェニル)−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−{4−クロロ−3−[4−(チアゾール−2−イルオキシ)−ベンジル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−{4−クロロ−3−[4−(ピリミジン−5−イルオキシ)−ベンジル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−{4−クロロ−3−[4−(2,6−ジメトキシ−ピリミジン−4−イルオキシ)−ベンジル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
2−{(2R,3S,4R,5R,6S)−6−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−テトラヒドロ−ピラン−2−イルスルファニル}−アセトアミド;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(フラン−2−イルメチルスルファニル)−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6S)−2−{4−クロロ−3−[(4−エトキシ−フェニル)−イミノ−メチル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6S)−2−{3−[(4−エトキシ−フェニル)−ヒドロキシ−メチル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3S,4S,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−ピペリジン−1−カルボン酸ベンジルエステル;
(2S,3S,4S,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−ピペリジン−1−カルボン酸アリルアミド;
N−(2−{(2R,3S,4R,5R,6S)−6−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−テトラヒドロ−ピラン−2−イルスルファニル}−エチル)−アセトアミド;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(2,2,2−トリフルオロ−エチルスルファニル)−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6S)−2−{4−クロロ−3−[1−(4−エトキシ−フェニル)−1−ヒドロキシ−エチル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
ジメチル−チオカルバミン酸O−{4−[2−クロロ−5−((2S,3R,4R,5S)−3,4,5−トリヒドロキシ−6−メトキシ−テトラヒドロ−ピラン−2−イル)−ベンジル]−フェニル}エステル;
(2S,3R,4R,5S,6S)−2−{3−[1−(4−エトキシ−フェニル)−エチル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
ジエチル−ジチオカルバミン酸(2R,3S,4R,5R,6S)−6−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−テトラヒドロ−ピラン−2−イルエステル;
(2S,3R,4R,5S,6S)−2−(4−クロロ−3−{4−[(R)−(テトラヒドロ−フラン−3−イル)オキシ]−ベンジル}−フェニル)−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−エタンスルフィニル−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−{4−クロロ−3−[4−((S)−1−メチル−ピロリジン−3−イルオキシ)−ベンジル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−{4−クロロ−3−[4−(テトラヒドロ−ピラン−4−イルオキシ)−ベンジル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−(4−クロロ−3−{4−ヒドロキシ−3−[1−(2−メチルアミノ−エチル)−アリル]−ベンジル}−フェニル)−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−{4−クロロ−3−[4−(1−メチル−ピペリジン−4−イルオキシ)−ベンジル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−メタンスルフィニル−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3S,4S,5R)−1−ベンジル−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−ピペリジン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−{3−[4−(2−ベンジルオキシ−エトキシ)−ベンジル]−4−クロロ−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−{3−[4−(2−ヒドロキシ−エトキシ)−ベンジル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−{4−クロロ−3−[4−(2−ヒドロキシ−エトキシ)−ベンジル]−フェニル}−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
2−{(2S,3S,4S,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−ピペリジン−1−イル}−アセトアミド;
(2S,3S,4S,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−1−イソブチル−ピペリジン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(2−メチル−テトラヒドロ−フラン−3−イルスルファニル)−テトラヒドロ−ピラン−3,4,5−トリオール;
(R)−2−アミノ−3−{(2R,3S,4R,5R,6S)−6−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−テトラヒドロ−ピラン−2−イルスルファニル}−プロピオン酸;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−シクロペンチルスルファニル−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−シクロヘキシルスルファニル−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S,6R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−(3−メチル−ブチルスルファニル)−テトラヒドロ−ピラン−3,4,5−トリオール;
(2S,3R,4R,5S)−2−[3−(4−エトキシ−ベンジル)−フェニル]−6−メトキシ−テトラヒドロ−ピラン−3,4,5−トリオール;
1−{(2S,3S,4S,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−ピペリジン−1−イル}−エタノン;
(2S,3S,4S,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−ピペリジン−1−カルボン酸ベンジルエステル;
(2S,3S,4S,5R)−1−ベンジル−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−ピペリジン−3,4,5−トリオール;
2−{(2S,3S,4S,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−3,4,5−トリヒドロキシ−ピペリジン−1−イル}−アセトアミド;
(2S,3S,4S,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−1−イソブチル−ピペリジン−3,4,5−トリオール;
(3S,4R,5R)−2−[4−クロロ−3−(4−エトキシ−ベンジル)−フェニル]−6−ヒドロキシメチル−ピペリジン−3,4,5−トリオール;
及びそれらの薬学的に許容される塩。
【0082】
5.3. 使用方法
本発明は、患者の心血管及び/又は代謝の健康を改善する方法であって、安全かつ有効な量の本発明の二重SGLT1/2阻害剤(すなわち、二重SGLT1/2阻害剤でもある上記5.2節において開示される化合物)を、それを必要とする患者へ投与することを含む、患者の心血管及び/又は代謝の健康を改善する方法を包含する。
【0083】
かかる改善を必要とする患者としては、アテローム動脈硬化症、心血管疾患、糖尿病(1型及び2型)、血液濃縮に関連した障害(例えば、血色素症、真性赤血球増加症)、高血糖症、高血圧、低マグネシウム血症、低ナトリウム血症、脂質障害、肥満症、腎不全(例えば、ステージ1、ステージ2又はステージ3の腎不全)及びX症候群のような疾患又は障害を患う者が挙げられる。特定の患者は、2型真性糖尿病を患っているか、又は2型真性糖尿病を患うリスクがある。
【0084】
本発明の一実施形態では、投与は、患者の空腹時血漿グルコースレベルの(例えば、約50mg/dl、55mg/gl又は60mg/dlを超える)減少をもたらす。一実施形態では、投与は、患者における経口耐糖能の改善をもたらす。一実施形態では、投与は、患者の食後血漿グルコースレベルを低下させる。一実施形態では、投与は、患者の血漿フルクトサミンレベルを(例えば、約30μmol/l、40μmol/l又は50μmol/lよりも多く)低下させる。一実施形態では、投与は、4週間の治療の後に患者のHbA1cレベルを(例えば、約1.0パーセント、1.1パーセント又は1.2パーセントよりも多く)低下させる。一実施形態では、投与は、患者の血圧(例えば、収縮期血圧及び拡張期血圧)を低減させる。一実施形態では、投与は、患者のトリグリセリドレベルを低減させる。
【0085】
特定の実施形態では、患者は、別の治療剤を同時に服用している。他の治療剤としては、抗糖尿病剤、抗高血糖症剤、抗高脂血症剤/脂質低下剤、抗肥満症剤、抗高血圧剤及び食欲抑制薬を含む上述の障害の治療に有用な既知の治療剤が挙げられる。
【0086】
適切な抗糖尿病剤の例としては、ビグアニド(例えば、メトホルミン、フェンホルミン)、グルコシダーゼ阻害剤(例えば、アカルボース、ミグリトール)、インスリン(インスリン分泌促進物質及びインスリン感作物質を含む)、メグリチニド(例えば、レパグリニド)、スルホニル尿素(例えば、グリメピリド、グリブリド、グリクラジド、クロルプロパミド及びグリピジド)、ビグアニド/グリブリドの組合せ(例えば、グルコバンス)、チアゾリジンジオン(例えば、トログリタゾン、ロシグリタゾン及びピオグリタゾン)、PPAR−αアゴニスト、PPAR−γアゴニスト、PPARα/γ二重アゴニスト、グリコーゲンホスホリラーゼ阻害剤、脂肪酸結合タンパク質(aP2)の阻害剤、グルカゴン様ペプチド−1(GLP−1)又はGLP−1受容体の他のアゴニスト、及びジペプチジルペプチダーゼIV(DPP4)阻害剤が挙げられる。
【0087】
メグリチニドの例としては、ナテグリニド(Novartis)及びKAD1229(PF/Kissei)が挙げられる。
【0088】
チアゾリジンジオンの例としては、MitsubishiのMCC−555(米国特許第5,594,016号に開示)、Glaxo-WelcomeのGL−262570、エングリタゾン(CP−68722、Pfizer)、ダルグリタゾン(CP−86325、Pfizer)、イサグリタゾン(MIT/J&J)、JTT−501(JPNT/P&U)、L−895645(Merck)、R−119702(Sankyo/WL)、NN−2344(Dr.Reddy/NN)又はYM−440(Yamanouchi)が挙げられる。
【0089】
PPAR−αアゴニスト、PPAR−γアゴニスト及びPPARα/γ二重アゴニストの例としては、ムラグリチザル(muraglitizar)、ペリグリタザル(peliglitazar)、AR−H039242(Astra/Zeneca)、GW−409544(Glaxo-Wellcome)、GW−501516(Glaxo-Wellcome)、KRP297(Kyorin Merck)、並びにMurakami et al, 、Diabetes 47, 1841-1847(1998)、国際公開第01/21602号及び米国特許第6,653,314号に開示されるものが挙げられる。
【0090】
aP2阻害剤の例としては、米国特許出願第09/391,053号(1999年9月7日に出願された)及び米国特許出願第09/519,079号(2000年5月6日に出願された)に開示されるもの(本明細書中で記述されるような投与量を用いる)が挙げられる。
【0091】
DPP4阻害剤の例としては、シタグリプチン(Janiuvia(商標)、Merck)、ビルダグリプチン(Galvus(商標)、Novartis)、サクサグリプチン(Onglyza(商標)、BMS−477118)、リナグリプチン(BI−1356)、デュトグリプチン(dutogliptin)(PHX1149T)、ゲミグリプチン(LG Life Sciences)、アログリプチン(SYR−322、武田)、国際公開第99/38501号、国際公開第99/46272号、国際公開第99/67279号(PROBIODRUG)、国際公開第99/67278号(PROBIODRUG)及び国際公開第99/61431号(PROBIODRUG)に開示されるもの、Hughes et al, Biochemistry, 38(36), 11597-11603, 1999により開示されるようなNVP−DPP728A(1−[[[2−[(5−シアノピリジン−2−イル)アミノ]エチル]アミノ]アセチル]−2−シアノ−(S)−ピロリジン(Novartis)、TSL−225(トリプトフィル−1,2,3,4−テトラヒドロイソキノリン−3−カルボン酸(Yamada et al, Bioorg. & Med. Chem. Lett. 8 (1998) 1537-1540によって開示)、Ashworth et al, Bioorg. & Med. Chem. Lett., Vol.6, No.22, pp 1163-1166及び2745-2748 (1996)により開示されるような2−シアノピロリジド及び4−シアノピロリジド、米国特許出願第10/899,641号、国際公開第01/868603号及び米国特許第6,395,767号に開示される化合物(上述の参照文献で記述されるような投与量を用いる)が挙げられる。
【0092】
抗高血糖症剤の例としては、グルカゴン様ペプチド−1(GLP−1)、GLP−1(1〜36)アミド、GLP−1(7〜36)アミド、GLP−1(7〜37)(米国特許第5,614,492号に開示されるような)、エクセナチド(Amylin/Lilly)、LY−315902(Lilly)、リラグルチド(NovoNordisk)、ZP−10(Zealand Pharmaceuticals A/S)、CJC−1131(Conjuchem Inc)、及び国際公開第03/033671号に開示される化合物が挙げられる。
【0093】
抗高脂血症剤/脂質低下剤の例としては、MTP阻害剤、HMG CoAレダクターゼ阻害剤、スクアレンシンテターゼ阻害剤、フィブリン酸誘導体、ACAT阻害剤、リポキシゲナーゼ阻害剤、コレステロール吸収阻害剤、Na+/胆汁酸共輸送体阻害剤、LDL受容体活性の上方調節因子、胆汁酸捕捉剤、コレステロールエステル転送タンパク質(例えば、CP−529414(Pfizer)及びJTT−705(Akros Pharma)のようなCETP阻害剤)並びにニコチン酸及びその誘導体が挙げられる。
【0094】
MTP阻害剤の例としては、米国特許第5,595,872号、米国特許第5,739,135号、米国特許第5,712,279号、米国特許第5,760,246号、米国特許第5,827,875号、米国特許第5,885,983号及び米国特許第5,962,440号に開示されるものが挙げられる。
【0095】
HMG CoAレダクターゼ阻害剤の例としては、米国特許第3,983,140号に開示されるようなメバスタチン及び関連化合物、米国特許第4,231,938号に開示されるようなロバスタチン(メビノリン)及び関連化合物、米国特許第4,346,227号に開示されるようなプラバスタチン及び関連化合物、米国特許第4,448,784号及び同第4,450,171号に開示されるようなシムバスタチン及び関連化合物が挙げられる。本明細書中で用いられ得る他のHMG CoAレダクターゼ阻害剤としては、米国特許第5,354,772号に開示されるフルバスタチン、米国特許第5,006,530号及び同第5,177,080号に開示されるようなセリバスタチン、米国特許第4,681,893号、同第5,273,995号、同第5,385,929号及び同第5,686,104号に開示されるようなアトルバスタチン、米国特許第5,011,930号に開示されるようなアタバスタチン(Nissan/Sankyoのニスバスタチン(NK−104))、米国特許第5,260,440号に開示されるようなビサスタチン(Shionogi-Astra/Zeneca(ZD−4522))、及び米国特許第5,753,675号に開示される関連スタチン化合物、米国特許第4,613,610号に開示されるようなメバロノラクトン誘導体のピラゾール類縁体、PCT出願(国際公開第86/03488号)に開示されるようなメバロノラクトン誘導体のインデン類縁体、米国特許第4,647,576号に開示されるような6−[2−(置換−ピロール−1−イル)−アルキル)ピラン−2−オン及びその誘導体、SearleのSC−45355(3−置換ペンタン二酸誘導体)ジクロロアセテート、PCT出願(国際公開第86/07054号)に開示されるようなメバロノラクトンのイミダゾール類縁体、仏国特許第2,596,393号に開示されるような3−カルボキシ−2−ヒドロキシ−プロパン−リン酸誘導体、欧州特許出願第0221025号に開示されるような2,3−二置換ピロール、フラン及びチオフェン誘導体、米国特許第4,686,237号に開示されるようなメバロノラクトンのナフチル類縁体、米国特許第4,499,289号に開示されるようなオクタヒドロナフタレン、欧州特許出願公開第0142146号に開示されるようなメビノリン(ロバスタチン)のケト類縁体、並びに米国特許第5,506,219号及び同第5,691,322号に開示されるようなキノリン及びピリジン誘導体が挙げられるが、これらに限定されない。
【0096】
抗高脂血症剤の例としては、プラバスタチン、ロバスタチン、シムバスタチン、アトルバスタチン、フルバスタチン、セリバスタチン、アタバスタチン及びZD−4522が挙げられる。
【0097】
HMG CoAレダクターゼを阻害するのに有用なホスフィン酸化合物の例としては、英国特許第2205837号に開示されるものが挙げられる。
【0098】
スクアレンシンテターゼ阻害剤の例としては、米国特許第5,712,396号に開示されるα−ホスホノ−スルホネート、Biller et al., J. Med. Chem. 1988, Vol.31, No.10, pp 1869-1871により開示されるもの(イソプレノイド(ホスフィニル−メチル)ホスホネートを含む)、並びに例えば米国特許第4,871,721号及び同第4,924,024号並びにBiller, S.A., et al., Current Pharmaceutical Design, 2, 1-40 (1996)に開示されるような他の既知のスクアレンシンテターゼ阻害剤が挙げられる。
【0099】
本明細書における使用に適した更なるスクアレンシンテターゼ阻害剤の例としては、P. Ortiz de Montellano et al., J. Med. Chem., 1977, 20, 243-249により開示されるテルペノイドピロホスフェート、Corey and Volante, J. Am. Chem. Soc. 1976, 98, 1291-1293により開示されるようなファルネシルジホスフェート類縁体A及びプレスクアレンピロホスフェート(PSQ−PP)類縁体、McClard, R.W. et al., J.A.C.S., 1987, 109, 5544により報告されるホスフィニルホスホネート、並びにCapson, T.L., PhD dissertation, June, 1987, Dept. Med. Chem. U of Utah, Abstract, Table of Contents, pp 16, 17, 40-43, 48-51, Summaryにより報告されるシクロプロパンが挙げられる。
【0100】
本発明の化合物と組み合わせて用いられ得るフィブリン酸誘導体の例としては、フェノフィブレート、ゲムフィブロジル、クロフィブレート、ベザフィブレート、シプロフィブレート、クリノフィブレート等、プロブコール及び関連化合物(米国特許第3,674,836号に開示されるような)(プロブコール及びゲムフィブロジルが好ましい)、コレスチラミン、コレスチポール及びDEAE−セファデックス(セコレックス、ポリセキシド)のような胆汁酸捕捉剤、並びにリポスタビル(Rhone-Poulenc)、Eisai E−5050(N置換エタノールアミン誘導体)、イマニキシル(HOE−402)、テトラヒドロリプスタチン(THL)、イスチグマスタニルホスホリルコリン(SPC、Roche)、アミノシクロデキストリン(田辺製薬)、味の素のAJ−814(アズレン誘導体)、メリナミド(住友)、Sandozの58−035、American CyanamidのCL−277,082及びCL−283,546(二置換尿素誘導体)、ニコチン酸、アシピモックス、アシフラン、ネオマイシン、p−アミノサリチル酸、アスピリン、ポリ(ジアリルメチルアミン)誘導体(米国特許第4,759,923号に開示されるような)、第4級アミンポリ(ジアリルジメチルアンモニウムクロリド)及びイオネン(米国特許第4,027,009号に開示されるような)並びに他の既知の血清コレステロール低下剤が挙げられる。
【0101】
本発明の化合物と組み合わせて用いられ得るACAT阻害剤の例としては、Drug of the Future 24, 9-15 (1999)(アバシミブ);Nicolosi et al., Atherosclerosis(Shannon, Irel). (1998), 137(1), 77-85;Ghiselli, Giancarlo, Cardiovasc. Drug Rev. (1998), 16(1), 16-30;Smith, C., et al., Bioorg. Med. Chem. Lett. (1996), 6(1), 47-50;Krause et al., Editor(s): Ruffolo, Robert R., Jr.;Hollinger, Mannfred A., Inflammation: Mediators Pathways (1995), 173-98, Publisher: CRC, Boca Raton, Fla;Sliskovic et al., Curr. Med. Chem. (1994), 1(3), 204-25;Stout et al., Chemtracts: Org. Chem. (1995), 8(6), 359-62に開示されるもの、又はTS−962(大正製薬株式会社)が挙げられる。
【0102】
抗高脂血症剤の例としては、MD−700(大正製薬株式会社)及びLY295427(Eli Lilly)のようなLD2受容体活性の上方調節因子が挙げられる。
【0103】
コレステロール吸収阻害剤の例としては、SCH48461(Schering-Plough)並びにAtherosclerosis 115, 45-63 (1995)及びJ. Med. Chem. 41, 973 (1998)に開示されるものが挙げられる。
【0104】
回腸Na+/胆汁酸共輸送体阻害剤の例としては、Drugs of the Future, 24, 425-430 (1999)に開示されるような化合物が挙げられる。
【0105】
リポキシゲナーゼ阻害剤の例としては、15−リポキシゲナーゼ(15−LO)阻害剤、例えば国際公開第97/12615号に開示されるようなベンゾイミダゾール誘導体、国際公開第97/12613号に開示されるような15−LO阻害剤、国際公開第96/38144号に開示されるようなイソチアゾロン、並びにSendobry et al., Brit. J. Pharmacology (1997) 120, 1199-1206及びCornicelli et al., Current Pharmaceutical Design, 1999, 5, 11-20に開示されるような15−LO阻害剤が挙げられる。
【0106】
本発明の化合物と組み合わせて使用するのに適した抗高血圧剤の例としては、βアドレナリン遮断薬、カルシウムチャネル遮断薬(L型及びT型、例えば、ジルチアゼム、ベラパミル、ニフェジピン、アムロジピン及びミベフラジル)、利尿薬(例えば、クロロチアジド、ヒドロクロロチアジド、フルメチアジド、ヒドロフルメチアジド、ベンドロフルメチアジド、メチルクロロチアジド、トリクロロメチアジド、ポリチアジド、ベンズチアジド、エタクリン酸トリクリナフェン、クロルタリドン、フロセミド、ムソリミン、ブメタミド、トリアムテン(triamterene)、アミロリド、スピロノラクトン)、レニン阻害剤、ACE阻害剤(例えば、カプトプリル、ゾフェノプリル、フォシノプリル、エナラプリル、セラノプリル、シラゾプリル、デラプリル、ペントプリル、キナプリル、ラミプリル、リシノプリル)、AT−1受容体アンタゴニスト(例えば、ロサルタン、イルベサルタン、バルサルタン)、ET受容体アンタゴニスト(例えば、シタクスセンタン、アトルセンタン並びに米国特許第5,612,359号及び同第6,043,265号に開示される化合物)、二重ET/AIIアンタゴニスト(例えば、国際公開第00/01389号に開示される化合物)、中性エンドペプチダーゼ(NEP)阻害剤、バソペプチダーゼ(vasopeptidase)阻害剤(二重NEP−ACE阻害剤)(例えば、オマパトリラト及びゲモパトリラト)及びニトレートが挙げられる。
【0107】
抗肥満症剤の例としては、β3アドレナリンアゴニスト、リパーゼ阻害剤、セロトニン(及びドーパミン)再取込み阻害剤、甲状腺受容体β薬、5HT2Cアゴニスト(例えば、Arena APD−356);MCHR1アンタゴニスト(例えば、SynapticのSNAP−7941及びTakedaのT−226926)、メラノコルチン受容体(MC4R)アゴニスト、メラニン凝集ホルモン受容体(MCHR)アンタゴニスト(例えば、SynapticのSNAP−7941及びTakedaのT−226926)、ゲラニン受容体モジュレータ、オレキシンアンタゴニスト、CCKアゴニスト、NPY1又はNPY5アンタゴニスト、NPY2及びNPY4モジュレータ、コルチコトロピン放出因子アゴニスト、ヒスタミン受容体−3(H3)モジュレータ、11−β−HSD−1阻害剤、アジノペクチン受容体モジュレータ、モノアミン再取込み阻害剤又は放出剤、毛様体神経栄養因子(CNTF、例えばRegeneronによるAXOKINE)、BDNF(脳由来神経栄養因子)、レプチン及びレプチン受容体モジュレータ、カンナビノイド−1受容体アンタゴニスト(例えば、SR−141716(Sanofi)又はSLV−319(Solvay))及び/又は食欲低下(anorectic)剤が挙げられる。
【0108】
β3アドレナリンアゴニストの例としては、AJ9677(Takeda/Dainippon)、L750355(Merck)若しくはCP331648(Pfizer)又は米国特許第5,541,204号、同第5,770,615号、同第5,491,134号、同第5,776,983号及び同第5,488,064号に開示されるような他の既知のβ3アゴニストが挙げられる。
【0109】
リパーゼ阻害剤の例としては、オルリスタット及びATL−962(Alizyme)が挙げられる。
【0110】
セロトニン(及びドーパミン)再取込み阻害剤(又はセロトニン受容体アゴニスト)の例としては、BVT−933(Biovitrum)、シブトラミン、トピラメート(Johnson & Johnson)及びアキソキン(Regeneron)が挙げられる。
【0111】
甲状腺受容体β化合物の例としては、国際公開第97/21993号(U. Cal SF)、国際公開第99/00353号(KaroBio)及び英国特許第98/284425号(KaroBio)に開示されるもののような甲状腺受容体リガンドが挙げられる。
【0112】
モノアミン再取込み阻害剤の例としては、フェンフルラミン、デクスフェンフルラミン、フルボキサミン、フルオキセチン、パロキセチン、セルトラリン、クロルフェンテルミン、クロフォレックス、クロルテルミン、ピシロレックス、シブトラミン、デキサムフェタミン、フェンテルミン、フェニルプロパノールアミン及びマジンドールが挙げられる。
【0113】
食欲低下剤の例としては、デキサムフェタミン、フェンテルミン、フェニルプロパノールアミン及びマジンドールが挙げられる。
【0114】
5.4. 医薬配合物
本発明は、5.3節で上述したもののような1つ又は複数の第2の活性成分と任意に組み合わせて、1つ又は複数の本発明の二重SGLT1/2阻害剤を含む医薬組成物を包含する。
【0115】
或る特定の医薬組成物は、患者への経口投与に適した単回単位剤形である。経口投与に好適な別々の剤形は、錠剤(例えば、チュアブル錠)、カプレット、カプセル及び液体(例えば、香味付与したシロップ)を含む。このような剤形は所定量の活性成分を含有し、当業者に既知の製薬法によって調製することができる。例えば、Remington's Pharmaceutical Sciences、第18版、(Mack Publishing, Easton PA: 1990)を参照されたい。
【0116】
典型的な経口剤形は、従来の薬学的配合技法に従い、密接な混和物中で活性成分(複数の場合もあり)を少なくとも1つの賦形剤と組み合わせることによって調製する。その投与のしやすさのため、錠剤及びカプセルが最も有益な経口単位剤形である。所望に応じて、錠剤は、標準的な水性又は非水性の技法によってコーティングすることができる。このような剤形は、従来の製薬法により調製することができる。一般に、医薬組成物及び剤形は、活性成分を液体担体、微粉固体担体、又はその両方と均一かつ密接に混和し、次に生成物を必要に応じて所望の形状に成形することによって調製する。崩壊剤は、固体剤形に組み込み、迅速な溶解を容易にすることができる。また、滑沢剤を組み込んで、剤形(例えば、錠剤)の製造を容易にすることができる。
【実施例】
【0117】
6.実施例
6.1 in vitroでのヒトSGLT2阻害アッセイ
ヒトナトリウム/グルコース共輸送体2型(SGLT2:アクセッション番号P31639、GI:400337)を、哺乳動物発現用のpIRESpuro2ベクターへクローニングした(構築物:HA−SGLT2−pIRESpuro2)。
【0118】
HEK293細胞を、ヒトHA−SGLT2−pIRESpuro2ベクターでトランスフェクトして、バルクの安定な細胞株を、0.5μg/mlのピューロマイシンの存在下で選択した。ヒトHA−SGLT2細胞は、10%FBS、1%GPS及び0.5μg/mlのピューロマイシンを含有するDMEM培地中で維持した。
【0119】
ヒトHA−SGLT2を発現するHEK293細胞を、10%FBS、1%GPS及び0.5μg/mlのピューロマイシンを含有するDMEM培地中で384ウェルプレートに播種して(30000個の細胞/ウェル)、続いて37℃、5%CO2で一晩インキュベートした。次に、細胞を取込み緩衝液(140mMのNaCl、2mMのKCl、1mMのCaCl2、1mMのMgCl2、10mMのHEPES、5mMのTris、1mg/mlのウシ血清アルブミン(BSA)、pH7.3)で洗浄した。試験化合物を含む又は含まない取込み緩衝液20マイクロリットルを細胞へ添加した。続いて、14C−AMGを含有する取込み緩衝液(100nCi)20マイクロリットルを細胞へ添加した。細胞プレートを37℃、5%CO2で1時間〜2時間インキュベートした。細胞を取込み緩衝液で洗浄した後、シンチレーション液を添加して(40マイクロリットル/ウェル)、14C−AMG取込みを、シンチレーションコールター(TopCoulter NXT;Packard Instruments)を使用して放射能を計数することにより測定した。
【0120】
6.2 in vitroでのヒトSGLT1阻害アッセイ
ヒトナトリウム/グルコース共輸送体1型(SGLT1:アクセッション番号NP_000334、GI:4507031)を、哺乳動物発現用のpIRESpuro2ベクターへクローニングした(構築物:HA−SGLT1−pIRESpuro2)。
【0121】
HEK293細胞を、ヒトHA−SGLT1−pIRESpuro2ベクターでトランスフェクトして、バルクの安定な細胞株を、0.5μg/mlのピューロマイシンの存在下で選択した。ヒトHA−SGLT1細胞は、10%FBS、1%GPS及び0.5μg/mlのピューロマイシンを含有するDMEM培地中で維持した。
【0122】
ヒトHA−SGLT1を発現するHEK293細胞を、10%FBS、1%GPS及び0.5μg/mlのピューロマイシンを含有するDMEM培地中で384ウェルプレートに播種して(30000個の細胞/ウェル)、続いて37℃、5%CO2で一晩インキュベートした。次に、細胞を取込み緩衝液(140mMのNaCl、2mMのKCl、1mMのCaCl2、1mMのMgCl2、10mMのHEPES、5mMのTris、1mg/mlのウシ血清アルブミン(BSA)、pH7.3)で洗浄した。試験化合物を含む又は含まない取込み緩衝液20マイクロリットルを細胞へ添加した。続いて、14C−AMGを含有する取込み緩衝液(100nCi)20マイクロリットルを細胞へ添加した。細胞プレートを37℃、5%CO2で1時間〜2時間インキュベートした。細胞を取込み緩衝液で洗浄した後、シンチレーション液を添加して(40マイクロリットル/ウェル)、14C−AMG取込みを、シンチレーションコールター(TopCoulter NXT;Packard Instruments)を使用して放射能を計数することにより測定した。
【0123】
6.3 (2S,3R,4R,5S,6R)−2−(4−クロロ−3−(4−エトキシベンジル)フェニル)−6−(メチルチオ)テトラヒドロ−2H−ピラン−3,4,5−トリオールの薬理
2型真性糖尿病を患う患者(n=36)に、1日1回、150mg若しくは300mgとして与えられる(2S,3R,4R,5S,6R)−2−(4−クロロ−3−(4−エトキシベンジル)フェニル)−6−(メチルチオ)テトラヒドロ−2H−ピラン−3,4,5−トリオールの2つの経口用量のうちの1つ、又は適合するプラセボを28日間与えた。予備データにより、プラセボと比較した場合に両方の用量レベルに関して、28日間の投薬期間にわたって重大かつ持続的な糖尿が示された。有害事象は概して穏やかであり、全ての用量群(プラセボを含む)にわたって均一に分布しており、用量制限毒性の証拠は観察されなかった。
【0124】
この研究では、メトホルミンを服用中の患者は、0日目の16日前にその薬物を取りやめて、最初の投薬日を開始した。図1に示されるように、プラセボ群並びに150mg/日及び300mg/日の治療群における患者の空腹時血漿グルコースレベルは、その期間中、増大した。治療後、両方の治療群における患者が、空腹時血漿グルコースレベルの迅速な統計学的に有意な減少を示し、4週目で、プラセボに関する15.1mg/dlと比較して、それぞれ150mg及び300mgの用量群において53.4mg/dl及び65.9mg/dlの低減を伴った。とりわけ、300mgの用量群における患者の実質的なパーセント(42%)は、プラセボと比較して、4週間の投薬で105mg/dl未満の空腹時血漿グルコースレベルを達成した(p=0.0037)。
【0125】
研究の間にわたって、患者の耐糖能を従来の様式で試験した。図2に示されるように、両方の治療群における患者が、プラセボ群における患者よりも高い耐糖能を示した。
【0126】
図3は、患者の平均グルコース血漿レベルの曲線下面積(AUC)を示す。ちょうど1日の治療後に、150mg/日及び300mg/日の両方の治療群が、それらの平均血漿グルコースAUCにおいて統計学的に有意な減少を示した。
【0127】
図4に示されるように、150mg/日及び300mg/日の治療群に対して無作為化した患者が、プラセボと比較して改善されたインスリン感受性を示した。この図は、群の恒常性モデル評価(HOMA)値の概要を提供する。
【0128】
図5に示されるように、両方の治療群における患者が、プラセボと比較して、食後グルコースレベルの迅速な統計学的に有意な減少を示した。
【0129】
フルクトサミン(糖化アルブミン)は多くの場合、血糖の短期制御を評価するのに測定される。図6は、患者の平均血漿フルクトサミンレベルに対する化合物の影響を示す。
【0130】
図7は、糖化ヘモグロビン(ヘモグロビンA1c;HbA1c)レベルにおける患者の平均パーセント変化を示す。HbA1cは、長期間にわたって平均血漿グルコース濃度を特定するのに主として使用されるヘモグロビンの形態である。150mg/日及び300mg/日の治療群に対して無作為化された患者が、それらの平均HbA1cレベルの著しい減少を示した。ちょうど4週間の投薬後に、平均パーセントHbA1cは、プラセボ群における0.49と比較して、150mg用量群では1.15(p=0.036)、及び300mg用量群では1.25(p=0.017)だけ有意に低減した。HbA1cレベルは、両方の用量群における患者の半分に関して7%以下に低減し、ベースラインレベルは、それぞれ150mg群、300mg群及びプラセボ群に関して、8.22%、8.50%及び8.20%であった。
【0131】
驚くべきことに、150mg/日及び300mg/日の治療群における患者はまた、プラセボと比較して、28日間の投薬の後に平均拡張期血圧及び収縮期血圧を減少させた。図8及び図9を参照されたい。また、図10に示されるように、両方の治療群における患者の平均動脈圧もまた減少した。
【0132】
以下で表1に示されるように、化合物の投与はまた、患者の血清トリグリセリドレベルを低下させて、また体重減少をもたらすことが見出された:
【0133】
【表1】

【0134】
これらの結果により、4週の治療期間内で、化合物の投与を受けた患者は、血糖パラメータの改善に関連付けられる血圧制御、減量及びトリグリセリドレベルの改善を示したことが実証される。
【0135】
上で引用した全ての刊行物(例えば、特許及び特許出願)はその全体が、参照により本明細書中に援用される。
【特許請求の範囲】
【請求項1】
糖尿病患者又は前糖尿病患者の心血管又は代謝の健康を改善するのに使用するための、300mg/日又はそれ未満の(例えば、250mg/日、200mg/日、150mg/日、100mg/日若しくは50mg/日、又はそれ未満の)用量の式:
【化1】

(式中、
R1Aはそれぞれ独立して、水素、アルキル、アリール又は複素環であり、
R6はそれぞれ独立して、水素、ヒドロキシル、アミノ、アルキル、アリール、シアノ、ハロゲン、ヘテロアルキル、複素環、ニトロ、C≡CR6A、OR6A、SR6A、SOR6A、SO2R6A、C(O)R6A、CO2R6A、CO2H、CON(R6A)(R6A)、CONH(R6A)、CONH2、NHC(O)R6A、又はNHSO2R6Aであり、
R6Aはそれぞれ独立して、アルキル、アリール又は複素環であり、
R7はそれぞれ独立して、水素、ヒドロキシル、アミノ、アルキル、アリール、シアノ、ハロゲン、ヘテロアルキル、複素環、ニトロ、C≡CR7A、OR7A、SR7A、SOR7A、SO2R7A、C(O)R7A、CO2R7A、CO2H、CON(R7A)(R7A)、CONH(R7A)、CONH2、NHC(O)R7A、又はNHSO2R7Aであり、
R7Aはそれぞれ独立して、アルキル、アリール又は複素環であり、
mは1〜4であり、
nは1〜3であり、
pは0〜2であり、
各アルキル、アリール、ヘテロアルキル又は複素環は、アルコキシ、アミノ、シアノ、ハロ、ヒドロキシル又はニトロのうちの1つ又は複数で必要に応じて置換される)
の二重SGLT1/2阻害剤、又はその薬学的に許容される塩。
【請求項2】
前記改善は、前記患者の空腹時血漿グルコースレベルが、約50mg/dl、55mg/dl又は60mg/dlよりも多く低下することである、請求項1に記載の使用。
【請求項3】
前記改善は、前記患者のHbA1cレベルが、約1.0パーセント、1.1パーセント又は1.2パーセントよりも多く低下することである、請求項1に記載の使用。
【請求項4】
前記改善は、前記患者の血漿フルクトサミンレベルが、約30μmol/l、40μmol/l又は50μmol/lよりも多く低下することである、請求項1に記載の方法。
【請求項5】
改善が前記患者の血圧の低下である、請求項1に記載の使用。
【請求項6】
前記血圧が拡張期血圧である、請求項5に記載の使用。
【請求項7】
前記改善が前記患者のトリグリセリドレベルの低下である、請求項1に記載の使用。
【請求項8】
前記二重SGLT1/2阻害剤が、式:
【化2】

の化合物である、請求項1に記載の使用。
【請求項9】
前記二重SGLT1/2阻害剤が、式:
【化3】

の化合物である、請求項8に記載の使用。
【請求項10】
前記二重SGLT1/2阻害剤が、式:
【化4】

の化合物である、請求項9に記載の使用。
【請求項11】
R7Aがメチル又はエチルである、請求項10に記載の使用。
【請求項12】
R1Aがメチルである、請求項10に記載の使用。
【請求項13】
前記二重SGLT1/2阻害剤が、(2S,3R,4R,5S,6R)−2−(4−クロロ−3−(4−エトキシベンジル)フェニル)−6−(メチルチオ)テトラヒドロ−2H−ピラン−3,4,5−トリオールである、請求項12に記載の使用。
【請求項14】
前記患者が、第2の治療剤を服用したか、又は第2の治療剤を同時に服用しており、該第2の治療剤が、抗糖尿病剤、抗高血糖症剤、抗高脂血症剤/脂質低下剤、抗肥満症剤、抗高血圧剤又は食欲抑制薬である、請求項1に記載の使用。
【請求項15】
前記第2の薬剤がビグアニド(例えば、メトホルミン、フェンホルミン)である、請求項14に記載の使用。
【請求項16】
前記第2の薬剤がDPP−4阻害剤(例えば、シタグリプチン、デュトグリプチン)である、請求項15に記載の使用。
【請求項1】
糖尿病患者又は前糖尿病患者の心血管又は代謝の健康を改善するのに使用するための、300mg/日又はそれ未満の(例えば、250mg/日、200mg/日、150mg/日、100mg/日若しくは50mg/日、又はそれ未満の)用量の式:
【化1】

(式中、
R1Aはそれぞれ独立して、水素、アルキル、アリール又は複素環であり、
R6はそれぞれ独立して、水素、ヒドロキシル、アミノ、アルキル、アリール、シアノ、ハロゲン、ヘテロアルキル、複素環、ニトロ、C≡CR6A、OR6A、SR6A、SOR6A、SO2R6A、C(O)R6A、CO2R6A、CO2H、CON(R6A)(R6A)、CONH(R6A)、CONH2、NHC(O)R6A、又はNHSO2R6Aであり、
R6Aはそれぞれ独立して、アルキル、アリール又は複素環であり、
R7はそれぞれ独立して、水素、ヒドロキシル、アミノ、アルキル、アリール、シアノ、ハロゲン、ヘテロアルキル、複素環、ニトロ、C≡CR7A、OR7A、SR7A、SOR7A、SO2R7A、C(O)R7A、CO2R7A、CO2H、CON(R7A)(R7A)、CONH(R7A)、CONH2、NHC(O)R7A、又はNHSO2R7Aであり、
R7Aはそれぞれ独立して、アルキル、アリール又は複素環であり、
mは1〜4であり、
nは1〜3であり、
pは0〜2であり、
各アルキル、アリール、ヘテロアルキル又は複素環は、アルコキシ、アミノ、シアノ、ハロ、ヒドロキシル又はニトロのうちの1つ又は複数で必要に応じて置換される)
の二重SGLT1/2阻害剤、又はその薬学的に許容される塩。
【請求項2】
前記改善は、前記患者の空腹時血漿グルコースレベルが、約50mg/dl、55mg/dl又は60mg/dlよりも多く低下することである、請求項1に記載の使用。
【請求項3】
前記改善は、前記患者のHbA1cレベルが、約1.0パーセント、1.1パーセント又は1.2パーセントよりも多く低下することである、請求項1に記載の使用。
【請求項4】
前記改善は、前記患者の血漿フルクトサミンレベルが、約30μmol/l、40μmol/l又は50μmol/lよりも多く低下することである、請求項1に記載の方法。
【請求項5】
改善が前記患者の血圧の低下である、請求項1に記載の使用。
【請求項6】
前記血圧が拡張期血圧である、請求項5に記載の使用。
【請求項7】
前記改善が前記患者のトリグリセリドレベルの低下である、請求項1に記載の使用。
【請求項8】
前記二重SGLT1/2阻害剤が、式:
【化2】

の化合物である、請求項1に記載の使用。
【請求項9】
前記二重SGLT1/2阻害剤が、式:
【化3】

の化合物である、請求項8に記載の使用。
【請求項10】
前記二重SGLT1/2阻害剤が、式:
【化4】

の化合物である、請求項9に記載の使用。
【請求項11】
R7Aがメチル又はエチルである、請求項10に記載の使用。
【請求項12】
R1Aがメチルである、請求項10に記載の使用。
【請求項13】
前記二重SGLT1/2阻害剤が、(2S,3R,4R,5S,6R)−2−(4−クロロ−3−(4−エトキシベンジル)フェニル)−6−(メチルチオ)テトラヒドロ−2H−ピラン−3,4,5−トリオールである、請求項12に記載の使用。
【請求項14】
前記患者が、第2の治療剤を服用したか、又は第2の治療剤を同時に服用しており、該第2の治療剤が、抗糖尿病剤、抗高血糖症剤、抗高脂血症剤/脂質低下剤、抗肥満症剤、抗高血圧剤又は食欲抑制薬である、請求項1に記載の使用。
【請求項15】
前記第2の薬剤がビグアニド(例えば、メトホルミン、フェンホルミン)である、請求項14に記載の使用。
【請求項16】
前記第2の薬剤がDPP−4阻害剤(例えば、シタグリプチン、デュトグリプチン)である、請求項15に記載の使用。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公表番号】特表2013−521293(P2013−521293A)
【公表日】平成25年6月10日(2013.6.10)
【国際特許分類】
【出願番号】特願2012−556154(P2012−556154)
【出願日】平成23年3月1日(2011.3.1)
【国際出願番号】PCT/US2011/026591
【国際公開番号】WO2011/109333
【国際公開日】平成23年9月9日(2011.9.9)
【出願人】(508192566)レクシコン ファーマシューティカルズ インコーポレイテッド (38)
【Fターム(参考)】
【公表日】平成25年6月10日(2013.6.10)
【国際特許分類】
【出願日】平成23年3月1日(2011.3.1)
【国際出願番号】PCT/US2011/026591
【国際公開番号】WO2011/109333
【国際公開日】平成23年9月9日(2011.9.9)
【出願人】(508192566)レクシコン ファーマシューティカルズ インコーポレイテッド (38)
【Fターム(参考)】
[ Back to top ]

