糖鎖修飾核酸及びその使用
【課題】インフルエンザウイルスに対して、ウイルス変異の影響を受けることなく結合定数の高い抗インフルエンザ剤を提供する。
【解決手段】糖と核酸がリンカーを介して結合しており、糖としてシアル酸を含むことを特徴とする糖修飾核酸による。糖としてシアル酸を含むことを特徴とする糖修飾核酸により、インフルエンザウイルスのHAの糖鎖結合サイトの構造を考慮した分子設計を比較的容易に行うことができる。インフルエンザウイルスのHAのシアル酸と結合する部位はほとんどアミノ酸残基が変異しないことから、ウイルス変異の影響を受けることなく結合定数の高い抗インフルエンザ剤を提供することができる。
【解決手段】糖と核酸がリンカーを介して結合しており、糖としてシアル酸を含むことを特徴とする糖修飾核酸による。糖としてシアル酸を含むことを特徴とする糖修飾核酸により、インフルエンザウイルスのHAの糖鎖結合サイトの構造を考慮した分子設計を比較的容易に行うことができる。インフルエンザウイルスのHAのシアル酸と結合する部位はほとんどアミノ酸残基が変異しないことから、ウイルス変異の影響を受けることなく結合定数の高い抗インフルエンザ剤を提供することができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、糖鎖修飾核酸及び当該糖鎖修飾核酸の製造方法に関する。さらには、当該糖鎖修飾核酸を含む薬剤、検査方法並びにキットに関する。
【背景技術】
【0002】
インフルエンザウイルスは、パンデミックが最も危惧されているウイルスであり、シアリダーゼ(ノイラミニダーゼ:NA)という酵素とヘマグルチニン(HA)というタンパク質によって覆われている。NAの酵素活性を阻害するのが、現在の治療薬の主流である、タミフル(商品名)である。また、HAはワクチンとして、またHAに結合する抗体は、フィルターなどに固定化することによりウイルスの除去シートなどとして市販されている。しかし、このウイルスの変異速度は非常に早いため、NAやHAの構造が時間と共に変わっていくことが、インフルエンザの予防、診断、治療を困難にしている。
【0003】
一方、NAやHAが変異によってその全体の構造が変化していく中で、HAのシアル酸と結合する部位はほとんどアミノ酸残基が変異しないことが知られている。そこで,この変異の少ないHAのシアル酸結合部位に注目することにより、あらゆる型のインフルエンザウイルスに対して予防、診断、治療が可能な材料が作製可能であると考えられる。
【0004】
シアル酸含有複合糖鎖であるシアリルラクトースは、A型インフルエンザのレセプターとして知られており、A型インフルエンザの感染予防剤として期待されている(非特許文献1)。しかし、シアリルラクトースのインフルエンザウイルスに対する付着阻止効果は、単位容積当たりシアリルラクトース0.1 %以上と極めて高い投与でなければ発揮されない。
【0005】
シアリル酸などの糖鎖によるインフルエンザ感染阻止作用に対する試みは多く報告されている。例えば、シアリルラクトースをポリスチレンに結合させたもの(特許文献1、非特許文献2)、γ‐ポリグルタミン酸にシアロ糖鎖を結合させたシアロ糖鎖含有ポリマー(特許文献2)、ポリアクリルアミドなどのポリマーにα‐シアロシドグループを結合させたもの(非特許文献3)、シアリルラクトースをポリペプチドに結合させたもの(非特許文献4)、シアリルラクトースをカルボシランをコアとするデンドリマー構造としたもの(非特許文献5)、シアル酸を含むポリバレント抗ウイルス阻害剤(非特許文献6)などが挙げられる。しかしながら、上記については、分子量の制御、糖鎖の数、糖鎖の配向を制御することが合成上困難である。また、ポリスチレンやポリアクリルアミドなどの合成高分子に共有結合させた糖鎖修飾合成高分子の場合は、高濃度で使用すると生体毒性を示す危険性がある。
【0006】
糖修飾核酸の製造方法として、任意の位置が選択的に糖で置換された、新規なオリゴヌクレオチド糖コンジュゲートの製造方法について開示がある(特許文献3)。ここで開示される糖修飾核酸は、糖とウリジンがスペーサーを介して結合している糖結合ウリジンである。また、糖としては、ガラクトースが開示されている。しかしながら、シアル酸で修飾した核酸についての報告はない。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開平10-310610号公報
【特許文献2】特開2008-31156号公報
【特許文献3】特開2001-247596号公報
【非特許文献】
【0008】
【非特許文献1】Nature, 333, pp. 426-431 (1988)
【非特許文献2】Glycoconjugate Journal 15, 1047-1054 (1998)
【非特許文献3】J. Med. Chem., 37, 3419-3433 (1994)
【非特許文献4】Angew. Chem. Int. Ed., 42, 5186-5189 (2003)
【非特許文献5】Bioorganic & Medicinal Chemistry letters, 18, 4405-4408 (2008)
【非特許文献6】Med. Chem. Res., 18, 477-494 (2009)
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、インフルエンザウイルスに対して、ウイルス変異の影響を受けることなく結合定数の高い抗インフルエンザ剤を提供することを課題とする。
【課題を解決するための手段】
【0010】
本発明者らは、HAのシアル酸と結合する部位は、ほとんどアミノ酸残基が変異しないことに着目し、上記課題を解決するために鋭意検討を重ねた結果、糖と核酸がリンカーを介して結合しており、糖としてシアル酸を含むことを特徴とする糖修飾核酸により、インフルエンザウイルスのHAの糖鎖結合サイトの構造を考慮した分子設計を比較的容易に行うことができ、ウイルス変異の影響を受けることなく結合定数の高い抗インフルエンザ剤を提供できることを見出し、本発明を完成した。
【0011】
すなわち本発明は、以下よりなる。
1.糖と核酸がリンカーを介して結合しており、糖としてシアル酸を含むことを特徴とする、糖修飾核酸。
2.前記糖が、シアリルラクトースである、前項1に記載の糖修飾核酸。
3.前記シアリルラクトースが、2-6型シアリルラクトース又は2-3型シアリルラクトースである、前項2に記載の糖修飾核酸。
4.前項1〜3のいずれか1に記載の糖修飾核酸を含む糖修飾オリゴヌクレオチド。
5.前項1〜3のいずれか1に記載の糖修飾核酸、あるいは前項4に記載の糖修飾オリゴヌクレオチドを有効成分として含む抗インフルエンザ剤。
6.抗インフルエンザ剤が、インフルエンザ治療剤又はインフルエンザウイルス捕捉剤である、前項5に記載の抗インフルエンザ剤。
7.以下の工程を含む、前項1〜3のいずれか1に記載の糖修飾核酸の製造方法:
1)シアル酸誘導体修飾アクリルアミドを合成する工程;
2)前記シアル酸誘導体修飾アクリルアミドをパラジウム触媒を用いてヌクレオシド3リン酸に付加する工程。
8.前項1〜3のいずれか1に記載の糖修飾核酸、基質としてのdNTP及びDNAポリメラーゼを少なくとも用いることを特徴とする、前項4に記載の糖修飾オリゴヌクレオチドの製造方法。
9.核酸増幅方法により作製される前項8に記載の糖修飾オリゴヌクレオチドの製造方法。
10.前項1〜3のいずれか1に記載の糖修飾核酸、基質としてのdNTP及びDNAポリメラーゼを少なくとも含む、前項4に記載の糖修飾オリゴヌクレオチド作製用キット。
【発明の効果】
【0012】
本発明の糖修飾核酸を用いて、糖修飾オリゴヌクレオチドを作製することができる。この場合は、テンプレート(鋳型DNA)の塩基配列に応じて、導入する糖鎖の数や立体的な位置を制御することができるので、インフルエンザウイルスHAの糖鎖結合サイトの構造を考慮した分子設計を行うことができる。また、実際にオリゴヌクレオチドへの糖残基の導入は、DNAポリメラーゼを用いて行うため、糖修飾オリゴヌクレオチドの合成及び精製を容易に行うことができる。本発明の糖修飾核酸及び糖修飾オリゴヌクレオチドは、インフルエンザウイルスのHAとトリ赤血球の反応による赤血球凝集反応に対して、強い阻害活性を有する。さらに、本発明の糖修飾核酸は、生体内において、最終的には生体内のヌクレアーゼで分解されるため、生体毒性がほとんどないことが期待される。
【図面の簡単な説明】
【0013】
【図1】シアル酸修飾核酸の合成スキームを示す図である。(実施例1−1)
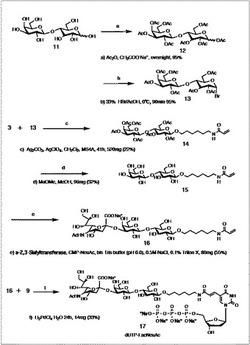
【図2】シアリルラクトース修飾核酸の合成スキームを示す図である。(実施例2−1)
【図3】DNAポリメラーゼによるオリゴヌクレオチドへの糖修飾核酸の導入模式図である。
【図4】糖修飾オリゴヌクレオチド作製に用いたテンプレート(鋳型DNA)を示す図である。(実施例1−2)
【図5】糖修飾オリゴヌクレオチドへのシアル酸修飾核酸の導入を、電気泳動により確認した写真図である。(実験例1−2)
【図6】シアリルラクトース酸修飾核酸の、インフルエンザウイルスのHAとトリ赤血球の反応による赤血球凝集反応に対する阻害活性を示す図である。(実験例2−1)
【図7】シアリルラクトース酸修飾オリゴヌクレオチドの、インフルエンザウイルスのHAとトリ赤血球の反応による赤血球凝集反応に対する阻害活性を示す図である。(実験例2−2)
【発明を実施するための形態】
【0014】
本発明は、糖と核酸がリンカーを介して結合しており、糖としてシアル酸を含むことを特徴とする、糖修飾核酸に関する。
【0015】
前記糖は、シアル酸又はシアリルラクトースとすることができる。また、糖がシアリルラクトースの場合は、2-6型シアリルラクトース又は2-3型シアリルラクトースとすることができる。ヒト由来のインフルエンザウイルスのHAは、シアル酸とラクトース(Galβ1→4Glc)とがα2→6結合したもの、即ち「2-6型シアリルラクトース」を認識し、トリ由来のインフルエンザウイルスのHAは、同様にα2→3結合したもの、即ち「2-3型シアリルラクトース」を認識することが知られている。従って、本発明の糖修飾核酸における糖がシアリルラクトースの場合、その型は、必要に応じて適宜選択することができる。
【0016】
前記核酸は、デオキシリボヌクレオチド、リボヌクレオチド、人工核酸のいずれであってもよく、特に限定されず、用途により適宜選択することができる。例えば、当該糖修飾核酸をインフルエンザ治療薬のように、生体に用いる場合には、適当な時期にヌクレアーゼなどによって分解される天然型の核酸が好ましい。また、当該糖修飾核酸を、フィルターやマスクなどの固相担体に固相化する場合などは、安定性の優れた人工核酸を用いてもよい。当該核酸に含まれる塩基の型は、ピリミジン塩基であってもよいし、プリン塩基であってもよいが、好ましくはピリミジン塩基である。従って、核酸を構成するヌクレオシドとしては、例えばウリジン、チミジン、シチジンが挙げられ、特に好適にはウリジンが挙げられる。
【0017】
前記リンカーは、糖と核酸を結合させるものであり、柔らかい構造を賦与してフレキシビリティーを持たせる作用を有するもので、疎水性であることが好ましい。例えば、炭素数1から10のアルカン、エーテル、エステル又はアミドなどが挙げられ、芳香族系炭化水素などを含んでいてもよい。好ましいリンカーの例としては、エタン、プロパン、n−ブタン、n−ペンタン、n−ヘキサン等の直鎖状アルカン、及びエチレングリコールなどが挙げられる。
【0018】
本発明の糖修飾核酸の例として、具体的には以下の式(I)〜式(III)に示す化合物が挙げられる。各式で表される化合物は、各々トランス体、シス体又は単結合体のいずれであってもよい。
【0019】
【化1】

【0020】
【化2】

【0021】
【化3】

【0022】
本発明の修飾核酸の製造方法は、図1又は図2に記載の合成方法によることができる。本発明の修飾核酸の合成方法において、必須の工程は、シアル酸誘導体修飾アクリルアミドを合成する工程、及びこのシアル酸誘導体修飾アクリルアミドをパラジウム触媒を用いてヌクレオシド3リン酸に付加する工程である。この反応の生成物として、アクリルアミド部分の二重結合に対して (a)トランス体と(b)シス体の2種類の化合物が生成されうる。図1及び図2で示した(a)トランス体の化合物を得るためには、遮光下、特に300 nmの波長以下の光の遮断下で反応を進行させることが必須である。一方、300 nm以下の光の照射下でこの反応を行うと、90 %以上がシス体として得られる。また、トランス体、シス体いずれの状態であっても、この二重結合部分を水素還元して単結合に変換することもできる。このように、シアル酸と核酸塩基をつなぐリンカー部分が(a)トランス体、(b)シス体、(c)単結合の構造を選択的に合成することが可能である。このリンカー部分の構造の違いにより、(1)DNAポリメラーゼによる導入効率、(2)インフルエンザウイルスのHAサイトとの親和性の大小を制御することができる。
【0023】
上記により作製した本発明の糖修飾核酸を用いて、糖修飾オリゴヌクレオチドを製造することができる。本発明の糖修飾オリゴヌクレオチドは、DNAポリメラーゼを用いて合成することができる(図3参照)。例えば、基質としての本発明の糖修飾核酸及びdNTPを基にして、DNAポリメラーゼを用いて製造することができる。具体的には、鋳型DNAを基にして、核酸増幅方法により合成することができる。核酸増幅方法については、特に限定されないが、例えばPCR(Polymerase Chain Reaction)法、LAMP法、TMA(Transcription Mediated Amplification)法、NASBA(Nucleic Acid Sequence-Based Amplification)法や、LCR(Ligase Chain Reaction)法などが挙げられ、特にPCR法やLAMP法などが好適に用いられる。このような核酸増幅方法により、所望の配列のオリゴヌクレオチドを作製することができる。例えば、鋳型DNAにおいて、糖鎖修飾核酸に対する相補的なヌクレオチドを所望の位置に配置させることで、増幅されたオリゴヌクレオチドには、所望の位置に糖修飾核酸を配置させることができる。本発明における糖修飾オリゴヌクレオチドの長さは、約15〜1000塩基長、好ましくは約15〜200塩基長、より好ましくは約20〜90塩基長とすることができる。また、本発明の糖修飾オリゴヌクレオチドには、約1〜70個、好ましくは約1〜15個の糖修飾核酸を含ませることができる。
【0024】
本発明は、上記糖修飾オリゴヌクレオチドの製造方法にも及ぶ。本発明の糖修飾オリゴヌクレオチド製造方法では、本発明の糖修飾核酸、基質としてのdNTP及びDNAポリメラーゼを少なくとも用いることを特徴とする。DNAポリメラーゼとしては、自体公知のものを使用することができ、例えば市販のDNAポリメラーゼとして、KOD Dash(R)(東洋紡)やVent(R)(exo-) DNA ポリメラーゼ(New England BioLabs)のようなFamily B型に属する多くの種類の酵素を使用することができる。
【0025】
オリゴヌクレオチドの製造は、具体的には、上述の核酸増幅方法によることができる。核酸増幅方法に使用する鋳型DNAとしてのオリゴヌクレオチドは、既存のオリゴヌクレオチドを使用することもできるし、所望の位置に本発明の糖修飾核酸を配置しうるように、適宜設計することもできる。そのような鋳型DNAとしてのオリゴヌクレオチドは、オリゴヌクレオチド合成装置を用いるなど、自体公知の方法により作製することができる。
【0026】
インフルエンザウイルスのHAとシアリルラクトースの結合定数は、102〜103 M-1程度であることが知られている(非特許文献2参照)。それに対し、本発明の糖修飾核酸は、核酸塩基、リンカーとの共同的相互作用により、単なるシアル酸やシアリルラクトースに比べて、インフルエンザウイルスのHAに対して強く結合しうる。例えば、ウリジンとシアリルラクトースを炭素数6のメチレン基リンカーで結合した糖修飾核酸(dUTP-NeuAcLac)の場合は、単量体で105 〜106 M-1程度の結合定数を示す。さらに、上記の糖修飾オリゴヌクレオチドのように、複数個の複数個オリゴヌクレオチドに配置させることで、より効果的にHAに対して強く結合し、HAの立体構造を考慮しながら糖修飾核酸を合成することで、さらに効果的に結合させることも可能と考えられる。
【0027】
さらに、本発明は糖修飾オリゴヌクレオチド作製用キットにも及ぶ。当該キットには、本発明の糖修飾核酸、基質としてのdNTP及びDNAポリメラーゼを少なくとも含む。さらには、鋳型DNAとしてのオリゴヌクレオチドや必要な緩衝液等を適宜含めることができる。
【0028】
本発明は、上記糖修飾核酸を含む糖修飾オリゴヌクレオチドに及び、さらには糖修飾核酸あるいは糖修飾オリゴヌクレオチドを有効成分として含む抗インフルエンザ剤にも及ぶ。抗インフルエンザ剤としては、例えばインフルエンザ治療剤やインフルエンザウイルス捕捉剤が挙げられる。インフルエンザ治療剤の場合は、生体内でインフルエンザウイルスのHAと結合し、インフルエンザウイルスが細胞内に侵入するのを阻止することができる。また、インフルエンザウイルス捕捉剤としては、生体内に限らず当該ウイルスを捕捉することができる。例えば、本発明の糖修飾核酸あるいは糖修飾オリゴヌクレオチドをフィルター等に固定することで、インフルエンザウイルスを除去する材料とすることができる。また、本発明の糖修飾核酸あるいは糖修飾オリゴヌクレオチドをマスク等の材料に固定することで、外部からのインフルエンザウイルスの侵入を阻止したり、例えばインフルエンザウイルスの感染患者から外部へウイルスが飛散するのを阻止することができる。
【0029】
本発明の糖修飾核酸又は糖修飾オリゴヌクレオチドを有効成分として含む抗インフルエンザ剤は、インフルエンザ治療薬又はインフルエンザ捕捉剤等の用途に応じて、糖修飾核酸又は糖修飾オリゴヌクレオチドとともに、適宜必要な添加剤等を含めることができる。
【0030】
インフルエンザ治療薬とする場合は、必要な添加剤、即ち薬学的に許容しうる添加剤を混和し製剤化して使用することができる。上記添加剤としては、一般に医薬に使用される、賦形剤、結合剤、滑沢剤、崩壊剤、着色剤、矯味矯臭剤、乳化剤、界面活性剤、溶解補助剤、懸濁化剤、等張化剤、緩衝剤、防腐剤、抗酸化剤、安定化剤、吸収促進剤等を挙げることができ、所望により、これらを適宜組み合わせて使用することもできる。
【0031】
以下に上記添加剤の例を挙げる。賦形剤としては、例えば乳糖、白糖、ブドウ糖、コーンスターチ、マンニトール、ソルビトール、デンプン、α化デンプン、デキストリン、結晶セルロース、軽質無水ケイ酸、ケイ酸アルミニウム、ケイ酸カルシウム、メタケイ酸アルミン酸マグネシウム、リン酸水素カルシウムが挙げられる。
【0032】
結合剤としては、例えばポリビニルアルコール、メチルセルロース、エチルセルロース、アラビアゴム、トラガント、ゼラチン、シェラック、ヒドロキシプロピルメチルセルロース、ヒドロキシプロピルセルロース、カルボキシメチルセルロースナトリウム、ポリビニルピロリドン、マクロゴールが挙げられる。滑沢剤としては、ステアリン酸マグネシウム、ステアリン酸カルシウム、フマル酸ステアリルナトリウム、タルク、ポリエチレングリコール、コロイドシリカが挙げられる。崩壊剤としては、結晶セルロース、寒天、ゼラチン、炭酸カルシウム、炭酸水素ナトリウム、クエン酸カルシウム、デキストリン、ペクチン、低置換度ヒドロキシプロピルセルロース、カルボキシメチルセルロース、カルボキシメチルセルロースカルシウム、クロスカルメロースナトリウム、カルボキシメチルスターチ、カルボキシメチルスターチナトリウムが挙げられる。着色剤としては三二酸化鉄、黄色三二酸化鉄、カルミン、カラメル、β−カロチン、酸化チタン、タルク、リン酸リボフラビンナトリウム、黄色アルミニウムレーキ等、医薬品に添加することが許可されているものが挙げられる。
【0033】
矯味矯臭剤としては、ココア末、ハッカ脳、芳香散、ハッカ油、竜脳、桂皮末が挙げられる。乳化剤又は界面活性剤としては、ステアリルトリエタノールアミン、ラウリル硫酸ナトリウム、ラウリルアミノプロピオン酸、レシチン、モノステアリン酸グリセリン、ショ糖脂肪酸エステル、グリセリン脂肪酸エステルが挙げられる。溶解補助剤としては、ポリエチレングリコール、プロピレングリコール、安息香酸ベンジル、エタノール、コレステロール、トリエタノールアミン、炭酸ナトリウム、クエン酸ナトリウム、ポリソルベート80、ニコチン酸アミドが挙げられる。懸濁化剤としては、前記界面活性剤のほか、例えばポリビニルアルコール、ポリビニルピロリドン、メチルセルロース、ヒドロキシメチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース等の親水性高分子が挙げられる。
【0034】
等張化剤としては、ブドウ糖、塩化ナトリウム、マンニトール、ソルビトールが挙げられる。緩衝剤としてはリン酸塩、酢酸塩、炭酸塩、クエン酸塩などの緩衝液が挙げられる。防腐剤としてはメチルパラベン、プロピルパラベン、クロロブタノール、ベンジルアルコール、フェネチルアルコール、デヒドロ酢酸、ソルビン酸が挙げられる。抗酸化剤としては硫酸塩、アスコルビン酸、α−トコフェロールが挙げられる。安定化剤としては一般に医薬に使用されるものが挙げられる。吸収促進剤としては一般に医薬に使用されるものが挙げられる。また、必要に応じて、ビタミン類、アミノ酸等の成分を配合してもよい。
【0035】
また、上記製剤としては、錠剤、散剤、顆粒剤、細粒剤、カプセル剤、シロップ剤、トローチ剤、吸入剤等の経口剤;坐剤、軟膏剤、眼軟膏剤、テープ剤、点眼剤、点鼻剤、点耳剤、パップ剤、ローション剤等の外用剤又は注射剤を挙げることができる。上記経口剤は、上記添加剤を適宜組み合わせて製剤化することができる。なお、必要に応じてこれらの表面をコーティングしてもよい。上記外用剤は、上記添加剤のうち、特に賦形剤、結合剤、矯味矯臭剤、乳化剤、界面活性剤、溶解補助剤、懸濁化剤、等張化剤、防腐剤、抗酸化剤、安定化剤又は吸収促進剤を適宜組み合わせて製剤化することができる。上記注射剤は、上記添加剤のうち、特に乳化剤、界面活性剤、溶解補助剤、懸濁化剤、等張化剤、緩衝剤、防腐剤、抗酸化剤、安定化剤又は吸収促進剤を適宜組み合わせて製剤化することができる。
【0036】
また、インフルエンザ治療薬として使用する場合は、糖修飾核酸の投与量は適宜決定することができる。例えばヒトに投与する場合、投与量や投与方法は適宜決定することができる。好ましい投与量は、糖修飾核酸として、成人(体重60 kg)あたり、通常、10〜1000 mg/日であり、好ましくは15〜700 mg/日であり、さらに好ましくは30〜300 mg/日(例えば200 mg/日)である。投与量及び投与期間は、炎症の治療効果と患者の状態を勘案しながら、適宜設定することができる。
【0037】
インフルエンザ捕捉剤として、生体外で使用する場合は、上述の他、フィルター、マスク材料、固相などの固相担体に、糖修飾核酸あるいは糖修飾オリゴヌクレオチドを適宜固相化することもできる。これらの固相化の方法は、核酸やオリゴヌクレオチドの固相方法に準じて固相化することができる。
【実施例】
【0038】
本発明の理解を深めるために、以下の実施例により更に詳細に説明するが、本発明はこれら実施例に限定されるものではないことは明らかである。
【0039】
(実施例1−1)シアル酸修飾核酸(dUTP-NeuAc)の合成
図1の化合物3から10の詳細な合成方法を以下に示す。
【0040】
1)6-(N-アクロイルアミノ)ヘキサン-1-オール(3)の合成
ジクロロメタン100 mlにトリエチルアミン9.58 g (94.7 mmol)、6-アミノ-1-ヘキサノール 4.96 g (42.3 mmol)を入れ、ジクロロメタン70 mlで溶解させたアクリル酸クロリド11.52 g (127.3 mmol)を滴下し、室温で24時間撹拌した。反応液をクロロホルムで希釈し、1 M NaHCO3 50 ml×1と蒸留水50 ml×2で洗浄した。有機層からクロロホルムを減圧留去後の固体に99.5 %エタノール50 mlを加え、続けて2 M NaOH 30 mlを加え1 時間撹拌した。反応溶液を減圧留去し、得られた固体をフラッシュカラムクロマトグラフィーにより、酢酸エチルで溶出し、白色固体を得た。(収量:4.48 g、収率:62 %)
【0041】
1H-NMR (500 MHz; CDCl3): δ 6.27 (dd, J = 17.0, 1.4 Hz, 1H), 6.10 (dd, J = 17.0, 10.3 Hz, 1H), 5.89 (br, 1H), 5.63 (dd, J = 10.3, 1.4 Hz, 1H), 3.63 (t, J = 6.5 Hz, 1H), 3.33 (q, J = 6.6 Hz, 1H), 1.60-1.51 (m, 4H), 1.44-1.32 (m, 4H); 13C-NMR (126 MHz; CDCl3): δ 165.67, 130.90, 126.22 62.57, 39.37, 32.47, 29.50, 26.47, 25.24
【0042】
2)メチル 4,7,8,9-テトラ-O-アセチル-2-クロロ-2-デオキシ-D-ノイラミネート(5)の合成
氷浴下でメチルN-アセチβ- D -ノイラミネート(4)1.96 g(6.06 mmol)にアセチルクロリド25 g(319 mmol)を加え、24時間後反応させた。アセチルクロリドを減圧留去し、発泡性のある褐色粘稠体を得た。この褐色粘稠体をベンゼンに溶かして攪拌したn-ヘキサン溶液に滴下し、生成した沈殿を回収した。(収量:2.87g、収率:87 %)
【0043】
1H-NMR (500 MHz; CDCl3): δ 5.55 (d, JNH,5 = 10.1 Hz, 1H,NH), 5.48 (dd, J7,8 = 6.9, J7,6 = 2.2 Hz, 1H, 7-H), 5.40 (ddd, J4,3ax = 11.9, J4, 5 = 10.8, J4,3eq = 4.8 Hz, 1H, 4-H), 5.18 (ddd, J8,7 = 6.9 Hz, J8,9b = 5.9 Hz, J8,9a = 2.7 Hz, 1H, 8-H), 4.44 (dd, J9a,9b = 12.5, J9a,8 = 2.5 Hz, 1H, 9a-H), 4.36 (dd, J6, 5= 10.8, J6, 7= 2.2 Hz, 1H, 6-H), 4.22 (ddd, J = 10.4, 10.4, 10.4 Hz, 1H), 4.07 (dd, J9b,9a = 12.5 Hz, J9b,8 = 5.8 Hz Hz, 1H, 9b-H), 3.88 (s, 3H, CO2CH3), 2.79 (dd, J3eq, 3ax = 13.9 Hz, J3eq, 4 = 4.7 Hz, 1H, 3eq-H), 2.28 (dd, J3ax, 3eq = 13.8 Hz, J3ax, 4 = 11.3 Hz, 1H, 3ax-H), 2.13, 2.08, 2.06, 2.05 (4×s, 12H, 4×OAc), 1.91 (s, 3H, NAc); 13C-NMR (126 MHz; CDCl3): δ 170.93, 170.60, 170.34, 169.91, 169.63, 165.58, 96.57, 73.87, 69.90, 68.72, 66.83, 62.03, 53.76, 48.73, 40.62, 23.10, 20.90, 20.79, 20.75, 20.72
【0044】
3)6-(N-アクロイルアミノ)ヘキシル メチル(5-アセタミド-4,7,8,9-テトラ-O-アセチル-3,5-ジデオキシ-D-グリセロ-α-D-ガラクト-2-ノニュロピラノシル)オネート(6)の合成
脱水ジクロロメタンに、メチル 4,7,8,9-テトラ-O-アセチル-2-クロロ-2-デオキシ-D-ノイラミネート(5)1.00 g(1.96mmol)、6-(N-アクロイルアミノ)ヘキサン-1-オール(3)0.480 g(2.80mmol、1.43eq)、サリチル酸銀0.930 g(3.80 mmol、1.94 eq)を加え、室温で5 日間(111時間)反応させた。反応溶液をセライト濾過し、ジクロロメタンを減圧留去した。クロロホルム:メタノール=100:0から99:1のグラジエント溶出によるフラッシュカラムクロマトグラフィー精製を行い、褐色粘稠体を得た。(収量:308 mg、収率:23 %)
【0045】
1H-NMR (500 MHz; CDCl3): δ 6.28 (dd, J = 17.0, 1.1 Hz, 1H), 6.10 (dd, J = 17.0, 10.3 Hz, 1H), 6.00 (br, 1H), 5.62 (dd, J = 10.3, 1.2 Hz, 1H), 5.39 (ddd, J = 8.3, 5.9, 2.4 Hz, 1H), 5.33-5.24 (m, 2H), 4.87-4.81 (m, 1H), 4.34 (dd, J = 12.4, 2.5 Hz, 1H), 4.10 (s, 1H), 4.07 (dd, J = 12.3, 6.0 Hz, 2H), 3.80 (s, 3H), 3.74 (ddd, J = 9.1, 6.7 Hz, 1H), 3.34 (q, J = 6.3 Hz, 2H), 3.22 (ddd, J = 9.2, 6.7 Hz, 1H), 2.58 (dd, J = 12.8, 4.6 Hz, 1H), 2.15 (s, 2H), 2.14 (s, 2H), 2.04 (s, 3H), 2.03 (s, 3H), 1.95 ( J = 12.6 Hz, 1H), 1.89 (s, 3H), 1.60-1.55 (m, 4H), 1.46-1.27 (m, 4H); 13C-NMR (125.8 MHz; CDCl3): δ 171.0, 170.8, 170.30, 170.21, 168.5, 165.6, 131.0, 126.1, 98.7, 72.4, 69.1, 68.6, 67.4, 64.8, 62.5, 52.6, 49.5, 39.4, 38.0, 29.3, 26.3, 25.4, 23.2, 21.1, 20.83, 20.76
【0046】
4)6-(N-アクロイルアミノ)ヘキシル 5-アセタミド-3,5-ジデオキシ-D-グリセロ-α-D-ガラクト-2-ノニュロピラノソ酸(7)の合成
MeOH 3.0 mlに6-(N-アクロイルアミノ)ヘキシル メチル(5-アセタミド-4,7,8,9-テトラ-O-アセチル-3,5-ジデオキシ-D-グリセロ-α-D-ガラクト-2-ノニュロピラノシル)オネート(6)150.0 mg(232.7μmol)、1 M水酸化ナトリウム水溶液11 mlを加え、室温で1 時間反応させた。 薄層クロマトグラフィー(TLC)で反応の進行を確認した後、イオン交換樹脂(DOWEXTM 50W×8; 100 - 200 MESH、H FORM)3.41 g(約1 eq)を加えて中和し、10 分間攪拌した。DOWEXTMをろ過した溶液を減圧留去し、白色固体を得た。(収量:108 mg、収率:100 %)
【0047】
1H-NMR (500 MHz; D2O): δ 6.15 (dd, J = 17.1, 10.2 Hz, 1H), 6.06 (dd, J = 17.1, 1.2 Hz, 1H), 5.64 (dd, J = 10.3, 1.2 Hz, 1H), 3.87-3.30 (m, 9H), 3.15 ( J = 6.6 Hz, 2H), 2.61 (dd, J = 12.5, 4.3 Hz, 1H), 1.93 (s, 3H), 1.61 (t, J = 12.2 Hz, 1H), 1.52-1.32 (m, 4H), 1.32-1.10 (m, 4H); 13C-NMR (126 MHz; D2O): δ 175.1, 172.5, 168.5, 130.2, 126.9, 99.9, 72.8, 71.4, 68.3, 67.9, 65.0, 62.8, 51.9, 39.9, 39.4, 28.8, 28.1, 25.7, 24.8, 22.1
【0048】
5)dUTP-HgCl(9)の合成
0.1 M 酢酸バッファー(pH =6.0) 20 ml にdUTP Na塩(8)240 mg(432μmol、1.00eq)と酢酸水銀688 mg(2.16mmol、5.00eq)を加え、50 ℃で5 時間反応させた。5 時間後、TLCにより反応の進行を確認し、塩化リチウム165 mg(3.89mmol、9.00eq)を加え、10 分間攪拌した。酢酸エチル20 mlで10 回水層を洗浄した後、冷エタノール60 mlを加えると、白色沈殿が生じた。溶液を遠心分離し、上澄みをデカンテーションにより除去した。同様の操作を各遠心管について冷エタノール3 mlを二回、冷ジエチルエーテル3 mlを一回ずつ行った。沈殿物を乾燥させ、白色固体を得た。(収量:308 mg、収率:90.1 %)
【0049】
6)dUTP-NeuAc(10)の合成
超純水(MilliQ水)3.00 mlに6-(N-アクロイルアミノ)ヘキシル 5-アセタミド-3,5-ジデオキシ-D-グリセロ-α-D-ガラクト-2-ノニュロピラノソ酸(7)112 mg(231μmol、4eq)とdUTP-HgCl (9)46.1 mg(58.3μmol)、Li2PdCl4 45.8 mg(174μmol、3.00eq)を加え、24時間室温で反応させた。UV吸光光度測定により反応の進行を確認した後、直径5 cmのメンブレンフィルターで反応溶液を濾過し、陰イオン交換クロマトグラフィー(直径1 cm、DEAE Sephadex A-25 2.2g、展開溶媒:50 mM - 1.5 M TEABバッファー pH =7.54)精製を行った。TEABバッファーを減圧留去後、MilliQ水、イオン交換樹脂(DOWEXTM 50W×8; 100 - 200 MESH、Na FORM)を加えて20 分間撹拌した。DOWEXTM 50W×8をろ過した後、溶液を減圧留去し、茶褐色粘稠体を得た。(収量:23.5 mg、収率:40 %)
【0050】
1H-NMR (500 MHz; D2O): δ 8.08 (s, 1H), 7.12 (d, J = 15.8 Hz, 1H), 6.78 (d, J = 15.8 Hz, 1H), 6.19 (t, J = 6.5 Hz, 1H), 4.54 (m, 1H), 3.81-3.26 (m, 9H), 3.24-3.11 (m, 2H), 2.68-2.48 (m, 2H), 2.38-2.20 (m, 2H), 1.95-1.84 (m, 3H), 1.66-1.50 (m, 2H), 1.50-1.33 (m, 4H), 1.30-1.17 (m, 4H); 13C-NMR (126 MHz; D2O): δ 175.06, 172.25, 168.53, 163.92, 150.74, 141.17, 131.45, 121.08, 110.37, 99.75, 85.88, 72.83, 71.30, 70.78, 68.36, 67.78, 65.61, 64.96, 62.88, 51.90, 42.25, 39.82, 39.59, 28.77, 28.32, 25.79, 24.81, 22.11.
【0051】
(実施例1−2)シアル酸修飾オリゴヌクレオチドの合成
DNA polymerase KOD Dash(R)を用いて、dUTP-NeuAcがDNAへ導入されるか否かを検討した。テンプレート(鋳型DNA)として、図4のT1〜T7に示す各配列のものを用い、添付の試薬及び取扱説明書に従って、PCR反応を行い、シアル酸修飾オリゴヌクレオチドを合成した。
【0052】
(実験例1−1)シアル酸修飾オリゴヌクレオチドの合成確認
実施例1−2にて合成した各シアル酸修飾オリゴヌクレオチド(T1〜T7)について、40mer T1、T2、T3、T4、T5、T6、T7 (5 pmol/μl)をテンプレートとして、dATP, dCTP及びdGTP を各々0.2 mM, dUTP-NeuAc 0.2 mM、プライマー(5 pmol/μl)、DNA polymerase KOD Dash(R) 0.1 U/μlの存在下、55 ℃で1 時間インキュベートした後、15 %ポリアクリルアミド電気泳動により確認した。その結果、dUTP-NeuAcが1個(T1)、2個(T2)、5残基おきに4個(T3)、5個(T4)、10個(T5)、15個(T6)が導入されていることが確認された(図5)。
【0053】
(実施例2−1)シアリルラクトース修飾核酸(dUTP-LacNeuAc)の合成
図2の化合物12〜17の詳細な合成方法を以下に示す。
【0054】
1)アセチル化ラクトース(12)の合成
無水酢酸50 ml (531.34 mmol, 18.1 eq) に無水酢酸ナトリウム3.00 g (36.61 mmol, 1.2 eq)を入れ140 ℃で加熱した。そこにラクトース・一水和物10.05 g (27.92 mmol)を加え、10 分間反応させた。その後、反応溶液を氷水250 ml に入れ撹拌し、粘性のある物質を析出させた。得られた固体をエタノールから再結晶を行い白色固体を得た。(収量:18.0 g、収率:95.0 %)
【0055】
2)ヘプタアセチル-α-ブロモラクトース(13)の合成
脱水ジクロロメタン230 mlにα-D-ラクトースオクタアセテート23.25 g (34.3 mmol, 1 eq) を加え、0 ℃に冷却した。33 %臭化水素・酢酸溶液40 mlを加え、90分間撹拌した。TLCにより反応の進行を確認した後、反応液を1 M NaHCO3 100 ml×1, 蒸留水 100 ml×1で分液抽出し、有機層にMgSO4を加え乾燥させろ過した。ろ液を減圧留去して得られた固体をフラッシュカラムクロマトグラフィーhexane : AcOEt = 6 : 4 - 4 : 6により精製し、白色固体を得た。(収量:22.8 g、収率:95 %)
【0056】
3)6-(N-アクロイルアミノ)ヘキシル 2,3,4,6-テトラ-O-アセチル-β-D-ガラクトピラノシル-(1→4)-2,3,6-トリ-O-アセチル-β-D-グルコピラノシド(14)の合成
脱水ジクロロメタン50 mlにヘプタアセチル-α-ブロモラクトース(13)2.09 g (2.98 mmol,)、N-(6-ヒドロキシヘキシル)プロペンアミド(3) 0.610 g (3.56 mmol, 3.1 eq)、炭酸銀0.348 g (1.26 mmol, 1.1 eq)、過塩素酸銀0.251 g (1.21 mmol, 1.1 eq)、180 ℃で3 時間活性化したモレキュラーシーブス4Aを加え、遮光下室温で41時間撹拌した。反応液をセライトでろ過し、ろ液を1 M NaHCO3 100 ml×1、蒸留水100 ml×1で分液抽出し、有機層にMgSO4を加え乾燥させろ過した。ろ液を減圧留去して得られた固体をフラッシュカラムクロマトグラフィー(hexane : AcOEt = 1 : 1 - 0 : 1, AcOEt : MeOH = 1 : 0 - 95 : 5)により精製し、白色固体を得た。(収量:520 mg、収率:22.1 %)
【0057】
1H-NMR (500 MHz; CDCl3): δ 6.28 (dd, J = 17.0, 1.5 Hz, 1H), 6.10 (dd, J = 17.0, 10.3 Hz, 1H), 5.75 (s, 1H), 5.63 (dd, J = 10.3, 1.5 Hz, 1H), 5.35 (dd, J = 3.4, 1.1 Hz, 1H), 5.19 (t, J = 9.3 Hz, 1H), 5.11 (dd, J = 10.4, 7.9 Hz, 1H), 4.96 (dd, J = 10.4, 3.5 Hz, 1H), 4.88 (dd, J = 9.6, 7.9 Hz, 1H), 4.52-4.44 (m, 3H), 4.15-4.06 (m, 3H), 3.89-3.86 (m, 1H), 3.84-3.77 (m, 2H), 3.59 (ddd, J = 9.9, 5.0, 2.1 Hz, 1H), 3.46 (dt, J = 9.7, 6.6 Hz, 1H), 3.34-3.30 (m, 2H), 2.16-1.97 (m, 23H), 1.57-1.51 (m, 4H), 1.36-1.32 (m, 4H); 13C-NMR (126 MHz; CDCl3): δ 170.40, 170.32, 170.11, 170.03, 169.75, 169.65, 169.04, 165.49, 130.92, 126.16, 101.04, 100.55, 76.26, 72.78, 72.58, 71.73, 70.96, 70.65, 69.97, 69.10, 66.59, 61.94, 60.77, 39.43, 29.41, 29.19, 26.52, 25.52, 20.87, 20.79, 20.71, 20.61, 20.48.
【0058】
4)6-(N-アクロイルアミノ)ヘキシルβ-D-ガラクトピラノシル-(1→4)-β-D-グルコピラノシド(15)の合成
脱水メタノール25 mlに、6-(N-アクロイルアミノ)ヘキシル 2,3,4,6-テトラ-O-アセチル-β-D-ガラクトピラノシル-(1→4)-2,3,6-トリ-O-アセチル-β-D-グルコピラノシド(14)475 mg (0.601 mmol, 1 eq)、NaOMe (116 mg 、2.15 mmol, 3.6 eq)を加え、1 時間反応させた。TLCで脱保護の進行を確認した後、アンバーライトIR-120B(H)でイオン交換した。溶液を減圧留去し、フラッシュカラムクロマトグラフィー(CHCl3 : MeOH = 3 : 1 - 7 : 3)により精製し、白色固体を得た。(収量:96 mg、収率 32.2 %、融点183-184 ℃)
【0059】
1H-NMR (500 MHz; D2O): δ 6.25 (dd, J = 17.2, 10.2 Hz, 1H), 6.15 (dd, J = 17.1, 1.3 Hz, 1H), 5.73 (dd, J = 10.2, 1.3 Hz, 1H), 4.50-4.40 (m, 2H), 3.99-3.50 (s, 16H), 3.34-3.20 (3H), 1.68-1.58 (m, 2H), 1.58-1.46 (m, 2H), 1.44-1.28 (m, 4H); 13C-NMR (126 MHz; D2O): δ 168.44, 130.13, 126.92, 102.96, 102.05, 78.46, 75.38, 74.78, 74.49, 72.88, 72.57, 70.99, 70.58, 68.58, 61.04, 60.15, 39.35, 28.62, 28.14, 25.75, 24.69.
【0060】
5)6-(N-アクロイルアミノ)ヘキシル 5-アセタミド-3,5-ジデオキシ-D-グリセロ-α-D-ガラクト-2-ノニュロピラノシロネート)-(2→3)-β-D-ガラクトピラノシル-(1→4)-β-D-グルコピラノシド(16)の合成
bis trisバッファー(15 mM, pH 6.0, 1.0 M NaCl, Triton-X 0.1 %) 10 mlに6-(N-アクロイルアミノ)ヘキシルβ-D-ガラクトピラノシル-(1→4)-β-D-グルコピラノシド(15)100 mg (200μmol)、CMP-NeuAc(シチジン 5'-モノホスホ-β-D-N-アセチルノイラミン酸) 190 mg (300μmol)、α-2,3-シアル酸転移酵素(α-2,3-Sialyltransferase)200 munitを加え、室温で72時間撹拌した。逆相カラムクロマトグラフィー(水-メタノール)により精製し、白色固体を得た。(収量:86 mg、収率:55 %)
【0061】
1H-NMR (500 MHz; D2O): δ 6.12 (dd, J = 17.2, 10.1 Hz, 1H), 6.02 (dd, J = 17.1, 1.2 Hz, 1H), 5.60 (dd, J = 10.2, 1.2 Hz, 1H), 4.39 (d, J = 7.9 Hz, 1H), 4.34 (d, J = 8.0 Hz, 1H), 3.98 (dd, J = 9.9, 2.8 Hz, 1H), 3.89-3.41 (m, 27H), 3.20-3.10 (m, 3H), 2.62 (dd, J = 12.4, 4.5 Hz, 1H), 1.89 (s, 3H), 1.66 (t, J = 12.2 Hz, 1H), 1.54-1.46 (m, 2H), 1.45-1.37 (m, 2H), 1.28-1.18 (m, 4H); 13C-NMR (126 MHz; D2O): δ 168.45, 130.11, 126.90, 102.67, 102.05, 99.83, 78.31, 75.51, 75.18, 74.77, 74.45, 72.90, 72.86, 71.78, 70.56, 69.39, 68.36, 68.12, 67.49, 62.61, 61.04, 60.11, 51.71, 39.66, 39.35, 28.61, 28.11, 25.74, 24.67, 22.06.
【0062】
6)dUTP-LacNeuAc(17)の合成
MilliQ水3.00 mlに6-(N-アクロイルアミノ)ヘキシル 5-アセタミド-3,5-ジデオキシ-D-グリセロ-α-D-ガラクト-2-ノニュロピラノシロネート)-(2→3)-β-D-ガラクトピラノシル-(1→4)-β-D-グルコピラノシド(16)112 mg(231μmol、4eq)とdUTP-HgCl (9)46.1 mg(58.3μmol)、Li2PdCl4 45.8 mg(174μmol、3.00eq)を加え、24時間室温で反応させた。UV吸光光度測定により反応の進行を確認した後、直径5 cmのメンブレンフィルターで反応溶液を濾過し、陰イオン交換クロマトグラフィー(DEAE SephadexTM A-25 2.2g、展開溶媒:50 mM - 1.5 M TEABバッファー pH =7.54)精製を行った。TEABバッファーを減圧留去後、MilliQ水、イオン交換樹脂(DOWEXTM 50W×8; 100 - 200 MESH、Na FORM)を加えて20 分間撹拌した。DOWEXTM 50W×8をろ過した後、溶液を減圧留去し、茶褐色粘稠体を得た。(収量:14 mg、収率:33 %)
【0063】
1H-NMR (500 MHz; D2O): δ 8.18 (s, 1H), 7.23 (d, J = 15.9 Hz, 1H), 6.86 (d, J = 16.0 Hz, 1H), 6.29 (t, J = 6.5 Hz, 1H), 4.68-4.54 (m, 2H), 4.48 (d, J = 7.8 Hz, 1H), 4.42 (d, J = 7.9 Hz, 1H), 4.28-4.21 (m, 3H), 4.21-4.04 (m, 1H), 3.98-3.47 (m, 25H), 3.30-3.23 (m, 3H), 3.20-3.10 (m, 1H), 2.77-2.67 (m, 2H), 2.44-2.29 (m, 2H), 2.03-1.95 (m, 3H), 1.88-1.80 (m, 1H), 1.66-1.46 (m, 4H), 1.40-1.27 (m, 4H); 13C-NMR (126 MHz; D2O): δ 175.05, 172.48, 168.57, 163.98, 150.77, 141.04, 131.44, 121.00, 110.41, 102.71, 102.12, 75.54, 75.12, 70.64, 67.69, 60.93, 39.61, 39.26, 39.21, 28.65, 28.27, 24.72, 22.14, 99.13, 85.96, 78.38, 73.14, 72.93, 74.78, 74.47, 71.30, 70.80, 69.42, 68.23, 67.87, 65.68, 62.89, 60.18, 51.72, 25.82, 25.80.
【0064】
(実施例2−2)シアリルラクトース修飾オリゴヌクレオチドの合成
実施例1−2と同手法により、dUTP-LacNeuAcを含むオリゴヌクレオチドを合成することができた。
【0065】
(実験例2−1)シアリルラクトース酸修飾核酸による赤血球凝集阻害活性
実施例2−1で合成したdUTP-LacNeuAcについて、インフルエンザウイルスとトリ赤血球との赤血球凝集反応に対する阻害効果を確認した。
0.2×105〜6.25×105 pfu/ml の濃度範囲のインフルエンザウイルスA型(A/PR/8/34(H1N1)株)と、0μM〜5μM の濃度範囲のdUTP-LacNeuAc、及びPBSバッファー(pH 7.4)を96-ウェルプレート上で混合し、37 ℃で30 分間インキュベートした。その後、PBSバッファーで1/100〜1/400に希釈したトリ赤血球を添加し、37 ℃でさらに60 分間インキュベートした。
【0066】
dUTP-LacNeuAc濃度を変化させ、赤血球凝集反応が生じる濃度と阻害される濃度の境界を赤血球凝集阻害濃度であると評価した。上記の結果、dUTP-LacNeuAc濃度が2 μM以下であっても、血球凝集阻害効果が認められた(図6参照)。
【0067】
(実験例2−2)シアリルラクトース酸修飾オリゴヌクレオチドによる赤血球凝集阻害活性
実施例2−2で合成した15個のdUTP-LacNeuAcを含むオリゴヌクレオチドについて、実験例2−1と同手法により、トリ赤血球凝集反応の阻害効果を確認した。上記の結果、上記オリゴヌクレオチドの濃度が40 nM以下であっても、血球凝集阻害効果が認められた(図7参照)。
【産業上の利用可能性】
【0068】
以上詳述したように本発明の糖修飾核酸を用いて、糖修飾オリゴヌクレオチドを作製する場合は、テンプレート(鋳型DNA)の塩基配列に応じて、導入する糖鎖の数や立体的な位置を制御することができるので、HAの糖鎖結合サイトの構造を考慮した分子設計を行うことができる。また、実際にオリゴヌクレオチドへの糖残基の導入は、DNAポリメラーゼを用いて行うため、化合物の合成及び精製を容易に行うことができる。さらに、本発明の糖修飾核酸は、生体内において、最終的には生体内のヌクレアーゼで分解されるため、生体毒性がほとんどないことが期待される。
【0069】
現在、インフルエンザ治療薬の主流であるタミフル(商品名)は、1 nMの濃度でインフルエンザの感染を阻害することができる。一方、本発明の糖修飾核酸を含む糖修飾オリゴヌクレオチドの設計により、少なくともオリゴヌクレオチドの濃度が40 nM以下であっても、血球凝集阻害効果が認められた。オリゴヌクレオチドの設計によっては、108 M-1の結合定数でインフルエンザウイルスと結合することが期待され、10 nMで感染を阻害できることとなり、タミフルに匹敵する治療薬となりうる。さらに、本発明の糖修飾核酸は、インフルエンザウイルスに対して変異の少ないHAのシアル酸結合部位をターゲットにするため、どのように変異したウイルスに対しても、吸着、結合能を維持することができる。
【0070】
したがって、本発明の糖修飾核酸又は糖修飾オリゴヌクレオチドを有効成分として含む抗インフルエンザ剤は、インフルエンザ治療剤又はインフルエンザウイルス捕捉剤として有用である。
【技術分野】
【0001】
本発明は、糖鎖修飾核酸及び当該糖鎖修飾核酸の製造方法に関する。さらには、当該糖鎖修飾核酸を含む薬剤、検査方法並びにキットに関する。
【背景技術】
【0002】
インフルエンザウイルスは、パンデミックが最も危惧されているウイルスであり、シアリダーゼ(ノイラミニダーゼ:NA)という酵素とヘマグルチニン(HA)というタンパク質によって覆われている。NAの酵素活性を阻害するのが、現在の治療薬の主流である、タミフル(商品名)である。また、HAはワクチンとして、またHAに結合する抗体は、フィルターなどに固定化することによりウイルスの除去シートなどとして市販されている。しかし、このウイルスの変異速度は非常に早いため、NAやHAの構造が時間と共に変わっていくことが、インフルエンザの予防、診断、治療を困難にしている。
【0003】
一方、NAやHAが変異によってその全体の構造が変化していく中で、HAのシアル酸と結合する部位はほとんどアミノ酸残基が変異しないことが知られている。そこで,この変異の少ないHAのシアル酸結合部位に注目することにより、あらゆる型のインフルエンザウイルスに対して予防、診断、治療が可能な材料が作製可能であると考えられる。
【0004】
シアル酸含有複合糖鎖であるシアリルラクトースは、A型インフルエンザのレセプターとして知られており、A型インフルエンザの感染予防剤として期待されている(非特許文献1)。しかし、シアリルラクトースのインフルエンザウイルスに対する付着阻止効果は、単位容積当たりシアリルラクトース0.1 %以上と極めて高い投与でなければ発揮されない。
【0005】
シアリル酸などの糖鎖によるインフルエンザ感染阻止作用に対する試みは多く報告されている。例えば、シアリルラクトースをポリスチレンに結合させたもの(特許文献1、非特許文献2)、γ‐ポリグルタミン酸にシアロ糖鎖を結合させたシアロ糖鎖含有ポリマー(特許文献2)、ポリアクリルアミドなどのポリマーにα‐シアロシドグループを結合させたもの(非特許文献3)、シアリルラクトースをポリペプチドに結合させたもの(非特許文献4)、シアリルラクトースをカルボシランをコアとするデンドリマー構造としたもの(非特許文献5)、シアル酸を含むポリバレント抗ウイルス阻害剤(非特許文献6)などが挙げられる。しかしながら、上記については、分子量の制御、糖鎖の数、糖鎖の配向を制御することが合成上困難である。また、ポリスチレンやポリアクリルアミドなどの合成高分子に共有結合させた糖鎖修飾合成高分子の場合は、高濃度で使用すると生体毒性を示す危険性がある。
【0006】
糖修飾核酸の製造方法として、任意の位置が選択的に糖で置換された、新規なオリゴヌクレオチド糖コンジュゲートの製造方法について開示がある(特許文献3)。ここで開示される糖修飾核酸は、糖とウリジンがスペーサーを介して結合している糖結合ウリジンである。また、糖としては、ガラクトースが開示されている。しかしながら、シアル酸で修飾した核酸についての報告はない。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開平10-310610号公報
【特許文献2】特開2008-31156号公報
【特許文献3】特開2001-247596号公報
【非特許文献】
【0008】
【非特許文献1】Nature, 333, pp. 426-431 (1988)
【非特許文献2】Glycoconjugate Journal 15, 1047-1054 (1998)
【非特許文献3】J. Med. Chem., 37, 3419-3433 (1994)
【非特許文献4】Angew. Chem. Int. Ed., 42, 5186-5189 (2003)
【非特許文献5】Bioorganic & Medicinal Chemistry letters, 18, 4405-4408 (2008)
【非特許文献6】Med. Chem. Res., 18, 477-494 (2009)
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、インフルエンザウイルスに対して、ウイルス変異の影響を受けることなく結合定数の高い抗インフルエンザ剤を提供することを課題とする。
【課題を解決するための手段】
【0010】
本発明者らは、HAのシアル酸と結合する部位は、ほとんどアミノ酸残基が変異しないことに着目し、上記課題を解決するために鋭意検討を重ねた結果、糖と核酸がリンカーを介して結合しており、糖としてシアル酸を含むことを特徴とする糖修飾核酸により、インフルエンザウイルスのHAの糖鎖結合サイトの構造を考慮した分子設計を比較的容易に行うことができ、ウイルス変異の影響を受けることなく結合定数の高い抗インフルエンザ剤を提供できることを見出し、本発明を完成した。
【0011】
すなわち本発明は、以下よりなる。
1.糖と核酸がリンカーを介して結合しており、糖としてシアル酸を含むことを特徴とする、糖修飾核酸。
2.前記糖が、シアリルラクトースである、前項1に記載の糖修飾核酸。
3.前記シアリルラクトースが、2-6型シアリルラクトース又は2-3型シアリルラクトースである、前項2に記載の糖修飾核酸。
4.前項1〜3のいずれか1に記載の糖修飾核酸を含む糖修飾オリゴヌクレオチド。
5.前項1〜3のいずれか1に記載の糖修飾核酸、あるいは前項4に記載の糖修飾オリゴヌクレオチドを有効成分として含む抗インフルエンザ剤。
6.抗インフルエンザ剤が、インフルエンザ治療剤又はインフルエンザウイルス捕捉剤である、前項5に記載の抗インフルエンザ剤。
7.以下の工程を含む、前項1〜3のいずれか1に記載の糖修飾核酸の製造方法:
1)シアル酸誘導体修飾アクリルアミドを合成する工程;
2)前記シアル酸誘導体修飾アクリルアミドをパラジウム触媒を用いてヌクレオシド3リン酸に付加する工程。
8.前項1〜3のいずれか1に記載の糖修飾核酸、基質としてのdNTP及びDNAポリメラーゼを少なくとも用いることを特徴とする、前項4に記載の糖修飾オリゴヌクレオチドの製造方法。
9.核酸増幅方法により作製される前項8に記載の糖修飾オリゴヌクレオチドの製造方法。
10.前項1〜3のいずれか1に記載の糖修飾核酸、基質としてのdNTP及びDNAポリメラーゼを少なくとも含む、前項4に記載の糖修飾オリゴヌクレオチド作製用キット。
【発明の効果】
【0012】
本発明の糖修飾核酸を用いて、糖修飾オリゴヌクレオチドを作製することができる。この場合は、テンプレート(鋳型DNA)の塩基配列に応じて、導入する糖鎖の数や立体的な位置を制御することができるので、インフルエンザウイルスHAの糖鎖結合サイトの構造を考慮した分子設計を行うことができる。また、実際にオリゴヌクレオチドへの糖残基の導入は、DNAポリメラーゼを用いて行うため、糖修飾オリゴヌクレオチドの合成及び精製を容易に行うことができる。本発明の糖修飾核酸及び糖修飾オリゴヌクレオチドは、インフルエンザウイルスのHAとトリ赤血球の反応による赤血球凝集反応に対して、強い阻害活性を有する。さらに、本発明の糖修飾核酸は、生体内において、最終的には生体内のヌクレアーゼで分解されるため、生体毒性がほとんどないことが期待される。
【図面の簡単な説明】
【0013】
【図1】シアル酸修飾核酸の合成スキームを示す図である。(実施例1−1)
【図2】シアリルラクトース修飾核酸の合成スキームを示す図である。(実施例2−1)
【図3】DNAポリメラーゼによるオリゴヌクレオチドへの糖修飾核酸の導入模式図である。
【図4】糖修飾オリゴヌクレオチド作製に用いたテンプレート(鋳型DNA)を示す図である。(実施例1−2)
【図5】糖修飾オリゴヌクレオチドへのシアル酸修飾核酸の導入を、電気泳動により確認した写真図である。(実験例1−2)
【図6】シアリルラクトース酸修飾核酸の、インフルエンザウイルスのHAとトリ赤血球の反応による赤血球凝集反応に対する阻害活性を示す図である。(実験例2−1)
【図7】シアリルラクトース酸修飾オリゴヌクレオチドの、インフルエンザウイルスのHAとトリ赤血球の反応による赤血球凝集反応に対する阻害活性を示す図である。(実験例2−2)
【発明を実施するための形態】
【0014】
本発明は、糖と核酸がリンカーを介して結合しており、糖としてシアル酸を含むことを特徴とする、糖修飾核酸に関する。
【0015】
前記糖は、シアル酸又はシアリルラクトースとすることができる。また、糖がシアリルラクトースの場合は、2-6型シアリルラクトース又は2-3型シアリルラクトースとすることができる。ヒト由来のインフルエンザウイルスのHAは、シアル酸とラクトース(Galβ1→4Glc)とがα2→6結合したもの、即ち「2-6型シアリルラクトース」を認識し、トリ由来のインフルエンザウイルスのHAは、同様にα2→3結合したもの、即ち「2-3型シアリルラクトース」を認識することが知られている。従って、本発明の糖修飾核酸における糖がシアリルラクトースの場合、その型は、必要に応じて適宜選択することができる。
【0016】
前記核酸は、デオキシリボヌクレオチド、リボヌクレオチド、人工核酸のいずれであってもよく、特に限定されず、用途により適宜選択することができる。例えば、当該糖修飾核酸をインフルエンザ治療薬のように、生体に用いる場合には、適当な時期にヌクレアーゼなどによって分解される天然型の核酸が好ましい。また、当該糖修飾核酸を、フィルターやマスクなどの固相担体に固相化する場合などは、安定性の優れた人工核酸を用いてもよい。当該核酸に含まれる塩基の型は、ピリミジン塩基であってもよいし、プリン塩基であってもよいが、好ましくはピリミジン塩基である。従って、核酸を構成するヌクレオシドとしては、例えばウリジン、チミジン、シチジンが挙げられ、特に好適にはウリジンが挙げられる。
【0017】
前記リンカーは、糖と核酸を結合させるものであり、柔らかい構造を賦与してフレキシビリティーを持たせる作用を有するもので、疎水性であることが好ましい。例えば、炭素数1から10のアルカン、エーテル、エステル又はアミドなどが挙げられ、芳香族系炭化水素などを含んでいてもよい。好ましいリンカーの例としては、エタン、プロパン、n−ブタン、n−ペンタン、n−ヘキサン等の直鎖状アルカン、及びエチレングリコールなどが挙げられる。
【0018】
本発明の糖修飾核酸の例として、具体的には以下の式(I)〜式(III)に示す化合物が挙げられる。各式で表される化合物は、各々トランス体、シス体又は単結合体のいずれであってもよい。
【0019】
【化1】

【0020】
【化2】

【0021】
【化3】

【0022】
本発明の修飾核酸の製造方法は、図1又は図2に記載の合成方法によることができる。本発明の修飾核酸の合成方法において、必須の工程は、シアル酸誘導体修飾アクリルアミドを合成する工程、及びこのシアル酸誘導体修飾アクリルアミドをパラジウム触媒を用いてヌクレオシド3リン酸に付加する工程である。この反応の生成物として、アクリルアミド部分の二重結合に対して (a)トランス体と(b)シス体の2種類の化合物が生成されうる。図1及び図2で示した(a)トランス体の化合物を得るためには、遮光下、特に300 nmの波長以下の光の遮断下で反応を進行させることが必須である。一方、300 nm以下の光の照射下でこの反応を行うと、90 %以上がシス体として得られる。また、トランス体、シス体いずれの状態であっても、この二重結合部分を水素還元して単結合に変換することもできる。このように、シアル酸と核酸塩基をつなぐリンカー部分が(a)トランス体、(b)シス体、(c)単結合の構造を選択的に合成することが可能である。このリンカー部分の構造の違いにより、(1)DNAポリメラーゼによる導入効率、(2)インフルエンザウイルスのHAサイトとの親和性の大小を制御することができる。
【0023】
上記により作製した本発明の糖修飾核酸を用いて、糖修飾オリゴヌクレオチドを製造することができる。本発明の糖修飾オリゴヌクレオチドは、DNAポリメラーゼを用いて合成することができる(図3参照)。例えば、基質としての本発明の糖修飾核酸及びdNTPを基にして、DNAポリメラーゼを用いて製造することができる。具体的には、鋳型DNAを基にして、核酸増幅方法により合成することができる。核酸増幅方法については、特に限定されないが、例えばPCR(Polymerase Chain Reaction)法、LAMP法、TMA(Transcription Mediated Amplification)法、NASBA(Nucleic Acid Sequence-Based Amplification)法や、LCR(Ligase Chain Reaction)法などが挙げられ、特にPCR法やLAMP法などが好適に用いられる。このような核酸増幅方法により、所望の配列のオリゴヌクレオチドを作製することができる。例えば、鋳型DNAにおいて、糖鎖修飾核酸に対する相補的なヌクレオチドを所望の位置に配置させることで、増幅されたオリゴヌクレオチドには、所望の位置に糖修飾核酸を配置させることができる。本発明における糖修飾オリゴヌクレオチドの長さは、約15〜1000塩基長、好ましくは約15〜200塩基長、より好ましくは約20〜90塩基長とすることができる。また、本発明の糖修飾オリゴヌクレオチドには、約1〜70個、好ましくは約1〜15個の糖修飾核酸を含ませることができる。
【0024】
本発明は、上記糖修飾オリゴヌクレオチドの製造方法にも及ぶ。本発明の糖修飾オリゴヌクレオチド製造方法では、本発明の糖修飾核酸、基質としてのdNTP及びDNAポリメラーゼを少なくとも用いることを特徴とする。DNAポリメラーゼとしては、自体公知のものを使用することができ、例えば市販のDNAポリメラーゼとして、KOD Dash(R)(東洋紡)やVent(R)(exo-) DNA ポリメラーゼ(New England BioLabs)のようなFamily B型に属する多くの種類の酵素を使用することができる。
【0025】
オリゴヌクレオチドの製造は、具体的には、上述の核酸増幅方法によることができる。核酸増幅方法に使用する鋳型DNAとしてのオリゴヌクレオチドは、既存のオリゴヌクレオチドを使用することもできるし、所望の位置に本発明の糖修飾核酸を配置しうるように、適宜設計することもできる。そのような鋳型DNAとしてのオリゴヌクレオチドは、オリゴヌクレオチド合成装置を用いるなど、自体公知の方法により作製することができる。
【0026】
インフルエンザウイルスのHAとシアリルラクトースの結合定数は、102〜103 M-1程度であることが知られている(非特許文献2参照)。それに対し、本発明の糖修飾核酸は、核酸塩基、リンカーとの共同的相互作用により、単なるシアル酸やシアリルラクトースに比べて、インフルエンザウイルスのHAに対して強く結合しうる。例えば、ウリジンとシアリルラクトースを炭素数6のメチレン基リンカーで結合した糖修飾核酸(dUTP-NeuAcLac)の場合は、単量体で105 〜106 M-1程度の結合定数を示す。さらに、上記の糖修飾オリゴヌクレオチドのように、複数個の複数個オリゴヌクレオチドに配置させることで、より効果的にHAに対して強く結合し、HAの立体構造を考慮しながら糖修飾核酸を合成することで、さらに効果的に結合させることも可能と考えられる。
【0027】
さらに、本発明は糖修飾オリゴヌクレオチド作製用キットにも及ぶ。当該キットには、本発明の糖修飾核酸、基質としてのdNTP及びDNAポリメラーゼを少なくとも含む。さらには、鋳型DNAとしてのオリゴヌクレオチドや必要な緩衝液等を適宜含めることができる。
【0028】
本発明は、上記糖修飾核酸を含む糖修飾オリゴヌクレオチドに及び、さらには糖修飾核酸あるいは糖修飾オリゴヌクレオチドを有効成分として含む抗インフルエンザ剤にも及ぶ。抗インフルエンザ剤としては、例えばインフルエンザ治療剤やインフルエンザウイルス捕捉剤が挙げられる。インフルエンザ治療剤の場合は、生体内でインフルエンザウイルスのHAと結合し、インフルエンザウイルスが細胞内に侵入するのを阻止することができる。また、インフルエンザウイルス捕捉剤としては、生体内に限らず当該ウイルスを捕捉することができる。例えば、本発明の糖修飾核酸あるいは糖修飾オリゴヌクレオチドをフィルター等に固定することで、インフルエンザウイルスを除去する材料とすることができる。また、本発明の糖修飾核酸あるいは糖修飾オリゴヌクレオチドをマスク等の材料に固定することで、外部からのインフルエンザウイルスの侵入を阻止したり、例えばインフルエンザウイルスの感染患者から外部へウイルスが飛散するのを阻止することができる。
【0029】
本発明の糖修飾核酸又は糖修飾オリゴヌクレオチドを有効成分として含む抗インフルエンザ剤は、インフルエンザ治療薬又はインフルエンザ捕捉剤等の用途に応じて、糖修飾核酸又は糖修飾オリゴヌクレオチドとともに、適宜必要な添加剤等を含めることができる。
【0030】
インフルエンザ治療薬とする場合は、必要な添加剤、即ち薬学的に許容しうる添加剤を混和し製剤化して使用することができる。上記添加剤としては、一般に医薬に使用される、賦形剤、結合剤、滑沢剤、崩壊剤、着色剤、矯味矯臭剤、乳化剤、界面活性剤、溶解補助剤、懸濁化剤、等張化剤、緩衝剤、防腐剤、抗酸化剤、安定化剤、吸収促進剤等を挙げることができ、所望により、これらを適宜組み合わせて使用することもできる。
【0031】
以下に上記添加剤の例を挙げる。賦形剤としては、例えば乳糖、白糖、ブドウ糖、コーンスターチ、マンニトール、ソルビトール、デンプン、α化デンプン、デキストリン、結晶セルロース、軽質無水ケイ酸、ケイ酸アルミニウム、ケイ酸カルシウム、メタケイ酸アルミン酸マグネシウム、リン酸水素カルシウムが挙げられる。
【0032】
結合剤としては、例えばポリビニルアルコール、メチルセルロース、エチルセルロース、アラビアゴム、トラガント、ゼラチン、シェラック、ヒドロキシプロピルメチルセルロース、ヒドロキシプロピルセルロース、カルボキシメチルセルロースナトリウム、ポリビニルピロリドン、マクロゴールが挙げられる。滑沢剤としては、ステアリン酸マグネシウム、ステアリン酸カルシウム、フマル酸ステアリルナトリウム、タルク、ポリエチレングリコール、コロイドシリカが挙げられる。崩壊剤としては、結晶セルロース、寒天、ゼラチン、炭酸カルシウム、炭酸水素ナトリウム、クエン酸カルシウム、デキストリン、ペクチン、低置換度ヒドロキシプロピルセルロース、カルボキシメチルセルロース、カルボキシメチルセルロースカルシウム、クロスカルメロースナトリウム、カルボキシメチルスターチ、カルボキシメチルスターチナトリウムが挙げられる。着色剤としては三二酸化鉄、黄色三二酸化鉄、カルミン、カラメル、β−カロチン、酸化チタン、タルク、リン酸リボフラビンナトリウム、黄色アルミニウムレーキ等、医薬品に添加することが許可されているものが挙げられる。
【0033】
矯味矯臭剤としては、ココア末、ハッカ脳、芳香散、ハッカ油、竜脳、桂皮末が挙げられる。乳化剤又は界面活性剤としては、ステアリルトリエタノールアミン、ラウリル硫酸ナトリウム、ラウリルアミノプロピオン酸、レシチン、モノステアリン酸グリセリン、ショ糖脂肪酸エステル、グリセリン脂肪酸エステルが挙げられる。溶解補助剤としては、ポリエチレングリコール、プロピレングリコール、安息香酸ベンジル、エタノール、コレステロール、トリエタノールアミン、炭酸ナトリウム、クエン酸ナトリウム、ポリソルベート80、ニコチン酸アミドが挙げられる。懸濁化剤としては、前記界面活性剤のほか、例えばポリビニルアルコール、ポリビニルピロリドン、メチルセルロース、ヒドロキシメチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース等の親水性高分子が挙げられる。
【0034】
等張化剤としては、ブドウ糖、塩化ナトリウム、マンニトール、ソルビトールが挙げられる。緩衝剤としてはリン酸塩、酢酸塩、炭酸塩、クエン酸塩などの緩衝液が挙げられる。防腐剤としてはメチルパラベン、プロピルパラベン、クロロブタノール、ベンジルアルコール、フェネチルアルコール、デヒドロ酢酸、ソルビン酸が挙げられる。抗酸化剤としては硫酸塩、アスコルビン酸、α−トコフェロールが挙げられる。安定化剤としては一般に医薬に使用されるものが挙げられる。吸収促進剤としては一般に医薬に使用されるものが挙げられる。また、必要に応じて、ビタミン類、アミノ酸等の成分を配合してもよい。
【0035】
また、上記製剤としては、錠剤、散剤、顆粒剤、細粒剤、カプセル剤、シロップ剤、トローチ剤、吸入剤等の経口剤;坐剤、軟膏剤、眼軟膏剤、テープ剤、点眼剤、点鼻剤、点耳剤、パップ剤、ローション剤等の外用剤又は注射剤を挙げることができる。上記経口剤は、上記添加剤を適宜組み合わせて製剤化することができる。なお、必要に応じてこれらの表面をコーティングしてもよい。上記外用剤は、上記添加剤のうち、特に賦形剤、結合剤、矯味矯臭剤、乳化剤、界面活性剤、溶解補助剤、懸濁化剤、等張化剤、防腐剤、抗酸化剤、安定化剤又は吸収促進剤を適宜組み合わせて製剤化することができる。上記注射剤は、上記添加剤のうち、特に乳化剤、界面活性剤、溶解補助剤、懸濁化剤、等張化剤、緩衝剤、防腐剤、抗酸化剤、安定化剤又は吸収促進剤を適宜組み合わせて製剤化することができる。
【0036】
また、インフルエンザ治療薬として使用する場合は、糖修飾核酸の投与量は適宜決定することができる。例えばヒトに投与する場合、投与量や投与方法は適宜決定することができる。好ましい投与量は、糖修飾核酸として、成人(体重60 kg)あたり、通常、10〜1000 mg/日であり、好ましくは15〜700 mg/日であり、さらに好ましくは30〜300 mg/日(例えば200 mg/日)である。投与量及び投与期間は、炎症の治療効果と患者の状態を勘案しながら、適宜設定することができる。
【0037】
インフルエンザ捕捉剤として、生体外で使用する場合は、上述の他、フィルター、マスク材料、固相などの固相担体に、糖修飾核酸あるいは糖修飾オリゴヌクレオチドを適宜固相化することもできる。これらの固相化の方法は、核酸やオリゴヌクレオチドの固相方法に準じて固相化することができる。
【実施例】
【0038】
本発明の理解を深めるために、以下の実施例により更に詳細に説明するが、本発明はこれら実施例に限定されるものではないことは明らかである。
【0039】
(実施例1−1)シアル酸修飾核酸(dUTP-NeuAc)の合成
図1の化合物3から10の詳細な合成方法を以下に示す。
【0040】
1)6-(N-アクロイルアミノ)ヘキサン-1-オール(3)の合成
ジクロロメタン100 mlにトリエチルアミン9.58 g (94.7 mmol)、6-アミノ-1-ヘキサノール 4.96 g (42.3 mmol)を入れ、ジクロロメタン70 mlで溶解させたアクリル酸クロリド11.52 g (127.3 mmol)を滴下し、室温で24時間撹拌した。反応液をクロロホルムで希釈し、1 M NaHCO3 50 ml×1と蒸留水50 ml×2で洗浄した。有機層からクロロホルムを減圧留去後の固体に99.5 %エタノール50 mlを加え、続けて2 M NaOH 30 mlを加え1 時間撹拌した。反応溶液を減圧留去し、得られた固体をフラッシュカラムクロマトグラフィーにより、酢酸エチルで溶出し、白色固体を得た。(収量:4.48 g、収率:62 %)
【0041】
1H-NMR (500 MHz; CDCl3): δ 6.27 (dd, J = 17.0, 1.4 Hz, 1H), 6.10 (dd, J = 17.0, 10.3 Hz, 1H), 5.89 (br, 1H), 5.63 (dd, J = 10.3, 1.4 Hz, 1H), 3.63 (t, J = 6.5 Hz, 1H), 3.33 (q, J = 6.6 Hz, 1H), 1.60-1.51 (m, 4H), 1.44-1.32 (m, 4H); 13C-NMR (126 MHz; CDCl3): δ 165.67, 130.90, 126.22 62.57, 39.37, 32.47, 29.50, 26.47, 25.24
【0042】
2)メチル 4,7,8,9-テトラ-O-アセチル-2-クロロ-2-デオキシ-D-ノイラミネート(5)の合成
氷浴下でメチルN-アセチβ- D -ノイラミネート(4)1.96 g(6.06 mmol)にアセチルクロリド25 g(319 mmol)を加え、24時間後反応させた。アセチルクロリドを減圧留去し、発泡性のある褐色粘稠体を得た。この褐色粘稠体をベンゼンに溶かして攪拌したn-ヘキサン溶液に滴下し、生成した沈殿を回収した。(収量:2.87g、収率:87 %)
【0043】
1H-NMR (500 MHz; CDCl3): δ 5.55 (d, JNH,5 = 10.1 Hz, 1H,NH), 5.48 (dd, J7,8 = 6.9, J7,6 = 2.2 Hz, 1H, 7-H), 5.40 (ddd, J4,3ax = 11.9, J4, 5 = 10.8, J4,3eq = 4.8 Hz, 1H, 4-H), 5.18 (ddd, J8,7 = 6.9 Hz, J8,9b = 5.9 Hz, J8,9a = 2.7 Hz, 1H, 8-H), 4.44 (dd, J9a,9b = 12.5, J9a,8 = 2.5 Hz, 1H, 9a-H), 4.36 (dd, J6, 5= 10.8, J6, 7= 2.2 Hz, 1H, 6-H), 4.22 (ddd, J = 10.4, 10.4, 10.4 Hz, 1H), 4.07 (dd, J9b,9a = 12.5 Hz, J9b,8 = 5.8 Hz Hz, 1H, 9b-H), 3.88 (s, 3H, CO2CH3), 2.79 (dd, J3eq, 3ax = 13.9 Hz, J3eq, 4 = 4.7 Hz, 1H, 3eq-H), 2.28 (dd, J3ax, 3eq = 13.8 Hz, J3ax, 4 = 11.3 Hz, 1H, 3ax-H), 2.13, 2.08, 2.06, 2.05 (4×s, 12H, 4×OAc), 1.91 (s, 3H, NAc); 13C-NMR (126 MHz; CDCl3): δ 170.93, 170.60, 170.34, 169.91, 169.63, 165.58, 96.57, 73.87, 69.90, 68.72, 66.83, 62.03, 53.76, 48.73, 40.62, 23.10, 20.90, 20.79, 20.75, 20.72
【0044】
3)6-(N-アクロイルアミノ)ヘキシル メチル(5-アセタミド-4,7,8,9-テトラ-O-アセチル-3,5-ジデオキシ-D-グリセロ-α-D-ガラクト-2-ノニュロピラノシル)オネート(6)の合成
脱水ジクロロメタンに、メチル 4,7,8,9-テトラ-O-アセチル-2-クロロ-2-デオキシ-D-ノイラミネート(5)1.00 g(1.96mmol)、6-(N-アクロイルアミノ)ヘキサン-1-オール(3)0.480 g(2.80mmol、1.43eq)、サリチル酸銀0.930 g(3.80 mmol、1.94 eq)を加え、室温で5 日間(111時間)反応させた。反応溶液をセライト濾過し、ジクロロメタンを減圧留去した。クロロホルム:メタノール=100:0から99:1のグラジエント溶出によるフラッシュカラムクロマトグラフィー精製を行い、褐色粘稠体を得た。(収量:308 mg、収率:23 %)
【0045】
1H-NMR (500 MHz; CDCl3): δ 6.28 (dd, J = 17.0, 1.1 Hz, 1H), 6.10 (dd, J = 17.0, 10.3 Hz, 1H), 6.00 (br, 1H), 5.62 (dd, J = 10.3, 1.2 Hz, 1H), 5.39 (ddd, J = 8.3, 5.9, 2.4 Hz, 1H), 5.33-5.24 (m, 2H), 4.87-4.81 (m, 1H), 4.34 (dd, J = 12.4, 2.5 Hz, 1H), 4.10 (s, 1H), 4.07 (dd, J = 12.3, 6.0 Hz, 2H), 3.80 (s, 3H), 3.74 (ddd, J = 9.1, 6.7 Hz, 1H), 3.34 (q, J = 6.3 Hz, 2H), 3.22 (ddd, J = 9.2, 6.7 Hz, 1H), 2.58 (dd, J = 12.8, 4.6 Hz, 1H), 2.15 (s, 2H), 2.14 (s, 2H), 2.04 (s, 3H), 2.03 (s, 3H), 1.95 ( J = 12.6 Hz, 1H), 1.89 (s, 3H), 1.60-1.55 (m, 4H), 1.46-1.27 (m, 4H); 13C-NMR (125.8 MHz; CDCl3): δ 171.0, 170.8, 170.30, 170.21, 168.5, 165.6, 131.0, 126.1, 98.7, 72.4, 69.1, 68.6, 67.4, 64.8, 62.5, 52.6, 49.5, 39.4, 38.0, 29.3, 26.3, 25.4, 23.2, 21.1, 20.83, 20.76
【0046】
4)6-(N-アクロイルアミノ)ヘキシル 5-アセタミド-3,5-ジデオキシ-D-グリセロ-α-D-ガラクト-2-ノニュロピラノソ酸(7)の合成
MeOH 3.0 mlに6-(N-アクロイルアミノ)ヘキシル メチル(5-アセタミド-4,7,8,9-テトラ-O-アセチル-3,5-ジデオキシ-D-グリセロ-α-D-ガラクト-2-ノニュロピラノシル)オネート(6)150.0 mg(232.7μmol)、1 M水酸化ナトリウム水溶液11 mlを加え、室温で1 時間反応させた。 薄層クロマトグラフィー(TLC)で反応の進行を確認した後、イオン交換樹脂(DOWEXTM 50W×8; 100 - 200 MESH、H FORM)3.41 g(約1 eq)を加えて中和し、10 分間攪拌した。DOWEXTMをろ過した溶液を減圧留去し、白色固体を得た。(収量:108 mg、収率:100 %)
【0047】
1H-NMR (500 MHz; D2O): δ 6.15 (dd, J = 17.1, 10.2 Hz, 1H), 6.06 (dd, J = 17.1, 1.2 Hz, 1H), 5.64 (dd, J = 10.3, 1.2 Hz, 1H), 3.87-3.30 (m, 9H), 3.15 ( J = 6.6 Hz, 2H), 2.61 (dd, J = 12.5, 4.3 Hz, 1H), 1.93 (s, 3H), 1.61 (t, J = 12.2 Hz, 1H), 1.52-1.32 (m, 4H), 1.32-1.10 (m, 4H); 13C-NMR (126 MHz; D2O): δ 175.1, 172.5, 168.5, 130.2, 126.9, 99.9, 72.8, 71.4, 68.3, 67.9, 65.0, 62.8, 51.9, 39.9, 39.4, 28.8, 28.1, 25.7, 24.8, 22.1
【0048】
5)dUTP-HgCl(9)の合成
0.1 M 酢酸バッファー(pH =6.0) 20 ml にdUTP Na塩(8)240 mg(432μmol、1.00eq)と酢酸水銀688 mg(2.16mmol、5.00eq)を加え、50 ℃で5 時間反応させた。5 時間後、TLCにより反応の進行を確認し、塩化リチウム165 mg(3.89mmol、9.00eq)を加え、10 分間攪拌した。酢酸エチル20 mlで10 回水層を洗浄した後、冷エタノール60 mlを加えると、白色沈殿が生じた。溶液を遠心分離し、上澄みをデカンテーションにより除去した。同様の操作を各遠心管について冷エタノール3 mlを二回、冷ジエチルエーテル3 mlを一回ずつ行った。沈殿物を乾燥させ、白色固体を得た。(収量:308 mg、収率:90.1 %)
【0049】
6)dUTP-NeuAc(10)の合成
超純水(MilliQ水)3.00 mlに6-(N-アクロイルアミノ)ヘキシル 5-アセタミド-3,5-ジデオキシ-D-グリセロ-α-D-ガラクト-2-ノニュロピラノソ酸(7)112 mg(231μmol、4eq)とdUTP-HgCl (9)46.1 mg(58.3μmol)、Li2PdCl4 45.8 mg(174μmol、3.00eq)を加え、24時間室温で反応させた。UV吸光光度測定により反応の進行を確認した後、直径5 cmのメンブレンフィルターで反応溶液を濾過し、陰イオン交換クロマトグラフィー(直径1 cm、DEAE Sephadex A-25 2.2g、展開溶媒:50 mM - 1.5 M TEABバッファー pH =7.54)精製を行った。TEABバッファーを減圧留去後、MilliQ水、イオン交換樹脂(DOWEXTM 50W×8; 100 - 200 MESH、Na FORM)を加えて20 分間撹拌した。DOWEXTM 50W×8をろ過した後、溶液を減圧留去し、茶褐色粘稠体を得た。(収量:23.5 mg、収率:40 %)
【0050】
1H-NMR (500 MHz; D2O): δ 8.08 (s, 1H), 7.12 (d, J = 15.8 Hz, 1H), 6.78 (d, J = 15.8 Hz, 1H), 6.19 (t, J = 6.5 Hz, 1H), 4.54 (m, 1H), 3.81-3.26 (m, 9H), 3.24-3.11 (m, 2H), 2.68-2.48 (m, 2H), 2.38-2.20 (m, 2H), 1.95-1.84 (m, 3H), 1.66-1.50 (m, 2H), 1.50-1.33 (m, 4H), 1.30-1.17 (m, 4H); 13C-NMR (126 MHz; D2O): δ 175.06, 172.25, 168.53, 163.92, 150.74, 141.17, 131.45, 121.08, 110.37, 99.75, 85.88, 72.83, 71.30, 70.78, 68.36, 67.78, 65.61, 64.96, 62.88, 51.90, 42.25, 39.82, 39.59, 28.77, 28.32, 25.79, 24.81, 22.11.
【0051】
(実施例1−2)シアル酸修飾オリゴヌクレオチドの合成
DNA polymerase KOD Dash(R)を用いて、dUTP-NeuAcがDNAへ導入されるか否かを検討した。テンプレート(鋳型DNA)として、図4のT1〜T7に示す各配列のものを用い、添付の試薬及び取扱説明書に従って、PCR反応を行い、シアル酸修飾オリゴヌクレオチドを合成した。
【0052】
(実験例1−1)シアル酸修飾オリゴヌクレオチドの合成確認
実施例1−2にて合成した各シアル酸修飾オリゴヌクレオチド(T1〜T7)について、40mer T1、T2、T3、T4、T5、T6、T7 (5 pmol/μl)をテンプレートとして、dATP, dCTP及びdGTP を各々0.2 mM, dUTP-NeuAc 0.2 mM、プライマー(5 pmol/μl)、DNA polymerase KOD Dash(R) 0.1 U/μlの存在下、55 ℃で1 時間インキュベートした後、15 %ポリアクリルアミド電気泳動により確認した。その結果、dUTP-NeuAcが1個(T1)、2個(T2)、5残基おきに4個(T3)、5個(T4)、10個(T5)、15個(T6)が導入されていることが確認された(図5)。
【0053】
(実施例2−1)シアリルラクトース修飾核酸(dUTP-LacNeuAc)の合成
図2の化合物12〜17の詳細な合成方法を以下に示す。
【0054】
1)アセチル化ラクトース(12)の合成
無水酢酸50 ml (531.34 mmol, 18.1 eq) に無水酢酸ナトリウム3.00 g (36.61 mmol, 1.2 eq)を入れ140 ℃で加熱した。そこにラクトース・一水和物10.05 g (27.92 mmol)を加え、10 分間反応させた。その後、反応溶液を氷水250 ml に入れ撹拌し、粘性のある物質を析出させた。得られた固体をエタノールから再結晶を行い白色固体を得た。(収量:18.0 g、収率:95.0 %)
【0055】
2)ヘプタアセチル-α-ブロモラクトース(13)の合成
脱水ジクロロメタン230 mlにα-D-ラクトースオクタアセテート23.25 g (34.3 mmol, 1 eq) を加え、0 ℃に冷却した。33 %臭化水素・酢酸溶液40 mlを加え、90分間撹拌した。TLCにより反応の進行を確認した後、反応液を1 M NaHCO3 100 ml×1, 蒸留水 100 ml×1で分液抽出し、有機層にMgSO4を加え乾燥させろ過した。ろ液を減圧留去して得られた固体をフラッシュカラムクロマトグラフィーhexane : AcOEt = 6 : 4 - 4 : 6により精製し、白色固体を得た。(収量:22.8 g、収率:95 %)
【0056】
3)6-(N-アクロイルアミノ)ヘキシル 2,3,4,6-テトラ-O-アセチル-β-D-ガラクトピラノシル-(1→4)-2,3,6-トリ-O-アセチル-β-D-グルコピラノシド(14)の合成
脱水ジクロロメタン50 mlにヘプタアセチル-α-ブロモラクトース(13)2.09 g (2.98 mmol,)、N-(6-ヒドロキシヘキシル)プロペンアミド(3) 0.610 g (3.56 mmol, 3.1 eq)、炭酸銀0.348 g (1.26 mmol, 1.1 eq)、過塩素酸銀0.251 g (1.21 mmol, 1.1 eq)、180 ℃で3 時間活性化したモレキュラーシーブス4Aを加え、遮光下室温で41時間撹拌した。反応液をセライトでろ過し、ろ液を1 M NaHCO3 100 ml×1、蒸留水100 ml×1で分液抽出し、有機層にMgSO4を加え乾燥させろ過した。ろ液を減圧留去して得られた固体をフラッシュカラムクロマトグラフィー(hexane : AcOEt = 1 : 1 - 0 : 1, AcOEt : MeOH = 1 : 0 - 95 : 5)により精製し、白色固体を得た。(収量:520 mg、収率:22.1 %)
【0057】
1H-NMR (500 MHz; CDCl3): δ 6.28 (dd, J = 17.0, 1.5 Hz, 1H), 6.10 (dd, J = 17.0, 10.3 Hz, 1H), 5.75 (s, 1H), 5.63 (dd, J = 10.3, 1.5 Hz, 1H), 5.35 (dd, J = 3.4, 1.1 Hz, 1H), 5.19 (t, J = 9.3 Hz, 1H), 5.11 (dd, J = 10.4, 7.9 Hz, 1H), 4.96 (dd, J = 10.4, 3.5 Hz, 1H), 4.88 (dd, J = 9.6, 7.9 Hz, 1H), 4.52-4.44 (m, 3H), 4.15-4.06 (m, 3H), 3.89-3.86 (m, 1H), 3.84-3.77 (m, 2H), 3.59 (ddd, J = 9.9, 5.0, 2.1 Hz, 1H), 3.46 (dt, J = 9.7, 6.6 Hz, 1H), 3.34-3.30 (m, 2H), 2.16-1.97 (m, 23H), 1.57-1.51 (m, 4H), 1.36-1.32 (m, 4H); 13C-NMR (126 MHz; CDCl3): δ 170.40, 170.32, 170.11, 170.03, 169.75, 169.65, 169.04, 165.49, 130.92, 126.16, 101.04, 100.55, 76.26, 72.78, 72.58, 71.73, 70.96, 70.65, 69.97, 69.10, 66.59, 61.94, 60.77, 39.43, 29.41, 29.19, 26.52, 25.52, 20.87, 20.79, 20.71, 20.61, 20.48.
【0058】
4)6-(N-アクロイルアミノ)ヘキシルβ-D-ガラクトピラノシル-(1→4)-β-D-グルコピラノシド(15)の合成
脱水メタノール25 mlに、6-(N-アクロイルアミノ)ヘキシル 2,3,4,6-テトラ-O-アセチル-β-D-ガラクトピラノシル-(1→4)-2,3,6-トリ-O-アセチル-β-D-グルコピラノシド(14)475 mg (0.601 mmol, 1 eq)、NaOMe (116 mg 、2.15 mmol, 3.6 eq)を加え、1 時間反応させた。TLCで脱保護の進行を確認した後、アンバーライトIR-120B(H)でイオン交換した。溶液を減圧留去し、フラッシュカラムクロマトグラフィー(CHCl3 : MeOH = 3 : 1 - 7 : 3)により精製し、白色固体を得た。(収量:96 mg、収率 32.2 %、融点183-184 ℃)
【0059】
1H-NMR (500 MHz; D2O): δ 6.25 (dd, J = 17.2, 10.2 Hz, 1H), 6.15 (dd, J = 17.1, 1.3 Hz, 1H), 5.73 (dd, J = 10.2, 1.3 Hz, 1H), 4.50-4.40 (m, 2H), 3.99-3.50 (s, 16H), 3.34-3.20 (3H), 1.68-1.58 (m, 2H), 1.58-1.46 (m, 2H), 1.44-1.28 (m, 4H); 13C-NMR (126 MHz; D2O): δ 168.44, 130.13, 126.92, 102.96, 102.05, 78.46, 75.38, 74.78, 74.49, 72.88, 72.57, 70.99, 70.58, 68.58, 61.04, 60.15, 39.35, 28.62, 28.14, 25.75, 24.69.
【0060】
5)6-(N-アクロイルアミノ)ヘキシル 5-アセタミド-3,5-ジデオキシ-D-グリセロ-α-D-ガラクト-2-ノニュロピラノシロネート)-(2→3)-β-D-ガラクトピラノシル-(1→4)-β-D-グルコピラノシド(16)の合成
bis trisバッファー(15 mM, pH 6.0, 1.0 M NaCl, Triton-X 0.1 %) 10 mlに6-(N-アクロイルアミノ)ヘキシルβ-D-ガラクトピラノシル-(1→4)-β-D-グルコピラノシド(15)100 mg (200μmol)、CMP-NeuAc(シチジン 5'-モノホスホ-β-D-N-アセチルノイラミン酸) 190 mg (300μmol)、α-2,3-シアル酸転移酵素(α-2,3-Sialyltransferase)200 munitを加え、室温で72時間撹拌した。逆相カラムクロマトグラフィー(水-メタノール)により精製し、白色固体を得た。(収量:86 mg、収率:55 %)
【0061】
1H-NMR (500 MHz; D2O): δ 6.12 (dd, J = 17.2, 10.1 Hz, 1H), 6.02 (dd, J = 17.1, 1.2 Hz, 1H), 5.60 (dd, J = 10.2, 1.2 Hz, 1H), 4.39 (d, J = 7.9 Hz, 1H), 4.34 (d, J = 8.0 Hz, 1H), 3.98 (dd, J = 9.9, 2.8 Hz, 1H), 3.89-3.41 (m, 27H), 3.20-3.10 (m, 3H), 2.62 (dd, J = 12.4, 4.5 Hz, 1H), 1.89 (s, 3H), 1.66 (t, J = 12.2 Hz, 1H), 1.54-1.46 (m, 2H), 1.45-1.37 (m, 2H), 1.28-1.18 (m, 4H); 13C-NMR (126 MHz; D2O): δ 168.45, 130.11, 126.90, 102.67, 102.05, 99.83, 78.31, 75.51, 75.18, 74.77, 74.45, 72.90, 72.86, 71.78, 70.56, 69.39, 68.36, 68.12, 67.49, 62.61, 61.04, 60.11, 51.71, 39.66, 39.35, 28.61, 28.11, 25.74, 24.67, 22.06.
【0062】
6)dUTP-LacNeuAc(17)の合成
MilliQ水3.00 mlに6-(N-アクロイルアミノ)ヘキシル 5-アセタミド-3,5-ジデオキシ-D-グリセロ-α-D-ガラクト-2-ノニュロピラノシロネート)-(2→3)-β-D-ガラクトピラノシル-(1→4)-β-D-グルコピラノシド(16)112 mg(231μmol、4eq)とdUTP-HgCl (9)46.1 mg(58.3μmol)、Li2PdCl4 45.8 mg(174μmol、3.00eq)を加え、24時間室温で反応させた。UV吸光光度測定により反応の進行を確認した後、直径5 cmのメンブレンフィルターで反応溶液を濾過し、陰イオン交換クロマトグラフィー(DEAE SephadexTM A-25 2.2g、展開溶媒:50 mM - 1.5 M TEABバッファー pH =7.54)精製を行った。TEABバッファーを減圧留去後、MilliQ水、イオン交換樹脂(DOWEXTM 50W×8; 100 - 200 MESH、Na FORM)を加えて20 分間撹拌した。DOWEXTM 50W×8をろ過した後、溶液を減圧留去し、茶褐色粘稠体を得た。(収量:14 mg、収率:33 %)
【0063】
1H-NMR (500 MHz; D2O): δ 8.18 (s, 1H), 7.23 (d, J = 15.9 Hz, 1H), 6.86 (d, J = 16.0 Hz, 1H), 6.29 (t, J = 6.5 Hz, 1H), 4.68-4.54 (m, 2H), 4.48 (d, J = 7.8 Hz, 1H), 4.42 (d, J = 7.9 Hz, 1H), 4.28-4.21 (m, 3H), 4.21-4.04 (m, 1H), 3.98-3.47 (m, 25H), 3.30-3.23 (m, 3H), 3.20-3.10 (m, 1H), 2.77-2.67 (m, 2H), 2.44-2.29 (m, 2H), 2.03-1.95 (m, 3H), 1.88-1.80 (m, 1H), 1.66-1.46 (m, 4H), 1.40-1.27 (m, 4H); 13C-NMR (126 MHz; D2O): δ 175.05, 172.48, 168.57, 163.98, 150.77, 141.04, 131.44, 121.00, 110.41, 102.71, 102.12, 75.54, 75.12, 70.64, 67.69, 60.93, 39.61, 39.26, 39.21, 28.65, 28.27, 24.72, 22.14, 99.13, 85.96, 78.38, 73.14, 72.93, 74.78, 74.47, 71.30, 70.80, 69.42, 68.23, 67.87, 65.68, 62.89, 60.18, 51.72, 25.82, 25.80.
【0064】
(実施例2−2)シアリルラクトース修飾オリゴヌクレオチドの合成
実施例1−2と同手法により、dUTP-LacNeuAcを含むオリゴヌクレオチドを合成することができた。
【0065】
(実験例2−1)シアリルラクトース酸修飾核酸による赤血球凝集阻害活性
実施例2−1で合成したdUTP-LacNeuAcについて、インフルエンザウイルスとトリ赤血球との赤血球凝集反応に対する阻害効果を確認した。
0.2×105〜6.25×105 pfu/ml の濃度範囲のインフルエンザウイルスA型(A/PR/8/34(H1N1)株)と、0μM〜5μM の濃度範囲のdUTP-LacNeuAc、及びPBSバッファー(pH 7.4)を96-ウェルプレート上で混合し、37 ℃で30 分間インキュベートした。その後、PBSバッファーで1/100〜1/400に希釈したトリ赤血球を添加し、37 ℃でさらに60 分間インキュベートした。
【0066】
dUTP-LacNeuAc濃度を変化させ、赤血球凝集反応が生じる濃度と阻害される濃度の境界を赤血球凝集阻害濃度であると評価した。上記の結果、dUTP-LacNeuAc濃度が2 μM以下であっても、血球凝集阻害効果が認められた(図6参照)。
【0067】
(実験例2−2)シアリルラクトース酸修飾オリゴヌクレオチドによる赤血球凝集阻害活性
実施例2−2で合成した15個のdUTP-LacNeuAcを含むオリゴヌクレオチドについて、実験例2−1と同手法により、トリ赤血球凝集反応の阻害効果を確認した。上記の結果、上記オリゴヌクレオチドの濃度が40 nM以下であっても、血球凝集阻害効果が認められた(図7参照)。
【産業上の利用可能性】
【0068】
以上詳述したように本発明の糖修飾核酸を用いて、糖修飾オリゴヌクレオチドを作製する場合は、テンプレート(鋳型DNA)の塩基配列に応じて、導入する糖鎖の数や立体的な位置を制御することができるので、HAの糖鎖結合サイトの構造を考慮した分子設計を行うことができる。また、実際にオリゴヌクレオチドへの糖残基の導入は、DNAポリメラーゼを用いて行うため、化合物の合成及び精製を容易に行うことができる。さらに、本発明の糖修飾核酸は、生体内において、最終的には生体内のヌクレアーゼで分解されるため、生体毒性がほとんどないことが期待される。
【0069】
現在、インフルエンザ治療薬の主流であるタミフル(商品名)は、1 nMの濃度でインフルエンザの感染を阻害することができる。一方、本発明の糖修飾核酸を含む糖修飾オリゴヌクレオチドの設計により、少なくともオリゴヌクレオチドの濃度が40 nM以下であっても、血球凝集阻害効果が認められた。オリゴヌクレオチドの設計によっては、108 M-1の結合定数でインフルエンザウイルスと結合することが期待され、10 nMで感染を阻害できることとなり、タミフルに匹敵する治療薬となりうる。さらに、本発明の糖修飾核酸は、インフルエンザウイルスに対して変異の少ないHAのシアル酸結合部位をターゲットにするため、どのように変異したウイルスに対しても、吸着、結合能を維持することができる。
【0070】
したがって、本発明の糖修飾核酸又は糖修飾オリゴヌクレオチドを有効成分として含む抗インフルエンザ剤は、インフルエンザ治療剤又はインフルエンザウイルス捕捉剤として有用である。
【特許請求の範囲】
【請求項1】
糖と核酸がリンカーを介して結合しており、糖としてシアル酸を含むことを特徴とする、糖修飾核酸。
【請求項2】
前記糖が、シアリルラクトースである、請求項1に記載の糖修飾核酸。
【請求項3】
前記シアリルラクトースが、2-6型シアリルラクトース又は2-3型シアリルラクトースである、請求項2に記載の糖修飾核酸。
【請求項4】
請求項1〜3のいずれか1に記載の糖修飾核酸を含む糖修飾オリゴヌクレオチド。
【請求項5】
請求項1〜3のいずれか1に記載の糖修飾核酸、あるいは請求項4に記載の糖修飾オリゴヌクレオチドを有効成分として含む抗インフルエンザ剤。
【請求項6】
抗インフルエンザ剤が、インフルエンザ治療剤又はインフルエンザウイルス捕捉剤である、請求項5に記載の抗インフルエンザ剤。
【請求項7】
以下の工程を含む、請求項1〜3のいずれか1に記載の糖修飾核酸の製造方法:
1)シアル酸誘導体修飾アクリルアミドを合成する工程;
2)前記シアル酸誘導体修飾アクリルアミドをパラジウム触媒を用いてヌクレオシド3リン酸に付加する工程。
【請求項8】
請求項1〜3のいずれか1に記載の糖修飾核酸、基質としてのdNTP及びDNAポリメラーゼを少なくとも用いることを特徴とする、請求項4に記載の糖修飾オリゴヌクレオチドの製造方法。
【請求項9】
核酸増幅方法により作製される請求項8に記載の糖修飾オリゴヌクレオチドの製造方法。
【請求項10】
請求項1〜3のいずれか1に記載の糖修飾核酸、基質としてのdNTP及びDNAポリメラーゼを少なくとも含む、請求項4に記載の糖修飾オリゴヌクレオチド作製用キット。
【請求項1】
糖と核酸がリンカーを介して結合しており、糖としてシアル酸を含むことを特徴とする、糖修飾核酸。
【請求項2】
前記糖が、シアリルラクトースである、請求項1に記載の糖修飾核酸。
【請求項3】
前記シアリルラクトースが、2-6型シアリルラクトース又は2-3型シアリルラクトースである、請求項2に記載の糖修飾核酸。
【請求項4】
請求項1〜3のいずれか1に記載の糖修飾核酸を含む糖修飾オリゴヌクレオチド。
【請求項5】
請求項1〜3のいずれか1に記載の糖修飾核酸、あるいは請求項4に記載の糖修飾オリゴヌクレオチドを有効成分として含む抗インフルエンザ剤。
【請求項6】
抗インフルエンザ剤が、インフルエンザ治療剤又はインフルエンザウイルス捕捉剤である、請求項5に記載の抗インフルエンザ剤。
【請求項7】
以下の工程を含む、請求項1〜3のいずれか1に記載の糖修飾核酸の製造方法:
1)シアル酸誘導体修飾アクリルアミドを合成する工程;
2)前記シアル酸誘導体修飾アクリルアミドをパラジウム触媒を用いてヌクレオシド3リン酸に付加する工程。
【請求項8】
請求項1〜3のいずれか1に記載の糖修飾核酸、基質としてのdNTP及びDNAポリメラーゼを少なくとも用いることを特徴とする、請求項4に記載の糖修飾オリゴヌクレオチドの製造方法。
【請求項9】
核酸増幅方法により作製される請求項8に記載の糖修飾オリゴヌクレオチドの製造方法。
【請求項10】
請求項1〜3のいずれか1に記載の糖修飾核酸、基質としてのdNTP及びDNAポリメラーゼを少なくとも含む、請求項4に記載の糖修飾オリゴヌクレオチド作製用キット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2012−56904(P2012−56904A)
【公開日】平成24年3月22日(2012.3.22)
【国際特許分類】
【出願番号】特願2010−202991(P2010−202991)
【出願日】平成22年9月10日(2010.9.10)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成22年3月12日、社団法人 日本化学会 発行の、「日本化学会第90春季年会2010年講演予稿集III」にて発表
【出願人】(504150450)国立大学法人神戸大学 (421)
【Fターム(参考)】
【公開日】平成24年3月22日(2012.3.22)
【国際特許分類】
【出願日】平成22年9月10日(2010.9.10)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成22年3月12日、社団法人 日本化学会 発行の、「日本化学会第90春季年会2010年講演予稿集III」にて発表
【出願人】(504150450)国立大学法人神戸大学 (421)
【Fターム(参考)】
[ Back to top ]

