糖鎖改変ウリナスタチンの製造方法
【課題】 計画的な改変デザインの下で、改変前のウリナスタチンが持つグリコサミノグリカン糖鎖を異なるグリコサミノグリカン糖鎖に付け替えることで得られる糖鎖改変ウリナスタチンの製造方法を提供すること。
【解決手段】 ウリナスタチンが持つグリコサミノグリカン糖鎖の非還元末端側の少なくとも一部を、エンド型グリコシダーゼを用いた加水分解反応によって遊離させた後、供与体とするグリコサミノグリカンを糖転移反応によって代わりに結合させることを特徴とする。
【解決手段】 ウリナスタチンが持つグリコサミノグリカン糖鎖の非還元末端側の少なくとも一部を、エンド型グリコシダーゼを用いた加水分解反応によって遊離させた後、供与体とするグリコサミノグリカンを糖転移反応によって代わりに結合させることを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、計画的な改変デザインの下で、改変前のウリナスタチンが持つグリコサミノグリカン糖鎖を異なるグリコサミノグリカン糖鎖に付け替えることで得られる糖鎖改変ウリナスタチンの製造方法に関する。
【背景技術】
【0002】
ヒトの尿中より抽出、精製される天然型ウリナスタチン(尿中トリプシンインヒビター:UTI)は、図2に示す1次構造を有する分子量が約67,000の糖タンパク質であり(非特許文献1)、種々のプロテアーゼに対する阻害活性を有し、急性膵炎や急性循環不全などの処置のための医薬品として用いられている。天然型ウリナスタチンは、そのコアタンパク質のN末端から10番目のセリン残基に、-Xyl-Gal-Gal-GlcA-の橋渡し4糖構造を介して、還元末端側にコンドロイチン4-硫酸、非還元末端側にコンドロイチンからなる硫酸化部位の偏った構造的特徴を持つ低硫酸化コンドロイチン硫酸が結合したグリコサミノグリカン糖鎖を持つ(非特許文献2、非特許文献3)。一般に糖タンパク質が持つ糖鎖は種々の生理的意義を担っていることから、近年、天然型ウリナスタチンが持つグリコサミノグリカン糖鎖の本質的な機能についても注目されているが、その解明は未だ十分になされていない。天然型ウリナスタチンが持つグリコサミノグリカン糖鎖を他のグリコサミノグリカン糖鎖に計画的な改変デザインの下で改変することができれば、天然型ウリナスタチンと糖鎖改変ウリナスタチンとの生理活性の比較を行うことにより、天然型ウリナスタチンが持つグリコサミノグリカン糖鎖の機能解明を大きく前進させることができることに加え、天然型ウリナスタチンの生理活性の向上や改善などが図られた糖鎖改変ウリナスタチンを創薬することができる可能性もある。しかしながら、これまでにそのような改変を行ったとする報告は、本発明者らが知る限りにおいて存在しない。
【非特許文献1】Watcher, E, and Hochstrasser, K. Hoppe. Seylers. Z. Physiol. Chem., 362, 1351, 1981
【非特許文献2】Toyoda, S, Kobayashi, H, Sakamoto, S, Toida, T, and Imanari, T. Biol. Pharm. Bull., 16, 945-947, 1993
【非特許文献3】Kakizaki, I, Takahashi, R, Ibori, N, Kojima, K, Takahashi, T, Yamaguchi, M, Kon, A, and Takagaki, K. Biochim. Biophys. Acta., 1770, 171- 177, 2007
【発明の開示】
【発明が解決しようとする課題】
【0003】
そこで本発明は、計画的な改変デザインの下で、改変前のウリナスタチンが持つグリコサミノグリカン糖鎖を異なるグリコサミノグリカン糖鎖に付け替えることで得られる糖鎖改変ウリナスタチンの製造方法を提供することを目的とする。
【課題を解決するための手段】
【0004】
本発明者らは、上記の点に鑑みて鋭意研究を重ねた結果、エンド型グリコシダーゼの1つであるヒアルロニダーゼを用いた加水分解反応と糖転移反応を利用することで、天然型ウリナスタチンのコアタンパク質に影響を及ぼすことなくそのグリコサミノグリカン糖鎖を他のグリコサミノグリカン糖鎖に計画的な改変デザインの下で改変できること、天然型ウリナスタチンが持つグリコサミノグリカン糖鎖を、ヒアルロン酸からなるグリコサミノグリカン糖鎖に改変して得られる糖鎖改変ウリナスタチンは、天然型ウリナスタチンが有するトリプシン阻害活性を保持したままで、ヒアルロニダーゼ阻害活性が消失したものであることを見出した。
【0005】
上記の知見に基づいてなされた本発明の糖鎖改変ウリナスタチンの製造方法は、請求項1記載の通り、ウリナスタチンが持つグリコサミノグリカン糖鎖の非還元末端側の少なくとも一部を、エンド型グリコシダーゼを用いた加水分解反応によって遊離させた後、供与体とするグリコサミノグリカンを糖転移反応によって代わりに結合させることを特徴とする。
また、請求項2記載の製造方法は、請求項1記載の製造方法において、エンド型グリコシダーゼがヒアルロニダーゼであることを特徴とする。
また、請求項3記載の製造方法は、請求項1または2記載の製造方法において、供与体とするグリコサミノグリカンがヒアルロン酸、コンドロイチン、コンドロイチン硫酸から選ばれる少なくとも1種であることを特徴とする。
また、請求項4記載の製造方法は、請求項3記載の製造方法において、コンドロイチン硫酸がコンドロイチン硫酸A、コンドロイチン硫酸C、コンドロイチン硫酸D、コンドロイチン硫酸Eから選ばれる少なくとも1種であることを特徴とする。
また、本発明の糖鎖改変ウリナスタチンは、請求項5記載の通り、ヒアルロン酸、コンドロイチン、コンドロイチン硫酸から選ばれる少なくとも1種のグリコサミノグリカンを少なくとも一部に含むグリコサミノグリカン糖鎖を持つことを特徴とする。
また、本発明のプロテアーゼ阻害剤は、請求項6記載の通り、ヒアルロン酸、コンドロイチン、コンドロイチン硫酸から選ばれる少なくとも1種のグリコサミノグリカンを少なくとも一部に含むグリコサミノグリカン糖鎖を持つ糖鎖改変ウリナスタチンを有効成分とすることを特徴とする。
【発明の効果】
【0006】
本発明によれば、計画的な改変デザインの下で、改変前のウリナスタチンが持つグリコサミノグリカン糖鎖を異なるグリコサミノグリカン糖鎖に付け替えることで得られる糖鎖改変ウリナスタチンの製造方法を提供することができる。
【発明を実施するための最良の形態】
【0007】
本発明の糖鎖改変ウリナスタチンの製造方法は、ウリナスタチンが持つグリコサミノグリカン糖鎖の非還元末端側の少なくとも一部を、エンド型グリコシダーゼを用いた加水分解反応によって遊離させた後、供与体とするグリコサミノグリカンを糖転移反応によって代わりに結合させることを特徴とするものである。
【0008】
本発明の糖鎖改変ウリナスタチンの製造方法において用いることができるエンド型グリコシダーゼは、改変前のウリナスタチンが持つグリコサミノグリカン糖鎖の非還元末端側の少なくとも一部を遊離させるための加水分解反応と、その後、欠失させたグリコサミノグリカンの代わりに、供与体とするグリコサミノグリカンを結合させるための糖転移反応を行えるものであればどのようなものであってもよい。供与体とするグリコサミノグリカンの糖転移反応による結合は、供与体とするグリコサミノグリカンがいったん加水分解されて遊離した構成糖が次々に結合することにより糖鎖が伸張することで達成されるものであってもよいし、供与体とするグリコサミノグリカンがそのまま欠失させたグリコサミノグリカンに置き換わることで達成されるものであってもよい。
【0009】
本発明の糖鎖改変ウリナスタチンの製造方法において用いることができるエンド型グリコシダーゼの具体例としては、ヒアルロニダーゼを挙げることができる(必要であれば例えばIwafune, M, Kakizaki, I, Yukawa, M, Kudo, D, Ota, S, Endo, M, and Takagaki, K. Biochem. Biophys. Res. Commun., 297, 1167-1170, 2002を参照のこと)。例えば、エンド型グリコシダーゼとしてヒアルロニダーゼを用いた場合、36〜38℃、pH3.5〜4.5の条件下において、改変前のウリナスタチンが持つグリコサミノグリカン糖鎖の非還元末端側から構成糖が2糖ずつ遊離するように糖鎖に存在するグリコシド結合を加水分解させることができ、その結果として、橋渡し4糖構造を含む4〜6糖を残してその非還元末端側が欠失した糖鎖欠損ウリナスタチンを得ることができる。また、36〜38℃、pH6.5〜7.5の条件下において、供与体とするグリコサミノグリカンを加水分解させて構成糖を2糖ずつ遊離させるとともに、遊離した構成糖を2糖ずつ上記の糖鎖欠損ウリナスタチンの残った糖鎖の非還元末端側に次々に結合させて糖鎖を伸張させることでき、その結果として、欠失させたグリコサミノグリカンの代わりに、供与体とするグリコサミノグリカンが結合した糖鎖改変ウリナスタチンを得ることができる。
【0010】
本発明の糖鎖改変ウリナスタチンの製造方法において供与体とすることができるグリコサミノグリカンの具体例としては、ヒアルロン酸の他、コンドロイチン、コンドロイチン硫酸、例えば、コンドロイチン硫酸A(コンドロイチン4-硫酸)、コンドロイチン硫酸C(コンドロイチン6-硫酸)、コンドロイチン硫酸D、コンドロイチン硫酸Eなどを挙げることができる。供与体とするグリコサミノグリカンは、単一のグリコサミノグリカンを糖転移反応に付してもよいし、異なるグリコサミノグリカンを段階的に糖転移反応に付してもよい。異なるグリコサミノグリカンを段階的に糖転移反応に付した場合、異なるクラスター構造を有するグリコサミノグリカン糖鎖を持つ糖鎖改変ウリナスタチンを得ることができる。
【0011】
なお、本発明の糖鎖改変ウリナスタチンの製造方法における糖鎖改変の対象となるウリナスタチンは、ヒトの尿中より抽出、精製される天然型ウリナスタチンの他、動物細胞や昆虫細胞や酵母を用いた遺伝子工学的手法によって発現させた、コアタンパク質のアミノ酸配列が天然型ウリナスタチンのアミノ酸配列と同じであるウリナスタチンや、コアタンパク質のアミノ酸配列が天然型ウリナスタチンのアミノ酸配列に対して1以上のアミノ酸が置換・欠失・付加・挿入されたアミノ酸配列であるウリナスタチンなどであってもよい。
【0012】
本発明の糖鎖改変ウリナスタチンの製造方法によれば、計画的な改変デザインの下で、改変前のウリナスタチンが持つグリコサミノグリカン糖鎖とは異なるグリコサミノグリカン糖鎖を持つウリナスタチンを得ることができる。従って、それぞれ異なるグリコサミノグリカン糖鎖を持つ複数種類のウリナスタチンの生理活性の比較を行うことにより、ウリナスタチンが持つグリコサミノグリカン糖鎖の機能解明を行うことができる。また、現在、医薬品として用いられている天然型ウリナスタチンに対して生理活性の向上や改善などが図られた次世代ウリナスタチンの探索を行うこともできる。
【実施例】
【0013】
以下、本発明を実施例によって詳細に説明するが、本発明は以下の記載に限定して解釈されるものではない。
【0014】
実施例1:糖鎖改変ウリナスタチンの製造(その1)
(1)精製ウリナスタチンの調製
中国のBiotech Center Shanghai Institute of Pharmaceutical Industryから購入したヒト尿中由来の部分精製ウリナスタチン(10 x 107units)を、DEAE-Cellulofineカラム(内径15cm x 長さ17cm,生化学工業,東京,日本)を用いて精製した。カラムの平衡化は50mM acetate buffer,pH4.0を用いて行い、50mM NaH2PO4 - 50mM NaCl,pH4.0で洗浄後、ウリナスタチンを50mM NaH2PO4 - 300mM NaCl,pH4.0で溶出した。ウリナスタチンを含むフラクションは、吸光度280nmとトリプシンインヒビター活性の測定(日本薬局方およびKassell, B. (1970) Bovine trypsin-kallikrein inhibitor (Kunitz inhibitor, basic pancreatic trypsin inhibitor, polyvalent inhibitor from bovine organs). Methods Enzymol., 19, 844-852)によりモニターした。ウリナスタチンを含むフラクションを集め、NaOHでpHを7.0に合わせた後、限外ろ過膜PM10 membrane(ミリポア, 東京, 日本)を用いて濃縮した。混入するヒト尿中カリクレインを除くために、濃縮されたウリナスタチンを、0.1M phosphate buffer,pH7.0で平衡化したaprotinin-Sepharose 6B column(内径5.0cm x 長さ17.5cm)でさらに精製し(Geiger, R, Stuckstedte, U, and Fritz, H. (1980) Isolation and characterization of human urinary kallikrein. Hoppe. Seylers. Z. Physiol. Chem., 361, 1003-1016)、最終的にPM10 membraneで濃縮することで、精製ウリナスタチンを得た。
【0015】
(2)ヒアルロニダーゼを用いた加水分解反応による糖鎖欠損ウリナスタチンの調製
(1)で調製した精製ウリナスタチン50nmolとウシ精巣性ヒアルロニダーゼ(シグマ,セントルイス,米国)5mgとを、タンパク質分解酵素阻害剤であるPMSFを最終濃度で1mMになるように添加した0.1M sodium acetate buffer,pH4.0 - 0.15M NaCl(総容量1ml)中で、37℃で一晩インキュベートした後、0.1M Tris-HCl,pH7.0で平衡化したゲルろ過カラム(Sephadex G-100)でウリナスタチンを分離した。ウリナスタチンを含むフラクションは、吸光度280nm、抗ウリナスタチン抗体を用いたwestern blotting、SDS-PAGEなどでモニターし、PM10 membraneで濃縮することで、糖鎖欠損ウリナスタチンを得た。なお、同様の方法で、ダンシル化したウリナスタチンを用いて糖鎖欠損ダンシル化ウリナスタチンを調製した。
【0016】
(3)ヒアルロニダーゼを用いた糖転移反応による糖鎖改変ウリナスタチンの調製
受容体(アクセプター)としての(2)で調製した糖鎖欠損ウリナスタチン25nmolと、供与体(ドナー)としての過剰量のヒアルロン酸(分子量:約80,000)と、ウシ精巣性ヒアルロニダーゼ0.3mgとを、タンパク質分解酵素阻害剤であるPMSFを最終濃度で1mMになるように添加した0.1M Tris-HCl,pH7.0(総容量0.4ml)中で、37℃で1時間インキュベートした後、0.1M Tris-HCl,pH4.0で平衡化したゲルろ過カラム(Sephadex G-100)でウリナスタチンを分離した。ウリナスタチンを含むフラクションは、吸光度280nm、抗ウリナスタチン抗体を用いたwestern blotting、SDS-PAGEなどでモニターし、PM10 membraneで濃縮することで、糖鎖改変ウリナスタチンを得た。なお、同様の方法で、(2)で調製した糖鎖欠損ダンシル化ウリナスタチンを用いて糖鎖改変ダンシル化ウリナスタチンを調製した。
【0017】
(糖鎖改変ウリナスタチンが持つグリコサミノグリカン糖鎖の検証)
(1)糖鎖改変ウリナスタチンが糖鎖欠損ウリナスタチンから糖鎖が伸張したものであることの証明
ダンシル化したウリナスタチン、糖鎖欠損ダンシル化ウリナスタチン、糖鎖改変ダンシル化ウリナスタチンを15%のアクリルアミドゲルを含むゲルで電気泳動(SDS-PAGE)し、UV照射によりダンシル基の蛍光を検出した。合わせて、クマシーブリリアントブルー(CBB)によるタンパク質染色も行った。その結果、ダンシル化したウリナスタチンは精製ウリナスタチンと同じ、分子量32,500付近に検出された。また、糖鎖欠損ダンシル化ウリナスタチンは分子量25,000付近に検出され、糖鎖改変ダンシル化ウリナスタチンは分子量25,000から62,000を中心として高分子領域にまで広い分子量分布を示した。糖鎖改変ダンシル化ウリナスタチンを、ヒアルロン酸に特異的な分解酵素であるStreptomyceshyaluronidase(生化学工業,東京,日本)を用いて徹底消化(0.1M sodium acetate buffer,pH6.0中で60℃、2時間反応させた後、酵素を足して37℃、16時間反応)すると、高分子領域に分布していたタンパク質のバンドが消え、糖鎖欠損ダンシル化ウリナスタチンと同じ分子量のタンパク質が検出された。以上の結果から、ヒアルロニダーゼを用いた糖転移反応によって糖鎖欠損ウリナスタチンに結合したグリコサミノグリカンはヒアルロン酸であることがわかった。以上の結果は、Shodex OH pak SB804およびShodex OH pak SB803(ともに内径8.0mm x 長さ300mm,Shodex,昭和電工,川崎,日本,溶出液は0.2M NaCl)を用いたゲルろ過HPLCを行った結果によっても支持された。
【0018】
次に、精製ウリナスタチン、糖鎖欠損ウリナスタチン、糖鎖改変ウリナスタチンの糖鎖分析を行った。具体的には、それぞれのウリナスタチンをプロテアーゼ(アクチナーゼE,科研製薬,東京,日本)で徹底消化(0.1M Tris-HCl buffer,pH8.0 - 0.01M CaCl2中で45℃、途中で酵素を足して16時間反応)して、コアタンパク質部分を短いペプチドとした。その後、エンド-β-キシロシダーゼ消化(0.1M sodium acetate buffer,pH4.0でエキソ型グリコシダーゼ阻害剤である25mM glucono-δ-lactone存在下で37℃、16時間反応)により、ペプチドに結合していたグリコサミノグリカン糖鎖を無傷で遊離させ、2-アミノピリジン(PA)により還元末端を蛍光標識した(Hase, S, Ibuki, T, and Ikenaka, T. (1984) Reexamination of the pyridylamination used for fluorescence labeling of oligosaccharides and its application to glycoproteins. J. Biochem (Tokyo). 95, 197-203およびKon, A, Takagaki, K, Kawasaki, H, Nakamura, T, and Endo M. (1991) Application of 2-aminopyridine fluorescence labeling to glycosaminoglycans. J. Biochem. (Tokyo). 110, 132-135)。PAにより蛍光標識されたそれぞれのグリコサミノグリカン糖鎖の糖鎖長を、TSKgel Amide-80 column(内径4.6mm x 長さ250mm,東ソー,東京,日本)を用いた順相HPLCで見積もった。HPLCは、A液;3% 酢酸 - トリエチルアミン(pH7.3)/ アセトニトリル(20/80, v/v)とB液;3% 酢酸 - トリエチルアミン(pH7.3)/ アセトニトリル(50/50, v/v)を用い、流速1.0ml/minとし、サンプルをインジェクトした後、120分かけてA液が100%からB液が100%になるようなlinear gradientでサンプルを溶出した。検出はex 320nm,em 400nmで行った。その結果、糖鎖欠損ウリナスタチンは、橋渡し4糖構造を含む4〜6糖分の糖鎖を持つこと、糖鎖改変ウリナスタチンは、糖鎖欠損ウリナスタチンが持つ糖鎖に対して少なくとも約40糖のヒアルロン酸が結合したものであることがわかった。
【0019】
(2)糖鎖改変ウリナスタチンが持つグリコサミノグリカン糖鎖がヒアルロン酸からなることの証明
糖鎖改変ウリナスタチンがヒアルロン酸結合タンパク質(HABP)に結合することをwestern-blotting likeな方法により確認することで、糖鎖改変ウリナスタチンが持つグリコサミノグリカン糖鎖がヒアルロン酸からなることを証明できた。また、糖鎖改変ウリナスタチンが持つグリコサミノグリカン糖鎖がヒアルロン酸からなることは、ヒアルロン酸に特異的な分解酵素であるStreptomyceshyaluronidaseを用いて糖鎖改変ウリナスタチンを消化した場合、消化後のウリナスタチンはHABPに結合しないことからも証明できた。
【0020】
(ヒアルロン酸からなるグリコサミノグリカン糖鎖を持つ糖鎖改変ウリナスタチンの生理活性)
(1)トリプシン阻害活性
N-alpha-ベンゾイル-L-アルギニン-4-ニトリロアニリドをトリプシンの基質に用いる日本薬局方の方法に従い、精製ウリナスタチンと糖鎖改変ウリナスタチンのトリプシン阻害活性を測定したところ、両者の間に活性の差はなく、いずれも高いトリプシン阻害活性を有していた。
【0021】
(2)ヒアルロニダーゼ阻害活性
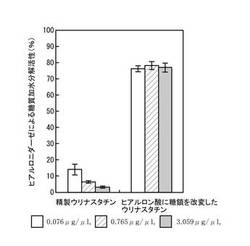
精製ウリナスタチンと糖鎖改変ウリナスタチンのヒアルロニダーゼ阻害活性(ヒアルロニダーゼによる糖質加水分解活性に及ぼす影響)を、Salmen, S, Hoechstetter, J, Kasbauer, C, Paper, D. H, Bernhardt, G, and Buschauer, A. Sulphated oligosaccharides as inhibitors of hyaluronidases from bovine testis, bee venom and Streptococcus agalactiae. Planta Med. (2005) 71(8) : 727-732に記載の方法に従って測定した。結果を図1に示す(ヒアルロン酸を基質とした場合のヒアルロニダーゼの加水分解活性(A%)をA(%)=[(B-C)/(D-E)]X100の計算式によって算出した。式中、Bは試験物質とヒアルロニダーゼを含む反応液の吸光度、Cは試験物質を含みヒアルロニダーゼを含まない反応液の吸光度、Dは試験物質を含まずヒアルロニダーゼを含む反応液の吸光度、Eは試験物質もヒアルロニダーゼも含まない反応液の吸光度を意味する)。図1から明らかなように、精製ウリナスタチンは、濃度依存的にヒアルロニダーゼ阻害活性を示したが、糖鎖改変ウリナスタチンは、濃度に関係なくヒアルロニダーゼ阻害活性を示さなかった。
【0022】
(3)まとめ
以上の結果から、ヒアルロン酸からなるグリコサミノグリカン糖鎖を持つ糖鎖改変ウリナスタチンは、天然型ウリナスタチンが有するトリプシン阻害活性を保持したままで、ヒアルロニダーゼ阻害活性が消失しており、トリプシン阻害活性の特異性が相対的に高められたプロテアーゼ阻害剤として有用であることがわかった。このようなプロテアーゼ阻害剤は、宿主の生体組織が感染防御のために分泌する糖質加水分解酵素の活性を阻害しないことから、ウイルスなどの外来生物に対する感染阻害効果が高いことが期待できる。
【0023】
実施例2:糖鎖改変ウリナスタチンの製造(その2)
実施例1における供与体としてのヒアルロン酸の代わりにコンドロイチン(分子量:約10,000)を用いること以外は実施例1と同様にして、コンドロイチンからなるグリコサミノグリカン糖鎖を持つ糖鎖改変ウリナスタチンを得た。
【0024】
実施例3:糖鎖改変ウリナスタチンの製造(その3)
実施例1における供与体としてのヒアルロン酸の代わりにコンドロイチン4-硫酸(分子量:約30,000)を用いること以外は実施例1と同様にして、コンドロイチン4-硫酸からなるグリコサミノグリカン糖鎖を持つ糖鎖改変ウリナスタチンを得た。
【0025】
実施例4:糖鎖改変ウリナスタチンの製造(その4)
実施例1における供与体としてのヒアルロン酸の代わりにコンドロイチン6-硫酸(分子量:約60,000)を用いること以外は実施例1と同様にして、コンドロイチン6-硫酸からなるグリコサミノグリカン糖鎖を持つ糖鎖改変ウリナスタチンを得た。
【産業上の利用可能性】
【0026】
本発明は、計画的な改変デザインの下で、改変前のウリナスタチンが持つグリコサミノグリカン糖鎖を異なるグリコサミノグリカン糖鎖に付け替えることで得られる糖鎖改変ウリナスタチンの製造方法を提供することができる点において産業上の利用可能性を有する。
【図面の簡単な説明】
【0027】
【図1】実施例1におけるヒアルロン酸からなるグリコサミノグリカン糖鎖を持つ糖鎖改変ウリナスタチンのヒアルロニダーゼ阻害活性を示すグラフである。
【図2】天然型ウリナスタチンの1次構造である。
【技術分野】
【0001】
本発明は、計画的な改変デザインの下で、改変前のウリナスタチンが持つグリコサミノグリカン糖鎖を異なるグリコサミノグリカン糖鎖に付け替えることで得られる糖鎖改変ウリナスタチンの製造方法に関する。
【背景技術】
【0002】
ヒトの尿中より抽出、精製される天然型ウリナスタチン(尿中トリプシンインヒビター:UTI)は、図2に示す1次構造を有する分子量が約67,000の糖タンパク質であり(非特許文献1)、種々のプロテアーゼに対する阻害活性を有し、急性膵炎や急性循環不全などの処置のための医薬品として用いられている。天然型ウリナスタチンは、そのコアタンパク質のN末端から10番目のセリン残基に、-Xyl-Gal-Gal-GlcA-の橋渡し4糖構造を介して、還元末端側にコンドロイチン4-硫酸、非還元末端側にコンドロイチンからなる硫酸化部位の偏った構造的特徴を持つ低硫酸化コンドロイチン硫酸が結合したグリコサミノグリカン糖鎖を持つ(非特許文献2、非特許文献3)。一般に糖タンパク質が持つ糖鎖は種々の生理的意義を担っていることから、近年、天然型ウリナスタチンが持つグリコサミノグリカン糖鎖の本質的な機能についても注目されているが、その解明は未だ十分になされていない。天然型ウリナスタチンが持つグリコサミノグリカン糖鎖を他のグリコサミノグリカン糖鎖に計画的な改変デザインの下で改変することができれば、天然型ウリナスタチンと糖鎖改変ウリナスタチンとの生理活性の比較を行うことにより、天然型ウリナスタチンが持つグリコサミノグリカン糖鎖の機能解明を大きく前進させることができることに加え、天然型ウリナスタチンの生理活性の向上や改善などが図られた糖鎖改変ウリナスタチンを創薬することができる可能性もある。しかしながら、これまでにそのような改変を行ったとする報告は、本発明者らが知る限りにおいて存在しない。
【非特許文献1】Watcher, E, and Hochstrasser, K. Hoppe. Seylers. Z. Physiol. Chem., 362, 1351, 1981
【非特許文献2】Toyoda, S, Kobayashi, H, Sakamoto, S, Toida, T, and Imanari, T. Biol. Pharm. Bull., 16, 945-947, 1993
【非特許文献3】Kakizaki, I, Takahashi, R, Ibori, N, Kojima, K, Takahashi, T, Yamaguchi, M, Kon, A, and Takagaki, K. Biochim. Biophys. Acta., 1770, 171- 177, 2007
【発明の開示】
【発明が解決しようとする課題】
【0003】
そこで本発明は、計画的な改変デザインの下で、改変前のウリナスタチンが持つグリコサミノグリカン糖鎖を異なるグリコサミノグリカン糖鎖に付け替えることで得られる糖鎖改変ウリナスタチンの製造方法を提供することを目的とする。
【課題を解決するための手段】
【0004】
本発明者らは、上記の点に鑑みて鋭意研究を重ねた結果、エンド型グリコシダーゼの1つであるヒアルロニダーゼを用いた加水分解反応と糖転移反応を利用することで、天然型ウリナスタチンのコアタンパク質に影響を及ぼすことなくそのグリコサミノグリカン糖鎖を他のグリコサミノグリカン糖鎖に計画的な改変デザインの下で改変できること、天然型ウリナスタチンが持つグリコサミノグリカン糖鎖を、ヒアルロン酸からなるグリコサミノグリカン糖鎖に改変して得られる糖鎖改変ウリナスタチンは、天然型ウリナスタチンが有するトリプシン阻害活性を保持したままで、ヒアルロニダーゼ阻害活性が消失したものであることを見出した。
【0005】
上記の知見に基づいてなされた本発明の糖鎖改変ウリナスタチンの製造方法は、請求項1記載の通り、ウリナスタチンが持つグリコサミノグリカン糖鎖の非還元末端側の少なくとも一部を、エンド型グリコシダーゼを用いた加水分解反応によって遊離させた後、供与体とするグリコサミノグリカンを糖転移反応によって代わりに結合させることを特徴とする。
また、請求項2記載の製造方法は、請求項1記載の製造方法において、エンド型グリコシダーゼがヒアルロニダーゼであることを特徴とする。
また、請求項3記載の製造方法は、請求項1または2記載の製造方法において、供与体とするグリコサミノグリカンがヒアルロン酸、コンドロイチン、コンドロイチン硫酸から選ばれる少なくとも1種であることを特徴とする。
また、請求項4記載の製造方法は、請求項3記載の製造方法において、コンドロイチン硫酸がコンドロイチン硫酸A、コンドロイチン硫酸C、コンドロイチン硫酸D、コンドロイチン硫酸Eから選ばれる少なくとも1種であることを特徴とする。
また、本発明の糖鎖改変ウリナスタチンは、請求項5記載の通り、ヒアルロン酸、コンドロイチン、コンドロイチン硫酸から選ばれる少なくとも1種のグリコサミノグリカンを少なくとも一部に含むグリコサミノグリカン糖鎖を持つことを特徴とする。
また、本発明のプロテアーゼ阻害剤は、請求項6記載の通り、ヒアルロン酸、コンドロイチン、コンドロイチン硫酸から選ばれる少なくとも1種のグリコサミノグリカンを少なくとも一部に含むグリコサミノグリカン糖鎖を持つ糖鎖改変ウリナスタチンを有効成分とすることを特徴とする。
【発明の効果】
【0006】
本発明によれば、計画的な改変デザインの下で、改変前のウリナスタチンが持つグリコサミノグリカン糖鎖を異なるグリコサミノグリカン糖鎖に付け替えることで得られる糖鎖改変ウリナスタチンの製造方法を提供することができる。
【発明を実施するための最良の形態】
【0007】
本発明の糖鎖改変ウリナスタチンの製造方法は、ウリナスタチンが持つグリコサミノグリカン糖鎖の非還元末端側の少なくとも一部を、エンド型グリコシダーゼを用いた加水分解反応によって遊離させた後、供与体とするグリコサミノグリカンを糖転移反応によって代わりに結合させることを特徴とするものである。
【0008】
本発明の糖鎖改変ウリナスタチンの製造方法において用いることができるエンド型グリコシダーゼは、改変前のウリナスタチンが持つグリコサミノグリカン糖鎖の非還元末端側の少なくとも一部を遊離させるための加水分解反応と、その後、欠失させたグリコサミノグリカンの代わりに、供与体とするグリコサミノグリカンを結合させるための糖転移反応を行えるものであればどのようなものであってもよい。供与体とするグリコサミノグリカンの糖転移反応による結合は、供与体とするグリコサミノグリカンがいったん加水分解されて遊離した構成糖が次々に結合することにより糖鎖が伸張することで達成されるものであってもよいし、供与体とするグリコサミノグリカンがそのまま欠失させたグリコサミノグリカンに置き換わることで達成されるものであってもよい。
【0009】
本発明の糖鎖改変ウリナスタチンの製造方法において用いることができるエンド型グリコシダーゼの具体例としては、ヒアルロニダーゼを挙げることができる(必要であれば例えばIwafune, M, Kakizaki, I, Yukawa, M, Kudo, D, Ota, S, Endo, M, and Takagaki, K. Biochem. Biophys. Res. Commun., 297, 1167-1170, 2002を参照のこと)。例えば、エンド型グリコシダーゼとしてヒアルロニダーゼを用いた場合、36〜38℃、pH3.5〜4.5の条件下において、改変前のウリナスタチンが持つグリコサミノグリカン糖鎖の非還元末端側から構成糖が2糖ずつ遊離するように糖鎖に存在するグリコシド結合を加水分解させることができ、その結果として、橋渡し4糖構造を含む4〜6糖を残してその非還元末端側が欠失した糖鎖欠損ウリナスタチンを得ることができる。また、36〜38℃、pH6.5〜7.5の条件下において、供与体とするグリコサミノグリカンを加水分解させて構成糖を2糖ずつ遊離させるとともに、遊離した構成糖を2糖ずつ上記の糖鎖欠損ウリナスタチンの残った糖鎖の非還元末端側に次々に結合させて糖鎖を伸張させることでき、その結果として、欠失させたグリコサミノグリカンの代わりに、供与体とするグリコサミノグリカンが結合した糖鎖改変ウリナスタチンを得ることができる。
【0010】
本発明の糖鎖改変ウリナスタチンの製造方法において供与体とすることができるグリコサミノグリカンの具体例としては、ヒアルロン酸の他、コンドロイチン、コンドロイチン硫酸、例えば、コンドロイチン硫酸A(コンドロイチン4-硫酸)、コンドロイチン硫酸C(コンドロイチン6-硫酸)、コンドロイチン硫酸D、コンドロイチン硫酸Eなどを挙げることができる。供与体とするグリコサミノグリカンは、単一のグリコサミノグリカンを糖転移反応に付してもよいし、異なるグリコサミノグリカンを段階的に糖転移反応に付してもよい。異なるグリコサミノグリカンを段階的に糖転移反応に付した場合、異なるクラスター構造を有するグリコサミノグリカン糖鎖を持つ糖鎖改変ウリナスタチンを得ることができる。
【0011】
なお、本発明の糖鎖改変ウリナスタチンの製造方法における糖鎖改変の対象となるウリナスタチンは、ヒトの尿中より抽出、精製される天然型ウリナスタチンの他、動物細胞や昆虫細胞や酵母を用いた遺伝子工学的手法によって発現させた、コアタンパク質のアミノ酸配列が天然型ウリナスタチンのアミノ酸配列と同じであるウリナスタチンや、コアタンパク質のアミノ酸配列が天然型ウリナスタチンのアミノ酸配列に対して1以上のアミノ酸が置換・欠失・付加・挿入されたアミノ酸配列であるウリナスタチンなどであってもよい。
【0012】
本発明の糖鎖改変ウリナスタチンの製造方法によれば、計画的な改変デザインの下で、改変前のウリナスタチンが持つグリコサミノグリカン糖鎖とは異なるグリコサミノグリカン糖鎖を持つウリナスタチンを得ることができる。従って、それぞれ異なるグリコサミノグリカン糖鎖を持つ複数種類のウリナスタチンの生理活性の比較を行うことにより、ウリナスタチンが持つグリコサミノグリカン糖鎖の機能解明を行うことができる。また、現在、医薬品として用いられている天然型ウリナスタチンに対して生理活性の向上や改善などが図られた次世代ウリナスタチンの探索を行うこともできる。
【実施例】
【0013】
以下、本発明を実施例によって詳細に説明するが、本発明は以下の記載に限定して解釈されるものではない。
【0014】
実施例1:糖鎖改変ウリナスタチンの製造(その1)
(1)精製ウリナスタチンの調製
中国のBiotech Center Shanghai Institute of Pharmaceutical Industryから購入したヒト尿中由来の部分精製ウリナスタチン(10 x 107units)を、DEAE-Cellulofineカラム(内径15cm x 長さ17cm,生化学工業,東京,日本)を用いて精製した。カラムの平衡化は50mM acetate buffer,pH4.0を用いて行い、50mM NaH2PO4 - 50mM NaCl,pH4.0で洗浄後、ウリナスタチンを50mM NaH2PO4 - 300mM NaCl,pH4.0で溶出した。ウリナスタチンを含むフラクションは、吸光度280nmとトリプシンインヒビター活性の測定(日本薬局方およびKassell, B. (1970) Bovine trypsin-kallikrein inhibitor (Kunitz inhibitor, basic pancreatic trypsin inhibitor, polyvalent inhibitor from bovine organs). Methods Enzymol., 19, 844-852)によりモニターした。ウリナスタチンを含むフラクションを集め、NaOHでpHを7.0に合わせた後、限外ろ過膜PM10 membrane(ミリポア, 東京, 日本)を用いて濃縮した。混入するヒト尿中カリクレインを除くために、濃縮されたウリナスタチンを、0.1M phosphate buffer,pH7.0で平衡化したaprotinin-Sepharose 6B column(内径5.0cm x 長さ17.5cm)でさらに精製し(Geiger, R, Stuckstedte, U, and Fritz, H. (1980) Isolation and characterization of human urinary kallikrein. Hoppe. Seylers. Z. Physiol. Chem., 361, 1003-1016)、最終的にPM10 membraneで濃縮することで、精製ウリナスタチンを得た。
【0015】
(2)ヒアルロニダーゼを用いた加水分解反応による糖鎖欠損ウリナスタチンの調製
(1)で調製した精製ウリナスタチン50nmolとウシ精巣性ヒアルロニダーゼ(シグマ,セントルイス,米国)5mgとを、タンパク質分解酵素阻害剤であるPMSFを最終濃度で1mMになるように添加した0.1M sodium acetate buffer,pH4.0 - 0.15M NaCl(総容量1ml)中で、37℃で一晩インキュベートした後、0.1M Tris-HCl,pH7.0で平衡化したゲルろ過カラム(Sephadex G-100)でウリナスタチンを分離した。ウリナスタチンを含むフラクションは、吸光度280nm、抗ウリナスタチン抗体を用いたwestern blotting、SDS-PAGEなどでモニターし、PM10 membraneで濃縮することで、糖鎖欠損ウリナスタチンを得た。なお、同様の方法で、ダンシル化したウリナスタチンを用いて糖鎖欠損ダンシル化ウリナスタチンを調製した。
【0016】
(3)ヒアルロニダーゼを用いた糖転移反応による糖鎖改変ウリナスタチンの調製
受容体(アクセプター)としての(2)で調製した糖鎖欠損ウリナスタチン25nmolと、供与体(ドナー)としての過剰量のヒアルロン酸(分子量:約80,000)と、ウシ精巣性ヒアルロニダーゼ0.3mgとを、タンパク質分解酵素阻害剤であるPMSFを最終濃度で1mMになるように添加した0.1M Tris-HCl,pH7.0(総容量0.4ml)中で、37℃で1時間インキュベートした後、0.1M Tris-HCl,pH4.0で平衡化したゲルろ過カラム(Sephadex G-100)でウリナスタチンを分離した。ウリナスタチンを含むフラクションは、吸光度280nm、抗ウリナスタチン抗体を用いたwestern blotting、SDS-PAGEなどでモニターし、PM10 membraneで濃縮することで、糖鎖改変ウリナスタチンを得た。なお、同様の方法で、(2)で調製した糖鎖欠損ダンシル化ウリナスタチンを用いて糖鎖改変ダンシル化ウリナスタチンを調製した。
【0017】
(糖鎖改変ウリナスタチンが持つグリコサミノグリカン糖鎖の検証)
(1)糖鎖改変ウリナスタチンが糖鎖欠損ウリナスタチンから糖鎖が伸張したものであることの証明
ダンシル化したウリナスタチン、糖鎖欠損ダンシル化ウリナスタチン、糖鎖改変ダンシル化ウリナスタチンを15%のアクリルアミドゲルを含むゲルで電気泳動(SDS-PAGE)し、UV照射によりダンシル基の蛍光を検出した。合わせて、クマシーブリリアントブルー(CBB)によるタンパク質染色も行った。その結果、ダンシル化したウリナスタチンは精製ウリナスタチンと同じ、分子量32,500付近に検出された。また、糖鎖欠損ダンシル化ウリナスタチンは分子量25,000付近に検出され、糖鎖改変ダンシル化ウリナスタチンは分子量25,000から62,000を中心として高分子領域にまで広い分子量分布を示した。糖鎖改変ダンシル化ウリナスタチンを、ヒアルロン酸に特異的な分解酵素であるStreptomyceshyaluronidase(生化学工業,東京,日本)を用いて徹底消化(0.1M sodium acetate buffer,pH6.0中で60℃、2時間反応させた後、酵素を足して37℃、16時間反応)すると、高分子領域に分布していたタンパク質のバンドが消え、糖鎖欠損ダンシル化ウリナスタチンと同じ分子量のタンパク質が検出された。以上の結果から、ヒアルロニダーゼを用いた糖転移反応によって糖鎖欠損ウリナスタチンに結合したグリコサミノグリカンはヒアルロン酸であることがわかった。以上の結果は、Shodex OH pak SB804およびShodex OH pak SB803(ともに内径8.0mm x 長さ300mm,Shodex,昭和電工,川崎,日本,溶出液は0.2M NaCl)を用いたゲルろ過HPLCを行った結果によっても支持された。
【0018】
次に、精製ウリナスタチン、糖鎖欠損ウリナスタチン、糖鎖改変ウリナスタチンの糖鎖分析を行った。具体的には、それぞれのウリナスタチンをプロテアーゼ(アクチナーゼE,科研製薬,東京,日本)で徹底消化(0.1M Tris-HCl buffer,pH8.0 - 0.01M CaCl2中で45℃、途中で酵素を足して16時間反応)して、コアタンパク質部分を短いペプチドとした。その後、エンド-β-キシロシダーゼ消化(0.1M sodium acetate buffer,pH4.0でエキソ型グリコシダーゼ阻害剤である25mM glucono-δ-lactone存在下で37℃、16時間反応)により、ペプチドに結合していたグリコサミノグリカン糖鎖を無傷で遊離させ、2-アミノピリジン(PA)により還元末端を蛍光標識した(Hase, S, Ibuki, T, and Ikenaka, T. (1984) Reexamination of the pyridylamination used for fluorescence labeling of oligosaccharides and its application to glycoproteins. J. Biochem (Tokyo). 95, 197-203およびKon, A, Takagaki, K, Kawasaki, H, Nakamura, T, and Endo M. (1991) Application of 2-aminopyridine fluorescence labeling to glycosaminoglycans. J. Biochem. (Tokyo). 110, 132-135)。PAにより蛍光標識されたそれぞれのグリコサミノグリカン糖鎖の糖鎖長を、TSKgel Amide-80 column(内径4.6mm x 長さ250mm,東ソー,東京,日本)を用いた順相HPLCで見積もった。HPLCは、A液;3% 酢酸 - トリエチルアミン(pH7.3)/ アセトニトリル(20/80, v/v)とB液;3% 酢酸 - トリエチルアミン(pH7.3)/ アセトニトリル(50/50, v/v)を用い、流速1.0ml/minとし、サンプルをインジェクトした後、120分かけてA液が100%からB液が100%になるようなlinear gradientでサンプルを溶出した。検出はex 320nm,em 400nmで行った。その結果、糖鎖欠損ウリナスタチンは、橋渡し4糖構造を含む4〜6糖分の糖鎖を持つこと、糖鎖改変ウリナスタチンは、糖鎖欠損ウリナスタチンが持つ糖鎖に対して少なくとも約40糖のヒアルロン酸が結合したものであることがわかった。
【0019】
(2)糖鎖改変ウリナスタチンが持つグリコサミノグリカン糖鎖がヒアルロン酸からなることの証明
糖鎖改変ウリナスタチンがヒアルロン酸結合タンパク質(HABP)に結合することをwestern-blotting likeな方法により確認することで、糖鎖改変ウリナスタチンが持つグリコサミノグリカン糖鎖がヒアルロン酸からなることを証明できた。また、糖鎖改変ウリナスタチンが持つグリコサミノグリカン糖鎖がヒアルロン酸からなることは、ヒアルロン酸に特異的な分解酵素であるStreptomyceshyaluronidaseを用いて糖鎖改変ウリナスタチンを消化した場合、消化後のウリナスタチンはHABPに結合しないことからも証明できた。
【0020】
(ヒアルロン酸からなるグリコサミノグリカン糖鎖を持つ糖鎖改変ウリナスタチンの生理活性)
(1)トリプシン阻害活性
N-alpha-ベンゾイル-L-アルギニン-4-ニトリロアニリドをトリプシンの基質に用いる日本薬局方の方法に従い、精製ウリナスタチンと糖鎖改変ウリナスタチンのトリプシン阻害活性を測定したところ、両者の間に活性の差はなく、いずれも高いトリプシン阻害活性を有していた。
【0021】
(2)ヒアルロニダーゼ阻害活性
精製ウリナスタチンと糖鎖改変ウリナスタチンのヒアルロニダーゼ阻害活性(ヒアルロニダーゼによる糖質加水分解活性に及ぼす影響)を、Salmen, S, Hoechstetter, J, Kasbauer, C, Paper, D. H, Bernhardt, G, and Buschauer, A. Sulphated oligosaccharides as inhibitors of hyaluronidases from bovine testis, bee venom and Streptococcus agalactiae. Planta Med. (2005) 71(8) : 727-732に記載の方法に従って測定した。結果を図1に示す(ヒアルロン酸を基質とした場合のヒアルロニダーゼの加水分解活性(A%)をA(%)=[(B-C)/(D-E)]X100の計算式によって算出した。式中、Bは試験物質とヒアルロニダーゼを含む反応液の吸光度、Cは試験物質を含みヒアルロニダーゼを含まない反応液の吸光度、Dは試験物質を含まずヒアルロニダーゼを含む反応液の吸光度、Eは試験物質もヒアルロニダーゼも含まない反応液の吸光度を意味する)。図1から明らかなように、精製ウリナスタチンは、濃度依存的にヒアルロニダーゼ阻害活性を示したが、糖鎖改変ウリナスタチンは、濃度に関係なくヒアルロニダーゼ阻害活性を示さなかった。
【0022】
(3)まとめ
以上の結果から、ヒアルロン酸からなるグリコサミノグリカン糖鎖を持つ糖鎖改変ウリナスタチンは、天然型ウリナスタチンが有するトリプシン阻害活性を保持したままで、ヒアルロニダーゼ阻害活性が消失しており、トリプシン阻害活性の特異性が相対的に高められたプロテアーゼ阻害剤として有用であることがわかった。このようなプロテアーゼ阻害剤は、宿主の生体組織が感染防御のために分泌する糖質加水分解酵素の活性を阻害しないことから、ウイルスなどの外来生物に対する感染阻害効果が高いことが期待できる。
【0023】
実施例2:糖鎖改変ウリナスタチンの製造(その2)
実施例1における供与体としてのヒアルロン酸の代わりにコンドロイチン(分子量:約10,000)を用いること以外は実施例1と同様にして、コンドロイチンからなるグリコサミノグリカン糖鎖を持つ糖鎖改変ウリナスタチンを得た。
【0024】
実施例3:糖鎖改変ウリナスタチンの製造(その3)
実施例1における供与体としてのヒアルロン酸の代わりにコンドロイチン4-硫酸(分子量:約30,000)を用いること以外は実施例1と同様にして、コンドロイチン4-硫酸からなるグリコサミノグリカン糖鎖を持つ糖鎖改変ウリナスタチンを得た。
【0025】
実施例4:糖鎖改変ウリナスタチンの製造(その4)
実施例1における供与体としてのヒアルロン酸の代わりにコンドロイチン6-硫酸(分子量:約60,000)を用いること以外は実施例1と同様にして、コンドロイチン6-硫酸からなるグリコサミノグリカン糖鎖を持つ糖鎖改変ウリナスタチンを得た。
【産業上の利用可能性】
【0026】
本発明は、計画的な改変デザインの下で、改変前のウリナスタチンが持つグリコサミノグリカン糖鎖を異なるグリコサミノグリカン糖鎖に付け替えることで得られる糖鎖改変ウリナスタチンの製造方法を提供することができる点において産業上の利用可能性を有する。
【図面の簡単な説明】
【0027】
【図1】実施例1におけるヒアルロン酸からなるグリコサミノグリカン糖鎖を持つ糖鎖改変ウリナスタチンのヒアルロニダーゼ阻害活性を示すグラフである。
【図2】天然型ウリナスタチンの1次構造である。
【特許請求の範囲】
【請求項1】
ウリナスタチンが持つグリコサミノグリカン糖鎖の非還元末端側の少なくとも一部を、エンド型グリコシダーゼを用いた加水分解反応によって遊離させた後、供与体とするグリコサミノグリカンを糖転移反応によって代わりに結合させることを特徴とする糖鎖改変ウリナスタチンの製造方法。
【請求項2】
エンド型グリコシダーゼがヒアルロニダーゼであることを特徴とする請求項1記載の製造方法。
【請求項3】
供与体とするグリコサミノグリカンがヒアルロン酸、コンドロイチン、コンドロイチン硫酸から選ばれる少なくとも1種であることを特徴とする請求項1または2記載の製造方法。
【請求項4】
コンドロイチン硫酸がコンドロイチン硫酸A、コンドロイチン硫酸C、コンドロイチン硫酸D、コンドロイチン硫酸Eから選ばれる少なくとも1種であることを特徴とする請求項3記載の製造方法。
【請求項5】
ヒアルロン酸、コンドロイチン、コンドロイチン硫酸から選ばれる少なくとも1種のグリコサミノグリカンを少なくとも一部に含むグリコサミノグリカン糖鎖を持つことを特徴とする糖鎖改変ウリナスタチン。
【請求項6】
ヒアルロン酸、コンドロイチン、コンドロイチン硫酸から選ばれる少なくとも1種のグリコサミノグリカンを少なくとも一部に含むグリコサミノグリカン糖鎖を持つ糖鎖改変ウリナスタチンを有効成分とすることを特徴とするプロテアーゼ阻害剤。
【請求項1】
ウリナスタチンが持つグリコサミノグリカン糖鎖の非還元末端側の少なくとも一部を、エンド型グリコシダーゼを用いた加水分解反応によって遊離させた後、供与体とするグリコサミノグリカンを糖転移反応によって代わりに結合させることを特徴とする糖鎖改変ウリナスタチンの製造方法。
【請求項2】
エンド型グリコシダーゼがヒアルロニダーゼであることを特徴とする請求項1記載の製造方法。
【請求項3】
供与体とするグリコサミノグリカンがヒアルロン酸、コンドロイチン、コンドロイチン硫酸から選ばれる少なくとも1種であることを特徴とする請求項1または2記載の製造方法。
【請求項4】
コンドロイチン硫酸がコンドロイチン硫酸A、コンドロイチン硫酸C、コンドロイチン硫酸D、コンドロイチン硫酸Eから選ばれる少なくとも1種であることを特徴とする請求項3記載の製造方法。
【請求項5】
ヒアルロン酸、コンドロイチン、コンドロイチン硫酸から選ばれる少なくとも1種のグリコサミノグリカンを少なくとも一部に含むグリコサミノグリカン糖鎖を持つことを特徴とする糖鎖改変ウリナスタチン。
【請求項6】
ヒアルロン酸、コンドロイチン、コンドロイチン硫酸から選ばれる少なくとも1種のグリコサミノグリカンを少なくとも一部に含むグリコサミノグリカン糖鎖を持つ糖鎖改変ウリナスタチンを有効成分とすることを特徴とするプロテアーゼ阻害剤。
【図2】


【図1】




【図1】


【公開番号】特開2008−247802(P2008−247802A)
【公開日】平成20年10月16日(2008.10.16)
【国際特許分類】
【出願番号】特願2007−90839(P2007−90839)
【出願日】平成19年3月30日(2007.3.30)
【出願人】(504229284)国立大学法人弘前大学 (162)
【Fターム(参考)】
【公開日】平成20年10月16日(2008.10.16)
【国際特許分類】
【出願日】平成19年3月30日(2007.3.30)
【出願人】(504229284)国立大学法人弘前大学 (162)
【Fターム(参考)】
[ Back to top ]

