糖鎖改変方法
【課題】 酵素学的手法による糖鎖改変方法において、反応に用いたグリコシダーゼの混入がない生成物を得るための方法を提供すること。
【解決手段】 グリコサミノグリカンおよび/またはプロテオグリカンを含む水溶液をグリコシダーゼ固定化カラムに通液し、グリコシダーゼの作用に基づく糖鎖の加水分解反応および/または糖転移反応をカラム内で行うことにより糖鎖を改変することを特徴とする。
【解決手段】 グリコサミノグリカンおよび/またはプロテオグリカンを含む水溶液をグリコシダーゼ固定化カラムに通液し、グリコシダーゼの作用に基づく糖鎖の加水分解反応および/または糖転移反応をカラム内で行うことにより糖鎖を改変することを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、酵素学的手法による糖鎖改変方法において、反応に用いたグリコシダーゼの混入がない生成物を得るための方法に関する。
【背景技術】
【0002】
糖鎖は、核酸、タンパク質に次ぐ第三の“鎖”であり、近年、その役割や機能の実態が次第に明らかになるとともに、糖鎖の機能の向上や改変のための糖鎖工学の研究も盛んに行われていることは当業者に周知の通りである。このような状況において、本発明者のグループは、これまでに、グリコシダーゼの1つであるヒアルロニダーゼを用いて糖鎖を2糖単位で加水分解したり転移させたりすることによる糖鎖改変方法を開発している(例えば非特許文献1および非特許文献2を参照のこと)。この方法は、計画的なデザインのもとで糖鎖を2糖またはその倍数のオリゴ糖の単位で改変できることから、糖鎖工学上において非常に利用価値が高いものである。
【0003】
しかしながら、糖鎖の改変対象となるグリコサミノグリカンやプロテオグリカンを含む水溶液にグリコシダーゼを添加して行う反応系(糖転移反応を行う場合にはさらに供与体となるグリコサミノグリカンやプロテオグリカンを添加)では、反応後に生成物を所定の精製手段(ゲルろ過クロマトグラフィーなど)によって精製しても、反応に用いたグリコシダーゼを生成物から除去することが必ずしも容易ではなく、そのため、生成物の生物学的活性を評価したり利用したりする際や生成物を出発原料として新たに糖鎖改変を行う際、生成物に混入したグリコシダーゼが悪影響を及ぼすことが否めないという問題があった。
【非特許文献1】K, Takagaki et al., Biochemistry, 33(21), 6503-6507, 1994.
【非特許文献2】H, Saitoh et al., J. Biol. Chem., 270, 3741-3747, 1995.
【発明の開示】
【発明が解決しようとする課題】
【0004】
そこで本発明は、酵素学的手法による糖鎖改変方法において、反応に用いたグリコシダーゼの混入がない生成物を得るための方法を提供することを目的とする。
【課題を解決するための手段】
【0005】
上記の点に鑑みてなされた本発明の方法は、請求項1記載の通り、グリコサミノグリカンおよび/またはプロテオグリカンを含む水溶液をグリコシダーゼ固定化カラムに通液し、グリコシダーゼの作用に基づく糖鎖の加水分解反応および/または糖転移反応をカラム内で行うことにより糖鎖を改変することを特徴とする。
また、請求項2記載の方法は、請求項1記載の方法において、グリコシダーゼがヒアルロニダーゼであることを特徴とする。
【発明の効果】
【0006】
本発明によれば、反応に用いるグリコシダーゼがカラム内に固定化されているので、反応後にグリコシダーゼを除去するための精製工程が不要となる。従って、グリコシダーゼの混入がない高い純度の糖鎖改変生成物の収量の向上を図ることができる。
【発明を実施するための最良の形態】
【0007】
本発明の方法は、グリコサミノグリカンおよび/またはプロテオグリカンを含む水溶液をグリコシダーゼ固定化カラムに通液し、グリコシダーゼの作用に基づく糖鎖の加水分解反応および/または糖転移反応をカラム内で行うことにより糖鎖を改変することを特徴とするものである。本発明において「糖鎖の改変」とは、グリコシダーゼの作用に基づく糖鎖の加水分解反応によってその構成糖の一部または全部を欠損させること、糖転移反応によって欠損させた構成糖を新たな構成糖に置換して糖鎖を組み換えることや糖鎖に新たな構成糖を付加して糖鎖を伸長することなど、糖鎖の構成糖を人為的に欠損、置換、付加する操作を意味するものとする。
【0008】
本発明において糖鎖を改変するために用いるグリコシダーゼは、糖鎖の加水分解活性および/または糖転移活性を有するものであればどのようなものであってもよく、例えば、グリコサミノグリカンとして、ヒアルロン酸の他、コンドロイチン、コンドロイチン硫酸A,C,E、脱硫酸化コンドロイチン硫酸Bなどに作用する精巣性ヒアルロニダーゼ(EC3.2.135:非特許文献1)や、プロテオグリカンのコアタンパク質とグリコサミノグリカン糖鎖の結合部位に存在する共通の橋渡し領域(−GlcA−Gal−Gal−Xyl−セリン)に特異的に作用するエンド−β−キシロシダーゼ、エンド−β−ガラクトシダーゼ、エンド−β−グルクロニダーゼや、エンド−β−キシロシダーゼと同様の酵素活性を有するセルラーゼやキシラナーゼなどのエンド型グリコシダーゼが挙げられる。
【0009】
グリコシダーゼ固定化カラムの作製は、酵素固定化カラムの一般的な作製方法に従って行うことができる。その一例としては、CNBr(臭化シアン)活性化セファロースなどのCNBrによって活性化させたビーズ状のアガロースゲルにグリコシダーゼをカップリングさせてガラス製のカラムに充填する方法が挙げられる(グリコシダーゼを固定する担体はビニルポリマーなどの合成樹脂からなるビーズなどであってもよい)。グリコシダーゼをカラム内に固定化することで、その酵素活性の安定化が図られるため、カラムを繰り返し利用できる。また、作製したカラムは3〜5℃で保存することにより、少なくとも3ヶ月はグリコシダーゼの酵素活性を維持しておくことができる(6ヶ月経過後においても約70%の酵素活性の維持が可能)。
【0010】
グリコシダーゼ固定化カラム内での糖鎖の加水分解反応や糖転移反応は、糖鎖改変対象とするグリコサミノグリカンやプロテオグリカンを含む水溶液を、予め至適な緩衝溶液で緩衝化したカラムに通液し(糖転移反応を行う場合にはさらに供与体となるグリコサミノグリカンやプロテオグリカンを通液)、カラム内を所定の反応条件に保つことで行うことができる。例えば、グリコシダーゼとして精巣性ヒアルロニダーゼを用いる場合、好適には36〜38℃、pH3.0〜6.5の条件下において、糖鎖改変対象とするグリコサミノグリカンやプロテオグリカンの糖鎖を、その非還元末端側から構成糖が2糖ずつ遊離するように加水分解することができる。また、好適には2〜50℃、pH5.0〜8.5の条件下において、反応系内に共存させた供与体となるグリコサミノグリカンやプロテオグリカンの糖鎖を加水分解し、その非還元末端側から構成糖を2糖ずつ遊離させるとともに、遊離した構成糖を2糖ずつ糖鎖改変対象とするグリコサミノグリカンやプロテオグリカンの糖鎖の非還元末端側に次々に転移させて糖鎖を伸長することができる。糖鎖をより長く伸長させるためには反応温度は低い方が望ましく、例えば2〜26℃の反応温度では10個以上の2糖単位を、16℃以下の反応温度では20個以上の2糖単位を効率的に転移させることができる。なお、言うまでもないことであるがグリコシダーゼとしてヒアルロニダーゼを用いる場合には糖鎖改変対象や供与体となるグリコサミノグリカンやプロテオグリカンはヒアルロニダーゼの作用を受けるものでなければならない。所定の反応時間(例えば10分間〜3日間)が経過した後、カラムに洗浄液として例えば水や塩化ナトリウム水溶液や酢酸アンモニウム水溶液などを通液して反応液を流出させ、必要な精製手段を適用することで、グリコシダーゼの混入がない糖鎖改変生成物を得ることができる。なお、精製手段は、反応液に含まれる目的生成物や未反応出発原料やこれらの分解物などの物理化学的性状を考慮し、ゲルろ過クロマトグラフィー、陽イオン交換クロマトグラフィー、陰イオン交換クロマトグラフィー、アフィニティークロマトグラフィー、透析、限外ろ過などから適宜採用すればよい。
【0011】
なお、糖鎖改変対象がプロテオグリカンの場合、予めプロテオグリカンにプロテアーゼを作用させてコアタンパク質をペプチドに断片化してからその水溶液をグリコシダーゼ固定化カラムに通液するようにしてもよい。本発明の「プロテオグリカン」には、コアタンパク質をペプチドに断片化したグリカンも含まれるものとする。
【0012】
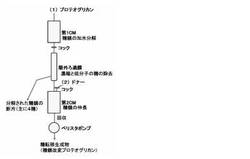
また、本発明の方法によれば、例えば、グリコシダーゼを用いてプロテオグリカンのグリコサミノグリカン糖鎖の加水分解反応を行ってその構成糖の一部または全部を欠損させた後、糖転移反応を行って欠損させた構成糖を新たな構成糖に置換して糖鎖を組み換えたり、さらに新たな構成糖を付加して糖鎖を伸長したりする連続工程を、グリコシダーゼ固定化カラムを組み込んだ図1に例示する糖鎖改変装置を用いて繰り返し行うことができる。
【0013】
図1に例示する糖鎖改変装置は、糖鎖の加水分解反応を行うための第1のグリコシダーゼ固定化カラム(第1CM)と糖転移反応を行うための第2のグリコシダーゼ固定化カラム(第2CM)を直列に連結したものであり、第1CMと第2CMの間には第1CM内で行う糖鎖の加水分解反応によって得られる生成物の精製手段としての限外ろ過膜ユニットが配置され、第2CMの下流には送液手段としてのペリスタポンプが配置されている。
以下、グリコシダーゼ固定化カラムとしてヒアルロニダーゼ固定化カラムを組み込んだ糖鎖改変装置の使用方法の一例について順を追って説明する。
まず、(1)から出発原料(糖鎖改変対象)であるプロテオグリカンを含む水溶液を第1CMにアプライした後、第1CMの出口のコックを閉じ、第1CM内で糖鎖の加水分解反応を所定の条件下(例えば0.1M酢酸ナトリウム緩衝液−0.15M NaCl,pH4.0〜5.5,37℃)で数時間〜一晩行う。この過程により、プロテオグリカンのグリコサミノグリカン糖鎖は、橋渡し領域の4糖を含む6糖を残して消化され、糖鎖欠損プロテオグリカンと主として4糖からなるグリコサミノグリカン糖鎖の分解断片が第1CM内に生成する。
次に、第1CMの出口のコックを開き、(1)から水を加え、ペリスタポンプを作動させて装置内の流路に反応液が流れるようにすることで、第1CMから流出した反応液に含まれる糖鎖欠損プロテオグリカンと糖鎖分解断片を、限外ろ過膜ユニット(例えばPellicon(商品名) XLデバイス,バイオマックス−5,日本ミリポア社)を循環する過程で分離し(反応液の循環速度は例えば3〜4mL/minが望ましい)、糖鎖分解断片を流路の外に排出するとともに、糖鎖欠損プロテオグリカンを第2CMに導入する。
次に、(2)から糖転移反応を行うための供与体(ドナー)となる長鎖のグリコサミノグリカン(例えばヒアルロン酸であれば150〜250糖、コンドロイチンやコンドロイチン硫酸Aであれば100〜150糖、コンドロイチン硫酸Cであれば50〜100糖が好適である)を第2CMの入口のコックを開いて導入し、糖転移反応を所定の条件下(例えば0.1M Tris−HCl緩衝液,pH7.0,37℃)で数時間〜一晩行う。第2CM内を糖転移反応の至適条件とするために、供与体となるグリコサミノグリカンは、例えば0.2〜1M Tris−HCl緩衝液に溶解して第2CMに導入することが望ましい。この過程により、供与体としたグリコサミノグリカンの糖鎖が加水分解されてその非還元末端側から構成糖が2糖ずつ遊離するとともに、遊離した構成糖が2糖ずつ糖鎖欠損プロテオグリカンが有する6糖からなる糖鎖の非還元末端側に次々に転移して糖鎖が伸長する。所定の反応時間が経過した後、(1)から水を加え、ペリスタポンプを作動させて生成物(糖鎖改変プロテオグリカン)を回収する。
なお、第1CM内での副反応である糖転移反応と第2CM内での副反応である糖鎖の加水分解反応を極力抑制し、第1CM内での糖鎖の加水分解反応と第2CM内での糖転移反応を効率的に行うためには、第2CMの酵素活性は第1CMの酵素活性よりも低いことが望ましい。従って、第1CMとしたカラムを繰り返し利用することで酵素活性が低下したら、新しいカラムに交換するとともに、酵素活性が低下したカラムは第2CMとして使用することで、カラムの有効利用を図ることができる。
【実施例】
【0014】
以下、本発明を実施例によって詳細に説明するが、本発明は以下の記載に限定して解釈されるものではない。
【0015】
参考例1:ヒアルロニダーゼ固定化カラムの作製
1.2gのウシ精巣性ヒアルロニダーゼ(Type1−S,シグマ社)と、膨潤させる前の乾燥重量で30g(膨潤させた後におけるタンパク質濃度が10mg/mL)のGEヘルスケア社のCNBr活性化セファロース4FFを、0.1Mリン酸緩衝液(pH7.0)中、室温で2時間または4℃で18時間かけてカップリングさせ、直径が15mmで長さが10cmのガラス製のカラムに充填することで作製した(充填した担体のベッドボリュームは3.6mLで高さは2cm)。カップリング効率は11.86%で、担体1mL(ベッドボリューム)あたりのヒアルロニダーゼのタンパク質量と力価はそれぞれ1.2mgと534U程度であった。このようにして作製したカラムは使用時まで4℃で保存した。
【0016】
実施例1:ヒアルロニダーゼ固定化カラムを用いた糖鎖欠損プロテオグリカンの調製(糖鎖の加水分解反応)
平衡化緩衝液(0.1M酢酸ナトリウム緩衝液−0.15M NaCl,pH5.0)で平衡化したヒアルロニダーゼ固定化カラムに、出発原料(糖鎖改変対象)であるプロテオグリカンとしてヒト尿中トリプシンインヒビター(UTI:わかもと製薬社)を担体1mL(ベッドボリューム)あたり約10mgアプライし(平衡化緩衝液を溶媒として使用)、37℃で18時間保持して糖鎖の加水分解反応を行って糖鎖を分解させた後、反応液をカラムから排出させ、限外ろ過膜(アミコン社)を用いて精製・濃縮することで、糖鎖欠損プロテオグリカンを得た。
【0017】
実施例2:ヒアルロニダーゼ固定化カラムを用いた糖鎖改変プロテオグリカンの調製(糖転移反応)
平衡化緩衝液(0.1M Tris−HCl緩衝液,pH7.0)で平衡化したヒアルロニダーゼ固定化カラムに、受容体(アクセプター)としての実施例1で調製した糖鎖欠損プロテオグリカンと供与体(ドナー)としての約200糖からなるヒアルロン酸(紀文フードケミファ社)を同時にアプライした。それぞれのアプライ量は、担体1mL(ベッドボリューム)あたり約15mgと約2mgとした(平衡化緩衝液を溶媒として使用)。4℃で18時間保持して糖転移反応を行って糖鎖を伸長させた後、反応液をカラムから排出させて濃縮することで、糖鎖改変プロテオグリカンを得た。
【0018】
(生成物の純度の評価)
実施例1で得られた糖鎖欠損プロテオグリカンと実施例2で得られた糖鎖改変プロテオグリカンの純度を、従来法(試験管内で行う反応系)で得られた糖鎖欠損プロテオグリカンと糖鎖改変プロテオグリカンの純度と比較した結果を図2に示す(CBB染色SDS−PAGE:いずれも反応液の状態のもの)。なお、各レーンは以下の通りである。
レーン1:プロテオグリカン
レーン2:実施例1で得られた糖鎖欠損プロテオグリカン
レーン3:実施例2で得られた糖鎖改変プロテオグリカン
レーン4:従来法で得られた糖鎖欠損プロテオグリカン
レーン5:従来法で得られた糖鎖改変プロテオグリカン
レーン6:ヒアルロニダーゼ
図2から明らかなように、本発明の方法によるレーン2とレーン3では、目的生成物のバンド(矢印1)の他にも出発原料由来のバンド(矢印2で示される低分子UTIなど)が認められるが、従来法によるレーン4とレーン5で認められるヒアルロニダーゼのバンドは認められず、本発明の方法によれば、従来法に比較して高い純度で目的生成物を調製できることがわかった。なお、種々の大きさやベッドボリュームのヒアルロニダーゼ固定化カラムを作製して同様の実験を行っても、結果は同じであった。
【産業上の利用可能性】
【0019】
本発明は、酵素学的手法による糖鎖改変方法において、反応に用いたグリコシダーゼの混入がない生成物を得るための方法を提供することができる点において産業上の利用可能性を有する。
【図面の簡単な説明】
【0020】
【図1】本発明の方法によって糖鎖の加水分解反応と糖転移反応を連続して行うことができる糖鎖改変装置の一例の構成図である。
【図2】実施例における本発明の方法によって得られた目的生成物と従来法によって得られた目的生成物の純度の違いを示すSDS−PAGEの結果である。
【技術分野】
【0001】
本発明は、酵素学的手法による糖鎖改変方法において、反応に用いたグリコシダーゼの混入がない生成物を得るための方法に関する。
【背景技術】
【0002】
糖鎖は、核酸、タンパク質に次ぐ第三の“鎖”であり、近年、その役割や機能の実態が次第に明らかになるとともに、糖鎖の機能の向上や改変のための糖鎖工学の研究も盛んに行われていることは当業者に周知の通りである。このような状況において、本発明者のグループは、これまでに、グリコシダーゼの1つであるヒアルロニダーゼを用いて糖鎖を2糖単位で加水分解したり転移させたりすることによる糖鎖改変方法を開発している(例えば非特許文献1および非特許文献2を参照のこと)。この方法は、計画的なデザインのもとで糖鎖を2糖またはその倍数のオリゴ糖の単位で改変できることから、糖鎖工学上において非常に利用価値が高いものである。
【0003】
しかしながら、糖鎖の改変対象となるグリコサミノグリカンやプロテオグリカンを含む水溶液にグリコシダーゼを添加して行う反応系(糖転移反応を行う場合にはさらに供与体となるグリコサミノグリカンやプロテオグリカンを添加)では、反応後に生成物を所定の精製手段(ゲルろ過クロマトグラフィーなど)によって精製しても、反応に用いたグリコシダーゼを生成物から除去することが必ずしも容易ではなく、そのため、生成物の生物学的活性を評価したり利用したりする際や生成物を出発原料として新たに糖鎖改変を行う際、生成物に混入したグリコシダーゼが悪影響を及ぼすことが否めないという問題があった。
【非特許文献1】K, Takagaki et al., Biochemistry, 33(21), 6503-6507, 1994.
【非特許文献2】H, Saitoh et al., J. Biol. Chem., 270, 3741-3747, 1995.
【発明の開示】
【発明が解決しようとする課題】
【0004】
そこで本発明は、酵素学的手法による糖鎖改変方法において、反応に用いたグリコシダーゼの混入がない生成物を得るための方法を提供することを目的とする。
【課題を解決するための手段】
【0005】
上記の点に鑑みてなされた本発明の方法は、請求項1記載の通り、グリコサミノグリカンおよび/またはプロテオグリカンを含む水溶液をグリコシダーゼ固定化カラムに通液し、グリコシダーゼの作用に基づく糖鎖の加水分解反応および/または糖転移反応をカラム内で行うことにより糖鎖を改変することを特徴とする。
また、請求項2記載の方法は、請求項1記載の方法において、グリコシダーゼがヒアルロニダーゼであることを特徴とする。
【発明の効果】
【0006】
本発明によれば、反応に用いるグリコシダーゼがカラム内に固定化されているので、反応後にグリコシダーゼを除去するための精製工程が不要となる。従って、グリコシダーゼの混入がない高い純度の糖鎖改変生成物の収量の向上を図ることができる。
【発明を実施するための最良の形態】
【0007】
本発明の方法は、グリコサミノグリカンおよび/またはプロテオグリカンを含む水溶液をグリコシダーゼ固定化カラムに通液し、グリコシダーゼの作用に基づく糖鎖の加水分解反応および/または糖転移反応をカラム内で行うことにより糖鎖を改変することを特徴とするものである。本発明において「糖鎖の改変」とは、グリコシダーゼの作用に基づく糖鎖の加水分解反応によってその構成糖の一部または全部を欠損させること、糖転移反応によって欠損させた構成糖を新たな構成糖に置換して糖鎖を組み換えることや糖鎖に新たな構成糖を付加して糖鎖を伸長することなど、糖鎖の構成糖を人為的に欠損、置換、付加する操作を意味するものとする。
【0008】
本発明において糖鎖を改変するために用いるグリコシダーゼは、糖鎖の加水分解活性および/または糖転移活性を有するものであればどのようなものであってもよく、例えば、グリコサミノグリカンとして、ヒアルロン酸の他、コンドロイチン、コンドロイチン硫酸A,C,E、脱硫酸化コンドロイチン硫酸Bなどに作用する精巣性ヒアルロニダーゼ(EC3.2.135:非特許文献1)や、プロテオグリカンのコアタンパク質とグリコサミノグリカン糖鎖の結合部位に存在する共通の橋渡し領域(−GlcA−Gal−Gal−Xyl−セリン)に特異的に作用するエンド−β−キシロシダーゼ、エンド−β−ガラクトシダーゼ、エンド−β−グルクロニダーゼや、エンド−β−キシロシダーゼと同様の酵素活性を有するセルラーゼやキシラナーゼなどのエンド型グリコシダーゼが挙げられる。
【0009】
グリコシダーゼ固定化カラムの作製は、酵素固定化カラムの一般的な作製方法に従って行うことができる。その一例としては、CNBr(臭化シアン)活性化セファロースなどのCNBrによって活性化させたビーズ状のアガロースゲルにグリコシダーゼをカップリングさせてガラス製のカラムに充填する方法が挙げられる(グリコシダーゼを固定する担体はビニルポリマーなどの合成樹脂からなるビーズなどであってもよい)。グリコシダーゼをカラム内に固定化することで、その酵素活性の安定化が図られるため、カラムを繰り返し利用できる。また、作製したカラムは3〜5℃で保存することにより、少なくとも3ヶ月はグリコシダーゼの酵素活性を維持しておくことができる(6ヶ月経過後においても約70%の酵素活性の維持が可能)。
【0010】
グリコシダーゼ固定化カラム内での糖鎖の加水分解反応や糖転移反応は、糖鎖改変対象とするグリコサミノグリカンやプロテオグリカンを含む水溶液を、予め至適な緩衝溶液で緩衝化したカラムに通液し(糖転移反応を行う場合にはさらに供与体となるグリコサミノグリカンやプロテオグリカンを通液)、カラム内を所定の反応条件に保つことで行うことができる。例えば、グリコシダーゼとして精巣性ヒアルロニダーゼを用いる場合、好適には36〜38℃、pH3.0〜6.5の条件下において、糖鎖改変対象とするグリコサミノグリカンやプロテオグリカンの糖鎖を、その非還元末端側から構成糖が2糖ずつ遊離するように加水分解することができる。また、好適には2〜50℃、pH5.0〜8.5の条件下において、反応系内に共存させた供与体となるグリコサミノグリカンやプロテオグリカンの糖鎖を加水分解し、その非還元末端側から構成糖を2糖ずつ遊離させるとともに、遊離した構成糖を2糖ずつ糖鎖改変対象とするグリコサミノグリカンやプロテオグリカンの糖鎖の非還元末端側に次々に転移させて糖鎖を伸長することができる。糖鎖をより長く伸長させるためには反応温度は低い方が望ましく、例えば2〜26℃の反応温度では10個以上の2糖単位を、16℃以下の反応温度では20個以上の2糖単位を効率的に転移させることができる。なお、言うまでもないことであるがグリコシダーゼとしてヒアルロニダーゼを用いる場合には糖鎖改変対象や供与体となるグリコサミノグリカンやプロテオグリカンはヒアルロニダーゼの作用を受けるものでなければならない。所定の反応時間(例えば10分間〜3日間)が経過した後、カラムに洗浄液として例えば水や塩化ナトリウム水溶液や酢酸アンモニウム水溶液などを通液して反応液を流出させ、必要な精製手段を適用することで、グリコシダーゼの混入がない糖鎖改変生成物を得ることができる。なお、精製手段は、反応液に含まれる目的生成物や未反応出発原料やこれらの分解物などの物理化学的性状を考慮し、ゲルろ過クロマトグラフィー、陽イオン交換クロマトグラフィー、陰イオン交換クロマトグラフィー、アフィニティークロマトグラフィー、透析、限外ろ過などから適宜採用すればよい。
【0011】
なお、糖鎖改変対象がプロテオグリカンの場合、予めプロテオグリカンにプロテアーゼを作用させてコアタンパク質をペプチドに断片化してからその水溶液をグリコシダーゼ固定化カラムに通液するようにしてもよい。本発明の「プロテオグリカン」には、コアタンパク質をペプチドに断片化したグリカンも含まれるものとする。
【0012】
また、本発明の方法によれば、例えば、グリコシダーゼを用いてプロテオグリカンのグリコサミノグリカン糖鎖の加水分解反応を行ってその構成糖の一部または全部を欠損させた後、糖転移反応を行って欠損させた構成糖を新たな構成糖に置換して糖鎖を組み換えたり、さらに新たな構成糖を付加して糖鎖を伸長したりする連続工程を、グリコシダーゼ固定化カラムを組み込んだ図1に例示する糖鎖改変装置を用いて繰り返し行うことができる。
【0013】
図1に例示する糖鎖改変装置は、糖鎖の加水分解反応を行うための第1のグリコシダーゼ固定化カラム(第1CM)と糖転移反応を行うための第2のグリコシダーゼ固定化カラム(第2CM)を直列に連結したものであり、第1CMと第2CMの間には第1CM内で行う糖鎖の加水分解反応によって得られる生成物の精製手段としての限外ろ過膜ユニットが配置され、第2CMの下流には送液手段としてのペリスタポンプが配置されている。
以下、グリコシダーゼ固定化カラムとしてヒアルロニダーゼ固定化カラムを組み込んだ糖鎖改変装置の使用方法の一例について順を追って説明する。
まず、(1)から出発原料(糖鎖改変対象)であるプロテオグリカンを含む水溶液を第1CMにアプライした後、第1CMの出口のコックを閉じ、第1CM内で糖鎖の加水分解反応を所定の条件下(例えば0.1M酢酸ナトリウム緩衝液−0.15M NaCl,pH4.0〜5.5,37℃)で数時間〜一晩行う。この過程により、プロテオグリカンのグリコサミノグリカン糖鎖は、橋渡し領域の4糖を含む6糖を残して消化され、糖鎖欠損プロテオグリカンと主として4糖からなるグリコサミノグリカン糖鎖の分解断片が第1CM内に生成する。
次に、第1CMの出口のコックを開き、(1)から水を加え、ペリスタポンプを作動させて装置内の流路に反応液が流れるようにすることで、第1CMから流出した反応液に含まれる糖鎖欠損プロテオグリカンと糖鎖分解断片を、限外ろ過膜ユニット(例えばPellicon(商品名) XLデバイス,バイオマックス−5,日本ミリポア社)を循環する過程で分離し(反応液の循環速度は例えば3〜4mL/minが望ましい)、糖鎖分解断片を流路の外に排出するとともに、糖鎖欠損プロテオグリカンを第2CMに導入する。
次に、(2)から糖転移反応を行うための供与体(ドナー)となる長鎖のグリコサミノグリカン(例えばヒアルロン酸であれば150〜250糖、コンドロイチンやコンドロイチン硫酸Aであれば100〜150糖、コンドロイチン硫酸Cであれば50〜100糖が好適である)を第2CMの入口のコックを開いて導入し、糖転移反応を所定の条件下(例えば0.1M Tris−HCl緩衝液,pH7.0,37℃)で数時間〜一晩行う。第2CM内を糖転移反応の至適条件とするために、供与体となるグリコサミノグリカンは、例えば0.2〜1M Tris−HCl緩衝液に溶解して第2CMに導入することが望ましい。この過程により、供与体としたグリコサミノグリカンの糖鎖が加水分解されてその非還元末端側から構成糖が2糖ずつ遊離するとともに、遊離した構成糖が2糖ずつ糖鎖欠損プロテオグリカンが有する6糖からなる糖鎖の非還元末端側に次々に転移して糖鎖が伸長する。所定の反応時間が経過した後、(1)から水を加え、ペリスタポンプを作動させて生成物(糖鎖改変プロテオグリカン)を回収する。
なお、第1CM内での副反応である糖転移反応と第2CM内での副反応である糖鎖の加水分解反応を極力抑制し、第1CM内での糖鎖の加水分解反応と第2CM内での糖転移反応を効率的に行うためには、第2CMの酵素活性は第1CMの酵素活性よりも低いことが望ましい。従って、第1CMとしたカラムを繰り返し利用することで酵素活性が低下したら、新しいカラムに交換するとともに、酵素活性が低下したカラムは第2CMとして使用することで、カラムの有効利用を図ることができる。
【実施例】
【0014】
以下、本発明を実施例によって詳細に説明するが、本発明は以下の記載に限定して解釈されるものではない。
【0015】
参考例1:ヒアルロニダーゼ固定化カラムの作製
1.2gのウシ精巣性ヒアルロニダーゼ(Type1−S,シグマ社)と、膨潤させる前の乾燥重量で30g(膨潤させた後におけるタンパク質濃度が10mg/mL)のGEヘルスケア社のCNBr活性化セファロース4FFを、0.1Mリン酸緩衝液(pH7.0)中、室温で2時間または4℃で18時間かけてカップリングさせ、直径が15mmで長さが10cmのガラス製のカラムに充填することで作製した(充填した担体のベッドボリュームは3.6mLで高さは2cm)。カップリング効率は11.86%で、担体1mL(ベッドボリューム)あたりのヒアルロニダーゼのタンパク質量と力価はそれぞれ1.2mgと534U程度であった。このようにして作製したカラムは使用時まで4℃で保存した。
【0016】
実施例1:ヒアルロニダーゼ固定化カラムを用いた糖鎖欠損プロテオグリカンの調製(糖鎖の加水分解反応)
平衡化緩衝液(0.1M酢酸ナトリウム緩衝液−0.15M NaCl,pH5.0)で平衡化したヒアルロニダーゼ固定化カラムに、出発原料(糖鎖改変対象)であるプロテオグリカンとしてヒト尿中トリプシンインヒビター(UTI:わかもと製薬社)を担体1mL(ベッドボリューム)あたり約10mgアプライし(平衡化緩衝液を溶媒として使用)、37℃で18時間保持して糖鎖の加水分解反応を行って糖鎖を分解させた後、反応液をカラムから排出させ、限外ろ過膜(アミコン社)を用いて精製・濃縮することで、糖鎖欠損プロテオグリカンを得た。
【0017】
実施例2:ヒアルロニダーゼ固定化カラムを用いた糖鎖改変プロテオグリカンの調製(糖転移反応)
平衡化緩衝液(0.1M Tris−HCl緩衝液,pH7.0)で平衡化したヒアルロニダーゼ固定化カラムに、受容体(アクセプター)としての実施例1で調製した糖鎖欠損プロテオグリカンと供与体(ドナー)としての約200糖からなるヒアルロン酸(紀文フードケミファ社)を同時にアプライした。それぞれのアプライ量は、担体1mL(ベッドボリューム)あたり約15mgと約2mgとした(平衡化緩衝液を溶媒として使用)。4℃で18時間保持して糖転移反応を行って糖鎖を伸長させた後、反応液をカラムから排出させて濃縮することで、糖鎖改変プロテオグリカンを得た。
【0018】
(生成物の純度の評価)
実施例1で得られた糖鎖欠損プロテオグリカンと実施例2で得られた糖鎖改変プロテオグリカンの純度を、従来法(試験管内で行う反応系)で得られた糖鎖欠損プロテオグリカンと糖鎖改変プロテオグリカンの純度と比較した結果を図2に示す(CBB染色SDS−PAGE:いずれも反応液の状態のもの)。なお、各レーンは以下の通りである。
レーン1:プロテオグリカン
レーン2:実施例1で得られた糖鎖欠損プロテオグリカン
レーン3:実施例2で得られた糖鎖改変プロテオグリカン
レーン4:従来法で得られた糖鎖欠損プロテオグリカン
レーン5:従来法で得られた糖鎖改変プロテオグリカン
レーン6:ヒアルロニダーゼ
図2から明らかなように、本発明の方法によるレーン2とレーン3では、目的生成物のバンド(矢印1)の他にも出発原料由来のバンド(矢印2で示される低分子UTIなど)が認められるが、従来法によるレーン4とレーン5で認められるヒアルロニダーゼのバンドは認められず、本発明の方法によれば、従来法に比較して高い純度で目的生成物を調製できることがわかった。なお、種々の大きさやベッドボリュームのヒアルロニダーゼ固定化カラムを作製して同様の実験を行っても、結果は同じであった。
【産業上の利用可能性】
【0019】
本発明は、酵素学的手法による糖鎖改変方法において、反応に用いたグリコシダーゼの混入がない生成物を得るための方法を提供することができる点において産業上の利用可能性を有する。
【図面の簡単な説明】
【0020】
【図1】本発明の方法によって糖鎖の加水分解反応と糖転移反応を連続して行うことができる糖鎖改変装置の一例の構成図である。
【図2】実施例における本発明の方法によって得られた目的生成物と従来法によって得られた目的生成物の純度の違いを示すSDS−PAGEの結果である。
【特許請求の範囲】
【請求項1】
グリコサミノグリカンおよび/またはプロテオグリカンを含む水溶液をグリコシダーゼ固定化カラムに通液し、グリコシダーゼの作用に基づく糖鎖の加水分解反応および/または糖転移反応をカラム内で行うことにより糖鎖を改変する方法。
【請求項2】
グリコシダーゼがヒアルロニダーゼである請求項1記載の方法。
【請求項1】
グリコサミノグリカンおよび/またはプロテオグリカンを含む水溶液をグリコシダーゼ固定化カラムに通液し、グリコシダーゼの作用に基づく糖鎖の加水分解反応および/または糖転移反応をカラム内で行うことにより糖鎖を改変する方法。
【請求項2】
グリコシダーゼがヒアルロニダーゼである請求項1記載の方法。
【図1】


【図2】




【図2】


【公開番号】特開2009−278907(P2009−278907A)
【公開日】平成21年12月3日(2009.12.3)
【国際特許分類】
【出願番号】特願2008−133815(P2008−133815)
【出願日】平成20年5月22日(2008.5.22)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2007年11月25日 BMB2007(第30回日本分子生物学会年会・第80回日本生化学会大会合同大会)発行の「BMB2007講演要旨集」に発表
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成19年度、文部科学省、地域科学技術振興事業委託事業、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504229284)国立大学法人弘前大学 (162)
【Fターム(参考)】
【公開日】平成21年12月3日(2009.12.3)
【国際特許分類】
【出願日】平成20年5月22日(2008.5.22)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2007年11月25日 BMB2007(第30回日本分子生物学会年会・第80回日本生化学会大会合同大会)発行の「BMB2007講演要旨集」に発表
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成19年度、文部科学省、地域科学技術振興事業委託事業、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504229284)国立大学法人弘前大学 (162)
【Fターム(参考)】
[ Back to top ]

