糖鎖構造解析方法
【課題】構造未知の糖鎖についてCID−MSn測定を行い、得られたデータをすでに取得されている参照データと比較することにより該糖鎖の構造解析を行う方法を提供する。
【解決手段】(a)目的糖鎖について特定のm/zのフラグメントイオンが得られるまでCID−MSn測定を行い、(b)該フラグメントイオンについてさらにCID−MS/MS測定を行い、得られた特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線を作成し、(c)該CIDエネルギー依存曲線と、構造既知の参照糖鎖から得られた、上記フラグメントイオンと同一のm/zのフラグメントイオンをCID−MS/MS測定することにより得られた、上記娘イオンと同一のm/zの娘イオンのCIDエネルギー依存曲線とを比較する糖鎖構造解析方法が提供される。
【解決手段】(a)目的糖鎖について特定のm/zのフラグメントイオンが得られるまでCID−MSn測定を行い、(b)該フラグメントイオンについてさらにCID−MS/MS測定を行い、得られた特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線を作成し、(c)該CIDエネルギー依存曲線と、構造既知の参照糖鎖から得られた、上記フラグメントイオンと同一のm/zのフラグメントイオンをCID−MS/MS測定することにより得られた、上記娘イオンと同一のm/zの娘イオンのCIDエネルギー依存曲線とを比較する糖鎖構造解析方法が提供される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、構造未知の糖鎖についてCID−MSn測定を行い、得られたデータをすでに取得されている参照データと比較することにより該糖鎖の構造解析を行う方法に関する。さらに本発明は、構造既知の複数の参照糖鎖をCID−MSn測定することにより得られる複数の特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線からなるCIDエネルギー依存曲線ライブラリーに関する。
【背景技術】
【0002】
糖鎖は主に細胞表面に糖タンパク質や糖脂質の一部として存在し、発生、分化誘導、受精、免疫、癌化、感染症等、様々な生命現象に深く関与している。このように多彩な機能を有する糖鎖の研究は近年盛んになっている。また、糖鎖は、タンパク質の翻訳後修飾の重要な部分を占め、今後の大きな研究対象である。糖タンパク質や糖脂質の機能は糖鎖により制御される場合があり、糖鎖の構造解析を極微量において達成する技術が必要である。しかし、糖鎖は生物工学的手法により増幅ができない分子種であるため、微量の物質のみで構造解析を達成することを可能とする新たな構造解析技術の開発が必要である。タンパク質の配列はゲノム配列が判明している場合、対応するタンパク質のアミノ酸配列も取得できるため、目的のタンパク質のアミノ酸配列は質量分析(例えば、MS/MS法)により解析することができる。しかし、被修飾タンパク質の配列解析技術については今後の課題として残されている。特に、糖鎖によるタンパク質の修飾は極めて大きな分子の多様性を生み出している。したがって、糖鎖の構造解析技術の開発は必要不可欠である。
【0003】
糖鎖は、核酸やタンパク質とは異なり配列以外の要因による構造異性体群を形成している。この理由の基本は、糖鎖を形成する単糖には反応点となる水酸基が複数存在するため結合位置異性体を形成する性質を有し、かつ、単糖間の結合の際にはアノメリック位の立体異性によるアノマー異性体を形成する性質を有しているためである。単糖間の結合は、生物体内においては糖鎖の合成に関わる酵素群の連続反応により行われるため、必ずしも組み合わせの原理に基づく糖鎖群を形成しているわけではない。しかし、酵素反応は副反応を伴うことが知られており、このような現象の生物における意味は解明されておらず、このような場合には遺伝情報によることのない全く新しい概念に基づく構造解析法が必要である。もちろん、遺伝情報が解明されていない、また、糖鎖の生合成経路が解明されていない生物種における糖鎖構造の解析についても新しい構造解析法が必要である。
【0004】
現在用いられている糖鎖の構造解析技術としては、(1)核磁気共鳴分光法、(2)質量分析法、(3)多次元クロマトグラフィーによるマッピング法(非特許文献1を参照)、(4)加水分解酵素による特異的部分加水分解法(非特許文献2を参照)、(5)レクチンによるマッピング法(非特許文献2を参照)、及び(6)メチル化−加水分解-ガスクロマトグラフィーによる組成分析法(非特許文献2を参照)をあげることができ、通常はこれらを組み合わせて糖鎖の解析が行われている。
【0005】
上記の中でも特に有効な糖鎖の解析手段としては、核磁気共鳴分光法及び質量分析法をあげることができるが、前者の問題点は解析に必要な量がμg以上であることであり、後者の問題点は立体異性体の解析が不可能なことである。これらの方法を含めいずれの解析法を用いるにせよ、糖鎖の構造解析は、得られた天然糖鎖構造の構造解析を直接行わなければならない(非特許文献3を参照)。
【0006】
一方、異なる糖鎖を質量分析することにより、その結果が異なることが示されている。例えば、ステロイドの水酸基の立体異性体のCID−MS/MS測定によるフラグメント化を行うと、各フラグメント強度が異なること(非特許文献4を参照)や、合成された硫酸化糖鎖の構造異性体のCID−MS/MS測定をFAB−q−Massで行って、特定イオンの強度を測定すると、その値に差があること(非特許文献5を参照)が示されている。しかし、これらはいずれも具体的に糖鎖の構造解析方法を示すものではなかった。
【0007】
質量分析装置を用いる糖鎖の構造解析技術において一般的な構造解析法としては、m/zとそのピーク強度をパラメータとし、構造既知の糖鎖のそれと比較することで同一構造か否かの判定をする方法がある(非特許文献6及び7を参照)。この方法は、特定の一点の電圧におけるフラグメントのピーク強度を指標とし、各々のフラグメントの強度が総合的に一致するか否かをスコア化して判定する方法であり、参照とする化合物群の網羅的なデータセット、あるいは、網羅的なデータベースが必要である。また、この方法の限界は、合否の判定をするだけで否の場合の構造予測が不可能な点であった。
【0008】
構造的に類似性のある化合物群に対しては、多変量解析が、質量分析により得られたデータから構造的特徴を抽出するのに新たな可能性を与えることを示唆している報告があるが、2糖の構造予測に応用できることを報告しているにすぎず、長い糖鎖の構造予測の可能性については具体的には何も触れていない(非特許文献8を参照)。
【0009】
さらに、質量分析法は極微量分析であり、検出される質量数(H、Na付加等)から物質の分子量が分かると共に、フラグメントイオンの解裂様式から、分子構造に関して重要な情報を得ることができるものの、サンプルに異性体(構造異性体、光学異性体)が混入して存在する場合、質量分析計のみではその混入物の存在すら識別できなかった。
【0010】
【非特許文献1】Royle, L. et al., Anal. Biochem., 2002,304,70-90
【非特許文献2】Chaplin, M.F et al., Carbohydrate Analysis, A Practical Approach, IRL Press, Oxford,1994
【非特許文献3】Dell, A., Adv. Carbohydr. Chem. Biochem. 1987, 45, 19-72
【非特許文献4】Faretto, D. et al., Mass Spectrom., 1991,5,240-244
【非特許文献5】Kurono, S. et al., J. Mass Spectrom., 1998, 33,35-44
【非特許文献6】Viseux. N. et al., Anal. Chem. 1998, 70, 4951-4959
【非特許文献7】Kameyama, A. et al., Anal. Chem. 2005, 77, 4719-4725
【非特許文献8】Faengmark, I. et al., Anal. Chem. 1999, 71, 1105-1110
【発明の開示】
【発明が解決しようとする課題】
【0011】
本発明の目的は、構造未知の糖鎖についてCID−MSn測定を行い、得られたデータをすでに取得されている参照データと比較することにより該糖鎖の構造解析を行う方法を提供することである。具体的には、本発明の目的は、構造解析の目的糖鎖に関する特定のm/zのフラグメントイオンついてCID−MS/MS測定を行い、得られたCIDエネルギー依存曲線を、同一のm/zの親イオンから同一のm/zの娘イオンを得た参照データであるCIDエネルギー依存曲線と比較して、同一か否かを特定することにより該糖鎖の構造決定を行う方法を提供することである。本発明の別の目的は、上記の目的糖鎖および参照糖鎖のCIDエネルギー依存曲線について、これらの曲線を特徴付ける数値で表した解裂イオンパラメータをそれぞれ作成し、これらのパラメータを統計的に解析することにより、目的糖鎖の構造決定又は構造推定を行う方法を提供することである。本発明のさらに別の目的は、質量分析計のみを用いた糖鎖の構造異性体混合物を識別するための分析方法を提供することである。
【課題を解決するための手段】
【0012】
本発明者らは、上記課題を達成するために鋭意検討を進めた結果、構造が異なる糖鎖および立体異性の糖鎖を合成し、特定のm/zのフラグメントイオンが得られるまでCID−MSn測定を行い、該フラグメントイオンについてさらにCID−MS/MS測定を行い、得られた特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線を作成したところ、同一の構造を有する糖鎖は複数回これを測定しても同一のCIDエネルギー依存曲線が得られ、逆に構造が異なる糖鎖はCIDエネルギー依存曲線も異なることを見出した。また、立体異性体もCIDエネルギー依存曲線が異なることを見出した。さらに、糖鎖の部分構造、そこから得られるCIDエネルギー依存曲線またはCIDエネルギー依存曲線のパラメータが一致しなくても、パラメータの統計的解析に基づき部分構造を推定できることを見出した。本発明はこれらの知見に基づいて成し遂げられたものである。
【0013】
すなわち本発明によれば、以下の発明が提供される。
(1) (a)目的糖鎖について特定のm/zのフラグメントイオンが得られるまでCID−MSn測定を行い、(b)該フラグメントイオンについてさらにCID−MS/MS測定を行い、得られた特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線を作成し、(c)該CIDエネルギー依存曲線と、構造既知の参照糖鎖から得られた、上記フラグメントイオンと同一のm/zのフラグメントイオンをCID−MS/MS測定することにより得られた、上記娘イオンと同一のm/zの娘イオンのCIDエネルギー依存曲線とを比較することを特徴とする糖鎖構造解析方法。
【0014】
(2) 構造既知の複数の参照糖鎖をCID−MSn測定することにより得られる複数の特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線からなるCIDエネルギー依存曲線ライブラリー。
(3) 参照糖鎖が3糖からなることを特徴とする(2)に記載のライブラリー。
【0015】
(4) (2)に記載のCIDエネルギー依存曲線から作成された、構造既知の複数の参照糖鎖の解裂イオンパラメータからなる解裂イオンパラメータライブラリー。
(5) 構造既知の複数の参照糖鎖の解裂イオンパラメータが、特定のm/zの娘イオンのイオン強度の最大値を該娘イオンの総イオンカウント数の相対数としてあらわした相対値、前記相対値が50%となるCIDエネルギー値、CIDエネルギー依存曲線の変曲点での傾き、から選ばれる少なくとも1つのパラメータであることを特徴とする、(4)に記載のライブラリー。
(6) 参照糖鎖が3糖からなることを特徴とする(4)または(5)に記載のライブラリー。
【0016】
(7) (a)目的糖鎖について特定のm/zのフラグメントイオンが得られるまでCID−MSn測定を行い、(b)該フラグメントイオンについてさらにCID−MS/MS測定を行い、得られた特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線を作成し、(c)該CIDエネルギー依存曲線と、(2)または(3)に記載のライブラリーに含まれる、上記フラグメントイオンと同一のm/zのフラグメントイオンをCID−MS/MS測定することにより得られた、上記娘イオンと同一のm/zの娘イオンのCIDエネルギー依存曲線とを比較することを特徴とする糖鎖構造解析方法。
【0017】
(8) (1)または(7)に記載の(c)の工程において、目的糖鎖の特定のm/zの娘イオンのCIDエネルギー依存曲線の解裂イオンパラメータを作成し、該解裂イオンパラメータと、構造既知の参照糖鎖の上記娘イオンと同一のm/zの娘イオンのCIDエネルギー依存曲線の解裂イオンパラメータとを比較することを特徴とする、(1)または(7)に記載の方法。
【0018】
(9) 解裂イオンパラメータが、特定のm/zの娘イオンのイオン強度の最大値を該娘イオンの総イオンカウント数の相対数としてあらわした相対値、前記相対値が50%となるCIDエネルギー値、CIDエネルギー依存曲線の変曲点での傾き、から選ばれる少なくとも1つのパラメータであることを特徴とする、(8)に記載の方法。
【0019】
(10) (a)目的糖鎖について特定のm/zのフラグメントイオンが得られるまでCID−MSn測定を行い、(b)該フラグメントイオンについてさらにCID−MS/MS測定を行い、得られた特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線を作成し、(c)該CIDエネルギー依存曲線の解裂イオンパラメータを作成し、(d)該解裂イオンパラメータと、(4)〜(6)のいずれかに記載のライブラリーに含まれる、上記フラグメントイオンと同一のm/zのフラグメントイオンをCID−MS/MS測定することにより得られた、上記娘イオンと同一のm/zの娘イオンのCIDエネルギー依存曲線から作成された解裂イオンパラメータを比較することを特徴とする糖鎖構造解析方法。
【0020】
(11) CIDエネルギー依存曲線の特定のm/zの娘イオンの総イオンカウント数が、特定のm/zの娘イオンの総イオンカウント数と、該娘イオンの総イオンカウント数と親イオンの総イオンカウント数の和の比であることを特徴とする(1)または(7)〜(10)のいずれかに記載の方法。
【0021】
(12) 目的糖鎖に含まれる異なる特定のm/zのフラグメントイオンについて(1)もしくは(7)に記載の(a)〜(c)の工程または(10)に記載の(a)〜(d)の工程を繰り返し、それらの結果を組み合わせることを特徴とする糖鎖構造解析方法。
【0022】
(13) 少なくともCID−MSn測定装置、(2)〜(6)のいずれかに記載のライブラリーをコンピューター読み取り可能なように記録した記録媒体、および目的糖鎖に含まれる異なる特定のフラグメントイオンについて(1)もしくは(7)に記載の(b)および(c)の工程または(10)に記載の(b)〜(d)の工程を行なうためのプログラムを記録した記録媒体を含む糖鎖構造解析システム。
【0023】
(14) (a)糖鎖検体について特定のm/zのフラグメントイオンが消失しないような任意の電圧でCID−MSn測定を行い、(b)残存する該フラグメントイオンについてさらにCID−MS/MS測定を行い、(c)前記2工程で得られたマススペクトル、CIDエネルギー依存曲線または該曲線の解裂イオンパラメータを比較することを特徴とする、糖鎖構造異性体の混入検定方法。
【発明の効果】
【0024】
本発明の糖鎖解析方法は、構造未知の糖鎖についてCID−MSn測定を行ない、得られたCIDエネルギー依存曲線を構造既知の糖鎖から得られた参照データと比較することにより構造決定を行う方法である。該方法は、天然に存在する構造未知の糖鎖を、置換基が異なるものや立体異性体等も含めその構造、またはその一部を決定又は推定することができ、また極微量の解析が行える点で非常に有用である。また該方法は、糖鎖の構造解析という次世代生命科学研究の基盤技術となるのみならず、糖鎖の異常を伴う疾病や感染症を引き起こすきっかけとなる糖鎖レセプターの特定等、診断医療に貢献する技術となるものである。さらに、本発明の純度検定方法により、検体の詳細なデータ解析をおこなう以前にその必要性を簡便に判定することが可能となる。
【発明を実施するための最良の形態】
【0025】
以下、本発明を更に詳細に説明するが、以下の構成要件の説明は、本発明の実施態様の代表例であり、本発明はこれらの内容のみに特定されるものではない。
以下の説明において、「CID−MSn測定」とは、CID(Collision induced dissociation:衝突誘起解離)による多段マススペクトロメトリーの取得を行うことを示し、「フラグメントイオン」とは、上記CID−MSn測定や物理化学的分解等により得られる各m/zを有するイオンを示し、「m/z」とは、質量数(m)と電荷(z)の比を示し、「娘イオン」とは、フラグメントイオンを上記CID−MSn測定することにより得られる各m/zを有するフラグメントイオンを示し、「総イオンカウント数」とは、各m/zを有するすべてのフラグメントイオンのイオン強度の総和を示し、また、「CIDエネルギー」とは、CIDを起こすときに加えるエネルギーを一般的に示し、実際にはイオンを振動させるためのある周波数の電場の電圧を示す。さらに、「構造解析方法」とは、構造決定方法および/または構造推定方法を意味する。
【0026】
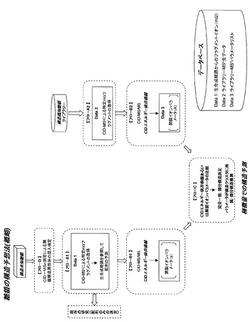
本発明の方法を図1〜5に示し、この図に従って以下に本発明を説明する。
(1)構造解析方法の概略(図1)
本発明は、構造未知の糖鎖(本明細書中では、これを「目的糖鎖」と称することがある)を特定のm/zのフラグメントイオン(以下、これを「親イオン」又は「親フラグメントイオン」と称することがある)が得られるまでCID−MSn測定を行い(フローA1)、得られた親フラグメントイオンについてさらにCID−MS/MS測定を行う(フローB1)。ここで、得られた特定のm/zを有する娘イオンについて総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線を作成し、必要に応じて該曲線の各特長をパラメータ化した解裂イオンパラメータを作成する(フローB1)。一方、参照データとして、構造既知の糖鎖(本明細書中では、これを「参照糖鎖」と称することがある)またはそのライブラリーについて、特定のm/zのフラグメントイオンが得られるまでCID−MSn測定を行い(フローA2)、得られたフラグメントイオンについてさらにCID−MS/MS測定を行う(フローB2)。ここで、得られた特定の娘イオンについて総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線を作成し、必要に応じて該曲線の各特長をパラメータ化した解裂イオンパラメータを作成する(フローB2)。本明細書中では、これら参照糖鎖のCIDエネルギー依存曲線および解裂イオンパラメータをあわせて「参照データ」と称することがある。なお、フローA1に先立って、目的糖鎖についてCID−MSn測定による糖鎖構造異性体の混入検定を行ってもよい(フローD)。
【0027】
かくして得られた目的糖鎖の特定のm/zのフラグメントイオンから得られた特定のm/zの娘イオンのCIDエネルギー依存曲線、または解裂イオンパラメータを、参照データと比較し(フローC)、目的糖鎖のデータと一致する参照データがあった場合に、その参照データが得られた参照糖鎖と目的糖鎖の一部の構造が一致すると判断することができる。
【0028】
また、目的糖鎖のデータと参照データが一致しない場合でも、目的糖鎖のパラメータが参照糖鎖のパラメータの統計的解析結果の範囲内であれば、部分構造を推定することができる。本発明には、このような構造の推定を行う方法も含まれる。
【0029】
このようにして目的糖鎖の一部の構造が決定または推定された場合、これらを目的糖鎖の生合成経路を参照する等して全体の構造を決定または推定していく(フローA1)ことができる。
【0030】
(2)目的親フラグメントイオンの調製(図1・図2/フローA1)
本発明に用いられる目的糖鎖は、以下に説明する方法により分解するなどしてCID−MSn測定を行い得るものであればいかなるものであってもよい。また、構造解析を目的として本発明の方法に供するものであるので、その全部または一部の構造が未知のものが好ましい。目的糖鎖は、生体組織又は細胞等から得られたものでもよいし、合成されたタンパク質に結合したものから得られたものでもよく、またそれを酸加水分解又は酵素分解したり、さらにHPLC等で分離精製したもの等を用いることができる。また、化学合成された糖鎖を用いることもできる。
【0031】
本発明では、目的糖鎖と参照糖鎖から得られる同一のm/zを有する親イオンについて、CID−MSn測定して得られる娘イオン強度を比較するので、参照データを誘導する親イオン(以下、これを「参照親フラグメントイオン」と称することがある)と同一のm/zを有するフラグメントイオン(以下、これを「目的親フラグメントイオン」と称することがある)が得られるまで何らかの方法で分解する必要がある。分解の方法は、それ自体公知の常法を用いることができるが、例えば、酸加水分解、酵素分解等により得られる糖鎖を液体クロマトグラフィー、キャピラリー電気泳動、ゲル電気泳動等により分離精製して用いることもでき、あるいは後述するCID−MSn測定等により得られる任意のフラグメントイオンをm/zにより分離して用いることができる。フローA1では、参照糖鎖として3糖ライブラリーを用いた場合を示しているので、目的糖鎖を1〜3糖に分解することが望ましい。また、目的糖鎖が置換基を有する場合、これを除去しても、また参照データに置換基を含むものがあれば付いたままでも用いることができる。最終的に得られた目的糖鎖分解物は、それぞれ質量分析することによりm/zを確認し、この質量とその他の情報、例えば生合成経路などの情報から配列を決定することもできるが、本発明の方法は、ここで決定することのできなかったフラグメントイオンについて用いることができる。
【0032】
(3)目的親フラグメントイオンのCID−MSn測定(図1、図3/フローB1)
上記で得られた目的親フラグメントイオンは、これをCID−MSn測定する(CID−MSn測定により得られた目的親フラグメントの場合は、これをCID−MS/MS測定する)。
【0033】
イオン化法としては、FAB(高速原子衝撃法)、CI(化学イオン化法)、ESI(エレクトロスプレーイオン化法)、MALDI(マトリクス支援レーザー脱離イオン化法)、APCI(大気圧化学イオン化法)等が用いられるが、本発明においてはサンプル調製が容易で、かつ、マトリックス由来の夾雑イオンの影響がないESI法を用いることが好ましい。しかし、上記CID−MSn測定が可能であればイオン化法はこれらに限定されるものではない。また、ESI法にはマイクロスプレー法とナノスプレー法があるが、サンプル使用量の面から本発明においてはナノスプレー法が好ましく用いられる。
【0034】
上記目的糖鎖またはその分解物をイオン化する場合、微液滴を真空下溶媒を蒸発させることでイオン化するため水/メタノールあるいは水/アセトニトリル(1:1)を溶媒として用いることができるが、物質の性質に従い選択が可能でありこれに限られることはない。目的糖鎖またはその分解物は、この溶媒に対して0.01〜100nmol/ml、より好ましくは0.5〜5nmol/ml、さらに好ましくは1nmol/mlの濃度に溶解することが好ましい。
【0035】
また、CID−MSn測定を行なう装置は、これが可能であれば、機種を問うものではないが、本発明においては、CID−MSn測定が可能な四重極イオントラップ型質量分析計を用いることが好ましい。このような装置としては、具体的には例えば、esquire 3000 plus(ブルカーダルトニクス社製)、LCQ DECA(サーモフィニガン社製)、AXIMA QIT(島津社製)、LCMS−IT−TOF(島津社製)等が挙げられる。測定方法としては、各親フラグメントイオンから解離する娘イオンのイオン強度が測定できる方法であればいかなるものでもよいが、具体的には、例えば、熱キャピラリー温度20〜365℃、キャピラリー電圧0〜6.0kV、CIDエネルギーが0〜25V、ポジティブモードまたはネガティブモードのいずれか等で測定することができる。ポジティブモードを用いる場合には、プロトン、ナトリウム、カリウム、リチウム、カルシウム、アンモニウム等の陽イオンを選択して用いることができる。
【0036】
上述のCID−MSn測定(またはCID−MS/MS測定)により得られたプロットから、特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線を作成する(式1)。このうち、特定のm/zの娘イオンの総イオンカウント数を、該娘イオンの総イオンカウント数と、該娘イオンの総イオンカウント数と上記親イオンの総イオンカウント数の和との比で表すことが好ましい(式2)。なお、式1及び式2は、親イオンAから娘イオンa,b,c,d,…,(i),…nが生成する場合の関係式を示す。この比で娘イオン強度を表すことにより、微弱なその他のイオンカウント数に影響を受けず、正確なCIDエネルギー依存曲線を作成することができる。特定のm/zの娘イオンとは、目的親フラグメントイオンから解離する何れの娘イオンでもよいし、その全てでもよい。
【式1】
【0037】

【式2】
【0038】

【0039】
さらに、上記CIDエネルギー依存曲線をそれ自体公知の方法で、特徴付ける数値で表すことにより、解裂イオンパラメータを作成することもできる。
【0040】
解裂イオンパラメータとしては、例えば、特定のm/zの娘イオンのイオン強度の最大値を該娘イオンの総イオンカウント数の相対数としてあらわした相対値、前記相対値が50%となるCIDエネルギー値、及びCIDエネルギー依存曲線の変曲点での傾き、から選ばれる少なくとも1つのパラメータを用いることができる。また、CIDエネルギー依存曲線をイオンカウント数の相対数としての基底値(Bottom=0)と最大値(Top=100)、その50%にあたるCIDエネルギー(V50)、およびCIDエネルギー依存曲線の変曲点での傾き(Slope)を指標として以下の式3により計算し、解裂イオンパラメータとすることもできる。式3のxは、CIDエネルギーを示す。
【式3】
【0041】

【0042】
上記のCIDエネルギー依存曲線あるいは解裂イオンパラメータを作成するためのCID−MSn測定において、CID−MSn測定器の機種、あるいは個体間においてデータのばらつきがあると、後述する参照データとの正確な比較が困難となる。そこで、必要に応じてスタンダードとなり得る物質についても同様にCID−MSn測定を行ない、このデータを用いて補正して比較することが好ましい。
【0043】
(4)参照親フラグメントイオンの調製(図1、図2/フローA2)
参照データを取得する目的で、参照糖鎖について上記(2)と同様に親フラグメントイオンを調製する。参照糖鎖は、目的糖鎖の全部または一部の構造を本発明の方法を用いて決定し得るものであればいかなるものであってもよい。具体的には、目的糖鎖またはその一部と構造が一致する可能性があり、構造が明らかであるものが用いられる。このような参照糖鎖は、天然のものでも合成されたものでもよく、また置換基がついていてもよい。糖鎖の長さは、1〜13個の糖が連結したものが用いられる。
【0044】
この参照糖鎖として、ある特定の集団であるライブラリーを用いることによれば、より網羅的、組織的に目的糖鎖の構造決定を行なうことができる。このようなライブラリーとしては、例えば、2〜25個の糖が連結した構造を有しており、ライブラリーを構成する各糖鎖は、天然糖鎖を構成する全ての種類の単糖の順列組み合わせの配列を有するもので、かつ立体異性も含むもの等が好ましく用いられる。また、非天然の単糖を含んでいてもよい。
【0045】
また、糖鎖構造を一般化すれば、非還元末端糖、還元末端糖、およびそれらの中間に存在する糖からなるポリマー性糖化合物ということができ、このポリマーの最小単位は3糖が連結した糖鎖である。このような3糖からなる天然糖鎖を構成する全ての種類の単糖の順列組み合わせの配列を有するもので、かつ立体異性も含む3糖ライブラリーは、生体に存在するあらゆる直鎖構造を有する糖鎖の部分構造を含んでいるため、本発明の参照糖鎖のライブラリーとしてより好ましい。
【0046】
上記の天然糖鎖を構成する単糖とは、例えば、グルコース、ガラクトース、マンノース、N-アセチルグルコサミン、N-アセチルガラクトサミン、キシロース、シアル酸、グルクロン酸、フコース等が挙げられる。また、これらは修飾基を有していても良い。
【0047】
参照糖鎖および参照糖鎖ライブラリーは、これを化学合成することが好ましい。合成の方法としては、通常用いられるそれ自体公知の方法を用いることができる。化学合成には、上述のような単糖各々を適当に保護した合成ユニットが必要である。さらに、立体異性体から成る糖鎖ライブラリーを効率良く合成するためには、立体選択的な合成ではα−グリコシドを得るためには隣接基関与のない保護基、例えばベンジル基(Bn)を、β−グリコシドを得るためには、隣接基関与のある保護基、例えばアセチル基等を用いる必要がある。これらの立体制御のための保護基の他に通して用いる保護基を用いる必要性から、単糖合成ユニット数は多くなり、合成経路の複雑化につながる。従って、2位の保護基は隣接基関与のない保護基とし、合成経路の簡略化を、例えばPCT/JP2004/009523号明細書に記載の方法等に従って行なうことが好ましい。
【0048】
かくして得られた参照糖鎖または参照糖鎖ライブラリーは、これを目的糖鎖と同様に特定のm/zのフラグメントイオンが得られるまでCID−MSn測定を行なう。特定のm/zのフラグメントイオンとは、目的糖鎖の親フラグメントイオンが有するm/zと同一のものであればいかなるものでもよい。また、参照糖鎖がライブラリーの場合には、該ライブラリーの各構成要素から得られる何れの解裂しえるフラグメントイオンでもよく、全ての解裂し得るフラグメントイオンでもよい。
【0049】
(5)参照親フラグメントイオンのCID−MSn測定(図1、図3/フローB2)
上記(4)で取得された参照親フラグメントイオンは、これを目的親フラグメントイオンと同様にCID−MSn測定する(CID−MSn測定により取得された参照親フラグメントの場合は、これをCID−MS/MS測定する)。イオン化法、溶媒、糖鎖の調製、測定装置などは全て目的糖鎖および親フラグメントイオンと同様のものを用いることができる。該測定により得られたプロットから、特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線を作成する(前述の式1)。このうち、特定のm/zの娘イオンの総イオンカウント数を、該娘イオンの総イオンカウント数と、該娘イオンの総イオンカウント数と上記親イオンの総イオンカウント数の和との比で表すことも好ましい(前述の式2)。この比で娘イオン強度を表すことにより、微弱なその他のイオンカウント数に影響を受けず、正確なCIDエネルギー依存曲線を作成することができる。特定のm/zの娘イオンとは、参照親フラグメントイオンから解離する何れの娘イオンでもよいし、その全てでもよい。さらに、参照糖鎖が、ライブラリーであった場合、該ライブラリーの全ての構成要素から得られる参照親フラグメントイオンについて得られる全ての娘イオンであることが網羅的、組織的解析を行なう上で好ましい。
【0050】
さらに、上記CIDエネルギー依存曲線をそれ自体公知の方法で、特徴付ける数値で表すことにより、解裂イオンパラメータを作成することもできる。
【0051】
解裂イオンパラメータとしては、例えば、特定のm/zの娘イオンのイオン強度の最大値を該娘イオンの総イオンカウント数の相対数としてあらわした相対値、前記相対値が50%となるCIDエネルギー値、及びCIDエネルギー依存曲線の変曲点での傾き、から選ばれる少なくとも1つのパラメータを用いることができる。また、CIDエネルギー依存曲線をイオンカウント数の相対数としての基底値(Bottom=0)と最大値(Top=100)、その50%にあたるCIDエネルギー(V50)、およびCIDエネルギー依存曲線の変曲点での傾き(Slope)を指標として前述の式3により計算し、解裂イオンパラメータとすること等が挙げられる。このとき、他の式によるCIDエネルギー依存曲線のカーブフィッティングを行なうこともでき、そのような場合には対応するパラメータを用いることができる。
【0052】
上記した方法により得られる、構造既知の複数の参照糖鎖をCID−MSn測定することにより得られる複数の特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線からなるCIDエネルギー依存曲線ライブラリー、並びに上記CIDエネルギー依存曲線から作成された、構造既知の複数の参照糖鎖の解裂イオンパラメータからなる解裂イオンパラメータライブラリーも本発明に含まれる。
【0053】
さらに、参照糖鎖または参照糖鎖ライブラリーをCID−MSn測定することにより得られるCIDエネルギー依存曲線、解裂イオンパラメータ等の参照データを、コンピュータにより読み取り可能な記憶装置に格納したデータセットも本発明に含まれる。
【0054】
さらに、CIDエネルギー依存曲線、または解裂イオンパラメータは深度を持つ新しい種類のバーコードとして扱うこともでき、分子の構造を記述するために用いることもできる。参照データとともに参照糖鎖名、起源、測定方法や条件等も同時にコード化することができ、サンプル瓶等に貼ることができる。従って、これを読み取るバーコードリーダー等と解析ソフトウェアについても当業者によれば作成することは可能であり本発明の範囲に含まれる。
【0055】
(6)目的糖鎖の構造決定(図1、図4/フローC)
本発明においては、上記(3)で得られた目的糖鎖の特定のm/zの親フラグメントイオンから得られた特定のm/zの娘イオン(以下、これを「目的娘イオン」と称することがある)のCIDエネルギー依存曲線について、目的親フラグメントイオンと同一のm/zを有する参照親フラグメントイオンから得られた、目的娘イオンと同一のm/zの娘イオン(以下、これを「参照娘イオン」と称することがある)のCIDエネルギー依存曲線を選択し、これを比較する。また、これらのCIDエネルギー依存曲線から得られた解裂イオンパラメータを比較してもよい。
【0056】
また、参照糖鎖がライブラリーである場合には、まず、参照データから目的親フラグメントイオンと同一のm/zを有する親イオンのデータを選択し、さらにその中から、比較しようとする目的娘イオンと同一のm/zの娘イオンのCIDエネルギー依存曲線または解裂イオンパラメータを選択してこれを比較する。
【0057】
目的親フラグメントイオンから得られたCIDエネルギー依存曲線または解裂イオンパラメータと、これに対応する参照データが一致した場合、参照データが誘導されたもとの参照親フラグメントイオンの構造と目的親フラグメントイオンの構造が同じであると決定することができる。ここで、それぞれのデータが一致するとは、CIDエネルギー依存曲線の場合、各々の曲線が95%以上の一致度を示すこといい、また、解裂イオンパラメータの場合にはその値の差が±2%以内であることを示す。また、目的親フラグメントイオンに置換基が結合していた場合には、置換基が結合した参照親フラグメントイオンから得られた参照データと比較して、一致した場合には、同一の置換基を有していると判断することができる。このとき、Z検定を判断基準とすることもできる。
【0058】
ここで、1つの特定のm/zを有する娘イオンのCIDエネルギー依存曲線または解裂イオンパラメータが一致しても、さらに他のm/zを有する娘イオンのデータを比較すると異なる場合もあるので、複数の娘イオンのデータを比較することが好ましい。
【0059】
かくして本発明の方法により目的糖鎖の一部が決定された場合、これらの全配列を決定するために、例えば、生合成経路に当てはまるものを参照してつなぎ合わせたり、初めに目的親フラグメントイオンを産生するために分解した場合には、その分解の方法から再構築する等の方法が用いられる。
【0060】
(7)目的糖鎖の構造推定(図1、図4/フローC)
上記(6)で比較したCIDエネルギー依存曲線または解裂イオンパラメータが一致しなかった場合は、解裂イオンパラメータを比較し、目的糖鎖の構造を推定することができる。具体的には、目的娘イオンのCIDエネルギー依存曲線から解裂イオンパラメータを作成し、参照娘イオンのCIDエネルギー依存曲線から作成した解裂イオンパラメータと比較することにより、目的糖鎖の構造を推定すればよい。統計的解析により比較するのが好ましく、また参照糖鎖として、前述の糖鎖ライブラリーを用いるのが好ましい。また、解裂イオンパラメータとして、例えば、CIDエネルギー依存曲線をイオンカウント数の相対数としての基底値(Bottom=0)と最大値(Top=100)、その50%にあたるCIDエネルギー(V50)、およびCIDエネルギー依存曲線の変曲点での傾き(Slope)を指標として前述の式3により計算した値を、挙げることができる。
【0061】
(8)糖鎖の構造異性体の純度検定(図1、図5/フローD)
前述のように、糖鎖の構造異性体毎にCID−MSn測定結果は相違する(図10)。すなわち、同一質量数であっても構造が異なる糖鎖異性体はこれを形成する結合の解裂反応の様子が異なる。この理由は構造異性を形成する化学結合エネルギーに差異が存在し、このため、異なる結合が各々CID条件下で解裂することによるためである。これを利用し、CID−MSn測定で親イオンが消失しない程度に衝突誘起解離を行い、この残存する親イオンをn+1段目で再度衝突誘起解離を行うこと(CID−MSn+1測定)により、糖鎖の構造異性体の純度検定を行うことができる。検体が純品ならばCID−MSnとCID−MSn+1の段数で得られるマススペクトル、あるいは、エネルギー依存曲線は一致する。検体が同一質量数の物質からなる混合物である(構造異性体混合物)ならば、CID−MSnとCID−MSn+1の各段の親イオンの組成比が異なることとなるので、得られる質量分析結果、特に、各シグナル強度、あるいは、エネルギー依存曲線が異なる。上記の純度検定の概略を図5に示す。
【実施例】
【0062】
以下、実施例を挙げて本発明を詳細に説明するが、本発明の範囲はこれらの実施例により限定されるものではない。
実施例1 CID−MSn測定の定量性の確認
(1)CID−MS/MS測定値の定量性
立体異性体や結合位置異性体からなる糖鎖のCID−MS/MS測定を行い、得られたCID−エネルギー依存曲線を比較して上記糖鎖の化学構造を決定するためには、取得したデータの定量性が問題となるためこれを確認した。Fucα(1−3)Galβ−Octyl(WO2005/000861号明細書に記載の方法で合成した)をH2O/メタノール(1:1)溶液に最終濃度10ng/μlとなるように溶解し、これをCID−MSn測定装置(esquire 3000 plus:ブルカーダルトニクス社製)のニードルにシリンジポンプを用いたインフュージョン法(流速を2μl/分)で注入し、熱キャピラリー温度250℃、キャピラリー電圧4.0kV、CIDエネルギーが0.5〜1.5V、ポジティブモードで測定を行った。
【0063】
上記の測定で得られる実際のイオングラフの1例として、m/z=315のフラグメントイオンのイオンクロマトグラム(TIC)を図6Aに示す。図中、階段状のカーブが電圧変化を示し、縦軸が総イオンカウント数、横軸が測定時間である。
【0064】
上記の測定におけるm/z=315およびその親イオンである416について、CIDエネルギー(電圧)と総イオンカウント数の関係を示したグラフ(CIDエネルギー依存曲線)を図6Bに示す。図中丸で示したグラフがm/z=315のもので、四角で示したグラフはm/z=416のもので、いずれも16プロットから電圧変化の直前直後の各々2プロットを除いた平均値をプロットした。
【0065】
図6Bの縦軸は、m/z=315の総イオンカウント数と、m/z=315の総イオンカウント数と親イオン(m/z=416)の総イオンカウント数の和の比である。この値を用いることにより、微弱な他のm/zのイオンカウント数の影響を受けない値で参照データと比較することができる。
【0066】
このグラフの定量性を検証するためにm/z=315のCIDエネルギー依存曲線の立ち上がり点(0.94V)、減衰する親イオン(m/z=416)のCIDエネルギー依存曲線との交点(1.12V)、およびプラトーに達する点(1.38V)の3点におけるイオンカウント数について上記16プロットから上限2プロットを除いた12プロットで、CV値(変動係数)を算出した結果を図6Cに示す。算出式は、標準偏差/平均値×100である。結果、それぞれの電圧における値のCV値(変動係数)がCIDエネルギー依存曲線の立ち上がり点で24.2%、親イオンCIDエネルギー依存曲線との交点で3.5%、およびプラトー到達点で7.3%であり、特に親イオンCIDエネルギー依存曲線との交点以降のデータは信頼性が高く、上記の方法により定量的解析が可能であることを示した。
【0067】
(2)CID−MSn測定により得られるCIDエネルギー依存曲線の同一性
本発明においては、同一のフラグメントイオンについて、CID−MS/MSとMS/MS/MS測定またはそれ以上の各CID−MSn測定で得られたCIDエネルギー依存曲線が同一でないと、参照データとの比較ができないので、これを確認した。
【0068】
マルトヘキサオース(6糖)のピリジルアミノ化物(図7A)をH2O/メタノール(1:1)溶液に最終濃度10ng/μlとなるように溶解し、これをCID−MSn測定装置(esquire 3000 plus:ブルカーダルトニクス社製)のニードルにシリンジポンプを用いたインフュージョン法(流速を2μl/分)で注入し、熱キャピラリー温度250℃、キャピラリー電圧4.0kV、CIDエネルギーが0.9〜1V、ポジティブモードで測定を行った。上記CID−MS/MS測定で得られたm/z=443(2糖)のCIDエネルギー依存曲線を図7A−1に示した。ここで、縦軸は、m/z=443の総イオンカウント数と、m/z=443の総イオンカウント数と親イオン(m/z=1091)の総イオンカウント数の和の比である。
【0069】
次にマルトヘプタオース(7糖)のピリジルアミノ化物(図7B)を上記と同様にCID−MS/MS測定を行い、得られたm/z=1091のフラグメントイオンについて、さらに1.1〜1.9VのCIDエネルギーでCID−MS(この時点ではMS/MS/MS)測定を行って得られたm/z=443(2糖)のCIDエネルギー依存曲線を図7B−1に示した。さらに上記2つのCIDエネルギー依存曲線を重ね合わせたものを図7Cに示した。図から明らかなように、同一のフラグメントイオンのCIDエネルギー依存曲線は、CID−MSn測定の異なる段数で得られたものでも同一でありCID−MSn測定の定量性が確認された。
【0070】
実施例2 CIDエネルギー依存曲線比較による構造決定
(1)天然糖鎖と合成オリゴ糖鎖におけるCIDエネルギー依存曲線の同一性
本発明は、参照糖鎖(ライブラリー)のCIDエネルギー依存曲線と構造未知の天然の糖鎖のCIDエネルギー依存曲線を比較することにより目的糖鎖の構造解析を行う方法である。ここで、構造は同じであるが異なる置換基を有している合成糖鎖と天然糖鎖について、CID−MS/MS測定で同一のm/zを有する親イオンを取得し、これをさらにCID−MS/MS測定した場合、得られた娘イオンのCIDエネルギー依存曲線が同一であることを確認した。
【0071】
Fucα(1−6)Galβ(1−4)Glcβ−Octyl(合成品/図8B)と、Fucα(1−2)Galβ(1−4)Glcを含むH2O−メタノール(1:1)(Dextra Lanoratories,Ltd.製/図8A)について、例1(1)と同様にして、CID−MS/MS測定を行い、得られたm/z=305.08のフラグメントイオン(グルコース環が解裂したもの(A0、2イオン))について、さらにCID−MS/MS測定を行った。この測定のm/z=245の時のCIDエネルギー依存曲線を図8に示す。図中、A−1で示されるグラフが天然の糖鎖から得られたもの、B−1がオクチル基が付いた合成オリゴ糖から得られたものである。また、これらを重ね合わせたものをCで示した。図から明らかなように、合成オリゴ糖と天然糖鎖では、同一のm/zを有するフラグメントイオンでは、その前段数のCID−MS/MS測定の親イオンが異なる置換基を有していても、また、天然糖鎖と合成糖鎖でも同一のCIDエネルギー依存曲線が得られることが確認された。
【0072】
また、上記CIDエネルギー依存曲線をイオンカウント数の相対数としての基底値(Bottom=0)と最大値(Top=100)、その50%にあたるCIDエネルギー(V50)、およびCIDエネルギー依存曲線の変曲点での傾き(Slope)を指標として式1によりパラメータ化(Prism4(GraphPad Software社製)を用いた)し、比較したところ、ほぼ同一の値を示した。従って、上記パラメータの比較によっても、構造未知の天然糖鎖の部分構造を明らかにすることができることが確認された。
【0073】
(2)異なる構造を有する糖鎖から得られる同一のフラグメントイオンにおけるCIDエネルギー依存曲線の同一性
本発明の方法は、目的糖鎖(参照データの親フラグメントイオンとは異なる構造を有する)を参照データの親イオンと同一の構造を有するフラグメントイオンが得られるまでCID−MSn測定を行い、これをさらにCID−MS/MS測定することにより得られたCIDエネルギー依存曲線を参照データと比較することにより糖鎖の構造解析を行う方法である。そこで、異なる構造を有する2種の糖鎖について同一のフラグメントイオンが得られるまでCID−MSn測定を行い、得られたフラグメントイオンをさらにCID−MS/MS測定し、得られた娘イオンのCIDエネルギー依存曲線が同一であることを確認した。
【0074】
PA化LeX5糖(図9A)および還元末端遊離のLeX5糖(B)のナトリウム付加イオンを実施例1と同様にCID−MS/MS測定を行い、LeX−osyl残基(LeX構造を含み、N−アセチルグルコサミン1位の酸素原子を含む)由来のフラグメントイオン(m/z=552.19)が共通に観察された。
【0075】
そこで、このフラグメントイオンについてさらにCID−MS/MS(この時点での段数は3段目となる)測定を行った。得られたプロットからm/z=406(C)および388(D)のフラグメントイオンについてCIDエネルギー依存曲線を作成した結果を図9CおよびDに示す。図中丸で示したグラフは、PA化LeX5糖由来のもの、四角が還元末端遊離のLeX5糖由来のものを示す。図から明らかなように、異なる構造を有する糖鎖から得られたものであっても、同一の構造を有するフラグメントイオンから得られる同一のm/zの娘イオンのCIDエネルギー依存曲線は一致することが確認された。
【0076】
(3)アノマーの識別
同一の構造を有するが立体異性のフラグメントイオンについて、これを本発明の方法で識別することができることを確認した。Fucα/β(1−6)Galα/β(1−6)Glcα/β−Octyl(図10A)の3つのグリコシド結合がそれぞれ異なる8種のアノマーを化学合成し、HPLCで分離精製を行なった後、これらを実施例1と同様にCID−MS/MS測定を行った。このときのFucα(1−6)Galα(1−6)Glcβ−OctylのMS/MSを異なるCIDエネルギー(B:0.82V、C:0.96V)で測定したスペクトルの1例を図10B、Cに示した。図から明らかなように、m/z=623.3の親イオンは、CIDエネルギーが0.82Vではm/z=477.2のフラグメントイオンを生じ、さらに0.96Vでは、該親イオンはm/z=477.2と331.1の2つのフラグメントイオンを生じた。
【0077】
本解析に用いた糖鎖が構造未知であったとすると、上記の結果からは、該糖鎖がデオキシヘキソースとヘキソースを含むことが判るが、上記8種のアノマーのいずれのグリコシド結合を有しているかは判らない。
【0078】
そこで、上記で得られたm/z=477.2のフラグメントイオンについてさらにCID−MS/MS測定を行った(この時点での段数は3段目となる)。条件は、実施例1と同じで、CIDエネルギーは0.5〜1.75Vで行った。m/z=477.23のフラグメントイオンは還元末端の単糖(フコース)を失った2糖の4種のアノマーのものである。
【0079】
得られたプロットからm/z=315のフラグメントイオンについてCIDエネルギー依存曲線を作成した結果を図10Dに示す。図中丸で示したグラフは、グリコシド結合α/αのもの、四角がβ/αのもの、三角がα/βのもの、ひし形がβ/βのものを示す。また、黒で示したグラフは1段目のCIDで遊離したフコースとのグリコシド結合がαであったもの、白で示したグラフがβであったものを示す。
【0080】
図から明らかなように、アノマー間では、CIDエネルギー依存曲線が明らかに異なり、本解析によりアノマーを識別できることが判った。また、親イオンのアノマーの違いは娘イオンのCIDエネルギー依存曲線には影響しないことが判った。
【0081】
さらに、上記のCIDエネルギー依存曲線をイオンカウント数の相対数としての基底値(Bottom=0)と最大値(Top=100)、その50%にあたるCIDエネルギー(V50)、およびCIDエネルギー依存曲線の変曲点での傾き(Slope)を指標として上記式1によりPrism4(GraphPad Software社製)を用いて算出、比較したところ、アノマー間では異なる値となり、また、親イオンのアノマーの違いは娘イオンの値には影響せず、上記計算式によってもアノマーを識別できることが判った。
【0082】
従って、構造未知の糖鎖についてCID−MSn測定を行い、得られるCIDエネルギー依存曲線を参照データと比較し、同一のものがあった場合には、目的糖鎖は、該CIDエネルギー依存曲線を与えた糖鎖と同一の構造であり、アノマーの違いも特定できることがわかった。
【0083】
逆に、構造が同一の糖鎖の参照データと、目的糖鎖をCID−MSn測定して得られたCIDエネルギー依存曲線が一致しなかった場合、参照データのもととなる糖鎖は目的糖鎖のアノマーである可能性がある。
【0084】
(4)CID−MSn測定の異なる段数におけるCIDエネルギー依存曲線の比較
本発明において、目的糖鎖の特定のm/zのフラグメントイオンの娘イオンのCIDエネルギー依存曲線が、参照データと一致した場合、この段数では一致していても、構造が異なることが考えられる。そこで、該CID−MSn測定で得られるその他の娘イオンについても参照データの同一のm/zの娘イオンのCIDエネルギー依存曲線と比較すると、さらに正確な構造解析を行うことができる。この場合の例を以下に示す。
【0085】
非還元末端にO型血液型抗原エピトープ(Fucα(1−2)Gal)を有する天然型糖鎖2種を比較対象として選択した。これらの糖鎖はエピトープ(Fucα(1−2)Gal)を共有するものの、フコースが結合しているガラクトースを含む2糖構造がラクト系列(図11A)とネオラクト系列(図11B)であり、結合位置異性体である。さらに、Aは3糖、Bは5糖であり、親イオンとしての質量数も明らかに異なるが、糖鎖A、BをそれぞれCID−MSn測定を行うことによりグルコサミニル結合部分で解裂したと考えられる共通のm/zを有するフラグメントイオン(m/z=534.18)がナトリウム付加物として得られる(図11A、およびBの線の左側部分)。
【0086】
そこで、さらにこのフラグメントイオンについてCID−MSn測定を行い、これらの娘イオン(m/z=388)のCIDエネルギー依存曲線を作成したところ、これらは一致した(図11C)。しかし、その他の娘イオンについても同様にCIDエネルギー依存曲線を作成したところ、m/z=349の娘イオンでは図11Dとなり、m/z=331の娘イオンでは図11Eとなり、明らかにCIDエネルギー依存曲線は異なることがわかった。このことから、上記2種の糖鎖の構造は異なると判断することができた。
【0087】
実施例3 パラメータ解析による構造異性の判別の可能性の確認
最初にアノマー異性体、および、結合位置異性体の判定をおこなうことの可能性に関して、単一の単糖の特定の結合のみからなるオリゴ糖を用いて検討した。マルトオリゴ糖はグルコースのみがα(1−4)、セロオリゴ糖はβ(1−4)結合それぞれした構造体でありであり、アノマー異性体の比較に適している。また、イソマルトオリゴ糖はα(1−6)の結合から成っており、マルトオリゴ糖との比較において結合位置異性の判別に重要な位置を占める。
【0088】
(1)アノマー異性の判別
実施例1(2)においてマルトオリゴ糖のCID−MS/MSとMS/MS/MS(CID−MSnとCID−MSn+1)測定のCIDエネルギー依存曲線が良い一致を示すことを示した。ここで得られたエネルギー依存曲線をシグモイドカーブフィットし、得られたパラメータ(Top、Slope、V50)について3D散布図を作成、この2D展開図を作成した。同時に結合位置はマルトオリゴ糖と同じでアノマー立体配置のみが異なるセロオリゴ糖に関して同様にプロットした(図12)。この結果、CID−MSn測定の2段目と3段目においてプレカーサーイオンが同一であればパラメータが良い一致を示し、特に、V50が1.40〜1.45Vの範囲に集中することが分かった。一方、セロオリゴ糖においてはV50値が1.5V付近にあり、これは、アノマー立体配置の相違による結合の解裂状況をパラメータで判別できることを示す結果である。
【0089】
(2)結合位置異性の判別
実施例3(1)のマルトースの結果に対しα(1−6)の結合から成っているイソマルトオリゴ糖の衝突エネルギーマップから各パラメータを取得し、マルトースのそれらと共にグラフとした(図13)。この結果、V50値が結合位置異性の指標として使用できることが示された。
【0090】
実施例4 構造推定方法に利用可能な3糖ライブラリーの参照データの同定
(1)3糖ライブラリーの合成およびそのCID−MSn測定
3糖ライブラリーの一部であるフコース(Fuc)、ガラクトース(Gal)、および、グルコース(Glc)で構成される3糖Fucα/β(1−6)Galα/β(1−2/3/4/6)Glcα/β−Octylをアノマー混合物として合成しHPLCを用いて単離した各々の3糖についてCID−MSn測定を行い、得られたライブラリー化合物からの構造情報を用いて構造未定化合物の構造予測をおこなった。情報源となる化合物は本来計32種(23×4)であるが、単離可能であった計23化合物についてライブラリー構造データとしてあつかった。全てのサンプルにおいてCID−MS/MS測定はm/z=623[M+Na]+、CID−MS/MS/MS測定はm/z=477[M−Fuc+Na]+に関しておこなった。
【0091】
(2)CID−MS/MS測定時の3糖ライブラリーのフコース残基解離データ
実施例1に記載の方法でCID−MS/MS測定をそれぞれのサンプルに関して行ってデータを取得した(図14)。その後カーブフィット(ボルツマンのシグモイド式)をおこない、各パラメータ(Top、Slope、V50)を算出した(図15)。3糖ライブラリーの23化合物のうち、Fucα/β(1−6)Galα/β(1−6)Glcβ−Octylの例を図14および15に示す。
【0092】
算出されたパラメータの散布図を作成するとプロットが二分していることが明らかであり、アノマー異性体(Fucα:黒丸、Fucβ:白丸)に着目すると、プロットがCIDプロセス下のフラグメント化においてグリコシド結合の立体(アノマー異性)を反映することが明らかである(図16)。この場合、V50とSlopeの両パラメータがアノマー異性の判別の指標となることが分かる。β体において1点のみSlopeが小さな値を示したが、これはデータのばらつきによるエラーであり統計的にもはずれ値として認識される。
【0093】
(3)CID−MS/MS/MS測定時の3糖ライブラリーのガラクトース残基解離データ
CID−MS/MS/MS測定においてもCID−MS/MS測定時のFucの脱離に関するプロットと同様にGalが脱離したm/z=315に関するデータは、2極化の傾向がある (図17)。この結果はV50のみがアノマー異性体を反映する結果である。
【0094】
実施例5 3糖ライブラリーのCID−MSn散布図を利用したアノマーの識別法
(1)各プロットと各平均との距離によるプロットの範囲
CID−MSn測定により得られるシグモイドカーブのグラフから、α配置およびβ配置(本実施例においてはフコースとガラクトースの場合について説明)はそれぞれある範囲を持ち収束していることがわかる。未知糖鎖のアノマー解析を行う際、この範囲に入っているか否かによりアノマーの推定が可能である。
【0095】
まずバラつきの範囲を認識するために、Fucのα配位、β配位のV50およびSlopeの平均をそれぞれもとめ、各プロットとの距離の値を範囲(R)とした。具体例を示すと、Fucα(1−6)Galα(1−3)Glcβ−Octylでは、
V50−α全体のV50の平均 = 0.00597、
Slope−α全体のSlopeの平均 = 0.000229
である。この値からの距離をもとめ、この距離を半径とする円をFucαの範囲とした(図18)。Fucαに関するライブラリーから得た数値を表1に示す。
【0096】
【表1】

【0097】
(3)構造解析における分子量の影響の補正
実施例2で、糖鎖ライブラリーをなす化合物のCID解析から得られる部分構造体のエネルギー依存曲線と未知物質の部分構造体のエネルギー依存カーブの比較から、カーブが完全一致すれば部分構造を推定できることを示した。これは異なった元の構造から得られた同一のフラグメントをライブラリーデータと参照することで可能としている。この場合トラップされたイオンは同一分子量であるため、部分構造の完全一致が可能となる。しかし質量分析において、親イオンの分子量(分子の大きさ)は結果に影響する重要な因子であり、本研究においても分子量の差異によりカーブおよびパラメータ(V50、Slope等)が異なる結果が得られているため、分子量の影響を考慮した糖鎖構造解析が必要となる。以下、得られた結果の補正法を提供する(図20)。
【0098】
糖鎖ライブラリー(Fucα/β(1−6)Galα/β(1−2/3/4/6)Glcα/β−Octyl) のm/z=477のフラグメントイオンのCIDエネルギー依存曲線と、今回補正サンプルとして用いる未知糖鎖の目的娘イオンと同一のm/zを有するLewis aの参照娘イオンのCIDエネルギー依存曲線からそれぞれ得られるV50およびSlopeを同一グラフにプロットした(図21)。ここからプロットは分子量の差異の影響を大きく受けていることが分かる。次にこの差異からV50、Slopeの補正値を導いた。以下に式を示す。
V50の補正値 = 脱Fucαライブラリー(m/z=477)のV50平均 / Lewis aのV50
Slopeの補正値=脱Fucαライブラリー(m/z=477)のSlope平均 / Lewis a のSlope
【0099】
この算出された各補正値を未知糖鎖の目的娘イオンのCIDエネルギー依存曲線から得られるV50およびSlopeに掛け合わせた。一例を示すと未知糖鎖の補正前プロットは図21に示すように、この未知糖鎖がFucβとは大きく差があるためFucαということが示唆された。この方法のみではデオキシヘキソースが何であるかの特定はできないが、ここで未知糖鎖として使用した糖鎖はヒトから単離された四糖構造であり、ヒトにおいて存在するデオキシヘキソースがフコースであるので未知検体はFucα構造を有すると推測できた。実際に未知糖鎖として用いた糖鎖はLewis XでありFucα構造を持っている。ライブラリーデータを充足することで、より精度の高い構造予測が可能である。
【0100】
(4)機器間のデータ補正
質量分析計を用いた構造解析を行うにあたり問題視されるのは、機器間のデータの差異である。これを上記の方法を用いて補正を行った。まず、共通のサンプルとしてFucα(1−6)Galα(1−6)Glcβ−Octylを補正サンプルとして用いた。比較に用いた機器は同一会社ではあるがブルカーQITMSを用いることで「個体差」の補正をおこなった。エネルギー依存曲線データを比べるとX軸(AmplおよびV50)に差異が見られる(図22)。次に、このサンプルを補正サンプルとしてFucβ(1−6)Galβ(1−6)Glcα−Octylの補正を段落番号0098の補正と同様の方法で行ったところ、差異が少なくなり補正可能であることが示唆された。補正用検体数を増やすことにより補正の精度を改善できる。
【0101】
実施例6 糖鎖の構造異性体の混入検定
(1)検体の調製および質量分析
以下の4種類の検体を調製し、それぞれを実施例1の方法に従い測定した。すなわち、検体の質量分析計への注入はインフュージョン法で、流速120μl/hで行い、用いているイオン源(エレクトロスプレーイオン化法:ESI)は1μl/min〜1ml/minの範囲で使用した。また、on lineあるいはoff line nanoESIを用いることにより、nl/minスケールでの分析が可能であった。検出機として質量分析計はブルカーダルトニクス esquire 3000plus(QIT−MSn)を用いた。分析条件を以下に示す。1)熱キャピラリー温度:205℃、2)キャピラリー電圧:4.0kV、3)Dry Gas:4.0l/min。ポジティブイオンモードで測定。ここで、CID−MSn測定の条件であるIsolation widthは同位体を含まない0.8 msで行った。
【0102】
純品A Galα(1−3)Galα−OMe(7 nmol)
純品B Galα(1−3)Galβ−OMe(7 nmol)
混合物C 純品A:純品B=1:1
混合物D 純品A:純品B=1:9
【0103】
(2)純品Aおよび純品Bの分析結果
純品AのCID−MS/MS測定及びCID−MS/MS/MS測定のAmpl Voltage毎の各フラグメント強度と各々の差を図23に示した。CID−MS/MS測定及びCID−MS/MS/MS測定では結果に差異が見られなかった。純品Bも同様の結果であった(図24)。
【0104】
(3)混合物Cおよび混合物Dの分析結果
混合物Cおよび混合物DのCID−MS/MS測定及びCID−MS/MS/MS測定のAmpl Voltage毎の各フラグメント強度と各々の差を図25および図26にそれぞれ示した。それぞれの混合物に関して、純品に比べ大きな差異が見られた。この差異から混合物/非混合物の判定が可能であった。
【図面の簡単な説明】
【0105】
【図1】図1は、本発明の方法の概略を示した図である。
【図2】図2は、本発明の方法の概略を示した図である。
【図3】図3は、本発明の方法の概略を示した図である。
【図4】図4は、本発明の方法の概略を示した図である。
【図5】図5は、本発明の方法の概略を示した図である。
【図6】図6は、Fucα(1−3)Galβ−OctylをCID−MSn測定した結果を示すグラフである。
【図7】図7は、マルトヘキサオースとマルトヘプタオースの構造、およびそれらをCID−MSn測定した結果、並びにそれらを比較した結果を示すグラフである。
【図8】図8は、Fucβ(1−6)Galβ(1−4)Glcの天然物および合成品の構造、およびそれらをCID−MSn測定した結果、並びにそれらを比較した結果を示すグラフである。
【図9】図9は、PA化LeX5糖と還元末端遊離のLeX5糖の構造、およびそれらをCID−MSn測定した結果、並びにそれらを比較した結果を示すグラフである。
【図10】図10は、Fucα(1−6)Galβ(1−6)Glcβ−Octylのアノマーの構造、およびそれらをCID−MSn測定した結果、並びにそれらを比較した結果を示すグラフである。
【図11】図11は、非還元末端にO型血液型抗原エピトープ(Fucα(1−2)Gal)を有する天然型糖鎖2種の構造、およびそれらをCID−MSn測定した結果、並びにそれらを比較した結果を示すグラフである。
【図12】図12は、マルトヘキサオースとマルトヘプタオースのCIDエネルギー依存曲線から得られた解裂イオンパラメータ(Top、Slope、V50)をそれぞれ2D展開図にプロットした結果を示すグラフである。
【図13】図13は、マルトヘキサオースとイソマルトヘキサオースのCIDエネルギー依存曲線から得られた解裂イオンパラメータ(Top、Slope、V50)をそれぞれ2D展開図にプロットした結果を示すグラフである。
【図14】図14は、3糖ライブラリーを構成するFucα/β(1−6)Galα/β(1−2/3/4/6)Glcα/β−Octylのアノマーのうち、Fucα(1−6)Galα(1−6)Glcβ−OctylをCID−MSn測定した結果を示すグラフである。
【図15】図15は、Fucα(1−6)Galα(1−6)Glcβ−OctylのCIDエネルギー依存曲線をカーブフィットした結果を示すグラフと、そのグラフから得られた解裂イオンパラメータ(Top、Slope、V50)の値である。
【図16】図16は、3糖ライブラリーを構成するFucα/β(1−6)Galα/β(1−2/3/4/6)Glcα/β−Octylの各アノマーのフコース残基を解離させた解裂イオンパラメータ(Top、Slope、V50)を2D展開図にプロットした結果を示すグラフである。各アノマーは結合位置異性で略して表記し、例えば163AABはFucα(1−6)Galα(1−3)Glcβ−Octylを意味する。
【図17】図17は、3糖ライブラリーを構成するFucα/β(1−6)Galα/β(1−2/3/4/6)Glcα/β−Octylの各アノマーのガラクトース残基をさらに解離させた解裂イオンパラメータ(Slope、V50)を2D展開図にプロットした結果を示すグラフである。
【図18】図18は、3糖ライブラリーを構成するアノマーの解裂イオンパラメータの平均値の2D展開図において、未知糖鎖のアノマーの推定が可能な範囲を示すグラフである。
【図19】図19は、3糖ライブラリーを構成するアノマーのフコースを解離させた解裂イオンパラメータ(Slope、V50)のα配置およびβ配置の各平均値ならびにそれらの標準偏差と、Fucβ(1−6)Galα(1−6)Glcα−Octylのフコースを解離させた解裂イオンパラメータを2D展開図にプロットした結果を示すグラフである。
【図20】図20は、参照娘イオンと目的娘イオンの分子量が異なった場合の補正方法の概略を示した図である。
【図21】図21は、参照娘イオンと目的娘イオンの分子量が異なった場合に得られる解裂イオンパラメータ(Slope、V50)の2D展開図における、測定値と補正値の関係を示すグラフである。
【図22】図22は、Fucα(1−6)Galα(1−6)Glcβ−Octylを異なる機種の質量分析計を用いてCID−MSn測定した結果を示すグラフである。
【図23】図23は、2糖の純品A(Galα(1−3)Galα−OMe)を、親イオンと最も強度の高いフラグメントイオンの比が約1:3、1:1、3:1となるAmpl VにてそれぞれCID−MS/MS測定およびCID−MS/MS/MS測定した結果を示すグラフである。
【図24】図24は、2糖の純品B(Galα(1−3)Galβ−OMe)を、親イオンと最も強度の高いフラグメントイオンの比が約1:3、1:1、3:1となるAmpl VにてそれぞれCID−MS/MS測定およびCID−MS/MS/MS測定した結果を示すグラフである。
【図25】図25は、2糖の純品A(Galα(1−3)Galα−OMe)および純品B(Galα(1−3)Galβ−OMe)を1:1の比で混合した混合物Cを、親イオンと最も強度の高いフラグメントイオンの比が約1:3、1:1、3:1となるAmpl VにてそれぞれCID−MS/MS測定およびCID−MS/MS/MS測定した結果を示すグラフである。
【図26】図26は、2糖の純品A(Galα(1−3)Galα−OMe)および純品B(Galα(1−3)Galβ−OMe)を1:9の比で混合した混合物Cを、親イオンと最も強度の高いフラグメントイオンの比が約1:3、1:1、3:1となるAmpl VにてそれぞれCID−MS/MS測定およびCID−MS/MS/MS測定した結果を示すグラフである。
【技術分野】
【0001】
本発明は、構造未知の糖鎖についてCID−MSn測定を行い、得られたデータをすでに取得されている参照データと比較することにより該糖鎖の構造解析を行う方法に関する。さらに本発明は、構造既知の複数の参照糖鎖をCID−MSn測定することにより得られる複数の特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線からなるCIDエネルギー依存曲線ライブラリーに関する。
【背景技術】
【0002】
糖鎖は主に細胞表面に糖タンパク質や糖脂質の一部として存在し、発生、分化誘導、受精、免疫、癌化、感染症等、様々な生命現象に深く関与している。このように多彩な機能を有する糖鎖の研究は近年盛んになっている。また、糖鎖は、タンパク質の翻訳後修飾の重要な部分を占め、今後の大きな研究対象である。糖タンパク質や糖脂質の機能は糖鎖により制御される場合があり、糖鎖の構造解析を極微量において達成する技術が必要である。しかし、糖鎖は生物工学的手法により増幅ができない分子種であるため、微量の物質のみで構造解析を達成することを可能とする新たな構造解析技術の開発が必要である。タンパク質の配列はゲノム配列が判明している場合、対応するタンパク質のアミノ酸配列も取得できるため、目的のタンパク質のアミノ酸配列は質量分析(例えば、MS/MS法)により解析することができる。しかし、被修飾タンパク質の配列解析技術については今後の課題として残されている。特に、糖鎖によるタンパク質の修飾は極めて大きな分子の多様性を生み出している。したがって、糖鎖の構造解析技術の開発は必要不可欠である。
【0003】
糖鎖は、核酸やタンパク質とは異なり配列以外の要因による構造異性体群を形成している。この理由の基本は、糖鎖を形成する単糖には反応点となる水酸基が複数存在するため結合位置異性体を形成する性質を有し、かつ、単糖間の結合の際にはアノメリック位の立体異性によるアノマー異性体を形成する性質を有しているためである。単糖間の結合は、生物体内においては糖鎖の合成に関わる酵素群の連続反応により行われるため、必ずしも組み合わせの原理に基づく糖鎖群を形成しているわけではない。しかし、酵素反応は副反応を伴うことが知られており、このような現象の生物における意味は解明されておらず、このような場合には遺伝情報によることのない全く新しい概念に基づく構造解析法が必要である。もちろん、遺伝情報が解明されていない、また、糖鎖の生合成経路が解明されていない生物種における糖鎖構造の解析についても新しい構造解析法が必要である。
【0004】
現在用いられている糖鎖の構造解析技術としては、(1)核磁気共鳴分光法、(2)質量分析法、(3)多次元クロマトグラフィーによるマッピング法(非特許文献1を参照)、(4)加水分解酵素による特異的部分加水分解法(非特許文献2を参照)、(5)レクチンによるマッピング法(非特許文献2を参照)、及び(6)メチル化−加水分解-ガスクロマトグラフィーによる組成分析法(非特許文献2を参照)をあげることができ、通常はこれらを組み合わせて糖鎖の解析が行われている。
【0005】
上記の中でも特に有効な糖鎖の解析手段としては、核磁気共鳴分光法及び質量分析法をあげることができるが、前者の問題点は解析に必要な量がμg以上であることであり、後者の問題点は立体異性体の解析が不可能なことである。これらの方法を含めいずれの解析法を用いるにせよ、糖鎖の構造解析は、得られた天然糖鎖構造の構造解析を直接行わなければならない(非特許文献3を参照)。
【0006】
一方、異なる糖鎖を質量分析することにより、その結果が異なることが示されている。例えば、ステロイドの水酸基の立体異性体のCID−MS/MS測定によるフラグメント化を行うと、各フラグメント強度が異なること(非特許文献4を参照)や、合成された硫酸化糖鎖の構造異性体のCID−MS/MS測定をFAB−q−Massで行って、特定イオンの強度を測定すると、その値に差があること(非特許文献5を参照)が示されている。しかし、これらはいずれも具体的に糖鎖の構造解析方法を示すものではなかった。
【0007】
質量分析装置を用いる糖鎖の構造解析技術において一般的な構造解析法としては、m/zとそのピーク強度をパラメータとし、構造既知の糖鎖のそれと比較することで同一構造か否かの判定をする方法がある(非特許文献6及び7を参照)。この方法は、特定の一点の電圧におけるフラグメントのピーク強度を指標とし、各々のフラグメントの強度が総合的に一致するか否かをスコア化して判定する方法であり、参照とする化合物群の網羅的なデータセット、あるいは、網羅的なデータベースが必要である。また、この方法の限界は、合否の判定をするだけで否の場合の構造予測が不可能な点であった。
【0008】
構造的に類似性のある化合物群に対しては、多変量解析が、質量分析により得られたデータから構造的特徴を抽出するのに新たな可能性を与えることを示唆している報告があるが、2糖の構造予測に応用できることを報告しているにすぎず、長い糖鎖の構造予測の可能性については具体的には何も触れていない(非特許文献8を参照)。
【0009】
さらに、質量分析法は極微量分析であり、検出される質量数(H、Na付加等)から物質の分子量が分かると共に、フラグメントイオンの解裂様式から、分子構造に関して重要な情報を得ることができるものの、サンプルに異性体(構造異性体、光学異性体)が混入して存在する場合、質量分析計のみではその混入物の存在すら識別できなかった。
【0010】
【非特許文献1】Royle, L. et al., Anal. Biochem., 2002,304,70-90
【非特許文献2】Chaplin, M.F et al., Carbohydrate Analysis, A Practical Approach, IRL Press, Oxford,1994
【非特許文献3】Dell, A., Adv. Carbohydr. Chem. Biochem. 1987, 45, 19-72
【非特許文献4】Faretto, D. et al., Mass Spectrom., 1991,5,240-244
【非特許文献5】Kurono, S. et al., J. Mass Spectrom., 1998, 33,35-44
【非特許文献6】Viseux. N. et al., Anal. Chem. 1998, 70, 4951-4959
【非特許文献7】Kameyama, A. et al., Anal. Chem. 2005, 77, 4719-4725
【非特許文献8】Faengmark, I. et al., Anal. Chem. 1999, 71, 1105-1110
【発明の開示】
【発明が解決しようとする課題】
【0011】
本発明の目的は、構造未知の糖鎖についてCID−MSn測定を行い、得られたデータをすでに取得されている参照データと比較することにより該糖鎖の構造解析を行う方法を提供することである。具体的には、本発明の目的は、構造解析の目的糖鎖に関する特定のm/zのフラグメントイオンついてCID−MS/MS測定を行い、得られたCIDエネルギー依存曲線を、同一のm/zの親イオンから同一のm/zの娘イオンを得た参照データであるCIDエネルギー依存曲線と比較して、同一か否かを特定することにより該糖鎖の構造決定を行う方法を提供することである。本発明の別の目的は、上記の目的糖鎖および参照糖鎖のCIDエネルギー依存曲線について、これらの曲線を特徴付ける数値で表した解裂イオンパラメータをそれぞれ作成し、これらのパラメータを統計的に解析することにより、目的糖鎖の構造決定又は構造推定を行う方法を提供することである。本発明のさらに別の目的は、質量分析計のみを用いた糖鎖の構造異性体混合物を識別するための分析方法を提供することである。
【課題を解決するための手段】
【0012】
本発明者らは、上記課題を達成するために鋭意検討を進めた結果、構造が異なる糖鎖および立体異性の糖鎖を合成し、特定のm/zのフラグメントイオンが得られるまでCID−MSn測定を行い、該フラグメントイオンについてさらにCID−MS/MS測定を行い、得られた特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線を作成したところ、同一の構造を有する糖鎖は複数回これを測定しても同一のCIDエネルギー依存曲線が得られ、逆に構造が異なる糖鎖はCIDエネルギー依存曲線も異なることを見出した。また、立体異性体もCIDエネルギー依存曲線が異なることを見出した。さらに、糖鎖の部分構造、そこから得られるCIDエネルギー依存曲線またはCIDエネルギー依存曲線のパラメータが一致しなくても、パラメータの統計的解析に基づき部分構造を推定できることを見出した。本発明はこれらの知見に基づいて成し遂げられたものである。
【0013】
すなわち本発明によれば、以下の発明が提供される。
(1) (a)目的糖鎖について特定のm/zのフラグメントイオンが得られるまでCID−MSn測定を行い、(b)該フラグメントイオンについてさらにCID−MS/MS測定を行い、得られた特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線を作成し、(c)該CIDエネルギー依存曲線と、構造既知の参照糖鎖から得られた、上記フラグメントイオンと同一のm/zのフラグメントイオンをCID−MS/MS測定することにより得られた、上記娘イオンと同一のm/zの娘イオンのCIDエネルギー依存曲線とを比較することを特徴とする糖鎖構造解析方法。
【0014】
(2) 構造既知の複数の参照糖鎖をCID−MSn測定することにより得られる複数の特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線からなるCIDエネルギー依存曲線ライブラリー。
(3) 参照糖鎖が3糖からなることを特徴とする(2)に記載のライブラリー。
【0015】
(4) (2)に記載のCIDエネルギー依存曲線から作成された、構造既知の複数の参照糖鎖の解裂イオンパラメータからなる解裂イオンパラメータライブラリー。
(5) 構造既知の複数の参照糖鎖の解裂イオンパラメータが、特定のm/zの娘イオンのイオン強度の最大値を該娘イオンの総イオンカウント数の相対数としてあらわした相対値、前記相対値が50%となるCIDエネルギー値、CIDエネルギー依存曲線の変曲点での傾き、から選ばれる少なくとも1つのパラメータであることを特徴とする、(4)に記載のライブラリー。
(6) 参照糖鎖が3糖からなることを特徴とする(4)または(5)に記載のライブラリー。
【0016】
(7) (a)目的糖鎖について特定のm/zのフラグメントイオンが得られるまでCID−MSn測定を行い、(b)該フラグメントイオンについてさらにCID−MS/MS測定を行い、得られた特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線を作成し、(c)該CIDエネルギー依存曲線と、(2)または(3)に記載のライブラリーに含まれる、上記フラグメントイオンと同一のm/zのフラグメントイオンをCID−MS/MS測定することにより得られた、上記娘イオンと同一のm/zの娘イオンのCIDエネルギー依存曲線とを比較することを特徴とする糖鎖構造解析方法。
【0017】
(8) (1)または(7)に記載の(c)の工程において、目的糖鎖の特定のm/zの娘イオンのCIDエネルギー依存曲線の解裂イオンパラメータを作成し、該解裂イオンパラメータと、構造既知の参照糖鎖の上記娘イオンと同一のm/zの娘イオンのCIDエネルギー依存曲線の解裂イオンパラメータとを比較することを特徴とする、(1)または(7)に記載の方法。
【0018】
(9) 解裂イオンパラメータが、特定のm/zの娘イオンのイオン強度の最大値を該娘イオンの総イオンカウント数の相対数としてあらわした相対値、前記相対値が50%となるCIDエネルギー値、CIDエネルギー依存曲線の変曲点での傾き、から選ばれる少なくとも1つのパラメータであることを特徴とする、(8)に記載の方法。
【0019】
(10) (a)目的糖鎖について特定のm/zのフラグメントイオンが得られるまでCID−MSn測定を行い、(b)該フラグメントイオンについてさらにCID−MS/MS測定を行い、得られた特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線を作成し、(c)該CIDエネルギー依存曲線の解裂イオンパラメータを作成し、(d)該解裂イオンパラメータと、(4)〜(6)のいずれかに記載のライブラリーに含まれる、上記フラグメントイオンと同一のm/zのフラグメントイオンをCID−MS/MS測定することにより得られた、上記娘イオンと同一のm/zの娘イオンのCIDエネルギー依存曲線から作成された解裂イオンパラメータを比較することを特徴とする糖鎖構造解析方法。
【0020】
(11) CIDエネルギー依存曲線の特定のm/zの娘イオンの総イオンカウント数が、特定のm/zの娘イオンの総イオンカウント数と、該娘イオンの総イオンカウント数と親イオンの総イオンカウント数の和の比であることを特徴とする(1)または(7)〜(10)のいずれかに記載の方法。
【0021】
(12) 目的糖鎖に含まれる異なる特定のm/zのフラグメントイオンについて(1)もしくは(7)に記載の(a)〜(c)の工程または(10)に記載の(a)〜(d)の工程を繰り返し、それらの結果を組み合わせることを特徴とする糖鎖構造解析方法。
【0022】
(13) 少なくともCID−MSn測定装置、(2)〜(6)のいずれかに記載のライブラリーをコンピューター読み取り可能なように記録した記録媒体、および目的糖鎖に含まれる異なる特定のフラグメントイオンについて(1)もしくは(7)に記載の(b)および(c)の工程または(10)に記載の(b)〜(d)の工程を行なうためのプログラムを記録した記録媒体を含む糖鎖構造解析システム。
【0023】
(14) (a)糖鎖検体について特定のm/zのフラグメントイオンが消失しないような任意の電圧でCID−MSn測定を行い、(b)残存する該フラグメントイオンについてさらにCID−MS/MS測定を行い、(c)前記2工程で得られたマススペクトル、CIDエネルギー依存曲線または該曲線の解裂イオンパラメータを比較することを特徴とする、糖鎖構造異性体の混入検定方法。
【発明の効果】
【0024】
本発明の糖鎖解析方法は、構造未知の糖鎖についてCID−MSn測定を行ない、得られたCIDエネルギー依存曲線を構造既知の糖鎖から得られた参照データと比較することにより構造決定を行う方法である。該方法は、天然に存在する構造未知の糖鎖を、置換基が異なるものや立体異性体等も含めその構造、またはその一部を決定又は推定することができ、また極微量の解析が行える点で非常に有用である。また該方法は、糖鎖の構造解析という次世代生命科学研究の基盤技術となるのみならず、糖鎖の異常を伴う疾病や感染症を引き起こすきっかけとなる糖鎖レセプターの特定等、診断医療に貢献する技術となるものである。さらに、本発明の純度検定方法により、検体の詳細なデータ解析をおこなう以前にその必要性を簡便に判定することが可能となる。
【発明を実施するための最良の形態】
【0025】
以下、本発明を更に詳細に説明するが、以下の構成要件の説明は、本発明の実施態様の代表例であり、本発明はこれらの内容のみに特定されるものではない。
以下の説明において、「CID−MSn測定」とは、CID(Collision induced dissociation:衝突誘起解離)による多段マススペクトロメトリーの取得を行うことを示し、「フラグメントイオン」とは、上記CID−MSn測定や物理化学的分解等により得られる各m/zを有するイオンを示し、「m/z」とは、質量数(m)と電荷(z)の比を示し、「娘イオン」とは、フラグメントイオンを上記CID−MSn測定することにより得られる各m/zを有するフラグメントイオンを示し、「総イオンカウント数」とは、各m/zを有するすべてのフラグメントイオンのイオン強度の総和を示し、また、「CIDエネルギー」とは、CIDを起こすときに加えるエネルギーを一般的に示し、実際にはイオンを振動させるためのある周波数の電場の電圧を示す。さらに、「構造解析方法」とは、構造決定方法および/または構造推定方法を意味する。
【0026】
本発明の方法を図1〜5に示し、この図に従って以下に本発明を説明する。
(1)構造解析方法の概略(図1)
本発明は、構造未知の糖鎖(本明細書中では、これを「目的糖鎖」と称することがある)を特定のm/zのフラグメントイオン(以下、これを「親イオン」又は「親フラグメントイオン」と称することがある)が得られるまでCID−MSn測定を行い(フローA1)、得られた親フラグメントイオンについてさらにCID−MS/MS測定を行う(フローB1)。ここで、得られた特定のm/zを有する娘イオンについて総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線を作成し、必要に応じて該曲線の各特長をパラメータ化した解裂イオンパラメータを作成する(フローB1)。一方、参照データとして、構造既知の糖鎖(本明細書中では、これを「参照糖鎖」と称することがある)またはそのライブラリーについて、特定のm/zのフラグメントイオンが得られるまでCID−MSn測定を行い(フローA2)、得られたフラグメントイオンについてさらにCID−MS/MS測定を行う(フローB2)。ここで、得られた特定の娘イオンについて総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線を作成し、必要に応じて該曲線の各特長をパラメータ化した解裂イオンパラメータを作成する(フローB2)。本明細書中では、これら参照糖鎖のCIDエネルギー依存曲線および解裂イオンパラメータをあわせて「参照データ」と称することがある。なお、フローA1に先立って、目的糖鎖についてCID−MSn測定による糖鎖構造異性体の混入検定を行ってもよい(フローD)。
【0027】
かくして得られた目的糖鎖の特定のm/zのフラグメントイオンから得られた特定のm/zの娘イオンのCIDエネルギー依存曲線、または解裂イオンパラメータを、参照データと比較し(フローC)、目的糖鎖のデータと一致する参照データがあった場合に、その参照データが得られた参照糖鎖と目的糖鎖の一部の構造が一致すると判断することができる。
【0028】
また、目的糖鎖のデータと参照データが一致しない場合でも、目的糖鎖のパラメータが参照糖鎖のパラメータの統計的解析結果の範囲内であれば、部分構造を推定することができる。本発明には、このような構造の推定を行う方法も含まれる。
【0029】
このようにして目的糖鎖の一部の構造が決定または推定された場合、これらを目的糖鎖の生合成経路を参照する等して全体の構造を決定または推定していく(フローA1)ことができる。
【0030】
(2)目的親フラグメントイオンの調製(図1・図2/フローA1)
本発明に用いられる目的糖鎖は、以下に説明する方法により分解するなどしてCID−MSn測定を行い得るものであればいかなるものであってもよい。また、構造解析を目的として本発明の方法に供するものであるので、その全部または一部の構造が未知のものが好ましい。目的糖鎖は、生体組織又は細胞等から得られたものでもよいし、合成されたタンパク質に結合したものから得られたものでもよく、またそれを酸加水分解又は酵素分解したり、さらにHPLC等で分離精製したもの等を用いることができる。また、化学合成された糖鎖を用いることもできる。
【0031】
本発明では、目的糖鎖と参照糖鎖から得られる同一のm/zを有する親イオンについて、CID−MSn測定して得られる娘イオン強度を比較するので、参照データを誘導する親イオン(以下、これを「参照親フラグメントイオン」と称することがある)と同一のm/zを有するフラグメントイオン(以下、これを「目的親フラグメントイオン」と称することがある)が得られるまで何らかの方法で分解する必要がある。分解の方法は、それ自体公知の常法を用いることができるが、例えば、酸加水分解、酵素分解等により得られる糖鎖を液体クロマトグラフィー、キャピラリー電気泳動、ゲル電気泳動等により分離精製して用いることもでき、あるいは後述するCID−MSn測定等により得られる任意のフラグメントイオンをm/zにより分離して用いることができる。フローA1では、参照糖鎖として3糖ライブラリーを用いた場合を示しているので、目的糖鎖を1〜3糖に分解することが望ましい。また、目的糖鎖が置換基を有する場合、これを除去しても、また参照データに置換基を含むものがあれば付いたままでも用いることができる。最終的に得られた目的糖鎖分解物は、それぞれ質量分析することによりm/zを確認し、この質量とその他の情報、例えば生合成経路などの情報から配列を決定することもできるが、本発明の方法は、ここで決定することのできなかったフラグメントイオンについて用いることができる。
【0032】
(3)目的親フラグメントイオンのCID−MSn測定(図1、図3/フローB1)
上記で得られた目的親フラグメントイオンは、これをCID−MSn測定する(CID−MSn測定により得られた目的親フラグメントの場合は、これをCID−MS/MS測定する)。
【0033】
イオン化法としては、FAB(高速原子衝撃法)、CI(化学イオン化法)、ESI(エレクトロスプレーイオン化法)、MALDI(マトリクス支援レーザー脱離イオン化法)、APCI(大気圧化学イオン化法)等が用いられるが、本発明においてはサンプル調製が容易で、かつ、マトリックス由来の夾雑イオンの影響がないESI法を用いることが好ましい。しかし、上記CID−MSn測定が可能であればイオン化法はこれらに限定されるものではない。また、ESI法にはマイクロスプレー法とナノスプレー法があるが、サンプル使用量の面から本発明においてはナノスプレー法が好ましく用いられる。
【0034】
上記目的糖鎖またはその分解物をイオン化する場合、微液滴を真空下溶媒を蒸発させることでイオン化するため水/メタノールあるいは水/アセトニトリル(1:1)を溶媒として用いることができるが、物質の性質に従い選択が可能でありこれに限られることはない。目的糖鎖またはその分解物は、この溶媒に対して0.01〜100nmol/ml、より好ましくは0.5〜5nmol/ml、さらに好ましくは1nmol/mlの濃度に溶解することが好ましい。
【0035】
また、CID−MSn測定を行なう装置は、これが可能であれば、機種を問うものではないが、本発明においては、CID−MSn測定が可能な四重極イオントラップ型質量分析計を用いることが好ましい。このような装置としては、具体的には例えば、esquire 3000 plus(ブルカーダルトニクス社製)、LCQ DECA(サーモフィニガン社製)、AXIMA QIT(島津社製)、LCMS−IT−TOF(島津社製)等が挙げられる。測定方法としては、各親フラグメントイオンから解離する娘イオンのイオン強度が測定できる方法であればいかなるものでもよいが、具体的には、例えば、熱キャピラリー温度20〜365℃、キャピラリー電圧0〜6.0kV、CIDエネルギーが0〜25V、ポジティブモードまたはネガティブモードのいずれか等で測定することができる。ポジティブモードを用いる場合には、プロトン、ナトリウム、カリウム、リチウム、カルシウム、アンモニウム等の陽イオンを選択して用いることができる。
【0036】
上述のCID−MSn測定(またはCID−MS/MS測定)により得られたプロットから、特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線を作成する(式1)。このうち、特定のm/zの娘イオンの総イオンカウント数を、該娘イオンの総イオンカウント数と、該娘イオンの総イオンカウント数と上記親イオンの総イオンカウント数の和との比で表すことが好ましい(式2)。なお、式1及び式2は、親イオンAから娘イオンa,b,c,d,…,(i),…nが生成する場合の関係式を示す。この比で娘イオン強度を表すことにより、微弱なその他のイオンカウント数に影響を受けず、正確なCIDエネルギー依存曲線を作成することができる。特定のm/zの娘イオンとは、目的親フラグメントイオンから解離する何れの娘イオンでもよいし、その全てでもよい。
【式1】
【0037】

【式2】
【0038】

【0039】
さらに、上記CIDエネルギー依存曲線をそれ自体公知の方法で、特徴付ける数値で表すことにより、解裂イオンパラメータを作成することもできる。
【0040】
解裂イオンパラメータとしては、例えば、特定のm/zの娘イオンのイオン強度の最大値を該娘イオンの総イオンカウント数の相対数としてあらわした相対値、前記相対値が50%となるCIDエネルギー値、及びCIDエネルギー依存曲線の変曲点での傾き、から選ばれる少なくとも1つのパラメータを用いることができる。また、CIDエネルギー依存曲線をイオンカウント数の相対数としての基底値(Bottom=0)と最大値(Top=100)、その50%にあたるCIDエネルギー(V50)、およびCIDエネルギー依存曲線の変曲点での傾き(Slope)を指標として以下の式3により計算し、解裂イオンパラメータとすることもできる。式3のxは、CIDエネルギーを示す。
【式3】
【0041】

【0042】
上記のCIDエネルギー依存曲線あるいは解裂イオンパラメータを作成するためのCID−MSn測定において、CID−MSn測定器の機種、あるいは個体間においてデータのばらつきがあると、後述する参照データとの正確な比較が困難となる。そこで、必要に応じてスタンダードとなり得る物質についても同様にCID−MSn測定を行ない、このデータを用いて補正して比較することが好ましい。
【0043】
(4)参照親フラグメントイオンの調製(図1、図2/フローA2)
参照データを取得する目的で、参照糖鎖について上記(2)と同様に親フラグメントイオンを調製する。参照糖鎖は、目的糖鎖の全部または一部の構造を本発明の方法を用いて決定し得るものであればいかなるものであってもよい。具体的には、目的糖鎖またはその一部と構造が一致する可能性があり、構造が明らかであるものが用いられる。このような参照糖鎖は、天然のものでも合成されたものでもよく、また置換基がついていてもよい。糖鎖の長さは、1〜13個の糖が連結したものが用いられる。
【0044】
この参照糖鎖として、ある特定の集団であるライブラリーを用いることによれば、より網羅的、組織的に目的糖鎖の構造決定を行なうことができる。このようなライブラリーとしては、例えば、2〜25個の糖が連結した構造を有しており、ライブラリーを構成する各糖鎖は、天然糖鎖を構成する全ての種類の単糖の順列組み合わせの配列を有するもので、かつ立体異性も含むもの等が好ましく用いられる。また、非天然の単糖を含んでいてもよい。
【0045】
また、糖鎖構造を一般化すれば、非還元末端糖、還元末端糖、およびそれらの中間に存在する糖からなるポリマー性糖化合物ということができ、このポリマーの最小単位は3糖が連結した糖鎖である。このような3糖からなる天然糖鎖を構成する全ての種類の単糖の順列組み合わせの配列を有するもので、かつ立体異性も含む3糖ライブラリーは、生体に存在するあらゆる直鎖構造を有する糖鎖の部分構造を含んでいるため、本発明の参照糖鎖のライブラリーとしてより好ましい。
【0046】
上記の天然糖鎖を構成する単糖とは、例えば、グルコース、ガラクトース、マンノース、N-アセチルグルコサミン、N-アセチルガラクトサミン、キシロース、シアル酸、グルクロン酸、フコース等が挙げられる。また、これらは修飾基を有していても良い。
【0047】
参照糖鎖および参照糖鎖ライブラリーは、これを化学合成することが好ましい。合成の方法としては、通常用いられるそれ自体公知の方法を用いることができる。化学合成には、上述のような単糖各々を適当に保護した合成ユニットが必要である。さらに、立体異性体から成る糖鎖ライブラリーを効率良く合成するためには、立体選択的な合成ではα−グリコシドを得るためには隣接基関与のない保護基、例えばベンジル基(Bn)を、β−グリコシドを得るためには、隣接基関与のある保護基、例えばアセチル基等を用いる必要がある。これらの立体制御のための保護基の他に通して用いる保護基を用いる必要性から、単糖合成ユニット数は多くなり、合成経路の複雑化につながる。従って、2位の保護基は隣接基関与のない保護基とし、合成経路の簡略化を、例えばPCT/JP2004/009523号明細書に記載の方法等に従って行なうことが好ましい。
【0048】
かくして得られた参照糖鎖または参照糖鎖ライブラリーは、これを目的糖鎖と同様に特定のm/zのフラグメントイオンが得られるまでCID−MSn測定を行なう。特定のm/zのフラグメントイオンとは、目的糖鎖の親フラグメントイオンが有するm/zと同一のものであればいかなるものでもよい。また、参照糖鎖がライブラリーの場合には、該ライブラリーの各構成要素から得られる何れの解裂しえるフラグメントイオンでもよく、全ての解裂し得るフラグメントイオンでもよい。
【0049】
(5)参照親フラグメントイオンのCID−MSn測定(図1、図3/フローB2)
上記(4)で取得された参照親フラグメントイオンは、これを目的親フラグメントイオンと同様にCID−MSn測定する(CID−MSn測定により取得された参照親フラグメントの場合は、これをCID−MS/MS測定する)。イオン化法、溶媒、糖鎖の調製、測定装置などは全て目的糖鎖および親フラグメントイオンと同様のものを用いることができる。該測定により得られたプロットから、特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線を作成する(前述の式1)。このうち、特定のm/zの娘イオンの総イオンカウント数を、該娘イオンの総イオンカウント数と、該娘イオンの総イオンカウント数と上記親イオンの総イオンカウント数の和との比で表すことも好ましい(前述の式2)。この比で娘イオン強度を表すことにより、微弱なその他のイオンカウント数に影響を受けず、正確なCIDエネルギー依存曲線を作成することができる。特定のm/zの娘イオンとは、参照親フラグメントイオンから解離する何れの娘イオンでもよいし、その全てでもよい。さらに、参照糖鎖が、ライブラリーであった場合、該ライブラリーの全ての構成要素から得られる参照親フラグメントイオンについて得られる全ての娘イオンであることが網羅的、組織的解析を行なう上で好ましい。
【0050】
さらに、上記CIDエネルギー依存曲線をそれ自体公知の方法で、特徴付ける数値で表すことにより、解裂イオンパラメータを作成することもできる。
【0051】
解裂イオンパラメータとしては、例えば、特定のm/zの娘イオンのイオン強度の最大値を該娘イオンの総イオンカウント数の相対数としてあらわした相対値、前記相対値が50%となるCIDエネルギー値、及びCIDエネルギー依存曲線の変曲点での傾き、から選ばれる少なくとも1つのパラメータを用いることができる。また、CIDエネルギー依存曲線をイオンカウント数の相対数としての基底値(Bottom=0)と最大値(Top=100)、その50%にあたるCIDエネルギー(V50)、およびCIDエネルギー依存曲線の変曲点での傾き(Slope)を指標として前述の式3により計算し、解裂イオンパラメータとすること等が挙げられる。このとき、他の式によるCIDエネルギー依存曲線のカーブフィッティングを行なうこともでき、そのような場合には対応するパラメータを用いることができる。
【0052】
上記した方法により得られる、構造既知の複数の参照糖鎖をCID−MSn測定することにより得られる複数の特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線からなるCIDエネルギー依存曲線ライブラリー、並びに上記CIDエネルギー依存曲線から作成された、構造既知の複数の参照糖鎖の解裂イオンパラメータからなる解裂イオンパラメータライブラリーも本発明に含まれる。
【0053】
さらに、参照糖鎖または参照糖鎖ライブラリーをCID−MSn測定することにより得られるCIDエネルギー依存曲線、解裂イオンパラメータ等の参照データを、コンピュータにより読み取り可能な記憶装置に格納したデータセットも本発明に含まれる。
【0054】
さらに、CIDエネルギー依存曲線、または解裂イオンパラメータは深度を持つ新しい種類のバーコードとして扱うこともでき、分子の構造を記述するために用いることもできる。参照データとともに参照糖鎖名、起源、測定方法や条件等も同時にコード化することができ、サンプル瓶等に貼ることができる。従って、これを読み取るバーコードリーダー等と解析ソフトウェアについても当業者によれば作成することは可能であり本発明の範囲に含まれる。
【0055】
(6)目的糖鎖の構造決定(図1、図4/フローC)
本発明においては、上記(3)で得られた目的糖鎖の特定のm/zの親フラグメントイオンから得られた特定のm/zの娘イオン(以下、これを「目的娘イオン」と称することがある)のCIDエネルギー依存曲線について、目的親フラグメントイオンと同一のm/zを有する参照親フラグメントイオンから得られた、目的娘イオンと同一のm/zの娘イオン(以下、これを「参照娘イオン」と称することがある)のCIDエネルギー依存曲線を選択し、これを比較する。また、これらのCIDエネルギー依存曲線から得られた解裂イオンパラメータを比較してもよい。
【0056】
また、参照糖鎖がライブラリーである場合には、まず、参照データから目的親フラグメントイオンと同一のm/zを有する親イオンのデータを選択し、さらにその中から、比較しようとする目的娘イオンと同一のm/zの娘イオンのCIDエネルギー依存曲線または解裂イオンパラメータを選択してこれを比較する。
【0057】
目的親フラグメントイオンから得られたCIDエネルギー依存曲線または解裂イオンパラメータと、これに対応する参照データが一致した場合、参照データが誘導されたもとの参照親フラグメントイオンの構造と目的親フラグメントイオンの構造が同じであると決定することができる。ここで、それぞれのデータが一致するとは、CIDエネルギー依存曲線の場合、各々の曲線が95%以上の一致度を示すこといい、また、解裂イオンパラメータの場合にはその値の差が±2%以内であることを示す。また、目的親フラグメントイオンに置換基が結合していた場合には、置換基が結合した参照親フラグメントイオンから得られた参照データと比較して、一致した場合には、同一の置換基を有していると判断することができる。このとき、Z検定を判断基準とすることもできる。
【0058】
ここで、1つの特定のm/zを有する娘イオンのCIDエネルギー依存曲線または解裂イオンパラメータが一致しても、さらに他のm/zを有する娘イオンのデータを比較すると異なる場合もあるので、複数の娘イオンのデータを比較することが好ましい。
【0059】
かくして本発明の方法により目的糖鎖の一部が決定された場合、これらの全配列を決定するために、例えば、生合成経路に当てはまるものを参照してつなぎ合わせたり、初めに目的親フラグメントイオンを産生するために分解した場合には、その分解の方法から再構築する等の方法が用いられる。
【0060】
(7)目的糖鎖の構造推定(図1、図4/フローC)
上記(6)で比較したCIDエネルギー依存曲線または解裂イオンパラメータが一致しなかった場合は、解裂イオンパラメータを比較し、目的糖鎖の構造を推定することができる。具体的には、目的娘イオンのCIDエネルギー依存曲線から解裂イオンパラメータを作成し、参照娘イオンのCIDエネルギー依存曲線から作成した解裂イオンパラメータと比較することにより、目的糖鎖の構造を推定すればよい。統計的解析により比較するのが好ましく、また参照糖鎖として、前述の糖鎖ライブラリーを用いるのが好ましい。また、解裂イオンパラメータとして、例えば、CIDエネルギー依存曲線をイオンカウント数の相対数としての基底値(Bottom=0)と最大値(Top=100)、その50%にあたるCIDエネルギー(V50)、およびCIDエネルギー依存曲線の変曲点での傾き(Slope)を指標として前述の式3により計算した値を、挙げることができる。
【0061】
(8)糖鎖の構造異性体の純度検定(図1、図5/フローD)
前述のように、糖鎖の構造異性体毎にCID−MSn測定結果は相違する(図10)。すなわち、同一質量数であっても構造が異なる糖鎖異性体はこれを形成する結合の解裂反応の様子が異なる。この理由は構造異性を形成する化学結合エネルギーに差異が存在し、このため、異なる結合が各々CID条件下で解裂することによるためである。これを利用し、CID−MSn測定で親イオンが消失しない程度に衝突誘起解離を行い、この残存する親イオンをn+1段目で再度衝突誘起解離を行うこと(CID−MSn+1測定)により、糖鎖の構造異性体の純度検定を行うことができる。検体が純品ならばCID−MSnとCID−MSn+1の段数で得られるマススペクトル、あるいは、エネルギー依存曲線は一致する。検体が同一質量数の物質からなる混合物である(構造異性体混合物)ならば、CID−MSnとCID−MSn+1の各段の親イオンの組成比が異なることとなるので、得られる質量分析結果、特に、各シグナル強度、あるいは、エネルギー依存曲線が異なる。上記の純度検定の概略を図5に示す。
【実施例】
【0062】
以下、実施例を挙げて本発明を詳細に説明するが、本発明の範囲はこれらの実施例により限定されるものではない。
実施例1 CID−MSn測定の定量性の確認
(1)CID−MS/MS測定値の定量性
立体異性体や結合位置異性体からなる糖鎖のCID−MS/MS測定を行い、得られたCID−エネルギー依存曲線を比較して上記糖鎖の化学構造を決定するためには、取得したデータの定量性が問題となるためこれを確認した。Fucα(1−3)Galβ−Octyl(WO2005/000861号明細書に記載の方法で合成した)をH2O/メタノール(1:1)溶液に最終濃度10ng/μlとなるように溶解し、これをCID−MSn測定装置(esquire 3000 plus:ブルカーダルトニクス社製)のニードルにシリンジポンプを用いたインフュージョン法(流速を2μl/分)で注入し、熱キャピラリー温度250℃、キャピラリー電圧4.0kV、CIDエネルギーが0.5〜1.5V、ポジティブモードで測定を行った。
【0063】
上記の測定で得られる実際のイオングラフの1例として、m/z=315のフラグメントイオンのイオンクロマトグラム(TIC)を図6Aに示す。図中、階段状のカーブが電圧変化を示し、縦軸が総イオンカウント数、横軸が測定時間である。
【0064】
上記の測定におけるm/z=315およびその親イオンである416について、CIDエネルギー(電圧)と総イオンカウント数の関係を示したグラフ(CIDエネルギー依存曲線)を図6Bに示す。図中丸で示したグラフがm/z=315のもので、四角で示したグラフはm/z=416のもので、いずれも16プロットから電圧変化の直前直後の各々2プロットを除いた平均値をプロットした。
【0065】
図6Bの縦軸は、m/z=315の総イオンカウント数と、m/z=315の総イオンカウント数と親イオン(m/z=416)の総イオンカウント数の和の比である。この値を用いることにより、微弱な他のm/zのイオンカウント数の影響を受けない値で参照データと比較することができる。
【0066】
このグラフの定量性を検証するためにm/z=315のCIDエネルギー依存曲線の立ち上がり点(0.94V)、減衰する親イオン(m/z=416)のCIDエネルギー依存曲線との交点(1.12V)、およびプラトーに達する点(1.38V)の3点におけるイオンカウント数について上記16プロットから上限2プロットを除いた12プロットで、CV値(変動係数)を算出した結果を図6Cに示す。算出式は、標準偏差/平均値×100である。結果、それぞれの電圧における値のCV値(変動係数)がCIDエネルギー依存曲線の立ち上がり点で24.2%、親イオンCIDエネルギー依存曲線との交点で3.5%、およびプラトー到達点で7.3%であり、特に親イオンCIDエネルギー依存曲線との交点以降のデータは信頼性が高く、上記の方法により定量的解析が可能であることを示した。
【0067】
(2)CID−MSn測定により得られるCIDエネルギー依存曲線の同一性
本発明においては、同一のフラグメントイオンについて、CID−MS/MSとMS/MS/MS測定またはそれ以上の各CID−MSn測定で得られたCIDエネルギー依存曲線が同一でないと、参照データとの比較ができないので、これを確認した。
【0068】
マルトヘキサオース(6糖)のピリジルアミノ化物(図7A)をH2O/メタノール(1:1)溶液に最終濃度10ng/μlとなるように溶解し、これをCID−MSn測定装置(esquire 3000 plus:ブルカーダルトニクス社製)のニードルにシリンジポンプを用いたインフュージョン法(流速を2μl/分)で注入し、熱キャピラリー温度250℃、キャピラリー電圧4.0kV、CIDエネルギーが0.9〜1V、ポジティブモードで測定を行った。上記CID−MS/MS測定で得られたm/z=443(2糖)のCIDエネルギー依存曲線を図7A−1に示した。ここで、縦軸は、m/z=443の総イオンカウント数と、m/z=443の総イオンカウント数と親イオン(m/z=1091)の総イオンカウント数の和の比である。
【0069】
次にマルトヘプタオース(7糖)のピリジルアミノ化物(図7B)を上記と同様にCID−MS/MS測定を行い、得られたm/z=1091のフラグメントイオンについて、さらに1.1〜1.9VのCIDエネルギーでCID−MS(この時点ではMS/MS/MS)測定を行って得られたm/z=443(2糖)のCIDエネルギー依存曲線を図7B−1に示した。さらに上記2つのCIDエネルギー依存曲線を重ね合わせたものを図7Cに示した。図から明らかなように、同一のフラグメントイオンのCIDエネルギー依存曲線は、CID−MSn測定の異なる段数で得られたものでも同一でありCID−MSn測定の定量性が確認された。
【0070】
実施例2 CIDエネルギー依存曲線比較による構造決定
(1)天然糖鎖と合成オリゴ糖鎖におけるCIDエネルギー依存曲線の同一性
本発明は、参照糖鎖(ライブラリー)のCIDエネルギー依存曲線と構造未知の天然の糖鎖のCIDエネルギー依存曲線を比較することにより目的糖鎖の構造解析を行う方法である。ここで、構造は同じであるが異なる置換基を有している合成糖鎖と天然糖鎖について、CID−MS/MS測定で同一のm/zを有する親イオンを取得し、これをさらにCID−MS/MS測定した場合、得られた娘イオンのCIDエネルギー依存曲線が同一であることを確認した。
【0071】
Fucα(1−6)Galβ(1−4)Glcβ−Octyl(合成品/図8B)と、Fucα(1−2)Galβ(1−4)Glcを含むH2O−メタノール(1:1)(Dextra Lanoratories,Ltd.製/図8A)について、例1(1)と同様にして、CID−MS/MS測定を行い、得られたm/z=305.08のフラグメントイオン(グルコース環が解裂したもの(A0、2イオン))について、さらにCID−MS/MS測定を行った。この測定のm/z=245の時のCIDエネルギー依存曲線を図8に示す。図中、A−1で示されるグラフが天然の糖鎖から得られたもの、B−1がオクチル基が付いた合成オリゴ糖から得られたものである。また、これらを重ね合わせたものをCで示した。図から明らかなように、合成オリゴ糖と天然糖鎖では、同一のm/zを有するフラグメントイオンでは、その前段数のCID−MS/MS測定の親イオンが異なる置換基を有していても、また、天然糖鎖と合成糖鎖でも同一のCIDエネルギー依存曲線が得られることが確認された。
【0072】
また、上記CIDエネルギー依存曲線をイオンカウント数の相対数としての基底値(Bottom=0)と最大値(Top=100)、その50%にあたるCIDエネルギー(V50)、およびCIDエネルギー依存曲線の変曲点での傾き(Slope)を指標として式1によりパラメータ化(Prism4(GraphPad Software社製)を用いた)し、比較したところ、ほぼ同一の値を示した。従って、上記パラメータの比較によっても、構造未知の天然糖鎖の部分構造を明らかにすることができることが確認された。
【0073】
(2)異なる構造を有する糖鎖から得られる同一のフラグメントイオンにおけるCIDエネルギー依存曲線の同一性
本発明の方法は、目的糖鎖(参照データの親フラグメントイオンとは異なる構造を有する)を参照データの親イオンと同一の構造を有するフラグメントイオンが得られるまでCID−MSn測定を行い、これをさらにCID−MS/MS測定することにより得られたCIDエネルギー依存曲線を参照データと比較することにより糖鎖の構造解析を行う方法である。そこで、異なる構造を有する2種の糖鎖について同一のフラグメントイオンが得られるまでCID−MSn測定を行い、得られたフラグメントイオンをさらにCID−MS/MS測定し、得られた娘イオンのCIDエネルギー依存曲線が同一であることを確認した。
【0074】
PA化LeX5糖(図9A)および還元末端遊離のLeX5糖(B)のナトリウム付加イオンを実施例1と同様にCID−MS/MS測定を行い、LeX−osyl残基(LeX構造を含み、N−アセチルグルコサミン1位の酸素原子を含む)由来のフラグメントイオン(m/z=552.19)が共通に観察された。
【0075】
そこで、このフラグメントイオンについてさらにCID−MS/MS(この時点での段数は3段目となる)測定を行った。得られたプロットからm/z=406(C)および388(D)のフラグメントイオンについてCIDエネルギー依存曲線を作成した結果を図9CおよびDに示す。図中丸で示したグラフは、PA化LeX5糖由来のもの、四角が還元末端遊離のLeX5糖由来のものを示す。図から明らかなように、異なる構造を有する糖鎖から得られたものであっても、同一の構造を有するフラグメントイオンから得られる同一のm/zの娘イオンのCIDエネルギー依存曲線は一致することが確認された。
【0076】
(3)アノマーの識別
同一の構造を有するが立体異性のフラグメントイオンについて、これを本発明の方法で識別することができることを確認した。Fucα/β(1−6)Galα/β(1−6)Glcα/β−Octyl(図10A)の3つのグリコシド結合がそれぞれ異なる8種のアノマーを化学合成し、HPLCで分離精製を行なった後、これらを実施例1と同様にCID−MS/MS測定を行った。このときのFucα(1−6)Galα(1−6)Glcβ−OctylのMS/MSを異なるCIDエネルギー(B:0.82V、C:0.96V)で測定したスペクトルの1例を図10B、Cに示した。図から明らかなように、m/z=623.3の親イオンは、CIDエネルギーが0.82Vではm/z=477.2のフラグメントイオンを生じ、さらに0.96Vでは、該親イオンはm/z=477.2と331.1の2つのフラグメントイオンを生じた。
【0077】
本解析に用いた糖鎖が構造未知であったとすると、上記の結果からは、該糖鎖がデオキシヘキソースとヘキソースを含むことが判るが、上記8種のアノマーのいずれのグリコシド結合を有しているかは判らない。
【0078】
そこで、上記で得られたm/z=477.2のフラグメントイオンについてさらにCID−MS/MS測定を行った(この時点での段数は3段目となる)。条件は、実施例1と同じで、CIDエネルギーは0.5〜1.75Vで行った。m/z=477.23のフラグメントイオンは還元末端の単糖(フコース)を失った2糖の4種のアノマーのものである。
【0079】
得られたプロットからm/z=315のフラグメントイオンについてCIDエネルギー依存曲線を作成した結果を図10Dに示す。図中丸で示したグラフは、グリコシド結合α/αのもの、四角がβ/αのもの、三角がα/βのもの、ひし形がβ/βのものを示す。また、黒で示したグラフは1段目のCIDで遊離したフコースとのグリコシド結合がαであったもの、白で示したグラフがβであったものを示す。
【0080】
図から明らかなように、アノマー間では、CIDエネルギー依存曲線が明らかに異なり、本解析によりアノマーを識別できることが判った。また、親イオンのアノマーの違いは娘イオンのCIDエネルギー依存曲線には影響しないことが判った。
【0081】
さらに、上記のCIDエネルギー依存曲線をイオンカウント数の相対数としての基底値(Bottom=0)と最大値(Top=100)、その50%にあたるCIDエネルギー(V50)、およびCIDエネルギー依存曲線の変曲点での傾き(Slope)を指標として上記式1によりPrism4(GraphPad Software社製)を用いて算出、比較したところ、アノマー間では異なる値となり、また、親イオンのアノマーの違いは娘イオンの値には影響せず、上記計算式によってもアノマーを識別できることが判った。
【0082】
従って、構造未知の糖鎖についてCID−MSn測定を行い、得られるCIDエネルギー依存曲線を参照データと比較し、同一のものがあった場合には、目的糖鎖は、該CIDエネルギー依存曲線を与えた糖鎖と同一の構造であり、アノマーの違いも特定できることがわかった。
【0083】
逆に、構造が同一の糖鎖の参照データと、目的糖鎖をCID−MSn測定して得られたCIDエネルギー依存曲線が一致しなかった場合、参照データのもととなる糖鎖は目的糖鎖のアノマーである可能性がある。
【0084】
(4)CID−MSn測定の異なる段数におけるCIDエネルギー依存曲線の比較
本発明において、目的糖鎖の特定のm/zのフラグメントイオンの娘イオンのCIDエネルギー依存曲線が、参照データと一致した場合、この段数では一致していても、構造が異なることが考えられる。そこで、該CID−MSn測定で得られるその他の娘イオンについても参照データの同一のm/zの娘イオンのCIDエネルギー依存曲線と比較すると、さらに正確な構造解析を行うことができる。この場合の例を以下に示す。
【0085】
非還元末端にO型血液型抗原エピトープ(Fucα(1−2)Gal)を有する天然型糖鎖2種を比較対象として選択した。これらの糖鎖はエピトープ(Fucα(1−2)Gal)を共有するものの、フコースが結合しているガラクトースを含む2糖構造がラクト系列(図11A)とネオラクト系列(図11B)であり、結合位置異性体である。さらに、Aは3糖、Bは5糖であり、親イオンとしての質量数も明らかに異なるが、糖鎖A、BをそれぞれCID−MSn測定を行うことによりグルコサミニル結合部分で解裂したと考えられる共通のm/zを有するフラグメントイオン(m/z=534.18)がナトリウム付加物として得られる(図11A、およびBの線の左側部分)。
【0086】
そこで、さらにこのフラグメントイオンについてCID−MSn測定を行い、これらの娘イオン(m/z=388)のCIDエネルギー依存曲線を作成したところ、これらは一致した(図11C)。しかし、その他の娘イオンについても同様にCIDエネルギー依存曲線を作成したところ、m/z=349の娘イオンでは図11Dとなり、m/z=331の娘イオンでは図11Eとなり、明らかにCIDエネルギー依存曲線は異なることがわかった。このことから、上記2種の糖鎖の構造は異なると判断することができた。
【0087】
実施例3 パラメータ解析による構造異性の判別の可能性の確認
最初にアノマー異性体、および、結合位置異性体の判定をおこなうことの可能性に関して、単一の単糖の特定の結合のみからなるオリゴ糖を用いて検討した。マルトオリゴ糖はグルコースのみがα(1−4)、セロオリゴ糖はβ(1−4)結合それぞれした構造体でありであり、アノマー異性体の比較に適している。また、イソマルトオリゴ糖はα(1−6)の結合から成っており、マルトオリゴ糖との比較において結合位置異性の判別に重要な位置を占める。
【0088】
(1)アノマー異性の判別
実施例1(2)においてマルトオリゴ糖のCID−MS/MSとMS/MS/MS(CID−MSnとCID−MSn+1)測定のCIDエネルギー依存曲線が良い一致を示すことを示した。ここで得られたエネルギー依存曲線をシグモイドカーブフィットし、得られたパラメータ(Top、Slope、V50)について3D散布図を作成、この2D展開図を作成した。同時に結合位置はマルトオリゴ糖と同じでアノマー立体配置のみが異なるセロオリゴ糖に関して同様にプロットした(図12)。この結果、CID−MSn測定の2段目と3段目においてプレカーサーイオンが同一であればパラメータが良い一致を示し、特に、V50が1.40〜1.45Vの範囲に集中することが分かった。一方、セロオリゴ糖においてはV50値が1.5V付近にあり、これは、アノマー立体配置の相違による結合の解裂状況をパラメータで判別できることを示す結果である。
【0089】
(2)結合位置異性の判別
実施例3(1)のマルトースの結果に対しα(1−6)の結合から成っているイソマルトオリゴ糖の衝突エネルギーマップから各パラメータを取得し、マルトースのそれらと共にグラフとした(図13)。この結果、V50値が結合位置異性の指標として使用できることが示された。
【0090】
実施例4 構造推定方法に利用可能な3糖ライブラリーの参照データの同定
(1)3糖ライブラリーの合成およびそのCID−MSn測定
3糖ライブラリーの一部であるフコース(Fuc)、ガラクトース(Gal)、および、グルコース(Glc)で構成される3糖Fucα/β(1−6)Galα/β(1−2/3/4/6)Glcα/β−Octylをアノマー混合物として合成しHPLCを用いて単離した各々の3糖についてCID−MSn測定を行い、得られたライブラリー化合物からの構造情報を用いて構造未定化合物の構造予測をおこなった。情報源となる化合物は本来計32種(23×4)であるが、単離可能であった計23化合物についてライブラリー構造データとしてあつかった。全てのサンプルにおいてCID−MS/MS測定はm/z=623[M+Na]+、CID−MS/MS/MS測定はm/z=477[M−Fuc+Na]+に関しておこなった。
【0091】
(2)CID−MS/MS測定時の3糖ライブラリーのフコース残基解離データ
実施例1に記載の方法でCID−MS/MS測定をそれぞれのサンプルに関して行ってデータを取得した(図14)。その後カーブフィット(ボルツマンのシグモイド式)をおこない、各パラメータ(Top、Slope、V50)を算出した(図15)。3糖ライブラリーの23化合物のうち、Fucα/β(1−6)Galα/β(1−6)Glcβ−Octylの例を図14および15に示す。
【0092】
算出されたパラメータの散布図を作成するとプロットが二分していることが明らかであり、アノマー異性体(Fucα:黒丸、Fucβ:白丸)に着目すると、プロットがCIDプロセス下のフラグメント化においてグリコシド結合の立体(アノマー異性)を反映することが明らかである(図16)。この場合、V50とSlopeの両パラメータがアノマー異性の判別の指標となることが分かる。β体において1点のみSlopeが小さな値を示したが、これはデータのばらつきによるエラーであり統計的にもはずれ値として認識される。
【0093】
(3)CID−MS/MS/MS測定時の3糖ライブラリーのガラクトース残基解離データ
CID−MS/MS/MS測定においてもCID−MS/MS測定時のFucの脱離に関するプロットと同様にGalが脱離したm/z=315に関するデータは、2極化の傾向がある (図17)。この結果はV50のみがアノマー異性体を反映する結果である。
【0094】
実施例5 3糖ライブラリーのCID−MSn散布図を利用したアノマーの識別法
(1)各プロットと各平均との距離によるプロットの範囲
CID−MSn測定により得られるシグモイドカーブのグラフから、α配置およびβ配置(本実施例においてはフコースとガラクトースの場合について説明)はそれぞれある範囲を持ち収束していることがわかる。未知糖鎖のアノマー解析を行う際、この範囲に入っているか否かによりアノマーの推定が可能である。
【0095】
まずバラつきの範囲を認識するために、Fucのα配位、β配位のV50およびSlopeの平均をそれぞれもとめ、各プロットとの距離の値を範囲(R)とした。具体例を示すと、Fucα(1−6)Galα(1−3)Glcβ−Octylでは、
V50−α全体のV50の平均 = 0.00597、
Slope−α全体のSlopeの平均 = 0.000229
である。この値からの距離をもとめ、この距離を半径とする円をFucαの範囲とした(図18)。Fucαに関するライブラリーから得た数値を表1に示す。
【0096】
【表1】

【0097】
(3)構造解析における分子量の影響の補正
実施例2で、糖鎖ライブラリーをなす化合物のCID解析から得られる部分構造体のエネルギー依存曲線と未知物質の部分構造体のエネルギー依存カーブの比較から、カーブが完全一致すれば部分構造を推定できることを示した。これは異なった元の構造から得られた同一のフラグメントをライブラリーデータと参照することで可能としている。この場合トラップされたイオンは同一分子量であるため、部分構造の完全一致が可能となる。しかし質量分析において、親イオンの分子量(分子の大きさ)は結果に影響する重要な因子であり、本研究においても分子量の差異によりカーブおよびパラメータ(V50、Slope等)が異なる結果が得られているため、分子量の影響を考慮した糖鎖構造解析が必要となる。以下、得られた結果の補正法を提供する(図20)。
【0098】
糖鎖ライブラリー(Fucα/β(1−6)Galα/β(1−2/3/4/6)Glcα/β−Octyl) のm/z=477のフラグメントイオンのCIDエネルギー依存曲線と、今回補正サンプルとして用いる未知糖鎖の目的娘イオンと同一のm/zを有するLewis aの参照娘イオンのCIDエネルギー依存曲線からそれぞれ得られるV50およびSlopeを同一グラフにプロットした(図21)。ここからプロットは分子量の差異の影響を大きく受けていることが分かる。次にこの差異からV50、Slopeの補正値を導いた。以下に式を示す。
V50の補正値 = 脱Fucαライブラリー(m/z=477)のV50平均 / Lewis aのV50
Slopeの補正値=脱Fucαライブラリー(m/z=477)のSlope平均 / Lewis a のSlope
【0099】
この算出された各補正値を未知糖鎖の目的娘イオンのCIDエネルギー依存曲線から得られるV50およびSlopeに掛け合わせた。一例を示すと未知糖鎖の補正前プロットは図21に示すように、この未知糖鎖がFucβとは大きく差があるためFucαということが示唆された。この方法のみではデオキシヘキソースが何であるかの特定はできないが、ここで未知糖鎖として使用した糖鎖はヒトから単離された四糖構造であり、ヒトにおいて存在するデオキシヘキソースがフコースであるので未知検体はFucα構造を有すると推測できた。実際に未知糖鎖として用いた糖鎖はLewis XでありFucα構造を持っている。ライブラリーデータを充足することで、より精度の高い構造予測が可能である。
【0100】
(4)機器間のデータ補正
質量分析計を用いた構造解析を行うにあたり問題視されるのは、機器間のデータの差異である。これを上記の方法を用いて補正を行った。まず、共通のサンプルとしてFucα(1−6)Galα(1−6)Glcβ−Octylを補正サンプルとして用いた。比較に用いた機器は同一会社ではあるがブルカーQITMSを用いることで「個体差」の補正をおこなった。エネルギー依存曲線データを比べるとX軸(AmplおよびV50)に差異が見られる(図22)。次に、このサンプルを補正サンプルとしてFucβ(1−6)Galβ(1−6)Glcα−Octylの補正を段落番号0098の補正と同様の方法で行ったところ、差異が少なくなり補正可能であることが示唆された。補正用検体数を増やすことにより補正の精度を改善できる。
【0101】
実施例6 糖鎖の構造異性体の混入検定
(1)検体の調製および質量分析
以下の4種類の検体を調製し、それぞれを実施例1の方法に従い測定した。すなわち、検体の質量分析計への注入はインフュージョン法で、流速120μl/hで行い、用いているイオン源(エレクトロスプレーイオン化法:ESI)は1μl/min〜1ml/minの範囲で使用した。また、on lineあるいはoff line nanoESIを用いることにより、nl/minスケールでの分析が可能であった。検出機として質量分析計はブルカーダルトニクス esquire 3000plus(QIT−MSn)を用いた。分析条件を以下に示す。1)熱キャピラリー温度:205℃、2)キャピラリー電圧:4.0kV、3)Dry Gas:4.0l/min。ポジティブイオンモードで測定。ここで、CID−MSn測定の条件であるIsolation widthは同位体を含まない0.8 msで行った。
【0102】
純品A Galα(1−3)Galα−OMe(7 nmol)
純品B Galα(1−3)Galβ−OMe(7 nmol)
混合物C 純品A:純品B=1:1
混合物D 純品A:純品B=1:9
【0103】
(2)純品Aおよび純品Bの分析結果
純品AのCID−MS/MS測定及びCID−MS/MS/MS測定のAmpl Voltage毎の各フラグメント強度と各々の差を図23に示した。CID−MS/MS測定及びCID−MS/MS/MS測定では結果に差異が見られなかった。純品Bも同様の結果であった(図24)。
【0104】
(3)混合物Cおよび混合物Dの分析結果
混合物Cおよび混合物DのCID−MS/MS測定及びCID−MS/MS/MS測定のAmpl Voltage毎の各フラグメント強度と各々の差を図25および図26にそれぞれ示した。それぞれの混合物に関して、純品に比べ大きな差異が見られた。この差異から混合物/非混合物の判定が可能であった。
【図面の簡単な説明】
【0105】
【図1】図1は、本発明の方法の概略を示した図である。
【図2】図2は、本発明の方法の概略を示した図である。
【図3】図3は、本発明の方法の概略を示した図である。
【図4】図4は、本発明の方法の概略を示した図である。
【図5】図5は、本発明の方法の概略を示した図である。
【図6】図6は、Fucα(1−3)Galβ−OctylをCID−MSn測定した結果を示すグラフである。
【図7】図7は、マルトヘキサオースとマルトヘプタオースの構造、およびそれらをCID−MSn測定した結果、並びにそれらを比較した結果を示すグラフである。
【図8】図8は、Fucβ(1−6)Galβ(1−4)Glcの天然物および合成品の構造、およびそれらをCID−MSn測定した結果、並びにそれらを比較した結果を示すグラフである。
【図9】図9は、PA化LeX5糖と還元末端遊離のLeX5糖の構造、およびそれらをCID−MSn測定した結果、並びにそれらを比較した結果を示すグラフである。
【図10】図10は、Fucα(1−6)Galβ(1−6)Glcβ−Octylのアノマーの構造、およびそれらをCID−MSn測定した結果、並びにそれらを比較した結果を示すグラフである。
【図11】図11は、非還元末端にO型血液型抗原エピトープ(Fucα(1−2)Gal)を有する天然型糖鎖2種の構造、およびそれらをCID−MSn測定した結果、並びにそれらを比較した結果を示すグラフである。
【図12】図12は、マルトヘキサオースとマルトヘプタオースのCIDエネルギー依存曲線から得られた解裂イオンパラメータ(Top、Slope、V50)をそれぞれ2D展開図にプロットした結果を示すグラフである。
【図13】図13は、マルトヘキサオースとイソマルトヘキサオースのCIDエネルギー依存曲線から得られた解裂イオンパラメータ(Top、Slope、V50)をそれぞれ2D展開図にプロットした結果を示すグラフである。
【図14】図14は、3糖ライブラリーを構成するFucα/β(1−6)Galα/β(1−2/3/4/6)Glcα/β−Octylのアノマーのうち、Fucα(1−6)Galα(1−6)Glcβ−OctylをCID−MSn測定した結果を示すグラフである。
【図15】図15は、Fucα(1−6)Galα(1−6)Glcβ−OctylのCIDエネルギー依存曲線をカーブフィットした結果を示すグラフと、そのグラフから得られた解裂イオンパラメータ(Top、Slope、V50)の値である。
【図16】図16は、3糖ライブラリーを構成するFucα/β(1−6)Galα/β(1−2/3/4/6)Glcα/β−Octylの各アノマーのフコース残基を解離させた解裂イオンパラメータ(Top、Slope、V50)を2D展開図にプロットした結果を示すグラフである。各アノマーは結合位置異性で略して表記し、例えば163AABはFucα(1−6)Galα(1−3)Glcβ−Octylを意味する。
【図17】図17は、3糖ライブラリーを構成するFucα/β(1−6)Galα/β(1−2/3/4/6)Glcα/β−Octylの各アノマーのガラクトース残基をさらに解離させた解裂イオンパラメータ(Slope、V50)を2D展開図にプロットした結果を示すグラフである。
【図18】図18は、3糖ライブラリーを構成するアノマーの解裂イオンパラメータの平均値の2D展開図において、未知糖鎖のアノマーの推定が可能な範囲を示すグラフである。
【図19】図19は、3糖ライブラリーを構成するアノマーのフコースを解離させた解裂イオンパラメータ(Slope、V50)のα配置およびβ配置の各平均値ならびにそれらの標準偏差と、Fucβ(1−6)Galα(1−6)Glcα−Octylのフコースを解離させた解裂イオンパラメータを2D展開図にプロットした結果を示すグラフである。
【図20】図20は、参照娘イオンと目的娘イオンの分子量が異なった場合の補正方法の概略を示した図である。
【図21】図21は、参照娘イオンと目的娘イオンの分子量が異なった場合に得られる解裂イオンパラメータ(Slope、V50)の2D展開図における、測定値と補正値の関係を示すグラフである。
【図22】図22は、Fucα(1−6)Galα(1−6)Glcβ−Octylを異なる機種の質量分析計を用いてCID−MSn測定した結果を示すグラフである。
【図23】図23は、2糖の純品A(Galα(1−3)Galα−OMe)を、親イオンと最も強度の高いフラグメントイオンの比が約1:3、1:1、3:1となるAmpl VにてそれぞれCID−MS/MS測定およびCID−MS/MS/MS測定した結果を示すグラフである。
【図24】図24は、2糖の純品B(Galα(1−3)Galβ−OMe)を、親イオンと最も強度の高いフラグメントイオンの比が約1:3、1:1、3:1となるAmpl VにてそれぞれCID−MS/MS測定およびCID−MS/MS/MS測定した結果を示すグラフである。
【図25】図25は、2糖の純品A(Galα(1−3)Galα−OMe)および純品B(Galα(1−3)Galβ−OMe)を1:1の比で混合した混合物Cを、親イオンと最も強度の高いフラグメントイオンの比が約1:3、1:1、3:1となるAmpl VにてそれぞれCID−MS/MS測定およびCID−MS/MS/MS測定した結果を示すグラフである。
【図26】図26は、2糖の純品A(Galα(1−3)Galα−OMe)および純品B(Galα(1−3)Galβ−OMe)を1:9の比で混合した混合物Cを、親イオンと最も強度の高いフラグメントイオンの比が約1:3、1:1、3:1となるAmpl VにてそれぞれCID−MS/MS測定およびCID−MS/MS/MS測定した結果を示すグラフである。
【特許請求の範囲】
【請求項1】
(a)目的糖鎖について特定のm/zのフラグメントイオンが得られるまでCID−MSn測定を行い、(b)該フラグメントイオンについてさらにCID−MS/MS測定を行い、得られた特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線を作成し、(c)該CIDエネルギー依存曲線と、構造既知の参照糖鎖から得られた、上記フラグメントイオンと同一のm/zのフラグメントイオンをCID−MS/MS測定することにより得られた、上記娘イオンと同一のm/zの娘イオンのCIDエネルギー依存曲線とを比較することを特徴とする糖鎖構造解析方法。
【請求項2】
構造既知の複数の参照糖鎖をCID−MSn測定することにより得られる複数の特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線からなるCIDエネルギー依存曲線ライブラリー。
【請求項3】
参照糖鎖が3糖からなることを特徴とする請求項2に記載のライブラリー。
【請求項4】
請求項2に記載のCIDエネルギー依存曲線から作成された、構造既知の複数の参照糖鎖の解裂イオンパラメータからなる解裂イオンパラメータライブラリー。
【請求項5】
構造既知の複数の参照糖鎖の解裂イオンパラメータが、特定のm/zの娘イオンのイオン強度の最大値を該娘イオンの総イオンカウント数の相対数としてあらわした相対値、前記相対値が50%となるCIDエネルギー値、CIDエネルギー依存曲線の変曲点での傾き、から選ばれる少なくとも1つのパラメータであることを特徴とする、請求項4に記載のライブラリー。
【請求項6】
参照糖鎖が3糖からなることを特徴とする請求項4または5に記載のライブラリー。
【請求項7】
(a)目的糖鎖について特定のm/zのフラグメントイオンが得られるまでCID−MSn測定を行い、(b)該フラグメントイオンについてさらにCID−MS/MS測定を行い、得られた特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線を作成し、(c)該CIDエネルギー依存曲線と、請求項2または3に記載のライブラリーに含まれる、上記フラグメントイオンと同一のm/zのフラグメントイオンをCID−MS/MS測定することにより得られた、上記娘イオンと同一のm/zの娘イオンのCIDエネルギー依存曲線とを比較することを特徴とする糖鎖構造解析方法。
【請求項8】
請求項1または7に記載の(c)の工程において、目的糖鎖の特定のm/zの娘イオンのCIDエネルギー依存曲線の解裂イオンパラメータを作成し、該解裂イオンパラメータと、構造既知の参照糖鎖の上記娘イオンと同一のm/zの娘イオンのCIDエネルギー依存曲線の解裂イオンパラメータとを比較することを特徴とする、請求項1または7に記載の方法。
【請求項9】
解裂イオンパラメータが、特定のm/zの娘イオンのイオン強度の最大値を該娘イオンの総イオンカウント数の相対数としてあらわした相対値、前記相対値が50%となるCIDエネルギー値、CIDエネルギー依存曲線の変曲点での傾き、から選ばれる少なくとも1つのパラメータであることを特徴とする、請求項8に記載の方法。
【請求項10】
(a)目的糖鎖について特定のm/zのフラグメントイオンが得られるまでCID−MSn測定を行い、(b)該フラグメントイオンについてさらにCID−MS/MS測定を行い、得られた特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線を作成し、(c)該CIDエネルギー依存曲線の解裂イオンパラメータを作成し、(d)該解裂イオンパラメータと、請求項4〜6のいずれかに記載のライブラリーに含まれる、上記フラグメントイオンと同一のm/zのフラグメントイオンをCID−MS/MS測定することにより得られた、上記娘イオンと同一のm/zの娘イオンのCIDエネルギー依存曲線から作成された解裂イオンパラメータを比較することを特徴とする糖鎖構造解析方法。
【請求項11】
CIDエネルギー依存曲線の特定のm/zの娘イオンの総イオンカウント数が、特定のm/zの娘イオンの総イオンカウント数と、該娘イオンの総イオンカウント数と親イオンの総イオンカウント数の和の比であることを特徴とする請求項1または7〜10のいずれかに記載の方法。
【請求項12】
目的糖鎖に含まれる異なる特定のm/zのフラグメントイオンについて請求項1もしくは7に記載の(a)〜(c)の工程または請求項10に記載の(a)〜(d)の工程を繰り返し、それらの結果を組み合わせることを特徴とする糖鎖構造解析方法。
【請求項13】
少なくともCID−MSn測定装置、請求項2〜6のいずれかに記載のライブラリーをコンピューター読み取り可能なように記録した記録媒体、および目的糖鎖に含まれる異なる特定のフラグメントイオンについて請求項1もしくは7に記載の(b)および(c)の工程または請求項10に記載の(b)〜(d)の工程を行なうためのプログラムを記録した記録媒体を含む糖鎖構造解析システム。
【請求項14】
(a)糖鎖検体について特定のm/zのフラグメントイオンが消失しないような任意の電圧でCID−MSn測定を行い、(b)残存する該フラグメントイオンについてさらにCID−MS/MS測定を行い、(c)前記2工程で得られたマススペクトル、CIDエネルギー依存曲線または該曲線の解裂イオンパラメータを比較することを特徴とする、糖鎖構造異性体の混入検定方法。
【請求項1】
(a)目的糖鎖について特定のm/zのフラグメントイオンが得られるまでCID−MSn測定を行い、(b)該フラグメントイオンについてさらにCID−MS/MS測定を行い、得られた特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線を作成し、(c)該CIDエネルギー依存曲線と、構造既知の参照糖鎖から得られた、上記フラグメントイオンと同一のm/zのフラグメントイオンをCID−MS/MS測定することにより得られた、上記娘イオンと同一のm/zの娘イオンのCIDエネルギー依存曲線とを比較することを特徴とする糖鎖構造解析方法。
【請求項2】
構造既知の複数の参照糖鎖をCID−MSn測定することにより得られる複数の特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線からなるCIDエネルギー依存曲線ライブラリー。
【請求項3】
参照糖鎖が3糖からなることを特徴とする請求項2に記載のライブラリー。
【請求項4】
請求項2に記載のCIDエネルギー依存曲線から作成された、構造既知の複数の参照糖鎖の解裂イオンパラメータからなる解裂イオンパラメータライブラリー。
【請求項5】
構造既知の複数の参照糖鎖の解裂イオンパラメータが、特定のm/zの娘イオンのイオン強度の最大値を該娘イオンの総イオンカウント数の相対数としてあらわした相対値、前記相対値が50%となるCIDエネルギー値、CIDエネルギー依存曲線の変曲点での傾き、から選ばれる少なくとも1つのパラメータであることを特徴とする、請求項4に記載のライブラリー。
【請求項6】
参照糖鎖が3糖からなることを特徴とする請求項4または5に記載のライブラリー。
【請求項7】
(a)目的糖鎖について特定のm/zのフラグメントイオンが得られるまでCID−MSn測定を行い、(b)該フラグメントイオンについてさらにCID−MS/MS測定を行い、得られた特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線を作成し、(c)該CIDエネルギー依存曲線と、請求項2または3に記載のライブラリーに含まれる、上記フラグメントイオンと同一のm/zのフラグメントイオンをCID−MS/MS測定することにより得られた、上記娘イオンと同一のm/zの娘イオンのCIDエネルギー依存曲線とを比較することを特徴とする糖鎖構造解析方法。
【請求項8】
請求項1または7に記載の(c)の工程において、目的糖鎖の特定のm/zの娘イオンのCIDエネルギー依存曲線の解裂イオンパラメータを作成し、該解裂イオンパラメータと、構造既知の参照糖鎖の上記娘イオンと同一のm/zの娘イオンのCIDエネルギー依存曲線の解裂イオンパラメータとを比較することを特徴とする、請求項1または7に記載の方法。
【請求項9】
解裂イオンパラメータが、特定のm/zの娘イオンのイオン強度の最大値を該娘イオンの総イオンカウント数の相対数としてあらわした相対値、前記相対値が50%となるCIDエネルギー値、CIDエネルギー依存曲線の変曲点での傾き、から選ばれる少なくとも1つのパラメータであることを特徴とする、請求項8に記載の方法。
【請求項10】
(a)目的糖鎖について特定のm/zのフラグメントイオンが得られるまでCID−MSn測定を行い、(b)該フラグメントイオンについてさらにCID−MS/MS測定を行い、得られた特定のm/zの娘イオンの総イオンカウント数とCIDエネルギーとの関係を示すCIDエネルギー依存曲線を作成し、(c)該CIDエネルギー依存曲線の解裂イオンパラメータを作成し、(d)該解裂イオンパラメータと、請求項4〜6のいずれかに記載のライブラリーに含まれる、上記フラグメントイオンと同一のm/zのフラグメントイオンをCID−MS/MS測定することにより得られた、上記娘イオンと同一のm/zの娘イオンのCIDエネルギー依存曲線から作成された解裂イオンパラメータを比較することを特徴とする糖鎖構造解析方法。
【請求項11】
CIDエネルギー依存曲線の特定のm/zの娘イオンの総イオンカウント数が、特定のm/zの娘イオンの総イオンカウント数と、該娘イオンの総イオンカウント数と親イオンの総イオンカウント数の和の比であることを特徴とする請求項1または7〜10のいずれかに記載の方法。
【請求項12】
目的糖鎖に含まれる異なる特定のm/zのフラグメントイオンについて請求項1もしくは7に記載の(a)〜(c)の工程または請求項10に記載の(a)〜(d)の工程を繰り返し、それらの結果を組み合わせることを特徴とする糖鎖構造解析方法。
【請求項13】
少なくともCID−MSn測定装置、請求項2〜6のいずれかに記載のライブラリーをコンピューター読み取り可能なように記録した記録媒体、および目的糖鎖に含まれる異なる特定のフラグメントイオンについて請求項1もしくは7に記載の(b)および(c)の工程または請求項10に記載の(b)〜(d)の工程を行なうためのプログラムを記録した記録媒体を含む糖鎖構造解析システム。
【請求項14】
(a)糖鎖検体について特定のm/zのフラグメントイオンが消失しないような任意の電圧でCID−MSn測定を行い、(b)残存する該フラグメントイオンについてさらにCID−MS/MS測定を行い、(c)前記2工程で得られたマススペクトル、CIDエネルギー依存曲線または該曲線の解裂イオンパラメータを比較することを特徴とする、糖鎖構造異性体の混入検定方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【公開番号】特開2006−145519(P2006−145519A)
【公開日】平成18年6月8日(2006.6.8)
【国際特許分類】
【出願番号】特願2005−301337(P2005−301337)
【出願日】平成17年10月17日(2005.10.17)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成16年10月1日 オックスフォード・ジャーナル、オックスフォード大学出版局がインターネットアドレス(http://glycob.oupjournals.org/cgi/reprint/14/11/1011)にて発表
【国等の委託研究の成果に係る記載事項】(出願人による申告)国等の委託研究の成果に係る特許出願(平成15年度新エネルギー・産業技術総合開発機構「基盤技術研究促進事業(民間基盤技術研究支援制度)/糖鎖の極微量構造解析技術開発研究」、平成16年度及び平成17年度独立行政法人新エネルギー・産業技術総合開発機構「基盤技術研究促進事業(民間基盤技術研究支援制度)/糖鎖の極微量構造解析技術開発研究」、産業活力再生特別措置法第30条の適用を受ける特許出願)
【出願人】(000005968)三菱化学株式会社 (4,356)
【Fターム(参考)】
【公開日】平成18年6月8日(2006.6.8)
【国際特許分類】
【出願日】平成17年10月17日(2005.10.17)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成16年10月1日 オックスフォード・ジャーナル、オックスフォード大学出版局がインターネットアドレス(http://glycob.oupjournals.org/cgi/reprint/14/11/1011)にて発表
【国等の委託研究の成果に係る記載事項】(出願人による申告)国等の委託研究の成果に係る特許出願(平成15年度新エネルギー・産業技術総合開発機構「基盤技術研究促進事業(民間基盤技術研究支援制度)/糖鎖の極微量構造解析技術開発研究」、平成16年度及び平成17年度独立行政法人新エネルギー・産業技術総合開発機構「基盤技術研究促進事業(民間基盤技術研究支援制度)/糖鎖の極微量構造解析技術開発研究」、産業活力再生特別措置法第30条の適用を受ける特許出願)
【出願人】(000005968)三菱化学株式会社 (4,356)
【Fターム(参考)】
[ Back to top ]

