糖鎖試料の製造方法
【課題】 本発明の目的は、複合糖質から、N−結合型糖鎖、およびO−結合型糖鎖を遊離し、それぞれを精製し製造する手段を提供する。
【解決手段】 複合糖質よりO−結合型糖鎖およびN−結合型糖鎖のいずれか一方の糖鎖を遊離する第1遊離工程と、前記第1遊離工程で遊離した糖鎖を回収する第1回収工程と、 前記第1遊離工程が行われた複合糖質より、他方の糖鎖を遊離する第2遊離工程と、 前記第2遊離工程で遊離した糖鎖を回収する第2回収工程とを有すること製造方法により、O−結合型糖鎖およびN−結合型糖鎖を別々に精製することが可能となった。
【解決手段】 複合糖質よりO−結合型糖鎖およびN−結合型糖鎖のいずれか一方の糖鎖を遊離する第1遊離工程と、前記第1遊離工程で遊離した糖鎖を回収する第1回収工程と、 前記第1遊離工程が行われた複合糖質より、他方の糖鎖を遊離する第2遊離工程と、 前記第2遊離工程で遊離した糖鎖を回収する第2回収工程とを有すること製造方法により、O−結合型糖鎖およびN−結合型糖鎖を別々に精製することが可能となった。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、複合糖質からO−結合型糖鎖、およびN−結合型糖鎖を別々に精製・回収する方法に関する。
【背景技術】
【0002】
生化学分野において、近年、核酸、タンパク質に続く第三の鎖として糖鎖分子が注目されている。特に細胞の分化や癌化、免疫反応や受精などのかかわりが研究され、新たな医薬や医療材料を創製しようとする試みが続けられている。糖鎖は多くの毒素、ウィルス及びバクテリアなどの病原性外来因子受容体であり、また、癌のマーカーとしても注目されており、どちらの分野においても、同様に新たな医薬や医療材料を創製しようとする試みが続けられている。生体内において糖タンパク質、糖ペプチドは、細胞膜表面に存在して細胞膜受容体として働いたり、血清などの体液中に分泌されたり、また細胞外マトリックスの構成物として存在している。近年、こうした糖鎖が、生体活動に重要な役割を果たしていることが明らかにされて来ている。
【0003】
糖タンパク質の糖鎖には、セリンやスレオニンのヒドロキシ基にα結合しているO−グリコシド結合糖鎖(O−結合型糖鎖)と、アスパラギンのアミノ基にβ結合しているN−グリコシド結合糖鎖がある(N−結合型糖鎖)。
【0004】
N−結合型糖鎖は生物の受精、発生、免疫、細胞内輸送、老化、癌などに関与していることが報告され、これまで多くの研究者により機能解明されてきた(例えば非特許文献1)。また、その多様性も共通の生合成経路の後に付与されるため、比較的少ない。
【0005】
糖タンパク質、糖ペプチドの解析方法は、種々の方法が開発されている(例えば、特許文献1、特許文献2)。しかしながら多くの場合、N−グリコシド結合糖鎖の分子の解析方法がほとんどである。
【0006】
一方、O−結合型糖鎖は様々なタンパク質−糖結合様式で構築されその大きさも多様である。O−結合型糖鎖の異常は先天性筋ジストロフィーなど様々な疾患や生体機能に影響をもたらす事が報告されているが、生合成メカニズムや代謝、機能については未だ多くが解明されていない。
【0007】
その原因の一つとして、O−結合型糖鎖を糖タンパク質コアから効率よく切り出す方法が確立されていないことが挙げられる。N−結合型糖鎖はN−グリコシダーゼで網羅的かつ高効率に切り出すことが可能である。一方、O−結合型糖鎖を切り出す酵素も存在するが、末端のシアル酸を分解する必要があるなど制限がある。そのためO−結合型糖鎖の切り出しはヒドラジン分解、またはアルカリ分解により成される事が多い。さらに、ヒドラジン分解で遊離された糖鎖試料には夾雑物が含まれており、糖鎖を分析するためには精製作業が必要であるが、これらの操作は非常に煩雑である。また、N−結合型糖鎖の一部も同時に切り出されるため、血清や体液、組織などの混合試料中からN−型糖鎖と大きさが多様なO−結合型糖鎖を分離するのは非常に困難であった。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2006−098367号公報
【特許文献2】特開2008−309501号公報
【非特許文献】
【0009】
【非特許文献1】糖鎖生物学入門、Muaureen E.、et.al.、西村紳一郎ら編、2005年、化学同人
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明の目的は、複合糖質よりN−結合型糖鎖およびO−結合型糖鎖をそれぞれ分離する糖鎖試料の製造方法を提供することにある。
【課題を解決するための手段】
【0011】
このような目的は、下記(1)〜(17)に記載の本発明により達成される。
(1)複合糖質よりO−結合型糖鎖およびN−結合型糖鎖をそれぞれ遊離して糖鎖試料を製造する製造方法であって、 複合糖質よりO−結合型糖鎖およびN−結合型糖鎖のいずれか一方の糖鎖を遊離する第1遊離工程と、前記第1遊離工程で遊離した糖鎖を回収する第1回収工程と、前記第1遊離工程が行われた複合糖質より、他方の糖鎖を遊離する第2遊離工程と、前記第2遊離工程で遊離した糖鎖を回収する第2回収工程と
を有することを特徴とする糖鎖試料の製造方法。
(2)前記第1回収工程および第2回収工程の少なくとも一方は、遊離したO−結合型糖鎖または遊離したN−結合型糖鎖と、結合可能な官能基を有する捕捉担体とを反応させるものである(1)記載の糖鎖試料の製造方法。
(3)糖鎖と結合可能な官能基がヒドラジド基あるいはアミノオキシ基である(1)または(2)記載の糖鎖試料の製造方法。
(4)前記第1遊離工程では、複合糖質よりN−結合型糖鎖を遊離するものである(1)ないし(3)いずれか1項に記載の糖鎖試料の製造方法。
(5)前記第1遊離工程では、複合糖質をN−結合型糖鎖のみを遊離させることの可能な酵素で処理するものである(1)ないし(4)いずれか1項に糖鎖試料の製造方法
(6)前記酵素がエンド型グリコシダーゼであること(5)記載の糖鎖試料の製造方法。
(7)前記エンド型グリコシダーゼが、ペプチド:N−グリカナーゼ、エンド−β−N−アセチルグルコサミニダーゼ、エンド−β−マンノシダーゼ、から選ばれる少なくとも1つである(6)記載の糖鎖試料の製造方法。
(8)前記第2遊離工程は、前記第1遊離工程後の前記複合糖質の残渣を、さらにO−結合型糖鎖を遊離させることが可能な化学処理、またはO−結合型糖鎖を遊離させることが可能な酵素処理するものである(5)ないし(7)いずれか1項に記載の糖鎖試料の製造方法。
(9)O−結合型糖鎖を遊離できる化学処理が、ヒドラジン分解またはアルカリ分解であることを特徴とする(8)記載の糖鎖試料の製造方法。
(10)O−結合型糖鎖を遊離できる酵素が、O−グリコシダーゼであることを特徴とする(8)記載の糖鎖試料の製造方法。
(11)前記第1遊離工程では、複合糖質よりO−結合型糖鎖を遊離するものである(1)ないし(3)いずれか1項に記載の糖鎖試料の製造方法。
(12)前記第1遊離工程では、複合糖質をO−結合型糖鎖のみを遊離させることの可能な酵素で処理するものである(11)記載の糖鎖試料の製造方法。
(13)O−結合型糖鎖を遊離できる酵素が、O−グリコシダーゼであることを特徴とする(12)記載の糖鎖試料の製造方法。
(14)前記第2遊離工程は、前記遊離工程後の前記複合糖質の残渣を、さらにN−結合型糖鎖を遊離させることが可能な化学処理、または−結合型糖鎖を遊離させることが可能な酵素処理するものである(11)ないし(13)いずれか1項記載の糖鎖試料の製造方法。
(15)N−結合型糖鎖を遊離できる化学処理が、ヒドラジン分解またはアルカリ分解であることを特徴とする(14)記載の糖鎖試料の製造方法。
(16)前記酵素がエンド型グリコシダーゼであること(14)記載の糖鎖試料の製造方法。
(17)前記エンド型グリコシダーゼが、ペプチド:N−グルカナーゼ、エンド−β−N−汗散るグルコサミニダーゼ、エンド−β−マンノシダーゼ、から選ばれる少なくとも1つである(16)記載の糖鎖試料の製造方法。
【発明の効果】
【0012】
本発明によれば、N−結合型糖鎖およびO−結合型糖鎖をそれぞれ分離する糖鎖試料の製造方法を提供することができる。
【図面の簡単な説明】
【0013】
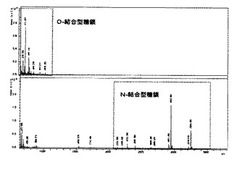
【図1】MALDI−TOF−MSチャート(上段)O−結合型糖鎖試料から得られた結果(下段)N−結合型糖鎖試料から得られた結果
【発明を実施するための形態】
【0014】
以下、本発明の実施形態について説明する。
なお、本願において遊離とは複合糖質から糖鎖のみを分けることを示し、分離とは、遊離した糖鎖中のN−結合型糖鎖とO−結合型糖鎖を分けることを示す。
N−結合型糖鎖とO−結合型糖鎖を分離して回収する方法としては、以下の二つの工程からなる。
【0015】
(1)複合糖質を含む試料からN−結合型糖鎖のみを遊離し、糖と特異的に結合する官能基を有する捕捉担体を用いて捕捉し試料中からN−結合型糖鎖を精製する。
(2)N−結合型糖鎖が除去された検体からO−結合型糖鎖を遊離し、糖と特異的に結合する官能基を有する捕捉担体を用いて精製する。
【0016】
前記方法は、N−結合型糖鎖を分離して、O−結合型糖鎖を回収する方法であるが、先に、O−結合型糖鎖のみを遊離して、O−結合型糖鎖が除去された検体からN−結合型糖鎖を遊離して精製する順序で、N−結合型糖鎖とO−結合型糖鎖を分離して回収することも可能である。
【0017】
(複合糖質)
本発明において使用する試料は複合糖質を含む試料であり、例えば、全血、血清、血漿、尿、唾液、細胞、組織、糖タンパク質、糖ペプチドの生体試料である。また、植物由来の試料も同様に用いることも可能である。
【0018】
酵素により糖鎖を遊離させる場合は、試料は水あるいは緩衝液に溶解されていることが好ましい。試料溶液は酵素処理するためにpH5以上9以下であることが好ましい。また、極端に酸性あるいは塩基性であると、試料に含まれる糖鎖が分解する恐れもあり、好ましくない。
【0019】
以下の説明は、N−結合型糖鎖の遊離→O−結合型糖鎖の遊離の順で製造する方法を例示する。
【0020】
(第1遊離工程、N−結合型糖鎖の遊離→O−結合型糖鎖の遊離)
一般的に、複合糖質に結合しているN−結合型糖鎖は、無水ヒドラジン処理、アルカリ処理、酵素処理により複合糖質から遊離させるが、本発明においてはN−結合型糖鎖のみを遊離させるエンド型グリコシダーゼを用いて遊離させることで、O−結合型糖鎖に影響を与えず、N−結合型糖鎖のみを遊離するのが望ましい。
【0021】
エンド型グリコシダーゼには、例えばペプチド:N−グリカナーゼ、エンド−β−N−アセチルグルコサミニダーゼ、エンド−β−マンノシダーゼ、が挙げられる。これらの中の1つ以上の酵素を利用してN−結合型糖鎖を遊離する。
具体的には、前記酵素群の中の1つ以上の酵素を、水溶液中で、0.1mU〜50mU/0.1mL、pH7.0〜8.0で、37℃で1〜17時間反応させる。ただし、ここでいう1Uとは適切な条件下で毎分1μmolの糖鎖を基質から遊離することができる酵素量の事である。
N−結合型糖鎖は、この処理において選択的にすべて遊離される。
【0022】
(第1回収工程、N−結合型糖鎖の遊離→O−結合型糖鎖の遊離)
前記の捕捉担体に前ステップにおいてN−結合型糖鎖を遊離した複合糖質を含む試料溶液を添加して所定の条件でN−結合型糖鎖を捕捉担体に結合させる。反応系のpHは、好ましくは2〜9、より好ましくは2〜7であり、さらに好ましくは2〜6である。pH調整のためには、各種緩衝液を用いることができる。糖鎖捕捉時の温度は,好ましくは4〜90℃,より好ましくは4〜85℃、さらに好ましくは30〜80℃であり,最も好ましくは40〜80℃である。反応時間は5分〜24時間が好ましく、10分〜5時間がより好ましい。反応時は反応容器を静置してもよく、振とうしてもよい。反応終了後、反応容器に水あるいは緩衝液を加え遠心分離あるいはフィルター操作により捕捉担体と溶液を分離する。
【0023】
この操作により、N−結合型糖鎖のみが捕捉担体に固定された状態で回収することが可能となる。
分離した溶液残渣中には、複合糖質が残っており、この複合糖質はO−型糖鎖が結合している。
前記のように捕捉担体に固定化された状態で回収されたN−結合型糖鎖を、担体から切り出す操作について以下に説明する。
【0024】
遊離操作の基本は、捕捉担体ごと回収しN−結合型鎖を酸性溶媒中、加熱反応を行うことでN−結合型糖鎖を捕捉担体から切り出すことができる。
具体的な方法を以下に示す。
【0025】
反応を行う溶媒は、酸と水が反応に必要であることから、酸と水と有機溶媒の混合溶媒が好ましい。酸と水と有機溶媒の混合溶媒の場合、水の含有率は好ましくは0.1%〜90%、より好ましくは0.1%〜80%、さらに好ましくは0.1%〜50%である。水の代わりに水性緩衝液を含有しても良い。混合前の緩衝液の濃度は好ましくは0.1mM〜1M、より好ましくは0.1mM〜500mM、さらに好ましくは1mM〜100mMである。反応溶液のpHは好ましくは2〜9、より好ましくは2〜7であり、さらに好ましくは2〜6である。使用する酸は例えば、酢酸、ギ酸、トリフルオロ酢酸、塩酸、クエン酸、リン酸、硫酸が好ましく、より好ましくは酢酸、ギ酸、トリフルオロ酢酸、リン酸、さらに好ましくは酢酸、トリフルオロ酢酸である。
【0026】
反応温度に関しては4〜90℃が好ましく、好ましくは25〜90℃で、さらに好ましくは50〜90℃である。反応時間は、5分間〜24時間、好ましくは10分間〜8時間、より好ましくは15分間〜120分間である。反応は、開放系で行って溶媒を完全に蒸発させることが好ましい。これは、溶媒が蒸発するにつれで溶液濃度が無限濃縮されることにより十分な反応をおこさせることが目的である。
【0027】
pH2の酸性から中性付近で、N−結合型糖鎖切り出し反応を行うことができるため、従来の強酸性処理、たとえば10%トリフルオロ酢酸処理による切出しのような強酸の存在下での切出し反応に比べて、シアル酸残基の脱離など糖鎖の加水分解などを引き起こすことを抑制することができるようになる。
【0028】
(第2遊離工程、N−結合型糖鎖の遊離→O−結合型糖鎖の遊離)
前記のN−結合型糖鎖の精製において溶液中に回収した残渣からO−結合型糖鎖を遊離させる。すでにN−結合型糖鎖の回収は終了しているので、残っている結合糖鎖はすべてO−結合型糖鎖と考えてよい。したがって遊離方法としては、ヒドラジン分解、またはアルカリ分解を使うことが可能である。また、O−グリカナーゼを用いてO−結合型糖鎖を遊離しても良い。
具体的な方法としては、以下の通りである。
【0029】
まず、ヒドラジン分解は、気相法と液相法の二種類がある。まず液相法は、試料をバイアル瓶など入れて凍結乾燥させ、無水ヒドラジンを加えオーブンで100℃、8〜10時間加熱する。反応終了後、トルエンを数滴加え、デシケーターに試料バイアルを入れ、冷却トラップを付けた真空ポンプで数時間以上減圧しヒドラジンを共沸留去する。この際に、前記共沸除去操作を数回繰り返し、ヒドラジンを完全に留去する。
【0030】
次に気相法は、糖鎖分析用機器として市販されているヒドラクラブ(J−OIL MILLS)を用いて行う。ヒドラクラブ付属の反応容器をヒドラクラブ内で120度、約12時間乾燥させる。試料は付属の反応用試験管にいれ乾固しておく(0〜10mg)。 十分乾燥された反応容器内に試料の入った試験管を入れてヒドラクラブにセットする。 ヒドラジン分解試薬のヒドラジンバイアルを反応容器内に注入させる。N−グリコシド糖鎖を切り出す場合は、100℃、2時間、N−グリコシド糖鎖およびO−グリコシド糖鎖を同時に切り出す場合は、65℃、6時間加熱する。
反応中にヒドラジン冷却トラップ(アセトン-ドライアイス)を準備し、反応終了後、真空ポンプを使って反応容器内のヒドラジンを除去する。 反応容器から反応用試験管を取り出しN-アセチル化処理を行う、もしくは、試験管ごと−20℃で保存する。
【0031】
次に、O−グリカナーゼを用いてO−結合型糖鎖を遊離する方法について述べる。
O−グリカナーゼとして機能する酵素に関して、特に限定するものではないが、O−グリコシダーゼが好適に用いられる。
O−グリコシダーゼは、水溶液中で、0.1〜50mU/0.1mL、pH6.0〜8.0で、37℃で1時間〜1晩反応させる。ただし、ここでいう1Uとは適切な条件下で毎分1μmolの糖鎖を基質から遊離することができる酵素量の事である。
【0032】
前記の捕捉担体に前ステップにおいて調製した、O−結合型糖鎖を遊離した溶液を添加して所定の反応温度でO−結合型糖鎖と捕捉担体とを結合反応させる。反応系のpHは、好ましくは2〜9、より好ましくは2〜7であり、さらに好ましくは2〜6である。pH調整のためには、各種緩衝液を用いることができる。糖鎖捕捉時の温度は,好ましくは4〜90℃,より好ましくは4〜85℃、さらに好ましくは30〜80℃であり,最も好ましくは40〜80℃である。反応時間は5分〜24時間が好ましく、10分〜5時間がより好ましい。反応時は反応容器を静置してもよく、振とうしてもよい。反応終了後、反応容器に水あるいは緩衝液を加え遠心分離あるいはフィルター操作により捕捉担体と溶液を分離して、溶液を分離する。
この操作により、O−結合型糖鎖のみが捕捉担体に固定された状態で回収することが可能となる。
【0033】
(第2回収工程、N−結合型糖鎖の遊離→O−結合型糖鎖の遊離)
前記のように捕捉担体に固定化された状態で回収されたO−結合型糖鎖を、捕捉担体から切り出す操作について以下に説明する。
【0034】
基本的な方法は、N−結合型糖鎖を捕捉担体から切り出す方法と同じである。
具体的な方法を以下に示す。
【0035】
反応を行う溶媒は、酸と水が反応に必要であることから、酸と水と有機溶媒の混合溶媒が好ましい。酸と水と有機溶媒の混合溶媒の場合、水の含有率は好ましくは0.1%〜90%、より好ましくは0.1%〜80%、さらに好ましくは0.1%〜50%である。水の代わりに水性緩衝液を含有しても良い。混合前の緩衝液の濃度は好ましくは0.1mM〜1M、より好ましくは0.1mM〜500mM、さらに好ましくは1mM〜100mMである。反応溶液のpHは好ましくは2〜9、より好ましくは2〜7であり、さらに好ましくは2〜6である。使用する酸は例えば、酢酸、ギ酸、トリフルオロ酢酸、塩酸、クエン酸、リン酸、硫酸が好ましく、より好ましくは酢酸、ギ酸、トリフルオロ酢酸、リン酸、さらに好ましくは酢酸、トリフルオロ酢酸である。
【0036】
反応温度に関しては4〜90℃が好ましく、好ましくは25〜90℃で、さらに好ましくは50〜90℃である。反応時間は、5分間〜24時間、好ましくは10分間〜8時間、より好ましくは15分間〜120分間である。反応は、開放系で行って溶媒を完全に蒸発させることが好ましい。これは、溶媒が蒸発するにつれで溶液濃度が無限濃縮されることにより十分な反応をおこさせることが目的である。
【0037】
pH2の酸性から中性付近で、O−結合型糖鎖切り出し反応を行うことができるため、従来の強酸性処理、たとえば10%トリフルオロ酢酸処理による切出しのような強酸の存在下での切出し反応に比べて、シアル酸残基の脱離など糖鎖の加水分解などを引き起こすことを抑制することができるようになる。
【0038】
次に、O−結合型糖鎖の遊離→N−結合型糖鎖の遊離の順で製造する方法を例示する。
【0039】
(第1遊離工程、O−結合型糖鎖の遊離→N−結合型糖鎖の遊離)
まず複合糖質に結合しているO−結合型糖鎖は、無水ヒドラジン処理、アルカリ処理、酵素処理により複合糖質から遊離させるが、本発明においてはO−結合型糖鎖のみを遊離させるO−グリカナーゼを用いて遊離させることで、N−結合型糖鎖に影響を与えず、O−結合型糖鎖のみを遊離するのが望ましい。O−グリカナーゼの使用法は前述の通りである。
【0040】
(第1回収工程、O−結合型糖鎖の遊離→N−結合型糖鎖の遊離)
O−結合型糖鎖の遊離→N−結合型糖鎖の遊離の順で製造する方法における第1回収工程は、前述のN−結合型糖鎖→O−結合型糖鎖の遊離の順で製造する方法と同じで、回収される糖鎖がO−結合型糖鎖になり、分離した溶液残渣中に残る複合糖質にはN−型糖鎖が結合している。
回収工程の詳細は、前述の通りに行うことができる。
【0041】
(第2遊離工程、O−結合型糖鎖の遊離→N−結合型糖鎖の遊離)
前記のO−結合型糖鎖の精製において溶液中に回収した残渣からN−結合型糖鎖を遊離させる。すでにO−結合型糖鎖の回収は終了しているが、残っている結合糖鎖中には、一部O−結合型糖鎖が残っている場合がある。したがって遊離方法としては、ヒドラジン分解、またはアルカリ分解を使うことも可能であるが、好ましくは、N−グリカナーゼを用いてN−結合型糖鎖を遊離する方法である。
具体的な方法としては、前述の方法を用いて行うことができる。
【0042】
(第2回収工程、O−結合型糖鎖の遊離→N−結合型糖鎖の遊離)
前記の第2回収工程に準じて、回収ことにより、N−結合型糖鎖のみを回収することができる。
【0043】
(糖鎖標識)
以上のようにして分離、精製された糖鎖試料(N−結合型糖鎖試料およびO−結合型糖鎖試料)は、そのまま、あるいは蛍光物質による標識を経て後、質量分析やHPLCなどの分析手段によって分析することができる。
【0044】
糖鎖標識方法の1例を以下に述べる。
回収した糖鎖試料を、溶液中でアミノ基を含む還元アミノ化反応により標識化合部と結合させる。
【0045】
前記のアミノ基を含む化合物は、具体的には蛍光物質またはUV吸収基を有する化合物が、下記のアミノ基を含む物質からなる群から選ぶことが、好ましい。
8-Aminopyrene-1,3,6-trisulfonate, 8-Aminonaphthalene-1,3,6-trisulphonate, 7-Amino-1,3-naphtalenedisulfonic acid, 2-Amino9(10H)-acridone,5-Aminofluorescein,Dansylethylenediamie, 2-Aminopyridine, 7-Amino-4-methylcoumarine, 2-Aminobenzamide, 2-Aminobenzoic acid, 3-Aminobenzoic acid, 7-Amino-1-naphthol, 3-(Acethylamino)-6-aminoacridine, 2-Amino-6-cyanoethylpyridine,Ethyl p-aminobenzoate, p-Aminobenzonitrile, 及び7-aminonaphothalene-1,3-disulfonic acid
【0046】
(還元アミノ化反応による標識方法)
具体的には、2-Aminobenzamideによる標識の場合、捕捉担体から酸性糖鎖を遊離後、反応容器に0.35 M 2-Aminobenzamid, 1 M sodium cyanoborohydride, 30% 酢酸水溶液を加え、60℃で数時間反応する事で達成される。
【0047】
また、糖鎖試料は捕捉担体から切り出すと同時に標識する方法がある。
この方法は、ヒドラジド基、またはアミノオキシ基を有する標識化合物を作用させて、ヒドラゾン−ヒドラゾンあるいはヒドラゾン−オキシム交換反応により酸性糖鎖を捕捉担体から切り離しすると同時に前記標識化合物に結合させることで可能である。
【0048】
この方法も前記の還元アミノ化反応による標識方法と同じく同じ反応容器内で連続的に行うことができるため、糖鎖の回収、精製から検出までの自動化が可能となる。
【0049】
ヒドラジド基を含む標識化合物の作製方法としては、上記糖鎖を遊離する工程において、ヒドラジド基を含有しており、蛍光物質またはUV吸収基を有する化合物を接触させ糖鎖を遊離させると同時に蛍光物質またはUV吸収物質で糖鎖を標識する方法がある。反応の溶媒、反応温度、時間の詳細は前記の通りであるが、アルデヒド基を含む化合物、例えば糖鎖に対して10等量以上の化合物を添加することで達成できる。
【0050】
前記ヒドラジド基を含む物質、具体的には蛍光物質またはUV吸収基を有する化合物が、下記のヒドラジド基を含む物質である群から選ぶことができる。
5-Dimethylaminonaphthalene-1-sulfonyl hydrazine (Dansylhydrazine); 2-hydrazinopyridine;9-fluorenylmethyl carbazate (Fmoc hydrazine);benzylhydrazine;4,4-difluoro-5,7-dimethyl-4-bora-3a,4a-diaza-s-indacene-3-propionoc acid, hydrazide;2-(6,8-difluoro-7-hydroxy-4-methylcoumarin)acetohydrazide;7-diethylaminocoumarin-3-carboxylic acid, hydrazide (DCCH);phenylhydrazine;1-Naphthaleneacethydrazide;2-hydrazinobenzoic acid;biotin hydrazide;phenylacetic hydrazide.
【0051】
アミノオキシ基を含む標識化合物としては、アミノオキシ基含有の蛍光物質またはUV吸収基を有する化合物を接触させ糖鎖を遊離させると同時に蛍光物質またはUV吸収基を有する化合物で糖鎖を標識する方法である。反応の溶媒、反応温度、時間の詳細は前記の通りであるが、アミノ基を含む化合物、例えば糖鎖に対して10等量以上の化合物を添加することで達成できる。
【0052】
上記アミノオキシ化合物が下記の化合物から選ばれる事が望ましい。
O-benzylhydroxylamine;O-phenylhydroxylamine; O-(2,3,4,5,6-pentafluorobenzyl)hydroxylamine; O-(4-nitrobenzyl)hydroxylamine; 2-aminooxypyridine; 2-aminooxymethylpyridine; 4-[(aminooxyacetyl)amino]benzoic acid methyl ester; 4-[(aminooxyacetyl)amino]benzoic acid ethyl ester; 4-[(aminooxyacetyl)amino]benzoic acid n-butyl ester.
【0053】
前記アミノオキシ基を有する化合物がアルギニン残基、トリプトファン残基、フェニルアラニン残基、チロシン残基、システイン残基およびこれら誘導体の少なくとも一つからなる部分を含む化合物であることが好ましく、下記〔化1〕で表される構造を有した化合物であることが好ましい。
【化1】

【0054】
(糖鎖捕捉担体)
次に糖鎖捕捉担体についても以下に述べる。
糖鎖は生体内に存在する物質の中で唯一、アルデヒド基をもつ物質である。すなわち、糖鎖は水溶液などの状態で環状のヘミアセタール型と、非環状型のアルデヒド型とが平衡で存在する。一方、タンパク質や、核酸、脂質等、糖鎖以外の生体物質にはアルデヒド基が含まれていないことから、アルデヒド基と特異的に反応して安定な結合を形成する官能基を利用すれば、糖鎖のみを選択的に捕捉することが可能である。
アルデヒド基と特異的に反応して安定な結合を形成する官能基としては、例えば、オキシルアミノ基、ヒドラジド基、アミノ基、セミチオカルバジド基ならびにそれらの誘導体がある。好ましくは温和な条件下でアルデヒドと反応するヒドラジド基あるいはオキシルアミノ基を使用することが好ましい。
【0055】
ヒドラジド基あるいはオキシルアミノ基は、酵素やカップリング試薬などの非存在下においても、糖鎖還元末端であるアルデヒド基と反応し結合可能であるから好適である。
【0056】
本発明に使用するヒドラジド基を有する捕捉担体としては、液体と分離可能な物質を指し、ポリマー粒子を用いることが好ましい、ポリマー粒子が固体粒子あるいはゲル粒子であれば、N−結合型糖鎖を遊離させた後、遠心分離やろ過などの方法により容易に液体から回収することができる。また、ポリマー粒子であれば、分離分取用カラムに充填して用いることも可能である。カラム充填により用いる方法は、特に連続操作化の観点から重要である。
【0057】
前記糖鎖捕捉担体は、下記一般式〔化2〕で表される構造が好ましい。
【化2】

(R1,R2は−O−,−S−,−NH−,−CO−,−CONH−が挿入されてもよい炭素数1〜20の炭化水素鎖,R3,R4,R5はH,CH3,または炭素数2〜5の炭化水素鎖を示す。m,nはモノマーユニット数を示す。)
【0058】
また、前記捕捉担体は、水溶液や有機溶媒に不溶性の担体であることがのぞましく、材質は特に限定するものではないが、ガラスや耐有機溶剤性に優れた樹脂、例えばシリコン、ポリスチレン、エチレン−無水マレイン酸共重合物、ポリメタクリル酸メチル等を選ぶことができる。
【0059】
具体的には、前記担体は、下記一般式〔化3〕の構造を有する架橋ポリマー構造を有するポリマーマトリックスで構成される粒子担体であることが好ましい
【化3】

【0060】
前記糖鎖捕捉担体の形態は、特に限定するものではないが、粒子またはプレート状の形態であることが好ましい。糖鎖ライブラリーを作製するためには、同時に多数の試料を処理する可能性があり、その際には、カラムに粒子を充填したものを使用する事で連続的な処理が可能である。また、マルチウェルプレートであれば同時に多検体を処理することが可能である。マルチウェルプレートとしては、6、12、24,48、96,384ウェルなどのマルチウェルプレートを適宜使用することが出来る。
【0061】
〔化3〕の担体以外では、粒子として無機物質を用いることができる。該担体としては、粒子状のものを用いることができ、例えばシリカ粒子、アルミナ粒子、ガラス粒子、金属粒子などが挙げられる。また、有機高分子物質としては、アガロース、セファロースに代表される多糖類ゲル、ビニル化合物の重合体であるポリマーを粒子状にしたものを使用することが出来る。
また、粒子としたときの形状は球であることが好ましく、平均粒径0.1μm以上500μm以下の粒子である。この場合の平均粒径は光学顕微鏡視野において観察される各粒子の直径を計測することにより求めたものである。このような範囲の粒径を有する担体の粒子は、遠心分離、 フィルターなどによる回収が容易であり、かつ、充分な表面積を有しているために糖鎖との反応効率も高いと考えられる。粒径が上記の範囲よりも大幅に大きい場合、表面積が小さくなるために糖鎖との反応効率が低くなることがある。また、粒径が上記の範囲よりも大幅に小さい場合、特にフィルターを用いて分離する際に目詰まりを起こす可能性があり作業性が著しく低下する可能性がある。さらに、粒子をカラムに充填して用いる場合、粒径が過小であると通液の際の圧力損失が大きくなってしまうことがある。
【実施例】
【0062】
以下、本発明を実施例および比較例に基づいて詳細に説明するが、本発明はこれに限定されるものではない。
【0063】
(実施例1)
(1.N−結合型糖鎖の遊離)
ウシ血清由来フェツイン(SIGMA、F3004)1 mgを100mM重炭酸アンモニウム(和光純薬、017−02875)50μLに溶解させた後、120mM DTT(ジチオスレイトール、SIGMA、D9779)を5μL加え、60℃で30分間反応させた。反応終了後、123mM IAA(ヨードアセトアミド、和光純薬、093−02152)10μLを加えて遮光下、室温で1時間反応させた。続いて400Uのトリプシン(SIGMA、T0303)によってプロテアーゼ処理をし、タンパク質部分をペプチド断片化した。反応溶液を90℃で5分処理した後、5Uのペプチド−N−グリコシダーゼF(Roche、1−365−193)による処理を行って糖鎖をペプチドから遊離させ、予備処理済の生体試料を得た。
【0064】
(2.糖鎖捕捉担体によるN−結合型糖鎖の捕捉)
糖鎖捕捉用の担体であるヒドラジド基を有する粒子5mg(BlotGlyco(R))、住友ベークライト株式会社製、BS−45603)が入ったディスポカラムに上記糖鎖溶液20μLおよび180μLの2%酢酸/アセトニトリル溶液を加え、80℃で1時間反応させた。反応は開放系で行い、溶媒が完全に蒸発し粒子が乾固した状態であることを目視で確認した。
【0065】
(3.O−結合型糖ペプチドの回収)
N−結合型糖鎖が結合した粒子を水、メタノールで繰り返し洗浄し、その洗浄溶液を回収した。回収した溶液中にはペプチド−N−グリコシダーゼで切り出されなかったO−結合型糖ペプチドが含まれる。得られた溶液を凍結乾燥させ、完全に水を除去した。
【0066】
(4.N−結合型糖鎖の精製、標識、回収)
N−結合型糖鎖が結合した粒子をトリエチルアミン溶液にて洗浄後、10%無水酢酸/メタノールを添加し、室温で30分間反応させ、未反応のヒドラジド基をキャッピングした。キャッピング後、メタノール、塩酸水溶液、水、ジメチルスルホキシドにて粒子を洗浄した。
【0067】
続いて、シアル酸残基のカルボン酸のメチルエステル化を行った。500mMの1−メチル−3−p−トリルトリアゼン(MTT)(東京化成 No.M0641)を100μL加え、60℃で1時間反応させた。反応後、メタノール、水で洗浄した。
最後に、粒子から糖鎖の切り出し反応を行った。純水20μLおよび2%酢酸/アセトニトリル溶液180μLを加え、80℃で1時間反応させた。反応は開放系で行い、溶媒が完全に蒸発し粒子が乾固した状態であることを目視で確認した。乾燥した粒子に水50μLを加え、N−結合型糖鎖を回収した。
【0068】
(5.ヒドラジン分解によるO−結合型糖鎖の遊離)
(3)の操作で得られたO−結合型糖ペプチド含有サンプルをヒドラジン分解する事でO−結合型糖鎖を遊離させた。ヒドラジン分解は、ヒドラクラブY2100(J−オイルミルズ)を用いて装置のプロトコルに従って行った。
【0069】
ヒドラクラブ付属の反応容器をヒドラクラブ内にて120℃で約12時間乾燥させた。十分乾燥された反応容器内に(3)の操作で得られた試料の入った容器を入れてヒドラクラブにセットした。続いて、ヒドラジン分解試薬(生化学バイオビジネス、800618)のヒドラジンバイアルを反納期内に注入させ、65℃で6時間加熱した。反応終了後、真空ポンプを使って反応容器内のヒドラジンを除去した。反応容器から試料を取り出し、アセチル化キット(生化学バイオビジネス、800620)を用いてアミノ化糖の再アセチル化を実施した。酢酸アンモニウムを200μL、トリエチルアミン10μL、無水酢酸10μLを試料に加え、室温で20分反応させた。反応終了後、遠心濃縮装置を用いて完全に試料を乾燥させた。再度純水200μLに溶解させた後凍結乾燥させ、ヒドラジン分解試料を得た。
【0070】
(6.O−結合型糖鎖の精製)
(5)で得られたヒドラジン分解試料を水20μLに溶解させた。糖鎖捕捉用の担体であるヒドラジド基を有する粒子5mg(BlotGlyco(R))、住友ベークライト株式会社製、BS−45603)が入ったディスポカラムに前記糖鎖溶液20μLおよび180μLの2%酢酸/アセトニトリル溶液を加え、80℃で1時間反応させた。反応は開放系で行い、溶媒が完全に蒸発し粒子が乾固した状態であることを目視で確認した。
【0071】
(7.O−結合型糖鎖の精製、標識、回収)
N−結合型糖鎖が結合した粒子をトリエチルアミン溶液にて洗浄後、10%無水酢酸/メタノールを添加し、室温で30分間反応させ、未反応のヒドラジド基をキャッピングした。キャッピング後、メタノール、塩酸水溶液、水、ジメチルスルホキシドにて粒子を洗浄した。
【0072】
続いて、シアル酸残基のカルボン酸のメチルエステル化を行った。500mMの1−メチル−3−p−トリルトリアゼン(MTT)(東京化成 No.M0641)を100μL加え、60℃で1時間反応させた。反応後、メタノール、水で洗浄した。
最後に、粒子から糖鎖の切り出し反応を行った。純水20μLおよび2%酢酸/アセトニトリル溶液180μLを加え、80℃で1時間反応させた。反応は開放系で行い、溶媒が完全に蒸発し粒子が乾固した状態であることを目視で確認した。乾燥した粒子に水50μLを加え、O−結合型糖鎖を回収した。
【0073】
(質量分析機器による解析)
回収したN,O−糖鎖サンプルをマトリックス支援レーザーイオン化−飛行時間型質量分析器(MALDI−TOF MS)(Bruker社製 autoflex III)によりポジティブモードにて分析した。マトリックスには2,5−ジヒドロキシ安息香酸を用いた。測定結果を図1に示す。上段はO−結合型糖鎖、下段はN−結合型糖鎖を測定した結果である。点線で囲った部分が糖鎖由来のピークである。N,O−結合型それぞれの糖鎖を完全に分離して分析できた。
【産業上の利用可能性】
【0074】
本発明により、複合糖質から簡便にN−結合型糖鎖と、O−結合型糖鎖を、分けて回収、精製することが可能となり、必要に応じて標識化合物による標識を実施でき、該糖鎖を提供することが可能となった。
【技術分野】
【0001】
本発明は、複合糖質からO−結合型糖鎖、およびN−結合型糖鎖を別々に精製・回収する方法に関する。
【背景技術】
【0002】
生化学分野において、近年、核酸、タンパク質に続く第三の鎖として糖鎖分子が注目されている。特に細胞の分化や癌化、免疫反応や受精などのかかわりが研究され、新たな医薬や医療材料を創製しようとする試みが続けられている。糖鎖は多くの毒素、ウィルス及びバクテリアなどの病原性外来因子受容体であり、また、癌のマーカーとしても注目されており、どちらの分野においても、同様に新たな医薬や医療材料を創製しようとする試みが続けられている。生体内において糖タンパク質、糖ペプチドは、細胞膜表面に存在して細胞膜受容体として働いたり、血清などの体液中に分泌されたり、また細胞外マトリックスの構成物として存在している。近年、こうした糖鎖が、生体活動に重要な役割を果たしていることが明らかにされて来ている。
【0003】
糖タンパク質の糖鎖には、セリンやスレオニンのヒドロキシ基にα結合しているO−グリコシド結合糖鎖(O−結合型糖鎖)と、アスパラギンのアミノ基にβ結合しているN−グリコシド結合糖鎖がある(N−結合型糖鎖)。
【0004】
N−結合型糖鎖は生物の受精、発生、免疫、細胞内輸送、老化、癌などに関与していることが報告され、これまで多くの研究者により機能解明されてきた(例えば非特許文献1)。また、その多様性も共通の生合成経路の後に付与されるため、比較的少ない。
【0005】
糖タンパク質、糖ペプチドの解析方法は、種々の方法が開発されている(例えば、特許文献1、特許文献2)。しかしながら多くの場合、N−グリコシド結合糖鎖の分子の解析方法がほとんどである。
【0006】
一方、O−結合型糖鎖は様々なタンパク質−糖結合様式で構築されその大きさも多様である。O−結合型糖鎖の異常は先天性筋ジストロフィーなど様々な疾患や生体機能に影響をもたらす事が報告されているが、生合成メカニズムや代謝、機能については未だ多くが解明されていない。
【0007】
その原因の一つとして、O−結合型糖鎖を糖タンパク質コアから効率よく切り出す方法が確立されていないことが挙げられる。N−結合型糖鎖はN−グリコシダーゼで網羅的かつ高効率に切り出すことが可能である。一方、O−結合型糖鎖を切り出す酵素も存在するが、末端のシアル酸を分解する必要があるなど制限がある。そのためO−結合型糖鎖の切り出しはヒドラジン分解、またはアルカリ分解により成される事が多い。さらに、ヒドラジン分解で遊離された糖鎖試料には夾雑物が含まれており、糖鎖を分析するためには精製作業が必要であるが、これらの操作は非常に煩雑である。また、N−結合型糖鎖の一部も同時に切り出されるため、血清や体液、組織などの混合試料中からN−型糖鎖と大きさが多様なO−結合型糖鎖を分離するのは非常に困難であった。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2006−098367号公報
【特許文献2】特開2008−309501号公報
【非特許文献】
【0009】
【非特許文献1】糖鎖生物学入門、Muaureen E.、et.al.、西村紳一郎ら編、2005年、化学同人
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明の目的は、複合糖質よりN−結合型糖鎖およびO−結合型糖鎖をそれぞれ分離する糖鎖試料の製造方法を提供することにある。
【課題を解決するための手段】
【0011】
このような目的は、下記(1)〜(17)に記載の本発明により達成される。
(1)複合糖質よりO−結合型糖鎖およびN−結合型糖鎖をそれぞれ遊離して糖鎖試料を製造する製造方法であって、 複合糖質よりO−結合型糖鎖およびN−結合型糖鎖のいずれか一方の糖鎖を遊離する第1遊離工程と、前記第1遊離工程で遊離した糖鎖を回収する第1回収工程と、前記第1遊離工程が行われた複合糖質より、他方の糖鎖を遊離する第2遊離工程と、前記第2遊離工程で遊離した糖鎖を回収する第2回収工程と
を有することを特徴とする糖鎖試料の製造方法。
(2)前記第1回収工程および第2回収工程の少なくとも一方は、遊離したO−結合型糖鎖または遊離したN−結合型糖鎖と、結合可能な官能基を有する捕捉担体とを反応させるものである(1)記載の糖鎖試料の製造方法。
(3)糖鎖と結合可能な官能基がヒドラジド基あるいはアミノオキシ基である(1)または(2)記載の糖鎖試料の製造方法。
(4)前記第1遊離工程では、複合糖質よりN−結合型糖鎖を遊離するものである(1)ないし(3)いずれか1項に記載の糖鎖試料の製造方法。
(5)前記第1遊離工程では、複合糖質をN−結合型糖鎖のみを遊離させることの可能な酵素で処理するものである(1)ないし(4)いずれか1項に糖鎖試料の製造方法
(6)前記酵素がエンド型グリコシダーゼであること(5)記載の糖鎖試料の製造方法。
(7)前記エンド型グリコシダーゼが、ペプチド:N−グリカナーゼ、エンド−β−N−アセチルグルコサミニダーゼ、エンド−β−マンノシダーゼ、から選ばれる少なくとも1つである(6)記載の糖鎖試料の製造方法。
(8)前記第2遊離工程は、前記第1遊離工程後の前記複合糖質の残渣を、さらにO−結合型糖鎖を遊離させることが可能な化学処理、またはO−結合型糖鎖を遊離させることが可能な酵素処理するものである(5)ないし(7)いずれか1項に記載の糖鎖試料の製造方法。
(9)O−結合型糖鎖を遊離できる化学処理が、ヒドラジン分解またはアルカリ分解であることを特徴とする(8)記載の糖鎖試料の製造方法。
(10)O−結合型糖鎖を遊離できる酵素が、O−グリコシダーゼであることを特徴とする(8)記載の糖鎖試料の製造方法。
(11)前記第1遊離工程では、複合糖質よりO−結合型糖鎖を遊離するものである(1)ないし(3)いずれか1項に記載の糖鎖試料の製造方法。
(12)前記第1遊離工程では、複合糖質をO−結合型糖鎖のみを遊離させることの可能な酵素で処理するものである(11)記載の糖鎖試料の製造方法。
(13)O−結合型糖鎖を遊離できる酵素が、O−グリコシダーゼであることを特徴とする(12)記載の糖鎖試料の製造方法。
(14)前記第2遊離工程は、前記遊離工程後の前記複合糖質の残渣を、さらにN−結合型糖鎖を遊離させることが可能な化学処理、または−結合型糖鎖を遊離させることが可能な酵素処理するものである(11)ないし(13)いずれか1項記載の糖鎖試料の製造方法。
(15)N−結合型糖鎖を遊離できる化学処理が、ヒドラジン分解またはアルカリ分解であることを特徴とする(14)記載の糖鎖試料の製造方法。
(16)前記酵素がエンド型グリコシダーゼであること(14)記載の糖鎖試料の製造方法。
(17)前記エンド型グリコシダーゼが、ペプチド:N−グルカナーゼ、エンド−β−N−汗散るグルコサミニダーゼ、エンド−β−マンノシダーゼ、から選ばれる少なくとも1つである(16)記載の糖鎖試料の製造方法。
【発明の効果】
【0012】
本発明によれば、N−結合型糖鎖およびO−結合型糖鎖をそれぞれ分離する糖鎖試料の製造方法を提供することができる。
【図面の簡単な説明】
【0013】
【図1】MALDI−TOF−MSチャート(上段)O−結合型糖鎖試料から得られた結果(下段)N−結合型糖鎖試料から得られた結果
【発明を実施するための形態】
【0014】
以下、本発明の実施形態について説明する。
なお、本願において遊離とは複合糖質から糖鎖のみを分けることを示し、分離とは、遊離した糖鎖中のN−結合型糖鎖とO−結合型糖鎖を分けることを示す。
N−結合型糖鎖とO−結合型糖鎖を分離して回収する方法としては、以下の二つの工程からなる。
【0015】
(1)複合糖質を含む試料からN−結合型糖鎖のみを遊離し、糖と特異的に結合する官能基を有する捕捉担体を用いて捕捉し試料中からN−結合型糖鎖を精製する。
(2)N−結合型糖鎖が除去された検体からO−結合型糖鎖を遊離し、糖と特異的に結合する官能基を有する捕捉担体を用いて精製する。
【0016】
前記方法は、N−結合型糖鎖を分離して、O−結合型糖鎖を回収する方法であるが、先に、O−結合型糖鎖のみを遊離して、O−結合型糖鎖が除去された検体からN−結合型糖鎖を遊離して精製する順序で、N−結合型糖鎖とO−結合型糖鎖を分離して回収することも可能である。
【0017】
(複合糖質)
本発明において使用する試料は複合糖質を含む試料であり、例えば、全血、血清、血漿、尿、唾液、細胞、組織、糖タンパク質、糖ペプチドの生体試料である。また、植物由来の試料も同様に用いることも可能である。
【0018】
酵素により糖鎖を遊離させる場合は、試料は水あるいは緩衝液に溶解されていることが好ましい。試料溶液は酵素処理するためにpH5以上9以下であることが好ましい。また、極端に酸性あるいは塩基性であると、試料に含まれる糖鎖が分解する恐れもあり、好ましくない。
【0019】
以下の説明は、N−結合型糖鎖の遊離→O−結合型糖鎖の遊離の順で製造する方法を例示する。
【0020】
(第1遊離工程、N−結合型糖鎖の遊離→O−結合型糖鎖の遊離)
一般的に、複合糖質に結合しているN−結合型糖鎖は、無水ヒドラジン処理、アルカリ処理、酵素処理により複合糖質から遊離させるが、本発明においてはN−結合型糖鎖のみを遊離させるエンド型グリコシダーゼを用いて遊離させることで、O−結合型糖鎖に影響を与えず、N−結合型糖鎖のみを遊離するのが望ましい。
【0021】
エンド型グリコシダーゼには、例えばペプチド:N−グリカナーゼ、エンド−β−N−アセチルグルコサミニダーゼ、エンド−β−マンノシダーゼ、が挙げられる。これらの中の1つ以上の酵素を利用してN−結合型糖鎖を遊離する。
具体的には、前記酵素群の中の1つ以上の酵素を、水溶液中で、0.1mU〜50mU/0.1mL、pH7.0〜8.0で、37℃で1〜17時間反応させる。ただし、ここでいう1Uとは適切な条件下で毎分1μmolの糖鎖を基質から遊離することができる酵素量の事である。
N−結合型糖鎖は、この処理において選択的にすべて遊離される。
【0022】
(第1回収工程、N−結合型糖鎖の遊離→O−結合型糖鎖の遊離)
前記の捕捉担体に前ステップにおいてN−結合型糖鎖を遊離した複合糖質を含む試料溶液を添加して所定の条件でN−結合型糖鎖を捕捉担体に結合させる。反応系のpHは、好ましくは2〜9、より好ましくは2〜7であり、さらに好ましくは2〜6である。pH調整のためには、各種緩衝液を用いることができる。糖鎖捕捉時の温度は,好ましくは4〜90℃,より好ましくは4〜85℃、さらに好ましくは30〜80℃であり,最も好ましくは40〜80℃である。反応時間は5分〜24時間が好ましく、10分〜5時間がより好ましい。反応時は反応容器を静置してもよく、振とうしてもよい。反応終了後、反応容器に水あるいは緩衝液を加え遠心分離あるいはフィルター操作により捕捉担体と溶液を分離する。
【0023】
この操作により、N−結合型糖鎖のみが捕捉担体に固定された状態で回収することが可能となる。
分離した溶液残渣中には、複合糖質が残っており、この複合糖質はO−型糖鎖が結合している。
前記のように捕捉担体に固定化された状態で回収されたN−結合型糖鎖を、担体から切り出す操作について以下に説明する。
【0024】
遊離操作の基本は、捕捉担体ごと回収しN−結合型鎖を酸性溶媒中、加熱反応を行うことでN−結合型糖鎖を捕捉担体から切り出すことができる。
具体的な方法を以下に示す。
【0025】
反応を行う溶媒は、酸と水が反応に必要であることから、酸と水と有機溶媒の混合溶媒が好ましい。酸と水と有機溶媒の混合溶媒の場合、水の含有率は好ましくは0.1%〜90%、より好ましくは0.1%〜80%、さらに好ましくは0.1%〜50%である。水の代わりに水性緩衝液を含有しても良い。混合前の緩衝液の濃度は好ましくは0.1mM〜1M、より好ましくは0.1mM〜500mM、さらに好ましくは1mM〜100mMである。反応溶液のpHは好ましくは2〜9、より好ましくは2〜7であり、さらに好ましくは2〜6である。使用する酸は例えば、酢酸、ギ酸、トリフルオロ酢酸、塩酸、クエン酸、リン酸、硫酸が好ましく、より好ましくは酢酸、ギ酸、トリフルオロ酢酸、リン酸、さらに好ましくは酢酸、トリフルオロ酢酸である。
【0026】
反応温度に関しては4〜90℃が好ましく、好ましくは25〜90℃で、さらに好ましくは50〜90℃である。反応時間は、5分間〜24時間、好ましくは10分間〜8時間、より好ましくは15分間〜120分間である。反応は、開放系で行って溶媒を完全に蒸発させることが好ましい。これは、溶媒が蒸発するにつれで溶液濃度が無限濃縮されることにより十分な反応をおこさせることが目的である。
【0027】
pH2の酸性から中性付近で、N−結合型糖鎖切り出し反応を行うことができるため、従来の強酸性処理、たとえば10%トリフルオロ酢酸処理による切出しのような強酸の存在下での切出し反応に比べて、シアル酸残基の脱離など糖鎖の加水分解などを引き起こすことを抑制することができるようになる。
【0028】
(第2遊離工程、N−結合型糖鎖の遊離→O−結合型糖鎖の遊離)
前記のN−結合型糖鎖の精製において溶液中に回収した残渣からO−結合型糖鎖を遊離させる。すでにN−結合型糖鎖の回収は終了しているので、残っている結合糖鎖はすべてO−結合型糖鎖と考えてよい。したがって遊離方法としては、ヒドラジン分解、またはアルカリ分解を使うことが可能である。また、O−グリカナーゼを用いてO−結合型糖鎖を遊離しても良い。
具体的な方法としては、以下の通りである。
【0029】
まず、ヒドラジン分解は、気相法と液相法の二種類がある。まず液相法は、試料をバイアル瓶など入れて凍結乾燥させ、無水ヒドラジンを加えオーブンで100℃、8〜10時間加熱する。反応終了後、トルエンを数滴加え、デシケーターに試料バイアルを入れ、冷却トラップを付けた真空ポンプで数時間以上減圧しヒドラジンを共沸留去する。この際に、前記共沸除去操作を数回繰り返し、ヒドラジンを完全に留去する。
【0030】
次に気相法は、糖鎖分析用機器として市販されているヒドラクラブ(J−OIL MILLS)を用いて行う。ヒドラクラブ付属の反応容器をヒドラクラブ内で120度、約12時間乾燥させる。試料は付属の反応用試験管にいれ乾固しておく(0〜10mg)。 十分乾燥された反応容器内に試料の入った試験管を入れてヒドラクラブにセットする。 ヒドラジン分解試薬のヒドラジンバイアルを反応容器内に注入させる。N−グリコシド糖鎖を切り出す場合は、100℃、2時間、N−グリコシド糖鎖およびO−グリコシド糖鎖を同時に切り出す場合は、65℃、6時間加熱する。
反応中にヒドラジン冷却トラップ(アセトン-ドライアイス)を準備し、反応終了後、真空ポンプを使って反応容器内のヒドラジンを除去する。 反応容器から反応用試験管を取り出しN-アセチル化処理を行う、もしくは、試験管ごと−20℃で保存する。
【0031】
次に、O−グリカナーゼを用いてO−結合型糖鎖を遊離する方法について述べる。
O−グリカナーゼとして機能する酵素に関して、特に限定するものではないが、O−グリコシダーゼが好適に用いられる。
O−グリコシダーゼは、水溶液中で、0.1〜50mU/0.1mL、pH6.0〜8.0で、37℃で1時間〜1晩反応させる。ただし、ここでいう1Uとは適切な条件下で毎分1μmolの糖鎖を基質から遊離することができる酵素量の事である。
【0032】
前記の捕捉担体に前ステップにおいて調製した、O−結合型糖鎖を遊離した溶液を添加して所定の反応温度でO−結合型糖鎖と捕捉担体とを結合反応させる。反応系のpHは、好ましくは2〜9、より好ましくは2〜7であり、さらに好ましくは2〜6である。pH調整のためには、各種緩衝液を用いることができる。糖鎖捕捉時の温度は,好ましくは4〜90℃,より好ましくは4〜85℃、さらに好ましくは30〜80℃であり,最も好ましくは40〜80℃である。反応時間は5分〜24時間が好ましく、10分〜5時間がより好ましい。反応時は反応容器を静置してもよく、振とうしてもよい。反応終了後、反応容器に水あるいは緩衝液を加え遠心分離あるいはフィルター操作により捕捉担体と溶液を分離して、溶液を分離する。
この操作により、O−結合型糖鎖のみが捕捉担体に固定された状態で回収することが可能となる。
【0033】
(第2回収工程、N−結合型糖鎖の遊離→O−結合型糖鎖の遊離)
前記のように捕捉担体に固定化された状態で回収されたO−結合型糖鎖を、捕捉担体から切り出す操作について以下に説明する。
【0034】
基本的な方法は、N−結合型糖鎖を捕捉担体から切り出す方法と同じである。
具体的な方法を以下に示す。
【0035】
反応を行う溶媒は、酸と水が反応に必要であることから、酸と水と有機溶媒の混合溶媒が好ましい。酸と水と有機溶媒の混合溶媒の場合、水の含有率は好ましくは0.1%〜90%、より好ましくは0.1%〜80%、さらに好ましくは0.1%〜50%である。水の代わりに水性緩衝液を含有しても良い。混合前の緩衝液の濃度は好ましくは0.1mM〜1M、より好ましくは0.1mM〜500mM、さらに好ましくは1mM〜100mMである。反応溶液のpHは好ましくは2〜9、より好ましくは2〜7であり、さらに好ましくは2〜6である。使用する酸は例えば、酢酸、ギ酸、トリフルオロ酢酸、塩酸、クエン酸、リン酸、硫酸が好ましく、より好ましくは酢酸、ギ酸、トリフルオロ酢酸、リン酸、さらに好ましくは酢酸、トリフルオロ酢酸である。
【0036】
反応温度に関しては4〜90℃が好ましく、好ましくは25〜90℃で、さらに好ましくは50〜90℃である。反応時間は、5分間〜24時間、好ましくは10分間〜8時間、より好ましくは15分間〜120分間である。反応は、開放系で行って溶媒を完全に蒸発させることが好ましい。これは、溶媒が蒸発するにつれで溶液濃度が無限濃縮されることにより十分な反応をおこさせることが目的である。
【0037】
pH2の酸性から中性付近で、O−結合型糖鎖切り出し反応を行うことができるため、従来の強酸性処理、たとえば10%トリフルオロ酢酸処理による切出しのような強酸の存在下での切出し反応に比べて、シアル酸残基の脱離など糖鎖の加水分解などを引き起こすことを抑制することができるようになる。
【0038】
次に、O−結合型糖鎖の遊離→N−結合型糖鎖の遊離の順で製造する方法を例示する。
【0039】
(第1遊離工程、O−結合型糖鎖の遊離→N−結合型糖鎖の遊離)
まず複合糖質に結合しているO−結合型糖鎖は、無水ヒドラジン処理、アルカリ処理、酵素処理により複合糖質から遊離させるが、本発明においてはO−結合型糖鎖のみを遊離させるO−グリカナーゼを用いて遊離させることで、N−結合型糖鎖に影響を与えず、O−結合型糖鎖のみを遊離するのが望ましい。O−グリカナーゼの使用法は前述の通りである。
【0040】
(第1回収工程、O−結合型糖鎖の遊離→N−結合型糖鎖の遊離)
O−結合型糖鎖の遊離→N−結合型糖鎖の遊離の順で製造する方法における第1回収工程は、前述のN−結合型糖鎖→O−結合型糖鎖の遊離の順で製造する方法と同じで、回収される糖鎖がO−結合型糖鎖になり、分離した溶液残渣中に残る複合糖質にはN−型糖鎖が結合している。
回収工程の詳細は、前述の通りに行うことができる。
【0041】
(第2遊離工程、O−結合型糖鎖の遊離→N−結合型糖鎖の遊離)
前記のO−結合型糖鎖の精製において溶液中に回収した残渣からN−結合型糖鎖を遊離させる。すでにO−結合型糖鎖の回収は終了しているが、残っている結合糖鎖中には、一部O−結合型糖鎖が残っている場合がある。したがって遊離方法としては、ヒドラジン分解、またはアルカリ分解を使うことも可能であるが、好ましくは、N−グリカナーゼを用いてN−結合型糖鎖を遊離する方法である。
具体的な方法としては、前述の方法を用いて行うことができる。
【0042】
(第2回収工程、O−結合型糖鎖の遊離→N−結合型糖鎖の遊離)
前記の第2回収工程に準じて、回収ことにより、N−結合型糖鎖のみを回収することができる。
【0043】
(糖鎖標識)
以上のようにして分離、精製された糖鎖試料(N−結合型糖鎖試料およびO−結合型糖鎖試料)は、そのまま、あるいは蛍光物質による標識を経て後、質量分析やHPLCなどの分析手段によって分析することができる。
【0044】
糖鎖標識方法の1例を以下に述べる。
回収した糖鎖試料を、溶液中でアミノ基を含む還元アミノ化反応により標識化合部と結合させる。
【0045】
前記のアミノ基を含む化合物は、具体的には蛍光物質またはUV吸収基を有する化合物が、下記のアミノ基を含む物質からなる群から選ぶことが、好ましい。
8-Aminopyrene-1,3,6-trisulfonate, 8-Aminonaphthalene-1,3,6-trisulphonate, 7-Amino-1,3-naphtalenedisulfonic acid, 2-Amino9(10H)-acridone,5-Aminofluorescein,Dansylethylenediamie, 2-Aminopyridine, 7-Amino-4-methylcoumarine, 2-Aminobenzamide, 2-Aminobenzoic acid, 3-Aminobenzoic acid, 7-Amino-1-naphthol, 3-(Acethylamino)-6-aminoacridine, 2-Amino-6-cyanoethylpyridine,Ethyl p-aminobenzoate, p-Aminobenzonitrile, 及び7-aminonaphothalene-1,3-disulfonic acid
【0046】
(還元アミノ化反応による標識方法)
具体的には、2-Aminobenzamideによる標識の場合、捕捉担体から酸性糖鎖を遊離後、反応容器に0.35 M 2-Aminobenzamid, 1 M sodium cyanoborohydride, 30% 酢酸水溶液を加え、60℃で数時間反応する事で達成される。
【0047】
また、糖鎖試料は捕捉担体から切り出すと同時に標識する方法がある。
この方法は、ヒドラジド基、またはアミノオキシ基を有する標識化合物を作用させて、ヒドラゾン−ヒドラゾンあるいはヒドラゾン−オキシム交換反応により酸性糖鎖を捕捉担体から切り離しすると同時に前記標識化合物に結合させることで可能である。
【0048】
この方法も前記の還元アミノ化反応による標識方法と同じく同じ反応容器内で連続的に行うことができるため、糖鎖の回収、精製から検出までの自動化が可能となる。
【0049】
ヒドラジド基を含む標識化合物の作製方法としては、上記糖鎖を遊離する工程において、ヒドラジド基を含有しており、蛍光物質またはUV吸収基を有する化合物を接触させ糖鎖を遊離させると同時に蛍光物質またはUV吸収物質で糖鎖を標識する方法がある。反応の溶媒、反応温度、時間の詳細は前記の通りであるが、アルデヒド基を含む化合物、例えば糖鎖に対して10等量以上の化合物を添加することで達成できる。
【0050】
前記ヒドラジド基を含む物質、具体的には蛍光物質またはUV吸収基を有する化合物が、下記のヒドラジド基を含む物質である群から選ぶことができる。
5-Dimethylaminonaphthalene-1-sulfonyl hydrazine (Dansylhydrazine); 2-hydrazinopyridine;9-fluorenylmethyl carbazate (Fmoc hydrazine);benzylhydrazine;4,4-difluoro-5,7-dimethyl-4-bora-3a,4a-diaza-s-indacene-3-propionoc acid, hydrazide;2-(6,8-difluoro-7-hydroxy-4-methylcoumarin)acetohydrazide;7-diethylaminocoumarin-3-carboxylic acid, hydrazide (DCCH);phenylhydrazine;1-Naphthaleneacethydrazide;2-hydrazinobenzoic acid;biotin hydrazide;phenylacetic hydrazide.
【0051】
アミノオキシ基を含む標識化合物としては、アミノオキシ基含有の蛍光物質またはUV吸収基を有する化合物を接触させ糖鎖を遊離させると同時に蛍光物質またはUV吸収基を有する化合物で糖鎖を標識する方法である。反応の溶媒、反応温度、時間の詳細は前記の通りであるが、アミノ基を含む化合物、例えば糖鎖に対して10等量以上の化合物を添加することで達成できる。
【0052】
上記アミノオキシ化合物が下記の化合物から選ばれる事が望ましい。
O-benzylhydroxylamine;O-phenylhydroxylamine; O-(2,3,4,5,6-pentafluorobenzyl)hydroxylamine; O-(4-nitrobenzyl)hydroxylamine; 2-aminooxypyridine; 2-aminooxymethylpyridine; 4-[(aminooxyacetyl)amino]benzoic acid methyl ester; 4-[(aminooxyacetyl)amino]benzoic acid ethyl ester; 4-[(aminooxyacetyl)amino]benzoic acid n-butyl ester.
【0053】
前記アミノオキシ基を有する化合物がアルギニン残基、トリプトファン残基、フェニルアラニン残基、チロシン残基、システイン残基およびこれら誘導体の少なくとも一つからなる部分を含む化合物であることが好ましく、下記〔化1〕で表される構造を有した化合物であることが好ましい。
【化1】

【0054】
(糖鎖捕捉担体)
次に糖鎖捕捉担体についても以下に述べる。
糖鎖は生体内に存在する物質の中で唯一、アルデヒド基をもつ物質である。すなわち、糖鎖は水溶液などの状態で環状のヘミアセタール型と、非環状型のアルデヒド型とが平衡で存在する。一方、タンパク質や、核酸、脂質等、糖鎖以外の生体物質にはアルデヒド基が含まれていないことから、アルデヒド基と特異的に反応して安定な結合を形成する官能基を利用すれば、糖鎖のみを選択的に捕捉することが可能である。
アルデヒド基と特異的に反応して安定な結合を形成する官能基としては、例えば、オキシルアミノ基、ヒドラジド基、アミノ基、セミチオカルバジド基ならびにそれらの誘導体がある。好ましくは温和な条件下でアルデヒドと反応するヒドラジド基あるいはオキシルアミノ基を使用することが好ましい。
【0055】
ヒドラジド基あるいはオキシルアミノ基は、酵素やカップリング試薬などの非存在下においても、糖鎖還元末端であるアルデヒド基と反応し結合可能であるから好適である。
【0056】
本発明に使用するヒドラジド基を有する捕捉担体としては、液体と分離可能な物質を指し、ポリマー粒子を用いることが好ましい、ポリマー粒子が固体粒子あるいはゲル粒子であれば、N−結合型糖鎖を遊離させた後、遠心分離やろ過などの方法により容易に液体から回収することができる。また、ポリマー粒子であれば、分離分取用カラムに充填して用いることも可能である。カラム充填により用いる方法は、特に連続操作化の観点から重要である。
【0057】
前記糖鎖捕捉担体は、下記一般式〔化2〕で表される構造が好ましい。
【化2】

(R1,R2は−O−,−S−,−NH−,−CO−,−CONH−が挿入されてもよい炭素数1〜20の炭化水素鎖,R3,R4,R5はH,CH3,または炭素数2〜5の炭化水素鎖を示す。m,nはモノマーユニット数を示す。)
【0058】
また、前記捕捉担体は、水溶液や有機溶媒に不溶性の担体であることがのぞましく、材質は特に限定するものではないが、ガラスや耐有機溶剤性に優れた樹脂、例えばシリコン、ポリスチレン、エチレン−無水マレイン酸共重合物、ポリメタクリル酸メチル等を選ぶことができる。
【0059】
具体的には、前記担体は、下記一般式〔化3〕の構造を有する架橋ポリマー構造を有するポリマーマトリックスで構成される粒子担体であることが好ましい
【化3】

【0060】
前記糖鎖捕捉担体の形態は、特に限定するものではないが、粒子またはプレート状の形態であることが好ましい。糖鎖ライブラリーを作製するためには、同時に多数の試料を処理する可能性があり、その際には、カラムに粒子を充填したものを使用する事で連続的な処理が可能である。また、マルチウェルプレートであれば同時に多検体を処理することが可能である。マルチウェルプレートとしては、6、12、24,48、96,384ウェルなどのマルチウェルプレートを適宜使用することが出来る。
【0061】
〔化3〕の担体以外では、粒子として無機物質を用いることができる。該担体としては、粒子状のものを用いることができ、例えばシリカ粒子、アルミナ粒子、ガラス粒子、金属粒子などが挙げられる。また、有機高分子物質としては、アガロース、セファロースに代表される多糖類ゲル、ビニル化合物の重合体であるポリマーを粒子状にしたものを使用することが出来る。
また、粒子としたときの形状は球であることが好ましく、平均粒径0.1μm以上500μm以下の粒子である。この場合の平均粒径は光学顕微鏡視野において観察される各粒子の直径を計測することにより求めたものである。このような範囲の粒径を有する担体の粒子は、遠心分離、 フィルターなどによる回収が容易であり、かつ、充分な表面積を有しているために糖鎖との反応効率も高いと考えられる。粒径が上記の範囲よりも大幅に大きい場合、表面積が小さくなるために糖鎖との反応効率が低くなることがある。また、粒径が上記の範囲よりも大幅に小さい場合、特にフィルターを用いて分離する際に目詰まりを起こす可能性があり作業性が著しく低下する可能性がある。さらに、粒子をカラムに充填して用いる場合、粒径が過小であると通液の際の圧力損失が大きくなってしまうことがある。
【実施例】
【0062】
以下、本発明を実施例および比較例に基づいて詳細に説明するが、本発明はこれに限定されるものではない。
【0063】
(実施例1)
(1.N−結合型糖鎖の遊離)
ウシ血清由来フェツイン(SIGMA、F3004)1 mgを100mM重炭酸アンモニウム(和光純薬、017−02875)50μLに溶解させた後、120mM DTT(ジチオスレイトール、SIGMA、D9779)を5μL加え、60℃で30分間反応させた。反応終了後、123mM IAA(ヨードアセトアミド、和光純薬、093−02152)10μLを加えて遮光下、室温で1時間反応させた。続いて400Uのトリプシン(SIGMA、T0303)によってプロテアーゼ処理をし、タンパク質部分をペプチド断片化した。反応溶液を90℃で5分処理した後、5Uのペプチド−N−グリコシダーゼF(Roche、1−365−193)による処理を行って糖鎖をペプチドから遊離させ、予備処理済の生体試料を得た。
【0064】
(2.糖鎖捕捉担体によるN−結合型糖鎖の捕捉)
糖鎖捕捉用の担体であるヒドラジド基を有する粒子5mg(BlotGlyco(R))、住友ベークライト株式会社製、BS−45603)が入ったディスポカラムに上記糖鎖溶液20μLおよび180μLの2%酢酸/アセトニトリル溶液を加え、80℃で1時間反応させた。反応は開放系で行い、溶媒が完全に蒸発し粒子が乾固した状態であることを目視で確認した。
【0065】
(3.O−結合型糖ペプチドの回収)
N−結合型糖鎖が結合した粒子を水、メタノールで繰り返し洗浄し、その洗浄溶液を回収した。回収した溶液中にはペプチド−N−グリコシダーゼで切り出されなかったO−結合型糖ペプチドが含まれる。得られた溶液を凍結乾燥させ、完全に水を除去した。
【0066】
(4.N−結合型糖鎖の精製、標識、回収)
N−結合型糖鎖が結合した粒子をトリエチルアミン溶液にて洗浄後、10%無水酢酸/メタノールを添加し、室温で30分間反応させ、未反応のヒドラジド基をキャッピングした。キャッピング後、メタノール、塩酸水溶液、水、ジメチルスルホキシドにて粒子を洗浄した。
【0067】
続いて、シアル酸残基のカルボン酸のメチルエステル化を行った。500mMの1−メチル−3−p−トリルトリアゼン(MTT)(東京化成 No.M0641)を100μL加え、60℃で1時間反応させた。反応後、メタノール、水で洗浄した。
最後に、粒子から糖鎖の切り出し反応を行った。純水20μLおよび2%酢酸/アセトニトリル溶液180μLを加え、80℃で1時間反応させた。反応は開放系で行い、溶媒が完全に蒸発し粒子が乾固した状態であることを目視で確認した。乾燥した粒子に水50μLを加え、N−結合型糖鎖を回収した。
【0068】
(5.ヒドラジン分解によるO−結合型糖鎖の遊離)
(3)の操作で得られたO−結合型糖ペプチド含有サンプルをヒドラジン分解する事でO−結合型糖鎖を遊離させた。ヒドラジン分解は、ヒドラクラブY2100(J−オイルミルズ)を用いて装置のプロトコルに従って行った。
【0069】
ヒドラクラブ付属の反応容器をヒドラクラブ内にて120℃で約12時間乾燥させた。十分乾燥された反応容器内に(3)の操作で得られた試料の入った容器を入れてヒドラクラブにセットした。続いて、ヒドラジン分解試薬(生化学バイオビジネス、800618)のヒドラジンバイアルを反納期内に注入させ、65℃で6時間加熱した。反応終了後、真空ポンプを使って反応容器内のヒドラジンを除去した。反応容器から試料を取り出し、アセチル化キット(生化学バイオビジネス、800620)を用いてアミノ化糖の再アセチル化を実施した。酢酸アンモニウムを200μL、トリエチルアミン10μL、無水酢酸10μLを試料に加え、室温で20分反応させた。反応終了後、遠心濃縮装置を用いて完全に試料を乾燥させた。再度純水200μLに溶解させた後凍結乾燥させ、ヒドラジン分解試料を得た。
【0070】
(6.O−結合型糖鎖の精製)
(5)で得られたヒドラジン分解試料を水20μLに溶解させた。糖鎖捕捉用の担体であるヒドラジド基を有する粒子5mg(BlotGlyco(R))、住友ベークライト株式会社製、BS−45603)が入ったディスポカラムに前記糖鎖溶液20μLおよび180μLの2%酢酸/アセトニトリル溶液を加え、80℃で1時間反応させた。反応は開放系で行い、溶媒が完全に蒸発し粒子が乾固した状態であることを目視で確認した。
【0071】
(7.O−結合型糖鎖の精製、標識、回収)
N−結合型糖鎖が結合した粒子をトリエチルアミン溶液にて洗浄後、10%無水酢酸/メタノールを添加し、室温で30分間反応させ、未反応のヒドラジド基をキャッピングした。キャッピング後、メタノール、塩酸水溶液、水、ジメチルスルホキシドにて粒子を洗浄した。
【0072】
続いて、シアル酸残基のカルボン酸のメチルエステル化を行った。500mMの1−メチル−3−p−トリルトリアゼン(MTT)(東京化成 No.M0641)を100μL加え、60℃で1時間反応させた。反応後、メタノール、水で洗浄した。
最後に、粒子から糖鎖の切り出し反応を行った。純水20μLおよび2%酢酸/アセトニトリル溶液180μLを加え、80℃で1時間反応させた。反応は開放系で行い、溶媒が完全に蒸発し粒子が乾固した状態であることを目視で確認した。乾燥した粒子に水50μLを加え、O−結合型糖鎖を回収した。
【0073】
(質量分析機器による解析)
回収したN,O−糖鎖サンプルをマトリックス支援レーザーイオン化−飛行時間型質量分析器(MALDI−TOF MS)(Bruker社製 autoflex III)によりポジティブモードにて分析した。マトリックスには2,5−ジヒドロキシ安息香酸を用いた。測定結果を図1に示す。上段はO−結合型糖鎖、下段はN−結合型糖鎖を測定した結果である。点線で囲った部分が糖鎖由来のピークである。N,O−結合型それぞれの糖鎖を完全に分離して分析できた。
【産業上の利用可能性】
【0074】
本発明により、複合糖質から簡便にN−結合型糖鎖と、O−結合型糖鎖を、分けて回収、精製することが可能となり、必要に応じて標識化合物による標識を実施でき、該糖鎖を提供することが可能となった。
【特許請求の範囲】
【請求項1】
複合糖質よりO−結合型糖鎖およびN−結合型糖鎖をそれぞれ遊離して糖鎖試料を製造する製造方法であって、
複合糖質よりO−結合型糖鎖およびN−結合型糖鎖のいずれか一方の糖鎖を遊離する第1遊離工程と、
前記第1遊離工程で遊離した糖鎖を回収する第1回収工程と、
前記第1遊離工程が行われた複合糖質より、他方の糖鎖を遊離する第2遊離工程と、
前記第2遊離工程で遊離した糖鎖を回収する第2回収工程と
を有することを特徴とする糖鎖試料の製造方法。
【請求項2】
前記第1回収工程および第2回収工程の少なくとも一方は、遊離したO−結合型糖鎖または遊離したN−結合型糖鎖と、結合可能な官能基を有する捕捉担体とを反応させるものである請求項1記載の糖鎖試料の製造方法。
【請求項3】
糖鎖と結合可能な官能基がヒドラジド基あるいはアミノオキシ基である請求項1、2記載の糖鎖試料の製造方法。
【請求項4】
前記第1遊離工程では、複合糖質よりN−結合型糖鎖を遊離するものである請求項1ないし3いずれか1項に記載の糖鎖試料の製造方法。
【請求項5】
前記第1遊離工程では、複合糖質をN−結合型糖鎖のみを遊離させることの可能な酵素で処理するものである請求項1ないし4いずれか1項に糖鎖試料の製造方法
【請求項6】
前記酵素がエンド型グリコシダーゼであること請求項5記載の糖鎖試料の製造方法。
【請求項7】
前記エンド型グリコシダーゼが、ペプチド:N−グリカナーゼ、エンド−β−N−アセチルグルコサミニダーゼ、エンド−β−マンノシダーゼ、から選ばれる少なくとも1つである請求項6記載の糖鎖試料の製造方法。
【請求項8】
前記第2遊離工程は、前記第1遊離工程後の前記複合糖質の残渣を、さらにO−結合型糖鎖を遊離させることが可能な化学処理、またはO−結合型糖鎖を遊離させることが可能な酵素処理するものである請求項5ないし7いずれか1項に記載の糖鎖試料の製造方法。
【請求項9】
O−結合型糖鎖を遊離できる化学処理が、ヒドラジン分解またはアルカリ分解であることを特徴とする請求項8記載の糖鎖試料の製造方法。
【請求項10】
O−結合型糖鎖を遊離できる酵素が、O−グリコシダーゼであることを特徴とする請求項8記載の糖鎖試料の製造方法。
【請求項11】
前記第1遊離工程では、複合糖質よりO−結合型糖鎖を遊離するものである請求項1ないし3いずれか1項に記載の糖鎖試料の製造方法。
【請求項12】
前記第1遊離工程では、複合糖質をO−結合型糖鎖のみを遊離させることの可能な酵素で処理するものである請求項11記載の糖鎖試料の製造方法。
【請求項13】
O−結合型糖鎖を遊離できる酵素が、O−グリコシダーゼであることを特徴とする請求項12記載の糖鎖試料の製造方法。
【請求項14】
前記第2遊離工程は、前記遊離工程後の前記複合糖質の残渣を、さらにN−結合型糖鎖を遊離させることが可能な化学処理、または−結合型糖鎖を遊離させることが可能な酵素処理するものである請求項11ないし13いずれか1項に記載の糖鎖試料の製造方法。
【請求項15】
N−結合型糖鎖を遊離できる化学処理が、ヒドラジン分解またはアルカリ分解であることを特徴とする請求項14記載の糖鎖試料の製造方法。
【請求項16】
前記酵素がエンド型グリコシダーゼであること請求項14記載の糖鎖試料の製造方法。
【請求項17】
前記エンド型グリコシダーゼが、ペプチド:N−グルカナーゼ、エンド−β−N−汗散るグルコサミニダーゼ、エンド−β−マンノシダーゼ、から選ばれる少なくとも1つである請求16記載の糖鎖試料の製造方法。
【請求項1】
複合糖質よりO−結合型糖鎖およびN−結合型糖鎖をそれぞれ遊離して糖鎖試料を製造する製造方法であって、
複合糖質よりO−結合型糖鎖およびN−結合型糖鎖のいずれか一方の糖鎖を遊離する第1遊離工程と、
前記第1遊離工程で遊離した糖鎖を回収する第1回収工程と、
前記第1遊離工程が行われた複合糖質より、他方の糖鎖を遊離する第2遊離工程と、
前記第2遊離工程で遊離した糖鎖を回収する第2回収工程と
を有することを特徴とする糖鎖試料の製造方法。
【請求項2】
前記第1回収工程および第2回収工程の少なくとも一方は、遊離したO−結合型糖鎖または遊離したN−結合型糖鎖と、結合可能な官能基を有する捕捉担体とを反応させるものである請求項1記載の糖鎖試料の製造方法。
【請求項3】
糖鎖と結合可能な官能基がヒドラジド基あるいはアミノオキシ基である請求項1、2記載の糖鎖試料の製造方法。
【請求項4】
前記第1遊離工程では、複合糖質よりN−結合型糖鎖を遊離するものである請求項1ないし3いずれか1項に記載の糖鎖試料の製造方法。
【請求項5】
前記第1遊離工程では、複合糖質をN−結合型糖鎖のみを遊離させることの可能な酵素で処理するものである請求項1ないし4いずれか1項に糖鎖試料の製造方法
【請求項6】
前記酵素がエンド型グリコシダーゼであること請求項5記載の糖鎖試料の製造方法。
【請求項7】
前記エンド型グリコシダーゼが、ペプチド:N−グリカナーゼ、エンド−β−N−アセチルグルコサミニダーゼ、エンド−β−マンノシダーゼ、から選ばれる少なくとも1つである請求項6記載の糖鎖試料の製造方法。
【請求項8】
前記第2遊離工程は、前記第1遊離工程後の前記複合糖質の残渣を、さらにO−結合型糖鎖を遊離させることが可能な化学処理、またはO−結合型糖鎖を遊離させることが可能な酵素処理するものである請求項5ないし7いずれか1項に記載の糖鎖試料の製造方法。
【請求項9】
O−結合型糖鎖を遊離できる化学処理が、ヒドラジン分解またはアルカリ分解であることを特徴とする請求項8記載の糖鎖試料の製造方法。
【請求項10】
O−結合型糖鎖を遊離できる酵素が、O−グリコシダーゼであることを特徴とする請求項8記載の糖鎖試料の製造方法。
【請求項11】
前記第1遊離工程では、複合糖質よりO−結合型糖鎖を遊離するものである請求項1ないし3いずれか1項に記載の糖鎖試料の製造方法。
【請求項12】
前記第1遊離工程では、複合糖質をO−結合型糖鎖のみを遊離させることの可能な酵素で処理するものである請求項11記載の糖鎖試料の製造方法。
【請求項13】
O−結合型糖鎖を遊離できる酵素が、O−グリコシダーゼであることを特徴とする請求項12記載の糖鎖試料の製造方法。
【請求項14】
前記第2遊離工程は、前記遊離工程後の前記複合糖質の残渣を、さらにN−結合型糖鎖を遊離させることが可能な化学処理、または−結合型糖鎖を遊離させることが可能な酵素処理するものである請求項11ないし13いずれか1項に記載の糖鎖試料の製造方法。
【請求項15】
N−結合型糖鎖を遊離できる化学処理が、ヒドラジン分解またはアルカリ分解であることを特徴とする請求項14記載の糖鎖試料の製造方法。
【請求項16】
前記酵素がエンド型グリコシダーゼであること請求項14記載の糖鎖試料の製造方法。
【請求項17】
前記エンド型グリコシダーゼが、ペプチド:N−グルカナーゼ、エンド−β−N−汗散るグルコサミニダーゼ、エンド−β−マンノシダーゼ、から選ばれる少なくとも1つである請求16記載の糖鎖試料の製造方法。
【図1】




【公開番号】特開2012−189439(P2012−189439A)
【公開日】平成24年10月4日(2012.10.4)
【国際特許分類】
【出願番号】特願2011−52987(P2011−52987)
【出願日】平成23年3月10日(2011.3.10)
【出願人】(000002141)住友ベークライト株式会社 (2,927)
【Fターム(参考)】
【公開日】平成24年10月4日(2012.10.4)
【国際特許分類】
【出願日】平成23年3月10日(2011.3.10)
【出願人】(000002141)住友ベークライト株式会社 (2,927)
【Fターム(参考)】
[ Back to top ]

