糖鎖試料調製方法
【課題】糖タンパク質に付加しているO−結合型糖鎖を、穏和な条件で、危険な試薬を用いずに遊離させる手段を提供すること。また、遊離されたO−結合型糖鎖を簡単な操作で精製、ラベル化するための手段を提供すること。
【解決手段】 糖タンパク質溶液を、ヒドラジド基を有する固相担体と混合してインキュベートして糖タンパク質からO−結合型糖鎖を遊離させる工程、溶液のpHを6以下に調整して加熱することにより、遊離した糖鎖と固相担体をヒドラゾン結合により結合させる工程、固相担体に結合しなかった莢雑物を洗浄除去する工程、アミノオキシ基を有する化合物を作用させて、ヒドラゾン−オキシム交換反応により糖鎖を固相担体から切り離しつつ前記化合物に結合させる工程とを含む糖鎖試料調製方法。
【解決手段】 糖タンパク質溶液を、ヒドラジド基を有する固相担体と混合してインキュベートして糖タンパク質からO−結合型糖鎖を遊離させる工程、溶液のpHを6以下に調整して加熱することにより、遊離した糖鎖と固相担体をヒドラゾン結合により結合させる工程、固相担体に結合しなかった莢雑物を洗浄除去する工程、アミノオキシ基を有する化合物を作用させて、ヒドラゾン−オキシム交換反応により糖鎖を固相担体から切り離しつつ前記化合物に結合させる工程とを含む糖鎖試料調製方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、糖タンパク質から糖鎖、特にO−結合型糖鎖を遊離させる方法に関する。
【背景技術】
【0002】
生体高分子とは、糖鎖、糖タンパク、糖ペプチド、ペプチド、オリゴペプチド、タンパク、核酸、脂質などの総称である。
また、これら生体高分子は、医学、細胞工学、臓器工学などのバイオテクノロジー分野において重要な役割を担っており、これら物質による生体反応の制御機構を明らかにすることはバイオテクノロジー分野の発展に繋がることになる。
この中でも、糖鎖は、非常に多様性に富んでおり、天然に存在する生物が有する様々な機能に関与する物質である。糖鎖は生体内でタンパク質や脂質などに結合した複合糖質として存在することが多く、生体内の重要な構成成分の一つである。生体内の糖鎖は細胞間情報伝達,タンパク質の機能や相互作用の調整などに深く関わっていることが明らかになりつつある。
なお、糖鎖とは、グルコース,ガラクトース,マンノース,フコース,キシロース,N−アセチルグルコサミン,N−アセチルガラクトサミン,シアル酸などの単糖およびこれらの誘導体がグリコシド結合によって鎖状に結合した分子の総称である。
例えば、糖鎖を有する生体高分子としては、細胞の安定化に寄与する植物細胞の細胞壁のプロテオグリカン、細胞の分化、増殖、接着、移動等に影響を与える糖脂質、及び細胞間相互作用や細胞認識に関与している糖タンパク質等が挙げられる。これらの生体高分子に含まれる糖鎖が、この生体高分子と互いに機能を代行、補助、増幅、調節、あるいは阻害しあいながら高度で精密な生体反応を制御する機構が次第に明らかにされつつある。さらに、このような糖鎖と細胞の分化増殖、細胞接着、免疫、及び細胞の癌化との関係が明確にされれば、この糖鎖工学と、医学、細胞工学、あるいは臓器工学とを密接に関連させて新たな展開を図ることが期待できる。
【0003】
O−結合型糖鎖(O−型糖鎖、O−グリカン)は、タンパク質のセリン、スレオニン残基に結合している糖鎖であり、ムチンに多く見られることからムチン型糖鎖とも呼称される。ムチン上の糖鎖は癌との関連も指摘されており、その構造と機能を調べることは学術にみならず産業的にも重要となってきている(非特許文献1)。しかし、N−結合型糖鎖(N−グリカン)の構造と機能に関する報告が比較的多いのに対し、O−結合型糖鎖の研究は進んでいないのが実情である。その原因の一つとして、O−結合型糖鎖を糖タンパク質コアから効率よく切り出す方法が確立されていないことが挙げられる。N−結合型糖鎖はN−グリコシダーゼで網羅的かつ高効率に切り出すことが可能であるが、O−結合型糖鎖の切り出しには無水ヒドラジンを使用したヒドラジン分解に代表される化学的手法を適用することが多い。ところがヒドラジンは毒性が強く、取り扱う際に細心の注意を必要とすることや、ヒドラジンの留去に真空装置を必要とすることなど、操作が煩雑で効率が低いことが問題となっている。さらに、ヒドラジン分解で遊離された糖鎖試料には莢雑物が含まれており、糖鎖を分析するためには精製作業が必要であるが、これらの操作は非常に煩雑である。
【0004】
【非特許文献1】「ポストゲノム時代の糖鎖生物学がわかる」 谷口直之編、p.37〜43、羊土社、2002年
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、糖タンパク質に付加しているO−結合型糖鎖を、穏和な条件で、危険な試薬を用いずに遊離させる手段を提供することを目的とする。また本発明は、遊離されたO−結合型糖鎖を簡単な操作で精製、ラベル化するための手段を提供することを目的とする。
【課題を解決するための手段】
【0006】
本発明は、
(1)糖タンパク質からO−結合型糖鎖を遊離させる方法であって、糖タンパク質溶液を、ヒドラジド基を有する固相担体と混合してインキュベートすることを特徴とする糖鎖試料調製方法、
(2)前記固相担体が、乾燥重量1mgあたり0.5μmol以上のヒドラジド基を有するポリマー粒子である(1)記載の糖鎖試料調製方法、
(3)前記固相担体が(式1)で表される構造を有するポリマー粒子である(1)又は(2)記載の糖鎖試料調製方法、
【化1】

(R1,R2は−O−,−S−,−NH−,−CO−,−CONH−で中断されてもよい炭素数1〜20の炭化水素鎖,R3,R4,R5はH,CH3,または炭素数2〜5の炭化水素鎖を示す。)
(4)前記固相担体が(式2)で表される構造を有するポリマー粒子である(1)又は(2)記載の試料調製方法、
【化2】

(5)前記糖タンパク質溶液のpHが5以上9以下である(1)〜(4)いずれか記載の糖鎖試料調製方法、
(6)前記インキュベートが4℃以上90℃以下の条件で、5分以上24時間以下の時間行われる(1)〜(5)いずれか記載の糖鎖試料調製方法、
(7)前記インキュベートが20℃以上65℃以下の条件で、1時間以上16時間以下の時間行われる(6)記載の糖鎖試料調製方法、
(8)(1)〜(7)いずれか記載の方法でO−結合型糖鎖を遊離させたのち、
溶液のpHを5以下に調整して加熱することにより、遊離した糖鎖と固相担体をヒドラゾン結合により結合させる工程と、
固相担体に結合しなかった莢雑物を洗浄除去する工程と、
アミノオキシ基を有する化合物を作用させて、ヒドラゾン−オキシム交換反応により糖鎖を固相担体から切り離しつつ前記化合物に結合させる工程とを含むことを特徴とする糖鎖試料調製方法、
(9)アミノオキシ基を有する化合物が下記から選ばれた物質またはその塩である(8)記載の糖鎖試料調製方法、
O-benzylhydroxylamine;O-phenylhydroxylamine; O-(2,3,4,5,6-pentafluorobenzyl)hydroxylamine; O-(4-nitrobenzyl)hydroxylamine; 2-aminooxypyridine; 2-aminooxymethylpyridine; 4-[(aminooxyacetyl)amino]benzoic acid methyl ester; 4-[(aminooxyacetyl)amino]benzoic acid ethyl ester; 4-[(aminooxyacetyl)amino]benzoic acid n-butyl ester.
(10)アミノオキシ基を有する化合物がアルギニン残基、トリプトファン残基、フェニルアラニン残基、チロシン残基、システイン残基およびこれら誘導体の少なくとも一つからなる部分を含む(8)記載の糖鎖試料調製方法、
(11)アミノオキシ基を有する化合物が(式3)で表される構造を有する(8)記載の糖鎖試料調製方法、
【化3】

である。
【発明の効果】
【0007】
本発明の方法によれば、簡単な操作、穏和な条件で、有害な試薬を用いずに糖タンパク質からO−結合型糖鎖を遊離することが可能になる。同時に、遊離されたO−結合型糖鎖の精製とラベル化を行うことが可能になる。
【発明を実施するための最良の形態】
【0008】
以下、本発明の実施形態について説明する。
(測定に供する試料)
本発明において使用する糖鎖を含む試料は、例えば全血、血清、血漿、尿、唾液、細胞、組織などの生体試料を用いることができる。植物由来の試料を用いることもできる。また、精製された、あるいは未精製の糖タンパク質を用いることができる。試料は脱脂、脱塩、タンパク質分画などの方法により前処理されていてもよい。試料は水あるいは緩衝液に溶解されていることが好ましい。試料溶液はpH5以上9以下であることが好ましい。試料溶液が極端に酸性あるいは塩基性であると、試料に含まれる糖鎖が分解するおそれがあるので好ましくない。
【0009】
(固相担体)
本発明に使用するヒドラジド基を有する固相担体としては、ポリマー粒子を用いることが好ましい。ポリマー粒子は、少なくとも表面の一部にヒドラジド基を有した固体あるいはゲル粒子であることが好ましい。ポリマー粒子としては、式1又は式2で表される構造のものが好ましいポリマー粒子が固体粒子あるいはゲル粒子であれば、O−結合型糖鎖を遊離させたのち、遠心分離やろ過などの手段によって容易に回収することができる。また,ポリマー粒子をカラムに充填して用いることも可能である。カラムに充填して用いる方法は、特に連続操作化の観点から重要となる。反応容器としてフィルタープレート(例えばMillipore社製 MultiScreen Solvinert Filter Plate)を用いることにより、複数のサンプルを同時に処理することが可能となり、糖鎖試料調製のスループットが大幅に向上される。
【0010】
ポリマー粒子の形状は特に限定しないが,球状またはそれに類する形状が好ましい。ポリマー粒子が球状の場合、平均粒径は好ましくは0.05〜1000μmであり、より好ましくは0.05〜200μmであり、さらに好ましくは0.1〜200μmであり、最も好ましくは0.1〜100μmである。平均粒径が下限値未満では,ポリマー粒子をカラムに充填して用いる際,通液性が悪くなるために大きな圧力を加える必要がある。また、ポリマー粒子を遠心分離やろ過で回収することも困難となる。平均粒径が上限値を超えると、ポリマー粒子と試料溶液の接触面積が少なくなり、遊離効率が低下する。
【0011】
(O−結合型糖鎖の遊離)
上記固相担体に試料溶液を添加して所定の温度で処理することにより、O−結合型糖鎖をタンパク質コアから遊離させる。固相担体をチューブ、フィルタープレート、カラム等の容器にとり、試料溶液を添加し、所定の反応温度で反応させる。反応温度は好ましくは4〜90℃、より好ましくは20〜65℃、最も好ましくは40〜65℃である。反応時間は5分〜24時間が好ましく、1時間〜16時間がより好ましい。反応時は反応容器を静置してもよく、振盪してもよい。反応終了後、遠心分離あるいはフィルター操作により固相担体と溶液を分離し、溶液を回収して分析に供する。
【0012】
(O−結合型糖鎖の精製、ラベル化および分析)
上記操作で得られたO−結合型糖鎖を含む溶液は、PA化に代表される還元末端ラベルを施したのち、あるいはそのまま、質量分析やHPLCなど各種分析に供することができる。
糖鎖は生体内物質のなかで唯一、アルデヒド基をもつ物質である。すなわち、糖鎖は水溶液などの状態で環状のヘミアセタール型と、非環状型のアルデヒド型とが平衡で存在する。タンパク質や核酸,脂質など糖鎖以外の生体内物質にはアルデヒド基が含まれていない。このことから、アルデヒド基と特異的に反応して安定な結合を形成する官能基を有する捕捉担体を利用すれば、糖鎖のみを選択的に捕捉することが可能である。本発明で用いるポリマー粒子はヒドラジド基を有することから、糖鎖を捕捉することができる。
【0013】
すなわち、同一のポリマー粒子を用いて、(1)O−結合型糖鎖をタンパク質コアから遊離させ、(2)遊離した糖鎖をポリマー粒子に捕捉する、という操作が可能となる。糖鎖をポリマー粒子に捕捉する際の反応液のpHは、pH2〜6が好ましく、pH3〜6がより好ましく、pH3.5〜5.5が最も好ましい。酢酸/アセトニトリル溶液を加えることにより、反応液を上記のpHに調整することができる。捕捉反応の温度は、50〜95℃が好ましく、60〜90℃がより好ましく、70〜90℃が最も好ましい。捕捉反応時、反応容器を開放して加熱操作を行うことにより、溶媒を蒸発させながら反応を進め、最終的に乾固させることにより、効率よく捕捉反応を行うことができる。
糖鎖をポリマー粒子に捕捉させた後、粒子を洗浄液で洗浄することにより、捕捉された糖鎖以外の莢雑物を排除することが好ましい。
【0014】
洗浄操作後、アミノオキシ基を有する化合物を作用させることにより、ヒドラゾン−オキシム交換反応によって糖鎖がポリマー粒子から切り離され、同時にアミノオキシ化合物によってラベル化される。
【0015】
アミノオキシ基を有する化合物としては、下記から選ばれた物質またはその塩であることが好ましい。
O-benzylhydroxylamine;O-phenylhydroxylamine; O-(2,3,4,5,6-pentafluorobenzyl)hydroxylamine; O-(4-nitrobenzyl)hydroxylamine; 2-aminooxypyridine; 2-aminooxymethylpyridine; 4-[(aminooxyacetyl)amino]benzoic acid methyl ester; 4-[(aminooxyacetyl)amino]benzoic acid ethyl ester; 4-[(aminooxyacetyl)amino]benzoic acid n-butyl ester.
【0016】
アミノオキシ基を有する化合物は、アルギニン残基、トリプトファン残基、フェニルアラニン残基、チロシン残基、システイン残基およびこれら誘導体の少なくとも一つからなる部分を含むことが好ましい。特に下記(式3)で表される構造を有するものが好ましい。
【0017】
交換反応時の反応液のpHは、pH2〜7が好ましく、pH3〜6がより好ましく、pH3.5〜5.5が最も好ましい。酢酸/アセトニトリル溶液を加えることにより、反応液を上記のpHに調整することができる。交換反応時の温度は、50〜95℃が好ましく、60〜90℃がより好ましく、70〜90℃が最も好ましい。交換反応時、反応容器を開放して加熱操作を行うことにより、溶媒を蒸発させながら反応を進め、最終的に乾固させることにより、効率よく交換反応を行うことができる。
回収したラベル化糖鎖溶液はそのまま、あるいは、過剰に含まれるアミノオキシ化合物を除去したのち、質量分析法やHPLCなどの分析手段によって分析することができる。
【実施例】
【0018】
以下の実験例にて、本発明を具体的に説明するが、本発明はこれらの実験例に限定されることはない。
(工程1:糖タンパク質溶液の調製)
ウシ胃粘膜由来ムチン(Type III, Sigma-Aldrich製)を20mg/mLの濃度で1mM重炭酸アンモニウム水溶液に溶解した。
(工程2:固相担体によるO−結合型糖鎖の遊離)
実験サンプルとして、(式2)の構造を有するヒドラジド基含有ポリマー粒子(住友ベークライト株式会社製、BS-X4104S)5mgをサンプルチューブ3本に量り取り、それぞれに上記ムチン溶液20μLを加えた。対照サンプルとして、ムチン溶液単独(ポリマー粒子なし)を入れたチューブを3本準備した。
実験サンプルおよび対照サンプルのチューブを振盪機能付きのオーブンに入れ、60℃、37℃、室温(23℃)の各温度で16時間振盪反応させた。
【0019】
(工程3:糖鎖の精製およびラベル化)
新しいチューブ3本にポリマー粒子5mgをとり、これに対照サンプルの内容物を全量加えた。これらのチューブと、実験サンプルのチューブそれぞれに2%酢酸/アセトニトリル180μLを加え、80℃で1時間加熱することにより溶媒を乾固させた。本工程で溶液中の糖鎖がポリマー粒子上のヒドラジド基に捕捉される。
ポリマー粒子を2Mグアニジン塩酸塩水溶液、純水、1%トリエチルアミン/メタノール溶液、メタノールで順次洗浄したのち、10%無水酢酸/メタノール溶液100μLを加え、30分間静置し、ポリマー粒子の余剰ヒドラジド基をキャップした。ポリマー粒子をメタノール、純水で順次洗浄した。
ポリマー粒子に20mM O-ベンジルヒドロキシルアミン (O-benzylhydroxylamine) 水溶液20μLおよび2%酢酸/アセトニトリル溶液180μLを加え、80℃で1時間加熱することにより溶媒を乾固させた。本工程で、ポリマー粒子に捕捉されていた糖鎖が、ヒドラゾン−オキシム交換反応によってポリマー粒子から切り離され、同時にO-ベンジルヒドロキシルアミンによってラベル化される。ポリマー粒子を純水50μLでリンスしてラベル化糖鎖を溶解し、遠心後、上清を回収した。
【0020】
(工程4:MALDI-TOF MS測定)
得られた溶液をマトリックス支援レーザーイオン化−飛行時間型質量分析器(MALDI-TOF-MS)(Bruker社製 'autoflex III')により分析した。溶液をマトリックス溶液(2,5-ジヒドロキシ安息香酸の10mg/mL水溶液)で10倍希釈したのち、1μLを試料台にスポット、乾燥・結晶化させたのち測定した。測定はポジティブイオン検出モード、リフレクトロンモードにて行い、シグナルはナトリウムイオン付加体([M+Na]+)で検出された。
【0021】
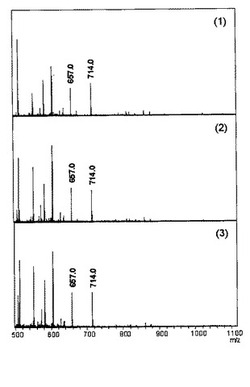
図1には実験サンプル、図2には対照サンプルのMALDI-TOF MSチャートを示す。実験サンプルのチャートでは、いずれの温度条件でもm/z657.0 および714.0 に顕著なピークが観測された。これらの数値からO-ベンジルヒドロキシルアミンの分子量を差し引き、糖鎖構造データベース ‘GlycoMod Tool’を用いて糖鎖組成を推定した。m/z657.0は (Hex)1(HexNAc)1 (Deoxyhexose)1 、m/z714.0は(Hex)1(HexNAc)2 に帰属された(略称はそれぞれHex:ヘキソース、HexNAc:N-アセチルヘキソサミン、Deoxyhexose:フコースを表す)。
一方、対照サンプルのチャートではこれらのピークはほとんど観測されなかった。
以上の結果より、本発明の方法でO−結合型糖鎖が遊離され、かつ、O-ベンジルヒドロキシルアミンによってラベル化されることが示された。
【産業上の利用可能性】
【0022】
本発明の糖鎖解析方法を用いると、簡単な操作、穏和な条件で、有害な試薬を用いずに糖タンパク質からO−結合型糖鎖を遊離することが可能になる。同時に、遊離されたO−結合型糖鎖の精製とラベル化を行うことが可能になる。本発明によれば、O−結合型糖鎖の遊離・精製・ラベル化を1チューブ(1カラム)で行うキットに応用展開が可能であり、糖鎖研究用ツール、糖鎖を利用した診断キットなどとしての産業化が可能である。
【図面の簡単な説明】
【0023】
【図1】実験サンプルのMALDI-TOF MSチャートを示す。図中(1)は工程1において60℃、(2)は37℃、(3)は室温(23℃)で処理したサンプルである。
【図2】対照サンプルのMALDI-TOF MSチャートを示す。図中(1)は工程1において60℃、(2)は37℃、(3)は室温(23℃)で処理したサンプルである。
【技術分野】
【0001】
本発明は、糖タンパク質から糖鎖、特にO−結合型糖鎖を遊離させる方法に関する。
【背景技術】
【0002】
生体高分子とは、糖鎖、糖タンパク、糖ペプチド、ペプチド、オリゴペプチド、タンパク、核酸、脂質などの総称である。
また、これら生体高分子は、医学、細胞工学、臓器工学などのバイオテクノロジー分野において重要な役割を担っており、これら物質による生体反応の制御機構を明らかにすることはバイオテクノロジー分野の発展に繋がることになる。
この中でも、糖鎖は、非常に多様性に富んでおり、天然に存在する生物が有する様々な機能に関与する物質である。糖鎖は生体内でタンパク質や脂質などに結合した複合糖質として存在することが多く、生体内の重要な構成成分の一つである。生体内の糖鎖は細胞間情報伝達,タンパク質の機能や相互作用の調整などに深く関わっていることが明らかになりつつある。
なお、糖鎖とは、グルコース,ガラクトース,マンノース,フコース,キシロース,N−アセチルグルコサミン,N−アセチルガラクトサミン,シアル酸などの単糖およびこれらの誘導体がグリコシド結合によって鎖状に結合した分子の総称である。
例えば、糖鎖を有する生体高分子としては、細胞の安定化に寄与する植物細胞の細胞壁のプロテオグリカン、細胞の分化、増殖、接着、移動等に影響を与える糖脂質、及び細胞間相互作用や細胞認識に関与している糖タンパク質等が挙げられる。これらの生体高分子に含まれる糖鎖が、この生体高分子と互いに機能を代行、補助、増幅、調節、あるいは阻害しあいながら高度で精密な生体反応を制御する機構が次第に明らかにされつつある。さらに、このような糖鎖と細胞の分化増殖、細胞接着、免疫、及び細胞の癌化との関係が明確にされれば、この糖鎖工学と、医学、細胞工学、あるいは臓器工学とを密接に関連させて新たな展開を図ることが期待できる。
【0003】
O−結合型糖鎖(O−型糖鎖、O−グリカン)は、タンパク質のセリン、スレオニン残基に結合している糖鎖であり、ムチンに多く見られることからムチン型糖鎖とも呼称される。ムチン上の糖鎖は癌との関連も指摘されており、その構造と機能を調べることは学術にみならず産業的にも重要となってきている(非特許文献1)。しかし、N−結合型糖鎖(N−グリカン)の構造と機能に関する報告が比較的多いのに対し、O−結合型糖鎖の研究は進んでいないのが実情である。その原因の一つとして、O−結合型糖鎖を糖タンパク質コアから効率よく切り出す方法が確立されていないことが挙げられる。N−結合型糖鎖はN−グリコシダーゼで網羅的かつ高効率に切り出すことが可能であるが、O−結合型糖鎖の切り出しには無水ヒドラジンを使用したヒドラジン分解に代表される化学的手法を適用することが多い。ところがヒドラジンは毒性が強く、取り扱う際に細心の注意を必要とすることや、ヒドラジンの留去に真空装置を必要とすることなど、操作が煩雑で効率が低いことが問題となっている。さらに、ヒドラジン分解で遊離された糖鎖試料には莢雑物が含まれており、糖鎖を分析するためには精製作業が必要であるが、これらの操作は非常に煩雑である。
【0004】
【非特許文献1】「ポストゲノム時代の糖鎖生物学がわかる」 谷口直之編、p.37〜43、羊土社、2002年
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、糖タンパク質に付加しているO−結合型糖鎖を、穏和な条件で、危険な試薬を用いずに遊離させる手段を提供することを目的とする。また本発明は、遊離されたO−結合型糖鎖を簡単な操作で精製、ラベル化するための手段を提供することを目的とする。
【課題を解決するための手段】
【0006】
本発明は、
(1)糖タンパク質からO−結合型糖鎖を遊離させる方法であって、糖タンパク質溶液を、ヒドラジド基を有する固相担体と混合してインキュベートすることを特徴とする糖鎖試料調製方法、
(2)前記固相担体が、乾燥重量1mgあたり0.5μmol以上のヒドラジド基を有するポリマー粒子である(1)記載の糖鎖試料調製方法、
(3)前記固相担体が(式1)で表される構造を有するポリマー粒子である(1)又は(2)記載の糖鎖試料調製方法、
【化1】

(R1,R2は−O−,−S−,−NH−,−CO−,−CONH−で中断されてもよい炭素数1〜20の炭化水素鎖,R3,R4,R5はH,CH3,または炭素数2〜5の炭化水素鎖を示す。)
(4)前記固相担体が(式2)で表される構造を有するポリマー粒子である(1)又は(2)記載の試料調製方法、
【化2】

(5)前記糖タンパク質溶液のpHが5以上9以下である(1)〜(4)いずれか記載の糖鎖試料調製方法、
(6)前記インキュベートが4℃以上90℃以下の条件で、5分以上24時間以下の時間行われる(1)〜(5)いずれか記載の糖鎖試料調製方法、
(7)前記インキュベートが20℃以上65℃以下の条件で、1時間以上16時間以下の時間行われる(6)記載の糖鎖試料調製方法、
(8)(1)〜(7)いずれか記載の方法でO−結合型糖鎖を遊離させたのち、
溶液のpHを5以下に調整して加熱することにより、遊離した糖鎖と固相担体をヒドラゾン結合により結合させる工程と、
固相担体に結合しなかった莢雑物を洗浄除去する工程と、
アミノオキシ基を有する化合物を作用させて、ヒドラゾン−オキシム交換反応により糖鎖を固相担体から切り離しつつ前記化合物に結合させる工程とを含むことを特徴とする糖鎖試料調製方法、
(9)アミノオキシ基を有する化合物が下記から選ばれた物質またはその塩である(8)記載の糖鎖試料調製方法、
O-benzylhydroxylamine;O-phenylhydroxylamine; O-(2,3,4,5,6-pentafluorobenzyl)hydroxylamine; O-(4-nitrobenzyl)hydroxylamine; 2-aminooxypyridine; 2-aminooxymethylpyridine; 4-[(aminooxyacetyl)amino]benzoic acid methyl ester; 4-[(aminooxyacetyl)amino]benzoic acid ethyl ester; 4-[(aminooxyacetyl)amino]benzoic acid n-butyl ester.
(10)アミノオキシ基を有する化合物がアルギニン残基、トリプトファン残基、フェニルアラニン残基、チロシン残基、システイン残基およびこれら誘導体の少なくとも一つからなる部分を含む(8)記載の糖鎖試料調製方法、
(11)アミノオキシ基を有する化合物が(式3)で表される構造を有する(8)記載の糖鎖試料調製方法、
【化3】

である。
【発明の効果】
【0007】
本発明の方法によれば、簡単な操作、穏和な条件で、有害な試薬を用いずに糖タンパク質からO−結合型糖鎖を遊離することが可能になる。同時に、遊離されたO−結合型糖鎖の精製とラベル化を行うことが可能になる。
【発明を実施するための最良の形態】
【0008】
以下、本発明の実施形態について説明する。
(測定に供する試料)
本発明において使用する糖鎖を含む試料は、例えば全血、血清、血漿、尿、唾液、細胞、組織などの生体試料を用いることができる。植物由来の試料を用いることもできる。また、精製された、あるいは未精製の糖タンパク質を用いることができる。試料は脱脂、脱塩、タンパク質分画などの方法により前処理されていてもよい。試料は水あるいは緩衝液に溶解されていることが好ましい。試料溶液はpH5以上9以下であることが好ましい。試料溶液が極端に酸性あるいは塩基性であると、試料に含まれる糖鎖が分解するおそれがあるので好ましくない。
【0009】
(固相担体)
本発明に使用するヒドラジド基を有する固相担体としては、ポリマー粒子を用いることが好ましい。ポリマー粒子は、少なくとも表面の一部にヒドラジド基を有した固体あるいはゲル粒子であることが好ましい。ポリマー粒子としては、式1又は式2で表される構造のものが好ましいポリマー粒子が固体粒子あるいはゲル粒子であれば、O−結合型糖鎖を遊離させたのち、遠心分離やろ過などの手段によって容易に回収することができる。また,ポリマー粒子をカラムに充填して用いることも可能である。カラムに充填して用いる方法は、特に連続操作化の観点から重要となる。反応容器としてフィルタープレート(例えばMillipore社製 MultiScreen Solvinert Filter Plate)を用いることにより、複数のサンプルを同時に処理することが可能となり、糖鎖試料調製のスループットが大幅に向上される。
【0010】
ポリマー粒子の形状は特に限定しないが,球状またはそれに類する形状が好ましい。ポリマー粒子が球状の場合、平均粒径は好ましくは0.05〜1000μmであり、より好ましくは0.05〜200μmであり、さらに好ましくは0.1〜200μmであり、最も好ましくは0.1〜100μmである。平均粒径が下限値未満では,ポリマー粒子をカラムに充填して用いる際,通液性が悪くなるために大きな圧力を加える必要がある。また、ポリマー粒子を遠心分離やろ過で回収することも困難となる。平均粒径が上限値を超えると、ポリマー粒子と試料溶液の接触面積が少なくなり、遊離効率が低下する。
【0011】
(O−結合型糖鎖の遊離)
上記固相担体に試料溶液を添加して所定の温度で処理することにより、O−結合型糖鎖をタンパク質コアから遊離させる。固相担体をチューブ、フィルタープレート、カラム等の容器にとり、試料溶液を添加し、所定の反応温度で反応させる。反応温度は好ましくは4〜90℃、より好ましくは20〜65℃、最も好ましくは40〜65℃である。反応時間は5分〜24時間が好ましく、1時間〜16時間がより好ましい。反応時は反応容器を静置してもよく、振盪してもよい。反応終了後、遠心分離あるいはフィルター操作により固相担体と溶液を分離し、溶液を回収して分析に供する。
【0012】
(O−結合型糖鎖の精製、ラベル化および分析)
上記操作で得られたO−結合型糖鎖を含む溶液は、PA化に代表される還元末端ラベルを施したのち、あるいはそのまま、質量分析やHPLCなど各種分析に供することができる。
糖鎖は生体内物質のなかで唯一、アルデヒド基をもつ物質である。すなわち、糖鎖は水溶液などの状態で環状のヘミアセタール型と、非環状型のアルデヒド型とが平衡で存在する。タンパク質や核酸,脂質など糖鎖以外の生体内物質にはアルデヒド基が含まれていない。このことから、アルデヒド基と特異的に反応して安定な結合を形成する官能基を有する捕捉担体を利用すれば、糖鎖のみを選択的に捕捉することが可能である。本発明で用いるポリマー粒子はヒドラジド基を有することから、糖鎖を捕捉することができる。
【0013】
すなわち、同一のポリマー粒子を用いて、(1)O−結合型糖鎖をタンパク質コアから遊離させ、(2)遊離した糖鎖をポリマー粒子に捕捉する、という操作が可能となる。糖鎖をポリマー粒子に捕捉する際の反応液のpHは、pH2〜6が好ましく、pH3〜6がより好ましく、pH3.5〜5.5が最も好ましい。酢酸/アセトニトリル溶液を加えることにより、反応液を上記のpHに調整することができる。捕捉反応の温度は、50〜95℃が好ましく、60〜90℃がより好ましく、70〜90℃が最も好ましい。捕捉反応時、反応容器を開放して加熱操作を行うことにより、溶媒を蒸発させながら反応を進め、最終的に乾固させることにより、効率よく捕捉反応を行うことができる。
糖鎖をポリマー粒子に捕捉させた後、粒子を洗浄液で洗浄することにより、捕捉された糖鎖以外の莢雑物を排除することが好ましい。
【0014】
洗浄操作後、アミノオキシ基を有する化合物を作用させることにより、ヒドラゾン−オキシム交換反応によって糖鎖がポリマー粒子から切り離され、同時にアミノオキシ化合物によってラベル化される。
【0015】
アミノオキシ基を有する化合物としては、下記から選ばれた物質またはその塩であることが好ましい。
O-benzylhydroxylamine;O-phenylhydroxylamine; O-(2,3,4,5,6-pentafluorobenzyl)hydroxylamine; O-(4-nitrobenzyl)hydroxylamine; 2-aminooxypyridine; 2-aminooxymethylpyridine; 4-[(aminooxyacetyl)amino]benzoic acid methyl ester; 4-[(aminooxyacetyl)amino]benzoic acid ethyl ester; 4-[(aminooxyacetyl)amino]benzoic acid n-butyl ester.
【0016】
アミノオキシ基を有する化合物は、アルギニン残基、トリプトファン残基、フェニルアラニン残基、チロシン残基、システイン残基およびこれら誘導体の少なくとも一つからなる部分を含むことが好ましい。特に下記(式3)で表される構造を有するものが好ましい。
【0017】
交換反応時の反応液のpHは、pH2〜7が好ましく、pH3〜6がより好ましく、pH3.5〜5.5が最も好ましい。酢酸/アセトニトリル溶液を加えることにより、反応液を上記のpHに調整することができる。交換反応時の温度は、50〜95℃が好ましく、60〜90℃がより好ましく、70〜90℃が最も好ましい。交換反応時、反応容器を開放して加熱操作を行うことにより、溶媒を蒸発させながら反応を進め、最終的に乾固させることにより、効率よく交換反応を行うことができる。
回収したラベル化糖鎖溶液はそのまま、あるいは、過剰に含まれるアミノオキシ化合物を除去したのち、質量分析法やHPLCなどの分析手段によって分析することができる。
【実施例】
【0018】
以下の実験例にて、本発明を具体的に説明するが、本発明はこれらの実験例に限定されることはない。
(工程1:糖タンパク質溶液の調製)
ウシ胃粘膜由来ムチン(Type III, Sigma-Aldrich製)を20mg/mLの濃度で1mM重炭酸アンモニウム水溶液に溶解した。
(工程2:固相担体によるO−結合型糖鎖の遊離)
実験サンプルとして、(式2)の構造を有するヒドラジド基含有ポリマー粒子(住友ベークライト株式会社製、BS-X4104S)5mgをサンプルチューブ3本に量り取り、それぞれに上記ムチン溶液20μLを加えた。対照サンプルとして、ムチン溶液単独(ポリマー粒子なし)を入れたチューブを3本準備した。
実験サンプルおよび対照サンプルのチューブを振盪機能付きのオーブンに入れ、60℃、37℃、室温(23℃)の各温度で16時間振盪反応させた。
【0019】
(工程3:糖鎖の精製およびラベル化)
新しいチューブ3本にポリマー粒子5mgをとり、これに対照サンプルの内容物を全量加えた。これらのチューブと、実験サンプルのチューブそれぞれに2%酢酸/アセトニトリル180μLを加え、80℃で1時間加熱することにより溶媒を乾固させた。本工程で溶液中の糖鎖がポリマー粒子上のヒドラジド基に捕捉される。
ポリマー粒子を2Mグアニジン塩酸塩水溶液、純水、1%トリエチルアミン/メタノール溶液、メタノールで順次洗浄したのち、10%無水酢酸/メタノール溶液100μLを加え、30分間静置し、ポリマー粒子の余剰ヒドラジド基をキャップした。ポリマー粒子をメタノール、純水で順次洗浄した。
ポリマー粒子に20mM O-ベンジルヒドロキシルアミン (O-benzylhydroxylamine) 水溶液20μLおよび2%酢酸/アセトニトリル溶液180μLを加え、80℃で1時間加熱することにより溶媒を乾固させた。本工程で、ポリマー粒子に捕捉されていた糖鎖が、ヒドラゾン−オキシム交換反応によってポリマー粒子から切り離され、同時にO-ベンジルヒドロキシルアミンによってラベル化される。ポリマー粒子を純水50μLでリンスしてラベル化糖鎖を溶解し、遠心後、上清を回収した。
【0020】
(工程4:MALDI-TOF MS測定)
得られた溶液をマトリックス支援レーザーイオン化−飛行時間型質量分析器(MALDI-TOF-MS)(Bruker社製 'autoflex III')により分析した。溶液をマトリックス溶液(2,5-ジヒドロキシ安息香酸の10mg/mL水溶液)で10倍希釈したのち、1μLを試料台にスポット、乾燥・結晶化させたのち測定した。測定はポジティブイオン検出モード、リフレクトロンモードにて行い、シグナルはナトリウムイオン付加体([M+Na]+)で検出された。
【0021】
図1には実験サンプル、図2には対照サンプルのMALDI-TOF MSチャートを示す。実験サンプルのチャートでは、いずれの温度条件でもm/z657.0 および714.0 に顕著なピークが観測された。これらの数値からO-ベンジルヒドロキシルアミンの分子量を差し引き、糖鎖構造データベース ‘GlycoMod Tool’を用いて糖鎖組成を推定した。m/z657.0は (Hex)1(HexNAc)1 (Deoxyhexose)1 、m/z714.0は(Hex)1(HexNAc)2 に帰属された(略称はそれぞれHex:ヘキソース、HexNAc:N-アセチルヘキソサミン、Deoxyhexose:フコースを表す)。
一方、対照サンプルのチャートではこれらのピークはほとんど観測されなかった。
以上の結果より、本発明の方法でO−結合型糖鎖が遊離され、かつ、O-ベンジルヒドロキシルアミンによってラベル化されることが示された。
【産業上の利用可能性】
【0022】
本発明の糖鎖解析方法を用いると、簡単な操作、穏和な条件で、有害な試薬を用いずに糖タンパク質からO−結合型糖鎖を遊離することが可能になる。同時に、遊離されたO−結合型糖鎖の精製とラベル化を行うことが可能になる。本発明によれば、O−結合型糖鎖の遊離・精製・ラベル化を1チューブ(1カラム)で行うキットに応用展開が可能であり、糖鎖研究用ツール、糖鎖を利用した診断キットなどとしての産業化が可能である。
【図面の簡単な説明】
【0023】
【図1】実験サンプルのMALDI-TOF MSチャートを示す。図中(1)は工程1において60℃、(2)は37℃、(3)は室温(23℃)で処理したサンプルである。
【図2】対照サンプルのMALDI-TOF MSチャートを示す。図中(1)は工程1において60℃、(2)は37℃、(3)は室温(23℃)で処理したサンプルである。
【特許請求の範囲】
【請求項1】
糖タンパク質からO−結合型糖鎖を遊離させる方法であって、糖タンパク質溶液を、ヒドラジド基を有する固相担体と混合してインキュベートすることを特徴とする糖鎖試料調製方法。
【請求項2】
前記固相担体が、乾燥重量1mgあたり0.5μmol以上のヒドラジド基を有するポリマー粒子である請求項1記載の糖鎖試料調製方法。
【請求項3】
前記固相担体が下記の(式1)で表される構造を有するポリマー粒子である請求項1又は2記載の糖鎖試料調製方法。
【化1】

(R1,R2は−O−,−S−,−NH−,−CO−,−CONH−で中断されてもよい炭素数1〜20の炭化水素鎖,R3,R4,R5はH,CH3,または炭素数2〜5の炭化水素鎖を示す。)
【請求項4】
前記固相担体が下記の(式2)で表される構造を有するポリマー粒子である請求項1又は2記載の試料調製方法。
【化2】

【請求項5】
前記糖タンパク質溶液のpHが5以上9以下である請求項1〜4いずれか記載の糖鎖試料調製方法。
【請求項6】
前記インキュベートが4℃以上90℃以下の条件で、5分以上24時間以下の時間行われる請求項1〜5いずれか記載の糖鎖試料調製方法。
【請求項7】
前記インキュベートが20℃以上65℃以下の条件で、1時間以上16時間以下の時間行われる請求項6記載の糖鎖試料調製方法。
【請求項8】
請求項1〜7いずれか記載の糖鎖試料調製方法でO−結合型糖鎖を遊離させたのち、溶液のpHを6以下に調整して加熱することにより、遊離した糖鎖と固相担体をヒドラゾン結合により結合させる工程と、
固相担体に結合しなかった莢雑物を洗浄除去する工程と、
アミノオキシ基を有する化合物を作用させて、ヒドラゾン−オキシム交換反応により糖鎖を固相担体から切り離しつつ前記化合物に結合させる工程とを含むことを特徴とする糖鎖試料調製方法。
【請求項9】
前記アミノオキシ基を有する化合物が下記から選ばれた物質またはその塩である請求項8記載の糖鎖試料調製方法。
O-benzylhydroxylamine;O-phenylhydroxylamine; O-(2,3,4,5,6-pentafluorobenzyl)hydroxylamine; O-(4-nitrobenzyl)hydroxylamine; 2-aminooxypyridine; 2-aminooxymethylpyridine; 4-[(aminooxyacetyl)amino]benzoic acid methyl ester; 4-[(aminooxyacetyl)amino]benzoic acid ethyl ester; 4-[(aminooxyacetyl)amino]benzoic acid n-butyl ester.
【請求項10】
前記アミノオキシ基を有する化合物がアルギニン残基、トリプトファン残基、フェニルアラニン残基、チロシン残基、システイン残基およびこれら誘導体の少なくとも一つからなる部分を含む請求項8記載の糖鎖試料調製方法。
【請求項11】
前記アミノオキシ基を有する化合物が下記(式3)で表される構造を有する請求項8記載の糖鎖試料調製方法。
【化3】

【請求項1】
糖タンパク質からO−結合型糖鎖を遊離させる方法であって、糖タンパク質溶液を、ヒドラジド基を有する固相担体と混合してインキュベートすることを特徴とする糖鎖試料調製方法。
【請求項2】
前記固相担体が、乾燥重量1mgあたり0.5μmol以上のヒドラジド基を有するポリマー粒子である請求項1記載の糖鎖試料調製方法。
【請求項3】
前記固相担体が下記の(式1)で表される構造を有するポリマー粒子である請求項1又は2記載の糖鎖試料調製方法。
【化1】

(R1,R2は−O−,−S−,−NH−,−CO−,−CONH−で中断されてもよい炭素数1〜20の炭化水素鎖,R3,R4,R5はH,CH3,または炭素数2〜5の炭化水素鎖を示す。)
【請求項4】
前記固相担体が下記の(式2)で表される構造を有するポリマー粒子である請求項1又は2記載の試料調製方法。
【化2】

【請求項5】
前記糖タンパク質溶液のpHが5以上9以下である請求項1〜4いずれか記載の糖鎖試料調製方法。
【請求項6】
前記インキュベートが4℃以上90℃以下の条件で、5分以上24時間以下の時間行われる請求項1〜5いずれか記載の糖鎖試料調製方法。
【請求項7】
前記インキュベートが20℃以上65℃以下の条件で、1時間以上16時間以下の時間行われる請求項6記載の糖鎖試料調製方法。
【請求項8】
請求項1〜7いずれか記載の糖鎖試料調製方法でO−結合型糖鎖を遊離させたのち、溶液のpHを6以下に調整して加熱することにより、遊離した糖鎖と固相担体をヒドラゾン結合により結合させる工程と、
固相担体に結合しなかった莢雑物を洗浄除去する工程と、
アミノオキシ基を有する化合物を作用させて、ヒドラゾン−オキシム交換反応により糖鎖を固相担体から切り離しつつ前記化合物に結合させる工程とを含むことを特徴とする糖鎖試料調製方法。
【請求項9】
前記アミノオキシ基を有する化合物が下記から選ばれた物質またはその塩である請求項8記載の糖鎖試料調製方法。
O-benzylhydroxylamine;O-phenylhydroxylamine; O-(2,3,4,5,6-pentafluorobenzyl)hydroxylamine; O-(4-nitrobenzyl)hydroxylamine; 2-aminooxypyridine; 2-aminooxymethylpyridine; 4-[(aminooxyacetyl)amino]benzoic acid methyl ester; 4-[(aminooxyacetyl)amino]benzoic acid ethyl ester; 4-[(aminooxyacetyl)amino]benzoic acid n-butyl ester.
【請求項10】
前記アミノオキシ基を有する化合物がアルギニン残基、トリプトファン残基、フェニルアラニン残基、チロシン残基、システイン残基およびこれら誘導体の少なくとも一つからなる部分を含む請求項8記載の糖鎖試料調製方法。
【請求項11】
前記アミノオキシ基を有する化合物が下記(式3)で表される構造を有する請求項8記載の糖鎖試料調製方法。
【化3】

【図1】


【図2】




【図2】


【公開番号】特開2009−216609(P2009−216609A)
【公開日】平成21年9月24日(2009.9.24)
【国際特許分類】
【出願番号】特願2008−61984(P2008−61984)
【出願日】平成20年3月12日(2008.3.12)
【出願人】(000002141)住友ベークライト株式会社 (2,927)
【Fターム(参考)】
【公開日】平成21年9月24日(2009.9.24)
【国際特許分類】
【出願日】平成20年3月12日(2008.3.12)
【出願人】(000002141)住友ベークライト株式会社 (2,927)
【Fターム(参考)】
[ Back to top ]

