糖鎖配列解析方法、プログラム、記録媒体、および糖鎖配列解析装置
【課題】 単一種類の単糖から構成された多糖、および、構造が未知または新規である多糖にも適用できて、簡便、短時間かつ高精度に構造解析が可能な糖鎖配列解析方法を提供する。
【解決手段】
多糖の糖鎖配列解析方法であって、
前記多糖を構成する各単糖内の共有結合、および前記各単糖間の共有結合のうち少なくとも一つの共有結合を、イオン化により非還元末端側から順に壊裂させて測定したマススペクトルのフラグメントイオンピークパターンを取得する、フラグメントイオンピークパターン取得工程S2と、
前記フラグメントイオンピークパターンを、あらかじめ準備した多糖のフラグメントイオンピークパターンと対比することにより、前記多糖の糖鎖配列を解析する糖鎖配列解析工程S3とを含むことを特徴とする、糖鎖配列解析方法。
【解決手段】
多糖の糖鎖配列解析方法であって、
前記多糖を構成する各単糖内の共有結合、および前記各単糖間の共有結合のうち少なくとも一つの共有結合を、イオン化により非還元末端側から順に壊裂させて測定したマススペクトルのフラグメントイオンピークパターンを取得する、フラグメントイオンピークパターン取得工程S2と、
前記フラグメントイオンピークパターンを、あらかじめ準備した多糖のフラグメントイオンピークパターンと対比することにより、前記多糖の糖鎖配列を解析する糖鎖配列解析工程S3とを含むことを特徴とする、糖鎖配列解析方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、糖鎖配列解析方法、プログラム、記録媒体、および糖鎖配列解析装置に関する。
【背景技術】
【0002】
多糖の構造解析方法としては、種々の方法が知られている。例えば、高速液体クロマトグラフィーによる保持時間を、構造が既知である多糖と照合する方法がある。この方法は、簡便に行なうことができるが、多糖の配列、結合等を高精度で解析することはできない。したがって、構造が未知または新規である多糖の構造解析をすることは極めて困難である。
【0003】
一方、構造が未知または新規である多糖の構造解析にも用いることのできる高精度な解析方法として、メチル化法、NMRを用いた方法等が知られている。しかしながら、これらの方法は、測定試料が大量に必要であるとともに、測定または構造解析に高度な専門性を要する。例えば、NMRは、スペクトルの解析に熟練を要する。また、メチル化法では、メチル化、加水分解、および場合によっては蛍光標識等の前処理が必要であり、この前処理に専門性が必要であるとともに、手間と時間がかかる。
【0004】
また、質量分析を用いて比較的簡便に行なうことが可能であり、かつ、構造が未知または新規である多糖の構造解析にも用いることのできる高精度な構造解析方法が、例えば、特許文献1および2等に記載されている。これらの文献では、グリコサミノグリカン(GAG)由来のオリゴ糖などを対象とした構造解析方法(共有結合切断の法則)を示しているが、測定対象となる糖が限定されている。例えば、前記測定対象となる糖において、二糖単位を構成する各単糖は異なっていなければならず(ウロン酸とヘキソサミンなど)、単一種類の単糖から構成された多糖の構造解析はできない。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特願2005−116014号公報
【特許文献2】特開2006−292627号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は、単一種類の単糖から構成された多糖、および、構造が未知または新規である多糖にも適用できて、簡便、短時間かつ高精度に構造解析が可能な糖鎖配列解析方法、プログラム、記録媒体、および糖鎖配列解析装置の提供を目的とする。
【課題を解決するための手段】
【0007】
前記目的を達成するために、本発明の糖鎖配列解析方法は、
多糖の糖鎖配列解析方法であって、
前記多糖を構成する各単糖内の共有結合、および前記各単糖間の共有結合のうち少なくとも一つの共有結合を、イオン化により非還元末端側から順に壊裂させて測定したマススペクトルのフラグメントイオンピークパターンを取得する、フラグメントイオンピークパターン取得工程と、
前記フラグメントイオンピークパターンを、あらかじめ準備した多糖のフラグメントイオンピークパターンと対比することにより、前記多糖の糖鎖配列を解析する糖鎖配列解析工程とを含むことを特徴とする。
【0008】
本発明のプログラムは、前記本発明の糖鎖配列解析方法をコンピュータ上で実行可能なプログラムである。
【0009】
本発明の記録媒体は、前記本発明のプログラムを記録した記録媒体である。
【0010】
本発明の糖鎖配列解析装置は、
多糖の糖鎖配列解析装置であって、
前記多糖を構成する各単糖内の共有結合、および前記各単糖間の共有結合のうち少なくとも一つの共有結合を、イオン化により非還元末端側から順に壊裂させて測定したマススペクトルのフラグメントイオンピークパターンを取得する、フラグメントイオンピークパターン取得手段と、
前記フラグメントイオンピークパターンを、あらかじめ準備した多糖のフラグメントイオンピークパターンと対比することにより、前記多糖の糖鎖配列を解析する糖鎖配列解析手段とを含むことを特徴とする。
【発明の効果】
【0011】
本発明によれば、単一種類の単糖から構成された多糖、および、構造が未知または新規である多糖にも適用できて、簡便、短時間かつ高精度に構造解析が可能な糖鎖配列解析方法、プログラム、記録媒体、および糖鎖配列解析装置を提供することができる。
【図面の簡単な説明】
【0012】
【図1】本発明の糖鎖配列解析方法の一例を示すフローチャート図である。
【図2A】本発明の糖鎖配列解析装置の一例を示すブロック図である。
【図2B】本発明の糖鎖配列解析装置の別の一例を示すブロック図である。
【図3】二糖のマススペクトル図の一例である。
【図4】二糖のマススペクトル図の別の一例である。
【図5】多糖の質量分析における、フラグメントイオン生成の一例を示す図である。
【図6】多糖の質量分析における、フラグメントイオン生成の別の一例を示す図である。
【図7】多糖の質量分析における、フラグメントイオン生成のさらに別の一例を示す図である。
【図8】多糖の質量分析における、フラグメントイオン生成のさらに別の一例を示す図である。
【図9】多糖の質量分析における、フラグメントイオン生成のさらに別の一例を示す図である。
【図10A】多糖のMSn測定におけるスペクトルを例示する図である。
【図10B】多糖のMSn測定におけるスペクトルおよび糖鎖配列解析を例示する図である。
【図10C】図10Aの一部の拡大図である。
【図10D】図10Aの別の一部の拡大図である。
【図10E】図10Aのさらに別の一部の拡大図である。
【図10F】図10Aのさらに別の一部の拡大図である。
【図10G】図10Bの一部の拡大図である。
【図10H】図10Bの別の一部の拡大図である。
【発明を実施するための形態】
【0013】
以下、本発明についてさらに具体的に説明する。ただし、本発明は、以下の説明により限定されない。
【0014】
[多糖]
本発明において、「多糖」は、オリゴ糖(例えば、二糖、三糖、四糖など)を含む。前記多糖は、例えば、二糖から十糖までのオリゴ糖であるが、さらに多数の単糖が縮合した構造の多糖でもよい。
【0015】
本発明において、前記多糖(糖鎖)を構成する各単糖(構成糖)は、特に制限されない。前記単糖(構成糖)としては、例えば、ケトヘキソース、アルドヘキソース、ケトペントース、アルドペントース等が挙げられる。前記ケトヘキソースとしては、例えば、ソルボース、プシコース、タガトース、フルクトースが挙げられる。前記アルドヘキソースとしては、例えば、イドース、グロース、アロース、アルトロース、ガラクトース、タロース、グルコース、マンノースが挙げられる。また、前記単糖は、D体でもL体でもよい。
【0016】
前記多糖(糖鎖)を構成する各単糖(構成糖)は、任意の水素原子または水酸基が、他の原子または置換基で置換された誘導体でもよい。前記他の原子または置換基は、例えば、アミノ酸またはタンパク質であってもよい。より具体的には、例えば、前記多糖(糖鎖)が、グリコサミノグリカン(GAG)であってもよい。他の例として、前記水素原子が、前記単糖の炭素原子に結合した水素原子である場合、前記他の原子または置換基としては、例えば、ハロゲン、水酸基、アルキル基、アルキルアミノ基、アルコキシ基、ペルフルオロアルキル基、ペルフルオロアルキルスルホニル基、ペルフルオロアシル基、アシル基、アシルオキシ基、アルカノイルオキシ基、アリール基、フェニル基、ナフチル基等が挙げられる。前記水素原子が、前記単糖の水酸基の水素原子である場合、前記他の原子または置換基としては、例えば、アルキル基、アリール基、フェニル基、ナフチル基等が挙げられる。前記水酸基が他の原子または置換基で置換される場合、前記他の原子または置換基としては、例えば、水素原子、ハロゲン、アルキル基、アルキルアミノ基等が挙げられる。
【0017】
なお、前記アルキル基は、例えば、炭素数1〜6の直鎖または分枝アルキル基であっても良く、前記アシル基は、例えば、炭素数1〜6の直鎖または分枝アシル基であってもよい。アルキル基またはアシル基から誘導される置換基(アルコキシ基、ペルフルオロアルキル基、アシルオキシ基等)においても同様である。また、アシル基の炭素数にはカルボニル炭素を含み、例えば、炭素数1のアルカノイル基(アシル基)とはホルミル基を指すものとする。アリール基とは、ベンゼン環から誘導される基のみならず、ベンゼン環、ナフタレン環、アントラセン環、フェナントレン環、ピリジン環、チオフェン環、ピレン環等の任意の芳香環または複素芳香環から誘導される基も含む。「ハロゲン」とは、任意のハロゲン元素を指すが、例えば、フッ素、塩素、臭素およびヨウ素が挙げられる。また、置換基等に異性体が存在する場合はどの異性体でも良く、例えば、「ナフチル基」という場合は、1−ナフチル基でも2−ナフチル基でもよい。
【0018】
本発明の糖鎖配列解析方法においては、前記多糖を構成する各単糖が異なっていてもよいが、前記多糖を構成する各単糖が、全て同じであってもよい。前記単糖は、例えば、グルコースであってもよい。
【0019】
従来は、単一種類の単糖から構成された糖鎖(多糖)は非常に識別が困難であった。しかし、本発明においては、そのような多糖も、非還元末端側から結合依存的に(結合タイプ別に)分子が壊裂(断片化)するという前記法則に基づき、配列解析(構造解析)することができる。すなわち、多糖の質量分析時において、隣接する前記各単糖の間の結合タイプ(例えば、結合位置(1位〜6位)および結合様式(αまたはβ))別に、まったく異なる断片化のパターンが出現することから、単一種類の単糖から構成された糖鎖(多糖)も配列解析(構造解析)できる。より具体的には、例えば、後述の実施形態1に記載のとおりである。
【0020】
[糖鎖配列解析方法]
本発明の糖鎖配列解析方法は、具体的には、例えば、以下のようにして行なうことができる。
【0021】
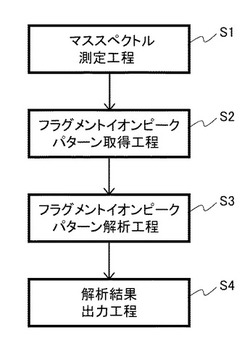
図1に、本発明の糖鎖配列解析方法のフローチャートの一例を示す。すなわち、まず、図示のとおり、測定対象である多糖のマススペクトルを測定する、マススペクトル測定工程を行なう(S1)。このマススペクトル測定において、前記多糖を構成する各単糖内の共有結合、および前記各単糖間の共有結合の少なくとも一つを、イオン化により非還元末端側から順に壊裂させる。次に、前記マススペクトルのフラグメントイオンピークパターンを取得する、前記フラグメントイオンピークパターン取得工程を行なう(S2)。
【0022】
なお、本発明の糖鎖配列解析方法において、前記マススペクトル測定工程(S1)は、なくてもよい。具体的には、例えば、依頼測定等により、マススペクトルを入手し、前記フラグメントイオンピークパターンを取得してもよい。また、例えば、サーバ等に記録されているフラグメントイオンピークパターンをダウンロードして取得してもよい。
【0023】
前記フラグメントイオンピークパターン取得工程(S2)において、前記マススペクトルが、MSn測定により測定されたマススペクトルであることが好ましい。なお、本発明において、「MSn測定」は、CID(Collision induced dissociation:衝突誘起解離)による多段(n段)マススペクトロメトリーの取得を行うことをいう。ただし、nは、2以上の整数である。また、「MSn測定」は、「MS/MS測定」または「MS/MS」ともいうことがある。
【0024】
また、前記マススペクトルにおいて、イオン化方法は特に制限されないが、例えば、ESI(electrospray ionization:エレクトロスプレーイオン化)法、EI(electron ionization:電子イオン化)法、CI(chemical ionization:化学イオン化)法、DEI(desorption electron ionization:脱離電子イオン化)法、DCI(desorption chemical ionization:脱離化学イオン化)法、FAB(fast atom bombardment:高速原子衝撃)法、FRIT−FAB(FRIT−fast atom bombardment:フリット高速原子衝撃)法、およびMALDI(matrix−assisted laser desorption ionization:マトリックス支援レーザー脱離イオン化)法からなる群から選択される少なくとも一つのイオン化方法を用いて測定されたマススペクトルが好ましい。前記イオン化法は、例えばフラグメントイオンピークパターンが良好であるという観点では、ESI法が好ましく、高分子量の多糖の構造解析をより高精度に行いやすいという観点では、MALDI法が好ましい。
【0025】
例えば、ESIによってイオン化された多糖に対し、CID法によってMS/MSを行う。その際のMS/MSのシグナル(フラグメントイオンピークパターン)が、前記法則に従って規則的に現れることを利用して、前記シグナルを解析する。このように、イオントラップによってトラップされたイオンから、MSのn乗(MSn)を分析する事によって、糖鎖の配列決定を短時間に行う事が可能である。本発明によれば、例えば、蛍光標織等のラベル化などの前処理を行なわずに配列解析を行なうことが可能である。これによれば、前処理による試料のロスが無いため、非常に効率良く分析する事が可能である。
【0026】
また、前記マススペクトルは、さらに高精度な構造解析のために、二重収束質量分析法を用いて測定されたマススペクトルであることが好ましい。
【0027】
さらに、図示のとおり、前記フラグメントイオンピークパターン取得工程(S2)で取得した前記フラグメントイオンピークパターンを、あらかじめ準備した多糖のフラグメントイオンピークパターンと対比することにより、前記多糖の糖鎖配列を解析する、前記糖鎖配列解析工程を行なう(S3)。前記あらかじめ準備したフラグメントイオンピークパターンは、例えば、配列が既知である多糖(糖鎖)のマススペクトル(フラグメントイオンピークパターン)をあらかじめ準備したものでもよい。
【0028】
さらに、前記糖鎖配列解析工程(S3)による解析結果を出力する、解析結果出力工程を行なう(S4)。ただし、本発明の糖鎖配列解析方法において、解析結果出力工程(S4)は、なくてもよい。
【0029】
本発明者らは、多糖の質量分析において、イオン化時に、多糖の糖鎖構造の非還元末端側から結合依存的に分子が壊裂するという、これまでに知られていなかった法則を見出し、本発明に到達した。すなわち、本発明の糖鎖配列解析方法は、多糖を構成する各単糖の配列を非還元末端側からシーケンシャルに解析する(配列順に逐次読み取る)ことが可能な、これまでに無い糖鎖配列解析方法である。このため、本発明の糖鎖配列解析方法は、単一種類の単糖から構成された多糖、および、構造が未知または新規である多糖にも適用できて、簡便、短時間かつ高精度に構造解析が可能である。
【0030】
また、本発明の糖鎖配列解析方法は、単独で用いてもよいが、他の分析方法と併用してもよい。例えば、多糖(糖鎖)を構成する各構成糖(単糖)の構造が不明な場合、前記各構成糖の分析(構造解析)と併用することによって、さらに高精度な解析が可能である。前記構成糖の分析(構造解析)方法は特に制限されず、例えば、NMR、UV(紫外可視吸収スペクトル法)、IR(赤外線吸収スペクトル法)等を用いてもよいし、前記多糖(糖鎖)を加水分解後、高速液体クロマトグラフィーにより分析してもよい。
【0031】
[糖鎖配列解析装置等]
本発明の糖鎖配列解析方法は、例えば、本発明の糖鎖配列解析装置を用いて行なうことができる。図2Aのブロック図に、本発明の糖鎖配列解析装置の一例を示す。図示のとおり、この装置は、フラグメントイオンピークパターン取得手段21および糖鎖配列解析手段22に加え、さらに、マススペクトル測定手段1および解析結果出力手段3を含む。本発明の糖鎖配列解析装置は、オリゴ糖配列の分析装置、または、多糖の配列解析のための糖鎖シーケンサとして用いることができる。
【0032】
マススペクトル測定手段1は特に制限されず、既存の質量分析装置を用いてもよい。前記質量分析装置については、前述のマススペクトルの説明の欄で記載したような測定が可能な装置が好ましい。また、本発明の糖鎖配列解析装置において、マススペクトル測定手段1は、なくてもよい。例えば、前記のように、本装置とは別の装置でマススペクトルおよびそのフラグメントイオンピークパターンを測定し、その測定データを用いてもよい。
【0033】
つぎに、フラグメントイオンピークパターン取得手段21およびフラグメントイオンピーク解析手段22は、パーソナルコンピュータ(PC)等の電子計算機2である。例えば、前記フラグメントイオンピークパターン取得工程およびフラグメントイオンピーク解析工程を実行可能なプログラムをインストールしたPCを用いればよい。図2Aに示すように、本装置において、マススペクトル測定手段(質量分析装置)を含む場合は、PCと質量分析装置を電気的に接続されている。また、解析結果出力手段3としては、例えば、プリンターおよびディスプレー等がある。本装置では、プリンター等もPCと電気的に接続されている。
【0034】
図2Bに、別の形態の本発明の糖鎖解析装置を示す。本装置は、マススペクトル測定手段を有さず、代わりに、フラグメントイオンピークパターン取得手段21が、インターネット接続手段等の通信手段である。また、本装置外のデータベース4には、本装置とは別の装置で測定されたマススペクトルデータが格納されている。本装置では、フラグメントイオンピークパターン取得手段21により、インターネット等の通信回線網5を介して、外部のデータベース4にアクセスし、格納されているマススペクトルデータを取得する。これら以外は、本装置は、図2Aの装置と同様である。
【0035】
なお、本発明の糖鎖配列解析方法は、本発明の糖鎖配列解析装置を用いずに行なうこともできる。例えば、前記フラグメントイオンピークパターンが記録されたマススペクトルデータを取得し、目視による確認のみで、前記フラグメントイオンピークパターンを、あらかじめ準備した多糖のフラグメントイオンピークパターンと対比することにより、前記多糖の糖鎖配列を解析してもよい。ただし、本発明の糖鎖配列解析方法は、本発明の糖鎖配列解析装置を用いて自動化すると、効率化が可能であるため好ましい。
【0036】
[実施形態1]
次に、本発明の具体的な実施形態について説明する。本実施形態では、前記糖鎖配列解析工程(S3)における糖鎖配列解析の具体的な手法について、前記多糖が単一の構成糖(グルコース)から成るオリゴ糖である場合を例として説明する。その他の工程、装置等は、前記のとおりでよい。
【0037】
図3および図4に、グルコースから成る、様々な結合を有する二糖(ビオース)の質量分析結果(マススペクトル図)を示す。図3は、β結合を有する二糖(グルコース二分子の縮合体)のマススペクトル図であり、上から順に、β1,1結合(ネオトレハロース)、β1,2結合(ソフォロース)、β1,3結合(ラミナリビオース)、β1,4結合(セロビオース)、β1,6結合(ゲンチオビオース)の測定結果である。図4は、α結合を有する二糖(グルコース二分子の縮合体)のマススペクトル図であり、上から順に、α1,1結合(トレハロース)、α1,2結合(コージビオース)、α1,3結合(ニゲロース)、α1,4結合(マルトース)、α1,6結合(イソマルトース)の測定結果である。図3および図4に示すように、同じくグルコースからなる二糖(ビオース)であっても、グルコース間の結合位置(1位〜6位)および結合様式(αまたはβ)に応じて、ESI−MS分析ピークのパターンが全て異なることが分かる。このように、各々の二糖が結合特異的なフラグメントイオンピークパターン(壊裂法則)を持つために、未知のサンプルであっても、ピークパターンから結合の状態を判別できるのである。この法則に則れば、理論上、全てのグルカン(グルコースが結合した糖鎖または多糖)の結合位置(1位〜6位)および結合様式(αまたはβ)を完全に解析する事ができる。例えばこのように、本発明の糖鎖配列解析方法における前記糖鎖配列解析工程では、隣接する前記各単糖の間の結合位置および結合様式を解析することが好ましい。
【0038】
図3および図4のスペクトル図は、例えば、下記の測定条件によるマススペクトル測定で得ることができる。まず、ESI−MSで、溶媒を、アセトニトリル:水=75:25として、イオン化した親イオンを検出する。この場合、前記イオン化した親イオンはグルコースの二糖であるため、質量数は342.16となるが、前記測定条件では、全てナトリウムアダクト型として検出されるので、342.16+23=365.16という質量のシグナルが得られる。これを、一度イオントラップでトラップする。この親イオンに対してCIDを行い、フラグメンテーション(内部壊裂)を起こさせて子イオン(フラグメントイオン)を発生させ、これを検出して、図3または図4のスペクトル図を得る。CIDは、具体的には、例えば、前記親イオンに、不活性ガスであるヘリウムを衝突させる事によって、内部壊裂(フラグメンテーション)を起こさせることができる。他の不活性化ガスとしては、アルゴンも用いられる。最適なイオンパワーは特に制限されず、適宜設定すればよいが、例えば、35%程度が最適である。なお、図3および図4のスペクトル図は、前記のように、自家によるマススペクトル測定(前記マススペクトル測定工程、図1のS1)により得てもよいし、それ以外の方法により取得してもよい。
【0039】
以下、親イオン(分子イオン)壊裂による子イオン(フラグメントイオン)生成の法則について、図4(α結合)を例として説明する。以下に示すように、全ての二糖において、非還元末端側が、部分的に、かつ結合特異的に壊裂するという法則が認められる。
【0040】
図5〜図9は、それぞれ、α1,1結合(トレハロース)、α1,2結合(コージビオース)、α1,3結合(ニゲロース)、α1,4結合(マルトース)、α1,6結合(イソマルトース)の分子イオンの壊裂パターンの例示である。各図において、右側が還元末端、左側が非還元末端である。例えば、図4最上段のα1,1結合(トレハロース)の場合、203という質量のフラグメントイオンピークがみられる。これは、図5に示すように、二糖が2つのグルコースに壊裂し、ナトリウムイオンが結合することにより、質量180.16(グルコース)+23(ナトリウムイオン)=203を示すものである。なお、α結合を有している場合、グリコシドボンド(グリコシド結合すなわち各グルコース間の結合)で切れるピークと、結合位置(1位〜6位)に特有なフラグメントイオンピークの両方が生じる。
【0041】
α1,2結合(コージビオース)においてCIDの後に生じるピーク(質量数:245)は、図6の矢印で壊裂した右側の部分である。α1,3結合(ニゲロース)のピーク(質量数:275)、α1,4結合(マルトース)のピーク(質量数:305)、α1,6結合(イソマルトース)のピーク(質量数:275および305)において、同様に、図7〜図9に示すとおりである。このように、必ず、糖鎖構造(グルカン)の非還元末端側から結合依存的に分子が壊裂する。この原理(法則)は、前記のとおり、本発明者らがはじめて見出したことである。この原理(法則)を利用すれば、糖鎖構造を非還元末端側からシーケンシャルに解析する事が可能となる。
【0042】
図3〜図9のデータは、標準的なグルカン二糖の分析結果から得られたものである。次に、三糖以上の多糖のシーケンシャルな解析(配列解析、構造解析)について、β1,3グルカンオリゴ糖(三糖)の解析結果を例として説明する。
【0043】
図10Aは、β1,3グルカンオリゴ糖(三糖)のマススペクトルを例示する図である。図10Bは、β1,3グルカンオリゴ糖(三糖)のマススペクトルの別の例を示すとともに、同図および図10Aにおけるイオンの壊裂パターンを模式的に示す図である。図10Aおよび図10Bにおいて、「MS」と示したスペクトルは、β1,3グルカンオリゴ糖(三糖)の親イオン(分子イオン)ピークを示す。「MS2」と記したスペクトルは、前記親イオンを1回CID壊裂させて生じた子イオン(フラグメントイオン)のスペクトルを示す。「MS3」と記したスペクトルは、前記子イオンをさらに1回CID壊裂させて生じた孫イオン(フラグメントイオン)のスペクトルを示す。図10AおよびBにおいて、測定条件は、図3および図4と同様である。なお、図10Cは、図10A左上のスペクトル図を拡大したものである。図10Dは、図10A右上のスペクトル図を拡大したものである。図10Eは、図10A左下のスペクトル図を拡大したものである。図10Fは、図10A右下のスペクトル図を拡大したものである。図10Gは、図10B左上のスペクトル図を拡大したものである。図10Hは、図10B右上のスペクトル図を拡大したものである。
【0044】
以下、β1,3グルカンオリゴ糖(三糖)の配列解析(構造解析)方法について、図10AおよびBに基づき説明する。β1,3グルカンオリゴ糖(三糖)の親イオンのピークは、Naイオンアダクトとして現れるので、質量は527.16となる(図10A左上、図10C)。このイオンをCIDで壊裂させると(MS2測定)、図10A右上(図10D)に示すとおり、509(527−18)および437(527−90)のピークが得られる。図10A右上(図10D)を見ると、203のピークが殆ど現れていない。したがって、前記の法則に基づき、非還元末端に最も近いグリコシド結合(各グルコース間の結合)が、β結合の1,3リンケージであることが分かる。
【0045】
次に、このオリゴ糖はグルカンであるため、親イオンから162(グルコース1つ分)を引いた質量数のピークを、図10A右上(図10D)の中から探す。図示のとおり、該当する365.16という質量数のピークを見出すことができる。このイオンをさらにCIDを用いて内部崩壊裂をさせると、347(365−18)と、275(365−90)が得られる(図10B左上、図10G)。図10B左上(図10G)においても、203のピークが殆ど現れていない。したがって、前記の法則に基づき、非還元末端側から2番目のグリコシド結合(各グルコース間の結合)が、β結合の1,3リンケージであることが分かる。なお、図10A右上(図10D、MS2測定)において、365以外のフラグメントイオンのCID壊裂(MS3測定)のスペクトル図は、図10A左下(図10E)、図10A右下(図10F)、および図10B右上(図10H)に示すとおりである。例えば、図10B右上(図10H)における203のピークは、グリコシド結合が壊裂したことを示すフラグメントイオンピークである。
【0046】
以上と同様の解析方法により、四糖以上のグルカンも、同様に、非還元末端側からシーケンシャルに解析が可能である。すなわち、具体的にまとめて示すと、前記多糖が、x個(xは2以上の整数)のグルコースのグリコシド結合により構成される(グルカンである)場合、以下のように配列解析できる。
【0047】
前記フラグメントイオンピークパターン取得工程において取得される前記フラグメントイオンピークパターンが、非還元末端と反対側からk個(kは、1以上、x以下の整数)のグルコースからなる分子イオンまたはフラグメントイオンをさらに壊裂させて得られるフラグメントイオンピークパターンPkを含む場合、前記フラグメントイオンピーク解析工程において、(x−k+1)番目のグリコシド結合の結合位置および結合様式を、以下のとおり判定する。この判定を、kの値を1からxまで変化して順に行なえば、全てのグリコシド結合の結合位置および結合様式を判定できる。すなわち、これにより、前記グルカンの配列解析(構造解析)を達成できる。
(1)Pkが、下記表左欄のピークを含む場合に、非還元末端側から(x−k+1)番目のグリコシド結合の結合位置が下記表右欄であると判定する。
(2)さらに、Pkが、グルコースイオンに由来するピークを所定値以上の強度で含む場合(mk−162がグルコースイオン由来ピークである場合を除く)に、前記(x−k+1)番目のグリコシド結合様式がα結合であると判定する。
(3)また、Pkが、グルコースイオンに由来するピークを含まないか、または前記グルコースイオンピークの強度が前記所定値未満の場合は、前記(x−k+1)番目のグリコシド結合の結合様式がβ結合であると判定する。
【表1】

【0048】
なお、前記(2)(3)において、グリコシド結合様式(αまたはβ)の判断基準である前記グルコースイオンピーク強度の「所定値」は、誤判定が少なくなるように、例えば、既知のグルカンの、同条件におけるマススペクトル等を基準にして適宜設定すればよい。前記「所定値」は、具体的には、例えば、基準ピークイオン強度の8%〜31%、好ましくは10%〜28%、より好ましくは15%〜25%である。なお、「基準イオンピーク強度」は、フラグメントイオンピークパターン中、相対強度が最も大きいイオンピーク(基準イオンピーク)の強度をいう。
【0049】
さらに、グルコース以外の単糖から構成された糖鎖(多糖)、複数種類の単糖から構成された糖鎖(多糖)においても、非還元末端側から結合依存的に分子が壊裂するという法則に基づけば、同様に、非還元末端側からシーケンシャルに解析が可能である。さらに、前記各単糖(構成糖)が、任意の水素原子または水酸基が他の原子または置換基で置換された誘導体である場合にも、同様に、非還元末端側からシーケンシャルに解析が可能である。このようにすれば、複雑な糖鎖の配列解析(構造解析)も可能である。
【0050】
このように、本発明の糖鎖配列解析方法によれば、多糖の質量分析において、イオン化時に、多糖の糖鎖構造の非還元末端側から結合依存的に分子が壊裂するという法則に基づき、多糖を構成する各単糖の配列を非還元末端側からシーケンシャルに解析する(配列順に逐次読み取る)ことができる。本発明によれば、例えば、前記フラグメントイオンピークパターンの解析において、隣接する前記各単糖の間の結合位置および結合様式の両方を解析することも可能である。また、本発明によれば、例えば、従来のメチル化法やNMRを用いた分析では難しかった未知または新規な糖質の構造解析を、簡便に高精度で行うことができる。このような法則および本発明の優れた効果については、本願出願時までには何ら知られておらず、本発明者らがはじめて見出したことである。
【実施例】
【0051】
[実施例1]
グルコースから成る、様々な結合を有する二糖(ビオース)について、実際に質量分析を行い、フラグメントイオンピークパターンを取得し、さらにその解析を行なうことで、糖鎖配列を解析した。測定条件は、前記実施形態1に示したとおりである。すなわち、測定モードはESI−MSで、溶媒は、アセトニトリル:水=75:25とした。これにより検出された親イオン(質量数342.16、ナトリウムアダクト型)を、一度イオントラップでトラップした。この親イオンに対してCID(衝突誘起解離)を行い、フラグメンテーション(内部壊裂)を起こさせて子イオン(フラグメントイオン)を発生させ、これを検出して、図3または図4のスペクトル図を得た。CIDは、前記親イオンに、不活性ガスであるヘリウムを衝突させる事によって行なった。イオンパワーは、35%程度に調整した。前述のとおり、図3は、β結合を有する二糖(グルコース二分子の縮合体)のマススペクトル図であり、上から順に、β1,1結合(ネオトレハロース)、β1,2結合(ソフォロース)、β1,3結合(ラミナリビオース)、β1,4結合(セロビオース)、β1,6結合(ゲンチオビオース)の測定結果である。図4は、α結合を有する二糖(グルコース二分子の縮合体)のマススペクトル図であり、上から順に、α1,1結合(トレハロース)、α1,2結合(コージビオース)、α1,3結合(ニゲロース)、α1,4結合(マルトース)、α1,6結合(イソマルトース)の測定結果である。前記実施形態1において説明したように、全ての二糖において、非還元末端側が、部分的に、かつ結合特異的に壊裂し、それぞれ異なるフラグメントイオンピークパターンを示すことが確認された。このようにして、前記各二糖の配列解析(構造解析)を行うことができた。なお、前記各二糖のフラグメントイオンピークパターンにおいて、グリコシド結合がα結合の場合、基準イオンピーク強度に対するグルコースイオンピーク(質量数:203)の強度比が大きく現れ、最も小さいものでも基準イオンピーク強度の31%であった。また、例えば、グリコシド結合がα1,2結合(コージビオース)の場合、グルコースイオンピークのピーク強度(強度比)は、基準イオンピーク(質量数:245)強度の93%ときわめて大きい値を示した。これに対し、グリコシド結合がβ結合の場合は、β1,1結合(ネオトレハロース)を除いて、グルコースイオンピークがほとんど現れなかった。具体的には、グルコースイオンピークのピーク強度比は、最も大きく現れたβ1,4結合(セロビオース)において、基準イオンピーク強度の7.1%であった。β1,2結合(ソフォロース)、β1,3結合(ラミナリビオース)、β1,6結合(ゲンチオビオース)においては、グルコースイオンピークがほとんど観測されなかった。
【0052】
[実施例2]
実施例1と同様の測定条件により、β1,3グルカンオリゴ糖(三糖)のマススペクトルを測定し、フラグメントイオンピークパターンを取得した。前記実施形態1で述べた方法により、前記フラグメントイオンピークパターンを解析し、配列解析(構造解析)を行った。スペクトルおよび解析方法は、図10A〜Gを用いて説明したとおりである。
【産業上の利用可能性】
【0053】
以上説明したとおり、本発明によれば、単一種類の単糖から構成された多糖、および、構造が未知または新規である多糖にも適用できて、簡便、短時間かつ高精度に構造解析が可能な糖鎖配列解析方法、糖鎖配列解析装置、プログラム、および記録媒体を提供することができる。本発明は、多糖の糖鎖構造の非還元末端側から結合依存的に分子が壊裂するという、本発明者らが見出した前記法則を、糖鎖配列解析の基本原理として用いることができる。このため、糖鎖に関する広範な分野に適用可能であり、産業上の利用価値は多大である。
【符号の説明】
【0054】
1 マススペクトル測定手段
2 PC等
21 フラグメントイオンピークパターン取得手段
22 フラグメントイオンピークパターン解析手段
3 解析結果出力手段
4 データベース
5 インターネット
【技術分野】
【0001】
本発明は、糖鎖配列解析方法、プログラム、記録媒体、および糖鎖配列解析装置に関する。
【背景技術】
【0002】
多糖の構造解析方法としては、種々の方法が知られている。例えば、高速液体クロマトグラフィーによる保持時間を、構造が既知である多糖と照合する方法がある。この方法は、簡便に行なうことができるが、多糖の配列、結合等を高精度で解析することはできない。したがって、構造が未知または新規である多糖の構造解析をすることは極めて困難である。
【0003】
一方、構造が未知または新規である多糖の構造解析にも用いることのできる高精度な解析方法として、メチル化法、NMRを用いた方法等が知られている。しかしながら、これらの方法は、測定試料が大量に必要であるとともに、測定または構造解析に高度な専門性を要する。例えば、NMRは、スペクトルの解析に熟練を要する。また、メチル化法では、メチル化、加水分解、および場合によっては蛍光標識等の前処理が必要であり、この前処理に専門性が必要であるとともに、手間と時間がかかる。
【0004】
また、質量分析を用いて比較的簡便に行なうことが可能であり、かつ、構造が未知または新規である多糖の構造解析にも用いることのできる高精度な構造解析方法が、例えば、特許文献1および2等に記載されている。これらの文献では、グリコサミノグリカン(GAG)由来のオリゴ糖などを対象とした構造解析方法(共有結合切断の法則)を示しているが、測定対象となる糖が限定されている。例えば、前記測定対象となる糖において、二糖単位を構成する各単糖は異なっていなければならず(ウロン酸とヘキソサミンなど)、単一種類の単糖から構成された多糖の構造解析はできない。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特願2005−116014号公報
【特許文献2】特開2006−292627号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は、単一種類の単糖から構成された多糖、および、構造が未知または新規である多糖にも適用できて、簡便、短時間かつ高精度に構造解析が可能な糖鎖配列解析方法、プログラム、記録媒体、および糖鎖配列解析装置の提供を目的とする。
【課題を解決するための手段】
【0007】
前記目的を達成するために、本発明の糖鎖配列解析方法は、
多糖の糖鎖配列解析方法であって、
前記多糖を構成する各単糖内の共有結合、および前記各単糖間の共有結合のうち少なくとも一つの共有結合を、イオン化により非還元末端側から順に壊裂させて測定したマススペクトルのフラグメントイオンピークパターンを取得する、フラグメントイオンピークパターン取得工程と、
前記フラグメントイオンピークパターンを、あらかじめ準備した多糖のフラグメントイオンピークパターンと対比することにより、前記多糖の糖鎖配列を解析する糖鎖配列解析工程とを含むことを特徴とする。
【0008】
本発明のプログラムは、前記本発明の糖鎖配列解析方法をコンピュータ上で実行可能なプログラムである。
【0009】
本発明の記録媒体は、前記本発明のプログラムを記録した記録媒体である。
【0010】
本発明の糖鎖配列解析装置は、
多糖の糖鎖配列解析装置であって、
前記多糖を構成する各単糖内の共有結合、および前記各単糖間の共有結合のうち少なくとも一つの共有結合を、イオン化により非還元末端側から順に壊裂させて測定したマススペクトルのフラグメントイオンピークパターンを取得する、フラグメントイオンピークパターン取得手段と、
前記フラグメントイオンピークパターンを、あらかじめ準備した多糖のフラグメントイオンピークパターンと対比することにより、前記多糖の糖鎖配列を解析する糖鎖配列解析手段とを含むことを特徴とする。
【発明の効果】
【0011】
本発明によれば、単一種類の単糖から構成された多糖、および、構造が未知または新規である多糖にも適用できて、簡便、短時間かつ高精度に構造解析が可能な糖鎖配列解析方法、プログラム、記録媒体、および糖鎖配列解析装置を提供することができる。
【図面の簡単な説明】
【0012】
【図1】本発明の糖鎖配列解析方法の一例を示すフローチャート図である。
【図2A】本発明の糖鎖配列解析装置の一例を示すブロック図である。
【図2B】本発明の糖鎖配列解析装置の別の一例を示すブロック図である。
【図3】二糖のマススペクトル図の一例である。
【図4】二糖のマススペクトル図の別の一例である。
【図5】多糖の質量分析における、フラグメントイオン生成の一例を示す図である。
【図6】多糖の質量分析における、フラグメントイオン生成の別の一例を示す図である。
【図7】多糖の質量分析における、フラグメントイオン生成のさらに別の一例を示す図である。
【図8】多糖の質量分析における、フラグメントイオン生成のさらに別の一例を示す図である。
【図9】多糖の質量分析における、フラグメントイオン生成のさらに別の一例を示す図である。
【図10A】多糖のMSn測定におけるスペクトルを例示する図である。
【図10B】多糖のMSn測定におけるスペクトルおよび糖鎖配列解析を例示する図である。
【図10C】図10Aの一部の拡大図である。
【図10D】図10Aの別の一部の拡大図である。
【図10E】図10Aのさらに別の一部の拡大図である。
【図10F】図10Aのさらに別の一部の拡大図である。
【図10G】図10Bの一部の拡大図である。
【図10H】図10Bの別の一部の拡大図である。
【発明を実施するための形態】
【0013】
以下、本発明についてさらに具体的に説明する。ただし、本発明は、以下の説明により限定されない。
【0014】
[多糖]
本発明において、「多糖」は、オリゴ糖(例えば、二糖、三糖、四糖など)を含む。前記多糖は、例えば、二糖から十糖までのオリゴ糖であるが、さらに多数の単糖が縮合した構造の多糖でもよい。
【0015】
本発明において、前記多糖(糖鎖)を構成する各単糖(構成糖)は、特に制限されない。前記単糖(構成糖)としては、例えば、ケトヘキソース、アルドヘキソース、ケトペントース、アルドペントース等が挙げられる。前記ケトヘキソースとしては、例えば、ソルボース、プシコース、タガトース、フルクトースが挙げられる。前記アルドヘキソースとしては、例えば、イドース、グロース、アロース、アルトロース、ガラクトース、タロース、グルコース、マンノースが挙げられる。また、前記単糖は、D体でもL体でもよい。
【0016】
前記多糖(糖鎖)を構成する各単糖(構成糖)は、任意の水素原子または水酸基が、他の原子または置換基で置換された誘導体でもよい。前記他の原子または置換基は、例えば、アミノ酸またはタンパク質であってもよい。より具体的には、例えば、前記多糖(糖鎖)が、グリコサミノグリカン(GAG)であってもよい。他の例として、前記水素原子が、前記単糖の炭素原子に結合した水素原子である場合、前記他の原子または置換基としては、例えば、ハロゲン、水酸基、アルキル基、アルキルアミノ基、アルコキシ基、ペルフルオロアルキル基、ペルフルオロアルキルスルホニル基、ペルフルオロアシル基、アシル基、アシルオキシ基、アルカノイルオキシ基、アリール基、フェニル基、ナフチル基等が挙げられる。前記水素原子が、前記単糖の水酸基の水素原子である場合、前記他の原子または置換基としては、例えば、アルキル基、アリール基、フェニル基、ナフチル基等が挙げられる。前記水酸基が他の原子または置換基で置換される場合、前記他の原子または置換基としては、例えば、水素原子、ハロゲン、アルキル基、アルキルアミノ基等が挙げられる。
【0017】
なお、前記アルキル基は、例えば、炭素数1〜6の直鎖または分枝アルキル基であっても良く、前記アシル基は、例えば、炭素数1〜6の直鎖または分枝アシル基であってもよい。アルキル基またはアシル基から誘導される置換基(アルコキシ基、ペルフルオロアルキル基、アシルオキシ基等)においても同様である。また、アシル基の炭素数にはカルボニル炭素を含み、例えば、炭素数1のアルカノイル基(アシル基)とはホルミル基を指すものとする。アリール基とは、ベンゼン環から誘導される基のみならず、ベンゼン環、ナフタレン環、アントラセン環、フェナントレン環、ピリジン環、チオフェン環、ピレン環等の任意の芳香環または複素芳香環から誘導される基も含む。「ハロゲン」とは、任意のハロゲン元素を指すが、例えば、フッ素、塩素、臭素およびヨウ素が挙げられる。また、置換基等に異性体が存在する場合はどの異性体でも良く、例えば、「ナフチル基」という場合は、1−ナフチル基でも2−ナフチル基でもよい。
【0018】
本発明の糖鎖配列解析方法においては、前記多糖を構成する各単糖が異なっていてもよいが、前記多糖を構成する各単糖が、全て同じであってもよい。前記単糖は、例えば、グルコースであってもよい。
【0019】
従来は、単一種類の単糖から構成された糖鎖(多糖)は非常に識別が困難であった。しかし、本発明においては、そのような多糖も、非還元末端側から結合依存的に(結合タイプ別に)分子が壊裂(断片化)するという前記法則に基づき、配列解析(構造解析)することができる。すなわち、多糖の質量分析時において、隣接する前記各単糖の間の結合タイプ(例えば、結合位置(1位〜6位)および結合様式(αまたはβ))別に、まったく異なる断片化のパターンが出現することから、単一種類の単糖から構成された糖鎖(多糖)も配列解析(構造解析)できる。より具体的には、例えば、後述の実施形態1に記載のとおりである。
【0020】
[糖鎖配列解析方法]
本発明の糖鎖配列解析方法は、具体的には、例えば、以下のようにして行なうことができる。
【0021】
図1に、本発明の糖鎖配列解析方法のフローチャートの一例を示す。すなわち、まず、図示のとおり、測定対象である多糖のマススペクトルを測定する、マススペクトル測定工程を行なう(S1)。このマススペクトル測定において、前記多糖を構成する各単糖内の共有結合、および前記各単糖間の共有結合の少なくとも一つを、イオン化により非還元末端側から順に壊裂させる。次に、前記マススペクトルのフラグメントイオンピークパターンを取得する、前記フラグメントイオンピークパターン取得工程を行なう(S2)。
【0022】
なお、本発明の糖鎖配列解析方法において、前記マススペクトル測定工程(S1)は、なくてもよい。具体的には、例えば、依頼測定等により、マススペクトルを入手し、前記フラグメントイオンピークパターンを取得してもよい。また、例えば、サーバ等に記録されているフラグメントイオンピークパターンをダウンロードして取得してもよい。
【0023】
前記フラグメントイオンピークパターン取得工程(S2)において、前記マススペクトルが、MSn測定により測定されたマススペクトルであることが好ましい。なお、本発明において、「MSn測定」は、CID(Collision induced dissociation:衝突誘起解離)による多段(n段)マススペクトロメトリーの取得を行うことをいう。ただし、nは、2以上の整数である。また、「MSn測定」は、「MS/MS測定」または「MS/MS」ともいうことがある。
【0024】
また、前記マススペクトルにおいて、イオン化方法は特に制限されないが、例えば、ESI(electrospray ionization:エレクトロスプレーイオン化)法、EI(electron ionization:電子イオン化)法、CI(chemical ionization:化学イオン化)法、DEI(desorption electron ionization:脱離電子イオン化)法、DCI(desorption chemical ionization:脱離化学イオン化)法、FAB(fast atom bombardment:高速原子衝撃)法、FRIT−FAB(FRIT−fast atom bombardment:フリット高速原子衝撃)法、およびMALDI(matrix−assisted laser desorption ionization:マトリックス支援レーザー脱離イオン化)法からなる群から選択される少なくとも一つのイオン化方法を用いて測定されたマススペクトルが好ましい。前記イオン化法は、例えばフラグメントイオンピークパターンが良好であるという観点では、ESI法が好ましく、高分子量の多糖の構造解析をより高精度に行いやすいという観点では、MALDI法が好ましい。
【0025】
例えば、ESIによってイオン化された多糖に対し、CID法によってMS/MSを行う。その際のMS/MSのシグナル(フラグメントイオンピークパターン)が、前記法則に従って規則的に現れることを利用して、前記シグナルを解析する。このように、イオントラップによってトラップされたイオンから、MSのn乗(MSn)を分析する事によって、糖鎖の配列決定を短時間に行う事が可能である。本発明によれば、例えば、蛍光標織等のラベル化などの前処理を行なわずに配列解析を行なうことが可能である。これによれば、前処理による試料のロスが無いため、非常に効率良く分析する事が可能である。
【0026】
また、前記マススペクトルは、さらに高精度な構造解析のために、二重収束質量分析法を用いて測定されたマススペクトルであることが好ましい。
【0027】
さらに、図示のとおり、前記フラグメントイオンピークパターン取得工程(S2)で取得した前記フラグメントイオンピークパターンを、あらかじめ準備した多糖のフラグメントイオンピークパターンと対比することにより、前記多糖の糖鎖配列を解析する、前記糖鎖配列解析工程を行なう(S3)。前記あらかじめ準備したフラグメントイオンピークパターンは、例えば、配列が既知である多糖(糖鎖)のマススペクトル(フラグメントイオンピークパターン)をあらかじめ準備したものでもよい。
【0028】
さらに、前記糖鎖配列解析工程(S3)による解析結果を出力する、解析結果出力工程を行なう(S4)。ただし、本発明の糖鎖配列解析方法において、解析結果出力工程(S4)は、なくてもよい。
【0029】
本発明者らは、多糖の質量分析において、イオン化時に、多糖の糖鎖構造の非還元末端側から結合依存的に分子が壊裂するという、これまでに知られていなかった法則を見出し、本発明に到達した。すなわち、本発明の糖鎖配列解析方法は、多糖を構成する各単糖の配列を非還元末端側からシーケンシャルに解析する(配列順に逐次読み取る)ことが可能な、これまでに無い糖鎖配列解析方法である。このため、本発明の糖鎖配列解析方法は、単一種類の単糖から構成された多糖、および、構造が未知または新規である多糖にも適用できて、簡便、短時間かつ高精度に構造解析が可能である。
【0030】
また、本発明の糖鎖配列解析方法は、単独で用いてもよいが、他の分析方法と併用してもよい。例えば、多糖(糖鎖)を構成する各構成糖(単糖)の構造が不明な場合、前記各構成糖の分析(構造解析)と併用することによって、さらに高精度な解析が可能である。前記構成糖の分析(構造解析)方法は特に制限されず、例えば、NMR、UV(紫外可視吸収スペクトル法)、IR(赤外線吸収スペクトル法)等を用いてもよいし、前記多糖(糖鎖)を加水分解後、高速液体クロマトグラフィーにより分析してもよい。
【0031】
[糖鎖配列解析装置等]
本発明の糖鎖配列解析方法は、例えば、本発明の糖鎖配列解析装置を用いて行なうことができる。図2Aのブロック図に、本発明の糖鎖配列解析装置の一例を示す。図示のとおり、この装置は、フラグメントイオンピークパターン取得手段21および糖鎖配列解析手段22に加え、さらに、マススペクトル測定手段1および解析結果出力手段3を含む。本発明の糖鎖配列解析装置は、オリゴ糖配列の分析装置、または、多糖の配列解析のための糖鎖シーケンサとして用いることができる。
【0032】
マススペクトル測定手段1は特に制限されず、既存の質量分析装置を用いてもよい。前記質量分析装置については、前述のマススペクトルの説明の欄で記載したような測定が可能な装置が好ましい。また、本発明の糖鎖配列解析装置において、マススペクトル測定手段1は、なくてもよい。例えば、前記のように、本装置とは別の装置でマススペクトルおよびそのフラグメントイオンピークパターンを測定し、その測定データを用いてもよい。
【0033】
つぎに、フラグメントイオンピークパターン取得手段21およびフラグメントイオンピーク解析手段22は、パーソナルコンピュータ(PC)等の電子計算機2である。例えば、前記フラグメントイオンピークパターン取得工程およびフラグメントイオンピーク解析工程を実行可能なプログラムをインストールしたPCを用いればよい。図2Aに示すように、本装置において、マススペクトル測定手段(質量分析装置)を含む場合は、PCと質量分析装置を電気的に接続されている。また、解析結果出力手段3としては、例えば、プリンターおよびディスプレー等がある。本装置では、プリンター等もPCと電気的に接続されている。
【0034】
図2Bに、別の形態の本発明の糖鎖解析装置を示す。本装置は、マススペクトル測定手段を有さず、代わりに、フラグメントイオンピークパターン取得手段21が、インターネット接続手段等の通信手段である。また、本装置外のデータベース4には、本装置とは別の装置で測定されたマススペクトルデータが格納されている。本装置では、フラグメントイオンピークパターン取得手段21により、インターネット等の通信回線網5を介して、外部のデータベース4にアクセスし、格納されているマススペクトルデータを取得する。これら以外は、本装置は、図2Aの装置と同様である。
【0035】
なお、本発明の糖鎖配列解析方法は、本発明の糖鎖配列解析装置を用いずに行なうこともできる。例えば、前記フラグメントイオンピークパターンが記録されたマススペクトルデータを取得し、目視による確認のみで、前記フラグメントイオンピークパターンを、あらかじめ準備した多糖のフラグメントイオンピークパターンと対比することにより、前記多糖の糖鎖配列を解析してもよい。ただし、本発明の糖鎖配列解析方法は、本発明の糖鎖配列解析装置を用いて自動化すると、効率化が可能であるため好ましい。
【0036】
[実施形態1]
次に、本発明の具体的な実施形態について説明する。本実施形態では、前記糖鎖配列解析工程(S3)における糖鎖配列解析の具体的な手法について、前記多糖が単一の構成糖(グルコース)から成るオリゴ糖である場合を例として説明する。その他の工程、装置等は、前記のとおりでよい。
【0037】
図3および図4に、グルコースから成る、様々な結合を有する二糖(ビオース)の質量分析結果(マススペクトル図)を示す。図3は、β結合を有する二糖(グルコース二分子の縮合体)のマススペクトル図であり、上から順に、β1,1結合(ネオトレハロース)、β1,2結合(ソフォロース)、β1,3結合(ラミナリビオース)、β1,4結合(セロビオース)、β1,6結合(ゲンチオビオース)の測定結果である。図4は、α結合を有する二糖(グルコース二分子の縮合体)のマススペクトル図であり、上から順に、α1,1結合(トレハロース)、α1,2結合(コージビオース)、α1,3結合(ニゲロース)、α1,4結合(マルトース)、α1,6結合(イソマルトース)の測定結果である。図3および図4に示すように、同じくグルコースからなる二糖(ビオース)であっても、グルコース間の結合位置(1位〜6位)および結合様式(αまたはβ)に応じて、ESI−MS分析ピークのパターンが全て異なることが分かる。このように、各々の二糖が結合特異的なフラグメントイオンピークパターン(壊裂法則)を持つために、未知のサンプルであっても、ピークパターンから結合の状態を判別できるのである。この法則に則れば、理論上、全てのグルカン(グルコースが結合した糖鎖または多糖)の結合位置(1位〜6位)および結合様式(αまたはβ)を完全に解析する事ができる。例えばこのように、本発明の糖鎖配列解析方法における前記糖鎖配列解析工程では、隣接する前記各単糖の間の結合位置および結合様式を解析することが好ましい。
【0038】
図3および図4のスペクトル図は、例えば、下記の測定条件によるマススペクトル測定で得ることができる。まず、ESI−MSで、溶媒を、アセトニトリル:水=75:25として、イオン化した親イオンを検出する。この場合、前記イオン化した親イオンはグルコースの二糖であるため、質量数は342.16となるが、前記測定条件では、全てナトリウムアダクト型として検出されるので、342.16+23=365.16という質量のシグナルが得られる。これを、一度イオントラップでトラップする。この親イオンに対してCIDを行い、フラグメンテーション(内部壊裂)を起こさせて子イオン(フラグメントイオン)を発生させ、これを検出して、図3または図4のスペクトル図を得る。CIDは、具体的には、例えば、前記親イオンに、不活性ガスであるヘリウムを衝突させる事によって、内部壊裂(フラグメンテーション)を起こさせることができる。他の不活性化ガスとしては、アルゴンも用いられる。最適なイオンパワーは特に制限されず、適宜設定すればよいが、例えば、35%程度が最適である。なお、図3および図4のスペクトル図は、前記のように、自家によるマススペクトル測定(前記マススペクトル測定工程、図1のS1)により得てもよいし、それ以外の方法により取得してもよい。
【0039】
以下、親イオン(分子イオン)壊裂による子イオン(フラグメントイオン)生成の法則について、図4(α結合)を例として説明する。以下に示すように、全ての二糖において、非還元末端側が、部分的に、かつ結合特異的に壊裂するという法則が認められる。
【0040】
図5〜図9は、それぞれ、α1,1結合(トレハロース)、α1,2結合(コージビオース)、α1,3結合(ニゲロース)、α1,4結合(マルトース)、α1,6結合(イソマルトース)の分子イオンの壊裂パターンの例示である。各図において、右側が還元末端、左側が非還元末端である。例えば、図4最上段のα1,1結合(トレハロース)の場合、203という質量のフラグメントイオンピークがみられる。これは、図5に示すように、二糖が2つのグルコースに壊裂し、ナトリウムイオンが結合することにより、質量180.16(グルコース)+23(ナトリウムイオン)=203を示すものである。なお、α結合を有している場合、グリコシドボンド(グリコシド結合すなわち各グルコース間の結合)で切れるピークと、結合位置(1位〜6位)に特有なフラグメントイオンピークの両方が生じる。
【0041】
α1,2結合(コージビオース)においてCIDの後に生じるピーク(質量数:245)は、図6の矢印で壊裂した右側の部分である。α1,3結合(ニゲロース)のピーク(質量数:275)、α1,4結合(マルトース)のピーク(質量数:305)、α1,6結合(イソマルトース)のピーク(質量数:275および305)において、同様に、図7〜図9に示すとおりである。このように、必ず、糖鎖構造(グルカン)の非還元末端側から結合依存的に分子が壊裂する。この原理(法則)は、前記のとおり、本発明者らがはじめて見出したことである。この原理(法則)を利用すれば、糖鎖構造を非還元末端側からシーケンシャルに解析する事が可能となる。
【0042】
図3〜図9のデータは、標準的なグルカン二糖の分析結果から得られたものである。次に、三糖以上の多糖のシーケンシャルな解析(配列解析、構造解析)について、β1,3グルカンオリゴ糖(三糖)の解析結果を例として説明する。
【0043】
図10Aは、β1,3グルカンオリゴ糖(三糖)のマススペクトルを例示する図である。図10Bは、β1,3グルカンオリゴ糖(三糖)のマススペクトルの別の例を示すとともに、同図および図10Aにおけるイオンの壊裂パターンを模式的に示す図である。図10Aおよび図10Bにおいて、「MS」と示したスペクトルは、β1,3グルカンオリゴ糖(三糖)の親イオン(分子イオン)ピークを示す。「MS2」と記したスペクトルは、前記親イオンを1回CID壊裂させて生じた子イオン(フラグメントイオン)のスペクトルを示す。「MS3」と記したスペクトルは、前記子イオンをさらに1回CID壊裂させて生じた孫イオン(フラグメントイオン)のスペクトルを示す。図10AおよびBにおいて、測定条件は、図3および図4と同様である。なお、図10Cは、図10A左上のスペクトル図を拡大したものである。図10Dは、図10A右上のスペクトル図を拡大したものである。図10Eは、図10A左下のスペクトル図を拡大したものである。図10Fは、図10A右下のスペクトル図を拡大したものである。図10Gは、図10B左上のスペクトル図を拡大したものである。図10Hは、図10B右上のスペクトル図を拡大したものである。
【0044】
以下、β1,3グルカンオリゴ糖(三糖)の配列解析(構造解析)方法について、図10AおよびBに基づき説明する。β1,3グルカンオリゴ糖(三糖)の親イオンのピークは、Naイオンアダクトとして現れるので、質量は527.16となる(図10A左上、図10C)。このイオンをCIDで壊裂させると(MS2測定)、図10A右上(図10D)に示すとおり、509(527−18)および437(527−90)のピークが得られる。図10A右上(図10D)を見ると、203のピークが殆ど現れていない。したがって、前記の法則に基づき、非還元末端に最も近いグリコシド結合(各グルコース間の結合)が、β結合の1,3リンケージであることが分かる。
【0045】
次に、このオリゴ糖はグルカンであるため、親イオンから162(グルコース1つ分)を引いた質量数のピークを、図10A右上(図10D)の中から探す。図示のとおり、該当する365.16という質量数のピークを見出すことができる。このイオンをさらにCIDを用いて内部崩壊裂をさせると、347(365−18)と、275(365−90)が得られる(図10B左上、図10G)。図10B左上(図10G)においても、203のピークが殆ど現れていない。したがって、前記の法則に基づき、非還元末端側から2番目のグリコシド結合(各グルコース間の結合)が、β結合の1,3リンケージであることが分かる。なお、図10A右上(図10D、MS2測定)において、365以外のフラグメントイオンのCID壊裂(MS3測定)のスペクトル図は、図10A左下(図10E)、図10A右下(図10F)、および図10B右上(図10H)に示すとおりである。例えば、図10B右上(図10H)における203のピークは、グリコシド結合が壊裂したことを示すフラグメントイオンピークである。
【0046】
以上と同様の解析方法により、四糖以上のグルカンも、同様に、非還元末端側からシーケンシャルに解析が可能である。すなわち、具体的にまとめて示すと、前記多糖が、x個(xは2以上の整数)のグルコースのグリコシド結合により構成される(グルカンである)場合、以下のように配列解析できる。
【0047】
前記フラグメントイオンピークパターン取得工程において取得される前記フラグメントイオンピークパターンが、非還元末端と反対側からk個(kは、1以上、x以下の整数)のグルコースからなる分子イオンまたはフラグメントイオンをさらに壊裂させて得られるフラグメントイオンピークパターンPkを含む場合、前記フラグメントイオンピーク解析工程において、(x−k+1)番目のグリコシド結合の結合位置および結合様式を、以下のとおり判定する。この判定を、kの値を1からxまで変化して順に行なえば、全てのグリコシド結合の結合位置および結合様式を判定できる。すなわち、これにより、前記グルカンの配列解析(構造解析)を達成できる。
(1)Pkが、下記表左欄のピークを含む場合に、非還元末端側から(x−k+1)番目のグリコシド結合の結合位置が下記表右欄であると判定する。
(2)さらに、Pkが、グルコースイオンに由来するピークを所定値以上の強度で含む場合(mk−162がグルコースイオン由来ピークである場合を除く)に、前記(x−k+1)番目のグリコシド結合様式がα結合であると判定する。
(3)また、Pkが、グルコースイオンに由来するピークを含まないか、または前記グルコースイオンピークの強度が前記所定値未満の場合は、前記(x−k+1)番目のグリコシド結合の結合様式がβ結合であると判定する。
【表1】

【0048】
なお、前記(2)(3)において、グリコシド結合様式(αまたはβ)の判断基準である前記グルコースイオンピーク強度の「所定値」は、誤判定が少なくなるように、例えば、既知のグルカンの、同条件におけるマススペクトル等を基準にして適宜設定すればよい。前記「所定値」は、具体的には、例えば、基準ピークイオン強度の8%〜31%、好ましくは10%〜28%、より好ましくは15%〜25%である。なお、「基準イオンピーク強度」は、フラグメントイオンピークパターン中、相対強度が最も大きいイオンピーク(基準イオンピーク)の強度をいう。
【0049】
さらに、グルコース以外の単糖から構成された糖鎖(多糖)、複数種類の単糖から構成された糖鎖(多糖)においても、非還元末端側から結合依存的に分子が壊裂するという法則に基づけば、同様に、非還元末端側からシーケンシャルに解析が可能である。さらに、前記各単糖(構成糖)が、任意の水素原子または水酸基が他の原子または置換基で置換された誘導体である場合にも、同様に、非還元末端側からシーケンシャルに解析が可能である。このようにすれば、複雑な糖鎖の配列解析(構造解析)も可能である。
【0050】
このように、本発明の糖鎖配列解析方法によれば、多糖の質量分析において、イオン化時に、多糖の糖鎖構造の非還元末端側から結合依存的に分子が壊裂するという法則に基づき、多糖を構成する各単糖の配列を非還元末端側からシーケンシャルに解析する(配列順に逐次読み取る)ことができる。本発明によれば、例えば、前記フラグメントイオンピークパターンの解析において、隣接する前記各単糖の間の結合位置および結合様式の両方を解析することも可能である。また、本発明によれば、例えば、従来のメチル化法やNMRを用いた分析では難しかった未知または新規な糖質の構造解析を、簡便に高精度で行うことができる。このような法則および本発明の優れた効果については、本願出願時までには何ら知られておらず、本発明者らがはじめて見出したことである。
【実施例】
【0051】
[実施例1]
グルコースから成る、様々な結合を有する二糖(ビオース)について、実際に質量分析を行い、フラグメントイオンピークパターンを取得し、さらにその解析を行なうことで、糖鎖配列を解析した。測定条件は、前記実施形態1に示したとおりである。すなわち、測定モードはESI−MSで、溶媒は、アセトニトリル:水=75:25とした。これにより検出された親イオン(質量数342.16、ナトリウムアダクト型)を、一度イオントラップでトラップした。この親イオンに対してCID(衝突誘起解離)を行い、フラグメンテーション(内部壊裂)を起こさせて子イオン(フラグメントイオン)を発生させ、これを検出して、図3または図4のスペクトル図を得た。CIDは、前記親イオンに、不活性ガスであるヘリウムを衝突させる事によって行なった。イオンパワーは、35%程度に調整した。前述のとおり、図3は、β結合を有する二糖(グルコース二分子の縮合体)のマススペクトル図であり、上から順に、β1,1結合(ネオトレハロース)、β1,2結合(ソフォロース)、β1,3結合(ラミナリビオース)、β1,4結合(セロビオース)、β1,6結合(ゲンチオビオース)の測定結果である。図4は、α結合を有する二糖(グルコース二分子の縮合体)のマススペクトル図であり、上から順に、α1,1結合(トレハロース)、α1,2結合(コージビオース)、α1,3結合(ニゲロース)、α1,4結合(マルトース)、α1,6結合(イソマルトース)の測定結果である。前記実施形態1において説明したように、全ての二糖において、非還元末端側が、部分的に、かつ結合特異的に壊裂し、それぞれ異なるフラグメントイオンピークパターンを示すことが確認された。このようにして、前記各二糖の配列解析(構造解析)を行うことができた。なお、前記各二糖のフラグメントイオンピークパターンにおいて、グリコシド結合がα結合の場合、基準イオンピーク強度に対するグルコースイオンピーク(質量数:203)の強度比が大きく現れ、最も小さいものでも基準イオンピーク強度の31%であった。また、例えば、グリコシド結合がα1,2結合(コージビオース)の場合、グルコースイオンピークのピーク強度(強度比)は、基準イオンピーク(質量数:245)強度の93%ときわめて大きい値を示した。これに対し、グリコシド結合がβ結合の場合は、β1,1結合(ネオトレハロース)を除いて、グルコースイオンピークがほとんど現れなかった。具体的には、グルコースイオンピークのピーク強度比は、最も大きく現れたβ1,4結合(セロビオース)において、基準イオンピーク強度の7.1%であった。β1,2結合(ソフォロース)、β1,3結合(ラミナリビオース)、β1,6結合(ゲンチオビオース)においては、グルコースイオンピークがほとんど観測されなかった。
【0052】
[実施例2]
実施例1と同様の測定条件により、β1,3グルカンオリゴ糖(三糖)のマススペクトルを測定し、フラグメントイオンピークパターンを取得した。前記実施形態1で述べた方法により、前記フラグメントイオンピークパターンを解析し、配列解析(構造解析)を行った。スペクトルおよび解析方法は、図10A〜Gを用いて説明したとおりである。
【産業上の利用可能性】
【0053】
以上説明したとおり、本発明によれば、単一種類の単糖から構成された多糖、および、構造が未知または新規である多糖にも適用できて、簡便、短時間かつ高精度に構造解析が可能な糖鎖配列解析方法、糖鎖配列解析装置、プログラム、および記録媒体を提供することができる。本発明は、多糖の糖鎖構造の非還元末端側から結合依存的に分子が壊裂するという、本発明者らが見出した前記法則を、糖鎖配列解析の基本原理として用いることができる。このため、糖鎖に関する広範な分野に適用可能であり、産業上の利用価値は多大である。
【符号の説明】
【0054】
1 マススペクトル測定手段
2 PC等
21 フラグメントイオンピークパターン取得手段
22 フラグメントイオンピークパターン解析手段
3 解析結果出力手段
4 データベース
5 インターネット
【特許請求の範囲】
【請求項1】
多糖の糖鎖配列解析方法であって、
前記多糖を構成する各単糖内の共有結合、および前記各単糖間の共有結合のうち少なくとも一つの共有結合を、イオン化により非還元末端側から順に壊裂させて測定したマススペクトルのフラグメントイオンピークパターンを取得する、フラグメントイオンピークパターン取得工程と、
前記フラグメントイオンピークパターンを、あらかじめ準備した多糖のフラグメントイオンピークパターンと対比することにより、前記多糖の糖鎖配列を解析する糖鎖配列解析工程とを含むことを特徴とする、糖鎖配列解析方法。
【請求項2】
前記多糖を構成する各単糖が、全て同じである請求項1記載の糖鎖配列解析方法。
【請求項3】
前記多糖が、x個(xは2以上の整数)のグルコースのグリコシド結合により構成され、
前記フラグメントイオンピークパターン取得工程において取得される前記フラグメントイオンピークパターンが、非還元末端と反対側からk個(kは、1以上、x以下の整数)のグルコースからなる分子イオンまたはフラグメントイオンをさらに壊裂させて得られるフラグメントイオンピークパターンPkを含み、
前記フラグメントイオンピーク解析工程において、
Pkが、下記表左欄のピークを含む場合に、非還元末端側から(x−k+1)番目のグリコシド結合の結合位置が下記表右欄であると判定し、
Pkが、グルコースイオンに由来するピークを所定値以上の強度で含む場合(mk−162がグルコースイオン由来ピークである場合を除く)に、前記(x−k+1)番目のグリコシド結合様式がα結合であると判定し、
Pkが、グルコースイオンに由来するピークを含まないか、または前記グルコースイオンピークの強度が前記所定値未満の場合に、前記(x−k+1)番目のグリコシド結合の結合様式がβ結合であると判定する、
請求項2記載の糖鎖配列解析方法。
【表1】

【請求項4】
前記糖鎖配列解析工程において、隣接する前記各単糖の間の結合位置および結合様式を解析する請求項1から3のいずれか一項に記載の糖鎖配列解析方法。
【請求項5】
前記フラグメントイオンピークパターン取得工程において、前記マススペクトルが、MSn測定により測定されたマススペクトルである請求項1から4のいずれか一項に記載の糖鎖配列解析方法。
【請求項6】
請求項1から5のいずれか一項に記載の糖鎖配列解析方法をコンピュータ上で実行可能なプログラム。
【請求項7】
請求項6記載のプログラムを記録した記録媒体。
【請求項8】
多糖の糖鎖配列解析装置であって、
前記多糖を構成する各単糖内の共有結合、および前記各単糖間の共有結合のうち少なくとも一つの共有結合を、イオン化により非還元末端側から順に壊裂させて測定したマススペクトルのフラグメントイオンピークパターンを取得する、フラグメントイオンピークパターン取得手段と、
前記フラグメントイオンピークパターンを、あらかじめ準備した多糖のフラグメントイオンピークパターンと対比することにより、前記多糖の糖鎖配列を解析する糖鎖配列解析手段とを含むことを特徴とする、糖鎖配列解析装置。
【請求項9】
前記多糖を構成する各単糖が、全て同じである請求項8記載の糖鎖配列解析装置。
【請求項10】
前記多糖が、x個(xは2以上の整数)のグルコースのグリコシド結合により構成され、
前記フラグメントイオンピークパターン取得手段において取得する前記フラグメントイオンピークパターンが、非還元末端と反対側からk個(kは、1以上、x以下の整数)のグルコースからなる分子イオンまたはフラグメントイオンをさらに壊裂させて得られるフラグメントイオンピークパターンPkを含み、
前記フラグメントイオンピーク解析手段において、
Pkが、下記表左欄のピークを含む場合に、非還元末端側から(x−k+1)番目のグリコシド結合の結合位置が下記表右欄であると判定し、
Pkが、グルコースイオンに由来するピークを所定値以上の強度で含む場合(mk−162がグルコースイオン由来ピークである場合を除く)に、前記(x−k+1)番目のグリコシド結合様式がα結合であると判定し、
Pkが、グルコースイオンに由来するピークを含まないか、または前記グルコースイオンピークの強度が前記所定値未満の場合に、前記(x−k+1)番目のグリコシド結合の結合様式がβ結合であると判定する、
請求項9記載の糖鎖配列解析装置。
【表1】

【請求項11】
前記糖鎖配列解析手段において、隣接する前記各単糖の間の結合位置および結合様式を解析する請求項8から10のいずれか一項に記載の糖鎖配列解析装置。
【請求項12】
前記フラグメントイオンピークパターン取得手段において、前記マススペクトルとして、MSn測定により測定されたマススペクトルを取得する請求項8から11のいずれか一項に記載の糖鎖配列解析装置。
【請求項13】
さらに、前記糖鎖配列解析手段により解析した解析結果を出力する、解析結果出力手段を含む、請求項8から12のいずれか一項に記載の糖鎖配列解析装置。
【請求項14】
さらに、前記マススペクトルを測定するマススペクトル測定手段を含む、請求項8から13のいずれか一項に記載の糖鎖配列解析装置。
【請求項1】
多糖の糖鎖配列解析方法であって、
前記多糖を構成する各単糖内の共有結合、および前記各単糖間の共有結合のうち少なくとも一つの共有結合を、イオン化により非還元末端側から順に壊裂させて測定したマススペクトルのフラグメントイオンピークパターンを取得する、フラグメントイオンピークパターン取得工程と、
前記フラグメントイオンピークパターンを、あらかじめ準備した多糖のフラグメントイオンピークパターンと対比することにより、前記多糖の糖鎖配列を解析する糖鎖配列解析工程とを含むことを特徴とする、糖鎖配列解析方法。
【請求項2】
前記多糖を構成する各単糖が、全て同じである請求項1記載の糖鎖配列解析方法。
【請求項3】
前記多糖が、x個(xは2以上の整数)のグルコースのグリコシド結合により構成され、
前記フラグメントイオンピークパターン取得工程において取得される前記フラグメントイオンピークパターンが、非還元末端と反対側からk個(kは、1以上、x以下の整数)のグルコースからなる分子イオンまたはフラグメントイオンをさらに壊裂させて得られるフラグメントイオンピークパターンPkを含み、
前記フラグメントイオンピーク解析工程において、
Pkが、下記表左欄のピークを含む場合に、非還元末端側から(x−k+1)番目のグリコシド結合の結合位置が下記表右欄であると判定し、
Pkが、グルコースイオンに由来するピークを所定値以上の強度で含む場合(mk−162がグルコースイオン由来ピークである場合を除く)に、前記(x−k+1)番目のグリコシド結合様式がα結合であると判定し、
Pkが、グルコースイオンに由来するピークを含まないか、または前記グルコースイオンピークの強度が前記所定値未満の場合に、前記(x−k+1)番目のグリコシド結合の結合様式がβ結合であると判定する、
請求項2記載の糖鎖配列解析方法。
【表1】

【請求項4】
前記糖鎖配列解析工程において、隣接する前記各単糖の間の結合位置および結合様式を解析する請求項1から3のいずれか一項に記載の糖鎖配列解析方法。
【請求項5】
前記フラグメントイオンピークパターン取得工程において、前記マススペクトルが、MSn測定により測定されたマススペクトルである請求項1から4のいずれか一項に記載の糖鎖配列解析方法。
【請求項6】
請求項1から5のいずれか一項に記載の糖鎖配列解析方法をコンピュータ上で実行可能なプログラム。
【請求項7】
請求項6記載のプログラムを記録した記録媒体。
【請求項8】
多糖の糖鎖配列解析装置であって、
前記多糖を構成する各単糖内の共有結合、および前記各単糖間の共有結合のうち少なくとも一つの共有結合を、イオン化により非還元末端側から順に壊裂させて測定したマススペクトルのフラグメントイオンピークパターンを取得する、フラグメントイオンピークパターン取得手段と、
前記フラグメントイオンピークパターンを、あらかじめ準備した多糖のフラグメントイオンピークパターンと対比することにより、前記多糖の糖鎖配列を解析する糖鎖配列解析手段とを含むことを特徴とする、糖鎖配列解析装置。
【請求項9】
前記多糖を構成する各単糖が、全て同じである請求項8記載の糖鎖配列解析装置。
【請求項10】
前記多糖が、x個(xは2以上の整数)のグルコースのグリコシド結合により構成され、
前記フラグメントイオンピークパターン取得手段において取得する前記フラグメントイオンピークパターンが、非還元末端と反対側からk個(kは、1以上、x以下の整数)のグルコースからなる分子イオンまたはフラグメントイオンをさらに壊裂させて得られるフラグメントイオンピークパターンPkを含み、
前記フラグメントイオンピーク解析手段において、
Pkが、下記表左欄のピークを含む場合に、非還元末端側から(x−k+1)番目のグリコシド結合の結合位置が下記表右欄であると判定し、
Pkが、グルコースイオンに由来するピークを所定値以上の強度で含む場合(mk−162がグルコースイオン由来ピークである場合を除く)に、前記(x−k+1)番目のグリコシド結合様式がα結合であると判定し、
Pkが、グルコースイオンに由来するピークを含まないか、または前記グルコースイオンピークの強度が前記所定値未満の場合に、前記(x−k+1)番目のグリコシド結合の結合様式がβ結合であると判定する、
請求項9記載の糖鎖配列解析装置。
【表1】

【請求項11】
前記糖鎖配列解析手段において、隣接する前記各単糖の間の結合位置および結合様式を解析する請求項8から10のいずれか一項に記載の糖鎖配列解析装置。
【請求項12】
前記フラグメントイオンピークパターン取得手段において、前記マススペクトルとして、MSn測定により測定されたマススペクトルを取得する請求項8から11のいずれか一項に記載の糖鎖配列解析装置。
【請求項13】
さらに、前記糖鎖配列解析手段により解析した解析結果を出力する、解析結果出力手段を含む、請求項8から12のいずれか一項に記載の糖鎖配列解析装置。
【請求項14】
さらに、前記マススペクトルを測定するマススペクトル測定手段を含む、請求項8から13のいずれか一項に記載の糖鎖配列解析装置。
【図1】


【図2A】


【図2B】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10A】


【図10B】


【図10C】


【図10D】


【図10E】


【図10F】


【図10G】


【図10H】




【図2A】


【図2B】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10A】


【図10B】


【図10C】


【図10D】


【図10E】


【図10F】


【図10G】


【図10H】


【公開番号】特開2011−257354(P2011−257354A)
【公開日】平成23年12月22日(2011.12.22)
【国際特許分類】
【出願番号】特願2010−134124(P2010−134124)
【出願日】平成22年6月11日(2010.6.11)
【出願人】(304028346)国立大学法人 香川大学 (285)
【Fターム(参考)】
【公開日】平成23年12月22日(2011.12.22)
【国際特許分類】
【出願日】平成22年6月11日(2010.6.11)
【出願人】(304028346)国立大学法人 香川大学 (285)
【Fターム(参考)】
[ Back to top ]

