糖類測定用蛍光モノマー化合物、糖類測定用蛍光センサー物質および体内埋め込み用の糖類測定用センサー
【課題】 グルコースなどの糖類検出能に優れる蛍光モノマー化合物、蛍光センサー物質および該蛍光センサー物質を使用した糖類測定用センサーを提供する。
【解決手段】 糖類と結合して蛍光を発する疎水性部位に親水性基を導入した蛍光モノマー化合物および、該蛍光モノマー化合物と(メタ)アクリルアミド残基を有する重合性単量体とを共重合することにより得られた蛍光センサー物質である。親水性基の導入により、蛍光センサー物質の糖類結合能が向上する。
【解決手段】 糖類と結合して蛍光を発する疎水性部位に親水性基を導入した蛍光モノマー化合物および、該蛍光モノマー化合物と(メタ)アクリルアミド残基を有する重合性単量体とを共重合することにより得られた蛍光センサー物質である。親水性基の導入により、蛍光センサー物質の糖類結合能が向上する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、糖類の検出能に優れる蛍光モノマー化合物、蛍光センサー物質、その製造方法およびそれらを用いた体内埋め込み用の糖類測定用センサー等に関する。
【背景技術】
【0002】
体内埋め込み型センサーは、様々な疾患においてその病状の経過観察や治療効果のモニタなどに有用であり、近年、盛んに研究されている分野の一つである。特に糖尿病治療においては、連続血糖測定による血糖コントロールが、病状の進行遅延や合併症の罹病の低減に貢献すると言われている。
【0003】
現状の糖尿病患者の多くは、血糖の自己管理のために、指等の穿刺によって血液試料を採取し、血糖計に供給して測定値を読み取ることを行っている。しかし、このような方法は患者への苦痛や簡便性のうえで問題があり、一日に数回の測定が限界で、血糖値変化の動向を頻繁に測定して把握することが難しいのが現状である。このような理由から、埋め込み型連続血糖計の有用性は高いと考えられる。
【0004】
一方、生体内のグルコース濃度を継続的に測定するための技術開発は古くからなされており、たとえば、可逆的にグルコースと反応して蛍光を発する物質を用いて蛍光量の変化でグルコース濃度を測定するものがある。このような蛍光物質として、発蛍光性原子団と、少なくとも1つのフェニルボロン酸部位と、少なくとも1つのアミン性窒素とを有し、アミン性窒素がフェニルボロン酸部位の近傍に配置されて該フェニルボロン酸と分子内結合する分子構造を有する発蛍光性化合物が開示されている(特許文献1)。発蛍光性原子団としては、ナフチル基やアンスリル基などがある。該化合物は、そのボロン酸部位を介して糖分子と安定なコンプレックスを形成すると蛍光を発する、というものである。
【0005】
また、水性環境中での検体の濃度検出のための指示高分子として、親水性モノマーと、アントラセンホウ酸エステル誘導体などのエシキマー形成多環芳香族炭化水素とを有する化合物も開示されている(特許文献2)。該エシキマー形成多環芳香族炭化水素は水への溶解性が充分でないためメタクリルアミドなどの親水性基を導入し、水性環境中でも検体濃度を検出できるようにしたものである。
【0006】
また、蛍光センサーとして、プラスチックフィルムなどの固相に直接蛍光物質を固定化する方法も開示されている(特許文献3)。特許文献3では発光性、発蛍光性または発色性の原子団にフェニルボロン酸をただ一つ付加したものを用いている。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開平8−53467号公報
【特許文献2】特表2004−506069号公報
【特許文献3】米国特許第6,319,540号明細書
【発明の概要】
【発明が解決しようとする課題】
【0008】
しかしながら、上記特許文献1記載の化合物は、発蛍光性原子団としてナフチル基やアンスリル基などの嵩高くかつ疎水性の部位を有するため、水溶性の糖類との結合が容易でなく、検出感度の向上が望まれる。また、特許文献2記載の化合物は、実施例6のGにおいてメタクリル酸などの親水性モノマーと重合を行う際に、エチレングリコールを溶液として用いている。
【0009】
一方、蛍光センサーとして使用するために蛍光物質を直接基材に固定すると、蛍光物質による被検出物質の検出能が固定前よりも低下する場合がある。
【0010】
このような状況下、本発明は、グルコースなどの糖類検出能に優れる蛍光モノマー化合物、蛍光センサー物質および該蛍光センサー物質を使用した糖類測定用センサーを提供することを目的とする。
【課題を解決するための手段】
【0011】
本発明者は、糖類測定用蛍光モノマー化合物における糖類の結合状態を詳細に検討した結果、糖類検出のためのモノマー化合物に親水性基を導入すると、該疎水性部位の自由度を確保しつつ糖類との結合を促進できること、更に該蛍光モノマー化合物を(メタ)アクリルアミドと共重合させると、これを基材に固定した場合であっても血液や体液などの水溶液中でも検出感度を下げることなく、糖類の測定ができることを見出し、本発明を完成させた。
【発明の効果】
【0012】
本発明による、糖類測定用の蛍光モノマー化合物、蛍光センサー物質、および検出層は糖類検出能に優れる。また、体液中の糖類検出能に優れるため、長期間の埋め込みに耐える蛍光センサーとなる。
【図面の簡単な説明】
【0013】
【図1】本発明の蛍光モノマー化合物の一例の合成スキームである。
【図2】光学分離層の概念図である。
【図3】本発明の体内埋め込み用の糖類測定用センサーの外観の斜視図である。
【図4】本発明の体内埋め込み用の糖類測定用センサーの内部構造を示す図である。
【図5】実施例4の蛍光モノマー化合物の合成スキームである。
【図6】実施例2、実施例4および比較例の蛍光センサー物質のグルコース応答性を示す図である。
【発明を実施するための形態】
【0014】
本発明の第一は、化学式1に示す蛍光モノマー化合物である。
【0015】
【化1】

【0016】
化学式1において、X1およびX2は同一または異なっていてもよく、−COO−、−OCO−、−CH2NR−、−NR−、−NRCO−、−CONR−、−SO2NR−、−NRSO2−、−O−、−S−、−SS−、−NRCOO−、−OCONR−および−CO−からなる群より選択される少なくとも1種の置換基を含む炭素数1〜30のアルキレンを示し、Rは水素または置換されていてもよいアルキル基である。本明細書において少なくとも1種の置換基を含むアルキレンとは、アルキレンの端部に置換基を結合したもの、およびアルキレンの鎖中に置換基を有するものをいう。アルキレンの炭素数は1〜30が好ましく、より好ましくは3〜12である。具体的にはプロピレン、ヘキシレンおよびオクチレンなどがある。該アルキレンに含まれる置換基としては、好ましくは−NRCO−および−CONR−が好ましい。Rがアルキル基である場合、炭素数1〜10のものが好ましく、より好ましくは1〜5である。具体的にはメチル基、エチル基、プロピル基、ブチル基またはペンチル基などがある。Rとしては水素が好ましい。
【0017】
化学式1において、Z1およびZ2は同一または異なっていてもよく、−O−または−NR’−を示し、R’は水素または置換されてもよいアルキル基を示す。アルキル基としては、炭素数1〜10のものが好ましく、より好ましくは1〜5である。具体的にはメチル基、エチル基、プロピル基、ブチル基またはペンチル基などがある。Z1およびZ2としては、−O−が好ましい。
【0018】
化学式1において、Y1およびY2は同一または異なっていてもよく、置換されていてもよい2価の有機残基であり、蛍光モノマー化合物を水に溶解させうる。本発明において「蛍光モノマー化合物を水に溶解させうる」とは、有機溶媒や可溶化剤の存在無しに、蛍光モノマー化合物が、温度25℃pH7.0の条件下において濃度1mM以上水に溶解し得ることをいう。Y1およびY2としてアミノ基、カルボキシル基、スルホ基、ニトロ基、アミノ基、リン酸基および水酸基などの親水性基を有するものや、構造中にエーテル結合、アミド結合およびエステル結合などの親水性結合を有するものが例示できる。
【0019】
また、Y1およびY2は該有機残基中に、下記化学式2または化学式3に示す構造を含むことが好ましく、更に、他の置換基や2価の有機残基を有していてもよい。化学式2〜3において、nは2〜4が好ましく、より好ましくは2または3であり、jは1〜3が好ましく、より好ましくは1であり、mは20〜150が好ましく、より好ましくは40〜120である。
【0020】
該Yの分子量としては500〜10,000が好ましく、より好ましくは1,000〜5,000である。化学式2または化学式3で示す2価の有機残基は、例えばエチレングリコール、プロピレングリコールなどのアルキレングリコールまたはビニルアルコールなどを重合することで、調製することができる。
【0021】
【化2】

【0022】
本発明の特徴である蛍光モノマー化合物は親水性鎖Yの導入によって、より具体的には以下のような効果が得られる。(1)蛍光モノマー化合物が水溶性となるため、蛍光センサー物質を形成する際の固定化や重合反応を効率良く行う事が出来る。例えばアクリルアミドゲルを作製する場合は、水のみを溶媒として重合が可能であり、物理的強度、安定性、均一性が高いものが得られる。疎水性のモノマー化合物では可溶化させるために有機溶媒等を使用する必要があり、良好でない性状のゲルとなる場合がある。(2)親水性鎖の導入は被検出物質と相互作用するフェニルボロン酸周辺の環境や運動性を変化させ、感度、精度、応答速度、被測定物質である糖類の選択性の向上に寄与する。(3)親水性鎖が蛍光センサー物質全体、例えば重合された構造を安定化する。(4)水のみで反応できるため、有機溶剤に侵されやすい基材、例えばアクリル製のプレート等の上でも重合を行う事が出来る。
【0023】
化学式1において、Q、Q’、Q’’およびQ’’’は、水素、水酸基、置換されていてもよいアルキル基、アシル基、オキシアルキル基、ハロゲン、カルボキシル基、カルボキシエステル、カルボキシアミド、シアノ基、ニトロ基、アミノ基およびアミノアルキル基からなる群より選択される置換基である。アルキル基としては、炭素数1〜10のものが好ましく、具体的にはメチル基、エチル基、プロピル基、ブチル基またはペンチル基などがあり;アシル基としては、ホルミル基、アセチル基、プロピオニル基、ブチリル基またはイソブチリル基などがあり;オキシアルキル基としては、メトキシ基、エトキシ基などがあり;ハロゲンとしては、F−、Cl−、Br−、またはI−などがあり;アミノアルキル基としては、メチルアミノ基、エチルアミノ基などがある。Q、Q’、Q’’およびQ’’’は同一または異なっていてもよく、QおよびQ’は一緒になって縮合環を形成していてもよく、Q’’およびQ’’’は一緒になって縮合環を形成していてもよい。Q、Q’、Q’’およびQ’’’として、ニトロ基、シアノ基またはアシル基などを導入すると、蛍光の赤色変移または励起波長ピークと蛍光波長ピークとの間隔拡大に寄与するといった効果が得られる。本発明では、Q、Q’、Q’’およびQ’’’のうち、少なくとも一つが、アセチル基、カルボキシエステルおよびシアノ基からなる群より選択される1種であり、残りが水素であることが好ましい。
【0024】
本発明の蛍光モノマー化合物は、糖類検出のためのモノマー化合物に上記Xを介してYを導入する点に特徴があり、これによって蛍光モノマー化合物の物理的性質や安定性、検出感度、検出精度、被測定物質である糖類の選択性などを向上させることができる。
【0025】
なお、上記のように、本発明の蛍光モノマー化合物はアントラセン骨格を含むフェニルボロン酸誘導体であり、アントラセン骨格は発蛍光性原子団として作用することが知られている。フェニルボロン酸部位と糖とが安定な複合体を形成すると、発蛍光性原子団の介在によって蛍光を発するが、本発明の蛍光モノマー化合物は2つのフェニルボロン酸を有するため、特に糖類の検出感度に優れている。なお、化学式1においてZ1、およびZ2に結合するCOCHCH2は、該蛍光モノマー化合物が血液などの体液に溶解しないように基材その他と結合させるために導入したものである。
【0026】
本発明の第二は、少なくとも以下に記載の(I)および(II)の2種の化合物を共重合してなる糖類測定用の蛍光センサー物質である。
(I):上記化学式1で示す蛍光モノマー化合物
(II):(メタ)アクリルアミド残基を含む重合性単量体
上記蛍光モノマー化合物を用いて血液に含まれる糖類を検出するには、該蛍光モノマー化合物が、血液または体液などの水溶液に溶解したり流出したりしないように固定される必要がある。しかしながら、単に蛍光モノマー化合物を基材に固定すると、該蛍光モノマー化合物と糖との接触および結合が阻害され検出感度が低下する。本発明では、該蛍光モノマー化合物と(メタ)アクリルアミド残基を含む重合性単量体を共重合させ、該蛍光モノマー化合物に親水性のポリ(メタ)アクリルアミド鎖を導入して固定化することで蛍光モノマー化合物を不溶化し、かつ該蛍光モノマー化合物と糖との親和性を確保する。
【0027】
(メタ)アクリルアミド残基を含む重合性単量体としては、得られた重合体がその構造中にアクリロイル基とアミドとを有すればよく、(メタ)アクリルアミドやそれらの誘導体が含まれる。例えば、アクリルアミド、メタクリルアミド、N,N−ジメチルアクリルアミド、N−イソプロピルアクリルアミド、N−tert−ブチルアクリルアミド、N−tris−ヒドロキシメチルアクリルアミド、N−ヒドロキシメチルアクリルアミド、N−(n−ブトキシメチル)アクリルアミド、N−アクリルオイルリジンやN−アクリルオイルヘキサメチレンジアミンなどの(メタ)アクリルオイルクロライドとアミノ酸または活性アミノ基をもつ化合物との縮合体、および化学式4に示す化合物等がある。
【0028】
【化3】

【0029】
化学式4において、Aは、水素またはメチル基であり、UおよびU’は同一または異なっていてもよく、水素または置換されていてもよいアルキル基である。アルキル基としては、メチル基、エチル基、プロピル基、ブチル基またはペンチル基などがある。
【0030】
(メタ)アクリルアミド残基を含む重合性単量体からなる重合体は親水性が高いため、蛍光モノマー化合物と結合すると、該蛍光モノマー化合物に存在するフェニルボロン酸を含む疎水性の強い発蛍光性原子団が親水性の高い構造体中に取り込まれる。これによって血液や体液に含まれる糖類を測定する場合であっても、水溶性の糖類が容易に該発蛍光性原子団に接近および結合することができる。
【0031】
蛍光センサー物質を構成する、該蛍光モノマー化合物(I)と該アクリルアミド残基を含む重合性単量体(II)との共重合体組成モル比((I):(II))は1:50〜1:6,000であることが好ましく、より好ましくは1:150〜1:3,000である。モル比1:50よりも蛍光モノマー化合物の割合が大きくなると、該蛍光モノマー化合物の嵩高さのため自由度が失われ、糖類との相互作用が低下するおそれがある。一方、モル比1:6,000よりも蛍光モノマー化合物の割合が小さければ、蛍光強度の絶対量を確保できない場合がある。
【0032】
上記二成分からなる蛍光センサー物質の、重量平均分子量は、GPCによるポリエチレンオキサイド換算で、50,000〜750,000が好ましく、より好ましくは150,000〜450,000である。
【0033】
一方、本発明の蛍光センサー物質は、上記蛍光モノマー化合物と(メタ)アクリルアミド残基を含む重合性単量体とに加えて他の成分を併用してもよい。このような成分としては、架橋性単量体、他の架橋性成分、水中で陽イオンとなり得るカチオン性モノマー、水中で陰イオンとなり得るアニオン性モノマー、およびイオンを持たないノニオン系モノマーがある。
【0034】
架橋性単量体としては、重合性二重結合によって蛍光センサー物質中に三次元架橋構造を導入し得るものを広く含み、使用する蛍光センサー物質の置換基によっても異なるが、N,N’−メチレンビス(メタ)アクリルアミド、N,N’−(1,2−ジヒドロキシエチレン)−ビス(メタ)アクリルアミド、ジエチレングリコールジ(メタ)アクリレート、(ポリ)エチレングリコールジ(メタ)アクリレート、トリエチレングリコールジ(メタ)アクリレート、プロピレングリコールジ(メタ)アクリレート、トリメチロールプロパンジ(メタ)アクリレート、トリメチロールプロパントリ(メタ)アクリレート、ペンタエリスリトールジ(メタ)アクリレート、ペンタエリスリトールトリ(メタ)アクリレート、ペンタエリスリトールテトラ(メタ)アクリレート、(ポリ)プロピレングリコールジ(メタ)アクリレート、グリセリントリ(メタ)アクリレート、グリセリンアクリレートメタクリレート、エチレンオキサイド変性トリメチロールプロパントリ(メタ)アクリレート、ペンタエリスリトールテトラ(メタ)アクリレート、ジペンタエリスリトールヘキサ(メタ)アクリレートなどのジビニル化合物がある。本発明では、これらの2種以上を併用してもよい。
【0035】
他の架橋性成分としては、2個以上の官能基を有する化合物を広く含み、使用する蛍光センサー物質の置換基によっても異なるが、トリアリルシアヌレート、トリアリルイソシアヌレート、トリアリルホスフェート、トリアリルアミン、ポリ(メタ)アリロキシアルカン、(ポリ)エチレングリコールジグリシジルエ−テル、グリセロールジグリシジルエーテル、エチレングリコール、ポリエチレングリコール、プロピレングリコール、グリセリン、ペンタエリスリトール、エチレンジアミン、ポリエチレンイミン、グリシジル(メタ)アクリレート、イソシアヌル酸トリアリル、トリメチロールプロパンジ(メタ)アリルエーテル、テトラアリロキシエタンまたはグリセロールプロポキシトリアクリレートなども挙げることが出来る。本発明では、これらの2種以上を併用してもよい。
【0036】
水中で陽イオンとなり得るカチオン性モノマーとしては、ジメチルアミノエチル(メタ)アクリレート、ジエチルアミノエチル(メタ)アクリレートまたは4−ビニルピリジンなどを挙げることができる。本発明では、これらの2種以上を併用してもよい。
【0037】
水中で陰イオンとなり得るアニオン性モノマーとしては、(メタ)アクリル酸、ビニルプロピオン酸または4−ビニルベンゼンスルホン酸などを挙げることができる。本発明では、これらの2種以上を併用してもよい。
【0038】
イオンを持たないノニオン系モノマーとしては、2−ヒドロキシエチル(メタ)アクリレート、3−メトキシプロピル(メタ)アクリレート、4−ヒドロキシブチル(メタ)アクリレート、2−メトキシエチルアクリレートまたは1,4−シクロヘキサンジメタノールモノアクリレートなどを挙げることができる。本発明では、これらの2種以上を併用してもよい。
【0039】
またこれらの架橋性単量体、他の架橋性成分、カチオン性モノマー、アニオン性モノマーおよびノニオン系モノマーは2種以上併用してもよい。これらの他の成分の配合量は、蛍光モノマー化合物と(メタ)アクリルアミド残基を含む重合性単量体との合計量の0.1〜10モル%が好ましく、より好ましくは2〜7モル%である。これら他の成分の併用によって、三次元架橋構造を形成させることができ、また、親水性の調節、反応起点の導入などを行うことができる。なお、三次元架橋構造については後述する。
【0040】
本発明の蛍光センサー物質として、化学式5に示される構造を有していることが好ましい。
【0041】
【化4】

【0042】
化学式5において、X1、X2、Z1、Z2、Y1、Y2、Q、Q’、Q’’およびQ’’’は化学式1に示した蛍光モノマー化合物と同様である。U1、U2、U3、U4、A1およびA2は化学式4に示した(メタ)アクリルアミド残基を含む重合性単量体と同様である。
【0043】
また、p1とq1とのモル比(p1:q1)およびp2とq2とのモル比(p2:q2)は前記(I):(II)のモル比に対応して、1:50〜1:6,000が好ましく、より好ましくは1:150〜1:3,000である。
【0044】
本発明で使用する蛍光センサー物質は、該共重合体の少なくとも一部が分子間架橋を形成し、三次元架橋構造を示していてもよい。ポリ(メタ)アクリルアミド鎖に三次元架橋を形成させると上記蛍光モノマー化合物が基材に固定され、水溶液中でも蛍光モノマー化合物を溶出させることなく糖類の検出が容易にできる。なお、本発明の蛍光モノマー化合物は上記したように糖類と結合して蛍光を発する疎水性部位を有するが、該疎水性部位はYで示す二価の有機残基を介してポリ(メタ)アクリルアミド鎖に結合されるために水溶液中で糖類と結合できる自由度が確保されている。従って、三次元架橋構造を形成しても糖類の検出感度を低下させることがない。
【0045】
本発明の蛍光モノマー化合物や蛍光センサー物質の製造方法および、三次元架橋構造の形成方法には制限がないが、以下の方法で製造することができる。
【0046】
(1−1)蛍光モノマー化合物の製造
化学式1で示される蛍光モノマー化合物として、Xが−C6H12−NHCO−、YがPEG残基、Zが−O−、Qが−COCH3基、Q’、Q’’およびQ’’’が水素である化合物、9,10−ビス(メチレン)[[N−(オルトボロノベンジル)メチレン]−N−[(アクリロイルポリオキシエチレン)カルボニルアミノ]−n−ヘキサメチレン]−2−アセチルアントラセン(F−PEG−AAm−1)の製造方法の1例として、図1に示す合成スキームに従って説明する。
【0047】
原料として2−アセチル−9,10−ジメチルアントラセンを使用し、四塩化炭素/クロロホルム溶媒を加熱してN−ブロモスクシンイミド(NBS)および過酸化ベンゾイル(BPO)と反応させることにより、2−アセチル−9,10−ビス(ブロモメチレン)アントラセンとする。次いで、これをジメチルホルムアミド(DMF)等の溶媒中で、ジイソプロピルエチルアミン(DIEA)等の塩基存在下で、N−(t−ブトキシカルボニル)−ヘキシルジアミンを反応させると、ブロモメチレン基が[(t−ブトキシカルボニルアミノ)ヘキシルアミノ]メチレン基となる。これを、DMF等の溶媒中で、DIEA等の塩基存在下で、2−(2−ブロモメチルフェニル)−1,3−ジオキサボナリンを作用させると、9,10−ビス[[N−6’−(t−ブトキシカルボニルアミノ)ヘキシル−N−[2−(5,5−ジメチルボリナン−2−イル)ベンジル]アミノ]メチル]−2−アセチルアントラセンが得られる。これに塩酸等の酸を作用させて脱保護すると、9,10−ビス(メチレン)[[N−(オルトボロノベンジル)メチレン]−N−(アミノヘキシル)]−2−アセチルアントラセンが得られる。次にアクリロイル−(ポリエチレングリコール)−N−ヒドロキシスクシンイミドエステルを塩基性緩衝液中で反応させると、目的物を得ることができる。
【0048】
なお、原料化合物として、アントラセン骨格に化学式1で示すQで示す置換基として上記化合物と異なる原料化合物を使用すると、溶媒、添加剤、反応温度、反応時間および分離方法等を適宜選択することでQとしてアセチル基以外の基を有する化合物を製造することができる。
【0049】
(1−2)蛍光モノマー化合物の製造
化学式1で示される蛍光モノマー化合物として、Xが−C6H12−NHCO−、YがPEG残基、Zが−O−、Qが−COOCH3基、Q’、Q’’およびQ’’’が水素である化合物、9,10−ビス(メチレン)[[N−(オルトボロノベンジル)メチレン]−N−[(アクリロイルポリオキシエチレン)カルボニルアミノ]−n−ヘキサメチレン]アントラセン−2−カルボキシメチルエステル(F−PEG−AAm−2)の製造方法の1例として、図5に示す合成スキームに従って説明する。
【0050】
原料として9,10−ジメチル−2−アセチルアントラセンを使用し、ジオキサン/過塩素酸ナトリウム水溶液に添加し、加熱攪拌後に酸を加えて、9,10−ジメチルアントラセン−2−カルボン酸の沈殿物を得る。次いで、これを塩酸/メタノール溶媒に溶解し、加熱還流することにより、9,10−ジメチルアントラセン−2−カルボキシメチルエステルとする。これを四塩化炭素/クロロホルム溶媒に溶解し、加熱してN−ブロモスクシンイミド(NBS)および過酸化ベンゾイル(BPO)と反応させることにより、9,10−ビス(ブロモメチレン)アントラセン−2−カルボキシメチルエステルとする。次いで、これをジメチルホルムアミド(DMF)等の溶媒中で、ジイソプロピルエチルアミン(DIEA)等の塩基存在下で、N−(t−ブトキシカルボニル)−ヘキシルジアミンを反応させると、ブロモメチレン基が[(t−ブトキシカルボニルアミノ)ヘキシルアミノ]メチレン基となる。これを、DMF等の溶媒中で、DIEA等の塩基存在下で、2−(2−ブロモメチルフェニル)−1,3−ジオキサボナリンを作用させると、9,10−ビス[[N−6’−(t−ブトキシカルボニルアミノ)ヘキシル−N−[2−(5,5−ジメチルボリナン−2−イル)ベンジル]アミノ]メチル]アントラセン−2−カルボキシメチルエステルが得られる。これに塩酸等の酸を作用させて脱保護すると、9,10−ビス(メチレン)[[N−(オルトボロノベンジル)メチレン]−N−(アミノヘキシル)]アントラセン−2−カルボキシメチルエステルが得られる。次にアクリロイル−(ポリエチレングリコール)−N−ヒドロキシスクシンイミドエステルを塩基性緩衝液中で反応させると、目的物を得ることができる。
【0051】
なお、原料化合物として、アントラセン骨格に化学式1で示すQで示す置換基として上記化合物と異なる原料化合物を使用すると、溶媒、添加剤、反応温度、反応時間および分離方法等を適宜選択することでQとしてカルボキシメチルエステル以外の基を有する化合物を製造することができる。
【0052】
(2)蛍光センサー物質の製造
化学式1で示す蛍光モノマー化合物と(メタ)アクリルアミド残基を含む重合性単量体との共重合は、溶媒の下で、重合促進剤または重合開始剤を用いることができる。溶媒としては、水を使用することができる。蛍光モノマー化合物を水溶性にできる程度の親水性を有するYを導入することにより溶媒が水のみでも重合が可能となった。また、水にジメチルスルホキシド、ジメチルホルムアミド、エチレングリコール、ジエチレングリコールなどのいずれか1種以上を混合したものも用いることができる。本発明において、有機溶媒を混合する場合には、その含有量は10〜50質量%混合することが好ましく、より好ましくは20〜30質量%である。
【0053】
化学式1で示す蛍光モノマー化合物と(メタ)アクリルアミド残基を含む重合性単量体との共重合に際して、更に他の成分を配合することもできる。他の成分を配合する場合、その配合量は、蛍光モノマー化合物と(メタ)アクリルアミド残基を含む重合性単量体との合計量の0.1〜10モル%が好ましく、より好ましくは2〜7モル%である。他の成分を配合する場合、重合時に、重合開始剤や重合促進剤と同時に添加しておくことが好ましい。
【0054】
重合開始剤としては、例えば、過硫酸アンモニウム、過硫酸ナトリウム、過硫酸カリウムまたは過硫酸アンモニウムなどの過硫酸塩;過酸化水素;アゾビス−2−メチルプロピオンアミジン塩酸塩またはアゾイソブチロニトリルなどのアゾ化合物;ベンゾイルパーオキシド、ラウロイルパーオキシド、クメンハイドロパーオキシドまたは酸化ベンゾイルなどのパーオキシド等を挙げることができ、これらの1種または2種以上を用いることができる。この際、重合促進剤として亜硫酸水素ナトリウム、亜硫酸ナトリウム、モール塩、ピロ重亜硫酸ナトリウム、ホルムアルデヒドナトリウムスルホキシレートまたはアスコルビン酸などの還元剤;エチレンジアミン、エチレンジアミン四酢酸ナトリウム、グリシンまたはN,N,N’,N’−テトラメチルエチレンジアミンなどのアミン化合物;などの1種または2種以上を併用することもできる。重合温度は15〜75℃が好ましく、より好ましくは20〜60℃、重合時間は1〜20時間、より好ましくは2〜8時間である。なお、重合開始剤として過硫酸塩と重合促進剤としてN,N,N’,N’−テトラメチルエチレンジアミンとを併用する場合には、室温で重合を行うことができる点で、特に好ましい。
【0055】
一方、上記化学式5で示す化合物は、化学式1で示す蛍光モノマー化合物と(メタ)アクリルアミド残基を含む重合性単量体との共重合によらず製造することもできる。化学式1で示す蛍光モノマー化合物は複数の工程で合成されるため、化合物1で示す蛍光モノマー化合物を原料とすることなくその中間産物に他の化合物を作用させても、最終的に化学式5で示す蛍光センサー物質を製造することができる。例えば、図1のスキームで示した9,10−ビス[[N−(6’−アミノヘキシル)−N−(オルト−ボロノベンジル)アミノ]メチル]−2−アセチルアントラセン、または図5のスキームで示した9,10−ビス[[N−(6’−アミノヘキシル)−N−(オルト−ボロノベンジル)アミノ]メチル]アントラセン−2−カルボキシメチルエステルと(メタ)アクリルアミド残基を含む重合性単量体の重合物にカルボキシル基を導入したものとをカップリング試薬の存在下で作用させても、化学式5で示す蛍光センサー物質を製造することができる。また別の例として、予め(メタ)アクリルアミド残基を有する重合性単量体を重合した後、重合開始剤や重合促進剤の存在下で上記蛍光モノマー化合物と共重合させても化学式5で示す蛍光センサー物質を製造することができる。
【0056】
(3)三次元架橋構造の形成
本発明の蛍光センサー物質は、三次元架橋を有していてもよいのであるが、三次元架橋の導入方法も限定されない。本発明の蛍光センサー物質に架橋成分を作用させて、蛍光センサー物質と蛍光センサー物質との少なくとも一部に分子間架橋を形成させる方法がある。
【0057】
また、前記したように、化学式1で示す蛍光モノマー化合物と(メタ)アクリルアミド残基を含む重合性単量体との共重合に際して、反応溶媒に架橋成分を添加しても三次元架橋を形成させることができる。
【0058】
一方、蛍光センサー物質を、体内埋め込み用の糖類測定用センサーとして使用する場合には蛍光センサー物質の流出を防止するため、基材に固定されることが一般的であるが、このような基材として、(メタ)アクリルアミド残基を含む重合性単量体またはその重合体を使用し、化学式1で示す蛍光モノマー化合物に必要に応じて架橋成分を使用し、これらを重合させ、基材への固定と三次元架橋とを同時に行うこともできる。
【0059】
このような架橋成分としては、前記蛍光センサー物質の配合し得る他の成分の項で記載した架橋性単量体、他の架橋性成分、カチオン性モノマー、アニオン性モノマーおよびノニオン系モノマーを好ましく使用することができ、架橋性単量体および他の架橋性成分をより好ましく用いることができる。本発明では、これらの2種以上を併用してもよい。
【0060】
本発明の第三は、上記蛍光センサー物質が基材に固定化されてなる検出層である。また、本発明の第四は、上記検出層を有する体内埋め込み用の糖類測定用センサーである。
【0061】
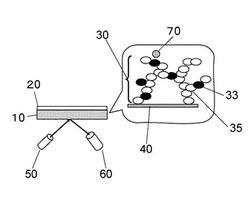
体内埋め込み用の糖類測定用センサーは、蛍光センサー物質が流出しないように基材などの固定材料に、共有結合や疎水結合によって、または電気的、その他の相互作用によって固定されていることが好ましい。本発明の蛍光センサー物質を使用した糖類検出方法の概略を、図2を用いて説明する。
【0062】
該センサーは、検出層10を含み、検出層10には蛍光センサー物質30が基材40を介して固定されている。蛍光センサー物質30は、少なくとも黒丸で示す蛍光モノマー化合物33と白丸で示す(メタ)アクリルアミド残基を含む重合性単量体35を含む共重合体であり、水溶液中の糖類70が蛍光モノマー化合物33と相互作用すると蛍光を発する。検出層10は、光学分離層20を有していてもよい。検出層10に光源50から波長350〜420nmの光を当て、反射された蛍光量または波長の変化を検出器60によって検出すると、蛍光量に依存した糖類の濃度を知ることができる。本発明の検出層に使用する基材としては、例えばガラス、金属などの無機材料、プラスチックフィルムなどの有機材料を広く使用することができる。糖類測定用センサーに用いる検出層の基材としては、透明性に優れ、体液中でも溶解や溶出しない材料であることが好ましく、本発明では、ガラスやプラスチックフィルムの中でもポリ(メタ)アクリルアミド膜、またはポリ(メタ)アクリレート膜などを好ましく使用することができる。なお、上述したようにポリ(メタ)アクリルアミド膜を基材として使用すると、蛍光センサー物質の基材への固定と三次元架橋の形成とが同時に行える点で有利である。なお、架橋性重合体を使用した場合の架橋構造は、図2に示すように、(メタ)アクリルアミド残基を含む重合性単量体部位35と(メタ)アクリルアミド残基を含む重合性単量体部位35との間、蛍光モノマー化合物部位33と(メタ)アクリルアミド残基を含む重合性単量体部位35との間、または(メタ)アクリルアミド残基を含む重合性単量体部位35と基材40との間に形成される。
【0063】
蛍光センサー物質を無機材料または有機材料からなる基材表面に固定する場合、基材と蛍光センサー物質とを架橋剤などを使用して化学的に結合させることもできる。このような架橋剤としては、化学式6に示すシランカップリング剤がある。
【0064】
【化5】

【0065】
化学式6において、R”Oは、メトキシ基、エトキシ基、プロポキシ基などの炭素数1〜5のアルコキシ基を示し、好ましくはメトキシ基、エトキシ基である。無機材料は、該アルコキシ基と化学結合をすることができる。Eは、ビニル基、エポキシ基、アミノ基、メルカプト基、アクリル基、メタクリル基、(メタ)アクリロイル基、またはこれらの誘導体であって、有機材料と化学結合することができる官能基である。本発明で好適に使用できるシランカップリング剤としては、ビニルトリメトキシシラン、3−グリシドキシプロピルトリメトキシシラン、N−2−(アミノエチル)−3−アミノプロピルエトキシシラン、3−メルカプトプロピルトリメトキシシラン、3−アクリロキシプロピルトリメトキシシラン、3−メタクリロキシプロピルトリメトキシシラン、および3−メタクリロキシプロピルトリエトキシシランなどがある。
【0066】
上記シランカップリング剤のうち、Eがビニル基、アクリル基、メタクリル基、(メタ)アクリロイル基などの重合性二重結合を有する置換基である場合には、これをガラス、金属ななどの無機材料の表面に予め塗布しておけば、これら表面でフェニルボロン酸残基とアクリルアミド残基とを含む蛍光モノマー化合物と、(メタ)アクリルアミド残基を含む重合性単量体とを共重合させつつ直接固定化することもできる。なお、シランカップリング剤で表面処理した基材表面に直接蛍光センサー物質を固定することもできる。
【0067】
一方、蛍光センサー物質をプラスチックフィルムなどの有機材料表面に固定するには、プラスチックフィルムに反応活性基を有する置換基を導入し、蛍光センサー物質と結合させてもよい。このような反応活性基の導入方法としては、例えば、特開平5−245198号公報に記載の、プラズマ、電子線、放射線などによるグリシジル(メタ)アクリレートのグラフト重合法などがある。
【0068】
これらシランカップリング処理した無機材料または有機材料、もしくは反応活性基を導入したプラスチックフィルムに蛍光センサー物質をより結合しやすくするには、蛍光センサー物質の合成時に予め反応活性置換基を有する単量体を共重合成分として使用してもよく、蛍光センサー物質合成後に反応活性基を導入してもよい。このような単量体としては、蛍光センサー物質の項で記載したものを使用することができる。このような反応活性基としては、アミノ基、カルボキシル基、水酸基、ハロゲン化カルボキシル基、スルホニル基、チオール基、イソシアネート基、イソチオシアネート基、またはエポキシ基等がある。なお、シランカップリング処理した無機材料や有機材料上の反応活性基と蛍光センサー物質との結合は、適当な溶媒、触媒、縮合剤の存在下、非存在下に行うことができる。
【0069】
本発明の体内埋め込み用の糖類測定用センサーは、少なくとも図2に示すように、蛍光センサー物質を固定した検出層、光源および蛍光検出装置を有すればよく、これらが適当なハウジング内に配置されていればよい。
【0070】
本発明の検出層が、体内埋め込み用の糖類測定用センサー内に用いられる場合、図2に示すように検出層10に光学分離層20が積層されることが好ましい。光学分離層20がセンサーの外表面側に配置されると、検出層10に含まれる蛍光センサー物質と体液成分であるラジカル、酸化性物質または還元性物質などとの接触を回避することができ、これらの体液内成分による蛍光センサー物質の劣化を防止することができる。また、光学分離層20を積層すると、光源50から発した励起光の反射や散乱による検出能の低下も防止することができる。更に、糖類以外の生体物質が光源からの励起光により励起した場合であっても、光学分離層20の存在によって光源50からの励起光外部由来の光を遮蔽し、または生体内の有色物質または蛍光物質の影響を排除することもできる。
【0071】
このような作用を有する光学分離層20は、光学分離層基材と不透明物質とからなる。光学分離層基材としては、架橋または化学修飾されていてもよい高分子が選択され、高分子として例えばデキストラン、ポリ(メタ)アクリルアミド、ポリ(メタ)アクリレート、ポリエチレングリコール、ポリビニルアルコール、ポリアミド、ポリウレタン、これらの混合物、またはこれらの共重合体などがある。また、光学分離層基材にはビタミンE、ポリフェノール類または金属キレート類などで修飾したり、またはこれらを担持したりしてもよい。また、不透明物質としては、カーボンブラック、フラーレン、カーボンナノチューブ、または酸化鉄などを用いることができる。
【0072】
検出層10と光学分離層20とは共有結合、イオン結合または疎水結合などにより、化学結合によって積層させることができる。例えば、光学分離層がその基材としてデキストランを、不透明物質としてカーボンブラックを使用する場合には、溶媒にデキストランを溶解させた後にカーボンブラックを添加し、超音波処理により均一化し、これにアルカリ水溶液とエチレングリコールジグリシジルエーテルを更に添加する。ついで、検出層に噴霧器を用いて上記溶液を均一に噴霧し、加熱および乾燥して検出層に光学分離層を積層する。
【0073】
図3に本発明の体内埋め込み用の糖類測定用センサーの外観の斜視図を示す。該体内埋め込み用の糖類測定用センサーは、その内部を液密に保つハウジング110、光学分離層または検出層のみを露出させる窓部120および体外のシステムと通信するためのアンテナ部130を有する。
【0074】
図4に該体内埋め込み用の糖類測定用センサーの内部構造を示す。光学分離層20または検出層10が内部を液密に保つために窓部120を塞ぐように設けられ、励起光を発する光源50、光源50からの光を検出層10まで導く光学導波路170、検出層10からの蛍光を検出する蛍光検出装置60、蛍光検出装置60からの信号データを処理する集積回路140および内部の電源である電池150が搭載されている。なお、アンテナ部130には、アンテナ用コイル160が配設されている。なお、図3、図4は概念図であり、実施はこれに限定するものではない。必要に応じて各構成物の大きさ、形状、配置を自由に設定できる。
【0075】
体内埋め込み用の糖類測定用センサーを用いることにより、糖尿病患者が血糖値を自己制御する際の、煩雑性または血糖値のタイムラグの発生を回避することができる。また、体内埋め込み用の糖類測定用センサーを用いることにより、糖尿病患者以外の人々が、健康管理のための血糖値測定を簡便に行うことも可能となる。
【実施例】
【0076】
以下に実施例を挙げて本発明を具体的に説明するが、これらの実施例は何ら本発明を制限するものではない。
【0077】
(実施例1:9,10−ビス(メチレン)[[N−(オルトボロノベンジル)メチレン]−N−[(アクリロイルポリオキシエチレン)カルボニルアミノ]−n−ヘキサメチレン]−2−アセチルアントラセン(以下F−PEG−AAm−1と記載)の合成)
A)9,10−ビス(ブロモメチル)−2−アセチルアントラセンの合成
9,10−ジメチル−2−アセチルアントラセン600mg、N−ブロモスクシンイミド800mg、過酸化ベンゾイル5mgを、クロロホルム6mLと四塩化炭素20mLの混合物に加え、80℃で2時間加熱還流を行った。溶媒を除去後、残渣をメタノールで抽出し、780mgの目的物を得た。
【0078】
B) 9,10−ビス[6’−(t−ブトキシカルボニルアミノ)ヘキシルアミノメチル]−2−アセチルアントラセンの合成
上記A)で得た生成物500mg、N−BOC−ヘキシルジアミン1.125g、ジイソプロピルエチルアミン1.25mLをジメチルホルムアミド10mLに溶解し、45℃で1時間攪拌反応を行った。反応混合物はクロロホルム60mLで希釈し、水100mLで3回、飽和食塩水100mLで1回洗浄し、有機相を無水硫酸ナトリウムで乾燥した。乾燥剤を濾過後、濃縮しクロロホルム/メタノールを溶離液とするシリカゲルカラムクロマトグラフィーにて精製し、367mgの目的物を得た。
【0079】
C) 9,10−ビス[[N−6’−(t−ブトキシカルボニルアミノ)ヘキシル−N−[2−(5,5−ジメチルボリナン−2−イル)ベンジル]アミノ]メチル]−2−アセチルアントラセンの合成
上記B)で得た生成物200mg、2−(2−ブロモメチルフェニル)−1,3−ジオキサボリナン700mg、N,N−ジイソプロピルエチルアミン0.35mLを3mLのジメチルホルムアミドに溶解し、25℃で16時間攪拌した。溶媒除去後、メタノール/クロロホルムを溶離液とするシリカゲルカラムで精製し目的物194mgを得た。
【0080】
D) 9,10−ビス[[N−(6’−アミノヘキシル)−N−(オルト−ボロノベンジル)アミノ]メチル]−2−アセチルアントラセンの合成
上記C)で得た生成物100mgを2mLのメタノールに溶解し、4N塩酸2mLを加えて25℃で10時間攪拌した。蒸発乾固後、ゲル濾過によって無機塩を除去し、目的物95mgを得た。
【0081】
E) F−PEG−AAm−1の合成
上記D)で得た生成物160mgを0.5mLのジメチルホルムアミドに溶解し、アクリロイル−(ポリエチレングリコール)−N−ヒドロキシスクシンイミドエステル(PEG分子量3,400)1.22gの10mL100mMリン酸緩衝液(pH=8.0)溶液に加え、25℃で20時間攪拌した。反応混合物をゲル濾過に供し、蛍光高分子画分を採取し、凍結乾燥後、目的物1.2gを得た。上記A)〜E)を図1の合成スキームに示す。F−PEG−AAm−1は有機溶媒や可溶化剤の存在無しに、温度25℃pH7.0の条件下において濃度100mMで水に溶解した。重クロロホルム中のNMRデータは以下の通りであった。δ1.30−1.65(m,C−CH2−C),2.90(s,Ac),2.78(m,−C(−C)N−CH2−C),3.25(m,CH2−NH−COO),3.50−3.80(s,PEG),5.80(d,COCH=C),6.17(m,C=CH2),7.20−8.20(m,aromatic)、PEG残基由来のピークと重なる水素のシグナルは確認出来なかった。
【0082】
(実施例2)
最終濃度としてアクリルアミドが15質量%、実施例1で合成したF−PEG−AAm−1が10質量%、メチレンビスアクリルアミドが0.3質量%、および過硫酸ナトリウムが0.18質量%,N,N,N’,N’−テトラメチルエチレンジアミンが0.36質量%となるように純水に溶解・混合して溶液を調製した。予め、シランカップリング剤による表面処理を行ったガラスプレートと無処理のガラスプレートとを隙間を設けて設置し、隙間に上記溶液を流し込み、窒素雰囲気下25℃で8時間重合させた。重合終了後ガラスプレートを純水につけて、無処理のガラスプレートのみを剥がして、ガラス基材上にアクリルアミド/F−PEG−AAm−1(160/1モル比)が固定されたゲルシートを得た。
【0083】
さらに、得られたゲルシート表面に最終濃度としてアクリルアミドが20質量%、メチレンビスアクリルアミドが1質量%、および過硫酸ナトリウムが0.18質量%、N,N,N’,N’−テトラメチルエチレンジアミンが0.36質量%、カーボンブラックが5質量%となるように純水に溶解・混合して調製した溶液を積層し、窒素雰囲気下25℃で24時間重合させた。得られたゲルシートを、グルコース濃度500mg/dLの50mMリン酸緩衝液(pH7.0)への浸漬洗浄30分間を合計10回繰り返した。その後50mMリン酸緩衝液(pH7.0)への浸漬洗浄30分間を合計4回繰り返してグルコースを洗い流して検出層を得た。
【0084】
(実施例3:9,10−ビス(メチレン)[[N−(オルトボロノベンジル)]−N−[(アクリロイルポリオキシエチレン)カルボニルアミノ]−n−ヘキサメチレン]−アントラセン−2−カルボキシメチルエステル(以下F−PEG−AAm−2と記載)の合成)
a) 9,10−ジメチルアントラセン−2−カルボン酸の合成
9,10−ジメチル−2−アセチルアントラセン1.2gを24mLのジオキサンに溶解し、10mLの過塩素酸ナトリウム水溶液(有効塩素濃度10質量%)を加え、85℃で8時間攪拌反応した。反応混合物を冷却後に希塩酸で酸性とし、析出した沈殿をろ過および少量の水で洗浄した後に真空乾燥し、目的物1.16gを得た。
【0085】
b) 9,10−ジメチルアントラセン−2−カルボキシメチルエステルの合成
上記a)で得られた生成物1gを5質量%塩酸−メタノールに溶解し、20時間加熱還流を行った。反応混合物を濃縮し、30mLの水を加え、100mLのクロロホルムで抽出を行った。クロロホルム層は重炭酸水素ナトリウム水溶液、飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥した。これを蒸発乾固し、915mgの目的物を得た。
【0086】
c) 9,10−ビス(ブロモメチレン)アントラセン−2−カルボキシメチルエステルの合成
上記b)で得た生成物600mg、N−ブロモスクシンイミド800mg、過酸化ベンゾイル5mgを、クロロホルム6mLと四塩化炭素20mLの混合物に加え、2時間加熱還流を行った。溶媒を除去後、残渣をメタノールで抽出し、767mgの目的物を得た。
【0087】
d) 9,10−ビス[6’−(t−ブトキシカルボニルアミノ)ヘキシルアミノメチル]アントラセン−2−カルボキシメチルエステルの合成
上記c)で得た生成物500mg、N−BOC−ヘキシルジアミン1.125g、ジイソプロピルエチルアミン1.25mLをジメチルホルムアミド10mLに溶解し、45℃で2時間攪拌反応を行った。反応混合物はクロロホルム60mLで希釈し、水100mLで3回、飽和食塩水100mLで1回洗浄し、有機相を無水硫酸ナトリウムで乾燥した。乾燥剤を濾過後、濃縮しクロロホルム/メタノールを溶離液とするシリカゲルカラムクロマトグラフィーにて精製し、307mgの目的物を得た。
【0088】
e) 9,10−ビス[[N−6’−(t−ブトキシカルボニルアミノ)ヘキシル−N−[2−(5,5−ジメチルボリナン−2−イル)ベンジル]アミノ]メチル]アントラセン−2−カルボキシメチルエステルの合成
上記d)で得た生成物200mg、2−(2−ブロモメチルフェニル)−1,3−ジオキサボリナン700mg、N,N−ジイソプロピルエチルアミン0.35mLを3mLのジメチルホルムアミドに溶解し、25℃で16時間攪拌した。溶媒除去後、メタノール/クロロホルムを溶離液とするシリカゲルカラムで精製し目的物203mgを得た。
【0089】
f) 9,10−ビス(メチレン)[[N−(オルトボロノベンジル)メチレン]−N−(アミノヘキシル)]アントラセン−2−カルボキシメチルエステルの合成
上記e)で得た生成物100mgを3mLのメタノールに溶解し、8N塩酸0.5mLを加えて25℃で2日間攪拌した。蒸発乾固後、ゲル濾過によって無機塩を除去し、目的物82mgを得た。
【0090】
g) F−PEG−AAm−2の合成
上記f)で得た生成物160mgを0.5mLのジメチルホルムアミドに溶解し、アクリロイル−(ポリエチレングリコール)−N−ヒドロキシスクシニイミドエステル(PEG分子量3,400)1.22gの10mL100mMリン酸緩衝液(pH=8.0)溶液に加え、25℃で20時間攪拌した。反応混合物をゲル濾過に供し、蛍光高分子画分を採取し、凍結乾燥後、目的物1.1gを得た。上記a)〜e)を図5の合成スキームに示す。F−PEG−AAm−2は有機溶媒や可溶化剤の存在無しに、温度25℃pH7.0の条件下において濃度100mMで水に溶解した。重クロロホルム中のNMRデータは以下の通りであった。d1.30−1.65(m,C−CH2−C),2.78(m,−C(−C)N−CH2−C),3.25(m,CH2−NH−COO),3.50−3.80(s,PEG),4.10(s,COOCH3),5.80(d,COCH=C),6.17(m,C=CH2),7.20−8.20(m,aromatic),PEG鎖ピークと重なる水素のシグナルは確認出来なかった。
【0091】
(実施例4)
実施例3で合成したF-PEG−AAm−2を用いて実施例2と同様の方法でガラス基材上にアクリルアミド/F−PEG−AAm−2(160/1モル比)が固定されたゲルシートを得た。さらに実施例2と同様の方法で検出層を得た。
【0092】
(比較例:9,10−ビス(メチレン)[N−(アクリロイルアミノヘキシル)−N−(オルト−ボロノベンジル)メチレン]−アントラセン(以下F−AAmと記載)の合成)
【0093】
【化6】

【0094】
A’) 9,10−ビス[6’−(t−ブトキシカルボニルアミノ)ヘキシルアミノメチル]アントラセンの合成
9,10−ビス(クロロメチル)−アントラセン500mg、N−BOC−ヘキシルジアミン1.3g、ジイソプロピルエチルアミン1.25mLをジメチルスルホキシド10mLに溶解し、60℃で6時間攪拌反応を行った。反応混合物はクロロホルム60mLで希釈し、水100mLで3回、飽和食塩水100mLで1回洗浄し、有機相を無水硫酸ナトリウムで乾燥した。乾燥剤を濾過後、濃縮しクロロホルム/メタノールを溶離液とするシリカゲルカラムクロマトグラフィーにて精製し、56mgの目的物を得た。
【0095】
B’) 9,10−ビス[[N−6’−(t−ブトキシカルボニルアミノ)ヘキシル−N−[2−(5,5−ジメチルボリナン−2−イル)ベンジル]アミノ]メチル]アントラセンの合成
上記A’)で得た生成物50mg、2−(2−ブロモメチルフェニル)−1,3−ジオキサボリナン170mg、N,N−ジイソプロピルエチルアミン0.1mLを1mLのジメチルホルムアミドに溶解し、25℃で5時間攪拌した。溶媒除去後、メタノール/クロロホルムを溶離液とするシリカゲルカラムで精製し目的物35mgを得た。
【0096】
C’) 9,10−ビス[[N−(6’−アミノヘキシル)−N−(オルト−ボロノベンジル)アミノ]メチル]アントラセンの合成
上記B’)で得た生成物35mgを1mLのメタノールに溶解し、4N塩酸0.5mLを加えて25℃で10時間攪拌した。蒸発乾固後、ゲル濾過によって無機塩を除去し、目的物26mgを得た。
【0097】
D’) F−AAmの合成
上記C’)で得た生成物25mgをDMF0.5mLに溶解し、窒素雰囲気下、−10℃でN,N−ジイソプロピルエチルアミン20mg、塩化アクリロイル12mgを加え、30分攪拌反応を行った。反応混合物を氷水中に注ぎ、クロロホルムで抽出し、飽和食塩水で洗浄を行った。クロロホルム相は乾燥後、蒸発乾固し、化学式7に示す目的物26mgを得た。
【0098】
E’)重合
最終濃度としてアクリルアミドが15質量%、メチレンビスアクリルアミドが0.3質量%、F−AAmが1.2質量%、および過硫酸ナトリウムが0.18質量%、N,N,N’,N’−テトラメチルエチレンジアミンが0.36質量%となるように80v/v%ジメチルスルホキシド水溶液に溶解・混合して溶液を調製した。予めシランカップリング剤による表面処理を行ったガラスプレートと無処理のガラスプレートとを隙間を設けて設置し、隙間に上記溶液を流し込み、窒素雰囲気下25℃で8時間重合させた。重合終了後ガラスプレートを純水につけて、無処理のガラスプレートのみを剥がして、ガラス基材状にアクリルアミド/F−AAm(150/1モル比)が固定されたゲルシートを得た。
【0099】
さらに、得られたゲルシート表面に最終濃度としてアクリルアミドが20質量%、メチレンビスアクリルアミドが1質量%、および過硫酸ナトリウムが0.18質量%、N,N,N’,N’−テトラメチルエチレンジアミンが0.36質量%、カーボンブラックが5質量%となるように純水に溶解・混合して調製した溶液を積層し、窒素雰囲気下25℃で24時間重合させた。得られたゲルシートを、グルコース濃度500mg/dLの50mMリン酸緩衝液(pH7.0)への浸漬洗浄30分間を合計10回繰り返した。その後50mMリン酸緩衝液(pH7.0)への浸漬洗浄30分間を合計4回繰り返してグルコースを洗い流して検出層を得た。
【0100】
(実施例5)
実施例2、実施例4および比較例で得られたセンサーをそれぞれ評価装置に固定し、リン酸緩衝液(pH=7.0)下で蛍光強度のグルコース応答性を評価した(図6)。励起波長は405nm、蛍光検出波長は475nmを用いた。
【0101】
評価装置は、検出層を固定し内部に液体を循環することのできるセルと、セルの裏面に末端が固定された光学ファイバーの束、そしてその光学ファイバーの他方末端が蛍光分光光度計へ接続された構造になっている。光学ファイバーの束の一部は励起光をセルに送るために、残りは蛍光放射光をセルから返すために用いられる構造となっている。
【0102】
図6から明らかなように、本発明の水溶性蛍光モノマーからなるセンサーは、従来の疎水性モノマーからなるセンサーと比較して、グルコースへの応答性が大幅に改善されていることが明らかとなった。
【0103】
(実施例6)
実施例2、実施例4および比較例で得られたセンサーをそれぞれ評価装置に固定し、リン酸緩衝液(pH=7.0)下で蛍光スペクトルを測定した。
【0104】
比較例のセンサーは377nmの励起で極大蛍光波長が403nmと430nmなのに対し、実施例2のセンサーは400nmの励起で極大蛍光波長が480nmであり、実施例4のセンサーは400nmの励起で極大蛍光波長が455nmであった。本発明のセンサーは、蛍光波長が長波長側にシフトしており、さらに励起波長と蛍光波長との差が大きく、蛍光特性上有利であり、測定精度が高いと推定される。
【符号の説明】
【0105】
10 検出層、
20 光学分離層、
30 蛍光センサー物質、
33 蛍光モノマー化合物、
35 (メタ)アクリルアミド残基を含む重合性単量体、
40 基材、
50 光源、
60 蛍光検出装置、
70 糖類、
110 ハウジング、
120 窓部、
130 アンテナ部、
140 集積回路、
150 電池、
160 アンテナ用コイル、
170 光学導波路。
【技術分野】
【0001】
本発明は、糖類の検出能に優れる蛍光モノマー化合物、蛍光センサー物質、その製造方法およびそれらを用いた体内埋め込み用の糖類測定用センサー等に関する。
【背景技術】
【0002】
体内埋め込み型センサーは、様々な疾患においてその病状の経過観察や治療効果のモニタなどに有用であり、近年、盛んに研究されている分野の一つである。特に糖尿病治療においては、連続血糖測定による血糖コントロールが、病状の進行遅延や合併症の罹病の低減に貢献すると言われている。
【0003】
現状の糖尿病患者の多くは、血糖の自己管理のために、指等の穿刺によって血液試料を採取し、血糖計に供給して測定値を読み取ることを行っている。しかし、このような方法は患者への苦痛や簡便性のうえで問題があり、一日に数回の測定が限界で、血糖値変化の動向を頻繁に測定して把握することが難しいのが現状である。このような理由から、埋め込み型連続血糖計の有用性は高いと考えられる。
【0004】
一方、生体内のグルコース濃度を継続的に測定するための技術開発は古くからなされており、たとえば、可逆的にグルコースと反応して蛍光を発する物質を用いて蛍光量の変化でグルコース濃度を測定するものがある。このような蛍光物質として、発蛍光性原子団と、少なくとも1つのフェニルボロン酸部位と、少なくとも1つのアミン性窒素とを有し、アミン性窒素がフェニルボロン酸部位の近傍に配置されて該フェニルボロン酸と分子内結合する分子構造を有する発蛍光性化合物が開示されている(特許文献1)。発蛍光性原子団としては、ナフチル基やアンスリル基などがある。該化合物は、そのボロン酸部位を介して糖分子と安定なコンプレックスを形成すると蛍光を発する、というものである。
【0005】
また、水性環境中での検体の濃度検出のための指示高分子として、親水性モノマーと、アントラセンホウ酸エステル誘導体などのエシキマー形成多環芳香族炭化水素とを有する化合物も開示されている(特許文献2)。該エシキマー形成多環芳香族炭化水素は水への溶解性が充分でないためメタクリルアミドなどの親水性基を導入し、水性環境中でも検体濃度を検出できるようにしたものである。
【0006】
また、蛍光センサーとして、プラスチックフィルムなどの固相に直接蛍光物質を固定化する方法も開示されている(特許文献3)。特許文献3では発光性、発蛍光性または発色性の原子団にフェニルボロン酸をただ一つ付加したものを用いている。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開平8−53467号公報
【特許文献2】特表2004−506069号公報
【特許文献3】米国特許第6,319,540号明細書
【発明の概要】
【発明が解決しようとする課題】
【0008】
しかしながら、上記特許文献1記載の化合物は、発蛍光性原子団としてナフチル基やアンスリル基などの嵩高くかつ疎水性の部位を有するため、水溶性の糖類との結合が容易でなく、検出感度の向上が望まれる。また、特許文献2記載の化合物は、実施例6のGにおいてメタクリル酸などの親水性モノマーと重合を行う際に、エチレングリコールを溶液として用いている。
【0009】
一方、蛍光センサーとして使用するために蛍光物質を直接基材に固定すると、蛍光物質による被検出物質の検出能が固定前よりも低下する場合がある。
【0010】
このような状況下、本発明は、グルコースなどの糖類検出能に優れる蛍光モノマー化合物、蛍光センサー物質および該蛍光センサー物質を使用した糖類測定用センサーを提供することを目的とする。
【課題を解決するための手段】
【0011】
本発明者は、糖類測定用蛍光モノマー化合物における糖類の結合状態を詳細に検討した結果、糖類検出のためのモノマー化合物に親水性基を導入すると、該疎水性部位の自由度を確保しつつ糖類との結合を促進できること、更に該蛍光モノマー化合物を(メタ)アクリルアミドと共重合させると、これを基材に固定した場合であっても血液や体液などの水溶液中でも検出感度を下げることなく、糖類の測定ができることを見出し、本発明を完成させた。
【発明の効果】
【0012】
本発明による、糖類測定用の蛍光モノマー化合物、蛍光センサー物質、および検出層は糖類検出能に優れる。また、体液中の糖類検出能に優れるため、長期間の埋め込みに耐える蛍光センサーとなる。
【図面の簡単な説明】
【0013】
【図1】本発明の蛍光モノマー化合物の一例の合成スキームである。
【図2】光学分離層の概念図である。
【図3】本発明の体内埋め込み用の糖類測定用センサーの外観の斜視図である。
【図4】本発明の体内埋め込み用の糖類測定用センサーの内部構造を示す図である。
【図5】実施例4の蛍光モノマー化合物の合成スキームである。
【図6】実施例2、実施例4および比較例の蛍光センサー物質のグルコース応答性を示す図である。
【発明を実施するための形態】
【0014】
本発明の第一は、化学式1に示す蛍光モノマー化合物である。
【0015】
【化1】

【0016】
化学式1において、X1およびX2は同一または異なっていてもよく、−COO−、−OCO−、−CH2NR−、−NR−、−NRCO−、−CONR−、−SO2NR−、−NRSO2−、−O−、−S−、−SS−、−NRCOO−、−OCONR−および−CO−からなる群より選択される少なくとも1種の置換基を含む炭素数1〜30のアルキレンを示し、Rは水素または置換されていてもよいアルキル基である。本明細書において少なくとも1種の置換基を含むアルキレンとは、アルキレンの端部に置換基を結合したもの、およびアルキレンの鎖中に置換基を有するものをいう。アルキレンの炭素数は1〜30が好ましく、より好ましくは3〜12である。具体的にはプロピレン、ヘキシレンおよびオクチレンなどがある。該アルキレンに含まれる置換基としては、好ましくは−NRCO−および−CONR−が好ましい。Rがアルキル基である場合、炭素数1〜10のものが好ましく、より好ましくは1〜5である。具体的にはメチル基、エチル基、プロピル基、ブチル基またはペンチル基などがある。Rとしては水素が好ましい。
【0017】
化学式1において、Z1およびZ2は同一または異なっていてもよく、−O−または−NR’−を示し、R’は水素または置換されてもよいアルキル基を示す。アルキル基としては、炭素数1〜10のものが好ましく、より好ましくは1〜5である。具体的にはメチル基、エチル基、プロピル基、ブチル基またはペンチル基などがある。Z1およびZ2としては、−O−が好ましい。
【0018】
化学式1において、Y1およびY2は同一または異なっていてもよく、置換されていてもよい2価の有機残基であり、蛍光モノマー化合物を水に溶解させうる。本発明において「蛍光モノマー化合物を水に溶解させうる」とは、有機溶媒や可溶化剤の存在無しに、蛍光モノマー化合物が、温度25℃pH7.0の条件下において濃度1mM以上水に溶解し得ることをいう。Y1およびY2としてアミノ基、カルボキシル基、スルホ基、ニトロ基、アミノ基、リン酸基および水酸基などの親水性基を有するものや、構造中にエーテル結合、アミド結合およびエステル結合などの親水性結合を有するものが例示できる。
【0019】
また、Y1およびY2は該有機残基中に、下記化学式2または化学式3に示す構造を含むことが好ましく、更に、他の置換基や2価の有機残基を有していてもよい。化学式2〜3において、nは2〜4が好ましく、より好ましくは2または3であり、jは1〜3が好ましく、より好ましくは1であり、mは20〜150が好ましく、より好ましくは40〜120である。
【0020】
該Yの分子量としては500〜10,000が好ましく、より好ましくは1,000〜5,000である。化学式2または化学式3で示す2価の有機残基は、例えばエチレングリコール、プロピレングリコールなどのアルキレングリコールまたはビニルアルコールなどを重合することで、調製することができる。
【0021】
【化2】

【0022】
本発明の特徴である蛍光モノマー化合物は親水性鎖Yの導入によって、より具体的には以下のような効果が得られる。(1)蛍光モノマー化合物が水溶性となるため、蛍光センサー物質を形成する際の固定化や重合反応を効率良く行う事が出来る。例えばアクリルアミドゲルを作製する場合は、水のみを溶媒として重合が可能であり、物理的強度、安定性、均一性が高いものが得られる。疎水性のモノマー化合物では可溶化させるために有機溶媒等を使用する必要があり、良好でない性状のゲルとなる場合がある。(2)親水性鎖の導入は被検出物質と相互作用するフェニルボロン酸周辺の環境や運動性を変化させ、感度、精度、応答速度、被測定物質である糖類の選択性の向上に寄与する。(3)親水性鎖が蛍光センサー物質全体、例えば重合された構造を安定化する。(4)水のみで反応できるため、有機溶剤に侵されやすい基材、例えばアクリル製のプレート等の上でも重合を行う事が出来る。
【0023】
化学式1において、Q、Q’、Q’’およびQ’’’は、水素、水酸基、置換されていてもよいアルキル基、アシル基、オキシアルキル基、ハロゲン、カルボキシル基、カルボキシエステル、カルボキシアミド、シアノ基、ニトロ基、アミノ基およびアミノアルキル基からなる群より選択される置換基である。アルキル基としては、炭素数1〜10のものが好ましく、具体的にはメチル基、エチル基、プロピル基、ブチル基またはペンチル基などがあり;アシル基としては、ホルミル基、アセチル基、プロピオニル基、ブチリル基またはイソブチリル基などがあり;オキシアルキル基としては、メトキシ基、エトキシ基などがあり;ハロゲンとしては、F−、Cl−、Br−、またはI−などがあり;アミノアルキル基としては、メチルアミノ基、エチルアミノ基などがある。Q、Q’、Q’’およびQ’’’は同一または異なっていてもよく、QおよびQ’は一緒になって縮合環を形成していてもよく、Q’’およびQ’’’は一緒になって縮合環を形成していてもよい。Q、Q’、Q’’およびQ’’’として、ニトロ基、シアノ基またはアシル基などを導入すると、蛍光の赤色変移または励起波長ピークと蛍光波長ピークとの間隔拡大に寄与するといった効果が得られる。本発明では、Q、Q’、Q’’およびQ’’’のうち、少なくとも一つが、アセチル基、カルボキシエステルおよびシアノ基からなる群より選択される1種であり、残りが水素であることが好ましい。
【0024】
本発明の蛍光モノマー化合物は、糖類検出のためのモノマー化合物に上記Xを介してYを導入する点に特徴があり、これによって蛍光モノマー化合物の物理的性質や安定性、検出感度、検出精度、被測定物質である糖類の選択性などを向上させることができる。
【0025】
なお、上記のように、本発明の蛍光モノマー化合物はアントラセン骨格を含むフェニルボロン酸誘導体であり、アントラセン骨格は発蛍光性原子団として作用することが知られている。フェニルボロン酸部位と糖とが安定な複合体を形成すると、発蛍光性原子団の介在によって蛍光を発するが、本発明の蛍光モノマー化合物は2つのフェニルボロン酸を有するため、特に糖類の検出感度に優れている。なお、化学式1においてZ1、およびZ2に結合するCOCHCH2は、該蛍光モノマー化合物が血液などの体液に溶解しないように基材その他と結合させるために導入したものである。
【0026】
本発明の第二は、少なくとも以下に記載の(I)および(II)の2種の化合物を共重合してなる糖類測定用の蛍光センサー物質である。
(I):上記化学式1で示す蛍光モノマー化合物
(II):(メタ)アクリルアミド残基を含む重合性単量体
上記蛍光モノマー化合物を用いて血液に含まれる糖類を検出するには、該蛍光モノマー化合物が、血液または体液などの水溶液に溶解したり流出したりしないように固定される必要がある。しかしながら、単に蛍光モノマー化合物を基材に固定すると、該蛍光モノマー化合物と糖との接触および結合が阻害され検出感度が低下する。本発明では、該蛍光モノマー化合物と(メタ)アクリルアミド残基を含む重合性単量体を共重合させ、該蛍光モノマー化合物に親水性のポリ(メタ)アクリルアミド鎖を導入して固定化することで蛍光モノマー化合物を不溶化し、かつ該蛍光モノマー化合物と糖との親和性を確保する。
【0027】
(メタ)アクリルアミド残基を含む重合性単量体としては、得られた重合体がその構造中にアクリロイル基とアミドとを有すればよく、(メタ)アクリルアミドやそれらの誘導体が含まれる。例えば、アクリルアミド、メタクリルアミド、N,N−ジメチルアクリルアミド、N−イソプロピルアクリルアミド、N−tert−ブチルアクリルアミド、N−tris−ヒドロキシメチルアクリルアミド、N−ヒドロキシメチルアクリルアミド、N−(n−ブトキシメチル)アクリルアミド、N−アクリルオイルリジンやN−アクリルオイルヘキサメチレンジアミンなどの(メタ)アクリルオイルクロライドとアミノ酸または活性アミノ基をもつ化合物との縮合体、および化学式4に示す化合物等がある。
【0028】
【化3】

【0029】
化学式4において、Aは、水素またはメチル基であり、UおよびU’は同一または異なっていてもよく、水素または置換されていてもよいアルキル基である。アルキル基としては、メチル基、エチル基、プロピル基、ブチル基またはペンチル基などがある。
【0030】
(メタ)アクリルアミド残基を含む重合性単量体からなる重合体は親水性が高いため、蛍光モノマー化合物と結合すると、該蛍光モノマー化合物に存在するフェニルボロン酸を含む疎水性の強い発蛍光性原子団が親水性の高い構造体中に取り込まれる。これによって血液や体液に含まれる糖類を測定する場合であっても、水溶性の糖類が容易に該発蛍光性原子団に接近および結合することができる。
【0031】
蛍光センサー物質を構成する、該蛍光モノマー化合物(I)と該アクリルアミド残基を含む重合性単量体(II)との共重合体組成モル比((I):(II))は1:50〜1:6,000であることが好ましく、より好ましくは1:150〜1:3,000である。モル比1:50よりも蛍光モノマー化合物の割合が大きくなると、該蛍光モノマー化合物の嵩高さのため自由度が失われ、糖類との相互作用が低下するおそれがある。一方、モル比1:6,000よりも蛍光モノマー化合物の割合が小さければ、蛍光強度の絶対量を確保できない場合がある。
【0032】
上記二成分からなる蛍光センサー物質の、重量平均分子量は、GPCによるポリエチレンオキサイド換算で、50,000〜750,000が好ましく、より好ましくは150,000〜450,000である。
【0033】
一方、本発明の蛍光センサー物質は、上記蛍光モノマー化合物と(メタ)アクリルアミド残基を含む重合性単量体とに加えて他の成分を併用してもよい。このような成分としては、架橋性単量体、他の架橋性成分、水中で陽イオンとなり得るカチオン性モノマー、水中で陰イオンとなり得るアニオン性モノマー、およびイオンを持たないノニオン系モノマーがある。
【0034】
架橋性単量体としては、重合性二重結合によって蛍光センサー物質中に三次元架橋構造を導入し得るものを広く含み、使用する蛍光センサー物質の置換基によっても異なるが、N,N’−メチレンビス(メタ)アクリルアミド、N,N’−(1,2−ジヒドロキシエチレン)−ビス(メタ)アクリルアミド、ジエチレングリコールジ(メタ)アクリレート、(ポリ)エチレングリコールジ(メタ)アクリレート、トリエチレングリコールジ(メタ)アクリレート、プロピレングリコールジ(メタ)アクリレート、トリメチロールプロパンジ(メタ)アクリレート、トリメチロールプロパントリ(メタ)アクリレート、ペンタエリスリトールジ(メタ)アクリレート、ペンタエリスリトールトリ(メタ)アクリレート、ペンタエリスリトールテトラ(メタ)アクリレート、(ポリ)プロピレングリコールジ(メタ)アクリレート、グリセリントリ(メタ)アクリレート、グリセリンアクリレートメタクリレート、エチレンオキサイド変性トリメチロールプロパントリ(メタ)アクリレート、ペンタエリスリトールテトラ(メタ)アクリレート、ジペンタエリスリトールヘキサ(メタ)アクリレートなどのジビニル化合物がある。本発明では、これらの2種以上を併用してもよい。
【0035】
他の架橋性成分としては、2個以上の官能基を有する化合物を広く含み、使用する蛍光センサー物質の置換基によっても異なるが、トリアリルシアヌレート、トリアリルイソシアヌレート、トリアリルホスフェート、トリアリルアミン、ポリ(メタ)アリロキシアルカン、(ポリ)エチレングリコールジグリシジルエ−テル、グリセロールジグリシジルエーテル、エチレングリコール、ポリエチレングリコール、プロピレングリコール、グリセリン、ペンタエリスリトール、エチレンジアミン、ポリエチレンイミン、グリシジル(メタ)アクリレート、イソシアヌル酸トリアリル、トリメチロールプロパンジ(メタ)アリルエーテル、テトラアリロキシエタンまたはグリセロールプロポキシトリアクリレートなども挙げることが出来る。本発明では、これらの2種以上を併用してもよい。
【0036】
水中で陽イオンとなり得るカチオン性モノマーとしては、ジメチルアミノエチル(メタ)アクリレート、ジエチルアミノエチル(メタ)アクリレートまたは4−ビニルピリジンなどを挙げることができる。本発明では、これらの2種以上を併用してもよい。
【0037】
水中で陰イオンとなり得るアニオン性モノマーとしては、(メタ)アクリル酸、ビニルプロピオン酸または4−ビニルベンゼンスルホン酸などを挙げることができる。本発明では、これらの2種以上を併用してもよい。
【0038】
イオンを持たないノニオン系モノマーとしては、2−ヒドロキシエチル(メタ)アクリレート、3−メトキシプロピル(メタ)アクリレート、4−ヒドロキシブチル(メタ)アクリレート、2−メトキシエチルアクリレートまたは1,4−シクロヘキサンジメタノールモノアクリレートなどを挙げることができる。本発明では、これらの2種以上を併用してもよい。
【0039】
またこれらの架橋性単量体、他の架橋性成分、カチオン性モノマー、アニオン性モノマーおよびノニオン系モノマーは2種以上併用してもよい。これらの他の成分の配合量は、蛍光モノマー化合物と(メタ)アクリルアミド残基を含む重合性単量体との合計量の0.1〜10モル%が好ましく、より好ましくは2〜7モル%である。これら他の成分の併用によって、三次元架橋構造を形成させることができ、また、親水性の調節、反応起点の導入などを行うことができる。なお、三次元架橋構造については後述する。
【0040】
本発明の蛍光センサー物質として、化学式5に示される構造を有していることが好ましい。
【0041】
【化4】

【0042】
化学式5において、X1、X2、Z1、Z2、Y1、Y2、Q、Q’、Q’’およびQ’’’は化学式1に示した蛍光モノマー化合物と同様である。U1、U2、U3、U4、A1およびA2は化学式4に示した(メタ)アクリルアミド残基を含む重合性単量体と同様である。
【0043】
また、p1とq1とのモル比(p1:q1)およびp2とq2とのモル比(p2:q2)は前記(I):(II)のモル比に対応して、1:50〜1:6,000が好ましく、より好ましくは1:150〜1:3,000である。
【0044】
本発明で使用する蛍光センサー物質は、該共重合体の少なくとも一部が分子間架橋を形成し、三次元架橋構造を示していてもよい。ポリ(メタ)アクリルアミド鎖に三次元架橋を形成させると上記蛍光モノマー化合物が基材に固定され、水溶液中でも蛍光モノマー化合物を溶出させることなく糖類の検出が容易にできる。なお、本発明の蛍光モノマー化合物は上記したように糖類と結合して蛍光を発する疎水性部位を有するが、該疎水性部位はYで示す二価の有機残基を介してポリ(メタ)アクリルアミド鎖に結合されるために水溶液中で糖類と結合できる自由度が確保されている。従って、三次元架橋構造を形成しても糖類の検出感度を低下させることがない。
【0045】
本発明の蛍光モノマー化合物や蛍光センサー物質の製造方法および、三次元架橋構造の形成方法には制限がないが、以下の方法で製造することができる。
【0046】
(1−1)蛍光モノマー化合物の製造
化学式1で示される蛍光モノマー化合物として、Xが−C6H12−NHCO−、YがPEG残基、Zが−O−、Qが−COCH3基、Q’、Q’’およびQ’’’が水素である化合物、9,10−ビス(メチレン)[[N−(オルトボロノベンジル)メチレン]−N−[(アクリロイルポリオキシエチレン)カルボニルアミノ]−n−ヘキサメチレン]−2−アセチルアントラセン(F−PEG−AAm−1)の製造方法の1例として、図1に示す合成スキームに従って説明する。
【0047】
原料として2−アセチル−9,10−ジメチルアントラセンを使用し、四塩化炭素/クロロホルム溶媒を加熱してN−ブロモスクシンイミド(NBS)および過酸化ベンゾイル(BPO)と反応させることにより、2−アセチル−9,10−ビス(ブロモメチレン)アントラセンとする。次いで、これをジメチルホルムアミド(DMF)等の溶媒中で、ジイソプロピルエチルアミン(DIEA)等の塩基存在下で、N−(t−ブトキシカルボニル)−ヘキシルジアミンを反応させると、ブロモメチレン基が[(t−ブトキシカルボニルアミノ)ヘキシルアミノ]メチレン基となる。これを、DMF等の溶媒中で、DIEA等の塩基存在下で、2−(2−ブロモメチルフェニル)−1,3−ジオキサボナリンを作用させると、9,10−ビス[[N−6’−(t−ブトキシカルボニルアミノ)ヘキシル−N−[2−(5,5−ジメチルボリナン−2−イル)ベンジル]アミノ]メチル]−2−アセチルアントラセンが得られる。これに塩酸等の酸を作用させて脱保護すると、9,10−ビス(メチレン)[[N−(オルトボロノベンジル)メチレン]−N−(アミノヘキシル)]−2−アセチルアントラセンが得られる。次にアクリロイル−(ポリエチレングリコール)−N−ヒドロキシスクシンイミドエステルを塩基性緩衝液中で反応させると、目的物を得ることができる。
【0048】
なお、原料化合物として、アントラセン骨格に化学式1で示すQで示す置換基として上記化合物と異なる原料化合物を使用すると、溶媒、添加剤、反応温度、反応時間および分離方法等を適宜選択することでQとしてアセチル基以外の基を有する化合物を製造することができる。
【0049】
(1−2)蛍光モノマー化合物の製造
化学式1で示される蛍光モノマー化合物として、Xが−C6H12−NHCO−、YがPEG残基、Zが−O−、Qが−COOCH3基、Q’、Q’’およびQ’’’が水素である化合物、9,10−ビス(メチレン)[[N−(オルトボロノベンジル)メチレン]−N−[(アクリロイルポリオキシエチレン)カルボニルアミノ]−n−ヘキサメチレン]アントラセン−2−カルボキシメチルエステル(F−PEG−AAm−2)の製造方法の1例として、図5に示す合成スキームに従って説明する。
【0050】
原料として9,10−ジメチル−2−アセチルアントラセンを使用し、ジオキサン/過塩素酸ナトリウム水溶液に添加し、加熱攪拌後に酸を加えて、9,10−ジメチルアントラセン−2−カルボン酸の沈殿物を得る。次いで、これを塩酸/メタノール溶媒に溶解し、加熱還流することにより、9,10−ジメチルアントラセン−2−カルボキシメチルエステルとする。これを四塩化炭素/クロロホルム溶媒に溶解し、加熱してN−ブロモスクシンイミド(NBS)および過酸化ベンゾイル(BPO)と反応させることにより、9,10−ビス(ブロモメチレン)アントラセン−2−カルボキシメチルエステルとする。次いで、これをジメチルホルムアミド(DMF)等の溶媒中で、ジイソプロピルエチルアミン(DIEA)等の塩基存在下で、N−(t−ブトキシカルボニル)−ヘキシルジアミンを反応させると、ブロモメチレン基が[(t−ブトキシカルボニルアミノ)ヘキシルアミノ]メチレン基となる。これを、DMF等の溶媒中で、DIEA等の塩基存在下で、2−(2−ブロモメチルフェニル)−1,3−ジオキサボナリンを作用させると、9,10−ビス[[N−6’−(t−ブトキシカルボニルアミノ)ヘキシル−N−[2−(5,5−ジメチルボリナン−2−イル)ベンジル]アミノ]メチル]アントラセン−2−カルボキシメチルエステルが得られる。これに塩酸等の酸を作用させて脱保護すると、9,10−ビス(メチレン)[[N−(オルトボロノベンジル)メチレン]−N−(アミノヘキシル)]アントラセン−2−カルボキシメチルエステルが得られる。次にアクリロイル−(ポリエチレングリコール)−N−ヒドロキシスクシンイミドエステルを塩基性緩衝液中で反応させると、目的物を得ることができる。
【0051】
なお、原料化合物として、アントラセン骨格に化学式1で示すQで示す置換基として上記化合物と異なる原料化合物を使用すると、溶媒、添加剤、反応温度、反応時間および分離方法等を適宜選択することでQとしてカルボキシメチルエステル以外の基を有する化合物を製造することができる。
【0052】
(2)蛍光センサー物質の製造
化学式1で示す蛍光モノマー化合物と(メタ)アクリルアミド残基を含む重合性単量体との共重合は、溶媒の下で、重合促進剤または重合開始剤を用いることができる。溶媒としては、水を使用することができる。蛍光モノマー化合物を水溶性にできる程度の親水性を有するYを導入することにより溶媒が水のみでも重合が可能となった。また、水にジメチルスルホキシド、ジメチルホルムアミド、エチレングリコール、ジエチレングリコールなどのいずれか1種以上を混合したものも用いることができる。本発明において、有機溶媒を混合する場合には、その含有量は10〜50質量%混合することが好ましく、より好ましくは20〜30質量%である。
【0053】
化学式1で示す蛍光モノマー化合物と(メタ)アクリルアミド残基を含む重合性単量体との共重合に際して、更に他の成分を配合することもできる。他の成分を配合する場合、その配合量は、蛍光モノマー化合物と(メタ)アクリルアミド残基を含む重合性単量体との合計量の0.1〜10モル%が好ましく、より好ましくは2〜7モル%である。他の成分を配合する場合、重合時に、重合開始剤や重合促進剤と同時に添加しておくことが好ましい。
【0054】
重合開始剤としては、例えば、過硫酸アンモニウム、過硫酸ナトリウム、過硫酸カリウムまたは過硫酸アンモニウムなどの過硫酸塩;過酸化水素;アゾビス−2−メチルプロピオンアミジン塩酸塩またはアゾイソブチロニトリルなどのアゾ化合物;ベンゾイルパーオキシド、ラウロイルパーオキシド、クメンハイドロパーオキシドまたは酸化ベンゾイルなどのパーオキシド等を挙げることができ、これらの1種または2種以上を用いることができる。この際、重合促進剤として亜硫酸水素ナトリウム、亜硫酸ナトリウム、モール塩、ピロ重亜硫酸ナトリウム、ホルムアルデヒドナトリウムスルホキシレートまたはアスコルビン酸などの還元剤;エチレンジアミン、エチレンジアミン四酢酸ナトリウム、グリシンまたはN,N,N’,N’−テトラメチルエチレンジアミンなどのアミン化合物;などの1種または2種以上を併用することもできる。重合温度は15〜75℃が好ましく、より好ましくは20〜60℃、重合時間は1〜20時間、より好ましくは2〜8時間である。なお、重合開始剤として過硫酸塩と重合促進剤としてN,N,N’,N’−テトラメチルエチレンジアミンとを併用する場合には、室温で重合を行うことができる点で、特に好ましい。
【0055】
一方、上記化学式5で示す化合物は、化学式1で示す蛍光モノマー化合物と(メタ)アクリルアミド残基を含む重合性単量体との共重合によらず製造することもできる。化学式1で示す蛍光モノマー化合物は複数の工程で合成されるため、化合物1で示す蛍光モノマー化合物を原料とすることなくその中間産物に他の化合物を作用させても、最終的に化学式5で示す蛍光センサー物質を製造することができる。例えば、図1のスキームで示した9,10−ビス[[N−(6’−アミノヘキシル)−N−(オルト−ボロノベンジル)アミノ]メチル]−2−アセチルアントラセン、または図5のスキームで示した9,10−ビス[[N−(6’−アミノヘキシル)−N−(オルト−ボロノベンジル)アミノ]メチル]アントラセン−2−カルボキシメチルエステルと(メタ)アクリルアミド残基を含む重合性単量体の重合物にカルボキシル基を導入したものとをカップリング試薬の存在下で作用させても、化学式5で示す蛍光センサー物質を製造することができる。また別の例として、予め(メタ)アクリルアミド残基を有する重合性単量体を重合した後、重合開始剤や重合促進剤の存在下で上記蛍光モノマー化合物と共重合させても化学式5で示す蛍光センサー物質を製造することができる。
【0056】
(3)三次元架橋構造の形成
本発明の蛍光センサー物質は、三次元架橋を有していてもよいのであるが、三次元架橋の導入方法も限定されない。本発明の蛍光センサー物質に架橋成分を作用させて、蛍光センサー物質と蛍光センサー物質との少なくとも一部に分子間架橋を形成させる方法がある。
【0057】
また、前記したように、化学式1で示す蛍光モノマー化合物と(メタ)アクリルアミド残基を含む重合性単量体との共重合に際して、反応溶媒に架橋成分を添加しても三次元架橋を形成させることができる。
【0058】
一方、蛍光センサー物質を、体内埋め込み用の糖類測定用センサーとして使用する場合には蛍光センサー物質の流出を防止するため、基材に固定されることが一般的であるが、このような基材として、(メタ)アクリルアミド残基を含む重合性単量体またはその重合体を使用し、化学式1で示す蛍光モノマー化合物に必要に応じて架橋成分を使用し、これらを重合させ、基材への固定と三次元架橋とを同時に行うこともできる。
【0059】
このような架橋成分としては、前記蛍光センサー物質の配合し得る他の成分の項で記載した架橋性単量体、他の架橋性成分、カチオン性モノマー、アニオン性モノマーおよびノニオン系モノマーを好ましく使用することができ、架橋性単量体および他の架橋性成分をより好ましく用いることができる。本発明では、これらの2種以上を併用してもよい。
【0060】
本発明の第三は、上記蛍光センサー物質が基材に固定化されてなる検出層である。また、本発明の第四は、上記検出層を有する体内埋め込み用の糖類測定用センサーである。
【0061】
体内埋め込み用の糖類測定用センサーは、蛍光センサー物質が流出しないように基材などの固定材料に、共有結合や疎水結合によって、または電気的、その他の相互作用によって固定されていることが好ましい。本発明の蛍光センサー物質を使用した糖類検出方法の概略を、図2を用いて説明する。
【0062】
該センサーは、検出層10を含み、検出層10には蛍光センサー物質30が基材40を介して固定されている。蛍光センサー物質30は、少なくとも黒丸で示す蛍光モノマー化合物33と白丸で示す(メタ)アクリルアミド残基を含む重合性単量体35を含む共重合体であり、水溶液中の糖類70が蛍光モノマー化合物33と相互作用すると蛍光を発する。検出層10は、光学分離層20を有していてもよい。検出層10に光源50から波長350〜420nmの光を当て、反射された蛍光量または波長の変化を検出器60によって検出すると、蛍光量に依存した糖類の濃度を知ることができる。本発明の検出層に使用する基材としては、例えばガラス、金属などの無機材料、プラスチックフィルムなどの有機材料を広く使用することができる。糖類測定用センサーに用いる検出層の基材としては、透明性に優れ、体液中でも溶解や溶出しない材料であることが好ましく、本発明では、ガラスやプラスチックフィルムの中でもポリ(メタ)アクリルアミド膜、またはポリ(メタ)アクリレート膜などを好ましく使用することができる。なお、上述したようにポリ(メタ)アクリルアミド膜を基材として使用すると、蛍光センサー物質の基材への固定と三次元架橋の形成とが同時に行える点で有利である。なお、架橋性重合体を使用した場合の架橋構造は、図2に示すように、(メタ)アクリルアミド残基を含む重合性単量体部位35と(メタ)アクリルアミド残基を含む重合性単量体部位35との間、蛍光モノマー化合物部位33と(メタ)アクリルアミド残基を含む重合性単量体部位35との間、または(メタ)アクリルアミド残基を含む重合性単量体部位35と基材40との間に形成される。
【0063】
蛍光センサー物質を無機材料または有機材料からなる基材表面に固定する場合、基材と蛍光センサー物質とを架橋剤などを使用して化学的に結合させることもできる。このような架橋剤としては、化学式6に示すシランカップリング剤がある。
【0064】
【化5】

【0065】
化学式6において、R”Oは、メトキシ基、エトキシ基、プロポキシ基などの炭素数1〜5のアルコキシ基を示し、好ましくはメトキシ基、エトキシ基である。無機材料は、該アルコキシ基と化学結合をすることができる。Eは、ビニル基、エポキシ基、アミノ基、メルカプト基、アクリル基、メタクリル基、(メタ)アクリロイル基、またはこれらの誘導体であって、有機材料と化学結合することができる官能基である。本発明で好適に使用できるシランカップリング剤としては、ビニルトリメトキシシラン、3−グリシドキシプロピルトリメトキシシラン、N−2−(アミノエチル)−3−アミノプロピルエトキシシラン、3−メルカプトプロピルトリメトキシシラン、3−アクリロキシプロピルトリメトキシシラン、3−メタクリロキシプロピルトリメトキシシラン、および3−メタクリロキシプロピルトリエトキシシランなどがある。
【0066】
上記シランカップリング剤のうち、Eがビニル基、アクリル基、メタクリル基、(メタ)アクリロイル基などの重合性二重結合を有する置換基である場合には、これをガラス、金属ななどの無機材料の表面に予め塗布しておけば、これら表面でフェニルボロン酸残基とアクリルアミド残基とを含む蛍光モノマー化合物と、(メタ)アクリルアミド残基を含む重合性単量体とを共重合させつつ直接固定化することもできる。なお、シランカップリング剤で表面処理した基材表面に直接蛍光センサー物質を固定することもできる。
【0067】
一方、蛍光センサー物質をプラスチックフィルムなどの有機材料表面に固定するには、プラスチックフィルムに反応活性基を有する置換基を導入し、蛍光センサー物質と結合させてもよい。このような反応活性基の導入方法としては、例えば、特開平5−245198号公報に記載の、プラズマ、電子線、放射線などによるグリシジル(メタ)アクリレートのグラフト重合法などがある。
【0068】
これらシランカップリング処理した無機材料または有機材料、もしくは反応活性基を導入したプラスチックフィルムに蛍光センサー物質をより結合しやすくするには、蛍光センサー物質の合成時に予め反応活性置換基を有する単量体を共重合成分として使用してもよく、蛍光センサー物質合成後に反応活性基を導入してもよい。このような単量体としては、蛍光センサー物質の項で記載したものを使用することができる。このような反応活性基としては、アミノ基、カルボキシル基、水酸基、ハロゲン化カルボキシル基、スルホニル基、チオール基、イソシアネート基、イソチオシアネート基、またはエポキシ基等がある。なお、シランカップリング処理した無機材料や有機材料上の反応活性基と蛍光センサー物質との結合は、適当な溶媒、触媒、縮合剤の存在下、非存在下に行うことができる。
【0069】
本発明の体内埋め込み用の糖類測定用センサーは、少なくとも図2に示すように、蛍光センサー物質を固定した検出層、光源および蛍光検出装置を有すればよく、これらが適当なハウジング内に配置されていればよい。
【0070】
本発明の検出層が、体内埋め込み用の糖類測定用センサー内に用いられる場合、図2に示すように検出層10に光学分離層20が積層されることが好ましい。光学分離層20がセンサーの外表面側に配置されると、検出層10に含まれる蛍光センサー物質と体液成分であるラジカル、酸化性物質または還元性物質などとの接触を回避することができ、これらの体液内成分による蛍光センサー物質の劣化を防止することができる。また、光学分離層20を積層すると、光源50から発した励起光の反射や散乱による検出能の低下も防止することができる。更に、糖類以外の生体物質が光源からの励起光により励起した場合であっても、光学分離層20の存在によって光源50からの励起光外部由来の光を遮蔽し、または生体内の有色物質または蛍光物質の影響を排除することもできる。
【0071】
このような作用を有する光学分離層20は、光学分離層基材と不透明物質とからなる。光学分離層基材としては、架橋または化学修飾されていてもよい高分子が選択され、高分子として例えばデキストラン、ポリ(メタ)アクリルアミド、ポリ(メタ)アクリレート、ポリエチレングリコール、ポリビニルアルコール、ポリアミド、ポリウレタン、これらの混合物、またはこれらの共重合体などがある。また、光学分離層基材にはビタミンE、ポリフェノール類または金属キレート類などで修飾したり、またはこれらを担持したりしてもよい。また、不透明物質としては、カーボンブラック、フラーレン、カーボンナノチューブ、または酸化鉄などを用いることができる。
【0072】
検出層10と光学分離層20とは共有結合、イオン結合または疎水結合などにより、化学結合によって積層させることができる。例えば、光学分離層がその基材としてデキストランを、不透明物質としてカーボンブラックを使用する場合には、溶媒にデキストランを溶解させた後にカーボンブラックを添加し、超音波処理により均一化し、これにアルカリ水溶液とエチレングリコールジグリシジルエーテルを更に添加する。ついで、検出層に噴霧器を用いて上記溶液を均一に噴霧し、加熱および乾燥して検出層に光学分離層を積層する。
【0073】
図3に本発明の体内埋め込み用の糖類測定用センサーの外観の斜視図を示す。該体内埋め込み用の糖類測定用センサーは、その内部を液密に保つハウジング110、光学分離層または検出層のみを露出させる窓部120および体外のシステムと通信するためのアンテナ部130を有する。
【0074】
図4に該体内埋め込み用の糖類測定用センサーの内部構造を示す。光学分離層20または検出層10が内部を液密に保つために窓部120を塞ぐように設けられ、励起光を発する光源50、光源50からの光を検出層10まで導く光学導波路170、検出層10からの蛍光を検出する蛍光検出装置60、蛍光検出装置60からの信号データを処理する集積回路140および内部の電源である電池150が搭載されている。なお、アンテナ部130には、アンテナ用コイル160が配設されている。なお、図3、図4は概念図であり、実施はこれに限定するものではない。必要に応じて各構成物の大きさ、形状、配置を自由に設定できる。
【0075】
体内埋め込み用の糖類測定用センサーを用いることにより、糖尿病患者が血糖値を自己制御する際の、煩雑性または血糖値のタイムラグの発生を回避することができる。また、体内埋め込み用の糖類測定用センサーを用いることにより、糖尿病患者以外の人々が、健康管理のための血糖値測定を簡便に行うことも可能となる。
【実施例】
【0076】
以下に実施例を挙げて本発明を具体的に説明するが、これらの実施例は何ら本発明を制限するものではない。
【0077】
(実施例1:9,10−ビス(メチレン)[[N−(オルトボロノベンジル)メチレン]−N−[(アクリロイルポリオキシエチレン)カルボニルアミノ]−n−ヘキサメチレン]−2−アセチルアントラセン(以下F−PEG−AAm−1と記載)の合成)
A)9,10−ビス(ブロモメチル)−2−アセチルアントラセンの合成
9,10−ジメチル−2−アセチルアントラセン600mg、N−ブロモスクシンイミド800mg、過酸化ベンゾイル5mgを、クロロホルム6mLと四塩化炭素20mLの混合物に加え、80℃で2時間加熱還流を行った。溶媒を除去後、残渣をメタノールで抽出し、780mgの目的物を得た。
【0078】
B) 9,10−ビス[6’−(t−ブトキシカルボニルアミノ)ヘキシルアミノメチル]−2−アセチルアントラセンの合成
上記A)で得た生成物500mg、N−BOC−ヘキシルジアミン1.125g、ジイソプロピルエチルアミン1.25mLをジメチルホルムアミド10mLに溶解し、45℃で1時間攪拌反応を行った。反応混合物はクロロホルム60mLで希釈し、水100mLで3回、飽和食塩水100mLで1回洗浄し、有機相を無水硫酸ナトリウムで乾燥した。乾燥剤を濾過後、濃縮しクロロホルム/メタノールを溶離液とするシリカゲルカラムクロマトグラフィーにて精製し、367mgの目的物を得た。
【0079】
C) 9,10−ビス[[N−6’−(t−ブトキシカルボニルアミノ)ヘキシル−N−[2−(5,5−ジメチルボリナン−2−イル)ベンジル]アミノ]メチル]−2−アセチルアントラセンの合成
上記B)で得た生成物200mg、2−(2−ブロモメチルフェニル)−1,3−ジオキサボリナン700mg、N,N−ジイソプロピルエチルアミン0.35mLを3mLのジメチルホルムアミドに溶解し、25℃で16時間攪拌した。溶媒除去後、メタノール/クロロホルムを溶離液とするシリカゲルカラムで精製し目的物194mgを得た。
【0080】
D) 9,10−ビス[[N−(6’−アミノヘキシル)−N−(オルト−ボロノベンジル)アミノ]メチル]−2−アセチルアントラセンの合成
上記C)で得た生成物100mgを2mLのメタノールに溶解し、4N塩酸2mLを加えて25℃で10時間攪拌した。蒸発乾固後、ゲル濾過によって無機塩を除去し、目的物95mgを得た。
【0081】
E) F−PEG−AAm−1の合成
上記D)で得た生成物160mgを0.5mLのジメチルホルムアミドに溶解し、アクリロイル−(ポリエチレングリコール)−N−ヒドロキシスクシンイミドエステル(PEG分子量3,400)1.22gの10mL100mMリン酸緩衝液(pH=8.0)溶液に加え、25℃で20時間攪拌した。反応混合物をゲル濾過に供し、蛍光高分子画分を採取し、凍結乾燥後、目的物1.2gを得た。上記A)〜E)を図1の合成スキームに示す。F−PEG−AAm−1は有機溶媒や可溶化剤の存在無しに、温度25℃pH7.0の条件下において濃度100mMで水に溶解した。重クロロホルム中のNMRデータは以下の通りであった。δ1.30−1.65(m,C−CH2−C),2.90(s,Ac),2.78(m,−C(−C)N−CH2−C),3.25(m,CH2−NH−COO),3.50−3.80(s,PEG),5.80(d,COCH=C),6.17(m,C=CH2),7.20−8.20(m,aromatic)、PEG残基由来のピークと重なる水素のシグナルは確認出来なかった。
【0082】
(実施例2)
最終濃度としてアクリルアミドが15質量%、実施例1で合成したF−PEG−AAm−1が10質量%、メチレンビスアクリルアミドが0.3質量%、および過硫酸ナトリウムが0.18質量%,N,N,N’,N’−テトラメチルエチレンジアミンが0.36質量%となるように純水に溶解・混合して溶液を調製した。予め、シランカップリング剤による表面処理を行ったガラスプレートと無処理のガラスプレートとを隙間を設けて設置し、隙間に上記溶液を流し込み、窒素雰囲気下25℃で8時間重合させた。重合終了後ガラスプレートを純水につけて、無処理のガラスプレートのみを剥がして、ガラス基材上にアクリルアミド/F−PEG−AAm−1(160/1モル比)が固定されたゲルシートを得た。
【0083】
さらに、得られたゲルシート表面に最終濃度としてアクリルアミドが20質量%、メチレンビスアクリルアミドが1質量%、および過硫酸ナトリウムが0.18質量%、N,N,N’,N’−テトラメチルエチレンジアミンが0.36質量%、カーボンブラックが5質量%となるように純水に溶解・混合して調製した溶液を積層し、窒素雰囲気下25℃で24時間重合させた。得られたゲルシートを、グルコース濃度500mg/dLの50mMリン酸緩衝液(pH7.0)への浸漬洗浄30分間を合計10回繰り返した。その後50mMリン酸緩衝液(pH7.0)への浸漬洗浄30分間を合計4回繰り返してグルコースを洗い流して検出層を得た。
【0084】
(実施例3:9,10−ビス(メチレン)[[N−(オルトボロノベンジル)]−N−[(アクリロイルポリオキシエチレン)カルボニルアミノ]−n−ヘキサメチレン]−アントラセン−2−カルボキシメチルエステル(以下F−PEG−AAm−2と記載)の合成)
a) 9,10−ジメチルアントラセン−2−カルボン酸の合成
9,10−ジメチル−2−アセチルアントラセン1.2gを24mLのジオキサンに溶解し、10mLの過塩素酸ナトリウム水溶液(有効塩素濃度10質量%)を加え、85℃で8時間攪拌反応した。反応混合物を冷却後に希塩酸で酸性とし、析出した沈殿をろ過および少量の水で洗浄した後に真空乾燥し、目的物1.16gを得た。
【0085】
b) 9,10−ジメチルアントラセン−2−カルボキシメチルエステルの合成
上記a)で得られた生成物1gを5質量%塩酸−メタノールに溶解し、20時間加熱還流を行った。反応混合物を濃縮し、30mLの水を加え、100mLのクロロホルムで抽出を行った。クロロホルム層は重炭酸水素ナトリウム水溶液、飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥した。これを蒸発乾固し、915mgの目的物を得た。
【0086】
c) 9,10−ビス(ブロモメチレン)アントラセン−2−カルボキシメチルエステルの合成
上記b)で得た生成物600mg、N−ブロモスクシンイミド800mg、過酸化ベンゾイル5mgを、クロロホルム6mLと四塩化炭素20mLの混合物に加え、2時間加熱還流を行った。溶媒を除去後、残渣をメタノールで抽出し、767mgの目的物を得た。
【0087】
d) 9,10−ビス[6’−(t−ブトキシカルボニルアミノ)ヘキシルアミノメチル]アントラセン−2−カルボキシメチルエステルの合成
上記c)で得た生成物500mg、N−BOC−ヘキシルジアミン1.125g、ジイソプロピルエチルアミン1.25mLをジメチルホルムアミド10mLに溶解し、45℃で2時間攪拌反応を行った。反応混合物はクロロホルム60mLで希釈し、水100mLで3回、飽和食塩水100mLで1回洗浄し、有機相を無水硫酸ナトリウムで乾燥した。乾燥剤を濾過後、濃縮しクロロホルム/メタノールを溶離液とするシリカゲルカラムクロマトグラフィーにて精製し、307mgの目的物を得た。
【0088】
e) 9,10−ビス[[N−6’−(t−ブトキシカルボニルアミノ)ヘキシル−N−[2−(5,5−ジメチルボリナン−2−イル)ベンジル]アミノ]メチル]アントラセン−2−カルボキシメチルエステルの合成
上記d)で得た生成物200mg、2−(2−ブロモメチルフェニル)−1,3−ジオキサボリナン700mg、N,N−ジイソプロピルエチルアミン0.35mLを3mLのジメチルホルムアミドに溶解し、25℃で16時間攪拌した。溶媒除去後、メタノール/クロロホルムを溶離液とするシリカゲルカラムで精製し目的物203mgを得た。
【0089】
f) 9,10−ビス(メチレン)[[N−(オルトボロノベンジル)メチレン]−N−(アミノヘキシル)]アントラセン−2−カルボキシメチルエステルの合成
上記e)で得た生成物100mgを3mLのメタノールに溶解し、8N塩酸0.5mLを加えて25℃で2日間攪拌した。蒸発乾固後、ゲル濾過によって無機塩を除去し、目的物82mgを得た。
【0090】
g) F−PEG−AAm−2の合成
上記f)で得た生成物160mgを0.5mLのジメチルホルムアミドに溶解し、アクリロイル−(ポリエチレングリコール)−N−ヒドロキシスクシニイミドエステル(PEG分子量3,400)1.22gの10mL100mMリン酸緩衝液(pH=8.0)溶液に加え、25℃で20時間攪拌した。反応混合物をゲル濾過に供し、蛍光高分子画分を採取し、凍結乾燥後、目的物1.1gを得た。上記a)〜e)を図5の合成スキームに示す。F−PEG−AAm−2は有機溶媒や可溶化剤の存在無しに、温度25℃pH7.0の条件下において濃度100mMで水に溶解した。重クロロホルム中のNMRデータは以下の通りであった。d1.30−1.65(m,C−CH2−C),2.78(m,−C(−C)N−CH2−C),3.25(m,CH2−NH−COO),3.50−3.80(s,PEG),4.10(s,COOCH3),5.80(d,COCH=C),6.17(m,C=CH2),7.20−8.20(m,aromatic),PEG鎖ピークと重なる水素のシグナルは確認出来なかった。
【0091】
(実施例4)
実施例3で合成したF-PEG−AAm−2を用いて実施例2と同様の方法でガラス基材上にアクリルアミド/F−PEG−AAm−2(160/1モル比)が固定されたゲルシートを得た。さらに実施例2と同様の方法で検出層を得た。
【0092】
(比較例:9,10−ビス(メチレン)[N−(アクリロイルアミノヘキシル)−N−(オルト−ボロノベンジル)メチレン]−アントラセン(以下F−AAmと記載)の合成)
【0093】
【化6】

【0094】
A’) 9,10−ビス[6’−(t−ブトキシカルボニルアミノ)ヘキシルアミノメチル]アントラセンの合成
9,10−ビス(クロロメチル)−アントラセン500mg、N−BOC−ヘキシルジアミン1.3g、ジイソプロピルエチルアミン1.25mLをジメチルスルホキシド10mLに溶解し、60℃で6時間攪拌反応を行った。反応混合物はクロロホルム60mLで希釈し、水100mLで3回、飽和食塩水100mLで1回洗浄し、有機相を無水硫酸ナトリウムで乾燥した。乾燥剤を濾過後、濃縮しクロロホルム/メタノールを溶離液とするシリカゲルカラムクロマトグラフィーにて精製し、56mgの目的物を得た。
【0095】
B’) 9,10−ビス[[N−6’−(t−ブトキシカルボニルアミノ)ヘキシル−N−[2−(5,5−ジメチルボリナン−2−イル)ベンジル]アミノ]メチル]アントラセンの合成
上記A’)で得た生成物50mg、2−(2−ブロモメチルフェニル)−1,3−ジオキサボリナン170mg、N,N−ジイソプロピルエチルアミン0.1mLを1mLのジメチルホルムアミドに溶解し、25℃で5時間攪拌した。溶媒除去後、メタノール/クロロホルムを溶離液とするシリカゲルカラムで精製し目的物35mgを得た。
【0096】
C’) 9,10−ビス[[N−(6’−アミノヘキシル)−N−(オルト−ボロノベンジル)アミノ]メチル]アントラセンの合成
上記B’)で得た生成物35mgを1mLのメタノールに溶解し、4N塩酸0.5mLを加えて25℃で10時間攪拌した。蒸発乾固後、ゲル濾過によって無機塩を除去し、目的物26mgを得た。
【0097】
D’) F−AAmの合成
上記C’)で得た生成物25mgをDMF0.5mLに溶解し、窒素雰囲気下、−10℃でN,N−ジイソプロピルエチルアミン20mg、塩化アクリロイル12mgを加え、30分攪拌反応を行った。反応混合物を氷水中に注ぎ、クロロホルムで抽出し、飽和食塩水で洗浄を行った。クロロホルム相は乾燥後、蒸発乾固し、化学式7に示す目的物26mgを得た。
【0098】
E’)重合
最終濃度としてアクリルアミドが15質量%、メチレンビスアクリルアミドが0.3質量%、F−AAmが1.2質量%、および過硫酸ナトリウムが0.18質量%、N,N,N’,N’−テトラメチルエチレンジアミンが0.36質量%となるように80v/v%ジメチルスルホキシド水溶液に溶解・混合して溶液を調製した。予めシランカップリング剤による表面処理を行ったガラスプレートと無処理のガラスプレートとを隙間を設けて設置し、隙間に上記溶液を流し込み、窒素雰囲気下25℃で8時間重合させた。重合終了後ガラスプレートを純水につけて、無処理のガラスプレートのみを剥がして、ガラス基材状にアクリルアミド/F−AAm(150/1モル比)が固定されたゲルシートを得た。
【0099】
さらに、得られたゲルシート表面に最終濃度としてアクリルアミドが20質量%、メチレンビスアクリルアミドが1質量%、および過硫酸ナトリウムが0.18質量%、N,N,N’,N’−テトラメチルエチレンジアミンが0.36質量%、カーボンブラックが5質量%となるように純水に溶解・混合して調製した溶液を積層し、窒素雰囲気下25℃で24時間重合させた。得られたゲルシートを、グルコース濃度500mg/dLの50mMリン酸緩衝液(pH7.0)への浸漬洗浄30分間を合計10回繰り返した。その後50mMリン酸緩衝液(pH7.0)への浸漬洗浄30分間を合計4回繰り返してグルコースを洗い流して検出層を得た。
【0100】
(実施例5)
実施例2、実施例4および比較例で得られたセンサーをそれぞれ評価装置に固定し、リン酸緩衝液(pH=7.0)下で蛍光強度のグルコース応答性を評価した(図6)。励起波長は405nm、蛍光検出波長は475nmを用いた。
【0101】
評価装置は、検出層を固定し内部に液体を循環することのできるセルと、セルの裏面に末端が固定された光学ファイバーの束、そしてその光学ファイバーの他方末端が蛍光分光光度計へ接続された構造になっている。光学ファイバーの束の一部は励起光をセルに送るために、残りは蛍光放射光をセルから返すために用いられる構造となっている。
【0102】
図6から明らかなように、本発明の水溶性蛍光モノマーからなるセンサーは、従来の疎水性モノマーからなるセンサーと比較して、グルコースへの応答性が大幅に改善されていることが明らかとなった。
【0103】
(実施例6)
実施例2、実施例4および比較例で得られたセンサーをそれぞれ評価装置に固定し、リン酸緩衝液(pH=7.0)下で蛍光スペクトルを測定した。
【0104】
比較例のセンサーは377nmの励起で極大蛍光波長が403nmと430nmなのに対し、実施例2のセンサーは400nmの励起で極大蛍光波長が480nmであり、実施例4のセンサーは400nmの励起で極大蛍光波長が455nmであった。本発明のセンサーは、蛍光波長が長波長側にシフトしており、さらに励起波長と蛍光波長との差が大きく、蛍光特性上有利であり、測定精度が高いと推定される。
【符号の説明】
【0105】
10 検出層、
20 光学分離層、
30 蛍光センサー物質、
33 蛍光モノマー化合物、
35 (メタ)アクリルアミド残基を含む重合性単量体、
40 基材、
50 光源、
60 蛍光検出装置、
70 糖類、
110 ハウジング、
120 窓部、
130 アンテナ部、
140 集積回路、
150 電池、
160 アンテナ用コイル、
170 光学導波路。
【特許請求の範囲】
【請求項1】
化学式5に示す蛍光センサー物質。
【化1】

(化学式5において、
X1およびX2は同一または異なっていてもよく、−COO−、−OCO−、−CH2NR−、−NR−、−NRCO−、−CONR−、−SO2NR−、−NRSO2−、−O−、−S−、−SS−、−NRCOO−、−OCONR−および−CO−からなる群より選択される少なくとも1種の置換基を含む炭素数1〜30のアルキレンを示し、Rは水素または置換されていてもよいアルキル基を示し、
Z1およびZ2は同一または異なっていてもよく、−O−または−NR’−を示し、R’は水素または置換されていてもよいアルキル基を示し、
Y1およびY2は同一または異なっていてもよく、前記蛍光モノマー化合物を水に溶解させうる2価の有機残基であり、
Q、Q’、Q’’、およびQ’’’は同一または異なっていてもよく、水素、水酸基、置換されていてもよいアルキル基、アシル基、オキシアルキル基、ハロゲン、カルボキシル基、カルボキシエステル、カルボキシアミド、シアノ基、ニトロ基、アミノ基およびアミノアルキル基からなる群より選択される置換基であって、QおよびQ’は一緒になって縮合環を形成していてもよく、Q’’およびQ’’’は一緒になって縮合環を形成していてもよく、
A1およびA2は同一または異なっていてもよく、水素またはメチル基であり、
U1、U2、U3およびU4は同一または異なっていてもよく、水素または置換されていてもよいアルキル基である。)
【請求項2】
該Y1および該Y2の少なくとも一方が化学式2または化学式3に示す構造を含む請求項1に記載の蛍光センサー物質。
【化2】

(化学式2および化学式3において、nは2〜5であり、jは1〜5であり、mは1〜200である。)
【請求項3】
該p1に対する該q1のモル比(p1:q1)および/または該p2に対する該q2のモル比(p2:q2)が、1:50〜1:6,000である請求項2または3に記載の蛍光センサー物質。
【請求項1】
化学式5に示す蛍光センサー物質。
【化1】

(化学式5において、
X1およびX2は同一または異なっていてもよく、−COO−、−OCO−、−CH2NR−、−NR−、−NRCO−、−CONR−、−SO2NR−、−NRSO2−、−O−、−S−、−SS−、−NRCOO−、−OCONR−および−CO−からなる群より選択される少なくとも1種の置換基を含む炭素数1〜30のアルキレンを示し、Rは水素または置換されていてもよいアルキル基を示し、
Z1およびZ2は同一または異なっていてもよく、−O−または−NR’−を示し、R’は水素または置換されていてもよいアルキル基を示し、
Y1およびY2は同一または異なっていてもよく、前記蛍光モノマー化合物を水に溶解させうる2価の有機残基であり、
Q、Q’、Q’’、およびQ’’’は同一または異なっていてもよく、水素、水酸基、置換されていてもよいアルキル基、アシル基、オキシアルキル基、ハロゲン、カルボキシル基、カルボキシエステル、カルボキシアミド、シアノ基、ニトロ基、アミノ基およびアミノアルキル基からなる群より選択される置換基であって、QおよびQ’は一緒になって縮合環を形成していてもよく、Q’’およびQ’’’は一緒になって縮合環を形成していてもよく、
A1およびA2は同一または異なっていてもよく、水素またはメチル基であり、
U1、U2、U3およびU4は同一または異なっていてもよく、水素または置換されていてもよいアルキル基である。)
【請求項2】
該Y1および該Y2の少なくとも一方が化学式2または化学式3に示す構造を含む請求項1に記載の蛍光センサー物質。
【化2】

(化学式2および化学式3において、nは2〜5であり、jは1〜5であり、mは1〜200である。)
【請求項3】
該p1に対する該q1のモル比(p1:q1)および/または該p2に対する該q2のモル比(p2:q2)が、1:50〜1:6,000である請求項2または3に記載の蛍光センサー物質。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2010−209339(P2010−209339A)
【公開日】平成22年9月24日(2010.9.24)
【国際特許分類】
【出願番号】特願2010−96002(P2010−96002)
【出願日】平成22年4月19日(2010.4.19)
【分割の表示】特願2004−299991(P2004−299991)の分割
【原出願日】平成16年10月14日(2004.10.14)
【出願人】(000109543)テルモ株式会社 (2,232)
【Fターム(参考)】
【公開日】平成22年9月24日(2010.9.24)
【国際特許分類】
【出願日】平成22年4月19日(2010.4.19)
【分割の表示】特願2004−299991(P2004−299991)の分割
【原出願日】平成16年10月14日(2004.10.14)
【出願人】(000109543)テルモ株式会社 (2,232)
【Fターム(参考)】
[ Back to top ]

