納豆菌による高分子量ポリ−γ−グルタミン酸の生産方法
【課題】 γ−PGAの液体培地中への蓄積が、培地中のγ−PGAの蓄積量が一定しないことに起因して非常に不安定である納豆菌を用いて、遺伝子操作によらず、納豆菌が生産するγ−PGA分解酵素群の生成を抑制することによって、高分子量のγ−PGAを安定して生産する方法を提案する。
【解決手段】 納豆の製造に供される納豆菌に、養分の枯渇と再投与、温度変動、酸素供給の有無、pH変動の何れかの外的ストレスを単独または組み合わせて与えることによって、ポリ−γ−グルタミン酸分解酵素群の生成を抑制する高分子量(300万以上)ポリ−γ−グルタミン酸の安定生産方法である。
【解決手段】 納豆の製造に供される納豆菌に、養分の枯渇と再投与、温度変動、酸素供給の有無、pH変動の何れかの外的ストレスを単独または組み合わせて与えることによって、ポリ−γ−グルタミン酸分解酵素群の生成を抑制する高分子量(300万以上)ポリ−γ−グルタミン酸の安定生産方法である。
【発明の詳細な説明】
【技術分野】
【0001】
この発明は、ポリ−γ−グルタミン酸(以下γ−PGAと称する)の生産方法、とくに、納豆菌による高分子量ポリ−γ−グルタミン酸の生産方法に関する。
【背景技術】
【0002】
バチルス属細菌がグルコースあるいはクエン酸などからγ−PGAを生産することは、非特許文献1にも記載されているようによく知られている。
【0003】
しかし、長い食経験を有し、生体安全性の高い納豆菌(Bacillus subtilis var. natto)によるγ−PGAの生産は、固体培養では安定するものの、大量生産に不可欠である液体培養では極めて不安定である。
【0004】
これは、液体培養では培地中のγ−PGAの蓄積量が一定しないことに起因しており、同一の培養条件であってもγ−PGAをほとんど回収できない場合もある。
【0005】
この不安定さは培養規模が拡大すると加速度的に増大し、50リットル以上の培養規模では粘性がほとんど認められない割合が9割を越えることもあるなど、固体培養と同等の高分子量γ−PGAを安定して得ることは極めて困難である。このように、納豆菌において液体培養が不安定であることは、人体に対する安全性の面で不安のないγ−PGAを大量生産できないことを意味する。
【0006】
納豆菌以外のバチルス・ズブチリス(Bacillus subtilis)、バチルス・リケニホルミス(Bacillus licheniformis)やバチルス・メガテリウム(Bacillus megaterium)などのバチルス属細菌は比較的容易にγ−PGAを生産・蓄積できるため、これらの菌を用いて糖類を追加供給する方法が特許文献1に提案されている。
【0007】
しかしながら、この方法は、不純物である多糖類の生成を防ぎつつ不足する養分を供給し、γ−PGAの収量を向上させることを目的としたものであり、糖類の濃度を2から3g/l以下に維持するように流加培養を行うものである。
【0008】
ところが、糖類の濃度を望ましいレベルに維持することは、γ−PGAを蓄積する状態にあるバチルス属細菌には効果を示すが、培地中にγ−PGAを蓄積しない状態に陥った納豆菌には効果を示さない。
【0009】
また、バチルス属細菌が生産するγ−PGAの平均分子量は、特許文献2〜5に記載のとおり、数千ないしは200万のレベルであり、納豆菌が固体培養において生産するγ−PGAの平均分子量の300万以上には及ばない。
【0010】
加えて、これらのバチルス属細菌は生体安全性の検討が十分とは言えず、人体に与える影響の面で不安がある。
【0011】
このγ−PGAの生産をコードする遺伝子はpgsBCAであり、その直下にD−グルタミン酸とL−グルタミン酸の結合を切断して分子量10万から50万に断片化するγ−PGA分解酵素YwtDをコードする遺伝子、ywtDが存在することが非特許文献2と特許文献6に報告されている。
【0012】
YwtD以外にも、特許文献7には、分子量10万の断片に切断する酵素、ポリグルタミン酸ハイドラーゼ(以下PghAと表記する)が存在することが記載され、また、非特許文献3、4および特許文献8、9には、末端からグルタミン酸を順次切断する酵素、γ−グルタミルトランスペプチダーゼ(以下GGTと表記する)を有することも報告されている。
【0013】
また、γ−PGAは将来の飢餓に備えた栄養源の蓄積と、アメーバなどの外敵から菌体自身を保護することを目的として生産されるものと考えられている。固体培養では菌体表面に存在する何らかの受容体が菌体が空気中に露出していることを認識し、上記のYwtD、PghAやGGT等のγ−PGA分解酵素群の生成が抑制されて、相当量のγ−PGAが蓄積される。
【0014】
これに対して、液体培養では菌体表面が空気中に露出していないためγ−PGA分解酵素群の生成が抑制されにくくなり、結果としてγ−PGAの蓄積が不安定になるものと考えられる。
【0015】
これに対処することを目的として、下記特許文献10と11には、γ−PGA分解酵素群に係わる遺伝子を欠損させることが提案されている。
【0016】
しかし、遺伝子組み換え体を大量に培養することは、各省庁が定めるガイドラインの拘束を受けるため実施が困難であり、また、消費者に与えるイメージの点でも問題があった。
【特許文献1】大韓民国特許第363434号(PCT/KR00/00761)
【特許文献2】特公昭43−24472号公報
【特許文献3】特開平1−174397号公報
【特許文献4】特開平3−47087号公報
【特許文献5】特許第3081901号明細書
【特許文献6】特開2003−235566号公報
【特許文献7】特開2003−230384号公報
【特許文献8】特開2003−230384号公報
【特許文献9】特開2003−235566号公報
【特許文献10】特開2003−230384号公報
【特許文献11】特開2003−235566号公報
【非特許文献1】F.B.Oppermann−Sanio and A.Steinbuchel, Naturwissenschaften, Vol.89, pp.11−22 (2002)
【非特許文献2】T.Suzuki and Y.Tahara, J.Bacteriol., Vol.185, No.7, pp.2379−2382 (2003)
【非特許文献3】Y.Ogawa, H.Hosoyama, M.Hamano and H.Motai, Agri.Biol.Chem., 55, pp.2971−2977 (1991)
【非特許文献4】K.Xu and M.A.Strauch, J.Bacteriol., 178, pp.4319−4322 (1996)
【非特許文献5】T.Nagai, L.S.Phan Tran, Y.Inatsu and Y.Itoh, J.Bacteriology, 182, pp.2387−2392 (2000)
【非特許文献6】T.Nagai, L.−S. Phan Tran, Y.Inatsu, and Y.Itoh, J.Bacteriol., 182, pp.2387−2392 (2000)
【非特許文献7】納豆試験法研究会, 納豆試験法, pp.65−73, 光琳 (1990)
【非特許文献8】A.Goto and M.Kunioka, Biosci.Biotech.Biochem., 56, pp.1031−1035 (1992)
【非特許文献9】M.Kambourova, M.Tangney and F.G.Priest, Appl.and Environ.Microbiol., Vol.67, No.2, pp.1004−1007 (2001)
【発明の開示】
【発明が解決しようとする課題】
【0017】
この発明が解決しようとする課題は、γ−PGAの液体培地中への蓄積が、培地中のγ−PGAの蓄積量が一定しないことに起因して非常に不安定である納豆菌を用いて、高分子量のγ−PGAを安定して生産する方法を提案するものである。
【0018】
さらに詳しくは、液体培地を用いた納豆菌によるγ−PGAの生産が困難である要因はYwtD、PghAやGGTなどのγ−PGA分解酵素群にある。分解酵素群が生成すると、納豆菌が生成したγ−PGAは即座に分解されて、培地中に蓄積されない。この発明は、遺伝子操作によらず、納豆菌が生産するγ−PGA分解酵素群の生成を抑制する手法を提供するものである。
【課題を解決するための手段】
【0019】
この発明は、γ−PGAの生産安定性はγ−PGA分解酵素群の生成によって損なわれており、γ−PGA分解酵素群の生成を抑制できれば安定生産が可能であることに着目し、菌体に外的ストレスを与えることによってγ−PGA分解酵素群の生成を効果的に抑制できることを見出し、この知見に基づいて完成したものである。
【0020】
この発明が対象とする納豆菌は市販の納豆の生産に供されるものを指す。市販の納豆製造には、γ−PGAの生産にビオチンを要求し、バチルス・ズブチリスに分類される菌株が用いられる。納豆の製造に用いられる代表的な納豆菌は、宮城野菌、高橋菌、成瀬菌であるが、これらは共通の菌株に由来することが分子遺伝学的手法によって確認されている(非特許文献5)。
【0021】
γ−PGAの生産に供する菌株はこれらのいずれでも良く、Bacillus subtilis var. nattoとして登録されている、例えばIFO3009、IFO3013、IFO3335、IFO3336、IFO3936、IFO13169、ATCC7058、ATCC7059、ATCC15245のような任意の分譲菌株を用いることもできる。
【0022】
ただし、非特許文献6にも記載のとおり、納豆菌は遺伝的に不安定であり、生産を安定させるためには、好ましくは市販納豆から高粘性発現株を選択したものを拡大培養して用いることが望ましい。この高粘性発現株は、非特許文献7にも記載の公知の手法によって取得できる。
【0023】
この発明にいう外的ストレスとは、培地中の養分の枯渇、温度の変動、酸素供給の有無、pHの変動など、γ−PGA分解酵素群の生成に影響を与える種々の外的因子を指し、列挙した項目に限定されるものではない。これらの外的ストレスは単独で与えても組み合わせて与えてもよい。
【0024】
外的ストレスによるγ−PGA分解酵素群の生成抑制の機構は、外的ストレスの種類に関係なく類似している。
【0025】
例えば、外的ストレスの一つとして、培地中の養分の枯渇についてのγ−PGA分解酵素群の生成抑制の機構は以下のように考えられる。
【0026】
すなわち、納豆菌が生産するγ−PGAは、非特許文献8に記載のとおり、培地中に存在するグルタミン酸からではなく、グルコースなどの糖分やクエン酸などの有機酸を炭素源として、TCA回路を経て合成される。納豆菌においてグルタミン酸はγ−PGA合成経路の効率的な発現に必要であることが知られているが、非特許文献9に記載のとおり、グルコースの存在下では培養期間を通じてほとんど消費されない。培地中の炭素源が枯渇すると、グルタミン酸が栄養源としてTCA回路に取り込まれ、併せて菌体外に貯蔵したγ−PGAを利用するためにγ−PGA分解酵素群が盛んに生産される。この時、炭素源としてグルコースなどの糖を使用していた場合には、グルタミン酸の消費が開始されると培地中の有機酸の消費と合わせてアンモニアの蓄積が始まるため、pHが急激に上昇する。このpHの急激な上昇を指標とすることで、容易に炭素源の枯渇を検知し、自動的に炭素源を流加することが可能となる。
【0027】
培地中の炭素源が枯渇した状態で炭素源を再度流加すると、TCA回路へのグルタミン酸の取り込みは速やかに停止する。生成していたγ−PGA分解酵素群はグルタミン酸の取り込みの停止と同時に生成が抑制され、γ−PGAが効率的に蓄積されることになる。
【0028】
同様に、他の外的ストレスとして温度については40℃から50℃の範囲に置いたとき、また、酸素供給については供給を停止したとき、さらには、pHについては5以上かつ6未満の範囲にしたとき、γ−PGA分解酵素群の生成が促進される。なお、γ−PGA分解酵素群の生成が抑制される条件は、温度については40℃未満、酸素供給については酸素が供給されているとき、pHについては6以上かつ8までの範囲である。
【0029】
このように、いずれの外的ストレスの因子についても、酵素群の生成が促進される環境から抑制される環境に外的条件を切り替えることによって納豆菌に外的ストレスを与え、γ−PGA分解酵素群の生成を抑制してγ−PGAの蓄積を促進する。
【0030】
また、純粋なγ−PGAを得るためには、生産に用いる培地はグルタミン酸ナトリウム1水和物が1.0〜5.0(質量/容量)%(以下%は(質量/容量)%である)、グルコースが1.0〜5.0%、リン酸2水素カリウムが0.25%、リン酸水素2ナトリウム12水和物が0.17%、塩化ナトリウムが0.05%、硫酸マグネシウム7水和物が0.05%、それに、ビオチンが0.1ppmから構成されるものが望ましい。
【0031】
不純物であるフラクタンなどの多糖類が混入しても良い場合もあるが、この場合には、グルコースの替わりにサッカロースなどを用いても良い。同様の理由で、不純物が混入しても差し支えない場合には、上記組成の追加養分として、ポリペプトンSやフィトンなどの大豆蛋白分解物を1.0%〜2.0%追加しても良い。
【0032】
また、炭素源が存在する間は菌体外に排出される各種有機酸の影響でpHが低下する。このとき、水酸化ナトリウム、水酸化カリウム、水酸化カルシウムやアンモニアなどのアルカリ溶液を添加することでpHを6.4〜7の間に保つと、納豆菌の活動を高いレベルに維持することが可能である。
【0033】
なお、以上の説明においては、対象を納豆菌と特定して説明しているが、γ−PGA分解酵素群によってγ−PGAを蓄積しない状態にある納豆菌以外のバチルス属細菌にも効果を発揮するもので、これらのバチルス属細菌も、この発明においては納豆菌に含まれる。
【0034】
また、この発明においては、生産対象をγ−PGAと特定しているが、γ−PGA以外の生体高分子の生産が、当該生体高分子分解酵素の生成によって阻害されている状態にある細菌においても効果を発揮する。この発明においては、このような細菌が生産する任意の生体高分子もγ−PGAに含まれるものとする。
【発明の効果】
【0035】
この発明によって、生体安全性が食経験によって確認されている納豆菌によって、平均分子量300万以上の高分子量γ−PGAを安定生産することができる。
【0036】
また、この発明によって得られるγ−PGAは、従来提供されているものに比べて分子量が高く、生体安全性の面でも不安がないため、特に化粧品、医薬品や食品に関連する用途に適用できる。
【0037】
これらの用途に積極的に利用できるγ−PGAを安定供給できる点で、産業上極めて有用である。
【発明を実施するための最良の形態】
【0038】
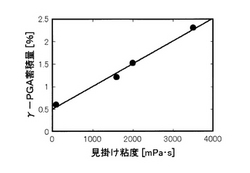
γ−PGA分解酵素群の生成の抑制効果は、培養液中のγ−PGAの蓄積量によって知ることができる。そして、培養液中のγ−PGAの蓄積量は、培養液の見掛け粘度と一義的な比例関係にある。
【0039】
図1は、培養液の見掛け粘度とγ−PGAの蓄積量との関係を示す。この図から、培養液の見掛け粘度とγ−PGAの蓄積量は比例関係にあることが分かる。
【0040】
以下に、この発明の実施の形態を実施例に示し、それぞれの培養液の見掛け粘度mPa・sとγ−PGA濃度g/lによって、γ−PGA分解酵素群の生成の抑制効果を調べた。
【比較例】
【0041】
γ−PGA分解酵素群の生成の抑制効果の確認の基準として、ストレスを与えない従来法によってγ−PGAを培養した例を示す。
【0042】
市販納豆表面の粘質物を白金耳でかき取ったものを滅菌水10mlに懸濁し、粘質物生産寒天培地に懸濁液1白金耳を連続して画線して、37℃で24時間培養した。
【0043】
粘質物生産寒天培地としては、グルタミン酸ナトリウム1水和物2.0%、サッカロース3%、リン酸2水素カリウム0.25%、リン酸水素2ナトリウム12水和物0.17%、塩化ナトリウム0.05%、硫酸マグネシウム7水和物0.05%、ビオチン0.1ppm、寒天2%を含む培地をpH6.8に調整したものを使用した。
【0044】
培養後のコロニーに白金耳の先端を当て、もっとも強く糸を引くコロニーを単離した。単離した納豆菌は標準寒天培地で37℃、3日間の培養を行い、胞子化した菌叢を得た。 この胞子化した菌叢を滅菌水1mlあたり1白金耳となるように懸濁して、γ−PGAの生産に供するまで20℃以下の環境に保存した。得られた胞子懸濁液は、108〜109cfu/mlの納豆菌胞子を含有するものであった。
【0045】
この納豆菌胞子懸濁液をγ−PGA生産培地30リットルに104cfu/mlとなるように接種した。培養には丸菱バイオエンジ社MSJ−U2 50L型ファーメンターを使用した。
【0046】
γ−PGA生産培地は、グルタミン酸ナトリウム1水和物2.0%、グルコース2%、リン酸2水素カリウム0.25%、リン酸水素2ナトリウム12水和物0.17%、塩化ナトリウム0.05%、硫酸マグネシウム7水和物0.05%、ビオチン0.1ppmからなり、接種前にpH6.8に調整した。通気量1VVM、撹拌速度120rpmに設定し、37℃で培養を行ったところ、培養開始から32時間経過後に炭素源であるグルコースの枯渇に伴うpHの上昇が観察された。このとき、培養液の見掛け粘度は100mPa・sであり、そのγ−PGA濃度は、6.1g/lであった。見掛け粘度はB型粘度計によって計測し、測定回転数30rpm、使用ローターNo.2の条件で見掛け粘度を得た。
【0047】
γ−PGAは、γ−PGA含有培養液に公知の分離方法であるアルコール沈殿法を施すことによって粗精製した。
【0048】
この粗精製物を水に再溶解して透析を一夜行ったうえで凍結乾燥を行い、精製γ−PGAを得た。上記のγ−PGA濃度は、このようにして得られた精製γ−PGAの濃度である。精製γ−PGAは白色の固体であり、90%以上がグルタミン酸から構成され、多糖類は含まなかった。各γ−PGA粉末粉末の分子量を検討したところ、平均分子量は300万以上であった。
【0049】
なお、平均分子量はゲルろ過カラムを用いた高速液体クロマトグラフによるもので、図2(a)に示すように保持時間約10分でピークが見られ、図2(b)に示す図から平均分子量が300万以上であることが確認された。測定は、カラムにTSK−GEL GMPWXL(内径7.8mm、長さ300mm)、移動相に50mMリン酸カリウム緩衝液(pH6.5)を使用し、カラム温度40℃、流量0.5ml/minの条件で行った。ピークの検出にはUV検出器を使用し、214nmの吸収でγ−PGAに由来するピークを検出した。以下の実施例1〜3についても同様である。
【実施例1】
【0050】
この実施例は、付与ストレスとして養分を枯渇させたのち、再投与する例を示す。
【0051】
培養の条件は、上記比較例と同様とし、32時間が経過したのち、pHの上昇によってグルコースの枯渇が観察された時点でグルコース2%を流加した。流加直前の培養液粘度は、比較例と同様、100mPa・sであった(No.2ローター、30rpm)。その後、48時間が経過するまで培養を行ったところ、培養液の見掛け粘度は2,000mPa・s、そのγ−PGA濃度は15.4g/lに達した(No.3ローター、30rpm)。そして、平均分子量は300万以上であった。このように、この実施例の場合、ストレスを与えない比較例と対比して、その抑制効果は、ほぼ、2.5倍に達している。
【実施例2】
【0052】
この実施例は、付与ストレスとして温度変化を与えた例を示す。
【0053】
培養温度を45℃に設定した以外は、上記比較例と同様の条件で培養を行った。7.5時間が経過して対数増殖期の中期から後期に差し掛かり、溶存酸素濃度が急減し始めた時点で、培養液温度を37℃に変更した。培養開始から30時間が経過すると、グルコースの枯渇に伴うpHの上昇が観察された。この時、培養液粘度は1,600mPa・sに達し、そのγ−PGA濃度は12.2g/lであった(No.3ローター、30rpm)。平均分子量は300万以上であった。このように、この実施例の場合、ストレスを与えない比較例と対比して、その抑制効果は、ほぼ、2倍に達している。
【実施例3】
【0054】
この実施例は、付与ストレスとして、養分の枯渇と再投与、それに温度変化を組み合わせた例を示す。
【0055】
実施例2と同様の条件で培養を行い、30時間が経過してグルコースの枯渇に伴うpHの上昇が観察された時点でグルコース2%を流加した。流加直前の培養液粘度は、実施例2と同様1,600mPa・sであった。その後、48時間が経過するまで培養を行ったところ、培養液粘度は3,500mPa・s、γ−PGA濃度は22.8g/lに達した(No.3ローター、30rpm)。平均分子量は300万以上であった。このように、この実施例の場合、ストレスを与えない比較例と対比して、その抑制効果は、ほぼ、3.7倍に達した。
【0056】
表1は、上記各実施例及び比較例におけるγ−PGA分解酵素群の生成の抑制効果を、まとめて比較したものである。
【表1】

【0057】
同表から明かなとおり、この発明に基づいて培養中にストレスを付加した場合には、γ−PGAの蓄積量は、ストレスを付加しない場合と比較して著しく増大しており、また異なるストレスを複合して付加した場合、その効果は更に著しくなることが分かる。
【0058】
また、実施例1から4の各培養液の粘度とγ−PGAの培地中への蓄積量の間には、図2に示すように良好な相関が認められ、γ−PGA分解経路が抑制されたことによりγ−PGAが効果的に蓄積されたことと、異なるストレスを組み合わせて与えることで分解経路の抑制効果を増強できることを確認できた。
【産業上の利用可能性】
【0059】
この発明によって得られるγ−PGAは、化粧品、医薬品、食品の他に、水質浄化剤、コンクリートのひび割れ防止剤、砂漠緑化用保水材料、結露防止剤など幅広い用途に用いることができる。
【図面の簡単な説明】
【0060】
【図1】γ−PGA蓄積量と培養液見掛け粘度の関係を示すグラフである。
【図2】(a)は高速液体クロマトグラフによる分子量分布測定結果を示すチャート、(b)は保持時間と分子量の関係を示すグラフである。
【技術分野】
【0001】
この発明は、ポリ−γ−グルタミン酸(以下γ−PGAと称する)の生産方法、とくに、納豆菌による高分子量ポリ−γ−グルタミン酸の生産方法に関する。
【背景技術】
【0002】
バチルス属細菌がグルコースあるいはクエン酸などからγ−PGAを生産することは、非特許文献1にも記載されているようによく知られている。
【0003】
しかし、長い食経験を有し、生体安全性の高い納豆菌(Bacillus subtilis var. natto)によるγ−PGAの生産は、固体培養では安定するものの、大量生産に不可欠である液体培養では極めて不安定である。
【0004】
これは、液体培養では培地中のγ−PGAの蓄積量が一定しないことに起因しており、同一の培養条件であってもγ−PGAをほとんど回収できない場合もある。
【0005】
この不安定さは培養規模が拡大すると加速度的に増大し、50リットル以上の培養規模では粘性がほとんど認められない割合が9割を越えることもあるなど、固体培養と同等の高分子量γ−PGAを安定して得ることは極めて困難である。このように、納豆菌において液体培養が不安定であることは、人体に対する安全性の面で不安のないγ−PGAを大量生産できないことを意味する。
【0006】
納豆菌以外のバチルス・ズブチリス(Bacillus subtilis)、バチルス・リケニホルミス(Bacillus licheniformis)やバチルス・メガテリウム(Bacillus megaterium)などのバチルス属細菌は比較的容易にγ−PGAを生産・蓄積できるため、これらの菌を用いて糖類を追加供給する方法が特許文献1に提案されている。
【0007】
しかしながら、この方法は、不純物である多糖類の生成を防ぎつつ不足する養分を供給し、γ−PGAの収量を向上させることを目的としたものであり、糖類の濃度を2から3g/l以下に維持するように流加培養を行うものである。
【0008】
ところが、糖類の濃度を望ましいレベルに維持することは、γ−PGAを蓄積する状態にあるバチルス属細菌には効果を示すが、培地中にγ−PGAを蓄積しない状態に陥った納豆菌には効果を示さない。
【0009】
また、バチルス属細菌が生産するγ−PGAの平均分子量は、特許文献2〜5に記載のとおり、数千ないしは200万のレベルであり、納豆菌が固体培養において生産するγ−PGAの平均分子量の300万以上には及ばない。
【0010】
加えて、これらのバチルス属細菌は生体安全性の検討が十分とは言えず、人体に与える影響の面で不安がある。
【0011】
このγ−PGAの生産をコードする遺伝子はpgsBCAであり、その直下にD−グルタミン酸とL−グルタミン酸の結合を切断して分子量10万から50万に断片化するγ−PGA分解酵素YwtDをコードする遺伝子、ywtDが存在することが非特許文献2と特許文献6に報告されている。
【0012】
YwtD以外にも、特許文献7には、分子量10万の断片に切断する酵素、ポリグルタミン酸ハイドラーゼ(以下PghAと表記する)が存在することが記載され、また、非特許文献3、4および特許文献8、9には、末端からグルタミン酸を順次切断する酵素、γ−グルタミルトランスペプチダーゼ(以下GGTと表記する)を有することも報告されている。
【0013】
また、γ−PGAは将来の飢餓に備えた栄養源の蓄積と、アメーバなどの外敵から菌体自身を保護することを目的として生産されるものと考えられている。固体培養では菌体表面に存在する何らかの受容体が菌体が空気中に露出していることを認識し、上記のYwtD、PghAやGGT等のγ−PGA分解酵素群の生成が抑制されて、相当量のγ−PGAが蓄積される。
【0014】
これに対して、液体培養では菌体表面が空気中に露出していないためγ−PGA分解酵素群の生成が抑制されにくくなり、結果としてγ−PGAの蓄積が不安定になるものと考えられる。
【0015】
これに対処することを目的として、下記特許文献10と11には、γ−PGA分解酵素群に係わる遺伝子を欠損させることが提案されている。
【0016】
しかし、遺伝子組み換え体を大量に培養することは、各省庁が定めるガイドラインの拘束を受けるため実施が困難であり、また、消費者に与えるイメージの点でも問題があった。
【特許文献1】大韓民国特許第363434号(PCT/KR00/00761)
【特許文献2】特公昭43−24472号公報
【特許文献3】特開平1−174397号公報
【特許文献4】特開平3−47087号公報
【特許文献5】特許第3081901号明細書
【特許文献6】特開2003−235566号公報
【特許文献7】特開2003−230384号公報
【特許文献8】特開2003−230384号公報
【特許文献9】特開2003−235566号公報
【特許文献10】特開2003−230384号公報
【特許文献11】特開2003−235566号公報
【非特許文献1】F.B.Oppermann−Sanio and A.Steinbuchel, Naturwissenschaften, Vol.89, pp.11−22 (2002)
【非特許文献2】T.Suzuki and Y.Tahara, J.Bacteriol., Vol.185, No.7, pp.2379−2382 (2003)
【非特許文献3】Y.Ogawa, H.Hosoyama, M.Hamano and H.Motai, Agri.Biol.Chem., 55, pp.2971−2977 (1991)
【非特許文献4】K.Xu and M.A.Strauch, J.Bacteriol., 178, pp.4319−4322 (1996)
【非特許文献5】T.Nagai, L.S.Phan Tran, Y.Inatsu and Y.Itoh, J.Bacteriology, 182, pp.2387−2392 (2000)
【非特許文献6】T.Nagai, L.−S. Phan Tran, Y.Inatsu, and Y.Itoh, J.Bacteriol., 182, pp.2387−2392 (2000)
【非特許文献7】納豆試験法研究会, 納豆試験法, pp.65−73, 光琳 (1990)
【非特許文献8】A.Goto and M.Kunioka, Biosci.Biotech.Biochem., 56, pp.1031−1035 (1992)
【非特許文献9】M.Kambourova, M.Tangney and F.G.Priest, Appl.and Environ.Microbiol., Vol.67, No.2, pp.1004−1007 (2001)
【発明の開示】
【発明が解決しようとする課題】
【0017】
この発明が解決しようとする課題は、γ−PGAの液体培地中への蓄積が、培地中のγ−PGAの蓄積量が一定しないことに起因して非常に不安定である納豆菌を用いて、高分子量のγ−PGAを安定して生産する方法を提案するものである。
【0018】
さらに詳しくは、液体培地を用いた納豆菌によるγ−PGAの生産が困難である要因はYwtD、PghAやGGTなどのγ−PGA分解酵素群にある。分解酵素群が生成すると、納豆菌が生成したγ−PGAは即座に分解されて、培地中に蓄積されない。この発明は、遺伝子操作によらず、納豆菌が生産するγ−PGA分解酵素群の生成を抑制する手法を提供するものである。
【課題を解決するための手段】
【0019】
この発明は、γ−PGAの生産安定性はγ−PGA分解酵素群の生成によって損なわれており、γ−PGA分解酵素群の生成を抑制できれば安定生産が可能であることに着目し、菌体に外的ストレスを与えることによってγ−PGA分解酵素群の生成を効果的に抑制できることを見出し、この知見に基づいて完成したものである。
【0020】
この発明が対象とする納豆菌は市販の納豆の生産に供されるものを指す。市販の納豆製造には、γ−PGAの生産にビオチンを要求し、バチルス・ズブチリスに分類される菌株が用いられる。納豆の製造に用いられる代表的な納豆菌は、宮城野菌、高橋菌、成瀬菌であるが、これらは共通の菌株に由来することが分子遺伝学的手法によって確認されている(非特許文献5)。
【0021】
γ−PGAの生産に供する菌株はこれらのいずれでも良く、Bacillus subtilis var. nattoとして登録されている、例えばIFO3009、IFO3013、IFO3335、IFO3336、IFO3936、IFO13169、ATCC7058、ATCC7059、ATCC15245のような任意の分譲菌株を用いることもできる。
【0022】
ただし、非特許文献6にも記載のとおり、納豆菌は遺伝的に不安定であり、生産を安定させるためには、好ましくは市販納豆から高粘性発現株を選択したものを拡大培養して用いることが望ましい。この高粘性発現株は、非特許文献7にも記載の公知の手法によって取得できる。
【0023】
この発明にいう外的ストレスとは、培地中の養分の枯渇、温度の変動、酸素供給の有無、pHの変動など、γ−PGA分解酵素群の生成に影響を与える種々の外的因子を指し、列挙した項目に限定されるものではない。これらの外的ストレスは単独で与えても組み合わせて与えてもよい。
【0024】
外的ストレスによるγ−PGA分解酵素群の生成抑制の機構は、外的ストレスの種類に関係なく類似している。
【0025】
例えば、外的ストレスの一つとして、培地中の養分の枯渇についてのγ−PGA分解酵素群の生成抑制の機構は以下のように考えられる。
【0026】
すなわち、納豆菌が生産するγ−PGAは、非特許文献8に記載のとおり、培地中に存在するグルタミン酸からではなく、グルコースなどの糖分やクエン酸などの有機酸を炭素源として、TCA回路を経て合成される。納豆菌においてグルタミン酸はγ−PGA合成経路の効率的な発現に必要であることが知られているが、非特許文献9に記載のとおり、グルコースの存在下では培養期間を通じてほとんど消費されない。培地中の炭素源が枯渇すると、グルタミン酸が栄養源としてTCA回路に取り込まれ、併せて菌体外に貯蔵したγ−PGAを利用するためにγ−PGA分解酵素群が盛んに生産される。この時、炭素源としてグルコースなどの糖を使用していた場合には、グルタミン酸の消費が開始されると培地中の有機酸の消費と合わせてアンモニアの蓄積が始まるため、pHが急激に上昇する。このpHの急激な上昇を指標とすることで、容易に炭素源の枯渇を検知し、自動的に炭素源を流加することが可能となる。
【0027】
培地中の炭素源が枯渇した状態で炭素源を再度流加すると、TCA回路へのグルタミン酸の取り込みは速やかに停止する。生成していたγ−PGA分解酵素群はグルタミン酸の取り込みの停止と同時に生成が抑制され、γ−PGAが効率的に蓄積されることになる。
【0028】
同様に、他の外的ストレスとして温度については40℃から50℃の範囲に置いたとき、また、酸素供給については供給を停止したとき、さらには、pHについては5以上かつ6未満の範囲にしたとき、γ−PGA分解酵素群の生成が促進される。なお、γ−PGA分解酵素群の生成が抑制される条件は、温度については40℃未満、酸素供給については酸素が供給されているとき、pHについては6以上かつ8までの範囲である。
【0029】
このように、いずれの外的ストレスの因子についても、酵素群の生成が促進される環境から抑制される環境に外的条件を切り替えることによって納豆菌に外的ストレスを与え、γ−PGA分解酵素群の生成を抑制してγ−PGAの蓄積を促進する。
【0030】
また、純粋なγ−PGAを得るためには、生産に用いる培地はグルタミン酸ナトリウム1水和物が1.0〜5.0(質量/容量)%(以下%は(質量/容量)%である)、グルコースが1.0〜5.0%、リン酸2水素カリウムが0.25%、リン酸水素2ナトリウム12水和物が0.17%、塩化ナトリウムが0.05%、硫酸マグネシウム7水和物が0.05%、それに、ビオチンが0.1ppmから構成されるものが望ましい。
【0031】
不純物であるフラクタンなどの多糖類が混入しても良い場合もあるが、この場合には、グルコースの替わりにサッカロースなどを用いても良い。同様の理由で、不純物が混入しても差し支えない場合には、上記組成の追加養分として、ポリペプトンSやフィトンなどの大豆蛋白分解物を1.0%〜2.0%追加しても良い。
【0032】
また、炭素源が存在する間は菌体外に排出される各種有機酸の影響でpHが低下する。このとき、水酸化ナトリウム、水酸化カリウム、水酸化カルシウムやアンモニアなどのアルカリ溶液を添加することでpHを6.4〜7の間に保つと、納豆菌の活動を高いレベルに維持することが可能である。
【0033】
なお、以上の説明においては、対象を納豆菌と特定して説明しているが、γ−PGA分解酵素群によってγ−PGAを蓄積しない状態にある納豆菌以外のバチルス属細菌にも効果を発揮するもので、これらのバチルス属細菌も、この発明においては納豆菌に含まれる。
【0034】
また、この発明においては、生産対象をγ−PGAと特定しているが、γ−PGA以外の生体高分子の生産が、当該生体高分子分解酵素の生成によって阻害されている状態にある細菌においても効果を発揮する。この発明においては、このような細菌が生産する任意の生体高分子もγ−PGAに含まれるものとする。
【発明の効果】
【0035】
この発明によって、生体安全性が食経験によって確認されている納豆菌によって、平均分子量300万以上の高分子量γ−PGAを安定生産することができる。
【0036】
また、この発明によって得られるγ−PGAは、従来提供されているものに比べて分子量が高く、生体安全性の面でも不安がないため、特に化粧品、医薬品や食品に関連する用途に適用できる。
【0037】
これらの用途に積極的に利用できるγ−PGAを安定供給できる点で、産業上極めて有用である。
【発明を実施するための最良の形態】
【0038】
γ−PGA分解酵素群の生成の抑制効果は、培養液中のγ−PGAの蓄積量によって知ることができる。そして、培養液中のγ−PGAの蓄積量は、培養液の見掛け粘度と一義的な比例関係にある。
【0039】
図1は、培養液の見掛け粘度とγ−PGAの蓄積量との関係を示す。この図から、培養液の見掛け粘度とγ−PGAの蓄積量は比例関係にあることが分かる。
【0040】
以下に、この発明の実施の形態を実施例に示し、それぞれの培養液の見掛け粘度mPa・sとγ−PGA濃度g/lによって、γ−PGA分解酵素群の生成の抑制効果を調べた。
【比較例】
【0041】
γ−PGA分解酵素群の生成の抑制効果の確認の基準として、ストレスを与えない従来法によってγ−PGAを培養した例を示す。
【0042】
市販納豆表面の粘質物を白金耳でかき取ったものを滅菌水10mlに懸濁し、粘質物生産寒天培地に懸濁液1白金耳を連続して画線して、37℃で24時間培養した。
【0043】
粘質物生産寒天培地としては、グルタミン酸ナトリウム1水和物2.0%、サッカロース3%、リン酸2水素カリウム0.25%、リン酸水素2ナトリウム12水和物0.17%、塩化ナトリウム0.05%、硫酸マグネシウム7水和物0.05%、ビオチン0.1ppm、寒天2%を含む培地をpH6.8に調整したものを使用した。
【0044】
培養後のコロニーに白金耳の先端を当て、もっとも強く糸を引くコロニーを単離した。単離した納豆菌は標準寒天培地で37℃、3日間の培養を行い、胞子化した菌叢を得た。 この胞子化した菌叢を滅菌水1mlあたり1白金耳となるように懸濁して、γ−PGAの生産に供するまで20℃以下の環境に保存した。得られた胞子懸濁液は、108〜109cfu/mlの納豆菌胞子を含有するものであった。
【0045】
この納豆菌胞子懸濁液をγ−PGA生産培地30リットルに104cfu/mlとなるように接種した。培養には丸菱バイオエンジ社MSJ−U2 50L型ファーメンターを使用した。
【0046】
γ−PGA生産培地は、グルタミン酸ナトリウム1水和物2.0%、グルコース2%、リン酸2水素カリウム0.25%、リン酸水素2ナトリウム12水和物0.17%、塩化ナトリウム0.05%、硫酸マグネシウム7水和物0.05%、ビオチン0.1ppmからなり、接種前にpH6.8に調整した。通気量1VVM、撹拌速度120rpmに設定し、37℃で培養を行ったところ、培養開始から32時間経過後に炭素源であるグルコースの枯渇に伴うpHの上昇が観察された。このとき、培養液の見掛け粘度は100mPa・sであり、そのγ−PGA濃度は、6.1g/lであった。見掛け粘度はB型粘度計によって計測し、測定回転数30rpm、使用ローターNo.2の条件で見掛け粘度を得た。
【0047】
γ−PGAは、γ−PGA含有培養液に公知の分離方法であるアルコール沈殿法を施すことによって粗精製した。
【0048】
この粗精製物を水に再溶解して透析を一夜行ったうえで凍結乾燥を行い、精製γ−PGAを得た。上記のγ−PGA濃度は、このようにして得られた精製γ−PGAの濃度である。精製γ−PGAは白色の固体であり、90%以上がグルタミン酸から構成され、多糖類は含まなかった。各γ−PGA粉末粉末の分子量を検討したところ、平均分子量は300万以上であった。
【0049】
なお、平均分子量はゲルろ過カラムを用いた高速液体クロマトグラフによるもので、図2(a)に示すように保持時間約10分でピークが見られ、図2(b)に示す図から平均分子量が300万以上であることが確認された。測定は、カラムにTSK−GEL GMPWXL(内径7.8mm、長さ300mm)、移動相に50mMリン酸カリウム緩衝液(pH6.5)を使用し、カラム温度40℃、流量0.5ml/minの条件で行った。ピークの検出にはUV検出器を使用し、214nmの吸収でγ−PGAに由来するピークを検出した。以下の実施例1〜3についても同様である。
【実施例1】
【0050】
この実施例は、付与ストレスとして養分を枯渇させたのち、再投与する例を示す。
【0051】
培養の条件は、上記比較例と同様とし、32時間が経過したのち、pHの上昇によってグルコースの枯渇が観察された時点でグルコース2%を流加した。流加直前の培養液粘度は、比較例と同様、100mPa・sであった(No.2ローター、30rpm)。その後、48時間が経過するまで培養を行ったところ、培養液の見掛け粘度は2,000mPa・s、そのγ−PGA濃度は15.4g/lに達した(No.3ローター、30rpm)。そして、平均分子量は300万以上であった。このように、この実施例の場合、ストレスを与えない比較例と対比して、その抑制効果は、ほぼ、2.5倍に達している。
【実施例2】
【0052】
この実施例は、付与ストレスとして温度変化を与えた例を示す。
【0053】
培養温度を45℃に設定した以外は、上記比較例と同様の条件で培養を行った。7.5時間が経過して対数増殖期の中期から後期に差し掛かり、溶存酸素濃度が急減し始めた時点で、培養液温度を37℃に変更した。培養開始から30時間が経過すると、グルコースの枯渇に伴うpHの上昇が観察された。この時、培養液粘度は1,600mPa・sに達し、そのγ−PGA濃度は12.2g/lであった(No.3ローター、30rpm)。平均分子量は300万以上であった。このように、この実施例の場合、ストレスを与えない比較例と対比して、その抑制効果は、ほぼ、2倍に達している。
【実施例3】
【0054】
この実施例は、付与ストレスとして、養分の枯渇と再投与、それに温度変化を組み合わせた例を示す。
【0055】
実施例2と同様の条件で培養を行い、30時間が経過してグルコースの枯渇に伴うpHの上昇が観察された時点でグルコース2%を流加した。流加直前の培養液粘度は、実施例2と同様1,600mPa・sであった。その後、48時間が経過するまで培養を行ったところ、培養液粘度は3,500mPa・s、γ−PGA濃度は22.8g/lに達した(No.3ローター、30rpm)。平均分子量は300万以上であった。このように、この実施例の場合、ストレスを与えない比較例と対比して、その抑制効果は、ほぼ、3.7倍に達した。
【0056】
表1は、上記各実施例及び比較例におけるγ−PGA分解酵素群の生成の抑制効果を、まとめて比較したものである。
【表1】

【0057】
同表から明かなとおり、この発明に基づいて培養中にストレスを付加した場合には、γ−PGAの蓄積量は、ストレスを付加しない場合と比較して著しく増大しており、また異なるストレスを複合して付加した場合、その効果は更に著しくなることが分かる。
【0058】
また、実施例1から4の各培養液の粘度とγ−PGAの培地中への蓄積量の間には、図2に示すように良好な相関が認められ、γ−PGA分解経路が抑制されたことによりγ−PGAが効果的に蓄積されたことと、異なるストレスを組み合わせて与えることで分解経路の抑制効果を増強できることを確認できた。
【産業上の利用可能性】
【0059】
この発明によって得られるγ−PGAは、化粧品、医薬品、食品の他に、水質浄化剤、コンクリートのひび割れ防止剤、砂漠緑化用保水材料、結露防止剤など幅広い用途に用いることができる。
【図面の簡単な説明】
【0060】
【図1】γ−PGA蓄積量と培養液見掛け粘度の関係を示すグラフである。
【図2】(a)は高速液体クロマトグラフによる分子量分布測定結果を示すチャート、(b)は保持時間と分子量の関係を示すグラフである。
【特許請求の範囲】
【請求項1】
納豆の製造に供される納豆菌に外的ストレスを与えることによってポリ−γ−グルタミン酸分解酵素群の生成を抑制する、高分子量ポリ−γ−グルタミン酸の安定生産方法。
【請求項2】
外的ストレスが、養分の枯渇と再投与、温度変動、酸素供給の有無、pH変動の何れかの単独または組み合わせである請求項1に記載の高分子量ポリ−γ−グルタミン酸の安定生産方法。
【請求項1】
納豆の製造に供される納豆菌に外的ストレスを与えることによってポリ−γ−グルタミン酸分解酵素群の生成を抑制する、高分子量ポリ−γ−グルタミン酸の安定生産方法。
【請求項2】
外的ストレスが、養分の枯渇と再投与、温度変動、酸素供給の有無、pH変動の何れかの単独または組み合わせである請求項1に記載の高分子量ポリ−γ−グルタミン酸の安定生産方法。
【図1】


【図2】




【図2】


【公開番号】特開2006−42617(P2006−42617A)
【公開日】平成18年2月16日(2006.2.16)
【国際特許分類】
【出願番号】特願2004−224472(P2004−224472)
【出願日】平成16年7月30日(2004.7.30)
【出願人】(591065549)福岡県 (121)
【出願人】(591027927)福岡県醤油醸造協同組合 (11)
【Fターム(参考)】
【公開日】平成18年2月16日(2006.2.16)
【国際特許分類】
【出願日】平成16年7月30日(2004.7.30)
【出願人】(591065549)福岡県 (121)
【出願人】(591027927)福岡県醤油醸造協同組合 (11)
【Fターム(参考)】
[ Back to top ]

