紙状バイオデバイス及びバイオリアクタ
【課題】長寿命化及び低コスト化が可能であり、かつ、高効率に除去対象物質を除去することが可能な紙状バイオデバイス及び当該紙状バイオデバイスを用いたバイオリアクタを提供する。
【解決手段】紙状基材11と、紙状基材11上に形成されたメソ多孔性シリカ層12と、メソ多孔性シリカ層12の細孔の内部に固定された酵素13と、により紙状バイオデバイス10を構成した。
【解決手段】紙状基材11と、紙状基材11上に形成されたメソ多孔性シリカ層12と、メソ多孔性シリカ層12の細孔の内部に固定された酵素13と、により紙状バイオデバイス10を構成した。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、紙状バイオデバイス及び当該紙状バイオデバイスを用いたバイオリアクタに関する。
【背景技術】
【0002】
従来、環境中の汚染物質等の人体に有害な物質を高効率で除去する技術が求められている。このような技術としては、例えば、流体中の環境ホルモン等を、溶媒抽出で除去したり、活性炭、シリカゲル、アルミナ等の多孔性材料に吸着させて除去したり(例えば特許文献1参照)、酵素を用いたバイオデバイスで除去したりする技術が知られている。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特許第4202004号
【発明の概要】
【発明が解決しようとする課題】
【0004】
しかしながら、溶媒抽出法や多孔性材料を用いた吸着法で除去する場合、流体中の汚染物質等の濃度が低濃度であると、汚染物質等を効率よく除去できないという問題があった。
また、酵素を用いたバイオデバイスで除去する場合、酵素自体の経時変化により酵素活性が低下する等の影響で、寿命が短い、コストが高い等の問題があった。
【0005】
本発明の課題は、長寿命化及び低コスト化が可能であり、かつ、高効率に除去対象物質を除去することが可能な紙状バイオデバイス及び当該紙状バイオデバイスを用いたバイオリアクタを提供することにある。
【課題を解決するための手段】
【0006】
上記課題を解決するために、請求項1に記載の発明は、紙状バイオデバイスにおいて、
紙状基材と、
前記紙状基材上に形成されたメソ多孔性シリカ層と、
前記メソ多孔性シリカ層の細孔の内部に固定された酵素と、
を備えることを特徴とする。
【0007】
請求項2に記載の発明は、請求項1に記載の紙状バイオデバイスにおいて、
前記メソ多孔性シリカ層は、粉末状のメソ多孔性シリカとバインダーとを混合したものを前記紙状基材上に積層することによって形成されていることを特徴とする。
【0008】
請求項3に記載の発明は、請求項2に記載の紙状バイオデバイスにおいて、
前記バインダーは酢酸セルロースであることを特徴とする。
【0009】
請求項4に記載の発明は、請求項1から請求項3の何れか一項に記載の紙状バイオデバイスにおいて、
前記紙状基材はセルロース紙であることを特徴とする。
【0010】
請求項5に記載の発明は、バイオリアクタシステムにおいて、
請求項1から請求項4の何れか一項に記載の紙状バイオデバイスと、
所定の流体が流れる流路と、を備え、
前記紙状バイオデバイスは、筒状に巻かれた状態で、前記流路中に配置されることを特徴とする。
【0011】
請求項6に記載の発明は、請求項5に記載のバイオリアクタシステムにおいて、
当該バイオリアクタシステムは、前記流体から除去対象物質を除去するためのシステムであり、
前記酵素はラッカーゼであり、
前記除去対象物質はフェノール系物質であることを特徴とする。
【発明の効果】
【0012】
本発明によれば、酵素をメソ多孔性シリカ層の細孔の内部に固定することにより、酵素自体の経時変化を生じ難くして、酵素活性の低下を抑制しているとともに、メソ多孔性シリカ層を紙状基材上に形成しているので、低コスト化及び長寿命化が可能である。
さらに、紙状バイオデバイスは、酵素を用いたバイオデバイスであるので、高効率に汚染物質を除去することが可能である。
【図面の簡単な説明】
【0013】
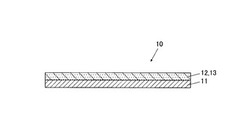
【図1】本実施形態の紙状バイオデバイスの構成を示す断面図である
【図2】本実施形態のバイオリアクタシステムを模式的に示す図である。
【図3】除去対象物質がフェノール系物質であり、酵素がフェノール系物質に選択的に作用するラッカーゼである場合における酵素反応を説明するための図である。
【図4】(A)紙状バイオデバイスを筒状に巻いた状態を説明する図、(B)筒状に巻いた紙状バイオデバイスをケース体の本体部に収納した状態を説明する図、(C)紙状バイオデバイスを流路中に配置した状態を説明する図である。
【図5】メソ多孔性シリカのラッカーゼ吸着特性についての評価実験で得られた図である。
【図6】アセトン中におけるメソ多孔性シリカに固定されたラッカーゼの活性特性についての評価実験で得られた図である。
【図7】紙状バイオデバイスによる除去効率の流速依存性についての評価実験で得られた図である。
【図8】紙状バイオデバイスによる除去効率の循環回数依存性についての評価実験で得られた図である。
【図9】紙状バイオデバイスの動作安定性(経時安定性)についての評価実験で得られた図である。
【発明を実施するための形態】
【0014】
以下、図面を参照して、本発明の好適な実施形態について説明する。ただし、本発明を適用可能な実施形態はこれに限定されるものではなく、また、本発明は図示例に限定されるものでもない。
【0015】
<紙状バイオデバイス>
本実施形態に係る紙状バイオデバイス10は、汚水や汚染ガスなどの流体から環境ホルモン等の除去対象物質を除去するためのデバイスであり、例えば図1に示すように、紙状基材11と、紙状基材11上に形成されたメソ多孔性シリカ層12と、メソ多孔性シリカ層12の細孔の内部に固定された酵素13と、を備えて構成される。
【0016】
(紙状基材)
紙状基材11は、メソ多孔性シリカ層12を保持するための支持体としての機能を有する。
なお、本実施形態では、紙状基材11として、セルロース紙、具体的には市販されている化学実験用のろ紙を用いているが、紙状基材11は、これに限定されるものではなく、メソ多孔性シリカ層12を保持できる紙状の支持体であれば、その他の紙等も適宜用いることが可能である。
【0017】
(メソ多孔性シリカ層)
メソ多孔性シリカ層12は、粉末状のメソ多孔性シリカとバインダーとを混合したものを紙状基材11に塗布することによって形成される。
【0018】
バインダーは、メソ多孔性シリカを紙状基材11に固定するために、メソ多孔性シリカと紙状基材11とを接合する接合剤としての機能を有する。
なお、本実施形態では、バインダーとして、酢酸セルロースを用いているが、バインダーは、これに限定されるものではなく、メソ多孔性シリカと紙状基材11とを接合できる接合剤であれば、その他の高分子等も適宜用いることが可能である。
【0019】
ここで、メソ多孔性シリカ層12の形成方法の一例について説明する。
まず、バインダーである酢酸セルロースをアセトン等の有機溶媒に溶解させてバインダー溶液を作成する。
次いで、細孔の内部に酵素13が固定された粉末状のメソ多孔性シリカを用意し、その粉末状のメソ多孔性シリカをバインダー溶液中に分散させてメソ多孔性シリカ分散液を作成する。
そして、メソ多孔性シリカ分散液を紙状基材11の一方の面(或いは両面であってもよい。)に塗布して乾燥させると、細孔の内部に酵素13が固定されたメソ多孔性シリカ層12が紙状基材11上に形成される。
【0020】
なお、本実施形態では、細孔の内部に酵素13が固定された粉末状のメソ多孔性シリカを用いて紙状基材11上にメソ多孔性シリカ層12を形成するようにしたが、メソ多孔性シリカ層12の形成方法は、これに限定されるものではなく、例えば、細孔の内部に酵素13が固定されていない粉末状のメソ多孔性シリカを用いて紙状基材11上にメソ多孔性シリカ層12を形成することも可能である。この場合、紙状基材11上にメソ多孔性シリカ層12を形成した後に、当該メソ多孔性シリカ層12の細孔の内部に酵素13を固定する。
【0021】
メソ多孔性シリカ層12を形成するメソ多孔性シリカは、粉末状であり、例えば、ケイ酸やアルミナなどの各種金属酸化物、ケイ酸と他種の金属との複合酸化物等によって構成することができる。
例えば、ケイ酸により構成されるメソ多孔性シリカの作製においては、例えば、カネマイトのような層状シリケート、アルコキシシラン、シリカゲル、水ガラス、ケイ酸ソーダ等を好ましく用いることができる。
具体的には、メソ多孔性シリカは、例えば、無機材料を界面活性剤と混合反応させて、界面活性剤のミセルの周りに無機の骨格が形成された界面活性剤/無機複合体を形成させた後、例えば、400℃〜600℃で焼成したり有機溶剤で抽出したりする等して界面活性剤を除去することにより作製される。これにより、メソ多孔性シリカは、無機骨格中に、界面活性剤のミセルと同じ形状のメソポア細孔を有するものとなる。
【0022】
メソ多孔性シリカの作製において、ケイ酸等のケイ素含有化合物を出発材料とする場合には、例えば、カネマイトのような層状シリケートを形成して、この層間にミセルを挿入し、そして、ミセルが存在しない層間をシリケート分子でつなぎ、その後、ミセルを除去することによって細孔を形成することができる。
また、メソ多孔性シリカの作製において、水ガラス等のケイ素含有物質を出発材料とする場合には、例えば、ミセルの周囲にシリケート分子を集合させて重合させることによりシリカを形成し、その後、ミセルを除去することによって細孔を形成することができる。この場合、通常、ミセルの形状は柱状となり、その結果、メソ多孔性シリカに、柱状の細孔が形成されることになる。
メソ多孔性シリカは、作製段階で、界面活性剤のアルキル鎖の長さを変えてミセルの径を変化させることによって、細孔の内径を制御することができる。また、界面活性剤と併せて、トリメチルベンゼン、トリプロピルベンゼン等の比較的疎水性の分子を添加することによって、ミセルを膨潤させ、さらに大きな内径の細孔を形成することもできる。
【0023】
メソ多孔性シリカにおける細孔の配向は、ランダムであっても、一次元シリカナノチャンネルの集合体のように方向性が制御されたものであってもよい。
メソ多孔性シリカの種類としては、細孔のサイズが均一であり、且つ、大きな空隙率を持つという特徴を有する、例えば、KSW、FSM、SBA、MCM、HOM等の公知の種類を採用することができる。
【0024】
メソ多孔性シリカの細孔のサイズは、当該メソ多孔性シリカにより形成されるメソ多孔性シリカ層12に固定する酵素13の立体構造の変化を防止可能な程度に設定されている。これにより、酵素13の立体構造を維持することができ、メソ多孔性シリカ層12の細孔の内部に固定された酵素13を安定化することができる。
具体的には、メソ多孔性シリカ層12の細孔のサイズ(すなわち、メソ多孔性シリカ層12を形成する粉末状のメソ多孔性シリカの細孔のサイズ)は、酵素13(酵素分子又は活性部位を含む酵素の断片)のサイズの0.5〜2.0倍程度であることが好ましく、酵素13のサイズの0.7〜1.4倍程度であることがより好ましく、酵素13のサイズとほぼ同等であることが最も好ましい。すなわち、メソ多孔性シリカ層12の細孔の直径(中心細孔直径)は、酵素13の直径の0.5〜2.0倍程度であることが好ましく、酵素13の直径の0.7〜1.4倍程度であることがより好ましく、酵素13の直径とほぼ同等であることが最も好ましい。なお、具体的な中心細孔直径の値は、酵素13の直径との関係で決定されるので一律には規定できないが、例えば、1〜50nm程度とすることができる。
【0025】
ここで、酵素13が多量体を形成する場合には、酵素13のサイズ(径)は、多量体のサイズ(径)とすることができる。ここで、多量体とは、2以上の酵素(タンパク質)が、直接に、又は水などの低分子を介して結合してなる化合物をいい、結合には、共有結合、イオン結合、水素結合、配位結合が含まれる。しかし、これらの結合の種類は、特に制限されない。
【0026】
メソ多孔性シリカの比表面積は、例えば、200〜1500m2程度である。
メソ多孔性シリカの細孔の深さは、2nm以上である。具体的には、好ましい深さの範囲は20〜1000nmであり、より好ましい深さの範囲は50〜500nmであり、最も好ましい深さの範囲は50〜150nmである。
メソ多孔性シリカの細孔のピッチは、細孔のピッチを細孔の中心間の距離と定義すると、好ましいピッチは2〜500nmであり、より好ましいピッチは2〜100nmであり、最も好ましいピッチは2〜50nmである。
【0027】
(酵素)
酵素13は、紙状基材11上に形成されたメソ多孔性シリカ層12を形成する粉末状のメソ多孔性シリカの細孔の内部に固定されている。
酵素13をメソ多孔性シリカに固定する方法としては、例えば、メソ多孔性シリカに酵素13を含む溶液(酵素溶液)を滴下するディップ法や、酵素溶液にメソ多孔性シリカを浸漬する浸漬法、メソ多孔性シリカの表面に酵素13と反応性の高い官能基を導入して酵素13と共有結合等する方法などが挙げられるが、特に限定されるものではない。これにより、高次構造と活性を保持したまま、酵素13をメソ多孔性シリカの細孔の内部に導入して固定することができる。
さらに、必要に応じて、公知の酵素固定化法(例えば、導電性高分子、グルタルアルデヒド、光架橋性樹脂等を用いる固定化法等)と併用することもできる。
【0028】
酵素13は、汚水や汚染ガスなどの流体に含まれる除去対象物質と選択的に反応する酵素であれば任意であり、除去対象物質の種類によって適宜変更可能である。
具体的には、酵素13は、例えば、酸化還元酵素、加水分解酵素、転移酵素、異性化酵素等の酵素(酵素タンパク質)である。
また、酵素13は、例えば、生来の酵素分子であっても、活性部位を含む酵素の断片であってもよい。当該酵素分子又は当該活性部位を含む酵素の断片は、例えば、動植物や微生物から抽出したものであってもよいし、所望によりそれを切断したものであってもよいし、遺伝子工学的に又は化学的に合成したものであってもよい。
【0029】
酸化還元酵素としては、例えば、ラッカーゼ、グルコースオキシダーゼ、乳酸オキシダーゼ、コレステロールオキシダーゼ、アルコールオキシダーゼ、ホルムアルデヒドオキシダーゼ、ソルビトールオキシダーゼ、フルクトースオキシダーゼ、ザルコシンオキシダーゼ、フルクトシルアミンオキシダーゼ、ピルビン酸オキシダーゼ、キサンチンオキシダーゼ、アスコルビン酸オキシダーゼ、サルコシンオキシダーゼ、コリンオキシダーゼ、アミンオキシダーゼ、グルコースデヒドロゲナーゼ、乳酸デヒドロゲナーゼ、コレステロールデヒドロゲナーゼ、アルコールデヒドロゲナーゼ、ホルムアルデヒドデヒドロゲナーゼ、ソルビトールデヒドロゲナーゼ、フルクトースデヒドロゲナーゼ、ヒドロキシ酪酸デヒドロゲナーゼ、グリセロールデヒドロゲナーゼ、グルタメートデヒドロゲナーゼ、ピルビン酸デヒドロゲナーゼ、リンゴ酸デヒドロゲナーゼ、グルタミン酸デヒドロゲナーゼ、カタラーゼ、ペルオキシダーゼ、ウリカーゼ等を用いることができる。この他に、コレステロールエステラーゼ、アセチルコリンエステラーゼ、ブチリルコリンエステラーゼ、クレアチニナーゼ、クレアチナーゼ、DNAポリメラーゼ、さらにこれら酵素のミュータント等を用いることができる。
【0030】
加水分解酵素としては、例えば、プロテアーゼ、リパーゼ、アミラーゼ、インベルターゼ、マルターゼ、β−ガラクトシダーゼ、リゾチーム、ウレアーゼ、エステラーゼ、ヌクレアーゼ群、ホスファターゼ群等を用いることができる。
【0031】
転移酵素としては、例えば、各種アシル転移酵素、キナーゼ群、アミノトランスフェラーゼ群等を用いることができる。
【0032】
異性化酵素としては、例えば、ラセマーゼ群、ホスホグリセリン酸ホスホムターゼ、グルコース6−リン酸イソメラーゼ等を用いることができる。
【0033】
メソ多孔性シリカ層12に固定する酵素13は、1種類の酵素であっても、2種類以上の酵素であってもよい。
具体的には、メソ多孔性シリカ層12に固定する酵素13は、例えば、1種類の酵素であっても、分子量及び/又はサイズ(径)が略同一の2種類以上の酵素であっても、分子量及び/又はサイズが異なる2種類以上の酵素であってもよい。また、メソ多孔性シリカ層12に固定する酵素13が2種類以上である場合、酵素13は、例えば、同種の除去対象物質(基質)に作用する2種類以上の酵素であっても、異種の除去対象物質に作用する2種類以上の酵素であっても、同種及び/又は異種の除去対象物質に作用する2種類以上の酵素であってもよい。
【0034】
また、メソ多孔性シリカ層12に固定する酵素13が2種類以上である場合、その2種類以上の酵素は、メソ多孔性シリカ層12における別々の細孔の内部に固定されていても、同一の細孔の内部に固定されていてもよい。
さらに、メソ多孔性シリカ層12に固定する酵素13が2種類以上であり、その2種類以上の酵素の中にサイズが異なる酵素が含まれる場合、当該メソ多孔性シリカ層12を、各酵素のサイズに応じて異なる細孔径を有する同一或いは異種のメソ多孔性シリカにより形成してもよい。
ここで、特に、メソ多孔性シリカ層12に固定する酵素13が2種類以上であって、その2種類以上の酵素が異種の除去対象物質に作用する場合、紙状バイオデバイス10は、その異種の除去対象物質(2種類以上の除去対象物質)を同時に除去することができる。
【0035】
さらに、酵素13に加えて、電子伝達物質を、メソ多孔性シリカ層12の細孔の内部、具体的にはメソ多孔性シリカ層12を形成する粉末状のメソ多孔性シリカの細孔の内部に導入することも可能である。
電子伝達物質は、酵素13と除去対象物質との間の電子の受け渡しを促進するためのものであり、酵素13と流体中の除去対象物質との間の電子移動を媒介する媒介物質として機能する。
【0036】
なお、電子伝達物質は、流体中に含有されていれば任意であり、例えば、流入容器50内の処理前液(後述)等の流体に混入した状態で流体中に含有されていてもよいし、メソ多孔性シリカ層12やその他の担体に担持された状態で流体中に含有されていてもよい。また、除去対象物質に加えて、電子伝達物質を別途、流体中に含有させることとしてもよい。
具体的には、電子伝達物質としては、例えば、フェリシアン化カリウム、フェロセン、フェロセン誘導体、ベンゾキノン、キノン誘導体、オスミウム錯体、HBT、ABTS、ビオルリン酸(violuric acid、Vio)、NNS、3−ヒドロキシアントラニル酸(3−HAA)、4−アミノアンチピリン、HOBt等を用いることができる。
【0037】
酵素13は、細孔のサイズが酵素13のサイズの0.5〜2.0倍程度であるメソ多孔性シリカ層12の細孔の内部に安定的に固定されているため、除去対象物質の分子量が大きい場合、除去対象物質とメソ多孔性シリカの表面との間に相互作用がある場合等は、酵素分子内の活性中心が除去対象物質と効率的に電子移動を行うことが難しい場合がある。また、酵素13が、一次元シリカナノチャンネルの集合体のように方向性が制御されたアスペクト比の大きな細孔を有する粉末状のメソ多孔性シリカにより形成されメソ多孔性シリカ層12の細孔の内部に固定されている場合にも同様である。したがって、流体中に、電子伝達物質を含有させることが好ましい。
【0038】
また、酵素13に加えて、補酵素も、メソ多孔性シリカ層12の細孔の内部、具体的にはメソ多孔性シリカ層12を形成する粉末状のメソ多孔性シリカの細孔の内部に導入することも可能である。
補酵素は、酵素13の活性の発現を触媒するためのものであり、酵素13と除去対象物質或いは電子伝達物質との間の電子移動を媒介する媒介物質として機能する。
【0039】
例えば、不安定中間体を経由する反応等、酵素13のアミノ酸側鎖の触媒作用では容易に進まない反応の場合、適当な構造を有し、酵素反応の発現に関与する低分子量の有機小分子や金属イオン、金属錯体などを補因子(cofactor)として使用することが多い。補因子の中でも有機小分子や金属錯体を補酵素と呼ぶ。特に、酵素13として、補酵素依存型酵素を用いた場合、流体中に補酵素を導入することによって、酵素反応を効率よく行わせることができる。
【0040】
補酵素は、酵素13(補酵素依存型酵素)の種類に応じて、適宜選択することができる。具体的には、補酵素としては、例えば、ニコチンアミドアデニンジヌクレオチド(NAD+)、ニコチンアミドアデニンジヌクレオチドリン酸(NADP+)、補酵素I、補酵素II、フラビンモノヌクレオチド(FMN)、フラビンアデニンジヌクレオチド(FAD)、リポ酸、アデノシン三リン酸(ATP)、チアミンピロリン酸(TPP)、ピリドキサルリン酸(PALP)、テトラヒドロ葉酸(THF,Coenzyme F)、UDPグルコース(UDPG)、補酵素A、補酵素Q、ビオチン、補酵素B12(コバラミン)、S−アデノシルメチオニン等の1種又は2種以上の組み合わせが挙げられる。
【0041】
なお、補酵素は、流体中に含有されていれば任意であり、例えば、流入容器50内の処理前液(後述)等の流体に混入した状態で流体に含有されていてもよいし、メソ多孔性シリカ層12やその他の担体に担持された状態で流体中に含有されていてもよい。
また、補酵素は、例えば、補因子としての各種金属原子や金属イオン、金属錯体、各種色素など(例えば、Fe2+、Mn2+、Cu2+、Zn2+、Co3+等)とともに流体中に含有されていてもよい。
【0042】
ここで、NAD+などの補酵素を使用すると、メソ多孔性シリカ層12の細孔の内部に固定された酵素13の活性が低下する場合があることが分かっている。これは、NAD+などの補酵素が、メソ多孔性シリカ層12表面のシラノール基と反応して、酵素13の活性に影響を与えるためであると考えられる。
そこで、この場合、流体中に、補酵素を使用した際に生じる酵素13の活性の低下を抑制するための補酵素用活性低下抑制物質を添加するのが好ましい。
補酵素用活性低下抑制物質としては、例えば、生体高分子や、合成高分子、電解質などが挙げられる。
なお、補酵素用活性低下抑制物質は、流体中に含有されていれば任意であり、例えば、流入容器50内の処理前液(後述)等の流体に溶解した状態で流体に含有されていてもよいし、例えば、メソ多孔性シリカ層12やその他の担体に担持された状態で流体に含有されていてもよい。
【0043】
生体高分子は、分子量1000以上の生体高分子であれば任意であり、具体的には、例えば、血清アルブミン、ゼラチン、セルロース、デンプン等である。
【0044】
また、合成高分子は、分子量1000以上の合成高分子であれば任意であり、具体的には、例えば、ポリエチレングリコール、デキストラン等である。
【0045】
また、電解質は、流入容器50内の処理前液(後述)等の流体に溶解して、陽イオンと陰イオンとに電離する物質であれば任意であり、具体的には、例えば、塩化カリウム等である。
【0046】
なお、流体には、補酵素用活性低下抑制物質として、分子量1000以上の生体高分子、分子量1000以上の合成高分子及び電解質のうちの少なくとも何れか1つが添加されていればよい。
また、流体に添加される分子量1000以上の生体高分子の種類は、1種類であっても複数種類であってもよい。流体に添加される分子量1000以上の合成高分子の種類は、1種類であっても複数種類であってもよい。流体に添加される電解質の種類は、1種類であっても複数種類であってもよい。
【0047】
<バイオリアクタシステム>
本実施形態に係るバイオリアクタシステム1は、汚水等から環境ホルモン等の除去対象物質を除去するためのシステムであり、紙状バイオデバイス10と、汚水等が流れる流路20と、を備えて構成される。
なお、本実施形態では、バイオリアクタシステム1を、汚水等の液体から除去対象物質を除去するシステムとして構成したが、これに限ることはなく、バイオリアクタシステム1は、流体から除去対象物質を除去するシステムであれば任意であり、例えば汚染ガス等の気体から除去対象物質を除去するシステムとして構成することも可能である。
【0048】
具体的には、バイオリアクタシステム1は、例えば図2に示すように、紙状バイオデバイス10と、汚水等の液体が流れる流路20と、紙状バイオデバイス10を収納するためのケース体30と、ケース体30に収納された紙状バイオデバイス10を一定の温度に保つための恒温水槽40と、紙状バイオデバイス10によって処理する汚水等(以下「処理前液」という。)を入れるための流入容器50と、流入容器50内の処理前液を流路20に送り込むための第一ポンプ60と、流路20内の液体をケース体30に収納された紙状バイオデバイス10に循環させるための第二ポンプ70と、紙状バイオデバイス10によって処理された汚水等(以下「処理後液」という)を入れるための流出容器80と、を備えて構成される。
【0049】
また、バイオリアクタシステム1は、必要に応じて、例えば図2に示すように、流入容器50内の処理前液に空気等の所定のガスを供給するためのガスポンプ51や、ガスポンプ51により供給されるガスの流量を測定するための流量計52を備えることが好ましい。
具体的には、例えば、除去対象物質がフェノール系物質であり、酵素がフェノール系物質に選択的に作用するラッカーゼである場合、例えば図3(A)に示すように、まず、酸化型のラッカーゼ(Eox)は、選択的触媒作用により基質(すなわち、流体中のフェノール系物質(X))を酸化して、生成物(Y)を生成し、還元型のラッカーゼ(Ered)となる。そして、この還元型のラッカーゼ(Ered)は、流体中の酸素と反応して酸化型のラッカーゼ(Eox)に戻る。また、電子伝達物質を添加した場合、図3(B)に示すように、除去対象物質であるフェノール系物質(X)と酵素(E)との間の反応を電子伝達物質(M)が媒介し、より効率的な除去を行うことが可能となる。この場合、流体(本実施形態の場合、流路20内の液体)中に酸素が不足していると、還元型のラッカーゼは酸化型のラッカーゼに戻ることができず、酵素反応が進まない。このように、酵素反応に酸素等の所定のガスが必要な場合、バイオリアクタシステム1にガスポンプ51等を備えることが好ましい。
【0050】
また、ガスポンプ51で汚染ガス等の気体を供給する等のバブリング機能を装着すれば、バイオリアクタシステム1を汚染ガス等の気体から除去対象物質を除去するシステムとして構成することができる。
【0051】
本実施形態において、ケース体30は、筒状の本体部30aと、本体部30aの両端部を塞ぐための蓋部30b,30bと、により構成されている。
また、バイオリアクタシステム1において、紙状バイオデバイス10は、例えば図4(A)、図4(B)に示すように、酵素13が固定されたメソ多孔性シリカ層12を内側にして筒状に巻かれた状態で、本体部30a内に収納されている。そして、本体部30aは、例えば図4(C)に示すように、当該本体部30aの両端部が蓋部30b,30bで塞がれて、当該本体部30a内に収納されている筒状に巻かれた紙状バイオデバイス10の貫通方向が流路20に沿うように、当該流路20中に配設されている。すなわち、紙状バイオデバイス10は、筒状に巻かれた状態で、流路20中に配置されている。
【0052】
なお、本実施形態では、筒状に巻かれた紙状バイオデバイス10をそのまま用いるように構成したが、これに限ることはなく、例えば、筒状に巻かれた紙状バイオデバイス10の一端側(流出容器80側)を塞ぐ等して、筒状に巻かれた紙状バイオデバイス10の内側(中空部分)を通過する流体が、紙状バイオデバイス10を透過して外側へと染み出す状態にして用いるように構成することも可能である。この場合、流路20を流れる流体が紙状バイオデバイス10を透過するので、流体中の除去対象物質を効率よく酵素13に接触させることが可能となる。
また、本実施形態では、紙状バイオデバイス10を筒状に巻かれた状態で流路20中に配置するように構成したが、これに限ることはなく、例えば、紙状バイオデバイス10を筒状に巻かずにそのまま流路20に直交するように配置して、流路20を流れる流体が紙状バイオデバイス10を透過するように構成することも可能である。この場合も、流路20を流れる流体が紙状バイオデバイス10を透過するので、流体中の除去対象物質を効率よく酵素13に接触させることが可能となる。
【0053】
また、本実施形態において、流路20の両端には、例えば図2に示すように、三方バルブ21,21が取り付けられている。
そして、バイオリアクタシステム1は、この三方バルブ21,21によって、紙状バイオデバイス10から流出してきた液体を処理後液として流出容器80へと排出する経路(図2における「Path(1)」)と、紙状バイオデバイス10から流出してきた液体を再び紙状バイオデバイス10に供給する経路(図2における「Path(2)」)と、を切り替えることができるように構成されている。
【0054】
以下、具体的な実施例によって本発明を説明するが、発明はこれらに限定されるものではない。
本実施例では、除去対象物質としてフェノール系物質であるビスフェノールAを採用し、メソ多孔性シリカ層12の細孔の内部に固定する酵素13としてラッカーゼを採用する。また、メソ多孔性シリカ層12を形成するバインダーとして、酢酸セルロースを採用し、それをアセトンに溶解させて使用する。
【0055】
〔1〕メソ多孔性シリカのラッカーゼ吸着特性
まず、メソ多孔性シリカ層12を形成するメソ多孔性シリカのラッカーゼ吸着特性について評価した。
【0056】
具体的には、まず、サイズ(径)が7.0nmよりも若干小さいラッカーゼを固定するので、細孔径(中心細孔直径)が7.0nmである粉末状のメソ多孔性シリカを準備した。
また、ラッカーゼ濃度が1〜15mg/mlの範囲で異なる複数種類のラッカーゼ溶液を準備した。
そして、粉末状のメソ多孔性シリカを100mgずつ各ラッカーゼ溶液に浸漬させて、当該メソ多孔性シリカへのラッカーゼの吸着量を測定した。
また、比較のために、細孔径(中心細孔直径)が1.5nmである粉末状のメソ多孔性シリカについても同様にして、当該メソ多孔性シリカへのラッカーゼの吸着量を測定した。
【0057】
その結果を図5に示す。図5において、縦軸は100mgのメソ多孔性シリカ(FSM)へのラッカーゼの吸着量(mg)を示し、横軸は当該メソ多孔性シリカを浸漬させたラッカーゼ溶液のラッカーゼ濃度(mg/ml)を示す。
【0058】
図5に示す結果から、ラッカーゼ溶液の濃度にかかわらず、比較例の場合、すなわちメソ多孔性シリカの細孔径が1.5nmの場合(△)よりも、実施例の場合、すなわちメソ多孔性シリカの細孔径が7.0nmの場合(□)の方が、ラッカーゼの吸着量が多いことが分かった。これにより、細孔のサイズが、ラッカーゼのサイズの0.2倍程度であるメソ多孔性シリカでは、ラッカーゼの吸着量が少なく、ラッカーゼが主に細孔外部の表面部分に吸着していると考えられる。これに対し、細孔のサイズが、ラッカーゼのサイズとほぼ同等であるメソ多孔性シリカでは、ラッカーゼの吸着量が多く、大部分のラッカーゼが細孔内部に吸着(固定)していると考えられる。
また、図5に示す結果から、実施例の場合、すなわちメソ多孔性シリカの細孔径が7.0nmの場合(□)は、ラッカーゼ濃度が約10mg/mlで吸着量が飽和に達することが分かった。
【0059】
〔2〕アセトン中におけるメソ多孔性シリカに固定されたラッカーゼの活性特性
次に、メソ多孔性シリカ層12を形成するバインダー(酢酸セルロース)を溶解させるアセトン中における、メソ多孔性シリカに固定されたラッカーゼの活性特定について評価した。
【0060】
具体的には、まず、細孔径(中心細孔直径)が7.0nmである粉末状のメソ多孔性シリカを、ラッカーゼ濃度が10mg/mlのラッカーゼ溶液に浸漬させて、ラッカーゼが固定された粉末状のメソ多孔性シリカ(以下「Lac−FSM7.0」という。)を作成した。
そして、Lac−FSM7.0をアセトンに添加して、所定時間毎に当該Lac−FSM7.0中のラッカーゼの酵素活性を測定した。
【0061】
その結果を図6に示す。図6において、縦軸は相対酵素活性(%)=100×((時間“T1”経過後のLac−FSM7.0のラッカーゼの酵素活性)/(アセトンに添加する前のLac−FSM7.0のラッカーゼの酵素活性))を示し、横軸は時間“T1”(min)を示す。
【0062】
図6に示す結果から、Lac−FSM7.0のアセトン中での保存時間が2500分を超えても、相対酵素活性が80%以上を維持できることが分かった。すなわち、ラッカーゼが固定されたメソ多孔性シリカを、酢酸セルロースをアセトンに溶解させて作成したバインダー溶液中に分散させた状態でも、当該ラッカーゼの活性を長時間維持できることが分かった。これにより、ラッカーゼ(酵素13)の活性を維持した状態で、紙状バイオデバイス10を作成できることが分かった。
【0063】
〔3〕紙状バイオデバイス10による除去効率の流速依存性
次に、紙状バイオデバイス10を作成し、それを備えたバイオリアクタシステム1を構成して、当該紙状バイオデバイス10による除去効率の流速依存性について評価した。
【0064】
具体的には、まず、細孔径(中心細孔直径)が7.0nmである粉末状のメソ多孔性シリカを、ラッカーゼ濃度が10mg/mlのラッカーゼ溶液に浸漬させて、Lac−FSM7.0を作成した。
次いで、バインダー溶液として、酢酸セルロースを10%含むアセトン溶液を準備し、そのバインダー溶液に100mgのLac−FSM7.0を分散させて、メソ多孔性シリカ分散液を作成した。
次いで、紙状基材11として、市販されている化学実験用のろ紙を5.0cm×20.0cmの矩形状に切断したものを準備し、その紙状基材11の一方の面にメソ多孔性シリカ分散液を塗布して、真空デシケータ中で12時間静置した。
次いで、紙状基材11に塗布されているメソ多孔性シリカ分散液を蒸留水でリンスしてポリマー化し、真空デシケータ中で24時間乾燥させて、紙状バイオデバイス10を作成した。
【0065】
次いで、ケース体30の本体部30aとして、ガラス製の筒(長さ:6cm、内径:10mm)を準備し、その本体部30a内に、筒状に巻いた紙状バイオデバイス10を収納し、紙状バイオデバイス10を備えたバイオリアクタシステム1を構成した。
次いで、恒温水槽40の温度を30℃に設定し、三方バルブ21,21を調節して、紙状バイオデバイス10から流出してきた液体を処理後液として流出容器80へと排出する経路(図2における「Path(1)」)に切り替えた。
次いで、処理前液として、1.0mMのビスフェノールA溶液を準備し、流入容器50に入れた。
次いで、第一ポンプ60を調節して、紙状バイオデバイス10(具体的には、紙状バイオデバイス10が収納されたケース体30)に供給する液体の流速として2.0〜18.0ml/minの範囲で異なる複数種類の流速を設定し、第一ポンプ60を動作させた。
そして、各流速について流出容器80へと排出された処理後液中のビスフェノールA濃度を測定した。
【0066】
その結果を図7に示す。図7において、縦軸は除去効率(%)=100×([(処理前液中のビスフェノールA濃度)−(流速“S”での処理後液中のビスフェノールA濃度)]/[(処理前液中のビスフェノールA濃度)−(流速2.0ml/minでの処理後液中のビスフェノールA濃度)])を示し、横軸は流速“S”(ml/min)を示す。
【0067】
図7に示す結果から、流速が大きくなるほど、除去効率が低下することが分かった。これにより、除去対象物質(ビスフェノールA)を含む流体の滞留時間が大きいほど、酵素13(ラッカーゼ)との反応が十分に進行し、効率的に除去対象物質(ビスフェノールA)を除去できることが分かった。
【0068】
〔4〕紙状バイオデバイス10による除去効率の循環回数依存性
次に、紙状バイオデバイス10による除去効率の循環回数依存性について評価した。
【0069】
具体的には、まず、上記〔3〕の場合と同様にして、紙状バイオデバイス10を備えたバイオリアクタシステム1を構成した。
次いで、恒温水槽40の温度を30℃に設定し、三方バルブ21,21を調節して、紙状バイオデバイス10から流出してきた液体を処理後液として流出容器80へと排出する経路(図2における「Path(1)」)に切り替えた。
次いで、処理前液として、1.0mMのビスフェノールA溶液を準備して流入容器50に入れ、第一ポンプ60を調節して、紙状バイオデバイス10(具体的には、紙状バイオデバイス10が収納されたケース体30)に供給する液体の流速として2.0ml/minを設定し、第一ポンプ60を動作させた。
【0070】
次いで、三方バルブ21,21を調節して、紙状バイオデバイス10から流出してきた液体を再び紙状バイオデバイス10に供給する経路(図2における「Path(2)」)に切り替えた。
次いで、第二ポンプ70を調節して、紙状バイオデバイス10(具体的には、紙状バイオデバイス10が収納されたケース体30)に供給する液体の流速として2.0ml/minを設定し、第二ポンプ70を動作させて、流路20内の液体を紙状バイオデバイス10に循環させた。
【0071】
次いで、循環回数が所定回数に達すると、三方バルブ21,21を調節して、紙状バイオデバイス10から流出してきた液体を処理後液として流出容器80へと排出する経路(図2における「Path(1)」)に切り替え、具体的には、流入容器50側の三方バルブ21はそのまま(「Path(2)」のまま)の状態で、流出容器80側の三方バルブ21を「Path(1)」と同様に切り替えて、流出容器80へと排出された処理後液中のビスフェノールA濃度を測定した。
【0072】
また、比較のために、ラッカーゼが固定されていない粉末状のメソ多孔性シリカを用いて作成したデバイスを備えたリアクタを構成し、同様にして、流出容器80へと排出された処理後液中のビスフェノールA濃度を測定した。
【0073】
その結果を図8に示す。図8において、縦軸はビスフェノールAの相対濃度(%)=100×((循環回数“N”での処理後液中のビスフェノールA濃度)/(処理前液中のビスフェノールA濃度))を示し、横軸は循環回数“N”(回)を示す。
【0074】
図8に示す結果から、比較例の場合、すなわちメソ多孔性シリカ層12にラッカーゼが固定されていない場合(△)でも、循環回数が増加するほど、相対濃度が低下することが分かった。また、比較例の場合は、所定濃度以下の低濃度のビスフェノールAは除去できないことが分かった。これにより、所定濃度を上回る高濃度のビスフェノールAは、酵素13(ラッカーゼ)が固定されていないメソ多孔性シリカ層12や紙状基材11への吸着だけでも除去できるが、所定濃度以下の低濃度のビスフェノールAは除去できないことが分かった。
【0075】
一方、実施例の場合、すなわちメソ多孔性シリカ層12にラッカーゼが固定されている場合(□)も、循環回数が増加するほど、相対濃度が低下することが分かった。また、実施例の場合は、所定濃度以下の低濃度のビスフェノールAでも除去できることが分かった。これにより、ビスフェノールAは、メソ多孔性シリカ層12に固定されたラッカーゼとの反応により、非常に低濃度であっても効率的に除去できることが分かった。これは、メソ多孔性シリカの比表面積が非常に大きく酵素13(ラッカーゼ)を高密度に固定できること、固定された酵素13(ラッカーゼ)の活性が維持されていることが効いていると考えられる。
【0076】
〔5〕紙状バイオデバイス10の動作安定性(経時安定性)
次に、紙状バイオデバイス10の動作安定性(経時安定性)について評価した。
【0077】
具体的には、まず、上記〔3〕の場合と同様にして、紙状バイオデバイス10を備えたバイオリアクタシステム1を構成した。
次いで、恒温水槽40の温度を30℃に設定し、三方バルブ21,21を調節して、紙状バイオデバイス10から流出してきた液体を処理後液として流出容器80へと排出する経路(図2における「Path(1)」)に切り替えた。
次いで、処理前液として、1.0mMのビスフェノールA溶液を準備して流入容器50に入れ、第一ポンプ60を調節して、紙状バイオデバイス10(具体的には、紙状バイオデバイス10が収納されたケース体30)に供給する液体の流速として2.0ml/minを設定し、第一ポンプ60を動作させた。
そして、所定時間毎に、流出容器80へと排出された処理後液中のビスフェノールA濃度を測定した。
【0078】
また、比較のために、ラッカーゼをメソ多孔性シリカに固定しない状態でバインダー溶液に分散させて作成したデバイスを備えたリアクタを構成し、同様にして、流出容器80へと排出された処理後液中のビスフェノールA濃度を測定した。
【0079】
その結果を図9に示す。図9において、縦軸は除去効率(%)=100×([(処理前液中のビスフェノールA濃度)−(時間“T2”経過後の処理後液中のビスフェノールA濃度)]/[(処理前液中のビスフェノールA濃度)−(時間0.5hでの処理後液中のビスフェノールA濃度)])を示し、横軸は時間“T2”(h)を示す。
【0080】
図9に示す結果から、比較例の場合、すなわちラッカーゼをメソ多孔性シリカ層12に固定しない場合(△)は、時間が経過するほど除去効率が低下し、約450時間が経過すると、除去効率がほぼ0%になることが分かった。これにより、ラッカーゼをメソ多孔性シリカ層12に固定しないと、当該ラッカーゼが剥がれてしまったり失活してしまったりすることが分かった。
【0081】
一方、実施例の場合、すなわちラッカーゼをメソ多孔性シリカ層12に固定した場合(□)は、時間が経過してもほとんど除去効率が低下せず、1400時間が経過しても、除去効率が90%程度を維持できることが分かった。これは、メソ多孔性シリカ層12(具体的には、メソ多孔性シリカ層12を形成するメソ多孔性シリカ)の細孔のサイズが、酵素13(ラッカーゼ)のサイズとほぼ同じであるため、酵素13(ラッカーゼ)が構造的に安定した状態で固定されて、活性が維持されているためと考えられる。
【0082】
以上説明した本実施形態の紙状バイオデバイス10及びバイオリアクタシステム1によれば、紙状バイオデバイス10は、紙状基材11と、紙状基材11上に形成されたメソ多孔性シリカ層12と、メソ多孔性シリカ層12の細孔の内部に固定された酵素13と、を備えて構成されている。
すなわち、酵素13をメソ多孔性シリカ層12の細孔の内部に固定することにより、酵素13自体の経時変化を生じ難くして、酵素活性の低下を抑制しているとともに、メソ多孔性シリカ層12を紙状基材11上に形成しているので、低コスト化及び長寿命化が可能である。
さらに、紙状バイオデバイス10は、酵素13を用いたバイオデバイスであるので、高効率に汚染物質等の除去対象物質を除去することが可能である。
【0083】
また、以上説明した本実施形態の紙状バイオデバイス10及びバイオリアクタシステム1によれば、粉末状のメソ多孔性シリカとバインダーとを混合したものを紙状基材11上に積層するだけの簡易な手法で、紙状基材11上にメソ多孔性シリカ層12を形成することができる。
【0084】
また、以上説明した本実施形態の紙状バイオデバイス10及びバイオリアクタシステム1によれば、バインダーは酢酸セルロースであるので、取り扱い易く低コスト化が容易である。
【0085】
また、以上説明した本実施形態の紙状バイオデバイス10及びバイオリアクタシステム1によれば、紙状基材11はセルロース紙であるので、取り扱い易く低コスト化が容易である。
【0086】
また、以上説明した本実施形態のバイオリアクタシステム1によれば、紙状バイオデバイス10は、筒状に巻かれた状態で流路20中に配置されているので、非常に簡便な構成で、汚染物質等の除去対象物質を除去することが可能である。
【0087】
なお、本発明は上記の実施形態に限定されず、本発明の趣旨から逸脱しない限り、適宜変更可能であることはいうまでもない。
【0088】
例えば、上記の実施形態では、紙状バイオデバイス10及びバイオリアクタシステム1を、流体から除去対象物質を除去するデバイス及びシステムとして構成したが、これに限定されることはなく、例えば、有用な物質を高効率で生成するデバイス及びシステムとして構成することも可能である。例えば、アルコール脱水素酵素の逆反応を利用して、アルデヒドからエタノールを生成すること等も可能である。
【符号の説明】
【0089】
1 バイオリアクタシステム
10 紙状バイオデバイス
11 紙状基材
12 メソ多孔性シリカ層
13 酵素
20 流路
【技術分野】
【0001】
本発明は、紙状バイオデバイス及び当該紙状バイオデバイスを用いたバイオリアクタに関する。
【背景技術】
【0002】
従来、環境中の汚染物質等の人体に有害な物質を高効率で除去する技術が求められている。このような技術としては、例えば、流体中の環境ホルモン等を、溶媒抽出で除去したり、活性炭、シリカゲル、アルミナ等の多孔性材料に吸着させて除去したり(例えば特許文献1参照)、酵素を用いたバイオデバイスで除去したりする技術が知られている。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特許第4202004号
【発明の概要】
【発明が解決しようとする課題】
【0004】
しかしながら、溶媒抽出法や多孔性材料を用いた吸着法で除去する場合、流体中の汚染物質等の濃度が低濃度であると、汚染物質等を効率よく除去できないという問題があった。
また、酵素を用いたバイオデバイスで除去する場合、酵素自体の経時変化により酵素活性が低下する等の影響で、寿命が短い、コストが高い等の問題があった。
【0005】
本発明の課題は、長寿命化及び低コスト化が可能であり、かつ、高効率に除去対象物質を除去することが可能な紙状バイオデバイス及び当該紙状バイオデバイスを用いたバイオリアクタを提供することにある。
【課題を解決するための手段】
【0006】
上記課題を解決するために、請求項1に記載の発明は、紙状バイオデバイスにおいて、
紙状基材と、
前記紙状基材上に形成されたメソ多孔性シリカ層と、
前記メソ多孔性シリカ層の細孔の内部に固定された酵素と、
を備えることを特徴とする。
【0007】
請求項2に記載の発明は、請求項1に記載の紙状バイオデバイスにおいて、
前記メソ多孔性シリカ層は、粉末状のメソ多孔性シリカとバインダーとを混合したものを前記紙状基材上に積層することによって形成されていることを特徴とする。
【0008】
請求項3に記載の発明は、請求項2に記載の紙状バイオデバイスにおいて、
前記バインダーは酢酸セルロースであることを特徴とする。
【0009】
請求項4に記載の発明は、請求項1から請求項3の何れか一項に記載の紙状バイオデバイスにおいて、
前記紙状基材はセルロース紙であることを特徴とする。
【0010】
請求項5に記載の発明は、バイオリアクタシステムにおいて、
請求項1から請求項4の何れか一項に記載の紙状バイオデバイスと、
所定の流体が流れる流路と、を備え、
前記紙状バイオデバイスは、筒状に巻かれた状態で、前記流路中に配置されることを特徴とする。
【0011】
請求項6に記載の発明は、請求項5に記載のバイオリアクタシステムにおいて、
当該バイオリアクタシステムは、前記流体から除去対象物質を除去するためのシステムであり、
前記酵素はラッカーゼであり、
前記除去対象物質はフェノール系物質であることを特徴とする。
【発明の効果】
【0012】
本発明によれば、酵素をメソ多孔性シリカ層の細孔の内部に固定することにより、酵素自体の経時変化を生じ難くして、酵素活性の低下を抑制しているとともに、メソ多孔性シリカ層を紙状基材上に形成しているので、低コスト化及び長寿命化が可能である。
さらに、紙状バイオデバイスは、酵素を用いたバイオデバイスであるので、高効率に汚染物質を除去することが可能である。
【図面の簡単な説明】
【0013】
【図1】本実施形態の紙状バイオデバイスの構成を示す断面図である
【図2】本実施形態のバイオリアクタシステムを模式的に示す図である。
【図3】除去対象物質がフェノール系物質であり、酵素がフェノール系物質に選択的に作用するラッカーゼである場合における酵素反応を説明するための図である。
【図4】(A)紙状バイオデバイスを筒状に巻いた状態を説明する図、(B)筒状に巻いた紙状バイオデバイスをケース体の本体部に収納した状態を説明する図、(C)紙状バイオデバイスを流路中に配置した状態を説明する図である。
【図5】メソ多孔性シリカのラッカーゼ吸着特性についての評価実験で得られた図である。
【図6】アセトン中におけるメソ多孔性シリカに固定されたラッカーゼの活性特性についての評価実験で得られた図である。
【図7】紙状バイオデバイスによる除去効率の流速依存性についての評価実験で得られた図である。
【図8】紙状バイオデバイスによる除去効率の循環回数依存性についての評価実験で得られた図である。
【図9】紙状バイオデバイスの動作安定性(経時安定性)についての評価実験で得られた図である。
【発明を実施するための形態】
【0014】
以下、図面を参照して、本発明の好適な実施形態について説明する。ただし、本発明を適用可能な実施形態はこれに限定されるものではなく、また、本発明は図示例に限定されるものでもない。
【0015】
<紙状バイオデバイス>
本実施形態に係る紙状バイオデバイス10は、汚水や汚染ガスなどの流体から環境ホルモン等の除去対象物質を除去するためのデバイスであり、例えば図1に示すように、紙状基材11と、紙状基材11上に形成されたメソ多孔性シリカ層12と、メソ多孔性シリカ層12の細孔の内部に固定された酵素13と、を備えて構成される。
【0016】
(紙状基材)
紙状基材11は、メソ多孔性シリカ層12を保持するための支持体としての機能を有する。
なお、本実施形態では、紙状基材11として、セルロース紙、具体的には市販されている化学実験用のろ紙を用いているが、紙状基材11は、これに限定されるものではなく、メソ多孔性シリカ層12を保持できる紙状の支持体であれば、その他の紙等も適宜用いることが可能である。
【0017】
(メソ多孔性シリカ層)
メソ多孔性シリカ層12は、粉末状のメソ多孔性シリカとバインダーとを混合したものを紙状基材11に塗布することによって形成される。
【0018】
バインダーは、メソ多孔性シリカを紙状基材11に固定するために、メソ多孔性シリカと紙状基材11とを接合する接合剤としての機能を有する。
なお、本実施形態では、バインダーとして、酢酸セルロースを用いているが、バインダーは、これに限定されるものではなく、メソ多孔性シリカと紙状基材11とを接合できる接合剤であれば、その他の高分子等も適宜用いることが可能である。
【0019】
ここで、メソ多孔性シリカ層12の形成方法の一例について説明する。
まず、バインダーである酢酸セルロースをアセトン等の有機溶媒に溶解させてバインダー溶液を作成する。
次いで、細孔の内部に酵素13が固定された粉末状のメソ多孔性シリカを用意し、その粉末状のメソ多孔性シリカをバインダー溶液中に分散させてメソ多孔性シリカ分散液を作成する。
そして、メソ多孔性シリカ分散液を紙状基材11の一方の面(或いは両面であってもよい。)に塗布して乾燥させると、細孔の内部に酵素13が固定されたメソ多孔性シリカ層12が紙状基材11上に形成される。
【0020】
なお、本実施形態では、細孔の内部に酵素13が固定された粉末状のメソ多孔性シリカを用いて紙状基材11上にメソ多孔性シリカ層12を形成するようにしたが、メソ多孔性シリカ層12の形成方法は、これに限定されるものではなく、例えば、細孔の内部に酵素13が固定されていない粉末状のメソ多孔性シリカを用いて紙状基材11上にメソ多孔性シリカ層12を形成することも可能である。この場合、紙状基材11上にメソ多孔性シリカ層12を形成した後に、当該メソ多孔性シリカ層12の細孔の内部に酵素13を固定する。
【0021】
メソ多孔性シリカ層12を形成するメソ多孔性シリカは、粉末状であり、例えば、ケイ酸やアルミナなどの各種金属酸化物、ケイ酸と他種の金属との複合酸化物等によって構成することができる。
例えば、ケイ酸により構成されるメソ多孔性シリカの作製においては、例えば、カネマイトのような層状シリケート、アルコキシシラン、シリカゲル、水ガラス、ケイ酸ソーダ等を好ましく用いることができる。
具体的には、メソ多孔性シリカは、例えば、無機材料を界面活性剤と混合反応させて、界面活性剤のミセルの周りに無機の骨格が形成された界面活性剤/無機複合体を形成させた後、例えば、400℃〜600℃で焼成したり有機溶剤で抽出したりする等して界面活性剤を除去することにより作製される。これにより、メソ多孔性シリカは、無機骨格中に、界面活性剤のミセルと同じ形状のメソポア細孔を有するものとなる。
【0022】
メソ多孔性シリカの作製において、ケイ酸等のケイ素含有化合物を出発材料とする場合には、例えば、カネマイトのような層状シリケートを形成して、この層間にミセルを挿入し、そして、ミセルが存在しない層間をシリケート分子でつなぎ、その後、ミセルを除去することによって細孔を形成することができる。
また、メソ多孔性シリカの作製において、水ガラス等のケイ素含有物質を出発材料とする場合には、例えば、ミセルの周囲にシリケート分子を集合させて重合させることによりシリカを形成し、その後、ミセルを除去することによって細孔を形成することができる。この場合、通常、ミセルの形状は柱状となり、その結果、メソ多孔性シリカに、柱状の細孔が形成されることになる。
メソ多孔性シリカは、作製段階で、界面活性剤のアルキル鎖の長さを変えてミセルの径を変化させることによって、細孔の内径を制御することができる。また、界面活性剤と併せて、トリメチルベンゼン、トリプロピルベンゼン等の比較的疎水性の分子を添加することによって、ミセルを膨潤させ、さらに大きな内径の細孔を形成することもできる。
【0023】
メソ多孔性シリカにおける細孔の配向は、ランダムであっても、一次元シリカナノチャンネルの集合体のように方向性が制御されたものであってもよい。
メソ多孔性シリカの種類としては、細孔のサイズが均一であり、且つ、大きな空隙率を持つという特徴を有する、例えば、KSW、FSM、SBA、MCM、HOM等の公知の種類を採用することができる。
【0024】
メソ多孔性シリカの細孔のサイズは、当該メソ多孔性シリカにより形成されるメソ多孔性シリカ層12に固定する酵素13の立体構造の変化を防止可能な程度に設定されている。これにより、酵素13の立体構造を維持することができ、メソ多孔性シリカ層12の細孔の内部に固定された酵素13を安定化することができる。
具体的には、メソ多孔性シリカ層12の細孔のサイズ(すなわち、メソ多孔性シリカ層12を形成する粉末状のメソ多孔性シリカの細孔のサイズ)は、酵素13(酵素分子又は活性部位を含む酵素の断片)のサイズの0.5〜2.0倍程度であることが好ましく、酵素13のサイズの0.7〜1.4倍程度であることがより好ましく、酵素13のサイズとほぼ同等であることが最も好ましい。すなわち、メソ多孔性シリカ層12の細孔の直径(中心細孔直径)は、酵素13の直径の0.5〜2.0倍程度であることが好ましく、酵素13の直径の0.7〜1.4倍程度であることがより好ましく、酵素13の直径とほぼ同等であることが最も好ましい。なお、具体的な中心細孔直径の値は、酵素13の直径との関係で決定されるので一律には規定できないが、例えば、1〜50nm程度とすることができる。
【0025】
ここで、酵素13が多量体を形成する場合には、酵素13のサイズ(径)は、多量体のサイズ(径)とすることができる。ここで、多量体とは、2以上の酵素(タンパク質)が、直接に、又は水などの低分子を介して結合してなる化合物をいい、結合には、共有結合、イオン結合、水素結合、配位結合が含まれる。しかし、これらの結合の種類は、特に制限されない。
【0026】
メソ多孔性シリカの比表面積は、例えば、200〜1500m2程度である。
メソ多孔性シリカの細孔の深さは、2nm以上である。具体的には、好ましい深さの範囲は20〜1000nmであり、より好ましい深さの範囲は50〜500nmであり、最も好ましい深さの範囲は50〜150nmである。
メソ多孔性シリカの細孔のピッチは、細孔のピッチを細孔の中心間の距離と定義すると、好ましいピッチは2〜500nmであり、より好ましいピッチは2〜100nmであり、最も好ましいピッチは2〜50nmである。
【0027】
(酵素)
酵素13は、紙状基材11上に形成されたメソ多孔性シリカ層12を形成する粉末状のメソ多孔性シリカの細孔の内部に固定されている。
酵素13をメソ多孔性シリカに固定する方法としては、例えば、メソ多孔性シリカに酵素13を含む溶液(酵素溶液)を滴下するディップ法や、酵素溶液にメソ多孔性シリカを浸漬する浸漬法、メソ多孔性シリカの表面に酵素13と反応性の高い官能基を導入して酵素13と共有結合等する方法などが挙げられるが、特に限定されるものではない。これにより、高次構造と活性を保持したまま、酵素13をメソ多孔性シリカの細孔の内部に導入して固定することができる。
さらに、必要に応じて、公知の酵素固定化法(例えば、導電性高分子、グルタルアルデヒド、光架橋性樹脂等を用いる固定化法等)と併用することもできる。
【0028】
酵素13は、汚水や汚染ガスなどの流体に含まれる除去対象物質と選択的に反応する酵素であれば任意であり、除去対象物質の種類によって適宜変更可能である。
具体的には、酵素13は、例えば、酸化還元酵素、加水分解酵素、転移酵素、異性化酵素等の酵素(酵素タンパク質)である。
また、酵素13は、例えば、生来の酵素分子であっても、活性部位を含む酵素の断片であってもよい。当該酵素分子又は当該活性部位を含む酵素の断片は、例えば、動植物や微生物から抽出したものであってもよいし、所望によりそれを切断したものであってもよいし、遺伝子工学的に又は化学的に合成したものであってもよい。
【0029】
酸化還元酵素としては、例えば、ラッカーゼ、グルコースオキシダーゼ、乳酸オキシダーゼ、コレステロールオキシダーゼ、アルコールオキシダーゼ、ホルムアルデヒドオキシダーゼ、ソルビトールオキシダーゼ、フルクトースオキシダーゼ、ザルコシンオキシダーゼ、フルクトシルアミンオキシダーゼ、ピルビン酸オキシダーゼ、キサンチンオキシダーゼ、アスコルビン酸オキシダーゼ、サルコシンオキシダーゼ、コリンオキシダーゼ、アミンオキシダーゼ、グルコースデヒドロゲナーゼ、乳酸デヒドロゲナーゼ、コレステロールデヒドロゲナーゼ、アルコールデヒドロゲナーゼ、ホルムアルデヒドデヒドロゲナーゼ、ソルビトールデヒドロゲナーゼ、フルクトースデヒドロゲナーゼ、ヒドロキシ酪酸デヒドロゲナーゼ、グリセロールデヒドロゲナーゼ、グルタメートデヒドロゲナーゼ、ピルビン酸デヒドロゲナーゼ、リンゴ酸デヒドロゲナーゼ、グルタミン酸デヒドロゲナーゼ、カタラーゼ、ペルオキシダーゼ、ウリカーゼ等を用いることができる。この他に、コレステロールエステラーゼ、アセチルコリンエステラーゼ、ブチリルコリンエステラーゼ、クレアチニナーゼ、クレアチナーゼ、DNAポリメラーゼ、さらにこれら酵素のミュータント等を用いることができる。
【0030】
加水分解酵素としては、例えば、プロテアーゼ、リパーゼ、アミラーゼ、インベルターゼ、マルターゼ、β−ガラクトシダーゼ、リゾチーム、ウレアーゼ、エステラーゼ、ヌクレアーゼ群、ホスファターゼ群等を用いることができる。
【0031】
転移酵素としては、例えば、各種アシル転移酵素、キナーゼ群、アミノトランスフェラーゼ群等を用いることができる。
【0032】
異性化酵素としては、例えば、ラセマーゼ群、ホスホグリセリン酸ホスホムターゼ、グルコース6−リン酸イソメラーゼ等を用いることができる。
【0033】
メソ多孔性シリカ層12に固定する酵素13は、1種類の酵素であっても、2種類以上の酵素であってもよい。
具体的には、メソ多孔性シリカ層12に固定する酵素13は、例えば、1種類の酵素であっても、分子量及び/又はサイズ(径)が略同一の2種類以上の酵素であっても、分子量及び/又はサイズが異なる2種類以上の酵素であってもよい。また、メソ多孔性シリカ層12に固定する酵素13が2種類以上である場合、酵素13は、例えば、同種の除去対象物質(基質)に作用する2種類以上の酵素であっても、異種の除去対象物質に作用する2種類以上の酵素であっても、同種及び/又は異種の除去対象物質に作用する2種類以上の酵素であってもよい。
【0034】
また、メソ多孔性シリカ層12に固定する酵素13が2種類以上である場合、その2種類以上の酵素は、メソ多孔性シリカ層12における別々の細孔の内部に固定されていても、同一の細孔の内部に固定されていてもよい。
さらに、メソ多孔性シリカ層12に固定する酵素13が2種類以上であり、その2種類以上の酵素の中にサイズが異なる酵素が含まれる場合、当該メソ多孔性シリカ層12を、各酵素のサイズに応じて異なる細孔径を有する同一或いは異種のメソ多孔性シリカにより形成してもよい。
ここで、特に、メソ多孔性シリカ層12に固定する酵素13が2種類以上であって、その2種類以上の酵素が異種の除去対象物質に作用する場合、紙状バイオデバイス10は、その異種の除去対象物質(2種類以上の除去対象物質)を同時に除去することができる。
【0035】
さらに、酵素13に加えて、電子伝達物質を、メソ多孔性シリカ層12の細孔の内部、具体的にはメソ多孔性シリカ層12を形成する粉末状のメソ多孔性シリカの細孔の内部に導入することも可能である。
電子伝達物質は、酵素13と除去対象物質との間の電子の受け渡しを促進するためのものであり、酵素13と流体中の除去対象物質との間の電子移動を媒介する媒介物質として機能する。
【0036】
なお、電子伝達物質は、流体中に含有されていれば任意であり、例えば、流入容器50内の処理前液(後述)等の流体に混入した状態で流体中に含有されていてもよいし、メソ多孔性シリカ層12やその他の担体に担持された状態で流体中に含有されていてもよい。また、除去対象物質に加えて、電子伝達物質を別途、流体中に含有させることとしてもよい。
具体的には、電子伝達物質としては、例えば、フェリシアン化カリウム、フェロセン、フェロセン誘導体、ベンゾキノン、キノン誘導体、オスミウム錯体、HBT、ABTS、ビオルリン酸(violuric acid、Vio)、NNS、3−ヒドロキシアントラニル酸(3−HAA)、4−アミノアンチピリン、HOBt等を用いることができる。
【0037】
酵素13は、細孔のサイズが酵素13のサイズの0.5〜2.0倍程度であるメソ多孔性シリカ層12の細孔の内部に安定的に固定されているため、除去対象物質の分子量が大きい場合、除去対象物質とメソ多孔性シリカの表面との間に相互作用がある場合等は、酵素分子内の活性中心が除去対象物質と効率的に電子移動を行うことが難しい場合がある。また、酵素13が、一次元シリカナノチャンネルの集合体のように方向性が制御されたアスペクト比の大きな細孔を有する粉末状のメソ多孔性シリカにより形成されメソ多孔性シリカ層12の細孔の内部に固定されている場合にも同様である。したがって、流体中に、電子伝達物質を含有させることが好ましい。
【0038】
また、酵素13に加えて、補酵素も、メソ多孔性シリカ層12の細孔の内部、具体的にはメソ多孔性シリカ層12を形成する粉末状のメソ多孔性シリカの細孔の内部に導入することも可能である。
補酵素は、酵素13の活性の発現を触媒するためのものであり、酵素13と除去対象物質或いは電子伝達物質との間の電子移動を媒介する媒介物質として機能する。
【0039】
例えば、不安定中間体を経由する反応等、酵素13のアミノ酸側鎖の触媒作用では容易に進まない反応の場合、適当な構造を有し、酵素反応の発現に関与する低分子量の有機小分子や金属イオン、金属錯体などを補因子(cofactor)として使用することが多い。補因子の中でも有機小分子や金属錯体を補酵素と呼ぶ。特に、酵素13として、補酵素依存型酵素を用いた場合、流体中に補酵素を導入することによって、酵素反応を効率よく行わせることができる。
【0040】
補酵素は、酵素13(補酵素依存型酵素)の種類に応じて、適宜選択することができる。具体的には、補酵素としては、例えば、ニコチンアミドアデニンジヌクレオチド(NAD+)、ニコチンアミドアデニンジヌクレオチドリン酸(NADP+)、補酵素I、補酵素II、フラビンモノヌクレオチド(FMN)、フラビンアデニンジヌクレオチド(FAD)、リポ酸、アデノシン三リン酸(ATP)、チアミンピロリン酸(TPP)、ピリドキサルリン酸(PALP)、テトラヒドロ葉酸(THF,Coenzyme F)、UDPグルコース(UDPG)、補酵素A、補酵素Q、ビオチン、補酵素B12(コバラミン)、S−アデノシルメチオニン等の1種又は2種以上の組み合わせが挙げられる。
【0041】
なお、補酵素は、流体中に含有されていれば任意であり、例えば、流入容器50内の処理前液(後述)等の流体に混入した状態で流体に含有されていてもよいし、メソ多孔性シリカ層12やその他の担体に担持された状態で流体中に含有されていてもよい。
また、補酵素は、例えば、補因子としての各種金属原子や金属イオン、金属錯体、各種色素など(例えば、Fe2+、Mn2+、Cu2+、Zn2+、Co3+等)とともに流体中に含有されていてもよい。
【0042】
ここで、NAD+などの補酵素を使用すると、メソ多孔性シリカ層12の細孔の内部に固定された酵素13の活性が低下する場合があることが分かっている。これは、NAD+などの補酵素が、メソ多孔性シリカ層12表面のシラノール基と反応して、酵素13の活性に影響を与えるためであると考えられる。
そこで、この場合、流体中に、補酵素を使用した際に生じる酵素13の活性の低下を抑制するための補酵素用活性低下抑制物質を添加するのが好ましい。
補酵素用活性低下抑制物質としては、例えば、生体高分子や、合成高分子、電解質などが挙げられる。
なお、補酵素用活性低下抑制物質は、流体中に含有されていれば任意であり、例えば、流入容器50内の処理前液(後述)等の流体に溶解した状態で流体に含有されていてもよいし、例えば、メソ多孔性シリカ層12やその他の担体に担持された状態で流体に含有されていてもよい。
【0043】
生体高分子は、分子量1000以上の生体高分子であれば任意であり、具体的には、例えば、血清アルブミン、ゼラチン、セルロース、デンプン等である。
【0044】
また、合成高分子は、分子量1000以上の合成高分子であれば任意であり、具体的には、例えば、ポリエチレングリコール、デキストラン等である。
【0045】
また、電解質は、流入容器50内の処理前液(後述)等の流体に溶解して、陽イオンと陰イオンとに電離する物質であれば任意であり、具体的には、例えば、塩化カリウム等である。
【0046】
なお、流体には、補酵素用活性低下抑制物質として、分子量1000以上の生体高分子、分子量1000以上の合成高分子及び電解質のうちの少なくとも何れか1つが添加されていればよい。
また、流体に添加される分子量1000以上の生体高分子の種類は、1種類であっても複数種類であってもよい。流体に添加される分子量1000以上の合成高分子の種類は、1種類であっても複数種類であってもよい。流体に添加される電解質の種類は、1種類であっても複数種類であってもよい。
【0047】
<バイオリアクタシステム>
本実施形態に係るバイオリアクタシステム1は、汚水等から環境ホルモン等の除去対象物質を除去するためのシステムであり、紙状バイオデバイス10と、汚水等が流れる流路20と、を備えて構成される。
なお、本実施形態では、バイオリアクタシステム1を、汚水等の液体から除去対象物質を除去するシステムとして構成したが、これに限ることはなく、バイオリアクタシステム1は、流体から除去対象物質を除去するシステムであれば任意であり、例えば汚染ガス等の気体から除去対象物質を除去するシステムとして構成することも可能である。
【0048】
具体的には、バイオリアクタシステム1は、例えば図2に示すように、紙状バイオデバイス10と、汚水等の液体が流れる流路20と、紙状バイオデバイス10を収納するためのケース体30と、ケース体30に収納された紙状バイオデバイス10を一定の温度に保つための恒温水槽40と、紙状バイオデバイス10によって処理する汚水等(以下「処理前液」という。)を入れるための流入容器50と、流入容器50内の処理前液を流路20に送り込むための第一ポンプ60と、流路20内の液体をケース体30に収納された紙状バイオデバイス10に循環させるための第二ポンプ70と、紙状バイオデバイス10によって処理された汚水等(以下「処理後液」という)を入れるための流出容器80と、を備えて構成される。
【0049】
また、バイオリアクタシステム1は、必要に応じて、例えば図2に示すように、流入容器50内の処理前液に空気等の所定のガスを供給するためのガスポンプ51や、ガスポンプ51により供給されるガスの流量を測定するための流量計52を備えることが好ましい。
具体的には、例えば、除去対象物質がフェノール系物質であり、酵素がフェノール系物質に選択的に作用するラッカーゼである場合、例えば図3(A)に示すように、まず、酸化型のラッカーゼ(Eox)は、選択的触媒作用により基質(すなわち、流体中のフェノール系物質(X))を酸化して、生成物(Y)を生成し、還元型のラッカーゼ(Ered)となる。そして、この還元型のラッカーゼ(Ered)は、流体中の酸素と反応して酸化型のラッカーゼ(Eox)に戻る。また、電子伝達物質を添加した場合、図3(B)に示すように、除去対象物質であるフェノール系物質(X)と酵素(E)との間の反応を電子伝達物質(M)が媒介し、より効率的な除去を行うことが可能となる。この場合、流体(本実施形態の場合、流路20内の液体)中に酸素が不足していると、還元型のラッカーゼは酸化型のラッカーゼに戻ることができず、酵素反応が進まない。このように、酵素反応に酸素等の所定のガスが必要な場合、バイオリアクタシステム1にガスポンプ51等を備えることが好ましい。
【0050】
また、ガスポンプ51で汚染ガス等の気体を供給する等のバブリング機能を装着すれば、バイオリアクタシステム1を汚染ガス等の気体から除去対象物質を除去するシステムとして構成することができる。
【0051】
本実施形態において、ケース体30は、筒状の本体部30aと、本体部30aの両端部を塞ぐための蓋部30b,30bと、により構成されている。
また、バイオリアクタシステム1において、紙状バイオデバイス10は、例えば図4(A)、図4(B)に示すように、酵素13が固定されたメソ多孔性シリカ層12を内側にして筒状に巻かれた状態で、本体部30a内に収納されている。そして、本体部30aは、例えば図4(C)に示すように、当該本体部30aの両端部が蓋部30b,30bで塞がれて、当該本体部30a内に収納されている筒状に巻かれた紙状バイオデバイス10の貫通方向が流路20に沿うように、当該流路20中に配設されている。すなわち、紙状バイオデバイス10は、筒状に巻かれた状態で、流路20中に配置されている。
【0052】
なお、本実施形態では、筒状に巻かれた紙状バイオデバイス10をそのまま用いるように構成したが、これに限ることはなく、例えば、筒状に巻かれた紙状バイオデバイス10の一端側(流出容器80側)を塞ぐ等して、筒状に巻かれた紙状バイオデバイス10の内側(中空部分)を通過する流体が、紙状バイオデバイス10を透過して外側へと染み出す状態にして用いるように構成することも可能である。この場合、流路20を流れる流体が紙状バイオデバイス10を透過するので、流体中の除去対象物質を効率よく酵素13に接触させることが可能となる。
また、本実施形態では、紙状バイオデバイス10を筒状に巻かれた状態で流路20中に配置するように構成したが、これに限ることはなく、例えば、紙状バイオデバイス10を筒状に巻かずにそのまま流路20に直交するように配置して、流路20を流れる流体が紙状バイオデバイス10を透過するように構成することも可能である。この場合も、流路20を流れる流体が紙状バイオデバイス10を透過するので、流体中の除去対象物質を効率よく酵素13に接触させることが可能となる。
【0053】
また、本実施形態において、流路20の両端には、例えば図2に示すように、三方バルブ21,21が取り付けられている。
そして、バイオリアクタシステム1は、この三方バルブ21,21によって、紙状バイオデバイス10から流出してきた液体を処理後液として流出容器80へと排出する経路(図2における「Path(1)」)と、紙状バイオデバイス10から流出してきた液体を再び紙状バイオデバイス10に供給する経路(図2における「Path(2)」)と、を切り替えることができるように構成されている。
【0054】
以下、具体的な実施例によって本発明を説明するが、発明はこれらに限定されるものではない。
本実施例では、除去対象物質としてフェノール系物質であるビスフェノールAを採用し、メソ多孔性シリカ層12の細孔の内部に固定する酵素13としてラッカーゼを採用する。また、メソ多孔性シリカ層12を形成するバインダーとして、酢酸セルロースを採用し、それをアセトンに溶解させて使用する。
【0055】
〔1〕メソ多孔性シリカのラッカーゼ吸着特性
まず、メソ多孔性シリカ層12を形成するメソ多孔性シリカのラッカーゼ吸着特性について評価した。
【0056】
具体的には、まず、サイズ(径)が7.0nmよりも若干小さいラッカーゼを固定するので、細孔径(中心細孔直径)が7.0nmである粉末状のメソ多孔性シリカを準備した。
また、ラッカーゼ濃度が1〜15mg/mlの範囲で異なる複数種類のラッカーゼ溶液を準備した。
そして、粉末状のメソ多孔性シリカを100mgずつ各ラッカーゼ溶液に浸漬させて、当該メソ多孔性シリカへのラッカーゼの吸着量を測定した。
また、比較のために、細孔径(中心細孔直径)が1.5nmである粉末状のメソ多孔性シリカについても同様にして、当該メソ多孔性シリカへのラッカーゼの吸着量を測定した。
【0057】
その結果を図5に示す。図5において、縦軸は100mgのメソ多孔性シリカ(FSM)へのラッカーゼの吸着量(mg)を示し、横軸は当該メソ多孔性シリカを浸漬させたラッカーゼ溶液のラッカーゼ濃度(mg/ml)を示す。
【0058】
図5に示す結果から、ラッカーゼ溶液の濃度にかかわらず、比較例の場合、すなわちメソ多孔性シリカの細孔径が1.5nmの場合(△)よりも、実施例の場合、すなわちメソ多孔性シリカの細孔径が7.0nmの場合(□)の方が、ラッカーゼの吸着量が多いことが分かった。これにより、細孔のサイズが、ラッカーゼのサイズの0.2倍程度であるメソ多孔性シリカでは、ラッカーゼの吸着量が少なく、ラッカーゼが主に細孔外部の表面部分に吸着していると考えられる。これに対し、細孔のサイズが、ラッカーゼのサイズとほぼ同等であるメソ多孔性シリカでは、ラッカーゼの吸着量が多く、大部分のラッカーゼが細孔内部に吸着(固定)していると考えられる。
また、図5に示す結果から、実施例の場合、すなわちメソ多孔性シリカの細孔径が7.0nmの場合(□)は、ラッカーゼ濃度が約10mg/mlで吸着量が飽和に達することが分かった。
【0059】
〔2〕アセトン中におけるメソ多孔性シリカに固定されたラッカーゼの活性特性
次に、メソ多孔性シリカ層12を形成するバインダー(酢酸セルロース)を溶解させるアセトン中における、メソ多孔性シリカに固定されたラッカーゼの活性特定について評価した。
【0060】
具体的には、まず、細孔径(中心細孔直径)が7.0nmである粉末状のメソ多孔性シリカを、ラッカーゼ濃度が10mg/mlのラッカーゼ溶液に浸漬させて、ラッカーゼが固定された粉末状のメソ多孔性シリカ(以下「Lac−FSM7.0」という。)を作成した。
そして、Lac−FSM7.0をアセトンに添加して、所定時間毎に当該Lac−FSM7.0中のラッカーゼの酵素活性を測定した。
【0061】
その結果を図6に示す。図6において、縦軸は相対酵素活性(%)=100×((時間“T1”経過後のLac−FSM7.0のラッカーゼの酵素活性)/(アセトンに添加する前のLac−FSM7.0のラッカーゼの酵素活性))を示し、横軸は時間“T1”(min)を示す。
【0062】
図6に示す結果から、Lac−FSM7.0のアセトン中での保存時間が2500分を超えても、相対酵素活性が80%以上を維持できることが分かった。すなわち、ラッカーゼが固定されたメソ多孔性シリカを、酢酸セルロースをアセトンに溶解させて作成したバインダー溶液中に分散させた状態でも、当該ラッカーゼの活性を長時間維持できることが分かった。これにより、ラッカーゼ(酵素13)の活性を維持した状態で、紙状バイオデバイス10を作成できることが分かった。
【0063】
〔3〕紙状バイオデバイス10による除去効率の流速依存性
次に、紙状バイオデバイス10を作成し、それを備えたバイオリアクタシステム1を構成して、当該紙状バイオデバイス10による除去効率の流速依存性について評価した。
【0064】
具体的には、まず、細孔径(中心細孔直径)が7.0nmである粉末状のメソ多孔性シリカを、ラッカーゼ濃度が10mg/mlのラッカーゼ溶液に浸漬させて、Lac−FSM7.0を作成した。
次いで、バインダー溶液として、酢酸セルロースを10%含むアセトン溶液を準備し、そのバインダー溶液に100mgのLac−FSM7.0を分散させて、メソ多孔性シリカ分散液を作成した。
次いで、紙状基材11として、市販されている化学実験用のろ紙を5.0cm×20.0cmの矩形状に切断したものを準備し、その紙状基材11の一方の面にメソ多孔性シリカ分散液を塗布して、真空デシケータ中で12時間静置した。
次いで、紙状基材11に塗布されているメソ多孔性シリカ分散液を蒸留水でリンスしてポリマー化し、真空デシケータ中で24時間乾燥させて、紙状バイオデバイス10を作成した。
【0065】
次いで、ケース体30の本体部30aとして、ガラス製の筒(長さ:6cm、内径:10mm)を準備し、その本体部30a内に、筒状に巻いた紙状バイオデバイス10を収納し、紙状バイオデバイス10を備えたバイオリアクタシステム1を構成した。
次いで、恒温水槽40の温度を30℃に設定し、三方バルブ21,21を調節して、紙状バイオデバイス10から流出してきた液体を処理後液として流出容器80へと排出する経路(図2における「Path(1)」)に切り替えた。
次いで、処理前液として、1.0mMのビスフェノールA溶液を準備し、流入容器50に入れた。
次いで、第一ポンプ60を調節して、紙状バイオデバイス10(具体的には、紙状バイオデバイス10が収納されたケース体30)に供給する液体の流速として2.0〜18.0ml/minの範囲で異なる複数種類の流速を設定し、第一ポンプ60を動作させた。
そして、各流速について流出容器80へと排出された処理後液中のビスフェノールA濃度を測定した。
【0066】
その結果を図7に示す。図7において、縦軸は除去効率(%)=100×([(処理前液中のビスフェノールA濃度)−(流速“S”での処理後液中のビスフェノールA濃度)]/[(処理前液中のビスフェノールA濃度)−(流速2.0ml/minでの処理後液中のビスフェノールA濃度)])を示し、横軸は流速“S”(ml/min)を示す。
【0067】
図7に示す結果から、流速が大きくなるほど、除去効率が低下することが分かった。これにより、除去対象物質(ビスフェノールA)を含む流体の滞留時間が大きいほど、酵素13(ラッカーゼ)との反応が十分に進行し、効率的に除去対象物質(ビスフェノールA)を除去できることが分かった。
【0068】
〔4〕紙状バイオデバイス10による除去効率の循環回数依存性
次に、紙状バイオデバイス10による除去効率の循環回数依存性について評価した。
【0069】
具体的には、まず、上記〔3〕の場合と同様にして、紙状バイオデバイス10を備えたバイオリアクタシステム1を構成した。
次いで、恒温水槽40の温度を30℃に設定し、三方バルブ21,21を調節して、紙状バイオデバイス10から流出してきた液体を処理後液として流出容器80へと排出する経路(図2における「Path(1)」)に切り替えた。
次いで、処理前液として、1.0mMのビスフェノールA溶液を準備して流入容器50に入れ、第一ポンプ60を調節して、紙状バイオデバイス10(具体的には、紙状バイオデバイス10が収納されたケース体30)に供給する液体の流速として2.0ml/minを設定し、第一ポンプ60を動作させた。
【0070】
次いで、三方バルブ21,21を調節して、紙状バイオデバイス10から流出してきた液体を再び紙状バイオデバイス10に供給する経路(図2における「Path(2)」)に切り替えた。
次いで、第二ポンプ70を調節して、紙状バイオデバイス10(具体的には、紙状バイオデバイス10が収納されたケース体30)に供給する液体の流速として2.0ml/minを設定し、第二ポンプ70を動作させて、流路20内の液体を紙状バイオデバイス10に循環させた。
【0071】
次いで、循環回数が所定回数に達すると、三方バルブ21,21を調節して、紙状バイオデバイス10から流出してきた液体を処理後液として流出容器80へと排出する経路(図2における「Path(1)」)に切り替え、具体的には、流入容器50側の三方バルブ21はそのまま(「Path(2)」のまま)の状態で、流出容器80側の三方バルブ21を「Path(1)」と同様に切り替えて、流出容器80へと排出された処理後液中のビスフェノールA濃度を測定した。
【0072】
また、比較のために、ラッカーゼが固定されていない粉末状のメソ多孔性シリカを用いて作成したデバイスを備えたリアクタを構成し、同様にして、流出容器80へと排出された処理後液中のビスフェノールA濃度を測定した。
【0073】
その結果を図8に示す。図8において、縦軸はビスフェノールAの相対濃度(%)=100×((循環回数“N”での処理後液中のビスフェノールA濃度)/(処理前液中のビスフェノールA濃度))を示し、横軸は循環回数“N”(回)を示す。
【0074】
図8に示す結果から、比較例の場合、すなわちメソ多孔性シリカ層12にラッカーゼが固定されていない場合(△)でも、循環回数が増加するほど、相対濃度が低下することが分かった。また、比較例の場合は、所定濃度以下の低濃度のビスフェノールAは除去できないことが分かった。これにより、所定濃度を上回る高濃度のビスフェノールAは、酵素13(ラッカーゼ)が固定されていないメソ多孔性シリカ層12や紙状基材11への吸着だけでも除去できるが、所定濃度以下の低濃度のビスフェノールAは除去できないことが分かった。
【0075】
一方、実施例の場合、すなわちメソ多孔性シリカ層12にラッカーゼが固定されている場合(□)も、循環回数が増加するほど、相対濃度が低下することが分かった。また、実施例の場合は、所定濃度以下の低濃度のビスフェノールAでも除去できることが分かった。これにより、ビスフェノールAは、メソ多孔性シリカ層12に固定されたラッカーゼとの反応により、非常に低濃度であっても効率的に除去できることが分かった。これは、メソ多孔性シリカの比表面積が非常に大きく酵素13(ラッカーゼ)を高密度に固定できること、固定された酵素13(ラッカーゼ)の活性が維持されていることが効いていると考えられる。
【0076】
〔5〕紙状バイオデバイス10の動作安定性(経時安定性)
次に、紙状バイオデバイス10の動作安定性(経時安定性)について評価した。
【0077】
具体的には、まず、上記〔3〕の場合と同様にして、紙状バイオデバイス10を備えたバイオリアクタシステム1を構成した。
次いで、恒温水槽40の温度を30℃に設定し、三方バルブ21,21を調節して、紙状バイオデバイス10から流出してきた液体を処理後液として流出容器80へと排出する経路(図2における「Path(1)」)に切り替えた。
次いで、処理前液として、1.0mMのビスフェノールA溶液を準備して流入容器50に入れ、第一ポンプ60を調節して、紙状バイオデバイス10(具体的には、紙状バイオデバイス10が収納されたケース体30)に供給する液体の流速として2.0ml/minを設定し、第一ポンプ60を動作させた。
そして、所定時間毎に、流出容器80へと排出された処理後液中のビスフェノールA濃度を測定した。
【0078】
また、比較のために、ラッカーゼをメソ多孔性シリカに固定しない状態でバインダー溶液に分散させて作成したデバイスを備えたリアクタを構成し、同様にして、流出容器80へと排出された処理後液中のビスフェノールA濃度を測定した。
【0079】
その結果を図9に示す。図9において、縦軸は除去効率(%)=100×([(処理前液中のビスフェノールA濃度)−(時間“T2”経過後の処理後液中のビスフェノールA濃度)]/[(処理前液中のビスフェノールA濃度)−(時間0.5hでの処理後液中のビスフェノールA濃度)])を示し、横軸は時間“T2”(h)を示す。
【0080】
図9に示す結果から、比較例の場合、すなわちラッカーゼをメソ多孔性シリカ層12に固定しない場合(△)は、時間が経過するほど除去効率が低下し、約450時間が経過すると、除去効率がほぼ0%になることが分かった。これにより、ラッカーゼをメソ多孔性シリカ層12に固定しないと、当該ラッカーゼが剥がれてしまったり失活してしまったりすることが分かった。
【0081】
一方、実施例の場合、すなわちラッカーゼをメソ多孔性シリカ層12に固定した場合(□)は、時間が経過してもほとんど除去効率が低下せず、1400時間が経過しても、除去効率が90%程度を維持できることが分かった。これは、メソ多孔性シリカ層12(具体的には、メソ多孔性シリカ層12を形成するメソ多孔性シリカ)の細孔のサイズが、酵素13(ラッカーゼ)のサイズとほぼ同じであるため、酵素13(ラッカーゼ)が構造的に安定した状態で固定されて、活性が維持されているためと考えられる。
【0082】
以上説明した本実施形態の紙状バイオデバイス10及びバイオリアクタシステム1によれば、紙状バイオデバイス10は、紙状基材11と、紙状基材11上に形成されたメソ多孔性シリカ層12と、メソ多孔性シリカ層12の細孔の内部に固定された酵素13と、を備えて構成されている。
すなわち、酵素13をメソ多孔性シリカ層12の細孔の内部に固定することにより、酵素13自体の経時変化を生じ難くして、酵素活性の低下を抑制しているとともに、メソ多孔性シリカ層12を紙状基材11上に形成しているので、低コスト化及び長寿命化が可能である。
さらに、紙状バイオデバイス10は、酵素13を用いたバイオデバイスであるので、高効率に汚染物質等の除去対象物質を除去することが可能である。
【0083】
また、以上説明した本実施形態の紙状バイオデバイス10及びバイオリアクタシステム1によれば、粉末状のメソ多孔性シリカとバインダーとを混合したものを紙状基材11上に積層するだけの簡易な手法で、紙状基材11上にメソ多孔性シリカ層12を形成することができる。
【0084】
また、以上説明した本実施形態の紙状バイオデバイス10及びバイオリアクタシステム1によれば、バインダーは酢酸セルロースであるので、取り扱い易く低コスト化が容易である。
【0085】
また、以上説明した本実施形態の紙状バイオデバイス10及びバイオリアクタシステム1によれば、紙状基材11はセルロース紙であるので、取り扱い易く低コスト化が容易である。
【0086】
また、以上説明した本実施形態のバイオリアクタシステム1によれば、紙状バイオデバイス10は、筒状に巻かれた状態で流路20中に配置されているので、非常に簡便な構成で、汚染物質等の除去対象物質を除去することが可能である。
【0087】
なお、本発明は上記の実施形態に限定されず、本発明の趣旨から逸脱しない限り、適宜変更可能であることはいうまでもない。
【0088】
例えば、上記の実施形態では、紙状バイオデバイス10及びバイオリアクタシステム1を、流体から除去対象物質を除去するデバイス及びシステムとして構成したが、これに限定されることはなく、例えば、有用な物質を高効率で生成するデバイス及びシステムとして構成することも可能である。例えば、アルコール脱水素酵素の逆反応を利用して、アルデヒドからエタノールを生成すること等も可能である。
【符号の説明】
【0089】
1 バイオリアクタシステム
10 紙状バイオデバイス
11 紙状基材
12 メソ多孔性シリカ層
13 酵素
20 流路
【特許請求の範囲】
【請求項1】
紙状基材と、
前記紙状基材上に形成されたメソ多孔性シリカ層と、
前記メソ多孔性シリカ層の細孔の内部に固定された酵素と、
を備えることを特徴とする紙状バイオデバイス。
【請求項2】
請求項1に記載の紙状バイオデバイスにおいて、
前記メソ多孔性シリカ層は、粉末状のメソ多孔性シリカとバインダーとを混合したものを前記紙状基材上に積層することによって形成されていることを特徴とする紙状バイオデバイス。
【請求項3】
請求項2に記載の紙状バイオデバイスにおいて、
前記バインダーは酢酸セルロースであることを特徴とする紙状バイオデバイス。
【請求項4】
請求項1から請求項3の何れか一項に記載の紙状バイオデバイスにおいて、
前記紙状基材はセルロース紙であることを特徴とする紙状バイオデバイス。
【請求項5】
請求項1から請求項4の何れか一項に記載の紙状バイオデバイスと、
所定の流体が流れる流路と、を備え、
前記紙状バイオデバイスは、筒状に巻かれた状態で、前記流路中に配置されることを特徴とするバイオリアクタシステム。
【請求項6】
請求項5に記載のバイオリアクタシステムにおいて、
当該バイオリアクタシステムは、前記流体から除去対象物質を除去するためのシステムであり、
前記酵素はラッカーゼであり、
前記除去対象物質はフェノール系物質であることを特徴とするバイオリアクタシステム。
【請求項1】
紙状基材と、
前記紙状基材上に形成されたメソ多孔性シリカ層と、
前記メソ多孔性シリカ層の細孔の内部に固定された酵素と、
を備えることを特徴とする紙状バイオデバイス。
【請求項2】
請求項1に記載の紙状バイオデバイスにおいて、
前記メソ多孔性シリカ層は、粉末状のメソ多孔性シリカとバインダーとを混合したものを前記紙状基材上に積層することによって形成されていることを特徴とする紙状バイオデバイス。
【請求項3】
請求項2に記載の紙状バイオデバイスにおいて、
前記バインダーは酢酸セルロースであることを特徴とする紙状バイオデバイス。
【請求項4】
請求項1から請求項3の何れか一項に記載の紙状バイオデバイスにおいて、
前記紙状基材はセルロース紙であることを特徴とする紙状バイオデバイス。
【請求項5】
請求項1から請求項4の何れか一項に記載の紙状バイオデバイスと、
所定の流体が流れる流路と、を備え、
前記紙状バイオデバイスは、筒状に巻かれた状態で、前記流路中に配置されることを特徴とするバイオリアクタシステム。
【請求項6】
請求項5に記載のバイオリアクタシステムにおいて、
当該バイオリアクタシステムは、前記流体から除去対象物質を除去するためのシステムであり、
前記酵素はラッカーゼであり、
前記除去対象物質はフェノール系物質であることを特徴とするバイオリアクタシステム。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2012−143182(P2012−143182A)
【公開日】平成24年8月2日(2012.8.2)
【国際特許分類】
【出願番号】特願2011−3518(P2011−3518)
【出願日】平成23年1月12日(2011.1.12)
【出願人】(505303059)株式会社船井電機新応用技術研究所 (108)
【出願人】(000201113)船井電機株式会社 (7,855)
【Fターム(参考)】
【公開日】平成24年8月2日(2012.8.2)
【国際特許分類】
【出願日】平成23年1月12日(2011.1.12)
【出願人】(505303059)株式会社船井電機新応用技術研究所 (108)
【出願人】(000201113)船井電機株式会社 (7,855)
【Fターム(参考)】
[ Back to top ]

