紫外線誘発性紅斑の予防用剤
【課題】紫外線誘発性紅斑予防用剤を提供する。
【解決手段】リンゴ抽出物を有効成分とする紅斑予防剤、リンゴ抽出物を有効成分とする皮膚アポトーシス抑制剤。
【解決手段】リンゴ抽出物を有効成分とする紅斑予防剤、リンゴ抽出物を有効成分とする皮膚アポトーシス抑制剤。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、紫外線誘発性紅斑の発生を予防する剤に関する。
【背景技術】
【0002】
近年、紫外線の皮膚に及ぼす影響や、その作用機構が研究され、従来問題としなかったレベルの紫外線であっても長期的に暴露すると影響が生体に及ぶことが明らかとなってきた。
【0003】
通常、地表に達する太陽放射は、紫外線(UV)(λ<400nm)、可視光線(400nm<λ<700nm)および赤外線(IR)(λ>700nm)で構成されている。UV放射は通常、UVA(320〜400nm)、UVB(290〜320nm)、UVC(<290nm)に分けられる。UVC放射は成層圏のオゾンによって遮断され、地表には届かない。一般に、太陽光線の紫外線(UV)成分、特にUVBがいわゆる日焼けの主な原因であると考えられている。
【0004】
UV照射による皮膚の日焼けには2種類あり、サンバーンは暴露の数時間から始まり、12〜24時間後に皮膚に発赤、腫脹、水疱の形成が認められる状態を指す。その後消退し、色素沈着が起きる、これがサンタンである。
肌色を4段階(I−IV)に分けると日本人の皮膚は色白のタイプI−色黒のタイプIIIに分けられる。非特許文献1(小林静子、薬学雑誌、Vol.126、677−693,2006)では、平均的なタイプIIの人が真夏の東京湾で約20分日光浴すると12−24時間後にうっすら赤くなった状態のサンバーンを紅斑と呼んでいる。
【0005】
このヒトの皮膚に紅斑(一般にサンバーンとして見られる赤味)を発生させるのに必要な量は周知であり、特定のUV源からの「最小紅斑量(MED)」として経験的に定量化されている。紅斑誘発性が最も高いのはUVB波長290〜300nmである。UV波長が約300nmよりも長くなるとUV放射による紅斑発生率は急激に落ちる。波長320nmおよび340nmで皮膚の赤味が生じる可能性はそれぞれ、波長約298nmの場合の100分の1および1000分の1である。それにもかかわらず、紅斑や皮膚の変色(tanning)を引き起こすレベルで太陽光線に繰り返し曝露されることと光老化との間には、関連性があるのが普通である。UVBによる紅斑は被曝強度ではなく全被曝量の関数になると考えられている(非特許文献2:Physiology,Biochemistry,and Molecular Biology of the Skin(皮膚の生理学、生化学、分子生物学)、第2版、L.A.Goldsmith編(New York:オックスフォード大学出版、1991))によれば、UVAはメラニン形成誘発性かつ紅斑誘発性であり、UVAに曝露されると、ヒトの皮膚で32kDaのストレスタンパク質(ヘムオキシゲナーゼ)の合成が誘発されるだけでなく、UVB曝露後には見られなかった「即時」紅斑が発生する。
【0006】
ヒトの皮膚の光老化は、臨床的には肌荒れ、シワ、まだらな色素沈着、黄ばみ、たるみ、さらには前ガン性腫瘍、最終的には悪性腫瘍となる症状によって特定される。光老化は一般に、顔、耳、頭皮のはげた部分、首、前腕、手など日常的に太陽光線に曝露される皮膚に発生する。
皮膚の太陽光線に曝露される部分の光老化の防止には、一般にサンスクリーン剤が用いられる。サンスクリーン剤は、UV光を吸収、反射および/または散乱させる成分を含有する局所製剤である。上述したように、一般に認められている皮膚に対する光損傷の病因には、紅斑(サンバーンまたは赤味すなわち、文字通りの意味で皮膚の紅潮)を引き起こすのに十分な太陽光線への曝露が関与しており、十分なUVB暴露が紅斑を引き起こすことが知られている。
【0007】
従って、光老化を抑制するためにはUVBを遮断または吸収する化合物を使用することが一般的に考えられ、実行されてきた。このような剤はもっぱら外用剤として使用し効果を示すもので、経口投与によって効果を示すものはまだ提供されていない。
さらにまた、この技術思想を一歩進めて、特許文献1:特開2009−108019号公報にはチオクト酸とキチンを含有する剤をUVBに対する皮膚の抵抗力を高めるために使用することが開示されている。また特許文献2:特表2001−520677号公報には皮膚の光老化を抑制するためにマトリックスメタルプロテナーゼ(MMP)阻害剤とUVA、UVB遮断剤を皮膚に塗布する方法が提案されている。これまで市場に提供されているものは、外用剤としての遮断剤が殆どである。
【0008】
また、近年の研究では、上記の紫外線による紅斑の発生に先立って、皮膚細胞のアポトーシスが誘導され、その結果として炎症や紅斑が発生することが明らかとなった(非特許文献3:森田明理、日皮会誌、Vol.118,PP1683−1689,2008)。たとえばアルビノのヘアレスマウスを用いた試験によってMED照射の影響が検討されている(非特許文献4:Cancer Epidemiol Biomarkers Prev. 14(5):1344-1349., 2005年)。このようなアポトーシスの発生を抑制することでサンバーンによる皮膚紅斑を抑制することが期待される。
【0009】
また、本発明者は、本発明に係るリンゴ抽出物の研究開発を行っている。とくにリンゴ抽出物に含有されているポリフェノールが活性酸素による酸化が原因の皮膚老化全般に対して予防効果を有することを見出して特許出願を行っている(特許文献4:特開2011−51967号公報参照)。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開2009−108019号公報
【特許文献2】特表2001−520677号公報
【特許文献3】特開2011−51967号公報
【非特許文献】
【0011】
【非特許文献1】小林静子、薬学雑誌、Vol.126、677−693,2006
【非特許文献2】Physiology,Biochemistry,and Molecular Biology of the Skin(皮膚の生理学、生化学、分子生物学)、第2版、L.A.Goldsmith編(New York:オックスフォード大学出版、1991)
【非特許文献3】森田明理、日皮会誌、Vol.118,PP1683−1689,2008
【非特許文献4】Cancer EpidemiolBiomarkers Prev. 14(5):1344-1349., 2005年)
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明は、紫外線によって発生する皮膚細胞のアポトーシス発生を予防する剤を提供することを課題とする。また本発明は紫外線によって引き起こされる皮膚紅斑の発生を予防する剤を提供することを課題とする。
【課題を解決するための手段】
【0013】
本発明者らはリンゴ抽出物に着目して試験した結果、リンゴポリフェノールに紫外線によって引き起こされるアポトーシス発生抑制作用があることを知見したことに基づき、本発明を提案する。
【0014】
すなわち、本発明は、
(1)リンゴ抽出物を有効成分とする紫外線誘発性紅斑予防用剤。
(2)紫外線誘発性紅斑が紫外線誘発性アポトーシスによるものである(1)記載の剤。(3)リンゴ抽出物が、リンゴ由来のポリフェノールを含むものである(1)又は(2)に記載の剤。
(4)経口剤である(1)〜(3)のいずれかに記載の剤。
【発明の効果】
【0015】
本発明は、紫外線によって誘発される皮膚細胞のアポトーシスを予防し、さらに紅斑の発生を予防することができる。
【図面の簡単な説明】
【0016】
【図1】紫外線B波誘発紅斑の発生と本発明の予防効果を示すグラフ
【図2】紫外線B波誘発アポトーシスの発生と本発明の予防効果を示すグラフ
【発明を実施するための形態】
【0017】
本発明の紫外線誘発性紅斑予防用剤は、リンゴ抽出物を有効成分とし、前記リンゴ抽出物が、リンゴ果実の抽出物であることが好ましい。
【0018】
リンゴ抽出物には、ポリフェノール、有機酸、アミノ酸などが含まれることが知られている。リンゴ抽出物は、血管機能改善作用を高めることが可能なBNP調節剤として該抽出物を有効成分として含有してなるBNP調節剤、血行促進剤(特開2007−008837号公報、特開2006−265220号公報)や飲料(特開2004−305087号公報)、化粧料配合剤(特開2001−187724号公報)、消臭剤成分(特開平11−319051号公報)、香料成分(特開平08−023939号公報)などに用いられることが知られている。しかしリンゴ抽出物およびリンゴ由来のポリフェノールについて、紫外線誘発アポトーシス抑制作用及び紫外線誘発性皮膚紅斑の予防作用があることは知られていない。
【0019】
以下に、本発明の紫外線誘発性紅斑予防用剤について、詳細に説明する。
本発明の剤はリンゴ抽出物を有効成分とすることを特徴とする。
【0020】
リンゴ抽出物は、例えば、市販のリンゴ抽出物を用いても良く、リンゴ果実から抽出して調製しても良く、特に制限されない。本発明の剤中に含まれるリンゴ抽出物含量は、特に制限されないが、例えば、0.001〜99重量%、好ましくは、0.001〜5重量%である。リンゴ由来のポリフェノールを含むリンゴ抽出物が好ましい。
【0021】
リンゴ由来のポリフェノールの分画方法は、従来公知の方法を採用できる。ポリフェノールは、リンゴ抽出物をカラムに通液後、カラムの吸着物を溶出し、この溶出画分を減圧留去濃縮して分画しても良い。また、さらに、この濃縮液に粉末助剤を添加し、凍結乾燥または噴霧乾燥して、ポリフェノール粉末を調製しても良い。
ポリフェノールは、市販のリンゴ由来のポリフェノール含有物を用いても良く、リンゴ果実から抽出および分画して調製しても良い。本発明の剤中に含まれる前記ポリフェノール含量は、特に制限されないが、例えば、0.01〜99重量%、好ましくは、0.1〜50重量%である。
【0022】
リンゴ抽出物において、リンゴ(Malus pumila)の品種は、例えば、ふじ、国光、王林、紅玉、ジョナゴールド、デリシャス、さんさ、千秋などが挙げられ、特に制限されない。リンゴの抽出部位は、特に制限されず、例えば、果実、葉、幹、花などが挙げられ、好ましくは、果実である。前記果実は、例えば、未熟果(幼果)でも良く、完熟果でも良く、特に制限されない。抽出に用いる前記果実の部位は、特に制限されず、例えば、全果、果肉、果皮、種などが挙げられる。リンゴ抽出物は、これらの部位を、単独で、または2種以上組み合わせて抽出しても良い。特に好ましくはポリフェノール含量の高いリンゴの幼果が好ましい。
【0023】
リンゴ抽出物を得るための抽出方法は、特に制限されず、従来公知の方法を採用できる。抽出方法の具体例としては、例えば、以下のようであっても良い。まず、リンゴの全果を、水洗後、グラインダーなどにより粉砕する。この粉砕物を、ペクチナーゼ処理に供し、遠心分離後、抽出溶媒により分配ろ過して、リンゴ抽出物を調製しても良い。前記ペクチナーゼ処理としては、特に制限されないが、例えば、20〜60℃の温度条件化で、ペクチナーゼを10〜50ppm添加して行っても良い。抽出溶媒としては、特に制限されないが、例えば、ヘキサン、クロロホルムなどの有機溶媒が挙げられる。
【0024】
本発明において、リンゴ抽出物は、例えば、市販のリンゴ抽出物を用いても良く、リンゴ果実から抽出して調製しても良く、特に制限されない。本発明の実施にあたってはリンゴ由来のポリフェノールを高濃度に含むリンゴ抽出物が好ましい。
【0025】
リンゴ由来のポリフェノールの分画方法は、特に制限されず、従来公知の方法を採用できる。ポリフェノールは、例えば、リンゴ抽出物をカラムに通液後、カラムの吸着物を溶出し、この溶出画分を減圧留去濃縮して分画しても良い。また、さらに、この濃縮液に粉末助剤を添加し、凍結乾燥または噴霧乾燥して、ポリフェノール粉末を調製しても良い。
【0026】
本発明において、リンゴ由来のポリフェノールは、例えば、市販のリンゴ由来のポリフェノール含有物を用いても良く、リンゴ果実から抽出および分画して調製しても良く、特に制限されない。
【0027】
本発明の紫外線誘発性紅斑予防用剤はそのままあるいは、結着剤、賦型剤、滑沢剤など製剤用の添加剤とともに打錠して錠剤としてもよい。また造粒して顆粒剤、カプセル剤などの固型剤とすることもできる。あるいは甘味料や果汁などを配合して液剤とすることもできる。経口剤としての形態に特に制限はない。
【0028】
かくして得られた本発明の紫外線誘発性紅斑予防用剤は、あらかじめ経口で継続的に摂取しておくことで紫外線暴露により発生する皮膚細胞のアポトーシスの発生を予防することで、皮膚の紅斑発生を予防し、長期的には皮膚の光老化を予防することができる。
以下実施例を示し本発明をさらに説明する。
【実施例】
【0029】
1.紫外線照射に紅斑の誘発予防試験・アポトーシス予防試験
ヘアレスマウスにリンゴ抽出物を3週間摂取させ、その後、一定の紫外線B波を照射した時の紫外線障害(日焼け)の程度を色彩色差計で算出した色差ΔE*ab値を指標で評価し紫外線誘発性紅斑の予防効果の評価を行った。
【0030】
(1)実験動物および紫外線照射条件の設定
試験動物
ヘアレスマウスHos:HR-1(メス)を用いた。このマウスはアルビノ(c/c)種であり、メラニン色素を有しない。Hos:HR-1は実験科学上、多く報告されている。紫外線照射による「メラニン形成・シミ形成・色素沈着形成」の試験系には用いる事が出来ず、シミ・美白・メラニンを評価する試験系とは明確に区別される。
【0031】
紫外線B波照射条件
紫外線B波照射量は180mJ/cm2(約3MED、1MED=最小紅斑量)で設定した。紫外線B波(中波長紫外線、UV‐Bと称される、波長領域は290−320nm)は紅斑(サンバーン)を引き起こす主要因である。
この紫外線照射量は、(Cancer Epidemiol Biomarkers Prev. 14(5):1344-1349., 2005年)に準拠した。ヘアレスマウスHos:HR-1に対する紫外線B波MED線量は、J DermatolSci. 2001年;27 Suppl 1:S19-25.に拠ると1MEDはUV‐B約55‐60mJ/cm2となる。よって180mJ/cm2の紫外線B波の線量はヘアレスマウスに対して約3MEDとなり、3MEDの線量は各マウス皮膚の紅斑・サンバーンを引き起こすに充分な線量である。
皮膚組織への紫外線B波照射の影響は表皮が主な到達部位であるが、真皮にも10%程度到達してDNA断片化およびDNA断片化を契機としてタンパク合成を必要とするアポトーシス(delayed apoptosis)を引き起こす(日皮会誌:118(9)1683−9、2008年、森田 明理 他)。すなわち、サンバーン細胞はUV‐BによってDNAが損傷を受けた皮膚細胞が、その損傷を修復できずに遺伝子の変異を回避するために自ら死んでいく(アポトーシス)。また、紫外線B波でサンバーン・日焼け・紅斑を引き起こす過程では皮膚上皮の毛細血管において炎症を惹起するプロスタグランジンの上昇も確認されており、サンバーン・日焼け・紅斑といった外観変化においては皮膚内部では炎症反応が惹起している(薬学雑誌:126(9)677−93、2006年、小林静子)。
よって、日焼け(サンバーン)という外観の変化において、皮膚組織のアポトーシス亢進が定義付けされているので、in situ hybridization法によるアポトーシスの検出を行った。
【0032】
試薬、材料
市販のリンゴ抽出物としてリンゴポリフェノール(AP)ポマクティブHFV(ユニテックフーズ社販売)を用いた。
色彩色差計CR-400(コニカミノルタ製)、デジタルカメラ IXY DIGITAL 930I(キャノン製)、紫外線照射ランプ FL20SE-30/DMR(クリニカル・サプライ製)を使用した。
【0033】
動物飼育
群設定(1群6匹)
群1.紫外線照射無し、コントロール食
群2.紫外線照射アリ、コントロール食 照射1h後に解剖
群3.紫外線照射アリ、コントロール食 照射6h後に解剖
群4.紫外線照射アリ、AP1%(w/w)混餌 照射1h後に解剖
群5.紫外線照射アリ、AP1%(w/w)混餌 照射6h後に解剖
群6.紫外線照射アリ、AP1%(w/w)混餌 照射18h後に解剖
群7.紫外線照射アリ、コントロール食(w/w)混餌 照射18h後に解剖
群8.紫外線照射無し、AP1%(w/w)混餌
種及び系統:マウス HR‐1(ヘアレスマウス)
供給源: 日本エスエルシー株式会社
静岡県浜松市西区湖東町3371番地の8
購入動物数、性別、入荷時週齢及び体重範囲
購入動物数 性別 入荷時週齢 体重範囲
60匹 ♀ 8週齢 16−21g
飼育経緯:動物入荷後21日間を混餌摂取期間とし、この間に一般状態の観察及び体重測定を行い、すべてのマウスを計画通りに11週齢時に紫外線照射などの試験に供した。異常が認められた個体は確認されなかった。
飼育室:条件
温度:(設定値)23℃、(許容範囲)21〜25℃
湿度:(設定値)55%、(許容範囲)40〜70%
照明:12時間(午前7時〜午後7時)
飼料:固形飼料AIN‐76A (オリエンタル酵母工業株式会社)の自由摂取
飲水:5μmカートリッジフィルターを通過させた水道水を給水瓶で与えた。
床敷: パルソフト(オリエンタル酵母株式会社)を高圧蒸気滅菌して使用した。
収容動物数: 最大 3匹/ケージ
【0034】
(2)解剖(紫外線照射、皮膚計測、生体試料回収)
上記の群設定に示した条件で飼育、紫外線照射を行った。
紫外線誘発紅斑抑制剤を含む試験試料の混餌は解剖直前まで行った、但し、紫外線B波照射の時間帯(約20分間)は絶食扱いとした。
紫外線照射直前にマウス背部皮膚の色差(ΔE*ab)および体重を測定した。
1回あたりの紫外線照射量はUV‐B波を180mJ/cm2(約3MED、1MED=最小紅斑量)、この紫外線照射量は、(Cancer Epidemiol Biomarkers Prev. 14(5):1344-1349., 2005年)に準拠した。
紫外線照射1時間後もしくは6時間後、18時間後に解剖を行った。
紫外線照射後のマウス背部皮膚の色差を測定した。
ジエチルエーテルを吸入法によって深麻酔を施し、麻酔下で背部皮膚の写真撮影を行った。その後、開腹し腹部大動脈もしくは心臓からの採血によって安楽死を施した。そして、血液は1時間〜4時間程度氷冷保存後に遠心分離して血漿を分画し冷凍保存した。堵殺後の個体から肝臓摘出と背部皮膚部の摘出を行った。肝臓は生理食塩水にて洗浄後、アルミ箔に包んで冷凍保存した。背部皮膚は中央部2片をバイオプシーパンチしメタカン(メタノール:クロロホルム:酢酸=6:3:1(v/v/v))固定後にパラフィン包埋とスライドガラスへの切り出し操作を行い、組織染色に供した。残りの背部皮膚はアルミ箔に包んで冷凍保存した。
【0035】
(3)皮膚アポトーシスのTUNEL法による染色
皮膚組織のアポトーシスは、市販のキット(DermaTACs In Situ Apoptosis Detection Kit、Trevigen製)を用いたTUNEL(TdT mediated dUTP nick end labeling)染色法により各群のアポトーシスを比較した。
定法により解剖後、パラフィン包埋、スライドガラスへの切り出し、脱パラフィン処理した皮膚切片に対して、PBS(−)洗浄後にプロテアーゼK(50倍希釈)を室温で30分処理し、酵素反応終了後に軽くプロテアーゼK溶液をスライドガラスから落とした後にCytoninTM溶液を30分室温で処理した。
脱イオン水で5分間2回洗浄後、内因性ペルオキシダーゼ阻害を目的として3%過酸化水素(溶媒:メタノール)を5分間処理した。
PBS(−)で1分間1回洗浄後、1×TdT labeling bufferで室温5分間処理した。
引き続き、Labeling Reaction Mix (B-dNTP MixおよびTdT Enzymeの1×TdT Labeling Buffer50倍希釈混合液)を滴下し、湿潤箱内にサンプルを移し、37℃30分間処理した。
反応終了後、1×TdT labeling bufferで室温5分間処理し、PBS(−)で2分間2回室温にて洗浄後、抗体溶液(Anti-BrdUのStrep-Diluent50倍希釈液)を滴下し、湿潤箱内にサンプルを移し、37℃30分間処理した。
反応終了後、PBST(Tween(R)20のPBS(−)2000倍希釈液)で2分間3回室温にて洗浄した。引き続き、Strep-HRP溶液(Strep-HRPのStrep-HRP Diluent 800倍希釈液)を10分間室温で反応させた。反応終了後、PBS(−)で2分間2回洗浄後、引き続き脱イオン水で1分間1回洗浄した。
呈色反応試薬であるTACS Blue LabelTM50μLを各スライドガラスに滴下し、5分間顕微鏡観察下で反応させた。反応終了後、脱イオン水で洗浄し、定法に従い、脱水、透徹、封入を行い、観察用標本を作製した。
光学顕微鏡による皮膚組織のアポトーシス検出と定量は、深さは皮膚上層50μm(角層、表皮層、真皮乳頭層から構成される部分)および任意の幅200μmの範囲10000μm2におけるTUNEL陽性細胞をカウントした。
【0036】
(4)統計処理
全8群について、「紫外線未照射2群」「紫外線照射1時間後(初期)解剖2群」「紫外線照射6時間後(中期)解剖2群」「紫外線照射18時間後(後記)2群」に分け、2群間の有意差検定はwelch’s t-testを用い、有意差検定した。
【0037】
(5)試験結果
体重
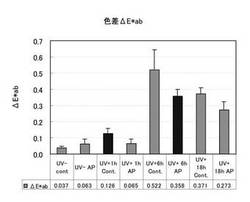
搬入時および解剖直前のマウス体重において、各群間に有意な差は確認されなかった。背部紅斑の色差測定
背部写真を一例として示す。コントロール食群では紫外線照射6時間後のマウスで赤味が増していた。
色差は、色彩色差計CR‐400(コニカミノルタ製)を用いて、紫外線照射前後それぞれにつき、ヘアレスマウス背部中央近傍のL*a*b*表色系で2回ずつ測定し、その2回の平均値から、同一個体の色差ΔE*abを算出した。
ΔE*ab = [(ΔL*)2 + (Δa*)2 + (Δb*)2] 1/2
得た色差ΔE*abは、各群のmean±S.D.としてグラフ表記した(図1)。
【0038】
色差に関して、コントロール食群における紫外線照射後の色差の変遷は照射6h後で最大の色差を示し、18h後では色差が収束した。今回の試験条件(紫外線照射条件)により、1回の紫外線照射による色差の増加と収束が確認できた。
紫外線未照射群2群間では、コントロール食群と1%リンゴポリフェノール混餌群間では有意な差が無かった。
紫外線照射1h後の2群間では、コントロール食群と1%リンゴポリフェノール混餌群間および1%リンゴポリフェノール混餌群で有意な差が検出された(リンゴポリフェノール混餌群の色差が抑制されていた)。
紫外線照射6h後の2群間では、コントロール食群と1%リンゴポリフェノール混餌群間で有意な差としてリンゴポリフェノール混餌群の色差が抑制されていた。
紫外線照射18h後の2群間では、コントロール食群と1%リンゴポリフェノール混餌群間で有意な差としてリンゴポリフェノール混餌群の色差が抑制されていた。
以上の結果から、リンゴポリフェノールは紫外線照射ダメージを初期・中期・後期において抑制していた。
【0039】
図2には皮膚組織アポトーシス陽性細胞数をカウントした結果を示した。その結果、紫外線照射1h、6hおよび18h後解剖のコントロール食群においてはいずれもアポトーシスが誘導されていた。
紫外線未照射群2群間では、コントロール食群と1%AP混餌群間では有意な差が無かった。
紫外線照射1h後の2群間では、コントロール食群と1%AP混餌群間および1%AP混餌群と1%SB混餌群間で有意な差としてAP混餌群におけるアポトーシス抑制が確認された。
紫外線照射6h後の2群間では、コントロール食群と1%AP混餌群間およびコントロール食群との間で有意にアポトーシス抑制が確認された。
紫外線照射18h後の2群間では、コントロール食群と1%AP混餌群間で有意な差としてAP混餌群のアポトーシス抑制が確認されていた。
以上の結果から、リンゴポリフェノールは紫外線照射惹起性の皮膚アポトーシスを抑制することが明らかになった。
【技術分野】
【0001】
本発明は、紫外線誘発性紅斑の発生を予防する剤に関する。
【背景技術】
【0002】
近年、紫外線の皮膚に及ぼす影響や、その作用機構が研究され、従来問題としなかったレベルの紫外線であっても長期的に暴露すると影響が生体に及ぶことが明らかとなってきた。
【0003】
通常、地表に達する太陽放射は、紫外線(UV)(λ<400nm)、可視光線(400nm<λ<700nm)および赤外線(IR)(λ>700nm)で構成されている。UV放射は通常、UVA(320〜400nm)、UVB(290〜320nm)、UVC(<290nm)に分けられる。UVC放射は成層圏のオゾンによって遮断され、地表には届かない。一般に、太陽光線の紫外線(UV)成分、特にUVBがいわゆる日焼けの主な原因であると考えられている。
【0004】
UV照射による皮膚の日焼けには2種類あり、サンバーンは暴露の数時間から始まり、12〜24時間後に皮膚に発赤、腫脹、水疱の形成が認められる状態を指す。その後消退し、色素沈着が起きる、これがサンタンである。
肌色を4段階(I−IV)に分けると日本人の皮膚は色白のタイプI−色黒のタイプIIIに分けられる。非特許文献1(小林静子、薬学雑誌、Vol.126、677−693,2006)では、平均的なタイプIIの人が真夏の東京湾で約20分日光浴すると12−24時間後にうっすら赤くなった状態のサンバーンを紅斑と呼んでいる。
【0005】
このヒトの皮膚に紅斑(一般にサンバーンとして見られる赤味)を発生させるのに必要な量は周知であり、特定のUV源からの「最小紅斑量(MED)」として経験的に定量化されている。紅斑誘発性が最も高いのはUVB波長290〜300nmである。UV波長が約300nmよりも長くなるとUV放射による紅斑発生率は急激に落ちる。波長320nmおよび340nmで皮膚の赤味が生じる可能性はそれぞれ、波長約298nmの場合の100分の1および1000分の1である。それにもかかわらず、紅斑や皮膚の変色(tanning)を引き起こすレベルで太陽光線に繰り返し曝露されることと光老化との間には、関連性があるのが普通である。UVBによる紅斑は被曝強度ではなく全被曝量の関数になると考えられている(非特許文献2:Physiology,Biochemistry,and Molecular Biology of the Skin(皮膚の生理学、生化学、分子生物学)、第2版、L.A.Goldsmith編(New York:オックスフォード大学出版、1991))によれば、UVAはメラニン形成誘発性かつ紅斑誘発性であり、UVAに曝露されると、ヒトの皮膚で32kDaのストレスタンパク質(ヘムオキシゲナーゼ)の合成が誘発されるだけでなく、UVB曝露後には見られなかった「即時」紅斑が発生する。
【0006】
ヒトの皮膚の光老化は、臨床的には肌荒れ、シワ、まだらな色素沈着、黄ばみ、たるみ、さらには前ガン性腫瘍、最終的には悪性腫瘍となる症状によって特定される。光老化は一般に、顔、耳、頭皮のはげた部分、首、前腕、手など日常的に太陽光線に曝露される皮膚に発生する。
皮膚の太陽光線に曝露される部分の光老化の防止には、一般にサンスクリーン剤が用いられる。サンスクリーン剤は、UV光を吸収、反射および/または散乱させる成分を含有する局所製剤である。上述したように、一般に認められている皮膚に対する光損傷の病因には、紅斑(サンバーンまたは赤味すなわち、文字通りの意味で皮膚の紅潮)を引き起こすのに十分な太陽光線への曝露が関与しており、十分なUVB暴露が紅斑を引き起こすことが知られている。
【0007】
従って、光老化を抑制するためにはUVBを遮断または吸収する化合物を使用することが一般的に考えられ、実行されてきた。このような剤はもっぱら外用剤として使用し効果を示すもので、経口投与によって効果を示すものはまだ提供されていない。
さらにまた、この技術思想を一歩進めて、特許文献1:特開2009−108019号公報にはチオクト酸とキチンを含有する剤をUVBに対する皮膚の抵抗力を高めるために使用することが開示されている。また特許文献2:特表2001−520677号公報には皮膚の光老化を抑制するためにマトリックスメタルプロテナーゼ(MMP)阻害剤とUVA、UVB遮断剤を皮膚に塗布する方法が提案されている。これまで市場に提供されているものは、外用剤としての遮断剤が殆どである。
【0008】
また、近年の研究では、上記の紫外線による紅斑の発生に先立って、皮膚細胞のアポトーシスが誘導され、その結果として炎症や紅斑が発生することが明らかとなった(非特許文献3:森田明理、日皮会誌、Vol.118,PP1683−1689,2008)。たとえばアルビノのヘアレスマウスを用いた試験によってMED照射の影響が検討されている(非特許文献4:Cancer Epidemiol Biomarkers Prev. 14(5):1344-1349., 2005年)。このようなアポトーシスの発生を抑制することでサンバーンによる皮膚紅斑を抑制することが期待される。
【0009】
また、本発明者は、本発明に係るリンゴ抽出物の研究開発を行っている。とくにリンゴ抽出物に含有されているポリフェノールが活性酸素による酸化が原因の皮膚老化全般に対して予防効果を有することを見出して特許出願を行っている(特許文献4:特開2011−51967号公報参照)。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開2009−108019号公報
【特許文献2】特表2001−520677号公報
【特許文献3】特開2011−51967号公報
【非特許文献】
【0011】
【非特許文献1】小林静子、薬学雑誌、Vol.126、677−693,2006
【非特許文献2】Physiology,Biochemistry,and Molecular Biology of the Skin(皮膚の生理学、生化学、分子生物学)、第2版、L.A.Goldsmith編(New York:オックスフォード大学出版、1991)
【非特許文献3】森田明理、日皮会誌、Vol.118,PP1683−1689,2008
【非特許文献4】Cancer EpidemiolBiomarkers Prev. 14(5):1344-1349., 2005年)
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明は、紫外線によって発生する皮膚細胞のアポトーシス発生を予防する剤を提供することを課題とする。また本発明は紫外線によって引き起こされる皮膚紅斑の発生を予防する剤を提供することを課題とする。
【課題を解決するための手段】
【0013】
本発明者らはリンゴ抽出物に着目して試験した結果、リンゴポリフェノールに紫外線によって引き起こされるアポトーシス発生抑制作用があることを知見したことに基づき、本発明を提案する。
【0014】
すなわち、本発明は、
(1)リンゴ抽出物を有効成分とする紫外線誘発性紅斑予防用剤。
(2)紫外線誘発性紅斑が紫外線誘発性アポトーシスによるものである(1)記載の剤。(3)リンゴ抽出物が、リンゴ由来のポリフェノールを含むものである(1)又は(2)に記載の剤。
(4)経口剤である(1)〜(3)のいずれかに記載の剤。
【発明の効果】
【0015】
本発明は、紫外線によって誘発される皮膚細胞のアポトーシスを予防し、さらに紅斑の発生を予防することができる。
【図面の簡単な説明】
【0016】
【図1】紫外線B波誘発紅斑の発生と本発明の予防効果を示すグラフ
【図2】紫外線B波誘発アポトーシスの発生と本発明の予防効果を示すグラフ
【発明を実施するための形態】
【0017】
本発明の紫外線誘発性紅斑予防用剤は、リンゴ抽出物を有効成分とし、前記リンゴ抽出物が、リンゴ果実の抽出物であることが好ましい。
【0018】
リンゴ抽出物には、ポリフェノール、有機酸、アミノ酸などが含まれることが知られている。リンゴ抽出物は、血管機能改善作用を高めることが可能なBNP調節剤として該抽出物を有効成分として含有してなるBNP調節剤、血行促進剤(特開2007−008837号公報、特開2006−265220号公報)や飲料(特開2004−305087号公報)、化粧料配合剤(特開2001−187724号公報)、消臭剤成分(特開平11−319051号公報)、香料成分(特開平08−023939号公報)などに用いられることが知られている。しかしリンゴ抽出物およびリンゴ由来のポリフェノールについて、紫外線誘発アポトーシス抑制作用及び紫外線誘発性皮膚紅斑の予防作用があることは知られていない。
【0019】
以下に、本発明の紫外線誘発性紅斑予防用剤について、詳細に説明する。
本発明の剤はリンゴ抽出物を有効成分とすることを特徴とする。
【0020】
リンゴ抽出物は、例えば、市販のリンゴ抽出物を用いても良く、リンゴ果実から抽出して調製しても良く、特に制限されない。本発明の剤中に含まれるリンゴ抽出物含量は、特に制限されないが、例えば、0.001〜99重量%、好ましくは、0.001〜5重量%である。リンゴ由来のポリフェノールを含むリンゴ抽出物が好ましい。
【0021】
リンゴ由来のポリフェノールの分画方法は、従来公知の方法を採用できる。ポリフェノールは、リンゴ抽出物をカラムに通液後、カラムの吸着物を溶出し、この溶出画分を減圧留去濃縮して分画しても良い。また、さらに、この濃縮液に粉末助剤を添加し、凍結乾燥または噴霧乾燥して、ポリフェノール粉末を調製しても良い。
ポリフェノールは、市販のリンゴ由来のポリフェノール含有物を用いても良く、リンゴ果実から抽出および分画して調製しても良い。本発明の剤中に含まれる前記ポリフェノール含量は、特に制限されないが、例えば、0.01〜99重量%、好ましくは、0.1〜50重量%である。
【0022】
リンゴ抽出物において、リンゴ(Malus pumila)の品種は、例えば、ふじ、国光、王林、紅玉、ジョナゴールド、デリシャス、さんさ、千秋などが挙げられ、特に制限されない。リンゴの抽出部位は、特に制限されず、例えば、果実、葉、幹、花などが挙げられ、好ましくは、果実である。前記果実は、例えば、未熟果(幼果)でも良く、完熟果でも良く、特に制限されない。抽出に用いる前記果実の部位は、特に制限されず、例えば、全果、果肉、果皮、種などが挙げられる。リンゴ抽出物は、これらの部位を、単独で、または2種以上組み合わせて抽出しても良い。特に好ましくはポリフェノール含量の高いリンゴの幼果が好ましい。
【0023】
リンゴ抽出物を得るための抽出方法は、特に制限されず、従来公知の方法を採用できる。抽出方法の具体例としては、例えば、以下のようであっても良い。まず、リンゴの全果を、水洗後、グラインダーなどにより粉砕する。この粉砕物を、ペクチナーゼ処理に供し、遠心分離後、抽出溶媒により分配ろ過して、リンゴ抽出物を調製しても良い。前記ペクチナーゼ処理としては、特に制限されないが、例えば、20〜60℃の温度条件化で、ペクチナーゼを10〜50ppm添加して行っても良い。抽出溶媒としては、特に制限されないが、例えば、ヘキサン、クロロホルムなどの有機溶媒が挙げられる。
【0024】
本発明において、リンゴ抽出物は、例えば、市販のリンゴ抽出物を用いても良く、リンゴ果実から抽出して調製しても良く、特に制限されない。本発明の実施にあたってはリンゴ由来のポリフェノールを高濃度に含むリンゴ抽出物が好ましい。
【0025】
リンゴ由来のポリフェノールの分画方法は、特に制限されず、従来公知の方法を採用できる。ポリフェノールは、例えば、リンゴ抽出物をカラムに通液後、カラムの吸着物を溶出し、この溶出画分を減圧留去濃縮して分画しても良い。また、さらに、この濃縮液に粉末助剤を添加し、凍結乾燥または噴霧乾燥して、ポリフェノール粉末を調製しても良い。
【0026】
本発明において、リンゴ由来のポリフェノールは、例えば、市販のリンゴ由来のポリフェノール含有物を用いても良く、リンゴ果実から抽出および分画して調製しても良く、特に制限されない。
【0027】
本発明の紫外線誘発性紅斑予防用剤はそのままあるいは、結着剤、賦型剤、滑沢剤など製剤用の添加剤とともに打錠して錠剤としてもよい。また造粒して顆粒剤、カプセル剤などの固型剤とすることもできる。あるいは甘味料や果汁などを配合して液剤とすることもできる。経口剤としての形態に特に制限はない。
【0028】
かくして得られた本発明の紫外線誘発性紅斑予防用剤は、あらかじめ経口で継続的に摂取しておくことで紫外線暴露により発生する皮膚細胞のアポトーシスの発生を予防することで、皮膚の紅斑発生を予防し、長期的には皮膚の光老化を予防することができる。
以下実施例を示し本発明をさらに説明する。
【実施例】
【0029】
1.紫外線照射に紅斑の誘発予防試験・アポトーシス予防試験
ヘアレスマウスにリンゴ抽出物を3週間摂取させ、その後、一定の紫外線B波を照射した時の紫外線障害(日焼け)の程度を色彩色差計で算出した色差ΔE*ab値を指標で評価し紫外線誘発性紅斑の予防効果の評価を行った。
【0030】
(1)実験動物および紫外線照射条件の設定
試験動物
ヘアレスマウスHos:HR-1(メス)を用いた。このマウスはアルビノ(c/c)種であり、メラニン色素を有しない。Hos:HR-1は実験科学上、多く報告されている。紫外線照射による「メラニン形成・シミ形成・色素沈着形成」の試験系には用いる事が出来ず、シミ・美白・メラニンを評価する試験系とは明確に区別される。
【0031】
紫外線B波照射条件
紫外線B波照射量は180mJ/cm2(約3MED、1MED=最小紅斑量)で設定した。紫外線B波(中波長紫外線、UV‐Bと称される、波長領域は290−320nm)は紅斑(サンバーン)を引き起こす主要因である。
この紫外線照射量は、(Cancer Epidemiol Biomarkers Prev. 14(5):1344-1349., 2005年)に準拠した。ヘアレスマウスHos:HR-1に対する紫外線B波MED線量は、J DermatolSci. 2001年;27 Suppl 1:S19-25.に拠ると1MEDはUV‐B約55‐60mJ/cm2となる。よって180mJ/cm2の紫外線B波の線量はヘアレスマウスに対して約3MEDとなり、3MEDの線量は各マウス皮膚の紅斑・サンバーンを引き起こすに充分な線量である。
皮膚組織への紫外線B波照射の影響は表皮が主な到達部位であるが、真皮にも10%程度到達してDNA断片化およびDNA断片化を契機としてタンパク合成を必要とするアポトーシス(delayed apoptosis)を引き起こす(日皮会誌:118(9)1683−9、2008年、森田 明理 他)。すなわち、サンバーン細胞はUV‐BによってDNAが損傷を受けた皮膚細胞が、その損傷を修復できずに遺伝子の変異を回避するために自ら死んでいく(アポトーシス)。また、紫外線B波でサンバーン・日焼け・紅斑を引き起こす過程では皮膚上皮の毛細血管において炎症を惹起するプロスタグランジンの上昇も確認されており、サンバーン・日焼け・紅斑といった外観変化においては皮膚内部では炎症反応が惹起している(薬学雑誌:126(9)677−93、2006年、小林静子)。
よって、日焼け(サンバーン)という外観の変化において、皮膚組織のアポトーシス亢進が定義付けされているので、in situ hybridization法によるアポトーシスの検出を行った。
【0032】
試薬、材料
市販のリンゴ抽出物としてリンゴポリフェノール(AP)ポマクティブHFV(ユニテックフーズ社販売)を用いた。
色彩色差計CR-400(コニカミノルタ製)、デジタルカメラ IXY DIGITAL 930I(キャノン製)、紫外線照射ランプ FL20SE-30/DMR(クリニカル・サプライ製)を使用した。
【0033】
動物飼育
群設定(1群6匹)
群1.紫外線照射無し、コントロール食
群2.紫外線照射アリ、コントロール食 照射1h後に解剖
群3.紫外線照射アリ、コントロール食 照射6h後に解剖
群4.紫外線照射アリ、AP1%(w/w)混餌 照射1h後に解剖
群5.紫外線照射アリ、AP1%(w/w)混餌 照射6h後に解剖
群6.紫外線照射アリ、AP1%(w/w)混餌 照射18h後に解剖
群7.紫外線照射アリ、コントロール食(w/w)混餌 照射18h後に解剖
群8.紫外線照射無し、AP1%(w/w)混餌
種及び系統:マウス HR‐1(ヘアレスマウス)
供給源: 日本エスエルシー株式会社
静岡県浜松市西区湖東町3371番地の8
購入動物数、性別、入荷時週齢及び体重範囲
購入動物数 性別 入荷時週齢 体重範囲
60匹 ♀ 8週齢 16−21g
飼育経緯:動物入荷後21日間を混餌摂取期間とし、この間に一般状態の観察及び体重測定を行い、すべてのマウスを計画通りに11週齢時に紫外線照射などの試験に供した。異常が認められた個体は確認されなかった。
飼育室:条件
温度:(設定値)23℃、(許容範囲)21〜25℃
湿度:(設定値)55%、(許容範囲)40〜70%
照明:12時間(午前7時〜午後7時)
飼料:固形飼料AIN‐76A (オリエンタル酵母工業株式会社)の自由摂取
飲水:5μmカートリッジフィルターを通過させた水道水を給水瓶で与えた。
床敷: パルソフト(オリエンタル酵母株式会社)を高圧蒸気滅菌して使用した。
収容動物数: 最大 3匹/ケージ
【0034】
(2)解剖(紫外線照射、皮膚計測、生体試料回収)
上記の群設定に示した条件で飼育、紫外線照射を行った。
紫外線誘発紅斑抑制剤を含む試験試料の混餌は解剖直前まで行った、但し、紫外線B波照射の時間帯(約20分間)は絶食扱いとした。
紫外線照射直前にマウス背部皮膚の色差(ΔE*ab)および体重を測定した。
1回あたりの紫外線照射量はUV‐B波を180mJ/cm2(約3MED、1MED=最小紅斑量)、この紫外線照射量は、(Cancer Epidemiol Biomarkers Prev. 14(5):1344-1349., 2005年)に準拠した。
紫外線照射1時間後もしくは6時間後、18時間後に解剖を行った。
紫外線照射後のマウス背部皮膚の色差を測定した。
ジエチルエーテルを吸入法によって深麻酔を施し、麻酔下で背部皮膚の写真撮影を行った。その後、開腹し腹部大動脈もしくは心臓からの採血によって安楽死を施した。そして、血液は1時間〜4時間程度氷冷保存後に遠心分離して血漿を分画し冷凍保存した。堵殺後の個体から肝臓摘出と背部皮膚部の摘出を行った。肝臓は生理食塩水にて洗浄後、アルミ箔に包んで冷凍保存した。背部皮膚は中央部2片をバイオプシーパンチしメタカン(メタノール:クロロホルム:酢酸=6:3:1(v/v/v))固定後にパラフィン包埋とスライドガラスへの切り出し操作を行い、組織染色に供した。残りの背部皮膚はアルミ箔に包んで冷凍保存した。
【0035】
(3)皮膚アポトーシスのTUNEL法による染色
皮膚組織のアポトーシスは、市販のキット(DermaTACs In Situ Apoptosis Detection Kit、Trevigen製)を用いたTUNEL(TdT mediated dUTP nick end labeling)染色法により各群のアポトーシスを比較した。
定法により解剖後、パラフィン包埋、スライドガラスへの切り出し、脱パラフィン処理した皮膚切片に対して、PBS(−)洗浄後にプロテアーゼK(50倍希釈)を室温で30分処理し、酵素反応終了後に軽くプロテアーゼK溶液をスライドガラスから落とした後にCytoninTM溶液を30分室温で処理した。
脱イオン水で5分間2回洗浄後、内因性ペルオキシダーゼ阻害を目的として3%過酸化水素(溶媒:メタノール)を5分間処理した。
PBS(−)で1分間1回洗浄後、1×TdT labeling bufferで室温5分間処理した。
引き続き、Labeling Reaction Mix (B-dNTP MixおよびTdT Enzymeの1×TdT Labeling Buffer50倍希釈混合液)を滴下し、湿潤箱内にサンプルを移し、37℃30分間処理した。
反応終了後、1×TdT labeling bufferで室温5分間処理し、PBS(−)で2分間2回室温にて洗浄後、抗体溶液(Anti-BrdUのStrep-Diluent50倍希釈液)を滴下し、湿潤箱内にサンプルを移し、37℃30分間処理した。
反応終了後、PBST(Tween(R)20のPBS(−)2000倍希釈液)で2分間3回室温にて洗浄した。引き続き、Strep-HRP溶液(Strep-HRPのStrep-HRP Diluent 800倍希釈液)を10分間室温で反応させた。反応終了後、PBS(−)で2分間2回洗浄後、引き続き脱イオン水で1分間1回洗浄した。
呈色反応試薬であるTACS Blue LabelTM50μLを各スライドガラスに滴下し、5分間顕微鏡観察下で反応させた。反応終了後、脱イオン水で洗浄し、定法に従い、脱水、透徹、封入を行い、観察用標本を作製した。
光学顕微鏡による皮膚組織のアポトーシス検出と定量は、深さは皮膚上層50μm(角層、表皮層、真皮乳頭層から構成される部分)および任意の幅200μmの範囲10000μm2におけるTUNEL陽性細胞をカウントした。
【0036】
(4)統計処理
全8群について、「紫外線未照射2群」「紫外線照射1時間後(初期)解剖2群」「紫外線照射6時間後(中期)解剖2群」「紫外線照射18時間後(後記)2群」に分け、2群間の有意差検定はwelch’s t-testを用い、有意差検定した。
【0037】
(5)試験結果
体重
搬入時および解剖直前のマウス体重において、各群間に有意な差は確認されなかった。背部紅斑の色差測定
背部写真を一例として示す。コントロール食群では紫外線照射6時間後のマウスで赤味が増していた。
色差は、色彩色差計CR‐400(コニカミノルタ製)を用いて、紫外線照射前後それぞれにつき、ヘアレスマウス背部中央近傍のL*a*b*表色系で2回ずつ測定し、その2回の平均値から、同一個体の色差ΔE*abを算出した。
ΔE*ab = [(ΔL*)2 + (Δa*)2 + (Δb*)2] 1/2
得た色差ΔE*abは、各群のmean±S.D.としてグラフ表記した(図1)。
【0038】
色差に関して、コントロール食群における紫外線照射後の色差の変遷は照射6h後で最大の色差を示し、18h後では色差が収束した。今回の試験条件(紫外線照射条件)により、1回の紫外線照射による色差の増加と収束が確認できた。
紫外線未照射群2群間では、コントロール食群と1%リンゴポリフェノール混餌群間では有意な差が無かった。
紫外線照射1h後の2群間では、コントロール食群と1%リンゴポリフェノール混餌群間および1%リンゴポリフェノール混餌群で有意な差が検出された(リンゴポリフェノール混餌群の色差が抑制されていた)。
紫外線照射6h後の2群間では、コントロール食群と1%リンゴポリフェノール混餌群間で有意な差としてリンゴポリフェノール混餌群の色差が抑制されていた。
紫外線照射18h後の2群間では、コントロール食群と1%リンゴポリフェノール混餌群間で有意な差としてリンゴポリフェノール混餌群の色差が抑制されていた。
以上の結果から、リンゴポリフェノールは紫外線照射ダメージを初期・中期・後期において抑制していた。
【0039】
図2には皮膚組織アポトーシス陽性細胞数をカウントした結果を示した。その結果、紫外線照射1h、6hおよび18h後解剖のコントロール食群においてはいずれもアポトーシスが誘導されていた。
紫外線未照射群2群間では、コントロール食群と1%AP混餌群間では有意な差が無かった。
紫外線照射1h後の2群間では、コントロール食群と1%AP混餌群間および1%AP混餌群と1%SB混餌群間で有意な差としてAP混餌群におけるアポトーシス抑制が確認された。
紫外線照射6h後の2群間では、コントロール食群と1%AP混餌群間およびコントロール食群との間で有意にアポトーシス抑制が確認された。
紫外線照射18h後の2群間では、コントロール食群と1%AP混餌群間で有意な差としてAP混餌群のアポトーシス抑制が確認されていた。
以上の結果から、リンゴポリフェノールは紫外線照射惹起性の皮膚アポトーシスを抑制することが明らかになった。
【特許請求の範囲】
【請求項1】
リンゴ抽出物を有効成分とする紫外線誘発性紅斑予防剤。
【請求項2】
紫外線誘発性紅斑が紫外線誘発性アポトーシスによるものである請求項1記載の剤。
【請求項3】
リンゴ抽出物が、リンゴ由来のポリフェノールを含むものである、請求項1又は請求項2に記載の剤。
【請求項4】
経口剤である請求項1〜3のいずれかに記載の剤。
【請求項1】
リンゴ抽出物を有効成分とする紫外線誘発性紅斑予防剤。
【請求項2】
紫外線誘発性紅斑が紫外線誘発性アポトーシスによるものである請求項1記載の剤。
【請求項3】
リンゴ抽出物が、リンゴ由来のポリフェノールを含むものである、請求項1又は請求項2に記載の剤。
【請求項4】
経口剤である請求項1〜3のいずれかに記載の剤。
【図1】


【図2】




【図2】


【公開番号】特開2013−95704(P2013−95704A)
【公開日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願番号】特願2011−240152(P2011−240152)
【出願日】平成23年11月1日(2011.11.1)
【出願人】(593106918)株式会社ファンケル (310)
【Fターム(参考)】
【公開日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願日】平成23年11月1日(2011.11.1)
【出願人】(593106918)株式会社ファンケル (310)
【Fターム(参考)】
[ Back to top ]

