細孔を有する微生物セルロース粒子の製造方法
【課題】 クロマトグラフィー用分離材として使用可能な微生物セルロース粒子の製造方法、及び前記製造方法により得られたクロマトグラフィー用分離材を提供すること。
【解決手段】 微生物セルロースをアルカリ水溶液に溶解させる工程、前記溶解液に分散溶媒を添加後微生物セルロースを粒子化する工程、粒子化した微生物セルロースを冷却した凍結溶媒に添加し微生物セルロース粒子を凍結させる工程、及び凍結した微生物セルロース粒子を洗浄溶媒で洗浄する工程からなる微生物セルロース粒子の製造方法、並びに前記製造方法により得られたセルロース粒子により、前記課題を解決することができた。
【解決手段】 微生物セルロースをアルカリ水溶液に溶解させる工程、前記溶解液に分散溶媒を添加後微生物セルロースを粒子化する工程、粒子化した微生物セルロースを冷却した凍結溶媒に添加し微生物セルロース粒子を凍結させる工程、及び凍結した微生物セルロース粒子を洗浄溶媒で洗浄する工程からなる微生物セルロース粒子の製造方法、並びに前記製造方法により得られたセルロース粒子により、前記課題を解決することができた。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、医薬品、化成品、食品等あらゆる産業分野における特定成分の分離・精製工程に用いるクロマトグラフィー用分離材として利用可能な、微生物セルロース粒子の製造方法に関する。
【背景技術】
【0002】
化合物の分離、精製の手段として各種クロマトグラフィーが利用されている。このうち、薄層クロマトグラフィー、ペーパークロマトグラフィー、液体クロマトグラフィー及び電気泳動等におけるセルロース系分離材の原料としては、従来より植物由来のセルロース(植物セルロース)が用いられている。しかしながら、植物セルロースを原料としたクロマトグラフィー用分離材は、安価で取扱いやすい長所がある反面、分離能が必ずしも満足できるものではなかった。
【0003】
一方、微生物由来のセルロース(微生物セルロース)は植物セルロースと比較し微細な繊維構造を有しているため、微生物セルロースを原料としたクロマトグラフィー用分離材は植物セルロースを原料とした分離材と比較し、高い分離能が見込まれる。微生物セルロース粒子の製造方法としては、微生物セルロースのシート製造に使用可能な直径1から2mm程度のセルロース粒子の製造方法が開示されている(特許文献1)。しかしながら、特許文献1で開示の製造方法はクロマトグラフィーの性能を左右する細孔付与が困難であり、かつ特許文献1で得られた粒子は不定形かつ粒径も大きいため、クロマトグラフィー用分離材としては必ずしも適切ではなかった。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2004−270064号公報
【特許文献2】特開昭64−43530号公報
【特許文献3】特公平7−62041号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
クロマトグラフィー用分離材として使用可能な、細孔を有する球状セルロース粒子の製造法としては、セルロースのアルカリ溶液を凝固点以下の有機溶媒中に滴下して、凍結した粒子を硫酸で中和し、精製水で洗浄、乾燥することによるセルロース粒子製造方法(特許文献2及び3)が知られている。そして、特許文献2ではセルロース原料として、植物セルロース及び微生物セルロースを例示している。しかしながら、特許文献2に従い、微生物セルロース粒子の調製を試みたところ、シリコンオイル中に生成した凍結セルロース粒子が硫酸中和の際に溶解したため、最終的にセルロース粒子を得ることはできなかった。
【0006】
そこで、本発明の目的は、クロマトグラフィー用分離材として使用可能な微生物セルロース粒子の製造方法、及び前記製造方法により得られたクロマトグラフィー用分離材を提供することである。
【課題を解決するための手段】
【0007】
本発明者らは前記の課題を解決すべく鋭意検討した結果、微生物セルロースのアルカリ水溶液に分散溶媒を添加後、所望の大きさのセルロース粒子を調製し、次いで冷却した凍結溶媒に添加してセルロース粒子を凍結後、凍結粒子を洗浄除去することによってクロマトグラフィー用分離材として使用可能なセルロース粒子を調製できることを見出し、本発明を完成するに至った。
【0008】
第一の発明は、
(1)微生物セルロースをアルカリ水溶液に溶解させる工程、
(2)(1)の溶解液に分散溶媒を添加後、微生物セルロースを粒子化する工程、
(3)粒子化した微生物セルロースを冷却した凍結溶媒に添加し、微生物セルロース粒子を凍結させる工程、
(4)凍結した微生物セルロース粒子を洗浄溶媒で洗浄する工程、
からなる微生物セルロース粒子の製造方法である。
【0009】
第二の発明は、冷却した凍結溶媒の液温、及び(4)の工程を−20℃以下で行なう、第一の発明に記載の製造方法である。
【0010】
第三の発明は、微生物セルロースの重合度が200から1000である、第一または第二の発明に記載の製造方法である。
【0011】
第四の発明は、アルカリ水溶液が濃度3から20重量%のアルカリ金属水酸化物水溶液である、第一から第三のいずれかの発明に記載の製造方法である。
【0012】
第五の発明は、前記(1)の溶解液中に含まれる微生物セルロース濃度が、1から10重量%である、第一から第四のいずれかの発明に記載の製造方法である。
【0013】
第六の発明は、分散溶媒が、凝固点−20℃(1気圧)以下であり、−20℃以下における密度が1.1g/cm3以下の有機溶媒であり、かつ水に対する溶解度が0.1から10g/L(25℃)の有機溶媒である、第二から第五のいずれかの発明に記載の製造方法である。
【0014】
第七の発明は、凍結溶媒が、凝固点−20℃(1気圧)以下であり、かつ−20℃以下における密度が1.1g/cm3以下の有機溶媒である、第二から第五のいずれかの発明に記載の製造方法である。
【0015】
第八の発明は、洗浄溶媒が、凝固点−20℃(1気圧)以下であり、かつ−20℃以下における密度が1.1g/cm3以下の有機溶媒である、第二から第五のいずれかの発明に記載の製造方法である。
【0016】
第九の発明は、
(1)微生物セルロースをアルカリ水溶液に溶解させる工程、
(2)(1)の溶解液に分散溶媒を添加後、微生物セルロースを粒子化する工程、
(3)粒子化した微生物セルロースを冷却した凍結溶媒に添加し、微生物セルロース粒子を凍結させる工程、
(4)凍結した微生物セルロース粒子を洗浄溶媒で洗浄する工程、
より得られる微生物セルロース粒子である。
【0017】
以下、本発明をさらに詳細に説明する。
【0018】
本発明の原料として使用される微生物セルロースは微生物が産生するセルロースであれば特に制限はない。一例として、アセトバクター・キシリナム、アセトバクター・パスツリアヌス、サルシナ・ベントリクリ、バクテリウム・キシロイデス、シュードモナス属細菌、アグロバクテリウム属細菌、リゾビウム属細菌、藻類、カビ等が産生するセルロースがあげられる。
【0019】
微生物セルロースを培養生産するためには、前記微生物を用いて、通常の細菌を培養する一般的な方法に従えばよい。すなわち、炭素源、窒素源、無機塩類、その他の必要に応じて、アミノ酸、ビタミン等の有機微量栄養素を含有する通常の栄養培地に接種し、20から40℃の温度で1日から3ヶ月間培養を行なうことで、効率よく微生物セルロースを産生させることができる。静置培養の場合は、培養液表面に膜状の微生物セルロースが産生される。また振盪培養の場合は、パルプ状、フロック状、ペレット状、球状等様々な形状のセルロースが産生される。
【0020】
前記方法で生産した微生物セルロースは、液体成分とともに菌体と培地成分が含まれるが、希アルカリ、希酸、有機酸、熱水、界面活性剤等を単独または組み合わせて洗浄を行なうことで微生物セルロースを精製することができる。前記微生物セルロースの重合度は、大きすぎると粒子の製造に必要なアルカリ水溶液への溶解ができなくなり好ましくない。また、粒子の粒度分布を揃えるためにも、重合度が適切な範囲内に揃った微生物セルロースを原料に用いるのが好ましい。微生物セルロースの重合度は酸分解における酸の濃度、温度、時間により適宜調節することができる。具体的方法として1から10%塩酸に懸濁後、80から110℃で、10から60分間加熱する方法が例示できる。本発明の製造方法においては、重合度200から1000の微生物セルロースが好ましい。
【0021】
本発明の製造方法は、工程1:微生物セルロースの溶解、工程2:粒子化、工程3:凍結粒子の生成、工程4:凍結粒子の洗浄、の4つの工程からなる。以下、各工程毎に詳細に説明する。
【0022】
工程1:微生物セルロースの溶解
工程1は、所望の重合度を有する微生物セルロースをアルカリ水溶液に溶解させる工程である。
【0023】
工程1で用いるアルカリ水溶液としては、水酸化ナトリウムや水酸化カリウム等のアルカリ金属水酸化物の水溶液が好ましく、安価な点で水酸化ナトリウム水溶液が特に好ましい。アルカリ水溶液の濃度は微生物セルロースを十分溶解できる濃度であればよいが、好ましくは3から20重量%、より好ましくは5から10重量%である。アルカリ水溶液中に溶解させる微生物セルロースの濃度は、工程2において粒子化したセルロースの再結合を防げる範囲であればよいが、好ましくは1から10重量%、より好ましくは3から8重量%程度の希薄溶液である。微生物セルロースをアルカリ水溶液に懸濁させることで溶解した液は、−80から−10℃で凍結した後、室温に戻すことによって均質化し、工程2へ進む。
【0024】
工程2:粒子化
工程2は、微生物セルロースを溶解したアルカリ水溶液に分散溶媒を添加後、粒子化させる工程である。
【0025】
分散溶媒としては、微生物セルロースを含むアルカリ水溶液と均一に混合しない疎水性の有機溶媒が好ましく、水に対する溶解度が0.1から10g/L(25℃)の有機溶媒が特に好ましい。また工程3で生成する凍結粒子の再結合を抑制しやすい点で、分散溶媒の密度は1.1g/cm3以下が好ましい。さらに分散溶媒は、工程3で冷却した凍結溶媒に添加するため、前記凍結溶媒の液温で凝固しない有機溶媒であることが必要である。例えば、工程3で−20℃の凍結溶媒を添加する場合は、−20℃で凝固しない有機溶媒であればよい。
【0026】
工程3で−20℃の凍結溶媒に添加する場合の好ましい分散溶媒としては、凝固点が−20℃(1気圧)以下であって、−20℃以下における密度が1.1g/cm3以下、かつ水に対する溶解度が0.1から10g/L(25℃)の物性を有する有機溶媒である。具体的には、ペンタン、ヘキサン、デカン等の炭素数5から10の直鎖、分岐または環状の炭化水素系溶媒、アニソール、エチルトルエン、クロロベンゼン等の置換されていてもよい炭素数6から10の芳香族炭化水素系溶媒、ジペンチルエーテル等のエーテル系溶媒、オクタン酸エチル、酢酸ベンジル、ヘキサン酸エチル、ヘプタン酸エチル等のエステル系溶媒、塩化ブチル、クロロホルム等のハロゲン系溶媒、ジメチルヘプタノン、メチルシクロヘキサノン、メチルヘプテノン等のケトン系溶媒、ノナノール等のアルコール系溶媒、ヘキサンニトリル等のニトリル系溶媒等を例示することができる。前記例示した溶媒の中でも、微生物セルロースを含むアルカリ水溶液の分散性がよい点で、酢酸ベンジル、プロピオン酸エチル、ヘキサン酸エチル、酢酸ヘキシル等のエステル系溶媒が好ましく、入手が容易かつ安全性の高い酢酸ベンジルや酢酸ヘキシルが特に好ましい。
【0027】
分散溶媒の使用量に特に制限はないが、生成する粒子の再結合を抑制しやすい点で、微生物セルロースを溶解したアルカリ水溶液の5から50倍容量用いるのが好ましい。
【0028】
工程2では、工程1で得られた微生物セルロースを溶解したアルカリ水溶液に分散溶媒を添加後、微生物セルロース繊維をせん断することで粒子化する。微生物セルロース繊維のせん断方法としては、均一な粒子を簡便に生成可能な、撹拌による方法が好ましい。なお、撹拌により微生物セルロース繊維をせん断し粒子化させる際は、可能な限り粒径が均一な粒子を生成させるために、適切な撹拌操作が必要である。撹拌方法に特に制限はなく、撹拌翼を取付けた撹拌機による撹拌、試験管ミキサーのような回転振盪機による撹拌、レシプロシェーカーなどの直線運動による撹拌、またはこれらを組み合わせた撹拌が例示できる。撹拌速度も特に制限はなく、例えば回転式撹拌機による撹拌の場合、反応容器や撹拌翼の形状やサイズによっても異なるが、毎分100から1000回転程度の撹拌速度で撹拌することが、また直線運動型の振盪撹拌機による撹拌の場合、毎分100から300回程度の振盪速度で撹拌することが、均一な粒子を生成できる点で好ましい。
【0029】
工程3:凍結粒子の生成
工程3は、工程2で得られた、アルカリ水溶液を含む微生物セルロース粒子が分散溶媒中に分散した状態の懸濁液を、あらかじめ冷却した凍結溶媒中に撹拌しながら加えることにより、前記懸濁液中の微生物セルロース粒子を短時間に凍結させて、凍結粒子を生成させる工程である。
【0030】
工程3で添加する凍結溶媒の液温は−20℃以下が好ましいため、凍結溶媒としては前記温度で凝固しない有機溶媒であることが好ましい。また分散溶媒と同様、生成した凍結粒子の再結合を抑制しやすい点で、前記温度での密度が1.1g/cm3以下の物性を有する有機溶媒が好ましい。凍結溶媒として好ましい態様は、凝固点が−20℃(1気圧)以下、−20℃以下での密度が1.1g/cm3以下、かつ分散溶媒と均一に混合できる有機溶媒である。具体的には、シクロペンタン、ヘキサンデカン等の炭素数5から10の直鎖、分岐または環状の炭化水素系溶媒、ジメトキシベンゼン、トルエン、ブチルベンゼン、メシチレン等の置換されていてもよい芳香族炭化水素系溶媒、ジブチルエーテル、ジプロピルエーテル、ジペンチルエーテル等のエーテル系溶媒、アジピン酸ジブチルノナン酸エチル、プロピオン酸メチル、ヘキサン酸エチル、マロン酸ジエチル、酪酸エチル、酪酸ブチル等のエステル系溶媒、塩化イソペンチル等のハロゲン系溶媒、シクロヘキサノン、シクロペンタノン等のケトン系溶媒、メタノール、ノナノール、フェネトール等のアルコール系溶媒等を例示することができる。前記例示した溶媒の中でも、凍結粒子の分散性がよい点で、炭素数5から10の直鎖、分岐または環状の炭化水素系溶媒、炭素数3から10のエステル系溶媒及びケトン系溶媒、炭素数1から4のアルコール系溶媒が好ましく、入手が容易かつ安全性の高いヘキサンやメタノール等の溶媒が特に好ましい。凍結溶媒の使用量に特に制限はないが、生成した粒子の再結合を抑制しやすい点で、アルカリ水溶液を含む微生物セルロース粒子の懸濁液量に対して2から10倍容量用いることが好ましい。なお、工程3において、あらかじめ−140℃から−30℃に冷却した凍結溶媒を用いると、凍結粒子を等方的に析出させることができる点でより好ましい。
【0031】
前記方法で得られた微生物セルロース凍結粒子は、粒子内部に凍結したアルカリ水溶液を含む。前記アルカリ水溶液は、工程4の操作で除去することにより、得られた微生物セルロース粒子に細孔を施すことができる。凍結粒子中にある凍結したアルカリ水溶液の占有体積は、工程1におけるアルカリ水溶液に溶解させる微生物セルロース濃度を調節することにより容易に制御することが可能なため、前記操作により微生物セルロース粒子中の細孔体積を制御することができる。
【0032】
工程4:凍結粒子の洗浄
工程4は、工程3で調製した微生物セルロース凍結粒子を洗浄することで、内部に細孔を有した微生物セルロース粒子を製造する工程である。具体的には、低温下で、工程3の凍結粒子を含んだ溶液からデカンテーション等の操作により、溶媒を除去して凍結粒子を得た後、あらかじめ低温に冷却した洗浄溶媒を用いて凍結粒子を洗浄することで、内部に細孔を有した微生物セルロース粒子を得ることができる。工程4を実施する温度は、粒子の再結合を抑制できる点で、−20℃以下の低温下で実施するのが好ましい。
【0033】
工程4で用いる洗浄溶媒は、工程4を実施する温度で凝固しない溶媒であることが必要である。また分散溶媒及び凍結溶媒と同様、凍結粒子の再結合を抑制しやすい点で、前記温度での密度が1.1g/cm3以下の物性を有する有機溶媒が好ましい。さらに、洗浄溶媒の目的が凍結したアルカリ水溶液の除去であることから、極性の高い溶媒が好ましい。好ましい洗浄溶媒の具体例として、エチレングリコール、ジメチルエーテル、ジエチルエーテル、ジオキサン、テトラヒドロピラン、テトラヒドロフラン等のエーテル系溶媒、ギ酸プロピル、ギ酸メチル、プロピオン酸エチル等のエステル系溶媒、アセトン等のケトン系溶媒、メタノール、エタノール、ペンタノール等のアルコール系溶媒があげられる。また、これらの溶媒と水との混合溶媒を洗浄用溶媒として使用することができるが、工程4を実施する温度で凝固しない混合比で用いることが必要である。前記例示した溶媒の中でも、凍結したアルカリ水溶液の洗浄能力の高いアルコール系溶媒、またはアルコール系溶媒と水との混合溶媒が好ましく、メタノールやエタノール等の汎用溶媒が特に好ましい。
【0034】
洗浄溶媒の使用量や洗浄回数に特に制限はなく、1から5回洗浄操作を繰り返すことにより、凍結粒子中のアルカリ水溶液を除去することができる。洗浄操作後は、室温に戻して洗浄用溶媒で洗浄することにより、ほぼ完全にアルカリ水溶液を除去することができる。
【0035】
本発明の製造方法によって得られた内部に細孔を有した微生物セルロース粒子は、通常の処理により様々な形状の担体に変換することができる。例えば、得られた微生物セルロースを離解してスラリー状にした後、ガラス板に引き延ばすことで薄層クロマトグラフィー用プレートを作製することができるし、離解物を抄紙してペーパークロマトグラフィーを行なうこともできる。特に本発明の製造方法によって得られた微生物セルロース粒子は、カラムクロマトグラフィー用分離材として好ましい。カラムクロマトグラフィーの種類としては特に限定はなく、粒子表面に種々の吸着基を結合させたイオン交換クロマトグラフィー、疎水性相互作用クロマトグラフィー、アフィニティークロマトグラフィーを例示することができる。また、表面処理をしないゲルろ過クロマトグラフィーに対しても本発明の微生物セルロース粒子が適用可能である。本発明の微生物セルロース粒子をカラムクロマトグラフィー用分離材として使用するには、工程4でペレット状に生産された微生物セルロース粒子を篩にかけて適当な粒径に揃えた後、適切なカラムに詰めればよい。この際、微生物セルロース粒子にアセチル基やメチル基を修飾させることもできるし、エチルアミノエチル基やカルボキシメチル基等のイオン交換基を修飾させてイオン交換体クロマトグラフィー用充填材とすることもできる。
【0036】
本発明のセルロース粒子を用いたクロマトグラフィー用分離材で分離される化合物としては従来の植物セルロース由来の分離材で分離され得る化合物であれば限定はなく、単糖、少糖、多糖、アミノ酸、ペプチド、タンパク質、有機酸、アミン類、アルコール類、ビタミン類、アルカロイド、核酸、リン酸エステル、脂質等を例示できる。
【発明の効果】
【0037】
本発明の製造方法により、クロマトグラフィー用分離材として使用可能な、所望の細孔構造を有した微生物セルロース粒子を、簡便に製造することができる。また、微生物セルロースは植物セルロースと比較し微細な繊維構造を有しているため、本発明の製造方法により得られた微生物セルロース粒子を、クロマトグラフィー用分離材に適用することで、植物セルロースを用いた分離材と比較し、高い分離能を有した分離材を提供することができる。
【図面の簡単な説明】
【0038】
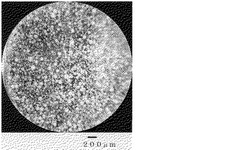
【図1】凍結溶媒としてn−ヘキサンを用いて調製した微生物セルロース粒子の実体顕微鏡写真。
【図2】凍結溶媒としてメタノールを用いて調製した微生物セルロース粒子の実体顕微鏡写真。
【実施例】
【0039】
以下に実施例をあげて本発明を説明するが、本発明はこれにより限定されるものではない。
【0040】
実施例1 微生物セルロースの調製
下記に示す方法により、微生物セルロースを調製した。
(1)三角フラスコに表1に示す培地を入れ、Gluconacetobacter xylinus(NBRC 13693)を植菌し、30℃で静置培養を行なった。
【0041】
【表1】

(2)培養3週間後に産生した微生物セルロースを培養液から取り出し、ミキサーで粉砕した。
(3)(2)の粉砕物をリゾチーム溶液(2mg/mL)に懸濁して30℃で24時間振盪した後、再度ミキサーで粉砕した。
(4)(3)の粉砕したセルロースを1M水酸化ナトリウム水溶液に懸濁して80℃で1時間加熱した。処理後のセルロースは濾別し、精製水で洗浄後、凍結乾燥した。
(5)(4)の凍結乾燥セルロースを10%塩酸に懸濁して105℃で30分間加熱した。処理後のセルロースは濾別し、精製水で洗浄後、凍結乾燥した。
【0042】
(1)から(5)の操作で得られた凍結乾燥セルロース(40mg)を、4mLの1Mの銅エチレンジアミンに溶解し、同量の精製水を添加することで、0.5%のセルロースを含む0.5M銅エチレンジアミン溶液を調製した。さらに、前記溶液の一部に0.5M銅エチレンジアミン溶液を加えることで、希釈溶液を作製した。キャノンフェンスケ粘度計を用いて前記希釈溶液の流下時間を測定し、相対粘度、還元粘度及び固有粘度を計算した後、下記のMark−Houwink式から重合度を算出した。同じ操作を2度繰り返した結果、重合度は280から360であった。
【0043】
η=1.67×DP0.71(η:固有粘度、DP:重合度)
実施例2 微生物セルロース粒子の調製(その1)
実施例1で得られた微生物セルロースより粒子体を調製した。
(1)実施例1で得られた微生物セルロースを5重量%になるように8重量%水酸化ナトリウム水溶液に懸濁し、前記懸濁液を−20℃に凍結した後、室温に戻すことで均一のセルロース溶液を得た。
(2)(1)のセルロース溶液(1mL)に酢酸ベンジル(20mL)を加えた後、回転振盪機と垂直振盪機でそれぞれ30秒間撹拌することで、水酸化ナトリウム水溶液を含むセルロース粒子の懸濁液を調製した。
(3)(2)の懸濁液を−50℃に冷却したn−ヘキサン(100mL)に添加し、粒子を凍結させた。凍結粒子を沈降させた後、溶媒をデカンテーションで除去した。
(4)溶媒を除去した凍結粒子に−50℃に冷却したメタノール(100mL)を加え、凍結粒子を沈降させた後、メタノールをデカンテーション操作により除去し、凍結粒子を洗浄した。この洗浄操作は合わせて3回繰り返した。
(5)得られた粒子を常温に戻し、更にメタノール(100mL)で3回洗浄することにより、微生物セルロース粒子を得た。
【0044】
得られた粒子の大きさを実体顕微鏡を用いて測定したところ、粒子の直径は10から150μmであることを確認した(図1)。
【0045】
実施例3 分離性能評価
実施例2で得られたセルロース粒子の分離性能評価を液体クロマトグラフィーを用いて行なった。
【0046】
実施例2で調製した微生物セルロース粒子を、内径6.6mm、長さ220mmのカラムに充填し、50mMトリス塩酸/100mM塩化カリウム(pH7.5)からなる溶出液を0.3mL/minの流速で流し、チトクロムC(分子量12400)、アミラーゼ(分子量200000)及びチログロブリン(分子量669000)の保持容量と理論段数を測定した。結果を表2に示す。
【0047】
【表2】

チトクロムCの保持容量、理論段数は後述する市販の架橋セルロース粒子であるセルファインGCL−2000m(商品名)(チッソ社製)とほぼ同等であった。また、チログロブリンの保持容量はセルファインGCL−2000mよりも大きかった。以上より、本発明の微生物セルロース粒子はセルファインGCL−2000mよりも大きな細孔を有していると考えられる。
【0048】
実施例4 微生物セルロース粒子の調製(その2)
(1)実施例1で調製した微生物セルロースを5重量%になるように8重量%水酸化ナトリウム水溶液に懸濁し、前記懸濁液を−20℃で凍結した後、室温に戻すことによって均一のセルロース溶液を得た。
(2)(1)のセルロース溶液(1mL)を酢酸ベンジル(20mL)に加えた後、回転振盪機と垂直振盪機でそれぞれ30秒間撹拌することで、水酸化ナトリウム水溶液を含むセルロース粒子の懸濁液を調製した。
(3)(2)の懸濁液を−50℃に冷却したメタノール(100mL)に添加し、粒子を凍結させた。凍結粒子は−20℃にて、遠心で沈降させた後、溶媒をデカンテーションで除去した。
(4)溶媒を除去した凍結粒子に−50℃に冷却したメタノール(100mL)を加え、凍結粒子を沈降させた後、メタノールをデカンテーション操作により除去し、凍結粒子を洗浄した。前記洗浄操作は合わせて3回繰り返した。
(5)得られた粒子を常温に戻し、さらにメタノール(100mL)で3回洗浄することにより、微生物セルロース粒子を得た。
【0049】
得られた粒子の大きさを実体顕微鏡を用いて測定したところ、粒子の直径は10から100μmであることを確認した(図2)。
【0050】
比較例1 市販の架橋セルロース粒子の分離特性の測定
ゲルろ過クロマトグラフィー用分離剤として市販されている、セルファインGLC−2000m(商品名、チッソ社製、直径45から105μmの架橋セルロース粒子)を実施例3に記載のカラムに充填し、実施例3と同様にチトクロムC、アミラーゼ及びチログロブリンの保持容量と理論段数を測定した。その結果を表3に示す。
【0051】
【表3】

実施例5 本発明の微生物セルロース粒子及び市販の架橋セルロース粒子の耐圧性測定
実施例2で調製した本発明の微生物セルロース粒子と市販の架橋セルロース粒子とで耐圧性の比較を行なった。
【0052】
内径6.6mm、長さ220mmのカラムに、実施例2で製造した微生物セルロース粒子(粒径:60から300μm)及びセルファインGLC−2000m(商品名、チッソ社製)(粒径:45から105μm)を充填し、溶出液流量の増加に伴う送液圧力の変化を測定した。
【0053】
結果、セルファインGLC−2000mを充填したカラムの場合、溶出液流量の増加と共に送液圧力が増加し、送液圧力が0.8MPaに達したところで急激に増加し、装置の安全設定値5MPaを超えた。よってセルファインGLC−2000mの耐圧は0.8MPaと判定した。一方、本発明の微生物セルロース粒子の場合、送液圧力が1.0MPaに達した後も急激な上昇は認められなかった。以上より、本発明の微生物セルロース粒子の耐圧は1MPa以上であり、セルファインGLC−2000mよりも耐圧性が優れていることが判明した。
【技術分野】
【0001】
本発明は、医薬品、化成品、食品等あらゆる産業分野における特定成分の分離・精製工程に用いるクロマトグラフィー用分離材として利用可能な、微生物セルロース粒子の製造方法に関する。
【背景技術】
【0002】
化合物の分離、精製の手段として各種クロマトグラフィーが利用されている。このうち、薄層クロマトグラフィー、ペーパークロマトグラフィー、液体クロマトグラフィー及び電気泳動等におけるセルロース系分離材の原料としては、従来より植物由来のセルロース(植物セルロース)が用いられている。しかしながら、植物セルロースを原料としたクロマトグラフィー用分離材は、安価で取扱いやすい長所がある反面、分離能が必ずしも満足できるものではなかった。
【0003】
一方、微生物由来のセルロース(微生物セルロース)は植物セルロースと比較し微細な繊維構造を有しているため、微生物セルロースを原料としたクロマトグラフィー用分離材は植物セルロースを原料とした分離材と比較し、高い分離能が見込まれる。微生物セルロース粒子の製造方法としては、微生物セルロースのシート製造に使用可能な直径1から2mm程度のセルロース粒子の製造方法が開示されている(特許文献1)。しかしながら、特許文献1で開示の製造方法はクロマトグラフィーの性能を左右する細孔付与が困難であり、かつ特許文献1で得られた粒子は不定形かつ粒径も大きいため、クロマトグラフィー用分離材としては必ずしも適切ではなかった。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2004−270064号公報
【特許文献2】特開昭64−43530号公報
【特許文献3】特公平7−62041号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
クロマトグラフィー用分離材として使用可能な、細孔を有する球状セルロース粒子の製造法としては、セルロースのアルカリ溶液を凝固点以下の有機溶媒中に滴下して、凍結した粒子を硫酸で中和し、精製水で洗浄、乾燥することによるセルロース粒子製造方法(特許文献2及び3)が知られている。そして、特許文献2ではセルロース原料として、植物セルロース及び微生物セルロースを例示している。しかしながら、特許文献2に従い、微生物セルロース粒子の調製を試みたところ、シリコンオイル中に生成した凍結セルロース粒子が硫酸中和の際に溶解したため、最終的にセルロース粒子を得ることはできなかった。
【0006】
そこで、本発明の目的は、クロマトグラフィー用分離材として使用可能な微生物セルロース粒子の製造方法、及び前記製造方法により得られたクロマトグラフィー用分離材を提供することである。
【課題を解決するための手段】
【0007】
本発明者らは前記の課題を解決すべく鋭意検討した結果、微生物セルロースのアルカリ水溶液に分散溶媒を添加後、所望の大きさのセルロース粒子を調製し、次いで冷却した凍結溶媒に添加してセルロース粒子を凍結後、凍結粒子を洗浄除去することによってクロマトグラフィー用分離材として使用可能なセルロース粒子を調製できることを見出し、本発明を完成するに至った。
【0008】
第一の発明は、
(1)微生物セルロースをアルカリ水溶液に溶解させる工程、
(2)(1)の溶解液に分散溶媒を添加後、微生物セルロースを粒子化する工程、
(3)粒子化した微生物セルロースを冷却した凍結溶媒に添加し、微生物セルロース粒子を凍結させる工程、
(4)凍結した微生物セルロース粒子を洗浄溶媒で洗浄する工程、
からなる微生物セルロース粒子の製造方法である。
【0009】
第二の発明は、冷却した凍結溶媒の液温、及び(4)の工程を−20℃以下で行なう、第一の発明に記載の製造方法である。
【0010】
第三の発明は、微生物セルロースの重合度が200から1000である、第一または第二の発明に記載の製造方法である。
【0011】
第四の発明は、アルカリ水溶液が濃度3から20重量%のアルカリ金属水酸化物水溶液である、第一から第三のいずれかの発明に記載の製造方法である。
【0012】
第五の発明は、前記(1)の溶解液中に含まれる微生物セルロース濃度が、1から10重量%である、第一から第四のいずれかの発明に記載の製造方法である。
【0013】
第六の発明は、分散溶媒が、凝固点−20℃(1気圧)以下であり、−20℃以下における密度が1.1g/cm3以下の有機溶媒であり、かつ水に対する溶解度が0.1から10g/L(25℃)の有機溶媒である、第二から第五のいずれかの発明に記載の製造方法である。
【0014】
第七の発明は、凍結溶媒が、凝固点−20℃(1気圧)以下であり、かつ−20℃以下における密度が1.1g/cm3以下の有機溶媒である、第二から第五のいずれかの発明に記載の製造方法である。
【0015】
第八の発明は、洗浄溶媒が、凝固点−20℃(1気圧)以下であり、かつ−20℃以下における密度が1.1g/cm3以下の有機溶媒である、第二から第五のいずれかの発明に記載の製造方法である。
【0016】
第九の発明は、
(1)微生物セルロースをアルカリ水溶液に溶解させる工程、
(2)(1)の溶解液に分散溶媒を添加後、微生物セルロースを粒子化する工程、
(3)粒子化した微生物セルロースを冷却した凍結溶媒に添加し、微生物セルロース粒子を凍結させる工程、
(4)凍結した微生物セルロース粒子を洗浄溶媒で洗浄する工程、
より得られる微生物セルロース粒子である。
【0017】
以下、本発明をさらに詳細に説明する。
【0018】
本発明の原料として使用される微生物セルロースは微生物が産生するセルロースであれば特に制限はない。一例として、アセトバクター・キシリナム、アセトバクター・パスツリアヌス、サルシナ・ベントリクリ、バクテリウム・キシロイデス、シュードモナス属細菌、アグロバクテリウム属細菌、リゾビウム属細菌、藻類、カビ等が産生するセルロースがあげられる。
【0019】
微生物セルロースを培養生産するためには、前記微生物を用いて、通常の細菌を培養する一般的な方法に従えばよい。すなわち、炭素源、窒素源、無機塩類、その他の必要に応じて、アミノ酸、ビタミン等の有機微量栄養素を含有する通常の栄養培地に接種し、20から40℃の温度で1日から3ヶ月間培養を行なうことで、効率よく微生物セルロースを産生させることができる。静置培養の場合は、培養液表面に膜状の微生物セルロースが産生される。また振盪培養の場合は、パルプ状、フロック状、ペレット状、球状等様々な形状のセルロースが産生される。
【0020】
前記方法で生産した微生物セルロースは、液体成分とともに菌体と培地成分が含まれるが、希アルカリ、希酸、有機酸、熱水、界面活性剤等を単独または組み合わせて洗浄を行なうことで微生物セルロースを精製することができる。前記微生物セルロースの重合度は、大きすぎると粒子の製造に必要なアルカリ水溶液への溶解ができなくなり好ましくない。また、粒子の粒度分布を揃えるためにも、重合度が適切な範囲内に揃った微生物セルロースを原料に用いるのが好ましい。微生物セルロースの重合度は酸分解における酸の濃度、温度、時間により適宜調節することができる。具体的方法として1から10%塩酸に懸濁後、80から110℃で、10から60分間加熱する方法が例示できる。本発明の製造方法においては、重合度200から1000の微生物セルロースが好ましい。
【0021】
本発明の製造方法は、工程1:微生物セルロースの溶解、工程2:粒子化、工程3:凍結粒子の生成、工程4:凍結粒子の洗浄、の4つの工程からなる。以下、各工程毎に詳細に説明する。
【0022】
工程1:微生物セルロースの溶解
工程1は、所望の重合度を有する微生物セルロースをアルカリ水溶液に溶解させる工程である。
【0023】
工程1で用いるアルカリ水溶液としては、水酸化ナトリウムや水酸化カリウム等のアルカリ金属水酸化物の水溶液が好ましく、安価な点で水酸化ナトリウム水溶液が特に好ましい。アルカリ水溶液の濃度は微生物セルロースを十分溶解できる濃度であればよいが、好ましくは3から20重量%、より好ましくは5から10重量%である。アルカリ水溶液中に溶解させる微生物セルロースの濃度は、工程2において粒子化したセルロースの再結合を防げる範囲であればよいが、好ましくは1から10重量%、より好ましくは3から8重量%程度の希薄溶液である。微生物セルロースをアルカリ水溶液に懸濁させることで溶解した液は、−80から−10℃で凍結した後、室温に戻すことによって均質化し、工程2へ進む。
【0024】
工程2:粒子化
工程2は、微生物セルロースを溶解したアルカリ水溶液に分散溶媒を添加後、粒子化させる工程である。
【0025】
分散溶媒としては、微生物セルロースを含むアルカリ水溶液と均一に混合しない疎水性の有機溶媒が好ましく、水に対する溶解度が0.1から10g/L(25℃)の有機溶媒が特に好ましい。また工程3で生成する凍結粒子の再結合を抑制しやすい点で、分散溶媒の密度は1.1g/cm3以下が好ましい。さらに分散溶媒は、工程3で冷却した凍結溶媒に添加するため、前記凍結溶媒の液温で凝固しない有機溶媒であることが必要である。例えば、工程3で−20℃の凍結溶媒を添加する場合は、−20℃で凝固しない有機溶媒であればよい。
【0026】
工程3で−20℃の凍結溶媒に添加する場合の好ましい分散溶媒としては、凝固点が−20℃(1気圧)以下であって、−20℃以下における密度が1.1g/cm3以下、かつ水に対する溶解度が0.1から10g/L(25℃)の物性を有する有機溶媒である。具体的には、ペンタン、ヘキサン、デカン等の炭素数5から10の直鎖、分岐または環状の炭化水素系溶媒、アニソール、エチルトルエン、クロロベンゼン等の置換されていてもよい炭素数6から10の芳香族炭化水素系溶媒、ジペンチルエーテル等のエーテル系溶媒、オクタン酸エチル、酢酸ベンジル、ヘキサン酸エチル、ヘプタン酸エチル等のエステル系溶媒、塩化ブチル、クロロホルム等のハロゲン系溶媒、ジメチルヘプタノン、メチルシクロヘキサノン、メチルヘプテノン等のケトン系溶媒、ノナノール等のアルコール系溶媒、ヘキサンニトリル等のニトリル系溶媒等を例示することができる。前記例示した溶媒の中でも、微生物セルロースを含むアルカリ水溶液の分散性がよい点で、酢酸ベンジル、プロピオン酸エチル、ヘキサン酸エチル、酢酸ヘキシル等のエステル系溶媒が好ましく、入手が容易かつ安全性の高い酢酸ベンジルや酢酸ヘキシルが特に好ましい。
【0027】
分散溶媒の使用量に特に制限はないが、生成する粒子の再結合を抑制しやすい点で、微生物セルロースを溶解したアルカリ水溶液の5から50倍容量用いるのが好ましい。
【0028】
工程2では、工程1で得られた微生物セルロースを溶解したアルカリ水溶液に分散溶媒を添加後、微生物セルロース繊維をせん断することで粒子化する。微生物セルロース繊維のせん断方法としては、均一な粒子を簡便に生成可能な、撹拌による方法が好ましい。なお、撹拌により微生物セルロース繊維をせん断し粒子化させる際は、可能な限り粒径が均一な粒子を生成させるために、適切な撹拌操作が必要である。撹拌方法に特に制限はなく、撹拌翼を取付けた撹拌機による撹拌、試験管ミキサーのような回転振盪機による撹拌、レシプロシェーカーなどの直線運動による撹拌、またはこれらを組み合わせた撹拌が例示できる。撹拌速度も特に制限はなく、例えば回転式撹拌機による撹拌の場合、反応容器や撹拌翼の形状やサイズによっても異なるが、毎分100から1000回転程度の撹拌速度で撹拌することが、また直線運動型の振盪撹拌機による撹拌の場合、毎分100から300回程度の振盪速度で撹拌することが、均一な粒子を生成できる点で好ましい。
【0029】
工程3:凍結粒子の生成
工程3は、工程2で得られた、アルカリ水溶液を含む微生物セルロース粒子が分散溶媒中に分散した状態の懸濁液を、あらかじめ冷却した凍結溶媒中に撹拌しながら加えることにより、前記懸濁液中の微生物セルロース粒子を短時間に凍結させて、凍結粒子を生成させる工程である。
【0030】
工程3で添加する凍結溶媒の液温は−20℃以下が好ましいため、凍結溶媒としては前記温度で凝固しない有機溶媒であることが好ましい。また分散溶媒と同様、生成した凍結粒子の再結合を抑制しやすい点で、前記温度での密度が1.1g/cm3以下の物性を有する有機溶媒が好ましい。凍結溶媒として好ましい態様は、凝固点が−20℃(1気圧)以下、−20℃以下での密度が1.1g/cm3以下、かつ分散溶媒と均一に混合できる有機溶媒である。具体的には、シクロペンタン、ヘキサンデカン等の炭素数5から10の直鎖、分岐または環状の炭化水素系溶媒、ジメトキシベンゼン、トルエン、ブチルベンゼン、メシチレン等の置換されていてもよい芳香族炭化水素系溶媒、ジブチルエーテル、ジプロピルエーテル、ジペンチルエーテル等のエーテル系溶媒、アジピン酸ジブチルノナン酸エチル、プロピオン酸メチル、ヘキサン酸エチル、マロン酸ジエチル、酪酸エチル、酪酸ブチル等のエステル系溶媒、塩化イソペンチル等のハロゲン系溶媒、シクロヘキサノン、シクロペンタノン等のケトン系溶媒、メタノール、ノナノール、フェネトール等のアルコール系溶媒等を例示することができる。前記例示した溶媒の中でも、凍結粒子の分散性がよい点で、炭素数5から10の直鎖、分岐または環状の炭化水素系溶媒、炭素数3から10のエステル系溶媒及びケトン系溶媒、炭素数1から4のアルコール系溶媒が好ましく、入手が容易かつ安全性の高いヘキサンやメタノール等の溶媒が特に好ましい。凍結溶媒の使用量に特に制限はないが、生成した粒子の再結合を抑制しやすい点で、アルカリ水溶液を含む微生物セルロース粒子の懸濁液量に対して2から10倍容量用いることが好ましい。なお、工程3において、あらかじめ−140℃から−30℃に冷却した凍結溶媒を用いると、凍結粒子を等方的に析出させることができる点でより好ましい。
【0031】
前記方法で得られた微生物セルロース凍結粒子は、粒子内部に凍結したアルカリ水溶液を含む。前記アルカリ水溶液は、工程4の操作で除去することにより、得られた微生物セルロース粒子に細孔を施すことができる。凍結粒子中にある凍結したアルカリ水溶液の占有体積は、工程1におけるアルカリ水溶液に溶解させる微生物セルロース濃度を調節することにより容易に制御することが可能なため、前記操作により微生物セルロース粒子中の細孔体積を制御することができる。
【0032】
工程4:凍結粒子の洗浄
工程4は、工程3で調製した微生物セルロース凍結粒子を洗浄することで、内部に細孔を有した微生物セルロース粒子を製造する工程である。具体的には、低温下で、工程3の凍結粒子を含んだ溶液からデカンテーション等の操作により、溶媒を除去して凍結粒子を得た後、あらかじめ低温に冷却した洗浄溶媒を用いて凍結粒子を洗浄することで、内部に細孔を有した微生物セルロース粒子を得ることができる。工程4を実施する温度は、粒子の再結合を抑制できる点で、−20℃以下の低温下で実施するのが好ましい。
【0033】
工程4で用いる洗浄溶媒は、工程4を実施する温度で凝固しない溶媒であることが必要である。また分散溶媒及び凍結溶媒と同様、凍結粒子の再結合を抑制しやすい点で、前記温度での密度が1.1g/cm3以下の物性を有する有機溶媒が好ましい。さらに、洗浄溶媒の目的が凍結したアルカリ水溶液の除去であることから、極性の高い溶媒が好ましい。好ましい洗浄溶媒の具体例として、エチレングリコール、ジメチルエーテル、ジエチルエーテル、ジオキサン、テトラヒドロピラン、テトラヒドロフラン等のエーテル系溶媒、ギ酸プロピル、ギ酸メチル、プロピオン酸エチル等のエステル系溶媒、アセトン等のケトン系溶媒、メタノール、エタノール、ペンタノール等のアルコール系溶媒があげられる。また、これらの溶媒と水との混合溶媒を洗浄用溶媒として使用することができるが、工程4を実施する温度で凝固しない混合比で用いることが必要である。前記例示した溶媒の中でも、凍結したアルカリ水溶液の洗浄能力の高いアルコール系溶媒、またはアルコール系溶媒と水との混合溶媒が好ましく、メタノールやエタノール等の汎用溶媒が特に好ましい。
【0034】
洗浄溶媒の使用量や洗浄回数に特に制限はなく、1から5回洗浄操作を繰り返すことにより、凍結粒子中のアルカリ水溶液を除去することができる。洗浄操作後は、室温に戻して洗浄用溶媒で洗浄することにより、ほぼ完全にアルカリ水溶液を除去することができる。
【0035】
本発明の製造方法によって得られた内部に細孔を有した微生物セルロース粒子は、通常の処理により様々な形状の担体に変換することができる。例えば、得られた微生物セルロースを離解してスラリー状にした後、ガラス板に引き延ばすことで薄層クロマトグラフィー用プレートを作製することができるし、離解物を抄紙してペーパークロマトグラフィーを行なうこともできる。特に本発明の製造方法によって得られた微生物セルロース粒子は、カラムクロマトグラフィー用分離材として好ましい。カラムクロマトグラフィーの種類としては特に限定はなく、粒子表面に種々の吸着基を結合させたイオン交換クロマトグラフィー、疎水性相互作用クロマトグラフィー、アフィニティークロマトグラフィーを例示することができる。また、表面処理をしないゲルろ過クロマトグラフィーに対しても本発明の微生物セルロース粒子が適用可能である。本発明の微生物セルロース粒子をカラムクロマトグラフィー用分離材として使用するには、工程4でペレット状に生産された微生物セルロース粒子を篩にかけて適当な粒径に揃えた後、適切なカラムに詰めればよい。この際、微生物セルロース粒子にアセチル基やメチル基を修飾させることもできるし、エチルアミノエチル基やカルボキシメチル基等のイオン交換基を修飾させてイオン交換体クロマトグラフィー用充填材とすることもできる。
【0036】
本発明のセルロース粒子を用いたクロマトグラフィー用分離材で分離される化合物としては従来の植物セルロース由来の分離材で分離され得る化合物であれば限定はなく、単糖、少糖、多糖、アミノ酸、ペプチド、タンパク質、有機酸、アミン類、アルコール類、ビタミン類、アルカロイド、核酸、リン酸エステル、脂質等を例示できる。
【発明の効果】
【0037】
本発明の製造方法により、クロマトグラフィー用分離材として使用可能な、所望の細孔構造を有した微生物セルロース粒子を、簡便に製造することができる。また、微生物セルロースは植物セルロースと比較し微細な繊維構造を有しているため、本発明の製造方法により得られた微生物セルロース粒子を、クロマトグラフィー用分離材に適用することで、植物セルロースを用いた分離材と比較し、高い分離能を有した分離材を提供することができる。
【図面の簡単な説明】
【0038】
【図1】凍結溶媒としてn−ヘキサンを用いて調製した微生物セルロース粒子の実体顕微鏡写真。
【図2】凍結溶媒としてメタノールを用いて調製した微生物セルロース粒子の実体顕微鏡写真。
【実施例】
【0039】
以下に実施例をあげて本発明を説明するが、本発明はこれにより限定されるものではない。
【0040】
実施例1 微生物セルロースの調製
下記に示す方法により、微生物セルロースを調製した。
(1)三角フラスコに表1に示す培地を入れ、Gluconacetobacter xylinus(NBRC 13693)を植菌し、30℃で静置培養を行なった。
【0041】
【表1】

(2)培養3週間後に産生した微生物セルロースを培養液から取り出し、ミキサーで粉砕した。
(3)(2)の粉砕物をリゾチーム溶液(2mg/mL)に懸濁して30℃で24時間振盪した後、再度ミキサーで粉砕した。
(4)(3)の粉砕したセルロースを1M水酸化ナトリウム水溶液に懸濁して80℃で1時間加熱した。処理後のセルロースは濾別し、精製水で洗浄後、凍結乾燥した。
(5)(4)の凍結乾燥セルロースを10%塩酸に懸濁して105℃で30分間加熱した。処理後のセルロースは濾別し、精製水で洗浄後、凍結乾燥した。
【0042】
(1)から(5)の操作で得られた凍結乾燥セルロース(40mg)を、4mLの1Mの銅エチレンジアミンに溶解し、同量の精製水を添加することで、0.5%のセルロースを含む0.5M銅エチレンジアミン溶液を調製した。さらに、前記溶液の一部に0.5M銅エチレンジアミン溶液を加えることで、希釈溶液を作製した。キャノンフェンスケ粘度計を用いて前記希釈溶液の流下時間を測定し、相対粘度、還元粘度及び固有粘度を計算した後、下記のMark−Houwink式から重合度を算出した。同じ操作を2度繰り返した結果、重合度は280から360であった。
【0043】
η=1.67×DP0.71(η:固有粘度、DP:重合度)
実施例2 微生物セルロース粒子の調製(その1)
実施例1で得られた微生物セルロースより粒子体を調製した。
(1)実施例1で得られた微生物セルロースを5重量%になるように8重量%水酸化ナトリウム水溶液に懸濁し、前記懸濁液を−20℃に凍結した後、室温に戻すことで均一のセルロース溶液を得た。
(2)(1)のセルロース溶液(1mL)に酢酸ベンジル(20mL)を加えた後、回転振盪機と垂直振盪機でそれぞれ30秒間撹拌することで、水酸化ナトリウム水溶液を含むセルロース粒子の懸濁液を調製した。
(3)(2)の懸濁液を−50℃に冷却したn−ヘキサン(100mL)に添加し、粒子を凍結させた。凍結粒子を沈降させた後、溶媒をデカンテーションで除去した。
(4)溶媒を除去した凍結粒子に−50℃に冷却したメタノール(100mL)を加え、凍結粒子を沈降させた後、メタノールをデカンテーション操作により除去し、凍結粒子を洗浄した。この洗浄操作は合わせて3回繰り返した。
(5)得られた粒子を常温に戻し、更にメタノール(100mL)で3回洗浄することにより、微生物セルロース粒子を得た。
【0044】
得られた粒子の大きさを実体顕微鏡を用いて測定したところ、粒子の直径は10から150μmであることを確認した(図1)。
【0045】
実施例3 分離性能評価
実施例2で得られたセルロース粒子の分離性能評価を液体クロマトグラフィーを用いて行なった。
【0046】
実施例2で調製した微生物セルロース粒子を、内径6.6mm、長さ220mmのカラムに充填し、50mMトリス塩酸/100mM塩化カリウム(pH7.5)からなる溶出液を0.3mL/minの流速で流し、チトクロムC(分子量12400)、アミラーゼ(分子量200000)及びチログロブリン(分子量669000)の保持容量と理論段数を測定した。結果を表2に示す。
【0047】
【表2】

チトクロムCの保持容量、理論段数は後述する市販の架橋セルロース粒子であるセルファインGCL−2000m(商品名)(チッソ社製)とほぼ同等であった。また、チログロブリンの保持容量はセルファインGCL−2000mよりも大きかった。以上より、本発明の微生物セルロース粒子はセルファインGCL−2000mよりも大きな細孔を有していると考えられる。
【0048】
実施例4 微生物セルロース粒子の調製(その2)
(1)実施例1で調製した微生物セルロースを5重量%になるように8重量%水酸化ナトリウム水溶液に懸濁し、前記懸濁液を−20℃で凍結した後、室温に戻すことによって均一のセルロース溶液を得た。
(2)(1)のセルロース溶液(1mL)を酢酸ベンジル(20mL)に加えた後、回転振盪機と垂直振盪機でそれぞれ30秒間撹拌することで、水酸化ナトリウム水溶液を含むセルロース粒子の懸濁液を調製した。
(3)(2)の懸濁液を−50℃に冷却したメタノール(100mL)に添加し、粒子を凍結させた。凍結粒子は−20℃にて、遠心で沈降させた後、溶媒をデカンテーションで除去した。
(4)溶媒を除去した凍結粒子に−50℃に冷却したメタノール(100mL)を加え、凍結粒子を沈降させた後、メタノールをデカンテーション操作により除去し、凍結粒子を洗浄した。前記洗浄操作は合わせて3回繰り返した。
(5)得られた粒子を常温に戻し、さらにメタノール(100mL)で3回洗浄することにより、微生物セルロース粒子を得た。
【0049】
得られた粒子の大きさを実体顕微鏡を用いて測定したところ、粒子の直径は10から100μmであることを確認した(図2)。
【0050】
比較例1 市販の架橋セルロース粒子の分離特性の測定
ゲルろ過クロマトグラフィー用分離剤として市販されている、セルファインGLC−2000m(商品名、チッソ社製、直径45から105μmの架橋セルロース粒子)を実施例3に記載のカラムに充填し、実施例3と同様にチトクロムC、アミラーゼ及びチログロブリンの保持容量と理論段数を測定した。その結果を表3に示す。
【0051】
【表3】

実施例5 本発明の微生物セルロース粒子及び市販の架橋セルロース粒子の耐圧性測定
実施例2で調製した本発明の微生物セルロース粒子と市販の架橋セルロース粒子とで耐圧性の比較を行なった。
【0052】
内径6.6mm、長さ220mmのカラムに、実施例2で製造した微生物セルロース粒子(粒径:60から300μm)及びセルファインGLC−2000m(商品名、チッソ社製)(粒径:45から105μm)を充填し、溶出液流量の増加に伴う送液圧力の変化を測定した。
【0053】
結果、セルファインGLC−2000mを充填したカラムの場合、溶出液流量の増加と共に送液圧力が増加し、送液圧力が0.8MPaに達したところで急激に増加し、装置の安全設定値5MPaを超えた。よってセルファインGLC−2000mの耐圧は0.8MPaと判定した。一方、本発明の微生物セルロース粒子の場合、送液圧力が1.0MPaに達した後も急激な上昇は認められなかった。以上より、本発明の微生物セルロース粒子の耐圧は1MPa以上であり、セルファインGLC−2000mよりも耐圧性が優れていることが判明した。
【特許請求の範囲】
【請求項1】
以下の工程からなる微生物セルロース粒子の製造方法:
(1)微生物セルロースをアルカリ水溶液に溶解させる工程、
(2)(1)の溶解液に分散溶媒を添加後、微生物セルロースを粒子化する工程、
(3)粒子化した微生物セルロースを冷却した凍結溶媒に添加し、微生物セルロース粒子を凍結させる工程、
(4)凍結した微生物セルロース粒子を洗浄溶媒で洗浄する工程。
【請求項2】
冷却した凍結溶媒の液温、及び(4)の工程を−20℃以下で行なう、請求項1に記載の製造方法。
【請求項3】
微生物セルロースの重合度が200から1000である、請求項1または2に記載の製造方法。
【請求項4】
アルカリ水溶液が濃度3から20重量%のアルカリ金属水酸化物水溶液である、請求項1から3のいずれかに記載の製造方法。
【請求項5】
前記(1)の溶解液中に含まれる微生物セルロース濃度が、1から10重量%である、請求項1から4のいずれかに記載の製造方法。
【請求項6】
分散溶媒が、凝固点−20℃(1気圧)以下であり、−20℃以下における1.1g/cm3以下の有機溶媒であり、かつ水に対する溶解度が0.1から10g/L(25℃)の有機溶媒である、請求項2から5のいずれかに記載の製造方法。
【請求項7】
凍結溶媒が、凝固点−20℃(1気圧)以下であり、かつ−20℃以下における1.1g/cm3以下の有機溶媒である、請求項2から5のいずれかに記載の製造方法。
【請求項8】
洗浄溶媒が、凝固点−20℃(1気圧)以下であり、かつ−20℃以下における1.1g/cm3以下の有機溶媒である、請求項2から5のいずれかに記載の製造方法。
【請求項9】
以下の工程により得られる微生物セルロース粒子:
(1)微生物セルロースをアルカリ水溶液に溶解させる工程、
(2)(1)の溶解液に分散溶媒を添加後、微生物セルロースを粒子化する工程、
(3)粒子化した微生物セルロースを冷却した凍結溶媒に添加し、微生物セルロース粒子を凍結させる工程、
(4)凍結した微生物セルロース粒子を洗浄溶媒で洗浄する工程。
【請求項1】
以下の工程からなる微生物セルロース粒子の製造方法:
(1)微生物セルロースをアルカリ水溶液に溶解させる工程、
(2)(1)の溶解液に分散溶媒を添加後、微生物セルロースを粒子化する工程、
(3)粒子化した微生物セルロースを冷却した凍結溶媒に添加し、微生物セルロース粒子を凍結させる工程、
(4)凍結した微生物セルロース粒子を洗浄溶媒で洗浄する工程。
【請求項2】
冷却した凍結溶媒の液温、及び(4)の工程を−20℃以下で行なう、請求項1に記載の製造方法。
【請求項3】
微生物セルロースの重合度が200から1000である、請求項1または2に記載の製造方法。
【請求項4】
アルカリ水溶液が濃度3から20重量%のアルカリ金属水酸化物水溶液である、請求項1から3のいずれかに記載の製造方法。
【請求項5】
前記(1)の溶解液中に含まれる微生物セルロース濃度が、1から10重量%である、請求項1から4のいずれかに記載の製造方法。
【請求項6】
分散溶媒が、凝固点−20℃(1気圧)以下であり、−20℃以下における1.1g/cm3以下の有機溶媒であり、かつ水に対する溶解度が0.1から10g/L(25℃)の有機溶媒である、請求項2から5のいずれかに記載の製造方法。
【請求項7】
凍結溶媒が、凝固点−20℃(1気圧)以下であり、かつ−20℃以下における1.1g/cm3以下の有機溶媒である、請求項2から5のいずれかに記載の製造方法。
【請求項8】
洗浄溶媒が、凝固点−20℃(1気圧)以下であり、かつ−20℃以下における1.1g/cm3以下の有機溶媒である、請求項2から5のいずれかに記載の製造方法。
【請求項9】
以下の工程により得られる微生物セルロース粒子:
(1)微生物セルロースをアルカリ水溶液に溶解させる工程、
(2)(1)の溶解液に分散溶媒を添加後、微生物セルロースを粒子化する工程、
(3)粒子化した微生物セルロースを冷却した凍結溶媒に添加し、微生物セルロース粒子を凍結させる工程、
(4)凍結した微生物セルロース粒子を洗浄溶媒で洗浄する工程。
【図1】


【図2】




【図2】


【公開番号】特開2010−236975(P2010−236975A)
【公開日】平成22年10月21日(2010.10.21)
【国際特許分類】
【出願番号】特願2009−84083(P2009−84083)
【出願日】平成21年3月31日(2009.3.31)
【出願人】(000003300)東ソー株式会社 (1,901)
【出願人】(000173762)公益財団法人相模中央化学研究所 (151)
【Fターム(参考)】
【公開日】平成22年10月21日(2010.10.21)
【国際特許分類】
【出願日】平成21年3月31日(2009.3.31)
【出願人】(000003300)東ソー株式会社 (1,901)
【出願人】(000173762)公益財団法人相模中央化学研究所 (151)
【Fターム(参考)】
[ Back to top ]

