細胞など微小域観察を伴った成分捕獲と注入および分子分析自動化装置
【課題】 顕微観察しながら1生細胞など微小域試料をナノスプレーイオン化細管チップで吸引捕捉し、直接質量分析する際、当該チップを微小域の視野しかない顕微視野内の細胞などの目的位置に誘導するのが、もっとも手間と時間と技術の必要な過程であり、測定法の隘路となっている。
【解決手段】細胞など顕微下で刺入するナノスプレーイオン化細管チップなどの試料捕捉細管をロボットの先端に保持し、そのチップの先端位置を検出し補正し、当該チップ取り付け毎のチップ先端位置の空間座標を補正し、また顕微鏡での焦点位置の対空間座標を観察する焦点面位置を顕微ステージのZ軸エンコードで補正し、その両点間をロボットで先端誘導し、高速・高精度に試料捕捉細管を細胞など対象微小試料に誘導する。
【解決手段】細胞など顕微下で刺入するナノスプレーイオン化細管チップなどの試料捕捉細管をロボットの先端に保持し、そのチップの先端位置を検出し補正し、当該チップ取り付け毎のチップ先端位置の空間座標を補正し、また顕微鏡での焦点位置の対空間座標を観察する焦点面位置を顕微ステージのZ軸エンコードで補正し、その両点間をロボットで先端誘導し、高速・高精度に試料捕捉細管を細胞など対象微小試料に誘導する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、細胞観察などの微小域空間体の観察をともなった細胞内など微小域空間内溶液捕獲と成分分析法および細胞液など微小域空間液の捕獲・分析装置に関するものである。
【背景技術】
【0002】
細胞内での分子メカニズムは生命現象を引き起こす本質的なものであり、生命科学が解明すべき永遠の課題である。しかし、現在までに、リアルタイムで生きた細胞における分子探索をし、そのメカニズムを解明する為の分析手法はなかった。もしそのような手法や装置が開発されれば、生命現象のみならず病態や病態を検知するマーカー分子あるいは医薬品となりうる候補分子の発見は迅速に行えることになり、人類の恩恵は計り知れない。
一般にこの様な分析では、従来は、ある設定された状態に細胞を置き、刺激などの外部因子などの条件設定の前後の多数の細胞を集めてすり潰し、その後感度も不十分なため手間と時間のかかる様々な分子解析を別に行い、その多くの細胞の平均値とも言える分子探索の結果により、生命体の分子メカニズムを推測している。しかし細胞の応答は同じでないことをわれわれは長年の細胞のビデオ顕微鏡観察で認識している。
また、近年ナノテクノロジーの進展とともに、200μm以下の微小域の物質の変化を観察しながら、その分子変化を例えば最終的に質量分析で検出する場合においてもその他の微量分析法であっても、その観察実態とともに捉えることも必要になってきている。更に病気の診断や病変組織などからの病態メカニズムの研究などにも今後質量分析が分子検出や同定の中心となって来る場合においても、超微量の生体試料の採取でこれらの分析が可能になれば、患者への痛みや負担は緩和され、使用される溶媒なども微量ですむなど、様々なメリットが生まれる。本説明では、微小域空間体として、もっとも複雑で、生命体という有機体であり、まだ不明なことの多い細胞を、そのもっとも適用の難しい微小試料の例として取り上げているが、その対象は液体状であればほぼすべてを対象とでき、あるいは固体でもその成分を溶解した液体が僅かに共存すれば、その僅かな量の試料を直接捕捉し、分離法などを付加しないで、そのまま分子検出でき、さらに、その微小域を観察や位置情報で特定しつつ行える特徴を持つ、本発明を説明する。
【0003】
細胞の分子解析には、従来、多数の細胞を、一定時間、一定処理、あるいは一定の刺激をした前後で比較するのが通常である。それを、細胞をリアルタイムに観察し、1細胞の挙動を観察しながら、分子動態を迅速に解析する方法が開発できれば、世界の生命科学を一気に加速させる。いわばこれは生命科学の夢である。またこれはナノテクノロジーや化学、材料化学などあらゆる微小域での分子変化を追跡する有益な手法としても有用で、その手法の実現が望まれている。また、1細胞の体積である1ピコリッター以下の量で分子解析が可能であれば、血液や汗、唾液などを極微量採取するのみで、ほとんど無痛で分子分析し診断なども可能であり、他にも、小動物や昆虫などのごく微量な尿などの体液でも1ピコリッターあれば分析でき、致命的な量で行わずに分析可能で、その用途は無限に広い。
【先行技術文献】
【0004】
我々は、上記の問題を解決する新しい手法をすでに特許申請した。
【特許文献1】特願2007−286208
【特許文献2】特願2008−095092
その特許は、細胞の様に1ピコリッター程度とその体積は超微量でも、その試料を、ナノスプレーチップという、先端が髭の毛の先の様な口径数ミクロンメーターのマイクロピペットでもあるその先端に試料を捕捉し、その先端試料の濃度を拡散させず留めたままにして初めて可能となった。しかし、多くの生体試料は粘性があり、このままでは、電場印加による液体成分のナノスプレーは起こらない。そこで、さらに、その背後に有機溶媒を含むイオン化溶媒を接合させることで、その溶媒が捕捉した先端にあるごくわずかな試料中を通り抜ける時に、溶媒に溶出する成分を一緒にナノスプレーとして排出させる事が出来ることを初めて発見し、これにより試料中の成分をイオン化させ、質量分析計にダイレクトに導入できる事を世界で初めて実現できた。しかし、その後、本発明を応用する際、習熟しないと時間のかかる過程があることに気づいた。それは試料採取が1細胞レベルのミクロン域であるので、そこに迅速に採取針の先端を持ってゆくことに、時間と技術が必要であることである。この世界で初めての可能性の広い手法を誰でもいつでも迅速に使用できるようにするには、その操作を容易にする必要があることに気づいた。また、細胞に成分液を注入するいままでにある手法(マイクロインジェクション)においても、その操作が迅速化できる。更に、対象分子やイオンを更に広げる事も重要なポイントであり、将来への医療診断法への基礎は申請できたが、様々な応用につながる周辺技術の構築も必須と思えるようになってきた。
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明は、以下に記載する課題をロボットなどの限定空間位置自動移送システムを用いて、微小な試料を採取する際、先端の壊れやすい針などの採取器具を、所定の空間内の位置と向きを連続的に移動させ、高効率に作業を可能とするものである。
今まで殆ど集合体でしか解析されていなかった細胞分子機構の解析手段を1細胞で細胞の個性も含めその挙動を見ながら、細胞1つ、あるいはその細胞内小器官までも成分を捕捉し、その分子解析と定量を可能とする高感度で高速かつ直接的で高い信頼性のある手法を実現したり、あるいは、癌組織の様に細胞集合体の1つである生体組織の中の細胞あるいは細胞間隙のうち、その少なくとも1つの形成空間内成分を直接的に取り出すことを可能とし、可能な限り迅速かつ直接的にその成分を分析する手段を実現することにおける微小域への操作性改善の解決法を提供する。
しかも、細胞は生き物であり、その挙動と細胞内分子動態は連動することが多い。従って、生命現象の分子メカニズムを解明するには、上記の分析手段が、細胞の形態観察と同時に迅速に行われることが望ましい。また、細胞や生体組織中の細胞は、外界からの様々な因子に応答しており、その機能発現のメカニズム解明には、外界から与えられた因子と細胞内分子変動の関連を迅速に調べる方法を提供する事も必要な事である。上記手法の発見の結果、個性のある細胞少なくとも1つ1つについて、その挙動分析と分子動態分析および分子探索分析を同時に可能とし、生命現象の分子メカニズムを迅速かつ直接的に解明する手段を与えることができたが、その操作は煩雑で、微小空間内へ迅速に再現性よく成分捕捉デバイスの先端を持っていくことは手動では簡単ではないことを認識した。また浮遊細胞や卵などは、もう一つのマニュピレーターで軽く吸引捕捉し、それに、ナノスプレーチップなどの細管捕捉器具をつけた本来のマニュピレーターで顕微鏡下、手さぐりで、細管を挿入し、所定の成分を吸引捕捉したり、所定の成分を注入したりして来た。これは2重に困難な作業であった。また、観察する細胞の場と位置を確認しながら、その細胞に一本の光ファイバーでミクロの光照射をしたり、近接場光を先端に出す探査子を細胞に接触させたり、微細な磁石で、磁気ビーズ上に捕捉した細胞内成分を集めることをミクロ域で可能としたり、電極を細胞などにミクロに挿入したり、親和性のある分子を表面に結合した分子捕捉針の様なものを細胞壁から細胞内に挿入したりと、今後は様々なミクロ域の操作が必要とされる時代になってくる。これらを高効率に可能とする必要がある。また、近年ナノテクノロジーの進展とともに、200μm以下の微小域の物質の変化を観察しながら、その分子変化をその観察実態とともに捉えることも必要になってきており、その微小域の変化の可視化と分子機構などの解明をもたらす手段を与えるにも、試料補足および成分液注入におけるミクロ域への成分捕捉・注入デバイスの迅速で正確な移動が不可欠であった。
【0006】
さらに現在、各種疾患や診断に対し、できれば無痛に近い成分捕捉が望ましい。その一つの手段として、採取量が極微量ですめば、血液も耳たぶに痛くない小径の針で刺入するのみで、噴出したわずかな試料や、細針への流入で得た試料で分析でき、他にもまったく痛くない唾液や汗(1汗腺から噴出す量はナノリッター程度)や涙でも診断ができるようになる。その時に、狙った所に採取針を刺入あるいは先端を持っていったりすることを、熟練や手間を要しないで、かつ自動化できれば、その恩恵は計り知れない。更にこの技術によれば、たとえば、皮膚の下の血管の位置を、血液からでる近赤外線や赤外線のイメージと、対物レンズの皮膚表面と当該赤外線の最強深度から、特に女性にわかりにくい血管の位置へ自動的に刺入するシステムを完成することもできる。
病気の診断には、現在、血液中に漏出した各組織中に特異的に存在する酵素なども検出されている。この場合、従来の臨床検査では、酵素の基質となるものを加え、酵素反応とカップルする反応をうまく利用して呈色させたりして、その酵素活性を一つ一つ計測している。本手法によれば、血液、唾液、あるいは汗腺からの1ナノリッター以下の汗など、極微量でも測定できることから、あらかじめ、この様な基質をナノスプレーチップ内壁にコーティングなどで存在させておき、酵素基質とその反応物の比から、血中の逸脱酵素などの診断に利用されている蛋白質などの機能を分析できるようにしたく思う。
【0007】
また、飲食品分野では、ワイン、日本酒、ビール、ウイスキー、焼酎等のアルコール性飲料、醤油、味噌などの醗酵食品、漬物、キムチ、ピクルスなどの野菜果実加工品、ヨーグルト、チーズ等の酪農食品には酵母、乳酸菌等の微生物細胞についても遺伝子レベルにおける解析、研究等が進んでいるが、風味、香等微妙な品質を研究したい場合には、それらの遺伝子解析やタンパク質の分析のみでは限度があり、酵母、乳酸菌等の醗酵と関連する微生物の細胞内の低分子動態の解析手段の出現や、発酵などの製造過程でのリアルタイムでの成分解析が望まれており、その結果と遺伝子解析やタンパク質の解析結果との統合が望まれている。もし発酵過程などでの、極微量での解析が簡単に低コストで、かつ自動化して行えれば、その恩恵も計り知れない。
さらに、反応系、例えば合成や誘導体化や分子結合の様な化学反応の進む試料を、ごく僅かナノスプレーチップ先端に捕捉し、すぐに分析して、反応の進行をチェックすることもできる。
【0008】
また植物研究については、一般的な植物生理学・発生学等の各種の研究分野において、動物細胞と比較して一般的に未解明事象が多く、植物の分化、形、色、香をつかさどる分子機構等の解明や、植物の重力や光などの環境応答に対する低分子の動態の研究が望まれている。また近年、食糧事情等の関係から、遺伝子組み換え植物の需要は高まっており、生態的リスク評価のみならず、遺伝子組み換えによる安全性評価や、品種改良の迅速な評価も非常に重要な課題であり、細胞内外の低分子動態の変化を追跡する手段の出現が望まれている。我々は最近植物細胞1ヶでの分子解析にも成功しているが、空間に植物の葉や茎を固定して、そこに3次元的に、細胞採取用ナノスプレーチップを刺入する事は簡単では無く、自動化が望まれている。
【0009】
さらに一般的化学品製造産業等において、例えば、有機半導体、有機導電体、有機光学材料のように高純度が要求される製品の製造過程において、または食品添加物等の健康面での品質保証が重要な製品の製造過程において、微量の因子が、物理化学的性能または安全性等の要求品質に影響を与えるような製造工程では、そのような微量因子のモニタリング、制御など、製造管理、品質管理のために、微小域での迅速な分子動態の自動解析が望まれている。
【0010】
しかし、光学顕微鏡内に観察される細胞などの微小対象は、細胞で10ミクロンメーター程度ときわめて微小である。対物レンズの倍率にもよるが、その顕微鏡の視野内で見ている範囲はせいぜい1mmからそれ以下である。そこに視野外から、顕微鏡の焦点外の上下(Z軸)方向も含む不確定位置から、先端口径数ミクロンの針の様なナノスプレーイオン化細管チップの先端を細胞近辺に誘導するのは、とても時間と手間のかかる作業で、1細胞成分捕獲など微小域成分捕捉において、この操作が一番難しく、対物レンズの倍率を上げれば上げるほど困難さは増し、チップ先端を間違ってシャーレの底面に当てて先端を折ってしまうなど失敗の多い操作である。この操作の手間と時間が短縮できれば、上記新分析法は世界中で誰でも、色々な分野で利用される方法となると考えられた。
【課題を解決するための手段】
【0011】
そこで、この1細胞などの微小域試料捕捉用のナノスプレーイオン化細管チップ(以下チップと表記)を多軸ロボットなど、3次元空間位置認識移動体の先端に固定し、かつ、固定時に、チップ装着時にチップの製造時の長さ変動や先端保持の微妙な固定点の違いなどによるチップ先端位置のミクロンメータースケールでのずれを認識し、補正して、再現性良く、チップ先端を1細胞近辺など指定微小域試料位置に、所定の移動空間内を、所定の軌跡とチップの向きなどの姿勢を保ちながら、一気に移動させることができないかと考えた。これによれば、一番時間と手間のかかるチップ先端のミクロ域での対象試料付近への誘導が数秒で再現性良く実現でき、またその後、チップ先端に捕捉した成分に溶媒を入れる操作も、ロボットが試料採取後のチップを一度ラックのようなものに置き、ロボット先端からチップを開放し、その後、ロボットは指定の量の溶媒を入れることのできるマイクロディスペンサーを取り上げ、その先端に溶媒採量用のマイクロピペッティングチップを保持し、一定量の溶媒吸引操作の後、先ほど細胞などの成分を捕捉したナノスプレーチップの後端から、マイクロピペッティングチップの糸の様なプラスティック細管を当該ナノスプレーチップ内に挿入して、イオン化補助溶媒を試料採取チップに添加し、その後、ロボットはマイクロディスペンサーを所定のディスペンサー保持部に戻して離し、もう一度、当該ナノスプレーチップを取り上げ、チップ先端を下向きにしての振動付加や遠心力付加などで、ナノスプレーチップ先端に向かって溶媒を落とし、気泡などを取り除き、その後質量分析計の専用ナノスプレーイオン化アタッチメントに、このチップを置き操作の1サイクルを終え、次の細胞などの微小域成分捕捉の準備に、新しいナノスプレーチップをチップラックから取り上げ入る。これにより、質量分析計側では、同時にナノスプレーイオン化による細胞などの微小域成分の分子分析が平行してスタートすることになる。
【0012】
ロボットはサーボ制御であるので、サーボ制御によるある一点を維持するための振動的な制御の結果ハンチングなども予測されたが、実験して見ると、顕微鏡で見ても、細胞1ヶでの成分捕捉に問題ない範囲で細胞付近を動かず、非常に再現性良くかつ位置精度高く、一度セットした位置に、位置を維持することがわかった。また何十センチメートルも顕微鏡から離れた位置に戻した後でも、再現性良くチップ先端を細胞近くの所定の位置に誘導できることができることがわかった。その理由として、軽量にチップ保持部分を製作できたことも一因であろう。10ミクロンメーター程度のメーカー精度保障しか無いロボットでも、軽量に先端部を製作すれば1ミクロン程度での空間精度維持が可能であることを見出したことは、驚きであった。これを達成するために、台にも工夫を施し、顕微鏡とロボットを結ぶ面の台の下部には、高剛性のフレームを溶接して対応した。これもチップ先端の揺れ防止に対しての、対振対策、剛性向上として重要なポイントであった。これで多軸ロボットをミクロ操作にも応用できることを証明した。これにより、一連の操作をかなり複雑でも自動で行う事ができる様になった。
[特許文献2]特願2008−095092ですでに詳述したが、従来のマイクロマニュピレーターを電動とし、チップ先端の計測法を加味すれば、小さな稼動範囲に限れば、使用できる(図1)。しかし、質量分析計へのチップの配送には、距離が長く、無理がある。もし、この従来型マイクロマニュピレーターを高精度で直線移動できるリニアーアクチュエーターなどの上に保持すれば、空間移動距離も増え、ロボットに擬した操作を行う事ができる。しかし、溶媒充填などの細かな操作は置き場所をよほど限定しなくては難しい。
さらに、
【発明の効果】
【0013】
この顕微鏡での観察を伴う微小域試料の採取に対する多軸ロボットの採用の成功で、ナノスプレーチップの先端位置を計測すれば、1細胞内成分捕獲など、顕微鏡内で狙った微小空間内試料の捕捉までの少なくとも細胞などターゲット近辺への高速なチップ先端誘導と、それに引き継いでのジョイスティックなどでの微小移動による細胞などへの狙った位置からの刺入や吸引などが簡単にかつ高速にできる様になった。さらに、細胞内成分など試料吸引後、チップへの溶媒注入や、その後のチップの質量分析計のナノスプレー用専用アタッチメントへの搬送も自動で行う事ができ、本分析手法の高速化・効率化・自動化を図ることができるようになった。
【図面の簡単な説明】
【0014】
【図1】 [特許文献2]特願2008−095092で記載した1細胞捕獲の電動マイクロマニュピレーターシステム
【図2】 自動化に対応したナノスプレーイオン化細管チップの迅速交換ホルダー
【図3】 自動化に対応した鞘付きナノスプレーイオン化細管チップと鞘の形状の例
【図4】 図3表記の鞘付きチップの保持ラックの1例
【図5】 鞘をガラス細管上部を高温軟化させ押し広げて形成したナノスプレーイオン化細管チップ
【図6】 多軸ロボットを使ったチップ先端計測モニター補正装置付き自動ナノスプレーイオン化細管チップ細胞誘導システム
【図7】 多軸ロボットを使ったチップ先端簡易型計測モニター補正装置付き自動ナノスプレーイオン化細管チップ細胞誘導システム
【図8】 レーザーなどのビーム中心遮断によるチップ先端計測システム
【図9】 図6のシステムで、チップ保持ラックからチップを取り出し、また細胞成分捕捉後チップを元のラックに戻す機能を付加したシステム
【図10】 図9のシステムで、更に、チップに溶媒添加後、質量分析計のナノスプレーイオン化システムにチップを搬送する機能を付加したシステム
【図11】 図9のシステムで、先端のチップ保持部を従来型マイクロマニュピレーターとし、最後の微細操作を容易にしたもの
【図12】 図10のシステムに、足ふみペダル操作により細胞など微小空間試料の吸引捕捉と、加圧による培養液の混入防止を可能としたシステムを付加したもの
【図13】 ロボット化自動細胞捕捉システムを細胞の増殖維持に必要な恒温チェンバー内に配置したもの
【図14】 ロボット化自動細胞捕捉システムによる細胞捕捉実験の様子
【図15】 ロボット化自動細胞捕捉システムの細胞付近でのジョイスティックによる微動試験の様子
【図16】 ロボットを複数台設置し、同じ観察点にある浮遊細胞や卵などの位置の移動を行う試料を、もう一つのマニュピレーターで軽く吸引捕捉し、それに、ナノスプレーイオン化細管チップなどの細管捕捉器具をつけた本来のマニュピレーターで、同じ観察点に向かってロボットで成分採取を行う一例
【図17】 ロボットを複数台設置し、観察する細胞の場と位置を確認しながら、その細胞に一本の光ファイバーでミクロの光照射をしたり、近接場光を先端に出す探査子を細胞に接触させたりしながら、その条件による細胞の変化を、成分の変化として、もう一つのロボットの先端にある試料採取細管で捕捉する場合の一例
【図18】 試料捕捉用の図3にある鞘付チップの、先端ナノスプレーイオン化細管チップ内部に、ロボットでも容易に溶液注入用のチップの髭の様な先端部が導入できるよう、鞘の結合部と、ナノスプレーイオン化細管チップ内径の間にスロープを設けた一例
【図19】 本ロボットをフレーム移動型とした場合の全体操作の一例
【図20】 本ロボットにより、ヒトの血液を腕から採取できるようにしたシステムの一例
【図21】 指の指紋領域に見られる汗腺一つから噴き出るナノリッターレベルの汗を、本ロボットでナノスプレーイオン化細管チップ先端に捕捉する時の図の一例
【図22】 図21で捕捉した汗から検出された質量スペクトルとその中の同定分子の一例
【発明を実施するための形態】
【実施例1】
【0015】
まず細胞成分捕獲を自動化するためには、その際大量に使用するナノスプレーイオン化細管チップ1の迅速な交換を可能にする必要がある。図2では、ナノスプレーイオン化細管チップ1内には安定してナノスプレーが生じるよう先端への毛管現象を維持するためフィラメント338が配してある。この金属コーティングを外面に施されたナノスプレーイオン化細管チップ1は、二つのO−リング341を介して、空気漏れなくチップホルダー340中心部に保持され、チップホルダー後端にある二つのO−リングで空気漏れなくロボット先端のナノスプレーイオン化細管チップ1のロボット先端取り付け部363に保持される。チップ1の交換は、チップをつまんで引き抜く。これで、迅速にチップを交換できる。また、このナノスプレーイオン化細管チップを金属コーティングせずマイクロキャピラリーとして、成分液体の注入用としても使うことができる。以下、説明において、注入に関しては述べないが、同じく可能である。
【実施例2】
【0016】
ロボットが次々に空気漏れなくチップ1をロボット先端取り付け部363に保持するには、注射針の鞘部のように、内部に丸状テーパになったチップ結合用鞘をチップ後端に設けることで解決できる。図3は、さまざまな形状の鞘を持ったナノスプレーイオン化細管チップ1の例を示す。円形の断面を持つものに比べ、角型の断面を持つものは、チップ1をロボット先端に保持する際、チップをチップホルダーに食い込ませる時に少し回転をさせるが、この動きをラック内にチップ1がある場合に、完全に回転運動をチップ1にさせないで食い込ませることが容易であるからである。さらに一部襟が鞘についているのは、ラックから落ちにくくするためである。これらの鞘は、ナノスプレーチップにインジェクションでプラスティックを成型付加するのがもっともやりやすい製造法であろう。ナノスプレーチップをガラス加熱引き伸ばしで作る際は、引き伸ばす前に両端に鞘を形成して後、引き伸ばしても良い。
【実施例3】
【0017】
図4は、1例として、襟付き角型鞘348のあるナノスプレーイオン化細管チップ1を保持するラックを示す。この場合は細胞などの捕捉後のチップや、溶媒添加待ちのチップ、あるいは質量分析待ちや終了後のチップをこの6ヶの穴の中に保持させて、置くことができる。
【実施例4】
【0018】
図5は、フィラメント338付きのナノスプレーイオン化細管チップ1の鞘を、同じチップ素材であるガラスなどの加熱押し出し成型で形成したものである。プラスティック鞘の付加の様に、プラスティックの可塑剤などの分子ピークが質量スペクトルに現れにくく、また回収に際しても、ガラスとコーティング金属のみが原料で、再生性に優れている。鞘押し出し成型時に形成された突起部359は、ラックでのチップに回転でチップホルダーに食い込ませたり、はずしたりする際に、回転運動を受け止められるようにしたものである。
【実施例5】
【0019】
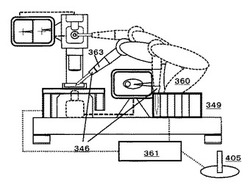
図6は、上記のようなチップ1を使用し、多軸ロボット360で細胞などの微小域成分捕捉システムを形成した1例である。この場合は6軸ロボットを使用した例であるが、ロボットは小型ロボット制御部361で制御される。まずホルダーへの食いつきの違いやチップ先端長さのばらつきから、微妙にチップ先端位置が異なるので、その先端位置補正を、顕微鏡やそれとは切り離して別に設けられた3次元位置顕微撮影装置376(X−Y平面),378(X−Z平面)でモニター上377,379に表示される先端点402に先端位置をジョイスティック405などの微動装置で移動させることで、補正絶対座標値が検出される。このチップ先端位置座標と、この顕微鏡ステージ373のZ軸移動エンコーダー値を顕微鏡X−Zステージ駆動部401からもらい、例えば視野中心部である焦点面を、チップ捕捉点・焦点面403として誘導座標を決め、あとはロボットを移動させるのみとさせる。この様に、微細空間では、顕微鏡の焦点位置とロボットが操作するチップ1の先端位置を、絶対座標あるいは相対座標の中で共有し、さらに、障害物などのそれらの位置情報をあらかじめコンピューターに記憶させておくことで、目標の微細試料へのチップ1などの、目的ツールを、高精度に、かつ正確に、かつその移動空間内での軌跡と向きなどの姿勢も含めて制御できる様になる。細胞付近にチップ先端が来ると急に細胞モニター画面372の色合いが、光をチップ先端がさえぎるので、変わる。ロボットと顕微鏡の間の絶対位置が正確でないと、再現性良くチップ誘導できないので、ロボット化微小域自動試料採取システムの取り付け台362の裏打ちとして取り付け台の剛性補強材400などを介して剛性強化して置くことも重要である。この様にして、簡便にかつ高速高精度で再現性良く細胞などの微小域試料を捕捉することができる様になる。尚、捕捉にあたっての、チップ内への成分吸引のための減圧吸引や、細胞などへのアプローチの際に培養液などをチップ1内に入れないための軽い加圧は、後述図12で説明する。
【実施例6】
【0020】
図7は、図6において、チップの先端位置補正を簡略化し、顕微鏡やそれとは切り離して別に設けられた3次元位置顕微撮影装置376(X−Y平面)のみでチップ先端をモニター377上に表示する様にしたものである。Z軸方向の補正は、ロボットが90度回転してチップ位置を見せることでわかるようにして、6軸ロボットの特性を使ってコストダウンを計ったものである。後は、図6と同じである。
【実施例7】
【0021】
図8は、チップ先端計測の別の手法を示したもので、チップ先端部が、非常に小さく焦点化された点をX軸、Y軸、Z軸移動で移動する際、通過光強度が大きく変化することを利用する。先端付近がこの小さな焦点化光経路を横切ると、非常に狭い範囲で大きな通過光強度の変化が生じる。チップ1をX軸、Y軸、Z軸ロボットで動かしながら、光強度変化で先端位置を割り出すことができ、その時の絶対座標をチップ1の先端座標とすることができる。また、ロボット363の回転軸を回転させることで、チップ1の中心回転軸からのずれにより、補正することもできる。
【実施例8】
【0022】
図9は、図6のシステムで、更にチップをラックから取り出したり、ラックに細胞などの捕捉後、チップを置いたりする操作をさせるものである。この試料採取後のチップをラックに置いて、その後、例えば、ロボットは指定の量の溶媒を入れることのできるマイクロディスペンサーを取り上げ、その先端に溶媒採量用のマイクロピペッティングチップを保持し、一定量の溶媒吸引操作の後、先ほど細胞などの成分を捕捉したナノスプレーチップの後端から、マイクロピペッティングチップの糸の様なプラスティック細管を当該ナノスプレーチップ内に挿入して、イオン化補助溶媒を試料採取チップに添加し、その後、ロボットはマイクロディスペンサーを所定のディスペンサー保持部に戻して離すこともできる。
【実施例9】
【0023】
図10は、図9に加え、更にロボットに質量分析装置へのチップの搬送をさせ、自動化を更に進めるものである。ロボットは、もう一度、溶媒を添加されたナノスプレーチップ1を取り上げ、チップ先端を下向きにしての振動付加や遠心力付加などで、ナノスプレーチップ先端に向かって溶媒を落とし、気泡などを取り除き、その後質量分析計の専用ナノスプレーイオン化アタッチメントに、このチップを置き去り、操作の1サイクルを終え、次の細胞などの微小域成分捕捉の準備のために、新しいナノスプレーチップをチップラックから取り上げ入る。これにより、質量分析計側では、同時にナノスプレーイオン化による細胞などの微小域成分の分子分析が平行してスタートすることになる。
【実施例10】
【0024】
図11は、上記のロボットのみによる細胞などの微小域試料捕捉において、最後の細胞捕捉などのための微動操作を変えたもので、更に細かく微動操作できる、従来の小型X−Y−Zマイクマニュピレーターをロボット先端部に取り付けた場合を示す。ロボット先端部が重くなり、ロボット自身がハンチングを起こさない範囲の重量で行う必要があるが、微動に関してはよりスムースになる。
【実施例11】
【0025】
図12は、図11やそれ以前の図で、細胞など微小域試料のナノスプレーチップ1での吸引捕獲のために、手での注射筒を使った吸引操作ではなく、ふさがりがちな手を用いないで、足によるペダル437の操作でピストン436を動かし、チューブを介して、捕捉にあたってのチップ内への成分吸引のための減圧吸引や、細胞などへのアプローチの際に培養液などをチップ1内に入れないための軽い加圧を可能とするものである。チューブ内には、吸引加圧の操作特性向上のために液体を入れることも可能である。この操作も電動で自動化できるが、操作のスムースさや適切性には欠ける。
【実施例12】
【0026】
図13は、上記システムを細胞観察の適正温度である摂氏36度付近に維持するためのもので、特に細胞を培養し長時間観察するためには必須の炭酸ガス濃度維持および恒温チェンバーである。正面は、二重ガラスでは無く、有機ガラス1枚で形成され、顕微鏡観察窓453、顕微鏡操作窓454やチップ取り出し窓455などが設けてあり、質量分析計を内部に入れて、全自動化を図ることもできる。その場合は、質量分析計やそのイオン化アタッチメントの維持のために、大きな透明ドア457を設ける。
【実施例13】
【0027】
図14は、実際に6軸小型ロボットを用いて、細胞刺入を行っている写真である。
【実施例14】
【0028】
図15は、図14において、細胞内刺入の最後の段階で、ジョイスティック操作により微動操作を行っているところである。いずれも期待を上回る性能を発揮した。
【実施例15】
【0029】
図16は、6軸小型ロボットを複数台設置して行う例を示しており、左側のロボットで浮遊細胞や卵など、貼り付き細胞と異なり、その位置が移動する試料に対し、先端口径が対象試料の大きさに近く、傷つけないように角が丸くなっている細管で、弱く吸引することで捕捉し、その捕捉位置は、ロボットの座標軸値から割り出せるので、その場所に、もう一つのロボットのチップの先端を誘導する事を可能としたシステムである。この様に複数のロボットを使う場合、絶対座標を共有できるロボットの特性を生かした操作がさらに可能となり、作業の高精度化と高効率化が達成できる。
【実施例16】
【0030】
図17は、ロボットを複数台設置し、観察する細胞の場と位置を確認しながら、その細胞に一本の光ファイバーでミクロの光照射をしたり、近接場光を先端に出す探査子を細胞に接触させたりしながら、その条件による細胞の変化を、もう一つのロボットの先端にある試料採取細管で捕捉する場合の一例である。測定試料(この場合は細胞であるが)に対し、他に微細な磁石で、磁気ビーズ上に細胞内成分を集めることをミクロ域で可能としたり、電極を細胞などにミクロに押し付けたり、挿入したり、親和性のある分子を表面に結合した分子捕捉針の様なものを細胞壁から細胞内に挿入したりと、今後は様々なミクロ域の操作が同時に可能となる。
【実施例17】
【0031】
図18は試料捕捉用の図3にある鞘付チップの、先端ナノスプレーイオン化細管チップ内部に、ロボットでも容易に溶液注入用のチップの髭の様な先端部482がチップ後端部から導入できるよう、鞘の結合部と、ナノスプレーイオン化細管チップ内径の間にスロープ480を設けた一例であり、ロボットは、当該チップで細胞などの試料成分を捕捉後、一度ラックにこのチップを置き、これに、この様な鞘の形状を生かして、このチップの後端から容易に、溶液添加用細管チップ481を使って、この細管内部に溶媒を添加する事ができる。今まで、この重要な溶媒添加作業も、細かな作業で、難しく、効率化の妨げになっていた。
【実施例18】
【0032】
図19は、本ロボットのタイプをフレーム移動型とした場合の全体操作の一例である。フレームを移動軸501として動くこのタイプのロボットは、低コストであるが、移動空間に制約が多く、使える場合が上記の6軸回転型のロボットよりは狭い。他にもアーム式や色々なロボットがあるが、その操作の基本は変わらない。
【実施例19】
【0033】
図20は、本ロボットにより、ヒトの血液を腕510から採取できるようにしたシステムの一例である。近赤外あるいは赤外域に感度を持つカメラ371をカメラに用いれば、温度の高い血管511などの位置を容易に可視化する。その焦点面から、血管の大きさと位置を確認できれば、ヒトの腕510を、血液採取する位置を生体試料採取ポイント確定プレート514で固定し、そこに注射針などの生体試料採取針515を刺入する。その時の血管壁通過などを針の根元に設置した採取時の感触センサー518で感知し、血管壁の片側を刺入した所で、ロボットの動きを止め、採血などに入るようにしている。そのセンサーからの信号は、センサー信号線520を介し、プリアンプ521で増幅されて、ロボット駆動コンピューターに送られる。
【実施例20】
【0034】
図21は指の指紋領域に見られる汗腺一つから噴き出るナノリッターレベルの汗を、本ロボットでナノスプレーイオン化細管チップ先端に捕捉する時の図の一例である。指の指紋領域にある汗腺一つから噴き出た汗530は、ナノスプレーイオン化チップ515で捕捉され、これに溶媒を後端から添加して、ナノスプレーイオン化質量分析法で直接分子ピークを検出した。その検出に成功した質量スペクトルを図21に示す。汗一滴から得られた質量スペクトルの中で、汗に特異的な分子ピークは130本あり、その中でアミノ酸とともに同定された分子のピークとその分子構造を3例記載した。摂取したカフェインやニコチン、および服用している医薬品分子の検出にも成功し、この成功は、将来診断などが、血液では無く、もっと患者に負荷のない、痛みの無い試料で様々にできる可能性を示している。
【産業上の利用可能性】
【0035】
合目的的に動き外部因子に応答している細胞は、その挙動と細胞内分子動態が連動することが多く、細胞の顕微観察と分子検出をリアルタイムに行うことで、生命現象の合目的的分子メカニズムを迅速に解明することができる。本発明は、生命現象とその分子メカニズムの両方を細胞1つまでミクロなスケールで、迅速かつ直接的に解明する手段を与え、その用途は膨大である。何よりも疾患細胞と正常細胞の動態と分子比較による疾患の分子メカニズムの解明が加速する。そして、細胞内分子メカニズムが分かれば、その分子あるいはメカニズムを利用した創薬や診断法、治療法の開発、新しい分子が見つかれば新医薬品への応用あるいはライフサイエンス用の試薬の開発、など実に多彩な応用が考えられる。
また、細胞内や生体組織中の細胞内の様々な分子メカニズムの解明の高速化は、医薬品候補分子も含め新分子の発見、新生命現象の発見の高速化をもたらし、医療や診断あるいはバイオ応用を大きく展開し加速することができる。例えば、再生医療などの万能細胞の細胞分化因子の高速探索、細胞分化制御、細胞増殖因子の発見や制御法、がん細胞など細胞種の分子診断や分子探索、細胞種の同定など様々な分析が高速に展開することとなる。
【0036】
現在、各種疾患について網羅的な解析が進められている多くの遺伝子およびその発現産物であるタンパク質等と関連して、細胞内の低分子動態を明確にすることができ、統合的な生命現象の解明が可能となり、生命現象の統合的理解は、人類の生命、健康の増進に大きく貢献し、付帯的な様々な事業を生み出しうる。
【0037】
また、食品分野では、風味、香等微妙な品質を研究できる細胞内や発酵液などの直接的で迅速な低分子動態の解析手段を与えることができる。
さらに一般的化学品製造産業等において、例えば、ナノテクノロジーの微小域分子機構の解明や、有機半導体、有機導電体、有機光学材料のように高純度が要求される製品の製造管理、あるいは食品添加物等の健康面での品質保証が重要な製品の製造過程において、微量の副生物が、物理化学的性能または安全性等の要求品質に悪影響を与えるような製造工程では、そのような副生物の監視、製造管理、品質管理など、微小域での分子検出と解析が可能となる。
【符号の説明】
【0038】
1 ナノスプレーイオン化細管チップ
2 質量分析装置
3 試料溶液と添加イオン化溶媒
4 高圧電圧(この場合はポジティブモードの例でありチップ側が+)
5 ナノスプレー
6 細管表面の金属コーティング部
8 細胞
9 顕微鏡ステージ
10 捕捉した細胞液
11 対物レンズ
12 ビデオカメラ
13 吸引操作
15 シャーレ
16 細胞培養液
17 モニター
35 細胞刺入ナノスプレー細管チップを細胞位置まで駆動するホルダーのX−Y−Z駆動ステージ(この図では電動型、手動のギア粗動・微動型もあり)
36 細胞刺入ナノスプレー細管チップを細胞位置まで駆動するホルダーの軸方向アクチュエーター(この図では電動型、他に手動の水圧または油圧ピストン駆動型もあり)
37 細胞刺入ナノスプレー細管チップを細胞位置まで駆動する軸方向アクチュエータによる細胞刺入および吸引後引き戻し移動方向
38 細胞刺入ナノスプレー細管チップホルダー駆動制御装置
39 細胞刺入ナノスプレー細管チップホルダー駆動用端末(この図ではジョイスティック)
40 細胞成分吸引駆動用チューブ
41 細胞成分吸引用ピストン(注射器でも代用可)
42 細胞成分吸引用ピストン駆動装置
338 ナノスプレー管内付設フィラメント
340 ナノスプレー吸引ホルダー
341 ナノスプレー吸引時密封O−リング
342 ホルダー取り付け部O−リング
343 ナノスプレー吸引ホルダー本体
344 吸引用鞘付きナノスプレーイオン化細管チップ(表面金属コーティングは細管のみでも、鞘を含んでコーティングしても可)
345 同心円状鞘(インジェクション成型などで製作、吸引部との接合部は丸状テーパ)
346 角状鞘(インジェクション成型などで製作、吸引部との接合部は丸状テーパ)
347 一部襟付き角状鞘(インジェクション成型などで製作、吸引部との接合部は丸状テーパ)
348 周囲襟付き角状鞘(インジェクション成型などで製作、吸引部との接合部は丸状テーパ)
349 鞘付きナノスプレーイオン化細管チップ収納ラック
350 鞘付きナノスプレーイオン化細管チップ収納用の穴(角型)
352 加熱フィラメント
353 ナノスプレーイオン化細管チップ開口後端部押し広げ用受け金型
354 ナノスプレーイオン化細管チップ開口後端部押し広げ用押し込み金型
355 出来上がった後端部鞘構造をした一体型ナノスプレーイオン化細管チップ(金属コーティングは、押し広げ前後のどちらで行っても良いが、後の方がより良い)
359 後端部鞘構造をした一体型ナノスプレーイオン化細管チップに金型形状の変化により形成した位置決め突起部
360 小型ロボット(一例として6軸制御ロボットを示す)
361 小型ロボット制御部
362 ロボット化微小域自動試料採取システムの取り付け台
363 ナノスプレーイオン化細管チップのロボット先端取り付け部
370 自動微小域試料採取用顕微鏡システム
371 顕微解析用ビデオカメラと対物レンズ
372 371で捉えた細胞のモニター図
373 顕微ステージ
374 顕微鏡X−Yステージ駆動部
375 細胞培養シャーレ
376 ナノスプレーイオン化細管チップの先端計測用対物レンズ付きビデオカメラ(X−Y平面)
377 376で捉えられたチップ先端図
378 ナノスプレーイオン化細管チップの先端計測用対物レンズ付きビデオカメラ(X−Z平面)
379 378で捉えられたチップ先端部
400 ロボット化微小域自動試料採取システムの取り付け台の剛性補強材
401 顕微鏡X−Zステージ駆動部
402 ナノスプレーイオン化細管チップの先端点
403 チップ捕捉点・焦点面
404 顕微鏡焦点面Z軸変動エンコード通信線
405 ロボット微動用アタッチメント(この場合はジョイスティック)
410 チップ先端検出用光源(この場合はレーザーなど)
411 光源用丸穴スリット
412 光源角度変更ミラー
413 集光レンズ
414 集光ポイント・ピンホールスリット
415 光検出器
420 チップ内捕捉試料ナノスプレーイオン化装置
421 ナノスプレーイオン化細管チップ固定・電圧印加部
425 質量分析計アタッチメントとしてのチップ内捕捉試料ナノスプレーイオン化装置
430 X−Y−Zマイクロマニュピレーター駆動部(水圧、油圧、電動など各種ある)
431 X−Y−Zマイクロマニュピレーター駆動用チューブ(水圧、油圧式の場合)または電線(電動式の場合)
432 X−Y−Zマイクロマニュピレーター微細駆動用回転式ハンドル
435 試料吸引用チューブ
436 試料吸引用ピストンシリンジ
437 ペダル
438 ペダル回転軸
439 ペダル回転時のスイングアーム
440 ペダル式試料吸引圧力調節機
450 細胞捕捉用または細胞捕捉分子解析統合システム用恒温チェンバー
451 細胞補足用恒温チェンバー台
452 二重ガラスまたは2重有機ガラス
453 顕微観察用窓
454 顕微鏡操作用窓
455 試料捕捉チップ取り出し窓
456 熱源(オイルヒーターなど)
457 質量分析計操作用ドア
460 浮遊細胞または卵などの浮遊性微小試料
461 細胞保持用ロボット
462 細胞保持用ピペット
463 細胞など微小試料保持・吸引・注入用ピストンシリンジ
470 光ファイバー
471 光源
472 光ファイバー保持ロッド
473 照射された光
480 溶液添加用細管導入スロープ
481 溶液添加用細管チップ
482 溶液添加用細管チップ先端部
483 細管内に添加された溶液
500 フレーム移動ロボット用フレーム支え
501 ロボット移動水平フレーム
505 ロボット回転部
506 ロボットのフレーム移動部
510 ヒトの腕(生体の一例)
511 血管
514 生体試料採取ポイント確定プレート
515 生体試料採取針
516 生体試料採取吸引ピストンシリンジ
517 生体試料採取ピストン駆動部
518 採取時の感触センサー
520 センサー信号線
521 センサー信号プリアンプ
530 指の指紋領域にある汗腺一つから噴き出た汗
540 汗一滴から得られた質量スペクトルと同定された分子
【技術分野】
【0001】
本発明は、細胞観察などの微小域空間体の観察をともなった細胞内など微小域空間内溶液捕獲と成分分析法および細胞液など微小域空間液の捕獲・分析装置に関するものである。
【背景技術】
【0002】
細胞内での分子メカニズムは生命現象を引き起こす本質的なものであり、生命科学が解明すべき永遠の課題である。しかし、現在までに、リアルタイムで生きた細胞における分子探索をし、そのメカニズムを解明する為の分析手法はなかった。もしそのような手法や装置が開発されれば、生命現象のみならず病態や病態を検知するマーカー分子あるいは医薬品となりうる候補分子の発見は迅速に行えることになり、人類の恩恵は計り知れない。
一般にこの様な分析では、従来は、ある設定された状態に細胞を置き、刺激などの外部因子などの条件設定の前後の多数の細胞を集めてすり潰し、その後感度も不十分なため手間と時間のかかる様々な分子解析を別に行い、その多くの細胞の平均値とも言える分子探索の結果により、生命体の分子メカニズムを推測している。しかし細胞の応答は同じでないことをわれわれは長年の細胞のビデオ顕微鏡観察で認識している。
また、近年ナノテクノロジーの進展とともに、200μm以下の微小域の物質の変化を観察しながら、その分子変化を例えば最終的に質量分析で検出する場合においてもその他の微量分析法であっても、その観察実態とともに捉えることも必要になってきている。更に病気の診断や病変組織などからの病態メカニズムの研究などにも今後質量分析が分子検出や同定の中心となって来る場合においても、超微量の生体試料の採取でこれらの分析が可能になれば、患者への痛みや負担は緩和され、使用される溶媒なども微量ですむなど、様々なメリットが生まれる。本説明では、微小域空間体として、もっとも複雑で、生命体という有機体であり、まだ不明なことの多い細胞を、そのもっとも適用の難しい微小試料の例として取り上げているが、その対象は液体状であればほぼすべてを対象とでき、あるいは固体でもその成分を溶解した液体が僅かに共存すれば、その僅かな量の試料を直接捕捉し、分離法などを付加しないで、そのまま分子検出でき、さらに、その微小域を観察や位置情報で特定しつつ行える特徴を持つ、本発明を説明する。
【0003】
細胞の分子解析には、従来、多数の細胞を、一定時間、一定処理、あるいは一定の刺激をした前後で比較するのが通常である。それを、細胞をリアルタイムに観察し、1細胞の挙動を観察しながら、分子動態を迅速に解析する方法が開発できれば、世界の生命科学を一気に加速させる。いわばこれは生命科学の夢である。またこれはナノテクノロジーや化学、材料化学などあらゆる微小域での分子変化を追跡する有益な手法としても有用で、その手法の実現が望まれている。また、1細胞の体積である1ピコリッター以下の量で分子解析が可能であれば、血液や汗、唾液などを極微量採取するのみで、ほとんど無痛で分子分析し診断なども可能であり、他にも、小動物や昆虫などのごく微量な尿などの体液でも1ピコリッターあれば分析でき、致命的な量で行わずに分析可能で、その用途は無限に広い。
【先行技術文献】
【0004】
我々は、上記の問題を解決する新しい手法をすでに特許申請した。
【特許文献1】特願2007−286208
【特許文献2】特願2008−095092
その特許は、細胞の様に1ピコリッター程度とその体積は超微量でも、その試料を、ナノスプレーチップという、先端が髭の毛の先の様な口径数ミクロンメーターのマイクロピペットでもあるその先端に試料を捕捉し、その先端試料の濃度を拡散させず留めたままにして初めて可能となった。しかし、多くの生体試料は粘性があり、このままでは、電場印加による液体成分のナノスプレーは起こらない。そこで、さらに、その背後に有機溶媒を含むイオン化溶媒を接合させることで、その溶媒が捕捉した先端にあるごくわずかな試料中を通り抜ける時に、溶媒に溶出する成分を一緒にナノスプレーとして排出させる事が出来ることを初めて発見し、これにより試料中の成分をイオン化させ、質量分析計にダイレクトに導入できる事を世界で初めて実現できた。しかし、その後、本発明を応用する際、習熟しないと時間のかかる過程があることに気づいた。それは試料採取が1細胞レベルのミクロン域であるので、そこに迅速に採取針の先端を持ってゆくことに、時間と技術が必要であることである。この世界で初めての可能性の広い手法を誰でもいつでも迅速に使用できるようにするには、その操作を容易にする必要があることに気づいた。また、細胞に成分液を注入するいままでにある手法(マイクロインジェクション)においても、その操作が迅速化できる。更に、対象分子やイオンを更に広げる事も重要なポイントであり、将来への医療診断法への基礎は申請できたが、様々な応用につながる周辺技術の構築も必須と思えるようになってきた。
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明は、以下に記載する課題をロボットなどの限定空間位置自動移送システムを用いて、微小な試料を採取する際、先端の壊れやすい針などの採取器具を、所定の空間内の位置と向きを連続的に移動させ、高効率に作業を可能とするものである。
今まで殆ど集合体でしか解析されていなかった細胞分子機構の解析手段を1細胞で細胞の個性も含めその挙動を見ながら、細胞1つ、あるいはその細胞内小器官までも成分を捕捉し、その分子解析と定量を可能とする高感度で高速かつ直接的で高い信頼性のある手法を実現したり、あるいは、癌組織の様に細胞集合体の1つである生体組織の中の細胞あるいは細胞間隙のうち、その少なくとも1つの形成空間内成分を直接的に取り出すことを可能とし、可能な限り迅速かつ直接的にその成分を分析する手段を実現することにおける微小域への操作性改善の解決法を提供する。
しかも、細胞は生き物であり、その挙動と細胞内分子動態は連動することが多い。従って、生命現象の分子メカニズムを解明するには、上記の分析手段が、細胞の形態観察と同時に迅速に行われることが望ましい。また、細胞や生体組織中の細胞は、外界からの様々な因子に応答しており、その機能発現のメカニズム解明には、外界から与えられた因子と細胞内分子変動の関連を迅速に調べる方法を提供する事も必要な事である。上記手法の発見の結果、個性のある細胞少なくとも1つ1つについて、その挙動分析と分子動態分析および分子探索分析を同時に可能とし、生命現象の分子メカニズムを迅速かつ直接的に解明する手段を与えることができたが、その操作は煩雑で、微小空間内へ迅速に再現性よく成分捕捉デバイスの先端を持っていくことは手動では簡単ではないことを認識した。また浮遊細胞や卵などは、もう一つのマニュピレーターで軽く吸引捕捉し、それに、ナノスプレーチップなどの細管捕捉器具をつけた本来のマニュピレーターで顕微鏡下、手さぐりで、細管を挿入し、所定の成分を吸引捕捉したり、所定の成分を注入したりして来た。これは2重に困難な作業であった。また、観察する細胞の場と位置を確認しながら、その細胞に一本の光ファイバーでミクロの光照射をしたり、近接場光を先端に出す探査子を細胞に接触させたり、微細な磁石で、磁気ビーズ上に捕捉した細胞内成分を集めることをミクロ域で可能としたり、電極を細胞などにミクロに挿入したり、親和性のある分子を表面に結合した分子捕捉針の様なものを細胞壁から細胞内に挿入したりと、今後は様々なミクロ域の操作が必要とされる時代になってくる。これらを高効率に可能とする必要がある。また、近年ナノテクノロジーの進展とともに、200μm以下の微小域の物質の変化を観察しながら、その分子変化をその観察実態とともに捉えることも必要になってきており、その微小域の変化の可視化と分子機構などの解明をもたらす手段を与えるにも、試料補足および成分液注入におけるミクロ域への成分捕捉・注入デバイスの迅速で正確な移動が不可欠であった。
【0006】
さらに現在、各種疾患や診断に対し、できれば無痛に近い成分捕捉が望ましい。その一つの手段として、採取量が極微量ですめば、血液も耳たぶに痛くない小径の針で刺入するのみで、噴出したわずかな試料や、細針への流入で得た試料で分析でき、他にもまったく痛くない唾液や汗(1汗腺から噴出す量はナノリッター程度)や涙でも診断ができるようになる。その時に、狙った所に採取針を刺入あるいは先端を持っていったりすることを、熟練や手間を要しないで、かつ自動化できれば、その恩恵は計り知れない。更にこの技術によれば、たとえば、皮膚の下の血管の位置を、血液からでる近赤外線や赤外線のイメージと、対物レンズの皮膚表面と当該赤外線の最強深度から、特に女性にわかりにくい血管の位置へ自動的に刺入するシステムを完成することもできる。
病気の診断には、現在、血液中に漏出した各組織中に特異的に存在する酵素なども検出されている。この場合、従来の臨床検査では、酵素の基質となるものを加え、酵素反応とカップルする反応をうまく利用して呈色させたりして、その酵素活性を一つ一つ計測している。本手法によれば、血液、唾液、あるいは汗腺からの1ナノリッター以下の汗など、極微量でも測定できることから、あらかじめ、この様な基質をナノスプレーチップ内壁にコーティングなどで存在させておき、酵素基質とその反応物の比から、血中の逸脱酵素などの診断に利用されている蛋白質などの機能を分析できるようにしたく思う。
【0007】
また、飲食品分野では、ワイン、日本酒、ビール、ウイスキー、焼酎等のアルコール性飲料、醤油、味噌などの醗酵食品、漬物、キムチ、ピクルスなどの野菜果実加工品、ヨーグルト、チーズ等の酪農食品には酵母、乳酸菌等の微生物細胞についても遺伝子レベルにおける解析、研究等が進んでいるが、風味、香等微妙な品質を研究したい場合には、それらの遺伝子解析やタンパク質の分析のみでは限度があり、酵母、乳酸菌等の醗酵と関連する微生物の細胞内の低分子動態の解析手段の出現や、発酵などの製造過程でのリアルタイムでの成分解析が望まれており、その結果と遺伝子解析やタンパク質の解析結果との統合が望まれている。もし発酵過程などでの、極微量での解析が簡単に低コストで、かつ自動化して行えれば、その恩恵も計り知れない。
さらに、反応系、例えば合成や誘導体化や分子結合の様な化学反応の進む試料を、ごく僅かナノスプレーチップ先端に捕捉し、すぐに分析して、反応の進行をチェックすることもできる。
【0008】
また植物研究については、一般的な植物生理学・発生学等の各種の研究分野において、動物細胞と比較して一般的に未解明事象が多く、植物の分化、形、色、香をつかさどる分子機構等の解明や、植物の重力や光などの環境応答に対する低分子の動態の研究が望まれている。また近年、食糧事情等の関係から、遺伝子組み換え植物の需要は高まっており、生態的リスク評価のみならず、遺伝子組み換えによる安全性評価や、品種改良の迅速な評価も非常に重要な課題であり、細胞内外の低分子動態の変化を追跡する手段の出現が望まれている。我々は最近植物細胞1ヶでの分子解析にも成功しているが、空間に植物の葉や茎を固定して、そこに3次元的に、細胞採取用ナノスプレーチップを刺入する事は簡単では無く、自動化が望まれている。
【0009】
さらに一般的化学品製造産業等において、例えば、有機半導体、有機導電体、有機光学材料のように高純度が要求される製品の製造過程において、または食品添加物等の健康面での品質保証が重要な製品の製造過程において、微量の因子が、物理化学的性能または安全性等の要求品質に影響を与えるような製造工程では、そのような微量因子のモニタリング、制御など、製造管理、品質管理のために、微小域での迅速な分子動態の自動解析が望まれている。
【0010】
しかし、光学顕微鏡内に観察される細胞などの微小対象は、細胞で10ミクロンメーター程度ときわめて微小である。対物レンズの倍率にもよるが、その顕微鏡の視野内で見ている範囲はせいぜい1mmからそれ以下である。そこに視野外から、顕微鏡の焦点外の上下(Z軸)方向も含む不確定位置から、先端口径数ミクロンの針の様なナノスプレーイオン化細管チップの先端を細胞近辺に誘導するのは、とても時間と手間のかかる作業で、1細胞成分捕獲など微小域成分捕捉において、この操作が一番難しく、対物レンズの倍率を上げれば上げるほど困難さは増し、チップ先端を間違ってシャーレの底面に当てて先端を折ってしまうなど失敗の多い操作である。この操作の手間と時間が短縮できれば、上記新分析法は世界中で誰でも、色々な分野で利用される方法となると考えられた。
【課題を解決するための手段】
【0011】
そこで、この1細胞などの微小域試料捕捉用のナノスプレーイオン化細管チップ(以下チップと表記)を多軸ロボットなど、3次元空間位置認識移動体の先端に固定し、かつ、固定時に、チップ装着時にチップの製造時の長さ変動や先端保持の微妙な固定点の違いなどによるチップ先端位置のミクロンメータースケールでのずれを認識し、補正して、再現性良く、チップ先端を1細胞近辺など指定微小域試料位置に、所定の移動空間内を、所定の軌跡とチップの向きなどの姿勢を保ちながら、一気に移動させることができないかと考えた。これによれば、一番時間と手間のかかるチップ先端のミクロ域での対象試料付近への誘導が数秒で再現性良く実現でき、またその後、チップ先端に捕捉した成分に溶媒を入れる操作も、ロボットが試料採取後のチップを一度ラックのようなものに置き、ロボット先端からチップを開放し、その後、ロボットは指定の量の溶媒を入れることのできるマイクロディスペンサーを取り上げ、その先端に溶媒採量用のマイクロピペッティングチップを保持し、一定量の溶媒吸引操作の後、先ほど細胞などの成分を捕捉したナノスプレーチップの後端から、マイクロピペッティングチップの糸の様なプラスティック細管を当該ナノスプレーチップ内に挿入して、イオン化補助溶媒を試料採取チップに添加し、その後、ロボットはマイクロディスペンサーを所定のディスペンサー保持部に戻して離し、もう一度、当該ナノスプレーチップを取り上げ、チップ先端を下向きにしての振動付加や遠心力付加などで、ナノスプレーチップ先端に向かって溶媒を落とし、気泡などを取り除き、その後質量分析計の専用ナノスプレーイオン化アタッチメントに、このチップを置き操作の1サイクルを終え、次の細胞などの微小域成分捕捉の準備に、新しいナノスプレーチップをチップラックから取り上げ入る。これにより、質量分析計側では、同時にナノスプレーイオン化による細胞などの微小域成分の分子分析が平行してスタートすることになる。
【0012】
ロボットはサーボ制御であるので、サーボ制御によるある一点を維持するための振動的な制御の結果ハンチングなども予測されたが、実験して見ると、顕微鏡で見ても、細胞1ヶでの成分捕捉に問題ない範囲で細胞付近を動かず、非常に再現性良くかつ位置精度高く、一度セットした位置に、位置を維持することがわかった。また何十センチメートルも顕微鏡から離れた位置に戻した後でも、再現性良くチップ先端を細胞近くの所定の位置に誘導できることができることがわかった。その理由として、軽量にチップ保持部分を製作できたことも一因であろう。10ミクロンメーター程度のメーカー精度保障しか無いロボットでも、軽量に先端部を製作すれば1ミクロン程度での空間精度維持が可能であることを見出したことは、驚きであった。これを達成するために、台にも工夫を施し、顕微鏡とロボットを結ぶ面の台の下部には、高剛性のフレームを溶接して対応した。これもチップ先端の揺れ防止に対しての、対振対策、剛性向上として重要なポイントであった。これで多軸ロボットをミクロ操作にも応用できることを証明した。これにより、一連の操作をかなり複雑でも自動で行う事ができる様になった。
[特許文献2]特願2008−095092ですでに詳述したが、従来のマイクロマニュピレーターを電動とし、チップ先端の計測法を加味すれば、小さな稼動範囲に限れば、使用できる(図1)。しかし、質量分析計へのチップの配送には、距離が長く、無理がある。もし、この従来型マイクロマニュピレーターを高精度で直線移動できるリニアーアクチュエーターなどの上に保持すれば、空間移動距離も増え、ロボットに擬した操作を行う事ができる。しかし、溶媒充填などの細かな操作は置き場所をよほど限定しなくては難しい。
さらに、
【発明の効果】
【0013】
この顕微鏡での観察を伴う微小域試料の採取に対する多軸ロボットの採用の成功で、ナノスプレーチップの先端位置を計測すれば、1細胞内成分捕獲など、顕微鏡内で狙った微小空間内試料の捕捉までの少なくとも細胞などターゲット近辺への高速なチップ先端誘導と、それに引き継いでのジョイスティックなどでの微小移動による細胞などへの狙った位置からの刺入や吸引などが簡単にかつ高速にできる様になった。さらに、細胞内成分など試料吸引後、チップへの溶媒注入や、その後のチップの質量分析計のナノスプレー用専用アタッチメントへの搬送も自動で行う事ができ、本分析手法の高速化・効率化・自動化を図ることができるようになった。
【図面の簡単な説明】
【0014】
【図1】 [特許文献2]特願2008−095092で記載した1細胞捕獲の電動マイクロマニュピレーターシステム
【図2】 自動化に対応したナノスプレーイオン化細管チップの迅速交換ホルダー
【図3】 自動化に対応した鞘付きナノスプレーイオン化細管チップと鞘の形状の例
【図4】 図3表記の鞘付きチップの保持ラックの1例
【図5】 鞘をガラス細管上部を高温軟化させ押し広げて形成したナノスプレーイオン化細管チップ
【図6】 多軸ロボットを使ったチップ先端計測モニター補正装置付き自動ナノスプレーイオン化細管チップ細胞誘導システム
【図7】 多軸ロボットを使ったチップ先端簡易型計測モニター補正装置付き自動ナノスプレーイオン化細管チップ細胞誘導システム
【図8】 レーザーなどのビーム中心遮断によるチップ先端計測システム
【図9】 図6のシステムで、チップ保持ラックからチップを取り出し、また細胞成分捕捉後チップを元のラックに戻す機能を付加したシステム
【図10】 図9のシステムで、更に、チップに溶媒添加後、質量分析計のナノスプレーイオン化システムにチップを搬送する機能を付加したシステム
【図11】 図9のシステムで、先端のチップ保持部を従来型マイクロマニュピレーターとし、最後の微細操作を容易にしたもの
【図12】 図10のシステムに、足ふみペダル操作により細胞など微小空間試料の吸引捕捉と、加圧による培養液の混入防止を可能としたシステムを付加したもの
【図13】 ロボット化自動細胞捕捉システムを細胞の増殖維持に必要な恒温チェンバー内に配置したもの
【図14】 ロボット化自動細胞捕捉システムによる細胞捕捉実験の様子
【図15】 ロボット化自動細胞捕捉システムの細胞付近でのジョイスティックによる微動試験の様子
【図16】 ロボットを複数台設置し、同じ観察点にある浮遊細胞や卵などの位置の移動を行う試料を、もう一つのマニュピレーターで軽く吸引捕捉し、それに、ナノスプレーイオン化細管チップなどの細管捕捉器具をつけた本来のマニュピレーターで、同じ観察点に向かってロボットで成分採取を行う一例
【図17】 ロボットを複数台設置し、観察する細胞の場と位置を確認しながら、その細胞に一本の光ファイバーでミクロの光照射をしたり、近接場光を先端に出す探査子を細胞に接触させたりしながら、その条件による細胞の変化を、成分の変化として、もう一つのロボットの先端にある試料採取細管で捕捉する場合の一例
【図18】 試料捕捉用の図3にある鞘付チップの、先端ナノスプレーイオン化細管チップ内部に、ロボットでも容易に溶液注入用のチップの髭の様な先端部が導入できるよう、鞘の結合部と、ナノスプレーイオン化細管チップ内径の間にスロープを設けた一例
【図19】 本ロボットをフレーム移動型とした場合の全体操作の一例
【図20】 本ロボットにより、ヒトの血液を腕から採取できるようにしたシステムの一例
【図21】 指の指紋領域に見られる汗腺一つから噴き出るナノリッターレベルの汗を、本ロボットでナノスプレーイオン化細管チップ先端に捕捉する時の図の一例
【図22】 図21で捕捉した汗から検出された質量スペクトルとその中の同定分子の一例
【発明を実施するための形態】
【実施例1】
【0015】
まず細胞成分捕獲を自動化するためには、その際大量に使用するナノスプレーイオン化細管チップ1の迅速な交換を可能にする必要がある。図2では、ナノスプレーイオン化細管チップ1内には安定してナノスプレーが生じるよう先端への毛管現象を維持するためフィラメント338が配してある。この金属コーティングを外面に施されたナノスプレーイオン化細管チップ1は、二つのO−リング341を介して、空気漏れなくチップホルダー340中心部に保持され、チップホルダー後端にある二つのO−リングで空気漏れなくロボット先端のナノスプレーイオン化細管チップ1のロボット先端取り付け部363に保持される。チップ1の交換は、チップをつまんで引き抜く。これで、迅速にチップを交換できる。また、このナノスプレーイオン化細管チップを金属コーティングせずマイクロキャピラリーとして、成分液体の注入用としても使うことができる。以下、説明において、注入に関しては述べないが、同じく可能である。
【実施例2】
【0016】
ロボットが次々に空気漏れなくチップ1をロボット先端取り付け部363に保持するには、注射針の鞘部のように、内部に丸状テーパになったチップ結合用鞘をチップ後端に設けることで解決できる。図3は、さまざまな形状の鞘を持ったナノスプレーイオン化細管チップ1の例を示す。円形の断面を持つものに比べ、角型の断面を持つものは、チップ1をロボット先端に保持する際、チップをチップホルダーに食い込ませる時に少し回転をさせるが、この動きをラック内にチップ1がある場合に、完全に回転運動をチップ1にさせないで食い込ませることが容易であるからである。さらに一部襟が鞘についているのは、ラックから落ちにくくするためである。これらの鞘は、ナノスプレーチップにインジェクションでプラスティックを成型付加するのがもっともやりやすい製造法であろう。ナノスプレーチップをガラス加熱引き伸ばしで作る際は、引き伸ばす前に両端に鞘を形成して後、引き伸ばしても良い。
【実施例3】
【0017】
図4は、1例として、襟付き角型鞘348のあるナノスプレーイオン化細管チップ1を保持するラックを示す。この場合は細胞などの捕捉後のチップや、溶媒添加待ちのチップ、あるいは質量分析待ちや終了後のチップをこの6ヶの穴の中に保持させて、置くことができる。
【実施例4】
【0018】
図5は、フィラメント338付きのナノスプレーイオン化細管チップ1の鞘を、同じチップ素材であるガラスなどの加熱押し出し成型で形成したものである。プラスティック鞘の付加の様に、プラスティックの可塑剤などの分子ピークが質量スペクトルに現れにくく、また回収に際しても、ガラスとコーティング金属のみが原料で、再生性に優れている。鞘押し出し成型時に形成された突起部359は、ラックでのチップに回転でチップホルダーに食い込ませたり、はずしたりする際に、回転運動を受け止められるようにしたものである。
【実施例5】
【0019】
図6は、上記のようなチップ1を使用し、多軸ロボット360で細胞などの微小域成分捕捉システムを形成した1例である。この場合は6軸ロボットを使用した例であるが、ロボットは小型ロボット制御部361で制御される。まずホルダーへの食いつきの違いやチップ先端長さのばらつきから、微妙にチップ先端位置が異なるので、その先端位置補正を、顕微鏡やそれとは切り離して別に設けられた3次元位置顕微撮影装置376(X−Y平面),378(X−Z平面)でモニター上377,379に表示される先端点402に先端位置をジョイスティック405などの微動装置で移動させることで、補正絶対座標値が検出される。このチップ先端位置座標と、この顕微鏡ステージ373のZ軸移動エンコーダー値を顕微鏡X−Zステージ駆動部401からもらい、例えば視野中心部である焦点面を、チップ捕捉点・焦点面403として誘導座標を決め、あとはロボットを移動させるのみとさせる。この様に、微細空間では、顕微鏡の焦点位置とロボットが操作するチップ1の先端位置を、絶対座標あるいは相対座標の中で共有し、さらに、障害物などのそれらの位置情報をあらかじめコンピューターに記憶させておくことで、目標の微細試料へのチップ1などの、目的ツールを、高精度に、かつ正確に、かつその移動空間内での軌跡と向きなどの姿勢も含めて制御できる様になる。細胞付近にチップ先端が来ると急に細胞モニター画面372の色合いが、光をチップ先端がさえぎるので、変わる。ロボットと顕微鏡の間の絶対位置が正確でないと、再現性良くチップ誘導できないので、ロボット化微小域自動試料採取システムの取り付け台362の裏打ちとして取り付け台の剛性補強材400などを介して剛性強化して置くことも重要である。この様にして、簡便にかつ高速高精度で再現性良く細胞などの微小域試料を捕捉することができる様になる。尚、捕捉にあたっての、チップ内への成分吸引のための減圧吸引や、細胞などへのアプローチの際に培養液などをチップ1内に入れないための軽い加圧は、後述図12で説明する。
【実施例6】
【0020】
図7は、図6において、チップの先端位置補正を簡略化し、顕微鏡やそれとは切り離して別に設けられた3次元位置顕微撮影装置376(X−Y平面)のみでチップ先端をモニター377上に表示する様にしたものである。Z軸方向の補正は、ロボットが90度回転してチップ位置を見せることでわかるようにして、6軸ロボットの特性を使ってコストダウンを計ったものである。後は、図6と同じである。
【実施例7】
【0021】
図8は、チップ先端計測の別の手法を示したもので、チップ先端部が、非常に小さく焦点化された点をX軸、Y軸、Z軸移動で移動する際、通過光強度が大きく変化することを利用する。先端付近がこの小さな焦点化光経路を横切ると、非常に狭い範囲で大きな通過光強度の変化が生じる。チップ1をX軸、Y軸、Z軸ロボットで動かしながら、光強度変化で先端位置を割り出すことができ、その時の絶対座標をチップ1の先端座標とすることができる。また、ロボット363の回転軸を回転させることで、チップ1の中心回転軸からのずれにより、補正することもできる。
【実施例8】
【0022】
図9は、図6のシステムで、更にチップをラックから取り出したり、ラックに細胞などの捕捉後、チップを置いたりする操作をさせるものである。この試料採取後のチップをラックに置いて、その後、例えば、ロボットは指定の量の溶媒を入れることのできるマイクロディスペンサーを取り上げ、その先端に溶媒採量用のマイクロピペッティングチップを保持し、一定量の溶媒吸引操作の後、先ほど細胞などの成分を捕捉したナノスプレーチップの後端から、マイクロピペッティングチップの糸の様なプラスティック細管を当該ナノスプレーチップ内に挿入して、イオン化補助溶媒を試料採取チップに添加し、その後、ロボットはマイクロディスペンサーを所定のディスペンサー保持部に戻して離すこともできる。
【実施例9】
【0023】
図10は、図9に加え、更にロボットに質量分析装置へのチップの搬送をさせ、自動化を更に進めるものである。ロボットは、もう一度、溶媒を添加されたナノスプレーチップ1を取り上げ、チップ先端を下向きにしての振動付加や遠心力付加などで、ナノスプレーチップ先端に向かって溶媒を落とし、気泡などを取り除き、その後質量分析計の専用ナノスプレーイオン化アタッチメントに、このチップを置き去り、操作の1サイクルを終え、次の細胞などの微小域成分捕捉の準備のために、新しいナノスプレーチップをチップラックから取り上げ入る。これにより、質量分析計側では、同時にナノスプレーイオン化による細胞などの微小域成分の分子分析が平行してスタートすることになる。
【実施例10】
【0024】
図11は、上記のロボットのみによる細胞などの微小域試料捕捉において、最後の細胞捕捉などのための微動操作を変えたもので、更に細かく微動操作できる、従来の小型X−Y−Zマイクマニュピレーターをロボット先端部に取り付けた場合を示す。ロボット先端部が重くなり、ロボット自身がハンチングを起こさない範囲の重量で行う必要があるが、微動に関してはよりスムースになる。
【実施例11】
【0025】
図12は、図11やそれ以前の図で、細胞など微小域試料のナノスプレーチップ1での吸引捕獲のために、手での注射筒を使った吸引操作ではなく、ふさがりがちな手を用いないで、足によるペダル437の操作でピストン436を動かし、チューブを介して、捕捉にあたってのチップ内への成分吸引のための減圧吸引や、細胞などへのアプローチの際に培養液などをチップ1内に入れないための軽い加圧を可能とするものである。チューブ内には、吸引加圧の操作特性向上のために液体を入れることも可能である。この操作も電動で自動化できるが、操作のスムースさや適切性には欠ける。
【実施例12】
【0026】
図13は、上記システムを細胞観察の適正温度である摂氏36度付近に維持するためのもので、特に細胞を培養し長時間観察するためには必須の炭酸ガス濃度維持および恒温チェンバーである。正面は、二重ガラスでは無く、有機ガラス1枚で形成され、顕微鏡観察窓453、顕微鏡操作窓454やチップ取り出し窓455などが設けてあり、質量分析計を内部に入れて、全自動化を図ることもできる。その場合は、質量分析計やそのイオン化アタッチメントの維持のために、大きな透明ドア457を設ける。
【実施例13】
【0027】
図14は、実際に6軸小型ロボットを用いて、細胞刺入を行っている写真である。
【実施例14】
【0028】
図15は、図14において、細胞内刺入の最後の段階で、ジョイスティック操作により微動操作を行っているところである。いずれも期待を上回る性能を発揮した。
【実施例15】
【0029】
図16は、6軸小型ロボットを複数台設置して行う例を示しており、左側のロボットで浮遊細胞や卵など、貼り付き細胞と異なり、その位置が移動する試料に対し、先端口径が対象試料の大きさに近く、傷つけないように角が丸くなっている細管で、弱く吸引することで捕捉し、その捕捉位置は、ロボットの座標軸値から割り出せるので、その場所に、もう一つのロボットのチップの先端を誘導する事を可能としたシステムである。この様に複数のロボットを使う場合、絶対座標を共有できるロボットの特性を生かした操作がさらに可能となり、作業の高精度化と高効率化が達成できる。
【実施例16】
【0030】
図17は、ロボットを複数台設置し、観察する細胞の場と位置を確認しながら、その細胞に一本の光ファイバーでミクロの光照射をしたり、近接場光を先端に出す探査子を細胞に接触させたりしながら、その条件による細胞の変化を、もう一つのロボットの先端にある試料採取細管で捕捉する場合の一例である。測定試料(この場合は細胞であるが)に対し、他に微細な磁石で、磁気ビーズ上に細胞内成分を集めることをミクロ域で可能としたり、電極を細胞などにミクロに押し付けたり、挿入したり、親和性のある分子を表面に結合した分子捕捉針の様なものを細胞壁から細胞内に挿入したりと、今後は様々なミクロ域の操作が同時に可能となる。
【実施例17】
【0031】
図18は試料捕捉用の図3にある鞘付チップの、先端ナノスプレーイオン化細管チップ内部に、ロボットでも容易に溶液注入用のチップの髭の様な先端部482がチップ後端部から導入できるよう、鞘の結合部と、ナノスプレーイオン化細管チップ内径の間にスロープ480を設けた一例であり、ロボットは、当該チップで細胞などの試料成分を捕捉後、一度ラックにこのチップを置き、これに、この様な鞘の形状を生かして、このチップの後端から容易に、溶液添加用細管チップ481を使って、この細管内部に溶媒を添加する事ができる。今まで、この重要な溶媒添加作業も、細かな作業で、難しく、効率化の妨げになっていた。
【実施例18】
【0032】
図19は、本ロボットのタイプをフレーム移動型とした場合の全体操作の一例である。フレームを移動軸501として動くこのタイプのロボットは、低コストであるが、移動空間に制約が多く、使える場合が上記の6軸回転型のロボットよりは狭い。他にもアーム式や色々なロボットがあるが、その操作の基本は変わらない。
【実施例19】
【0033】
図20は、本ロボットにより、ヒトの血液を腕510から採取できるようにしたシステムの一例である。近赤外あるいは赤外域に感度を持つカメラ371をカメラに用いれば、温度の高い血管511などの位置を容易に可視化する。その焦点面から、血管の大きさと位置を確認できれば、ヒトの腕510を、血液採取する位置を生体試料採取ポイント確定プレート514で固定し、そこに注射針などの生体試料採取針515を刺入する。その時の血管壁通過などを針の根元に設置した採取時の感触センサー518で感知し、血管壁の片側を刺入した所で、ロボットの動きを止め、採血などに入るようにしている。そのセンサーからの信号は、センサー信号線520を介し、プリアンプ521で増幅されて、ロボット駆動コンピューターに送られる。
【実施例20】
【0034】
図21は指の指紋領域に見られる汗腺一つから噴き出るナノリッターレベルの汗を、本ロボットでナノスプレーイオン化細管チップ先端に捕捉する時の図の一例である。指の指紋領域にある汗腺一つから噴き出た汗530は、ナノスプレーイオン化チップ515で捕捉され、これに溶媒を後端から添加して、ナノスプレーイオン化質量分析法で直接分子ピークを検出した。その検出に成功した質量スペクトルを図21に示す。汗一滴から得られた質量スペクトルの中で、汗に特異的な分子ピークは130本あり、その中でアミノ酸とともに同定された分子のピークとその分子構造を3例記載した。摂取したカフェインやニコチン、および服用している医薬品分子の検出にも成功し、この成功は、将来診断などが、血液では無く、もっと患者に負荷のない、痛みの無い試料で様々にできる可能性を示している。
【産業上の利用可能性】
【0035】
合目的的に動き外部因子に応答している細胞は、その挙動と細胞内分子動態が連動することが多く、細胞の顕微観察と分子検出をリアルタイムに行うことで、生命現象の合目的的分子メカニズムを迅速に解明することができる。本発明は、生命現象とその分子メカニズムの両方を細胞1つまでミクロなスケールで、迅速かつ直接的に解明する手段を与え、その用途は膨大である。何よりも疾患細胞と正常細胞の動態と分子比較による疾患の分子メカニズムの解明が加速する。そして、細胞内分子メカニズムが分かれば、その分子あるいはメカニズムを利用した創薬や診断法、治療法の開発、新しい分子が見つかれば新医薬品への応用あるいはライフサイエンス用の試薬の開発、など実に多彩な応用が考えられる。
また、細胞内や生体組織中の細胞内の様々な分子メカニズムの解明の高速化は、医薬品候補分子も含め新分子の発見、新生命現象の発見の高速化をもたらし、医療や診断あるいはバイオ応用を大きく展開し加速することができる。例えば、再生医療などの万能細胞の細胞分化因子の高速探索、細胞分化制御、細胞増殖因子の発見や制御法、がん細胞など細胞種の分子診断や分子探索、細胞種の同定など様々な分析が高速に展開することとなる。
【0036】
現在、各種疾患について網羅的な解析が進められている多くの遺伝子およびその発現産物であるタンパク質等と関連して、細胞内の低分子動態を明確にすることができ、統合的な生命現象の解明が可能となり、生命現象の統合的理解は、人類の生命、健康の増進に大きく貢献し、付帯的な様々な事業を生み出しうる。
【0037】
また、食品分野では、風味、香等微妙な品質を研究できる細胞内や発酵液などの直接的で迅速な低分子動態の解析手段を与えることができる。
さらに一般的化学品製造産業等において、例えば、ナノテクノロジーの微小域分子機構の解明や、有機半導体、有機導電体、有機光学材料のように高純度が要求される製品の製造管理、あるいは食品添加物等の健康面での品質保証が重要な製品の製造過程において、微量の副生物が、物理化学的性能または安全性等の要求品質に悪影響を与えるような製造工程では、そのような副生物の監視、製造管理、品質管理など、微小域での分子検出と解析が可能となる。
【符号の説明】
【0038】
1 ナノスプレーイオン化細管チップ
2 質量分析装置
3 試料溶液と添加イオン化溶媒
4 高圧電圧(この場合はポジティブモードの例でありチップ側が+)
5 ナノスプレー
6 細管表面の金属コーティング部
8 細胞
9 顕微鏡ステージ
10 捕捉した細胞液
11 対物レンズ
12 ビデオカメラ
13 吸引操作
15 シャーレ
16 細胞培養液
17 モニター
35 細胞刺入ナノスプレー細管チップを細胞位置まで駆動するホルダーのX−Y−Z駆動ステージ(この図では電動型、手動のギア粗動・微動型もあり)
36 細胞刺入ナノスプレー細管チップを細胞位置まで駆動するホルダーの軸方向アクチュエーター(この図では電動型、他に手動の水圧または油圧ピストン駆動型もあり)
37 細胞刺入ナノスプレー細管チップを細胞位置まで駆動する軸方向アクチュエータによる細胞刺入および吸引後引き戻し移動方向
38 細胞刺入ナノスプレー細管チップホルダー駆動制御装置
39 細胞刺入ナノスプレー細管チップホルダー駆動用端末(この図ではジョイスティック)
40 細胞成分吸引駆動用チューブ
41 細胞成分吸引用ピストン(注射器でも代用可)
42 細胞成分吸引用ピストン駆動装置
338 ナノスプレー管内付設フィラメント
340 ナノスプレー吸引ホルダー
341 ナノスプレー吸引時密封O−リング
342 ホルダー取り付け部O−リング
343 ナノスプレー吸引ホルダー本体
344 吸引用鞘付きナノスプレーイオン化細管チップ(表面金属コーティングは細管のみでも、鞘を含んでコーティングしても可)
345 同心円状鞘(インジェクション成型などで製作、吸引部との接合部は丸状テーパ)
346 角状鞘(インジェクション成型などで製作、吸引部との接合部は丸状テーパ)
347 一部襟付き角状鞘(インジェクション成型などで製作、吸引部との接合部は丸状テーパ)
348 周囲襟付き角状鞘(インジェクション成型などで製作、吸引部との接合部は丸状テーパ)
349 鞘付きナノスプレーイオン化細管チップ収納ラック
350 鞘付きナノスプレーイオン化細管チップ収納用の穴(角型)
352 加熱フィラメント
353 ナノスプレーイオン化細管チップ開口後端部押し広げ用受け金型
354 ナノスプレーイオン化細管チップ開口後端部押し広げ用押し込み金型
355 出来上がった後端部鞘構造をした一体型ナノスプレーイオン化細管チップ(金属コーティングは、押し広げ前後のどちらで行っても良いが、後の方がより良い)
359 後端部鞘構造をした一体型ナノスプレーイオン化細管チップに金型形状の変化により形成した位置決め突起部
360 小型ロボット(一例として6軸制御ロボットを示す)
361 小型ロボット制御部
362 ロボット化微小域自動試料採取システムの取り付け台
363 ナノスプレーイオン化細管チップのロボット先端取り付け部
370 自動微小域試料採取用顕微鏡システム
371 顕微解析用ビデオカメラと対物レンズ
372 371で捉えた細胞のモニター図
373 顕微ステージ
374 顕微鏡X−Yステージ駆動部
375 細胞培養シャーレ
376 ナノスプレーイオン化細管チップの先端計測用対物レンズ付きビデオカメラ(X−Y平面)
377 376で捉えられたチップ先端図
378 ナノスプレーイオン化細管チップの先端計測用対物レンズ付きビデオカメラ(X−Z平面)
379 378で捉えられたチップ先端部
400 ロボット化微小域自動試料採取システムの取り付け台の剛性補強材
401 顕微鏡X−Zステージ駆動部
402 ナノスプレーイオン化細管チップの先端点
403 チップ捕捉点・焦点面
404 顕微鏡焦点面Z軸変動エンコード通信線
405 ロボット微動用アタッチメント(この場合はジョイスティック)
410 チップ先端検出用光源(この場合はレーザーなど)
411 光源用丸穴スリット
412 光源角度変更ミラー
413 集光レンズ
414 集光ポイント・ピンホールスリット
415 光検出器
420 チップ内捕捉試料ナノスプレーイオン化装置
421 ナノスプレーイオン化細管チップ固定・電圧印加部
425 質量分析計アタッチメントとしてのチップ内捕捉試料ナノスプレーイオン化装置
430 X−Y−Zマイクロマニュピレーター駆動部(水圧、油圧、電動など各種ある)
431 X−Y−Zマイクロマニュピレーター駆動用チューブ(水圧、油圧式の場合)または電線(電動式の場合)
432 X−Y−Zマイクロマニュピレーター微細駆動用回転式ハンドル
435 試料吸引用チューブ
436 試料吸引用ピストンシリンジ
437 ペダル
438 ペダル回転軸
439 ペダル回転時のスイングアーム
440 ペダル式試料吸引圧力調節機
450 細胞捕捉用または細胞捕捉分子解析統合システム用恒温チェンバー
451 細胞補足用恒温チェンバー台
452 二重ガラスまたは2重有機ガラス
453 顕微観察用窓
454 顕微鏡操作用窓
455 試料捕捉チップ取り出し窓
456 熱源(オイルヒーターなど)
457 質量分析計操作用ドア
460 浮遊細胞または卵などの浮遊性微小試料
461 細胞保持用ロボット
462 細胞保持用ピペット
463 細胞など微小試料保持・吸引・注入用ピストンシリンジ
470 光ファイバー
471 光源
472 光ファイバー保持ロッド
473 照射された光
480 溶液添加用細管導入スロープ
481 溶液添加用細管チップ
482 溶液添加用細管チップ先端部
483 細管内に添加された溶液
500 フレーム移動ロボット用フレーム支え
501 ロボット移動水平フレーム
505 ロボット回転部
506 ロボットのフレーム移動部
510 ヒトの腕(生体の一例)
511 血管
514 生体試料採取ポイント確定プレート
515 生体試料採取針
516 生体試料採取吸引ピストンシリンジ
517 生体試料採取ピストン駆動部
518 採取時の感触センサー
520 センサー信号線
521 センサー信号プリアンプ
530 指の指紋領域にある汗腺一つから噴き出た汗
540 汗一滴から得られた質量スペクトルと同定された分子
【特許請求の範囲】
【請求項1】
細胞など微小試料からの吸引捕捉または当該試料への注入において、ロボットの先端取り付け部に保持させた試料吸引用細管あるいは成分液体注入細管の先端の絶対空間座標ないしは相対空間座標と、当該試料の観察用顕微鏡での観察焦点面での吸引点あるいは注入点の絶対空間座標ないしは相対空間座標を規定し、計算したロボットアームの変位量により、当該細管を自動的に、所定の位置まで、所定の移動空間の軌跡を、所定の細管の向きなどの姿勢を維持して、細管の保管位置から当該ロボットにより、当該微小試料域に誘導を行う装置およびシステム
【請求項2】
請求項1において、さらに同じ機能の一台以上のロボットを設置し、その複数のロボットには、移動して位置の決まらない細胞などの対象微小試料を空間内に固定したり、微小試料の限られた空間に、光を当てたり、磁場を当てたり、分子を捕捉する先端部を持つ棒状微細器具を近づけたり試料内に挿入したりして、副次的な操作を同時に行えるようにした装置およびシステム
【請求項3】
請求項1において、試料吸引捕捉後、同じロボットか、別のロボットで当該細管に溶媒を添加し、その後、質量分析計のナノスプレーイオン化アタッチメントに当該チップを装着させることまでを自動的に行う装置およびシステム
【請求項4】
請求項1および2および3において、ロボットにより当該細管を対象試料近くまで移動させ、その後の操作は、ジョイスティックなどのインターフェイスを使い、ロボットを微細駆動させるか、ロボットの先端取り付け部に油圧あるいは水圧あるいは電動のマイクロマニュピレーターを保持し、所定の位置から、さらに微細な操作ができるようにした装置およびシステム
【請求項5】
請求項1,2、3および4において、試料吸引用細管チップあるいは成分液体注入チップへの吸引あるいは加圧を、チューブを介して、足で操作するピストンの動きで制御する装置およびシステム
【請求項6】
請求項1,2,3および4において、当該装置あるいはシステムを細胞が成育する炭酸ガス濃度ないしは温度に保ったチェンバー内に置き、かつチャンバー窓に形成した袖を通して、外から内部の雰囲気を最小限にしか変化させず、操作できるようにした装置およびシステム
【請求項7】
ロボット保持具やピストン付シリンダーと空気を漏らさないように容易に結合する様、鞘部を持ったナノスプレーイオン化チップであり、更に、後端から溶媒導入細管が入りやすいように、鞘の上記結合用保持部内面と、当該チップ内径の間をスムースな勾配で繋がれた鞘付ナノスプレーイオン化チップ
【請求項1】
細胞など微小試料からの吸引捕捉または当該試料への注入において、ロボットの先端取り付け部に保持させた試料吸引用細管あるいは成分液体注入細管の先端の絶対空間座標ないしは相対空間座標と、当該試料の観察用顕微鏡での観察焦点面での吸引点あるいは注入点の絶対空間座標ないしは相対空間座標を規定し、計算したロボットアームの変位量により、当該細管を自動的に、所定の位置まで、所定の移動空間の軌跡を、所定の細管の向きなどの姿勢を維持して、細管の保管位置から当該ロボットにより、当該微小試料域に誘導を行う装置およびシステム
【請求項2】
請求項1において、さらに同じ機能の一台以上のロボットを設置し、その複数のロボットには、移動して位置の決まらない細胞などの対象微小試料を空間内に固定したり、微小試料の限られた空間に、光を当てたり、磁場を当てたり、分子を捕捉する先端部を持つ棒状微細器具を近づけたり試料内に挿入したりして、副次的な操作を同時に行えるようにした装置およびシステム
【請求項3】
請求項1において、試料吸引捕捉後、同じロボットか、別のロボットで当該細管に溶媒を添加し、その後、質量分析計のナノスプレーイオン化アタッチメントに当該チップを装着させることまでを自動的に行う装置およびシステム
【請求項4】
請求項1および2および3において、ロボットにより当該細管を対象試料近くまで移動させ、その後の操作は、ジョイスティックなどのインターフェイスを使い、ロボットを微細駆動させるか、ロボットの先端取り付け部に油圧あるいは水圧あるいは電動のマイクロマニュピレーターを保持し、所定の位置から、さらに微細な操作ができるようにした装置およびシステム
【請求項5】
請求項1,2、3および4において、試料吸引用細管チップあるいは成分液体注入チップへの吸引あるいは加圧を、チューブを介して、足で操作するピストンの動きで制御する装置およびシステム
【請求項6】
請求項1,2,3および4において、当該装置あるいはシステムを細胞が成育する炭酸ガス濃度ないしは温度に保ったチェンバー内に置き、かつチャンバー窓に形成した袖を通して、外から内部の雰囲気を最小限にしか変化させず、操作できるようにした装置およびシステム
【請求項7】
ロボット保持具やピストン付シリンダーと空気を漏らさないように容易に結合する様、鞘部を持ったナノスプレーイオン化チップであり、更に、後端から溶媒導入細管が入りやすいように、鞘の上記結合用保持部内面と、当該チップ内径の間をスムースな勾配で繋がれた鞘付ナノスプレーイオン化チップ
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【公開番号】特開2011−120582(P2011−120582A)
【公開日】平成23年6月23日(2011.6.23)
【国際特許分類】
【出願番号】特願2010−271978(P2010−271978)
【出願日】平成22年11月16日(2010.11.16)
【出願人】(507170653)株式会社HUMANIX (2)
【Fターム(参考)】
【公開日】平成23年6月23日(2011.6.23)
【国際特許分類】
【出願日】平成22年11月16日(2010.11.16)
【出願人】(507170653)株式会社HUMANIX (2)
【Fターム(参考)】
[ Back to top ]

