細胞の膜電位測定用の培養液、及びそれを用いた培養方法、膜電位測定方法
【課題】従来の培養液には多くのアミノ酸やタンパク質等の物質を含むため、薬効を評価する被検化合物との間で相互作用や吸着が多く起こり、正確な薬効評価ができなかった。
【解決手段】細胞の膜電位測定用の培養液において、アミノ酸及びタンパク質を添加せずに、セレン並びに/又は硝酸イオン及び鉄イオンを含むことによって、蛍光標識が阻害されず、薬効を評価する試験の際に薬効を評価する被検化合物との相互作用や吸着が起こらず正確な測定をすることができる。また、特にヒトiPS細胞由来の心筋細胞において、培養液にセレン並びに/又は硝酸イオン及び鉄イオンを含むことによって長期間の膜電位測定ができる。
【解決手段】細胞の膜電位測定用の培養液において、アミノ酸及びタンパク質を添加せずに、セレン並びに/又は硝酸イオン及び鉄イオンを含むことによって、蛍光標識が阻害されず、薬効を評価する試験の際に薬効を評価する被検化合物との相互作用や吸着が起こらず正確な測定をすることができる。また、特にヒトiPS細胞由来の心筋細胞において、培養液にセレン並びに/又は硝酸イオン及び鉄イオンを含むことによって長期間の膜電位測定ができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、細胞の膜電位測定用の培養液、及びそれを用いた培養方法、膜電位測定方法に係り、特に、ヒトiPS細胞由来の心筋細胞の膜電位測定用の培養液、及びそれを用いた培養方法、膜電位測定方法に関する。
【背景技術】
【0002】
新規薬物開発においては、薬物の効能や毒性について迅速且つ適切に評価することが求められている。
そして、細胞の膜に存在する電位依存性のイオンチャンネル(細胞表面に存在する膜貫通タンパク質で、特定のイオンを選択的に通過させるもの)は、生理的に重要な機能を有しており、薬物開発の効能や毒性についての評価の標的となる。
例えば、イオンチャンネルに作用することで患者に重篤な不整脈を引き起こす疾患として薬物誘発性(後天性)QT延長症候群がある。薬物誘発性QT延長症候群は、薬物の投与後に心電図上のQT間隔の延長が起こり、TdP(Torsades de pointes、トルサード・ド・ポアンツ=非持続性多形性心室頻拍)から、しばしば心室細動が起こり、失神、突然死をきたす重篤な疾患である。この薬物誘発性QT延長症候群の誘発原因としては、薬物が心筋細胞のイオンチャネルに作用することで、調和のとれた心臓の拍動を阻害し、QT間隔の延長を引き起こすことが知られている(非特許文献1)。
【0003】
薬物が、薬物誘発性QT延長症候群を引き起こすかどうかを評価する方法の1例として細胞の膜電位測定方法がある。非特許文献2を参照すると、膜電位測定方法の1例として、パッチクランプ法や蛍光膜電位測定法が記載されている。
ここで、蛍光膜電位測定法は、蛍光カルシウムプローブ、Bis−oxonolのような膜透過性で陰イオン性の蛍光色素がイオンの移動に応じて細胞膜内外に移動することにより、この蛍光色素の蛍光を測定することで細胞の膜電位を計測する方法である。蛍光膜電位測定法は、非常に高いスループット性を有するという特徴がある。
蛍光膜電位測定法は、上述の細胞に被検化合物である薬物を与えたときに、蛍光を測定することで、薬物誘発性QT延長症候群の薬効評価として利用することができる。具体的には、毒性ある薬物によりhERGチャンネルの活動が阻害されると、所定の波長の電磁波を照射したときの蛍光光度が変化するため、これを検出することで膜電位の変化が検出できる。これにより、被検化合物である薬物が薬物誘発性QT延長症候群を引き起こすかについて検査できる。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】薬理雑誌121号、384〜392、2003年
【非特許文献2】薬理雑誌126号、321〜327、2005年
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、従来の細胞の膜電位測定に用いる培養液では、その培養液自体が蛍光を持つもしくは所定の波長の電磁波を照射する場合、蛍光を発するため、蛍光標識を検出する蛍光膜電位測定法等には適用できなかった。これは、基礎培地の成分や血清由来のタンパク質等、蛍光を発する物質を多く含むためであった。また、従来の培養液には多くのアミノ酸やタンパク質等の物質を含むため、薬効を評価する被検化合物との間で相互作用や吸着が多く起こり、正確な薬効評価ができなかった。
【0006】
本発明はこのような状況に鑑みてなされたものであり、上記問題点を解決できる培養液を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明の細胞の膜電位測定用の培養液は、細胞由来でないアミノ酸及びタンパク質を添加せずに、セレン並びに/又は硝酸イオン及び鉄イオンを含むことを特徴とする。
本発明の細胞の膜電位測定用の培養液は、前記セレンは亜セレン酸ナトリウムの濃度0.001〜0.1μMで供給され、並びに/又は前記硝酸イオン及び鉄イオンは硝酸鉄(III)の濃度0.1〜9μMで供給されることを特徴とする。
本発明の細胞の膜電位測定用の培養液は、前記細胞は、ヒトiPS細胞由来の心筋細胞であることを特徴とする。
本発明の細胞の培養方法は、本発明の培養液を用いることを特徴とする。
本発明の細胞の膜電位測定方法は、本発明の培養液を用いることを特徴とする。
【発明の効果】
【0008】
本発明の細胞の膜電位測定用の培養液は、タンパク質等の蛍光を発する物質を含まず、ほぼ無蛍光であるため、蛍光カルシウムプローブ、又は蛍光膜感受性色素のような蛍光色素等を使用する際にも蛍光標識が阻害されずに好適な測定結果を得ることができる。また、本発明の細胞の膜電位測定用の培養液は、アミノ酸及びタンパク質の濃度が蛍光膜電位測定法の測定可能濃度及び/又はアミノ酸及びタンパク質の濃度が被検化合物との相互作用や吸着を起こさない濃度以下であるため、薬効を評価する試験の際に薬効を評価する被検化合物との相互作用や吸着が起こらず正確な測定をすることができる。これにより、新規薬物の効能や毒性について迅速且つ適切に評価することができる。
【図面の簡単な説明】
【0009】
【図1】本発明の実施の形態に係る培養液の組成例を示した図である。
【図2】(a)本発明の実施の形態に係る培養液と(b)一般的な緩衝液との間で波形変化の比較例を示した図である。
【図3】(a)本発明の実施の形態に係る培養液と(b)従来の培養液との間でノイズの比較例を示した図である。
【図4A】本発明の実施の形態に係る培養液にQT間隔を延長する試薬(アステミゾール)の構造式を示した図である。
【図4B】本発明の実施の形態に係る培養液にQT間隔を延長する試薬(アステミゾール)のQT間隔の延長に対する濃度依存性曲線を示した図である。
【図4C】本発明の実施の形態に係る培養液にQT間隔を延長する試薬(アステミゾール)を添加した際の波形変化を詳細に示した図である。
【図4D】本発明の実施の形態に係る培養液にQT間隔を延長する試薬(アステミゾール)を添加した際の波形変化を詳細に示した図である。
【図4E】本発明の実施の形態に係る培養液にQT間隔を延長する試薬(アステミゾール)を添加した際の波形変化を詳細に示した図である。
【図5A】本発明の実施の形態に係る培養液にQT間隔に影響しないと判断される(±5%以内)試薬(アスピリン)のQT間隔の変動を示した図である。
【図5B】本発明の実施の形態に係る培養液にQT間隔に影響しないと判断される(±5%以内)試薬(アスピリン)のQT間隔の変動に対する濃度依存性曲線を示した図である。
【図5C】本発明の実施の形態に係る培養液にQT間隔に影響しないと判断される(±5%以内)試薬(アスピリン)を添加した際の波形変化を詳細に示した図である。
【図6】本発明の実施の形態に係る培養液のみでは同一実験環境下ではQT間隔に影響を与えないことを示した図である。
【発明を実施するための形態】
【0010】
上述のように、従来の細胞の膜電位測定に用いる培養液は、培養液自身が蛍光を発していたため、顕微鏡下での蛍光観察には適していなかった。したがって、本発明の発明者は、従来の培養液に代えて、より正確に膜電位測定及び蛍光標識を検出するための培養液を模索していた。
ここで当業者にとっては、細胞の膜電位測定用培養液として、細胞が正常に拍動を維持するために種々イオン、糖、必須アミノ酸、アルブミン等のタンパク質が常識的に必要と考えられており、これらの物質について最適濃度の調整を図ることで培養液の改良が図られてきた。
【0011】
ところが、本発明の発明者は、従来の培養液に多く含まれているアミノ酸やタンパク質等の物質は、蛍光を発し、薬効を検査する化合物と相互作用や吸着等をすることを見いだした。しかし、これらの物質を除くと、細胞を拍動したまま培養することが困難であり、そもそも蛍光観察を行うこと自体ができなかった。
これに対して、本発明の発明者は、アミノ酸やタンパク質を除いて蛍光や相互作用や吸着に係る物質を除去した状態でも、セレン並びに/又は硝酸イオン及び鉄イオンを添加することで、細胞を拍動したまま培養し、相互作用や吸着を抑えて蛍光観察を行うことができる顕著な効果が得られることを見いだし、本実施形態で例示した本発明に係る培養液を発明するに至った。
【0012】
すなわち、本発明の細胞の膜電位測定用培養液を用いることによって、細胞を長期間正常な状態で維持することができる。また、本発明の培養液は、無蛍光であるため、蛍光法による細胞の膜電位測定あるいは蛍光法や発光法を用いて観察する際にも検出系が妨害されずに好適な結果を得ることができる。また、本発明の培養液は、アミノ酸及びタンパク質の濃度が蛍光膜電位測定法の測定可能濃度及び/又はアミノ酸及びタンパク質の濃度が被検化合物との相互作用や吸着を起こさない濃度以下であるため、薬効を評価する試験の際に薬効を評価する被検化合物との相互作用や吸着が起こらず正確な測定をすることができる。さらに、本発明の培養液は、グルコースレベルおよび各種イオン強度を最適化しているため、心筋細胞等の正常な拍動を長時間観察することができる。
【0013】
(培養液の組成)
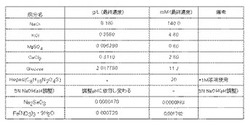
図1を示して、本発明の実施の形態に係る培養液の組成について説明する。
図1に示すように、本発明の実施の形態に係る培養液の成分は、主にナトリウム、カリウム、マグネシウム、カルシウム等の各イオン、糖、緩衝液、pH調整試薬から構成される。図1に示された各物質の濃度は、最終濃度を示す。以下、具体的に説明する。
【0014】
各イオンの濃度は、細胞の膜電位測定の最適化を図る上で適宜変更することができる。例えば、図1に示したように140mMの塩化ナトリウム(NaCl)、4.8mMの塩化カリウム(KCl)、0.8mMの硫酸マグネシウム(MgSO4)、2.8mMの塩化カルシウム(CaCl2)を用いることができる。また、他のイオンについても各細胞の特性や膜電位測定の目的等によって適宜添加することができる。
【0015】
糖の濃度は、膜電位測定の最適化を図る上で適宜変更できる。好ましくは、糖は、グルコース(Glucose)を用いる。例えば、11.2mMのグルコースを用いることができる。
【0016】
緩衝液は、膜電位測定の最適化を図る上で適宜変更することができる。好ましくは、緩衝液は、Hepes(C8H18N2O4S)を用いて作製する。緩衝液は、長期間の細胞培養中における培養液のアシドーシス等によるpHの変化を防ぐ目的もある。
なお、緩衝液としては、最適なpHを得るために任意の緩衝剤を用いることができ、例えば、PBS等を用いることもできる。
【0017】
pH調整試薬は、pHが調整できれば任意の物質を用いることができる。例えば、NaOH、HCl等の酸塩基物質を用いてpHを調整する。好ましくは、細胞培養の最適pHとなるように調整し、心筋細胞の培養の場合にはpH=7.2〜7.4の範囲で調整する。なお、各細胞の特性や膜電位測定の目的等によって適宜pHを任意に変化させて用いることができる。
【0018】
本発明の実施の形態に係る培養液では、必須アミノ酸や非必須アミノ酸といったアミノ酸、アルブミンといったタンパク質、ビタミン類、酵母エキス等といった従来の培養液で含有されている物質の濃度は、蛍光膜電位測定法の測定可能濃度及び/又は被検化合物と相互作用や吸着を起こさない濃度以下である。特に、アミノ酸及びタンパク質の濃度が、蛍光膜電位測定法の測定可能濃度及び/又はアミノ酸及びタンパク質の濃度が被検化合物との相互作用や吸着を起こさない濃度以下である。ここで、アミノ酸及びタンパク質の濃度とは、アミノ酸及びタンパク質を合わせた濃度のことを示す。そして、好ましくは、細胞由来でないアミノ酸及びタンパク質は全く添加されず含有されない。
このアミノ酸、タンパク質、ビタミン類、酵母エキス等の物質を含む培養液では、培養液自身が蛍光を有するようになり、高感度蛍光検出機器を使用する細胞の膜電位の正確な測定をすることが困難である。また、蛍光膜電位測定に用いる蛍光物質や薬効を評価する被検化合物が、これらの物質に相互作用や吸着するため、正確な測定結果が担保されない。
これに対して、本発明の実施の形態に係る培養液では、このアミノ酸、タンパク質、ビタミン類、酵母エキス等の物質といった培養液自身の蛍光に関与したり、被検化合物と相互作用や吸着するような物質を除いているため、従来の培養液が有していた正確な測定結果が担保されないといった不利益が克服される。
【0019】
さらに、本発明の実施の形態に係る培養液は、適切な濃度のセレンを含むことで細胞の蛍光膜電位測定を良好に行うことができる。これは、特にヒトiPS細胞由来の心筋細胞の測定において、長期間正常な膜電位測定を行うことができるという顕著な効果を奏する。
好ましくは、セレンは、Na2SeO3(亜セレン酸ナトリウム)によって提供する。さらに好ましくは、Na2SeO3の濃度は、0.001〜0.1μMで変動させることができる。
【0020】
さらに、本発明の実施の形態に係る培養液は、適切な濃度の硝酸イオン及び鉄イオンを含むことで細胞の蛍光膜電位測定を良好に行うことができる。これは、特にヒトiPS細胞由来の心筋細胞の測定において、長期間正常な膜電位測定を行うことができるという顕著な効果を奏する。
好ましくは、硝酸イオン及び鉄イオンは、Fe(NO3)3・9H2O(硝酸鉄(III)水和物)によって提供する。さらに好ましくは、Fe(NO3)3・9H2Oの濃度は、0.1〜9μMで変動させることができる。
【0021】
本発明の実施の形態に係る培養液は、当業者が使用することができる通常の方法で調製が可能である。例えば、予め調製した液に、各成分を添加調製して最終濃度とする方法などがある。被検物質は、任意の濃度から使用することができ、例えばDMSO等の適当な溶媒に溶かすか、測定用培地等の測定液に直接溶かしてもよい。
なお、図1で示した培養液の組成及び濃度は、あくまで各物質の濃度を最適化した一例であって、各物質の濃度は電位測定の最適化を図る上で適宜変更できる。例えば、使用する細胞の由来や細胞の種類等によって、培養液の組成を調整することが可能である。例えば、性質の異なる心筋細胞等では、培養液の組成について適宜調整することが必要である。
【0022】
本発明の実施の形態に係る試験培養液を用いることによって、例えば1日以上といった長期間において細胞の培養ができるようになる。この際に、細胞が拍動した状態を保つことができる。このように、細胞の膜電位測定用の培養液として最適化されているので、より細胞の機能を安定させて膜電位を長時間観察することができる。したがって、心筋細胞等の拍動運動する細胞の薬効評価に用いる測定を行うのに適した培養液であるといえる。
なお、培養液の組成が好ましく無い場合には、細胞の拍動停止、ひいては死滅が誘導される。拍動停止や死滅した細胞は、もはや観察に適切ではない。このため、本発明の実施の形態に係る培養液のように、拍動細胞の培養液をアミノ酸やタンパク質等を除いた状態で実現することは、困難であった。
【0023】
(本発明の培養液を用いた膜電位測定方法)
本発明の実施の形態に係る培養液を用いた膜電位測定方法の実際について、以下のプロトコルの例を示しながら説明する。なお、具体的な膜電位測定方法については、非特許文献2の記載を参照されたい。
【0024】
(1)まず、測定対象の細胞又は細胞のコロニーを適当な大きさ(約10μm〜1mm程度)に、例えばDMEMといった適当な培養液中で調製する。
測定対象の細胞としては、神経細胞、肝細胞、心筋細胞等の任意の細胞を用いることができる。また、これらの細胞は、単一で又は複数用いることができる。また、複数の細胞は、細胞塊(コロニー)であってもよい。より具体的な測定対象の細胞としては、幹細胞由来あるいは初代培養細胞拍動心筋塊があげられる。
【0025】
(2)次に、調製した細胞を、例えばDMEMといった適当な培養液の入った測定容器の中にピペット等を用いて移動する。
培養液中に移動された細胞は、自重により培養液中を測定容器の底面まで沈降する。また、遠心機を用いて遠心力を加えて測定容器の底面に沈降させてもよい。
【0026】
(3)次に、測定容器中の電極上等の好ましい位置に細胞を配置し、そのまま細胞が接着するまで静置する。この静置は、細胞により最適な所定期間行う。ヒトiPS細胞由来の心筋細胞では、1時間〜1日程度の静置を行うのが普通である。
ここで、膜電位測定を行う測定容器は、任意の形状であってもよい。例えば、培養皿の中心に複数個の電極を高密度に集積させて備える多電極シングルディッシュや、容器の底がすり鉢状になっていて自然に沈降した細胞が測定電極上で確実に接着する細胞測定容器(PCT/JP2009/059359参照)等を用いて行うことができる。
【0027】
(4)次に、細胞が電極等に接着した後、本発明の実施の形態に係る培養液に置換する。
ここでいう接着とは、電位を測定するのに適当な距離をもって固定されることをいう。このような作業を、細胞の配置及び培養液の置換の各作業毎に行う。
この際に、細胞が本発明の実施の形態に係る培養液に適応するまで、1日程度、そのまま培養することが可能である。また、この培養の際に、本発明の実施の形態に係る培養液を、通常の接着細胞の培養方法のように取り換えることも可能である。このように、本発明の実施の形態に係る培養液を用いると、長期の培養を行っても、拍動状態を保つことができる。
【0028】
(5)そして、膜電位測定に供する。
被検化合物等がある場合には、本発明の培養液に化合物を溶解して添加する。必要に応じて、被検化合物を供給した後に振動させる等して、培養液中に被検化合物を拡散させることもできる。細胞の接着後にこの作業を行うことにより、振動等の影響で電極等から細胞が剥がれるのを防止することができる。被検化合物が供給されると、細胞の膜電位の計測値が変化するので、被検化合物の供給前後での計測値の変化の状態から、各化合物が細胞に与える影響を評価することにより、薬効評価を行う。この薬効評価には多電極システムを用いることができる。
【実施例】
【0029】
以下の実施例によって本発明の実施の形態に係る培養液をさらに具体的に説明する。この実施例は一例にすぎず、これに限定されるものではない。
【0030】
(心筋細胞の測定例)
本発明の実施の形態に係る培養液を用いて、測定対象の細胞として拍動を行うヒトiPS細胞由来で、公知の方法にて分化させた心筋細胞を蛍光膜電位測定法を用いて膜電位測定を行った実施例を示す。
【0031】
図2を用いて、心筋細胞の膜電位測定における拍動の比較例を示す。図2(a)は本発明の実施の形態に係る培養液を用いて膜電位測定を行った結果を示し、図2(b)は一般的な緩衝液のひとつである(11.2mMのグルコース含有PBS)を用いて膜電位測定を行った結果を示す。矢印で示した時間は2分間を示す。縦のスパイク状の信号が心筋細胞の拍動の発生を示す。
これらの実験結果から、本発明の実施の形態に係る培養液では、心筋細胞から継続的に規則正しく拍動が観察されるが、一般的な緩衝液では、心筋細胞からの拍動は断続的になり規則正しくなく安定しない拍動が観察される。
このように本発明の実施の形態に係る培養液では、より正確な拍動が観察される膜電位測定をすることができることが示される。
【0032】
次に、図3を用いて、心筋細胞の膜電位測定におけるノイズの比較例を示す。図3(a)は本発明の実施の形態に係る培養液を用いて膜電位測定を行った結果を示し、図3(b)は従来の培養液を用いて膜電位測定を行った結果を示す。ここで従来の培養液とは、DMEM(ギブコ社製等)にウシ血清(ギブコ社製等、10〜20%)を加えたものである。
これらの実験結果から、本発明の実施の形態に係る培養液を用いた場合には、明確な鋭いNa+ピーク(Na+カレントピーク:QRS波様波形)と共に、矢印で示したようにK+ピーク(K+カレントピーク:T波様波形)と考えられる波形が確認できる。また、本発明の実施の形態に係る培養液を用いることによってノイズが少なくなるため、薬効評価の詳細パラメータの観察も容易な膜電位波形の測定ができる。それに対して、従来の培養液では、ノイズが多い波形となり、Na+ピークとNa+ピークの間隔は不規則であり、電位波形の振幅も不均一であった。また、本発明の実施の形態に係る培養液で確認されたようなK+ピーク様の波形は確認できなかった。
このように本発明の実施の形態に係る培養液では、よりノイズの少ない正確な細胞の膜電位測定をすることができるため、K+ピーク様の波形も検出することが可能であり、被検化合物の薬効評価に供することができる培養液であることが示される。
【0033】
次に、図4A〜Eを用いて、QT間隔を延長する試薬(アステミゾール、和光純薬)を用いたポジティブコントロールとしての測定例を示す。図4Aは、アステミゾールの構造式を示す。図4Bは、アステミゾールを濃度0.10nMから、0.01Mの濃度で加えた際の、QT間隔の延長(norm QT−Interval)に対する濃度依存性曲線を示す。図4C〜Eは、アステミゾールを添加した際の時間経過毎(Time[ms])の電位変化(FP[μV])を詳細に示し、図4C、図4D、図4Eになるにつれて図が拡大されている。
これらの実験結果から、図4Bに示すように、アステミゾールを用いてQT間隔を測定した場合には、濃度に依存してQT間隔が延長していることが分かる。また、図4C、図4D、図4Eに示すように、アステミゾールを添加した場合には、無添加、添加低濃度領域、高濃度領域までNa+ピーク及びK+ピークが検出されて良好に測定が可能であることが分かる。
【0034】
次に、図5A〜Cを用いて、QT間隔に影響を与えない(±5%以内)試薬(アスピリン、Cayman chemical company)を用いたネガティブコントロールとしての測定例を示す。図5Aは、アスピリンのQT間隔に影響を与えない(±5%以内)ことを示したものである。図5Bは、アスピリンを濃度0.10nMから、0.10Mの濃度で加えた際のQT間隔(norm QT−Interval)に対する濃度依存性曲線を示す。図5Cは、アスピリンを添加した際の時間経過毎(Time[ms])の電位変化(FP[μV])を詳細に示す。
これらの実験結果から、図5Aに示すように、アスピリンを用いてQT間隔を測定した場合には、試験濃度域においてQT間隔が変化していないことが分かる。また、図5Bに示すように、アスピリンを用いてQT間隔を測定した場合には、試験濃度域においてQT間隔が変化していないことが分かる。また、図5Cに示すように、アスピリンを添加した場合には無添加、添加低濃度領域から高濃度領域までNa+ピーク及びK+ピークが検出され良好に測定が可能であることが分かる。
【0035】
次に、図6を用いて、QT間隔に影響を与えない本発明の実施の形態に係る培地をアステミゾールおよびアスピリンを実験したときと同じ手順で測定した例を示す。
この実験結果から、図6に示すように、本発明の実施の形態に係る培地を用いてQT間隔を測定した場合には、濃度に依存してQT間隔は変化しないことが分かる。
【0036】
このように本発明の実施の形態に係る培養液を用いて膜電位測定を行った場合には、QT間隔への影響の有無に関係なく任意の化合物を用いても、詳細なノイズの少ない膜電位波形を検出することができた。これは、まさに本発明の実施の形態に係る培養液が、イオンチャンネルに影響を与えるような被検化合物の薬効評価に適したものであることが示されたものである。
【0037】
また、従来から、蛍光膜電位測定法は、非常に高いスループット性を有していたが、擬陽性の割合も高いという難点があった。しかし、本発明の実施の形態に係る培養液を用いることによって、詳細な膜電位波形を検出することができるようになるため、擬陽性の割合を低減させることができることによる正確な被検化合物の薬効評価が期待される。これにより薬効評価を早め、新規薬物の開発を迅速化、効率化することができる。
【産業上の利用可能性】
【0038】
本発明によれば、蛍光がなく被検化合物との相互作用や吸着を起こさない拍動細胞用の培養液を提供することで、新規薬物の薬効評価を迅速にしてコストを低減することができる。
【技術分野】
【0001】
本発明は、細胞の膜電位測定用の培養液、及びそれを用いた培養方法、膜電位測定方法に係り、特に、ヒトiPS細胞由来の心筋細胞の膜電位測定用の培養液、及びそれを用いた培養方法、膜電位測定方法に関する。
【背景技術】
【0002】
新規薬物開発においては、薬物の効能や毒性について迅速且つ適切に評価することが求められている。
そして、細胞の膜に存在する電位依存性のイオンチャンネル(細胞表面に存在する膜貫通タンパク質で、特定のイオンを選択的に通過させるもの)は、生理的に重要な機能を有しており、薬物開発の効能や毒性についての評価の標的となる。
例えば、イオンチャンネルに作用することで患者に重篤な不整脈を引き起こす疾患として薬物誘発性(後天性)QT延長症候群がある。薬物誘発性QT延長症候群は、薬物の投与後に心電図上のQT間隔の延長が起こり、TdP(Torsades de pointes、トルサード・ド・ポアンツ=非持続性多形性心室頻拍)から、しばしば心室細動が起こり、失神、突然死をきたす重篤な疾患である。この薬物誘発性QT延長症候群の誘発原因としては、薬物が心筋細胞のイオンチャネルに作用することで、調和のとれた心臓の拍動を阻害し、QT間隔の延長を引き起こすことが知られている(非特許文献1)。
【0003】
薬物が、薬物誘発性QT延長症候群を引き起こすかどうかを評価する方法の1例として細胞の膜電位測定方法がある。非特許文献2を参照すると、膜電位測定方法の1例として、パッチクランプ法や蛍光膜電位測定法が記載されている。
ここで、蛍光膜電位測定法は、蛍光カルシウムプローブ、Bis−oxonolのような膜透過性で陰イオン性の蛍光色素がイオンの移動に応じて細胞膜内外に移動することにより、この蛍光色素の蛍光を測定することで細胞の膜電位を計測する方法である。蛍光膜電位測定法は、非常に高いスループット性を有するという特徴がある。
蛍光膜電位測定法は、上述の細胞に被検化合物である薬物を与えたときに、蛍光を測定することで、薬物誘発性QT延長症候群の薬効評価として利用することができる。具体的には、毒性ある薬物によりhERGチャンネルの活動が阻害されると、所定の波長の電磁波を照射したときの蛍光光度が変化するため、これを検出することで膜電位の変化が検出できる。これにより、被検化合物である薬物が薬物誘発性QT延長症候群を引き起こすかについて検査できる。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】薬理雑誌121号、384〜392、2003年
【非特許文献2】薬理雑誌126号、321〜327、2005年
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、従来の細胞の膜電位測定に用いる培養液では、その培養液自体が蛍光を持つもしくは所定の波長の電磁波を照射する場合、蛍光を発するため、蛍光標識を検出する蛍光膜電位測定法等には適用できなかった。これは、基礎培地の成分や血清由来のタンパク質等、蛍光を発する物質を多く含むためであった。また、従来の培養液には多くのアミノ酸やタンパク質等の物質を含むため、薬効を評価する被検化合物との間で相互作用や吸着が多く起こり、正確な薬効評価ができなかった。
【0006】
本発明はこのような状況に鑑みてなされたものであり、上記問題点を解決できる培養液を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明の細胞の膜電位測定用の培養液は、細胞由来でないアミノ酸及びタンパク質を添加せずに、セレン並びに/又は硝酸イオン及び鉄イオンを含むことを特徴とする。
本発明の細胞の膜電位測定用の培養液は、前記セレンは亜セレン酸ナトリウムの濃度0.001〜0.1μMで供給され、並びに/又は前記硝酸イオン及び鉄イオンは硝酸鉄(III)の濃度0.1〜9μMで供給されることを特徴とする。
本発明の細胞の膜電位測定用の培養液は、前記細胞は、ヒトiPS細胞由来の心筋細胞であることを特徴とする。
本発明の細胞の培養方法は、本発明の培養液を用いることを特徴とする。
本発明の細胞の膜電位測定方法は、本発明の培養液を用いることを特徴とする。
【発明の効果】
【0008】
本発明の細胞の膜電位測定用の培養液は、タンパク質等の蛍光を発する物質を含まず、ほぼ無蛍光であるため、蛍光カルシウムプローブ、又は蛍光膜感受性色素のような蛍光色素等を使用する際にも蛍光標識が阻害されずに好適な測定結果を得ることができる。また、本発明の細胞の膜電位測定用の培養液は、アミノ酸及びタンパク質の濃度が蛍光膜電位測定法の測定可能濃度及び/又はアミノ酸及びタンパク質の濃度が被検化合物との相互作用や吸着を起こさない濃度以下であるため、薬効を評価する試験の際に薬効を評価する被検化合物との相互作用や吸着が起こらず正確な測定をすることができる。これにより、新規薬物の効能や毒性について迅速且つ適切に評価することができる。
【図面の簡単な説明】
【0009】
【図1】本発明の実施の形態に係る培養液の組成例を示した図である。
【図2】(a)本発明の実施の形態に係る培養液と(b)一般的な緩衝液との間で波形変化の比較例を示した図である。
【図3】(a)本発明の実施の形態に係る培養液と(b)従来の培養液との間でノイズの比較例を示した図である。
【図4A】本発明の実施の形態に係る培養液にQT間隔を延長する試薬(アステミゾール)の構造式を示した図である。
【図4B】本発明の実施の形態に係る培養液にQT間隔を延長する試薬(アステミゾール)のQT間隔の延長に対する濃度依存性曲線を示した図である。
【図4C】本発明の実施の形態に係る培養液にQT間隔を延長する試薬(アステミゾール)を添加した際の波形変化を詳細に示した図である。
【図4D】本発明の実施の形態に係る培養液にQT間隔を延長する試薬(アステミゾール)を添加した際の波形変化を詳細に示した図である。
【図4E】本発明の実施の形態に係る培養液にQT間隔を延長する試薬(アステミゾール)を添加した際の波形変化を詳細に示した図である。
【図5A】本発明の実施の形態に係る培養液にQT間隔に影響しないと判断される(±5%以内)試薬(アスピリン)のQT間隔の変動を示した図である。
【図5B】本発明の実施の形態に係る培養液にQT間隔に影響しないと判断される(±5%以内)試薬(アスピリン)のQT間隔の変動に対する濃度依存性曲線を示した図である。
【図5C】本発明の実施の形態に係る培養液にQT間隔に影響しないと判断される(±5%以内)試薬(アスピリン)を添加した際の波形変化を詳細に示した図である。
【図6】本発明の実施の形態に係る培養液のみでは同一実験環境下ではQT間隔に影響を与えないことを示した図である。
【発明を実施するための形態】
【0010】
上述のように、従来の細胞の膜電位測定に用いる培養液は、培養液自身が蛍光を発していたため、顕微鏡下での蛍光観察には適していなかった。したがって、本発明の発明者は、従来の培養液に代えて、より正確に膜電位測定及び蛍光標識を検出するための培養液を模索していた。
ここで当業者にとっては、細胞の膜電位測定用培養液として、細胞が正常に拍動を維持するために種々イオン、糖、必須アミノ酸、アルブミン等のタンパク質が常識的に必要と考えられており、これらの物質について最適濃度の調整を図ることで培養液の改良が図られてきた。
【0011】
ところが、本発明の発明者は、従来の培養液に多く含まれているアミノ酸やタンパク質等の物質は、蛍光を発し、薬効を検査する化合物と相互作用や吸着等をすることを見いだした。しかし、これらの物質を除くと、細胞を拍動したまま培養することが困難であり、そもそも蛍光観察を行うこと自体ができなかった。
これに対して、本発明の発明者は、アミノ酸やタンパク質を除いて蛍光や相互作用や吸着に係る物質を除去した状態でも、セレン並びに/又は硝酸イオン及び鉄イオンを添加することで、細胞を拍動したまま培養し、相互作用や吸着を抑えて蛍光観察を行うことができる顕著な効果が得られることを見いだし、本実施形態で例示した本発明に係る培養液を発明するに至った。
【0012】
すなわち、本発明の細胞の膜電位測定用培養液を用いることによって、細胞を長期間正常な状態で維持することができる。また、本発明の培養液は、無蛍光であるため、蛍光法による細胞の膜電位測定あるいは蛍光法や発光法を用いて観察する際にも検出系が妨害されずに好適な結果を得ることができる。また、本発明の培養液は、アミノ酸及びタンパク質の濃度が蛍光膜電位測定法の測定可能濃度及び/又はアミノ酸及びタンパク質の濃度が被検化合物との相互作用や吸着を起こさない濃度以下であるため、薬効を評価する試験の際に薬効を評価する被検化合物との相互作用や吸着が起こらず正確な測定をすることができる。さらに、本発明の培養液は、グルコースレベルおよび各種イオン強度を最適化しているため、心筋細胞等の正常な拍動を長時間観察することができる。
【0013】
(培養液の組成)
図1を示して、本発明の実施の形態に係る培養液の組成について説明する。
図1に示すように、本発明の実施の形態に係る培養液の成分は、主にナトリウム、カリウム、マグネシウム、カルシウム等の各イオン、糖、緩衝液、pH調整試薬から構成される。図1に示された各物質の濃度は、最終濃度を示す。以下、具体的に説明する。
【0014】
各イオンの濃度は、細胞の膜電位測定の最適化を図る上で適宜変更することができる。例えば、図1に示したように140mMの塩化ナトリウム(NaCl)、4.8mMの塩化カリウム(KCl)、0.8mMの硫酸マグネシウム(MgSO4)、2.8mMの塩化カルシウム(CaCl2)を用いることができる。また、他のイオンについても各細胞の特性や膜電位測定の目的等によって適宜添加することができる。
【0015】
糖の濃度は、膜電位測定の最適化を図る上で適宜変更できる。好ましくは、糖は、グルコース(Glucose)を用いる。例えば、11.2mMのグルコースを用いることができる。
【0016】
緩衝液は、膜電位測定の最適化を図る上で適宜変更することができる。好ましくは、緩衝液は、Hepes(C8H18N2O4S)を用いて作製する。緩衝液は、長期間の細胞培養中における培養液のアシドーシス等によるpHの変化を防ぐ目的もある。
なお、緩衝液としては、最適なpHを得るために任意の緩衝剤を用いることができ、例えば、PBS等を用いることもできる。
【0017】
pH調整試薬は、pHが調整できれば任意の物質を用いることができる。例えば、NaOH、HCl等の酸塩基物質を用いてpHを調整する。好ましくは、細胞培養の最適pHとなるように調整し、心筋細胞の培養の場合にはpH=7.2〜7.4の範囲で調整する。なお、各細胞の特性や膜電位測定の目的等によって適宜pHを任意に変化させて用いることができる。
【0018】
本発明の実施の形態に係る培養液では、必須アミノ酸や非必須アミノ酸といったアミノ酸、アルブミンといったタンパク質、ビタミン類、酵母エキス等といった従来の培養液で含有されている物質の濃度は、蛍光膜電位測定法の測定可能濃度及び/又は被検化合物と相互作用や吸着を起こさない濃度以下である。特に、アミノ酸及びタンパク質の濃度が、蛍光膜電位測定法の測定可能濃度及び/又はアミノ酸及びタンパク質の濃度が被検化合物との相互作用や吸着を起こさない濃度以下である。ここで、アミノ酸及びタンパク質の濃度とは、アミノ酸及びタンパク質を合わせた濃度のことを示す。そして、好ましくは、細胞由来でないアミノ酸及びタンパク質は全く添加されず含有されない。
このアミノ酸、タンパク質、ビタミン類、酵母エキス等の物質を含む培養液では、培養液自身が蛍光を有するようになり、高感度蛍光検出機器を使用する細胞の膜電位の正確な測定をすることが困難である。また、蛍光膜電位測定に用いる蛍光物質や薬効を評価する被検化合物が、これらの物質に相互作用や吸着するため、正確な測定結果が担保されない。
これに対して、本発明の実施の形態に係る培養液では、このアミノ酸、タンパク質、ビタミン類、酵母エキス等の物質といった培養液自身の蛍光に関与したり、被検化合物と相互作用や吸着するような物質を除いているため、従来の培養液が有していた正確な測定結果が担保されないといった不利益が克服される。
【0019】
さらに、本発明の実施の形態に係る培養液は、適切な濃度のセレンを含むことで細胞の蛍光膜電位測定を良好に行うことができる。これは、特にヒトiPS細胞由来の心筋細胞の測定において、長期間正常な膜電位測定を行うことができるという顕著な効果を奏する。
好ましくは、セレンは、Na2SeO3(亜セレン酸ナトリウム)によって提供する。さらに好ましくは、Na2SeO3の濃度は、0.001〜0.1μMで変動させることができる。
【0020】
さらに、本発明の実施の形態に係る培養液は、適切な濃度の硝酸イオン及び鉄イオンを含むことで細胞の蛍光膜電位測定を良好に行うことができる。これは、特にヒトiPS細胞由来の心筋細胞の測定において、長期間正常な膜電位測定を行うことができるという顕著な効果を奏する。
好ましくは、硝酸イオン及び鉄イオンは、Fe(NO3)3・9H2O(硝酸鉄(III)水和物)によって提供する。さらに好ましくは、Fe(NO3)3・9H2Oの濃度は、0.1〜9μMで変動させることができる。
【0021】
本発明の実施の形態に係る培養液は、当業者が使用することができる通常の方法で調製が可能である。例えば、予め調製した液に、各成分を添加調製して最終濃度とする方法などがある。被検物質は、任意の濃度から使用することができ、例えばDMSO等の適当な溶媒に溶かすか、測定用培地等の測定液に直接溶かしてもよい。
なお、図1で示した培養液の組成及び濃度は、あくまで各物質の濃度を最適化した一例であって、各物質の濃度は電位測定の最適化を図る上で適宜変更できる。例えば、使用する細胞の由来や細胞の種類等によって、培養液の組成を調整することが可能である。例えば、性質の異なる心筋細胞等では、培養液の組成について適宜調整することが必要である。
【0022】
本発明の実施の形態に係る試験培養液を用いることによって、例えば1日以上といった長期間において細胞の培養ができるようになる。この際に、細胞が拍動した状態を保つことができる。このように、細胞の膜電位測定用の培養液として最適化されているので、より細胞の機能を安定させて膜電位を長時間観察することができる。したがって、心筋細胞等の拍動運動する細胞の薬効評価に用いる測定を行うのに適した培養液であるといえる。
なお、培養液の組成が好ましく無い場合には、細胞の拍動停止、ひいては死滅が誘導される。拍動停止や死滅した細胞は、もはや観察に適切ではない。このため、本発明の実施の形態に係る培養液のように、拍動細胞の培養液をアミノ酸やタンパク質等を除いた状態で実現することは、困難であった。
【0023】
(本発明の培養液を用いた膜電位測定方法)
本発明の実施の形態に係る培養液を用いた膜電位測定方法の実際について、以下のプロトコルの例を示しながら説明する。なお、具体的な膜電位測定方法については、非特許文献2の記載を参照されたい。
【0024】
(1)まず、測定対象の細胞又は細胞のコロニーを適当な大きさ(約10μm〜1mm程度)に、例えばDMEMといった適当な培養液中で調製する。
測定対象の細胞としては、神経細胞、肝細胞、心筋細胞等の任意の細胞を用いることができる。また、これらの細胞は、単一で又は複数用いることができる。また、複数の細胞は、細胞塊(コロニー)であってもよい。より具体的な測定対象の細胞としては、幹細胞由来あるいは初代培養細胞拍動心筋塊があげられる。
【0025】
(2)次に、調製した細胞を、例えばDMEMといった適当な培養液の入った測定容器の中にピペット等を用いて移動する。
培養液中に移動された細胞は、自重により培養液中を測定容器の底面まで沈降する。また、遠心機を用いて遠心力を加えて測定容器の底面に沈降させてもよい。
【0026】
(3)次に、測定容器中の電極上等の好ましい位置に細胞を配置し、そのまま細胞が接着するまで静置する。この静置は、細胞により最適な所定期間行う。ヒトiPS細胞由来の心筋細胞では、1時間〜1日程度の静置を行うのが普通である。
ここで、膜電位測定を行う測定容器は、任意の形状であってもよい。例えば、培養皿の中心に複数個の電極を高密度に集積させて備える多電極シングルディッシュや、容器の底がすり鉢状になっていて自然に沈降した細胞が測定電極上で確実に接着する細胞測定容器(PCT/JP2009/059359参照)等を用いて行うことができる。
【0027】
(4)次に、細胞が電極等に接着した後、本発明の実施の形態に係る培養液に置換する。
ここでいう接着とは、電位を測定するのに適当な距離をもって固定されることをいう。このような作業を、細胞の配置及び培養液の置換の各作業毎に行う。
この際に、細胞が本発明の実施の形態に係る培養液に適応するまで、1日程度、そのまま培養することが可能である。また、この培養の際に、本発明の実施の形態に係る培養液を、通常の接着細胞の培養方法のように取り換えることも可能である。このように、本発明の実施の形態に係る培養液を用いると、長期の培養を行っても、拍動状態を保つことができる。
【0028】
(5)そして、膜電位測定に供する。
被検化合物等がある場合には、本発明の培養液に化合物を溶解して添加する。必要に応じて、被検化合物を供給した後に振動させる等して、培養液中に被検化合物を拡散させることもできる。細胞の接着後にこの作業を行うことにより、振動等の影響で電極等から細胞が剥がれるのを防止することができる。被検化合物が供給されると、細胞の膜電位の計測値が変化するので、被検化合物の供給前後での計測値の変化の状態から、各化合物が細胞に与える影響を評価することにより、薬効評価を行う。この薬効評価には多電極システムを用いることができる。
【実施例】
【0029】
以下の実施例によって本発明の実施の形態に係る培養液をさらに具体的に説明する。この実施例は一例にすぎず、これに限定されるものではない。
【0030】
(心筋細胞の測定例)
本発明の実施の形態に係る培養液を用いて、測定対象の細胞として拍動を行うヒトiPS細胞由来で、公知の方法にて分化させた心筋細胞を蛍光膜電位測定法を用いて膜電位測定を行った実施例を示す。
【0031】
図2を用いて、心筋細胞の膜電位測定における拍動の比較例を示す。図2(a)は本発明の実施の形態に係る培養液を用いて膜電位測定を行った結果を示し、図2(b)は一般的な緩衝液のひとつである(11.2mMのグルコース含有PBS)を用いて膜電位測定を行った結果を示す。矢印で示した時間は2分間を示す。縦のスパイク状の信号が心筋細胞の拍動の発生を示す。
これらの実験結果から、本発明の実施の形態に係る培養液では、心筋細胞から継続的に規則正しく拍動が観察されるが、一般的な緩衝液では、心筋細胞からの拍動は断続的になり規則正しくなく安定しない拍動が観察される。
このように本発明の実施の形態に係る培養液では、より正確な拍動が観察される膜電位測定をすることができることが示される。
【0032】
次に、図3を用いて、心筋細胞の膜電位測定におけるノイズの比較例を示す。図3(a)は本発明の実施の形態に係る培養液を用いて膜電位測定を行った結果を示し、図3(b)は従来の培養液を用いて膜電位測定を行った結果を示す。ここで従来の培養液とは、DMEM(ギブコ社製等)にウシ血清(ギブコ社製等、10〜20%)を加えたものである。
これらの実験結果から、本発明の実施の形態に係る培養液を用いた場合には、明確な鋭いNa+ピーク(Na+カレントピーク:QRS波様波形)と共に、矢印で示したようにK+ピーク(K+カレントピーク:T波様波形)と考えられる波形が確認できる。また、本発明の実施の形態に係る培養液を用いることによってノイズが少なくなるため、薬効評価の詳細パラメータの観察も容易な膜電位波形の測定ができる。それに対して、従来の培養液では、ノイズが多い波形となり、Na+ピークとNa+ピークの間隔は不規則であり、電位波形の振幅も不均一であった。また、本発明の実施の形態に係る培養液で確認されたようなK+ピーク様の波形は確認できなかった。
このように本発明の実施の形態に係る培養液では、よりノイズの少ない正確な細胞の膜電位測定をすることができるため、K+ピーク様の波形も検出することが可能であり、被検化合物の薬効評価に供することができる培養液であることが示される。
【0033】
次に、図4A〜Eを用いて、QT間隔を延長する試薬(アステミゾール、和光純薬)を用いたポジティブコントロールとしての測定例を示す。図4Aは、アステミゾールの構造式を示す。図4Bは、アステミゾールを濃度0.10nMから、0.01Mの濃度で加えた際の、QT間隔の延長(norm QT−Interval)に対する濃度依存性曲線を示す。図4C〜Eは、アステミゾールを添加した際の時間経過毎(Time[ms])の電位変化(FP[μV])を詳細に示し、図4C、図4D、図4Eになるにつれて図が拡大されている。
これらの実験結果から、図4Bに示すように、アステミゾールを用いてQT間隔を測定した場合には、濃度に依存してQT間隔が延長していることが分かる。また、図4C、図4D、図4Eに示すように、アステミゾールを添加した場合には、無添加、添加低濃度領域、高濃度領域までNa+ピーク及びK+ピークが検出されて良好に測定が可能であることが分かる。
【0034】
次に、図5A〜Cを用いて、QT間隔に影響を与えない(±5%以内)試薬(アスピリン、Cayman chemical company)を用いたネガティブコントロールとしての測定例を示す。図5Aは、アスピリンのQT間隔に影響を与えない(±5%以内)ことを示したものである。図5Bは、アスピリンを濃度0.10nMから、0.10Mの濃度で加えた際のQT間隔(norm QT−Interval)に対する濃度依存性曲線を示す。図5Cは、アスピリンを添加した際の時間経過毎(Time[ms])の電位変化(FP[μV])を詳細に示す。
これらの実験結果から、図5Aに示すように、アスピリンを用いてQT間隔を測定した場合には、試験濃度域においてQT間隔が変化していないことが分かる。また、図5Bに示すように、アスピリンを用いてQT間隔を測定した場合には、試験濃度域においてQT間隔が変化していないことが分かる。また、図5Cに示すように、アスピリンを添加した場合には無添加、添加低濃度領域から高濃度領域までNa+ピーク及びK+ピークが検出され良好に測定が可能であることが分かる。
【0035】
次に、図6を用いて、QT間隔に影響を与えない本発明の実施の形態に係る培地をアステミゾールおよびアスピリンを実験したときと同じ手順で測定した例を示す。
この実験結果から、図6に示すように、本発明の実施の形態に係る培地を用いてQT間隔を測定した場合には、濃度に依存してQT間隔は変化しないことが分かる。
【0036】
このように本発明の実施の形態に係る培養液を用いて膜電位測定を行った場合には、QT間隔への影響の有無に関係なく任意の化合物を用いても、詳細なノイズの少ない膜電位波形を検出することができた。これは、まさに本発明の実施の形態に係る培養液が、イオンチャンネルに影響を与えるような被検化合物の薬効評価に適したものであることが示されたものである。
【0037】
また、従来から、蛍光膜電位測定法は、非常に高いスループット性を有していたが、擬陽性の割合も高いという難点があった。しかし、本発明の実施の形態に係る培養液を用いることによって、詳細な膜電位波形を検出することができるようになるため、擬陽性の割合を低減させることができることによる正確な被検化合物の薬効評価が期待される。これにより薬効評価を早め、新規薬物の開発を迅速化、効率化することができる。
【産業上の利用可能性】
【0038】
本発明によれば、蛍光がなく被検化合物との相互作用や吸着を起こさない拍動細胞用の培養液を提供することで、新規薬物の薬効評価を迅速にしてコストを低減することができる。
【特許請求の範囲】
【請求項1】
細胞由来でないアミノ酸及びタンパク質を添加せずに、セレン並びに/又は硝酸イオン及び鉄イオンを含むことを特徴とする細胞の膜電位測定用の培養液。
【請求項2】
前記セレンは亜セレン酸ナトリウムの濃度0.001〜0.1μMで供給され、並びに/又は前記硝酸イオン及び鉄イオンは硝酸鉄(III)の濃度0.1〜9μMで供給されることを特徴とする請求項1に記載の培養液。
【請求項3】
前記細胞は、ヒトiPS細胞由来の心筋細胞であることを特徴とする請求項1又は2に記載の培養液。
【請求項4】
請求項1から3のいずれか1項に記載の培養液を用いた細胞の培養方法。
【請求項5】
請求項1から3のいずれか1項に記載の培養液を用いた細胞の膜電位測定方法。
【請求項1】
細胞由来でないアミノ酸及びタンパク質を添加せずに、セレン並びに/又は硝酸イオン及び鉄イオンを含むことを特徴とする細胞の膜電位測定用の培養液。
【請求項2】
前記セレンは亜セレン酸ナトリウムの濃度0.001〜0.1μMで供給され、並びに/又は前記硝酸イオン及び鉄イオンは硝酸鉄(III)の濃度0.1〜9μMで供給されることを特徴とする請求項1に記載の培養液。
【請求項3】
前記細胞は、ヒトiPS細胞由来の心筋細胞であることを特徴とする請求項1又は2に記載の培養液。
【請求項4】
請求項1から3のいずれか1項に記載の培養液を用いた細胞の培養方法。
【請求項5】
請求項1から3のいずれか1項に記載の培養液を用いた細胞の膜電位測定方法。
【図1】


【図2】


【図3】


【図4A】


【図4B】


【図4C】


【図4D】


【図4E】


【図5A】


【図5B】


【図5C】


【図6】




【図2】


【図3】


【図4A】


【図4B】


【図4C】


【図4D】


【図4E】


【図5A】


【図5B】


【図5C】


【図6】


【公開番号】特開2011−15643(P2011−15643A)
【公開日】平成23年1月27日(2011.1.27)
【国際特許分類】
【出願番号】特願2009−162753(P2009−162753)
【出願日】平成21年7月9日(2009.7.9)
【出願人】(503341675)株式会社リプロセル (13)
【Fターム(参考)】
【公開日】平成23年1月27日(2011.1.27)
【国際特許分類】
【出願日】平成21年7月9日(2009.7.9)
【出願人】(503341675)株式会社リプロセル (13)
【Fターム(参考)】
[ Back to top ]

