細胞のNF−κB活性化を調節するための組成物および方法
【課題】ユビキチン経路を経由するIκB分解のさらなる理解を提供すること。
【解決手段】核因子κB(NF−κB)の活性化を調節する組成物および方法が提供される。この組成物は、リン酸化IκBαおよび/またはIκBβのユビキチン化を調節する1つ以上の因子を含む。このような組成物は、NF−κB活性化に関連する疾患を処置するために用いられ得る。調節因子は、E3ユビキチンリガーゼの認識ドメインを含むペプチドを含む。
【解決手段】核因子κB(NF−κB)の活性化を調節する組成物および方法が提供される。この組成物は、リン酸化IκBαおよび/またはIκBβのユビキチン化を調節する1つ以上の因子を含む。このような組成物は、NF−κB活性化に関連する疾患を処置するために用いられ得る。調節因子は、E3ユビキチンリガーゼの認識ドメインを含むペプチドを含む。
【発明の詳細な説明】
【技術分野】
【0001】
(技術分野)
本発明は、一般に、核因子κB(NF−κB)の活性化を調節する組成物および方法に関する。より詳細には、本発明は、リン酸化IκBαおよび/またはIκBβのユビキチン化を調節する因子、このような因子を同定する方法、およびNF−κB活性化と関連する疾患を処置する方法に関する。本発明に含まれる調節因子は、E3ユビキチンリガーゼの認識ドメインを含むペプチドを含む。
【背景技術】
【0002】
(発明の背景)
NF−κBは、インターロイキン1、インターロイキン8、腫瘍壊死因子および特定の細胞接着分子を含む、免疫、炎症性および急性相応答遺伝子で観察される高度に特異的なパターンの遺伝子発現で中心的役割を果たす転写因子である。転写アクチベーターのRelファミリーの他のメンバーのように、NF−κBは、大部分の細胞型の細胞質中で不活性形態で隔離されている。マイトゲン、サイトカイン、抗原、ストレス誘導剤、UV光および生体タンパク質を含む種々の細胞外刺激は、最終的にはNF−κB放出および活性化を導くシグナル伝達経路を開始する。
【0003】
NF−κB活性化の重要なモジュレーターは、インビボでNF−κBと会合(そしてそれによってこれを不活性化する)インヒビタータンパク質IκBαおよびIκBβ(本明細書でIκBと呼ぶ)である。NF−κBの活性化および核移行は、シグナルで誘導されるIκBのリン酸化の後で起こり、これは、ユビキチン経路を経由するタンパク質分解に至る。IκBαについていえば、刺激で誘導されたセリン32および36におけるリン酸化は、このインヒビターを、リジン21および22におけるユビキチン化の標的にし、その結果分解する。同様に、セリン19および23におけるIκBβのリン酸化は、このインヒビターを、リジン9におけるユビキチン化の標的にする。しかし、ユビキチン系により認識されるIκBの部位、およびIκB認識を仲介するユビキチン系の成分のいずれも同定されていない。
【0004】
ユビキチン経路を経由するタンパク質の分解は、以下の2つの別個の連続的な工程により進行する:(a)複数ユビキチン分子のタンパク質基質への共有結合、および(b)26Sプロテオソーム複合体の標的となるタンパク質の分解である。ユビキチン経路は、協調し、かつ階層的な様式で作用するいくつかの成分からなる(レビューのために、非特許文献1;非特許文献2;非特許文献3;非特許文献4を参照のこと)。1つのこのような成分、単一のE1酵素は、ユビキチンの活性化を実施する。E2酵素のいくつかの主要な種が、哺乳動物細胞、植物および酵母で特徴付けられている。E2酵素は、おそらく、リガーゼE3に結合し(非特許文献5;非特許文献6)、そして各E2酵素は、1つ以上のE3タンパク質とともに作用し得るようである(非特許文献7;非特許文献8;非特許文献9;非特許文献10)。
【0005】
ほんのわずかのE3酵素(ユビキチンリガーゼ)が記載されている。哺乳動物E3α(酵母におけるUBR1)およびE3βは、タンパク質基質の遊離のN末端アミノ酸残基を介してそれらを認識する(「N末端規則」;非特許文献11;非特許文献12)。Cdc53は、おそらく、リン酸化G1サイクリンを標的にする際に関与するE3である(非特許文献13)。E6−APは、p53の認識に関与し(非特許文献14)、そして一連の特有のE6−AP相同タンパク質が同定されている(非特許文献15):Nedd4は、上皮Na+チャンネルの分解に関与し(非特許文献16)、そしてRSP5(NIP1)は、パーミアーゼGap1およびFur1をタグ化することに関与し(非特許文献17)、その一方、Pub1は、Cdc25を標的にする(非特許文献18)。最近単離されたいくつかのその他のE3酵素は、筋肉タンパク質のサブセットであるc−Fosの分解に、およびNF−κBの前駆体であるp105のプロセシングに関与するようである(非特許文献8;非特許文献9;非特許文献10)。従って、リガーゼ類は、大きな、大部分が解明されていない酵素のファミリーを示すようであり、「N末端規則」リガーゼ(E3αおよびE3β)の認識の様式を除いて、ユビキチン系のすべてのその他の既知の基質の認識モチーフは同定されていない。
【0006】
従って、当該技術分野には、ユビキチン経路を経由するIκB分解のさらなる理解に対する要求、およびNF−κBの活性化に関連する疾患を処置することにおける使用のためのこの分解プロセスのモジュレーターの同定に対する要求が存在する。本発明はこれらの要求を満たし、そしてその他の関連する利点をさらに提供する。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Ciechanover、Cell 79:13、1994
【非特許文献2】Hochstrasser、Curr. Op. Cell. Biol. 7:215、1995
【非特許文献3】JentschおよびSchlenker、Cell 82:881、1995
【非特許文献4】Deshaies、Trends Cell Biol.5:428、1995
【非特許文献5】ReissおよびHersko、J.Biol.Chem.265:3685、1990
【非特許文献6】Dohmenら、Proc.Natl.Acad.Sci.USA 88:7351、1991
【非特許文献7】Nuberら、J.Biol.Chem.271:2795、1996
【非特許文献8】Orianら、J.Biol.Chem.270:21707、1995
【非特許文献9】Stancovskiら、Mol.Cell.Biol.15:7106、1995
【非特許文献10】Gonenら、J.Biol.Chem.271:302、1996
【非特許文献11】Varshavsky、Cell 69:725、1992
【非特許文献12】HershkoおよびCiechanover、Ann.Rev.Biochem. 61:761、1992
【非特許文献13】Willemsら、Cell 86:453、1996
【非特許文献14】Scheffnerら、Cell 75:495、1993
【非特許文献15】Huibregtseら、Proc.Natl.Acad.Sci. USA 92:2563、1995
【非特許文献16】Staubら、Embo J.15:2371、1996
【非特許文献17】Heinら、Mol.Microbiol.18:77、1995
【非特許文献18】NefskyおよびBeach、EMBO J.15:1301、1996
【発明の概要】
【課題を解決するための手段】
【0008】
(発明の要旨)
簡単に述べれば、本発明は、リン酸化IκBαおよび/またはIκBβのユビキチン化を調節することにより核因子κB(NF−κB)の活性化を調節する組成物および方法を提供する。1つの局面では、本発明は、インビボでユビキチン化を行うIκBポリペプチドの能力をアッセイする方法を提供し、この方法は、(a)IκBポリペプチドを細胞抽出物とインキュベートする工程であって、ここで該インキュベートする工程は、IκBポリペプチドのリン酸化およびリン酸化IκBポリペプチドとNF−κBとを含む複合体の形成を可能にするに十分な条件下および時間の間実施され;(b)次いで該複合体をインビトロユビキチン化に供する工程;および(c)次いで該複合体のユビキチン化の程度を評価し、そしてそれによってIκBポリペプチドがインビボでユビキチン化を行う能力をアッセイする工程、を包含する。
【0009】
別の局面では、IκBαおよび/またはIκBβのユビキチン化を調節する因子を同定する方法が提供され、この方法は、(a)候補因子を、IκBポリペプチドおよび細胞抽出物とインキュベートする工程であって、ここで該インキュベートする工程は、IκBポリペプチドのリン酸化およびリン酸化IκBポリペプチドとNF−κBとを含む複合体の形成を可能にするに十分な条件下および時間の間実施され;および(b)次いで該複合体のユビキチン化を調節する候補因子の能力を測定し、そしてそれからIκBαおよび/またはIκBβのユビキチン化を調節する因子を同定する工程を包含する。
【0010】
本発明はまた、IκBαおよび/またはIκBβのユビキチン化を調節する因子を提供する。このような因子は、E3ユビキチンリガーゼの認識ドメインを含むペプチドを含み、例えば、配列番号5〜配列番号9に記載のペプチドを包含する。ペプチド因子をコードする、単離されたDNA分子および組換え発現ベクター、ならびにこのような発現ベクターで形質転換またはトランスフェクトされた宿主細胞もまた提供する。
【0011】
別の局面では、本発明は、IκBαおよび/またはIκBβのユビキチン化を調節する1つ以上の因子を、薬学的に受容可能なキャリアと組み合わせて含む、薬学的組成物を提供する。
【0012】
本発明はまた、さらなる局面で、患者におけるNF−κB活性を調節する方法、およびNF−κB活性化に関連する障害をもつ患者を処置する方法を提供し、
これらの方法は、患者に上記の薬学的組成物を投与する工程を包含する。NF−κB活性化に関連する障害には、炎症性疾患、自己免疫疾患、癌およびウイルス感染が包含される。
【0013】
本発明のこれらおよびその他の局面は、以下の詳細な説明および添付の図面を参照すれば明らかになる。本明細書に開示されるすべての参考文献は、各々が個々に援用されるように、それらの全体が参考として本明細書に援用される。
【0014】
本発明は、例えば以下の項目を提供する。
(項目1) インビボでユビキチン化を行うIκBポリペプチドの能力をアッセイする方法であって:
(a)IκBポリペプチドを細胞抽出物とインキュベートする工程であって、ここで該インキュベートする工程は、IκBポリペプチドのリン酸化およびリン酸化IκBポリペプチドとNF−κBとを含む複合体の形成を可能にするに十分な条件下および時間の間実施され;
(b)次いで該複合体をインビトロでユビキチン化に供する工程;および
(c)次いで該複合体のユビキチン化の程度を評価し、そしてそれによってIκBポリペプチドがインビボでユビキチン化を行う能力をアッセイする工程、
を包含する方法。
(項目2) IκBαおよび/またはIκBβのユビキチン化を調節する因子を同定する方法であって:
(a)候補因子を、IκBポリペプチドおよび細胞抽出物とインキュベートする工程であって、ここで該インキュベートする工程は、IκBポリペプチドのリン酸化およびリン酸化IκBポリペプチドとNF−κBとを含む複合体の形成を可能にするに十分な条件下および時間の間実施され;および
(b)次いで、該候補因子の、該複合体のユビキチン化を調節する能力を測定し、そしてそれからIκBαおよび/またはIκBβのユビキチン化を調節する因子を同定する工程。
(項目3) 前記因子がペプチドである、項目2に記載の方法。
(項目4) 前記ペプチドが、E3ユビキチンリガーゼの認識ドメインを含む、項目3に記載の方法。
(項目5) IκBαおよび/またはIκBβのユビキチン化を調節する因子。
(項目6) 前記因子がペプチドである、項目5に記載の因子。
(項目7) 前記因子が、E3ユビキチンリガーゼの認識ドメインを含む、項目6に記載の因子。
(項目8) 前記因子が、配列番号5〜配列番号9の少なくとも1つに記載のアミノ酸配列を含む、項目7に記載の因子。
(項目9) 項目6〜8の少なくとも1つに記載の因子をコードする、単離されたDNA分子。
(項目10) 項目9に記載のDNA分子を含む、組換え発現ベクター。
(項目11) 項目10に記載の発現ベクターで形質転換またはトランスフェクトされた、宿主細胞。
(項目12) 前記宿主細胞が、細菌、酵母、バキュロウイルスに感染した昆虫細胞および哺乳動物細胞からなる群から選択される、項目11に記載の宿主細胞。
(項目13) IκBαおよび/またはIκBβのユビキチン化を調節する因子を、薬学的に受容可能なキャリアと組み合わせて含む、薬学的組成物。
(項目14) 患者におけるNF−κB活性を調節する方法であって、項目13に記載の薬学的組成物を患者に投与する工程を包含する、方法。
(項目15) NF−κB活性化に関連する障害をもつ患者を処置する医薬の製造における使用のための、項目5〜8のいずれか1つに記載の因子。
(項目16) 前記障害が、炎症性疾患、自己免疫疾患、癌およびウイルス感染からなる群から選択される、項目15に記載の因子。
【図面の簡単な説明】
【0015】
【図1A】図1A〜1Dは、代表的な調節因子の存在下および非存在下で実施されたユビキチン化アッセイのSDS−PAGE分析の結果を示すオートラジオグラムである。他に示されていなければ、基質は、リン酸化され、そしてNF−κBが複合会合した、35S標識、HAタグ化IκBポリペプチドであった。図1A中、レーン1は、32位および36位にアラニン残基を含むIκBαポリペプチド(S32/36A;配列番号13)のユビキチン化を示し、そしてレーン2は、非リン酸化野生型IκBαポリペプチド(配列番号12)のユビキチン化を示す。レーン3〜14では、ユビキチン化の基質は、野生型IκBα(配列番号12)であった。レーン3では、ユビキチン化は、ATPの非存在下で実施され;そしてレーン4〜14では、反応は、ATPγSの存在下で、候補ペプチド調節因子とともに(レーン5〜14)またはなしで(レーン4)実施された。示された候補因子は:400μMのc−Fosホスホペプチド(ppFos(配列番号10)、レーン5);400μMのセリン32、36をアラニンで置換したIκBαペプチド(pp21S/A(配列番号11)、レーン6);40μMの二重リン酸化IκBαペプチド(pp21(配列番号9、レーン7);400μMの非リン酸化IκBαペプチド(p21(配列番号9、レーン8);100μMの1つのリン酸化IκBαペプチド(ppS32(配列番号9、レーン9;ppS36(配列番号9)、レーン10);および40μMの、より短い、二重リン酸化IκBαペプチド(pp19(配列番号8)、レーン11);pp15(配列番号7)、レーン12;pp11(配列番号6)、レーン13;pp7(配列番号5)、レーン14)である。
【図1B】図1A〜1Dは、代表的な調節因子の存在下および非存在下で実施されたユビキチン化アッセイのSDS−PAGE分析の結果を示すオートラジオグラムである。他に示されていなければ、基質は、リン酸化され、そしてNF−κBが複合会合した、35S標識、HAタグ化IκBポリペプチドであった。図1Bでは、ユビキチン化基質は、遊離の野生型IκBα(配列番号12、レーン1〜3)または遊離のS32/36A置換IκBα(配列番号13、レーン4〜6)であった。反応は、ATPγSの非存在下(レーン1および4)または存在下(レーン2、3、5および6)で実施された。40μMの二重リン酸化IκBαペプチド(pp21(配列番号9)を、レーン3および6に示された試料中の結合反応混合物に添加した。
【図1C】図1A〜1Dは、代表的な調節因子の存在下および非存在下で実施されたユビキチン化アッセイのSDS−PAGE分析の結果を示すオートラジオグラムである。他に示されていなければ、基質は、リン酸化され、そしてNF−κBが複合会合した、35S標識、HAタグ化IκBポリペプチドであった。図1Cでは、HeLa抽出物中のバルク細胞タンパク質のユビキチン化が示される。レーン1は、ATP非存在下のユビキチン化を示し、そしてレーン5は、ATP存在下のユビキチン化を示す。レーン3〜5では、以下の候補調節因子が添加された:40μMの二重リン酸化IκBαペプチド(pp21(配列番号9)、レーン2);400μMのc−Fosホスホペプチド(ppFos(配列番号10)、レーン3);および400μMの非リン酸化IκBαペプチド(p21(配列番号9)、レーン4)。
【図1D】図1A〜1Dは、代表的な調節因子の存在下および非存在下で実施されたユビキチン化アッセイのSDS−PAGE分析の結果を示すオートラジオグラムである。他に示されていなければ、基質は、リン酸化され、そしてNF−κBが複合会合した、35S標識、HAタグ化IκBポリペプチドであった。図1Dでは、ユビキチン化基質は、リン酸化(レーン2〜7)または非リン酸化(レーン1)野生型IκBβ(配列番号14)であった。反応は、ATPγSの非存在下(レーン2)または存在下(レーン1、3〜7)で、かつ候補ペプチド調節因子とともに(レーン4〜7)またはなしで(レーン1〜3)実施された。示された候補因子は:400μMの二重リン酸化IκBαペプチド(pp21(配列番号9)、レーン4);400μMのc−Fosホスホペプチド(ppFos(配列番号10)、レーン5);40μMの二重リン酸化IκBαペプチド(pp19(配列番号8、レーン6);および400μMの非リン酸化IκBαペプチド(p21(配列番号9、レーン7)である。
【図2】図2は、刺激されたHeLa細胞からの抽出物を用いて実施された、インビトロでのユビキチン依存性分解アッセイの結果を示すオートラジオグラムである。SDS−PAGEの各レーンにおいて、分解アッセイ後の、リン酸化(上のバンド)および非リン酸化(下のバンド)HAタグ化IκBαポリペプチド(配列番号12)のレベルが示される。レーン1は、ATPなしで実施された分解アッセイ後のこれらのペプチドのレベルを示す。レーン2〜6では、ATPを反応混合物中に含めた。40μMの候補調節因子が、レーン3〜6に示される反応物に添加された:二重リン酸化IκBαペプチド(pp21(配列番号9)、レーン3);二重リン酸化IκBαペプチド(pp19(配列番号8、レーン4);c−Fosホスホペプチド(ppFos(配列番号10)、レーン5);および非リン酸化IκBαペプチド(p21(配列番号9、レーン6)である。
【図3A】図3Aは、調節因子カラム上で分画されたHeLa細胞溶解物のフロースルー画分を用いて実施されたユビキチンアッセイのSDS−PAGEの結果を示すオートラジオグラムである。各場合において、基質は、リン酸化およびNF−κB複合会合された、35S標識、HAタグ化IκBαポリペプチド(配列番号12)であった。レーン1は、非分画抽出物を用いるユビキチン化のレベルを示す。レーン2〜9では、抽出物は、ペプチドSepharose(登録商標)カラム上で分画した。用いたペプチドは:c−Fosホスホペプチド(ppFos(配列番号10)、レーン2);セリン32、36をアラニンで置換したIκBαペプチド(pp21S/A(配列番号11)、レーン3);二重リン酸化IκBαペプチド(pp21(配列番号9、レーン4〜6);および二重リン酸化IκBαペプチド(pp19(配列番号8、レーン7〜9)である。さらに、網状赤血球画分II(160μg)を、レーン5および8に示されるユビキチン化反応物に添加し、そして画分I(160μg)を、レーン6および9中の反応物に添加した。
【図3B】図3Bは、HeLa抽出物中のバルク細胞タンパク質のユビキチン化を示すオートラジオグラムである。レーン1は、ATP非存在下のユビキチン化を示し、そしてレーン2は、ATP存在下のユビキチン化を示し、しかし、候補調節因子なしである。レーン3〜6では、以下の候補調節因子が添加された:40μMの二重リン酸化IκBαペプチド(pp19(配列番号8)、レーン3);400μMのc−Fosホスホペプチド(ppFos(配列番号10)、レーン4);400μMのセリン32、36をアラニンで置換したIκBαペプチド(pp21S/A(配列番号11)、レーン5);および40μMの二重リン酸化IκBαペプチド(pp21(配列番号9、レーン6)。
【図4−1】図4A〜4Fは、核NF−κB移行に対する候補調節因子の影響を示す顕微鏡写真である。図4A〜4Cでは、pp21(図4Aおよび4B)またはppFos(図4C)が、HeLa細胞の細胞質にマイクロインジェクトされた。次いで細胞を、即座にTNFαで活性化し、そして抗p65抗体で免疫染色した。図4D〜Fでは、pp21(図4D)またはppFos(図4F)が、ヒト血管内皮細胞(HUVEC)の細胞質に注入された。次いで細胞を、即座にTNFαで活性化し、そして抗Eセレクチン抗体で免疫染色した。図4Eは、図4Dの位相差写真である。各顕微鏡写真において、注入された細胞は大きな矢印で記されている。図4Dおよび4Eでは、小矢印によって、注入されていないEセレクチンネガティブ細胞が記されている。
【図4−2】図4A〜4Fは、核NF−κB移行に対する候補調節因子の影響を示す顕微鏡写真である。図4A〜4Cでは、pp21(図4Aおよび4B)またはppFos(図4C)が、HeLa細胞の細胞質にマイクロインジェクトされた。次いで細胞を、即座にTNFαで活性化し、そして抗p65抗体で免疫染色した。図4D〜Fでは、pp21(図4D)またはppFos(図4F)が、ヒト血管内皮細胞(HUVEC)の細胞質に注入された。次いで細胞を、即座にTNFαで活性化し、そして抗Eセレクチン抗体で免疫染色した。図4Eは、図4Dの位相差写真である。各顕微鏡写真において、注入された細胞は大きな矢印で記されている。図4Dおよび4Eでは、小矢印によって、注入されていないEセレクチンネガティブ細胞が記されている。
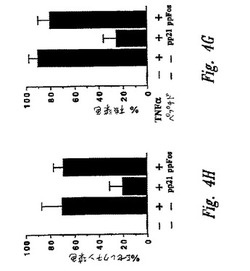
【図4−3】図4Gおよび4Hは、図4A〜4Fに示されるマイクロインジェクション実験の要約を示すグラフである。図4Gには、核p65染色を示すHeLa細胞のパーセントが示される。90および42細胞は、それぞれpp21およびppFosでマイクロインジェクトされた。図4Hは、Eセレクチン染色を示すHUVECのパーセントを示す。160および36細胞は、それぞれ、pp21およびppFosでマイクロインジェクトされた。各グラフについて、カラム1は、候補調節因子およびTNFα活性化の非存在下でのレベルを示す。カラム2〜4は、候補調節因子の非存在下(カラム2)、pp21の存在下(カラム3)またはppFosの存在下(カラム4)のTNFα活性化後のレベルを示す。
【発明を実施するための形態】
【0016】
(発明の詳細な説明)
上記の通り、本発明は一般的に、核因子κB(NF−κB)の活性化の調節およびこのような活性化に関連する疾患の処置に有用な組成物および方法に関する。特に、本発明は、リン酸化IκB(すなわち、IκBαおよび/またはIκBβ)のユビキチン化を調節する因子、ならびにそのような因子の同定の方法に関する。
【0017】
刺激に応答して、NF−κBと会合したIκBは活性化され(すなわち、リン酸化され)、そしてIκBを分解の標的とし、それによってNF−κBを遊離および活性化する。本発明の状況において、リン酸化され、そしてNF−κBと会合したIκBは、特異的なユビキチンリガーゼE3により認識されることが見出されている。IκBαおよびIκBβ間で機能的に保存されているN末端シグナル誘導リン酸化部位は、E3認識モチーフを構成し、そして近傍のユビキチン化部位と異なる。このモチーフに対応するペプチドおよびその改変体は、IκBのユビキチン化およびそれに続く分解を阻害し、そしてそのようなペプチドは本発明の範囲中の調節因子である。
【0018】
1つの局面において、本発明は、インビボでのIκBαのユビキチン化を高い忠実度で再現するインビトロでのユビキチン化アッセイを提供する。インビボにおいて、IκBはセリン32およびセリン36のリン酸化による分解の標識となり、その一方で、32位と36位にアラニン残基を含有するIκBαの改変形態は、ユビキチン結合に供されない。同様に、セリン19およびセリン23のリン酸化は、IκBβのユビキチン化に必要とされる。しかし、遊離IκBは、ユビキチン系により非差別的様式で認識される(すなわち、リン酸化は必要とされない)。本明細書中で提供されるユビキチン化アッセイは、インビボにおいて観察される調節に対応するIκBユビキチン化の調節を可能とする。
【0019】
本明細書中に記載されるユビキチン化アッセイに使用されるIκBポリペプチドは、ネイティブヒトIκBα(配列番号1)あるいはネイティブヒトIκBβ(配列番号3)であり得、またはネイティブタンパク質の改変体であり得る。本明細書中で使用するように、改変体は、1つ以上の置換および/または改変を含有するポリペプチドである。改変体としては、短縮型ポリペプチドおよびポリペプチドの活性に最小の影響を有するさらなるアミノ酸配列を含有するポリペプチドが挙げられる。特に、改変体は、さらなるアミノ酸配列をアミノ末端および/またはカルボキシル末端に含有し得る。このような配列は、例えば、ポリペプチドの精製または検出を容易にするために、使用され得る。IκBのポリペプチド改変体は、本明細書中に記載するようなユビキチン化アッセイにおいてリン酸化およびユビキチン化される改変体の能力が、実質的に減少しないように、改変される。好ましくは、IκBポリペプチドは標識される。例えば、標準的な技術を用い、35Sメチオニン存在下で、35Sは、ポリペプチドのインビトロ翻訳によってIκBポリペプチド中に取り込まれ得る。
【0020】
IκBポリペプチドは、一般的に、培養宿主細胞中のDNAの発現により、またはコムギ胚抽出物のようなインビトロ系を用いた翻訳により、ポリペプチドをコードするDNAから調製され得る。宿主細胞が用いられる場合、そのような細胞は、好ましくは、細菌、酵母、バキュロウイルス感染昆虫細胞または哺乳動物細胞である。組換えDNAは、当業者にとって周知である技術を用い、宿主細胞中での使用に適切な任意の発現ベクター中にクローン化され得る。ポリペプチドのインビトロ翻訳は、一般的に製造者の指示に従い、実施され得る。
【0021】
この様式で発現されるDNA配列は、ネイティブIκBαあるいはIκBβをコードし得るか、またはこのDNA配列は、ネイティブIκBの一部あるいは改変体をコードし得る。改変体をコードするDNA分子は、一般的に、オリゴヌクレオチド指向性部位特異的変異誘発のような、標準的な変異誘発技術を用い調製され得る。あるいは、DNA配列のセクションはまた、短縮型ポリペプチドの調製を可能とするために除去され得、そして「タグ」のようなさらなる配列をコードするDNAは、DNA分子の5’または3’末端に付加され得る。例えば、IκBポリペプチドをコードするDNAはまた、組換えタンパク質がN末端またはC末端にエピトープを含むように、エピトープをコードし得る。グルタチオン−Sトランスフェラーゼタンパク質(GST)、HA(赤血球凝集素)−タグ、FLAGおよびヒスチジン−タグのようなエピトープは、当業者に周知の技術を用い、付加され得る。
【0022】
発現されたIκBポリペプチドは、インビトロ翻訳に続く精製をせずに用いられ得る。あるいは、ポリペプチドは、実質的に純粋な形態で単離され得る。IκBポリペプチドは少なくとも80重量%の純度で単離され得、好ましくは、少なくとも95重量%の純度、より好ましくは、少なくとも99重量%の純度で単離され得る。一般的に、このような精製は、例えば、本明細書中に記載した代表的な精製方法または、硫安分画、SDS−PAGE電気泳動、およびアフィニティークロマトグラフィーの標準的な技術を用い達成され得る。
【0023】
本明細書中に提供したユビキチン化アッセイにおいて、刺激し、または刺激しないJurkat細胞、HeLa細胞、THP−1細胞、または内皮細胞由来の細胞抽出物は、インビトロにおいて、ATPおよびホスファターゼインヒビターのオカダ酸の存在下でIκBポリペプチドとインキュベートされる。細胞抽出物は、一般的に、Alkalayら、(Proc.Natl.Acad.Sci.USA 92:10599,1995)の方法に従い調製され得る。インキュベーションは、IκBポリペプチドのリン酸化(IκBαおよびその改変体についてはセリン32およびセリン36)およびリン酸化ポリペプチド(pIκB)と細胞由来NF−κB複合体との会合を生ずるのに十分な条件下で行われる。例えば、IκBポリペプチドは、HeLa細胞抽出物またはJurkat細胞抽出物、ATPならびにオカダ酸とインキュベートされ得る。90分、30℃でのインキュベーションは、一般的に、IκBポリペプチドのリン酸化を可能とするのに十分である。このインキュベーションに続き、pIκB/NF−κB複合体は、例えば、抗p65抗体により免疫精製され得、そして、Alkalayら、(Proc.Natl.Acad.Sci.USA 92:10599,1995)が記載したように、無細胞系でのインビトロユビキチン化に供され得る。次に、ユビキチン化のレベルは、SDS−PAGEとそれに続くオートラジオグラフィーの周知の技術を用い、評価され得る。
【0024】
これらの条件下において、ATPγSの存在下で、野生型35S−pIκBαポリペプチドは、多重にユビキチン化された種を産生する(図1A、レーン4を参照)。IκBαの35S標識されたS32/36A変異体(レーン1)も非リン酸化野生型35S−IκBα(レーン2)もユビキチン化されない。しかし、遊離型変異体IκBαあるいは遊離型野生型IκBαのいずれも、容易に結合する(図1B)。同様に、IκBαの遊離型(しかし、複合体に会合していない)リジン21、22変異体は、インビトロでユビキチン化され得る。従って、遊離型IκBポリペプチドを用い行われるユビキチン化アッセイと異なり、本明細書中で提供されるユビキチン化アッセイは、複合体に会合し適切にリン酸化されたIκBポリペプチドのみを標的とする。
【0025】
本発明の別の局面において、上記のユビキチン化アッセイは、IκBのユビキチン化を調節する因子を同定するために使用され得る。調節因子としては、抗体(例えば、モノクローナル抗体)、ペプチド、およびIκBαおよび/またはIκBβポリペプチドのユビキチン化を刺激または、好ましくは、阻害する他の薬物が挙げられ得る。一般的に、このような因子は、その他の点で上記のとおり実施され得るユビキチン化反応において調節因子候補を含ませること、および因子のユビキチン化レベルへの影響を評価することにより、同定され得る。候補因子のそのようなアッセイにおける使用での適切な濃度は、一般的に、約0.1μM〜約1mMの範囲である。ペプチド候補因子について、ベスタチンのようなペプチダーゼインヒビター(40μg/mL)もまた、加えられ得る。そして、ペプチドの量は、好ましくは、約10μM〜約1mMの範囲である。ユビキチン化のレベルに統計学的に有意な効果を生じる候補因子は、本発明により包含される調節因子である。
【0026】
上記のとおり、本発明の状況において、複合体に会合したIκBは、特異的ユビキチンリガーゼE3によって認識されることが見出された。従って、本発明の範囲内の調節因子として、E3ユビキチンリガーゼの認識ドメインを含有するペプチドが挙げられるが、これに限定されない。このようなペプチドは、N末端シグナルドメイン(ネイティブIκBαまたはIκBβの残基1〜54)より由来し得、そして、最低限、シグナルリン酸化部位(ネイティブIκBαの残基32〜36またはネイティブIκBβの残基19〜23)を含有すべきである。ペプチド調節因子は、一般的に、標準的な自動合成技術を用い、または所望のペプチドをコードする組換えDNAの発現により調製され得る。このような因子は、上記のように、1つ以上の置換および/または改変のために、ネイティブIκBαおよびIκBβと配列が異なり得る。ただし、ペプチド改変体は、IκBポリペプチドのユビキチン化を阻害する。
【0027】
最大限の阻害のために、ペプチド調節因子はリン酸化されるべきである;好ましくは、ネイティブなリン酸化部位の両方(例えば、IκBαのセリン32およびセリン36)がリン酸化されるか、一方がリン酸化されたペプチドも用いられ得る。リン酸化ペプチドは周知の技術により調製され得る。例えば、ホスホセリン残基は、合成中にペプチドに取り込まれ得る。あるいは、ペプチドは、合成後に標準的な技術を用いリン酸化され得る。
【0028】
一般的に、ペプチド調節因子は、アミノ酸および/またはアミノ酸アナログを取り込む標準的な技術を用い調製され得る。合成中に、アミノ酸および/またはアミノ酸アナログの活性基は、必要な場合、例えば、t−ブチルジカルボネート(t−BOC)基またはフルオレニルメトキシカルボニル(FMOC)基を用い保護され得る。アミノ酸およびアミノ酸アナログは、市販品を購入し得る(例えば、Sigma Chemical Co.; Advanced Chemtec)か、または当該分野において公知の方法を用いて合成され得る。ペプチドは固相法を用い合成され得る。固相法では、ペプチドは、4−メチルベンズヒドリルアミン(MBHA)、4−(オキシメチル)−フェニルアセトアミドメチル−および4−(ヒドロキシメチル)フェノキシメチル−コポリ(スチレン−1%ジビニルベンゼン)(Wang樹脂)(全て市販されている)、またはDe GradoおよびKaiser(J.Org.Chem.47:3258,1982)によって記述されたように合成され得るp−ニトロベンゾフェノンオキシムポリマー(オキシム樹脂)のような樹脂に付着される。当業者は、アミノ酸および/またはアミノ酸アナログの選択が、所望の特定の物理学的、化学的または生物学的な特徴に部分的に依存することを理解する。このような特徴は、投与方法および患者における標的位置により、部分的に決定される。
【0029】
ペプチド中の反応性基の選択的改変はまた、所望の特徴を与え得る。ペプチドは、アセチル化ペプチドのようにN末端改変した化合物を得るために、まだ樹脂に付着している間に、操作され得る。または、ペプチドは、フッ化水素または同等の切断因子を用い樹脂から取り出され、そして改変され得る。合成されたC末端カルボキシル基を含む化合物(Wang樹脂)は、樹脂からの切断後、またはいくつかの場合には溶液相合成に先立って、改変され得る。ペプチドのN末端またはC末端を改変する方法は、当該分野において周知である。この方法としては、例えば、N末端のアセチル化またはC末端のアミド化が挙げられる。同様に、アミノ酸側鎖またはアミノ酸アナログ側鎖を改変する方法は、ペプチド合成における当業者にとって周知である。ペプチド上に存在する反応性基に対してなされる改変の選択は、所望の特徴によって決められる。
【0030】
調節因子はまた、環状ペプチドであり得る。環状ペプチドは、例えば、ペプチドのN末端のアミノ基とC末端のカルボキシル基との間の共有結合の形成を誘導することにより得られ得る。あるいは、環状ペプチドは、末端の反応性基と反応性アミノ酸側鎖との間、または2つの反応性側鎖間での共有結合の形成により得られ得る。所望の特徴に基づき環状ペプチドが選択されることは、当業者にとって明らかである。例えば、環状ペプチドは、増加した安定性、増加した可溶性、減少した免疫原性または減少したインビボクリアランスを提供し得る。
【0031】
新たに合成されたペプチドは、逆相高性能液体クロマトグラフィー(RP−HPLC)またはサイズもしくは電荷に基づき分離する他の方法のような方法を用い、精製され得る。さらに、精製ペプチドは、これらの方法およびアミノ酸分析および質量分析のような他の周知の方法を用いることにより、特徴づけられ得る。
【0032】
ペプチド調節因子のいくつかの代表的な例は表Iに提供される。
【0033】
(表I)
代表的なペプチド調節因子
【0034】
【表1】

*は、リン酸化残基を示す。
【0035】
調節因子のさらなる特徴づけは、ユビチン依存性インビトロ分解アッセイを用いることにより、達成され得る。そのようなアッセイは、一般的には、Alkalayら(Proc. Natl. Acad. Sci. USA 92:10599,1995)が記載したように実施され得る。このアッセイにおいて、刺激された細胞由来のpIκBαは、インビトロでユビキチン依存性様式で分解され、他方、同一の細胞抽出物由来の非リン酸化IκBαは、分解を受けない。IκBαのユビキチン化を阻害する調節因子はまた、このようなインビトロ分解アッセイでpIκBαの安定化を生ずるべきである。
【0036】
本明細書中で記する調節因子は、一般的に、細胞のNF−κB機能を特異的に阻害するために用いられ得る。このような阻害は、一般的に、因子(例えば、約5mg/mLのペプチド因子)の適切な細胞(例えば、HeLa細胞、または初代ヒト血管内皮細胞)へのマイクロインジェクションにより示され得る。マイクロインジェクションに続き、細胞は、NF−κBの活性化を可能にするように刺激され(例えば、TNFαを用い)そしてインキュベートされる。HeLa細胞において、TNFαは、NF−κBの核中への迅速な核移行を誘導し、この核移行はp65特異的抗体での染色により検出され得る。調節因子は、NF−κB移行の統計学的に有意な減少を誘導し、そしてこのような移行を検出不可能なレベルまで減少させ得る。
【0037】
初代ヒト血管内皮細胞(HUVEC)は、NF−κBにより調節される接着タンパク質(例えば、ICAM−1、V−CAM−1およびEセレクチン(Readら、Immunity 2:493,1995; Chenら、J. Immunol 155:3538,1995))の表面発現により、TNFα刺激に応答する。Eセレクチンの発現は特にNF−κB依存性であり、そしてEセレクチンは、最初の好中球付着および活性化内皮上のローリングに主要な誘導性内皮接着分子である。刺激された細胞は、1つ以上のNF−κBに調節される接着タンパク質の発現を検出するために、固定され、そして染色され得る。調節因子のマイクロインジェクションは、そのような発現の統計学的に有意な阻害を生じるが、ICAM2のようなNF−κB非依存性接着タンパク質の発現には影響しない。
【0038】
調節因子はまた、患者におけるIκBαおよび/またはIκBβのユビキチン化を調節するのに用いられ得、それによりインビボでNF−κB細胞機能を調節する。本明細書中で使用するように、「患者」は、ヒトを含む任意の哺乳動物であり得、そしてNF−κBの活性化に関連する疾患に苦しんでいてもよく、または検出可能な疾患に罹患していなくてもよい。従って、処置は現存の疾患について、または予防的なものであり得る。NF−κB活性化に関連する疾患として、炎症性疾患、自己免疫疾患、ガンおよびウイルス感染が挙げられる。
【0039】
処置とは、本明細書中に記載の調節因子の投与をいう。患者への投与について、1つ以上のこのような化合物は、一般的に、薬学的組成物として処方される。薬学的組成物は、生理学的に受容可能なキャリア(すなわち、活性成分の活性を妨害しない非毒性物質)をさらに含有する、滅菌の水性もしくは非水性溶液、懸濁液あるいはエマルジョンであり得る。当業者にとって公知である任意の適切なキャリアが、本発明の薬学的組成物に用いられ得る。代表的なキャリアとして、生理食塩水溶液、ゼラチン、水、アルコール、天然あるいは合成油、糖類溶液、グリコール、オレイン酸エチルのような注射用有機エステル、またはこのような物質の組み合わせが挙げられる。必要に応じて、薬学的組成物は、さらに、保存剤および/または他の添加物(例えば、抗菌剤、酸化防止剤、キレート剤および/または不活性ガス)、および/または他の活性成分を含有し得る。
【0040】
あるいは、薬学的組成物は、生理学的に受容可能なキャリアと組み合わせて、調節因子をコードするポリヌクレオチドを含有し得る(その結果、調節因子がインサイチュで産生される)。そのような薬学的組成物において、ポリヌクレオチドは、当業者に公知である任意の種々の送達系内に存在し得る。送達系としては、核酸、細菌およびウイルス発現系、ならびにリポソームを含むコロイド分散系が挙げられる。適切な核酸発現系は、患者内での発現に必要なポリヌクレオチド配列(例えば、適切なプロモーターおよびターミネーターシグナル)を含有する。DNAはまた、例えば、Ulmerら(Science 259:1745−1749,1993)が記載したように、「裸」であり得る。
【0041】
標的化された患者の細胞へ核酸配列を導入するために使用され得る種々のウイルスベクターとして、ワクシニアもしくは他のポックスウイルス、ヘルペスウイルス、レトロウイルス、またはアデノウイルスが挙げられるが、これらに限定されない。DNAをこのようなベクターへ組み込む技術は、当業者にとって周知である。好ましくは、レトロウイルスベクターは、マウスレトロウイルスまたはトリレトロウイルスの誘導体である。レトロウイルスとしては、モロニーマウス白血病ウイルス(MoMuLV)、ハーベイマウス肉腫ウイルス(HaMuSV)、マウス乳ガンウイルス(MuMTV)、およびラウス肉腫ウイルス(RSV)が挙げられるが、これらに限定されない。レトロウイルスベクターは、選択マーカー遺伝子(形質導入細胞の同定または選択を助けるため)および/あるいは特定の標的細胞上のレセプターについてのリガンドをコードする遺伝子(ベクターを標的特異的にするため)をさらに導入または取り込み得る。例えば、レトロウイルスベクターは、糖、糖脂質またはタンパク質をコードするヌクレオチド配列を挿入することにより、標的特異的とされ得る。標的化はまた、当業者に公知の方法により、抗体を用いて達成され得る。
【0042】
ウイルスベクターは、代表的には、非病原性(欠損性)の、複製能力のあるウイルスであり、これは感染性のベクター粒子の産生のために補助を必要とする。この補助は、例えば、LTR内の調節配列の制御下にレトロウイルスの全ての構造遺伝子をコードするプラスミドを含有するが、パッケージング機構がカプセル化のためのRNA転写物を認識することを可能にするヌクレオチド配列を欠くヘルパー細胞株を用いることにより、提供され得る。このようなヘルパー細胞株としては、ψ2、PA317、およびPA12が挙げられるが、これらに限定されない。このような細胞に導入されたレトロウイルスベクターは、パッケージされ得、そしてベクタービリオンを産生し得る。次に、この方法により産生されたベクタービリオンは、NIH3T3細胞のような組織細胞株への感染に用いられ、大量のキメラレトロウイルスビリオンを産生し得る。
【0043】
ポリヌクレオチドのための別の標的化送達系は、コロイド分散系である。コロイド分散系としては、高分子複合体、ナノカプセル(nanocapsule)、ミクロスフェア、ビーズ、および脂質ベースの系(水中油エマルジョン、ミセル、混合ミセルおよびリポソームを含む)が挙げられる。インビトロおよびインビボでの送達ビヒクルとして用いるのに好ましいコロイド系は、リポソーム(すなわち、人工膜小胞)である。0.2〜4.0μmのサイズ範囲の大きな単層小胞(LUV)は、大きな高分子を含有する水性緩衝液のかなりの割合をカプセル化し得ることが示されている。RNA、DNAおよびインタクトなビリオンは、水性内部にカプセル化され、そして細胞へ生物学的に活性な形態で送達され得る(Fraleyら、Trends Biochem.Sci.6:77,1981)。哺乳動物細胞に加え、リポソームは、ポリヌクレオチドの植物細胞、酵母細胞および細菌細胞への送達にも使用されてきた。リポソームが効率的な遺伝子導入ビヒクルであるために、以下の特徴が存在すべきである:(1)目的遺伝子を高効率でカプセル化するが、生物学活性を損なわない;(2)非標的細胞と比べ標的細胞への優先的および実質的な結合;(3)小胞の水性内容物の標的細胞細胞質への高効率送達;および(4)遺伝情報の正確で効果的な発現(Manninoら、Biotechniques 6:882,1988)。
【0044】
リポソームの標的化は、解剖学上の因子および機械論的な因子に基づき、分類され得る。解剖学上の分類は、選択性のレベルに基づき、そして例えば、器官特異的、細胞特異的、および/またはオルガネラ特異的であり得る。機械論的な標的化は、受動的であるかまたは能動的であるかに基づき区別され得る。受動的な標的化は、リポソームが、洞様毛細血管を含む器官における細網内皮系(RES)の細胞に分布する天然の傾向を利用する。一方、能動的な標的化としては、天然に生じる局在部位以外の器官および細胞型への標的化を達成するための、リポソームと特異的なリガンド(例えば、モノクローナル抗体、糖、糖脂質、またはタンパク質)の結合による、またはリポソームの組成もしくはサイズの変更によるリポソームの改変が挙げられる。
【0045】
投与の経路および頻度、ならびに用量は、患者により異なる。一般的に、薬学的組成物は、静脈内に、腹腔内に、筋肉内に、皮下に、腔内にまたは経皮的に投与され得る。1〜6の間の用量が、毎日投与され得る。適切な用量は、NF−κB活性化と関連した疾患に苦しむ患者の症状の改善を示すのに十分な量である。このような改善は、炎症応答(例えば、浮腫、移植片拒絶、過敏症)をモニターすることにより、または疾患と関連した臨床症状の改善を通して検出され得る。一般的に、用量中に存在する調節因子の量、または用量中に存在するDNAによりインサイチュで産生される調節因子の量は、宿主1kgあたり約1μg〜約100mgの範囲である。適切な用量サイズは、患者のサイズにより異なるが、代表的には、10〜60kgの動物について約10mL〜約500mLの範囲である。
【0046】
以下の実施例は、例示のみを目的として提供され、そして限定することを意図しない。
【実施例】
【0047】
実施例1
ユビキチン化アッセイを使用する調節因子の同定
この実施例は、代表的なユビキチン化アッセイ、および候補調節因子を評価するためのこのようなアッセイの使用を例示する。
【0048】
A.インビトロでのユビキチン化アッセイ
HAタグ化IκBαまたはHAタグ化IκBβ cDNA(Haskillら、Cell 65:1281−1289,1991)を、コムギ胚芽抽出物においてインビトロで35Sメチオニンの存在下で、製造業者の指示(Promega,Madison,WI)に従って翻訳した。IκBαまたはIκBβをリン酸化するために、標識したタンパク質を含有する1μlの抽出物を、90分間30℃で、最終容量30μlを有する反応混合物(100μg HeLa細胞またはJurkat細胞抽出物(Alkalayら、Proc.Natl.Acad.Sci.USA 92:10599,1995に記載されるように調製した)、2mM ATP、および1μM オカダ酸)中でインキュベートした。このインキュベーションの間、標識したIκBポリぺプチドを、セリン32および36においてリン酸化し、そして内因性のNF−κB複合体に会合させた(データ示さず)。
【0049】
インキュベーション後、1μlの抗p65血清を添加し、そしてNF−κB免疫複合体を、Protein A−Sepharose(登録商標)に固定化し、そしてAlkalayらによって記載されるように、HeLa細胞抽出物においてインビトロでのユビキチン化に供した。ユビキチン化したタンパク質を、SDS−PAGEによって分離し、そしてオートラジオグラフィーによって可視化した。
【0050】
図1Aに示すように、野生型35S−pIκBαのみが多様に(multiply)ユビキチン化した種を生成した(レーン4)。IκBαの35S標識したS32/36A変異体(レーン1)も、非リン酸化野生型35S−IκBα(レーン2)もいずれも、ユビキチン化されず、そしてpIκBαのユビキチン化は、ATPの非存在下で観察されなかった(レーン3)。
【0051】
このアッセイの生理学的な関連性を、遊離の35S−IκBのインビトロでのユビキチン化の、複合体に会合したリン酸化基質のユビキチン化との比較によってさらに記録した。複合体に会合したS32/36A変異体が、そのインビボでの運命に従ってユビキチン結合に供されなかったのに対し、変異体または野生型IκBαの遊離の形態は、容易に結合した(図1B)。同様に、遊離のIκBαのみがインビトロでユビキチン化され得たが、複合体に会合したリジン21、22変異体のIκBαは、インビトロでユビキチン化され得た(データは示さず)。従って、遊離のIκBαが、無差別的に、ユビキチン系によって認識されるのに対し、複合体に会合したインヒビターは、適切にリン酸化されていない限り、マスクされる。
【0052】
B.ペプチド調節因子の同定
IκBαユビキチンリガーゼ認識モチーフを同定するために、種々のペプチドを、種々の濃度で、ペプチダーゼインヒビターBestatin(40μg/ml)の存在下で、反応混合物に添加した。ペプチドは、タンパク質のN末端シグナリングドメインにわたり、そして1つまたは両方のセリン残基(32および36)でリン酸化されるか、または改変されないかもしくはセリン置換された。これらのペプチドを、種々の濃度でユビキチン反応に含ませ、そしてpIκBα特異的ユビキチン化のインヒビターについて試験した。遊離のIκBαの結合をモニターした場合、翻訳されたタンパク質を、結合反応混合物に直接添加した。
【0053】
両方のセリン32および36でリン酸化されたペプチド(pIκBαペプチド)のみが、pIκBαユビキチン化を効果的に阻害した(図1A、レーン7、11〜14)。c−Fosホスホペプチド(ppFos、レーン5)、セリン32、36をアラニンで置換したIκBαペプチド(p21S/A、レーン6)、および非リン酸化ペプチド(p21、レーン8)は、400μMの濃度で、pIκBのユビキチン化に対して検出可能な効果を有さなかった。リン酸化IκBαペプチドのIC50を計算した。そして代表的な阻害濃度を図1Aに示す。二重にリン酸化されたIκBαペプチドは、pIκB結合反応を、5μMのIC50で阻害した(レーン7、11〜14)。これらのペプチドの配列を上記表I、および配列番号5〜9に提供する。対照的に、一重リン酸化ペプチド(レーン9、10)は、400μMのIC50でpIκBα結合を阻害した。試験した最小サイズのペプチド(シグナリングリン酸化部位に広がるのみである)(pp7、レーン14)は、いくらか高いIC50(10μM)であったが、ユビキチン化を効果的に阻害するのに十分であった。従って、配列番号1の残基21〜41を含むペプチドは、E3ユビキチンリガーゼについての認識ドメインを含む。興味深いことに、リジン残基21および22は、阻害について必須ではなく、ユビキチン系認識部位は、実際の認識部位とは異なることを示唆する。
【0054】
ペプチド調節因子の特異性を、2つの他のユビキチン結合反応において試験した:遊離の野生型の結合(図1B、レーン1〜3)またはS32/36A変異体IκBα(図1B、レーン4〜6)、およびHeLa抽出物中の細胞性タンパク質のバルクへのユビキチン結合(Alkalayらに従って125I標識化ユビキチンによって検出される、図1C )。いずれの反応も、ペプチド調節因子またはコントロールペプチドの添加によって影響を受けなかった。
【0055】
ペプチド調節因子は、pIκBαに関連する基質pIκBβのユビキチン化を消滅させることを見出した(図1D)。pIκBαの結合と同様に、IκBβの特異的結合もまた、会合したNF−κB複合体(示さず)およびIκBα相同性残基Ser19および23で予めリン酸化することを必要とした。ホスファターゼインヒビターの非存在下で調製されたIκBβ基質は、ユビキチン化に供されなかった(図1D、レーン1)。ペプチド調節因子は、pIκBαについて観察されたものと類似のIC50でpIκBβユビキチン化に影響を与えた(図1D、レーン4〜7)。従って、同一の酵素が、ユビキチン依存性分解について両方のIκBを標的化するようである。
【0056】
阻害性pIκBαペプチドを、相補的ユビキチン依存性インビボ分解アッセイにおいて試験した(Orianら、J.Biol.Chem.270:21707,1995;Stancovskiら、Mol.Cell.Biol.15:7106,1995)。このアッセイを使用して、刺激された細胞由来のpIκBαのみが、ユビキチン依存的にインビトロで分解するのに対し、同一の細胞抽出物由来の非リン酸化IκBαは、分解に供されない。結合阻害ホスホペプチド調節因子の分解アッセイへの組み込みは、pIκBα基質の安定化を生じた(図2、レーン3、4)のに対し、非リン酸化ペプチド因子またはコントロールホスホFosペプチドは、特異的pIκBα分解に対して効果を有さなかった(レーン5、6)。ペプチドをLys21/22でトリムすることは、分解阻害効果を減退させなかった(レーン4)。これは、ペプチドが結合可能な基質としてのユビキチンプロテアーゼ系を消耗させることによってpIκBα分解を消滅させないことを示す。
【0057】
実施例2
基質認識に関与するユビキチン系成分の同定
この実施例は、pIκBポリぺプチドの認識を担う特定のE3の同定を例示する。
【0058】
pIκBαユビキチン結合および分解は、ユビキチン系酵素:E1、ユビキチン系画分Iに由来する特定のE2、E2F1(Alkalayら、Proc.Natl.Acad.Sci.USA 92:10599,1995;Chenら、Cell 84: 853,1996)、および画分IIの成分E3の全ての成分を必要とする。基質認識に関与するユビキチン系成分を同定するために、HeLa溶解物を、IκBαホスホペプチド調節因子カラムにかけて分画し、そしてフロースルー画分をpIκBα結合についてアッセイした。ペプチドを、製造業者の指示に従って、2mg/mlの濃度でNHS−Sepharose(R)(Pharmacia)に結合させた。100μgのHeLa抽出物を、2.5μlの結合化樹脂とともに、0.1%NP40および3%オボアルブミンの存在下で1時間、4℃でインキュベートした。樹脂を捨て、そして未結合の物質を上記のユビキチン化アッセイで試験した。
【0059】
コントロールホスホペプチドカラムおよびS32/36Aペプチドカラムからのフロースルー画分は、全IκBα結合能力を維持した(図3A、レーン2、3)が、2つの異なるpIκBαペプチド由来のフロースルー画分は、そのIκBα特異的結合能力を失った(レーン4、7)。欠失した結合活性は、E3酵素の全ての公知の種を含む網状赤血球画分II(レーン5、8)によって補足され得た(Ciechanover, Cell 79:13, 1994)。相補化は、画分Iまたは画分IおよびE1の添加によって得られず(それぞれ、レーン6および9)、このことはペプチドカラムがE2またはE1よりむしろE3を涸渇させたことを示している。再び、IκBαリジン残基21および22は、E3を維持するために不必要であり(図3A、レーン7〜レーン4を比較のこと)、基質認識と結合部位との間の区別を強調した。ペプチドカラム涸渇は、IκB E3に特異的であることを見出した。なぜなら、全てのフロースルー画分が、ランダムHeLaタンパク質結合において全活性を維持したからである(125Iユビキチンの結合を測定することによって検出した。図3B)。これは、特定のE3が、同定されたモチーフにおいてpIκBの認識を担うことを示す。
【0060】
実施例3
胞性NF−κB活性化に対する代表的なペプチド調節因子の効果
この実施例は、細胞性NF−κB活性化の、ペプチド調節因子の微量注入による阻害を例示する。
【0061】
HeLa細胞を、微量注入の18時間前にグリッドのカバースリップ(Cellocate, Eppendorf)上に置いた。微量注入を、22アミノ酸pIκBαペプチド(pp21;表Iおよび配列番号9)またはコントロールホスホFosペプチド(配列番号10)を用いて、半自動化装置(Eppendorf)を使用して行った。ペプチドを細胞の細胞質中に、5mg/mlの濃度で、100mM KCl、5mM Na2HPO4 (pH 7.2)で注入し、そしてTNFα(200ユニット/mL)で20分間(NF−κB移行)または3時間(Eセレクチン発現)のいずれかで、迅速に活性化した。活性化の後、細胞を固定し、そしてp65特異的抗体(Mercurioら、Genes&Dev.7:705,1993;Santa Cruz)またはモノクローナル抗Eセレクチン抗体(R&D Systems)で染色した。
【0062】
ペプチド調節因子の非存在下で、TNFαは、90%の細胞のp65核染色によって示されるように、NF−κBの核内への迅速な核移行を誘導する(図4G、カラム2を参照のこと)。pp21ペプチドは、いくつかの実験において微量注入した細胞の50〜70%において、TNFα刺激によるNF−κB活性化を消滅させた(図4Aおよび4Bにおける代表的な視野;および図4G、カラム3を参照のこと)。対照的に、コントロールpp−Fosペプチドは、微量注入されていない細胞と比較して、NF−κB誘導性核移行の割合に対して効果を有さなかった(図4Cおよび4G、カラム4)。
【0063】
NF−κB阻害の機能的コンセンサスをさらに評価するために、IκB−E3阻害ペプチドを、原発性ヒト血管内皮細胞中に微量注入した(HUVEC;Chenら、J.Immunol 155:3538,1995)。これらの細胞は、Eセレクチンのような、NF−κB調節接着タンパク質の表面発現によってTNFα刺激に応答する。HUVEC細胞を上記のようにプレートし、微量注入し、そして刺激した。刺激の3時間後、細胞を固定し、そしてNF−κB依存性Eセレクチンの発現について染色した。HUVEC細胞の75%〜85%を、いくつかの実験において、TNFα刺激後にEセレクチンについて強度に染色した。pp21ペプチドの微量注入は、微量注入した細胞の70〜80%のEセレクチン発現を阻害した(図4D;および図4H、カラム3)。対照的に、コントロールpp−Fosペプチドは、微量注入していない細胞と比較して、Eセレクチン発現に対して効果を有さなかった(図4Fおよび4H、カラム4)。コントロールの、S32/36A置換されたIκBαペプチドの微量注入は、Eセレクチン発現の割合に対して効果を有さなかった(データ示さず)。
【0064】
これらの結果は、シグナル誘導リン酸化IκBαおよびIκBβのサブユニット特異的分解が、特定のE3によって媒介されることを示す。E3ユビキチンリガーゼの認識ドメインは、短い配列であり、両方のIκBにて保存されている2つのシグナル獲得ホスホセリンを中心を置き、第1の生物学的に関連性のあるE3認識モチーフを表す。IκB認識における特異性は、リン酸化基質の状況によって支持される:会合した細胞性複合体は、非特異的E3から基質をマスクする。この特徴は、NF−κBインヒビター分解を刺激後相に制限し、ここで部位特異的リン酸化事象を介して特定のリガーゼに曝露される。NF−κB活性化およびその得られる機能が、本明細書中で提供される調節因子を使用して、IκBリガーゼのインビボ阻害によって特異的に消滅させられ得る。
【0065】
上記から、本発明の特定の実施態様が例示の目的で記載されているが、種々の改変が本発明の精神および範囲を逸脱することなくなされ得ることが理解される。従って、本発明は、添付の請求の範囲による以外は限定されない。
【0066】
配列表の要旨
配列番号1は、IκBαのアミノ酸配列である。
配列番号2は、IκBαのDNA配列である。
配列番号3は、IκBβのアミノ酸配列である。
配列番号4は、IκBβのDNA配列である。
配列番号5は、pp7のアミノ酸配列である。
配列番号6は、pp11のアミノ酸配列である。
配列番号7は、pp15のアミノ酸配列である。
配列番号8は、pp19のアミノ酸配列である。
配列番号9は、pp21のアミノ酸配列である。
配列番号10は、ホスホFosペプチドのアミノ酸配列である。
配列番号11は、pp21 S/Aのアミノ酸配列である。
配列番号12は、HAタグ化IκBαのアミノ酸配列である。
配列番号13は、HAタグ化S32,36IκBαのアミノ酸配列である。
配列番号14は、HAタグ化IκBβのアミノ酸配列である。
【0067】
(配列表)
【0068】
【化1】

【0069】
【化2】

【0070】
【化3】

【0071】
【化4】

【0072】
【化5】

【0073】
【化6】

【0074】
【化7】

【0075】
【化8】

【0076】
【化9】

【0077】
【化10】

【0078】
【化11】

【0079】
【化12】

【技術分野】
【0001】
(技術分野)
本発明は、一般に、核因子κB(NF−κB)の活性化を調節する組成物および方法に関する。より詳細には、本発明は、リン酸化IκBαおよび/またはIκBβのユビキチン化を調節する因子、このような因子を同定する方法、およびNF−κB活性化と関連する疾患を処置する方法に関する。本発明に含まれる調節因子は、E3ユビキチンリガーゼの認識ドメインを含むペプチドを含む。
【背景技術】
【0002】
(発明の背景)
NF−κBは、インターロイキン1、インターロイキン8、腫瘍壊死因子および特定の細胞接着分子を含む、免疫、炎症性および急性相応答遺伝子で観察される高度に特異的なパターンの遺伝子発現で中心的役割を果たす転写因子である。転写アクチベーターのRelファミリーの他のメンバーのように、NF−κBは、大部分の細胞型の細胞質中で不活性形態で隔離されている。マイトゲン、サイトカイン、抗原、ストレス誘導剤、UV光および生体タンパク質を含む種々の細胞外刺激は、最終的にはNF−κB放出および活性化を導くシグナル伝達経路を開始する。
【0003】
NF−κB活性化の重要なモジュレーターは、インビボでNF−κBと会合(そしてそれによってこれを不活性化する)インヒビタータンパク質IκBαおよびIκBβ(本明細書でIκBと呼ぶ)である。NF−κBの活性化および核移行は、シグナルで誘導されるIκBのリン酸化の後で起こり、これは、ユビキチン経路を経由するタンパク質分解に至る。IκBαについていえば、刺激で誘導されたセリン32および36におけるリン酸化は、このインヒビターを、リジン21および22におけるユビキチン化の標的にし、その結果分解する。同様に、セリン19および23におけるIκBβのリン酸化は、このインヒビターを、リジン9におけるユビキチン化の標的にする。しかし、ユビキチン系により認識されるIκBの部位、およびIκB認識を仲介するユビキチン系の成分のいずれも同定されていない。
【0004】
ユビキチン経路を経由するタンパク質の分解は、以下の2つの別個の連続的な工程により進行する:(a)複数ユビキチン分子のタンパク質基質への共有結合、および(b)26Sプロテオソーム複合体の標的となるタンパク質の分解である。ユビキチン経路は、協調し、かつ階層的な様式で作用するいくつかの成分からなる(レビューのために、非特許文献1;非特許文献2;非特許文献3;非特許文献4を参照のこと)。1つのこのような成分、単一のE1酵素は、ユビキチンの活性化を実施する。E2酵素のいくつかの主要な種が、哺乳動物細胞、植物および酵母で特徴付けられている。E2酵素は、おそらく、リガーゼE3に結合し(非特許文献5;非特許文献6)、そして各E2酵素は、1つ以上のE3タンパク質とともに作用し得るようである(非特許文献7;非特許文献8;非特許文献9;非特許文献10)。
【0005】
ほんのわずかのE3酵素(ユビキチンリガーゼ)が記載されている。哺乳動物E3α(酵母におけるUBR1)およびE3βは、タンパク質基質の遊離のN末端アミノ酸残基を介してそれらを認識する(「N末端規則」;非特許文献11;非特許文献12)。Cdc53は、おそらく、リン酸化G1サイクリンを標的にする際に関与するE3である(非特許文献13)。E6−APは、p53の認識に関与し(非特許文献14)、そして一連の特有のE6−AP相同タンパク質が同定されている(非特許文献15):Nedd4は、上皮Na+チャンネルの分解に関与し(非特許文献16)、そしてRSP5(NIP1)は、パーミアーゼGap1およびFur1をタグ化することに関与し(非特許文献17)、その一方、Pub1は、Cdc25を標的にする(非特許文献18)。最近単離されたいくつかのその他のE3酵素は、筋肉タンパク質のサブセットであるc−Fosの分解に、およびNF−κBの前駆体であるp105のプロセシングに関与するようである(非特許文献8;非特許文献9;非特許文献10)。従って、リガーゼ類は、大きな、大部分が解明されていない酵素のファミリーを示すようであり、「N末端規則」リガーゼ(E3αおよびE3β)の認識の様式を除いて、ユビキチン系のすべてのその他の既知の基質の認識モチーフは同定されていない。
【0006】
従って、当該技術分野には、ユビキチン経路を経由するIκB分解のさらなる理解に対する要求、およびNF−κBの活性化に関連する疾患を処置することにおける使用のためのこの分解プロセスのモジュレーターの同定に対する要求が存在する。本発明はこれらの要求を満たし、そしてその他の関連する利点をさらに提供する。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Ciechanover、Cell 79:13、1994
【非特許文献2】Hochstrasser、Curr. Op. Cell. Biol. 7:215、1995
【非特許文献3】JentschおよびSchlenker、Cell 82:881、1995
【非特許文献4】Deshaies、Trends Cell Biol.5:428、1995
【非特許文献5】ReissおよびHersko、J.Biol.Chem.265:3685、1990
【非特許文献6】Dohmenら、Proc.Natl.Acad.Sci.USA 88:7351、1991
【非特許文献7】Nuberら、J.Biol.Chem.271:2795、1996
【非特許文献8】Orianら、J.Biol.Chem.270:21707、1995
【非特許文献9】Stancovskiら、Mol.Cell.Biol.15:7106、1995
【非特許文献10】Gonenら、J.Biol.Chem.271:302、1996
【非特許文献11】Varshavsky、Cell 69:725、1992
【非特許文献12】HershkoおよびCiechanover、Ann.Rev.Biochem. 61:761、1992
【非特許文献13】Willemsら、Cell 86:453、1996
【非特許文献14】Scheffnerら、Cell 75:495、1993
【非特許文献15】Huibregtseら、Proc.Natl.Acad.Sci. USA 92:2563、1995
【非特許文献16】Staubら、Embo J.15:2371、1996
【非特許文献17】Heinら、Mol.Microbiol.18:77、1995
【非特許文献18】NefskyおよびBeach、EMBO J.15:1301、1996
【発明の概要】
【課題を解決するための手段】
【0008】
(発明の要旨)
簡単に述べれば、本発明は、リン酸化IκBαおよび/またはIκBβのユビキチン化を調節することにより核因子κB(NF−κB)の活性化を調節する組成物および方法を提供する。1つの局面では、本発明は、インビボでユビキチン化を行うIκBポリペプチドの能力をアッセイする方法を提供し、この方法は、(a)IκBポリペプチドを細胞抽出物とインキュベートする工程であって、ここで該インキュベートする工程は、IκBポリペプチドのリン酸化およびリン酸化IκBポリペプチドとNF−κBとを含む複合体の形成を可能にするに十分な条件下および時間の間実施され;(b)次いで該複合体をインビトロユビキチン化に供する工程;および(c)次いで該複合体のユビキチン化の程度を評価し、そしてそれによってIκBポリペプチドがインビボでユビキチン化を行う能力をアッセイする工程、を包含する。
【0009】
別の局面では、IκBαおよび/またはIκBβのユビキチン化を調節する因子を同定する方法が提供され、この方法は、(a)候補因子を、IκBポリペプチドおよび細胞抽出物とインキュベートする工程であって、ここで該インキュベートする工程は、IκBポリペプチドのリン酸化およびリン酸化IκBポリペプチドとNF−κBとを含む複合体の形成を可能にするに十分な条件下および時間の間実施され;および(b)次いで該複合体のユビキチン化を調節する候補因子の能力を測定し、そしてそれからIκBαおよび/またはIκBβのユビキチン化を調節する因子を同定する工程を包含する。
【0010】
本発明はまた、IκBαおよび/またはIκBβのユビキチン化を調節する因子を提供する。このような因子は、E3ユビキチンリガーゼの認識ドメインを含むペプチドを含み、例えば、配列番号5〜配列番号9に記載のペプチドを包含する。ペプチド因子をコードする、単離されたDNA分子および組換え発現ベクター、ならびにこのような発現ベクターで形質転換またはトランスフェクトされた宿主細胞もまた提供する。
【0011】
別の局面では、本発明は、IκBαおよび/またはIκBβのユビキチン化を調節する1つ以上の因子を、薬学的に受容可能なキャリアと組み合わせて含む、薬学的組成物を提供する。
【0012】
本発明はまた、さらなる局面で、患者におけるNF−κB活性を調節する方法、およびNF−κB活性化に関連する障害をもつ患者を処置する方法を提供し、
これらの方法は、患者に上記の薬学的組成物を投与する工程を包含する。NF−κB活性化に関連する障害には、炎症性疾患、自己免疫疾患、癌およびウイルス感染が包含される。
【0013】
本発明のこれらおよびその他の局面は、以下の詳細な説明および添付の図面を参照すれば明らかになる。本明細書に開示されるすべての参考文献は、各々が個々に援用されるように、それらの全体が参考として本明細書に援用される。
【0014】
本発明は、例えば以下の項目を提供する。
(項目1) インビボでユビキチン化を行うIκBポリペプチドの能力をアッセイする方法であって:
(a)IκBポリペプチドを細胞抽出物とインキュベートする工程であって、ここで該インキュベートする工程は、IκBポリペプチドのリン酸化およびリン酸化IκBポリペプチドとNF−κBとを含む複合体の形成を可能にするに十分な条件下および時間の間実施され;
(b)次いで該複合体をインビトロでユビキチン化に供する工程;および
(c)次いで該複合体のユビキチン化の程度を評価し、そしてそれによってIκBポリペプチドがインビボでユビキチン化を行う能力をアッセイする工程、
を包含する方法。
(項目2) IκBαおよび/またはIκBβのユビキチン化を調節する因子を同定する方法であって:
(a)候補因子を、IκBポリペプチドおよび細胞抽出物とインキュベートする工程であって、ここで該インキュベートする工程は、IκBポリペプチドのリン酸化およびリン酸化IκBポリペプチドとNF−κBとを含む複合体の形成を可能にするに十分な条件下および時間の間実施され;および
(b)次いで、該候補因子の、該複合体のユビキチン化を調節する能力を測定し、そしてそれからIκBαおよび/またはIκBβのユビキチン化を調節する因子を同定する工程。
(項目3) 前記因子がペプチドである、項目2に記載の方法。
(項目4) 前記ペプチドが、E3ユビキチンリガーゼの認識ドメインを含む、項目3に記載の方法。
(項目5) IκBαおよび/またはIκBβのユビキチン化を調節する因子。
(項目6) 前記因子がペプチドである、項目5に記載の因子。
(項目7) 前記因子が、E3ユビキチンリガーゼの認識ドメインを含む、項目6に記載の因子。
(項目8) 前記因子が、配列番号5〜配列番号9の少なくとも1つに記載のアミノ酸配列を含む、項目7に記載の因子。
(項目9) 項目6〜8の少なくとも1つに記載の因子をコードする、単離されたDNA分子。
(項目10) 項目9に記載のDNA分子を含む、組換え発現ベクター。
(項目11) 項目10に記載の発現ベクターで形質転換またはトランスフェクトされた、宿主細胞。
(項目12) 前記宿主細胞が、細菌、酵母、バキュロウイルスに感染した昆虫細胞および哺乳動物細胞からなる群から選択される、項目11に記載の宿主細胞。
(項目13) IκBαおよび/またはIκBβのユビキチン化を調節する因子を、薬学的に受容可能なキャリアと組み合わせて含む、薬学的組成物。
(項目14) 患者におけるNF−κB活性を調節する方法であって、項目13に記載の薬学的組成物を患者に投与する工程を包含する、方法。
(項目15) NF−κB活性化に関連する障害をもつ患者を処置する医薬の製造における使用のための、項目5〜8のいずれか1つに記載の因子。
(項目16) 前記障害が、炎症性疾患、自己免疫疾患、癌およびウイルス感染からなる群から選択される、項目15に記載の因子。
【図面の簡単な説明】
【0015】
【図1A】図1A〜1Dは、代表的な調節因子の存在下および非存在下で実施されたユビキチン化アッセイのSDS−PAGE分析の結果を示すオートラジオグラムである。他に示されていなければ、基質は、リン酸化され、そしてNF−κBが複合会合した、35S標識、HAタグ化IκBポリペプチドであった。図1A中、レーン1は、32位および36位にアラニン残基を含むIκBαポリペプチド(S32/36A;配列番号13)のユビキチン化を示し、そしてレーン2は、非リン酸化野生型IκBαポリペプチド(配列番号12)のユビキチン化を示す。レーン3〜14では、ユビキチン化の基質は、野生型IκBα(配列番号12)であった。レーン3では、ユビキチン化は、ATPの非存在下で実施され;そしてレーン4〜14では、反応は、ATPγSの存在下で、候補ペプチド調節因子とともに(レーン5〜14)またはなしで(レーン4)実施された。示された候補因子は:400μMのc−Fosホスホペプチド(ppFos(配列番号10)、レーン5);400μMのセリン32、36をアラニンで置換したIκBαペプチド(pp21S/A(配列番号11)、レーン6);40μMの二重リン酸化IκBαペプチド(pp21(配列番号9、レーン7);400μMの非リン酸化IκBαペプチド(p21(配列番号9、レーン8);100μMの1つのリン酸化IκBαペプチド(ppS32(配列番号9、レーン9;ppS36(配列番号9)、レーン10);および40μMの、より短い、二重リン酸化IκBαペプチド(pp19(配列番号8)、レーン11);pp15(配列番号7)、レーン12;pp11(配列番号6)、レーン13;pp7(配列番号5)、レーン14)である。
【図1B】図1A〜1Dは、代表的な調節因子の存在下および非存在下で実施されたユビキチン化アッセイのSDS−PAGE分析の結果を示すオートラジオグラムである。他に示されていなければ、基質は、リン酸化され、そしてNF−κBが複合会合した、35S標識、HAタグ化IκBポリペプチドであった。図1Bでは、ユビキチン化基質は、遊離の野生型IκBα(配列番号12、レーン1〜3)または遊離のS32/36A置換IκBα(配列番号13、レーン4〜6)であった。反応は、ATPγSの非存在下(レーン1および4)または存在下(レーン2、3、5および6)で実施された。40μMの二重リン酸化IκBαペプチド(pp21(配列番号9)を、レーン3および6に示された試料中の結合反応混合物に添加した。
【図1C】図1A〜1Dは、代表的な調節因子の存在下および非存在下で実施されたユビキチン化アッセイのSDS−PAGE分析の結果を示すオートラジオグラムである。他に示されていなければ、基質は、リン酸化され、そしてNF−κBが複合会合した、35S標識、HAタグ化IκBポリペプチドであった。図1Cでは、HeLa抽出物中のバルク細胞タンパク質のユビキチン化が示される。レーン1は、ATP非存在下のユビキチン化を示し、そしてレーン5は、ATP存在下のユビキチン化を示す。レーン3〜5では、以下の候補調節因子が添加された:40μMの二重リン酸化IκBαペプチド(pp21(配列番号9)、レーン2);400μMのc−Fosホスホペプチド(ppFos(配列番号10)、レーン3);および400μMの非リン酸化IκBαペプチド(p21(配列番号9)、レーン4)。
【図1D】図1A〜1Dは、代表的な調節因子の存在下および非存在下で実施されたユビキチン化アッセイのSDS−PAGE分析の結果を示すオートラジオグラムである。他に示されていなければ、基質は、リン酸化され、そしてNF−κBが複合会合した、35S標識、HAタグ化IκBポリペプチドであった。図1Dでは、ユビキチン化基質は、リン酸化(レーン2〜7)または非リン酸化(レーン1)野生型IκBβ(配列番号14)であった。反応は、ATPγSの非存在下(レーン2)または存在下(レーン1、3〜7)で、かつ候補ペプチド調節因子とともに(レーン4〜7)またはなしで(レーン1〜3)実施された。示された候補因子は:400μMの二重リン酸化IκBαペプチド(pp21(配列番号9)、レーン4);400μMのc−Fosホスホペプチド(ppFos(配列番号10)、レーン5);40μMの二重リン酸化IκBαペプチド(pp19(配列番号8、レーン6);および400μMの非リン酸化IκBαペプチド(p21(配列番号9、レーン7)である。
【図2】図2は、刺激されたHeLa細胞からの抽出物を用いて実施された、インビトロでのユビキチン依存性分解アッセイの結果を示すオートラジオグラムである。SDS−PAGEの各レーンにおいて、分解アッセイ後の、リン酸化(上のバンド)および非リン酸化(下のバンド)HAタグ化IκBαポリペプチド(配列番号12)のレベルが示される。レーン1は、ATPなしで実施された分解アッセイ後のこれらのペプチドのレベルを示す。レーン2〜6では、ATPを反応混合物中に含めた。40μMの候補調節因子が、レーン3〜6に示される反応物に添加された:二重リン酸化IκBαペプチド(pp21(配列番号9)、レーン3);二重リン酸化IκBαペプチド(pp19(配列番号8、レーン4);c−Fosホスホペプチド(ppFos(配列番号10)、レーン5);および非リン酸化IκBαペプチド(p21(配列番号9、レーン6)である。
【図3A】図3Aは、調節因子カラム上で分画されたHeLa細胞溶解物のフロースルー画分を用いて実施されたユビキチンアッセイのSDS−PAGEの結果を示すオートラジオグラムである。各場合において、基質は、リン酸化およびNF−κB複合会合された、35S標識、HAタグ化IκBαポリペプチド(配列番号12)であった。レーン1は、非分画抽出物を用いるユビキチン化のレベルを示す。レーン2〜9では、抽出物は、ペプチドSepharose(登録商標)カラム上で分画した。用いたペプチドは:c−Fosホスホペプチド(ppFos(配列番号10)、レーン2);セリン32、36をアラニンで置換したIκBαペプチド(pp21S/A(配列番号11)、レーン3);二重リン酸化IκBαペプチド(pp21(配列番号9、レーン4〜6);および二重リン酸化IκBαペプチド(pp19(配列番号8、レーン7〜9)である。さらに、網状赤血球画分II(160μg)を、レーン5および8に示されるユビキチン化反応物に添加し、そして画分I(160μg)を、レーン6および9中の反応物に添加した。
【図3B】図3Bは、HeLa抽出物中のバルク細胞タンパク質のユビキチン化を示すオートラジオグラムである。レーン1は、ATP非存在下のユビキチン化を示し、そしてレーン2は、ATP存在下のユビキチン化を示し、しかし、候補調節因子なしである。レーン3〜6では、以下の候補調節因子が添加された:40μMの二重リン酸化IκBαペプチド(pp19(配列番号8)、レーン3);400μMのc−Fosホスホペプチド(ppFos(配列番号10)、レーン4);400μMのセリン32、36をアラニンで置換したIκBαペプチド(pp21S/A(配列番号11)、レーン5);および40μMの二重リン酸化IκBαペプチド(pp21(配列番号9、レーン6)。
【図4−1】図4A〜4Fは、核NF−κB移行に対する候補調節因子の影響を示す顕微鏡写真である。図4A〜4Cでは、pp21(図4Aおよび4B)またはppFos(図4C)が、HeLa細胞の細胞質にマイクロインジェクトされた。次いで細胞を、即座にTNFαで活性化し、そして抗p65抗体で免疫染色した。図4D〜Fでは、pp21(図4D)またはppFos(図4F)が、ヒト血管内皮細胞(HUVEC)の細胞質に注入された。次いで細胞を、即座にTNFαで活性化し、そして抗Eセレクチン抗体で免疫染色した。図4Eは、図4Dの位相差写真である。各顕微鏡写真において、注入された細胞は大きな矢印で記されている。図4Dおよび4Eでは、小矢印によって、注入されていないEセレクチンネガティブ細胞が記されている。
【図4−2】図4A〜4Fは、核NF−κB移行に対する候補調節因子の影響を示す顕微鏡写真である。図4A〜4Cでは、pp21(図4Aおよび4B)またはppFos(図4C)が、HeLa細胞の細胞質にマイクロインジェクトされた。次いで細胞を、即座にTNFαで活性化し、そして抗p65抗体で免疫染色した。図4D〜Fでは、pp21(図4D)またはppFos(図4F)が、ヒト血管内皮細胞(HUVEC)の細胞質に注入された。次いで細胞を、即座にTNFαで活性化し、そして抗Eセレクチン抗体で免疫染色した。図4Eは、図4Dの位相差写真である。各顕微鏡写真において、注入された細胞は大きな矢印で記されている。図4Dおよび4Eでは、小矢印によって、注入されていないEセレクチンネガティブ細胞が記されている。
【図4−3】図4Gおよび4Hは、図4A〜4Fに示されるマイクロインジェクション実験の要約を示すグラフである。図4Gには、核p65染色を示すHeLa細胞のパーセントが示される。90および42細胞は、それぞれpp21およびppFosでマイクロインジェクトされた。図4Hは、Eセレクチン染色を示すHUVECのパーセントを示す。160および36細胞は、それぞれ、pp21およびppFosでマイクロインジェクトされた。各グラフについて、カラム1は、候補調節因子およびTNFα活性化の非存在下でのレベルを示す。カラム2〜4は、候補調節因子の非存在下(カラム2)、pp21の存在下(カラム3)またはppFosの存在下(カラム4)のTNFα活性化後のレベルを示す。
【発明を実施するための形態】
【0016】
(発明の詳細な説明)
上記の通り、本発明は一般的に、核因子κB(NF−κB)の活性化の調節およびこのような活性化に関連する疾患の処置に有用な組成物および方法に関する。特に、本発明は、リン酸化IκB(すなわち、IκBαおよび/またはIκBβ)のユビキチン化を調節する因子、ならびにそのような因子の同定の方法に関する。
【0017】
刺激に応答して、NF−κBと会合したIκBは活性化され(すなわち、リン酸化され)、そしてIκBを分解の標的とし、それによってNF−κBを遊離および活性化する。本発明の状況において、リン酸化され、そしてNF−κBと会合したIκBは、特異的なユビキチンリガーゼE3により認識されることが見出されている。IκBαおよびIκBβ間で機能的に保存されているN末端シグナル誘導リン酸化部位は、E3認識モチーフを構成し、そして近傍のユビキチン化部位と異なる。このモチーフに対応するペプチドおよびその改変体は、IκBのユビキチン化およびそれに続く分解を阻害し、そしてそのようなペプチドは本発明の範囲中の調節因子である。
【0018】
1つの局面において、本発明は、インビボでのIκBαのユビキチン化を高い忠実度で再現するインビトロでのユビキチン化アッセイを提供する。インビボにおいて、IκBはセリン32およびセリン36のリン酸化による分解の標識となり、その一方で、32位と36位にアラニン残基を含有するIκBαの改変形態は、ユビキチン結合に供されない。同様に、セリン19およびセリン23のリン酸化は、IκBβのユビキチン化に必要とされる。しかし、遊離IκBは、ユビキチン系により非差別的様式で認識される(すなわち、リン酸化は必要とされない)。本明細書中で提供されるユビキチン化アッセイは、インビボにおいて観察される調節に対応するIκBユビキチン化の調節を可能とする。
【0019】
本明細書中に記載されるユビキチン化アッセイに使用されるIκBポリペプチドは、ネイティブヒトIκBα(配列番号1)あるいはネイティブヒトIκBβ(配列番号3)であり得、またはネイティブタンパク質の改変体であり得る。本明細書中で使用するように、改変体は、1つ以上の置換および/または改変を含有するポリペプチドである。改変体としては、短縮型ポリペプチドおよびポリペプチドの活性に最小の影響を有するさらなるアミノ酸配列を含有するポリペプチドが挙げられる。特に、改変体は、さらなるアミノ酸配列をアミノ末端および/またはカルボキシル末端に含有し得る。このような配列は、例えば、ポリペプチドの精製または検出を容易にするために、使用され得る。IκBのポリペプチド改変体は、本明細書中に記載するようなユビキチン化アッセイにおいてリン酸化およびユビキチン化される改変体の能力が、実質的に減少しないように、改変される。好ましくは、IκBポリペプチドは標識される。例えば、標準的な技術を用い、35Sメチオニン存在下で、35Sは、ポリペプチドのインビトロ翻訳によってIκBポリペプチド中に取り込まれ得る。
【0020】
IκBポリペプチドは、一般的に、培養宿主細胞中のDNAの発現により、またはコムギ胚抽出物のようなインビトロ系を用いた翻訳により、ポリペプチドをコードするDNAから調製され得る。宿主細胞が用いられる場合、そのような細胞は、好ましくは、細菌、酵母、バキュロウイルス感染昆虫細胞または哺乳動物細胞である。組換えDNAは、当業者にとって周知である技術を用い、宿主細胞中での使用に適切な任意の発現ベクター中にクローン化され得る。ポリペプチドのインビトロ翻訳は、一般的に製造者の指示に従い、実施され得る。
【0021】
この様式で発現されるDNA配列は、ネイティブIκBαあるいはIκBβをコードし得るか、またはこのDNA配列は、ネイティブIκBの一部あるいは改変体をコードし得る。改変体をコードするDNA分子は、一般的に、オリゴヌクレオチド指向性部位特異的変異誘発のような、標準的な変異誘発技術を用い調製され得る。あるいは、DNA配列のセクションはまた、短縮型ポリペプチドの調製を可能とするために除去され得、そして「タグ」のようなさらなる配列をコードするDNAは、DNA分子の5’または3’末端に付加され得る。例えば、IκBポリペプチドをコードするDNAはまた、組換えタンパク質がN末端またはC末端にエピトープを含むように、エピトープをコードし得る。グルタチオン−Sトランスフェラーゼタンパク質(GST)、HA(赤血球凝集素)−タグ、FLAGおよびヒスチジン−タグのようなエピトープは、当業者に周知の技術を用い、付加され得る。
【0022】
発現されたIκBポリペプチドは、インビトロ翻訳に続く精製をせずに用いられ得る。あるいは、ポリペプチドは、実質的に純粋な形態で単離され得る。IκBポリペプチドは少なくとも80重量%の純度で単離され得、好ましくは、少なくとも95重量%の純度、より好ましくは、少なくとも99重量%の純度で単離され得る。一般的に、このような精製は、例えば、本明細書中に記載した代表的な精製方法または、硫安分画、SDS−PAGE電気泳動、およびアフィニティークロマトグラフィーの標準的な技術を用い達成され得る。
【0023】
本明細書中に提供したユビキチン化アッセイにおいて、刺激し、または刺激しないJurkat細胞、HeLa細胞、THP−1細胞、または内皮細胞由来の細胞抽出物は、インビトロにおいて、ATPおよびホスファターゼインヒビターのオカダ酸の存在下でIκBポリペプチドとインキュベートされる。細胞抽出物は、一般的に、Alkalayら、(Proc.Natl.Acad.Sci.USA 92:10599,1995)の方法に従い調製され得る。インキュベーションは、IκBポリペプチドのリン酸化(IκBαおよびその改変体についてはセリン32およびセリン36)およびリン酸化ポリペプチド(pIκB)と細胞由来NF−κB複合体との会合を生ずるのに十分な条件下で行われる。例えば、IκBポリペプチドは、HeLa細胞抽出物またはJurkat細胞抽出物、ATPならびにオカダ酸とインキュベートされ得る。90分、30℃でのインキュベーションは、一般的に、IκBポリペプチドのリン酸化を可能とするのに十分である。このインキュベーションに続き、pIκB/NF−κB複合体は、例えば、抗p65抗体により免疫精製され得、そして、Alkalayら、(Proc.Natl.Acad.Sci.USA 92:10599,1995)が記載したように、無細胞系でのインビトロユビキチン化に供され得る。次に、ユビキチン化のレベルは、SDS−PAGEとそれに続くオートラジオグラフィーの周知の技術を用い、評価され得る。
【0024】
これらの条件下において、ATPγSの存在下で、野生型35S−pIκBαポリペプチドは、多重にユビキチン化された種を産生する(図1A、レーン4を参照)。IκBαの35S標識されたS32/36A変異体(レーン1)も非リン酸化野生型35S−IκBα(レーン2)もユビキチン化されない。しかし、遊離型変異体IκBαあるいは遊離型野生型IκBαのいずれも、容易に結合する(図1B)。同様に、IκBαの遊離型(しかし、複合体に会合していない)リジン21、22変異体は、インビトロでユビキチン化され得る。従って、遊離型IκBポリペプチドを用い行われるユビキチン化アッセイと異なり、本明細書中で提供されるユビキチン化アッセイは、複合体に会合し適切にリン酸化されたIκBポリペプチドのみを標的とする。
【0025】
本発明の別の局面において、上記のユビキチン化アッセイは、IκBのユビキチン化を調節する因子を同定するために使用され得る。調節因子としては、抗体(例えば、モノクローナル抗体)、ペプチド、およびIκBαおよび/またはIκBβポリペプチドのユビキチン化を刺激または、好ましくは、阻害する他の薬物が挙げられ得る。一般的に、このような因子は、その他の点で上記のとおり実施され得るユビキチン化反応において調節因子候補を含ませること、および因子のユビキチン化レベルへの影響を評価することにより、同定され得る。候補因子のそのようなアッセイにおける使用での適切な濃度は、一般的に、約0.1μM〜約1mMの範囲である。ペプチド候補因子について、ベスタチンのようなペプチダーゼインヒビター(40μg/mL)もまた、加えられ得る。そして、ペプチドの量は、好ましくは、約10μM〜約1mMの範囲である。ユビキチン化のレベルに統計学的に有意な効果を生じる候補因子は、本発明により包含される調節因子である。
【0026】
上記のとおり、本発明の状況において、複合体に会合したIκBは、特異的ユビキチンリガーゼE3によって認識されることが見出された。従って、本発明の範囲内の調節因子として、E3ユビキチンリガーゼの認識ドメインを含有するペプチドが挙げられるが、これに限定されない。このようなペプチドは、N末端シグナルドメイン(ネイティブIκBαまたはIκBβの残基1〜54)より由来し得、そして、最低限、シグナルリン酸化部位(ネイティブIκBαの残基32〜36またはネイティブIκBβの残基19〜23)を含有すべきである。ペプチド調節因子は、一般的に、標準的な自動合成技術を用い、または所望のペプチドをコードする組換えDNAの発現により調製され得る。このような因子は、上記のように、1つ以上の置換および/または改変のために、ネイティブIκBαおよびIκBβと配列が異なり得る。ただし、ペプチド改変体は、IκBポリペプチドのユビキチン化を阻害する。
【0027】
最大限の阻害のために、ペプチド調節因子はリン酸化されるべきである;好ましくは、ネイティブなリン酸化部位の両方(例えば、IκBαのセリン32およびセリン36)がリン酸化されるか、一方がリン酸化されたペプチドも用いられ得る。リン酸化ペプチドは周知の技術により調製され得る。例えば、ホスホセリン残基は、合成中にペプチドに取り込まれ得る。あるいは、ペプチドは、合成後に標準的な技術を用いリン酸化され得る。
【0028】
一般的に、ペプチド調節因子は、アミノ酸および/またはアミノ酸アナログを取り込む標準的な技術を用い調製され得る。合成中に、アミノ酸および/またはアミノ酸アナログの活性基は、必要な場合、例えば、t−ブチルジカルボネート(t−BOC)基またはフルオレニルメトキシカルボニル(FMOC)基を用い保護され得る。アミノ酸およびアミノ酸アナログは、市販品を購入し得る(例えば、Sigma Chemical Co.; Advanced Chemtec)か、または当該分野において公知の方法を用いて合成され得る。ペプチドは固相法を用い合成され得る。固相法では、ペプチドは、4−メチルベンズヒドリルアミン(MBHA)、4−(オキシメチル)−フェニルアセトアミドメチル−および4−(ヒドロキシメチル)フェノキシメチル−コポリ(スチレン−1%ジビニルベンゼン)(Wang樹脂)(全て市販されている)、またはDe GradoおよびKaiser(J.Org.Chem.47:3258,1982)によって記述されたように合成され得るp−ニトロベンゾフェノンオキシムポリマー(オキシム樹脂)のような樹脂に付着される。当業者は、アミノ酸および/またはアミノ酸アナログの選択が、所望の特定の物理学的、化学的または生物学的な特徴に部分的に依存することを理解する。このような特徴は、投与方法および患者における標的位置により、部分的に決定される。
【0029】
ペプチド中の反応性基の選択的改変はまた、所望の特徴を与え得る。ペプチドは、アセチル化ペプチドのようにN末端改変した化合物を得るために、まだ樹脂に付着している間に、操作され得る。または、ペプチドは、フッ化水素または同等の切断因子を用い樹脂から取り出され、そして改変され得る。合成されたC末端カルボキシル基を含む化合物(Wang樹脂)は、樹脂からの切断後、またはいくつかの場合には溶液相合成に先立って、改変され得る。ペプチドのN末端またはC末端を改変する方法は、当該分野において周知である。この方法としては、例えば、N末端のアセチル化またはC末端のアミド化が挙げられる。同様に、アミノ酸側鎖またはアミノ酸アナログ側鎖を改変する方法は、ペプチド合成における当業者にとって周知である。ペプチド上に存在する反応性基に対してなされる改変の選択は、所望の特徴によって決められる。
【0030】
調節因子はまた、環状ペプチドであり得る。環状ペプチドは、例えば、ペプチドのN末端のアミノ基とC末端のカルボキシル基との間の共有結合の形成を誘導することにより得られ得る。あるいは、環状ペプチドは、末端の反応性基と反応性アミノ酸側鎖との間、または2つの反応性側鎖間での共有結合の形成により得られ得る。所望の特徴に基づき環状ペプチドが選択されることは、当業者にとって明らかである。例えば、環状ペプチドは、増加した安定性、増加した可溶性、減少した免疫原性または減少したインビボクリアランスを提供し得る。
【0031】
新たに合成されたペプチドは、逆相高性能液体クロマトグラフィー(RP−HPLC)またはサイズもしくは電荷に基づき分離する他の方法のような方法を用い、精製され得る。さらに、精製ペプチドは、これらの方法およびアミノ酸分析および質量分析のような他の周知の方法を用いることにより、特徴づけられ得る。
【0032】
ペプチド調節因子のいくつかの代表的な例は表Iに提供される。
【0033】
(表I)
代表的なペプチド調節因子
【0034】
【表1】

*は、リン酸化残基を示す。
【0035】
調節因子のさらなる特徴づけは、ユビチン依存性インビトロ分解アッセイを用いることにより、達成され得る。そのようなアッセイは、一般的には、Alkalayら(Proc. Natl. Acad. Sci. USA 92:10599,1995)が記載したように実施され得る。このアッセイにおいて、刺激された細胞由来のpIκBαは、インビトロでユビキチン依存性様式で分解され、他方、同一の細胞抽出物由来の非リン酸化IκBαは、分解を受けない。IκBαのユビキチン化を阻害する調節因子はまた、このようなインビトロ分解アッセイでpIκBαの安定化を生ずるべきである。
【0036】
本明細書中で記する調節因子は、一般的に、細胞のNF−κB機能を特異的に阻害するために用いられ得る。このような阻害は、一般的に、因子(例えば、約5mg/mLのペプチド因子)の適切な細胞(例えば、HeLa細胞、または初代ヒト血管内皮細胞)へのマイクロインジェクションにより示され得る。マイクロインジェクションに続き、細胞は、NF−κBの活性化を可能にするように刺激され(例えば、TNFαを用い)そしてインキュベートされる。HeLa細胞において、TNFαは、NF−κBの核中への迅速な核移行を誘導し、この核移行はp65特異的抗体での染色により検出され得る。調節因子は、NF−κB移行の統計学的に有意な減少を誘導し、そしてこのような移行を検出不可能なレベルまで減少させ得る。
【0037】
初代ヒト血管内皮細胞(HUVEC)は、NF−κBにより調節される接着タンパク質(例えば、ICAM−1、V−CAM−1およびEセレクチン(Readら、Immunity 2:493,1995; Chenら、J. Immunol 155:3538,1995))の表面発現により、TNFα刺激に応答する。Eセレクチンの発現は特にNF−κB依存性であり、そしてEセレクチンは、最初の好中球付着および活性化内皮上のローリングに主要な誘導性内皮接着分子である。刺激された細胞は、1つ以上のNF−κBに調節される接着タンパク質の発現を検出するために、固定され、そして染色され得る。調節因子のマイクロインジェクションは、そのような発現の統計学的に有意な阻害を生じるが、ICAM2のようなNF−κB非依存性接着タンパク質の発現には影響しない。
【0038】
調節因子はまた、患者におけるIκBαおよび/またはIκBβのユビキチン化を調節するのに用いられ得、それによりインビボでNF−κB細胞機能を調節する。本明細書中で使用するように、「患者」は、ヒトを含む任意の哺乳動物であり得、そしてNF−κBの活性化に関連する疾患に苦しんでいてもよく、または検出可能な疾患に罹患していなくてもよい。従って、処置は現存の疾患について、または予防的なものであり得る。NF−κB活性化に関連する疾患として、炎症性疾患、自己免疫疾患、ガンおよびウイルス感染が挙げられる。
【0039】
処置とは、本明細書中に記載の調節因子の投与をいう。患者への投与について、1つ以上のこのような化合物は、一般的に、薬学的組成物として処方される。薬学的組成物は、生理学的に受容可能なキャリア(すなわち、活性成分の活性を妨害しない非毒性物質)をさらに含有する、滅菌の水性もしくは非水性溶液、懸濁液あるいはエマルジョンであり得る。当業者にとって公知である任意の適切なキャリアが、本発明の薬学的組成物に用いられ得る。代表的なキャリアとして、生理食塩水溶液、ゼラチン、水、アルコール、天然あるいは合成油、糖類溶液、グリコール、オレイン酸エチルのような注射用有機エステル、またはこのような物質の組み合わせが挙げられる。必要に応じて、薬学的組成物は、さらに、保存剤および/または他の添加物(例えば、抗菌剤、酸化防止剤、キレート剤および/または不活性ガス)、および/または他の活性成分を含有し得る。
【0040】
あるいは、薬学的組成物は、生理学的に受容可能なキャリアと組み合わせて、調節因子をコードするポリヌクレオチドを含有し得る(その結果、調節因子がインサイチュで産生される)。そのような薬学的組成物において、ポリヌクレオチドは、当業者に公知である任意の種々の送達系内に存在し得る。送達系としては、核酸、細菌およびウイルス発現系、ならびにリポソームを含むコロイド分散系が挙げられる。適切な核酸発現系は、患者内での発現に必要なポリヌクレオチド配列(例えば、適切なプロモーターおよびターミネーターシグナル)を含有する。DNAはまた、例えば、Ulmerら(Science 259:1745−1749,1993)が記載したように、「裸」であり得る。
【0041】
標的化された患者の細胞へ核酸配列を導入するために使用され得る種々のウイルスベクターとして、ワクシニアもしくは他のポックスウイルス、ヘルペスウイルス、レトロウイルス、またはアデノウイルスが挙げられるが、これらに限定されない。DNAをこのようなベクターへ組み込む技術は、当業者にとって周知である。好ましくは、レトロウイルスベクターは、マウスレトロウイルスまたはトリレトロウイルスの誘導体である。レトロウイルスとしては、モロニーマウス白血病ウイルス(MoMuLV)、ハーベイマウス肉腫ウイルス(HaMuSV)、マウス乳ガンウイルス(MuMTV)、およびラウス肉腫ウイルス(RSV)が挙げられるが、これらに限定されない。レトロウイルスベクターは、選択マーカー遺伝子(形質導入細胞の同定または選択を助けるため)および/あるいは特定の標的細胞上のレセプターについてのリガンドをコードする遺伝子(ベクターを標的特異的にするため)をさらに導入または取り込み得る。例えば、レトロウイルスベクターは、糖、糖脂質またはタンパク質をコードするヌクレオチド配列を挿入することにより、標的特異的とされ得る。標的化はまた、当業者に公知の方法により、抗体を用いて達成され得る。
【0042】
ウイルスベクターは、代表的には、非病原性(欠損性)の、複製能力のあるウイルスであり、これは感染性のベクター粒子の産生のために補助を必要とする。この補助は、例えば、LTR内の調節配列の制御下にレトロウイルスの全ての構造遺伝子をコードするプラスミドを含有するが、パッケージング機構がカプセル化のためのRNA転写物を認識することを可能にするヌクレオチド配列を欠くヘルパー細胞株を用いることにより、提供され得る。このようなヘルパー細胞株としては、ψ2、PA317、およびPA12が挙げられるが、これらに限定されない。このような細胞に導入されたレトロウイルスベクターは、パッケージされ得、そしてベクタービリオンを産生し得る。次に、この方法により産生されたベクタービリオンは、NIH3T3細胞のような組織細胞株への感染に用いられ、大量のキメラレトロウイルスビリオンを産生し得る。
【0043】
ポリヌクレオチドのための別の標的化送達系は、コロイド分散系である。コロイド分散系としては、高分子複合体、ナノカプセル(nanocapsule)、ミクロスフェア、ビーズ、および脂質ベースの系(水中油エマルジョン、ミセル、混合ミセルおよびリポソームを含む)が挙げられる。インビトロおよびインビボでの送達ビヒクルとして用いるのに好ましいコロイド系は、リポソーム(すなわち、人工膜小胞)である。0.2〜4.0μmのサイズ範囲の大きな単層小胞(LUV)は、大きな高分子を含有する水性緩衝液のかなりの割合をカプセル化し得ることが示されている。RNA、DNAおよびインタクトなビリオンは、水性内部にカプセル化され、そして細胞へ生物学的に活性な形態で送達され得る(Fraleyら、Trends Biochem.Sci.6:77,1981)。哺乳動物細胞に加え、リポソームは、ポリヌクレオチドの植物細胞、酵母細胞および細菌細胞への送達にも使用されてきた。リポソームが効率的な遺伝子導入ビヒクルであるために、以下の特徴が存在すべきである:(1)目的遺伝子を高効率でカプセル化するが、生物学活性を損なわない;(2)非標的細胞と比べ標的細胞への優先的および実質的な結合;(3)小胞の水性内容物の標的細胞細胞質への高効率送達;および(4)遺伝情報の正確で効果的な発現(Manninoら、Biotechniques 6:882,1988)。
【0044】
リポソームの標的化は、解剖学上の因子および機械論的な因子に基づき、分類され得る。解剖学上の分類は、選択性のレベルに基づき、そして例えば、器官特異的、細胞特異的、および/またはオルガネラ特異的であり得る。機械論的な標的化は、受動的であるかまたは能動的であるかに基づき区別され得る。受動的な標的化は、リポソームが、洞様毛細血管を含む器官における細網内皮系(RES)の細胞に分布する天然の傾向を利用する。一方、能動的な標的化としては、天然に生じる局在部位以外の器官および細胞型への標的化を達成するための、リポソームと特異的なリガンド(例えば、モノクローナル抗体、糖、糖脂質、またはタンパク質)の結合による、またはリポソームの組成もしくはサイズの変更によるリポソームの改変が挙げられる。
【0045】
投与の経路および頻度、ならびに用量は、患者により異なる。一般的に、薬学的組成物は、静脈内に、腹腔内に、筋肉内に、皮下に、腔内にまたは経皮的に投与され得る。1〜6の間の用量が、毎日投与され得る。適切な用量は、NF−κB活性化と関連した疾患に苦しむ患者の症状の改善を示すのに十分な量である。このような改善は、炎症応答(例えば、浮腫、移植片拒絶、過敏症)をモニターすることにより、または疾患と関連した臨床症状の改善を通して検出され得る。一般的に、用量中に存在する調節因子の量、または用量中に存在するDNAによりインサイチュで産生される調節因子の量は、宿主1kgあたり約1μg〜約100mgの範囲である。適切な用量サイズは、患者のサイズにより異なるが、代表的には、10〜60kgの動物について約10mL〜約500mLの範囲である。
【0046】
以下の実施例は、例示のみを目的として提供され、そして限定することを意図しない。
【実施例】
【0047】
実施例1
ユビキチン化アッセイを使用する調節因子の同定
この実施例は、代表的なユビキチン化アッセイ、および候補調節因子を評価するためのこのようなアッセイの使用を例示する。
【0048】
A.インビトロでのユビキチン化アッセイ
HAタグ化IκBαまたはHAタグ化IκBβ cDNA(Haskillら、Cell 65:1281−1289,1991)を、コムギ胚芽抽出物においてインビトロで35Sメチオニンの存在下で、製造業者の指示(Promega,Madison,WI)に従って翻訳した。IκBαまたはIκBβをリン酸化するために、標識したタンパク質を含有する1μlの抽出物を、90分間30℃で、最終容量30μlを有する反応混合物(100μg HeLa細胞またはJurkat細胞抽出物(Alkalayら、Proc.Natl.Acad.Sci.USA 92:10599,1995に記載されるように調製した)、2mM ATP、および1μM オカダ酸)中でインキュベートした。このインキュベーションの間、標識したIκBポリぺプチドを、セリン32および36においてリン酸化し、そして内因性のNF−κB複合体に会合させた(データ示さず)。
【0049】
インキュベーション後、1μlの抗p65血清を添加し、そしてNF−κB免疫複合体を、Protein A−Sepharose(登録商標)に固定化し、そしてAlkalayらによって記載されるように、HeLa細胞抽出物においてインビトロでのユビキチン化に供した。ユビキチン化したタンパク質を、SDS−PAGEによって分離し、そしてオートラジオグラフィーによって可視化した。
【0050】
図1Aに示すように、野生型35S−pIκBαのみが多様に(multiply)ユビキチン化した種を生成した(レーン4)。IκBαの35S標識したS32/36A変異体(レーン1)も、非リン酸化野生型35S−IκBα(レーン2)もいずれも、ユビキチン化されず、そしてpIκBαのユビキチン化は、ATPの非存在下で観察されなかった(レーン3)。
【0051】
このアッセイの生理学的な関連性を、遊離の35S−IκBのインビトロでのユビキチン化の、複合体に会合したリン酸化基質のユビキチン化との比較によってさらに記録した。複合体に会合したS32/36A変異体が、そのインビボでの運命に従ってユビキチン結合に供されなかったのに対し、変異体または野生型IκBαの遊離の形態は、容易に結合した(図1B)。同様に、遊離のIκBαのみがインビトロでユビキチン化され得たが、複合体に会合したリジン21、22変異体のIκBαは、インビトロでユビキチン化され得た(データは示さず)。従って、遊離のIκBαが、無差別的に、ユビキチン系によって認識されるのに対し、複合体に会合したインヒビターは、適切にリン酸化されていない限り、マスクされる。
【0052】
B.ペプチド調節因子の同定
IκBαユビキチンリガーゼ認識モチーフを同定するために、種々のペプチドを、種々の濃度で、ペプチダーゼインヒビターBestatin(40μg/ml)の存在下で、反応混合物に添加した。ペプチドは、タンパク質のN末端シグナリングドメインにわたり、そして1つまたは両方のセリン残基(32および36)でリン酸化されるか、または改変されないかもしくはセリン置換された。これらのペプチドを、種々の濃度でユビキチン反応に含ませ、そしてpIκBα特異的ユビキチン化のインヒビターについて試験した。遊離のIκBαの結合をモニターした場合、翻訳されたタンパク質を、結合反応混合物に直接添加した。
【0053】
両方のセリン32および36でリン酸化されたペプチド(pIκBαペプチド)のみが、pIκBαユビキチン化を効果的に阻害した(図1A、レーン7、11〜14)。c−Fosホスホペプチド(ppFos、レーン5)、セリン32、36をアラニンで置換したIκBαペプチド(p21S/A、レーン6)、および非リン酸化ペプチド(p21、レーン8)は、400μMの濃度で、pIκBのユビキチン化に対して検出可能な効果を有さなかった。リン酸化IκBαペプチドのIC50を計算した。そして代表的な阻害濃度を図1Aに示す。二重にリン酸化されたIκBαペプチドは、pIκB結合反応を、5μMのIC50で阻害した(レーン7、11〜14)。これらのペプチドの配列を上記表I、および配列番号5〜9に提供する。対照的に、一重リン酸化ペプチド(レーン9、10)は、400μMのIC50でpIκBα結合を阻害した。試験した最小サイズのペプチド(シグナリングリン酸化部位に広がるのみである)(pp7、レーン14)は、いくらか高いIC50(10μM)であったが、ユビキチン化を効果的に阻害するのに十分であった。従って、配列番号1の残基21〜41を含むペプチドは、E3ユビキチンリガーゼについての認識ドメインを含む。興味深いことに、リジン残基21および22は、阻害について必須ではなく、ユビキチン系認識部位は、実際の認識部位とは異なることを示唆する。
【0054】
ペプチド調節因子の特異性を、2つの他のユビキチン結合反応において試験した:遊離の野生型の結合(図1B、レーン1〜3)またはS32/36A変異体IκBα(図1B、レーン4〜6)、およびHeLa抽出物中の細胞性タンパク質のバルクへのユビキチン結合(Alkalayらに従って125I標識化ユビキチンによって検出される、図1C )。いずれの反応も、ペプチド調節因子またはコントロールペプチドの添加によって影響を受けなかった。
【0055】
ペプチド調節因子は、pIκBαに関連する基質pIκBβのユビキチン化を消滅させることを見出した(図1D)。pIκBαの結合と同様に、IκBβの特異的結合もまた、会合したNF−κB複合体(示さず)およびIκBα相同性残基Ser19および23で予めリン酸化することを必要とした。ホスファターゼインヒビターの非存在下で調製されたIκBβ基質は、ユビキチン化に供されなかった(図1D、レーン1)。ペプチド調節因子は、pIκBαについて観察されたものと類似のIC50でpIκBβユビキチン化に影響を与えた(図1D、レーン4〜7)。従って、同一の酵素が、ユビキチン依存性分解について両方のIκBを標的化するようである。
【0056】
阻害性pIκBαペプチドを、相補的ユビキチン依存性インビボ分解アッセイにおいて試験した(Orianら、J.Biol.Chem.270:21707,1995;Stancovskiら、Mol.Cell.Biol.15:7106,1995)。このアッセイを使用して、刺激された細胞由来のpIκBαのみが、ユビキチン依存的にインビトロで分解するのに対し、同一の細胞抽出物由来の非リン酸化IκBαは、分解に供されない。結合阻害ホスホペプチド調節因子の分解アッセイへの組み込みは、pIκBα基質の安定化を生じた(図2、レーン3、4)のに対し、非リン酸化ペプチド因子またはコントロールホスホFosペプチドは、特異的pIκBα分解に対して効果を有さなかった(レーン5、6)。ペプチドをLys21/22でトリムすることは、分解阻害効果を減退させなかった(レーン4)。これは、ペプチドが結合可能な基質としてのユビキチンプロテアーゼ系を消耗させることによってpIκBα分解を消滅させないことを示す。
【0057】
実施例2
基質認識に関与するユビキチン系成分の同定
この実施例は、pIκBポリぺプチドの認識を担う特定のE3の同定を例示する。
【0058】
pIκBαユビキチン結合および分解は、ユビキチン系酵素:E1、ユビキチン系画分Iに由来する特定のE2、E2F1(Alkalayら、Proc.Natl.Acad.Sci.USA 92:10599,1995;Chenら、Cell 84: 853,1996)、および画分IIの成分E3の全ての成分を必要とする。基質認識に関与するユビキチン系成分を同定するために、HeLa溶解物を、IκBαホスホペプチド調節因子カラムにかけて分画し、そしてフロースルー画分をpIκBα結合についてアッセイした。ペプチドを、製造業者の指示に従って、2mg/mlの濃度でNHS−Sepharose(R)(Pharmacia)に結合させた。100μgのHeLa抽出物を、2.5μlの結合化樹脂とともに、0.1%NP40および3%オボアルブミンの存在下で1時間、4℃でインキュベートした。樹脂を捨て、そして未結合の物質を上記のユビキチン化アッセイで試験した。
【0059】
コントロールホスホペプチドカラムおよびS32/36Aペプチドカラムからのフロースルー画分は、全IκBα結合能力を維持した(図3A、レーン2、3)が、2つの異なるpIκBαペプチド由来のフロースルー画分は、そのIκBα特異的結合能力を失った(レーン4、7)。欠失した結合活性は、E3酵素の全ての公知の種を含む網状赤血球画分II(レーン5、8)によって補足され得た(Ciechanover, Cell 79:13, 1994)。相補化は、画分Iまたは画分IおよびE1の添加によって得られず(それぞれ、レーン6および9)、このことはペプチドカラムがE2またはE1よりむしろE3を涸渇させたことを示している。再び、IκBαリジン残基21および22は、E3を維持するために不必要であり(図3A、レーン7〜レーン4を比較のこと)、基質認識と結合部位との間の区別を強調した。ペプチドカラム涸渇は、IκB E3に特異的であることを見出した。なぜなら、全てのフロースルー画分が、ランダムHeLaタンパク質結合において全活性を維持したからである(125Iユビキチンの結合を測定することによって検出した。図3B)。これは、特定のE3が、同定されたモチーフにおいてpIκBの認識を担うことを示す。
【0060】
実施例3
胞性NF−κB活性化に対する代表的なペプチド調節因子の効果
この実施例は、細胞性NF−κB活性化の、ペプチド調節因子の微量注入による阻害を例示する。
【0061】
HeLa細胞を、微量注入の18時間前にグリッドのカバースリップ(Cellocate, Eppendorf)上に置いた。微量注入を、22アミノ酸pIκBαペプチド(pp21;表Iおよび配列番号9)またはコントロールホスホFosペプチド(配列番号10)を用いて、半自動化装置(Eppendorf)を使用して行った。ペプチドを細胞の細胞質中に、5mg/mlの濃度で、100mM KCl、5mM Na2HPO4 (pH 7.2)で注入し、そしてTNFα(200ユニット/mL)で20分間(NF−κB移行)または3時間(Eセレクチン発現)のいずれかで、迅速に活性化した。活性化の後、細胞を固定し、そしてp65特異的抗体(Mercurioら、Genes&Dev.7:705,1993;Santa Cruz)またはモノクローナル抗Eセレクチン抗体(R&D Systems)で染色した。
【0062】
ペプチド調節因子の非存在下で、TNFαは、90%の細胞のp65核染色によって示されるように、NF−κBの核内への迅速な核移行を誘導する(図4G、カラム2を参照のこと)。pp21ペプチドは、いくつかの実験において微量注入した細胞の50〜70%において、TNFα刺激によるNF−κB活性化を消滅させた(図4Aおよび4Bにおける代表的な視野;および図4G、カラム3を参照のこと)。対照的に、コントロールpp−Fosペプチドは、微量注入されていない細胞と比較して、NF−κB誘導性核移行の割合に対して効果を有さなかった(図4Cおよび4G、カラム4)。
【0063】
NF−κB阻害の機能的コンセンサスをさらに評価するために、IκB−E3阻害ペプチドを、原発性ヒト血管内皮細胞中に微量注入した(HUVEC;Chenら、J.Immunol 155:3538,1995)。これらの細胞は、Eセレクチンのような、NF−κB調節接着タンパク質の表面発現によってTNFα刺激に応答する。HUVEC細胞を上記のようにプレートし、微量注入し、そして刺激した。刺激の3時間後、細胞を固定し、そしてNF−κB依存性Eセレクチンの発現について染色した。HUVEC細胞の75%〜85%を、いくつかの実験において、TNFα刺激後にEセレクチンについて強度に染色した。pp21ペプチドの微量注入は、微量注入した細胞の70〜80%のEセレクチン発現を阻害した(図4D;および図4H、カラム3)。対照的に、コントロールpp−Fosペプチドは、微量注入していない細胞と比較して、Eセレクチン発現に対して効果を有さなかった(図4Fおよび4H、カラム4)。コントロールの、S32/36A置換されたIκBαペプチドの微量注入は、Eセレクチン発現の割合に対して効果を有さなかった(データ示さず)。
【0064】
これらの結果は、シグナル誘導リン酸化IκBαおよびIκBβのサブユニット特異的分解が、特定のE3によって媒介されることを示す。E3ユビキチンリガーゼの認識ドメインは、短い配列であり、両方のIκBにて保存されている2つのシグナル獲得ホスホセリンを中心を置き、第1の生物学的に関連性のあるE3認識モチーフを表す。IκB認識における特異性は、リン酸化基質の状況によって支持される:会合した細胞性複合体は、非特異的E3から基質をマスクする。この特徴は、NF−κBインヒビター分解を刺激後相に制限し、ここで部位特異的リン酸化事象を介して特定のリガーゼに曝露される。NF−κB活性化およびその得られる機能が、本明細書中で提供される調節因子を使用して、IκBリガーゼのインビボ阻害によって特異的に消滅させられ得る。
【0065】
上記から、本発明の特定の実施態様が例示の目的で記載されているが、種々の改変が本発明の精神および範囲を逸脱することなくなされ得ることが理解される。従って、本発明は、添付の請求の範囲による以外は限定されない。
【0066】
配列表の要旨
配列番号1は、IκBαのアミノ酸配列である。
配列番号2は、IκBαのDNA配列である。
配列番号3は、IκBβのアミノ酸配列である。
配列番号4は、IκBβのDNA配列である。
配列番号5は、pp7のアミノ酸配列である。
配列番号6は、pp11のアミノ酸配列である。
配列番号7は、pp15のアミノ酸配列である。
配列番号8は、pp19のアミノ酸配列である。
配列番号9は、pp21のアミノ酸配列である。
配列番号10は、ホスホFosペプチドのアミノ酸配列である。
配列番号11は、pp21 S/Aのアミノ酸配列である。
配列番号12は、HAタグ化IκBαのアミノ酸配列である。
配列番号13は、HAタグ化S32,36IκBαのアミノ酸配列である。
配列番号14は、HAタグ化IκBβのアミノ酸配列である。
【0067】
(配列表)
【0068】
【化1】

【0069】
【化2】

【0070】
【化3】

【0071】
【化4】

【0072】
【化5】

【0073】
【化6】

【0074】
【化7】

【0075】
【化8】

【0076】
【化9】

【0077】
【化10】

【0078】
【化11】

【0079】
【化12】

【特許請求の範囲】
【請求項1】
明細書に記載の発明。
【請求項1】
明細書に記載の発明。
【図1A】


【図1B】


【図1C】


【図1D】


【図2】


【図3A】


【図3B】


【図4−3】


【図4−1】


【図4−2】




【図1B】


【図1C】


【図1D】


【図2】


【図3A】


【図3B】


【図4−3】


【図4−1】


【図4−2】


【公開番号】特開2010−63461(P2010−63461A)
【公開日】平成22年3月25日(2010.3.25)
【国際特許分類】
【出願番号】特願2009−255576(P2009−255576)
【出願日】平成21年11月6日(2009.11.6)
【分割の表示】特願平10−536013の分割
【原出願日】平成10年2月18日(1998.2.18)
【出願人】(509307635)セルジーン コーポレイション (2)
【出願人】(504303573)イッサム リサーチ ディベロプメント カンパニー オブ ザ ヘブリュー ユニバーシティ オブ エルサレム (10)
【Fターム(参考)】
【公開日】平成22年3月25日(2010.3.25)
【国際特許分類】
【出願日】平成21年11月6日(2009.11.6)
【分割の表示】特願平10−536013の分割
【原出願日】平成10年2月18日(1998.2.18)
【出願人】(509307635)セルジーン コーポレイション (2)
【出願人】(504303573)イッサム リサーチ ディベロプメント カンパニー オブ ザ ヘブリュー ユニバーシティ オブ エルサレム (10)
【Fターム(参考)】
[ Back to top ]

