細胞またはコロニーの採取装置及び細胞またはコロニーの採取方法
【課題】細胞またはコロニーの培養環境を維持しながら培養中の細胞集団から所望の細胞またはコロニーを回収可能な細胞またはコロニーの採取装置及び細胞またはコロニーの採取方法を提供すること。
【解決手段】内壁面に細胞が付着して培養された培養容器の内部に少なくとも先端21aを挿入可能な筒部材21と、前記細胞を前記内壁面から剥離するための剥離液30を先端21aから吐出可能な吐出機構であると共に剥離液30によって剥離された前記コロニーを構成する細胞を先端21aから筒部材21の内部へ吸引する吸引機構であるシリンジポンプ23とを備え、剥離液30が、前記細胞の培養に用いられる培養液よりも比重及び粘度が高い。
【解決手段】内壁面に細胞が付着して培養された培養容器の内部に少なくとも先端21aを挿入可能な筒部材21と、前記細胞を前記内壁面から剥離するための剥離液30を先端21aから吐出可能な吐出機構であると共に剥離液30によって剥離された前記コロニーを構成する細胞を先端21aから筒部材21の内部へ吸引する吸引機構であるシリンジポンプ23とを備え、剥離液30が、前記細胞の培養に用いられる培養液よりも比重及び粘度が高い。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、細胞またはコロニーの採取装置及び細胞またはコロニーの採取方法に関する。
【背景技術】
【0002】
従来から、付着性細胞の細胞培養法では、付着性細胞の増殖に応じて培養容器内の付着面から付着性細胞を剥離し、新たな培養容器に播種する継代作業や、剥離された付着性細胞を回収して実験を行うことが知られている。
【0003】
一般的に、培養容器内の付着面に付着した付着性細胞を剥離する際には、付着性細胞が浸漬された培養液を、付着性細胞の接着因子を分解するための分解酵素等を含有する緩衝液に置換する方法が知られている。このとき、培養液に溶存する蛋白質を除去するために、蛋白質を含有しない緩衝液で付着面を洗浄することが必要であると考えられている。
【0004】
近年、細胞培養の工程を自動化し、手作業が介在することによる交差汚染の危険性を抑制しながら多様な細胞の培養ができる多検体細胞自動培養装置が開発されている。例えば特許文献1には、接着性細胞における継代操作などにおいて接着性細胞を剥離することができる培養細胞の剥離方法、並びに接着性細胞を自動的に剥離することができる細胞剥離判断装置及び自動細胞培養装置が記載されている。
【0005】
特許文献1に記載の培養細胞の剥離方法は、培養容器から培養細胞を剥離させるための剥離液を培養容器に投入するステップと、培養細胞の剥離を判断するステップと、培養容器に剥離停止液を投入するステップとを有している。この培養細胞の剥離方法によれば、培養細胞が剥離されたことを判断して剥離停止液を投入することで、人が介在しなくても培養細胞の剥離を判断することが可能となり、培養細胞の剥離を自動化することができる。
【0006】
一方、細胞培養法において、生体から採取された初代培養細胞あるいは人為的に改変を加えた培養細胞から所望の形質を有する培養細胞または培養細胞集団(以下「コロニー」と称する)を採取するために、培養容器の内部に播種された培養細胞の所望の一部を採取する装置が知られている。
【0007】
例えば、特許文献2には、スライドグラス上に塗布された細胞から標的対象物となる所望の細胞を回収する標的対象物の自動探索回収装置が記載されている。この特許文献2に記載の自動探索回収装置は、対象物を検査して対象物の画像を撮影可能な顕微鏡と、顕微鏡による検査可能領域内に配置され対象物を顕微鏡に対して相対移動可能な状態で支持する試料台と、対象物のうち回収対象となる標的対象物を回収するノズルとを備え、さらに標的対象物の画像及びノズルの画像を解析する解析部並びに標的対象物及びノズルに関する画像データ及びその位置を記憶する記憶部が設けられた画像処理ユニットと、前記対物レンズによる前記探索済みの標的対象物と前記ノズルに対する焦点を合わせると共に前記試料板と前記ノズルとのXY面内における相対位置を制御する制御ユニットとを有している。
【0008】
この特許文献2に記載の標的対象物の自動探索回収装置によれば、標的対象物となる細胞を選択した後、自動的にこの細胞を回収することができる。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特開2007−275030号公報
【特許文献2】特開2005−207986号公報
【発明の概要】
【発明が解決しようとする課題】
【0010】
しかしながら、特許文献1に記載の自動細胞培養装置では、培養容器の内部に剥離液を投入して剥離させるもので、一般的な細胞剥離方法と同様に培養容器内のすべての細胞を剥離させるようになっている。そのため所望の細胞またはコロニーを選択して採取することができないという問題があった。
【0011】
また、特許文献2には、スライドガラス上に塗布された例えば血液から標的対象物となる細胞を回収するようになっており、細胞の周囲には固定液が配置されていることが記載されている。したがって、特許文献2に記載の標的対象物の自動探索回収装置では、これらの細胞の培養環境を劇的に変化させてしまうため、標的対象物とならなかった他の細胞を標的対象物の回収前と同様の培養条件で継続して培養することができないという問題があった。
【0012】
上述の問題点により、特許文献2に記載の装置を特許文献1に適用させても、培養細胞の培養に至適化された培養用条件での培養を継続しながら所望の細胞またはコロニー(以下「細胞等」と称する)を回収することは困難である。
【0013】
本発明は、上述した事情に鑑みてなされたものであって、その第1の目的は細胞等の培養環境を維持しながら培養中の細胞集団から所望の細胞等を回収可能な細胞またはコロニーの採取装置及び細胞またはコロニーの採取方法を提供することにある。
【0014】
また、本発明の第2の目的は、細胞等の培養環境を維持しながら特定の細胞等を自動的に回収可能な細胞またはコロニーの採取装置を提供することにある。
【課題を解決するための手段】
【0015】
上記課題を解決するために、この発明は以下の手段を提案している。
本発明の細胞またはコロニーの採取装置は、内壁面に細胞が付着して培養された培養容器の内部に少なくとも先端を挿入可能な筒部材と、前記細胞を前記内壁面から剥離するための剥離液を前記先端から吐出可能な吐出機構と、前記剥離液によって剥離された前記コロニーを構成する細胞を前記先端から前記筒部材の内部へ吸引する吸引機構とを備え、前記剥離液が、前記細胞の培養に用いられる培養液よりも比重及び粘度が高いことを特徴としている。
【0016】
この発明によれば、筒部材の先端から吐出される剥離液は、培養液よりも比重及び粘度が高く設定されている。そのため、剥離液が培養液中に吐出された際に、剥離液は培養容器内において鉛直下方へ沈下して滞留する。したがって、培養容器内で培養液に浸漬され培養面に付着している細胞等に対してこの剥離液を吐出すると、剥離液は、細胞等の周囲の培養液を押しのけて滞留し、細胞の周囲の限局された領域において培養液が剥離液に置換される。その結果、前述の限局された領域に含まれる細胞等が選択的に培養容器から剥離される。さらに、培養容器から剥離された細胞等は吸引機構によって筒部材の内部に吸引採取される。
【0017】
また、本発明の細胞またはコロニーの採取装置は、前記剥離液が、前記細胞の細胞外基質を変性可能な酵素を含むことが好ましい。
この場合、剥離液に細胞外基質を変性可能な酵素を含むことによって、酵素が細胞と培養容器との間の結合因子を変性させ、迅速に細胞を培養容器から剥離させることができる。
【0018】
また、本発明の細胞またはコロニーの採取装置は、前記剥離液が、グリセリンと、糖と、塩との少なくとも一つを含むことが好ましい。
これにより、剥離液の比重及び粘度が緩衝液や培養液等に対して高くなるように調整されている。このとき、グリセリン、糖及び塩はいずれも細胞毒性が極めて低いので、細胞培養中の培養細胞に対する悪影響を低減しつつ剥離液の比重及び粘度を高く調製することができる。
【0019】
また、本発明の細胞またはコロニーの採取装置は、前記剥離液の比重が1.005〜1.4の間にあることが好ましく、前記剥離液の比重が1.01〜1.1の間にあることがより好ましい。
剥離液の比重が1.005よりも小さいと培養液の中で効果的に沈下できない。また、剥離液の比重が1.4よりも大きいと剥離液の取り扱いが困難になる。剥離液の比重が1.005〜1.4の間にあることで、内径が細い筒部材を通じて剥離液を培養液中に効果的に吐出させて沈下させることができる。
【0020】
また、本発明の細胞またはコロニーの採取装置は、前記剥離液の粘度が1.04cP〜300cPの間にあることが好ましく、前記剥離液の粘度が1.1cP〜150cPの間にあることがより好ましい。
剥離液の粘度が1.04cP以下であると、剥離液が培養液中に拡散しやすいため剥離液中で細胞の剥離作用を生じる物質の濃度が低下する。すると、目的とする細胞等が充分に剥離されない場合や、目的とする細胞等の周辺領域まで拡散した剥離液によって目的外の細胞等が剥離されてしまう可能性がある。また、剥離液の粘度が300cPよりも大きい場合には、筒部材の内部を通じた剥離液の移動が困難になる。
【0021】
また、本発明の細胞またはコロニーの採取装置は、前記細胞または前記コロニーを観察可能な顕微鏡をさらに備え、前記顕微鏡が、視野の少なくとも一部の所定領域に熱線を照射可能な加熱機構を有することが好ましい。
この場合、加熱機構により顕微鏡で確認可能な細胞等に対して熱線を照射することによりこれら細胞等の近傍の温度を上昇させることができる。このとき、剥離液が吐出された部分では剥離液の活性が高まることにより細胞の剥離が促進される。したがって、細胞の剥離に要する時間を短縮することができる。
【0022】
また、本発明の細胞またはコロニーの採取装置は、前記加熱機構が、前記顕微鏡の光源からなる熱源と、前記顕微鏡の光路に熱線吸収フィルターを挿脱可能な挿脱機構とを有することが好ましい。
この場合、顕微鏡に標準的に装備されている光源を加熱機構の熱源とできるので、装置を簡易に構成することができる。細胞観察時と細胞剥離時とに応じて熱線吸収フィルターを顕微鏡の光路に対して挿入及び抜脱できるので、細胞の観察からその細胞の剥離に移る際にフィルター操作のみで熱線を照射することができ、装置の操作性を高めることができる。
【0023】
また、本発明の細胞またはコロニーの採取装置は、前記加熱機構が、前記所定領域の温度を測定する測定部を有し、前記測定部による測定結果に基づいて前記所定領域の温度が所定温度になるように前記熱線の照射量を調整する温度調整機構を有することが好ましい。
この場合、加熱機構による細胞の暖めすぎを防止することができ、細胞への傷害を防止することができる。したがって、使用者に所定領域の温度管理のために加熱機構を逐次操作させる必要がないので作業性が向上する。
【0024】
また、本発明の細胞またはコロニーの採取装置は、前記所定温度が、前記酵素の酵素活性に対する至適温度であることが好ましい。
この場合、剥離する対象の細胞またはコロニーがある所定領域が、酵素の最大活性を引き出すことができる温度に維持される。このため細胞等に対して酵素を作用させる時間を短縮させても効果的に細胞等を剥離することができる。また、所定領域を暖めすぎることによる酵素の失活を抑制することもできる。
【0025】
また、本発明の細胞またはコロニーの採取装置は、前記培養容器における所定の細胞またはコロニーの位置を検出する位置検出機構と、前記位置検出機構によって検出された前記位置に前記筒部材の先端を誘導する誘導機構と、前記筒部材の内部に吸引された前記細胞を複数の前記所定の細胞またはコロニーごとに分取する分取機構とをさらに備えることが好ましい。
この場合、所定の細胞等が指定された後に、培養容器における所定の細胞等の位置まで筒部材の先端が誘導されて所定の細胞等が分取機構へと採取される。さらに、この発明によれば複数の所定の細胞等を一度に指定し、引き続いて所定の細胞等のそれぞれを分取することができるので、使用者が採取すべき細胞等を一括で指定した後は、採取動作が自動化されて指定された細胞等が分取される。
【0026】
また、本発明の細胞またはコロニーの採取装置は、少なくとも前記培養容器の内部を前記細胞の培養に適した温度及び二酸化炭素濃度に維持するインキュベーターをさらに備えることが好ましい。
この発明によれば、細胞の剥離作業がインキュベーターの管理下で温度及び二酸化炭素濃度が維持された状態で行われる。したがって、細胞培養における重要な培養条件である温度と二酸化炭素濃度とが至適に維持された環境下で培養容器内の細胞等を剥離して採取することができる。このため、培養容器の内部にある複数の細胞等を採取することによって処理時間がかかってもその間の培養容器内の温度及びに二酸化炭素濃度が至適条件に維持され、培養環境の変化が抑制されるので細胞の性質を適切に維持管理することができる。
【0027】
本発明の細胞またはコロニーの採取方法は、培養液に浸漬されて培養される細胞または複数の前記細胞からなるコロニーが付着する付着面から前記細胞または前記コロニーを採取する細胞またはコロニーの採取方法であって、前記培養液よりも高い比重および粘度を有する剥離液を前記培養液の内部で前記細胞または前記コロニーに対して吐出する吐出工程と、前記吐出工程に続いて前記剥離液によって前記細胞または前記コロニーを前記付着面から剥離する剥離工程と、前記剥離工程に続いて前記付着面から剥離された前記細胞または前記コロニーを回収する回収工程とを備えることを特徴としている。
この発明によれば、まず、培養液の内部に剥離液を吐出する。すると比重の重い剥離液は培養液の内部で沈下して所定の細胞等に到達する。続いて粘度の高い剥離液は培養液に拡散されることなく所定の細胞等の近傍に滞留する。続いて、剥離工程において剥離液の作用によって剥離液と接触している細胞等は付着面から剥離される。続いて付着面から剥離された細胞等が回収される。このようにして、培養容器中で、蛋白質等を含有する培養液を除去することなく、所望の細胞等を選択して剥離し、回収することができる。
【0028】
また、本発明の細胞またはコロニーの採取方法は、前記吐出工程に続いて、前記所定の細胞またはコロニーの近傍に吐出された前記剥離液を加熱する加熱工程をさらに備えることが好ましい。
この場合、剥離液を加熱することによって剥離液の活性を至適化し、剥離液による細胞の剥離時間を短縮することができる。
【発明の効果】
【0029】
本発明の細胞またはコロニーの採取装置及び細胞またはコロニーの採取方法によれば、培養中の細胞集団から所望の細胞またはコロニーを回収することができる。
また、本発明の細胞またはコロニーの採取装置によれば、細胞またはコロニーを自動的に回収することができる
また、本発明の細胞またはコロニーの採取装置によれば、細胞等の培養環境を維持しながら特定の細胞等を自動的に回収することができる。
【図面の簡単な説明】
【0030】
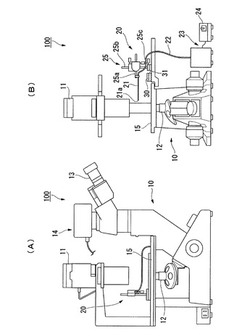
【図1】(A)は本発明の第1実施形態の細胞またはコロニーの採取装置の側面を示す構成図、(B)は同採取装置を一部破断して示す正面図である。
【図2】同採取装置の一部の構成を示す拡大図である。
【図3】(A)ないし(C)は同採取装置の使用時の動作を示す図である。
【図4】(A)ないし(D)は同採取装置の使用時の動作を示す図である。
【図5】(A)は本発明の第2実施形態の細胞またはコロニーの採取装置の側面を示す構成図、(B)は同採取装置を一部破断して示す正面図である。
【図6】(A)ないし(D)は同採取装置の使用時の動作を示す図である。
【図7】本発明の第3実施形態の細胞またはコロニーの採取装置を示す構成図である。
【図8】(A)ないし(C)は同採取装置の使用時の動作を示す図である。
【図9】本発明の第4実施形態の細胞またはコロニーの採取装置を示す構成図である。
【図10】同採取装置の使用時の動作を示すフローチャートである。
【図11】(A)ないし(C)は本発明の細胞またはコロニーの採取方法の実施例における一過程を示す顕微鏡写真である。
【図12】(A)ないし(D)は本発明の細胞またはコロニーの採取方法の実施例における一過程を示す顕微鏡写真である。
【図13】(A)及び(B)は本発明の細胞またはコロニーの採取方法の実施例における一過程を示す顕微鏡写真である。
【図14】(A)ないし(C)は本発明の細胞またはコロニーの採取方法の実施例における一過程を示す顕微鏡写真である。
【図15】(A)及び(B)は本発明の細胞またはコロニーの採取方法の実施例における一過程を示す顕微鏡写真である。
【発明を実施するための形態】
【0031】
(第1実施形態)
以下、本発明の第1実施形態の細胞またはコロニーの採取装置について図1から図4を参照して説明する。
図1は、本実施形態の細胞またはコロニーの採取装置(以下「採取装置100」と称する)の構成を模式的に示す構成図である。図1(A)は採取装置100を示す側面図であり、図1(B)は採取装置100を一部破断して示す正面図である。
【0032】
図1(A)及び図1(B)に示すように、採取装置100は、培養細胞の観察等に使用される顕微鏡装置10と、培養容器から細胞を採取するための採取機構20とを備える。
【0033】
顕微鏡装置10には、実体顕微鏡や位相差顕微鏡等の周知の生物顕微鏡を選択して使用することができる。顕微鏡装置10は、対象物に可視光を照射可能な光源11と、光源11からの光が入射可能な対物レンズ12とを備える。また、顕微鏡装置10には、使用者が対象物を観察するための接眼レンズ13あるいは対象物の画像を取得して表示するディスプレイ機構14の少なくともいずれかが設けられていることが好ましい。
【0034】
顕微鏡装置10には、対象物を載置するステージ15が設けられている。ステージ15は、対象物が載置されて対物レンズ12との間で相対移動可能な構成になっている。
【0035】
採取機構20は、先端開口21aと基端開口21bとを有する筒部材21(図2参照)と、筒部材の基端開口21bと連通するように一端が接続されたチューブ22と、チューブ22の他端と連通されたシリンジポンプ23とを備える。
【0036】
筒部材21は、ガラスあるいは樹脂からなる筒状の部材で、先端開口の内径は200μm程度に形成されていることが好ましい。なお、先端開口21aと基端開口21bとのそれぞれの内径は、同径でも異径でもよい。また、筒部材21は、少なくとも先端において光を透過可能であることが好ましい。これは、顕微鏡下において筒部材21の内部に取り込まれた対象物等を確認可能にするためである。なお、筒部材21は無色透明であってもよいし、着色されていてもかまわない。
【0037】
シリンジポンプ23は、詳細は図示しない外筒及びプランジャーを有する周知のシリンジと、外筒に対してプランジャーを進退移動させるための進退操作部24とが設けられている。
【0038】
また、筒部材21は、支持部25によって支持されている。支持部25は、直交する3軸線上で進退動作可能な構成になっており、例えば互いに相対移動可能な軸25a、25b、25cを備えて軸25aに固定された筒部材21を当該3軸に沿って移動させる構成を採用することができる。
【0039】
なお、本実施形態の採取装置100は、クリーンルームの中、クリーンベンチの中、あるいは空気清浄機能を有するフードの中など、落下菌による汚染が防止可能な環境下で使用されることが好ましい。
【0040】
次に、本実施形態において細胞の剥離に使用される剥離液について詳述する。
剥離液30は、培養容器の内壁である付着面に付着して培養された培養細胞等を付着面から剥離するための液体である。剥離液30は、燐酸緩衝生理食塩水(Phosphate buffered saline、以下「PBS」と称する)と、エチレンジアミン四酢酸(Ethylenediaminetetraacetic acid、以下「EDTA」と称する)と、グリセリンとを含有する液体であるPBS−EDTA−グリセリン溶液を採用することができる。なお、剥離液30は、剥離液容器31(図1(B)参照)の内部に貯留されて使用される。
【0041】
PBSは、培養細胞の培養液と等張に調製された周知の緩衝液である。また、EDTAは、培養細胞の細胞表面の接着因子からカルシウムイオンを奪うことによって接着因子による接着力を弱める作用を有する。EDTAは、その使用時の最終濃度が0.02%程度となるように調製されていることが好ましい。また、グリセリンは、親水性を有し前述のPBSに溶解されることで溶液の比重及び粘度を高める作用を有する。グリセリンは、その使用時の最終濃度が10%から50%の間に調整されていることが好ましい。
【0042】
さらに、剥離液30には、細胞表面の接着因子あるいは細胞外基質を分解可能なプロテアーゼを含有することが好ましい。このようなプロテアーゼには、コラゲナーゼやトリプシン等を剥離対象となる細胞に合わせて選択して採用することができる。例えばトリプシンを含有して使用する際には、トリプシンの濃度は使用時の最終濃度で0.05%から0.5%の間に調整されて使用されることが好ましい。
【0043】
また、剥離液30には、培養液と異なる色に着色可能な着色料を添加することができる。このような着色料としては、ブロモフェノールブルーやフェノールレッド等のpH指示薬等を採用することができる。また、このような着色料としては、細胞傷害性のない着色料であればpH指示薬に限定されるものではない。
【0044】
剥離液30使用時の比重は1.005〜1.4の間にあることが好ましく、これは培養細胞の培養液の比重よりも大きく設定されている。より好ましくは、剥離液30の使用時の比重は1.01〜1.1の間に設定され、培養液の内部で沈下可能になっている。
【0045】
また、剥離液30の使用時の粘度は、1.04cP〜300cPの間にあることが好ましい。剥離液30の使用時の粘度は、培養液の粘度よりも高く、かつ筒部材21等の内部で剥離液30を流動可能になっている。より好ましくは、剥離液30の粘度は1.1cP〜150cPの間に設定されている。このようにすると、培養液よりも十分に粘度が高く、剥離液30に含有されるトリプシン等が培養液内で拡散するのが抑制されると共に、筒部材21の内部で剥離液30を流動させることができる。
【0046】
以上に説明する構成の、採取装置100の作用について、図3及び図4を参照しながら説明を行う。
図3は、培養容器40の内部で培養された細胞Cを付着面41から剥離する工程を示す図である。
図3(A)に示すように、細胞Cは培養容器40の内部で付着面41に付着して培養されており、培養液Mに浸漬されている。使用者は培養容器40を周知の顕微鏡あるいは顕微鏡装置10のステージ15上に配置し、周知の方法で細胞Cの培養状態を観察し、採取すべき細胞C(例えば細胞C2)を決定する。
【0047】
続いて、使用者は落下菌の進入が防止できる手段を有する場所で培養容器40のキャップ42を取り外す。以降、培養容器40のキャップ42が空いている間の操作は無菌操作であることが好ましい。
【0048】
続いて、使用者は筒部材21の先端開口21aを剥離液容器31の内部に挿入し、剥離液30に浸漬させる。続いてシリンジポンプ23の進退操作部24を操作して剥離液30を所定量だけ筒部材21の先端から吸引する。筒部材21の内部に吸引する剥離液30の量は採取する対象となる細胞C2の量(すなわちコロニーの大きさ)に応じて適宜調整される。
【0049】
続いて、図3(B)に示すように、剥離液30が筒部材21の内部に保持された状態でシリンジポンプ23の動作を停止させ、筒部材21の先端開口21aを培養容器40の開口部43から内部へ挿入する。使用者は、顕微鏡装置10によって得られた細胞C2の像を頼りにして筒部材21の先端開口21aを細胞C2の近傍に誘導する。このとき、筒部材21の先端開口21aは細胞Cを培養するための培養液Mに浸漬された位置関係にある。
【0050】
続いて、図3(C)に示すように、使用者はシリンジポンプ23の進退操作部24を操作して筒部材21の先端開口21aから剥離液30を吐出させる(吐出工程)。すると、筒部材21の先端開口21aから吐出された剥離液30は、培養液Mの内部で重力に従って沈下し、細胞C2に重層される。ここで、剥離液30は培養液Mよりも粘度が高いので、剥離液30は細胞C2の近傍にあった培養液Mを押しのけるようにして細胞C2の近傍に留まる。
【0051】
図4は、剥離液30が吐出されてから細胞C2が採取されるまでの動作を示す図である。図4(A)に示すように、剥離液30に含有されたEDTAやプロテアーゼは、剥離液30と培養液Mとの界面では培養液Mに含有される蛋白質の一部を分解する作用を生じ、剥離液30と細胞C2との接触面では細胞C2の細胞表面の蛋白質を分解する作用を生じる。このとき、剥離液30の粘性が高く培養液M中で拡散することが抑制されているため、剥離液30による蛋白質の分解は剥離液30が吐出された細胞C2の近傍に限局されている。したがって、剥離液30が培養液M内に拡散する前に剥離液30が細胞C2と培養容器40の付着面41との間及び細胞C2のそれぞれの間に浸透して細胞表面の接着因子等の蛋白質が分解され、細胞C2は付着面41から離間する(剥離工程)。
【0052】
剥離工程が完了したか否かは、使用者が顕微鏡装置10等によって細胞C2を観察することで確認することができる。剥離工程が完了した後に、使用者は、シリンジポンプ23の進退操作部24を操作して筒部材21の先端開口21aから剥離液30を吸引し、剥離液30と共に細胞C2を筒部材21の内部へ吸引する。このとき、剥離液30が作用した範囲の細胞C2のみが付着面41から剥離しているので剥離液30によって剥離された細胞C2のみが吸引されている(図4(B)参照)。
【0053】
続いて、筒部材21の内部に細胞C2が吸引された状態で進退操作部24を停止させて筒部材21の内部に細胞Cを保持する(回収工程)。さらに筒部材21を培養容器40の開口部43から抜去する(図4(C)参照)。
続いて、筒部材21の先端開口21aを例えば滅菌された採取容器50まで誘導する。採取容器50の内部に筒部材21の先端開口21aを挿入し、シリンジポンプ23の進退操作部24を操作して細胞C2を採取容器50の中へ吐出する(図4(D)参照)。
【0054】
必要に応じて、採取容器50の内部で筒部材21の内部を共洗いして筒部材21の内部に残留した細胞C2を採取容器50に移す操作を行うことができる。また、必要に応じて、筒部材21の内部を図示しない洗浄液(例えばPBS)で洗浄し、筒部材21の内部に残留した細胞C2を除去してもよい。
【0055】
採取すべき細胞C2をすべて採取したら、キャップ42を培養容器40の開口部43に取り付け、培養容器40を適宜の培養環境が設定された図示しない培養装置に戻して一連の作業を完了する。採取された細胞C2は、拡大培養や実験、あるいは検査等の所望の工程に引き渡される。
【0056】
以上説明したように、本実施形態に係る細胞またはコロニーの採取装置及び細胞またはコロニーの採取方法によれば、培養液Mに比して比重及び粘度が高く設定された剥離液30を用い、剥離液30を培養液Mに沈下させて剥離液30を特定の細胞C2に対して選択的に作用させるようになっている。
【0057】
一般的に、細胞培養法において培養容器から培養細胞を剥離する際には、培養容器内にある培地を除去し、蛋白質等を含有しない緩衝液(例えばPBS)で培養細胞を数回洗浄する必要がある。これは、従来の剥離液は培養液の内部に吐出された際に剥離液が専ら培養液に含有された蛋白質を分解するに止まることを抑制するためである。
【0058】
一方、本実施形態の剥離液は、培養液Mの中で沈下すると共に培養液Mの中で拡散せずに培養液Mを押しのけて留まるので、剥離液30が吐出された位置の近傍に限局されて剥離液30による剥離作用が及ぶようになっている。したがって、剥離液が細胞の剥離に効果的に作用するようになっているために、培養液の存在下においても細胞を付着面から剥離することができる。
【0059】
このため、従来必須であった培養液を除去する工程と、培養細胞を緩衝液で洗浄する工程とを省くことができるので、試薬の削減による低コスト化と、工程の削減による汚染確率の低減とが可能になる。
【0060】
さらに、培養細胞が培養液に浸漬された状態で培養細胞の採取が可能であるので、採取対象とならなかった細胞に対して、培養液に浸漬された状態から何ら培養条件を変更せずに培養を継続することが可能になる。これは、培養液を緩衝液に置換することによる培養環境の変化を防止しながら所望の培養細胞を適宜採取できるという効果を奏する。
【0061】
(第2実施形態)
次に、本発明の第2実施形態の細胞またはコロニーの採取装置について図5及び図6を参照して説明する。なお、以下に説明する各実施形態において、上述した第1実施形態の細胞またはコロニーの採取装置と構成を共通とする箇所には同一符号を付けて、説明を省略することにする。
【0062】
本実施形態の細胞またはコロニーの採取装置200は、採取機構20に代えて採取機構220を備える点で第1実施形態と構成が異なっている。
また、剥離液30に代えて、上述のプロテアーゼ等の酵素を含有する剥離液30aが採用されている。
【0063】
採取機構220は、チューブ22に代えて、筒部材21の基端開口21bに一端が接続されたチューブ222aと、チューブ222aの他端に接続されて剥離液30aが貯留された剥離液容器231と、剥離液容器231からシリンジポンプ23まで連通され、中間部に滅菌フィルターを有するチューブ222bとを備えている。
【0064】
剥離液容器231には、剥離液30aが貯留されており、チューブ222aの他端は剥離液30aに浸漬されている。また、チューブ222bの開口端部は剥離基容器231の内部の空気層に開口する位置関係に配置されている。
【0065】
本実施形態のシリンジポンプ23は、進退操作部24を操作することによってチューブ222bを通じて剥離液容器231に気体を送出し、あるいは剥離液容器231から気体を吸引することができる。
【0066】
また、本実施形態では、顕微鏡装置10の視野の少なくとも一部を加熱する加熱機構260を有する。加熱機構260は、顕微鏡装置10の光源11から観察対象まで至る光路の一部に、光源11によって生じる赤外線等の熱線を吸収するための熱線吸収フィルタ16を挿脱可能な挿脱機構216を有する。なお、挿脱機構216は熱線吸収フィルタ16が顕微鏡装置10の光路に対して挿入状態と脱離状態とそれぞれの位置関係を生じさせることができればよいもので、駆動手段を備える構成であっても手動により挿脱する構成であっても本発明の効果を奏するものである。
すなわち、本実施形態の加熱機構260は、顕微鏡装置10の視野のうち細胞等がある位置の近傍を加熱することができるものであって、このための熱源として顕微鏡装置10に搭載された光源11を用いることができるようになっているものである。
【0067】
以下では、本実施形態の採取装置200の使用時の動作を、採取機構220の動作を中心に図6(A)から図6(D)を参照して説明する。図6(A)から図6(D)は採取装置200による細胞の採取の一過程をそれぞれ模式的に示すである。
【0068】
まず、使用者はシリンジポンプ23の進退操作部24を操作して筒部材21の内部における剥離液30aの位置関係を初期状態に設定する。初期状態では、筒部材21の内部に剥離液30aが充填されており、筒部材21の先端開口21aにおいて剥離液30aのメニスカスが生じている位置関係を目安として調整されることが好ましい。
【0069】
続いて、図6(A)に示すように、使用者は培養容器40の内部における採取すべき所望の細胞C2を決定し、使用者は筒部材21の先端開口21aを培養容器40の内部へ挿入し、筒部材21の先端開口21aを細胞C2の位置まで誘導する。
【0070】
筒部材21の先端開口21aは培養容器40の中で培養液Mに浸漬された状態にある。この状態で、シリンジポンプ23の進退操作部24を動作させて、チューブ222bの内部を陽圧にする。するとチューブ222bを通じて剥離液容器231の空気層に対して空気が送り込まれる。これによって剥離液容器231の内部の圧力が上昇する。すると空気層が剥離液容器231の内部の剥離液30aを押し下げることによって剥離液30aは剥離液容器231からチューブ222aへと押し出され、その結果、剥離液30aは、チューブ222a及び筒部材21を通じて筒部材21の先端開口21aから吐出される。
【0071】
図6(B)に示すように筒部材21の先端開口21aから吐出された剥離液30aは、培養液に対して比重及び粘度が高いので、第1実施形態と同様に培養液Mの内部で沈下して培養容器40の付着面41に留まる。このように剥離液30aは細胞C2によるコロニーの近傍に限局されて配置されている。
【0072】
使用者は、顕微鏡装置10の視野絞り(不図示)を操作して採取対象となる細胞C2を囲繞する位置関係まで視野を絞り、さらに挿脱機構216を操作して熱線吸収フィルター16を光路から外す。すると、それまで赤外線等の熱線が吸収されていた状態から熱線が透過可能な状態に切り替わるので、熱線は上記の視野に到達し、採取対象となる細胞C2の周辺の温度が上昇する。一方で、視野絞りによって光が遮断された領域には、熱線が到達しないのでこの領域において温度上昇は起こらない。
【0073】
一般的に、顕微鏡によって培養細胞の観察を行う際には、特別な保温手段がない場合には、培養容器の内部の培養液の温度は室温(生物学分野では、一般的に25℃から26℃程度の温度を指して室温と称することが多い。)まで徐々に低下してゆき平衡化する。本実施形態の剥離液に含まれる酵素は、細胞を剥離するための活性が最大となる温度が室温よりも高い。例えば、トリプシンの場合には、トリプシンを作用させる部位の温度が36℃から38℃程度の間にある場合に、効率よく細胞を剥離することができる。
【0074】
加熱機構260によって加熱する際の上記領域の温度は、採取対象の細胞C2の培養至適温度と酵素が最大活性を示す温度とのいずれも超えない温度であることが好ましい。また、培養液M中に、特に高温にさらされることが好ましくない物質を含有する場合にはその物質によって上限温度が規定される。
【0075】
なお、上記領域の温度を至適条件に維持する温度調整機構として、上記領域の温度を測定する測定部を備え、測定部によって測定された温度情報に基づいて加熱機構260の動作、すなわち挿脱機構216による熱線吸収フィルターの挿脱を制御する構成を採用することができる。この場合、測定部は、上記領域に対して非接触で温度を測定する構成であることが好ましい。
【0076】
使用者は、図6(C)に示すように、剥離液30aによる細胞剥離が起こるのを待つ間に、筒部材21の先端開口21aを培養液から取り出し、さらにシリンジポンプ23の進退操作部24を操作することによって筒部材21の先端開口21aに空気Aを吸引させる。空気Aを吸引する量は適宜である。ただし、最大値でも筒部材21の内部に充填される量であることが好ましく、剥離液容器231の内部までは吸引されないほうが好ましい。
【0077】
剥離液30aが添加され、加熱機構260によって熱線が照射された細胞C2は、剥離液30aの作用によって付着面41から剥離される。一方で、剥離液30aが添加されても加熱機構によって熱線が照射されなかった領域では、図示していないが熱線が照射された領域と比較して酵素活性が弱く作用しているため、細胞等の剥離が緩やかになっているかまったく剥離されていない。したがって、顕微鏡装置10の視野絞りを絞ることで特定の細胞C2が選択的に剥離される。
【0078】
図6(D)に示すように、使用者は、筒部材21の先端開口21aを再び培養液Mに浸漬し、筒部材21の先端開口21aを剥離された細胞C2まで誘導する。続いて、シリンジポンプ23の進退操作部24を操作して剥離液30aと細胞C2とを筒部材21の先端開口21aから吸引する。このとき、筒部材21の内部では、剥離液容器231から続く未吐出の剥離液30aと、培養容器40から吸引された剥離液30a・細胞C2の混合液との間に空気層Aが介在されている。このため、筒部材21の内部に吸引された細胞C2は未吐出の剥離液30a側へと拡散しない。
【0079】
続いて、使用者は筒部材21の先端を、第1実施形態で示したような採取容器50まで誘導し、筒部材21から剥離液30a・細胞C2の混合液を吐出させる。こうして一連の作業を完了する。採取すべき他の細胞等がある場合には、筒部材21の先端開口21aの内部及び外部をPBS等の緩衝液で洗浄した後に上述の操作を繰り返す。
【0080】
本実施形態の採取装置200によれば、剥離液容器231からチューブ222aを通じて筒部材21へと剥離液30aを送液する構成であるので、第1実施形態の採取装置100と比較して、細胞等の採取前に必要量の剥離液30aを筒部材21の先端開口21aから吸引する工程を廃することができる。これは、複数の細胞またはコロニーを順次採取するような作業において作業量を減らして作業に係る手間と時間を減らすことができるという効果を奏する。また、細胞の剥離に係る一連の作業時間を減少させることは、細胞培養において温度や二酸化炭素濃度等の培養条件が異なる環境下に置かれる時間を減少させることにつながり、細胞培養条件を至適条件に維持しながら細胞を採取することができる。
【0081】
また、加熱機構260によって採取対象の細胞等の近傍を加熱して剥離液30aの活性を高めて細胞を剥離することができるので、細胞を剥離するのにかかる時間を短縮できる。一般的に、顕微鏡に設けられた熱線吸収フィルターは、細胞の観察等において悪影響となる熱線を除去するためのフィルターであり、顕微鏡によって細胞を取り扱う際に熱線吸収フィルターを顕微鏡の光路から外すこと自体想定されていないものであった。
【0082】
本実施形態の採取装置では、熱線吸収フィルター16を挿脱する挿脱機構216を有し、かつ顕微鏡装置10の視野絞りによって熱線の照射範囲を制限することができるので、剥離対象となる細胞等に対して選択的に酵素の作用を高めて剥離することができる。これは、粘度及び比重が高められて剥離対象の細胞等の近傍に留まる剥離液30aの作用範囲をさらに制限することによって細胞またはコロニーの選択採取の精度を高めることができるという効果を奏する。
さらに、加熱機構260が顕微鏡装置10の光源11を熱源として転用可能に構成されているので、装置構成を簡略化できるという効果もある。
【0083】
(第3実施形態)
次に、本発明の第3実施形態の細胞またはコロニーの採取装置について図7及び図8を参照して説明する。
本実施形態の細胞またはコロニーの採取装置300(以下採取装置300と称する)は、第2実施形態の採取装置200に対して、採取機構220に代えて採取機構320を備える点で構成が異なっている。より詳しくは、チューブ222aの中間部に介在された電磁弁301と、電磁弁301に一端が連通されたチューブ302と、チューブ302の他端が開口された密閉容器状の採取容器350と、採取容器350の内部に連通されると共にシリンジポンプ23に連通されるように接続されたチューブ303とを備える点で構成が異なっている。
【0084】
図8は、採取装置300の使用時の動作を模式的に示す図である。図8(A)に示すように、採取装置300では、電磁弁301によって剥離液容器231から筒部材21に至る経路が選択された状態で剥離液30を採取対象の細胞C2の近傍に吐出する。
【0085】
続いて図8(B)に示すように、筒部材21の先端開口21aを培養液Mから取り出して、さらに筒部材21の内部にある剥離液30を剥離液容器231まで引き戻す。
【0086】
続いて、図8(C)に示すように、筒部材21から採取容器350までを連通させるように電磁弁301を動作させ、筒部材21の先端開口21aを細胞C2まで再び誘導した後にシリンジポンプ23によって細胞C2を採取容器350の内部に吸引する。
本実施形態の採取装置300でも、上述の各実施形態の採取装置と同様に所望の細胞またはコロニーを選択して採取することができる。
【0087】
なお、本実施形態では、採取された細胞C2が採取容器350に貯留される構成を説明したが、これにかぎらず採取された細胞を他の検査・実験工程に移送することもできる。例えば培養容器40から採取した細胞C2を所定個数ごとに培養容器に分取するセルソーターや、細胞C2の形状や表面抗原の差異によって分析するフローサイトメーター等に接続して使用することが可能である。
【0088】
なお、本実施形態では電磁弁301によって剥離液30等の流路を切り替える構成が採用されているが、これに限らず、手動で流路を切り替える三方活栓等を有する構成を採用することもできる。
【0089】
(第4実施形態)
次に、本発明の第4実施形態の細胞またはコロニーの採取装置について図9を参照して説明する。
本実施形態の細胞またはコロニーの採取装置400(以下採取装置400と称する)は、細胞培養における培養条件のうち少なくとも温度と二酸化炭素濃度とを制御可能なインキュベーター401を備える点で上述の各実施形態と構成が異なっている。インキュベーター401はHEPAフィルターを有する空気清浄機構402を備えている。さらに、採取機構20、220、320に代えて採取機構420を備える。
【0090】
採取機構420は、電磁弁301から分岐されて接続されたチューブ302の先端には、培養容器40の付着面41から剥離された細胞を回収するための分取機構450が設けられている。
【0091】
分取機構450は、軸回りに回転することでチューブ302の先端に対して相対移動可能で、周知のサンプルチューブや試験管等を配置可能なテーブル452と、テーブル452を回転させる回転駆動部(不図示)とを備える。また、サンプルチューブや試験管等の開口部を封止可能な栓体453及び栓体駆動部454が設けられている。テーブル452は、後述するコンピュータ403に制御されて断続的に軸回りに回転するようになっている。
【0092】
また、本実施形態では、支持部25に代えて、直交する3軸線上でそれぞれ進退動作可能な駆動部を有する可動支持部425と、ステージ15に代えて、周知のXYステージとしての機能を有する可動ステージ415とを備えている。このため、可動支持部425に支持された筒部材21の先端開口21aと可動ステージ415上に配置される培養容器とは相対移動可能になっている。
【0093】
また、本実施形態では、シリンジポンプ23は、外部からの駆動信号の入力によってその動作が制御される構成になっており、駆動信号に基づいて、筒部材21の先端開口21aから流体を吸引吐出できるようになっている。
【0094】
さらに、採取装置400には、コンピュータ403が接続されている。コンピュータ403は、対物レンズ12を通じて詳細は図示しない撮像部414によって取得された培養容器内の細胞の画像情報を受信し、同時に可動ステージ415と筒部材21の先端開口21aとの相対位置情報を受信する。コンピュータ403は、この画像情報と相対位置情報とに基づいて採取対象となる細胞等の位置を記憶可能である。また、コンピュータ403は可動ステージ415及び可動支持部425に、培養容器内の細胞の位置に筒部材21の先端開口21aを誘導する駆動信号を送信可能になっている。
【0095】
また、コンピュータ403は、分取機構450における上述の回転駆動部に対して断続的に駆動信号を送信してテーブル452を回転動作可能になっている。
【0096】
以上に説明する構成の、採取装置400の作用について、図10を参照しながら説明を行う。図10は採取装置400の動作を示すフローチャートである。
培養細胞が培養されている培養容器は、インキュベーター401の内部において可動ステージ415上にセットされている(配置工程S401)。このとき、培養容器40のキャップ42は緩められている。
続いて、使用者はコンピュータ403を操作し、培養容器40の付着面に付着した細胞を走査するように観察する。このとき、採取すべき細胞が画面上に確認できたら、その位置を指示し、コンピュータ403に記憶させながら、採取すべき細胞等を順次選択してゆく。(選択工程S402)
採取すべき細胞等の選択が完了したら、これらの細胞等の採取を開始する。
【0097】
まず、使用者は培養容器40のキャップ42を取り外し、開口部43を開放する。(開放工程S403)。以下の工程は、コンピュータ403から送信される駆動信号に基づいた動作である。
【0098】
まず、筒部材21の内部に剥離液30を充填させる。これは、電磁弁301によって剥離液容器231と筒部材21とが連通された状態でシリンジポンプ23が駆動されることによって行われる。このとき、筒部材21の先端から洩出する剥離液30を所定の位置で回収するようにしてもよい。
【0099】
続いて、可動支持部425及び可動ステージ415を動作させることによって、前述のように使用者が指定した細胞またはコロニーのうち最初の細胞等のある位置に筒部材21の先端21aが培養容器40の内部に挿入されて誘導される(誘導工程S405)。
【0100】
続いて、筒部材21の先端開口21aから剥離液30が培養液Mの内部に吐出される(吐出工程S406)。すると、上述の各実施形態と同様に剥離液30は培養液Mの内部で沈下し、採取対象となる細胞C2の近傍に留まる。したがって採取対象となる細胞C2が培養容器40の付着面から剥離される。本実施形態では、インキュベーター401によって培養容器40の内部の温度が培養細胞の培養に適した温度に維持されている。このとき、剥離液30に含まれる酵素の酵素活性が十分に高められているので剥離液30が接触している細胞C2は付着面41から速やかに剥離される。
【0101】
なお、筒部材21の先端開口21aから剥離液30が吐出されてから細胞C2が付着面41から剥離されるまでの間に、筒部材21の先端開口に空気Aが吸引される。より詳しくは、吐出工程S406に続いて筒部材21の先端開口21aが移動されて培養液Mから取り出される(筒部材移動工程S407)。さらに続いて、筒部材21の先端から空気Aが吸引されて電磁弁301を超えて剥離液容器231側まで空気Aが吸引されたところで停止される(空気吸引工程S408)。
続いて電磁弁301の経路が分取機構450側の経路に切り替えられる(流路切替工程S410)。さらに筒部材21の先端開口21aは前述の細胞等の位置へと再び誘導される。
【0102】
なお、細胞等の剥離にかかる時間は細胞の種類と付着面の種類とが主な要因となって変動する。したがって、細胞が十分に剥離されたかどうかは、使用者の目視によって判断され、細胞が十分に剥離された際に、使用者がコンピュータ403に対して細胞等の剥離が完了したことを示す入力を行う(確認工程S409)。
【0103】
すると、コンピュータ403は、シリンジポンプ23を駆動させて筒部材21の内部に剥離液30・細胞C2混合液を吸引する(回収工程S411)。すると、細胞C2は、筒部材21の先端開口21aからチューブ222a、電磁弁301、チューブ302を通じて分取機構450へと移送され、分取機構450に設けられたサンプルチューブあるいは試験管の一つに回収される。
【0104】
なお、必要に応じて、筒部材21の先端開口21aから適宜の量の培養液Mが吸引されサンプルチューブあるいは試験管に剥離液30と共に移送されるように、筒部材21の先端開口21aが培養液Mに浸漬されたまま細胞C2の吸引を行うこともできる。この場合、サンプルチューブあるいは試験管の内部において剥離液30と培養液Mとが攪拌され、剥離液30中の酵素は培養液M中の蛋白質等を分解する。したがって、サンプルチューブあるいは試験管に回収された細胞C2の膜表面蛋白質の分解作用が低減された状態になっている。
【0105】
細胞等が分取機構450に回収されたら、分取機構450のテーブル452が回転し、チューブ302が挿入可能な位置に別のサンプルチューブが位置される。また、筒部材21の先端開口21aの外面が図示しないPBS等の洗浄液で洗浄される(洗浄工程S412)。また電磁弁301の経路が再び筒部材21と剥離液容器231とを連通する経路へと切り替えられ、筒部材21に剥離液30が充填されることによって初期状態に戻る(復帰工程S413)。さらに、筒部材21の先端開口21aが、採取対象となる次の細胞またはコロニーの位置へと誘導され、次の細胞等が上述と同様に分取機構450に回収される。
【0106】
使用者が定めた所定の細胞等の採取が完了したら、筒部材21が培養容器40の外へ引き抜かれて一連の工程を完了する。
【0107】
本実施形態の採取装置400によれば、使用者は画面を見ながら所望の細胞に対して採取するかどうかを決定し、続く採取作業はコンピュータ403によって指示されて動作するようになっている。したがって、使用者は、細胞等が剥離されたかどうかを画面上で確認して作業を継続させるだけでよいので使用者にかかる負担を低減する事ができる。また、剥離に係る作業に人手が介在しないので、使用者の熟練度によらず安定して細胞を採取することができる。
【0108】
また、インキュベーター401の内部において、培養容器40ごと温度、二酸化炭素濃度の制御を行っているので、培養容器40内の培養細胞に対して培養条件の大きな変動を生じさせることを抑制することができる。したがって、多数の細胞またはコロニーを順次採取する場合においても培養条件を至適条件に維持したまま細胞等を採取することができる。
【0109】
以上、本発明の実施形態について図面を参照して詳述したが、具体的な構成はこの実施形態に限られるものではなく、本発明の要旨を逸脱しない範囲の設計変更等も含まれる。
例えば、本発明の第4実施形態の細胞またはコロニーの採取装置では、インキュベーターは、温度および二酸化炭素濃度を至適条件となるように制御する構成であるが、これに代えて窒素濃度あるいは酸素濃度を制御する構成が付加されたインキュベーターを採用することもできる。
【0110】
また、細胞等の採取が短時間で済むことが予想される場合には、二酸化炭素濃度を制御する構成を備えずに温度を制御する構成のみを備えたインキュベーターを採用してもよい。なお、温度のみを調整するインキュベーターには、顕微鏡の中座としてのサーモプレートの概念が含まれている。
【0111】
また、本発明の第4実施形態では、細胞が付着面からはがれたことを使用者が確認して処理を継続させる構成を採用した。本発明は、この構成に限られるものではなく、例えば採取対象の細胞等が剥離されたかどうかを確認するステップを設けずに、剥離液の吐出から所定時間だけ経過した後に細胞の吸引を開始する構成とすることもできる。この場合、使用者は採取すべき所定の細胞またはコロニーを選択するだけよいので作業性を大幅に向上させることができる。
【0112】
さらに、採取対象の細胞等を特定する手段として、コンピュータ403において受信さされた細胞等の画像情報に基づいて所定の特徴を有する細胞を認識してその細胞またはコロニーの位置を記憶する構成を採用することもできる。
例えば、採取対象の細胞において特異的に発現している物質に対応して生じる蛍光や着色を検知する構成や、採取対象の細胞の大きさや形状があらかじめ設定した範囲にあることを認識して採取対象として設定する構成等を採用することができる。
この場合、使用者が採取対象の細胞を選択する工程を削減できるので、定量的な判断基準で採取対象となる細胞等を選択することができると共に、使用者の作業量を低減することができる。
【0113】
また、採取対象となる細胞等が剥離されたか否かを判断する判断機構をさらに備えることもできる。例えば、コンピュータ403による画像解析によって、付着性細胞によるコロニーが付着面から剥離されている際にその外部形状が略球形となることを検知して細胞等が剥離されたことを判断することができる。この場合、当該コロニーのうち略球形となった細胞が所定割合以上に達したことが判断されたことに基づいて当該細胞の採取を行うことができる。
【0114】
次に、以下に示す各実施例に基づいて、細胞またはコロニーの採取についてより詳細に説明する。
【実施例1】
【0115】
図11は、本発明の細胞またはコロニーの採取方法により付着性細胞を付着面から剥離して採取する一過程を撮影した顕微鏡写真である。
【0116】
本実施例では、細胞にはヒト子宮頸癌由来の培養細胞株であるHeLa(25株)が用いられた。培養容器には、Corning社製の組織培養プレートで直径3.5cmのものが用いられた。培養液は、Gibco社製のMEM(Minimum Essential Medium)に体積比で10%のGibco社製FCS(Fetal Cow Serum)を混合したものが用いられた。
【0117】
採取装置には、筒部材として、Drummond社製のガラス製細管である開口径200μmのガラスキャピラリーが用いられた。
【0118】
剥離液には、Gibco社製の0.5%トリプシン−EDTA溶液に体積比10%となるようにナカライテスク社製のグリセリンが添加されたものが用いられた。トリプシン−EDTA溶液の粘度は無視できる程度であり、グリセリンの粘度は1500cPである。したがって、本実施例のように体積比10%のグリセリンを含有する剥離液の粘度は150cPである。また、トリプシン−EDTA溶液の比重は約1であり、グリセリンの比重は1.261であるので、本実施例の剥離液の比重は約1.026である。
【0119】
図11(A)は、培養容器の付着面にHeLa細胞が付着した様子が撮影された顕微鏡写真である。図11(A)に示すように、HeLa細胞は、培養容器内でコンフルエントな状態で付着面に付着している。
【0120】
図11(B)は、本発明の細胞またはコロニーの採取方法によってコンフルエントなHeLa細胞の一部の区画のみを剥離して細胞を採取した後の様子が撮影された顕微鏡写真である。図11(B)に示すように、コンフルエントな細胞の層の一部に細胞が剥離された領域が認められる。
【0121】
図11(C)は、本発明の細胞またはコロニーの採取方法によって採取された細胞を他の容器に吐出したものが撮影された顕微鏡写真である。図11(C)に示すように、容器内に細胞塊が認められる。
【実施例2】
【0122】
本実施例では、HeLa細胞からなるコロニーを採取する具体的な例を図12を参照して説明する。
本実施例では、図12(A)に矢印で示すように、例えば培養容器内に薄まきにされたり、薬剤選択によって選択培養されることによってコロニーが形成されている。
図12(B)に示すように、コロニーの近傍にキャピラリーの先端が誘導され、トリプシン及びグリセリンを含有する剥離液がコロニーに向けて吐出された。
図12(C)に示すように、コロニーは培養容器の付着面から剥離されて、キャピラリーの内部に吸引されている。
図12(D)に示すように、別の採取容器においてコロニーが吐出され、コロニーの採取が完了した。
【実施例3】
【0123】
本実施例では、培養容器内で任意のコロニーを選択して採取する具体的な例を図13を参照して説明する。
図13(A)は、培養容器の付着面に付着して培養されたHeLa細胞を示す顕微鏡写真である。図13(A)に示すように、採取すべきコロニーが視野の中心に配置されている。図13(B)は図13(A)に示すHeLa細胞に対して本発明の細胞またはコロニーの採取方法によって細胞の採取を行った後の顕微鏡写真である。図13(B)に示すように、剥離液の作用によって採取すべきコロニーが選択的に剥離され、培養容器から回収された。このとき、採取すべきコロニーの周囲の他のコロニーは剥離が抑制されていた。
【実施例4】
【0124】
本実施例では、実施例2で用いた構成に加えて、加熱機構を備えた例を図14を参照して示す。
図14(A)は培養容器の付着面に付着して培養されているHeLa細胞を撮影した顕微鏡写真である。図14(A)に示すように、採取すべきコロニーが視野の中心に配置されている。
図14(B)に示すように、視野絞りが絞られることによって視野のうち中心部分に光及び熱線が照射されている。
図14(C)に示すように、剥離液の作用によって採取すべきコロニーが選択的に剥離され、培養容器から回収された。このとき、採取すべきコロニーの周囲の他のコロニーの剥離は不完全になっており剥離が抑制されていた。
【実施例5】
【0125】
本実施例では、剥離液が着色された具体例を図15を参照して示す。
本実施例では、剥離液に対して1%の濃度になるように、ブロモフェノールブルーを含有させたものが用いられた。
図15(A)は、剥離液の吐出前を示す顕微鏡写真であり、図15(B)は剥離液が吐出された状態を示す顕微鏡写真である。
図15(B)に示すように、培養液中に吐出された剥離液は、上面視略円形でキャピラリーの先端近傍に限局していた。さらに、ブロモフェノールブルーによって着色された剥離液と培養液との界面が明瞭であり、剥離液が培養液中に拡散することなく留まっていることが分かった。
【符号の説明】
【0126】
100、200、300、400 細胞またはコロニーの採取装置
10 顕微鏡装置
11 光源(熱源)
21 筒部材
23 シリンジポンプ(吐出機構、吸引機構)
30、30a 剥離液
260 加熱機構
216 挿脱機構
401 インキュベーター
403 コンピュータ(位置検出機構)
415 可動ステージ(誘導機構)
425 可動支持部(誘導機構)
【技術分野】
【0001】
本発明は、細胞またはコロニーの採取装置及び細胞またはコロニーの採取方法に関する。
【背景技術】
【0002】
従来から、付着性細胞の細胞培養法では、付着性細胞の増殖に応じて培養容器内の付着面から付着性細胞を剥離し、新たな培養容器に播種する継代作業や、剥離された付着性細胞を回収して実験を行うことが知られている。
【0003】
一般的に、培養容器内の付着面に付着した付着性細胞を剥離する際には、付着性細胞が浸漬された培養液を、付着性細胞の接着因子を分解するための分解酵素等を含有する緩衝液に置換する方法が知られている。このとき、培養液に溶存する蛋白質を除去するために、蛋白質を含有しない緩衝液で付着面を洗浄することが必要であると考えられている。
【0004】
近年、細胞培養の工程を自動化し、手作業が介在することによる交差汚染の危険性を抑制しながら多様な細胞の培養ができる多検体細胞自動培養装置が開発されている。例えば特許文献1には、接着性細胞における継代操作などにおいて接着性細胞を剥離することができる培養細胞の剥離方法、並びに接着性細胞を自動的に剥離することができる細胞剥離判断装置及び自動細胞培養装置が記載されている。
【0005】
特許文献1に記載の培養細胞の剥離方法は、培養容器から培養細胞を剥離させるための剥離液を培養容器に投入するステップと、培養細胞の剥離を判断するステップと、培養容器に剥離停止液を投入するステップとを有している。この培養細胞の剥離方法によれば、培養細胞が剥離されたことを判断して剥離停止液を投入することで、人が介在しなくても培養細胞の剥離を判断することが可能となり、培養細胞の剥離を自動化することができる。
【0006】
一方、細胞培養法において、生体から採取された初代培養細胞あるいは人為的に改変を加えた培養細胞から所望の形質を有する培養細胞または培養細胞集団(以下「コロニー」と称する)を採取するために、培養容器の内部に播種された培養細胞の所望の一部を採取する装置が知られている。
【0007】
例えば、特許文献2には、スライドグラス上に塗布された細胞から標的対象物となる所望の細胞を回収する標的対象物の自動探索回収装置が記載されている。この特許文献2に記載の自動探索回収装置は、対象物を検査して対象物の画像を撮影可能な顕微鏡と、顕微鏡による検査可能領域内に配置され対象物を顕微鏡に対して相対移動可能な状態で支持する試料台と、対象物のうち回収対象となる標的対象物を回収するノズルとを備え、さらに標的対象物の画像及びノズルの画像を解析する解析部並びに標的対象物及びノズルに関する画像データ及びその位置を記憶する記憶部が設けられた画像処理ユニットと、前記対物レンズによる前記探索済みの標的対象物と前記ノズルに対する焦点を合わせると共に前記試料板と前記ノズルとのXY面内における相対位置を制御する制御ユニットとを有している。
【0008】
この特許文献2に記載の標的対象物の自動探索回収装置によれば、標的対象物となる細胞を選択した後、自動的にこの細胞を回収することができる。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特開2007−275030号公報
【特許文献2】特開2005−207986号公報
【発明の概要】
【発明が解決しようとする課題】
【0010】
しかしながら、特許文献1に記載の自動細胞培養装置では、培養容器の内部に剥離液を投入して剥離させるもので、一般的な細胞剥離方法と同様に培養容器内のすべての細胞を剥離させるようになっている。そのため所望の細胞またはコロニーを選択して採取することができないという問題があった。
【0011】
また、特許文献2には、スライドガラス上に塗布された例えば血液から標的対象物となる細胞を回収するようになっており、細胞の周囲には固定液が配置されていることが記載されている。したがって、特許文献2に記載の標的対象物の自動探索回収装置では、これらの細胞の培養環境を劇的に変化させてしまうため、標的対象物とならなかった他の細胞を標的対象物の回収前と同様の培養条件で継続して培養することができないという問題があった。
【0012】
上述の問題点により、特許文献2に記載の装置を特許文献1に適用させても、培養細胞の培養に至適化された培養用条件での培養を継続しながら所望の細胞またはコロニー(以下「細胞等」と称する)を回収することは困難である。
【0013】
本発明は、上述した事情に鑑みてなされたものであって、その第1の目的は細胞等の培養環境を維持しながら培養中の細胞集団から所望の細胞等を回収可能な細胞またはコロニーの採取装置及び細胞またはコロニーの採取方法を提供することにある。
【0014】
また、本発明の第2の目的は、細胞等の培養環境を維持しながら特定の細胞等を自動的に回収可能な細胞またはコロニーの採取装置を提供することにある。
【課題を解決するための手段】
【0015】
上記課題を解決するために、この発明は以下の手段を提案している。
本発明の細胞またはコロニーの採取装置は、内壁面に細胞が付着して培養された培養容器の内部に少なくとも先端を挿入可能な筒部材と、前記細胞を前記内壁面から剥離するための剥離液を前記先端から吐出可能な吐出機構と、前記剥離液によって剥離された前記コロニーを構成する細胞を前記先端から前記筒部材の内部へ吸引する吸引機構とを備え、前記剥離液が、前記細胞の培養に用いられる培養液よりも比重及び粘度が高いことを特徴としている。
【0016】
この発明によれば、筒部材の先端から吐出される剥離液は、培養液よりも比重及び粘度が高く設定されている。そのため、剥離液が培養液中に吐出された際に、剥離液は培養容器内において鉛直下方へ沈下して滞留する。したがって、培養容器内で培養液に浸漬され培養面に付着している細胞等に対してこの剥離液を吐出すると、剥離液は、細胞等の周囲の培養液を押しのけて滞留し、細胞の周囲の限局された領域において培養液が剥離液に置換される。その結果、前述の限局された領域に含まれる細胞等が選択的に培養容器から剥離される。さらに、培養容器から剥離された細胞等は吸引機構によって筒部材の内部に吸引採取される。
【0017】
また、本発明の細胞またはコロニーの採取装置は、前記剥離液が、前記細胞の細胞外基質を変性可能な酵素を含むことが好ましい。
この場合、剥離液に細胞外基質を変性可能な酵素を含むことによって、酵素が細胞と培養容器との間の結合因子を変性させ、迅速に細胞を培養容器から剥離させることができる。
【0018】
また、本発明の細胞またはコロニーの採取装置は、前記剥離液が、グリセリンと、糖と、塩との少なくとも一つを含むことが好ましい。
これにより、剥離液の比重及び粘度が緩衝液や培養液等に対して高くなるように調整されている。このとき、グリセリン、糖及び塩はいずれも細胞毒性が極めて低いので、細胞培養中の培養細胞に対する悪影響を低減しつつ剥離液の比重及び粘度を高く調製することができる。
【0019】
また、本発明の細胞またはコロニーの採取装置は、前記剥離液の比重が1.005〜1.4の間にあることが好ましく、前記剥離液の比重が1.01〜1.1の間にあることがより好ましい。
剥離液の比重が1.005よりも小さいと培養液の中で効果的に沈下できない。また、剥離液の比重が1.4よりも大きいと剥離液の取り扱いが困難になる。剥離液の比重が1.005〜1.4の間にあることで、内径が細い筒部材を通じて剥離液を培養液中に効果的に吐出させて沈下させることができる。
【0020】
また、本発明の細胞またはコロニーの採取装置は、前記剥離液の粘度が1.04cP〜300cPの間にあることが好ましく、前記剥離液の粘度が1.1cP〜150cPの間にあることがより好ましい。
剥離液の粘度が1.04cP以下であると、剥離液が培養液中に拡散しやすいため剥離液中で細胞の剥離作用を生じる物質の濃度が低下する。すると、目的とする細胞等が充分に剥離されない場合や、目的とする細胞等の周辺領域まで拡散した剥離液によって目的外の細胞等が剥離されてしまう可能性がある。また、剥離液の粘度が300cPよりも大きい場合には、筒部材の内部を通じた剥離液の移動が困難になる。
【0021】
また、本発明の細胞またはコロニーの採取装置は、前記細胞または前記コロニーを観察可能な顕微鏡をさらに備え、前記顕微鏡が、視野の少なくとも一部の所定領域に熱線を照射可能な加熱機構を有することが好ましい。
この場合、加熱機構により顕微鏡で確認可能な細胞等に対して熱線を照射することによりこれら細胞等の近傍の温度を上昇させることができる。このとき、剥離液が吐出された部分では剥離液の活性が高まることにより細胞の剥離が促進される。したがって、細胞の剥離に要する時間を短縮することができる。
【0022】
また、本発明の細胞またはコロニーの採取装置は、前記加熱機構が、前記顕微鏡の光源からなる熱源と、前記顕微鏡の光路に熱線吸収フィルターを挿脱可能な挿脱機構とを有することが好ましい。
この場合、顕微鏡に標準的に装備されている光源を加熱機構の熱源とできるので、装置を簡易に構成することができる。細胞観察時と細胞剥離時とに応じて熱線吸収フィルターを顕微鏡の光路に対して挿入及び抜脱できるので、細胞の観察からその細胞の剥離に移る際にフィルター操作のみで熱線を照射することができ、装置の操作性を高めることができる。
【0023】
また、本発明の細胞またはコロニーの採取装置は、前記加熱機構が、前記所定領域の温度を測定する測定部を有し、前記測定部による測定結果に基づいて前記所定領域の温度が所定温度になるように前記熱線の照射量を調整する温度調整機構を有することが好ましい。
この場合、加熱機構による細胞の暖めすぎを防止することができ、細胞への傷害を防止することができる。したがって、使用者に所定領域の温度管理のために加熱機構を逐次操作させる必要がないので作業性が向上する。
【0024】
また、本発明の細胞またはコロニーの採取装置は、前記所定温度が、前記酵素の酵素活性に対する至適温度であることが好ましい。
この場合、剥離する対象の細胞またはコロニーがある所定領域が、酵素の最大活性を引き出すことができる温度に維持される。このため細胞等に対して酵素を作用させる時間を短縮させても効果的に細胞等を剥離することができる。また、所定領域を暖めすぎることによる酵素の失活を抑制することもできる。
【0025】
また、本発明の細胞またはコロニーの採取装置は、前記培養容器における所定の細胞またはコロニーの位置を検出する位置検出機構と、前記位置検出機構によって検出された前記位置に前記筒部材の先端を誘導する誘導機構と、前記筒部材の内部に吸引された前記細胞を複数の前記所定の細胞またはコロニーごとに分取する分取機構とをさらに備えることが好ましい。
この場合、所定の細胞等が指定された後に、培養容器における所定の細胞等の位置まで筒部材の先端が誘導されて所定の細胞等が分取機構へと採取される。さらに、この発明によれば複数の所定の細胞等を一度に指定し、引き続いて所定の細胞等のそれぞれを分取することができるので、使用者が採取すべき細胞等を一括で指定した後は、採取動作が自動化されて指定された細胞等が分取される。
【0026】
また、本発明の細胞またはコロニーの採取装置は、少なくとも前記培養容器の内部を前記細胞の培養に適した温度及び二酸化炭素濃度に維持するインキュベーターをさらに備えることが好ましい。
この発明によれば、細胞の剥離作業がインキュベーターの管理下で温度及び二酸化炭素濃度が維持された状態で行われる。したがって、細胞培養における重要な培養条件である温度と二酸化炭素濃度とが至適に維持された環境下で培養容器内の細胞等を剥離して採取することができる。このため、培養容器の内部にある複数の細胞等を採取することによって処理時間がかかってもその間の培養容器内の温度及びに二酸化炭素濃度が至適条件に維持され、培養環境の変化が抑制されるので細胞の性質を適切に維持管理することができる。
【0027】
本発明の細胞またはコロニーの採取方法は、培養液に浸漬されて培養される細胞または複数の前記細胞からなるコロニーが付着する付着面から前記細胞または前記コロニーを採取する細胞またはコロニーの採取方法であって、前記培養液よりも高い比重および粘度を有する剥離液を前記培養液の内部で前記細胞または前記コロニーに対して吐出する吐出工程と、前記吐出工程に続いて前記剥離液によって前記細胞または前記コロニーを前記付着面から剥離する剥離工程と、前記剥離工程に続いて前記付着面から剥離された前記細胞または前記コロニーを回収する回収工程とを備えることを特徴としている。
この発明によれば、まず、培養液の内部に剥離液を吐出する。すると比重の重い剥離液は培養液の内部で沈下して所定の細胞等に到達する。続いて粘度の高い剥離液は培養液に拡散されることなく所定の細胞等の近傍に滞留する。続いて、剥離工程において剥離液の作用によって剥離液と接触している細胞等は付着面から剥離される。続いて付着面から剥離された細胞等が回収される。このようにして、培養容器中で、蛋白質等を含有する培養液を除去することなく、所望の細胞等を選択して剥離し、回収することができる。
【0028】
また、本発明の細胞またはコロニーの採取方法は、前記吐出工程に続いて、前記所定の細胞またはコロニーの近傍に吐出された前記剥離液を加熱する加熱工程をさらに備えることが好ましい。
この場合、剥離液を加熱することによって剥離液の活性を至適化し、剥離液による細胞の剥離時間を短縮することができる。
【発明の効果】
【0029】
本発明の細胞またはコロニーの採取装置及び細胞またはコロニーの採取方法によれば、培養中の細胞集団から所望の細胞またはコロニーを回収することができる。
また、本発明の細胞またはコロニーの採取装置によれば、細胞またはコロニーを自動的に回収することができる
また、本発明の細胞またはコロニーの採取装置によれば、細胞等の培養環境を維持しながら特定の細胞等を自動的に回収することができる。
【図面の簡単な説明】
【0030】
【図1】(A)は本発明の第1実施形態の細胞またはコロニーの採取装置の側面を示す構成図、(B)は同採取装置を一部破断して示す正面図である。
【図2】同採取装置の一部の構成を示す拡大図である。
【図3】(A)ないし(C)は同採取装置の使用時の動作を示す図である。
【図4】(A)ないし(D)は同採取装置の使用時の動作を示す図である。
【図5】(A)は本発明の第2実施形態の細胞またはコロニーの採取装置の側面を示す構成図、(B)は同採取装置を一部破断して示す正面図である。
【図6】(A)ないし(D)は同採取装置の使用時の動作を示す図である。
【図7】本発明の第3実施形態の細胞またはコロニーの採取装置を示す構成図である。
【図8】(A)ないし(C)は同採取装置の使用時の動作を示す図である。
【図9】本発明の第4実施形態の細胞またはコロニーの採取装置を示す構成図である。
【図10】同採取装置の使用時の動作を示すフローチャートである。
【図11】(A)ないし(C)は本発明の細胞またはコロニーの採取方法の実施例における一過程を示す顕微鏡写真である。
【図12】(A)ないし(D)は本発明の細胞またはコロニーの採取方法の実施例における一過程を示す顕微鏡写真である。
【図13】(A)及び(B)は本発明の細胞またはコロニーの採取方法の実施例における一過程を示す顕微鏡写真である。
【図14】(A)ないし(C)は本発明の細胞またはコロニーの採取方法の実施例における一過程を示す顕微鏡写真である。
【図15】(A)及び(B)は本発明の細胞またはコロニーの採取方法の実施例における一過程を示す顕微鏡写真である。
【発明を実施するための形態】
【0031】
(第1実施形態)
以下、本発明の第1実施形態の細胞またはコロニーの採取装置について図1から図4を参照して説明する。
図1は、本実施形態の細胞またはコロニーの採取装置(以下「採取装置100」と称する)の構成を模式的に示す構成図である。図1(A)は採取装置100を示す側面図であり、図1(B)は採取装置100を一部破断して示す正面図である。
【0032】
図1(A)及び図1(B)に示すように、採取装置100は、培養細胞の観察等に使用される顕微鏡装置10と、培養容器から細胞を採取するための採取機構20とを備える。
【0033】
顕微鏡装置10には、実体顕微鏡や位相差顕微鏡等の周知の生物顕微鏡を選択して使用することができる。顕微鏡装置10は、対象物に可視光を照射可能な光源11と、光源11からの光が入射可能な対物レンズ12とを備える。また、顕微鏡装置10には、使用者が対象物を観察するための接眼レンズ13あるいは対象物の画像を取得して表示するディスプレイ機構14の少なくともいずれかが設けられていることが好ましい。
【0034】
顕微鏡装置10には、対象物を載置するステージ15が設けられている。ステージ15は、対象物が載置されて対物レンズ12との間で相対移動可能な構成になっている。
【0035】
採取機構20は、先端開口21aと基端開口21bとを有する筒部材21(図2参照)と、筒部材の基端開口21bと連通するように一端が接続されたチューブ22と、チューブ22の他端と連通されたシリンジポンプ23とを備える。
【0036】
筒部材21は、ガラスあるいは樹脂からなる筒状の部材で、先端開口の内径は200μm程度に形成されていることが好ましい。なお、先端開口21aと基端開口21bとのそれぞれの内径は、同径でも異径でもよい。また、筒部材21は、少なくとも先端において光を透過可能であることが好ましい。これは、顕微鏡下において筒部材21の内部に取り込まれた対象物等を確認可能にするためである。なお、筒部材21は無色透明であってもよいし、着色されていてもかまわない。
【0037】
シリンジポンプ23は、詳細は図示しない外筒及びプランジャーを有する周知のシリンジと、外筒に対してプランジャーを進退移動させるための進退操作部24とが設けられている。
【0038】
また、筒部材21は、支持部25によって支持されている。支持部25は、直交する3軸線上で進退動作可能な構成になっており、例えば互いに相対移動可能な軸25a、25b、25cを備えて軸25aに固定された筒部材21を当該3軸に沿って移動させる構成を採用することができる。
【0039】
なお、本実施形態の採取装置100は、クリーンルームの中、クリーンベンチの中、あるいは空気清浄機能を有するフードの中など、落下菌による汚染が防止可能な環境下で使用されることが好ましい。
【0040】
次に、本実施形態において細胞の剥離に使用される剥離液について詳述する。
剥離液30は、培養容器の内壁である付着面に付着して培養された培養細胞等を付着面から剥離するための液体である。剥離液30は、燐酸緩衝生理食塩水(Phosphate buffered saline、以下「PBS」と称する)と、エチレンジアミン四酢酸(Ethylenediaminetetraacetic acid、以下「EDTA」と称する)と、グリセリンとを含有する液体であるPBS−EDTA−グリセリン溶液を採用することができる。なお、剥離液30は、剥離液容器31(図1(B)参照)の内部に貯留されて使用される。
【0041】
PBSは、培養細胞の培養液と等張に調製された周知の緩衝液である。また、EDTAは、培養細胞の細胞表面の接着因子からカルシウムイオンを奪うことによって接着因子による接着力を弱める作用を有する。EDTAは、その使用時の最終濃度が0.02%程度となるように調製されていることが好ましい。また、グリセリンは、親水性を有し前述のPBSに溶解されることで溶液の比重及び粘度を高める作用を有する。グリセリンは、その使用時の最終濃度が10%から50%の間に調整されていることが好ましい。
【0042】
さらに、剥離液30には、細胞表面の接着因子あるいは細胞外基質を分解可能なプロテアーゼを含有することが好ましい。このようなプロテアーゼには、コラゲナーゼやトリプシン等を剥離対象となる細胞に合わせて選択して採用することができる。例えばトリプシンを含有して使用する際には、トリプシンの濃度は使用時の最終濃度で0.05%から0.5%の間に調整されて使用されることが好ましい。
【0043】
また、剥離液30には、培養液と異なる色に着色可能な着色料を添加することができる。このような着色料としては、ブロモフェノールブルーやフェノールレッド等のpH指示薬等を採用することができる。また、このような着色料としては、細胞傷害性のない着色料であればpH指示薬に限定されるものではない。
【0044】
剥離液30使用時の比重は1.005〜1.4の間にあることが好ましく、これは培養細胞の培養液の比重よりも大きく設定されている。より好ましくは、剥離液30の使用時の比重は1.01〜1.1の間に設定され、培養液の内部で沈下可能になっている。
【0045】
また、剥離液30の使用時の粘度は、1.04cP〜300cPの間にあることが好ましい。剥離液30の使用時の粘度は、培養液の粘度よりも高く、かつ筒部材21等の内部で剥離液30を流動可能になっている。より好ましくは、剥離液30の粘度は1.1cP〜150cPの間に設定されている。このようにすると、培養液よりも十分に粘度が高く、剥離液30に含有されるトリプシン等が培養液内で拡散するのが抑制されると共に、筒部材21の内部で剥離液30を流動させることができる。
【0046】
以上に説明する構成の、採取装置100の作用について、図3及び図4を参照しながら説明を行う。
図3は、培養容器40の内部で培養された細胞Cを付着面41から剥離する工程を示す図である。
図3(A)に示すように、細胞Cは培養容器40の内部で付着面41に付着して培養されており、培養液Mに浸漬されている。使用者は培養容器40を周知の顕微鏡あるいは顕微鏡装置10のステージ15上に配置し、周知の方法で細胞Cの培養状態を観察し、採取すべき細胞C(例えば細胞C2)を決定する。
【0047】
続いて、使用者は落下菌の進入が防止できる手段を有する場所で培養容器40のキャップ42を取り外す。以降、培養容器40のキャップ42が空いている間の操作は無菌操作であることが好ましい。
【0048】
続いて、使用者は筒部材21の先端開口21aを剥離液容器31の内部に挿入し、剥離液30に浸漬させる。続いてシリンジポンプ23の進退操作部24を操作して剥離液30を所定量だけ筒部材21の先端から吸引する。筒部材21の内部に吸引する剥離液30の量は採取する対象となる細胞C2の量(すなわちコロニーの大きさ)に応じて適宜調整される。
【0049】
続いて、図3(B)に示すように、剥離液30が筒部材21の内部に保持された状態でシリンジポンプ23の動作を停止させ、筒部材21の先端開口21aを培養容器40の開口部43から内部へ挿入する。使用者は、顕微鏡装置10によって得られた細胞C2の像を頼りにして筒部材21の先端開口21aを細胞C2の近傍に誘導する。このとき、筒部材21の先端開口21aは細胞Cを培養するための培養液Mに浸漬された位置関係にある。
【0050】
続いて、図3(C)に示すように、使用者はシリンジポンプ23の進退操作部24を操作して筒部材21の先端開口21aから剥離液30を吐出させる(吐出工程)。すると、筒部材21の先端開口21aから吐出された剥離液30は、培養液Mの内部で重力に従って沈下し、細胞C2に重層される。ここで、剥離液30は培養液Mよりも粘度が高いので、剥離液30は細胞C2の近傍にあった培養液Mを押しのけるようにして細胞C2の近傍に留まる。
【0051】
図4は、剥離液30が吐出されてから細胞C2が採取されるまでの動作を示す図である。図4(A)に示すように、剥離液30に含有されたEDTAやプロテアーゼは、剥離液30と培養液Mとの界面では培養液Mに含有される蛋白質の一部を分解する作用を生じ、剥離液30と細胞C2との接触面では細胞C2の細胞表面の蛋白質を分解する作用を生じる。このとき、剥離液30の粘性が高く培養液M中で拡散することが抑制されているため、剥離液30による蛋白質の分解は剥離液30が吐出された細胞C2の近傍に限局されている。したがって、剥離液30が培養液M内に拡散する前に剥離液30が細胞C2と培養容器40の付着面41との間及び細胞C2のそれぞれの間に浸透して細胞表面の接着因子等の蛋白質が分解され、細胞C2は付着面41から離間する(剥離工程)。
【0052】
剥離工程が完了したか否かは、使用者が顕微鏡装置10等によって細胞C2を観察することで確認することができる。剥離工程が完了した後に、使用者は、シリンジポンプ23の進退操作部24を操作して筒部材21の先端開口21aから剥離液30を吸引し、剥離液30と共に細胞C2を筒部材21の内部へ吸引する。このとき、剥離液30が作用した範囲の細胞C2のみが付着面41から剥離しているので剥離液30によって剥離された細胞C2のみが吸引されている(図4(B)参照)。
【0053】
続いて、筒部材21の内部に細胞C2が吸引された状態で進退操作部24を停止させて筒部材21の内部に細胞Cを保持する(回収工程)。さらに筒部材21を培養容器40の開口部43から抜去する(図4(C)参照)。
続いて、筒部材21の先端開口21aを例えば滅菌された採取容器50まで誘導する。採取容器50の内部に筒部材21の先端開口21aを挿入し、シリンジポンプ23の進退操作部24を操作して細胞C2を採取容器50の中へ吐出する(図4(D)参照)。
【0054】
必要に応じて、採取容器50の内部で筒部材21の内部を共洗いして筒部材21の内部に残留した細胞C2を採取容器50に移す操作を行うことができる。また、必要に応じて、筒部材21の内部を図示しない洗浄液(例えばPBS)で洗浄し、筒部材21の内部に残留した細胞C2を除去してもよい。
【0055】
採取すべき細胞C2をすべて採取したら、キャップ42を培養容器40の開口部43に取り付け、培養容器40を適宜の培養環境が設定された図示しない培養装置に戻して一連の作業を完了する。採取された細胞C2は、拡大培養や実験、あるいは検査等の所望の工程に引き渡される。
【0056】
以上説明したように、本実施形態に係る細胞またはコロニーの採取装置及び細胞またはコロニーの採取方法によれば、培養液Mに比して比重及び粘度が高く設定された剥離液30を用い、剥離液30を培養液Mに沈下させて剥離液30を特定の細胞C2に対して選択的に作用させるようになっている。
【0057】
一般的に、細胞培養法において培養容器から培養細胞を剥離する際には、培養容器内にある培地を除去し、蛋白質等を含有しない緩衝液(例えばPBS)で培養細胞を数回洗浄する必要がある。これは、従来の剥離液は培養液の内部に吐出された際に剥離液が専ら培養液に含有された蛋白質を分解するに止まることを抑制するためである。
【0058】
一方、本実施形態の剥離液は、培養液Mの中で沈下すると共に培養液Mの中で拡散せずに培養液Mを押しのけて留まるので、剥離液30が吐出された位置の近傍に限局されて剥離液30による剥離作用が及ぶようになっている。したがって、剥離液が細胞の剥離に効果的に作用するようになっているために、培養液の存在下においても細胞を付着面から剥離することができる。
【0059】
このため、従来必須であった培養液を除去する工程と、培養細胞を緩衝液で洗浄する工程とを省くことができるので、試薬の削減による低コスト化と、工程の削減による汚染確率の低減とが可能になる。
【0060】
さらに、培養細胞が培養液に浸漬された状態で培養細胞の採取が可能であるので、採取対象とならなかった細胞に対して、培養液に浸漬された状態から何ら培養条件を変更せずに培養を継続することが可能になる。これは、培養液を緩衝液に置換することによる培養環境の変化を防止しながら所望の培養細胞を適宜採取できるという効果を奏する。
【0061】
(第2実施形態)
次に、本発明の第2実施形態の細胞またはコロニーの採取装置について図5及び図6を参照して説明する。なお、以下に説明する各実施形態において、上述した第1実施形態の細胞またはコロニーの採取装置と構成を共通とする箇所には同一符号を付けて、説明を省略することにする。
【0062】
本実施形態の細胞またはコロニーの採取装置200は、採取機構20に代えて採取機構220を備える点で第1実施形態と構成が異なっている。
また、剥離液30に代えて、上述のプロテアーゼ等の酵素を含有する剥離液30aが採用されている。
【0063】
採取機構220は、チューブ22に代えて、筒部材21の基端開口21bに一端が接続されたチューブ222aと、チューブ222aの他端に接続されて剥離液30aが貯留された剥離液容器231と、剥離液容器231からシリンジポンプ23まで連通され、中間部に滅菌フィルターを有するチューブ222bとを備えている。
【0064】
剥離液容器231には、剥離液30aが貯留されており、チューブ222aの他端は剥離液30aに浸漬されている。また、チューブ222bの開口端部は剥離基容器231の内部の空気層に開口する位置関係に配置されている。
【0065】
本実施形態のシリンジポンプ23は、進退操作部24を操作することによってチューブ222bを通じて剥離液容器231に気体を送出し、あるいは剥離液容器231から気体を吸引することができる。
【0066】
また、本実施形態では、顕微鏡装置10の視野の少なくとも一部を加熱する加熱機構260を有する。加熱機構260は、顕微鏡装置10の光源11から観察対象まで至る光路の一部に、光源11によって生じる赤外線等の熱線を吸収するための熱線吸収フィルタ16を挿脱可能な挿脱機構216を有する。なお、挿脱機構216は熱線吸収フィルタ16が顕微鏡装置10の光路に対して挿入状態と脱離状態とそれぞれの位置関係を生じさせることができればよいもので、駆動手段を備える構成であっても手動により挿脱する構成であっても本発明の効果を奏するものである。
すなわち、本実施形態の加熱機構260は、顕微鏡装置10の視野のうち細胞等がある位置の近傍を加熱することができるものであって、このための熱源として顕微鏡装置10に搭載された光源11を用いることができるようになっているものである。
【0067】
以下では、本実施形態の採取装置200の使用時の動作を、採取機構220の動作を中心に図6(A)から図6(D)を参照して説明する。図6(A)から図6(D)は採取装置200による細胞の採取の一過程をそれぞれ模式的に示すである。
【0068】
まず、使用者はシリンジポンプ23の進退操作部24を操作して筒部材21の内部における剥離液30aの位置関係を初期状態に設定する。初期状態では、筒部材21の内部に剥離液30aが充填されており、筒部材21の先端開口21aにおいて剥離液30aのメニスカスが生じている位置関係を目安として調整されることが好ましい。
【0069】
続いて、図6(A)に示すように、使用者は培養容器40の内部における採取すべき所望の細胞C2を決定し、使用者は筒部材21の先端開口21aを培養容器40の内部へ挿入し、筒部材21の先端開口21aを細胞C2の位置まで誘導する。
【0070】
筒部材21の先端開口21aは培養容器40の中で培養液Mに浸漬された状態にある。この状態で、シリンジポンプ23の進退操作部24を動作させて、チューブ222bの内部を陽圧にする。するとチューブ222bを通じて剥離液容器231の空気層に対して空気が送り込まれる。これによって剥離液容器231の内部の圧力が上昇する。すると空気層が剥離液容器231の内部の剥離液30aを押し下げることによって剥離液30aは剥離液容器231からチューブ222aへと押し出され、その結果、剥離液30aは、チューブ222a及び筒部材21を通じて筒部材21の先端開口21aから吐出される。
【0071】
図6(B)に示すように筒部材21の先端開口21aから吐出された剥離液30aは、培養液に対して比重及び粘度が高いので、第1実施形態と同様に培養液Mの内部で沈下して培養容器40の付着面41に留まる。このように剥離液30aは細胞C2によるコロニーの近傍に限局されて配置されている。
【0072】
使用者は、顕微鏡装置10の視野絞り(不図示)を操作して採取対象となる細胞C2を囲繞する位置関係まで視野を絞り、さらに挿脱機構216を操作して熱線吸収フィルター16を光路から外す。すると、それまで赤外線等の熱線が吸収されていた状態から熱線が透過可能な状態に切り替わるので、熱線は上記の視野に到達し、採取対象となる細胞C2の周辺の温度が上昇する。一方で、視野絞りによって光が遮断された領域には、熱線が到達しないのでこの領域において温度上昇は起こらない。
【0073】
一般的に、顕微鏡によって培養細胞の観察を行う際には、特別な保温手段がない場合には、培養容器の内部の培養液の温度は室温(生物学分野では、一般的に25℃から26℃程度の温度を指して室温と称することが多い。)まで徐々に低下してゆき平衡化する。本実施形態の剥離液に含まれる酵素は、細胞を剥離するための活性が最大となる温度が室温よりも高い。例えば、トリプシンの場合には、トリプシンを作用させる部位の温度が36℃から38℃程度の間にある場合に、効率よく細胞を剥離することができる。
【0074】
加熱機構260によって加熱する際の上記領域の温度は、採取対象の細胞C2の培養至適温度と酵素が最大活性を示す温度とのいずれも超えない温度であることが好ましい。また、培養液M中に、特に高温にさらされることが好ましくない物質を含有する場合にはその物質によって上限温度が規定される。
【0075】
なお、上記領域の温度を至適条件に維持する温度調整機構として、上記領域の温度を測定する測定部を備え、測定部によって測定された温度情報に基づいて加熱機構260の動作、すなわち挿脱機構216による熱線吸収フィルターの挿脱を制御する構成を採用することができる。この場合、測定部は、上記領域に対して非接触で温度を測定する構成であることが好ましい。
【0076】
使用者は、図6(C)に示すように、剥離液30aによる細胞剥離が起こるのを待つ間に、筒部材21の先端開口21aを培養液から取り出し、さらにシリンジポンプ23の進退操作部24を操作することによって筒部材21の先端開口21aに空気Aを吸引させる。空気Aを吸引する量は適宜である。ただし、最大値でも筒部材21の内部に充填される量であることが好ましく、剥離液容器231の内部までは吸引されないほうが好ましい。
【0077】
剥離液30aが添加され、加熱機構260によって熱線が照射された細胞C2は、剥離液30aの作用によって付着面41から剥離される。一方で、剥離液30aが添加されても加熱機構によって熱線が照射されなかった領域では、図示していないが熱線が照射された領域と比較して酵素活性が弱く作用しているため、細胞等の剥離が緩やかになっているかまったく剥離されていない。したがって、顕微鏡装置10の視野絞りを絞ることで特定の細胞C2が選択的に剥離される。
【0078】
図6(D)に示すように、使用者は、筒部材21の先端開口21aを再び培養液Mに浸漬し、筒部材21の先端開口21aを剥離された細胞C2まで誘導する。続いて、シリンジポンプ23の進退操作部24を操作して剥離液30aと細胞C2とを筒部材21の先端開口21aから吸引する。このとき、筒部材21の内部では、剥離液容器231から続く未吐出の剥離液30aと、培養容器40から吸引された剥離液30a・細胞C2の混合液との間に空気層Aが介在されている。このため、筒部材21の内部に吸引された細胞C2は未吐出の剥離液30a側へと拡散しない。
【0079】
続いて、使用者は筒部材21の先端を、第1実施形態で示したような採取容器50まで誘導し、筒部材21から剥離液30a・細胞C2の混合液を吐出させる。こうして一連の作業を完了する。採取すべき他の細胞等がある場合には、筒部材21の先端開口21aの内部及び外部をPBS等の緩衝液で洗浄した後に上述の操作を繰り返す。
【0080】
本実施形態の採取装置200によれば、剥離液容器231からチューブ222aを通じて筒部材21へと剥離液30aを送液する構成であるので、第1実施形態の採取装置100と比較して、細胞等の採取前に必要量の剥離液30aを筒部材21の先端開口21aから吸引する工程を廃することができる。これは、複数の細胞またはコロニーを順次採取するような作業において作業量を減らして作業に係る手間と時間を減らすことができるという効果を奏する。また、細胞の剥離に係る一連の作業時間を減少させることは、細胞培養において温度や二酸化炭素濃度等の培養条件が異なる環境下に置かれる時間を減少させることにつながり、細胞培養条件を至適条件に維持しながら細胞を採取することができる。
【0081】
また、加熱機構260によって採取対象の細胞等の近傍を加熱して剥離液30aの活性を高めて細胞を剥離することができるので、細胞を剥離するのにかかる時間を短縮できる。一般的に、顕微鏡に設けられた熱線吸収フィルターは、細胞の観察等において悪影響となる熱線を除去するためのフィルターであり、顕微鏡によって細胞を取り扱う際に熱線吸収フィルターを顕微鏡の光路から外すこと自体想定されていないものであった。
【0082】
本実施形態の採取装置では、熱線吸収フィルター16を挿脱する挿脱機構216を有し、かつ顕微鏡装置10の視野絞りによって熱線の照射範囲を制限することができるので、剥離対象となる細胞等に対して選択的に酵素の作用を高めて剥離することができる。これは、粘度及び比重が高められて剥離対象の細胞等の近傍に留まる剥離液30aの作用範囲をさらに制限することによって細胞またはコロニーの選択採取の精度を高めることができるという効果を奏する。
さらに、加熱機構260が顕微鏡装置10の光源11を熱源として転用可能に構成されているので、装置構成を簡略化できるという効果もある。
【0083】
(第3実施形態)
次に、本発明の第3実施形態の細胞またはコロニーの採取装置について図7及び図8を参照して説明する。
本実施形態の細胞またはコロニーの採取装置300(以下採取装置300と称する)は、第2実施形態の採取装置200に対して、採取機構220に代えて採取機構320を備える点で構成が異なっている。より詳しくは、チューブ222aの中間部に介在された電磁弁301と、電磁弁301に一端が連通されたチューブ302と、チューブ302の他端が開口された密閉容器状の採取容器350と、採取容器350の内部に連通されると共にシリンジポンプ23に連通されるように接続されたチューブ303とを備える点で構成が異なっている。
【0084】
図8は、採取装置300の使用時の動作を模式的に示す図である。図8(A)に示すように、採取装置300では、電磁弁301によって剥離液容器231から筒部材21に至る経路が選択された状態で剥離液30を採取対象の細胞C2の近傍に吐出する。
【0085】
続いて図8(B)に示すように、筒部材21の先端開口21aを培養液Mから取り出して、さらに筒部材21の内部にある剥離液30を剥離液容器231まで引き戻す。
【0086】
続いて、図8(C)に示すように、筒部材21から採取容器350までを連通させるように電磁弁301を動作させ、筒部材21の先端開口21aを細胞C2まで再び誘導した後にシリンジポンプ23によって細胞C2を採取容器350の内部に吸引する。
本実施形態の採取装置300でも、上述の各実施形態の採取装置と同様に所望の細胞またはコロニーを選択して採取することができる。
【0087】
なお、本実施形態では、採取された細胞C2が採取容器350に貯留される構成を説明したが、これにかぎらず採取された細胞を他の検査・実験工程に移送することもできる。例えば培養容器40から採取した細胞C2を所定個数ごとに培養容器に分取するセルソーターや、細胞C2の形状や表面抗原の差異によって分析するフローサイトメーター等に接続して使用することが可能である。
【0088】
なお、本実施形態では電磁弁301によって剥離液30等の流路を切り替える構成が採用されているが、これに限らず、手動で流路を切り替える三方活栓等を有する構成を採用することもできる。
【0089】
(第4実施形態)
次に、本発明の第4実施形態の細胞またはコロニーの採取装置について図9を参照して説明する。
本実施形態の細胞またはコロニーの採取装置400(以下採取装置400と称する)は、細胞培養における培養条件のうち少なくとも温度と二酸化炭素濃度とを制御可能なインキュベーター401を備える点で上述の各実施形態と構成が異なっている。インキュベーター401はHEPAフィルターを有する空気清浄機構402を備えている。さらに、採取機構20、220、320に代えて採取機構420を備える。
【0090】
採取機構420は、電磁弁301から分岐されて接続されたチューブ302の先端には、培養容器40の付着面41から剥離された細胞を回収するための分取機構450が設けられている。
【0091】
分取機構450は、軸回りに回転することでチューブ302の先端に対して相対移動可能で、周知のサンプルチューブや試験管等を配置可能なテーブル452と、テーブル452を回転させる回転駆動部(不図示)とを備える。また、サンプルチューブや試験管等の開口部を封止可能な栓体453及び栓体駆動部454が設けられている。テーブル452は、後述するコンピュータ403に制御されて断続的に軸回りに回転するようになっている。
【0092】
また、本実施形態では、支持部25に代えて、直交する3軸線上でそれぞれ進退動作可能な駆動部を有する可動支持部425と、ステージ15に代えて、周知のXYステージとしての機能を有する可動ステージ415とを備えている。このため、可動支持部425に支持された筒部材21の先端開口21aと可動ステージ415上に配置される培養容器とは相対移動可能になっている。
【0093】
また、本実施形態では、シリンジポンプ23は、外部からの駆動信号の入力によってその動作が制御される構成になっており、駆動信号に基づいて、筒部材21の先端開口21aから流体を吸引吐出できるようになっている。
【0094】
さらに、採取装置400には、コンピュータ403が接続されている。コンピュータ403は、対物レンズ12を通じて詳細は図示しない撮像部414によって取得された培養容器内の細胞の画像情報を受信し、同時に可動ステージ415と筒部材21の先端開口21aとの相対位置情報を受信する。コンピュータ403は、この画像情報と相対位置情報とに基づいて採取対象となる細胞等の位置を記憶可能である。また、コンピュータ403は可動ステージ415及び可動支持部425に、培養容器内の細胞の位置に筒部材21の先端開口21aを誘導する駆動信号を送信可能になっている。
【0095】
また、コンピュータ403は、分取機構450における上述の回転駆動部に対して断続的に駆動信号を送信してテーブル452を回転動作可能になっている。
【0096】
以上に説明する構成の、採取装置400の作用について、図10を参照しながら説明を行う。図10は採取装置400の動作を示すフローチャートである。
培養細胞が培養されている培養容器は、インキュベーター401の内部において可動ステージ415上にセットされている(配置工程S401)。このとき、培養容器40のキャップ42は緩められている。
続いて、使用者はコンピュータ403を操作し、培養容器40の付着面に付着した細胞を走査するように観察する。このとき、採取すべき細胞が画面上に確認できたら、その位置を指示し、コンピュータ403に記憶させながら、採取すべき細胞等を順次選択してゆく。(選択工程S402)
採取すべき細胞等の選択が完了したら、これらの細胞等の採取を開始する。
【0097】
まず、使用者は培養容器40のキャップ42を取り外し、開口部43を開放する。(開放工程S403)。以下の工程は、コンピュータ403から送信される駆動信号に基づいた動作である。
【0098】
まず、筒部材21の内部に剥離液30を充填させる。これは、電磁弁301によって剥離液容器231と筒部材21とが連通された状態でシリンジポンプ23が駆動されることによって行われる。このとき、筒部材21の先端から洩出する剥離液30を所定の位置で回収するようにしてもよい。
【0099】
続いて、可動支持部425及び可動ステージ415を動作させることによって、前述のように使用者が指定した細胞またはコロニーのうち最初の細胞等のある位置に筒部材21の先端21aが培養容器40の内部に挿入されて誘導される(誘導工程S405)。
【0100】
続いて、筒部材21の先端開口21aから剥離液30が培養液Mの内部に吐出される(吐出工程S406)。すると、上述の各実施形態と同様に剥離液30は培養液Mの内部で沈下し、採取対象となる細胞C2の近傍に留まる。したがって採取対象となる細胞C2が培養容器40の付着面から剥離される。本実施形態では、インキュベーター401によって培養容器40の内部の温度が培養細胞の培養に適した温度に維持されている。このとき、剥離液30に含まれる酵素の酵素活性が十分に高められているので剥離液30が接触している細胞C2は付着面41から速やかに剥離される。
【0101】
なお、筒部材21の先端開口21aから剥離液30が吐出されてから細胞C2が付着面41から剥離されるまでの間に、筒部材21の先端開口に空気Aが吸引される。より詳しくは、吐出工程S406に続いて筒部材21の先端開口21aが移動されて培養液Mから取り出される(筒部材移動工程S407)。さらに続いて、筒部材21の先端から空気Aが吸引されて電磁弁301を超えて剥離液容器231側まで空気Aが吸引されたところで停止される(空気吸引工程S408)。
続いて電磁弁301の経路が分取機構450側の経路に切り替えられる(流路切替工程S410)。さらに筒部材21の先端開口21aは前述の細胞等の位置へと再び誘導される。
【0102】
なお、細胞等の剥離にかかる時間は細胞の種類と付着面の種類とが主な要因となって変動する。したがって、細胞が十分に剥離されたかどうかは、使用者の目視によって判断され、細胞が十分に剥離された際に、使用者がコンピュータ403に対して細胞等の剥離が完了したことを示す入力を行う(確認工程S409)。
【0103】
すると、コンピュータ403は、シリンジポンプ23を駆動させて筒部材21の内部に剥離液30・細胞C2混合液を吸引する(回収工程S411)。すると、細胞C2は、筒部材21の先端開口21aからチューブ222a、電磁弁301、チューブ302を通じて分取機構450へと移送され、分取機構450に設けられたサンプルチューブあるいは試験管の一つに回収される。
【0104】
なお、必要に応じて、筒部材21の先端開口21aから適宜の量の培養液Mが吸引されサンプルチューブあるいは試験管に剥離液30と共に移送されるように、筒部材21の先端開口21aが培養液Mに浸漬されたまま細胞C2の吸引を行うこともできる。この場合、サンプルチューブあるいは試験管の内部において剥離液30と培養液Mとが攪拌され、剥離液30中の酵素は培養液M中の蛋白質等を分解する。したがって、サンプルチューブあるいは試験管に回収された細胞C2の膜表面蛋白質の分解作用が低減された状態になっている。
【0105】
細胞等が分取機構450に回収されたら、分取機構450のテーブル452が回転し、チューブ302が挿入可能な位置に別のサンプルチューブが位置される。また、筒部材21の先端開口21aの外面が図示しないPBS等の洗浄液で洗浄される(洗浄工程S412)。また電磁弁301の経路が再び筒部材21と剥離液容器231とを連通する経路へと切り替えられ、筒部材21に剥離液30が充填されることによって初期状態に戻る(復帰工程S413)。さらに、筒部材21の先端開口21aが、採取対象となる次の細胞またはコロニーの位置へと誘導され、次の細胞等が上述と同様に分取機構450に回収される。
【0106】
使用者が定めた所定の細胞等の採取が完了したら、筒部材21が培養容器40の外へ引き抜かれて一連の工程を完了する。
【0107】
本実施形態の採取装置400によれば、使用者は画面を見ながら所望の細胞に対して採取するかどうかを決定し、続く採取作業はコンピュータ403によって指示されて動作するようになっている。したがって、使用者は、細胞等が剥離されたかどうかを画面上で確認して作業を継続させるだけでよいので使用者にかかる負担を低減する事ができる。また、剥離に係る作業に人手が介在しないので、使用者の熟練度によらず安定して細胞を採取することができる。
【0108】
また、インキュベーター401の内部において、培養容器40ごと温度、二酸化炭素濃度の制御を行っているので、培養容器40内の培養細胞に対して培養条件の大きな変動を生じさせることを抑制することができる。したがって、多数の細胞またはコロニーを順次採取する場合においても培養条件を至適条件に維持したまま細胞等を採取することができる。
【0109】
以上、本発明の実施形態について図面を参照して詳述したが、具体的な構成はこの実施形態に限られるものではなく、本発明の要旨を逸脱しない範囲の設計変更等も含まれる。
例えば、本発明の第4実施形態の細胞またはコロニーの採取装置では、インキュベーターは、温度および二酸化炭素濃度を至適条件となるように制御する構成であるが、これに代えて窒素濃度あるいは酸素濃度を制御する構成が付加されたインキュベーターを採用することもできる。
【0110】
また、細胞等の採取が短時間で済むことが予想される場合には、二酸化炭素濃度を制御する構成を備えずに温度を制御する構成のみを備えたインキュベーターを採用してもよい。なお、温度のみを調整するインキュベーターには、顕微鏡の中座としてのサーモプレートの概念が含まれている。
【0111】
また、本発明の第4実施形態では、細胞が付着面からはがれたことを使用者が確認して処理を継続させる構成を採用した。本発明は、この構成に限られるものではなく、例えば採取対象の細胞等が剥離されたかどうかを確認するステップを設けずに、剥離液の吐出から所定時間だけ経過した後に細胞の吸引を開始する構成とすることもできる。この場合、使用者は採取すべき所定の細胞またはコロニーを選択するだけよいので作業性を大幅に向上させることができる。
【0112】
さらに、採取対象の細胞等を特定する手段として、コンピュータ403において受信さされた細胞等の画像情報に基づいて所定の特徴を有する細胞を認識してその細胞またはコロニーの位置を記憶する構成を採用することもできる。
例えば、採取対象の細胞において特異的に発現している物質に対応して生じる蛍光や着色を検知する構成や、採取対象の細胞の大きさや形状があらかじめ設定した範囲にあることを認識して採取対象として設定する構成等を採用することができる。
この場合、使用者が採取対象の細胞を選択する工程を削減できるので、定量的な判断基準で採取対象となる細胞等を選択することができると共に、使用者の作業量を低減することができる。
【0113】
また、採取対象となる細胞等が剥離されたか否かを判断する判断機構をさらに備えることもできる。例えば、コンピュータ403による画像解析によって、付着性細胞によるコロニーが付着面から剥離されている際にその外部形状が略球形となることを検知して細胞等が剥離されたことを判断することができる。この場合、当該コロニーのうち略球形となった細胞が所定割合以上に達したことが判断されたことに基づいて当該細胞の採取を行うことができる。
【0114】
次に、以下に示す各実施例に基づいて、細胞またはコロニーの採取についてより詳細に説明する。
【実施例1】
【0115】
図11は、本発明の細胞またはコロニーの採取方法により付着性細胞を付着面から剥離して採取する一過程を撮影した顕微鏡写真である。
【0116】
本実施例では、細胞にはヒト子宮頸癌由来の培養細胞株であるHeLa(25株)が用いられた。培養容器には、Corning社製の組織培養プレートで直径3.5cmのものが用いられた。培養液は、Gibco社製のMEM(Minimum Essential Medium)に体積比で10%のGibco社製FCS(Fetal Cow Serum)を混合したものが用いられた。
【0117】
採取装置には、筒部材として、Drummond社製のガラス製細管である開口径200μmのガラスキャピラリーが用いられた。
【0118】
剥離液には、Gibco社製の0.5%トリプシン−EDTA溶液に体積比10%となるようにナカライテスク社製のグリセリンが添加されたものが用いられた。トリプシン−EDTA溶液の粘度は無視できる程度であり、グリセリンの粘度は1500cPである。したがって、本実施例のように体積比10%のグリセリンを含有する剥離液の粘度は150cPである。また、トリプシン−EDTA溶液の比重は約1であり、グリセリンの比重は1.261であるので、本実施例の剥離液の比重は約1.026である。
【0119】
図11(A)は、培養容器の付着面にHeLa細胞が付着した様子が撮影された顕微鏡写真である。図11(A)に示すように、HeLa細胞は、培養容器内でコンフルエントな状態で付着面に付着している。
【0120】
図11(B)は、本発明の細胞またはコロニーの採取方法によってコンフルエントなHeLa細胞の一部の区画のみを剥離して細胞を採取した後の様子が撮影された顕微鏡写真である。図11(B)に示すように、コンフルエントな細胞の層の一部に細胞が剥離された領域が認められる。
【0121】
図11(C)は、本発明の細胞またはコロニーの採取方法によって採取された細胞を他の容器に吐出したものが撮影された顕微鏡写真である。図11(C)に示すように、容器内に細胞塊が認められる。
【実施例2】
【0122】
本実施例では、HeLa細胞からなるコロニーを採取する具体的な例を図12を参照して説明する。
本実施例では、図12(A)に矢印で示すように、例えば培養容器内に薄まきにされたり、薬剤選択によって選択培養されることによってコロニーが形成されている。
図12(B)に示すように、コロニーの近傍にキャピラリーの先端が誘導され、トリプシン及びグリセリンを含有する剥離液がコロニーに向けて吐出された。
図12(C)に示すように、コロニーは培養容器の付着面から剥離されて、キャピラリーの内部に吸引されている。
図12(D)に示すように、別の採取容器においてコロニーが吐出され、コロニーの採取が完了した。
【実施例3】
【0123】
本実施例では、培養容器内で任意のコロニーを選択して採取する具体的な例を図13を参照して説明する。
図13(A)は、培養容器の付着面に付着して培養されたHeLa細胞を示す顕微鏡写真である。図13(A)に示すように、採取すべきコロニーが視野の中心に配置されている。図13(B)は図13(A)に示すHeLa細胞に対して本発明の細胞またはコロニーの採取方法によって細胞の採取を行った後の顕微鏡写真である。図13(B)に示すように、剥離液の作用によって採取すべきコロニーが選択的に剥離され、培養容器から回収された。このとき、採取すべきコロニーの周囲の他のコロニーは剥離が抑制されていた。
【実施例4】
【0124】
本実施例では、実施例2で用いた構成に加えて、加熱機構を備えた例を図14を参照して示す。
図14(A)は培養容器の付着面に付着して培養されているHeLa細胞を撮影した顕微鏡写真である。図14(A)に示すように、採取すべきコロニーが視野の中心に配置されている。
図14(B)に示すように、視野絞りが絞られることによって視野のうち中心部分に光及び熱線が照射されている。
図14(C)に示すように、剥離液の作用によって採取すべきコロニーが選択的に剥離され、培養容器から回収された。このとき、採取すべきコロニーの周囲の他のコロニーの剥離は不完全になっており剥離が抑制されていた。
【実施例5】
【0125】
本実施例では、剥離液が着色された具体例を図15を参照して示す。
本実施例では、剥離液に対して1%の濃度になるように、ブロモフェノールブルーを含有させたものが用いられた。
図15(A)は、剥離液の吐出前を示す顕微鏡写真であり、図15(B)は剥離液が吐出された状態を示す顕微鏡写真である。
図15(B)に示すように、培養液中に吐出された剥離液は、上面視略円形でキャピラリーの先端近傍に限局していた。さらに、ブロモフェノールブルーによって着色された剥離液と培養液との界面が明瞭であり、剥離液が培養液中に拡散することなく留まっていることが分かった。
【符号の説明】
【0126】
100、200、300、400 細胞またはコロニーの採取装置
10 顕微鏡装置
11 光源(熱源)
21 筒部材
23 シリンジポンプ(吐出機構、吸引機構)
30、30a 剥離液
260 加熱機構
216 挿脱機構
401 インキュベーター
403 コンピュータ(位置検出機構)
415 可動ステージ(誘導機構)
425 可動支持部(誘導機構)
【特許請求の範囲】
【請求項1】
内壁面に細胞が付着して培養された培養容器の内部に少なくとも先端を挿入可能な筒部材と、
前記細胞を前記内壁面から剥離するための剥離液を前記先端から吐出可能な吐出機構と、
前記剥離液によって剥離された前記コロニーを構成する細胞を前記先端から前記筒部材の内部へ吸引する吸引機構と、
を備え、
前記剥離液が、前記細胞の培養に用いられる培養液よりも比重及び粘度が高いことを特徴とする細胞またはコロニーの採取装置。
【請求項2】
前記剥離液が、前記細胞の細胞外基質を変性可能な酵素を含む請求項1に記載の細胞またはコロニーの採取装置。
【請求項3】
前記剥離液が、グリセリンと、糖と、塩との少なくとも一つを含む請求項1または2に記載の細胞またはコロニーの採取装置。
【請求項4】
前記剥離液の比重が1.005〜1.4の間にある請求項1〜3のいずれか一項に記載の細胞またはコロニーの採取装置。
【請求項5】
前記剥離液の比重が1.01〜1.1の間にある請求項1〜4のいずれか一項に記載の細胞またはコロニーの採取装置。
【請求項6】
前記剥離液の粘度が1.04cP〜300cPの間にある請求項1〜5のいずれか一項に記載の細胞またはコロニーの採取装置。
【請求項7】
前記剥離液の粘度が1.1cP〜150cPの間にある請求項1〜6のいずれか一項に記載の細胞またはコロニーの採取装置。
【請求項8】
前記所定の細胞またはコロニーを観察可能な顕微鏡をさらに備え、
前記顕微鏡が、視野の少なくとも一部の所定領域に熱線を照射可能な加熱機構を有する請求項1〜7のいずれか一項に記載の細胞またはコロニーの採取装置。
【請求項9】
前記加熱機構が、
前記顕微鏡の光源からなる熱源と、
前記顕微鏡の光路に熱線吸収フィルターを挿脱可能な挿脱機構と、
を有する請求項8に記載の細胞またはコロニーの採取装置。
【請求項10】
前記加熱機構が、
前記所定領域の温度を測定する測定部を有し、
前記測定部による測定結果に基づいて前記所定領域の温度が所定温度になるように前記熱線の照射量を調整する温度調整機構を有する請求項8または9に記載の細胞またはコロニーの採取装置。
【請求項11】
前記所定温度が、前記酵素の酵素活性に対する至適温度である請求項10に記載の細胞またはコロニーの採取装置。
【請求項12】
前記培養容器における前記所定の細胞またはコロニーの位置を検出する位置検出機構と、
前記位置検出機構によって検出された前記位置に前記筒部材の先端を誘導する誘導機構と、
前記筒部材の内部に吸引された前記細胞を複数の前記所定の細胞またはコロニーごとに分取する分取機構と、
をさらに備える請求項1〜11のいずれか一項に記載の細胞またはコロニーの採取装置。
【請求項13】
少なくとも前記培養容器の内部を前記細胞の培養に適した温度及び二酸化炭素濃度に維持するインキュベーターをさらに備える請求項12に記載の細胞またはコロニーの採取装置。
【請求項14】
培養液に浸漬されて培養される細胞または複数の前記細胞からなるコロニーが付着する付着面から前記細胞または前記コロニーを採取する細胞またはコロニーの採取方法であって、
前記培養液よりも高い比重及び粘度を有する剥離液を前記培養液の内部で前記細胞または前記コロニーに対して吐出する吐出工程と、
前記吐出工程に続いて前記剥離液によって前記細胞または前記コロニーを前記付着面から剥離する剥離工程と、
前記剥離工程に続いて前記付着面から剥離された前記細胞または前記コロニーを回収する回収工程と、
を備える細胞またはコロニーの採取方法。
【請求項15】
前記吐出工程に続いて、前記所定の細胞またはコロニーの近傍に吐出された前記剥離液を加熱する加熱工程をさらに備える請求項14に記載の細胞またはコロニーの採取方法。
【請求項1】
内壁面に細胞が付着して培養された培養容器の内部に少なくとも先端を挿入可能な筒部材と、
前記細胞を前記内壁面から剥離するための剥離液を前記先端から吐出可能な吐出機構と、
前記剥離液によって剥離された前記コロニーを構成する細胞を前記先端から前記筒部材の内部へ吸引する吸引機構と、
を備え、
前記剥離液が、前記細胞の培養に用いられる培養液よりも比重及び粘度が高いことを特徴とする細胞またはコロニーの採取装置。
【請求項2】
前記剥離液が、前記細胞の細胞外基質を変性可能な酵素を含む請求項1に記載の細胞またはコロニーの採取装置。
【請求項3】
前記剥離液が、グリセリンと、糖と、塩との少なくとも一つを含む請求項1または2に記載の細胞またはコロニーの採取装置。
【請求項4】
前記剥離液の比重が1.005〜1.4の間にある請求項1〜3のいずれか一項に記載の細胞またはコロニーの採取装置。
【請求項5】
前記剥離液の比重が1.01〜1.1の間にある請求項1〜4のいずれか一項に記載の細胞またはコロニーの採取装置。
【請求項6】
前記剥離液の粘度が1.04cP〜300cPの間にある請求項1〜5のいずれか一項に記載の細胞またはコロニーの採取装置。
【請求項7】
前記剥離液の粘度が1.1cP〜150cPの間にある請求項1〜6のいずれか一項に記載の細胞またはコロニーの採取装置。
【請求項8】
前記所定の細胞またはコロニーを観察可能な顕微鏡をさらに備え、
前記顕微鏡が、視野の少なくとも一部の所定領域に熱線を照射可能な加熱機構を有する請求項1〜7のいずれか一項に記載の細胞またはコロニーの採取装置。
【請求項9】
前記加熱機構が、
前記顕微鏡の光源からなる熱源と、
前記顕微鏡の光路に熱線吸収フィルターを挿脱可能な挿脱機構と、
を有する請求項8に記載の細胞またはコロニーの採取装置。
【請求項10】
前記加熱機構が、
前記所定領域の温度を測定する測定部を有し、
前記測定部による測定結果に基づいて前記所定領域の温度が所定温度になるように前記熱線の照射量を調整する温度調整機構を有する請求項8または9に記載の細胞またはコロニーの採取装置。
【請求項11】
前記所定温度が、前記酵素の酵素活性に対する至適温度である請求項10に記載の細胞またはコロニーの採取装置。
【請求項12】
前記培養容器における前記所定の細胞またはコロニーの位置を検出する位置検出機構と、
前記位置検出機構によって検出された前記位置に前記筒部材の先端を誘導する誘導機構と、
前記筒部材の内部に吸引された前記細胞を複数の前記所定の細胞またはコロニーごとに分取する分取機構と、
をさらに備える請求項1〜11のいずれか一項に記載の細胞またはコロニーの採取装置。
【請求項13】
少なくとも前記培養容器の内部を前記細胞の培養に適した温度及び二酸化炭素濃度に維持するインキュベーターをさらに備える請求項12に記載の細胞またはコロニーの採取装置。
【請求項14】
培養液に浸漬されて培養される細胞または複数の前記細胞からなるコロニーが付着する付着面から前記細胞または前記コロニーを採取する細胞またはコロニーの採取方法であって、
前記培養液よりも高い比重及び粘度を有する剥離液を前記培養液の内部で前記細胞または前記コロニーに対して吐出する吐出工程と、
前記吐出工程に続いて前記剥離液によって前記細胞または前記コロニーを前記付着面から剥離する剥離工程と、
前記剥離工程に続いて前記付着面から剥離された前記細胞または前記コロニーを回収する回収工程と、
を備える細胞またはコロニーの採取方法。
【請求項15】
前記吐出工程に続いて、前記所定の細胞またはコロニーの近傍に吐出された前記剥離液を加熱する加熱工程をさらに備える請求項14に記載の細胞またはコロニーの採取方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【公開番号】特開2010−172231(P2010−172231A)
【公開日】平成22年8月12日(2010.8.12)
【国際特許分類】
【出願番号】特願2009−16658(P2009−16658)
【出願日】平成21年1月28日(2009.1.28)
【出願人】(000000376)オリンパス株式会社 (11,466)
【Fターム(参考)】
【公開日】平成22年8月12日(2010.8.12)
【国際特許分類】
【出願日】平成21年1月28日(2009.1.28)
【出願人】(000000376)オリンパス株式会社 (11,466)
【Fターム(参考)】
[ Back to top ]

