細胞または器官の分化調節剤およびそれを用いる形態形成の調節法
【課題】細胞または器官の分化を調節・制御する手段を提供する。
【解決手段】細胞の酸化還元状態調節物質を含有する細胞または器官の分化の調節剤及びそれを用いる細胞または器官の分化を調節・制御する方法。
【解決手段】細胞の酸化還元状態調節物質を含有する細胞または器官の分化の調節剤及びそれを用いる細胞または器官の分化を調節・制御する方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、細胞または器官の分化を調節・制御する方法に関し、より詳細には、細胞の酸化還元状態を制御しうる成分を用いて細胞または器官の分化を調節する方法およびそのような成分を含有する細胞または器官の分化の調節剤に関する。
【背景技術】
【0002】
あらゆる生物個体は、細胞や器官の分化、形態形成により構築される。例えば、多細胞生物においては、細胞が集まって組織や器官を形作り、さらには組織や器官が複雑に組み合わさって個体を構築している。それぞれの組織や器官が固有の機能を発揮するためには、細胞が個々の組織や器官に特異的な様式で分化し、組織化されなければならない。
【0003】
このような細胞および器官の分化、さらには形態形成において、細胞は、受けとるホルモン等の調節物質の影響下で自身の遺伝的プログラムを動かしていると考えられている。イモリなどの両生類では、発生などの形態形成段階での調節物質の濃度勾配が、器官の分化を決定していることが知られている。またショウジョウバエでは、その調節機構に変異のある変異体の単離を通じて関係遺伝子が突き止められてきた。植物の場合には、植物ホルモンと呼ばれる調節物質により形態形成が調節または制御されていることが知られている。このように、生物個体の形態形成には固有の調節物質が介在している。
【0004】
しかるに、近年、形態形成に係る遺伝的プログラムで働く遺伝子における広範な生物間での類似性が注目されている。
また、生物はすべて、その発生・形態形成である種のストレス(例、光、温度、化学物質等)により多大な影響を受けることが知られている。
【0005】
これら、形態形成に係る遺伝的プログラムに予測される高い類似性およびストレスを構成する要素(光、温度、化学物質等)の生物間での共通性は、該遺伝的プログラムに至る情報伝達機構に介在する物質の生物間での共通性を示唆している。しかし、そのような物質が単離・同定されたとの報告例はない。
生物界全般または広範な生物間で細胞および器官の分化を制御し得る物質を得ることができれば、それは、研究および産業の発達に大いに寄与しうると考えられる。
【発明の開示】
【発明が解決しようとする課題】
【0006】
本発明は、細胞および器官の分化を調節するための手段を提供することを目的とする。
本発明はまた、そのような調節剤を用いて、例えば植物の開花時期やカルスからの個体再生等を制御する方法を確立することを目的とする。
【課題を解決するための手段】
【0007】
本発明者らは、発生・形態形成に影響を与えるストレス関係因子のうち、生物間で共通する因子である、細胞の酸化還元状態を調節する物質が細胞および器官の分化、さらには形態形成に影響を及ぼしうることを見出し、本発明を完成するに至った、
即ち、本発明は細胞の酸化還元状態調節物質を含有する細胞または器官の分化の調節剤を提供するものである。
【発明を実施するための最良の形態】
【0008】
本明細書中、「細胞または器官等の分化」なる語句は、広く生物学の分野で一般に知られている意味で用いられており、通常、細胞や器官が構造的、機能的に特殊化することを指す。「細胞または器官等の分化」の具体例として、植物の場合は、花芽形成、発芽時の個体形成、離層形成を含む落葉、冬芽の形成、休眠打破、花粉発芽、受精の過程を含む胚発生、カルスからの再分化、管状要素形成、根毛形成、トライコーム形成等が挙げられる。また、動物の場合、神経細胞分化もしくはその樹状突起形成、上皮細胞もしくは組織の形成、生殖体形成、受精の過程を含む卵発生、血球分化、毛母細胞形成等が挙げられる。菌類界の場合は胞子体形成または穿孔菌糸形成;原生生物界の場合は個体発生、鞭毛形成または細胞の小器官の分化;細菌界の場合はコロニー形成、鞭毛形成または胞子形成が挙げられるが、これらに限定されない。
【0009】
さらに、色素体やミトコンドリアなどの細胞小器官の分化および発生も包含される。
【0010】
本発明との関係で「形態形成」とは、生物を構成する単位(分子、細胞など)から個体が形成される過程を指し、分子レベルおよび細胞レベルでの形づくりを意味する。
【0011】
従って、「細胞や器官の分化の調節」または「形態形成の調節」等の対象となる生物個体には、形態形成(生体構造の構成単位からの形作り)を伴う多細胞および単細胞のあらゆる生物が包含される。すなわち、本発明の主たる対象は顕花植物や地衣・苔類等を含む植物界、および棘皮動物や節足動物から哺乳動物までをも含む動物界であるが、形に関しては、単細胞生物も包含する。
【0012】
本明細書で用いる用語「細胞の酸化還元状態」は、以下の指標に基いて判断される状態である。活性酸素の生じやすさ、グルタチオンの絶対量、グルタチオン(還元型)とその酸化型との比(GSH/GSSG)、ニコチンアミドアデニンジヌクレオチドリン酸の還元型(NAD(P)H)の絶対量、NADPH/NADP+の比、チトクロムcの酸化型/還元型の比、プラストキノン、ユビキノン等の電子伝達鎖の構成要素の酸化/還元比で示される値。
ただし、生体内で酸化還元に関与する物質は当該技術分野で既知であり、上記に限定されない。
【0013】
用語「細胞の酸化還元状態調節物質」は、上記の値を変化させる物質を意味し、グルタチオンの合成もしくはグルタチオン量に影響を与える物質、活性酸素の生成を促進または阻害する物質、ある化合物を酸化型と還元型のいずれか一方への変化を促進または阻害する物質が例示される。
【0014】
本発明に用いる「細胞の酸化還元状態調節物質」は、上記の作用を表す任意の物質であってよいが、具体例には、過酸化水素やスーパーオキシドアニオンラジカルなどの活性酸素類、スーパーオキシドジスムターゼやカタラーゼやアスコルビン酸ペルオキシダーゼやデヒドロアスコルビン酸レダクターゼやモノアスコルビン酸レダクターゼやグルタチオンレダクターゼやグルタチオンペルオキシダーゼ等の抗酸化酵素、ブチオニンスルフォキシミンやメチオニンスルフォキシミンなどのグルタチオン合成阻害剤、還元型グルタチオンや酸化型グルタチオン、さらにはホモグルタチオンやカルボキシプロピルグルタチオン、ジカルボキシエチルグルタチオンなどのようなグルタチオン誘導体、パラコートやKCNやNaN3などの呼吸阻害剤、プトレシンやスペルミン、スペルミジンなどのポリアミン類、さらにはこれらの物質を細胞内で生じせしめる出発物質または誘導物質が含まれるが、これらに限定されない。
【0015】
本発明の細胞または器官の分化の調節剤(以下、分化調節剤と呼称)は、少なくとも1種の酸化還元状態調節物質からなるか、それを適当な担体、賦形剤と共に含有するものである。そのような製剤は、それぞれの分野で、製剤学上許容される公知の担体成分、製剤用補助剤等を適宜配合し既知の方法で製造することができる。剤形は、適用対象、適用方法に応じて、液剤、乳剤、固形剤など任意に選択できる。
【0016】
有効成分である酸化還元状態調節物質を2種以上併用することにより形態形成の速度、状態を任意に制御することが容易になる場合もある。そのような組み合わせは、例えば、互いに反する活性を有する物質同士のように、ある同一の代謝系において作用することに基いて選択することができる。例えば、後述の実施例では、グルタチオンとグルタチオン阻害剤であるBSOとの組み合わせにより、植物の開花時期を制御している。しかし、他の代謝系に作用する組合せであってもよい。
【0017】
本発明の分化調節剤が2種以上の酸化還元状態調節物質を含有する場合、これらの有効成分は1つの製剤中に存在していても良いが、別々に製剤化し、同時または時期をずれせて適用することもできる。
【0018】
本発明はまた、上記の分化調節剤を、該調節剤に感受性の変化した生物個体に適用することを特徴とする形態形成を調節する方法、およびそのようにして得られた生物個体を提供するものである。ここで、「感受性の変化した生物個体」とは、例えば、野生型植物体Lerに比較してBSOに対する感受性が変化している変異体fcaに例示されるように、特定の感受性が変化している個体を意味する。そのような個体は、自然に、または人工的に発現しうる。
【0019】
本発明の分化調節剤は、有効成分である細胞の酸化還元状態調節物質に対して感受性のある、あらゆる種類の生物に適用することができ、植物の場合、被子植物の双子葉植物および単子葉植物の両者に対して有効である。
【0020】
本発明の細胞の酸化還元状態調節物質を有効成分とする分化調節剤の使用対象が植物であるとき、開花やカルスからの個体再生や管状要素分化、発芽等の調節を人為的に行う場合においても、細胞の酸化還元状態、特に、活性酸素の生成レベルやグルタチオンの合成と酸化/還元比等を調節することで所望の調節が可能と考えられる。加えて、根毛やトライコームなどの植物の形態も、上記のような細胞の酸化還元状態を調節できる物質によって調節できると考えられる。
【0021】
従って本発明の方法によれば、広く植物の形態形成を制御することが可能になる。形態形成の調節の至適条件は一定ではなく、植物の種類および形態の種類等、および目的によって左右される。
【0022】
本発明の分化調節剤を適用することができる植物を以下に例示する。双子葉植物としては、例えばアサガオ属植物(アサガオ),ヒルガオ属植物(ヒルガオ,コヒルガオ,ハマヒルガオ),サツマイモ属植物(グンバイヒルガオ,サツマイモ),ネナシカズラ属植物(ネナシカズラ,マメダオシ)が含まれるひるがお科植物、ナデシコ属植物(カーネーション等),ハコベ属植物,タカネツメクサ属植物,ミミナグサ属植物,ツメクサ属植物,ノミノツヅリ属植物,オオヤマフスマ属植物,ワチガイソウ属植物,ハマハコベ属植物,オオツメクサ属植物,シオツメクサ属植物,マンテマ属植物,センノウ属植物,フシグロ属植物,ナンバンハコベ属植物が含まれるなでしこ科植物、もくまもう科植物、どくだみ科植物、こしょう科植物、せんりょう科植物、やなぎ科植物、やまもも科植物、くるみ科植物、かばのき科植物、ぶな科植物、にれ科植物、くわ科植物、いらくさ科植物、かわごけそう科植物、やまもがし科植物、ぼろぼろのき科植物、びゃくだん科植物、やどりぎ科植物、うまのすずくさ科植物、やっこそう科植物、つちとりもち科植物、たで科植物、あかざ科植物、ひゆ科植物、おしろいばな科植物、やまとぐさ科植物、やまごぼう科植物、つるな科植物、すべりひゆ科植物、もくれん科植物、やまぐるま科植物、かつら科植物、すいれん科植物、まつも科植物、きんぽうげ科植物、あけび科植物、めぎ科植物、つづらふじ科植物、ろうばい科植物、くすのき科植物、けし科植物、ふうちょうそう科植物、あぶらな科植物、もうせんごけ科植物、うつぼかずら科植物、べんけいそう科植物、ゆきのした科植物、とべら科植物、まんさく科植物、すずかけのき科植物、ばら科植物、まめ科植物、かたばみ科植物、ふうろそう科植物、あま科植物、はまびし科植物、みかん科植物、にがき科植物、せんだん科植物、ひめはぎ科植物、とうだいぐさ科植物、あわごけ科植物、つげ科植物、がんこうらん科植物、どくうつぎ科植物、うるし科植物、もちのき科植物、にしきぎ科植物、みつばうつぎ科植物、くろたきかずら科植物、かえで科植物、とちのき科植物、むくろじ科植物、あわぶき科植物、つりふねそう科植物、くろうめもどき科植物、ぶどう科植物、ほるとのき科植物、しなのき科植物、あおい科植物、あおぎり科植物、さるなし科植物、つばき科植物、おとぎりそう科植物、みぞはこべ科植物、ぎょりゅう科植物、すみれ科植物、いいぎり科植物、きぶし科植物、とけいそう科植物、しゅうかいどう科植物、さぼてん科植物、じんちょうげ科植物、ぐみ科植物、みそはぎ科植物、ざくろ科植物、ひるぎ科植物、うりのき科植物、のぼたん科植物、ひし科植物、あかばな科植物、ありのとうぐさ科植物、すぎなも科植物、うこぎ科植物、せり科植物、みずき科植物、いわうめ科植物、りょうぶ科植物、いちやくそう科植物、つつじ科植物、やぶこうじ科植物、さくらそう科植物、いそまつ科植物、かきのき科植物、はいのき科植物、えごのき科植物、もくせい科植物、ふじうつぎ科植物、りんどう科植物、きょうちくとう科植物、ががいも科植物、はなしのぶ科植物、むらさき科植物、くまつづら科植物、しそ科植物、なす科植物、ごまのはぐさ科植物、のうぜんかずら科植物、ごま科植物、はまうつぼ科植物、いわたばこ科植物、たぬきも科植物、きつねのまご科植物、はまじんちょう科植物、はえどくそう科植物、おおばこ科植物、あかね科植物、すいかずら科植物、れんぷくそう科植物、おみなえし科植物、まつむしそう科植物、うり科植物、ききょう科植物、きく科植物等を例示することができる。
【0023】
単子葉植物としては、例えばウキクサ属植物(ウキクサ)及びアオウキクサ属植物(アオウキクサ,ヒンジモ)が含まれる,うきくさ科植物、カトレア属植物,シンビジウム属植物,デンドロビューム属植物,ファレノプシス属植物,バンダ属植物,パフィオペディラム属植物,オンシジウム属植物等が含まれる,らん科植物、がま科植物、みくり科植物、ひるむしろ科植物、いばらも科植物、ほろむいそう科植物、おもだか科植物、とちかがみ科植物、ほんごうそう科植物、いね科植物、かやつりぐさ科植物、やし科植物、さといも科植物、ほしぐさ科植物、つゆくさ科植物、みずあおい科植物、いぐさ科植物、びゃくぶ科植物、ゆり科植物、ひがんばな科植物、やまのいも科植物、あやめ科植物、ばしょう科植物、しょうが科植物、かんな科植物、ひなのしゃくじょう科植物等を例示することができる。
【0024】
既述のごとく、本発明において、ある生物の「酸化還元状態」は生物界に広く共通する因子によって左右される。例えば、酸化還元状態を決定する重要な因子であるグルタチオンは生物に普遍的に存在しており、その合成系やそれらによって制御されるタンパク質因子も高い相同性を示す。さらに、活性酸素に関連する酵素も生物種を超えて高い相同性を有している。従って、本発明の酸化還元状態調節物質は動物等の、植物以外の生物における形態形成の調節剤としても有効である。
【0025】
そのような調節剤は、例えば、単為発生、神経や表皮などの細胞や組織の分化の誘導、神経樹状突起などの分化組織の修復、免疫担当細胞等の分化、接合子または胞子形成、鞭毛形成などを制御するのに有用であるが、これらに限定されない。
【0026】
上記の場合に例示される生物は、動物界では、脊椎動物門、棘皮動物門、原索動物門、腔腸動物門、軟体動物門、節足動物門、環形動物門、海綿動物、扁形動物門など、さらには、胞子体形成を行う担子菌や子嚢菌等の真菌類の他、胞子形成を行うような原核生物である放線菌などの微生物、出芽や接合体などを対象とした場合は酵母等も含まれるが、これに限定されない。
【0027】
これらの応用例としては、火傷等による皮膚修復や神経損傷の修復における調節剤などの医薬品、茸の培養制御、魚類等の単為発生による品質の均一化、花などの鮮度低下防止、病原菌の付着器の形成を抑制することによる感染防止などが挙げられるが、本発明はこれらに限定されるわけではない。
【0028】
本発明の分化調節剤は、その剤形に応じた方法で種々の生物個体もしくは器官、もしくは組織、もしくは細胞に用いられる。例えば、液剤や乳剤の場合、細胞または器官の分化を図る生物、たとえば植物の場合、その植物の生長点のみならず、茎,葉をはじめとする植物体の一部又は全体に散布,滴下,塗布することができる。また、固形剤や粉剤の場合には、たとえば地中から根に吸収させる。また、細胞または器官の分化を図る植物がウキクサ等の水草の場合には、底床添加剤として根から吸収させたり、固形剤を水中で除々に溶解させること等も可能である。本発明は任意の方法で適用することができ、上記の態様に限定されない。
【0029】
分化調節剤が底床添加剤又は固形剤である場合、担体成分としては、概ねタルク,クレー,バーミキュライト,珪藻土,カオリン,炭酸カルシウム,水酸化カルシウム,白土,シリカゲル等の無機質や小麦粉,澱粉等の固体担体が例示される。また液剤である場合は、概ね水、キシレン等の芳香族炭化水素類、エタノール,エチレングリコール等のアルコール類、アセトン等のケトン類、ジオキサン,テトラヒドロフラン等のエーテル類、ジメチルホルムアミド、ジメチルスルホキシド、アセトニトリル等の液体担体が例示される。
さらに、本発明の分化調節剤には、他の補助剤を適宜配合することができる。そのような補助剤として、例えばアルキル硫酸エステル類,アルキルスルホン酸塩,アルキルアリールスルホン酸塩,ジアルキルスルホコハク酸塩等の陰イオン界面活性剤、高級脂肪族アミンの塩類等の陽イオン界面活性剤、ポリオキシエチレングリコールアルキルエーテル,ポリオキシエチレングリコールアシルエステル,ポリオキシエチレングリコール多価アルコールアシルエステル,セルロース誘導体等の非イオン界面活性剤、ゼラチン,カゼイン,アラビアゴム等の増粘剤、増量剤、結合剤等が挙げられる。
【0030】
必要に応じて、植物生長調節剤、例えば安息香酸,ニコチン酸,ニコチン酸アミド,ピペコリン酸等を、本発明の所期の効果を損なわない限度において、製剤中に配合することもできる。
【0031】
以下に、本発明を主として開花時期の制御・調節を例として説明するが、当業者ならば、他の生物系においても、明細書の記載に従って同様に形態形成を制御しうることを理解するであろう。
【0032】
分化調節剤による処理は、対象となる植物の種子またはカルスの通常の栽培方法の開始前および/または栽培中に、適当な濃度の、細胞の酸化還元状態調節物質を適用することで行うことができる。通常、対象植物の性質(長日性、短日性など)に応じた処理を行いながら適用することが効果的である。そのような処理は、当業者に既知である。例えば、後述する実施例のトルコギキョウ等の相対長日植物の場合には、一定の光強度以上の光昭射を行いながら本発明の分化調節剤を用いることが効果的であると考えられる。
従って、本発明は、当該技術分野で通常用いられている任意の植物の育成方法における分化調節剤の使用をも包含する。
【0033】
分化調節剤は、有効成分である酸化還元状態調節物質単独であってもよいが、既述のごとく、それぞれの植物に適用可能な剤形、例えば液剤,固形剤,粉剤,乳剤,底床添加剤等の剤形で用いることが好ましい。そのような製剤は、それぞれの分野で、製剤学上適用することが可能な公知の担体成分、製剤用補助剤等を、開花調節が損なわれない限度において、有効成分である細胞の酸化還元状態調節物質に適宜配合し既知の方法で製造することができる。
以下、実施例により本発明を具体的に説明するが、本発明はこれらの実施例によりなんら限定されるものではない。
【実施例】
【0034】
実施例1 開花時期の調節(1)
イギリスのノッテンガム大学に公設されたArabidopsis Stock Centerから取り寄せたシロイヌナズナ晩生化変異体fca(寄託番号N167)および野生型植物体Ler(寄託番号NW20)を100μE/m2の強さの光で16時間明期/8時間暗期の日長条件のもと23℃で、を用いて生育させ実験に用いた。培地として、下層にバーミキュライト(旭工業)2、中層にクレハ育苗培土(クレハ化学)2、上層にバーミキュライト(旭工業)1の割合で重層して形成される土壌を用いた。
細胞の酸化還元状態調節物質として、グルタチオン合成の阻害剤であるL-Buthionine sulfoximine(BSO)とグルタチオンとを用いた。
【0035】
BSO処理:
BSOを10-1Mになるように水に溶かし、ストック液とした。つぎにその溶液から10-3から10-7Mの溶液を調整し処理液とした(図1〜3参照)。40×50 mm程度のポットに2〜3個体程度となるようにし、処理液を1ポットあたり5 ml/日となるように茎頂付近にドロップして与えた。処理は処理開始の当日、1、3、5、7日後に行い1回の処理とした。
【0036】
グルタチオン処理:
グルタチオン処理を行うときは、このBSO溶液にグルタチオンを濃度が10−4Mとなるように加えて処理した。
【0037】
処理の効果をロゼット葉数および花茎の伸長速度に基いて評価し、それぞれ、図1〜3に示した。図中、23 contおよび4 contは、それぞれ低温処理なしとありの場合の結果である(対照実験)。低温処理は、4℃で、薬剤処理と並行して行った。また、図2において、処理に用いたBSO濃度は、A, 0 M; B, 10-7 M; C, 10-6 M; D, 10-5 M; E, 10-4 M; F, 10-3 Mである。数値は平均値±標準誤差で表されている。
【0038】
(1)吸水後17日のfca植物体を、グルタチオン合成阻害剤BSOで処理した。1週間後の結果を図1Cに示す。その結果、処理終了から約1週間で花芽が肉眼で認められ、水処理のコントロールに比べてロゼット葉(根出葉)数が減少した。また花茎の伸びる速度を処理後約ヶ月にわたって調べた(図2)。図2から、花茎の述べる速度は、処理群でコントロールに比べて速く、開花が早められたことが分かる。これらは、ロゼット枚数の減少が、BSO処理が花芽が決定した後の成長だけでなく、花芽の決定自体を早めたことを示している。
【0039】
(2)一方、吸水後12日のfca植物体た。1週間後の結果を図1Aに示す。図1Aは、(1)の場合とは逆に、処理によりfcaの開花時期が遅れたことを示している。一方、同様の実験により、野生株Lerの場合には、吸水後12日からの処理開始によって花成が有意に早くなった(図1B)。このLerを発芽直後からBSOを含む寒天培地で生育させると、fcaを分化調節剤で早期(吸水12日目から)に処理を行った場合と同様に、抽苔が遅れた。
【0040】
(3)BSO処理と、グルタチオン(GSH)処理とを併用した。BSO溶液にグルタチオン(濃度:10−4M)を添加して上記と同様の方法で使用した。
BSOにより花芽形成が遅延される時期に処理した植物は、GSH濃度の上昇に従って、いったん花成が早まり、1mMでは花成が遅くなった(図3B)。一方、BSOによって花芽形成が早められる時期に処理した植物では、GSH濃度の上昇に従って花成が遅延された(図3A)。
これらの結果は、グルタチオン若しくはグルタチオン合成阻害剤またはそれらの組み合わせにより、開花時期、さらには花茎の伸長速度を調整できることを示している。なお、品種により処理時期を適宜調整する必要があることも明らかになった。
【0041】
実施例2 開花時期の調節(2)
実施例1と同様の方法で、シロイヌナズナ晩生化変異体fcaを100μE/m2の強さの光で16時間明期/8時間暗期の日長条件のもと、23℃で生育させ、実験に用いた。
細胞の酸化還元状態調節物質として、図4に記載した濃度の過酸化水素を用いた。過酸化水素水溶液は処理直前に調整して用いた。40×50 mm程度のポットに2〜3個体程度となるように配し、処理液を吸水の17日目から1ポットあたり5 ml/日となるように茎頂付近にドロップして与えた。処理は処理当日、1、3、5、7日後に行い1回の処理とした。個体のロゼット葉を指標にして花芽形成の時期を比較した。結果を図4に示す。図中、23 contは、水処理である(対照実験)。数値は平均値±標準誤差で表されている。
【0042】
個体のロゼット葉を指標にした花芽形成の時期は、処理を行った個体は水処理の場合に比べ、どの処理濃度でも早まった(図4)。また花茎の伸長速度も、至適濃度(10−5M)で早まった(図5)。図5において、横軸は薬剤処理完了後の日数を表している。
上記の結果は、活性酸素自体および活性酸素を生成せしめる物質が、花芽形成時期の調整効果のみならず、花茎の伸長促進効果をも有することを示している。
【0043】
実施例3 開花時期の調節3
実施例1と同様の方法で、シロイヌナズナ晩生化変異体fcaを100μE/m2の強さの光で16時間明期/8時間暗期の日長条件のもと23℃で生育させ実験に用いた。
細胞の酸化還元状態調節物質として、KCNまたはNaN3を用いた。KCNまたはアジ化ナトリウムは処理直前に調整し、それぞれ、図6および図7に記載の濃度で用いた。40×50 mm程度のポットに2〜3個体程度となるようにし、処理液を1ポットあたり5 ml/日となるように茎頂付近にドロップして与えた。KCNまたはNaN3による処理は種子吸水後17日目から行った。処理当日、1、3、5、7日後に行い1回の処理とした。個体のロゼット葉を指標にして花芽形成の時期を比較した。KCNまたはNaN3を用いた実験結果をそれぞれ図6および図7に示す。図中、23 contは、水処理である(対照実験)。数値は平均値±標準誤差で表されている。
【0044】
ロゼット葉を指標にした花芽形成の時期は、処理群において、水処理の対照群よりも、それぞれの至適濃度(KCN:10-3;NaN3:10-4)で早期化している。
上記の結果は、活性酸素を生成せしめる物質は花芽形成時期の調整効果を有することを示している。
【0045】
実施例4 発芽時の形態形成調節1
プラスチックディッシュ (100×15 mm)の中に柔らかい紙を敷き、コムギ(品種: シラサギ)またはイネ(品種:日本晴れ)の種子15個を入れ、さらに過酸化水素水溶液を15 mlとなるように加え、発芽させた(光条件、50 μE/ m2、 16 h light/ 8 h darkサイクル;温度、小麦:18℃、イネ:27℃)。図8に記載した濃度の過酸化水素水溶液を用時調整し、これらの種子の処理に用いた。吸水から144時間(6日)後に各過酸化水素濃度で処理したコムギの子葉鞘の長さを測定した。結果を図8に示す。図中、数値は平均値±標準誤差で表されている。
図8から、過酸化水素処理を施した植物では細胞が伸長していることが分かる。
上記の結果は、過酸化水素が発芽時の細胞の伸長に関する形態形成を調節する作用を有することを示している。
【0046】
実施例5 発芽時の形態形成調節2
プラスチックディッシュ (100×15 mm)の中に柔らかい紙を敷き、ヒャクニチソウ(cv スカーレットフレーム)の種子15個を入れ、さらに過酸化水素水溶液を15 mlとなるように加え、発芽させた(光条件、50 μE/ m2、 16 h light/ 8 h darkサイクル;温度、27℃)。図9に記載した濃度の過酸化水素水溶液を用時調整し、これらの種子の処理に用いた。吸水2日後の発芽個体の観察を行った(図9参照)。図中、処理に用いた過酸化水素濃度の数値(単位:mM)は、各図の右下に記載されている。60 mM過酸化水素処理の場合の発芽を示す図から、子葉の展開が早く起こり、根よりも先に果皮から子葉が出ている様子が認められる。このように、過酸化水素の処理濃度が高くなると、処理種子は、根からではなく、子葉から発芽するようになり、処理群の子葉の展開は無処理群に比較して早期化している。
上記の結果は、過酸化水素が子葉の展開時期を早める作用を有することを示している。
【0047】
実施例6 カルスの不定芽形成の調節
カルスからの不定芽形成に対するグルタチオンの調節効果を調べた。
無菌的に生育させたタバコ葉を1%寒天およびムラシゲ/スクーグ培地(MS培地)の基本培地にベンジルアデニン(BA)を0.1 mg/L、ナフタレン酢酸(NAA)を1 mg/Lで加えたカルス誘導培地上でカルス化させた後、そのカルスを1%寒天およびムラシゲ/スクーグ培地(MS培地)の基本培地にBAを1 mg/L、NAAを0.1 mg/L濃度にした不定芽形成培地に移した。不定芽誘導培地には酸化還元状態調整物質として、0.1 mM BSO、1 mM GSH、1 mM GSSG(酸化型グルタチオン)を加えた。対照培地として、これらの物質を無添加にした対照を用意した。これらの不定芽誘導培地および対照培地でカルスを誘導後3週間培養した後、不定芽の数を計算した。結果を表1に示す。
【表1】

上記の結果は、グルタチオン量および酸化還元比を人為的にかえることにより、不定芽形成の調整が可能であることを示している。
【0048】
実施例7 根毛形成の調節1
プラスチックディッシュ(100×15 mm)の中に柔らかい紙を敷き、シロイヌナズナ野生型植物体Lerを入れ、さらに過酸化水素濃度10-3 Mの水溶液を15 ml入れて吸水させた。23℃で発芽させ、吸水から一週間後に根毛形成を顕微鏡観察した。水では根毛形成が認められたのに対して、過酸化水素溶液では根毛形成が認められなかった。
【0049】
実施例8 根毛形成の調節2
プラスチックディッシュ(100×15 mm)の中に柔らかい紙を敷き、クロダイズ種子(品種:丹波黒)を入れ、さらに過酸化水素濃度10-3 Mの水溶液を15 ml入れて吸水させた。23℃で発芽させ、吸水から一週間後に根毛形成を顕微鏡観察した。水では根毛形成が認められたのに対して、過酸化水素溶液では根毛形成が認められなかった。
【0050】
実施例9 管状要素形成の調節
Sugiyamaらの方法(Sugiyama M. Fukuda, H. and Komamine, A. (1986) Plant Cell Physiol. 27: 601-606)に従い、ヒャクニチソウ (品種:カナリーバード)を播種し、播種後14日目に、長さ3.5〜4.5cmになった第1葉より単離した葉肉細胞をナフタレン酢酸(0.1 mg/l)、ベンジルアミノプリン(1 mg/l)を含むD培地に2.5〜4.0×106/mlとなるように懸濁した。この培養液を2 mlずつ試験管に分注し、25℃、暗所で回転培養した。培養開始時にスーパーオキシドジスムターゼ(SOD)またはカタラーゼを、図10に記載の濃度で添加した。培養72時間後にサンプリングを行い、二次細胞壁肥厚による縞模様が観察される細胞を管状要素へ分化した細胞とした。また、全細胞数に占める管状要素細胞の割合を分化率とした。結果を図10に示す。図10において、縦軸は管状要素分化率(TEdifferentiation) (%)を表している。また、培養開始時に加えたSODおよびカタラーゼの濃度はカラムの下に、活性(U/ml、上段)およびタンパク質量(μg protein/ml、下段)で記載されている。数値は平均値±標準誤差で表されている。図中、TEは管状要素を意味する。図中、「D」はD培地を意味する。
【産業上の利用可能性】
【0051】
本発明により、生物の種類に関係なく、細胞および器官の分化を制御することが可能となった。
【図面の簡単な説明】
【0052】
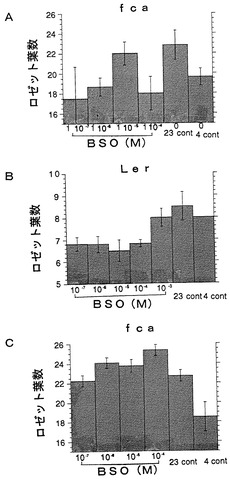
【図1】シロイヌナズナ晩生化変異体fca(以下、fcaと呼称)および野生型植物体Ler(以下、Lerと呼称)の開花時期に対するグルタチオン阻害剤L-ブチオニンスルホキシイミン(L−Buthionine sulfoximine :BSO)の調節効果を示すグラフである。調節効果をロゼット葉数に基いて評価した。 種子吸水後12日目からBSO処理を行った(図1A、fca; 図1B、Ler)。fcaについては17日目からもBSO処理を行った(図1C)。23 contおよび4 contは、それぞれ低温処理「なし」と「あり」の場合の結果である(対照実験)。数値は平均値±標準誤差で表されている。
【図2】fcaの花茎の伸長速度に対するBSOの調節効果を示すグラフである。発芽後12日目からBSO処理を行い、花茎伸長に対する効果を調べた。処理に用いたBSO濃度は以下の通りである。A, 0 M; B, 10-7 M; C, 10-6 M; D, 10-5 M; E, 10-4 M; F, 10-3 M。数値は平均値±標準誤差で表されている。
【図3】BSOの花成(花芽形成)時期調節効果に対するグルタチオン(GSH)の影響を示すグラフである。 発芽後12日目からBSO処理を行った。グルタチオンはBSO処理と同時に与えた。図中、23cont および4contは、図1と同意義である。また、AはLer,Bはfcaを用いた結果である。
【図4】晩生化変異体fcaの開花時期に対する過酸化水素の調節効果を示すグラフである。過酸化水素による処理は種子の吸水後17日目から行った。23 ℃は、水処理である(対照実験)。数値は平均値±標準誤差で表されている。
【図5】fcaの花茎の伸長速度に対する過酸化水素の調節効果を示すグラフである。発芽後12日目から過酸化水素処理を行い、花茎伸長への効果を調べた。処理に用いた過酸化水素の濃度は図上に記載されている。数値は平均値±標準誤差で表されている。
【図6】晩生化変異体fcaの開花時期に対するシアン酸カリウム(KCN)の調節効果を表すグラフである。KCNによる処理は種子吸水後17日目から行った。23 ℃は、水処理である(対照実験)。数値は平均値±標準誤差で表されている。
【図7】晩生化変異体fcaの開花時期に対するNaN3の調節効果を示すグラフである。種子吸水後17日目からアジ化ナトリウムによる処理を行った。23 contは、水処理である(対照実験)。数値は平均値±標準誤差で表されている。
【図8】過酸化水素によるコムギの形態変化に対する調節効果(形態調節1)を示すグラフである。吸水から144時間(6日)の結果を示している。各過酸化水素濃度で処理したコムギの子葉鞘の長さを表した。数値は平均値±標準誤差で表されている。
【図9】ヒャクニチソウの形態変化に対する過酸化水素の調節効果(形態調節2)を示す写真である。処理に用いた過酸化水素濃度の数値(単位:mM)は、各図の右下に記載されている。図は吸水48時間後の植物体の様子を示している。過酸化水素の処理濃度が高くなると、植物は、根ではなく、子葉の展開から発芽するようになる。60 mMの処理の場合の発芽を示す図から、子葉の展開が早く起こり、根よりも先に果皮から子葉が出ている様子が認められる。
【図10】ヒャクニチソウ(品種:カナリーバード)の播種後14日の長さ3.5〜4.5cmになった第1葉より単離した葉肉細胞をスーパーオキシドジスムターゼ(SOD)またはカタラーゼの存在下、試験管内で培養し、管状要素形成の調節効果を調べた結果を示すグラフである。培養開始時に加えたSODおよびカタラーゼの濃度をカラムの下に、活性およびタンパク質量で示した。図中、TEは管状要素を表す。数値は平均値±標準誤差で表されている。
【技術分野】
【0001】
本発明は、細胞または器官の分化を調節・制御する方法に関し、より詳細には、細胞の酸化還元状態を制御しうる成分を用いて細胞または器官の分化を調節する方法およびそのような成分を含有する細胞または器官の分化の調節剤に関する。
【背景技術】
【0002】
あらゆる生物個体は、細胞や器官の分化、形態形成により構築される。例えば、多細胞生物においては、細胞が集まって組織や器官を形作り、さらには組織や器官が複雑に組み合わさって個体を構築している。それぞれの組織や器官が固有の機能を発揮するためには、細胞が個々の組織や器官に特異的な様式で分化し、組織化されなければならない。
【0003】
このような細胞および器官の分化、さらには形態形成において、細胞は、受けとるホルモン等の調節物質の影響下で自身の遺伝的プログラムを動かしていると考えられている。イモリなどの両生類では、発生などの形態形成段階での調節物質の濃度勾配が、器官の分化を決定していることが知られている。またショウジョウバエでは、その調節機構に変異のある変異体の単離を通じて関係遺伝子が突き止められてきた。植物の場合には、植物ホルモンと呼ばれる調節物質により形態形成が調節または制御されていることが知られている。このように、生物個体の形態形成には固有の調節物質が介在している。
【0004】
しかるに、近年、形態形成に係る遺伝的プログラムで働く遺伝子における広範な生物間での類似性が注目されている。
また、生物はすべて、その発生・形態形成である種のストレス(例、光、温度、化学物質等)により多大な影響を受けることが知られている。
【0005】
これら、形態形成に係る遺伝的プログラムに予測される高い類似性およびストレスを構成する要素(光、温度、化学物質等)の生物間での共通性は、該遺伝的プログラムに至る情報伝達機構に介在する物質の生物間での共通性を示唆している。しかし、そのような物質が単離・同定されたとの報告例はない。
生物界全般または広範な生物間で細胞および器官の分化を制御し得る物質を得ることができれば、それは、研究および産業の発達に大いに寄与しうると考えられる。
【発明の開示】
【発明が解決しようとする課題】
【0006】
本発明は、細胞および器官の分化を調節するための手段を提供することを目的とする。
本発明はまた、そのような調節剤を用いて、例えば植物の開花時期やカルスからの個体再生等を制御する方法を確立することを目的とする。
【課題を解決するための手段】
【0007】
本発明者らは、発生・形態形成に影響を与えるストレス関係因子のうち、生物間で共通する因子である、細胞の酸化還元状態を調節する物質が細胞および器官の分化、さらには形態形成に影響を及ぼしうることを見出し、本発明を完成するに至った、
即ち、本発明は細胞の酸化還元状態調節物質を含有する細胞または器官の分化の調節剤を提供するものである。
【発明を実施するための最良の形態】
【0008】
本明細書中、「細胞または器官等の分化」なる語句は、広く生物学の分野で一般に知られている意味で用いられており、通常、細胞や器官が構造的、機能的に特殊化することを指す。「細胞または器官等の分化」の具体例として、植物の場合は、花芽形成、発芽時の個体形成、離層形成を含む落葉、冬芽の形成、休眠打破、花粉発芽、受精の過程を含む胚発生、カルスからの再分化、管状要素形成、根毛形成、トライコーム形成等が挙げられる。また、動物の場合、神経細胞分化もしくはその樹状突起形成、上皮細胞もしくは組織の形成、生殖体形成、受精の過程を含む卵発生、血球分化、毛母細胞形成等が挙げられる。菌類界の場合は胞子体形成または穿孔菌糸形成;原生生物界の場合は個体発生、鞭毛形成または細胞の小器官の分化;細菌界の場合はコロニー形成、鞭毛形成または胞子形成が挙げられるが、これらに限定されない。
【0009】
さらに、色素体やミトコンドリアなどの細胞小器官の分化および発生も包含される。
【0010】
本発明との関係で「形態形成」とは、生物を構成する単位(分子、細胞など)から個体が形成される過程を指し、分子レベルおよび細胞レベルでの形づくりを意味する。
【0011】
従って、「細胞や器官の分化の調節」または「形態形成の調節」等の対象となる生物個体には、形態形成(生体構造の構成単位からの形作り)を伴う多細胞および単細胞のあらゆる生物が包含される。すなわち、本発明の主たる対象は顕花植物や地衣・苔類等を含む植物界、および棘皮動物や節足動物から哺乳動物までをも含む動物界であるが、形に関しては、単細胞生物も包含する。
【0012】
本明細書で用いる用語「細胞の酸化還元状態」は、以下の指標に基いて判断される状態である。活性酸素の生じやすさ、グルタチオンの絶対量、グルタチオン(還元型)とその酸化型との比(GSH/GSSG)、ニコチンアミドアデニンジヌクレオチドリン酸の還元型(NAD(P)H)の絶対量、NADPH/NADP+の比、チトクロムcの酸化型/還元型の比、プラストキノン、ユビキノン等の電子伝達鎖の構成要素の酸化/還元比で示される値。
ただし、生体内で酸化還元に関与する物質は当該技術分野で既知であり、上記に限定されない。
【0013】
用語「細胞の酸化還元状態調節物質」は、上記の値を変化させる物質を意味し、グルタチオンの合成もしくはグルタチオン量に影響を与える物質、活性酸素の生成を促進または阻害する物質、ある化合物を酸化型と還元型のいずれか一方への変化を促進または阻害する物質が例示される。
【0014】
本発明に用いる「細胞の酸化還元状態調節物質」は、上記の作用を表す任意の物質であってよいが、具体例には、過酸化水素やスーパーオキシドアニオンラジカルなどの活性酸素類、スーパーオキシドジスムターゼやカタラーゼやアスコルビン酸ペルオキシダーゼやデヒドロアスコルビン酸レダクターゼやモノアスコルビン酸レダクターゼやグルタチオンレダクターゼやグルタチオンペルオキシダーゼ等の抗酸化酵素、ブチオニンスルフォキシミンやメチオニンスルフォキシミンなどのグルタチオン合成阻害剤、還元型グルタチオンや酸化型グルタチオン、さらにはホモグルタチオンやカルボキシプロピルグルタチオン、ジカルボキシエチルグルタチオンなどのようなグルタチオン誘導体、パラコートやKCNやNaN3などの呼吸阻害剤、プトレシンやスペルミン、スペルミジンなどのポリアミン類、さらにはこれらの物質を細胞内で生じせしめる出発物質または誘導物質が含まれるが、これらに限定されない。
【0015】
本発明の細胞または器官の分化の調節剤(以下、分化調節剤と呼称)は、少なくとも1種の酸化還元状態調節物質からなるか、それを適当な担体、賦形剤と共に含有するものである。そのような製剤は、それぞれの分野で、製剤学上許容される公知の担体成分、製剤用補助剤等を適宜配合し既知の方法で製造することができる。剤形は、適用対象、適用方法に応じて、液剤、乳剤、固形剤など任意に選択できる。
【0016】
有効成分である酸化還元状態調節物質を2種以上併用することにより形態形成の速度、状態を任意に制御することが容易になる場合もある。そのような組み合わせは、例えば、互いに反する活性を有する物質同士のように、ある同一の代謝系において作用することに基いて選択することができる。例えば、後述の実施例では、グルタチオンとグルタチオン阻害剤であるBSOとの組み合わせにより、植物の開花時期を制御している。しかし、他の代謝系に作用する組合せであってもよい。
【0017】
本発明の分化調節剤が2種以上の酸化還元状態調節物質を含有する場合、これらの有効成分は1つの製剤中に存在していても良いが、別々に製剤化し、同時または時期をずれせて適用することもできる。
【0018】
本発明はまた、上記の分化調節剤を、該調節剤に感受性の変化した生物個体に適用することを特徴とする形態形成を調節する方法、およびそのようにして得られた生物個体を提供するものである。ここで、「感受性の変化した生物個体」とは、例えば、野生型植物体Lerに比較してBSOに対する感受性が変化している変異体fcaに例示されるように、特定の感受性が変化している個体を意味する。そのような個体は、自然に、または人工的に発現しうる。
【0019】
本発明の分化調節剤は、有効成分である細胞の酸化還元状態調節物質に対して感受性のある、あらゆる種類の生物に適用することができ、植物の場合、被子植物の双子葉植物および単子葉植物の両者に対して有効である。
【0020】
本発明の細胞の酸化還元状態調節物質を有効成分とする分化調節剤の使用対象が植物であるとき、開花やカルスからの個体再生や管状要素分化、発芽等の調節を人為的に行う場合においても、細胞の酸化還元状態、特に、活性酸素の生成レベルやグルタチオンの合成と酸化/還元比等を調節することで所望の調節が可能と考えられる。加えて、根毛やトライコームなどの植物の形態も、上記のような細胞の酸化還元状態を調節できる物質によって調節できると考えられる。
【0021】
従って本発明の方法によれば、広く植物の形態形成を制御することが可能になる。形態形成の調節の至適条件は一定ではなく、植物の種類および形態の種類等、および目的によって左右される。
【0022】
本発明の分化調節剤を適用することができる植物を以下に例示する。双子葉植物としては、例えばアサガオ属植物(アサガオ),ヒルガオ属植物(ヒルガオ,コヒルガオ,ハマヒルガオ),サツマイモ属植物(グンバイヒルガオ,サツマイモ),ネナシカズラ属植物(ネナシカズラ,マメダオシ)が含まれるひるがお科植物、ナデシコ属植物(カーネーション等),ハコベ属植物,タカネツメクサ属植物,ミミナグサ属植物,ツメクサ属植物,ノミノツヅリ属植物,オオヤマフスマ属植物,ワチガイソウ属植物,ハマハコベ属植物,オオツメクサ属植物,シオツメクサ属植物,マンテマ属植物,センノウ属植物,フシグロ属植物,ナンバンハコベ属植物が含まれるなでしこ科植物、もくまもう科植物、どくだみ科植物、こしょう科植物、せんりょう科植物、やなぎ科植物、やまもも科植物、くるみ科植物、かばのき科植物、ぶな科植物、にれ科植物、くわ科植物、いらくさ科植物、かわごけそう科植物、やまもがし科植物、ぼろぼろのき科植物、びゃくだん科植物、やどりぎ科植物、うまのすずくさ科植物、やっこそう科植物、つちとりもち科植物、たで科植物、あかざ科植物、ひゆ科植物、おしろいばな科植物、やまとぐさ科植物、やまごぼう科植物、つるな科植物、すべりひゆ科植物、もくれん科植物、やまぐるま科植物、かつら科植物、すいれん科植物、まつも科植物、きんぽうげ科植物、あけび科植物、めぎ科植物、つづらふじ科植物、ろうばい科植物、くすのき科植物、けし科植物、ふうちょうそう科植物、あぶらな科植物、もうせんごけ科植物、うつぼかずら科植物、べんけいそう科植物、ゆきのした科植物、とべら科植物、まんさく科植物、すずかけのき科植物、ばら科植物、まめ科植物、かたばみ科植物、ふうろそう科植物、あま科植物、はまびし科植物、みかん科植物、にがき科植物、せんだん科植物、ひめはぎ科植物、とうだいぐさ科植物、あわごけ科植物、つげ科植物、がんこうらん科植物、どくうつぎ科植物、うるし科植物、もちのき科植物、にしきぎ科植物、みつばうつぎ科植物、くろたきかずら科植物、かえで科植物、とちのき科植物、むくろじ科植物、あわぶき科植物、つりふねそう科植物、くろうめもどき科植物、ぶどう科植物、ほるとのき科植物、しなのき科植物、あおい科植物、あおぎり科植物、さるなし科植物、つばき科植物、おとぎりそう科植物、みぞはこべ科植物、ぎょりゅう科植物、すみれ科植物、いいぎり科植物、きぶし科植物、とけいそう科植物、しゅうかいどう科植物、さぼてん科植物、じんちょうげ科植物、ぐみ科植物、みそはぎ科植物、ざくろ科植物、ひるぎ科植物、うりのき科植物、のぼたん科植物、ひし科植物、あかばな科植物、ありのとうぐさ科植物、すぎなも科植物、うこぎ科植物、せり科植物、みずき科植物、いわうめ科植物、りょうぶ科植物、いちやくそう科植物、つつじ科植物、やぶこうじ科植物、さくらそう科植物、いそまつ科植物、かきのき科植物、はいのき科植物、えごのき科植物、もくせい科植物、ふじうつぎ科植物、りんどう科植物、きょうちくとう科植物、ががいも科植物、はなしのぶ科植物、むらさき科植物、くまつづら科植物、しそ科植物、なす科植物、ごまのはぐさ科植物、のうぜんかずら科植物、ごま科植物、はまうつぼ科植物、いわたばこ科植物、たぬきも科植物、きつねのまご科植物、はまじんちょう科植物、はえどくそう科植物、おおばこ科植物、あかね科植物、すいかずら科植物、れんぷくそう科植物、おみなえし科植物、まつむしそう科植物、うり科植物、ききょう科植物、きく科植物等を例示することができる。
【0023】
単子葉植物としては、例えばウキクサ属植物(ウキクサ)及びアオウキクサ属植物(アオウキクサ,ヒンジモ)が含まれる,うきくさ科植物、カトレア属植物,シンビジウム属植物,デンドロビューム属植物,ファレノプシス属植物,バンダ属植物,パフィオペディラム属植物,オンシジウム属植物等が含まれる,らん科植物、がま科植物、みくり科植物、ひるむしろ科植物、いばらも科植物、ほろむいそう科植物、おもだか科植物、とちかがみ科植物、ほんごうそう科植物、いね科植物、かやつりぐさ科植物、やし科植物、さといも科植物、ほしぐさ科植物、つゆくさ科植物、みずあおい科植物、いぐさ科植物、びゃくぶ科植物、ゆり科植物、ひがんばな科植物、やまのいも科植物、あやめ科植物、ばしょう科植物、しょうが科植物、かんな科植物、ひなのしゃくじょう科植物等を例示することができる。
【0024】
既述のごとく、本発明において、ある生物の「酸化還元状態」は生物界に広く共通する因子によって左右される。例えば、酸化還元状態を決定する重要な因子であるグルタチオンは生物に普遍的に存在しており、その合成系やそれらによって制御されるタンパク質因子も高い相同性を示す。さらに、活性酸素に関連する酵素も生物種を超えて高い相同性を有している。従って、本発明の酸化還元状態調節物質は動物等の、植物以外の生物における形態形成の調節剤としても有効である。
【0025】
そのような調節剤は、例えば、単為発生、神経や表皮などの細胞や組織の分化の誘導、神経樹状突起などの分化組織の修復、免疫担当細胞等の分化、接合子または胞子形成、鞭毛形成などを制御するのに有用であるが、これらに限定されない。
【0026】
上記の場合に例示される生物は、動物界では、脊椎動物門、棘皮動物門、原索動物門、腔腸動物門、軟体動物門、節足動物門、環形動物門、海綿動物、扁形動物門など、さらには、胞子体形成を行う担子菌や子嚢菌等の真菌類の他、胞子形成を行うような原核生物である放線菌などの微生物、出芽や接合体などを対象とした場合は酵母等も含まれるが、これに限定されない。
【0027】
これらの応用例としては、火傷等による皮膚修復や神経損傷の修復における調節剤などの医薬品、茸の培養制御、魚類等の単為発生による品質の均一化、花などの鮮度低下防止、病原菌の付着器の形成を抑制することによる感染防止などが挙げられるが、本発明はこれらに限定されるわけではない。
【0028】
本発明の分化調節剤は、その剤形に応じた方法で種々の生物個体もしくは器官、もしくは組織、もしくは細胞に用いられる。例えば、液剤や乳剤の場合、細胞または器官の分化を図る生物、たとえば植物の場合、その植物の生長点のみならず、茎,葉をはじめとする植物体の一部又は全体に散布,滴下,塗布することができる。また、固形剤や粉剤の場合には、たとえば地中から根に吸収させる。また、細胞または器官の分化を図る植物がウキクサ等の水草の場合には、底床添加剤として根から吸収させたり、固形剤を水中で除々に溶解させること等も可能である。本発明は任意の方法で適用することができ、上記の態様に限定されない。
【0029】
分化調節剤が底床添加剤又は固形剤である場合、担体成分としては、概ねタルク,クレー,バーミキュライト,珪藻土,カオリン,炭酸カルシウム,水酸化カルシウム,白土,シリカゲル等の無機質や小麦粉,澱粉等の固体担体が例示される。また液剤である場合は、概ね水、キシレン等の芳香族炭化水素類、エタノール,エチレングリコール等のアルコール類、アセトン等のケトン類、ジオキサン,テトラヒドロフラン等のエーテル類、ジメチルホルムアミド、ジメチルスルホキシド、アセトニトリル等の液体担体が例示される。
さらに、本発明の分化調節剤には、他の補助剤を適宜配合することができる。そのような補助剤として、例えばアルキル硫酸エステル類,アルキルスルホン酸塩,アルキルアリールスルホン酸塩,ジアルキルスルホコハク酸塩等の陰イオン界面活性剤、高級脂肪族アミンの塩類等の陽イオン界面活性剤、ポリオキシエチレングリコールアルキルエーテル,ポリオキシエチレングリコールアシルエステル,ポリオキシエチレングリコール多価アルコールアシルエステル,セルロース誘導体等の非イオン界面活性剤、ゼラチン,カゼイン,アラビアゴム等の増粘剤、増量剤、結合剤等が挙げられる。
【0030】
必要に応じて、植物生長調節剤、例えば安息香酸,ニコチン酸,ニコチン酸アミド,ピペコリン酸等を、本発明の所期の効果を損なわない限度において、製剤中に配合することもできる。
【0031】
以下に、本発明を主として開花時期の制御・調節を例として説明するが、当業者ならば、他の生物系においても、明細書の記載に従って同様に形態形成を制御しうることを理解するであろう。
【0032】
分化調節剤による処理は、対象となる植物の種子またはカルスの通常の栽培方法の開始前および/または栽培中に、適当な濃度の、細胞の酸化還元状態調節物質を適用することで行うことができる。通常、対象植物の性質(長日性、短日性など)に応じた処理を行いながら適用することが効果的である。そのような処理は、当業者に既知である。例えば、後述する実施例のトルコギキョウ等の相対長日植物の場合には、一定の光強度以上の光昭射を行いながら本発明の分化調節剤を用いることが効果的であると考えられる。
従って、本発明は、当該技術分野で通常用いられている任意の植物の育成方法における分化調節剤の使用をも包含する。
【0033】
分化調節剤は、有効成分である酸化還元状態調節物質単独であってもよいが、既述のごとく、それぞれの植物に適用可能な剤形、例えば液剤,固形剤,粉剤,乳剤,底床添加剤等の剤形で用いることが好ましい。そのような製剤は、それぞれの分野で、製剤学上適用することが可能な公知の担体成分、製剤用補助剤等を、開花調節が損なわれない限度において、有効成分である細胞の酸化還元状態調節物質に適宜配合し既知の方法で製造することができる。
以下、実施例により本発明を具体的に説明するが、本発明はこれらの実施例によりなんら限定されるものではない。
【実施例】
【0034】
実施例1 開花時期の調節(1)
イギリスのノッテンガム大学に公設されたArabidopsis Stock Centerから取り寄せたシロイヌナズナ晩生化変異体fca(寄託番号N167)および野生型植物体Ler(寄託番号NW20)を100μE/m2の強さの光で16時間明期/8時間暗期の日長条件のもと23℃で、を用いて生育させ実験に用いた。培地として、下層にバーミキュライト(旭工業)2、中層にクレハ育苗培土(クレハ化学)2、上層にバーミキュライト(旭工業)1の割合で重層して形成される土壌を用いた。
細胞の酸化還元状態調節物質として、グルタチオン合成の阻害剤であるL-Buthionine sulfoximine(BSO)とグルタチオンとを用いた。
【0035】
BSO処理:
BSOを10-1Mになるように水に溶かし、ストック液とした。つぎにその溶液から10-3から10-7Mの溶液を調整し処理液とした(図1〜3参照)。40×50 mm程度のポットに2〜3個体程度となるようにし、処理液を1ポットあたり5 ml/日となるように茎頂付近にドロップして与えた。処理は処理開始の当日、1、3、5、7日後に行い1回の処理とした。
【0036】
グルタチオン処理:
グルタチオン処理を行うときは、このBSO溶液にグルタチオンを濃度が10−4Mとなるように加えて処理した。
【0037】
処理の効果をロゼット葉数および花茎の伸長速度に基いて評価し、それぞれ、図1〜3に示した。図中、23 contおよび4 contは、それぞれ低温処理なしとありの場合の結果である(対照実験)。低温処理は、4℃で、薬剤処理と並行して行った。また、図2において、処理に用いたBSO濃度は、A, 0 M; B, 10-7 M; C, 10-6 M; D, 10-5 M; E, 10-4 M; F, 10-3 Mである。数値は平均値±標準誤差で表されている。
【0038】
(1)吸水後17日のfca植物体を、グルタチオン合成阻害剤BSOで処理した。1週間後の結果を図1Cに示す。その結果、処理終了から約1週間で花芽が肉眼で認められ、水処理のコントロールに比べてロゼット葉(根出葉)数が減少した。また花茎の伸びる速度を処理後約ヶ月にわたって調べた(図2)。図2から、花茎の述べる速度は、処理群でコントロールに比べて速く、開花が早められたことが分かる。これらは、ロゼット枚数の減少が、BSO処理が花芽が決定した後の成長だけでなく、花芽の決定自体を早めたことを示している。
【0039】
(2)一方、吸水後12日のfca植物体た。1週間後の結果を図1Aに示す。図1Aは、(1)の場合とは逆に、処理によりfcaの開花時期が遅れたことを示している。一方、同様の実験により、野生株Lerの場合には、吸水後12日からの処理開始によって花成が有意に早くなった(図1B)。このLerを発芽直後からBSOを含む寒天培地で生育させると、fcaを分化調節剤で早期(吸水12日目から)に処理を行った場合と同様に、抽苔が遅れた。
【0040】
(3)BSO処理と、グルタチオン(GSH)処理とを併用した。BSO溶液にグルタチオン(濃度:10−4M)を添加して上記と同様の方法で使用した。
BSOにより花芽形成が遅延される時期に処理した植物は、GSH濃度の上昇に従って、いったん花成が早まり、1mMでは花成が遅くなった(図3B)。一方、BSOによって花芽形成が早められる時期に処理した植物では、GSH濃度の上昇に従って花成が遅延された(図3A)。
これらの結果は、グルタチオン若しくはグルタチオン合成阻害剤またはそれらの組み合わせにより、開花時期、さらには花茎の伸長速度を調整できることを示している。なお、品種により処理時期を適宜調整する必要があることも明らかになった。
【0041】
実施例2 開花時期の調節(2)
実施例1と同様の方法で、シロイヌナズナ晩生化変異体fcaを100μE/m2の強さの光で16時間明期/8時間暗期の日長条件のもと、23℃で生育させ、実験に用いた。
細胞の酸化還元状態調節物質として、図4に記載した濃度の過酸化水素を用いた。過酸化水素水溶液は処理直前に調整して用いた。40×50 mm程度のポットに2〜3個体程度となるように配し、処理液を吸水の17日目から1ポットあたり5 ml/日となるように茎頂付近にドロップして与えた。処理は処理当日、1、3、5、7日後に行い1回の処理とした。個体のロゼット葉を指標にして花芽形成の時期を比較した。結果を図4に示す。図中、23 contは、水処理である(対照実験)。数値は平均値±標準誤差で表されている。
【0042】
個体のロゼット葉を指標にした花芽形成の時期は、処理を行った個体は水処理の場合に比べ、どの処理濃度でも早まった(図4)。また花茎の伸長速度も、至適濃度(10−5M)で早まった(図5)。図5において、横軸は薬剤処理完了後の日数を表している。
上記の結果は、活性酸素自体および活性酸素を生成せしめる物質が、花芽形成時期の調整効果のみならず、花茎の伸長促進効果をも有することを示している。
【0043】
実施例3 開花時期の調節3
実施例1と同様の方法で、シロイヌナズナ晩生化変異体fcaを100μE/m2の強さの光で16時間明期/8時間暗期の日長条件のもと23℃で生育させ実験に用いた。
細胞の酸化還元状態調節物質として、KCNまたはNaN3を用いた。KCNまたはアジ化ナトリウムは処理直前に調整し、それぞれ、図6および図7に記載の濃度で用いた。40×50 mm程度のポットに2〜3個体程度となるようにし、処理液を1ポットあたり5 ml/日となるように茎頂付近にドロップして与えた。KCNまたはNaN3による処理は種子吸水後17日目から行った。処理当日、1、3、5、7日後に行い1回の処理とした。個体のロゼット葉を指標にして花芽形成の時期を比較した。KCNまたはNaN3を用いた実験結果をそれぞれ図6および図7に示す。図中、23 contは、水処理である(対照実験)。数値は平均値±標準誤差で表されている。
【0044】
ロゼット葉を指標にした花芽形成の時期は、処理群において、水処理の対照群よりも、それぞれの至適濃度(KCN:10-3;NaN3:10-4)で早期化している。
上記の結果は、活性酸素を生成せしめる物質は花芽形成時期の調整効果を有することを示している。
【0045】
実施例4 発芽時の形態形成調節1
プラスチックディッシュ (100×15 mm)の中に柔らかい紙を敷き、コムギ(品種: シラサギ)またはイネ(品種:日本晴れ)の種子15個を入れ、さらに過酸化水素水溶液を15 mlとなるように加え、発芽させた(光条件、50 μE/ m2、 16 h light/ 8 h darkサイクル;温度、小麦:18℃、イネ:27℃)。図8に記載した濃度の過酸化水素水溶液を用時調整し、これらの種子の処理に用いた。吸水から144時間(6日)後に各過酸化水素濃度で処理したコムギの子葉鞘の長さを測定した。結果を図8に示す。図中、数値は平均値±標準誤差で表されている。
図8から、過酸化水素処理を施した植物では細胞が伸長していることが分かる。
上記の結果は、過酸化水素が発芽時の細胞の伸長に関する形態形成を調節する作用を有することを示している。
【0046】
実施例5 発芽時の形態形成調節2
プラスチックディッシュ (100×15 mm)の中に柔らかい紙を敷き、ヒャクニチソウ(cv スカーレットフレーム)の種子15個を入れ、さらに過酸化水素水溶液を15 mlとなるように加え、発芽させた(光条件、50 μE/ m2、 16 h light/ 8 h darkサイクル;温度、27℃)。図9に記載した濃度の過酸化水素水溶液を用時調整し、これらの種子の処理に用いた。吸水2日後の発芽個体の観察を行った(図9参照)。図中、処理に用いた過酸化水素濃度の数値(単位:mM)は、各図の右下に記載されている。60 mM過酸化水素処理の場合の発芽を示す図から、子葉の展開が早く起こり、根よりも先に果皮から子葉が出ている様子が認められる。このように、過酸化水素の処理濃度が高くなると、処理種子は、根からではなく、子葉から発芽するようになり、処理群の子葉の展開は無処理群に比較して早期化している。
上記の結果は、過酸化水素が子葉の展開時期を早める作用を有することを示している。
【0047】
実施例6 カルスの不定芽形成の調節
カルスからの不定芽形成に対するグルタチオンの調節効果を調べた。
無菌的に生育させたタバコ葉を1%寒天およびムラシゲ/スクーグ培地(MS培地)の基本培地にベンジルアデニン(BA)を0.1 mg/L、ナフタレン酢酸(NAA)を1 mg/Lで加えたカルス誘導培地上でカルス化させた後、そのカルスを1%寒天およびムラシゲ/スクーグ培地(MS培地)の基本培地にBAを1 mg/L、NAAを0.1 mg/L濃度にした不定芽形成培地に移した。不定芽誘導培地には酸化還元状態調整物質として、0.1 mM BSO、1 mM GSH、1 mM GSSG(酸化型グルタチオン)を加えた。対照培地として、これらの物質を無添加にした対照を用意した。これらの不定芽誘導培地および対照培地でカルスを誘導後3週間培養した後、不定芽の数を計算した。結果を表1に示す。
【表1】

上記の結果は、グルタチオン量および酸化還元比を人為的にかえることにより、不定芽形成の調整が可能であることを示している。
【0048】
実施例7 根毛形成の調節1
プラスチックディッシュ(100×15 mm)の中に柔らかい紙を敷き、シロイヌナズナ野生型植物体Lerを入れ、さらに過酸化水素濃度10-3 Mの水溶液を15 ml入れて吸水させた。23℃で発芽させ、吸水から一週間後に根毛形成を顕微鏡観察した。水では根毛形成が認められたのに対して、過酸化水素溶液では根毛形成が認められなかった。
【0049】
実施例8 根毛形成の調節2
プラスチックディッシュ(100×15 mm)の中に柔らかい紙を敷き、クロダイズ種子(品種:丹波黒)を入れ、さらに過酸化水素濃度10-3 Mの水溶液を15 ml入れて吸水させた。23℃で発芽させ、吸水から一週間後に根毛形成を顕微鏡観察した。水では根毛形成が認められたのに対して、過酸化水素溶液では根毛形成が認められなかった。
【0050】
実施例9 管状要素形成の調節
Sugiyamaらの方法(Sugiyama M. Fukuda, H. and Komamine, A. (1986) Plant Cell Physiol. 27: 601-606)に従い、ヒャクニチソウ (品種:カナリーバード)を播種し、播種後14日目に、長さ3.5〜4.5cmになった第1葉より単離した葉肉細胞をナフタレン酢酸(0.1 mg/l)、ベンジルアミノプリン(1 mg/l)を含むD培地に2.5〜4.0×106/mlとなるように懸濁した。この培養液を2 mlずつ試験管に分注し、25℃、暗所で回転培養した。培養開始時にスーパーオキシドジスムターゼ(SOD)またはカタラーゼを、図10に記載の濃度で添加した。培養72時間後にサンプリングを行い、二次細胞壁肥厚による縞模様が観察される細胞を管状要素へ分化した細胞とした。また、全細胞数に占める管状要素細胞の割合を分化率とした。結果を図10に示す。図10において、縦軸は管状要素分化率(TEdifferentiation) (%)を表している。また、培養開始時に加えたSODおよびカタラーゼの濃度はカラムの下に、活性(U/ml、上段)およびタンパク質量(μg protein/ml、下段)で記載されている。数値は平均値±標準誤差で表されている。図中、TEは管状要素を意味する。図中、「D」はD培地を意味する。
【産業上の利用可能性】
【0051】
本発明により、生物の種類に関係なく、細胞および器官の分化を制御することが可能となった。
【図面の簡単な説明】
【0052】
【図1】シロイヌナズナ晩生化変異体fca(以下、fcaと呼称)および野生型植物体Ler(以下、Lerと呼称)の開花時期に対するグルタチオン阻害剤L-ブチオニンスルホキシイミン(L−Buthionine sulfoximine :BSO)の調節効果を示すグラフである。調節効果をロゼット葉数に基いて評価した。 種子吸水後12日目からBSO処理を行った(図1A、fca; 図1B、Ler)。fcaについては17日目からもBSO処理を行った(図1C)。23 contおよび4 contは、それぞれ低温処理「なし」と「あり」の場合の結果である(対照実験)。数値は平均値±標準誤差で表されている。
【図2】fcaの花茎の伸長速度に対するBSOの調節効果を示すグラフである。発芽後12日目からBSO処理を行い、花茎伸長に対する効果を調べた。処理に用いたBSO濃度は以下の通りである。A, 0 M; B, 10-7 M; C, 10-6 M; D, 10-5 M; E, 10-4 M; F, 10-3 M。数値は平均値±標準誤差で表されている。
【図3】BSOの花成(花芽形成)時期調節効果に対するグルタチオン(GSH)の影響を示すグラフである。 発芽後12日目からBSO処理を行った。グルタチオンはBSO処理と同時に与えた。図中、23cont および4contは、図1と同意義である。また、AはLer,Bはfcaを用いた結果である。
【図4】晩生化変異体fcaの開花時期に対する過酸化水素の調節効果を示すグラフである。過酸化水素による処理は種子の吸水後17日目から行った。23 ℃は、水処理である(対照実験)。数値は平均値±標準誤差で表されている。
【図5】fcaの花茎の伸長速度に対する過酸化水素の調節効果を示すグラフである。発芽後12日目から過酸化水素処理を行い、花茎伸長への効果を調べた。処理に用いた過酸化水素の濃度は図上に記載されている。数値は平均値±標準誤差で表されている。
【図6】晩生化変異体fcaの開花時期に対するシアン酸カリウム(KCN)の調節効果を表すグラフである。KCNによる処理は種子吸水後17日目から行った。23 ℃は、水処理である(対照実験)。数値は平均値±標準誤差で表されている。
【図7】晩生化変異体fcaの開花時期に対するNaN3の調節効果を示すグラフである。種子吸水後17日目からアジ化ナトリウムによる処理を行った。23 contは、水処理である(対照実験)。数値は平均値±標準誤差で表されている。
【図8】過酸化水素によるコムギの形態変化に対する調節効果(形態調節1)を示すグラフである。吸水から144時間(6日)の結果を示している。各過酸化水素濃度で処理したコムギの子葉鞘の長さを表した。数値は平均値±標準誤差で表されている。
【図9】ヒャクニチソウの形態変化に対する過酸化水素の調節効果(形態調節2)を示す写真である。処理に用いた過酸化水素濃度の数値(単位:mM)は、各図の右下に記載されている。図は吸水48時間後の植物体の様子を示している。過酸化水素の処理濃度が高くなると、植物は、根ではなく、子葉の展開から発芽するようになる。60 mMの処理の場合の発芽を示す図から、子葉の展開が早く起こり、根よりも先に果皮から子葉が出ている様子が認められる。
【図10】ヒャクニチソウ(品種:カナリーバード)の播種後14日の長さ3.5〜4.5cmになった第1葉より単離した葉肉細胞をスーパーオキシドジスムターゼ(SOD)またはカタラーゼの存在下、試験管内で培養し、管状要素形成の調節効果を調べた結果を示すグラフである。培養開始時に加えたSODおよびカタラーゼの濃度をカラムの下に、活性およびタンパク質量で示した。図中、TEは管状要素を表す。数値は平均値±標準誤差で表されている。
【特許請求の範囲】
【請求項1】
細胞の酸化還元状態調節物質を含有する細胞または器官の分化の調節剤。
【請求項2】
細胞または器官等の分化が、植物の花芽分化、発芽時の個体形成、カルスからの再分化、管状要素形成および根毛形成から選択される、請求項1記載の細胞または器官の分化の調節剤。
【請求項3】
酸化還元状態調節物質が細胞における活性酸素の生成に影響を与える物質である、請求項1または2に記載の細胞または器官の分化の調節剤。
【請求項4】
酸化還元状態調節物質がグルタチオンの合成またはグルタチオン量に影響を与える物質である、請求項1〜3のいずれか1項に記載の細胞または器官の分化の調節剤。
【請求項5】
細胞の酸化還元状態調節物質が活性酸素類、グルタチオン合成阻害剤、グルタチオン誘導体、ポリアミン類、呼吸阻害剤、およびこれらの物質を細胞内で生じせしめる物質からなる群から選択される、請求項1〜4のいずれか1項に記載の細胞または器官の分化の調節剤。
【請求項6】
細胞の酸化還元状態調節物質がKCN、NaN3、プトレシン、スペルミン、スペルミジン、過酸化水素、スーパーオキシドアニオンラジカル、ブチオニンスルフォキシミン、メチオニンスルフォキシミン、還元型グルタチオン、酸化型グルタチオン、ホモグルタチオン、カルボキシプロピルグルタチオンおよびジカルボキシエチルグルタチオンからなる群から選択される、請求項1〜5のいずれか1項に記載の細胞または器官の分化の調節剤。
【請求項7】
請求項1〜6のいずれか1項に記載の細胞または器官の分化の調節剤を、該調節剤に感受性の生物個体に適用することを特徴とする形態形成を制御する方法。
【請求項8】
請求項7に記載の方法で得られた生物。
【請求項9】
植物である請求項8記載の生物。
【請求項1】
細胞の酸化還元状態調節物質を含有する細胞または器官の分化の調節剤。
【請求項2】
細胞または器官等の分化が、植物の花芽分化、発芽時の個体形成、カルスからの再分化、管状要素形成および根毛形成から選択される、請求項1記載の細胞または器官の分化の調節剤。
【請求項3】
酸化還元状態調節物質が細胞における活性酸素の生成に影響を与える物質である、請求項1または2に記載の細胞または器官の分化の調節剤。
【請求項4】
酸化還元状態調節物質がグルタチオンの合成またはグルタチオン量に影響を与える物質である、請求項1〜3のいずれか1項に記載の細胞または器官の分化の調節剤。
【請求項5】
細胞の酸化還元状態調節物質が活性酸素類、グルタチオン合成阻害剤、グルタチオン誘導体、ポリアミン類、呼吸阻害剤、およびこれらの物質を細胞内で生じせしめる物質からなる群から選択される、請求項1〜4のいずれか1項に記載の細胞または器官の分化の調節剤。
【請求項6】
細胞の酸化還元状態調節物質がKCN、NaN3、プトレシン、スペルミン、スペルミジン、過酸化水素、スーパーオキシドアニオンラジカル、ブチオニンスルフォキシミン、メチオニンスルフォキシミン、還元型グルタチオン、酸化型グルタチオン、ホモグルタチオン、カルボキシプロピルグルタチオンおよびジカルボキシエチルグルタチオンからなる群から選択される、請求項1〜5のいずれか1項に記載の細胞または器官の分化の調節剤。
【請求項7】
請求項1〜6のいずれか1項に記載の細胞または器官の分化の調節剤を、該調節剤に感受性の生物個体に適用することを特徴とする形態形成を制御する方法。
【請求項8】
請求項7に記載の方法で得られた生物。
【請求項9】
植物である請求項8記載の生物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2008−120815(P2008−120815A)
【公開日】平成20年5月29日(2008.5.29)
【国際特許分類】
【出願番号】特願2007−312518(P2007−312518)
【出願日】平成19年12月3日(2007.12.3)
【分割の表示】特願2001−577748(P2001−577748)の分割
【原出願日】平成13年4月24日(2001.4.24)
【出願人】(591060980)岡山県 (96)
【Fターム(参考)】
【公開日】平成20年5月29日(2008.5.29)
【国際特許分類】
【出願日】平成19年12月3日(2007.12.3)
【分割の表示】特願2001−577748(P2001−577748)の分割
【原出願日】平成13年4月24日(2001.4.24)
【出願人】(591060980)岡山県 (96)
【Fターム(参考)】
[ Back to top ]

