細胞ベースアッセイ方法
ビーズ上に細胞を貯蔵し、続いて低温貯蔵した細胞を細胞アッセイで利用するための方法が開示される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は細胞の保存及び貯蔵に関し、特に凍結保存細胞を用いる細胞ベースアッセイに関する。
【背景技術】
【0002】
高スループットスクリーニング(HTS)技術の適用は、新しい治療薬剤の発見及び開発のための細胞ベースアッセイを実施する機会を製薬業界に提供することにより、薬剤発見における工程変化を可能にした。HTSプロセスでは、生体系における可能な効果について及び特定の標的に対する選択リード化合物の特異性について薬剤候補がスクリーニングされる。一次スクリーニングへの取組みは、HTSアッセイプロセスの開発、及び96、384、864、1536又はそれ以上の小形ウェルを有しかつ100000試験/日を超えるスループットレベルを可能にするマイクロタイターウェルプレート方式を用いるアッセイの小形化によって行われてきた。これは各タイプの試験に対して多数の細胞の必要性を生み出したが、かかる試験は例えば特定の遺伝的に操作された細胞を含んでいる。次に、一次スクリーニングプロセス中に確認されたリード化合物は、化合物の生物学的適合性を検討するため、各種のアッセイにおいてさらなる精細スクリーニング及び試験を受ける必要がある。かかるアッセイは、生体適合性、代謝及び毒性に加えて、レセプター結合及び酵素活性アッセイを含むことがある。
【0003】
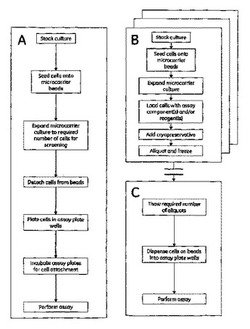
その結果、各回の一次スクリーニングについて何十億もの細胞を増殖させるための「培養」負担を克服するという大きな難題が存在している。通例、細胞はフラスコ及びローラーボトル内で培養される。1×1010個の細胞の増殖は、1回のアッセイ当たり10000個の細胞という値に基づけば、1000000回のアッセイを可能にするであろう。これには、約2000の大形フラスコを維持する必要があり、それによって大量の資源、プラスチック器具及び増殖培地成分が消費される。細胞培養方法におけるCytodex(商標)支持体粒子又は「マイクロキャリヤー」(GE Healthcare社)の使用は、増殖のための表面積を増加させることにより、足場依存性細胞の収量を向上させた。これらのマイクロキャリヤーの特性には、最大細胞増殖のための最適サイズ及び密度、撹拌培養のために強靱であるが剛性ではない支持体を与える生物学的に不活性なマトリックス、並びに付着細胞を容易に顕微鏡検査するための透明性がある。マイクロキャリヤーは、浮遊培養又は単層培養で使用して培養容器及び灌流チャンバーの表面積を増加させることができる。表面積の増加は、密度の増加した細胞、ウイルス及び細胞生産物の生産を可能にする。高スループット薬剤スクリーニング用の細胞を増殖させて製造するための通常のプロセス(図1A)では、保存培養物からの細胞をマイクロキャリヤービーズ上に播種することで細胞培養を開始する。次いで、薬剤スクリーニングを実施するために必要な数の細胞が生産されるまで、マイクロキャリヤー培養物を連続プロセスで拡大させる。所要数の細胞が単一バッチとして得られたならば、トリプシン処理又は他の手段で細胞をマイクロキャリヤービーズから引き離し、得られた細胞懸濁液をビーズから分離し、細胞を所期のアッセイに適したマイクロウェルプレートのウェル内に接種する。次いで、プレートを通例は1晩インキュベートすることで、細胞をウェルの表面に付着させ、マイクロキャリヤービーズからの分離プロセスから回復させた後にスクリーニングアッセイで使用する。
【0004】
通常のプロセスは、細胞の生産及び製薬用薬剤スクリーニング環境におけるスクリーニングアッセイの実施に関して2つの大きな欠点を有している。第一に、かかるプロセスは一度開始したら中断することができず、細胞培養及びスクリーニングプロセスを始めから終わりまで連続プロセスとして実施しなければならない。これは大きなスケジューリング上の問題を提起することがあり、装置の故障又はオペレーターの不在に対して被害を受けやすいことがある。例えば、スクリーニング段階で使用すべき装置(例えば、検出器)が動作しなければ、細胞培養物は使用できないので廃棄される。逆に、(例えば、汚染のため)細胞培養物に問題が起これば、細胞はスクリーニングの要求を満たすために送達されることがなく、高価な検出装置は遊んだ状態になる。第二に、通常のプロセスでは、マイクロウェルプレートへの分配に先立ち、通例は機械的手段又は酵素手段によってバルク培養細胞がマイクロキャリヤー支持体から回収される。連続プロセスでは、続くアッセイウェル内での細胞のインキュベーションのためには、通例はタンパク質分解酵素トリプシンを用いて実施される細胞−ビーズ分離中に受ける代謝ショック及び/又はタンパク質分解損傷から細胞を回復させることが必要である。この段階では、多数のアッセイプレートを組織培養条件下で貯蔵することが要求され、多大の設備及び人員が必要となる。本明細書中に記載する本発明は、ビーズ上での細胞貯蔵及びそれに続く細胞アッセイでの低温貯蔵細胞の利用のための手段を提供する。本発明は「アッセイ・オン・デマンド」のための機能の迅速な達成を可能にすると共に、アッセイの構成に関連した追加の利点を提供すると期待される。
【特許文献1】米国特許出願公開第2002/094543号明細書
【特許文献2】国際公開第99/21962号パンフレット
【特許文献3】英国特許出願公開第2059991号明細書
【非特許文献1】FURSOV NATALIE ET AL:ASSAY AND DRUG DEVELOPMENT TECHNOLOGIES,vol.3,no.1,February 2005,pages 7−15
【非特許文献2】YANAI N ET AL:BIOLOGICAL ABSTRACTS.−MICROFILMS,vol.88,no.9,1989,page AB240
【非特許文献3】DIGAN MARY ELLEN ET AL:JOURNAL OF BIOMOLECULAR SCREENING,vol.10,no.6,September 2005,pages 615−623
【発明の開示】
【0005】
本発明の第1の態様に従えば、細胞プロセスを測定するためのアッセイ方法であって、当該方法は
i)固体粒子に付着した培養細胞の集団を液体媒質中に用意する段階であって、前記細胞には前記アッセイを実施するための1種以上の成分がプレロードされており、前記粒子は細胞付着及び/又は細胞増殖のために適合している段階、
ii)培養細胞に1種以上の凍結保護剤を添加する段階、
iii)段階ii)からの前記細胞の別々のアリコートを低温での凍結保存に供する段階、
iv)段階iii)からの前記アリコートの1以上から得られる1以上の個別試料を別々の反応器に導入する段階、及び
v)前記アッセイを実施するための1種以上の追加試薬を前記反応器の各々に導入する段階
を含んでなり、前記細胞或いは前記試薬又は前記追加試薬の少なくとも1種が前記試薬及び前記細胞を合わせた後に光学信号を放出し又は光学信号の放出を誘起される検出可能なレポーターを含み、前記光学信号が前記細胞プロセスを測定するための手段として検出及び/又は定量化される方法が提供される。
【0006】
一実施形態では、細胞中にプレロードされるアッセイ成分は、細胞アッセイを実施するために必要な化学試薬であり得る。かかる化学試薬には、特に限定されないが、イオン感受性染料又は蛍光染料のような蛍光染料センサー、酵素基質、酵素補助因子、細胞刺激及びレセプターリガンドがある。この実施形態では、1種以上の追加アッセイ試薬を本方法の段階v)で細胞と合わせることで、研究中の細胞プロセスを開始させることができる。好適には、アッセイ混合物に添加されるアッセイ試薬の1種以上が、或いは別法としてプレロードされるアッセイ試薬が検出可能なレポーターで標識される。一実施形態では、研究中のアッセイは細胞カルシウム放出アッセイであり得るが、この場合にはプレロードされるアッセイ試薬はFluo−4のような蛍光カルシウムイオン感受性染料である。別の例では、細胞アッセイはレポーター遺伝子由来の活性のような酵素活性の検出に基づいており、この場合には凍結保存に先立って細胞中にプレロードされる化学試薬は酵素基質であり得る。哺乳動物細胞において各種の酵素遺伝子をレポーター遺伝子として使用する方法は公知である(総説としては、Naylor L.H.,Biochemical Pharmacology,(1999),58,749−757を参照されたい)。レポーター遺伝子は、遺伝子の生産物が他の細胞タンパク質の存在下で測定可能であるように選択され、宿主細胞中での遺伝子発現の変化に応答する選択された調節配列の制御下で細胞中に導入される。典型的な調節配列には、ホルモン、第二メッセンジャー及び他の細胞制御及びシグナリング因子に応答するものがある。適当な調節配列の選択により、レポーター遺伝子は、研究中の選択された調節配列が関与する細胞プロセスに対する添加薬剤の効果をアッセイするために使用できる。本発明に従って実施できるレポーター遺伝子アッセイの一例はルシフェラーゼレポーター遺伝子アッセイであり、この場合にはプレロードされる試薬はルシフェリン基質である。別の例は、国際公開第2005/118839号(GE Healthcare UK Limited)に記載されているようなニトロレダクターゼアッセイである。
【0007】
細胞アッセイの目的がアッセイで測定される細胞プロセスに対する阻害活性に関して化合物のスクリーニングを行うことである場合、プレロードされるアッセイ試薬は細胞プロセスに対する刺激剤であり得る。その結果、アッセイを実施するために細胞を凍結保存から取り出した場合、研究対象である細胞プロセスは直ちに阻害化合物の検出を行う準備ができた状態にアップレギュレートされている。アッセイの目的が細胞レセプターに対するリガンド結合の阻害に関して化合物のスクリーニングを行うことである場合、試薬は放射性標識レセプターリガンドであり得る。その結果、アッセイを実施するために細胞を凍結保存から取り出した場合、研究対象であるレセプターは既に検出可能なリガンドで占拠されており、続くアッセイの進行中にはそれの排除を阻害活性の指標として検出できる。要するに、本発明の方法によれば、細胞アッセイを実施するため細胞に通常添加される任意の化学試薬を凍結保存に先立って細胞中にプレロードできることが当業者には理解されよう。
【0008】
第2の実施形態では、細胞中にプレロードされるアッセイ成分は、一過的に発現される遺伝的にエンコードされたレポーターであり得る。かかるレポーターは、プラスミド又はウイルスベクター(通例はアデノウイルスベクター)によって細胞に導入できる。この実施形態に従えば、レポーターは検出可能なタンパク質、例えば緑色蛍光タンパク質及び赤色蛍光タンパク質(Tsien,R.et al,Nat.Methods,(2005),2(12),905−9)をはじめとする蛍光タンパク質からなる。好適な蛍光タンパク質は、Aequorea victoriaからの野生型GFP、及び野生型GFPのアミノ酸配列をアミノ酸欠失、付加又は置換によって改変した機能性GFP類似体のようなGFP誘導体を包含する。かかる蛍光タンパク質には、EGFP(Cormack,B.P.et al,Gene,(1996),173,33−38)、EYFP及びECFP(米国特許第6,066,476号、Tsien,R.et al)、F64L−GFP(米国特許第6,172,188号、Thastrup,O.et al)、BFP(米国特許第6,077,707号、Tsien,R.et al)がある。一過的に発現される遺伝的にエンコードされたレポーターの他の例には、(前述したように)ルシフェラーゼ、β−ラクタマーゼ及びニトロレダクターゼのような酵素があり、その発現は適当な酵素基質の添加によって測定できる。この実施形態では、レポータータンパク質をエンコードするDNA配列を含むベクターが凍結保存に先立って細胞に添加される。その結果、細胞を凍結保存から戻して所望の細胞アッセイを実施する場合、細胞はアッセイに必要な遺伝的にエンコードされたレポーターを発現できる。要するに、本発明の方法によれば、細胞アッセイを実施するため細胞に通常添加されてレポーターの一過性発現を生み出す任意の遺伝的にエンコードされたレポーターを凍結保存に先立って細胞中にプレロードできることが当業者には理解されよう。
【0009】
一実施形態では、細胞プロセスに対する試験剤の効果を測定するための方法であって、段階v)の前又は後に試験剤の試料をアッセイ混合物中に導入し、前記試験剤の不存在下及び存在下で測定される前記光学信号の変化が前記細胞プロセスに対する前記試験剤の効果を表す方法が提供される。別法として、試験剤の効果は、本方法の段階v)の前又は後に試験剤の試料を導入し、光学信号の測定値を対照値と比較することよっても求めることができる。対照値は、簡便にはデータベース又は他の電子フォーマットで電子的に記憶しておくことができる。
【発明を実施するための最良の形態】
【0010】
細胞プロセスとは、生細胞が受ける正常なプロセスを意味し、生合成、取込み、輸送、レセプター結合、代謝、融合、生化学的応答、増殖及び死滅を含む。(図2を参照しながら)本発明の方法に従えば、液体媒質[2]中に懸濁した支持体[1]上に細胞を増殖させる。この場合、必要に応じ、支持体は容器[3]内に含まれる細胞の付着及び増殖を可能にするように改質又は適合されている。細胞が支持体上で選択された増殖レベルに達した後には、追加の支持体材料を供給したさらに大きい容量の第2の容器[4]に支持体上の細胞を移すことでさらなる細胞増殖を達成できる。したがって、必要ならばさらにサイズ及び容量の増加した1以上の容器[5]に細胞を移すことを含め、このようにして所望数の細胞が得られるまで細胞数を拡大することができる。次に、支持体上に増殖した細胞にアッセイ成分又は試薬[6]をロードする。次に、表面上に増殖した細胞に適当な凍結保護剤[7]を添加して凍結保存の準備を行い、凍結保護剤混合物[8]中における支持体上の細胞[8]の懸濁液を容器[9]内のアリコートに分ける。容器[15]を凍結チャンバー[11]内の低温環境[12]に移すことで、凍結保存媒質[14]中に懸濁された支持体上の細胞[13]の凍結保存及び長期貯蔵を可能にする。
【0011】
細胞アッセイで細胞を使用するためには、液体媒質[17]中に懸濁された支持体に付着した凍結保存細胞を含む1以上の容器[16]を低温貯蔵から取り出し、周囲温度又は上昇温度に戻すことで、細胞ベースアッセイを実施するために適したマルチウェルプレート[20]のウェル[19]中に支持体表面上の細胞を分配することができる。アッセイプロトコルの要求に応じ、支持体表面上の細胞を含むウェル[23]に1以上の容器[22]内の追加のアッセイ試薬[21]を添加する。細胞集団中の細胞又はアッセイ試薬の1種以上は、試薬及び細胞を合わせた後に光学信号を放出し又は光学信号の放出を誘起される検出可能なレポーターで標識されており、光学信号は細胞プロセスを測定するための手段として検出及び/又は定量化される。アッセイウェルに試験剤[24]を添加し、アッセイを進行させてアッセイのリードアウトを生成することで、アッセイ中に試験剤が活性を示したウェル[25]を識別することができる。
【0012】
好適には、本発明の方法で使用するための支持体は粒子状支持体であり、付着した細胞の増殖を可能にするために適した任意の固体又は半固体材料からなる。好適には、支持体は細胞増殖培地中に浸漬され、支持体の懸濁液の分割によって複数の部分に分けることができる。粒子状支持体用の好適な材料には、特に限定されないが、プラスチック、ガラス又はポリマーの粒子又はビーズがある。好ましい粒子には、商業的に入手可能な細胞マイクロキャリヤー、特に架橋デキストランマイクロキャリヤー(例えば、Cytodex(GE Healthcare社))がある。
【0013】
本発明の方法で使用するのに適した細胞は、同じタイプの細胞の単一集団であってもよいし、或いは混合集団であってもよい。かかる細胞タイプは、付着性の原核細胞及び真核細胞、例えば細菌、酵母、昆虫細胞及び哺乳動物細胞から選択できる。その例には、幹細胞、分化幹細胞、一次細胞、形質転換細胞及び遺伝的に操作された細胞があり、これらの細胞は細胞の生存及び/又は増殖の維持のために粒子状支持体表面への付着を必要とすることを特徴とする。本発明に従った支持体上での細胞培養のためには、標準的な細胞培養技法の使用が必要である。例えば、細胞は給湿された95%空気/5%CO2雰囲気を含むインキュベーター内において37℃の無菌環境中で培養される。別法として、空気/5%CO2の雰囲気を含む密封容器内で細胞を培養することもできる。容器は撹拌培養物又は静置培養物を含むことができる。ウシ胎児血清のような未定義の生物学的液体を含む培地、並びに293SMFII無血清培地(Invitrogen、ペイズリー、英国)のような完全に定義された培地を含め、各種の細胞培養培地を使用することができる。各種細胞タイプの培養のために利用できる確立されたプロトコルが存在する。(例えば、Freshney,R.T.,Culture of Animal Cells:A Manual of Basic Techniques,2nd Edition,Alan R.Liss Inc.(1987)、Freshney,R.T.,Cloning and Selection of Specific Cell Types in Culture of Animal Cells,3rd Edition,Wiley−Liss Inc.(1994),p.161−178を参照されたい。)
一実施形態では、粒子状支持体上に増殖した細胞が、細胞アッセイセンサー又は検出可能なレポーター(例えば、蛍光タンパク質を発現し又は酵素を発現するレポーター遺伝子)を安定して発現して細胞アッセイリードアウトを与えるように操作される。
【0014】
別の実施形態では、粒子状支持体上に増殖した細胞が、凍結保存に先立ってバルク培養物にプラスミド又はウイルスベクターを添加することにより、細胞アッセイリードアウトを与える細胞アッセイセンサー又は検出可能なレポーターを一過的に発現させるように操作される。代わりの実施形態では、凍結保存から戻した細胞アリコートにプラスミド又はウイルスベクターを添加することにより、細胞アッセイリードアウトを与える細胞アッセイセンサー又は検出可能なレポーターを一過的に発現させるように、粒子状支持体上に増殖した細胞を操作することもできる。一過性発現のための好適なベクターには、特に限定されないが、プラスミド、アデノウイルス及びバキュロウイルスがある。
【0015】
レポーター遺伝子技術は、シグナルトランスダクション及び遺伝子発現に関連する細胞イベントをモニターするために広く使用されている。本発明の文脈中では、レポーター遺伝子という用語は、内因性タンパク質のバックグラウンドを越えて容易に識別できる容易に測定可能な表現型を有する遺伝子を定義するために使用される。レポーター遺伝子構築物は、例えば蛍ルシフェラーゼの発現を推進する活性化T細胞の核因子(NFAT)(Zhong,H.,Lee,D.,Robeva,A.,Minneman,K.P.,Life Sci.,(2001),68(19−20),2269−76)を用いて、レポーター遺伝子の発現を推進する誘導可能な転写制御要素を含んでいる。好適なレポーターには、特に限定されないが、酵素、蛍光タンパク質、発光タンパク質、融合タンパク質及びエピトープタグがある。酵素レポーターの例には、特に限定されないが、β−ガラクトシダーゼ、アルカリホスファターゼ、β−ラクタマーゼ、ルシフェラーゼ及びニトロレダクターゼがある。蛍光タンパク質の例には、特に限定されないが、Aequorea victoriaの緑色蛍光タンパク質及びその変異体がある。好適な発光タンパク質には、特に限定されないが、エクオリンがある。
【0016】
本発明に従って実施できるレポーター遺伝子アッセイの一例では、GFP或いは任意の機能性類似体(例えば、EGFP、YFP又はBFP(Shaner,N.C.,Steinbach,P.A.,Tsien,R.Y.,Nat.Methods,(2005),2(12),905−9))から導くことができる蛍光タンパク質をエンコードするヌクレオチド配列を含む核酸分子の導入によって操作された細胞が使用される。核酸分子は、発現制御配列に機能的に結合されかつその制御下にある。凍結保存から戻されかつ操作された核酸レポーター遺伝子配列を含む細胞は、研究対象であるタンパク質の発現のために適した条件下で培養される。次いで、GFP又は機能性GFP類似体の蛍光発光が研究対象であるタンパク質の発現を測定する手段としてモニターされる。かかる方法は、細胞中でのタンパク質の発現に対する試験剤の効果を検出及び比較するために使用できる。本発明の文脈中における「試験剤」という用語は、外部から適用される薬剤、ホルモン或いは別法として熱、ショック、pH変化などの環境刺激によるアゴニスト又はアンタゴニスト刺激を包括するものである。試験剤の存在下及び不存在下で得られる蛍光発光を比較することで、細胞中における研究対象のタンパク質の発現及び/又は局在に対する試験剤の効果を判定することが可能である。
【0017】
レポーター遺伝子アッセイの別の例は、細菌ニトロレダクターゼ(NTR)及び細胞浸透性シアニン染料類似体の使用に基づいている。ニトロレダクターゼは、Escherichia coli Bから単離されたFMN依存性酵素である。NTRの発現は多数の哺乳動物細胞で実証されている(米国特許第5,777,190号、Shah et al)。この酵素が蛍光消光したニトロ基含有染料のニトロ基を還元できることは、NTRの発現及びこの酵素の基質として作用する細胞浸透性の消光シアニン染料CytoCy5S(商標)に基づく便利な遺伝子レポーターアッセイ系の開発をもたらし、それによって生きた哺乳動物細胞での遺伝子発現のレポーターとしてNTRを使用することを可能にした。
【0018】
レポーター遺伝子アッセイを確立するための方法は公知である(Schenbom,E.,Groskreutz,D.,Reporter gene vectors and assays,Mol.Biotechnol.,(1999),13(1),29−44)。好適には、レポーター遺伝子はプロモーター又は最小プロモーターと共に存在するエンハンサーの転写制御下に置かれる。安定細胞系の生成のためには、プロモーター+レポーター遺伝子がプラスミド又はレトロウイルスのような適用なベクター中に挿入される。かかるベクターは、例えば、抗生物質(例えば、ネオマイシン)のような増殖抑制化合物に対する抵抗性を与える選択マーカーを含むレンチウイルス(Kafri,T.,Gene delivery by lentivirus vectors an overview,Methods Mol.Biol.,(2004),246,367−90)である。レポーターDNA構築物は細胞中に導入され、宿主細胞系のゲノム中に安定に組み込まれることで、操作細胞が抵抗性を有する適当な抗生物質の存在下で選択的に培養できる安定なレポーター細胞系を与える。別法として、アデノウイルスベクター(Hitt,M.M.,Addison,C.L.,Graham,F.L.,Human adenovirus vectors for gene tranfer into mammalian cells,Adv.Pharmacol.,(1997),40,137−206)を用いて宿主細胞の一過性トランスダクションを好適に実施することもできる。ベクターDNA分子は宿主クロマチン中に組み込まれず、通例は細胞タイプに応じて24〜96時間の寿命をもった染色体外分子として存在する。
【0019】
安定なトランスフェクションは、宿主ゲノム(即ち、遺伝し得る遺伝子型)中に組み込まれたレポーター遺伝子+選択マーカーを含む細胞系を与える。大量の細胞が要求されかつ長期間にわたって発現を持続させなければならない一次スクリーニングのような用途のためには、本発明の方法では安定にトランスフェクトされた細胞系が好ましいはずである。
【0020】
さらに別の実施形態では、凍結保存に先立ってバルク培養物にプラスミド又はウイルスベクターを添加するか、或いは凍結保存から戻した細胞のアリコートにプラスミド又はウイルスベクターを添加することにより、粒子状支持体表面上に増殖した細胞が細胞アッセイ成分(例えば、薬剤標的タンパク質)を一過的に発現させるように操作される。
【0021】
さらに別の実施形態では、粒子状支持体表面上での増殖前及び/又は後及び/又は凍結保存から戻す前又は戻した後に細胞に適用されるベクターの組合せを用いて細胞を操作することもできる。例えば、研究対象である薬剤標的(例えば、レセプター)を安定に発現させるため、支持体表面上での培養前にプラスミド又はレトロウイルスベクターを用いて宿主細胞系を操作できる。次いで、得られた安定な細胞系を粒子表面上においてバルク培養で増殖させ、粒子表面上で増殖している間にアデノウイルスベクターを用いて細胞アッセイ成分(例えば、レポーター遺伝子)を発現させるように追加の操作を施すことができる。単一又は複数の細胞操作プロセスを適用するためには、当業者にとって公知である多くの順列が可能であり、かかる順列は各種の細胞アッセイを実施する目的のための操作細胞を製造するのに適している。
【0022】
さらに別の実施形態では、細胞が支持体上でバルク培養されている間に試薬の溶液を添加することにより、化学又は生化学アッセイ試薬を単独で又は操作成分と組み合わせて細胞にプレロードすることもできる。その結果、凍結保存から戻した後に、追加の操作又は添加なしに細胞を選択されたアッセイで直ちに使用することができる。かかるアッセイ試薬を導入するための好適な方法には、細胞浸透性染料(例えば、Fluo−4(Invitrogen社、ペイズリー、英国)のような蛍光カルシウムセンサー)の使用、ペプチドキャリヤー(例えば、Chariot(Active Motif社、カリスバッド、米国))を用いた分子のデリバリー、或いは浸透圧ショックによる細胞中への分子のローディング(Ahmad,F.,Li,P.M.,Meyerovitch,J.,Goldstein,B.J.,Osmotic loading of neutralizing antibodies demonstrates a role for protein−tyrosine phosphatase 1B in negative regulation of the insulin action pathway,J.Biol.Chem.,(1995),270(35),20503−8)がある。
【0023】
別法として、細胞増殖に先立って粒子表面に試薬を共有結合で付着させる結果、細胞が表面を覆って増殖するのに伴い表面上で増殖する細胞の膜又は細胞質中に試薬が取り込まれることにより、細胞に細胞アッセイ成分又は試薬をプレロードすることもできる。好ましくは、共有結合による表面への試薬の付着は、細胞中への成分の取込みを可能にするため、柔軟なリンキング及びスペーシング部分を介して達成される。任意には、リンキング部分には、酵素のような細胞成分の作用を受けて表面からの成分の切離し及び細胞中への取込みを可能にする切断可能なリンカーを組み込むことができる。
【0024】
かかる化学又は生化学アッセイ試薬の例には、イオン感受性染料(例えば、Ca2+、K+)、酵素基質、酵素補助因子、レポーター遺伝子基質、蛍光染料、pH感受性染料、エネルギー転移染料及び蛍光サブセルラーイメージングマーカーがある。酵素基質の特定の例には、ルシフェリン、CytoCy5−S及びコエレンテラジンがある。イオン感受性染料の例には、Fura−2及びFluo−4がある。
【0025】
任意には、細胞はさらに、アッセイ標準化を可能にするための補助手段として支持体粒子の表面上で培養した細胞の可視化及び/又は定量化を可能にするマーカーで処理できる。支持体の表面上で増殖した細胞は、細胞アッセイに送達される細胞の定量化を可能にするための検出可能標識で標識することができ、検出可能標識の測定値を用いてアッセイ信号を正規化することで支持体上の細胞密度の変動を考慮することができる。即ち、粒子状支持体上に増殖した細胞には、バルク培養物に試薬を添加することで染料又は他のマーカー試薬をロードすることができる。好適なマーカーには、特に限定されないが、蛍光DNA染料(例えば、Hoechst 33342及びDRAQ5(BioStatus社、英国))又は膜染料(例えば、Dil及びDiO(Invitrogen社、ペイズリー、英国))がある。任意には、別法として又は追加として、細胞の生存能力をレポートする検出可能標識(例えば、Calcein AMエステル(Invitrogen社、ペイズリー、英国))で細胞を標識することもできる。任意には、別法として又は追加として、細胞アッセイにおける画像解析セグメンテーションを助ける検出可能標識で細胞を標識することもでき、好適なマーカーには蛍光DNA染料(例えば、DRAQ5(BioStatus社、英国))がある。
【0026】
さらに別の実施形態では、粒子状支持体表面上に増殖した細胞に対し、凍結保存に先立って細胞周期阻害剤(例えば、マイトマイシンC)の添加による増殖停止を施すことができる(Vasudevan,C.,Fursov,N.,Maunder,P.,Cong,M.,Federici,M.,Haskins,J.R.,Livelli,T.,Zhong,Z.,Improving high−content screening assay performance by using division−arrested cells,Assay Drug Dev.Tech.,(2005),3(5),515−23)。細胞の分裂停止は、細胞数が利用可能な増殖面積によって支持するには大きくなりすぎることなく、支持体表面上に増殖している細胞を標準組織培養条件下で維持状態に保つことを可能にし、凍結保存から戻した後にアッセイで細胞を使用するタイミングにさらなる融通性を与える。
【0027】
一実施形態では、粒子状支持体はデータ正規化のための内部アッセイ標準として使用するための検出可能なマーカー(例えば、蛍光染料、pH感受性染料又は固体センサー)を含むことができる。かかる検出可能なマーカーの使用は、細胞アッセイ中に存在する粒子状支持体の量の決定を可能にすると共に、検出可能標識の測定値を用いてアッセイ信号を正規化することでアッセイ間における粒子状支持体の量の変動(したがって細胞数の変動)を考慮することができる。別法として、検出可能なマーカーは、異なるやり方でエンコードされた表面が同一の細胞アッセイ中に共存している場合、かかる表面上で別々に増殖した2以上の細胞タイプの識別を可能にする。異種細胞集団の例には、表現型又は遺伝子型の異なる細胞(例えば、正常細胞及び腫瘍細胞)、細胞操作の異なる細胞(例えば、操作細胞及び非操作細胞)、並びに処理の異なる細胞(例えば、相異なる染料、センサー又はレポーターのプレローディング)がある。
【0028】
個別の細胞集団が対応する個別の識別可能な支持体粒子集団上に担持されているアッセイ中における2種以上の細胞集団の混合物は、粒子エンコーディングの存在しない粒子を用いて達成し得るものに比べてアッセイの複雑度の進歩を可能にする。かかるアッセイの例には、アッセイの多重化並びに応答性細胞及び非応答性細胞からの信号の比較がある。多重化は、例えば、同一のレポーター遺伝子及び基質を用いて2種の応答要素からのレポーター遺伝子活性の測定を達成するために使用できる。このアプローチでは、2種の細胞集団が2種の相異なる応答要素の制御下にある同一のレポーター遺伝子で操作され、かつ2種の細胞集団が2種の個別の識別可能な粒子集団上に支持されている場合、信号を2種の細胞集団の一方に個別に割り当てることができる。同様に、例えば一方の細胞タイプがシグナリング経路の鍵成分を欠いている場合、応答性細胞タイプ及び非応答性細胞タイプからのアッセイ信号の測定は、2種の識別可能な支持体粒子上にアッセイ用の細胞を用意することで達成できる。判別を達成するためには、アッセイ測定の進行中に適当な検出手段でコードを認識することがアッセイ中に存在する個別の細胞集団への検出アッセイ信号の割当てを可能にするように細胞増殖用の支持体材料をエンコードすることによって相異なる細胞集団を互いに識別できる。支持体をエンコードするのに適した方法には、特に限定されないが、サイズ及び形状のような物理的手段、染料の色又は蛍光のような光学的手段、並びに高周波エンコーディングの包含のような電子的手段がある。
【0029】
一実施形態では、粒子状支持体は、アッセイ信号生成方法の一部をなす検出可能なマーカー(例えば、蛍光染料又は消光染料)を含むことができる。かかる用途では、粒子状支持体は、アッセイの進行中に支持体に付随した細胞中又は細胞上で起こる生物学的イベントを表す検出可能な信号を生成する1種以上の成分を担持し又は組み込んでいる。支持体に付随したかかる信号生成手段の例には、特に限定されないが、蛍光体(例えば、FRET又はBRETパートナーを含む蛍光染料)、環境感受性センサー又は固体センサーの組込みがある。一実施形態では、エネルギー移動の目的で支持体中に蛍光染料を組み込むことにより、蛍光アッセイにおいて細胞由来の信号の発光波長シフトが達成され、或いは細胞蛍光体と支持体の蛍光体との間のFRET相互作用によって細胞の喪失又は細胞形状の変化が検出される。FRET(蛍光共鳴エネルギー移動)は、2つの染料分子の電子励起状態が光子の放出なしに相互作用する距離関連の過程である。Forster,T.,“Intermolecular Energy Transfer and Fluorescence”,Ann.Physik.,Vol.2,p.55,(1948)を参照されたい。この相互作用の1つの結果は、ドナー分子の励起がアクセプター分子からの蛍光発光をもたらすことである。FRETが起こるためには、好適にはドナー及びアクセプター染料分子が(通例は10〜100Åの範囲内で)近接していなければならない。これは、エネルギー移動効率がドナー分子とアクセプター分子との距離(r)の6乗に逆比例して減少するからである。好適には、本発明では、細胞又は支持体がドナー蛍光体又はアクセプター蛍光体を担持することができ、またその逆も可能である。ドナーとは、その染料部分が光からエネルギーを吸収し、少なくとも部分的にはアクセプターの吸収スペクトルの範囲内にある波長の光を放出できることを意味する。アクセプターとは、その染料部分がドナー染料部分から放出された波長の光を吸収できることを意味する。好適には、ドナー染料分子の発光スペクトルの少なくとも一部とアクセプター染料分子の吸収スペクトルとの間に重なりが存在する。好適には、アクセプター染料の発光極大の波長はドナー染料の発光極大の波長より長い。FRETペアの一方式では、アクセプター分子はドナー蛍光体に近接した非蛍光(又は消光)部分であり得る。この方式では、ドナー染料の励起は非蛍光アクセプターへのエネルギー移動をもたらし、エネルギーは蛍光ではなく熱として放散される。例えば連結結合の切断によってドナー部分とアクセプター部分とを分離すれば、アクセプターの消光効果が除去され、励起されたドナーからの蛍光発光が可能となる。
【0030】
FRETのこれらの特性を本発明に適用すれば、細胞を増殖させた支持体粒子がアッセイの構成部分となる細胞アッセイを実施することができる。かかるアッセイには、粒子上の細胞の各々をFRETドナー及びアクセプターペアの一方で標識し、ビーズの表面に強固に付着した細胞の増殖がドナー及びアクセプター部分をFRETが起こるのに十分な程度まで接近させることにより、細胞形態に対する試験化合物の毒性効果又は他の効果を検出するためのアッセイがある。細胞の形状の変化(例えば、毒性化合物に応答した細胞の球状化)はFRETパートナー間の距離を増加させ、その結果として観測される信号の変調を増加させる。
【0031】
本発明のさらに別の実施形態では、粒子状支持体は、凍結保存の前又は後において支持体表面及び付随した細胞に機械的手段又は流体手段による選別を施すための物理的選択手段を含む。本発明方法の若干の用途では、例えば、生存能力のない細胞をもった粒子を分離して廃棄するため、或いはベクターを用いて導入された細胞マーカーを発現している細胞をもった粒子を分離して保留するため、凍結保存に先立って特定の細胞集団の単離を実施することが有利であり得る。本発明方法のさらに別の用途では、凍結保存から戻した後に、かつ判別刺激に続いて現れる細胞の所望表現型を識別して単離するための細胞分析後に特定の細胞集団の単離を実施することが有利であり得る。これが該当するのは、例えば、支持体表面上で培養される細胞が幹細胞系であり、幹細胞を所望の表現型に判別するのに適した一定範囲の処理又は条件でスクリーニングを行うために細胞アッセイが実施された場合である。この場合、判別された細胞表現型を担持する支持体粒子を選別して保留することが望ましいであろう。かかる分離を達成するためには、支持体粒子の表面、内部又は全体を改質することで、個々の支持体粒子上に担持された個別細胞集団の選択及び/又は分離を助けるように、例えば差別的な密度、差別的な磁気的性質、及び定義された水溶液への差別的な溶解をはじめとする物理的性質を変化させればよい。
【0032】
蛍光検出を用いるアッセイ信号の測定は、検出器として光電子増倍管を組み込んだ計測器を用いて行うことができ、或いは別法として電荷結合素子(CCD)又は相補型金属酸化物半導体(CMOS)イメージャーを用いるイメージングによって行うことができる。例えば、マイクロウェルプレート方式でアッセイを実施する場合、LEADseeker(商標)イメージングシステム(GE Healthcare社)を用いてマイクロウェルプレートのすべてのウェルのエリアイメージングを簡便に実施でき、これは高密度マイクロウェルプレートのイメージングをただ1回のパスで可能にする。イメージングは定量的かつ迅速であり、イメージング用途のために適した計測器構成は今ではマルチウェルプレートの全体のイメージングを同時に行うことができる。細胞パラメーターに関する試験剤の活性の測定のためにアッセイがフォーマットされる場合には、かかるアッセイを連続測定下で実施することで動力学的調査をリアルタイムで実施できる。別法として、個々の細胞応答の分析が必要な場合には、適当な高スループットサブセルラーイメージング計測器構成(例えば、IN Cell Analyser 1000(GE Healthcare社))が使用できる。
【0033】
本発明の方法は、上記に記載されかつ図1Aに図示された先行技術の方法から大きくかけ離れており、それにまさるいくつかの利点を提供する。本発明に従えば(図1B及び1C)、本方法の細胞培養段階(B)及びスクリーニングアッセイ段階(C)は2つの不連続部分に分けられている。細胞培養段階(B)では、マイクロキャリヤー培養で細胞を所要細胞数まで増殖させるが、この所要細胞数はスクリーニングの要件を満たすために必要な細胞数以下であってよい。アッセイ成分又は試薬を細胞中にプレロードし、凍結保護剤をバルク培養物に添加し、培養物をアリコートに小分けし、アリコートを凍結して低温貯蔵状態で(本質的に無期限に)貯蔵する。必要に応じてこのプロセスを順次に又は並行して繰り返すことで、予想されるスクリーニング要求量を満たすのに十分な細胞の低温貯蔵アリコートを蓄積することができる。スクリーニングアッセイ(C)を実施するためには、マイクロキャリヤービーズ上の凍結細胞の1以上のアリコートを解凍し、所期のアッセイのために適したマイクロウェルプレートのウェル内にビーズを分配し、細胞をアッセイで直ちに使用する。
【0034】
さらに、本発明の方法は上述した通常の方法の欠点を解消する。第一に、細胞培養プロセス及びスクリーニングプロセスが今では時間的に分離されている。細胞培養プロセスは、スクリーニングプロセスから時間的及び/又は地理的に隔離した状態で実施できる。スクリーニングプロセスのスケジューリング又は設備利用可能性にかかわらず、細胞培養プロセスの要求条件のみによって決定される好都合な場所及び/又は時間において細胞を培養し、単一バッチ又は複数バッチとして数を拡大することができる。こうして得られたマイクロキャリヤービーズ上の凍結細胞のアリコートは、後日において直ちにスクリーニングの要件を満たしながら消費できる保存物として貯蔵でき、要求があれば培養実験室から遠隔のスクリーニング施設へ容易に輸送できる。細胞増殖プロセスをスクリーニングプロセスから切り離したことの利益に加えて、本発明の方法では、アッセイに先立ってアッセイウェル内で細胞を培養する必要性が回避される。細胞を低温貯蔵から戻し、直接にアッセイウェル内に分配し、ビーズ上に存在するままの細胞を用いてアッセイを実施するので、細胞は培養表面からの除去に伴う代謝損傷又はタンパク質分解損傷を受けない。これにより、スクリーニングに先立って細胞の保存物をアッセイプレート中で増殖させる必要なしに、細胞の凍結保存物から直接にスクリーニングを開始できる。細胞は凍結保存物から「ジャスト・イン・タイム」方式で供給されるので、スクリーニングの即時要求(例えば、1日だけのアッセイ)のために必要な細胞のみを一度に使用すれば事足りる。したがって、例えば装置の故障のためにスクリーニングプロセスに問題が起これば、スクリーニング作業を中断し、装置の補修後に新しい細胞供給物を用いて再開することができる。先行技術の通常の方法では、スクリーニング段階の遅れはスクリーニング全体を駄目にする可能性があり、数週間の仕事が無駄になることがある。これは、連結された細胞増殖段階及びスクリーニング段階を一度開始すると、スクリーニングプロセスの遅れに対処するためにプロセス全体のスケジューリングを変更できないからである。
【0035】
以下の実施例及び図面を参照することで本発明を例示する。図面中では、
図1は、通常のアッセイ手順(1A)及び本発明に係るアッセイ手順(1B及び1C)を流れ図によって示す。
【0036】
図2は、本発明に係る方法を示す略図である。
【0037】
図3は、マイクロキャリヤービーズ上で増殖させかつ凍結保存に先立ってFluo−4をプレロードした細胞を用いて実施したカルシウム放出アッセイを示すプロットである。
【実施例】
【0038】
実施例1
U2OS細胞におけるヒスタミン誘発カルシウム放出のアッセイ
i)製造者の指示に従い、10%(v/v)ウシ胎児血清(Sigma社)を追加したDMEM培地(Invitrogen社)中においてU2OS骨肉腫細胞をコラーゲン被覆Cytodex 3マイクロキャリヤー(GE Healthcare社)上で増殖させた。培養物が所要の体積及び細胞密度に達した後、ビーズ上の細胞に1μM Fluo−4(Invitrogen社)をロードした。マイクロキャリヤーを沈降させ、増殖培地を除去して1%BSA及び1μM Fluo−4(Invitrogen社)を含むカルシウムフラックス緩衝液(145mM塩化ナトリウム、5mM塩化カリウム、1mM硫酸マグネシウム、10mM HEPES、10mM D−グルコース、1mM塩化カルシウム)と交換し、細胞を37℃で40分間インキュベートした。ビーズを沈降させ、カルシウムフラックス緩衝液を除去して10%(v/v)ウシ胎児血清を追加したDMEM培地と交換し、凍結保護剤としてグリセロール(10%v/v最終濃度)を添加した。Fluo−4をロードしたビーズ上細胞を8×105細胞のアリコートに分け、1mlのアリコートを1℃/分の凍結速度で−140℃に凍結した。
【0039】
ii)細胞アッセイを開始するため、凍結保存細胞のバイアルを37℃の水浴中で急速に解凍し、ビーズ上細胞の懸濁液を1.5mlの分光蛍光計用キュベットに入れ、37℃で30分間平衡させた。Fluo−4に関する励起及び発光設定値を使用しながら、FluoroMax−3分光蛍光計を用いて経時的に蛍光測定値を求めた。対照細胞は、4500000蛍光単位の定常蛍光値を示した(図3、白丸)。第2のビーズ上細胞試料に対して20秒後に250mlの40mMヒスタミン溶液を添加したところ(矢印、図3)、Fluo−4蛍光値が5170000蛍光単位まで急速に上昇したが、これはヒスタミンによる細胞内カルシウム放出の刺激を表している。
【0040】
実施例2
下記の実施例は、レポーター遺伝子活性化のアッセイがいかにして実施できるかを例示している。
【0041】
i)製造者の指示に従い、10%(v/v)ウシ胎児血清(Sigma社)を追加したDMEM培地(Invitrogen社)中においてU2OS骨肉腫細胞をコラーゲン被覆Cytodex 3マイクロキャリヤービーズ(GE Healthcare社)上で増殖させる。ビーズ上の細胞は、組織培養インキュベーター内において、制御可能な磁気撹拌プラットホーム(VarioMag社)上の撹拌容器内に維持する。マイクロキャリヤー懸濁液をトリプシン処理して細胞を除去し、次いで新しいマイクロキャリヤービーズを添加して細胞増殖のために利用できる総面積を追加すると共に、培地を添加して培養物の体積を増加させることで、培養物をスケールアップする。培養物が所要の体積及び細胞密度に達した後、製造者の指示に従ってサイクリックAMP(CRE)応答要素(GDS40001 Ad−A−Gene CRE−NTR、GE Healthcare社)の制御下でニトロレダクターゼ(NTR)をエンコードするアデノウイルスのアリコートを培養物と混合する。ビーズ上の細胞を、6アデノウイルス粒子/細胞の感染多重度(moi)でAd−A−Gene CRE−NTRと共に24時間インキュベートする。細胞の凍結保存の準備のため、グリセロールを10%(v/v)の最終濃度に添加し、次いでマイクロキャリヤー懸濁液を細胞アッセイプレートの96のウェルに播種するのに十分な細胞を含むアリコートに分ける。マイクロキャリヤーのアリコートを、制御速度フリーザー内において、1℃/分の温度低下を使用しながら−70℃の温度に達するまで凍結する。次いで、アリコートを−150℃の貯蔵フリーザーに移す。
【0042】
ii)レポーター遺伝子アッセイを実施するため、細胞/ビーズ懸濁液のアリコートを37℃の水浴中で解凍し、懸濁液を100ml/ウェルで96ウェルマイクロタイタープレートのウェル内にピペット注入する。50mlの無血清培地中の化合物をウェルに添加することで、試験化合物によるレポーター遺伝子活性化をアッセイする。10ミリモル濃度のフォルスコリンを陽性対照アゴニストとして使用する。細胞を37℃で10分間インキュベートし、次いで10ミリモル濃度のCytoCy5S NTR基質(GE Healthcare社)10mlを各ウェルに添加する。細胞を37℃、5%CO2、95%湿度でさらに12〜16時間インキュベートしてNTR基質を活性化する。Tecan ULTRAマイクロプレートリーダーを用いて、CytoCy5S蛍光強度(励起:647nm、発光:667nm)を測定する。
【図面の簡単な説明】
【0043】
【図1】通常のアッセイ手順(1A)及び本発明に係るアッセイ手順(1B及び1C)を流れ図によって示す。
【図2】本発明に係る方法を示す略図である。
【図3】マイクロキャリヤービーズ上で増殖させかつ凍結保存に先立ってFluo−4をプレロードした細胞を用いて実施したカルシウム放出アッセイを示すプロットである。
【符号の説明】
【0044】
1 支持体
2 液体媒質
3 容器
6 アッセイ成分又は試薬
7 凍結保護剤
10 支持体上の細胞
11 凍結チャンバー
12 低温環境
19 ウェル
20 マルチウェルプレート
21 追加のアッセイ試薬
24 試験剤
25 試験剤が活性を示したウェル
【技術分野】
【0001】
本発明は細胞の保存及び貯蔵に関し、特に凍結保存細胞を用いる細胞ベースアッセイに関する。
【背景技術】
【0002】
高スループットスクリーニング(HTS)技術の適用は、新しい治療薬剤の発見及び開発のための細胞ベースアッセイを実施する機会を製薬業界に提供することにより、薬剤発見における工程変化を可能にした。HTSプロセスでは、生体系における可能な効果について及び特定の標的に対する選択リード化合物の特異性について薬剤候補がスクリーニングされる。一次スクリーニングへの取組みは、HTSアッセイプロセスの開発、及び96、384、864、1536又はそれ以上の小形ウェルを有しかつ100000試験/日を超えるスループットレベルを可能にするマイクロタイターウェルプレート方式を用いるアッセイの小形化によって行われてきた。これは各タイプの試験に対して多数の細胞の必要性を生み出したが、かかる試験は例えば特定の遺伝的に操作された細胞を含んでいる。次に、一次スクリーニングプロセス中に確認されたリード化合物は、化合物の生物学的適合性を検討するため、各種のアッセイにおいてさらなる精細スクリーニング及び試験を受ける必要がある。かかるアッセイは、生体適合性、代謝及び毒性に加えて、レセプター結合及び酵素活性アッセイを含むことがある。
【0003】
その結果、各回の一次スクリーニングについて何十億もの細胞を増殖させるための「培養」負担を克服するという大きな難題が存在している。通例、細胞はフラスコ及びローラーボトル内で培養される。1×1010個の細胞の増殖は、1回のアッセイ当たり10000個の細胞という値に基づけば、1000000回のアッセイを可能にするであろう。これには、約2000の大形フラスコを維持する必要があり、それによって大量の資源、プラスチック器具及び増殖培地成分が消費される。細胞培養方法におけるCytodex(商標)支持体粒子又は「マイクロキャリヤー」(GE Healthcare社)の使用は、増殖のための表面積を増加させることにより、足場依存性細胞の収量を向上させた。これらのマイクロキャリヤーの特性には、最大細胞増殖のための最適サイズ及び密度、撹拌培養のために強靱であるが剛性ではない支持体を与える生物学的に不活性なマトリックス、並びに付着細胞を容易に顕微鏡検査するための透明性がある。マイクロキャリヤーは、浮遊培養又は単層培養で使用して培養容器及び灌流チャンバーの表面積を増加させることができる。表面積の増加は、密度の増加した細胞、ウイルス及び細胞生産物の生産を可能にする。高スループット薬剤スクリーニング用の細胞を増殖させて製造するための通常のプロセス(図1A)では、保存培養物からの細胞をマイクロキャリヤービーズ上に播種することで細胞培養を開始する。次いで、薬剤スクリーニングを実施するために必要な数の細胞が生産されるまで、マイクロキャリヤー培養物を連続プロセスで拡大させる。所要数の細胞が単一バッチとして得られたならば、トリプシン処理又は他の手段で細胞をマイクロキャリヤービーズから引き離し、得られた細胞懸濁液をビーズから分離し、細胞を所期のアッセイに適したマイクロウェルプレートのウェル内に接種する。次いで、プレートを通例は1晩インキュベートすることで、細胞をウェルの表面に付着させ、マイクロキャリヤービーズからの分離プロセスから回復させた後にスクリーニングアッセイで使用する。
【0004】
通常のプロセスは、細胞の生産及び製薬用薬剤スクリーニング環境におけるスクリーニングアッセイの実施に関して2つの大きな欠点を有している。第一に、かかるプロセスは一度開始したら中断することができず、細胞培養及びスクリーニングプロセスを始めから終わりまで連続プロセスとして実施しなければならない。これは大きなスケジューリング上の問題を提起することがあり、装置の故障又はオペレーターの不在に対して被害を受けやすいことがある。例えば、スクリーニング段階で使用すべき装置(例えば、検出器)が動作しなければ、細胞培養物は使用できないので廃棄される。逆に、(例えば、汚染のため)細胞培養物に問題が起これば、細胞はスクリーニングの要求を満たすために送達されることがなく、高価な検出装置は遊んだ状態になる。第二に、通常のプロセスでは、マイクロウェルプレートへの分配に先立ち、通例は機械的手段又は酵素手段によってバルク培養細胞がマイクロキャリヤー支持体から回収される。連続プロセスでは、続くアッセイウェル内での細胞のインキュベーションのためには、通例はタンパク質分解酵素トリプシンを用いて実施される細胞−ビーズ分離中に受ける代謝ショック及び/又はタンパク質分解損傷から細胞を回復させることが必要である。この段階では、多数のアッセイプレートを組織培養条件下で貯蔵することが要求され、多大の設備及び人員が必要となる。本明細書中に記載する本発明は、ビーズ上での細胞貯蔵及びそれに続く細胞アッセイでの低温貯蔵細胞の利用のための手段を提供する。本発明は「アッセイ・オン・デマンド」のための機能の迅速な達成を可能にすると共に、アッセイの構成に関連した追加の利点を提供すると期待される。
【特許文献1】米国特許出願公開第2002/094543号明細書
【特許文献2】国際公開第99/21962号パンフレット
【特許文献3】英国特許出願公開第2059991号明細書
【非特許文献1】FURSOV NATALIE ET AL:ASSAY AND DRUG DEVELOPMENT TECHNOLOGIES,vol.3,no.1,February 2005,pages 7−15
【非特許文献2】YANAI N ET AL:BIOLOGICAL ABSTRACTS.−MICROFILMS,vol.88,no.9,1989,page AB240
【非特許文献3】DIGAN MARY ELLEN ET AL:JOURNAL OF BIOMOLECULAR SCREENING,vol.10,no.6,September 2005,pages 615−623
【発明の開示】
【0005】
本発明の第1の態様に従えば、細胞プロセスを測定するためのアッセイ方法であって、当該方法は
i)固体粒子に付着した培養細胞の集団を液体媒質中に用意する段階であって、前記細胞には前記アッセイを実施するための1種以上の成分がプレロードされており、前記粒子は細胞付着及び/又は細胞増殖のために適合している段階、
ii)培養細胞に1種以上の凍結保護剤を添加する段階、
iii)段階ii)からの前記細胞の別々のアリコートを低温での凍結保存に供する段階、
iv)段階iii)からの前記アリコートの1以上から得られる1以上の個別試料を別々の反応器に導入する段階、及び
v)前記アッセイを実施するための1種以上の追加試薬を前記反応器の各々に導入する段階
を含んでなり、前記細胞或いは前記試薬又は前記追加試薬の少なくとも1種が前記試薬及び前記細胞を合わせた後に光学信号を放出し又は光学信号の放出を誘起される検出可能なレポーターを含み、前記光学信号が前記細胞プロセスを測定するための手段として検出及び/又は定量化される方法が提供される。
【0006】
一実施形態では、細胞中にプレロードされるアッセイ成分は、細胞アッセイを実施するために必要な化学試薬であり得る。かかる化学試薬には、特に限定されないが、イオン感受性染料又は蛍光染料のような蛍光染料センサー、酵素基質、酵素補助因子、細胞刺激及びレセプターリガンドがある。この実施形態では、1種以上の追加アッセイ試薬を本方法の段階v)で細胞と合わせることで、研究中の細胞プロセスを開始させることができる。好適には、アッセイ混合物に添加されるアッセイ試薬の1種以上が、或いは別法としてプレロードされるアッセイ試薬が検出可能なレポーターで標識される。一実施形態では、研究中のアッセイは細胞カルシウム放出アッセイであり得るが、この場合にはプレロードされるアッセイ試薬はFluo−4のような蛍光カルシウムイオン感受性染料である。別の例では、細胞アッセイはレポーター遺伝子由来の活性のような酵素活性の検出に基づいており、この場合には凍結保存に先立って細胞中にプレロードされる化学試薬は酵素基質であり得る。哺乳動物細胞において各種の酵素遺伝子をレポーター遺伝子として使用する方法は公知である(総説としては、Naylor L.H.,Biochemical Pharmacology,(1999),58,749−757を参照されたい)。レポーター遺伝子は、遺伝子の生産物が他の細胞タンパク質の存在下で測定可能であるように選択され、宿主細胞中での遺伝子発現の変化に応答する選択された調節配列の制御下で細胞中に導入される。典型的な調節配列には、ホルモン、第二メッセンジャー及び他の細胞制御及びシグナリング因子に応答するものがある。適当な調節配列の選択により、レポーター遺伝子は、研究中の選択された調節配列が関与する細胞プロセスに対する添加薬剤の効果をアッセイするために使用できる。本発明に従って実施できるレポーター遺伝子アッセイの一例はルシフェラーゼレポーター遺伝子アッセイであり、この場合にはプレロードされる試薬はルシフェリン基質である。別の例は、国際公開第2005/118839号(GE Healthcare UK Limited)に記載されているようなニトロレダクターゼアッセイである。
【0007】
細胞アッセイの目的がアッセイで測定される細胞プロセスに対する阻害活性に関して化合物のスクリーニングを行うことである場合、プレロードされるアッセイ試薬は細胞プロセスに対する刺激剤であり得る。その結果、アッセイを実施するために細胞を凍結保存から取り出した場合、研究対象である細胞プロセスは直ちに阻害化合物の検出を行う準備ができた状態にアップレギュレートされている。アッセイの目的が細胞レセプターに対するリガンド結合の阻害に関して化合物のスクリーニングを行うことである場合、試薬は放射性標識レセプターリガンドであり得る。その結果、アッセイを実施するために細胞を凍結保存から取り出した場合、研究対象であるレセプターは既に検出可能なリガンドで占拠されており、続くアッセイの進行中にはそれの排除を阻害活性の指標として検出できる。要するに、本発明の方法によれば、細胞アッセイを実施するため細胞に通常添加される任意の化学試薬を凍結保存に先立って細胞中にプレロードできることが当業者には理解されよう。
【0008】
第2の実施形態では、細胞中にプレロードされるアッセイ成分は、一過的に発現される遺伝的にエンコードされたレポーターであり得る。かかるレポーターは、プラスミド又はウイルスベクター(通例はアデノウイルスベクター)によって細胞に導入できる。この実施形態に従えば、レポーターは検出可能なタンパク質、例えば緑色蛍光タンパク質及び赤色蛍光タンパク質(Tsien,R.et al,Nat.Methods,(2005),2(12),905−9)をはじめとする蛍光タンパク質からなる。好適な蛍光タンパク質は、Aequorea victoriaからの野生型GFP、及び野生型GFPのアミノ酸配列をアミノ酸欠失、付加又は置換によって改変した機能性GFP類似体のようなGFP誘導体を包含する。かかる蛍光タンパク質には、EGFP(Cormack,B.P.et al,Gene,(1996),173,33−38)、EYFP及びECFP(米国特許第6,066,476号、Tsien,R.et al)、F64L−GFP(米国特許第6,172,188号、Thastrup,O.et al)、BFP(米国特許第6,077,707号、Tsien,R.et al)がある。一過的に発現される遺伝的にエンコードされたレポーターの他の例には、(前述したように)ルシフェラーゼ、β−ラクタマーゼ及びニトロレダクターゼのような酵素があり、その発現は適当な酵素基質の添加によって測定できる。この実施形態では、レポータータンパク質をエンコードするDNA配列を含むベクターが凍結保存に先立って細胞に添加される。その結果、細胞を凍結保存から戻して所望の細胞アッセイを実施する場合、細胞はアッセイに必要な遺伝的にエンコードされたレポーターを発現できる。要するに、本発明の方法によれば、細胞アッセイを実施するため細胞に通常添加されてレポーターの一過性発現を生み出す任意の遺伝的にエンコードされたレポーターを凍結保存に先立って細胞中にプレロードできることが当業者には理解されよう。
【0009】
一実施形態では、細胞プロセスに対する試験剤の効果を測定するための方法であって、段階v)の前又は後に試験剤の試料をアッセイ混合物中に導入し、前記試験剤の不存在下及び存在下で測定される前記光学信号の変化が前記細胞プロセスに対する前記試験剤の効果を表す方法が提供される。別法として、試験剤の効果は、本方法の段階v)の前又は後に試験剤の試料を導入し、光学信号の測定値を対照値と比較することよっても求めることができる。対照値は、簡便にはデータベース又は他の電子フォーマットで電子的に記憶しておくことができる。
【発明を実施するための最良の形態】
【0010】
細胞プロセスとは、生細胞が受ける正常なプロセスを意味し、生合成、取込み、輸送、レセプター結合、代謝、融合、生化学的応答、増殖及び死滅を含む。(図2を参照しながら)本発明の方法に従えば、液体媒質[2]中に懸濁した支持体[1]上に細胞を増殖させる。この場合、必要に応じ、支持体は容器[3]内に含まれる細胞の付着及び増殖を可能にするように改質又は適合されている。細胞が支持体上で選択された増殖レベルに達した後には、追加の支持体材料を供給したさらに大きい容量の第2の容器[4]に支持体上の細胞を移すことでさらなる細胞増殖を達成できる。したがって、必要ならばさらにサイズ及び容量の増加した1以上の容器[5]に細胞を移すことを含め、このようにして所望数の細胞が得られるまで細胞数を拡大することができる。次に、支持体上に増殖した細胞にアッセイ成分又は試薬[6]をロードする。次に、表面上に増殖した細胞に適当な凍結保護剤[7]を添加して凍結保存の準備を行い、凍結保護剤混合物[8]中における支持体上の細胞[8]の懸濁液を容器[9]内のアリコートに分ける。容器[15]を凍結チャンバー[11]内の低温環境[12]に移すことで、凍結保存媒質[14]中に懸濁された支持体上の細胞[13]の凍結保存及び長期貯蔵を可能にする。
【0011】
細胞アッセイで細胞を使用するためには、液体媒質[17]中に懸濁された支持体に付着した凍結保存細胞を含む1以上の容器[16]を低温貯蔵から取り出し、周囲温度又は上昇温度に戻すことで、細胞ベースアッセイを実施するために適したマルチウェルプレート[20]のウェル[19]中に支持体表面上の細胞を分配することができる。アッセイプロトコルの要求に応じ、支持体表面上の細胞を含むウェル[23]に1以上の容器[22]内の追加のアッセイ試薬[21]を添加する。細胞集団中の細胞又はアッセイ試薬の1種以上は、試薬及び細胞を合わせた後に光学信号を放出し又は光学信号の放出を誘起される検出可能なレポーターで標識されており、光学信号は細胞プロセスを測定するための手段として検出及び/又は定量化される。アッセイウェルに試験剤[24]を添加し、アッセイを進行させてアッセイのリードアウトを生成することで、アッセイ中に試験剤が活性を示したウェル[25]を識別することができる。
【0012】
好適には、本発明の方法で使用するための支持体は粒子状支持体であり、付着した細胞の増殖を可能にするために適した任意の固体又は半固体材料からなる。好適には、支持体は細胞増殖培地中に浸漬され、支持体の懸濁液の分割によって複数の部分に分けることができる。粒子状支持体用の好適な材料には、特に限定されないが、プラスチック、ガラス又はポリマーの粒子又はビーズがある。好ましい粒子には、商業的に入手可能な細胞マイクロキャリヤー、特に架橋デキストランマイクロキャリヤー(例えば、Cytodex(GE Healthcare社))がある。
【0013】
本発明の方法で使用するのに適した細胞は、同じタイプの細胞の単一集団であってもよいし、或いは混合集団であってもよい。かかる細胞タイプは、付着性の原核細胞及び真核細胞、例えば細菌、酵母、昆虫細胞及び哺乳動物細胞から選択できる。その例には、幹細胞、分化幹細胞、一次細胞、形質転換細胞及び遺伝的に操作された細胞があり、これらの細胞は細胞の生存及び/又は増殖の維持のために粒子状支持体表面への付着を必要とすることを特徴とする。本発明に従った支持体上での細胞培養のためには、標準的な細胞培養技法の使用が必要である。例えば、細胞は給湿された95%空気/5%CO2雰囲気を含むインキュベーター内において37℃の無菌環境中で培養される。別法として、空気/5%CO2の雰囲気を含む密封容器内で細胞を培養することもできる。容器は撹拌培養物又は静置培養物を含むことができる。ウシ胎児血清のような未定義の生物学的液体を含む培地、並びに293SMFII無血清培地(Invitrogen、ペイズリー、英国)のような完全に定義された培地を含め、各種の細胞培養培地を使用することができる。各種細胞タイプの培養のために利用できる確立されたプロトコルが存在する。(例えば、Freshney,R.T.,Culture of Animal Cells:A Manual of Basic Techniques,2nd Edition,Alan R.Liss Inc.(1987)、Freshney,R.T.,Cloning and Selection of Specific Cell Types in Culture of Animal Cells,3rd Edition,Wiley−Liss Inc.(1994),p.161−178を参照されたい。)
一実施形態では、粒子状支持体上に増殖した細胞が、細胞アッセイセンサー又は検出可能なレポーター(例えば、蛍光タンパク質を発現し又は酵素を発現するレポーター遺伝子)を安定して発現して細胞アッセイリードアウトを与えるように操作される。
【0014】
別の実施形態では、粒子状支持体上に増殖した細胞が、凍結保存に先立ってバルク培養物にプラスミド又はウイルスベクターを添加することにより、細胞アッセイリードアウトを与える細胞アッセイセンサー又は検出可能なレポーターを一過的に発現させるように操作される。代わりの実施形態では、凍結保存から戻した細胞アリコートにプラスミド又はウイルスベクターを添加することにより、細胞アッセイリードアウトを与える細胞アッセイセンサー又は検出可能なレポーターを一過的に発現させるように、粒子状支持体上に増殖した細胞を操作することもできる。一過性発現のための好適なベクターには、特に限定されないが、プラスミド、アデノウイルス及びバキュロウイルスがある。
【0015】
レポーター遺伝子技術は、シグナルトランスダクション及び遺伝子発現に関連する細胞イベントをモニターするために広く使用されている。本発明の文脈中では、レポーター遺伝子という用語は、内因性タンパク質のバックグラウンドを越えて容易に識別できる容易に測定可能な表現型を有する遺伝子を定義するために使用される。レポーター遺伝子構築物は、例えば蛍ルシフェラーゼの発現を推進する活性化T細胞の核因子(NFAT)(Zhong,H.,Lee,D.,Robeva,A.,Minneman,K.P.,Life Sci.,(2001),68(19−20),2269−76)を用いて、レポーター遺伝子の発現を推進する誘導可能な転写制御要素を含んでいる。好適なレポーターには、特に限定されないが、酵素、蛍光タンパク質、発光タンパク質、融合タンパク質及びエピトープタグがある。酵素レポーターの例には、特に限定されないが、β−ガラクトシダーゼ、アルカリホスファターゼ、β−ラクタマーゼ、ルシフェラーゼ及びニトロレダクターゼがある。蛍光タンパク質の例には、特に限定されないが、Aequorea victoriaの緑色蛍光タンパク質及びその変異体がある。好適な発光タンパク質には、特に限定されないが、エクオリンがある。
【0016】
本発明に従って実施できるレポーター遺伝子アッセイの一例では、GFP或いは任意の機能性類似体(例えば、EGFP、YFP又はBFP(Shaner,N.C.,Steinbach,P.A.,Tsien,R.Y.,Nat.Methods,(2005),2(12),905−9))から導くことができる蛍光タンパク質をエンコードするヌクレオチド配列を含む核酸分子の導入によって操作された細胞が使用される。核酸分子は、発現制御配列に機能的に結合されかつその制御下にある。凍結保存から戻されかつ操作された核酸レポーター遺伝子配列を含む細胞は、研究対象であるタンパク質の発現のために適した条件下で培養される。次いで、GFP又は機能性GFP類似体の蛍光発光が研究対象であるタンパク質の発現を測定する手段としてモニターされる。かかる方法は、細胞中でのタンパク質の発現に対する試験剤の効果を検出及び比較するために使用できる。本発明の文脈中における「試験剤」という用語は、外部から適用される薬剤、ホルモン或いは別法として熱、ショック、pH変化などの環境刺激によるアゴニスト又はアンタゴニスト刺激を包括するものである。試験剤の存在下及び不存在下で得られる蛍光発光を比較することで、細胞中における研究対象のタンパク質の発現及び/又は局在に対する試験剤の効果を判定することが可能である。
【0017】
レポーター遺伝子アッセイの別の例は、細菌ニトロレダクターゼ(NTR)及び細胞浸透性シアニン染料類似体の使用に基づいている。ニトロレダクターゼは、Escherichia coli Bから単離されたFMN依存性酵素である。NTRの発現は多数の哺乳動物細胞で実証されている(米国特許第5,777,190号、Shah et al)。この酵素が蛍光消光したニトロ基含有染料のニトロ基を還元できることは、NTRの発現及びこの酵素の基質として作用する細胞浸透性の消光シアニン染料CytoCy5S(商標)に基づく便利な遺伝子レポーターアッセイ系の開発をもたらし、それによって生きた哺乳動物細胞での遺伝子発現のレポーターとしてNTRを使用することを可能にした。
【0018】
レポーター遺伝子アッセイを確立するための方法は公知である(Schenbom,E.,Groskreutz,D.,Reporter gene vectors and assays,Mol.Biotechnol.,(1999),13(1),29−44)。好適には、レポーター遺伝子はプロモーター又は最小プロモーターと共に存在するエンハンサーの転写制御下に置かれる。安定細胞系の生成のためには、プロモーター+レポーター遺伝子がプラスミド又はレトロウイルスのような適用なベクター中に挿入される。かかるベクターは、例えば、抗生物質(例えば、ネオマイシン)のような増殖抑制化合物に対する抵抗性を与える選択マーカーを含むレンチウイルス(Kafri,T.,Gene delivery by lentivirus vectors an overview,Methods Mol.Biol.,(2004),246,367−90)である。レポーターDNA構築物は細胞中に導入され、宿主細胞系のゲノム中に安定に組み込まれることで、操作細胞が抵抗性を有する適当な抗生物質の存在下で選択的に培養できる安定なレポーター細胞系を与える。別法として、アデノウイルスベクター(Hitt,M.M.,Addison,C.L.,Graham,F.L.,Human adenovirus vectors for gene tranfer into mammalian cells,Adv.Pharmacol.,(1997),40,137−206)を用いて宿主細胞の一過性トランスダクションを好適に実施することもできる。ベクターDNA分子は宿主クロマチン中に組み込まれず、通例は細胞タイプに応じて24〜96時間の寿命をもった染色体外分子として存在する。
【0019】
安定なトランスフェクションは、宿主ゲノム(即ち、遺伝し得る遺伝子型)中に組み込まれたレポーター遺伝子+選択マーカーを含む細胞系を与える。大量の細胞が要求されかつ長期間にわたって発現を持続させなければならない一次スクリーニングのような用途のためには、本発明の方法では安定にトランスフェクトされた細胞系が好ましいはずである。
【0020】
さらに別の実施形態では、凍結保存に先立ってバルク培養物にプラスミド又はウイルスベクターを添加するか、或いは凍結保存から戻した細胞のアリコートにプラスミド又はウイルスベクターを添加することにより、粒子状支持体表面上に増殖した細胞が細胞アッセイ成分(例えば、薬剤標的タンパク質)を一過的に発現させるように操作される。
【0021】
さらに別の実施形態では、粒子状支持体表面上での増殖前及び/又は後及び/又は凍結保存から戻す前又は戻した後に細胞に適用されるベクターの組合せを用いて細胞を操作することもできる。例えば、研究対象である薬剤標的(例えば、レセプター)を安定に発現させるため、支持体表面上での培養前にプラスミド又はレトロウイルスベクターを用いて宿主細胞系を操作できる。次いで、得られた安定な細胞系を粒子表面上においてバルク培養で増殖させ、粒子表面上で増殖している間にアデノウイルスベクターを用いて細胞アッセイ成分(例えば、レポーター遺伝子)を発現させるように追加の操作を施すことができる。単一又は複数の細胞操作プロセスを適用するためには、当業者にとって公知である多くの順列が可能であり、かかる順列は各種の細胞アッセイを実施する目的のための操作細胞を製造するのに適している。
【0022】
さらに別の実施形態では、細胞が支持体上でバルク培養されている間に試薬の溶液を添加することにより、化学又は生化学アッセイ試薬を単独で又は操作成分と組み合わせて細胞にプレロードすることもできる。その結果、凍結保存から戻した後に、追加の操作又は添加なしに細胞を選択されたアッセイで直ちに使用することができる。かかるアッセイ試薬を導入するための好適な方法には、細胞浸透性染料(例えば、Fluo−4(Invitrogen社、ペイズリー、英国)のような蛍光カルシウムセンサー)の使用、ペプチドキャリヤー(例えば、Chariot(Active Motif社、カリスバッド、米国))を用いた分子のデリバリー、或いは浸透圧ショックによる細胞中への分子のローディング(Ahmad,F.,Li,P.M.,Meyerovitch,J.,Goldstein,B.J.,Osmotic loading of neutralizing antibodies demonstrates a role for protein−tyrosine phosphatase 1B in negative regulation of the insulin action pathway,J.Biol.Chem.,(1995),270(35),20503−8)がある。
【0023】
別法として、細胞増殖に先立って粒子表面に試薬を共有結合で付着させる結果、細胞が表面を覆って増殖するのに伴い表面上で増殖する細胞の膜又は細胞質中に試薬が取り込まれることにより、細胞に細胞アッセイ成分又は試薬をプレロードすることもできる。好ましくは、共有結合による表面への試薬の付着は、細胞中への成分の取込みを可能にするため、柔軟なリンキング及びスペーシング部分を介して達成される。任意には、リンキング部分には、酵素のような細胞成分の作用を受けて表面からの成分の切離し及び細胞中への取込みを可能にする切断可能なリンカーを組み込むことができる。
【0024】
かかる化学又は生化学アッセイ試薬の例には、イオン感受性染料(例えば、Ca2+、K+)、酵素基質、酵素補助因子、レポーター遺伝子基質、蛍光染料、pH感受性染料、エネルギー転移染料及び蛍光サブセルラーイメージングマーカーがある。酵素基質の特定の例には、ルシフェリン、CytoCy5−S及びコエレンテラジンがある。イオン感受性染料の例には、Fura−2及びFluo−4がある。
【0025】
任意には、細胞はさらに、アッセイ標準化を可能にするための補助手段として支持体粒子の表面上で培養した細胞の可視化及び/又は定量化を可能にするマーカーで処理できる。支持体の表面上で増殖した細胞は、細胞アッセイに送達される細胞の定量化を可能にするための検出可能標識で標識することができ、検出可能標識の測定値を用いてアッセイ信号を正規化することで支持体上の細胞密度の変動を考慮することができる。即ち、粒子状支持体上に増殖した細胞には、バルク培養物に試薬を添加することで染料又は他のマーカー試薬をロードすることができる。好適なマーカーには、特に限定されないが、蛍光DNA染料(例えば、Hoechst 33342及びDRAQ5(BioStatus社、英国))又は膜染料(例えば、Dil及びDiO(Invitrogen社、ペイズリー、英国))がある。任意には、別法として又は追加として、細胞の生存能力をレポートする検出可能標識(例えば、Calcein AMエステル(Invitrogen社、ペイズリー、英国))で細胞を標識することもできる。任意には、別法として又は追加として、細胞アッセイにおける画像解析セグメンテーションを助ける検出可能標識で細胞を標識することもでき、好適なマーカーには蛍光DNA染料(例えば、DRAQ5(BioStatus社、英国))がある。
【0026】
さらに別の実施形態では、粒子状支持体表面上に増殖した細胞に対し、凍結保存に先立って細胞周期阻害剤(例えば、マイトマイシンC)の添加による増殖停止を施すことができる(Vasudevan,C.,Fursov,N.,Maunder,P.,Cong,M.,Federici,M.,Haskins,J.R.,Livelli,T.,Zhong,Z.,Improving high−content screening assay performance by using division−arrested cells,Assay Drug Dev.Tech.,(2005),3(5),515−23)。細胞の分裂停止は、細胞数が利用可能な増殖面積によって支持するには大きくなりすぎることなく、支持体表面上に増殖している細胞を標準組織培養条件下で維持状態に保つことを可能にし、凍結保存から戻した後にアッセイで細胞を使用するタイミングにさらなる融通性を与える。
【0027】
一実施形態では、粒子状支持体はデータ正規化のための内部アッセイ標準として使用するための検出可能なマーカー(例えば、蛍光染料、pH感受性染料又は固体センサー)を含むことができる。かかる検出可能なマーカーの使用は、細胞アッセイ中に存在する粒子状支持体の量の決定を可能にすると共に、検出可能標識の測定値を用いてアッセイ信号を正規化することでアッセイ間における粒子状支持体の量の変動(したがって細胞数の変動)を考慮することができる。別法として、検出可能なマーカーは、異なるやり方でエンコードされた表面が同一の細胞アッセイ中に共存している場合、かかる表面上で別々に増殖した2以上の細胞タイプの識別を可能にする。異種細胞集団の例には、表現型又は遺伝子型の異なる細胞(例えば、正常細胞及び腫瘍細胞)、細胞操作の異なる細胞(例えば、操作細胞及び非操作細胞)、並びに処理の異なる細胞(例えば、相異なる染料、センサー又はレポーターのプレローディング)がある。
【0028】
個別の細胞集団が対応する個別の識別可能な支持体粒子集団上に担持されているアッセイ中における2種以上の細胞集団の混合物は、粒子エンコーディングの存在しない粒子を用いて達成し得るものに比べてアッセイの複雑度の進歩を可能にする。かかるアッセイの例には、アッセイの多重化並びに応答性細胞及び非応答性細胞からの信号の比較がある。多重化は、例えば、同一のレポーター遺伝子及び基質を用いて2種の応答要素からのレポーター遺伝子活性の測定を達成するために使用できる。このアプローチでは、2種の細胞集団が2種の相異なる応答要素の制御下にある同一のレポーター遺伝子で操作され、かつ2種の細胞集団が2種の個別の識別可能な粒子集団上に支持されている場合、信号を2種の細胞集団の一方に個別に割り当てることができる。同様に、例えば一方の細胞タイプがシグナリング経路の鍵成分を欠いている場合、応答性細胞タイプ及び非応答性細胞タイプからのアッセイ信号の測定は、2種の識別可能な支持体粒子上にアッセイ用の細胞を用意することで達成できる。判別を達成するためには、アッセイ測定の進行中に適当な検出手段でコードを認識することがアッセイ中に存在する個別の細胞集団への検出アッセイ信号の割当てを可能にするように細胞増殖用の支持体材料をエンコードすることによって相異なる細胞集団を互いに識別できる。支持体をエンコードするのに適した方法には、特に限定されないが、サイズ及び形状のような物理的手段、染料の色又は蛍光のような光学的手段、並びに高周波エンコーディングの包含のような電子的手段がある。
【0029】
一実施形態では、粒子状支持体は、アッセイ信号生成方法の一部をなす検出可能なマーカー(例えば、蛍光染料又は消光染料)を含むことができる。かかる用途では、粒子状支持体は、アッセイの進行中に支持体に付随した細胞中又は細胞上で起こる生物学的イベントを表す検出可能な信号を生成する1種以上の成分を担持し又は組み込んでいる。支持体に付随したかかる信号生成手段の例には、特に限定されないが、蛍光体(例えば、FRET又はBRETパートナーを含む蛍光染料)、環境感受性センサー又は固体センサーの組込みがある。一実施形態では、エネルギー移動の目的で支持体中に蛍光染料を組み込むことにより、蛍光アッセイにおいて細胞由来の信号の発光波長シフトが達成され、或いは細胞蛍光体と支持体の蛍光体との間のFRET相互作用によって細胞の喪失又は細胞形状の変化が検出される。FRET(蛍光共鳴エネルギー移動)は、2つの染料分子の電子励起状態が光子の放出なしに相互作用する距離関連の過程である。Forster,T.,“Intermolecular Energy Transfer and Fluorescence”,Ann.Physik.,Vol.2,p.55,(1948)を参照されたい。この相互作用の1つの結果は、ドナー分子の励起がアクセプター分子からの蛍光発光をもたらすことである。FRETが起こるためには、好適にはドナー及びアクセプター染料分子が(通例は10〜100Åの範囲内で)近接していなければならない。これは、エネルギー移動効率がドナー分子とアクセプター分子との距離(r)の6乗に逆比例して減少するからである。好適には、本発明では、細胞又は支持体がドナー蛍光体又はアクセプター蛍光体を担持することができ、またその逆も可能である。ドナーとは、その染料部分が光からエネルギーを吸収し、少なくとも部分的にはアクセプターの吸収スペクトルの範囲内にある波長の光を放出できることを意味する。アクセプターとは、その染料部分がドナー染料部分から放出された波長の光を吸収できることを意味する。好適には、ドナー染料分子の発光スペクトルの少なくとも一部とアクセプター染料分子の吸収スペクトルとの間に重なりが存在する。好適には、アクセプター染料の発光極大の波長はドナー染料の発光極大の波長より長い。FRETペアの一方式では、アクセプター分子はドナー蛍光体に近接した非蛍光(又は消光)部分であり得る。この方式では、ドナー染料の励起は非蛍光アクセプターへのエネルギー移動をもたらし、エネルギーは蛍光ではなく熱として放散される。例えば連結結合の切断によってドナー部分とアクセプター部分とを分離すれば、アクセプターの消光効果が除去され、励起されたドナーからの蛍光発光が可能となる。
【0030】
FRETのこれらの特性を本発明に適用すれば、細胞を増殖させた支持体粒子がアッセイの構成部分となる細胞アッセイを実施することができる。かかるアッセイには、粒子上の細胞の各々をFRETドナー及びアクセプターペアの一方で標識し、ビーズの表面に強固に付着した細胞の増殖がドナー及びアクセプター部分をFRETが起こるのに十分な程度まで接近させることにより、細胞形態に対する試験化合物の毒性効果又は他の効果を検出するためのアッセイがある。細胞の形状の変化(例えば、毒性化合物に応答した細胞の球状化)はFRETパートナー間の距離を増加させ、その結果として観測される信号の変調を増加させる。
【0031】
本発明のさらに別の実施形態では、粒子状支持体は、凍結保存の前又は後において支持体表面及び付随した細胞に機械的手段又は流体手段による選別を施すための物理的選択手段を含む。本発明方法の若干の用途では、例えば、生存能力のない細胞をもった粒子を分離して廃棄するため、或いはベクターを用いて導入された細胞マーカーを発現している細胞をもった粒子を分離して保留するため、凍結保存に先立って特定の細胞集団の単離を実施することが有利であり得る。本発明方法のさらに別の用途では、凍結保存から戻した後に、かつ判別刺激に続いて現れる細胞の所望表現型を識別して単離するための細胞分析後に特定の細胞集団の単離を実施することが有利であり得る。これが該当するのは、例えば、支持体表面上で培養される細胞が幹細胞系であり、幹細胞を所望の表現型に判別するのに適した一定範囲の処理又は条件でスクリーニングを行うために細胞アッセイが実施された場合である。この場合、判別された細胞表現型を担持する支持体粒子を選別して保留することが望ましいであろう。かかる分離を達成するためには、支持体粒子の表面、内部又は全体を改質することで、個々の支持体粒子上に担持された個別細胞集団の選択及び/又は分離を助けるように、例えば差別的な密度、差別的な磁気的性質、及び定義された水溶液への差別的な溶解をはじめとする物理的性質を変化させればよい。
【0032】
蛍光検出を用いるアッセイ信号の測定は、検出器として光電子増倍管を組み込んだ計測器を用いて行うことができ、或いは別法として電荷結合素子(CCD)又は相補型金属酸化物半導体(CMOS)イメージャーを用いるイメージングによって行うことができる。例えば、マイクロウェルプレート方式でアッセイを実施する場合、LEADseeker(商標)イメージングシステム(GE Healthcare社)を用いてマイクロウェルプレートのすべてのウェルのエリアイメージングを簡便に実施でき、これは高密度マイクロウェルプレートのイメージングをただ1回のパスで可能にする。イメージングは定量的かつ迅速であり、イメージング用途のために適した計測器構成は今ではマルチウェルプレートの全体のイメージングを同時に行うことができる。細胞パラメーターに関する試験剤の活性の測定のためにアッセイがフォーマットされる場合には、かかるアッセイを連続測定下で実施することで動力学的調査をリアルタイムで実施できる。別法として、個々の細胞応答の分析が必要な場合には、適当な高スループットサブセルラーイメージング計測器構成(例えば、IN Cell Analyser 1000(GE Healthcare社))が使用できる。
【0033】
本発明の方法は、上記に記載されかつ図1Aに図示された先行技術の方法から大きくかけ離れており、それにまさるいくつかの利点を提供する。本発明に従えば(図1B及び1C)、本方法の細胞培養段階(B)及びスクリーニングアッセイ段階(C)は2つの不連続部分に分けられている。細胞培養段階(B)では、マイクロキャリヤー培養で細胞を所要細胞数まで増殖させるが、この所要細胞数はスクリーニングの要件を満たすために必要な細胞数以下であってよい。アッセイ成分又は試薬を細胞中にプレロードし、凍結保護剤をバルク培養物に添加し、培養物をアリコートに小分けし、アリコートを凍結して低温貯蔵状態で(本質的に無期限に)貯蔵する。必要に応じてこのプロセスを順次に又は並行して繰り返すことで、予想されるスクリーニング要求量を満たすのに十分な細胞の低温貯蔵アリコートを蓄積することができる。スクリーニングアッセイ(C)を実施するためには、マイクロキャリヤービーズ上の凍結細胞の1以上のアリコートを解凍し、所期のアッセイのために適したマイクロウェルプレートのウェル内にビーズを分配し、細胞をアッセイで直ちに使用する。
【0034】
さらに、本発明の方法は上述した通常の方法の欠点を解消する。第一に、細胞培養プロセス及びスクリーニングプロセスが今では時間的に分離されている。細胞培養プロセスは、スクリーニングプロセスから時間的及び/又は地理的に隔離した状態で実施できる。スクリーニングプロセスのスケジューリング又は設備利用可能性にかかわらず、細胞培養プロセスの要求条件のみによって決定される好都合な場所及び/又は時間において細胞を培養し、単一バッチ又は複数バッチとして数を拡大することができる。こうして得られたマイクロキャリヤービーズ上の凍結細胞のアリコートは、後日において直ちにスクリーニングの要件を満たしながら消費できる保存物として貯蔵でき、要求があれば培養実験室から遠隔のスクリーニング施設へ容易に輸送できる。細胞増殖プロセスをスクリーニングプロセスから切り離したことの利益に加えて、本発明の方法では、アッセイに先立ってアッセイウェル内で細胞を培養する必要性が回避される。細胞を低温貯蔵から戻し、直接にアッセイウェル内に分配し、ビーズ上に存在するままの細胞を用いてアッセイを実施するので、細胞は培養表面からの除去に伴う代謝損傷又はタンパク質分解損傷を受けない。これにより、スクリーニングに先立って細胞の保存物をアッセイプレート中で増殖させる必要なしに、細胞の凍結保存物から直接にスクリーニングを開始できる。細胞は凍結保存物から「ジャスト・イン・タイム」方式で供給されるので、スクリーニングの即時要求(例えば、1日だけのアッセイ)のために必要な細胞のみを一度に使用すれば事足りる。したがって、例えば装置の故障のためにスクリーニングプロセスに問題が起これば、スクリーニング作業を中断し、装置の補修後に新しい細胞供給物を用いて再開することができる。先行技術の通常の方法では、スクリーニング段階の遅れはスクリーニング全体を駄目にする可能性があり、数週間の仕事が無駄になることがある。これは、連結された細胞増殖段階及びスクリーニング段階を一度開始すると、スクリーニングプロセスの遅れに対処するためにプロセス全体のスケジューリングを変更できないからである。
【0035】
以下の実施例及び図面を参照することで本発明を例示する。図面中では、
図1は、通常のアッセイ手順(1A)及び本発明に係るアッセイ手順(1B及び1C)を流れ図によって示す。
【0036】
図2は、本発明に係る方法を示す略図である。
【0037】
図3は、マイクロキャリヤービーズ上で増殖させかつ凍結保存に先立ってFluo−4をプレロードした細胞を用いて実施したカルシウム放出アッセイを示すプロットである。
【実施例】
【0038】
実施例1
U2OS細胞におけるヒスタミン誘発カルシウム放出のアッセイ
i)製造者の指示に従い、10%(v/v)ウシ胎児血清(Sigma社)を追加したDMEM培地(Invitrogen社)中においてU2OS骨肉腫細胞をコラーゲン被覆Cytodex 3マイクロキャリヤー(GE Healthcare社)上で増殖させた。培養物が所要の体積及び細胞密度に達した後、ビーズ上の細胞に1μM Fluo−4(Invitrogen社)をロードした。マイクロキャリヤーを沈降させ、増殖培地を除去して1%BSA及び1μM Fluo−4(Invitrogen社)を含むカルシウムフラックス緩衝液(145mM塩化ナトリウム、5mM塩化カリウム、1mM硫酸マグネシウム、10mM HEPES、10mM D−グルコース、1mM塩化カルシウム)と交換し、細胞を37℃で40分間インキュベートした。ビーズを沈降させ、カルシウムフラックス緩衝液を除去して10%(v/v)ウシ胎児血清を追加したDMEM培地と交換し、凍結保護剤としてグリセロール(10%v/v最終濃度)を添加した。Fluo−4をロードしたビーズ上細胞を8×105細胞のアリコートに分け、1mlのアリコートを1℃/分の凍結速度で−140℃に凍結した。
【0039】
ii)細胞アッセイを開始するため、凍結保存細胞のバイアルを37℃の水浴中で急速に解凍し、ビーズ上細胞の懸濁液を1.5mlの分光蛍光計用キュベットに入れ、37℃で30分間平衡させた。Fluo−4に関する励起及び発光設定値を使用しながら、FluoroMax−3分光蛍光計を用いて経時的に蛍光測定値を求めた。対照細胞は、4500000蛍光単位の定常蛍光値を示した(図3、白丸)。第2のビーズ上細胞試料に対して20秒後に250mlの40mMヒスタミン溶液を添加したところ(矢印、図3)、Fluo−4蛍光値が5170000蛍光単位まで急速に上昇したが、これはヒスタミンによる細胞内カルシウム放出の刺激を表している。
【0040】
実施例2
下記の実施例は、レポーター遺伝子活性化のアッセイがいかにして実施できるかを例示している。
【0041】
i)製造者の指示に従い、10%(v/v)ウシ胎児血清(Sigma社)を追加したDMEM培地(Invitrogen社)中においてU2OS骨肉腫細胞をコラーゲン被覆Cytodex 3マイクロキャリヤービーズ(GE Healthcare社)上で増殖させる。ビーズ上の細胞は、組織培養インキュベーター内において、制御可能な磁気撹拌プラットホーム(VarioMag社)上の撹拌容器内に維持する。マイクロキャリヤー懸濁液をトリプシン処理して細胞を除去し、次いで新しいマイクロキャリヤービーズを添加して細胞増殖のために利用できる総面積を追加すると共に、培地を添加して培養物の体積を増加させることで、培養物をスケールアップする。培養物が所要の体積及び細胞密度に達した後、製造者の指示に従ってサイクリックAMP(CRE)応答要素(GDS40001 Ad−A−Gene CRE−NTR、GE Healthcare社)の制御下でニトロレダクターゼ(NTR)をエンコードするアデノウイルスのアリコートを培養物と混合する。ビーズ上の細胞を、6アデノウイルス粒子/細胞の感染多重度(moi)でAd−A−Gene CRE−NTRと共に24時間インキュベートする。細胞の凍結保存の準備のため、グリセロールを10%(v/v)の最終濃度に添加し、次いでマイクロキャリヤー懸濁液を細胞アッセイプレートの96のウェルに播種するのに十分な細胞を含むアリコートに分ける。マイクロキャリヤーのアリコートを、制御速度フリーザー内において、1℃/分の温度低下を使用しながら−70℃の温度に達するまで凍結する。次いで、アリコートを−150℃の貯蔵フリーザーに移す。
【0042】
ii)レポーター遺伝子アッセイを実施するため、細胞/ビーズ懸濁液のアリコートを37℃の水浴中で解凍し、懸濁液を100ml/ウェルで96ウェルマイクロタイタープレートのウェル内にピペット注入する。50mlの無血清培地中の化合物をウェルに添加することで、試験化合物によるレポーター遺伝子活性化をアッセイする。10ミリモル濃度のフォルスコリンを陽性対照アゴニストとして使用する。細胞を37℃で10分間インキュベートし、次いで10ミリモル濃度のCytoCy5S NTR基質(GE Healthcare社)10mlを各ウェルに添加する。細胞を37℃、5%CO2、95%湿度でさらに12〜16時間インキュベートしてNTR基質を活性化する。Tecan ULTRAマイクロプレートリーダーを用いて、CytoCy5S蛍光強度(励起:647nm、発光:667nm)を測定する。
【図面の簡単な説明】
【0043】
【図1】通常のアッセイ手順(1A)及び本発明に係るアッセイ手順(1B及び1C)を流れ図によって示す。
【図2】本発明に係る方法を示す略図である。
【図3】マイクロキャリヤービーズ上で増殖させかつ凍結保存に先立ってFluo−4をプレロードした細胞を用いて実施したカルシウム放出アッセイを示すプロットである。
【符号の説明】
【0044】
1 支持体
2 液体媒質
3 容器
6 アッセイ成分又は試薬
7 凍結保護剤
10 支持体上の細胞
11 凍結チャンバー
12 低温環境
19 ウェル
20 マルチウェルプレート
21 追加のアッセイ試薬
24 試験剤
25 試験剤が活性を示したウェル
【特許請求の範囲】
【請求項1】
細胞プロセスを測定するためのアッセイ方法であって、当該方法は
i)固体粒子に付着した培養細胞の集団を液体媒質中に用意する段階であって、前記細胞には前記アッセイを実施するための1種以上の成分がプレロードされており、前記粒子は細胞付着及び/又は細胞増殖のために適合している段階、
ii)培養細胞に1種以上の凍結保護剤を添加する段階、
iii)段階ii)からの前記細胞の別々のアリコートを低温での凍結保存に供する段階、
iv)段階iii)からの前記アリコートの1以上から得られる1以上の個別試料を別々の反応器に導入する段階、及び
v)前記アッセイを実施するための1種以上の追加試薬を前記反応器の各々に導入する段階
を含んでなり、前記細胞或いは前記試薬又は前記追加試薬の少なくとも1種が前記試薬及び前記細胞を合わせた後に光学信号を放出し又は光学信号の放出を誘起される検出可能なレポーターを含み、前記光学信号が前記細胞プロセスを測定するための手段として検出及び/又は定量化される、方法。
【請求項2】
細胞中にプレロードされるアッセイ成分が細胞アッセイを実施するために必要な化学試薬である、請求項1記載の方法。
【請求項3】
細胞に前記1種以上の凍結保護剤を添加するのに先立ち、液体媒質に試薬を添加することによって前記細胞に前記試薬がプレロードされる、請求項2記載の方法。
【請求項4】
前記試薬が、イオン感受性染料、酵素基質、酵素補助因子、レポーター遺伝子基質、蛍光染料、細胞刺激、レセプターリガンド及び蛍光サブセルラーイメージングマーカーから選択される、請求項2又は請求項3に記載の方法。
【請求項5】
前記細胞に一過的に発現される遺伝的にエンコードされたレポーターがプレロードされる、請求項1記載の方法。
【請求項6】
凍結保存に先立って前記液体媒質にプラスミド又はウイルスベクターを添加することにより、前記細胞が検出可能なレポーターを一過的に発現させるように操作される、請求項5記載の方法。
【請求項7】
前記レポーターが酵素である、請求項5又は請求項6に記載の方法。
【請求項8】
前記酵素が、β−ガラクトシダーゼ、アルカリホスファターゼ、β−ラクタマーゼ、ルシフェラーゼ及びニトロレダクターゼから選択される、請求項7記載の方法。
【請求項9】
前記酵素がニトロレダクターゼである、請求項7又は請求項8に記載の方法。
【請求項10】
前記レポーターが蛍光タンパク質である、請求項5又は請求項6に記載の方法。
【請求項11】
前記レポーターがGFP又はGFP融合タンパク質である、請求項10記載の方法。
【請求項12】
段階v)が試験剤の不存在下及び存在下で実施され、前記試験剤の不存在下及び存在下で測定された前記光学信号の変化が前記細胞プロセスに対する前記試験剤の効果を表す、請求項1記載の方法。
【請求項13】
段階v)が試験剤の存在下で実施され、前記試験剤の存在下で測定された光学信号が対照値と比較される、請求項1記載の方法。
【請求項14】
前記細胞が、幹細胞、分化幹細胞、一次細胞、形質転換細胞及び遺伝的に操作された細胞から選択される、請求項1乃至請求項13のいずれか1項記載の方法。
【請求項15】
前記細胞が、細菌細胞、酵母細胞、昆虫細胞及び哺乳動物細胞から選択される、請求項14記載の方法。
【請求項16】
前記細胞が細胞の混合集団からなる、請求項1記載の方法。
【請求項17】
細胞増殖に先立って粒子表面に試薬を共有結合で付着させる結果、表面上で増殖する前記細胞の膜又は細胞質中に試薬が取り込まれることにより、細胞に前記試薬がプレロードされる、請求項1乃至請求項4のいずれか1項記載の方法。
【請求項18】
凍結保存に先立って細胞周期阻害剤を添加することで前記細胞が増殖停止を受ける、請求項1乃至請求項17のいずれか1項記載の方法。
【請求項19】
前記細胞周期阻害剤がマイトマイシンCである、請求項18記載の方法。
【請求項20】
前記粒子状支持体が検出可能なマーカーでエンコードされる、請求項1乃至請求項19のいずれか1項記載の方法。
【請求項21】
前記マーカーが、蛍光染料、pH感受性染料、蛍光タンパク質及び固体センサーから選択される、請求項20記載の方法。
【請求項22】
前記細胞が機械的手段又は流体手段による選別を受ける、請求項1乃至請求項21のいずれか1項記載の方法。
【請求項23】
前記検出及び/又は定量化段階がイメージングによって実施される、請求項1乃至請求項22のいずれか1項記載の方法。
【請求項24】
前記細胞プロセスの測定がリアルタイムで実施される、請求項1乃至請求項23のいずれか1項記載の方法。
【請求項1】
細胞プロセスを測定するためのアッセイ方法であって、当該方法は
i)固体粒子に付着した培養細胞の集団を液体媒質中に用意する段階であって、前記細胞には前記アッセイを実施するための1種以上の成分がプレロードされており、前記粒子は細胞付着及び/又は細胞増殖のために適合している段階、
ii)培養細胞に1種以上の凍結保護剤を添加する段階、
iii)段階ii)からの前記細胞の別々のアリコートを低温での凍結保存に供する段階、
iv)段階iii)からの前記アリコートの1以上から得られる1以上の個別試料を別々の反応器に導入する段階、及び
v)前記アッセイを実施するための1種以上の追加試薬を前記反応器の各々に導入する段階
を含んでなり、前記細胞或いは前記試薬又は前記追加試薬の少なくとも1種が前記試薬及び前記細胞を合わせた後に光学信号を放出し又は光学信号の放出を誘起される検出可能なレポーターを含み、前記光学信号が前記細胞プロセスを測定するための手段として検出及び/又は定量化される、方法。
【請求項2】
細胞中にプレロードされるアッセイ成分が細胞アッセイを実施するために必要な化学試薬である、請求項1記載の方法。
【請求項3】
細胞に前記1種以上の凍結保護剤を添加するのに先立ち、液体媒質に試薬を添加することによって前記細胞に前記試薬がプレロードされる、請求項2記載の方法。
【請求項4】
前記試薬が、イオン感受性染料、酵素基質、酵素補助因子、レポーター遺伝子基質、蛍光染料、細胞刺激、レセプターリガンド及び蛍光サブセルラーイメージングマーカーから選択される、請求項2又は請求項3に記載の方法。
【請求項5】
前記細胞に一過的に発現される遺伝的にエンコードされたレポーターがプレロードされる、請求項1記載の方法。
【請求項6】
凍結保存に先立って前記液体媒質にプラスミド又はウイルスベクターを添加することにより、前記細胞が検出可能なレポーターを一過的に発現させるように操作される、請求項5記載の方法。
【請求項7】
前記レポーターが酵素である、請求項5又は請求項6に記載の方法。
【請求項8】
前記酵素が、β−ガラクトシダーゼ、アルカリホスファターゼ、β−ラクタマーゼ、ルシフェラーゼ及びニトロレダクターゼから選択される、請求項7記載の方法。
【請求項9】
前記酵素がニトロレダクターゼである、請求項7又は請求項8に記載の方法。
【請求項10】
前記レポーターが蛍光タンパク質である、請求項5又は請求項6に記載の方法。
【請求項11】
前記レポーターがGFP又はGFP融合タンパク質である、請求項10記載の方法。
【請求項12】
段階v)が試験剤の不存在下及び存在下で実施され、前記試験剤の不存在下及び存在下で測定された前記光学信号の変化が前記細胞プロセスに対する前記試験剤の効果を表す、請求項1記載の方法。
【請求項13】
段階v)が試験剤の存在下で実施され、前記試験剤の存在下で測定された光学信号が対照値と比較される、請求項1記載の方法。
【請求項14】
前記細胞が、幹細胞、分化幹細胞、一次細胞、形質転換細胞及び遺伝的に操作された細胞から選択される、請求項1乃至請求項13のいずれか1項記載の方法。
【請求項15】
前記細胞が、細菌細胞、酵母細胞、昆虫細胞及び哺乳動物細胞から選択される、請求項14記載の方法。
【請求項16】
前記細胞が細胞の混合集団からなる、請求項1記載の方法。
【請求項17】
細胞増殖に先立って粒子表面に試薬を共有結合で付着させる結果、表面上で増殖する前記細胞の膜又は細胞質中に試薬が取り込まれることにより、細胞に前記試薬がプレロードされる、請求項1乃至請求項4のいずれか1項記載の方法。
【請求項18】
凍結保存に先立って細胞周期阻害剤を添加することで前記細胞が増殖停止を受ける、請求項1乃至請求項17のいずれか1項記載の方法。
【請求項19】
前記細胞周期阻害剤がマイトマイシンCである、請求項18記載の方法。
【請求項20】
前記粒子状支持体が検出可能なマーカーでエンコードされる、請求項1乃至請求項19のいずれか1項記載の方法。
【請求項21】
前記マーカーが、蛍光染料、pH感受性染料、蛍光タンパク質及び固体センサーから選択される、請求項20記載の方法。
【請求項22】
前記細胞が機械的手段又は流体手段による選別を受ける、請求項1乃至請求項21のいずれか1項記載の方法。
【請求項23】
前記検出及び/又は定量化段階がイメージングによって実施される、請求項1乃至請求項22のいずれか1項記載の方法。
【請求項24】
前記細胞プロセスの測定がリアルタイムで実施される、請求項1乃至請求項23のいずれか1項記載の方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公表番号】特表2009−531053(P2009−531053A)
【公表日】平成21年9月3日(2009.9.3)
【国際特許分類】
【出願番号】特願2009−502216(P2009−502216)
【出願日】平成19年3月29日(2007.3.29)
【国際出願番号】PCT/GB2007/001148
【国際公開番号】WO2007/113496
【国際公開日】平成19年10月11日(2007.10.11)
【出願人】(398048914)ジーイー・ヘルスケア・ユーケイ・リミテッド (30)
【Fターム(参考)】
【公表日】平成21年9月3日(2009.9.3)
【国際特許分類】
【出願日】平成19年3月29日(2007.3.29)
【国際出願番号】PCT/GB2007/001148
【国際公開番号】WO2007/113496
【国際公開日】平成19年10月11日(2007.10.11)
【出願人】(398048914)ジーイー・ヘルスケア・ユーケイ・リミテッド (30)
【Fターム(参考)】
[ Back to top ]

