細胞分化誘導ペプチド及びその利用
【課題】高い分化誘導活性を有する人工ペプチドと、該ペプチドを有効成分とする細胞分化誘導剤を提供すること。
【解決手段】本発明によって提供される細胞分化誘導ペプチドは、(A)膜透過性ペプチドを構成するアミノ酸配列と、(B)配列番号19〜27のうちから選択されるいずれかのアミノ酸配列、若しくは該選択されたアミノ酸配列のうちの1個又は数個のアミノ酸残基が置換、欠失及び/又は付加されて形成されたアミノ酸配列とを有する人為的に合成されたペプチドである。
【解決手段】本発明によって提供される細胞分化誘導ペプチドは、(A)膜透過性ペプチドを構成するアミノ酸配列と、(B)配列番号19〜27のうちから選択されるいずれかのアミノ酸配列、若しくは該選択されたアミノ酸配列のうちの1個又は数個のアミノ酸残基が置換、欠失及び/又は付加されて形成されたアミノ酸配列とを有する人為的に合成されたペプチドである。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、胚性幹細胞(ES細胞)や人工多能性幹細胞(iPS細胞)その他の未分化細胞の分化を誘導し得る或いは分化誘導を促進し得る分化誘導活性を有する人工の生理活性ペプチドとその利用に関する。また、該ペプチドを含む細胞分化誘導剤(組成物)ならびに該ペプチドを使用して未分化細胞の分化誘導を促進する方法に関する。
【背景技術】
【0002】
再生医療分野における一つの課題として、未分化状態の培養細胞を、高効率に目的の機能を有する細胞に分化誘導する技術の確立が挙げられる(以下の特許文献参照)。
例えば、近年、特に注目されているiPS細胞やES細胞を未分化状態で培養(増殖)し、当該培養(増殖)により細胞数が増大した未分化幹細胞を、所定の段階で高効率に且つ簡便な手法で目的の機能を有する細胞に分化誘導する方法の確立が求められている。例えば以下の非特許文献1には、培養したiPS細胞から肝細胞を分化誘導したとする技術が記載されている。その他、未分化状態のiPS細胞やES細胞を、心筋細胞、血液細胞、生殖細胞、神経細胞等に分化誘導方法が多数報告されてきている。
【0003】
しかしながら、現在までに報告されている幹細胞の分化誘導法は、操作が煩雑な方法(例えば複数の外来遺伝子の導入を伴う分化誘導法)であったり、或いは、操作自体は比較的容易な方法(例えば液状の数種の分化誘導性化合物を培地に添加する方法)であってもその分化効率が低いものが多く、より簡便で分化効率の高い分化誘導方法が求められている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2009−165481号公報
【特許文献2】特開2009−215191号公報
【特許文献3】国際公開第WO2007/126077号パンフレット
【非特許文献】
【0005】
【非特許文献1】セル・リサーチ(Cell Research)、19巻、2009年、pp.1233−1242
【非特許文献2】PNAS、105巻(25号)、2008年、pp.8778−8783
【非特許文献3】EMBOレポート(EMBO reports)、10巻(3号)、2009年、pp.231−238
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は、上記非特許文献1に記載されるような従前の分化誘導方法とは異なり、人為的に合成可能な比較的短い鎖長のペプチドであって、iPS細胞その他の幹細胞のような未分化状態の細胞の分化誘導を効率的に行う目的に資する分化誘導活性を有する人工ペプチドの提供を目的とする。また、そのようなペプチドを含む細胞分化誘導剤(薬学的組成物)の提供を他の目的とする。また、そのようなペプチドを使用して所定の未分化細胞を分化誘導する方法、或いは、そのようなペプチドを使用して所定の未分化細胞の分化誘導を促進(助長)する方法の提供を他の目的とする。
【課題を解決するための手段】
【0007】
本発明によって提供される細胞分化誘導ペプチドは、所定の未分化細胞に供給された際(典型的には該細胞を培養している培地中に添加される。)、該細胞の分化を誘導し得る或いは該細胞の分化を促進し得るという分化誘導能を有することで特徴付けられる人為的に合成されたペプチドである。
即ち、ここで開示される一つの態様の細胞分化誘導ペプチドは、少なくとも1種の未分化細胞に対する分化誘導活性を有する人為的に合成されたペプチドであって、そのペプチド鎖中に以下の(A)と(B)にそれぞれ規定される部分アミノ酸配列:
(A)膜透過性ペプチドを構成するアミノ酸配列と、
(B)配列番号19〜27のうちから選択されるいずれかのアミノ酸配列、若しくは該選択されたアミノ酸配列のうちの1個又は数個(典型的には2〜5個程度、例えば2個又は3個)のアミノ酸残基が置換、欠失及び/又は付加(挿入)されて形成されたアミノ酸配列と、
を有する合成ペプチドである。
【0008】
また、本発明はここで開示されるいずれかの細胞分化誘導ペプチドを有効成分として含む、少なくとも1種の未分化細胞に対する細胞分化誘導剤を提供する。
典型的には、ここで開示される細胞分化誘導剤は、薬学上許容され得る少なくとも1種の担体(例えば上記ペプチドの安定性向上に資する少なくとも1種の基材、或いは生理食塩水や各種の緩衝液等の液状媒体)を含む。
【0009】
本発明者は、本来は別の機能を有するペプチド若しくは所定のペプチド中の特定の機能により画定された部分(即ちペプチドモチーフ若しくはドメイン)を構成するアミノ酸配列を複数組み合わせて構築した合成ペプチドを、培養中のiPS細胞等の幹細胞(即ち未分化細胞)に供給したところ該未分化培養細胞の形態が変化し、分化誘導されることを見出し、本発明を完成するに至った。具体的には、本発明者は、
(1)膜透過性ペプチドとして知られるペプチドモチーフ(特に、後述する核小体局在シグナルが好ましい。)を構成するアミノ酸配列と、
(2)神経系の発生段階における重要なプロセスである軸索誘導(axonal guidance)等のニューロン新生(neurogenesis)を制御する物質として知られるエフリン(Ephrin:非特許文献2参照)のAファミリー(細胞膜結合型)或いはBファミリー(細胞膜貫通型)に属するタンパク質のシグナルペプチド領域のアミノ酸配列と、
を有する(若しくは該(1)及び(2)のそれぞれのアミノ酸配列のうちの1個又は数個(典型的には2〜5個程度、例えば2個又は3個)のアミノ酸残基が置換、欠失及び/又は付加(挿入)されて形成された改変アミノ酸配列を有する)人為的に合成されたペプチドを提供する。
本発明者は、かかる2種類の機能の異なる(1)と(2)のアミノ酸配列を組み合わせて構築した合成ペプチドが優れた分化誘導活性を示すことを見出し、本発明を完成するに至った。
即ち、ここで開示される合成ペプチド(細胞分化誘導ペプチド)のペプチド鎖の一部を構成する上記(A)に規定されるアミノ酸配列は、膜透過性ペプチドのアミノ酸配列である。一方、上記(B)に規定されるアミノ酸配列は、種々のエフリンのシグナルペプチド領域のアミノ酸配列の具体例であり、配列番号19〜27としてここで開示されている。
【0010】
ここで開示される細胞分化誘導ペプチドは、化学合成(若しくは生合成)によって容易に人為的に製造することができる。また、物質自体が単純な構造(直鎖状のペプチド鎖)であるため、取り扱いが容易であり、例えば、未分化細胞の培養中に該細胞分化誘導ペプチド(若しくは該ペプチドを含む細胞分化誘導剤)を該未分化細胞に(典型的には培地中に)供給するという簡易な処理を行うことによって、当該未分化細胞の分化を誘導ないし該分化誘導の促進を実現することができる。
【0011】
ここで開示される好ましい一態様の合成ペプチド(細胞分化誘導ペプチド)は、上記(A)膜透過性ペプチドを構成するアミノ酸配列として配列番号1〜18のうちから選択されるいずれかのアミノ酸配列、若しくは該選択されたアミノ酸配列のうちの1個又は数個(典型的には2〜5個程度、例えば2個又は3個)のアミノ酸残基が置換、欠失及び/又は付加(挿入)されて形成されたアミノ酸配列を有するペプチドである。
配列番号1〜18としてここで開示されているアミノ酸配列は、上記(A)膜透過性ペプチドを構成するアミノ酸配列の典型例であり、本発明の実施に好適に採用することができる。タンパク質を核内の核小体へ局在化させるシグナル配列であり核小体局在シグナル(NoLS:Nucleolar localization signal、非特許文献3参照)として知られるいずれかのアミノ酸配列(典型的には配列番号1〜15、例えば配列番号14や15)を採用することが特に好ましい。
【0012】
また、ここで開示されるさらに好ましい一態様の合成ペプチド(細胞分化誘導ペプチド)は、該ペプチドを構成する全アミノ酸残基数が100以下(特には50以下)であることを特徴とする。このような短いペプチド鎖のペプチドは化学合成が容易であり、且つ、安価で取扱性に優れるため、細胞分化誘導剤の成分として好ましい。
【0013】
また、ここで開示される好ましい他の一態様の合成ペプチド(細胞分化誘導ペプチド)は、該ペプチドが上記(A)で規定されるアミノ酸配列のN末端側またはC末端側に隣接して上記(B)で規定されるアミノ酸配列を含むことを特徴とする。
このような構成のペプチドは、特に未分化細胞に対する分化誘導活性に優れる。該ペプチドを構成する全アミノ酸残基数が50以下であるものが、シンプルな構成であり化学合成も容易であるために特に好ましい。
本発明によって提供される合成ペプチド(細胞分化誘導ペプチド)の好ましい具体例として配列番号28〜33のうちから選択されるいずれかのアミノ酸配列を有するペプチド(特に全アミノ酸残基数が100以下若しくは50以下のもの)、或いは配列番号28〜33のうちから選択されるいずれかのアミノ酸配列から構成されているペプチドが挙げられる。このような合成ペプチド(細胞分化誘導ペプチド)を含む細胞分化誘導剤は、特にヒト若しくはヒト以外の哺乳動物由来の幹細胞(例えば胚性幹細胞)若しくは人工多能性幹細胞(iPS細胞)の分化誘導ないし分化を促進する用途に好適である。
【0014】
また、本発明は、他の側面として、少なくとも1種の未分化細胞(典型的には生体外で培養する未分化培養細胞、若しくは生体内の未分化細胞)の分化誘導を促進する方法であって、ここで開示されるいずれかの細胞分化誘導ペプチド(換言すればここで開示されるいずれかの細胞分化誘導ペプチドを含む細胞分化誘導剤)を該分化誘導対象とする未分化細胞に対して少なくとも1回供給することを特徴とする方法を提供する。
かかる分化誘導促進方法によると、上記のとおり単純な構成の合成ペプチドを細胞分化誘導因子として使用するという簡易な手法によって、目的の未分化細胞の分化誘導を効率的に実現することができる。
【0015】
また、本発明は、他の側面として、所定の未分化細胞(典型的には生体外で培養する未分化培養細胞、若しくは生体内の未分化細胞)を分化誘導して該分化した細胞又は該分化した細胞から成る組織体を生産する方法であって、該未分化細胞に対して、ここで開示されるいずれかの細胞分化誘導ペプチド(換言すればここで開示されるいずれかの細胞分化誘導ペプチドを含む細胞分化誘導剤)を少なくとも1回供給することを特徴とする生産方法を提供する。
かかる生産方法によると、上記のとおり単純な構成の合成ペプチドを細胞分化誘導因子として使用するという簡易な手法によって、目的の分化された細胞若しくは該分化細胞から成る組織体(皮膚、神経、血管、各種の臓器、等)を効率的に生産することができる。
【0016】
ここで開示される上記分化誘導促進方法または生産方法としての好ましい一態様では、上記未分化細胞がヒト若しくはヒト以外の哺乳動物由来の幹細胞若しくは人工多能性幹細胞(iPS細胞)である。ここで開示される細胞分化誘導ペプチドは、この種の細胞の分化誘導促進に好適に使用することができる。
【0017】
また、被験体(患者)の患部の修復や再生を促進させる目的に、ここで開示される分化誘導促進方法や生産方法を好適に実施することができる。即ち、ここで開示される分化誘導促進方法や生産方法は、修復や再生に資する未分化細胞(特に幹細胞)を生体外で高効率に分化誘導することができるため、本方法の実施によって効率よく生体外で分化誘導させた細胞若しくは該分化細胞から成る組織体を、被験体(患者)の体内に導入することによって、患部の修復や組織再生に要する時間を短縮することができる。
【図面の簡単な説明】
【0018】
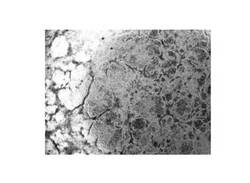
【図1】一実施例に係る細胞分化誘導ペプチド(サンプル1)を添加して培養したiPS細胞の形態変化を示す光学顕微鏡写真である。
【図2】一実施例に係る細胞分化誘導ペプチド(サンプル2)を添加して培養したiPS細胞の形態変化を示す光学顕微鏡写真である。
【図3】一実施例に係る細胞分化誘導ペプチド(サンプル3)を添加して培養したiPS細胞の形態変化を示す光学顕微鏡写真である。
【図4】細胞分化誘導ペプチド無添加で培養したiPS細胞(比較例)の形態を示す光学顕微鏡写真である。
【発明を実施するための形態】
【0019】
以下、本発明の好適な実施形態を説明する。なお、本明細書において特に言及している事項(例えば細胞分化誘導ペプチドの一次構造や鎖長)以外の事柄であって本発明の実施に必要な事柄(例えばペプチド合成、細胞培養技法、ペプチドを成分とする薬剤組成物の調製に関するような一般的事項)は、細胞工学、医学、薬学、有機化学、生化学、遺伝子工学、タンパク質工学、分子生物学、衛生学等の分野における従来技術に基づく当業者の設計事項として把握され得る。本発明は、本明細書に開示されている内容と当該分野における技術常識とに基づいて実施することができる。なお、以下の説明では、場合に応じてアミノ酸をIUPAC-IUBガイドラインで示されたアミノ酸に関する命名法に準拠した1文字表記(但し配列表では3文字表記)で表す。
なお、本明細書中に記載されるアミノ酸配列は、常に左側がN末端側であり右側がC末端側である。
また、本明細書中で引用されている全ての文献の全ての内容は本明細書中に参照として組み入れられている。
【0020】
本明細書において「人為的に合成された細胞分化誘導ペプチド」とは、そのペプチド鎖がそれのみで独立して自然界に安定的に存在するものではなく、人為的な化学合成或いは生合成(即ち遺伝子工学に基づく生産)によって製造され、所定の系(例えば細胞分化誘導剤を構成する組成物)の中で安定して存在し得るペプチド断片をいう。
本明細書において「ペプチド」とは、複数のペプチド結合を有するアミノ酸ポリマーを指す用語であり、ペプチド鎖に含まれるアミノ酸残基の数によって限定されないが、典型的には全アミノ酸残基数が概ね100以下、好ましくは50以下(例えば30〜50程度)のような比較的分子量の小さいものをいう。
【0021】
本明細書において「アミノ酸残基」とは、特に言及する場合を除いて、ペプチド鎖のN末端アミノ酸及びC末端アミノ酸を包含する用語である。また、本明細書において所定のアミノ酸配列に対して「改変アミノ酸配列」とは、当該所定のアミノ酸配列が有する細胞分化誘導能を損なうことなく、1個又は数個(典型的には2〜5個程度、例えば2個又は3個)のアミノ酸残基が置換、欠失及び/又は付加(挿入)されて形成されたアミノ酸配列をいう。例えば、1個又は数個(典型的には2〜5個程度、例えば2個又は3個)のアミノ酸残基が保守的に置換したいわゆる同類置換(conservative amino acid replacement)によって生じた配列(例えば塩基性アミノ酸残基が別の塩基性アミノ酸残基に置換した配列)、或いは、所定のアミノ酸配列について1個又は数個(典型的には2〜5個程度、例えば2個又は3個)のアミノ酸残基が付加(挿入)した若しくは欠失した配列等は、本明細書でいうところの改変アミノ酸配列に包含される典型例である。
また、本明細書において「ポリヌクレオチド」とは、複数のヌクレオチドがリン酸ジエステル結合で結ばれたポリマー(核酸)を指す用語であり、ヌクレオチドの数によって限定されない。種々の長さのDNAフラグメント及びRNAフラグメントが本明細書におけるポリヌクレオチドに包含される。また、「人為的に設計されたポリヌクレオチド」とは、そのヌクレオチド鎖(全長)がそれ単独で自然界に存在するものではなく、化学合成或いは生合成(即ち遺伝子工学に基づく生産)によって人為的に合成されたポリヌクレオチドをいう。
【0022】
ここで開示される細胞分化誘導剤は、本発明者によって見出された少なくとも1種の未分化細胞に対する分化誘導活性を有する合成ペプチド(即ち細胞分化誘導ペプチド)を有効成分として含有することで特徴付けられる組成物である。
ここで上記未分化細胞の好適例としては、各種の幹細胞、特にヒト又は他の動物(典型的には脊椎動物、特に哺乳動物)由来の胚性幹細胞(ES細胞ともいう。)、体性幹細胞(神経幹細胞、造血幹細胞、間葉系幹細胞、肝幹細胞、皮膚幹細胞、生殖幹細胞、筋幹細胞、等)或いは人工多能性幹細胞(iPS細胞ともいう。)が挙げられる。ここで開示される細胞分化誘導ペプチドは、特にES細胞、iPS細胞に対する高い分化誘導活性を有する。
ここで開示される細胞分化誘導剤(細胞分化誘導ペプチド)によると、上記のような幹細胞(未分化細胞)を、心筋細胞、血液細胞、皮膚細胞、生殖細胞、神経細胞、血管内皮細胞、肝細胞、膵臓細胞(特にインスリン産生細胞)等に分化誘導することができる、ないしはそのような細胞種への分化誘導を促進することができる。
【0023】
上述のとおり、ここで開示される細胞分化誘導ペプチドは、部分アミノ酸配列として、上記(A)で規定される膜透過性ペプチドを構成するアミノ酸配列(以下「(A)パート配列」と略称する場合がある。)を有する。
(A)パート配列は、細胞膜及び/又は核膜を通過し得る膜透過性ペプチドを構成するアミノ酸配列であれば特に限定なく使用することができる。例えば、本明細書の配列表における配列番号1〜18に示すアミノ酸配列およびそれらの改変アミノ酸配列(膜透過性を保持しているものに限られる。)は、(A)パート配列を構成するアミノ酸配列として好ましい。具体的には以下のとおりである。
【0024】
即ち、配列番号1のアミノ酸配列は、FGF2(塩基性線維芽細胞増殖因子)由来の合計14アミノ酸残基から成るNoLSに対応する。
配列番号2のアミノ酸配列は、核小体タンパク質の1種(ApLLP)由来の合計19アミノ酸残基から成るNoLSに対応する。
配列番号3のアミノ酸配列は、HSV−1(単純ヘルペスウイルス タイプ1)のタンパク質(γ(1)34.5)由来の合計16アミノ酸残基から成るNoLSに対応する。
配列番号4のアミノ酸配列は、HIC(human I-mfa domain-containing protein)のp40タンパク質由来の合計19アミノ酸残基から成るNoLSに対応する。
配列番号5のアミノ酸配列は、MDV(Marek病ウイルス)のMEQタンパク質由来の合計16アミノ酸残基から成るNoLSに対応する。
配列番号6のアミノ酸配列は、アポトーシスを抑制するタンパク質であるSurvivin- deltaEx3由来の合計17アミノ酸残基から成るNoLSに対応する。
配列番号7のアミノ酸配列は、血管増殖因子であるAngiogenin由来の合計7アミノ酸残基から成るNoLSに対応する。
配列番号8のアミノ酸配列は、核リンタンパク質であってp53腫瘍抑制タンパク質と複合体を形成するMDM2由来の合計8アミノ酸残基から成るNoLSに対応する。
配列番号9のアミノ酸配列は、ベータノダウイルスのタンパク質であるGGNNVα由来の合計9アミノ酸残基から成るNoLSに対応する。
配列番号10のアミノ酸配列は、NF−κB誘導性キナーゼ(NIK)由来の合計7アミノ酸残基から成るNoLSに対応する。
配列番号11のアミノ酸配列は、Nuclear VCP-like protein由来の合計15アミノ酸残基から成るNoLSに対応する。
配列番号12のアミノ酸配列は、核小体タンパク質であるp120由来の合計18アミノ酸残基から成るNoLSに対応する。
配列番号13のアミノ酸配列は、HVS(ヘルペスウイルスsaimiri)のORF57タンパク質由来の合計14アミノ酸残基から成るNoLSに対応する。
配列番号14のアミノ酸配列は、細胞内情報伝達に関与するプロテインキナーゼの1種であるヒト内皮細胞に存在するLIMキナーゼ2(LIM Kinase 2)の第491番目のアミノ酸残基から第503番目のアミノ酸残基までの合計13アミノ酸残基から成るNoLSに対応する。
配列番号15のアミノ酸配列は、IBV(トリ伝染性気管支炎ウイルス:avian infectious bronchitis virus)のNタンパク質(nucleocapsid protein)に含まれる合計8アミノ酸残基から成る核小体局在シグナル(Nucleolar localization sequence)に対応する。
配列番号16のアミノ酸配列は、HIV(ヒト免疫不全ウイルス:Human Immunodeficiency Virus)のTATに含まれるタンパク質導入ドメイン由来の合計11アミノ酸配列から成る膜透過性モチーフに対応する。
配列番号17のアミノ酸配列は、上記TATを改変したタンパク質導入ドメイン(PTD4)の合計11アミノ酸配列から成る膜透過性モチーフに対応する。
配列番号18のアミノ酸配列は、ショウジョウバエ(Drosophila)の変異体であるAntennapediaのANT由来の合計18アミノ酸配列から成る膜透過性モチーフに対応する。
これらのうち、特にNoLSに関連するアミノ酸配列(又はその改変アミノ酸配列)が好ましい。特に、配列番号14や15に示すようなNoLS関連のアミノ酸配列が細胞分化誘導ペプチドの(A)パート配列として好ましい。
【0025】
一方、細胞分化誘導ペプチドの(B)パート配列を構成するアミノ酸配列は、上記(A)パート配列と組み合わせることにより良好な分化誘導活性を有するペプチドが構築し得るものとして本発明者により見出された配列(ペプチドモチーフ)であり、配列番号19〜27に具体的アミノ酸配列の例が列挙されている。詳細は以下のとおりである。
【0026】
即ち、配列番号19〜27に示す各アミノ酸配列は、上述したとおり、エフリン(Ephrin)のAファミリー若しくはBファミリーに属するタンパク質のシグナルペプチド領域のアミノ酸配列である。
具体的には、配列番号19は、ヒト由来のEphrin−A2のシグナルペプチド領域の合計24アミノ酸残基から成るアミノ酸配列に対応する。
配列番号20は、マウス由来のEphrin−A2のシグナルペプチド領域の合計24アミノ酸残基から成るアミノ酸配列に対応する。
配列番号21は、ヒト及びマウス由来のEphrin−A3のシグナルペプチド領域の合計22アミノ酸残基から成るアミノ酸配列に対応する。
配列番号22は、ヒト由来のEphrin−A1のシグナルペプチド領域の合計27アミノ酸残基から成るアミノ酸配列に対応する。
配列番号23は、ヒト由来のEphrin−A4のシグナルペプチド領域の合計27アミノ酸残基から成るアミノ酸配列に対応する。
配列番号24は、ヒト由来のEphrin−A5のシグナルペプチド領域の合計27アミノ酸残基から成るアミノ酸配列に対応する。
配列番号25は、ヒト由来のEphrin−B1のシグナルペプチド領域の合計27アミノ酸残基から成るアミノ酸配列に対応する。
配列番号26は、ヒト由来のEphrin−B2のシグナルペプチド領域の合計27アミノ酸残基から成るアミノ酸配列に対応する。
配列番号27は、ヒト由来のEphrin−B3のシグナルペプチド領域の合計27アミノ酸残基から成るアミノ酸配列に対応する。
【0027】
ここで開示される細胞分化誘導ペプチドのペプチド鎖(アミノ酸配列)は、上述したような(A)パート配列と、(B)パート配列とを適宜組み合わせることにより構築される。(A)パート配列と(B)パート配列のいずれが相対的にC末端側(N末端側)に配置されてもよい。また、(A)パート配列と(B)パート配列とは隣接して配置されるのが好ましい。即ち、(A)パート配列と(B)パート配列との間には、両配列部分に包含されないアミノ酸残基が存在しないか或いは存在していても該残基数が1〜3個程度が好ましい。
好ましくは、細胞分化誘導ペプチドは、少なくとも一つのアミノ酸残基がアミド化されているものが好ましい。アミノ酸残基(典型的にはペプチド鎖のC末端アミノ酸残基)のカルボキシル基のアミド化により、合成ペプチドの構造安定性(例えばプロテアーゼ耐性)を向上させ得る。
【0028】
少なくとも1種の未分化細胞に対する分化誘導活性を失わない限りにおいて、(A)パート配列と(B)パート配列を構成するアミノ酸配列以外の配列(アミノ酸残基)部分を含み得る。特に限定するものではないが、かかる部分配列としては(A)パート配列と(B)パート配列部分の3次元形状(典型的には直鎖形状)を維持し得る配列が好ましい。該細胞分化誘導ペプチドは、ペプチド鎖を構成する全アミノ酸残基数が100以下が望ましく、50以下(例えば30〜50程度)が好ましい。このような鎖長の短いペプチドは、化学合成が容易であり、容易に細胞分化誘導ペプチドを提供することができる。なお、ペプチドのコンホメーション(立体構造)については、使用する環境下(生体外若しくは生体内)で分化誘導活性を保持する限りにおいて、特に限定されるものではないが、免疫原(抗原)になり難いという観点から直鎖状又はへリックス状のものが好ましい。このような形状のペプチドはエピトープを構成し難い。かかる観点から、細胞分化誘導剤に適用する細胞分化誘導ペプチドとしては、直鎖状であり比較的低分子量(典型的には100以下(特に50以下、例えば30〜50程度)のアミノ酸残基数)のものが好適である。
【0029】
全体のアミノ酸配列に対する(A)パート配列と(B)パート配列の占める割合(即ちペプチド鎖を構成する全アミノ酸残基数に占める(A)パート配列と(B)パート配列を構成するアミノ酸残基数の個数%)は、分化誘導活性を失わない限り特に限定されないが、当該割合は概ね60%以上が望ましく、80%以上が好ましい。90%以上(例えば(A)パート配列と(B)パート配列とから構成されたペプチド)が特に好ましい。
なお、本発明の細胞分化誘導ペプチドとしては、全てのアミノ酸残基がL型アミノ酸であるものが好ましいが、分化誘導活性を失わない限りにおいて、アミノ酸残基の一部又は全部がD型アミノ酸に置換されているものであってもよい。
【0030】
ここで開示される細胞分化誘導ペプチドのうちペプチド鎖の比較的短いものは、一般的な化学合成法に準じて容易に製造することができる。例えば、従来公知の固相合成法又は液相合成法のいずれを採用してもよい。アミノ基の保護基としてBoc(t-butyloxycarbonyl)或いはFmoc(9-fluorenylmethoxycarbonyl)を適用した固相合成法が好適である。
ここで開示される細胞分化誘導ペプチドは、市販のペプチド合成機(例えば、PerSeptive Biosystems社、Applied Biosystems社等から入手可能である。)を用いた固相合成法により、所望するアミノ酸配列、修飾(C末端アミド化等)部分を有するペプチド鎖を合成することができる。
【0031】
或いは、遺伝子工学的手法に基づいて細胞分化誘導ペプチドを生合成してもよい。このアプローチは、一般にポリペプチドと呼ばれるようなペプチド鎖の比較的長いペプチドを製造する場合に好適である。すなわち、所望する細胞分化誘導ペプチドのアミノ酸配列をコードするヌクレオチド配列(ATG開始コドンを含む。)のDNAを合成する。そして、このDNAと該アミノ酸配列を宿主細胞内で発現させるための種々の調節エレメント(プロモーター、リボゾーム結合部位、ターミネーター、エンハンサー、発現レベルを制御する種々のシスエレメントを包含する。)とから成る発現用遺伝子構築物を有する組換えベクターを、宿主細胞に応じて構築する。
一般的な技法によって、この組換えベクターを所定の宿主細胞に導入し、所定の条件で当該宿主細胞又は該細胞を含む組織や個体を培養する。このことにより、目的とするポリペプチドを細胞内で発現、生産させることができる。そして、宿主細胞(分泌された場合は培地中)からポリペプチドを単離し、精製することによって、目的の細胞分化誘導ペプチドを得ることができる。一般的な技法によって、この組換えベクターを所定の宿主細胞(例えばイースト、昆虫細胞)に導入し、所定の条件で当該宿主細胞又は該細胞を含む組織や個体を培養する。このことにより、目的とするポリペプチドを細胞内で発現、生産させることができる。そして、宿主細胞(分泌された場合は培地中)からポリペプチドを単離し、精製することによって、目的の細胞分化誘導ペプチドを得ることができる。
なお、組換えベクターの構築方法及び構築した組換えベクターの宿主細胞への導入方法等は、当該分野で従来から行われている方法をそのまま採用すればよく、かかる方法自体は特に本発明を特徴付けるものではないため、詳細な説明は省略する。
【0032】
例えば、宿主細胞内で効率よく大量に生産させるために融合タンパク質発現システムを利用することができる。すなわち、目的の細胞分化誘導ペプチドのアミノ酸配列をコードする遺伝子(DNA)を化学合成し、該合成遺伝子を適当な融合タンパク質発現用ベクター(例えばノバジェン社から提供されているpETシリーズおよびアマシャムバイオサイエンス社から提供されているpGEXシリーズのようなGST(Glutathione S-transferase)融合タンパク質発現用ベクター)の好適なサイトに導入する。そして該ベクターにより宿主細胞(典型的には大腸菌)を形質転換する。得られた形質転換体を培養して目的の融合タンパク質を調製する。次いで、該タンパク質を抽出及び精製する。次いで、得られた精製融合タンパク質を所定の酵素(プロテアーゼ)で切断し、遊離した目的のペプチド断片(設計した細胞分化誘導ペプチド)をアフィニティクロマトグラフィー等の方法によって回収する。このような従来公知の融合タンパク質発現システム(例えばアマシャムバイオサイエンス社により提供されるGST/Hisシステムを利用し得る。)を用いることによって、本発明の細胞分化誘導ペプチドを製造することができる。
或いは、無細胞タンパク質合成システム用の鋳型DNA(即ち細胞分化誘導ペプチドのアミノ酸配列をコードするヌクレオチド配列を含む合成遺伝子断片)を構築し、ペプチド合成に必要な種々の化合物(ATP、RNAポリメラーゼ、アミノ酸類等)を使用し、いわゆる無細胞タンパク質合成システムを採用して目的のポリペプチドをインビトロ合成することができる。無細胞タンパク質合成システムについては、例えばShimizuらの論文(Shimizu et al., Nature Biotechnology, 19, 751-755(2001))、Madinらの論文(Madin et al., Proc. Natl. Acad. Sci. USA, 97(2), 559-564(2000))が参考になる。これら論文に記載された技術に基づいて、本願出願時点において既に多くの企業がポリペプチドの受託生産を行っており、また、無細胞タンパク質合成用キット(例えば、日本の東洋紡績(株)から入手可能なPROTEIOS(商標)Wheat germ cell-free protein synthesis kit)が市販されている。
従って、利用する(A)パート配列ならびに(B)パート配列をひとたび決定し、ペプチド鎖を設計しさえすれば、そのアミノ酸配列に従って無細胞タンパク質合成システムによって目的の細胞分化誘導ペプチドを容易に合成・生産することができる。例えば、日本の(株)ポストゲノム研究所のピュアシステム(登録商標)に基づいて本発明の細胞分化誘導ペプチドを容易に生産することができる。
【0033】
ここで開示される細胞分化誘導ペプチドをコードするヌクレオチド配列及び/又は該配列と相補的なヌクレオチド配列を含む一本鎖又は二本鎖のポリヌクレオチドは、従来公知の方法によって容易に製造(合成)することができる。すなわち、設計したアミノ酸配列を構成する各アミノ酸残基に対応するコドンを選択することによって、細胞分化誘導ペプチドのアミノ酸配列に対応するヌクレオチド配列が容易に決定され、提供される。そして、ひとたびヌクレオチド配列が決定されれば、DNA合成機等を利用して、所望するヌクレオチド配列に対応するポリヌクレオチド(一本鎖)を容易に得ることができる。さらに得られた一本鎖DNAを鋳型として用い、種々の酵素的合成手段(典型的にはPCR)を採用して目的の二本鎖DNAを得ることができる。
本発明によって提供されるポリヌクレオチドは、DNAの形態であってもよく、RNA(mRNA等)の形態であってもよい。DNAは、二本鎖又は一本鎖で提供され得る。一本鎖で提供される場合は、コード鎖(センス鎖)であってもよく、それと相補的な配列の非コード鎖(アンチセンス鎖)であってもよい。
本発明によって提供されるポリヌクレオチドは、上述のように、種々の宿主細胞中で又は無細胞タンパク質合成システムにて、細胞分化誘導ペプチド生産のための組換え遺伝子(発現カセット)を構築するための材料として使用することができる。
本発明によると、新規なアミノ酸配列の細胞分化誘導ペプチドをコードするヌクレオチド配列及び/又は該配列と相補的なヌクレオチド配列を含むポリヌクレオチドが提供される。例えば、ペプチド鎖を構成する全アミノ酸残基数が100以下(好ましくは50以下)であって、配列番号28〜33で示されるアミノ酸配列或いは該配列の改変アミノ酸配列、または該配列を含むアミノ酸配列をコードするヌクレオチド配列及び/又は該配列と相補的なヌクレオチド配列を含む(又はそれら配列から実質的に構成された)人為的に設計されたポリヌクレオチドが提供される。
【0034】
ここで開示される好適な細胞分化誘導ペプチドは、少なくとも1種の未分化細胞に対して好ましい分化誘導活性を有する。このため、細胞分化誘導剤の有効成分として好適に使用し得る。なお、細胞分化誘導剤に含有される細胞分化誘導ペプチドは、分化誘導活性を損なわない限りにおいて、塩の形態であってもよい。例えば、常法に従って通常使用されている無機酸又は有機酸を付加反応させることにより得られ得る該ペプチドの酸付加塩を使用することができる。或いは、分化誘導活性を有する限り、他の塩(例えば金属塩)であってもよい。本明細書及び特許請求の範囲に記載の「ペプチド」は、かかる塩形態のものを包含する。
【0035】
ここで開示される細胞分化誘導剤は、有効成分である細胞分化誘導ペプチドをその分化誘導活性が失われない状態で保持し得る限りにおいて、使用形態に応じて薬学(医薬)上許容され得る種々の担体を含み得る。希釈剤、賦形剤等としてペプチド医薬において一般的に使用される担体が好ましい。細胞分化誘導剤の用途や形態に応じて適宜異なり得るが、典型的には、水、生理学的緩衝液、種々の有機溶媒が挙げられる。適当な濃度のアルコール(エタノール等)水溶液、グリセロール、オリーブ油のような不乾性油であり得る。或いはリポソームであってもよい。また、細胞分化誘導剤に含有させ得る他の成分としては、種々の充填剤、増量剤、結合剤、付湿剤、表面活性剤、色素、香料、抗生剤等が挙げられる。或いは、他の公知の細胞分化誘導因子を含有してもよい。ここで開示される細胞分化誘導ペプチドと他の細胞分化誘導因子(レチノイン酸、アクチビン、等)を併用することにより、細胞分化誘導を促進(増強)することができる。
細胞分化誘導剤の形態に関して特に限定はない。例えば、典型的な形態として、液剤、懸濁剤、乳剤、エアロゾル、泡沫剤、顆粒剤、粉末剤、錠剤、カプセル、軟膏、水性ジェル剤等が挙げられる。また、注射等に用いるため、使用直前に生理食塩水又は適当な緩衝液(例えばPBS)等に溶解して薬液を調製するための凍結乾燥物、造粒物とすることもできる。
なお、細胞分化誘導ペプチド(主成分)及び種々の担体(副成分)を材料にして種々の形態の薬剤(組成物)を調製するプロセス自体は従来公知の方法に準じればよく、かかる製剤方法自体は本発明を特徴付けるものでもないため詳細な説明は省略する。処方に関する詳細な情報源として、例えばComprehensive Medicinal Chemistry, Corwin Hansch監修,Pergamon Press刊(1990)が挙げられる。この書籍の全内容は本明細書中に参照として援用されている。
【0036】
ここで開示される細胞分化誘導剤(細胞分化誘導ペプチド)の適用対象未分化細胞は特に制限されず、種々の生物種の未分化細胞を分化誘導する(若しくは分化誘導を促進する)ことが可能である。ヒト又は他の動物(典型的には脊椎動物、特に哺乳動物)由来の胚性幹細胞(ES細胞)、体性幹細胞(神経幹細胞、造血幹細胞、間葉系幹細胞、肝幹細胞、皮膚幹細胞、生殖幹細胞、筋幹細胞、骨髄幹細胞、等)或いは人工多能性幹細胞(iPS細胞)が挙げられる。ここで開示される細胞分化誘導ペプチドは、特に胚性幹細胞、人工多能性幹細胞が適用対象として好ましい。
【0037】
ここで開示される細胞分化誘導剤(細胞分化誘導ペプチド)は、その形態及び目的に応じた方法や用量で使用することができる。
例えば、生体外(インビトロ)で培養(継代)している未分化培養細胞(例えばES細胞株やiPS細胞株)を分化誘導させる場合においては、ここで開示される細胞分化誘導剤(細胞分化誘導ペプチド)の適当量を、分化誘導する対象の未分化培養細胞に対し、培養過程のいずれかの段階(好ましくは未分化状態を維持しつつ所定期間の培養(増殖)や継代を行った後)で培地に添加するとよい。添加量及び添加回数は、培養細胞の種類、細胞密度(培養開始時の細胞密度)、継代数、培養条件、培地の種類、等の条件によって異なり得るため特に限定されない。未分化の幹細胞(特にiPS細胞やES細胞)を培養する場合、培地中の細胞分化誘導ペプチド濃度が概ね0.1μM〜100μMの範囲内、好ましくは0.1μM〜20μM(例えば1μM〜10μM)の範囲内となるように、1〜複数回添加する(例えば細胞の継代時や培地交換時に合わせて複数回供給する)ことが好ましい。
また、ここで開示される細胞分化誘導ペプチドは、対象とする未分化細胞種や目的(生産したい分化細胞の種類)に応じ、他の細胞分化誘導因子と併用することができる。かかる細胞分化誘導因子としては、例えば、レチノイン酸、種々の骨形成因子(BMPファミリーに属する因子)、アクチビン等のTGF−βスーパーファミリーに属する因子、塩基性線維芽細胞増殖因子(bFGF)、酸性線維芽細胞細胞増殖因子(aFGF)等のFGFスーパーファミリーに属する因子、白血病阻害因子(LIF)、コリン作働性神経分化因子(CDF)、毛様体神経栄養因子(CNTF)その他のサイトカインファミリーに属する因子、各種インターロイキン、腫瘍壊死因子(TNF−α)、インターフェロン−γ等が挙げられる。
【0038】
或いはまた、生体内(インビボ)で未分化細胞(例えば所定の部位に移植したiPS細胞、ES細胞その他の幹細胞)を分化誘導させる場合においては、ここで開示される細胞分化誘導剤(即ち細胞分化誘導ペプチド)の適当量を例えば液剤として患部(即ち生体内)に所望量供給することができる。或いは、錠剤等の固体形態のものや軟膏等のゲル状若しくは水性ジェリー状のものを患部(例えば火傷や創傷のような体表面)に投与することができる。これにより、生体内で、典型的には患部又はその周辺に存在する分化させたい目的の未分化細胞(幹細胞等)の分化誘導効率を向上(促進)させることができる。なお、添加量及び添加回数は、分化誘導させたい細胞の種類、存在部位、等の条件によって異なり得るため特に限定されない。
ここで開示される細胞分化誘導剤(細胞分化誘導ペプチド)を生体内の必要な部位に投与することにより、その分化誘導活性によって、神経再生能力、血管新生能力、皮膚再生能力、臓器再生能力等の向上を実現することができる。また、目的の細胞種や器官(臓器)への分化が促進されることにより、例えば、皮膚組織の改善、移植臓器の早期定着、交通事故その他の物理的障害による創傷部や火傷部の早期修復を実現することができる。また、例えば、パーキンソン病、脳梗塞、アルツハイマー病、脊髄損傷による身体の麻痺、脳挫傷、筋萎縮性側索硬化症、ハンチントン病、脳腫瘍、網膜変性症等の神経疾患を再生医療的アプローチによって治療することに資する薬剤組成物として使用することができる。
【0039】
或いはまた、材料とする幹細胞(iPS細胞やES細胞)の培養細胞株から目的の分化細胞(延いては分化した組織や器官)を効率よく生産することができる。即ち、ここで開示される生産方法(インビトロでの分化細胞又は該分化細胞から成る組織体の生産方法)を採用することによって生体外(インビトロ)で効率よく生産した目的の分化細胞(或いは該分化細胞から成る組織や器官)を、修復や再生が必要とされる患部に(即ち患者の生体内に)導入することにより、当該修復や再生を効果的に行うことができる。
【0040】
以下、本発明に関するいくつかの実施例を説明するが、本発明をかかる実施例に示すものに限定することを意図したものではない。
【0041】
<実施例1:ペプチド合成>
計6種類のペプチド(サンプル1〜6)を後述するペプチド合成機を用いて製造した。表1には、これら合成ペプチドのアミノ酸配列等の情報を列挙している。
【0042】
【表1】

【0043】
表1に示すように、サンプル1のペプチド(配列番号28)は、N末端側に(B)パート配列として配列番号19のヒトEphrin−A2のシグナルペプチド由来のアミノ酸配列を有し、該配列に隣接してそのC末端側に(A)パート配列として配列番号14の上記LIMキナーゼ2由来のアミノ酸配列(NoLS)を有する合計37アミノ酸残基から成るペプチドである。
また、サンプル2のペプチド(配列番号29)は、N末端側に(B)パート配列として配列番号20のマウスEphrin−A2のシグナルペプチド由来のアミノ酸配列を有し、該配列に隣接してそのC末端側に(A)パート配列として配列番号14の上記LIMキナーゼ2由来のアミノ酸配列(NoLS)を有する合計37アミノ酸残基から成るペプチドである。
また、サンプル3のペプチド(配列番号30)は、N末端側に(B)パート配列として配列番号21のヒト及びマウスEphrin−A3のシグナルペプチド由来のアミノ酸配列を有し、該配列に隣接してそのC末端側に(A)パート配列として配列番号14の上記LIMキナーゼ2由来のアミノ酸配列(NoLS)を有する合計35アミノ酸残基から成るペプチドである。
また、サンプル4(配列番号31)、サンプル5(配列番号32)及びサンプル6(配列番号33)は、それぞれ、サンプル1、サンプル2及びサンプル3の(A)パート配列と(B)パート配列とを逆にして構成したペプチドである。即ち、N末端側に(A)パート配列を配置しC末端側に(B)パート配列を配置した。
【0044】
なお、いずれのペプチドも、C末端アミノ酸のカルボキシル基(−COOH)はアミド化(−CONH2)されている。いずれのペプチドも、市販のペプチド合成機(Intavis AG社製品)を用いてマニュアルどおりに固相合成法(Fmoc法)を実施して合成した。なお、ペプチド合成機の使用態様自体は本発明を特徴付けるものではないため、詳細な説明は省略する。
合成した各サンプルペプチドは、PBS(リン酸緩衝生理食塩水)に溶かし、ペプチド濃度が1mMのストック液を調製した。
【0045】
<実施例2:合成ペプチドの分化誘導活性評価>
上記実施例1で得られた細胞分化誘導ペプチド(サンプル1〜6)についてインビトロで培養・継代したiPS細胞に対する分化誘導活性を調べた。また、比較例としてペプチド無添加で同様にiPS細胞を培養したものを設けた。評価試験の詳細は以下のとおりである。
【0046】
本実施例で使用するヒト由来のiPS細胞(細胞株:201B2−082008KU)とフィーダー細胞であるマウス胎児線維芽細胞(細胞株:SNL 76/7、以下「MEF」という。)は、京都大学再生医科学研究所山中研究室(山中伸弥教授)から供与されたものを使用した。
先ず、入手したMEFをマイトマイシンC処理(3時間)して不活性化し、1mMのEDTAを含む0.25%トリプシン溶液でトリプシン処理した。上記処理後、FBS含有培地にてトリプシンを失活させるとともに、MEF用培地(7%のFBS(Gibco社製品)、2mMのL−グルタミン(Gibco社製品)、50units/mLのペニシリンと50μg/mLのストレプトマイシン(Gibco社製品)を含むD−MEM培地(Dulbecco's Modified Eagle Medium):Gibco社製品)を用いてMEFを適当な細胞密度に調整し、0.1%ゼラチンで表面コートした培養容器(直径10cmの培養ディッシュ)に上記MEFを播種した。ここでは細胞密度は、約1.25×105cells/mLとなるように播種した。次いで、上記容器をインキュベーターに入れ、5%CO2条件下、37℃で一晩インキュベートした。
その後、MEF用培地を除去し、PBSで洗浄することによってフィーダー細胞を作製した。
【0047】
一方、入手したiPS細胞株にCTK溶液(0.1mg/mLのコラゲナーゼIV(Gibco社製品)、1mMの塩化カルシウム、20%のKSR(KnockOut(商標)Serum Replacement)を含む0.25%トリプシン溶液)を添加してMEFを剥がし、PBSで洗浄した。
次いで、1mLのhESC培地(即ちヒトES細胞培地、ここでは20%のKSR(Gibco社製品)、2mMのL−グルタミン(Gibco社製品)、0.1%の非必須アミノ酸(Gibco社製品)、0.1mMの2−メルカプトエタノール(Gibco社製品)、50units/mLのペニシリンと50μg/mLのストレプトマイシン(Invitrogen社製品)、4ng/mLのbFGF(Basic Fibroblast Growth Factor)を含むDMEM/F12培地(Gibco社製品))を添加し、セルスクレーパを用いてiPS細胞を剥がし、軽くピペッティングを行ってコロニーを崩した。
こうして得られたiPS細胞の懸濁物を上記のように作製しておいた培養容器中のフィーダー細胞上に播種した。そして上記hESC培地を添加し、培養容器をインキュベーターに入れ、5%CO2条件下、37℃で継代培養した。
【0048】
継代数が10パッセージであるiPS細胞の培養容器から培地を除去し、PBSで洗浄した。次いで、上記CTK溶液を添加して細胞塊を培養容器から剥がした。
そして、bFGFを添加しないこと以外は上記組成であるhESC培地(bFGFフリー培地)を上記培養容器に10mL添加して培養細胞を新たな培養容器(直径10cmの培養ディッシュ)に移した。該培養容器にROCK(Rho-associated coiled-coil forming kinase/Rho結合キナーゼ)阻害剤であるY−27632(商品名:(R)-(+)-trans-N-(4-pyridyl)-4-(1-aminoethyl)-cyclohexanecarboxamide・2HCl・H2O)を適量添加し、5%CO2条件下、37℃で3時間インキュベートしてフィーダー細胞を容器に付着させた。
【0049】
上記インキュベート後、培養液を15mL容チューブに移して5分間静置した。その後、上澄み液を除去し、PBS10mLを加えて洗浄した。次いで、遠心分離(900rpm、5分)によって上澄みを除き、沈殿物に上記CTK溶液を0.4mL添加し、37℃にて5分間インキュベートした。5分後、上記bFGFフリー培地を4mL加えてピペッティングを行い、細胞数をカウントした。
細胞密度が2.0×104cells/mLである供試細胞懸濁液を18mLほど調製し、Y−27632を適量添加した。
【0050】
こうして得られた供試iPS細胞懸濁液を、予めマイトマイシンC処理したフィーダー細胞を播種しておいた24ウェルプレートに、1ウェルあたり0.5mL注入(播種)した。
而して、各ウェルに上記ペプチドサンプル1〜6のいずれかをウェル中の培養液のペプチド濃度が2μMとなるように添加した。また、比較例として幾つかのウェルにはペプチドを添加することなく、他のペプチド添加ウェルと同様に培養を行った。
【0051】
上記プレートを5%CO2条件下、37℃でインキュベートし、培養開始から1日(24時間)経過後、培地交換とペプチドの追加添加を行った。具体的には、各ウェルから培地を除去し、新鮮なbFGFフリー培地を1ウェルあたり0.5mL注入し且つ上記ペプチドサンプル1〜6のいずれかをウェル中の培養液のペプチド濃度が2μMとなるように添加した。
さらに上記プレートを5%CO2条件下、37℃でインキュベートし、培養開始から3日経過後、培地交換とペプチドの追加添加を上記培養開始1日経過時と同様に行った。
さらに上記プレートを5%CO2条件下、37℃でインキュベートし、培養開始から5日経過後、6日経過後、8日経過後、9日経過後にそれぞれ培地交換とペプチドの追加添加を行った。具体的には、各ウェルから培地を除去し、新鮮なbFGFフリー培地を1ウェルあたり0.5mL注入し且つ上記ペプチドサンプル1〜6のいずれかをウェル中の培養液のペプチド濃度が4μMとなるように添加した。
【0052】
上記のように、培地交換とペプチドの追加添加を適宜行いつつ培養を継続し、培養開始から11日経過時点の培養iPS細胞の形態を顕微鏡で観察した(図1〜4参照)。
その結果、いずれのサンプルペプチド(細胞分化誘導ペプチド)も添加していない比較例の培養iPS細胞は、図4に示すように、光の透過性が低く顕微鏡下で細胞が白っぽく観察された。
一方、サンプル1〜6を添加して培養したiPS細胞では、サンプル1〜3についてそれぞれ図1〜3に示すように、光の透過性が高く顕微鏡下で細胞が顕著に黒っぽく観察された。かかる光透過性の変化は、iPS細胞の形態が変化した(具体的には細胞質部分が肥大して光の透過性が向上した)ことを示すものであり、比較例に比べて細胞分化誘導(具体的には肝細胞への分化誘導)が著しく促進されたことが確認された。
【0053】
<実施例3:顆粒剤の調製>
サンプル1のペプチド50mgと結晶化セルロース50mg及び乳糖400mgとを混合した後、エタノールと水の混合液1mLを加え混練した。この混練物を常法に従って造粒し、細胞分化誘導ペプチドを主成分とする顆粒剤(即ち、顆粒状の細胞分化誘導剤)を得た。
【産業上の利用可能性】
【0054】
上記のとおり、ここで開示される細胞分化誘導ペプチドは、高い分化誘導活性を有しているため、対象とする未分化細胞(特にES細胞やiPS細胞のような幹細胞)を分化誘導するないしは分化誘導を促進する目的に好適に使用し得る。従って、ここで開示される細胞分化誘導ペプチドを含む細胞分化誘導剤は、例えば再生医療用途の組成物として好適に利用することができる。
【配列表フリーテキスト】
【0055】
配列番号1〜配列番号33 合成ペプチド
【技術分野】
【0001】
本発明は、胚性幹細胞(ES細胞)や人工多能性幹細胞(iPS細胞)その他の未分化細胞の分化を誘導し得る或いは分化誘導を促進し得る分化誘導活性を有する人工の生理活性ペプチドとその利用に関する。また、該ペプチドを含む細胞分化誘導剤(組成物)ならびに該ペプチドを使用して未分化細胞の分化誘導を促進する方法に関する。
【背景技術】
【0002】
再生医療分野における一つの課題として、未分化状態の培養細胞を、高効率に目的の機能を有する細胞に分化誘導する技術の確立が挙げられる(以下の特許文献参照)。
例えば、近年、特に注目されているiPS細胞やES細胞を未分化状態で培養(増殖)し、当該培養(増殖)により細胞数が増大した未分化幹細胞を、所定の段階で高効率に且つ簡便な手法で目的の機能を有する細胞に分化誘導する方法の確立が求められている。例えば以下の非特許文献1には、培養したiPS細胞から肝細胞を分化誘導したとする技術が記載されている。その他、未分化状態のiPS細胞やES細胞を、心筋細胞、血液細胞、生殖細胞、神経細胞等に分化誘導方法が多数報告されてきている。
【0003】
しかしながら、現在までに報告されている幹細胞の分化誘導法は、操作が煩雑な方法(例えば複数の外来遺伝子の導入を伴う分化誘導法)であったり、或いは、操作自体は比較的容易な方法(例えば液状の数種の分化誘導性化合物を培地に添加する方法)であってもその分化効率が低いものが多く、より簡便で分化効率の高い分化誘導方法が求められている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2009−165481号公報
【特許文献2】特開2009−215191号公報
【特許文献3】国際公開第WO2007/126077号パンフレット
【非特許文献】
【0005】
【非特許文献1】セル・リサーチ(Cell Research)、19巻、2009年、pp.1233−1242
【非特許文献2】PNAS、105巻(25号)、2008年、pp.8778−8783
【非特許文献3】EMBOレポート(EMBO reports)、10巻(3号)、2009年、pp.231−238
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は、上記非特許文献1に記載されるような従前の分化誘導方法とは異なり、人為的に合成可能な比較的短い鎖長のペプチドであって、iPS細胞その他の幹細胞のような未分化状態の細胞の分化誘導を効率的に行う目的に資する分化誘導活性を有する人工ペプチドの提供を目的とする。また、そのようなペプチドを含む細胞分化誘導剤(薬学的組成物)の提供を他の目的とする。また、そのようなペプチドを使用して所定の未分化細胞を分化誘導する方法、或いは、そのようなペプチドを使用して所定の未分化細胞の分化誘導を促進(助長)する方法の提供を他の目的とする。
【課題を解決するための手段】
【0007】
本発明によって提供される細胞分化誘導ペプチドは、所定の未分化細胞に供給された際(典型的には該細胞を培養している培地中に添加される。)、該細胞の分化を誘導し得る或いは該細胞の分化を促進し得るという分化誘導能を有することで特徴付けられる人為的に合成されたペプチドである。
即ち、ここで開示される一つの態様の細胞分化誘導ペプチドは、少なくとも1種の未分化細胞に対する分化誘導活性を有する人為的に合成されたペプチドであって、そのペプチド鎖中に以下の(A)と(B)にそれぞれ規定される部分アミノ酸配列:
(A)膜透過性ペプチドを構成するアミノ酸配列と、
(B)配列番号19〜27のうちから選択されるいずれかのアミノ酸配列、若しくは該選択されたアミノ酸配列のうちの1個又は数個(典型的には2〜5個程度、例えば2個又は3個)のアミノ酸残基が置換、欠失及び/又は付加(挿入)されて形成されたアミノ酸配列と、
を有する合成ペプチドである。
【0008】
また、本発明はここで開示されるいずれかの細胞分化誘導ペプチドを有効成分として含む、少なくとも1種の未分化細胞に対する細胞分化誘導剤を提供する。
典型的には、ここで開示される細胞分化誘導剤は、薬学上許容され得る少なくとも1種の担体(例えば上記ペプチドの安定性向上に資する少なくとも1種の基材、或いは生理食塩水や各種の緩衝液等の液状媒体)を含む。
【0009】
本発明者は、本来は別の機能を有するペプチド若しくは所定のペプチド中の特定の機能により画定された部分(即ちペプチドモチーフ若しくはドメイン)を構成するアミノ酸配列を複数組み合わせて構築した合成ペプチドを、培養中のiPS細胞等の幹細胞(即ち未分化細胞)に供給したところ該未分化培養細胞の形態が変化し、分化誘導されることを見出し、本発明を完成するに至った。具体的には、本発明者は、
(1)膜透過性ペプチドとして知られるペプチドモチーフ(特に、後述する核小体局在シグナルが好ましい。)を構成するアミノ酸配列と、
(2)神経系の発生段階における重要なプロセスである軸索誘導(axonal guidance)等のニューロン新生(neurogenesis)を制御する物質として知られるエフリン(Ephrin:非特許文献2参照)のAファミリー(細胞膜結合型)或いはBファミリー(細胞膜貫通型)に属するタンパク質のシグナルペプチド領域のアミノ酸配列と、
を有する(若しくは該(1)及び(2)のそれぞれのアミノ酸配列のうちの1個又は数個(典型的には2〜5個程度、例えば2個又は3個)のアミノ酸残基が置換、欠失及び/又は付加(挿入)されて形成された改変アミノ酸配列を有する)人為的に合成されたペプチドを提供する。
本発明者は、かかる2種類の機能の異なる(1)と(2)のアミノ酸配列を組み合わせて構築した合成ペプチドが優れた分化誘導活性を示すことを見出し、本発明を完成するに至った。
即ち、ここで開示される合成ペプチド(細胞分化誘導ペプチド)のペプチド鎖の一部を構成する上記(A)に規定されるアミノ酸配列は、膜透過性ペプチドのアミノ酸配列である。一方、上記(B)に規定されるアミノ酸配列は、種々のエフリンのシグナルペプチド領域のアミノ酸配列の具体例であり、配列番号19〜27としてここで開示されている。
【0010】
ここで開示される細胞分化誘導ペプチドは、化学合成(若しくは生合成)によって容易に人為的に製造することができる。また、物質自体が単純な構造(直鎖状のペプチド鎖)であるため、取り扱いが容易であり、例えば、未分化細胞の培養中に該細胞分化誘導ペプチド(若しくは該ペプチドを含む細胞分化誘導剤)を該未分化細胞に(典型的には培地中に)供給するという簡易な処理を行うことによって、当該未分化細胞の分化を誘導ないし該分化誘導の促進を実現することができる。
【0011】
ここで開示される好ましい一態様の合成ペプチド(細胞分化誘導ペプチド)は、上記(A)膜透過性ペプチドを構成するアミノ酸配列として配列番号1〜18のうちから選択されるいずれかのアミノ酸配列、若しくは該選択されたアミノ酸配列のうちの1個又は数個(典型的には2〜5個程度、例えば2個又は3個)のアミノ酸残基が置換、欠失及び/又は付加(挿入)されて形成されたアミノ酸配列を有するペプチドである。
配列番号1〜18としてここで開示されているアミノ酸配列は、上記(A)膜透過性ペプチドを構成するアミノ酸配列の典型例であり、本発明の実施に好適に採用することができる。タンパク質を核内の核小体へ局在化させるシグナル配列であり核小体局在シグナル(NoLS:Nucleolar localization signal、非特許文献3参照)として知られるいずれかのアミノ酸配列(典型的には配列番号1〜15、例えば配列番号14や15)を採用することが特に好ましい。
【0012】
また、ここで開示されるさらに好ましい一態様の合成ペプチド(細胞分化誘導ペプチド)は、該ペプチドを構成する全アミノ酸残基数が100以下(特には50以下)であることを特徴とする。このような短いペプチド鎖のペプチドは化学合成が容易であり、且つ、安価で取扱性に優れるため、細胞分化誘導剤の成分として好ましい。
【0013】
また、ここで開示される好ましい他の一態様の合成ペプチド(細胞分化誘導ペプチド)は、該ペプチドが上記(A)で規定されるアミノ酸配列のN末端側またはC末端側に隣接して上記(B)で規定されるアミノ酸配列を含むことを特徴とする。
このような構成のペプチドは、特に未分化細胞に対する分化誘導活性に優れる。該ペプチドを構成する全アミノ酸残基数が50以下であるものが、シンプルな構成であり化学合成も容易であるために特に好ましい。
本発明によって提供される合成ペプチド(細胞分化誘導ペプチド)の好ましい具体例として配列番号28〜33のうちから選択されるいずれかのアミノ酸配列を有するペプチド(特に全アミノ酸残基数が100以下若しくは50以下のもの)、或いは配列番号28〜33のうちから選択されるいずれかのアミノ酸配列から構成されているペプチドが挙げられる。このような合成ペプチド(細胞分化誘導ペプチド)を含む細胞分化誘導剤は、特にヒト若しくはヒト以外の哺乳動物由来の幹細胞(例えば胚性幹細胞)若しくは人工多能性幹細胞(iPS細胞)の分化誘導ないし分化を促進する用途に好適である。
【0014】
また、本発明は、他の側面として、少なくとも1種の未分化細胞(典型的には生体外で培養する未分化培養細胞、若しくは生体内の未分化細胞)の分化誘導を促進する方法であって、ここで開示されるいずれかの細胞分化誘導ペプチド(換言すればここで開示されるいずれかの細胞分化誘導ペプチドを含む細胞分化誘導剤)を該分化誘導対象とする未分化細胞に対して少なくとも1回供給することを特徴とする方法を提供する。
かかる分化誘導促進方法によると、上記のとおり単純な構成の合成ペプチドを細胞分化誘導因子として使用するという簡易な手法によって、目的の未分化細胞の分化誘導を効率的に実現することができる。
【0015】
また、本発明は、他の側面として、所定の未分化細胞(典型的には生体外で培養する未分化培養細胞、若しくは生体内の未分化細胞)を分化誘導して該分化した細胞又は該分化した細胞から成る組織体を生産する方法であって、該未分化細胞に対して、ここで開示されるいずれかの細胞分化誘導ペプチド(換言すればここで開示されるいずれかの細胞分化誘導ペプチドを含む細胞分化誘導剤)を少なくとも1回供給することを特徴とする生産方法を提供する。
かかる生産方法によると、上記のとおり単純な構成の合成ペプチドを細胞分化誘導因子として使用するという簡易な手法によって、目的の分化された細胞若しくは該分化細胞から成る組織体(皮膚、神経、血管、各種の臓器、等)を効率的に生産することができる。
【0016】
ここで開示される上記分化誘導促進方法または生産方法としての好ましい一態様では、上記未分化細胞がヒト若しくはヒト以外の哺乳動物由来の幹細胞若しくは人工多能性幹細胞(iPS細胞)である。ここで開示される細胞分化誘導ペプチドは、この種の細胞の分化誘導促進に好適に使用することができる。
【0017】
また、被験体(患者)の患部の修復や再生を促進させる目的に、ここで開示される分化誘導促進方法や生産方法を好適に実施することができる。即ち、ここで開示される分化誘導促進方法や生産方法は、修復や再生に資する未分化細胞(特に幹細胞)を生体外で高効率に分化誘導することができるため、本方法の実施によって効率よく生体外で分化誘導させた細胞若しくは該分化細胞から成る組織体を、被験体(患者)の体内に導入することによって、患部の修復や組織再生に要する時間を短縮することができる。
【図面の簡単な説明】
【0018】
【図1】一実施例に係る細胞分化誘導ペプチド(サンプル1)を添加して培養したiPS細胞の形態変化を示す光学顕微鏡写真である。
【図2】一実施例に係る細胞分化誘導ペプチド(サンプル2)を添加して培養したiPS細胞の形態変化を示す光学顕微鏡写真である。
【図3】一実施例に係る細胞分化誘導ペプチド(サンプル3)を添加して培養したiPS細胞の形態変化を示す光学顕微鏡写真である。
【図4】細胞分化誘導ペプチド無添加で培養したiPS細胞(比較例)の形態を示す光学顕微鏡写真である。
【発明を実施するための形態】
【0019】
以下、本発明の好適な実施形態を説明する。なお、本明細書において特に言及している事項(例えば細胞分化誘導ペプチドの一次構造や鎖長)以外の事柄であって本発明の実施に必要な事柄(例えばペプチド合成、細胞培養技法、ペプチドを成分とする薬剤組成物の調製に関するような一般的事項)は、細胞工学、医学、薬学、有機化学、生化学、遺伝子工学、タンパク質工学、分子生物学、衛生学等の分野における従来技術に基づく当業者の設計事項として把握され得る。本発明は、本明細書に開示されている内容と当該分野における技術常識とに基づいて実施することができる。なお、以下の説明では、場合に応じてアミノ酸をIUPAC-IUBガイドラインで示されたアミノ酸に関する命名法に準拠した1文字表記(但し配列表では3文字表記)で表す。
なお、本明細書中に記載されるアミノ酸配列は、常に左側がN末端側であり右側がC末端側である。
また、本明細書中で引用されている全ての文献の全ての内容は本明細書中に参照として組み入れられている。
【0020】
本明細書において「人為的に合成された細胞分化誘導ペプチド」とは、そのペプチド鎖がそれのみで独立して自然界に安定的に存在するものではなく、人為的な化学合成或いは生合成(即ち遺伝子工学に基づく生産)によって製造され、所定の系(例えば細胞分化誘導剤を構成する組成物)の中で安定して存在し得るペプチド断片をいう。
本明細書において「ペプチド」とは、複数のペプチド結合を有するアミノ酸ポリマーを指す用語であり、ペプチド鎖に含まれるアミノ酸残基の数によって限定されないが、典型的には全アミノ酸残基数が概ね100以下、好ましくは50以下(例えば30〜50程度)のような比較的分子量の小さいものをいう。
【0021】
本明細書において「アミノ酸残基」とは、特に言及する場合を除いて、ペプチド鎖のN末端アミノ酸及びC末端アミノ酸を包含する用語である。また、本明細書において所定のアミノ酸配列に対して「改変アミノ酸配列」とは、当該所定のアミノ酸配列が有する細胞分化誘導能を損なうことなく、1個又は数個(典型的には2〜5個程度、例えば2個又は3個)のアミノ酸残基が置換、欠失及び/又は付加(挿入)されて形成されたアミノ酸配列をいう。例えば、1個又は数個(典型的には2〜5個程度、例えば2個又は3個)のアミノ酸残基が保守的に置換したいわゆる同類置換(conservative amino acid replacement)によって生じた配列(例えば塩基性アミノ酸残基が別の塩基性アミノ酸残基に置換した配列)、或いは、所定のアミノ酸配列について1個又は数個(典型的には2〜5個程度、例えば2個又は3個)のアミノ酸残基が付加(挿入)した若しくは欠失した配列等は、本明細書でいうところの改変アミノ酸配列に包含される典型例である。
また、本明細書において「ポリヌクレオチド」とは、複数のヌクレオチドがリン酸ジエステル結合で結ばれたポリマー(核酸)を指す用語であり、ヌクレオチドの数によって限定されない。種々の長さのDNAフラグメント及びRNAフラグメントが本明細書におけるポリヌクレオチドに包含される。また、「人為的に設計されたポリヌクレオチド」とは、そのヌクレオチド鎖(全長)がそれ単独で自然界に存在するものではなく、化学合成或いは生合成(即ち遺伝子工学に基づく生産)によって人為的に合成されたポリヌクレオチドをいう。
【0022】
ここで開示される細胞分化誘導剤は、本発明者によって見出された少なくとも1種の未分化細胞に対する分化誘導活性を有する合成ペプチド(即ち細胞分化誘導ペプチド)を有効成分として含有することで特徴付けられる組成物である。
ここで上記未分化細胞の好適例としては、各種の幹細胞、特にヒト又は他の動物(典型的には脊椎動物、特に哺乳動物)由来の胚性幹細胞(ES細胞ともいう。)、体性幹細胞(神経幹細胞、造血幹細胞、間葉系幹細胞、肝幹細胞、皮膚幹細胞、生殖幹細胞、筋幹細胞、等)或いは人工多能性幹細胞(iPS細胞ともいう。)が挙げられる。ここで開示される細胞分化誘導ペプチドは、特にES細胞、iPS細胞に対する高い分化誘導活性を有する。
ここで開示される細胞分化誘導剤(細胞分化誘導ペプチド)によると、上記のような幹細胞(未分化細胞)を、心筋細胞、血液細胞、皮膚細胞、生殖細胞、神経細胞、血管内皮細胞、肝細胞、膵臓細胞(特にインスリン産生細胞)等に分化誘導することができる、ないしはそのような細胞種への分化誘導を促進することができる。
【0023】
上述のとおり、ここで開示される細胞分化誘導ペプチドは、部分アミノ酸配列として、上記(A)で規定される膜透過性ペプチドを構成するアミノ酸配列(以下「(A)パート配列」と略称する場合がある。)を有する。
(A)パート配列は、細胞膜及び/又は核膜を通過し得る膜透過性ペプチドを構成するアミノ酸配列であれば特に限定なく使用することができる。例えば、本明細書の配列表における配列番号1〜18に示すアミノ酸配列およびそれらの改変アミノ酸配列(膜透過性を保持しているものに限られる。)は、(A)パート配列を構成するアミノ酸配列として好ましい。具体的には以下のとおりである。
【0024】
即ち、配列番号1のアミノ酸配列は、FGF2(塩基性線維芽細胞増殖因子)由来の合計14アミノ酸残基から成るNoLSに対応する。
配列番号2のアミノ酸配列は、核小体タンパク質の1種(ApLLP)由来の合計19アミノ酸残基から成るNoLSに対応する。
配列番号3のアミノ酸配列は、HSV−1(単純ヘルペスウイルス タイプ1)のタンパク質(γ(1)34.5)由来の合計16アミノ酸残基から成るNoLSに対応する。
配列番号4のアミノ酸配列は、HIC(human I-mfa domain-containing protein)のp40タンパク質由来の合計19アミノ酸残基から成るNoLSに対応する。
配列番号5のアミノ酸配列は、MDV(Marek病ウイルス)のMEQタンパク質由来の合計16アミノ酸残基から成るNoLSに対応する。
配列番号6のアミノ酸配列は、アポトーシスを抑制するタンパク質であるSurvivin- deltaEx3由来の合計17アミノ酸残基から成るNoLSに対応する。
配列番号7のアミノ酸配列は、血管増殖因子であるAngiogenin由来の合計7アミノ酸残基から成るNoLSに対応する。
配列番号8のアミノ酸配列は、核リンタンパク質であってp53腫瘍抑制タンパク質と複合体を形成するMDM2由来の合計8アミノ酸残基から成るNoLSに対応する。
配列番号9のアミノ酸配列は、ベータノダウイルスのタンパク質であるGGNNVα由来の合計9アミノ酸残基から成るNoLSに対応する。
配列番号10のアミノ酸配列は、NF−κB誘導性キナーゼ(NIK)由来の合計7アミノ酸残基から成るNoLSに対応する。
配列番号11のアミノ酸配列は、Nuclear VCP-like protein由来の合計15アミノ酸残基から成るNoLSに対応する。
配列番号12のアミノ酸配列は、核小体タンパク質であるp120由来の合計18アミノ酸残基から成るNoLSに対応する。
配列番号13のアミノ酸配列は、HVS(ヘルペスウイルスsaimiri)のORF57タンパク質由来の合計14アミノ酸残基から成るNoLSに対応する。
配列番号14のアミノ酸配列は、細胞内情報伝達に関与するプロテインキナーゼの1種であるヒト内皮細胞に存在するLIMキナーゼ2(LIM Kinase 2)の第491番目のアミノ酸残基から第503番目のアミノ酸残基までの合計13アミノ酸残基から成るNoLSに対応する。
配列番号15のアミノ酸配列は、IBV(トリ伝染性気管支炎ウイルス:avian infectious bronchitis virus)のNタンパク質(nucleocapsid protein)に含まれる合計8アミノ酸残基から成る核小体局在シグナル(Nucleolar localization sequence)に対応する。
配列番号16のアミノ酸配列は、HIV(ヒト免疫不全ウイルス:Human Immunodeficiency Virus)のTATに含まれるタンパク質導入ドメイン由来の合計11アミノ酸配列から成る膜透過性モチーフに対応する。
配列番号17のアミノ酸配列は、上記TATを改変したタンパク質導入ドメイン(PTD4)の合計11アミノ酸配列から成る膜透過性モチーフに対応する。
配列番号18のアミノ酸配列は、ショウジョウバエ(Drosophila)の変異体であるAntennapediaのANT由来の合計18アミノ酸配列から成る膜透過性モチーフに対応する。
これらのうち、特にNoLSに関連するアミノ酸配列(又はその改変アミノ酸配列)が好ましい。特に、配列番号14や15に示すようなNoLS関連のアミノ酸配列が細胞分化誘導ペプチドの(A)パート配列として好ましい。
【0025】
一方、細胞分化誘導ペプチドの(B)パート配列を構成するアミノ酸配列は、上記(A)パート配列と組み合わせることにより良好な分化誘導活性を有するペプチドが構築し得るものとして本発明者により見出された配列(ペプチドモチーフ)であり、配列番号19〜27に具体的アミノ酸配列の例が列挙されている。詳細は以下のとおりである。
【0026】
即ち、配列番号19〜27に示す各アミノ酸配列は、上述したとおり、エフリン(Ephrin)のAファミリー若しくはBファミリーに属するタンパク質のシグナルペプチド領域のアミノ酸配列である。
具体的には、配列番号19は、ヒト由来のEphrin−A2のシグナルペプチド領域の合計24アミノ酸残基から成るアミノ酸配列に対応する。
配列番号20は、マウス由来のEphrin−A2のシグナルペプチド領域の合計24アミノ酸残基から成るアミノ酸配列に対応する。
配列番号21は、ヒト及びマウス由来のEphrin−A3のシグナルペプチド領域の合計22アミノ酸残基から成るアミノ酸配列に対応する。
配列番号22は、ヒト由来のEphrin−A1のシグナルペプチド領域の合計27アミノ酸残基から成るアミノ酸配列に対応する。
配列番号23は、ヒト由来のEphrin−A4のシグナルペプチド領域の合計27アミノ酸残基から成るアミノ酸配列に対応する。
配列番号24は、ヒト由来のEphrin−A5のシグナルペプチド領域の合計27アミノ酸残基から成るアミノ酸配列に対応する。
配列番号25は、ヒト由来のEphrin−B1のシグナルペプチド領域の合計27アミノ酸残基から成るアミノ酸配列に対応する。
配列番号26は、ヒト由来のEphrin−B2のシグナルペプチド領域の合計27アミノ酸残基から成るアミノ酸配列に対応する。
配列番号27は、ヒト由来のEphrin−B3のシグナルペプチド領域の合計27アミノ酸残基から成るアミノ酸配列に対応する。
【0027】
ここで開示される細胞分化誘導ペプチドのペプチド鎖(アミノ酸配列)は、上述したような(A)パート配列と、(B)パート配列とを適宜組み合わせることにより構築される。(A)パート配列と(B)パート配列のいずれが相対的にC末端側(N末端側)に配置されてもよい。また、(A)パート配列と(B)パート配列とは隣接して配置されるのが好ましい。即ち、(A)パート配列と(B)パート配列との間には、両配列部分に包含されないアミノ酸残基が存在しないか或いは存在していても該残基数が1〜3個程度が好ましい。
好ましくは、細胞分化誘導ペプチドは、少なくとも一つのアミノ酸残基がアミド化されているものが好ましい。アミノ酸残基(典型的にはペプチド鎖のC末端アミノ酸残基)のカルボキシル基のアミド化により、合成ペプチドの構造安定性(例えばプロテアーゼ耐性)を向上させ得る。
【0028】
少なくとも1種の未分化細胞に対する分化誘導活性を失わない限りにおいて、(A)パート配列と(B)パート配列を構成するアミノ酸配列以外の配列(アミノ酸残基)部分を含み得る。特に限定するものではないが、かかる部分配列としては(A)パート配列と(B)パート配列部分の3次元形状(典型的には直鎖形状)を維持し得る配列が好ましい。該細胞分化誘導ペプチドは、ペプチド鎖を構成する全アミノ酸残基数が100以下が望ましく、50以下(例えば30〜50程度)が好ましい。このような鎖長の短いペプチドは、化学合成が容易であり、容易に細胞分化誘導ペプチドを提供することができる。なお、ペプチドのコンホメーション(立体構造)については、使用する環境下(生体外若しくは生体内)で分化誘導活性を保持する限りにおいて、特に限定されるものではないが、免疫原(抗原)になり難いという観点から直鎖状又はへリックス状のものが好ましい。このような形状のペプチドはエピトープを構成し難い。かかる観点から、細胞分化誘導剤に適用する細胞分化誘導ペプチドとしては、直鎖状であり比較的低分子量(典型的には100以下(特に50以下、例えば30〜50程度)のアミノ酸残基数)のものが好適である。
【0029】
全体のアミノ酸配列に対する(A)パート配列と(B)パート配列の占める割合(即ちペプチド鎖を構成する全アミノ酸残基数に占める(A)パート配列と(B)パート配列を構成するアミノ酸残基数の個数%)は、分化誘導活性を失わない限り特に限定されないが、当該割合は概ね60%以上が望ましく、80%以上が好ましい。90%以上(例えば(A)パート配列と(B)パート配列とから構成されたペプチド)が特に好ましい。
なお、本発明の細胞分化誘導ペプチドとしては、全てのアミノ酸残基がL型アミノ酸であるものが好ましいが、分化誘導活性を失わない限りにおいて、アミノ酸残基の一部又は全部がD型アミノ酸に置換されているものであってもよい。
【0030】
ここで開示される細胞分化誘導ペプチドのうちペプチド鎖の比較的短いものは、一般的な化学合成法に準じて容易に製造することができる。例えば、従来公知の固相合成法又は液相合成法のいずれを採用してもよい。アミノ基の保護基としてBoc(t-butyloxycarbonyl)或いはFmoc(9-fluorenylmethoxycarbonyl)を適用した固相合成法が好適である。
ここで開示される細胞分化誘導ペプチドは、市販のペプチド合成機(例えば、PerSeptive Biosystems社、Applied Biosystems社等から入手可能である。)を用いた固相合成法により、所望するアミノ酸配列、修飾(C末端アミド化等)部分を有するペプチド鎖を合成することができる。
【0031】
或いは、遺伝子工学的手法に基づいて細胞分化誘導ペプチドを生合成してもよい。このアプローチは、一般にポリペプチドと呼ばれるようなペプチド鎖の比較的長いペプチドを製造する場合に好適である。すなわち、所望する細胞分化誘導ペプチドのアミノ酸配列をコードするヌクレオチド配列(ATG開始コドンを含む。)のDNAを合成する。そして、このDNAと該アミノ酸配列を宿主細胞内で発現させるための種々の調節エレメント(プロモーター、リボゾーム結合部位、ターミネーター、エンハンサー、発現レベルを制御する種々のシスエレメントを包含する。)とから成る発現用遺伝子構築物を有する組換えベクターを、宿主細胞に応じて構築する。
一般的な技法によって、この組換えベクターを所定の宿主細胞に導入し、所定の条件で当該宿主細胞又は該細胞を含む組織や個体を培養する。このことにより、目的とするポリペプチドを細胞内で発現、生産させることができる。そして、宿主細胞(分泌された場合は培地中)からポリペプチドを単離し、精製することによって、目的の細胞分化誘導ペプチドを得ることができる。一般的な技法によって、この組換えベクターを所定の宿主細胞(例えばイースト、昆虫細胞)に導入し、所定の条件で当該宿主細胞又は該細胞を含む組織や個体を培養する。このことにより、目的とするポリペプチドを細胞内で発現、生産させることができる。そして、宿主細胞(分泌された場合は培地中)からポリペプチドを単離し、精製することによって、目的の細胞分化誘導ペプチドを得ることができる。
なお、組換えベクターの構築方法及び構築した組換えベクターの宿主細胞への導入方法等は、当該分野で従来から行われている方法をそのまま採用すればよく、かかる方法自体は特に本発明を特徴付けるものではないため、詳細な説明は省略する。
【0032】
例えば、宿主細胞内で効率よく大量に生産させるために融合タンパク質発現システムを利用することができる。すなわち、目的の細胞分化誘導ペプチドのアミノ酸配列をコードする遺伝子(DNA)を化学合成し、該合成遺伝子を適当な融合タンパク質発現用ベクター(例えばノバジェン社から提供されているpETシリーズおよびアマシャムバイオサイエンス社から提供されているpGEXシリーズのようなGST(Glutathione S-transferase)融合タンパク質発現用ベクター)の好適なサイトに導入する。そして該ベクターにより宿主細胞(典型的には大腸菌)を形質転換する。得られた形質転換体を培養して目的の融合タンパク質を調製する。次いで、該タンパク質を抽出及び精製する。次いで、得られた精製融合タンパク質を所定の酵素(プロテアーゼ)で切断し、遊離した目的のペプチド断片(設計した細胞分化誘導ペプチド)をアフィニティクロマトグラフィー等の方法によって回収する。このような従来公知の融合タンパク質発現システム(例えばアマシャムバイオサイエンス社により提供されるGST/Hisシステムを利用し得る。)を用いることによって、本発明の細胞分化誘導ペプチドを製造することができる。
或いは、無細胞タンパク質合成システム用の鋳型DNA(即ち細胞分化誘導ペプチドのアミノ酸配列をコードするヌクレオチド配列を含む合成遺伝子断片)を構築し、ペプチド合成に必要な種々の化合物(ATP、RNAポリメラーゼ、アミノ酸類等)を使用し、いわゆる無細胞タンパク質合成システムを採用して目的のポリペプチドをインビトロ合成することができる。無細胞タンパク質合成システムについては、例えばShimizuらの論文(Shimizu et al., Nature Biotechnology, 19, 751-755(2001))、Madinらの論文(Madin et al., Proc. Natl. Acad. Sci. USA, 97(2), 559-564(2000))が参考になる。これら論文に記載された技術に基づいて、本願出願時点において既に多くの企業がポリペプチドの受託生産を行っており、また、無細胞タンパク質合成用キット(例えば、日本の東洋紡績(株)から入手可能なPROTEIOS(商標)Wheat germ cell-free protein synthesis kit)が市販されている。
従って、利用する(A)パート配列ならびに(B)パート配列をひとたび決定し、ペプチド鎖を設計しさえすれば、そのアミノ酸配列に従って無細胞タンパク質合成システムによって目的の細胞分化誘導ペプチドを容易に合成・生産することができる。例えば、日本の(株)ポストゲノム研究所のピュアシステム(登録商標)に基づいて本発明の細胞分化誘導ペプチドを容易に生産することができる。
【0033】
ここで開示される細胞分化誘導ペプチドをコードするヌクレオチド配列及び/又は該配列と相補的なヌクレオチド配列を含む一本鎖又は二本鎖のポリヌクレオチドは、従来公知の方法によって容易に製造(合成)することができる。すなわち、設計したアミノ酸配列を構成する各アミノ酸残基に対応するコドンを選択することによって、細胞分化誘導ペプチドのアミノ酸配列に対応するヌクレオチド配列が容易に決定され、提供される。そして、ひとたびヌクレオチド配列が決定されれば、DNA合成機等を利用して、所望するヌクレオチド配列に対応するポリヌクレオチド(一本鎖)を容易に得ることができる。さらに得られた一本鎖DNAを鋳型として用い、種々の酵素的合成手段(典型的にはPCR)を採用して目的の二本鎖DNAを得ることができる。
本発明によって提供されるポリヌクレオチドは、DNAの形態であってもよく、RNA(mRNA等)の形態であってもよい。DNAは、二本鎖又は一本鎖で提供され得る。一本鎖で提供される場合は、コード鎖(センス鎖)であってもよく、それと相補的な配列の非コード鎖(アンチセンス鎖)であってもよい。
本発明によって提供されるポリヌクレオチドは、上述のように、種々の宿主細胞中で又は無細胞タンパク質合成システムにて、細胞分化誘導ペプチド生産のための組換え遺伝子(発現カセット)を構築するための材料として使用することができる。
本発明によると、新規なアミノ酸配列の細胞分化誘導ペプチドをコードするヌクレオチド配列及び/又は該配列と相補的なヌクレオチド配列を含むポリヌクレオチドが提供される。例えば、ペプチド鎖を構成する全アミノ酸残基数が100以下(好ましくは50以下)であって、配列番号28〜33で示されるアミノ酸配列或いは該配列の改変アミノ酸配列、または該配列を含むアミノ酸配列をコードするヌクレオチド配列及び/又は該配列と相補的なヌクレオチド配列を含む(又はそれら配列から実質的に構成された)人為的に設計されたポリヌクレオチドが提供される。
【0034】
ここで開示される好適な細胞分化誘導ペプチドは、少なくとも1種の未分化細胞に対して好ましい分化誘導活性を有する。このため、細胞分化誘導剤の有効成分として好適に使用し得る。なお、細胞分化誘導剤に含有される細胞分化誘導ペプチドは、分化誘導活性を損なわない限りにおいて、塩の形態であってもよい。例えば、常法に従って通常使用されている無機酸又は有機酸を付加反応させることにより得られ得る該ペプチドの酸付加塩を使用することができる。或いは、分化誘導活性を有する限り、他の塩(例えば金属塩)であってもよい。本明細書及び特許請求の範囲に記載の「ペプチド」は、かかる塩形態のものを包含する。
【0035】
ここで開示される細胞分化誘導剤は、有効成分である細胞分化誘導ペプチドをその分化誘導活性が失われない状態で保持し得る限りにおいて、使用形態に応じて薬学(医薬)上許容され得る種々の担体を含み得る。希釈剤、賦形剤等としてペプチド医薬において一般的に使用される担体が好ましい。細胞分化誘導剤の用途や形態に応じて適宜異なり得るが、典型的には、水、生理学的緩衝液、種々の有機溶媒が挙げられる。適当な濃度のアルコール(エタノール等)水溶液、グリセロール、オリーブ油のような不乾性油であり得る。或いはリポソームであってもよい。また、細胞分化誘導剤に含有させ得る他の成分としては、種々の充填剤、増量剤、結合剤、付湿剤、表面活性剤、色素、香料、抗生剤等が挙げられる。或いは、他の公知の細胞分化誘導因子を含有してもよい。ここで開示される細胞分化誘導ペプチドと他の細胞分化誘導因子(レチノイン酸、アクチビン、等)を併用することにより、細胞分化誘導を促進(増強)することができる。
細胞分化誘導剤の形態に関して特に限定はない。例えば、典型的な形態として、液剤、懸濁剤、乳剤、エアロゾル、泡沫剤、顆粒剤、粉末剤、錠剤、カプセル、軟膏、水性ジェル剤等が挙げられる。また、注射等に用いるため、使用直前に生理食塩水又は適当な緩衝液(例えばPBS)等に溶解して薬液を調製するための凍結乾燥物、造粒物とすることもできる。
なお、細胞分化誘導ペプチド(主成分)及び種々の担体(副成分)を材料にして種々の形態の薬剤(組成物)を調製するプロセス自体は従来公知の方法に準じればよく、かかる製剤方法自体は本発明を特徴付けるものでもないため詳細な説明は省略する。処方に関する詳細な情報源として、例えばComprehensive Medicinal Chemistry, Corwin Hansch監修,Pergamon Press刊(1990)が挙げられる。この書籍の全内容は本明細書中に参照として援用されている。
【0036】
ここで開示される細胞分化誘導剤(細胞分化誘導ペプチド)の適用対象未分化細胞は特に制限されず、種々の生物種の未分化細胞を分化誘導する(若しくは分化誘導を促進する)ことが可能である。ヒト又は他の動物(典型的には脊椎動物、特に哺乳動物)由来の胚性幹細胞(ES細胞)、体性幹細胞(神経幹細胞、造血幹細胞、間葉系幹細胞、肝幹細胞、皮膚幹細胞、生殖幹細胞、筋幹細胞、骨髄幹細胞、等)或いは人工多能性幹細胞(iPS細胞)が挙げられる。ここで開示される細胞分化誘導ペプチドは、特に胚性幹細胞、人工多能性幹細胞が適用対象として好ましい。
【0037】
ここで開示される細胞分化誘導剤(細胞分化誘導ペプチド)は、その形態及び目的に応じた方法や用量で使用することができる。
例えば、生体外(インビトロ)で培養(継代)している未分化培養細胞(例えばES細胞株やiPS細胞株)を分化誘導させる場合においては、ここで開示される細胞分化誘導剤(細胞分化誘導ペプチド)の適当量を、分化誘導する対象の未分化培養細胞に対し、培養過程のいずれかの段階(好ましくは未分化状態を維持しつつ所定期間の培養(増殖)や継代を行った後)で培地に添加するとよい。添加量及び添加回数は、培養細胞の種類、細胞密度(培養開始時の細胞密度)、継代数、培養条件、培地の種類、等の条件によって異なり得るため特に限定されない。未分化の幹細胞(特にiPS細胞やES細胞)を培養する場合、培地中の細胞分化誘導ペプチド濃度が概ね0.1μM〜100μMの範囲内、好ましくは0.1μM〜20μM(例えば1μM〜10μM)の範囲内となるように、1〜複数回添加する(例えば細胞の継代時や培地交換時に合わせて複数回供給する)ことが好ましい。
また、ここで開示される細胞分化誘導ペプチドは、対象とする未分化細胞種や目的(生産したい分化細胞の種類)に応じ、他の細胞分化誘導因子と併用することができる。かかる細胞分化誘導因子としては、例えば、レチノイン酸、種々の骨形成因子(BMPファミリーに属する因子)、アクチビン等のTGF−βスーパーファミリーに属する因子、塩基性線維芽細胞増殖因子(bFGF)、酸性線維芽細胞細胞増殖因子(aFGF)等のFGFスーパーファミリーに属する因子、白血病阻害因子(LIF)、コリン作働性神経分化因子(CDF)、毛様体神経栄養因子(CNTF)その他のサイトカインファミリーに属する因子、各種インターロイキン、腫瘍壊死因子(TNF−α)、インターフェロン−γ等が挙げられる。
【0038】
或いはまた、生体内(インビボ)で未分化細胞(例えば所定の部位に移植したiPS細胞、ES細胞その他の幹細胞)を分化誘導させる場合においては、ここで開示される細胞分化誘導剤(即ち細胞分化誘導ペプチド)の適当量を例えば液剤として患部(即ち生体内)に所望量供給することができる。或いは、錠剤等の固体形態のものや軟膏等のゲル状若しくは水性ジェリー状のものを患部(例えば火傷や創傷のような体表面)に投与することができる。これにより、生体内で、典型的には患部又はその周辺に存在する分化させたい目的の未分化細胞(幹細胞等)の分化誘導効率を向上(促進)させることができる。なお、添加量及び添加回数は、分化誘導させたい細胞の種類、存在部位、等の条件によって異なり得るため特に限定されない。
ここで開示される細胞分化誘導剤(細胞分化誘導ペプチド)を生体内の必要な部位に投与することにより、その分化誘導活性によって、神経再生能力、血管新生能力、皮膚再生能力、臓器再生能力等の向上を実現することができる。また、目的の細胞種や器官(臓器)への分化が促進されることにより、例えば、皮膚組織の改善、移植臓器の早期定着、交通事故その他の物理的障害による創傷部や火傷部の早期修復を実現することができる。また、例えば、パーキンソン病、脳梗塞、アルツハイマー病、脊髄損傷による身体の麻痺、脳挫傷、筋萎縮性側索硬化症、ハンチントン病、脳腫瘍、網膜変性症等の神経疾患を再生医療的アプローチによって治療することに資する薬剤組成物として使用することができる。
【0039】
或いはまた、材料とする幹細胞(iPS細胞やES細胞)の培養細胞株から目的の分化細胞(延いては分化した組織や器官)を効率よく生産することができる。即ち、ここで開示される生産方法(インビトロでの分化細胞又は該分化細胞から成る組織体の生産方法)を採用することによって生体外(インビトロ)で効率よく生産した目的の分化細胞(或いは該分化細胞から成る組織や器官)を、修復や再生が必要とされる患部に(即ち患者の生体内に)導入することにより、当該修復や再生を効果的に行うことができる。
【0040】
以下、本発明に関するいくつかの実施例を説明するが、本発明をかかる実施例に示すものに限定することを意図したものではない。
【0041】
<実施例1:ペプチド合成>
計6種類のペプチド(サンプル1〜6)を後述するペプチド合成機を用いて製造した。表1には、これら合成ペプチドのアミノ酸配列等の情報を列挙している。
【0042】
【表1】

【0043】
表1に示すように、サンプル1のペプチド(配列番号28)は、N末端側に(B)パート配列として配列番号19のヒトEphrin−A2のシグナルペプチド由来のアミノ酸配列を有し、該配列に隣接してそのC末端側に(A)パート配列として配列番号14の上記LIMキナーゼ2由来のアミノ酸配列(NoLS)を有する合計37アミノ酸残基から成るペプチドである。
また、サンプル2のペプチド(配列番号29)は、N末端側に(B)パート配列として配列番号20のマウスEphrin−A2のシグナルペプチド由来のアミノ酸配列を有し、該配列に隣接してそのC末端側に(A)パート配列として配列番号14の上記LIMキナーゼ2由来のアミノ酸配列(NoLS)を有する合計37アミノ酸残基から成るペプチドである。
また、サンプル3のペプチド(配列番号30)は、N末端側に(B)パート配列として配列番号21のヒト及びマウスEphrin−A3のシグナルペプチド由来のアミノ酸配列を有し、該配列に隣接してそのC末端側に(A)パート配列として配列番号14の上記LIMキナーゼ2由来のアミノ酸配列(NoLS)を有する合計35アミノ酸残基から成るペプチドである。
また、サンプル4(配列番号31)、サンプル5(配列番号32)及びサンプル6(配列番号33)は、それぞれ、サンプル1、サンプル2及びサンプル3の(A)パート配列と(B)パート配列とを逆にして構成したペプチドである。即ち、N末端側に(A)パート配列を配置しC末端側に(B)パート配列を配置した。
【0044】
なお、いずれのペプチドも、C末端アミノ酸のカルボキシル基(−COOH)はアミド化(−CONH2)されている。いずれのペプチドも、市販のペプチド合成機(Intavis AG社製品)を用いてマニュアルどおりに固相合成法(Fmoc法)を実施して合成した。なお、ペプチド合成機の使用態様自体は本発明を特徴付けるものではないため、詳細な説明は省略する。
合成した各サンプルペプチドは、PBS(リン酸緩衝生理食塩水)に溶かし、ペプチド濃度が1mMのストック液を調製した。
【0045】
<実施例2:合成ペプチドの分化誘導活性評価>
上記実施例1で得られた細胞分化誘導ペプチド(サンプル1〜6)についてインビトロで培養・継代したiPS細胞に対する分化誘導活性を調べた。また、比較例としてペプチド無添加で同様にiPS細胞を培養したものを設けた。評価試験の詳細は以下のとおりである。
【0046】
本実施例で使用するヒト由来のiPS細胞(細胞株:201B2−082008KU)とフィーダー細胞であるマウス胎児線維芽細胞(細胞株:SNL 76/7、以下「MEF」という。)は、京都大学再生医科学研究所山中研究室(山中伸弥教授)から供与されたものを使用した。
先ず、入手したMEFをマイトマイシンC処理(3時間)して不活性化し、1mMのEDTAを含む0.25%トリプシン溶液でトリプシン処理した。上記処理後、FBS含有培地にてトリプシンを失活させるとともに、MEF用培地(7%のFBS(Gibco社製品)、2mMのL−グルタミン(Gibco社製品)、50units/mLのペニシリンと50μg/mLのストレプトマイシン(Gibco社製品)を含むD−MEM培地(Dulbecco's Modified Eagle Medium):Gibco社製品)を用いてMEFを適当な細胞密度に調整し、0.1%ゼラチンで表面コートした培養容器(直径10cmの培養ディッシュ)に上記MEFを播種した。ここでは細胞密度は、約1.25×105cells/mLとなるように播種した。次いで、上記容器をインキュベーターに入れ、5%CO2条件下、37℃で一晩インキュベートした。
その後、MEF用培地を除去し、PBSで洗浄することによってフィーダー細胞を作製した。
【0047】
一方、入手したiPS細胞株にCTK溶液(0.1mg/mLのコラゲナーゼIV(Gibco社製品)、1mMの塩化カルシウム、20%のKSR(KnockOut(商標)Serum Replacement)を含む0.25%トリプシン溶液)を添加してMEFを剥がし、PBSで洗浄した。
次いで、1mLのhESC培地(即ちヒトES細胞培地、ここでは20%のKSR(Gibco社製品)、2mMのL−グルタミン(Gibco社製品)、0.1%の非必須アミノ酸(Gibco社製品)、0.1mMの2−メルカプトエタノール(Gibco社製品)、50units/mLのペニシリンと50μg/mLのストレプトマイシン(Invitrogen社製品)、4ng/mLのbFGF(Basic Fibroblast Growth Factor)を含むDMEM/F12培地(Gibco社製品))を添加し、セルスクレーパを用いてiPS細胞を剥がし、軽くピペッティングを行ってコロニーを崩した。
こうして得られたiPS細胞の懸濁物を上記のように作製しておいた培養容器中のフィーダー細胞上に播種した。そして上記hESC培地を添加し、培養容器をインキュベーターに入れ、5%CO2条件下、37℃で継代培養した。
【0048】
継代数が10パッセージであるiPS細胞の培養容器から培地を除去し、PBSで洗浄した。次いで、上記CTK溶液を添加して細胞塊を培養容器から剥がした。
そして、bFGFを添加しないこと以外は上記組成であるhESC培地(bFGFフリー培地)を上記培養容器に10mL添加して培養細胞を新たな培養容器(直径10cmの培養ディッシュ)に移した。該培養容器にROCK(Rho-associated coiled-coil forming kinase/Rho結合キナーゼ)阻害剤であるY−27632(商品名:(R)-(+)-trans-N-(4-pyridyl)-4-(1-aminoethyl)-cyclohexanecarboxamide・2HCl・H2O)を適量添加し、5%CO2条件下、37℃で3時間インキュベートしてフィーダー細胞を容器に付着させた。
【0049】
上記インキュベート後、培養液を15mL容チューブに移して5分間静置した。その後、上澄み液を除去し、PBS10mLを加えて洗浄した。次いで、遠心分離(900rpm、5分)によって上澄みを除き、沈殿物に上記CTK溶液を0.4mL添加し、37℃にて5分間インキュベートした。5分後、上記bFGFフリー培地を4mL加えてピペッティングを行い、細胞数をカウントした。
細胞密度が2.0×104cells/mLである供試細胞懸濁液を18mLほど調製し、Y−27632を適量添加した。
【0050】
こうして得られた供試iPS細胞懸濁液を、予めマイトマイシンC処理したフィーダー細胞を播種しておいた24ウェルプレートに、1ウェルあたり0.5mL注入(播種)した。
而して、各ウェルに上記ペプチドサンプル1〜6のいずれかをウェル中の培養液のペプチド濃度が2μMとなるように添加した。また、比較例として幾つかのウェルにはペプチドを添加することなく、他のペプチド添加ウェルと同様に培養を行った。
【0051】
上記プレートを5%CO2条件下、37℃でインキュベートし、培養開始から1日(24時間)経過後、培地交換とペプチドの追加添加を行った。具体的には、各ウェルから培地を除去し、新鮮なbFGFフリー培地を1ウェルあたり0.5mL注入し且つ上記ペプチドサンプル1〜6のいずれかをウェル中の培養液のペプチド濃度が2μMとなるように添加した。
さらに上記プレートを5%CO2条件下、37℃でインキュベートし、培養開始から3日経過後、培地交換とペプチドの追加添加を上記培養開始1日経過時と同様に行った。
さらに上記プレートを5%CO2条件下、37℃でインキュベートし、培養開始から5日経過後、6日経過後、8日経過後、9日経過後にそれぞれ培地交換とペプチドの追加添加を行った。具体的には、各ウェルから培地を除去し、新鮮なbFGFフリー培地を1ウェルあたり0.5mL注入し且つ上記ペプチドサンプル1〜6のいずれかをウェル中の培養液のペプチド濃度が4μMとなるように添加した。
【0052】
上記のように、培地交換とペプチドの追加添加を適宜行いつつ培養を継続し、培養開始から11日経過時点の培養iPS細胞の形態を顕微鏡で観察した(図1〜4参照)。
その結果、いずれのサンプルペプチド(細胞分化誘導ペプチド)も添加していない比較例の培養iPS細胞は、図4に示すように、光の透過性が低く顕微鏡下で細胞が白っぽく観察された。
一方、サンプル1〜6を添加して培養したiPS細胞では、サンプル1〜3についてそれぞれ図1〜3に示すように、光の透過性が高く顕微鏡下で細胞が顕著に黒っぽく観察された。かかる光透過性の変化は、iPS細胞の形態が変化した(具体的には細胞質部分が肥大して光の透過性が向上した)ことを示すものであり、比較例に比べて細胞分化誘導(具体的には肝細胞への分化誘導)が著しく促進されたことが確認された。
【0053】
<実施例3:顆粒剤の調製>
サンプル1のペプチド50mgと結晶化セルロース50mg及び乳糖400mgとを混合した後、エタノールと水の混合液1mLを加え混練した。この混練物を常法に従って造粒し、細胞分化誘導ペプチドを主成分とする顆粒剤(即ち、顆粒状の細胞分化誘導剤)を得た。
【産業上の利用可能性】
【0054】
上記のとおり、ここで開示される細胞分化誘導ペプチドは、高い分化誘導活性を有しているため、対象とする未分化細胞(特にES細胞やiPS細胞のような幹細胞)を分化誘導するないしは分化誘導を促進する目的に好適に使用し得る。従って、ここで開示される細胞分化誘導ペプチドを含む細胞分化誘導剤は、例えば再生医療用途の組成物として好適に利用することができる。
【配列表フリーテキスト】
【0055】
配列番号1〜配列番号33 合成ペプチド
【特許請求の範囲】
【請求項1】
少なくとも1種の未分化細胞に対する分化誘導活性を有する人為的に合成されたペプチドであって、
(A)膜透過性ペプチドを構成するアミノ酸配列と、
(B)配列番号19〜27のうちから選択されるいずれかのアミノ酸配列、若しくは該選択されたアミノ酸配列のうちの1個又は数個のアミノ酸残基が置換、欠失及び/又は付加されて形成されたアミノ酸配列と、
を有する合成ペプチド。
【請求項2】
前記(A)膜透過性ペプチドを構成するアミノ酸配列として、配列番号1〜18のうちから選択されるいずれかのアミノ酸配列、若しくは該選択されたアミノ酸配列のうちの1個又は数個のアミノ酸残基が置換、欠失及び/又は付加されて形成されたアミノ酸配列を有する、請求項1に記載の合成ペプチド。
【請求項3】
全アミノ酸残基数が100以下である、請求項1又は2に記載の合成ペプチド。
【請求項4】
前記(A)で規定されるアミノ酸配列のN末端側またはC末端側に隣接して前記(B)で規定されるアミノ酸配列を含む、請求項1〜3のいずれかに記載の合成ペプチド。
【請求項5】
全アミノ酸残基数が50以下である、請求項4に記載の合成ペプチド。
【請求項6】
配列番号28〜33のうちから選択されるいずれかのアミノ酸配列を有する、請求項1〜5のいずれかに記載の合成ペプチド。
【請求項7】
配列番号28〜33のうちから選択されるいずれかのアミノ酸配列から構成されている、請求項1〜5のいずれかに合成ペプチド。
【請求項8】
請求項1〜7のいずれかに記載の合成ペプチドを有効成分として含む、少なくとも1種の未分化細胞に対する細胞分化誘導剤。
【請求項9】
少なくとも1種の未分化細胞の分化誘導を促進する方法であって、
前記未分化細胞に対して、請求項1〜7のいずれかに記載の合成ペプチド若しくは請求項8に記載の細胞分化誘導剤を少なくとも1回供給することを特徴とする、方法。
【請求項10】
前記未分化細胞は、ヒト若しくはヒト以外の哺乳動物由来の幹細胞若しくは人工多能性幹細胞である、請求項9に記載の方法。
【請求項11】
所定の未分化細胞を分化誘導して該分化した細胞又は該分化した細胞から成る組織体を生産する方法であって、
前記未分化細胞に対して、請求項1〜7のいずれかに記載の合成ペプチド若しくは請求項8に記載の細胞分化誘導剤を少なくとも1回供給することを特徴とする、方法。
【請求項12】
前記未分化細胞は、ヒト若しくはヒト以外の哺乳動物由来の幹細胞若しくは人工多能性幹細胞である、請求項11に記載の方法。
【請求項1】
少なくとも1種の未分化細胞に対する分化誘導活性を有する人為的に合成されたペプチドであって、
(A)膜透過性ペプチドを構成するアミノ酸配列と、
(B)配列番号19〜27のうちから選択されるいずれかのアミノ酸配列、若しくは該選択されたアミノ酸配列のうちの1個又は数個のアミノ酸残基が置換、欠失及び/又は付加されて形成されたアミノ酸配列と、
を有する合成ペプチド。
【請求項2】
前記(A)膜透過性ペプチドを構成するアミノ酸配列として、配列番号1〜18のうちから選択されるいずれかのアミノ酸配列、若しくは該選択されたアミノ酸配列のうちの1個又は数個のアミノ酸残基が置換、欠失及び/又は付加されて形成されたアミノ酸配列を有する、請求項1に記載の合成ペプチド。
【請求項3】
全アミノ酸残基数が100以下である、請求項1又は2に記載の合成ペプチド。
【請求項4】
前記(A)で規定されるアミノ酸配列のN末端側またはC末端側に隣接して前記(B)で規定されるアミノ酸配列を含む、請求項1〜3のいずれかに記載の合成ペプチド。
【請求項5】
全アミノ酸残基数が50以下である、請求項4に記載の合成ペプチド。
【請求項6】
配列番号28〜33のうちから選択されるいずれかのアミノ酸配列を有する、請求項1〜5のいずれかに記載の合成ペプチド。
【請求項7】
配列番号28〜33のうちから選択されるいずれかのアミノ酸配列から構成されている、請求項1〜5のいずれかに合成ペプチド。
【請求項8】
請求項1〜7のいずれかに記載の合成ペプチドを有効成分として含む、少なくとも1種の未分化細胞に対する細胞分化誘導剤。
【請求項9】
少なくとも1種の未分化細胞の分化誘導を促進する方法であって、
前記未分化細胞に対して、請求項1〜7のいずれかに記載の合成ペプチド若しくは請求項8に記載の細胞分化誘導剤を少なくとも1回供給することを特徴とする、方法。
【請求項10】
前記未分化細胞は、ヒト若しくはヒト以外の哺乳動物由来の幹細胞若しくは人工多能性幹細胞である、請求項9に記載の方法。
【請求項11】
所定の未分化細胞を分化誘導して該分化した細胞又は該分化した細胞から成る組織体を生産する方法であって、
前記未分化細胞に対して、請求項1〜7のいずれかに記載の合成ペプチド若しくは請求項8に記載の細胞分化誘導剤を少なくとも1回供給することを特徴とする、方法。
【請求項12】
前記未分化細胞は、ヒト若しくはヒト以外の哺乳動物由来の幹細胞若しくは人工多能性幹細胞である、請求項11に記載の方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2011−98900(P2011−98900A)
【公開日】平成23年5月19日(2011.5.19)
【国際特許分類】
【出願番号】特願2009−253701(P2009−253701)
【出願日】平成21年11月5日(2009.11.5)
【出願人】(000003034)東亞合成株式会社 (548)
【Fターム(参考)】
【公開日】平成23年5月19日(2011.5.19)
【国際特許分類】
【出願日】平成21年11月5日(2009.11.5)
【出願人】(000003034)東亞合成株式会社 (548)
【Fターム(参考)】
[ Back to top ]

