細胞分散装置
【課題】生体試料に含まれる凝集細胞を十分に分散させることができる細胞分散装置を提供する。
【解決手段】本発明は、生体試料に含まれる凝集細胞を分散させる細胞分散装置であって、容器51aに収容された生体試料に超音波を付与して凝集細胞を分散させる超音波分散部55と、容器51a内で生体試料を循環させながら凝集細胞に物理的な力を作用させて当該凝集細胞を分散させる物理的分散部51と、物理的分散部51の作動時間と超音波分散部55の作動時間とを少なくとも一部において重複させるように、物理的分散部51及び超音波分散部55の動作を制御する制御部33と、を備える。
【解決手段】本発明は、生体試料に含まれる凝集細胞を分散させる細胞分散装置であって、容器51aに収容された生体試料に超音波を付与して凝集細胞を分散させる超音波分散部55と、容器51a内で生体試料を循環させながら凝集細胞に物理的な力を作用させて当該凝集細胞を分散させる物理的分散部51と、物理的分散部51の作動時間と超音波分散部55の作動時間とを少なくとも一部において重複させるように、物理的分散部51及び超音波分散部55の動作を制御する制御部33と、を備える。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生体から採取された生体試料に含まれる凝集細胞を分散させる細胞分散装置に関する。
【背景技術】
【0002】
フローサイトメータ等を利用して細胞を分析する場合、分析対象となる細胞が凝集した状態であると正確な分析が困難となる。そのため、細胞の分析に先だって、凝集細胞を分散させる技術が種々提案されている。
例えば、特許文献1には、患者の子宮頸部から採取された生体試料に含まれる子宮頸部細胞をフローサイトメータで測定するため、生体試料に対して物理的なせん断力を付与することによって、生体試料中の凝集細胞を分散する技術が開示されている。特許文献2には、植物プランクトンをフローサイトメータで測定するため、植物プランクトンを含む液体試料に超音波を付与することによって植物プランクトンを分散する技術が開示されている。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開2010−172251号公報
【特許文献2】特開2009−192450号公報
【発明の概要】
【発明が解決しようとする課題】
【0004】
特許文献2記載の技術のように、試料に対して超音波を付与すると、強いキャビテーション(気泡の発生と破裂)が発生する腹の部分と、腹の部分よりもキャビテーションの弱い節の部分とが生じる。腹の部分に存在する凝集細胞は強いキャビテーションによって十分に分散されるが、節の部分に存在する凝集細胞は分散が不十分になる可能性がある。また、特許文献2には、液体試料中の植物プランクトンは、超音波を付与するのみで分散することができることが記載されているが、生体から採取された生体試料に含まれる凝集細胞は、超音波のみでは十分に分散されない可能性がある。
【0005】
一方、特許文献1記載の技術の場合、凝集細胞に対して物理的なせん断力を付与しているので、超音波による分散よりも高い分散効果が期待できる。しかし、この種の分散装置においても、より一層高い分散効果が望まれている。
【0006】
このような事情に鑑み、本発明は、生体試料に含まれる凝集細胞を十分に分散させることができる細胞分散装置を提供することを目的とする。
【課題を解決するための手段】
【0007】
(1)本発明の第1の観点による細胞分散装置は、
生体試料に含まれる凝集細胞を分散させる細胞分散装置であって、
容器に収容された生体試料に超音波を付与して凝集細胞を分散させる超音波分散部と、
前記容器内で生体試料を循環させながら凝集細胞に物理的な力を作用させて当該凝集細胞を分散させる物理的分散部と、
前記物理的分散部の作動時間と前記超音波分散部の作動時間とを少なくとも一部において重複させるように、前記物理的分散部及び前記超音波分散部の動作を制御する制御部と、を備える。
【0008】
本発明の第1の観点による細胞分散装置は、物理的分散部と超音波分散部との2つの分散部を備えている。そのため、一方の分散部のみを備えた細胞分散装置と比較して高い分散効果を得ることができる。
さらに、物理的分散部の作動時間と超音波分散部の作動時間とを少なくとも一部において重複させているので、この重複する作動時間においては、物理的分散部によって循環されている生体試料中の凝集細胞が超音波分散部によって分散されることになる。物理的分散部によって生体試料が循環されると、キャビテーションの弱い超音波振動の節の部分に存在していた凝集細胞を、キャビテーションの強い腹の部分に移動させることが可能となり、この腹の部分において十分に凝集細胞を分散させることができる。したがって、本発明の細胞分散装置は、超音波分散部による分散の効果を物理的分散部による循環作用によってより高めることができ、これによって分散部全体として非常に高い分散効果を得ることができる。
また、物理的分散部と超音波分散部の作動時間を重複させているので、それぞれを単独で作動させる場合に比べて全体の分散処理の期間を短縮することができる。
【0009】
なお、上記の本発明において、「物理的な力を作用させて」というのは、凝集細胞に対して何らかの部材を作用させて機械的な力を付与することを意味しており、超音波による力の作用を除外するものである。
【0010】
(2)前記制御部は、前記物理的分散部の作動開始と同時又は作動開始後に、前記超音波分散部の作動を開始させることが好ましい。
この構成によれば、超音波分散部が作動を開始するときは、物理的分散部も作動を開始するか、又は既に作動している状態となる。そのため、超音波分散部は単独で作動を開始することがなく、物理的分散部によって効果的に分散効果が高められる。
【0011】
(3)前記制御部は、前記物理的分散部の作動停止と同時又は作動停止前に、前記超音波分散部の作動を停止させることが好ましい。
この構成によれば、超音波分散部が作動を停止するときは、物理的分散部は作動を停止するか、又は作動を継続している状態となる。そのため、超音波分散部は、作動が停止するまで物理的分散部によって効果的に分散効果が高められる。
【0012】
(4)本発明の第2の観点による細胞分散装置は、
生体試料に含まれる凝集細胞を分散させる細胞分散装置であって、
容器に収容された生体試料に超音波を付与して凝集細胞を分散させる超音波分散部と、
前記容器内で生体試料を循環させながら凝集細胞に物理的な力を作用させて当該凝集細胞を分散させる物理的分散部と、
前記物理的分散部の作動停止後、続けて前記超音波分散部を作動させるように、前記物理的分散部及び前記超音波分散部の動作を制御する制御部と、を備える。
【0013】
本発明の第2の観点による細胞分散装置は、物理的分散部と超音波分散部との2つの分散部を備えている。そのため、一方の分散部のみを備えた細胞分散装置と比較して高い分散効果を得ることができる。
さらに、超音波分散部は、物理的分散部の作動停止後、続けて作動される。そのため、物理的分散部による循環流が残った状態で超音波分散部を作動させることができる。したがって、超音波振動のうちキャビテーション弱い節の部分に存在している凝集細胞をキャビテーションの強い腹の部分に移動させることができ、この腹の部分において十分に凝集細胞を分散させることができる。したがって、本発明の細胞分散装置は、超音波分散部による分散の効果を物理的分散部による循環作用によってより高めることができ、これによって分散部全体として非常に高い分散効果を得ることができる。
なお、上記において、「続けて」というのは、物理的分散部の作動停止後に、他の処理を介在すること無く連続して超音波分散部を作動させることを意味する。したがって、物理的分散部の作動停止と同時に超音波分散部を作動させてもよいし、物理的分散部の作動停止後、僅かな時間が経過したあとに超音波分散部を作動させてもよい。
【0014】
(5)本発明の第3の観点による細胞分散装置は、
生体試料に含まれる凝集細胞を分散させる細胞分散装置であって、
容器に収容された生体試料に超音波を付与して凝集細胞を分散させる超音波分散部と、
前記容器内で生体試料を循環させながら凝集細胞に物理的な力を作用させて当該凝集細胞を分散させる物理的分散部と、
前記物理的分散部と前記超音波分散部とを交互に複数回作動させるように、前記物理的分散部及び前記超音波分散部の動作を制御する制御部と、を備える。
【0015】
本発明の第3の観点による細胞分散装置は、物理的分散部と超音波分散部との2つの分散部を備えている。そのため、一方の分散部のみを備えた細胞分散装置と比較して高い分散効果を得ることができる。
また、物理的分散部は生体試料を循環させるため、この物理的分散部の作動前と作動後とでは生体試料中の凝集細胞の分布が変化する。そのため、物理的分散部と超音波分散部とを交互に作動させることによって、物理的分散部の作動前に行われた超音波分散処理でキャビテーションの弱い節の部分に凝集細胞が存在していたとしても、当該物理的分散部の作動後に行われる超音波分散処理では当該凝集細胞をキャビテーションの強い腹の部分に移動させることが可能となり、これによって十分に凝集細胞を分散させることができる。したがって、本発明の細胞分散装置は、超音波分散部による分散の効果を物理的分散部による循環作用によってより高めることができ、これによって分散部全体として非常に高い分散効果を得ることができる。
【0016】
(6)前記物理的分散部と前記超音波分散部とは一体的に構成されていてもよい。
この構成によれば、物理的分散部と超音波分散部とをそれぞれ個別に移動させる構成が不要となり、装置の小型化や簡素化が可能となる。
【0017】
(7)本発明の細胞分散装置は、前記容器に洗浄液を供給する洗浄液供給部をさらに備え、
前記制御部は、前記洗浄液供給部によって前記容器に洗浄液を供給したのち、前記物理的分散部の少なくとも一部が前記容器に供給された洗浄液内に存在する状態で、前記超音波分散部を作動させることが好ましい。
この構成によれば、超音波分散部により洗浄液に付与される超音波によって物理的分散部の洗浄効果を高めることができる。また、物理的分散部の洗浄と容器の洗浄とを同一の場所で同時に行うことができ、洗浄処理時間を短縮できるとともに、洗浄のためのスペースを小さくすることができる。
【0018】
(8)前記物理的分散部は、前記容器内の生体試料の循環流が、前記超音波分散部による超音波の伝達方向と同一方向又は逆方向に流れるように、生体試料を循環させてもよい。
超音波分散部によって生体試料に付与される超音波は、その伝達方向に沿って節と腹とが交互に発生する。そのため、超音波の伝達方向と同一方向又は逆方向に生体試料を循環させることによって、超音波に節の部分に存在していた凝集細胞を好適に腹の部分にも移動させることができ、当該凝集細胞を強いキャビテーションによって効果的に分散させることができる。
【0019】
(9)前記物理的分散部は、側面及び先端にそれぞれ孔が形成され、前記容器に対して上方から挿入される筒状部材と、前記筒状部材の内部に設けられており、前記筒状部材の側面の孔及び先端の孔の一方から他方へ向かう液流を発生させる液流発生部材とを備え、
前記超音波分散部は、前記容器の底部に設けられ、前記容器の上方に向かって超音波を付与する振動子を備えることが好ましい。
【発明の効果】
【0020】
本発明によれば、生体試料に含まれる凝集細胞を十分に分散させることができる。
【図面の簡単な説明】
【0021】
【図1】本発明の第1の実施の形態に係る細胞分散装置(細胞分散部)を有する細胞分析装置の全体構成を示した斜視図である。
【図2】図1に示される細胞分析装置の測定装置の構成を示したブロック図である。
【図3】図2に示される測定装置の各部の平面的な配置を示した模式図である。
【図4】図2に示される測定装置の主検出部を構成するフローサイトメータを示した模式図である。
【図5】図3に示される測定装置の第1分散部の構成を示した斜視図である。
【図6】図5に示される第1分散部の縦断面図である。
【図7】図6に示される第1分散部の有孔部材の上面図である。
【図8】図7の500−500線に沿った有孔部材の断面図である。
【図9】図3に示される測定装置の第1分散部と第2分散部とを示す正面図(一部断面図)である。
【図10】図9に示される第1分散部と第2分散部との動作を説明するための模式図である。
【図11】図9に示される第1分散部と第2分散部との動作を説明するためのタイムチャートである。
【図12】細胞分析装置の動作手順を示すフローチャートである。
【図13】本発明の第2の実施の形態に係る細胞分散装置の第1分散部と第2分散部との動作を説明するためのタイムチャートである。
【図14】本発明の第3の実施の形態に係る細胞分散装置の第1分散部と第2分散部とを示す正面図(一部断面図)である。
【図15】本発明の第4の実施の形態に係る細胞分散装置の第1分散部と第2分散部とを示す正面図(一部断面図)である。
【発明を実施するための形態】
【0022】
[第1の実施の形態]
図1は、本発明の第1の実施の形態に係る細胞分散装置を有する細胞分析装置の全体構成を示した斜視図である。本実施の形態の細胞分析装置1は、患者等の被検者から採取した細胞を含む測定試料をフローセルに流し、フローセルを流れる測定試料にレーザ光を照射し、測定試料からの光(前方散乱光、側方蛍光等)を検出してその光信号を分析することにより、細胞に癌細胞が含まれているか否かを判断するものである。より具体的に、本実施の形態の細胞分析装置1は、子宮頸部の上皮細胞を分析対象としており、子宮頸癌をスクリーニングするのに用いられる。
【0023】
また、細胞分析装置1は、被検者から採取された生体試料に細胞分散処理や染色処理等を行って測定試料を調製し、測定試料に対してレーザ光による光学的な測定を行う測定装置2と、測定装置2での測定結果の分析等を行うデータ処理装置4とを備えている。
【0024】
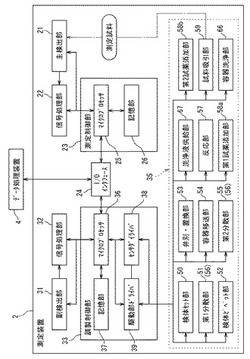
図2に示されるように、測定装置2は、主検出部21と、信号処理部22と、測定制御部23と、I/Oインタフェース24とを備えている。また、測定装置2は、副検出部31と、信号処理部32と、調製制御部33と、生体試料に対する成分調製を自動的に行うための調製デバイス部35とを備えている。
【0025】
主検出部21は、測定試料から測定対象細胞(子宮頸部の上皮細胞)やその核の数及びサイズ等を検出する機能を有する。本実施の形態の主検出部21には、図4に示すフローサイトメータ10が設けられている。
【0026】
信号処理部22は、主検出部21からの出力信号に対して必要な信号処理を行う信号処理回路からなる。また、測定制御部23は、マイクロプロセッサ25と記憶部26とを含んでいる。記憶部26は、主検出部21等の制御プログラムやデータを格納するROM及びRAM等からなる。
【0027】
測定制御部23のマイクロプロセッサ25は、I/Oインタフェース24を介して、データ処理装置4と調製制御部33の後述するマイクロプロセッサ36とに接続されている。これにより、データ処理装置4及び調製制御部33のマイクロプロセッサ36との間で各種データを送受信することが可能である。
【0028】
副検出部31は、生体試料に含まれる測定対象細胞の細胞数を検出する機能を有する。本実施の形態では、副検出部31についても、図4に示されるものとほぼ同様のフローサイトメータ10が採用されている。信号処理部32は、副検出部31からの出力信号に対して必要な信号処理を行う信号処理回路からなる。調製制御部33は、マイクロプロセッサ36と、記憶部37と、センサドライバ38と、駆動部ドライバ39とを含んでいる。また、記憶部37は、副検出部31や調製デバイス部35等を制御するための制御プログラム等を格納するROM及びRAM等からなる。
【0029】
調製デバイス部35は、検体セット部50と、検体ピペット部52と、弁別・置換部53と、容器移送部54と、洗浄液供給部67と、反応部57と、第1試薬添加部58aと、第2試薬添加部58bと、試料吸引部59と、容器洗浄部66とを備えている。さらに調製デバイス部35は、生体試料に含まれる凝集した細胞を分散するための細胞分散部(細胞分散装置)56を備えている。この細胞分散部56は、第1分散部(物理的分散部)51と第2分散部(超音波分散部)55とからなる。
【0030】
図3に示されるように、検体セット部50は、メタノールを主成分とする保存液と生体試料との混合液を収容する複数の生体容器6をセットするためのものである。検体セット部50は、セットされた生体容器6を検体ピペット部52による生体試料の吸引位置まで順次搬送する機能を有する。
【0031】
検体ピペット部52は、生体容器6内の生体試料を細胞分散部56に移送する機能、細胞分散部56内の生体試料を弁別・置換部53及び副検出部31に移送する機能、並びに、弁別・置換部53において濃縮された濃縮液を測定試料容器7に供給する機能を有する。具体的には、検体ピペット部52は、細胞分散部56の試料収容部51a、弁別・置換部53、副検出部31の試料取込部31a、及び試料受け渡し部52bに位置づけられた測定試料容器7等の上方位置へ移動可能に構成されている。また、検体ピペット部52は、生体試料の吸引及び吐出を行うピペット52aを有し、図示しない検体定量部(定量シリンダ、定量シリンダ内のピストンを駆動するモータ等からなる)により生体試料を定量して所定量の生体試料を上記した各部に供給することが可能なように構成されている。
【0032】
細胞分散部56は、生体試料に含まれる凝集細胞を分散させるための第1分散処理と第2分散処理とを生体試料に実行する機能を有する。第1分散処理は、第1分散部51によって実行され、第2分散処理は、第2分散部55によって実行される。
第1分散部51は、試料収容部51aに供給された生体試料中の凝集細胞に対して物理的な力、具体的にはせん断力を付与するように構成されている。また、第2分散部55は、試料収容部51aに供給された生体試料に超音波振動を付与するように構成されている。この第1分散部51及び第2分散部55の構成については、後に詳細に説明する。
【0033】
洗浄液供給部67は、細胞分散部56によって凝集細胞の分散処理が行われた後、細胞分散部56に対して洗浄液を供給する機能を有する。細胞分散部56は、供給された洗浄液によって第1分散部51や第2分散部55の構成部品を洗浄する。これにより、その後の分散処理において、他の生体試料に対するコンタミネーションを抑制することができる。
【0034】
弁別・置換部53は、細胞分散部56による分散処理後の生体試料と保存液との混合液を受け入れ、メタノールを主成分とする保存液を希釈液に置換する機能を有する。また、弁別・置換部53は、生体試料中に含まれる測定対象細胞(上皮細胞)とそれ以外の細胞(赤血球、白血球、細菌等)とを弁別する機能を有する。また、弁別・置換部53は、主検出部21による測定に必要な細胞測定数を得るために生体試料に含有される測定対象細胞の濃縮を行う機能を有する。弁別・置換部53は、図3に示されるように処理の効率化のために2つ設けられている。なお、弁別・置換部53には、たとえば国際公開第2009/122999号に開示された公知の構成を採用することが可能であるので、弁別・置換部53の具体的な構成についての説明は省略する。
【0035】
容器移送部54は、反応部57にユーザによってセットされた測定試料容器7をはさみ状の把持部54aにより把持して、試料受け渡し部52bと反応部57とに測定試料容器7を移送する機能を有する。容器移送部54は、所定の回動中心回りの円周状軌跡Cに沿って把持部54aを移動させるように構成されている。また、容器移送部54は、把持部54aを上下方向に移動させることが可能に構成されている。なお、試料受け渡し部52bと反応部57とは、この円周状軌跡C上に配置されている。これにより、反応部57にユーザによってセットされた測定試料容器7を容器移送部54の把持部54aにより把持して円周状軌跡C上の試料受け渡し部52bに移送することが可能である。
【0036】
反応部57は、測定試料容器7内の生体試料と第1試薬添加部58a及び第2試薬添加部58bにより添加される試薬との反応を促進させる機能を有する。反応部57は、図示しない駆動部により回転可能に構成された円形の回転テーブル57aを備えている。回転テーブル57aの外周縁部には、測定試料容器7をセット可能な複数の保持部57bが設けられている。この保持部57bにユーザによって測定試料容器7がセットされる。また、回転テーブル57aの回転による保持部57bの軌跡と容器移送部54の把持部54aの円周状軌跡Cとは所定位置で交差しており、この交差位置で容器移送部54が測定試料容器7を保持部57bにセットすることが可能なように構成されている。また、反応部57は、保持部57bにセットされた測定試料容器7を所定温度に加温して、生体試料と試薬との反応を促進させる機能を有する。
【0037】
第1試薬添加部58a及び第2試薬添加部58bは、それぞれ、反応部57(回転テーブル57a)の保持部57bにセットされた測定試料容器7内に試薬を供給する機能を有する。第1試薬添加部58a及び第2試薬添加部58bは、回転テーブル57aの周縁部近傍の位置に設置され、回転テーブル57aにセットされた測定試料容器7の上方の第1試薬添加位置P1及び第2試薬添加位置P2まで移動可能な供給部58c,58dを有する。これにより、回転テーブル57aにより第1試薬添加位置P1又は第2試薬添加位置P2に測定試料容器7が搬送されたときに、測定試料容器7内に供給部58c(58d)から所定量の試薬を添加することが可能となっている。
【0038】
本実施の形態では、第1試薬添加部58aにより添加される試薬は、細胞にRNA処理を行うためのRNaseであり、第2試薬添加部58bにより添加される試薬は、PI染色を行うための染色液である。RNA処理とは、細胞中のRNAを分解するための処理であり、この処理により細胞核のDNAのみを測定することが可能となる。PI染色は、色素を含む蛍光染色液であるヨウ化プロピジウム(PI)により行われる。PI染色では細胞内の核に選択的に染色が施されることにより、核からの蛍光が検出可能となる。第1の実施の形態では、第1分散処理及び第2分散処理が実行された後に、試薬(RNase及び染色液)の添加が行われるように構成されている。
【0039】
試料吸引部59は、反応部57(回転テーブル57a)にセットされた測定試料容器7内の測定試料を吸引して、主検出部21に測定試料を移送する機能を有する。試料吸引部59は、回転テーブル57aの周縁部近傍の位置に設置され、回転テーブル57aにセットされた測定試料容器7の上方の吸引位置P3まで移動可能なピペット59aを有する。これにより、回転テーブル57aにより吸引位置P3に測定試料容器7が搬送されたときに、測定試料容器7内の測定試料を吸引することが可能となっている。
【0040】
試料吸引部59は、図示しない流路を介して主検出部21の後述するフローセル13(図4参照)に接続されており、ピペット59aにより吸引した測定試料を主検出部21のフローセル13に供給することが可能なように構成されている。なお、本実施の形態では、生体試料は、第1試薬添加部58a及び第2試薬添加部58bによる処理の後に他の処理を介在させることなく試料吸引部59によって吸引される。したがって、第1試薬添加部58a及び第2試薬添加部58bによる処理の完了直後に、主検出部21による検出が実行されるように構成されている。
【0041】
容器洗浄部66は、試料吸引部59により測定試料が主検出部21に供給された後の測定試料容器7の内部を洗浄する機能を有する。容器洗浄部66は、回転テーブル57aの保持部57bに保持された測定試料容器7内に洗浄液を吐出することにより、測定試料容器7の内部を洗浄するように構成されている。これにより、その後の測定処理において同じ測定試料容器7を用いた場合に、他の生体試料とのコンタミネーションを抑制することが可能となる。
【0042】
図2に示されるように、調製制御部33のマイクロプロセッサ36は、センサドライバ38または駆動部ドライバ39を介して、調製デバイス部35の各部(検体セット部50、第1分散部51、検体ピペット部52、弁別・置換部53、容器移送部54、第2分散部55、洗浄液供給部67、反応部57、第1試薬添加部58a、第2試薬添加部58b及び試料吸引部59)のセンサ類や駆動モータと接続されている。これにより、マイクロプロセッサ36は、センサからの検知信号に基づいて制御プログラムを実行し、駆動モータの動作を制御する。
【0043】
図1に示されるように、データ処理装置4は、例えばノートPCやデスクトップPC等のパーソナルコンピュータからなり、制御部41と、表示部42と、入力デバイス43とを含んでいる。制御部41は、CPU、ROM,RAM及びハードディスク等からなる記憶部、CD−ROMドライブ等の読出装置、及び各種入出力インタフェース等を備えている。制御部41の記憶部には、オペレーティングシステム及びアプリケーションプログラム等の各種プログラムの他、図2に示される測定制御部23及び調製制御部33への動作命令の送信、測定装置2で行った測定結果の受信及び分析処理、並びに、処理した分析結果の表示等を行う操作プログラムがインストールされている。また、データ処理装置4は、測定装置2のI/Oインタフェース24とも接続されている。これにより、測定装置2とデータ処理装置4との間でデータの送受信を行うことが可能である。
【0044】
次に、測定装置2の主検出部21を構成するフローサイトメータ10について説明する。図4に示されるように、フローサイトメータ10のレンズ系11は、光源である半導体レーザ12からのレーザ光を、生体試料を通過させるフローセル13を流れる測定試料に集光する機能を有する。集光レンズ14は、測定試料中の細胞の前方散乱光をフォトダイオード15からなる散乱光検出器に集光する機能を有する。
【0045】
側方用の集光レンズ16は、測定対象細胞及びこの細胞中の核の側方散乱光と側方蛍光とをダイクロイックミラー17に集光する機能を有する。ダイクロイックミラー17は、側方散乱光をフォトマルチプライヤ(光電子増倍管)18へ反射させるとともに、側方蛍光をフォトマルチプライヤ(光電子増倍管)19の方へ透過させるように構成されている。これらの光は、測定試料中の細胞や核の特徴を反映したものとなっている。
【0046】
そして、フォトダイオード15、フォトマルチプライヤ18及び19は、受光した光信号を電気信号に変換して、それぞれ、前方散乱光信号(FSC)、側方散乱光信号(SSC)及び側方蛍光信号(SFL)を出力する。これらの出力信号は図示しないプリアンプにより増幅され、測定装置2の信号処理部22(図2参照)に送られる。測定装置2の信号処理部22で処理された各信号FSC、SSC、SFLは、それぞれ、マイクロプロセッサ25によってI/Oインタフェース24からデータ処理装置4に送信される。
【0047】
データ処理装置4の制御部41(図1参照)は、記憶部に記憶された操作プログラムを実行することにより、各信号FSC、SSC、SFLに基づいて、前方散乱光強度、側方蛍光強度等の特徴パラメータを取得し、これらの特徴パラメータに基づいて、細胞や核を分析するための頻度分布データを作成する。そして、制御部41は、この頻度分布データに基づいて、測定試料中の粒子の弁別処理を行い、測定対象細胞(上皮細胞)が異常であるか否か、具体的には癌化した細胞(異型細胞)であるか否かを判定する。
【0048】
また、副検出部31は、上記のように主検出部21とほぼ同じ構成のフローサイトメータ10を採用しているので、詳細な説明を省略する。なお、副検出部31は、主検出部21による本測定の前に測定対象細胞の濃度測定を予備的に行うものであるので、副検出部31では、その細胞数を計数するための信号を出力できれば足りる。具体的には、細胞数を計数するために前方散乱光信号(FSC)を取得できればよい。
【0049】
次に、細胞分散部56の具体的な構成を説明する。
細胞分散部56を構成する第1分散部51は、図5及び図6に示されるように、有孔部材60と、ローター(液流発生部材)70と、このローター70を回転駆動させるモータ80とを備えている。ローター70の外側には、生体試料の流れをガイドする機能を有するパイプ(筒状部材)90が配置されており、このパイプ90の先端の開口に有孔部材60が取り付けられている。パイプ90及び有孔部材60を試料収容部51a(図9及び図10参照)内に挿入してローター70を回転させることにより、試料収容部51a内の生体試料に含まれる凝集細胞が単一細胞に分散される。
【0050】
試料収容部51aは、図9及び図10に示されるように、ステンレス等によって形成された容器からなり、底板51a1と、この底板51a1の外周部から上方へ立ち上がる側壁51a2と、この側壁51a2の上端に取り付けられた上板51a3とを有している。そして、試料収容部51aは、底板51a1及び側壁51a2によって形成されるスペースに生体試料を収容可能に構成されている。また、上板51a3の中央部には、第1分散部51のパイプ90及び有孔部材60を挿入することができる開口部51a4が形成されている。第1分散部51は、図示しないアクチュエータ等によって上下方向や水平方向に移動可能であり、試料収容部51aの上方位置から下方へ移動することによって開口部51a4を介してパイプ90及び有孔部材60を試料収容部51a内に挿入することができる。
【0051】
図7及び図8に示されるように、有孔部材60は、耐薬品性や強度等を考慮してステンレスで作製されており、円筒形状の筒部61と、筒部61の下端を塞ぐように設けられ、4つの孔部63を有する底部62とが一体的に形成されている。有孔部材60は、パイプ90の先端の開口に取り付けられている。底部62は、平面的に見て円形に形成されている。4つの孔部63は、底部62の上面(内表面)から下面(外表面)までを貫通する。これらの孔部63は、凝集細胞(大きさ約100μm以上約500μm以下)が通過可能な大きさに形成されている。
【0052】
底部62の上面には、平面的に見て、ローター70の回転方向(矢印R方向)と直交する方向(半径方向)に延びるとともに、ローター70側(上方)に突出する4つの凸部64が形成されている。また、底部62の上面には、これらの凸部64を境界とする凹部からなる4つの保液部65が形成されている。本実施の形態では、図8に示されるように、底部62(凸部64)の厚さt1が約1mmとされ、保液部65の深さt2が約0.5mmとされている。
【0053】
図7に示されるように、底部62の4つの孔部63は、4つの保液部65内にそれぞれ配置されている。本実施の形態の孔部63は、幅Wが約0.5mm、長さLが約3.25mmの細長形状に形成されている。また、孔部63は、矢印R方向(ローター70の回転方向)と直交する方向に延びている。より具体的に、孔部63は、扇形状の保液部65の内部における、ローター70の回転方向(矢印R方向)の先方側の端部で凸部64と隣接し、当該凸部64と平行に延びている。また、孔部63は、扇形状の保液部65の半径方向内側の端部から半径方向外側の端部まで延びている。
【0054】
図6に示されるように、ローター70は、底部62と同じく耐薬品性や強度等を考慮してステンレスで作製され、パイプ90の内部に配置されている。ローター70の外周には、螺旋状の溝71が形成されている。溝71は、約40度のリード角で形成されている。また、溝71は、ローター70が矢印R方向(図7参照)に回転(正転)した場合に、下方(矢印Z2方向)へ生体試料を送るように設けられている。これにより、ローター70は、モータ80により軸心回り(矢印R方向)に回転されることによって、生体試料を下方の底部62に向けて供給する(生体試料に下方の推進力を付与する)ことができる。また、ローター70の下端面72は、平坦に形成されている。
【0055】
図10に示されるように、ローター70の下端面72と、パイプ90の下端に取り付けられた有孔部材60の底部62の上面(凸部64の上面)とは、所定の間隔CL1を隔てて離間するように構成されている。この間隔CL1は、凝集細胞(100μm以上)は通過不能で、かつ、単一細胞(平均60μm)は通過可能な大きさを有する。したがって、間隔CL1は、測定対象とする子宮頸部の上皮細胞(単一細胞)の大きさ(平均60μm)と略等しくなるように30〜80μmの範囲で設定されている。本実施の形態では、この間隔CL1は約50μmである。なお、図10では説明のために間隔CL1を誇張して図示している。
【0056】
ここで、凝集細胞は100μmを超える大きさとなるため、間隔CL1を約50μmとすることにより、凝集細胞に対して効果的にせん断力を与えることが可能である。このように、第1分散部51は、モータ80によりローター70を回転させることにより、有孔部材60の凸部64とローター70の下端面72との間で凝集細胞を分散するように構成されている。なお、間隔CL1を30〜80μmに設定したのは、30μm未満であれば、細胞が破砕されることがあり、80μmを超えると凝集細胞に与える分散力が低下してしまうことがあるためである。
【0057】
図6に示されるように、ローター70の上端部73は、回転軸74を介してモータ80の出力軸80aに連結されている。これにより、モータ80の駆動力(回転力)がローター70に伝達される。モータ80は、支持部材81の上面に取り付けられている。支持部材81の下部には、下方に延びるように筒体82が取り付けられている。この筒体82の内部において、回転軸74が回転可能に支持されている。
【0058】
パイプ90は、ローター70を内部に収容可能な内径を有するステンレス製の円形パイプからなる。パイプ90の上端は、回転軸74が挿入された筒体82に連結されている。回転軸74に取り付けられたローター70は、パイプ90と有孔部材60とにより、側方と下方とを取り囲まれるように配置されている。なお、図10に示されるように、ローター70の溝71が形成された外周とパイプ90の内周面とは、僅かに間隔CL2(約0.3mm)を隔てて離間している。
【0059】
パイプ90の側壁には、ローター70が配置される位置よりもやや上方の位置に長孔形状の開口部92(図5及び図10参照)が2つ形成されている。この2つの開口部92は、パイプ90の芯を中心として対向する位置に形成されている。図10に示されるように、パイプ90の外部の生体試料は、開口部92を流入口としてパイプ90内に導入され、ローター70により流入口からパイプ90内部を下方(矢印Z2方向)に移動する。そして、生体試料は、下端の有孔部材60の孔部63を流出口としてパイプ90の外側に流出し、再度開口部92(流入口)へ流入する。これにより、流入口(開口部92)からパイプ90の内側、流出口(孔部63)、パイプ90の外側、流入口(開口部92)へと生体試料を流動させる上下方向の循環流が形成される。
【0060】
次に、細胞分散部56を構成する第2分散部55の具体的な構成を説明する。
図9及び図10に示されるように、第2分散部55は、第1分散部51と同様に試料収容部51a内の生体試料に対して凝集細胞の分散処理を行うものである。具体的に、第2分散部55は、試料収容部51a内の生体試料に対して超音波振動を付与する超音波振動子112を備えている。この超音波振動子112は、試料収容部51aの底板51a1の下面に取り付けられている。超音波振動子112としては、たとえば部品の洗浄等に用いられる公知のものを利用することができる。また、超音波振動子112が取り付けられる試料収容部51aの底板51a1は、超音波振動子112からの振動を効果的に生体試料に伝達できるよう薄肉(例えば、約0.5mm)の板材によって形成されている。
【0061】
また、生体試料に超音波振動を効果的に発生させるため、超音波振動子112によって生じる超音波振動の節Pが生体試料の上面に位置するように、試料収容部51a内に収容される生体試料の量が設定されている。超音波振動は、節Pと節Pの間のλ/2(λは超音波振動の波長)の範囲で振動振幅が大きくなる。
【0062】
第2分散部55は、超音波振動子112によって発生した超音波振動が生体試料中にキャビテーション(微細な気泡の発生と気泡の破裂)を発生させ、キャビテーションに伴う衝撃(圧力変動)により、凝集した細胞を分散させる。特に、超音波振動の節と節との間のλ/2の範囲では振動振幅が大きくなるので、凝集した細胞の分散作用がより高くなる。
【0063】
なお、超音波振動子112により発生される超音波振動の振動数は、特に限定されるものではないが、第2分散処理に際して試料収容部51aに収容されている生体試料の量と、超音波振動の効率的な伝達等の観点から設定されることが好ましく、例えば、20kHz以上で、20kHz〜75kHzであることが好ましい。
【0064】
次に、細胞分析装置1の分析動作について説明する。なお、測定装置2の主検出部21及び信号処理部22の動作制御は、測定制御部23(マイクロプロセッサ25)により実行され、測定装置2の副検出部31、信号処理部32及び調製デバイス部35の動作制御は、調製制御部33(マイクロプロセッサ36)により実行される。データ処理装置4の制御は、制御部41(CPU)により実行される。
【0065】
図12に示されるように、細胞分析装置1による分析に際して、まず、ユーザにより分散液としてN−アセチル−L−システイン(NAC)を生体試料に添加する等の前処理が行われる。その後、生体試料と、アルコールを主成分とする保存液とが収容された生体容器6がユーザにより検体セット部50(図3参照)にセットされ、細胞分析装置1による分析が開始される。
【0066】
分析が開始されると、図12のステップS1において、細胞分散部56により生体試料中の凝集細胞の分散処理(第1分散処理及び第2分散処理)が行われる。具体的には、図3に示されるように、生体試料と、アルコールを主成分とする保存液とが収容された生体容器6内の混合液が、検体セット部50において検体ピペット部52によって吸引される。そして、検体ピペット部52が試料収容部51aの上方に移動して、試料収容部51a内に混合液を供給する。その後、試料収容部51a内の混合液が細胞分散部56で分散される。
【0067】
図11は、図9に示される細胞分散部56の動作を説明するためのタイムチャートである。本実施の形態の細胞分散部56は、第1分散部51と第2分散部55とを備えており、これらは図11に示されるように互いに連係した運転を行う。本実施の形態では、まず、第1分散部51が作動を開始し、数秒間(例えば7秒間)が経過してから第2分散部55が作動を開始する。そして、第2分散部55が所定時間経過後に作動を停止し、第1分散部51も所定時間経過後に作動を停止する。第1分散部51の作動時間は約20秒とされ、第2分散部55の作動時間は約10秒とされている。そして、以上の第1分散部51及び第2分散部55の動作が数回(例えば3サイクル)繰り返して行われる。
【0068】
したがって、第1分散部51と第2分散部55とは、作動時間が少なくとも一部において重複している。また、第1分散部51は、第2分散部55よりも先に作動を開始し、第2分散部55よりも後で作動を停止する。また、第1分散部51は、図11に示されるように、停止前の数秒間(約2秒)でローター70の回転方向を反転させるように構成されている。
【0069】
第1分散部51の動作をより詳しく説明する。図9及び図10に示されるように、調製制御部33(図2参照)により第1分散部51を下方に移動させて試料収容部51a内に有孔部材60及びパイプ90を挿入し、モータ80を駆動させると、回転軸74とローター70とが軸心回りに矢印R方向(図7参照)に回転する。このとき、ローター70の外周の溝71の回転により、溝71内の生体試料が下方の底部62(ローター70の下端面72と底部62との間)に向けて送られる。モータ80の回転数は例えば約10000rpmとすることができる。
【0070】
底部62に送られた生体試料は、凸部64によって分割された保液部(凹部)65(図7参照)に流れ込み、保液部65内に一時的に貯留(保液)される。この際、保液部65内に流れ込んだ生体試料の上方(矢印Z1方向)には、矢印R方向に回転するローター70の下端面72が存在するため、生体試料は保液部65内で矢印R方向に移動される。保液部65内における生体試料の矢印R方向の流れは、保液部65を分割する凸部64(図
7参照)の壁面により遮られる。これにより、矢印R方向の生体試料の流れは、矢印R方向側の端部に形成された孔部63から下方(外部)に流出しようとする生体試料の流れと、凸部64の壁面に沿って上方に移動して凸部64を乗り越えようとする生体試料の流れとに分かれる。
【0071】
孔部63から下方(外部)に流出しようとする生体試料の流れは、底部62の外部に流出(噴出)するとともに、ローター70の回転によりパイプ90の周壁の開口部92を介してパイプ90内部に引き込まれる。この結果、流入口(開口部92)からパイプ90内側、流出口(孔部63)、パイプ90外側、流入口(開口部92)へと循環する生体試料の流れが形成される。
【0072】
凸部64を乗り越えようとする流れは、ローター70の下端面72と凸部64の上面との間を通過する。ここで、ローター70の下端面72と底部62との間隔CL1は、凝集細胞が通過不可能な間隔(約50μm)である。このため、凸部64を乗り越えようとする流れに含まれる凝集細胞には回転されているローター70(下端面72)と固定的に設置された凸部64との間で機械的なせん断力が付与され、凝集細胞が単一細胞に分散される。なお、間隔CL1は単一細胞が通過可能な大きさであるので、凸部64を乗り越えようとする流れに含まれる単一細胞(及び分散された単一細胞)は、流れに乗って凸部64を乗り越える。このようにして凝集細胞は次々と分散され、所定時間(合計約60秒間)にわたって循環流を循環させることによって、生体試料中の凝集細胞が単一細胞に分散される。
なお、第1分散部51は、作動停止前の数秒間(約2秒間)、ローター70の回転を反転させるように構成されている。これにより、作動停止直前にパイプ90や有孔部材60の内部に細胞が残留しないように開口部92から排出することができる。
【0073】
他方、調製制御部33により第2分散部55の超音波振動子112を作動させると、試料収容部51aの底板51a1から試料収容部51a内の生体試料に超音波振動が伝達される。そして、この超音波振動が生体試料中にキャビテーションを発生させ、キャビテーションに伴う衝撃により、凝集した細胞が分散される。
【0074】
図11に示されるように、第2分散部55が作動している間は、第1分散部51も同時に作動しているので、生体試料は常に上下方向に循環している。そのため、生体試料中の凝集細胞は、循環流にのって超音波振動の節Pの部分と腹の部分とを通過する。超音波振動は、節Pの部分でキャビテーションが弱くなるため凝集細胞の分散作用も小さくなるが、生体試料は循環しているので超音波振動の節Pの部分に凝集細胞が滞留してしまうことがない。そのため、生体試料に含まれる凝集細胞を超音波振動の腹の部分で適切に分散させることができる。
【0075】
すなわち、第2分散部55を単独で作動させたとすると、超音波振動の節Pの部分で滞留した凝集細胞に強いキャビテーションを作用させることが出来ず、分散が不十分となる可能性があるが、本実施の形態では、第2分散部55を第1分散部51と連係させて作動することによって、凝集細胞を十分な分散させることができる。
【0076】
また、第1分散部51においては、ローター70の下面と底部62との間に形成された隙間CL1(図10参照)を通過できるような小さな凝集細胞を分散させることができないが、このような凝集細胞は、第2分散部55による超音波振動によって適切に分散させることができる。
【0077】
本実施の形態では、第1分散部51の作動時間と第2分散部55の作動時間とを少なくとも一部において重複させているので、それぞれを個別に作動させる場合に比べて短時間で分散処理を行うことができる。また、第1分散部51と第2分散部55とは、同一の試料収容部51a内の生体試料に対して処理を行うので、異なる場所で処理を行う場合に比べて測定装置2を小型化することができる。
【0078】
細胞分散部56による分散処理が終了すると、ステップS2において、調製制御部33により検体ピペット部52(図3参照)が作動され、分散済みの生体試料を含む混合液が副検出部31の試料取込部31aに供給される。これにより、副検出部31のフローセル13(図4参照)に分散済みの生体試料を含む混合液が送液される。そして、この副検出部31を用いて、フローサイトメトリー法によって生体試料のプレ測定(混合液に含まれる測定対象細胞の数の検出)が行われる。プレ測定の結果、癌判定ために測定装置2が行う本測定の前に、混合液(生体試料及び保存液)に含まれる測定対象細胞(上皮細胞)の濃度を反映した濃度情報が得られる。
【0079】
プレ測定が行われると、調製制御部33により、混合液(生体試料及び保存液)が副検出部31から排出される。そして、得られた濃度情報に基づいて混合液(生体試料および保存液)中の測定対象細胞(上皮細胞)の濃度が算出される。さらに、算出された濃度に基づいて、本測定に用いる測定試料を調製するための、混合液(生体試料及び保存液)の吸引量が決定される。すなわち、プレ測定に用いた生体試料中の測定対象細胞の濃度(単位体積あたりの測定対象細胞の数)と、本測定における癌細胞検出のために必要な有意細胞数とに基づき、この有意細胞数が確保される程度に本測定を行うために必要な混合液(生体試料及び保存液)の採取料(液量)が演算される。
【0080】
次に、ステップS3において、演算された採取料(液量)の混合液(生体試料及び保存液)について弁別・置換処理が実行される。すなわち、図3に示されるように、調製制御部33により検体ピペット部52が作動され、演算された吸引量だけ細胞分散部56の試料収容部51aから混合液(生体試料及び保存液)が吸引される。吸引された混合液が弁別・置換部53に供給されることにより、弁別・置換処理が開始される。
【0081】
この弁別・置換処理において、弁別・置換部53により、アルコールを主成分とする保存液が希釈液に置換されるとともに、測定対象細胞とその他の細胞や夾雑物とが弁別される。また、弁別の過程で測定対象細胞を含む液体が濃縮され、測定対象細胞の濃度が上昇する。この結果、癌細胞検出のために必要な有意細胞数を含むように測定対象細胞が濃縮された濃縮液が得られる。
【0082】
図3に示されるように、測定対象細胞が濃縮された濃縮液は、弁別・置換部53から検体ピペット部52によって吸引される。これに並行して、容器移送部54が反応部57の保持部57bにセットされた測定試料容器7を把持して取り出し、試料受け渡し部52bに位置づける。そして、検体ピペット部52が試料受け渡し部52bに位置づけられた測定試料容器7の上方(試料受け渡し部52bの上方)に移動して、測定試料容器7に濃縮液を供給する。その後、濃縮液を収容する測定試料容器7が容器移送部54により反応部57(回転テーブル57a)の保持部57bにセットされる。
【0083】
反応部57に測定試料容器7がセットされると、ステップS4において、試薬(RNase)の添加及び加温により、濃縮液中のRNA除去処理が行われる。具体的には、回転テーブル57aにセットされた測定試料容器7が第1試薬添加位置P1まで移動され、第1試薬添加部58aの供給部58cから測定試料容器7内の濃縮液に対して所定量の試薬(RNase)が添加される。その後、反応部57により測定試料容器7内の液体が所定温度(約37℃)で約10分間加温されることにより、RNA除去処理が実行される。
なお、試薬(RNase)の添加後、反応が完了するまでの約10分間の間に、回転テーブル57aにより測定試料容器7が第2試薬添加位置P2まで移動される。
【0084】
RNA除去処理の後、ステップS5において、試薬(染色液)の添加及び加温により、測定試料容器7内の測定対象細胞のDNAの染色処理が行われる。RNA除去処理が完了した時点で、回転テーブル57aにより測定試料容器7が第2試薬添加位置P2まで移動されるため、これに同期して第2試薬添加部58bの供給部58dから測定試料容器7内に所定量の試薬(染色液)が添加される。その後、反応部57により測定試料容器7内の液体が所定温度(約37℃)で約1分間加温されることにより、DNA染色処理が実行される。なお、染色液の添加後、反応(染色)が完了するまでの約1分間の間に、回転テーブル57aにより測定試料容器7が試料吸引部59の吸引位置P3まで移動される。
【0085】
次に、ステップS6において、染色処理済みの測定試料が主検出部21のフローセル13に送られるとともに、測定試料中の細胞に対する本測定が行われる。染色処理が完了した時点で、回転テーブル57aにより測定試料容器7が試料吸引部59の吸引位置P3まで移動されるため、これに同期して試料吸引部59のピペット59aが吸引位置P3まで移動される。これにより、染色処理が完了した直後に他の処理が介在することなく試料吸引部59のピペット59aにより測定試料が吸引される。そして、吸引された測定試料が試料吸引部59から主検出部21のフローセル13(図4参照)に移送されるとともに、測定装置2の測定制御部23(図2参照)により測定試料中の細胞に対する本測定が行われる。測定試料が主検出部21に送られた後に、容器洗浄部66によって測定試料容器7の内部が洗浄され、洗浄された測定試料容器7はその後の測定処理に用いられる。
【0086】
本測定後、ステップS7において、得られた測定データが測定装置2の測定制御部23からデータ処理装置4に送信される。データ処理装置4の制御部41は、測定装置2から測定データを受信したか否かを常時判定している。測定装置2から測定データを受信すると、ステップS8において、データ処理装置4の制御部41により、その測定データに基づいて測定試料中の粒子の弁別処理が行われ、測定試料中の測定対象細胞(上皮細胞)が異常であるか否か、すなわち、癌化した細胞(異型細胞)であるか否か等が判定される。以上により、測定処理が終了する。
【0087】
一方、ステップS9では、分散処理が終了した後の細胞分散部56の洗浄が行われる。まず、細胞分散部56の試料収容部51aに残った生体試料が排出され、その後、調製制御部33(図2参照)により洗浄液供給部67を作動させ、試料収容部51a内に洗浄液を供給する。そして、調製制御部33により試料収容部51a内に第1分散部51のパイプ90及び有孔部材60を挿入させ、これらを洗浄液に漬けた状態で、ローター70を回転させるとともに超音波振動子112を作動させる。この動作により、パイプ90や有孔部材60の内部で洗浄液が循環し、これらの部材やローター70が洗浄される。また、超音波振動子112によって洗浄液にキャビテーションが発生し、キャビテーションに伴う衝撃によって試料収容部51aの内部や第1分散部51のパイプ90、有孔部材60、及びローター70に付着していた汚れ等が引き剥がされる。したがって、単に洗浄液内でローター70を回転させてパイプ90や有孔部材60の内部を洗浄する場合に比べ、第2分散部55によって洗浄効果をより高めることができる。
なお、このステップS9の洗浄工程は、ステップS3の後、生体試料が次に試料収容部51a内に供給されるまでの間に行えばよく、ステップS4以降のいずれかの工程と並行して行ってもよい。
【0088】
以上説明した本実施の形態では、細胞分析装置1の測定装置2が、第1分散処理を行う第1分散部51と、第1分散処理とは異なる第2分散処理を行う第2分散部55とからなる細胞分散部56を備えているので、種類の異なる複数の分散処理を生体試料に行うことができる。そのため、生体試料中の細胞の凝集度合いが高い場合であっても効果的に細胞を分散させることができ、精度の高い細胞の検出やその検出結果に基づいた精度の高い細胞の分析を行うことができる。
【0089】
また、第1分散部51と第2分散部55とを互いに連係して作動させているため、生体試料中の凝集細胞をより効果的に分散させることができる。特に、第1分散部51によって生体試料を循環させることによって、第2分散部55による分散作用を効果的に高めることができる。
【0090】
また、第1分散部51及び第2分散部55による分散処理は、副検出部31による検出前に実行されるので、凝集細胞が十分に分散された状態で副検出部31による検出を行うことができる。この結果、副検出部31による検出の精度を向上させることができる。そして、副検出部31による検出結果に基づいて、検体ピペット部52により弁別・置換部53に供給される生体試料の量が調製されるように構成されているので、癌細胞検出のために必要な有意細胞数を含むように主検出部21による検出に適した測定試料の調製(生体試料中の測定対象細胞の濃縮)を行うことができる。
【0091】
また、第2試薬添加部58bによる染色液の添加は、第1分散部51及び第2分散部55による分散処理後に行われるので、十分に単一の細胞に分散された後の細胞に確実に染色を行うことができる。
【0092】
また、生体試料は、第1分散部51及び第2分散部55による分散処理後に第1試薬添加部58a及び第2試薬添加部58bにより処理され、第1試薬添加部58a及び第2試薬添加部58bによる処理後に他の処理を介在させることなく主検出部21による検出が行われる。そのため、染色液の添加を含む試薬による処理を、第1分散部51及び第2分散部55による分散処理によって凝集細胞が分散された後の単一の細胞に対して実行することができる。そして、試薬による処理と検出部による検出との間に他の処理が介在することがないので、試薬による処理が完了した直後に細胞の検出を行うことができる。この結果、検出対象の細胞が壊れる前に速やかに細胞検出を行うことができる。
【0093】
また、主検出部21は、生体試料を通過させるフローセル13と、フローセル13を通過する生体試料に光を照射する半導体レーザ12と、半導体レーザ12が生体試料に光を照射することによって生じる光を受光するフォトダイオード15、フォトマルチプライヤ18及び19とを含む。このように構成することによって、第1分散部51及び第2分散部55による分散処理によって効果的に分散された個々の細胞に対してフローサイトメトリー法による検出を行うことができるので、フローサイトメトリー法による検出精度を向上させることができる。
【0094】
また、主検出部21は、生体試料に含まれる上皮細胞を検出するように構成され、データ処理装置4は、検出した上皮細胞が癌細胞(異型細胞)であるか否かを分析するように構成されている。このように構成することによって、種類の異なる複数の分散処理を生体試料に実行することにより、生体試料中の上皮細胞の凝集度合いによらず精度の高い細胞検出を行うことが可能な癌細胞(異型上皮細胞)の細胞分析装置1を得ることができる。
【0095】
[第2の実施の形態]
図13は、本発明の第2の実施の形態に係る細胞分散装置の第1分散部と第2分散部との動作を説明するためのタイムチャートである。
前述の第1の実施の形態では、図11に示されるように細胞分散部56の第1分散部51と第2分散部55の作動時間が重複していたが、本実施の形態の細胞分散部56は、第1分散部51の作動を停止した後、続けて第2分散部55の作動を開始させるように構成されている。
【0096】
図13に示す例では、第1分散部51は、作動を開始してから18秒後に停止し、この停止と同時に第2分散部55が作動を開始し、その10秒後に停止している。そして、第1分散部51と第2分散部55の動作を数回(例えば、3サイクル)繰り返し行うことによって、試料収容部51a中の生体試料に含まれる凝集細胞を分散させるようになっている。
【0097】
第1分散部51を作動させると、停止後も暫くの間は生体試料に循環流が残った状態となる。そのため、第1分散部51の作動を停止した後、続けて第2分散部55を作動させると、超音波振動の節Pの部分に存在する凝集細胞を生体試料の循環流で超音波振動の腹の部分に移動させることが可能となる。そのため、凝集細胞を強いキャビテーションによって適切に分散させることができる。
【0098】
また、本実施の形態では、第1分散部51と第2分散部55とを交互に複数回ずつ作動させているので、次のような利点もある。第1分散部51を作動させると、試料収容部51a内の生体試料には循環流が発生するため、この第1分散部51の作動前と作動後とでは、生体試料中における凝集細胞の分布が変化する。このため、第1分散部51の作動前に行われる第2分散処理で、超音波振動の節Pの部分に存在していた凝集細胞は、第1分散部51の作動後の第2分散処理では超音波振動の節Pの部分から移動している可能性が高くなる。したがって、凝集細胞をより強いキャビテーションを作用させ、効果的に凝集細胞を分散させることができる。
【0099】
なお、本実施の形態において、第1分散部51や第2分散部55の作動時間や作動サイクルは適宜変更することができる。また、第2分散部55は、第1分散部51の作動停止と同時に作動を開始しなくてもよく、第1分散部51の停止後、時間をあけて第2分散部55を作動させてもよい。
【0100】
[第3の実施の形態]
図14は、本発明の第3の実施の形態に係る細胞分散装置の第1分散部と第2分散部とを示す正面図(一部断面図)である。本実施の形態の細胞分散部56は、第1分散部51と第2分散部55とが一体的に構成されている。具体的に、第2分散部55は、第1分散部51の支持部材81に取り付けられている。また、第2分散部55は、棒状の超音波振動子112を備えており、この超音波振動子112は、第1分散部51の筒体82やパイプ90と略平行に配置され、パイプ90及び有孔部材60とともに試料収容部51a内に挿入される。
【0101】
本実施の形態においても、上記第1の実施の形態と略同様の作用効果を奏する。また、本実施の形態では、第1分散部51と第2分散部55とが一体的に構成されているので、これらを別々に構成する場合に比べて細胞分散部56を小型化することができる。また、第1分散部51と第2分散部55とを一つの移動機構によって移動させることができるため、細胞分散部56の小型化や構造の簡素化を行うことができる。
なお、本実施の形態の細胞分散部56は、図11及び図13に示す動作パターンのいずれをも適用することができる。
【0102】
[第4の実施の形態]
図15は、本発明の第4の実施の形態に係る細胞分散装置の第1分散部と第2分散部とを示す正面図(一部断面図)である。
本実施の形態の細胞分散部56は、第1分散部51と第2分散部55とが別体で構成されている。そして、第1分散部51と第2分散部とはそれぞれ個別に上下方向や水平方向に移動可能とされ、試料収容部51aに対して個別に挿入されるように構成されている。
【0103】
本実施の形態においても、上記第1の実施の形態と略同様の作用効果を奏する。ただし、本実施の形態の場合、第1分散部51と第2分散部55とによって同時に凝集細胞を分散させることができない。そのため、前述した動作パターン(図11及び図13参照)のうち、図13に示すものが適用される。
【0104】
本発明は、上記実施の形態に限定されるものではなく、特許請求の範囲に記載された発明の範囲内において、適宜変更することができる。
たとえば、上記実施の形態では、子宮頸部の上皮細胞を分析する細胞分析装置1に本発明を適用した例を示したが、本発明はこれに限られない。子宮頸部の上皮細胞以外の細胞の分析を行う細胞分析装置に本発明を適用してもよい。
【0105】
また、図11に示す実施の形態では、第1分散部51の作動開始後に第2分散部55の作動を開始し、第1分散部51の作動停止前に第2分散部55の作動を停止しているが、第1分散部51と第2分散部55との作動開始のタイミングを一致させてもよいし、第1分散部51と第2分散部55との作動停止のタイミングを一致させてもよい。また、第1分散部51の作動停止後に、第2分散部55の作動を停止させてもよい。第1分散部51と第2分散部55との作動開始と作動停止の双方のタイミングを一致させてもよい。
【0106】
また、図13に示す実施の形態では、第1分散部51と第2分散部55と同じ回数だけ作動させているが、一方を他方よりも多く作動させてもよい。
【0107】
また、上記実施の形態では、副検出部31によるプレ測定の前に第1分散部51及び第2分散部55を作動させて凝集細胞を分散させているが、他のタイミングで第1分散部51及び第2分散部55を作動させてもよい。例えば、図12のステップS4の工程を行う前に第1分散部51及び第2分散部55を作動させてもよい。
【0108】
上記第1の実施の形態では、試料収容部51aの底板51a1に対して超音波振動を付与していたが、側壁51a2等の他の箇所に超音波振動を付与してもよい。また、第1分散部51による生体試料の循環方向は、上下方向(垂直方向)とするに限らず、水平方向とすることができる。ただし、第1分散部51による生体試料の循環方向は、上記第1の実施の形態のように、第2分散部55による超音波の伝達方向と一致させておくのが好ましい。これにより、超音波振動の節と腹が並ぶ方向に生体試料を循環させることができ、凝集細胞を確実に超音波振動の腹の部分に移動させ、強いキャビテーションによって効果的に凝集細胞を分散させることができる。
【0109】
また、上記実施の形態では、フローセルと、半導体レーザ(光源部)と、フォトダイオード及びフォトマルチプライヤ(受光部)とを備えたフローサイトメータからなる主検出部を設けた例を示したが、本発明はこれに限られない。本発明では、フローサイトメータ以外の検出部を設けてもよい。
【0110】
なお、上記実施の形態における各種の寸法(間隔CL1、CL2、底部(凸部)の厚さt1、保液部の深さt2等)等はあくまでも例示に過ぎず、本発明はこれに限られない。各部の寸法は、一度に分散処理を行う生体試料の量や、分散処理の対象となる細胞の種類に応じて変更すればよい。
【符号の説明】
【0111】
1 細胞分析装置
4 データ処理装置
33 調製制御部
51 第1分散部(物理的分散部)
51a 試料収容部
55 第2分散部(超音波分散部)
56 細胞分散部(細胞分散装置)
67 洗浄液供給部
【技術分野】
【0001】
本発明は、生体から採取された生体試料に含まれる凝集細胞を分散させる細胞分散装置に関する。
【背景技術】
【0002】
フローサイトメータ等を利用して細胞を分析する場合、分析対象となる細胞が凝集した状態であると正確な分析が困難となる。そのため、細胞の分析に先だって、凝集細胞を分散させる技術が種々提案されている。
例えば、特許文献1には、患者の子宮頸部から採取された生体試料に含まれる子宮頸部細胞をフローサイトメータで測定するため、生体試料に対して物理的なせん断力を付与することによって、生体試料中の凝集細胞を分散する技術が開示されている。特許文献2には、植物プランクトンをフローサイトメータで測定するため、植物プランクトンを含む液体試料に超音波を付与することによって植物プランクトンを分散する技術が開示されている。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開2010−172251号公報
【特許文献2】特開2009−192450号公報
【発明の概要】
【発明が解決しようとする課題】
【0004】
特許文献2記載の技術のように、試料に対して超音波を付与すると、強いキャビテーション(気泡の発生と破裂)が発生する腹の部分と、腹の部分よりもキャビテーションの弱い節の部分とが生じる。腹の部分に存在する凝集細胞は強いキャビテーションによって十分に分散されるが、節の部分に存在する凝集細胞は分散が不十分になる可能性がある。また、特許文献2には、液体試料中の植物プランクトンは、超音波を付与するのみで分散することができることが記載されているが、生体から採取された生体試料に含まれる凝集細胞は、超音波のみでは十分に分散されない可能性がある。
【0005】
一方、特許文献1記載の技術の場合、凝集細胞に対して物理的なせん断力を付与しているので、超音波による分散よりも高い分散効果が期待できる。しかし、この種の分散装置においても、より一層高い分散効果が望まれている。
【0006】
このような事情に鑑み、本発明は、生体試料に含まれる凝集細胞を十分に分散させることができる細胞分散装置を提供することを目的とする。
【課題を解決するための手段】
【0007】
(1)本発明の第1の観点による細胞分散装置は、
生体試料に含まれる凝集細胞を分散させる細胞分散装置であって、
容器に収容された生体試料に超音波を付与して凝集細胞を分散させる超音波分散部と、
前記容器内で生体試料を循環させながら凝集細胞に物理的な力を作用させて当該凝集細胞を分散させる物理的分散部と、
前記物理的分散部の作動時間と前記超音波分散部の作動時間とを少なくとも一部において重複させるように、前記物理的分散部及び前記超音波分散部の動作を制御する制御部と、を備える。
【0008】
本発明の第1の観点による細胞分散装置は、物理的分散部と超音波分散部との2つの分散部を備えている。そのため、一方の分散部のみを備えた細胞分散装置と比較して高い分散効果を得ることができる。
さらに、物理的分散部の作動時間と超音波分散部の作動時間とを少なくとも一部において重複させているので、この重複する作動時間においては、物理的分散部によって循環されている生体試料中の凝集細胞が超音波分散部によって分散されることになる。物理的分散部によって生体試料が循環されると、キャビテーションの弱い超音波振動の節の部分に存在していた凝集細胞を、キャビテーションの強い腹の部分に移動させることが可能となり、この腹の部分において十分に凝集細胞を分散させることができる。したがって、本発明の細胞分散装置は、超音波分散部による分散の効果を物理的分散部による循環作用によってより高めることができ、これによって分散部全体として非常に高い分散効果を得ることができる。
また、物理的分散部と超音波分散部の作動時間を重複させているので、それぞれを単独で作動させる場合に比べて全体の分散処理の期間を短縮することができる。
【0009】
なお、上記の本発明において、「物理的な力を作用させて」というのは、凝集細胞に対して何らかの部材を作用させて機械的な力を付与することを意味しており、超音波による力の作用を除外するものである。
【0010】
(2)前記制御部は、前記物理的分散部の作動開始と同時又は作動開始後に、前記超音波分散部の作動を開始させることが好ましい。
この構成によれば、超音波分散部が作動を開始するときは、物理的分散部も作動を開始するか、又は既に作動している状態となる。そのため、超音波分散部は単独で作動を開始することがなく、物理的分散部によって効果的に分散効果が高められる。
【0011】
(3)前記制御部は、前記物理的分散部の作動停止と同時又は作動停止前に、前記超音波分散部の作動を停止させることが好ましい。
この構成によれば、超音波分散部が作動を停止するときは、物理的分散部は作動を停止するか、又は作動を継続している状態となる。そのため、超音波分散部は、作動が停止するまで物理的分散部によって効果的に分散効果が高められる。
【0012】
(4)本発明の第2の観点による細胞分散装置は、
生体試料に含まれる凝集細胞を分散させる細胞分散装置であって、
容器に収容された生体試料に超音波を付与して凝集細胞を分散させる超音波分散部と、
前記容器内で生体試料を循環させながら凝集細胞に物理的な力を作用させて当該凝集細胞を分散させる物理的分散部と、
前記物理的分散部の作動停止後、続けて前記超音波分散部を作動させるように、前記物理的分散部及び前記超音波分散部の動作を制御する制御部と、を備える。
【0013】
本発明の第2の観点による細胞分散装置は、物理的分散部と超音波分散部との2つの分散部を備えている。そのため、一方の分散部のみを備えた細胞分散装置と比較して高い分散効果を得ることができる。
さらに、超音波分散部は、物理的分散部の作動停止後、続けて作動される。そのため、物理的分散部による循環流が残った状態で超音波分散部を作動させることができる。したがって、超音波振動のうちキャビテーション弱い節の部分に存在している凝集細胞をキャビテーションの強い腹の部分に移動させることができ、この腹の部分において十分に凝集細胞を分散させることができる。したがって、本発明の細胞分散装置は、超音波分散部による分散の効果を物理的分散部による循環作用によってより高めることができ、これによって分散部全体として非常に高い分散効果を得ることができる。
なお、上記において、「続けて」というのは、物理的分散部の作動停止後に、他の処理を介在すること無く連続して超音波分散部を作動させることを意味する。したがって、物理的分散部の作動停止と同時に超音波分散部を作動させてもよいし、物理的分散部の作動停止後、僅かな時間が経過したあとに超音波分散部を作動させてもよい。
【0014】
(5)本発明の第3の観点による細胞分散装置は、
生体試料に含まれる凝集細胞を分散させる細胞分散装置であって、
容器に収容された生体試料に超音波を付与して凝集細胞を分散させる超音波分散部と、
前記容器内で生体試料を循環させながら凝集細胞に物理的な力を作用させて当該凝集細胞を分散させる物理的分散部と、
前記物理的分散部と前記超音波分散部とを交互に複数回作動させるように、前記物理的分散部及び前記超音波分散部の動作を制御する制御部と、を備える。
【0015】
本発明の第3の観点による細胞分散装置は、物理的分散部と超音波分散部との2つの分散部を備えている。そのため、一方の分散部のみを備えた細胞分散装置と比較して高い分散効果を得ることができる。
また、物理的分散部は生体試料を循環させるため、この物理的分散部の作動前と作動後とでは生体試料中の凝集細胞の分布が変化する。そのため、物理的分散部と超音波分散部とを交互に作動させることによって、物理的分散部の作動前に行われた超音波分散処理でキャビテーションの弱い節の部分に凝集細胞が存在していたとしても、当該物理的分散部の作動後に行われる超音波分散処理では当該凝集細胞をキャビテーションの強い腹の部分に移動させることが可能となり、これによって十分に凝集細胞を分散させることができる。したがって、本発明の細胞分散装置は、超音波分散部による分散の効果を物理的分散部による循環作用によってより高めることができ、これによって分散部全体として非常に高い分散効果を得ることができる。
【0016】
(6)前記物理的分散部と前記超音波分散部とは一体的に構成されていてもよい。
この構成によれば、物理的分散部と超音波分散部とをそれぞれ個別に移動させる構成が不要となり、装置の小型化や簡素化が可能となる。
【0017】
(7)本発明の細胞分散装置は、前記容器に洗浄液を供給する洗浄液供給部をさらに備え、
前記制御部は、前記洗浄液供給部によって前記容器に洗浄液を供給したのち、前記物理的分散部の少なくとも一部が前記容器に供給された洗浄液内に存在する状態で、前記超音波分散部を作動させることが好ましい。
この構成によれば、超音波分散部により洗浄液に付与される超音波によって物理的分散部の洗浄効果を高めることができる。また、物理的分散部の洗浄と容器の洗浄とを同一の場所で同時に行うことができ、洗浄処理時間を短縮できるとともに、洗浄のためのスペースを小さくすることができる。
【0018】
(8)前記物理的分散部は、前記容器内の生体試料の循環流が、前記超音波分散部による超音波の伝達方向と同一方向又は逆方向に流れるように、生体試料を循環させてもよい。
超音波分散部によって生体試料に付与される超音波は、その伝達方向に沿って節と腹とが交互に発生する。そのため、超音波の伝達方向と同一方向又は逆方向に生体試料を循環させることによって、超音波に節の部分に存在していた凝集細胞を好適に腹の部分にも移動させることができ、当該凝集細胞を強いキャビテーションによって効果的に分散させることができる。
【0019】
(9)前記物理的分散部は、側面及び先端にそれぞれ孔が形成され、前記容器に対して上方から挿入される筒状部材と、前記筒状部材の内部に設けられており、前記筒状部材の側面の孔及び先端の孔の一方から他方へ向かう液流を発生させる液流発生部材とを備え、
前記超音波分散部は、前記容器の底部に設けられ、前記容器の上方に向かって超音波を付与する振動子を備えることが好ましい。
【発明の効果】
【0020】
本発明によれば、生体試料に含まれる凝集細胞を十分に分散させることができる。
【図面の簡単な説明】
【0021】
【図1】本発明の第1の実施の形態に係る細胞分散装置(細胞分散部)を有する細胞分析装置の全体構成を示した斜視図である。
【図2】図1に示される細胞分析装置の測定装置の構成を示したブロック図である。
【図3】図2に示される測定装置の各部の平面的な配置を示した模式図である。
【図4】図2に示される測定装置の主検出部を構成するフローサイトメータを示した模式図である。
【図5】図3に示される測定装置の第1分散部の構成を示した斜視図である。
【図6】図5に示される第1分散部の縦断面図である。
【図7】図6に示される第1分散部の有孔部材の上面図である。
【図8】図7の500−500線に沿った有孔部材の断面図である。
【図9】図3に示される測定装置の第1分散部と第2分散部とを示す正面図(一部断面図)である。
【図10】図9に示される第1分散部と第2分散部との動作を説明するための模式図である。
【図11】図9に示される第1分散部と第2分散部との動作を説明するためのタイムチャートである。
【図12】細胞分析装置の動作手順を示すフローチャートである。
【図13】本発明の第2の実施の形態に係る細胞分散装置の第1分散部と第2分散部との動作を説明するためのタイムチャートである。
【図14】本発明の第3の実施の形態に係る細胞分散装置の第1分散部と第2分散部とを示す正面図(一部断面図)である。
【図15】本発明の第4の実施の形態に係る細胞分散装置の第1分散部と第2分散部とを示す正面図(一部断面図)である。
【発明を実施するための形態】
【0022】
[第1の実施の形態]
図1は、本発明の第1の実施の形態に係る細胞分散装置を有する細胞分析装置の全体構成を示した斜視図である。本実施の形態の細胞分析装置1は、患者等の被検者から採取した細胞を含む測定試料をフローセルに流し、フローセルを流れる測定試料にレーザ光を照射し、測定試料からの光(前方散乱光、側方蛍光等)を検出してその光信号を分析することにより、細胞に癌細胞が含まれているか否かを判断するものである。より具体的に、本実施の形態の細胞分析装置1は、子宮頸部の上皮細胞を分析対象としており、子宮頸癌をスクリーニングするのに用いられる。
【0023】
また、細胞分析装置1は、被検者から採取された生体試料に細胞分散処理や染色処理等を行って測定試料を調製し、測定試料に対してレーザ光による光学的な測定を行う測定装置2と、測定装置2での測定結果の分析等を行うデータ処理装置4とを備えている。
【0024】
図2に示されるように、測定装置2は、主検出部21と、信号処理部22と、測定制御部23と、I/Oインタフェース24とを備えている。また、測定装置2は、副検出部31と、信号処理部32と、調製制御部33と、生体試料に対する成分調製を自動的に行うための調製デバイス部35とを備えている。
【0025】
主検出部21は、測定試料から測定対象細胞(子宮頸部の上皮細胞)やその核の数及びサイズ等を検出する機能を有する。本実施の形態の主検出部21には、図4に示すフローサイトメータ10が設けられている。
【0026】
信号処理部22は、主検出部21からの出力信号に対して必要な信号処理を行う信号処理回路からなる。また、測定制御部23は、マイクロプロセッサ25と記憶部26とを含んでいる。記憶部26は、主検出部21等の制御プログラムやデータを格納するROM及びRAM等からなる。
【0027】
測定制御部23のマイクロプロセッサ25は、I/Oインタフェース24を介して、データ処理装置4と調製制御部33の後述するマイクロプロセッサ36とに接続されている。これにより、データ処理装置4及び調製制御部33のマイクロプロセッサ36との間で各種データを送受信することが可能である。
【0028】
副検出部31は、生体試料に含まれる測定対象細胞の細胞数を検出する機能を有する。本実施の形態では、副検出部31についても、図4に示されるものとほぼ同様のフローサイトメータ10が採用されている。信号処理部32は、副検出部31からの出力信号に対して必要な信号処理を行う信号処理回路からなる。調製制御部33は、マイクロプロセッサ36と、記憶部37と、センサドライバ38と、駆動部ドライバ39とを含んでいる。また、記憶部37は、副検出部31や調製デバイス部35等を制御するための制御プログラム等を格納するROM及びRAM等からなる。
【0029】
調製デバイス部35は、検体セット部50と、検体ピペット部52と、弁別・置換部53と、容器移送部54と、洗浄液供給部67と、反応部57と、第1試薬添加部58aと、第2試薬添加部58bと、試料吸引部59と、容器洗浄部66とを備えている。さらに調製デバイス部35は、生体試料に含まれる凝集した細胞を分散するための細胞分散部(細胞分散装置)56を備えている。この細胞分散部56は、第1分散部(物理的分散部)51と第2分散部(超音波分散部)55とからなる。
【0030】
図3に示されるように、検体セット部50は、メタノールを主成分とする保存液と生体試料との混合液を収容する複数の生体容器6をセットするためのものである。検体セット部50は、セットされた生体容器6を検体ピペット部52による生体試料の吸引位置まで順次搬送する機能を有する。
【0031】
検体ピペット部52は、生体容器6内の生体試料を細胞分散部56に移送する機能、細胞分散部56内の生体試料を弁別・置換部53及び副検出部31に移送する機能、並びに、弁別・置換部53において濃縮された濃縮液を測定試料容器7に供給する機能を有する。具体的には、検体ピペット部52は、細胞分散部56の試料収容部51a、弁別・置換部53、副検出部31の試料取込部31a、及び試料受け渡し部52bに位置づけられた測定試料容器7等の上方位置へ移動可能に構成されている。また、検体ピペット部52は、生体試料の吸引及び吐出を行うピペット52aを有し、図示しない検体定量部(定量シリンダ、定量シリンダ内のピストンを駆動するモータ等からなる)により生体試料を定量して所定量の生体試料を上記した各部に供給することが可能なように構成されている。
【0032】
細胞分散部56は、生体試料に含まれる凝集細胞を分散させるための第1分散処理と第2分散処理とを生体試料に実行する機能を有する。第1分散処理は、第1分散部51によって実行され、第2分散処理は、第2分散部55によって実行される。
第1分散部51は、試料収容部51aに供給された生体試料中の凝集細胞に対して物理的な力、具体的にはせん断力を付与するように構成されている。また、第2分散部55は、試料収容部51aに供給された生体試料に超音波振動を付与するように構成されている。この第1分散部51及び第2分散部55の構成については、後に詳細に説明する。
【0033】
洗浄液供給部67は、細胞分散部56によって凝集細胞の分散処理が行われた後、細胞分散部56に対して洗浄液を供給する機能を有する。細胞分散部56は、供給された洗浄液によって第1分散部51や第2分散部55の構成部品を洗浄する。これにより、その後の分散処理において、他の生体試料に対するコンタミネーションを抑制することができる。
【0034】
弁別・置換部53は、細胞分散部56による分散処理後の生体試料と保存液との混合液を受け入れ、メタノールを主成分とする保存液を希釈液に置換する機能を有する。また、弁別・置換部53は、生体試料中に含まれる測定対象細胞(上皮細胞)とそれ以外の細胞(赤血球、白血球、細菌等)とを弁別する機能を有する。また、弁別・置換部53は、主検出部21による測定に必要な細胞測定数を得るために生体試料に含有される測定対象細胞の濃縮を行う機能を有する。弁別・置換部53は、図3に示されるように処理の効率化のために2つ設けられている。なお、弁別・置換部53には、たとえば国際公開第2009/122999号に開示された公知の構成を採用することが可能であるので、弁別・置換部53の具体的な構成についての説明は省略する。
【0035】
容器移送部54は、反応部57にユーザによってセットされた測定試料容器7をはさみ状の把持部54aにより把持して、試料受け渡し部52bと反応部57とに測定試料容器7を移送する機能を有する。容器移送部54は、所定の回動中心回りの円周状軌跡Cに沿って把持部54aを移動させるように構成されている。また、容器移送部54は、把持部54aを上下方向に移動させることが可能に構成されている。なお、試料受け渡し部52bと反応部57とは、この円周状軌跡C上に配置されている。これにより、反応部57にユーザによってセットされた測定試料容器7を容器移送部54の把持部54aにより把持して円周状軌跡C上の試料受け渡し部52bに移送することが可能である。
【0036】
反応部57は、測定試料容器7内の生体試料と第1試薬添加部58a及び第2試薬添加部58bにより添加される試薬との反応を促進させる機能を有する。反応部57は、図示しない駆動部により回転可能に構成された円形の回転テーブル57aを備えている。回転テーブル57aの外周縁部には、測定試料容器7をセット可能な複数の保持部57bが設けられている。この保持部57bにユーザによって測定試料容器7がセットされる。また、回転テーブル57aの回転による保持部57bの軌跡と容器移送部54の把持部54aの円周状軌跡Cとは所定位置で交差しており、この交差位置で容器移送部54が測定試料容器7を保持部57bにセットすることが可能なように構成されている。また、反応部57は、保持部57bにセットされた測定試料容器7を所定温度に加温して、生体試料と試薬との反応を促進させる機能を有する。
【0037】
第1試薬添加部58a及び第2試薬添加部58bは、それぞれ、反応部57(回転テーブル57a)の保持部57bにセットされた測定試料容器7内に試薬を供給する機能を有する。第1試薬添加部58a及び第2試薬添加部58bは、回転テーブル57aの周縁部近傍の位置に設置され、回転テーブル57aにセットされた測定試料容器7の上方の第1試薬添加位置P1及び第2試薬添加位置P2まで移動可能な供給部58c,58dを有する。これにより、回転テーブル57aにより第1試薬添加位置P1又は第2試薬添加位置P2に測定試料容器7が搬送されたときに、測定試料容器7内に供給部58c(58d)から所定量の試薬を添加することが可能となっている。
【0038】
本実施の形態では、第1試薬添加部58aにより添加される試薬は、細胞にRNA処理を行うためのRNaseであり、第2試薬添加部58bにより添加される試薬は、PI染色を行うための染色液である。RNA処理とは、細胞中のRNAを分解するための処理であり、この処理により細胞核のDNAのみを測定することが可能となる。PI染色は、色素を含む蛍光染色液であるヨウ化プロピジウム(PI)により行われる。PI染色では細胞内の核に選択的に染色が施されることにより、核からの蛍光が検出可能となる。第1の実施の形態では、第1分散処理及び第2分散処理が実行された後に、試薬(RNase及び染色液)の添加が行われるように構成されている。
【0039】
試料吸引部59は、反応部57(回転テーブル57a)にセットされた測定試料容器7内の測定試料を吸引して、主検出部21に測定試料を移送する機能を有する。試料吸引部59は、回転テーブル57aの周縁部近傍の位置に設置され、回転テーブル57aにセットされた測定試料容器7の上方の吸引位置P3まで移動可能なピペット59aを有する。これにより、回転テーブル57aにより吸引位置P3に測定試料容器7が搬送されたときに、測定試料容器7内の測定試料を吸引することが可能となっている。
【0040】
試料吸引部59は、図示しない流路を介して主検出部21の後述するフローセル13(図4参照)に接続されており、ピペット59aにより吸引した測定試料を主検出部21のフローセル13に供給することが可能なように構成されている。なお、本実施の形態では、生体試料は、第1試薬添加部58a及び第2試薬添加部58bによる処理の後に他の処理を介在させることなく試料吸引部59によって吸引される。したがって、第1試薬添加部58a及び第2試薬添加部58bによる処理の完了直後に、主検出部21による検出が実行されるように構成されている。
【0041】
容器洗浄部66は、試料吸引部59により測定試料が主検出部21に供給された後の測定試料容器7の内部を洗浄する機能を有する。容器洗浄部66は、回転テーブル57aの保持部57bに保持された測定試料容器7内に洗浄液を吐出することにより、測定試料容器7の内部を洗浄するように構成されている。これにより、その後の測定処理において同じ測定試料容器7を用いた場合に、他の生体試料とのコンタミネーションを抑制することが可能となる。
【0042】
図2に示されるように、調製制御部33のマイクロプロセッサ36は、センサドライバ38または駆動部ドライバ39を介して、調製デバイス部35の各部(検体セット部50、第1分散部51、検体ピペット部52、弁別・置換部53、容器移送部54、第2分散部55、洗浄液供給部67、反応部57、第1試薬添加部58a、第2試薬添加部58b及び試料吸引部59)のセンサ類や駆動モータと接続されている。これにより、マイクロプロセッサ36は、センサからの検知信号に基づいて制御プログラムを実行し、駆動モータの動作を制御する。
【0043】
図1に示されるように、データ処理装置4は、例えばノートPCやデスクトップPC等のパーソナルコンピュータからなり、制御部41と、表示部42と、入力デバイス43とを含んでいる。制御部41は、CPU、ROM,RAM及びハードディスク等からなる記憶部、CD−ROMドライブ等の読出装置、及び各種入出力インタフェース等を備えている。制御部41の記憶部には、オペレーティングシステム及びアプリケーションプログラム等の各種プログラムの他、図2に示される測定制御部23及び調製制御部33への動作命令の送信、測定装置2で行った測定結果の受信及び分析処理、並びに、処理した分析結果の表示等を行う操作プログラムがインストールされている。また、データ処理装置4は、測定装置2のI/Oインタフェース24とも接続されている。これにより、測定装置2とデータ処理装置4との間でデータの送受信を行うことが可能である。
【0044】
次に、測定装置2の主検出部21を構成するフローサイトメータ10について説明する。図4に示されるように、フローサイトメータ10のレンズ系11は、光源である半導体レーザ12からのレーザ光を、生体試料を通過させるフローセル13を流れる測定試料に集光する機能を有する。集光レンズ14は、測定試料中の細胞の前方散乱光をフォトダイオード15からなる散乱光検出器に集光する機能を有する。
【0045】
側方用の集光レンズ16は、測定対象細胞及びこの細胞中の核の側方散乱光と側方蛍光とをダイクロイックミラー17に集光する機能を有する。ダイクロイックミラー17は、側方散乱光をフォトマルチプライヤ(光電子増倍管)18へ反射させるとともに、側方蛍光をフォトマルチプライヤ(光電子増倍管)19の方へ透過させるように構成されている。これらの光は、測定試料中の細胞や核の特徴を反映したものとなっている。
【0046】
そして、フォトダイオード15、フォトマルチプライヤ18及び19は、受光した光信号を電気信号に変換して、それぞれ、前方散乱光信号(FSC)、側方散乱光信号(SSC)及び側方蛍光信号(SFL)を出力する。これらの出力信号は図示しないプリアンプにより増幅され、測定装置2の信号処理部22(図2参照)に送られる。測定装置2の信号処理部22で処理された各信号FSC、SSC、SFLは、それぞれ、マイクロプロセッサ25によってI/Oインタフェース24からデータ処理装置4に送信される。
【0047】
データ処理装置4の制御部41(図1参照)は、記憶部に記憶された操作プログラムを実行することにより、各信号FSC、SSC、SFLに基づいて、前方散乱光強度、側方蛍光強度等の特徴パラメータを取得し、これらの特徴パラメータに基づいて、細胞や核を分析するための頻度分布データを作成する。そして、制御部41は、この頻度分布データに基づいて、測定試料中の粒子の弁別処理を行い、測定対象細胞(上皮細胞)が異常であるか否か、具体的には癌化した細胞(異型細胞)であるか否かを判定する。
【0048】
また、副検出部31は、上記のように主検出部21とほぼ同じ構成のフローサイトメータ10を採用しているので、詳細な説明を省略する。なお、副検出部31は、主検出部21による本測定の前に測定対象細胞の濃度測定を予備的に行うものであるので、副検出部31では、その細胞数を計数するための信号を出力できれば足りる。具体的には、細胞数を計数するために前方散乱光信号(FSC)を取得できればよい。
【0049】
次に、細胞分散部56の具体的な構成を説明する。
細胞分散部56を構成する第1分散部51は、図5及び図6に示されるように、有孔部材60と、ローター(液流発生部材)70と、このローター70を回転駆動させるモータ80とを備えている。ローター70の外側には、生体試料の流れをガイドする機能を有するパイプ(筒状部材)90が配置されており、このパイプ90の先端の開口に有孔部材60が取り付けられている。パイプ90及び有孔部材60を試料収容部51a(図9及び図10参照)内に挿入してローター70を回転させることにより、試料収容部51a内の生体試料に含まれる凝集細胞が単一細胞に分散される。
【0050】
試料収容部51aは、図9及び図10に示されるように、ステンレス等によって形成された容器からなり、底板51a1と、この底板51a1の外周部から上方へ立ち上がる側壁51a2と、この側壁51a2の上端に取り付けられた上板51a3とを有している。そして、試料収容部51aは、底板51a1及び側壁51a2によって形成されるスペースに生体試料を収容可能に構成されている。また、上板51a3の中央部には、第1分散部51のパイプ90及び有孔部材60を挿入することができる開口部51a4が形成されている。第1分散部51は、図示しないアクチュエータ等によって上下方向や水平方向に移動可能であり、試料収容部51aの上方位置から下方へ移動することによって開口部51a4を介してパイプ90及び有孔部材60を試料収容部51a内に挿入することができる。
【0051】
図7及び図8に示されるように、有孔部材60は、耐薬品性や強度等を考慮してステンレスで作製されており、円筒形状の筒部61と、筒部61の下端を塞ぐように設けられ、4つの孔部63を有する底部62とが一体的に形成されている。有孔部材60は、パイプ90の先端の開口に取り付けられている。底部62は、平面的に見て円形に形成されている。4つの孔部63は、底部62の上面(内表面)から下面(外表面)までを貫通する。これらの孔部63は、凝集細胞(大きさ約100μm以上約500μm以下)が通過可能な大きさに形成されている。
【0052】
底部62の上面には、平面的に見て、ローター70の回転方向(矢印R方向)と直交する方向(半径方向)に延びるとともに、ローター70側(上方)に突出する4つの凸部64が形成されている。また、底部62の上面には、これらの凸部64を境界とする凹部からなる4つの保液部65が形成されている。本実施の形態では、図8に示されるように、底部62(凸部64)の厚さt1が約1mmとされ、保液部65の深さt2が約0.5mmとされている。
【0053】
図7に示されるように、底部62の4つの孔部63は、4つの保液部65内にそれぞれ配置されている。本実施の形態の孔部63は、幅Wが約0.5mm、長さLが約3.25mmの細長形状に形成されている。また、孔部63は、矢印R方向(ローター70の回転方向)と直交する方向に延びている。より具体的に、孔部63は、扇形状の保液部65の内部における、ローター70の回転方向(矢印R方向)の先方側の端部で凸部64と隣接し、当該凸部64と平行に延びている。また、孔部63は、扇形状の保液部65の半径方向内側の端部から半径方向外側の端部まで延びている。
【0054】
図6に示されるように、ローター70は、底部62と同じく耐薬品性や強度等を考慮してステンレスで作製され、パイプ90の内部に配置されている。ローター70の外周には、螺旋状の溝71が形成されている。溝71は、約40度のリード角で形成されている。また、溝71は、ローター70が矢印R方向(図7参照)に回転(正転)した場合に、下方(矢印Z2方向)へ生体試料を送るように設けられている。これにより、ローター70は、モータ80により軸心回り(矢印R方向)に回転されることによって、生体試料を下方の底部62に向けて供給する(生体試料に下方の推進力を付与する)ことができる。また、ローター70の下端面72は、平坦に形成されている。
【0055】
図10に示されるように、ローター70の下端面72と、パイプ90の下端に取り付けられた有孔部材60の底部62の上面(凸部64の上面)とは、所定の間隔CL1を隔てて離間するように構成されている。この間隔CL1は、凝集細胞(100μm以上)は通過不能で、かつ、単一細胞(平均60μm)は通過可能な大きさを有する。したがって、間隔CL1は、測定対象とする子宮頸部の上皮細胞(単一細胞)の大きさ(平均60μm)と略等しくなるように30〜80μmの範囲で設定されている。本実施の形態では、この間隔CL1は約50μmである。なお、図10では説明のために間隔CL1を誇張して図示している。
【0056】
ここで、凝集細胞は100μmを超える大きさとなるため、間隔CL1を約50μmとすることにより、凝集細胞に対して効果的にせん断力を与えることが可能である。このように、第1分散部51は、モータ80によりローター70を回転させることにより、有孔部材60の凸部64とローター70の下端面72との間で凝集細胞を分散するように構成されている。なお、間隔CL1を30〜80μmに設定したのは、30μm未満であれば、細胞が破砕されることがあり、80μmを超えると凝集細胞に与える分散力が低下してしまうことがあるためである。
【0057】
図6に示されるように、ローター70の上端部73は、回転軸74を介してモータ80の出力軸80aに連結されている。これにより、モータ80の駆動力(回転力)がローター70に伝達される。モータ80は、支持部材81の上面に取り付けられている。支持部材81の下部には、下方に延びるように筒体82が取り付けられている。この筒体82の内部において、回転軸74が回転可能に支持されている。
【0058】
パイプ90は、ローター70を内部に収容可能な内径を有するステンレス製の円形パイプからなる。パイプ90の上端は、回転軸74が挿入された筒体82に連結されている。回転軸74に取り付けられたローター70は、パイプ90と有孔部材60とにより、側方と下方とを取り囲まれるように配置されている。なお、図10に示されるように、ローター70の溝71が形成された外周とパイプ90の内周面とは、僅かに間隔CL2(約0.3mm)を隔てて離間している。
【0059】
パイプ90の側壁には、ローター70が配置される位置よりもやや上方の位置に長孔形状の開口部92(図5及び図10参照)が2つ形成されている。この2つの開口部92は、パイプ90の芯を中心として対向する位置に形成されている。図10に示されるように、パイプ90の外部の生体試料は、開口部92を流入口としてパイプ90内に導入され、ローター70により流入口からパイプ90内部を下方(矢印Z2方向)に移動する。そして、生体試料は、下端の有孔部材60の孔部63を流出口としてパイプ90の外側に流出し、再度開口部92(流入口)へ流入する。これにより、流入口(開口部92)からパイプ90の内側、流出口(孔部63)、パイプ90の外側、流入口(開口部92)へと生体試料を流動させる上下方向の循環流が形成される。
【0060】
次に、細胞分散部56を構成する第2分散部55の具体的な構成を説明する。
図9及び図10に示されるように、第2分散部55は、第1分散部51と同様に試料収容部51a内の生体試料に対して凝集細胞の分散処理を行うものである。具体的に、第2分散部55は、試料収容部51a内の生体試料に対して超音波振動を付与する超音波振動子112を備えている。この超音波振動子112は、試料収容部51aの底板51a1の下面に取り付けられている。超音波振動子112としては、たとえば部品の洗浄等に用いられる公知のものを利用することができる。また、超音波振動子112が取り付けられる試料収容部51aの底板51a1は、超音波振動子112からの振動を効果的に生体試料に伝達できるよう薄肉(例えば、約0.5mm)の板材によって形成されている。
【0061】
また、生体試料に超音波振動を効果的に発生させるため、超音波振動子112によって生じる超音波振動の節Pが生体試料の上面に位置するように、試料収容部51a内に収容される生体試料の量が設定されている。超音波振動は、節Pと節Pの間のλ/2(λは超音波振動の波長)の範囲で振動振幅が大きくなる。
【0062】
第2分散部55は、超音波振動子112によって発生した超音波振動が生体試料中にキャビテーション(微細な気泡の発生と気泡の破裂)を発生させ、キャビテーションに伴う衝撃(圧力変動)により、凝集した細胞を分散させる。特に、超音波振動の節と節との間のλ/2の範囲では振動振幅が大きくなるので、凝集した細胞の分散作用がより高くなる。
【0063】
なお、超音波振動子112により発生される超音波振動の振動数は、特に限定されるものではないが、第2分散処理に際して試料収容部51aに収容されている生体試料の量と、超音波振動の効率的な伝達等の観点から設定されることが好ましく、例えば、20kHz以上で、20kHz〜75kHzであることが好ましい。
【0064】
次に、細胞分析装置1の分析動作について説明する。なお、測定装置2の主検出部21及び信号処理部22の動作制御は、測定制御部23(マイクロプロセッサ25)により実行され、測定装置2の副検出部31、信号処理部32及び調製デバイス部35の動作制御は、調製制御部33(マイクロプロセッサ36)により実行される。データ処理装置4の制御は、制御部41(CPU)により実行される。
【0065】
図12に示されるように、細胞分析装置1による分析に際して、まず、ユーザにより分散液としてN−アセチル−L−システイン(NAC)を生体試料に添加する等の前処理が行われる。その後、生体試料と、アルコールを主成分とする保存液とが収容された生体容器6がユーザにより検体セット部50(図3参照)にセットされ、細胞分析装置1による分析が開始される。
【0066】
分析が開始されると、図12のステップS1において、細胞分散部56により生体試料中の凝集細胞の分散処理(第1分散処理及び第2分散処理)が行われる。具体的には、図3に示されるように、生体試料と、アルコールを主成分とする保存液とが収容された生体容器6内の混合液が、検体セット部50において検体ピペット部52によって吸引される。そして、検体ピペット部52が試料収容部51aの上方に移動して、試料収容部51a内に混合液を供給する。その後、試料収容部51a内の混合液が細胞分散部56で分散される。
【0067】
図11は、図9に示される細胞分散部56の動作を説明するためのタイムチャートである。本実施の形態の細胞分散部56は、第1分散部51と第2分散部55とを備えており、これらは図11に示されるように互いに連係した運転を行う。本実施の形態では、まず、第1分散部51が作動を開始し、数秒間(例えば7秒間)が経過してから第2分散部55が作動を開始する。そして、第2分散部55が所定時間経過後に作動を停止し、第1分散部51も所定時間経過後に作動を停止する。第1分散部51の作動時間は約20秒とされ、第2分散部55の作動時間は約10秒とされている。そして、以上の第1分散部51及び第2分散部55の動作が数回(例えば3サイクル)繰り返して行われる。
【0068】
したがって、第1分散部51と第2分散部55とは、作動時間が少なくとも一部において重複している。また、第1分散部51は、第2分散部55よりも先に作動を開始し、第2分散部55よりも後で作動を停止する。また、第1分散部51は、図11に示されるように、停止前の数秒間(約2秒)でローター70の回転方向を反転させるように構成されている。
【0069】
第1分散部51の動作をより詳しく説明する。図9及び図10に示されるように、調製制御部33(図2参照)により第1分散部51を下方に移動させて試料収容部51a内に有孔部材60及びパイプ90を挿入し、モータ80を駆動させると、回転軸74とローター70とが軸心回りに矢印R方向(図7参照)に回転する。このとき、ローター70の外周の溝71の回転により、溝71内の生体試料が下方の底部62(ローター70の下端面72と底部62との間)に向けて送られる。モータ80の回転数は例えば約10000rpmとすることができる。
【0070】
底部62に送られた生体試料は、凸部64によって分割された保液部(凹部)65(図7参照)に流れ込み、保液部65内に一時的に貯留(保液)される。この際、保液部65内に流れ込んだ生体試料の上方(矢印Z1方向)には、矢印R方向に回転するローター70の下端面72が存在するため、生体試料は保液部65内で矢印R方向に移動される。保液部65内における生体試料の矢印R方向の流れは、保液部65を分割する凸部64(図
7参照)の壁面により遮られる。これにより、矢印R方向の生体試料の流れは、矢印R方向側の端部に形成された孔部63から下方(外部)に流出しようとする生体試料の流れと、凸部64の壁面に沿って上方に移動して凸部64を乗り越えようとする生体試料の流れとに分かれる。
【0071】
孔部63から下方(外部)に流出しようとする生体試料の流れは、底部62の外部に流出(噴出)するとともに、ローター70の回転によりパイプ90の周壁の開口部92を介してパイプ90内部に引き込まれる。この結果、流入口(開口部92)からパイプ90内側、流出口(孔部63)、パイプ90外側、流入口(開口部92)へと循環する生体試料の流れが形成される。
【0072】
凸部64を乗り越えようとする流れは、ローター70の下端面72と凸部64の上面との間を通過する。ここで、ローター70の下端面72と底部62との間隔CL1は、凝集細胞が通過不可能な間隔(約50μm)である。このため、凸部64を乗り越えようとする流れに含まれる凝集細胞には回転されているローター70(下端面72)と固定的に設置された凸部64との間で機械的なせん断力が付与され、凝集細胞が単一細胞に分散される。なお、間隔CL1は単一細胞が通過可能な大きさであるので、凸部64を乗り越えようとする流れに含まれる単一細胞(及び分散された単一細胞)は、流れに乗って凸部64を乗り越える。このようにして凝集細胞は次々と分散され、所定時間(合計約60秒間)にわたって循環流を循環させることによって、生体試料中の凝集細胞が単一細胞に分散される。
なお、第1分散部51は、作動停止前の数秒間(約2秒間)、ローター70の回転を反転させるように構成されている。これにより、作動停止直前にパイプ90や有孔部材60の内部に細胞が残留しないように開口部92から排出することができる。
【0073】
他方、調製制御部33により第2分散部55の超音波振動子112を作動させると、試料収容部51aの底板51a1から試料収容部51a内の生体試料に超音波振動が伝達される。そして、この超音波振動が生体試料中にキャビテーションを発生させ、キャビテーションに伴う衝撃により、凝集した細胞が分散される。
【0074】
図11に示されるように、第2分散部55が作動している間は、第1分散部51も同時に作動しているので、生体試料は常に上下方向に循環している。そのため、生体試料中の凝集細胞は、循環流にのって超音波振動の節Pの部分と腹の部分とを通過する。超音波振動は、節Pの部分でキャビテーションが弱くなるため凝集細胞の分散作用も小さくなるが、生体試料は循環しているので超音波振動の節Pの部分に凝集細胞が滞留してしまうことがない。そのため、生体試料に含まれる凝集細胞を超音波振動の腹の部分で適切に分散させることができる。
【0075】
すなわち、第2分散部55を単独で作動させたとすると、超音波振動の節Pの部分で滞留した凝集細胞に強いキャビテーションを作用させることが出来ず、分散が不十分となる可能性があるが、本実施の形態では、第2分散部55を第1分散部51と連係させて作動することによって、凝集細胞を十分な分散させることができる。
【0076】
また、第1分散部51においては、ローター70の下面と底部62との間に形成された隙間CL1(図10参照)を通過できるような小さな凝集細胞を分散させることができないが、このような凝集細胞は、第2分散部55による超音波振動によって適切に分散させることができる。
【0077】
本実施の形態では、第1分散部51の作動時間と第2分散部55の作動時間とを少なくとも一部において重複させているので、それぞれを個別に作動させる場合に比べて短時間で分散処理を行うことができる。また、第1分散部51と第2分散部55とは、同一の試料収容部51a内の生体試料に対して処理を行うので、異なる場所で処理を行う場合に比べて測定装置2を小型化することができる。
【0078】
細胞分散部56による分散処理が終了すると、ステップS2において、調製制御部33により検体ピペット部52(図3参照)が作動され、分散済みの生体試料を含む混合液が副検出部31の試料取込部31aに供給される。これにより、副検出部31のフローセル13(図4参照)に分散済みの生体試料を含む混合液が送液される。そして、この副検出部31を用いて、フローサイトメトリー法によって生体試料のプレ測定(混合液に含まれる測定対象細胞の数の検出)が行われる。プレ測定の結果、癌判定ために測定装置2が行う本測定の前に、混合液(生体試料及び保存液)に含まれる測定対象細胞(上皮細胞)の濃度を反映した濃度情報が得られる。
【0079】
プレ測定が行われると、調製制御部33により、混合液(生体試料及び保存液)が副検出部31から排出される。そして、得られた濃度情報に基づいて混合液(生体試料および保存液)中の測定対象細胞(上皮細胞)の濃度が算出される。さらに、算出された濃度に基づいて、本測定に用いる測定試料を調製するための、混合液(生体試料及び保存液)の吸引量が決定される。すなわち、プレ測定に用いた生体試料中の測定対象細胞の濃度(単位体積あたりの測定対象細胞の数)と、本測定における癌細胞検出のために必要な有意細胞数とに基づき、この有意細胞数が確保される程度に本測定を行うために必要な混合液(生体試料及び保存液)の採取料(液量)が演算される。
【0080】
次に、ステップS3において、演算された採取料(液量)の混合液(生体試料及び保存液)について弁別・置換処理が実行される。すなわち、図3に示されるように、調製制御部33により検体ピペット部52が作動され、演算された吸引量だけ細胞分散部56の試料収容部51aから混合液(生体試料及び保存液)が吸引される。吸引された混合液が弁別・置換部53に供給されることにより、弁別・置換処理が開始される。
【0081】
この弁別・置換処理において、弁別・置換部53により、アルコールを主成分とする保存液が希釈液に置換されるとともに、測定対象細胞とその他の細胞や夾雑物とが弁別される。また、弁別の過程で測定対象細胞を含む液体が濃縮され、測定対象細胞の濃度が上昇する。この結果、癌細胞検出のために必要な有意細胞数を含むように測定対象細胞が濃縮された濃縮液が得られる。
【0082】
図3に示されるように、測定対象細胞が濃縮された濃縮液は、弁別・置換部53から検体ピペット部52によって吸引される。これに並行して、容器移送部54が反応部57の保持部57bにセットされた測定試料容器7を把持して取り出し、試料受け渡し部52bに位置づける。そして、検体ピペット部52が試料受け渡し部52bに位置づけられた測定試料容器7の上方(試料受け渡し部52bの上方)に移動して、測定試料容器7に濃縮液を供給する。その後、濃縮液を収容する測定試料容器7が容器移送部54により反応部57(回転テーブル57a)の保持部57bにセットされる。
【0083】
反応部57に測定試料容器7がセットされると、ステップS4において、試薬(RNase)の添加及び加温により、濃縮液中のRNA除去処理が行われる。具体的には、回転テーブル57aにセットされた測定試料容器7が第1試薬添加位置P1まで移動され、第1試薬添加部58aの供給部58cから測定試料容器7内の濃縮液に対して所定量の試薬(RNase)が添加される。その後、反応部57により測定試料容器7内の液体が所定温度(約37℃)で約10分間加温されることにより、RNA除去処理が実行される。
なお、試薬(RNase)の添加後、反応が完了するまでの約10分間の間に、回転テーブル57aにより測定試料容器7が第2試薬添加位置P2まで移動される。
【0084】
RNA除去処理の後、ステップS5において、試薬(染色液)の添加及び加温により、測定試料容器7内の測定対象細胞のDNAの染色処理が行われる。RNA除去処理が完了した時点で、回転テーブル57aにより測定試料容器7が第2試薬添加位置P2まで移動されるため、これに同期して第2試薬添加部58bの供給部58dから測定試料容器7内に所定量の試薬(染色液)が添加される。その後、反応部57により測定試料容器7内の液体が所定温度(約37℃)で約1分間加温されることにより、DNA染色処理が実行される。なお、染色液の添加後、反応(染色)が完了するまでの約1分間の間に、回転テーブル57aにより測定試料容器7が試料吸引部59の吸引位置P3まで移動される。
【0085】
次に、ステップS6において、染色処理済みの測定試料が主検出部21のフローセル13に送られるとともに、測定試料中の細胞に対する本測定が行われる。染色処理が完了した時点で、回転テーブル57aにより測定試料容器7が試料吸引部59の吸引位置P3まで移動されるため、これに同期して試料吸引部59のピペット59aが吸引位置P3まで移動される。これにより、染色処理が完了した直後に他の処理が介在することなく試料吸引部59のピペット59aにより測定試料が吸引される。そして、吸引された測定試料が試料吸引部59から主検出部21のフローセル13(図4参照)に移送されるとともに、測定装置2の測定制御部23(図2参照)により測定試料中の細胞に対する本測定が行われる。測定試料が主検出部21に送られた後に、容器洗浄部66によって測定試料容器7の内部が洗浄され、洗浄された測定試料容器7はその後の測定処理に用いられる。
【0086】
本測定後、ステップS7において、得られた測定データが測定装置2の測定制御部23からデータ処理装置4に送信される。データ処理装置4の制御部41は、測定装置2から測定データを受信したか否かを常時判定している。測定装置2から測定データを受信すると、ステップS8において、データ処理装置4の制御部41により、その測定データに基づいて測定試料中の粒子の弁別処理が行われ、測定試料中の測定対象細胞(上皮細胞)が異常であるか否か、すなわち、癌化した細胞(異型細胞)であるか否か等が判定される。以上により、測定処理が終了する。
【0087】
一方、ステップS9では、分散処理が終了した後の細胞分散部56の洗浄が行われる。まず、細胞分散部56の試料収容部51aに残った生体試料が排出され、その後、調製制御部33(図2参照)により洗浄液供給部67を作動させ、試料収容部51a内に洗浄液を供給する。そして、調製制御部33により試料収容部51a内に第1分散部51のパイプ90及び有孔部材60を挿入させ、これらを洗浄液に漬けた状態で、ローター70を回転させるとともに超音波振動子112を作動させる。この動作により、パイプ90や有孔部材60の内部で洗浄液が循環し、これらの部材やローター70が洗浄される。また、超音波振動子112によって洗浄液にキャビテーションが発生し、キャビテーションに伴う衝撃によって試料収容部51aの内部や第1分散部51のパイプ90、有孔部材60、及びローター70に付着していた汚れ等が引き剥がされる。したがって、単に洗浄液内でローター70を回転させてパイプ90や有孔部材60の内部を洗浄する場合に比べ、第2分散部55によって洗浄効果をより高めることができる。
なお、このステップS9の洗浄工程は、ステップS3の後、生体試料が次に試料収容部51a内に供給されるまでの間に行えばよく、ステップS4以降のいずれかの工程と並行して行ってもよい。
【0088】
以上説明した本実施の形態では、細胞分析装置1の測定装置2が、第1分散処理を行う第1分散部51と、第1分散処理とは異なる第2分散処理を行う第2分散部55とからなる細胞分散部56を備えているので、種類の異なる複数の分散処理を生体試料に行うことができる。そのため、生体試料中の細胞の凝集度合いが高い場合であっても効果的に細胞を分散させることができ、精度の高い細胞の検出やその検出結果に基づいた精度の高い細胞の分析を行うことができる。
【0089】
また、第1分散部51と第2分散部55とを互いに連係して作動させているため、生体試料中の凝集細胞をより効果的に分散させることができる。特に、第1分散部51によって生体試料を循環させることによって、第2分散部55による分散作用を効果的に高めることができる。
【0090】
また、第1分散部51及び第2分散部55による分散処理は、副検出部31による検出前に実行されるので、凝集細胞が十分に分散された状態で副検出部31による検出を行うことができる。この結果、副検出部31による検出の精度を向上させることができる。そして、副検出部31による検出結果に基づいて、検体ピペット部52により弁別・置換部53に供給される生体試料の量が調製されるように構成されているので、癌細胞検出のために必要な有意細胞数を含むように主検出部21による検出に適した測定試料の調製(生体試料中の測定対象細胞の濃縮)を行うことができる。
【0091】
また、第2試薬添加部58bによる染色液の添加は、第1分散部51及び第2分散部55による分散処理後に行われるので、十分に単一の細胞に分散された後の細胞に確実に染色を行うことができる。
【0092】
また、生体試料は、第1分散部51及び第2分散部55による分散処理後に第1試薬添加部58a及び第2試薬添加部58bにより処理され、第1試薬添加部58a及び第2試薬添加部58bによる処理後に他の処理を介在させることなく主検出部21による検出が行われる。そのため、染色液の添加を含む試薬による処理を、第1分散部51及び第2分散部55による分散処理によって凝集細胞が分散された後の単一の細胞に対して実行することができる。そして、試薬による処理と検出部による検出との間に他の処理が介在することがないので、試薬による処理が完了した直後に細胞の検出を行うことができる。この結果、検出対象の細胞が壊れる前に速やかに細胞検出を行うことができる。
【0093】
また、主検出部21は、生体試料を通過させるフローセル13と、フローセル13を通過する生体試料に光を照射する半導体レーザ12と、半導体レーザ12が生体試料に光を照射することによって生じる光を受光するフォトダイオード15、フォトマルチプライヤ18及び19とを含む。このように構成することによって、第1分散部51及び第2分散部55による分散処理によって効果的に分散された個々の細胞に対してフローサイトメトリー法による検出を行うことができるので、フローサイトメトリー法による検出精度を向上させることができる。
【0094】
また、主検出部21は、生体試料に含まれる上皮細胞を検出するように構成され、データ処理装置4は、検出した上皮細胞が癌細胞(異型細胞)であるか否かを分析するように構成されている。このように構成することによって、種類の異なる複数の分散処理を生体試料に実行することにより、生体試料中の上皮細胞の凝集度合いによらず精度の高い細胞検出を行うことが可能な癌細胞(異型上皮細胞)の細胞分析装置1を得ることができる。
【0095】
[第2の実施の形態]
図13は、本発明の第2の実施の形態に係る細胞分散装置の第1分散部と第2分散部との動作を説明するためのタイムチャートである。
前述の第1の実施の形態では、図11に示されるように細胞分散部56の第1分散部51と第2分散部55の作動時間が重複していたが、本実施の形態の細胞分散部56は、第1分散部51の作動を停止した後、続けて第2分散部55の作動を開始させるように構成されている。
【0096】
図13に示す例では、第1分散部51は、作動を開始してから18秒後に停止し、この停止と同時に第2分散部55が作動を開始し、その10秒後に停止している。そして、第1分散部51と第2分散部55の動作を数回(例えば、3サイクル)繰り返し行うことによって、試料収容部51a中の生体試料に含まれる凝集細胞を分散させるようになっている。
【0097】
第1分散部51を作動させると、停止後も暫くの間は生体試料に循環流が残った状態となる。そのため、第1分散部51の作動を停止した後、続けて第2分散部55を作動させると、超音波振動の節Pの部分に存在する凝集細胞を生体試料の循環流で超音波振動の腹の部分に移動させることが可能となる。そのため、凝集細胞を強いキャビテーションによって適切に分散させることができる。
【0098】
また、本実施の形態では、第1分散部51と第2分散部55とを交互に複数回ずつ作動させているので、次のような利点もある。第1分散部51を作動させると、試料収容部51a内の生体試料には循環流が発生するため、この第1分散部51の作動前と作動後とでは、生体試料中における凝集細胞の分布が変化する。このため、第1分散部51の作動前に行われる第2分散処理で、超音波振動の節Pの部分に存在していた凝集細胞は、第1分散部51の作動後の第2分散処理では超音波振動の節Pの部分から移動している可能性が高くなる。したがって、凝集細胞をより強いキャビテーションを作用させ、効果的に凝集細胞を分散させることができる。
【0099】
なお、本実施の形態において、第1分散部51や第2分散部55の作動時間や作動サイクルは適宜変更することができる。また、第2分散部55は、第1分散部51の作動停止と同時に作動を開始しなくてもよく、第1分散部51の停止後、時間をあけて第2分散部55を作動させてもよい。
【0100】
[第3の実施の形態]
図14は、本発明の第3の実施の形態に係る細胞分散装置の第1分散部と第2分散部とを示す正面図(一部断面図)である。本実施の形態の細胞分散部56は、第1分散部51と第2分散部55とが一体的に構成されている。具体的に、第2分散部55は、第1分散部51の支持部材81に取り付けられている。また、第2分散部55は、棒状の超音波振動子112を備えており、この超音波振動子112は、第1分散部51の筒体82やパイプ90と略平行に配置され、パイプ90及び有孔部材60とともに試料収容部51a内に挿入される。
【0101】
本実施の形態においても、上記第1の実施の形態と略同様の作用効果を奏する。また、本実施の形態では、第1分散部51と第2分散部55とが一体的に構成されているので、これらを別々に構成する場合に比べて細胞分散部56を小型化することができる。また、第1分散部51と第2分散部55とを一つの移動機構によって移動させることができるため、細胞分散部56の小型化や構造の簡素化を行うことができる。
なお、本実施の形態の細胞分散部56は、図11及び図13に示す動作パターンのいずれをも適用することができる。
【0102】
[第4の実施の形態]
図15は、本発明の第4の実施の形態に係る細胞分散装置の第1分散部と第2分散部とを示す正面図(一部断面図)である。
本実施の形態の細胞分散部56は、第1分散部51と第2分散部55とが別体で構成されている。そして、第1分散部51と第2分散部とはそれぞれ個別に上下方向や水平方向に移動可能とされ、試料収容部51aに対して個別に挿入されるように構成されている。
【0103】
本実施の形態においても、上記第1の実施の形態と略同様の作用効果を奏する。ただし、本実施の形態の場合、第1分散部51と第2分散部55とによって同時に凝集細胞を分散させることができない。そのため、前述した動作パターン(図11及び図13参照)のうち、図13に示すものが適用される。
【0104】
本発明は、上記実施の形態に限定されるものではなく、特許請求の範囲に記載された発明の範囲内において、適宜変更することができる。
たとえば、上記実施の形態では、子宮頸部の上皮細胞を分析する細胞分析装置1に本発明を適用した例を示したが、本発明はこれに限られない。子宮頸部の上皮細胞以外の細胞の分析を行う細胞分析装置に本発明を適用してもよい。
【0105】
また、図11に示す実施の形態では、第1分散部51の作動開始後に第2分散部55の作動を開始し、第1分散部51の作動停止前に第2分散部55の作動を停止しているが、第1分散部51と第2分散部55との作動開始のタイミングを一致させてもよいし、第1分散部51と第2分散部55との作動停止のタイミングを一致させてもよい。また、第1分散部51の作動停止後に、第2分散部55の作動を停止させてもよい。第1分散部51と第2分散部55との作動開始と作動停止の双方のタイミングを一致させてもよい。
【0106】
また、図13に示す実施の形態では、第1分散部51と第2分散部55と同じ回数だけ作動させているが、一方を他方よりも多く作動させてもよい。
【0107】
また、上記実施の形態では、副検出部31によるプレ測定の前に第1分散部51及び第2分散部55を作動させて凝集細胞を分散させているが、他のタイミングで第1分散部51及び第2分散部55を作動させてもよい。例えば、図12のステップS4の工程を行う前に第1分散部51及び第2分散部55を作動させてもよい。
【0108】
上記第1の実施の形態では、試料収容部51aの底板51a1に対して超音波振動を付与していたが、側壁51a2等の他の箇所に超音波振動を付与してもよい。また、第1分散部51による生体試料の循環方向は、上下方向(垂直方向)とするに限らず、水平方向とすることができる。ただし、第1分散部51による生体試料の循環方向は、上記第1の実施の形態のように、第2分散部55による超音波の伝達方向と一致させておくのが好ましい。これにより、超音波振動の節と腹が並ぶ方向に生体試料を循環させることができ、凝集細胞を確実に超音波振動の腹の部分に移動させ、強いキャビテーションによって効果的に凝集細胞を分散させることができる。
【0109】
また、上記実施の形態では、フローセルと、半導体レーザ(光源部)と、フォトダイオード及びフォトマルチプライヤ(受光部)とを備えたフローサイトメータからなる主検出部を設けた例を示したが、本発明はこれに限られない。本発明では、フローサイトメータ以外の検出部を設けてもよい。
【0110】
なお、上記実施の形態における各種の寸法(間隔CL1、CL2、底部(凸部)の厚さt1、保液部の深さt2等)等はあくまでも例示に過ぎず、本発明はこれに限られない。各部の寸法は、一度に分散処理を行う生体試料の量や、分散処理の対象となる細胞の種類に応じて変更すればよい。
【符号の説明】
【0111】
1 細胞分析装置
4 データ処理装置
33 調製制御部
51 第1分散部(物理的分散部)
51a 試料収容部
55 第2分散部(超音波分散部)
56 細胞分散部(細胞分散装置)
67 洗浄液供給部
【特許請求の範囲】
【請求項1】
生体試料に含まれる凝集細胞を分散させる細胞分散装置であって、
容器に収容された生体試料に超音波を付与して凝集細胞を分散させる超音波分散部と、
前記容器内で生体試料を循環させながら凝集細胞に物理的な力を作用させて当該凝集細胞を分散させる物理的分散部と、
前記物理的分散部の作動時間と前記超音波分散部の作動時間とを少なくとも一部において重複させるように、前記物理的分散部及び前記超音波分散部の動作を制御する制御部と、を備える細胞分散装置。
【請求項2】
前記制御部は、前記物理的分散部の作動開始と同時又は作動開始後に、前記超音波分散部の作動を開始させる、請求項1に記載の細胞分散装置。
【請求項3】
前記制御部は、前記物理的分散部の作動停止と同時又は作動停止前に、前記超音波分散部の作動を停止させる、請求項1又は2に記載の細胞分散装置。
【請求項4】
生体試料に含まれる凝集細胞を分散させる細胞分散装置であって、
容器に収容された生体試料に超音波を付与して凝集細胞を分散させる超音波分散部と、
前記容器内で生体試料を循環させながら凝集細胞に物理的な力を作用させて当該凝集細胞を分散させる物理的分散部と、
前記物理的分散部の作動停止後、続けて前記超音波分散部を作動させるように、前記物理的分散部及び前記超音波分散部の動作を制御する制御部と、を備える細胞分散装置。
【請求項5】
生体試料に含まれる凝集細胞を分散させる細胞分散装置であって、
容器に収容された生体試料に超音波を付与して凝集細胞を分散させる超音波分散部と、
前記容器内で生体試料を循環させながら凝集細胞に物理的な力を作用させて当該凝集細胞を分散させる物理的分散部と、
前記物理的分散部と前記超音波分散部とを交互に複数回作動させるように、前記物理的分散部及び前記超音波分散部の動作を制御する制御部と、を備える細胞分散装置。
【請求項6】
前記物理的分散部と前記超音波分散部とが一体的に構成されている、請求項1〜5のいずれかに記載の細胞分散装置。
【請求項7】
前記容器に洗浄液を供給する洗浄液供給部をさらに備え、
前記制御部は、前記洗浄液供給部によって前記容器に洗浄液を供給したのち、前記物理的分散部の少なくとも一部が前記容器に供給された洗浄液内に存在する状態で、前記超音波分散部を作動させる、請求項1〜6のいずれかに記載の細胞分散装置。
【請求項8】
前記物理的分散部は、前記容器内の生体試料の循環流が、前記超音波分散部による超音波の伝達方向と同一方向又は逆方向に流れるように、生体試料を循環させる、請求項1〜7のいずれかに記載の細胞分散装置。
【請求項9】
前記物理的分散部は、側面及び先端にそれぞれ孔が形成され、前記容器に対して上方から挿入される筒状部材と、前記筒状部材の内部に設けられており、前記筒状部材の側面の孔及び先端の孔の一方から他方へ向かう液流を発生させる液流発生部材とを備え、
前記超音波分散部は、前記容器の底部に設けられ、前記容器の上方に向かって超音波を付与する振動子を備える、請求項8に記載の細胞分散装置。
【請求項1】
生体試料に含まれる凝集細胞を分散させる細胞分散装置であって、
容器に収容された生体試料に超音波を付与して凝集細胞を分散させる超音波分散部と、
前記容器内で生体試料を循環させながら凝集細胞に物理的な力を作用させて当該凝集細胞を分散させる物理的分散部と、
前記物理的分散部の作動時間と前記超音波分散部の作動時間とを少なくとも一部において重複させるように、前記物理的分散部及び前記超音波分散部の動作を制御する制御部と、を備える細胞分散装置。
【請求項2】
前記制御部は、前記物理的分散部の作動開始と同時又は作動開始後に、前記超音波分散部の作動を開始させる、請求項1に記載の細胞分散装置。
【請求項3】
前記制御部は、前記物理的分散部の作動停止と同時又は作動停止前に、前記超音波分散部の作動を停止させる、請求項1又は2に記載の細胞分散装置。
【請求項4】
生体試料に含まれる凝集細胞を分散させる細胞分散装置であって、
容器に収容された生体試料に超音波を付与して凝集細胞を分散させる超音波分散部と、
前記容器内で生体試料を循環させながら凝集細胞に物理的な力を作用させて当該凝集細胞を分散させる物理的分散部と、
前記物理的分散部の作動停止後、続けて前記超音波分散部を作動させるように、前記物理的分散部及び前記超音波分散部の動作を制御する制御部と、を備える細胞分散装置。
【請求項5】
生体試料に含まれる凝集細胞を分散させる細胞分散装置であって、
容器に収容された生体試料に超音波を付与して凝集細胞を分散させる超音波分散部と、
前記容器内で生体試料を循環させながら凝集細胞に物理的な力を作用させて当該凝集細胞を分散させる物理的分散部と、
前記物理的分散部と前記超音波分散部とを交互に複数回作動させるように、前記物理的分散部及び前記超音波分散部の動作を制御する制御部と、を備える細胞分散装置。
【請求項6】
前記物理的分散部と前記超音波分散部とが一体的に構成されている、請求項1〜5のいずれかに記載の細胞分散装置。
【請求項7】
前記容器に洗浄液を供給する洗浄液供給部をさらに備え、
前記制御部は、前記洗浄液供給部によって前記容器に洗浄液を供給したのち、前記物理的分散部の少なくとも一部が前記容器に供給された洗浄液内に存在する状態で、前記超音波分散部を作動させる、請求項1〜6のいずれかに記載の細胞分散装置。
【請求項8】
前記物理的分散部は、前記容器内の生体試料の循環流が、前記超音波分散部による超音波の伝達方向と同一方向又は逆方向に流れるように、生体試料を循環させる、請求項1〜7のいずれかに記載の細胞分散装置。
【請求項9】
前記物理的分散部は、側面及び先端にそれぞれ孔が形成され、前記容器に対して上方から挿入される筒状部材と、前記筒状部材の内部に設けられており、前記筒状部材の側面の孔及び先端の孔の一方から他方へ向かう液流を発生させる液流発生部材とを備え、
前記超音波分散部は、前記容器の底部に設けられ、前記容器の上方に向かって超音波を付与する振動子を備える、請求項8に記載の細胞分散装置。
【図1】


【図2】


【図3】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2013−17401(P2013−17401A)
【公開日】平成25年1月31日(2013.1.31)
【国際特許分類】
【出願番号】特願2011−151177(P2011−151177)
【出願日】平成23年7月7日(2011.7.7)
【出願人】(390014960)シスメックス株式会社 (810)
【Fターム(参考)】
【公開日】平成25年1月31日(2013.1.31)
【国際特許分類】
【出願日】平成23年7月7日(2011.7.7)
【出願人】(390014960)シスメックス株式会社 (810)
【Fターム(参考)】
[ Back to top ]

