細胞分離チップ
【課題】サンプル量を少なくしつつ、信頼性の高い診断が可能となる細胞分離チップを提供する。
【解決手段】細胞分離測定チップ100は、基板1に部材2を貼りあわせることによって形成されている。基板1と部材2との間に設けられたマイクロリッターオーダの容積を有する空隙として、測定部4A、4Bと、溶液投入部3と、微細流路5とが設けられている。測定部4A、4Bは、測定対象の細胞がスポッティングされる金属薄膜6が、基板1上に設けられている。溶液投入部3は、測定対象の細胞とそれ以外の磁気修飾細胞とを含む溶液の投入口が部材2上に設けられている。微細流路5は、溶液投入部3と測定部4A、4Bとを連通する。磁性粒子7は、磁気修飾細胞の流れを妨げる磁場勾配を微細流路5内に発生させる。
【解決手段】細胞分離測定チップ100は、基板1に部材2を貼りあわせることによって形成されている。基板1と部材2との間に設けられたマイクロリッターオーダの容積を有する空隙として、測定部4A、4Bと、溶液投入部3と、微細流路5とが設けられている。測定部4A、4Bは、測定対象の細胞がスポッティングされる金属薄膜6が、基板1上に設けられている。溶液投入部3は、測定対象の細胞とそれ以外の磁気修飾細胞とを含む溶液の投入口が部材2上に設けられている。微細流路5は、溶液投入部3と測定部4A、4Bとを連通する。磁性粒子7は、磁気修飾細胞の流れを妨げる磁場勾配を微細流路5内に発生させる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、測定対象の細胞を他の細胞から分離する細胞分離チップに関する。
【背景技術】
【0002】
近年、食物アレルギー等の即時型アレルギーが社会問題化している。即時型アレルギーは、社会生活を妨げたり、場合によっては命に関わるものとなる。そこで、即時型アレルギーの診断の簡略化や、信頼性の向上が望まれている。
【0003】
当初、即時型アレルギー診断では、原因食物の摂取等により、症状の誘発を確認する負荷試験や、患者の血液や皮膚を用いた検査が行われるのが一般的であった。しかしながら、これらの方法は、被験者への負担が大きかったり、多くの血液が必要となったり、偽陽性、偽陰性の割合が高いなどの不都合があった。
【0004】
最近では、細胞レベルでの分析により、即時型アレルギー診断が行われるようになってきている。細胞レベルでの即時型アレルギー診断では、遠心分離やフィルタ分離などによって、血液サンプルの中から、測定対象となる細胞を抽出する必要がある。そこで、血液サンプル中における測定に不必要な細胞(例えば、測定対象をI型アレルギーの原因細胞である好塩基球細胞とするならば、好塩基球細胞以外の細胞)を磁気修飾し、磁気ビーズ法を用いて除去する装置等が開示されている(例えば、特許文献1参照)。磁気ビーズは、測定対象の細胞又はそれ以外の細胞に特異的な抗体に結合させ、細胞を磁気標識するものである。
【0005】
また、カラムの中に、直径約500μmの磁性粒子を敷き詰め、そのカラム内に血液を流すことにより、磁気修飾細胞を除去する装置も開示されている。このような装置で分離された好塩基球細胞は、抗原で刺激され、細胞から分泌されるヒスタミンの測定等に用いられる。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2006−006166号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
上述した装置で血液から細胞を取り出すには、多くの血液サンプル、例えば1検査に数ml(例えば2〜3ml以上)程度の血液サンプルが必要となるため、検査回数が増えると患者の負担も大きくなる。また、上述した装置は、何度も使用されるので、コンタミネーションにより診断の信頼性が低下するおそれがある。
【0008】
本発明は、上記実情に鑑みてなされたものであり、サンプル量を少なくしつつ、信頼性の高い診断が可能となる細胞分離チップを提供することを目的とする。
【課題を解決するための手段】
【0009】
上記目的を達成するために、本発明の第1の観点に係る細胞分離チップは、
基板に部材を貼りあわせることによって形成される細胞分離チップであって、
前記基板と前記部材との間に設けられたマイクロリッターオーダの容積を有する空隙として、
測定対象の細胞とそれ以外の磁気修飾細胞とを含む溶液の投入口が前記部材上に設けられた溶液投入部と、
前記溶液投入部から延びる微細流路と、
前記溶液投入部に投入され前記微細流路を流れる前記溶液が出力される溶液出力部と、
が設けられ、
前記磁気修飾細胞の流れを妨げる磁場勾配を前記微細流路内に発生させる磁場勾配発生手段を備える。
【0010】
前記溶液出力部は、
前記部材上に形成された大気開放部を有し、
前記微細流路は、毛細管力により前記溶液を前記溶液出力部側に送液するように形成されている、
こととしてもよい。
【0011】
前記溶液出力部には、
前記測定対象の細胞を刺激する物質を投入する投入口が設けられている、
こととしてもよい。
【0012】
前記磁場勾配発生手段は、
外部磁場の磁場勾配を大きくするために前記部材内に含有された磁性粒子である、
こととしてもよい。
【0013】
前記磁場勾配発生手段は、
前記部材内に配線された電流回路である、
こととしてもよい。
【0014】
前記磁場勾配発生手段は、
前記部材内に埋め込まれた小型磁石である、
こととしてもよい。
【0015】
前記溶液出力部には、
前記測定対象の細胞がスポッティングされる金属薄膜が、前記基板上に設けられている、
こととしてもよい。
【0016】
前記金属薄膜が形成された前記基板の反対側の面から、全反射条件を満たす入射角でP偏光を前記金属薄膜に入射させる入射手段と、
前記金属薄膜に入射した前記P偏光の反射光の強度に関する情報を検出する検出手段と、
をさらに備える、
こととしてもよい。
【0017】
前記検出手段は、
前記金属薄膜に入射した前記P偏光の反射光の2次元強度分布に相当する強度像を撮像する、
こととしてもよい。
【0018】
付着した前記測定対象の細胞の変化に伴って変化する前記金属薄膜のインピーダンスの変化を検出する検出手段をさらに備える、
こととしてもよい。
【0019】
前記金属薄膜への入射光と反射光との偏光状態の変化を検出する検出手段をさらに備える、
こととしてもよい。
【0020】
前記溶液出力部が複数設けられている、
こととしてもよい。
【0021】
前記溶液出力部として、
第1の溶液出力部と、第2の溶液出力部とが設けられ、
前記磁場勾配発生手段は、
前記第1の溶液出力部に連通する前記微細流路内だけに前記磁気修飾細胞の流れを妨げる磁場勾配を発生させる、
こととしてもよい。
【発明の効果】
【0022】
本発明に係る細胞分離チップは、マイクロリッターオーダの容積を有する空隙の一部である微細流路を、細胞を含む溶液が送液される間に、測定対象となる細胞を他の磁気修飾細胞から分離抽出することができるので、小量の溶液から測定対象の細胞を抽出することができる。また、本発明に係る細胞分離チップは、使い捨てとすることができるので、コンタミネーションを防止して、信頼性の高い診断を行うことができる。
【図面の簡単な説明】
【0023】
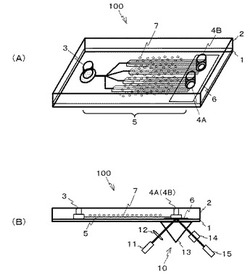
【図1】図1(A)は、本発明の実施の形態1に係る細胞分離測定チップの斜視図である。図1(B)は、その細胞分離測定チップの側面図である。
【図2】微細流路に生じる磁界を模式的に示す図である。
【図3】図1(B)の光学測定部の詳細な構成を示す模式図である。
【図4】反射光の強度の入射角度依存性の一例を示すグラフである。
【図5】図5(A)乃至図5(C)は、生細胞を刺激しない場合の反射強度像の画像の時間変化の一例である。
【図6】図6(A)乃至図6(C)は、生細胞を刺激した場合の反射強度像の画像の時間変化の一例である。
【図7】図1(A)の細胞分離測定装チップを用いた細胞測定動作のフローチャートである。
【図8】本発明の実施の形態2に係る細胞分離測定チップの斜視図である。
【発明を実施するための形態】
【0024】
この発明の実施の形態について、図面を参照して詳細に説明する。
【0025】
(実施の形態1)
まず、この発明の実施の形態1について説明する。
【0026】
図1(A)には、本実施形態に係る細胞分離チップとしての細胞分離測定チップ100の斜視図が示され、図1(B)には、細胞分離測定チップ100の側面図が示されている。
【0027】
図1(A)、図1(B)に示すように、細胞分離測定チップ100は、基板1と、部材2とを貼りあわせることによって形成されている。
【0028】
基板1は、ガラス基板である。このガラス基板としては、例えば、S−LAL−10ガラスが採用される。このガラスの屈折率は1.72である。
【0029】
部材2は、例えば、PDMS(ポリジメチルシロキサン)で形成されている。基板1と部材2との間には、空隙が設けられている。この空隙は全体でも、マイクロリッターオーダの容積を有している。
【0030】
この空隙は、溶液投入部3と、溶液出力部としての測定部4A、4Bと、微細流路5とに分けることができる。
【0031】
溶液投入部3は、測定対象の細胞とそれ以外の磁気修飾細胞とを含む溶液の投入口が部材2上に設けられている。溶液投入部3は、部材2の上面から下面を貫通している。溶液投入部3の最下部は、チャンバー構造となっており、そこに液溜りが形成されている。
【0032】
測定部4A、4Bは、溶液投入部3と、微細流路5を介して連通している。測定部4A、4Bでは、測定対象の細胞がスポッティングされる金属薄膜6が、基板1上に設けられている。金属薄膜6については、後述する。
【0033】
測定部4A、4Bでは、微細流路5に連通する大気開放部が部材2上に形成されている。この大気開放部は、測定対象の細胞に対する刺激物質を投入する投入口である。大気開放部から投入された刺激物質は、そのまま金属薄膜6に付着した測定対象の細胞を刺激する。
【0034】
微細流路5は、溶液投入部3と測定部4A、4Bとを連通する。微細流路5は、測定対象の細胞と磁気修飾細胞とを分離する機能性流路である。この細胞分離測定チップ100では、微細流路5が複数本設けられている。各微細流路5は、毛細管力により溶液を測定部4A、4Bに送液するように形成されている。すなわち、溶液投入部3に溶液が投入されると、その溶液は、微細流路5の毛細管力により、微細流路5内を測定部4A、4Bまで送液される。なお、各微細流路5の長さは同一である。このようにすれば、一方の測定部に早めに溶液が到達して、他方の測定部に溶液が送液されなくなるのを防ぐことができる。
【0035】
部材2は、砂鉄やフェライト等の磁性粒子7を複数包含する。磁性粒子7の直径は、例えば500μm程度である。磁性粒子7は、微細流路5の近傍に配置されている。
【0036】
ここで、細胞分離測定チップ100が、図2に示すように、微細流路5の流路方向に垂直な方向の磁界の中に置かれた場合について考える。この状態で、微細流路5内を直径2〜3μmの磁気ビーズで修飾された磁気修飾細胞が流れると、その磁気修飾細胞は、その磁界の影響を受けて、流れを妨げられ、微細流路5内の内壁等に付着する。
【0037】
この磁気修飾細胞が磁界より受ける力Fは、次式のようになる。
【数1】

部材2内に包含される磁性粒子7は、上記式(1)のうち、次式で示される磁場勾配の部分を大きくする。
【数2】

これにより、磁気修飾細胞が磁界から受ける力は大きくなる。
【0038】
なお、磁性粒子7が含有された部材2(PDMS製)を形成するには、二種の液体を混合してPDMS原液を生成した後に、液体の状態のPDMS原液を鋳型に流し、80度でベークして焼き固めるのが通常である。この際、鋳型に磁性粒子7を配置させ、PDMS原液を流し込み形成することで、部材2を作製する。
【0039】
PDMSに磁性粒子7を含有させると内部に気泡が発生しやすくなる。そのため、PDMS原液を鋳型に流し込んだ後に真空脱気処理を行うのが望ましい。
【0040】
また、磁性粒子7を含有するPDMSは焼き固めた際に反りかえる性質がある。これを避けるために、
(1)鋳型底面に配置する磁性粒子7の密度を調整する
(2)焼き固める上面に重しを載せておく
などの工夫が施されている。
【0041】
(1)の場合、部材2の微細流路5の近傍に磁性粒子7が配置されるように、鋳型にPDMS原液を注ぎこむ前に、鋳型内の微細流路5の近傍に相当する場所に、磁性粒子7を密集させて配置するにしてもよい。また、鋳型の微細流路5の近傍に相当する場所に、電気回路を配線しておき、電気回路に電流を流して周辺に磁界を発生させ、その磁界により磁性粒子7を引き寄せた状態で、PDMS原液を鋳型に流しこむようにしてもよい。
【0042】
完成した部材2では、微細流路5の近傍に磁性粒子7が配置され、流れるサンプルに磁場勾配の影響が生じやすくなっている。
【0043】
磁性粒子7のサイズは、現在450μmを用いているが、異なるサイズであっても機能を十分に発揮することが予想される。磁性粒子7のサイズは、微細流路5の断面積や長さなどに応じて適宜調整することができる。
【0044】
図1(B)に示すように、この細胞分離測定チップ100は、光学測定部10をさらに備える。光学測定部10は、光源11と、偏光板12と、プリズム13と、対物レンズ14と、撮像部15と、を備える。
【0045】
この光学測定部10は、表面プラズモン共鳴(SPR)現象を利用したセンサである。SPR現象は、金属薄膜6に全反射条件で光を入射すると、ある角度(共鳴角)でその光が金属表面のプラズモンと共鳴現象を起こし、反射光の減衰が起きる現象をいう。共鳴角は、金属薄膜6上の物質の屈折率に非常に敏感であり、共鳴角の変化を検出することで、金属薄膜6上の屈折率の変化を知ることが可能となる。
【0046】
図3には、光学測定部10の詳細な構成が示されている。
【0047】
光源11は、例えば半導体レーザである。この半導体レーザは、例えば波長が630nmのレーザ光を発振出力する。光源11から出力されたレーザ光は、不図示のコリメータレンズ等により平行光束に変換されて、偏光板12に入射する。なお、光源11として、赤色、白色LED(Light Emitting Diode)等を用いてもよい。
【0048】
偏光板12は、入射したレーザ光を直線偏光の平行光束に変換して出射する。この直線偏光は、後述する基板1と金属薄膜6との間の界面Fに対してP偏光となる。この光源11と偏光板12とが、入射手段に対応する。
【0049】
プリズム13は、偏光板2によりP偏光となった平行光束を入射する。プリズム13としては、基板1と同様に、例えばS−LAL−10ガラスが採用される。すなわち、基板1とプリズム13とは、屈折率が同じである。基板1とプリズム13は、当接しているため、プリズム13に入射したレーザ光(P偏光)は、基板1に入射し、そのまま直進する。
【0050】
金属薄膜6は、例えば金膜である。この他、Ag、Cu、Zn、Al、Kなどの薄膜も、金属薄膜6として用いることができる。金属薄膜6の厚みは、例えば50nmであり、センシングサイズは、例えば約1mm角である。金属薄膜6は、基板1上に例えば蒸着により成膜されている。基板1に入射したレーザ光は、基板1と金属薄膜6との間の界面Fに、例えば、全反射条件を満たし表面プラズモン共鳴現象を発生させる入射角θ=56°で入射する。仮に金属薄膜6が設置されていない状態であれば、このレーザ光は、界面Fで全反射する。
【0051】
界面Fで反射したレーザ光は、基板1及びプリズム13から出射して、対物レンズ14に入射する。対物レンズ14は、レーザ光を屈折させて出射する。対物レンズ14では、前側焦点距離よりも後側焦点距離の方が長いものが使用されている。したがって、この対物レンズ14は、物体像を所定の倍率で拡大して像面上に結像させる。対物レンズ14から出射されたレーザ光は、撮像部15の撮像面に到達する。
【0052】
撮像部15は、例えばCCD(Charge Coupled Device)イメージセンサ又はCMOS(Complementary Metal Oxide Semiconductor)イメージセンサである。撮像部15は、界面Fで反射されたレーザ光を受光する。撮像部15の撮像面と界面Fとは共役の関係にある。したがって、撮像部15の撮像面に、プリズム13の界面Fに入射した平行光束の反射光の2次元強度分布に相当する強度像、すなわち反射強度像が結像する。
【0053】
この反射強度像は、対物レンズ14により、例えば、2倍乃至40倍に拡大されている。撮像部15は、その反射強度像を撮像する。撮像部15は、その反射強度像に相当する画像信号を出力する。
【0054】
撮像部15から出力された画像信号は、コンピュータ(不図示)に入力される。コンピュータは、画像信号を表示し、又は画像信号に基づいて細胞の解析を行う。
【0055】
光学測定部10は、屈折率の異なる物質ごとの共鳴角の違いを利用して、金属薄膜6上の屈折率の相対的な強度分布を可視化する。金属薄膜6上で生細胞C1、C2を培養すると、生細胞C1、C2が接着している部分としていない部分とでは、屈折率が異なる。
【0056】
図4のグラフには、撮像部15で受光される反射光の強度の入射角依存性の一例が示されている。このグラフでは、横軸が界面Fへの平行光束の入射角θを示しており、縦軸が、その入射角θにおける反射光の強度を示している。図4には、3本の特性曲線(a)乃至(c)が示されている。
【0057】
特性曲線(a)は、金属薄膜6に何も置かれていない状態(生細胞C1、C2がない状態)での反射光の強度の入射角依存性を示す曲線である。これによれば、表面プラズモン共鳴現象により、入射角56°において反射光の強度が最も減衰している。この入射角56°を、共鳴角という。本実施形態では、生細胞C1、C2が接していない場合の反射光の強度が最も暗くなるように、界面Fへのレーザ光の入射角度を56°に設定している。
【0058】
特性曲線(b)は、生細胞C1、C2が金属薄膜6にセットされ、生細胞C1、C2がまだ刺激されていない状態での反射光強度の入射角依存性を示す曲線である。生細胞C1、C2は、誘電体であるため、生細胞C1、C2が当接する金属薄膜6の周辺では、誘電率(屈折率)が変化し、反射光強度の入射角依存性が特性曲線(a)から特性曲線(b)へシフトし、共鳴角も56°からθ1へシフトする。
【0059】
特性曲線(c)は、生細胞C1、C2が、金属薄膜6にセットされ、測定部4A、4Bに到達した液体に含まれる抗原等により、生細胞C1、C2が刺激され、その刺激に反応した状態での反射光強度の入射角依存性を示す曲線である。生細胞C1、C2が刺激され、その刺激に反応すると、生細胞C1、C2の誘電率(屈折率)はさらに変化するため、反射光の強度の入射角依存性が特性曲線(b)から特性曲線(c)へシフトし、共鳴角もθ1からθ2へシフトする。
【0060】
本実施形態では、平行光束の界面Fへの入射角が56°に固定されている。そこで、入射角56°に着目すると、金属薄膜6に生細胞C1、C2が接していない状態では、反射光の強度はI1となり最も暗くなっている。また、生細胞C1、C2が金属薄膜6に付着すると反射光の強度はI2となり、I1よりもΔI1だけ強くなっている。さらに、金属薄膜6に付着した生細胞C1、C2が抗原等により刺激され、その刺激に反応すると、反射光の強度はI2からΔI2だけ増えてI3となり、さらに強くなる。
【0061】
このように、撮像部15によって撮像される反射強度像の画像では、生細胞C1、C2が存在していない場所は暗くなり、細胞が存在している場所は明るくなり、生細胞C1、C2が活性化している場所は、さらに明るくなる。
【0062】
なお、生細胞C1、C2が存在している箇所と生細胞C1、C2が存在していない箇所とのコントラストが最も大きいのは、入射角θ=56°となる。このことは、図4において、生細胞C1、C2が存在していないときの共鳴角が56°で、反射光が最も減衰していることからも明らかである。すなわち、入射角を共鳴角と同じθ=56°とすると、Δl1を最大とすることができるので、画像のコントラストが増すのである。
【0063】
図5(A)乃至図5(C)には、生細胞C1、C2を抗原で刺激していない状態における0分後、10分後、20分後の反射強度像の画像の変化が示されている。また、図6(A)乃至図6(C)には、生細胞C1、C2を抗原で刺激した後における0分後、10分後、20分後の反射強度像の画像の変化が示されている。図5(A)乃至図5(C)と図6(A)乃至図6(C)を比較すると明らかなように、外部刺激に対して生細胞C1、C2が反応すると、生細胞C1、C2に相当する箇所の輝度が変化しているのがわかる。
【0064】
この光学測定部10を用いれば、細胞1つ1つの刺激応答(屈折率変化)を観察することができる。
【0065】
なお、光学測定部10は、測定部4A、4Bにそれぞれ対応して、2つ設けられていることとしてもよい。
【0066】
次に、本実施形態に係る細胞分離測定チップ100の動作について説明する。ここでは、好塩基球細胞を測定対象の細胞とする場合の動作について説明する。好塩基球細胞は、ヒト白血球に、0.5%前後含まれている。その直径は10μm程度である。
【0067】
図7には、この細胞分離測定チップ100を用いた細胞測定動作のフローチャートが示されている。
【0068】
まず、血液サンプルに対する前処理を行う(ステップS1)。より具体的には、血液サンプルから赤血球を分離除去した後、血液サンプル中の好塩基球細胞以外の白血球細胞を磁気ビーズで修飾する(ステップS1)。ここでは、好塩基球細胞になく、血液中の他の細胞に存在する表面抗原に結びつく磁気ビーズが用いられる。
【0069】
続いて、細胞分離測定チップ100を所定の位置に設置する(ステップS2)。これにより、図2に示すように、微細流路5内には、下向きの磁界が発生するようになり、光学測定部10が、図1(B)に示すような位置に設定される。磁性粒子7により、微細流路5内の磁場勾配はより大きくなっている。
【0070】
この状態で、溶液投入部3の投入口から、ステップS1で磁気修飾された血液サンプルをピペット等を用いて投入する(ステップS3)。溶液投入部3へ投入された血液サンプルは、溶液投入部3の液溜りを経て微細流路5に進入し、微細流路5に生じる毛細管力により、微細流路5を進む。
【0071】
微細流路5を進む間、血液サンプルは、図2に示す磁場を受ける。これにより、好塩基球細胞以外の磁気修飾細胞は、上向きの力を受け、微細流路5上面の磁性粒子7の下に留まるようになり、好塩基球細胞だけが、測定部4A、4Bに到達する。測定部4A、4Bに到達した好塩基球細胞は毛細管力から開放されて沈下し、金属薄膜6上に付着する。この結果、金属薄膜6に固定される細胞の大部分(望ましくは80%以上)は、好塩基球細胞となる。
【0072】
続いて、測定部4A、4Bの大気開放部から、刺激物質、すなわち抗原を投入する(ステップS4)。これにより、投入された抗原は、金属薄膜6に付着した好塩基球細胞の表面抗体と結びついて、抗原抗体反応を起こす。
【0073】
続いて、光学測定部10を用いて、測定を行う(ステップS5)。測定は、ステップS4で抗原を投入する前から開始するようにしてもよい。光源11からレーザ光の照射が開始され、撮像部15で、界面Fでの反射光に基づく金属薄膜6に付着した生細胞の2次元画像が撮像される。この2次元画像は、不図示のコンピュータで表示され、あるいは、解析され、その解析結果に基づいて、好塩基球細胞の特性を解析することが可能となる。
【0074】
以上詳細に説明したように、本実施の形態に係る細胞分離測定チップ100を用いれば、血液サンプルが微細流路5を送液される間に、測定対象となる好塩基球細胞を他の磁気修飾細胞から分離抽出することができるので、小量の血液サンプルから測定対象の細胞を抽出することができる。本発明者は、5μlの血液中に含まれる好塩基球細胞を使っても十分に診断可能であることを確認している。
【0075】
また、この細胞分離測定チップ100を用いれば、細胞の分離→固定→測定までを同一のチップ内で行うことができるので、その間のコンタミネーションを防止して、信頼性の高い計測を行うことができる。また、細胞分離測定チップ100自体を使い捨てとすることができるので、コンタミネーションを防止して、信頼性の高い診断を行うことができる。
【0076】
また、本実施の形態によれば、測定部4A、4Bには、微細流路5に連通する大気開放部が部材2上に形成されている。また、微細流路5は、毛細管力により血液サンプルを測定部4A、4Bに送液するように形成されている。このようにすれば、細胞を分離抽出してスポッティングするための外部ポンプが不要となるので、短時間な測定が可能となるうえ、アレルギー診断などに要するコストを低減することができるようになる。
【0077】
また、本実施の形態によれば、2次元SPR測定装置を用いて測定を行うので、信頼性が高く、かつ、迅速な診断が可能となる。
【0078】
このような細胞分離測定チップ100は、小型であるうえ、血液サンプルを滴下するだけで、細胞の分離から測定まで行えるので、簡便で使いやすくなるため、臨床現場での実用が容易になる。
【0079】
また、本実施の形態によれば、磁場勾配発生手段として、部材2内に含有され外部磁場の磁場勾配を大きくする磁性粒子7が用いられる。磁性粒子7として、例えば、砂鉄やフェライト等を用いることができるので、細胞分離測定チップ100の製造コストを低減することができる。
【0080】
また、本実施の形態によれば、同一の長さを有する微細流路5が複数設けられている。また、1つの溶液投入部3と、各微細流路5を介して連通する測定部4A、4Bが複数設けられている。このようにすれば、同一の測定対象の細胞に対して、異なる刺激を同時に与えることができるようになるので、診断に要する時間を短くすることができる。
【0081】
測定部の数は、3個以上であってもよい。測定部の数は、多ければ多いほどよい。このように、微細加工技術を用いることで、測定部を複数設けるなど、マルチチャンネル化が容易となる。
【0082】
(実施の形態2)
次に、本発明の実施の形態2について説明する。
【0083】
図8には、この実施の形態2に係る細胞分離測定チップ100の構成が示されている。図8に示すように、この細胞分離測定チップ100では、測定部4Bに連通する微細流路5の近傍には、磁性粒子7が配置されているが、測定部4Aに連通する微細流路5の近傍には、磁性粒子7が配置されていない点が、上記実施の形態1に係る細胞分離測定チップ100と異なる。
【0084】
このようにすれば、結果的に、測定部4Bには、好塩基球細胞だけが送られ、金属薄膜6に付着するが、測定部4Aには、血液サンプル内のすべての細胞が送られ、金属薄膜6に付着する。このようにすれば、同一の刺激物質を測定部4A、4Bに投入して、好塩基球以外の細胞があるときとないときでの、好塩基球における抗原反応の違いを観察することが可能となる。
【0085】
なお、上記各実施の形態では、磁場勾配発生手段を、部材2内に含有され外部磁場の磁場勾配を大きくする磁性粒子7としたが、本発明はこれには限られない。例えば、磁場勾配発生手段を、部材2内に配線された電流回路としてもよい。この電流回路を導通し、図2に示すような磁界を、微細流路5内に発生させればよい。この場合には、図2に示すような外部磁場は不要となる。また、磁場勾配発生手段として、部材2内に小型磁石を埋め込むようにしてもよい。この場合にも、図2に示すような外部磁場は不要となる。
【0086】
なお、上記各実施の形態では、部材2がPDMSで形成されているものとしたが、本発明はこれには限られない。例えば、アクリル樹脂等の樹脂やガラスで部材2を形成するようにしてもよい。要は、磁性粒子7等を含有できることができる物質であればよい。
【0087】
また、上記各実施の形態では、光学測定部10が、細胞の2次元画像を撮像したが、本発明はこれには限られない。例えば、界面Fへの反射光の強度を検出するだけでもよい。
【0088】
また、上記各実施の形態では、SPR(表面プラズモン共鳴)現象を利用して、測定対象の細胞の特性を検出したが、本発明はこれには限られない。例えば、細胞の変化に伴って変化する金属薄膜6のインピーダンスの変化を検出するようにしてもよいし、細胞の変化に伴って変化する金属薄膜6の屈折率を、金属薄膜6への入射光と反射光との偏光状態の変化を検出するエリプソメトリを用いて測定するようにしてもよい。
【0089】
また、測定対象の細胞も、好塩基球細胞に限られない。例えば、単球、リンパ球、好中球、好酸球など、血液中の他の細胞であってもよいし、血液以外に存在する細胞であってもよい。
【0090】
また、溶液投入部3の数も、複数設けることができる。このように、微細加工技術より、1つのチップに、溶液投入部や測定部を複数設けることができるので、マルチチャンネル化が容易となり、複数検体の同時検査も可能となる。通常、人体の主たるアレルギーは10種類程度であり、10個の測定部を設ければ、10種類のアレルギーを一度に調べることが可能となり、診断時間が著しく短縮される。
【0091】
また、上記各実施の形態では、微細流路5が、毛細管力により溶液を測定部4A、4Bに送液したが、本発明はこれには限られない。溶液投入部3に外部ポンプを接続して、外部ポンプを動作させて、溶液を測定部4A、4Bに送液するようにしてもよい。
【0092】
なお、本明細書において使用される「細胞」とは、当該分野において用いられる最も広義の意味と同様に定義され、どのような種類・動物の細胞でも構わない。また、天然に存在する細胞であっても、人工的に改変された細胞(例えば、融合細胞または遺伝子改変細胞)であってもよい。「生細胞」とは、このうち生きた細胞を示す。最も好ましくは、ヒト(Homo sapience)由来の生細胞を示す。
【0093】
また、「刺激」とは、細胞表面の受容体に対するリガンドの結合、温度もしくはpH等の環境変化、機械的刺激または電気的刺激等を意味し、細胞の活性(例えば、細胞内の情報伝達系の賦活等)に対して作用する全ての刺激を包含している。
【0094】
要は、本発明は、即時型アレルギー診断だけでなく、広く細胞の解析に有用である。
【0095】
また、「磁性粒子」とは、磁場中に置く事で磁化され磁石の性質を持つ鉄や砂鉄のような物質を指す。
【0096】
本発明は、本発明の広義の精神と範囲を逸脱することなく、様々な実施の形態及び変形が可能とされるものである。また、上述した実施の形態は、本発明を説明するためのものであり、本発明の範囲を限定するものではない。すなわち、本発明の範囲は、実施の形態ではなく、特許請求の範囲によって示される。そして、特許請求の範囲内及びそれと同等の発明の意義の範囲内で施される様々な変形が、本発明の範囲内とみなされる。
【産業上の利用可能性】
【0097】
本発明は、即時型アレルギー診断に好適である。
【符号の説明】
【0098】
1 基板
2 部材
3 溶液投入部
4A、4B 測定部
5 微細流路
6 金属薄膜
7 磁性粒子
10 光学測定部
11 光源
12 偏光板
13 プリズム
14 対物レンズ
15 撮像部
100 細胞分離測定チップ
C1、C2 生細胞
【技術分野】
【0001】
本発明は、測定対象の細胞を他の細胞から分離する細胞分離チップに関する。
【背景技術】
【0002】
近年、食物アレルギー等の即時型アレルギーが社会問題化している。即時型アレルギーは、社会生活を妨げたり、場合によっては命に関わるものとなる。そこで、即時型アレルギーの診断の簡略化や、信頼性の向上が望まれている。
【0003】
当初、即時型アレルギー診断では、原因食物の摂取等により、症状の誘発を確認する負荷試験や、患者の血液や皮膚を用いた検査が行われるのが一般的であった。しかしながら、これらの方法は、被験者への負担が大きかったり、多くの血液が必要となったり、偽陽性、偽陰性の割合が高いなどの不都合があった。
【0004】
最近では、細胞レベルでの分析により、即時型アレルギー診断が行われるようになってきている。細胞レベルでの即時型アレルギー診断では、遠心分離やフィルタ分離などによって、血液サンプルの中から、測定対象となる細胞を抽出する必要がある。そこで、血液サンプル中における測定に不必要な細胞(例えば、測定対象をI型アレルギーの原因細胞である好塩基球細胞とするならば、好塩基球細胞以外の細胞)を磁気修飾し、磁気ビーズ法を用いて除去する装置等が開示されている(例えば、特許文献1参照)。磁気ビーズは、測定対象の細胞又はそれ以外の細胞に特異的な抗体に結合させ、細胞を磁気標識するものである。
【0005】
また、カラムの中に、直径約500μmの磁性粒子を敷き詰め、そのカラム内に血液を流すことにより、磁気修飾細胞を除去する装置も開示されている。このような装置で分離された好塩基球細胞は、抗原で刺激され、細胞から分泌されるヒスタミンの測定等に用いられる。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2006−006166号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
上述した装置で血液から細胞を取り出すには、多くの血液サンプル、例えば1検査に数ml(例えば2〜3ml以上)程度の血液サンプルが必要となるため、検査回数が増えると患者の負担も大きくなる。また、上述した装置は、何度も使用されるので、コンタミネーションにより診断の信頼性が低下するおそれがある。
【0008】
本発明は、上記実情に鑑みてなされたものであり、サンプル量を少なくしつつ、信頼性の高い診断が可能となる細胞分離チップを提供することを目的とする。
【課題を解決するための手段】
【0009】
上記目的を達成するために、本発明の第1の観点に係る細胞分離チップは、
基板に部材を貼りあわせることによって形成される細胞分離チップであって、
前記基板と前記部材との間に設けられたマイクロリッターオーダの容積を有する空隙として、
測定対象の細胞とそれ以外の磁気修飾細胞とを含む溶液の投入口が前記部材上に設けられた溶液投入部と、
前記溶液投入部から延びる微細流路と、
前記溶液投入部に投入され前記微細流路を流れる前記溶液が出力される溶液出力部と、
が設けられ、
前記磁気修飾細胞の流れを妨げる磁場勾配を前記微細流路内に発生させる磁場勾配発生手段を備える。
【0010】
前記溶液出力部は、
前記部材上に形成された大気開放部を有し、
前記微細流路は、毛細管力により前記溶液を前記溶液出力部側に送液するように形成されている、
こととしてもよい。
【0011】
前記溶液出力部には、
前記測定対象の細胞を刺激する物質を投入する投入口が設けられている、
こととしてもよい。
【0012】
前記磁場勾配発生手段は、
外部磁場の磁場勾配を大きくするために前記部材内に含有された磁性粒子である、
こととしてもよい。
【0013】
前記磁場勾配発生手段は、
前記部材内に配線された電流回路である、
こととしてもよい。
【0014】
前記磁場勾配発生手段は、
前記部材内に埋め込まれた小型磁石である、
こととしてもよい。
【0015】
前記溶液出力部には、
前記測定対象の細胞がスポッティングされる金属薄膜が、前記基板上に設けられている、
こととしてもよい。
【0016】
前記金属薄膜が形成された前記基板の反対側の面から、全反射条件を満たす入射角でP偏光を前記金属薄膜に入射させる入射手段と、
前記金属薄膜に入射した前記P偏光の反射光の強度に関する情報を検出する検出手段と、
をさらに備える、
こととしてもよい。
【0017】
前記検出手段は、
前記金属薄膜に入射した前記P偏光の反射光の2次元強度分布に相当する強度像を撮像する、
こととしてもよい。
【0018】
付着した前記測定対象の細胞の変化に伴って変化する前記金属薄膜のインピーダンスの変化を検出する検出手段をさらに備える、
こととしてもよい。
【0019】
前記金属薄膜への入射光と反射光との偏光状態の変化を検出する検出手段をさらに備える、
こととしてもよい。
【0020】
前記溶液出力部が複数設けられている、
こととしてもよい。
【0021】
前記溶液出力部として、
第1の溶液出力部と、第2の溶液出力部とが設けられ、
前記磁場勾配発生手段は、
前記第1の溶液出力部に連通する前記微細流路内だけに前記磁気修飾細胞の流れを妨げる磁場勾配を発生させる、
こととしてもよい。
【発明の効果】
【0022】
本発明に係る細胞分離チップは、マイクロリッターオーダの容積を有する空隙の一部である微細流路を、細胞を含む溶液が送液される間に、測定対象となる細胞を他の磁気修飾細胞から分離抽出することができるので、小量の溶液から測定対象の細胞を抽出することができる。また、本発明に係る細胞分離チップは、使い捨てとすることができるので、コンタミネーションを防止して、信頼性の高い診断を行うことができる。
【図面の簡単な説明】
【0023】
【図1】図1(A)は、本発明の実施の形態1に係る細胞分離測定チップの斜視図である。図1(B)は、その細胞分離測定チップの側面図である。
【図2】微細流路に生じる磁界を模式的に示す図である。
【図3】図1(B)の光学測定部の詳細な構成を示す模式図である。
【図4】反射光の強度の入射角度依存性の一例を示すグラフである。
【図5】図5(A)乃至図5(C)は、生細胞を刺激しない場合の反射強度像の画像の時間変化の一例である。
【図6】図6(A)乃至図6(C)は、生細胞を刺激した場合の反射強度像の画像の時間変化の一例である。
【図7】図1(A)の細胞分離測定装チップを用いた細胞測定動作のフローチャートである。
【図8】本発明の実施の形態2に係る細胞分離測定チップの斜視図である。
【発明を実施するための形態】
【0024】
この発明の実施の形態について、図面を参照して詳細に説明する。
【0025】
(実施の形態1)
まず、この発明の実施の形態1について説明する。
【0026】
図1(A)には、本実施形態に係る細胞分離チップとしての細胞分離測定チップ100の斜視図が示され、図1(B)には、細胞分離測定チップ100の側面図が示されている。
【0027】
図1(A)、図1(B)に示すように、細胞分離測定チップ100は、基板1と、部材2とを貼りあわせることによって形成されている。
【0028】
基板1は、ガラス基板である。このガラス基板としては、例えば、S−LAL−10ガラスが採用される。このガラスの屈折率は1.72である。
【0029】
部材2は、例えば、PDMS(ポリジメチルシロキサン)で形成されている。基板1と部材2との間には、空隙が設けられている。この空隙は全体でも、マイクロリッターオーダの容積を有している。
【0030】
この空隙は、溶液投入部3と、溶液出力部としての測定部4A、4Bと、微細流路5とに分けることができる。
【0031】
溶液投入部3は、測定対象の細胞とそれ以外の磁気修飾細胞とを含む溶液の投入口が部材2上に設けられている。溶液投入部3は、部材2の上面から下面を貫通している。溶液投入部3の最下部は、チャンバー構造となっており、そこに液溜りが形成されている。
【0032】
測定部4A、4Bは、溶液投入部3と、微細流路5を介して連通している。測定部4A、4Bでは、測定対象の細胞がスポッティングされる金属薄膜6が、基板1上に設けられている。金属薄膜6については、後述する。
【0033】
測定部4A、4Bでは、微細流路5に連通する大気開放部が部材2上に形成されている。この大気開放部は、測定対象の細胞に対する刺激物質を投入する投入口である。大気開放部から投入された刺激物質は、そのまま金属薄膜6に付着した測定対象の細胞を刺激する。
【0034】
微細流路5は、溶液投入部3と測定部4A、4Bとを連通する。微細流路5は、測定対象の細胞と磁気修飾細胞とを分離する機能性流路である。この細胞分離測定チップ100では、微細流路5が複数本設けられている。各微細流路5は、毛細管力により溶液を測定部4A、4Bに送液するように形成されている。すなわち、溶液投入部3に溶液が投入されると、その溶液は、微細流路5の毛細管力により、微細流路5内を測定部4A、4Bまで送液される。なお、各微細流路5の長さは同一である。このようにすれば、一方の測定部に早めに溶液が到達して、他方の測定部に溶液が送液されなくなるのを防ぐことができる。
【0035】
部材2は、砂鉄やフェライト等の磁性粒子7を複数包含する。磁性粒子7の直径は、例えば500μm程度である。磁性粒子7は、微細流路5の近傍に配置されている。
【0036】
ここで、細胞分離測定チップ100が、図2に示すように、微細流路5の流路方向に垂直な方向の磁界の中に置かれた場合について考える。この状態で、微細流路5内を直径2〜3μmの磁気ビーズで修飾された磁気修飾細胞が流れると、その磁気修飾細胞は、その磁界の影響を受けて、流れを妨げられ、微細流路5内の内壁等に付着する。
【0037】
この磁気修飾細胞が磁界より受ける力Fは、次式のようになる。
【数1】

部材2内に包含される磁性粒子7は、上記式(1)のうち、次式で示される磁場勾配の部分を大きくする。
【数2】

これにより、磁気修飾細胞が磁界から受ける力は大きくなる。
【0038】
なお、磁性粒子7が含有された部材2(PDMS製)を形成するには、二種の液体を混合してPDMS原液を生成した後に、液体の状態のPDMS原液を鋳型に流し、80度でベークして焼き固めるのが通常である。この際、鋳型に磁性粒子7を配置させ、PDMS原液を流し込み形成することで、部材2を作製する。
【0039】
PDMSに磁性粒子7を含有させると内部に気泡が発生しやすくなる。そのため、PDMS原液を鋳型に流し込んだ後に真空脱気処理を行うのが望ましい。
【0040】
また、磁性粒子7を含有するPDMSは焼き固めた際に反りかえる性質がある。これを避けるために、
(1)鋳型底面に配置する磁性粒子7の密度を調整する
(2)焼き固める上面に重しを載せておく
などの工夫が施されている。
【0041】
(1)の場合、部材2の微細流路5の近傍に磁性粒子7が配置されるように、鋳型にPDMS原液を注ぎこむ前に、鋳型内の微細流路5の近傍に相当する場所に、磁性粒子7を密集させて配置するにしてもよい。また、鋳型の微細流路5の近傍に相当する場所に、電気回路を配線しておき、電気回路に電流を流して周辺に磁界を発生させ、その磁界により磁性粒子7を引き寄せた状態で、PDMS原液を鋳型に流しこむようにしてもよい。
【0042】
完成した部材2では、微細流路5の近傍に磁性粒子7が配置され、流れるサンプルに磁場勾配の影響が生じやすくなっている。
【0043】
磁性粒子7のサイズは、現在450μmを用いているが、異なるサイズであっても機能を十分に発揮することが予想される。磁性粒子7のサイズは、微細流路5の断面積や長さなどに応じて適宜調整することができる。
【0044】
図1(B)に示すように、この細胞分離測定チップ100は、光学測定部10をさらに備える。光学測定部10は、光源11と、偏光板12と、プリズム13と、対物レンズ14と、撮像部15と、を備える。
【0045】
この光学測定部10は、表面プラズモン共鳴(SPR)現象を利用したセンサである。SPR現象は、金属薄膜6に全反射条件で光を入射すると、ある角度(共鳴角)でその光が金属表面のプラズモンと共鳴現象を起こし、反射光の減衰が起きる現象をいう。共鳴角は、金属薄膜6上の物質の屈折率に非常に敏感であり、共鳴角の変化を検出することで、金属薄膜6上の屈折率の変化を知ることが可能となる。
【0046】
図3には、光学測定部10の詳細な構成が示されている。
【0047】
光源11は、例えば半導体レーザである。この半導体レーザは、例えば波長が630nmのレーザ光を発振出力する。光源11から出力されたレーザ光は、不図示のコリメータレンズ等により平行光束に変換されて、偏光板12に入射する。なお、光源11として、赤色、白色LED(Light Emitting Diode)等を用いてもよい。
【0048】
偏光板12は、入射したレーザ光を直線偏光の平行光束に変換して出射する。この直線偏光は、後述する基板1と金属薄膜6との間の界面Fに対してP偏光となる。この光源11と偏光板12とが、入射手段に対応する。
【0049】
プリズム13は、偏光板2によりP偏光となった平行光束を入射する。プリズム13としては、基板1と同様に、例えばS−LAL−10ガラスが採用される。すなわち、基板1とプリズム13とは、屈折率が同じである。基板1とプリズム13は、当接しているため、プリズム13に入射したレーザ光(P偏光)は、基板1に入射し、そのまま直進する。
【0050】
金属薄膜6は、例えば金膜である。この他、Ag、Cu、Zn、Al、Kなどの薄膜も、金属薄膜6として用いることができる。金属薄膜6の厚みは、例えば50nmであり、センシングサイズは、例えば約1mm角である。金属薄膜6は、基板1上に例えば蒸着により成膜されている。基板1に入射したレーザ光は、基板1と金属薄膜6との間の界面Fに、例えば、全反射条件を満たし表面プラズモン共鳴現象を発生させる入射角θ=56°で入射する。仮に金属薄膜6が設置されていない状態であれば、このレーザ光は、界面Fで全反射する。
【0051】
界面Fで反射したレーザ光は、基板1及びプリズム13から出射して、対物レンズ14に入射する。対物レンズ14は、レーザ光を屈折させて出射する。対物レンズ14では、前側焦点距離よりも後側焦点距離の方が長いものが使用されている。したがって、この対物レンズ14は、物体像を所定の倍率で拡大して像面上に結像させる。対物レンズ14から出射されたレーザ光は、撮像部15の撮像面に到達する。
【0052】
撮像部15は、例えばCCD(Charge Coupled Device)イメージセンサ又はCMOS(Complementary Metal Oxide Semiconductor)イメージセンサである。撮像部15は、界面Fで反射されたレーザ光を受光する。撮像部15の撮像面と界面Fとは共役の関係にある。したがって、撮像部15の撮像面に、プリズム13の界面Fに入射した平行光束の反射光の2次元強度分布に相当する強度像、すなわち反射強度像が結像する。
【0053】
この反射強度像は、対物レンズ14により、例えば、2倍乃至40倍に拡大されている。撮像部15は、その反射強度像を撮像する。撮像部15は、その反射強度像に相当する画像信号を出力する。
【0054】
撮像部15から出力された画像信号は、コンピュータ(不図示)に入力される。コンピュータは、画像信号を表示し、又は画像信号に基づいて細胞の解析を行う。
【0055】
光学測定部10は、屈折率の異なる物質ごとの共鳴角の違いを利用して、金属薄膜6上の屈折率の相対的な強度分布を可視化する。金属薄膜6上で生細胞C1、C2を培養すると、生細胞C1、C2が接着している部分としていない部分とでは、屈折率が異なる。
【0056】
図4のグラフには、撮像部15で受光される反射光の強度の入射角依存性の一例が示されている。このグラフでは、横軸が界面Fへの平行光束の入射角θを示しており、縦軸が、その入射角θにおける反射光の強度を示している。図4には、3本の特性曲線(a)乃至(c)が示されている。
【0057】
特性曲線(a)は、金属薄膜6に何も置かれていない状態(生細胞C1、C2がない状態)での反射光の強度の入射角依存性を示す曲線である。これによれば、表面プラズモン共鳴現象により、入射角56°において反射光の強度が最も減衰している。この入射角56°を、共鳴角という。本実施形態では、生細胞C1、C2が接していない場合の反射光の強度が最も暗くなるように、界面Fへのレーザ光の入射角度を56°に設定している。
【0058】
特性曲線(b)は、生細胞C1、C2が金属薄膜6にセットされ、生細胞C1、C2がまだ刺激されていない状態での反射光強度の入射角依存性を示す曲線である。生細胞C1、C2は、誘電体であるため、生細胞C1、C2が当接する金属薄膜6の周辺では、誘電率(屈折率)が変化し、反射光強度の入射角依存性が特性曲線(a)から特性曲線(b)へシフトし、共鳴角も56°からθ1へシフトする。
【0059】
特性曲線(c)は、生細胞C1、C2が、金属薄膜6にセットされ、測定部4A、4Bに到達した液体に含まれる抗原等により、生細胞C1、C2が刺激され、その刺激に反応した状態での反射光強度の入射角依存性を示す曲線である。生細胞C1、C2が刺激され、その刺激に反応すると、生細胞C1、C2の誘電率(屈折率)はさらに変化するため、反射光の強度の入射角依存性が特性曲線(b)から特性曲線(c)へシフトし、共鳴角もθ1からθ2へシフトする。
【0060】
本実施形態では、平行光束の界面Fへの入射角が56°に固定されている。そこで、入射角56°に着目すると、金属薄膜6に生細胞C1、C2が接していない状態では、反射光の強度はI1となり最も暗くなっている。また、生細胞C1、C2が金属薄膜6に付着すると反射光の強度はI2となり、I1よりもΔI1だけ強くなっている。さらに、金属薄膜6に付着した生細胞C1、C2が抗原等により刺激され、その刺激に反応すると、反射光の強度はI2からΔI2だけ増えてI3となり、さらに強くなる。
【0061】
このように、撮像部15によって撮像される反射強度像の画像では、生細胞C1、C2が存在していない場所は暗くなり、細胞が存在している場所は明るくなり、生細胞C1、C2が活性化している場所は、さらに明るくなる。
【0062】
なお、生細胞C1、C2が存在している箇所と生細胞C1、C2が存在していない箇所とのコントラストが最も大きいのは、入射角θ=56°となる。このことは、図4において、生細胞C1、C2が存在していないときの共鳴角が56°で、反射光が最も減衰していることからも明らかである。すなわち、入射角を共鳴角と同じθ=56°とすると、Δl1を最大とすることができるので、画像のコントラストが増すのである。
【0063】
図5(A)乃至図5(C)には、生細胞C1、C2を抗原で刺激していない状態における0分後、10分後、20分後の反射強度像の画像の変化が示されている。また、図6(A)乃至図6(C)には、生細胞C1、C2を抗原で刺激した後における0分後、10分後、20分後の反射強度像の画像の変化が示されている。図5(A)乃至図5(C)と図6(A)乃至図6(C)を比較すると明らかなように、外部刺激に対して生細胞C1、C2が反応すると、生細胞C1、C2に相当する箇所の輝度が変化しているのがわかる。
【0064】
この光学測定部10を用いれば、細胞1つ1つの刺激応答(屈折率変化)を観察することができる。
【0065】
なお、光学測定部10は、測定部4A、4Bにそれぞれ対応して、2つ設けられていることとしてもよい。
【0066】
次に、本実施形態に係る細胞分離測定チップ100の動作について説明する。ここでは、好塩基球細胞を測定対象の細胞とする場合の動作について説明する。好塩基球細胞は、ヒト白血球に、0.5%前後含まれている。その直径は10μm程度である。
【0067】
図7には、この細胞分離測定チップ100を用いた細胞測定動作のフローチャートが示されている。
【0068】
まず、血液サンプルに対する前処理を行う(ステップS1)。より具体的には、血液サンプルから赤血球を分離除去した後、血液サンプル中の好塩基球細胞以外の白血球細胞を磁気ビーズで修飾する(ステップS1)。ここでは、好塩基球細胞になく、血液中の他の細胞に存在する表面抗原に結びつく磁気ビーズが用いられる。
【0069】
続いて、細胞分離測定チップ100を所定の位置に設置する(ステップS2)。これにより、図2に示すように、微細流路5内には、下向きの磁界が発生するようになり、光学測定部10が、図1(B)に示すような位置に設定される。磁性粒子7により、微細流路5内の磁場勾配はより大きくなっている。
【0070】
この状態で、溶液投入部3の投入口から、ステップS1で磁気修飾された血液サンプルをピペット等を用いて投入する(ステップS3)。溶液投入部3へ投入された血液サンプルは、溶液投入部3の液溜りを経て微細流路5に進入し、微細流路5に生じる毛細管力により、微細流路5を進む。
【0071】
微細流路5を進む間、血液サンプルは、図2に示す磁場を受ける。これにより、好塩基球細胞以外の磁気修飾細胞は、上向きの力を受け、微細流路5上面の磁性粒子7の下に留まるようになり、好塩基球細胞だけが、測定部4A、4Bに到達する。測定部4A、4Bに到達した好塩基球細胞は毛細管力から開放されて沈下し、金属薄膜6上に付着する。この結果、金属薄膜6に固定される細胞の大部分(望ましくは80%以上)は、好塩基球細胞となる。
【0072】
続いて、測定部4A、4Bの大気開放部から、刺激物質、すなわち抗原を投入する(ステップS4)。これにより、投入された抗原は、金属薄膜6に付着した好塩基球細胞の表面抗体と結びついて、抗原抗体反応を起こす。
【0073】
続いて、光学測定部10を用いて、測定を行う(ステップS5)。測定は、ステップS4で抗原を投入する前から開始するようにしてもよい。光源11からレーザ光の照射が開始され、撮像部15で、界面Fでの反射光に基づく金属薄膜6に付着した生細胞の2次元画像が撮像される。この2次元画像は、不図示のコンピュータで表示され、あるいは、解析され、その解析結果に基づいて、好塩基球細胞の特性を解析することが可能となる。
【0074】
以上詳細に説明したように、本実施の形態に係る細胞分離測定チップ100を用いれば、血液サンプルが微細流路5を送液される間に、測定対象となる好塩基球細胞を他の磁気修飾細胞から分離抽出することができるので、小量の血液サンプルから測定対象の細胞を抽出することができる。本発明者は、5μlの血液中に含まれる好塩基球細胞を使っても十分に診断可能であることを確認している。
【0075】
また、この細胞分離測定チップ100を用いれば、細胞の分離→固定→測定までを同一のチップ内で行うことができるので、その間のコンタミネーションを防止して、信頼性の高い計測を行うことができる。また、細胞分離測定チップ100自体を使い捨てとすることができるので、コンタミネーションを防止して、信頼性の高い診断を行うことができる。
【0076】
また、本実施の形態によれば、測定部4A、4Bには、微細流路5に連通する大気開放部が部材2上に形成されている。また、微細流路5は、毛細管力により血液サンプルを測定部4A、4Bに送液するように形成されている。このようにすれば、細胞を分離抽出してスポッティングするための外部ポンプが不要となるので、短時間な測定が可能となるうえ、アレルギー診断などに要するコストを低減することができるようになる。
【0077】
また、本実施の形態によれば、2次元SPR測定装置を用いて測定を行うので、信頼性が高く、かつ、迅速な診断が可能となる。
【0078】
このような細胞分離測定チップ100は、小型であるうえ、血液サンプルを滴下するだけで、細胞の分離から測定まで行えるので、簡便で使いやすくなるため、臨床現場での実用が容易になる。
【0079】
また、本実施の形態によれば、磁場勾配発生手段として、部材2内に含有され外部磁場の磁場勾配を大きくする磁性粒子7が用いられる。磁性粒子7として、例えば、砂鉄やフェライト等を用いることができるので、細胞分離測定チップ100の製造コストを低減することができる。
【0080】
また、本実施の形態によれば、同一の長さを有する微細流路5が複数設けられている。また、1つの溶液投入部3と、各微細流路5を介して連通する測定部4A、4Bが複数設けられている。このようにすれば、同一の測定対象の細胞に対して、異なる刺激を同時に与えることができるようになるので、診断に要する時間を短くすることができる。
【0081】
測定部の数は、3個以上であってもよい。測定部の数は、多ければ多いほどよい。このように、微細加工技術を用いることで、測定部を複数設けるなど、マルチチャンネル化が容易となる。
【0082】
(実施の形態2)
次に、本発明の実施の形態2について説明する。
【0083】
図8には、この実施の形態2に係る細胞分離測定チップ100の構成が示されている。図8に示すように、この細胞分離測定チップ100では、測定部4Bに連通する微細流路5の近傍には、磁性粒子7が配置されているが、測定部4Aに連通する微細流路5の近傍には、磁性粒子7が配置されていない点が、上記実施の形態1に係る細胞分離測定チップ100と異なる。
【0084】
このようにすれば、結果的に、測定部4Bには、好塩基球細胞だけが送られ、金属薄膜6に付着するが、測定部4Aには、血液サンプル内のすべての細胞が送られ、金属薄膜6に付着する。このようにすれば、同一の刺激物質を測定部4A、4Bに投入して、好塩基球以外の細胞があるときとないときでの、好塩基球における抗原反応の違いを観察することが可能となる。
【0085】
なお、上記各実施の形態では、磁場勾配発生手段を、部材2内に含有され外部磁場の磁場勾配を大きくする磁性粒子7としたが、本発明はこれには限られない。例えば、磁場勾配発生手段を、部材2内に配線された電流回路としてもよい。この電流回路を導通し、図2に示すような磁界を、微細流路5内に発生させればよい。この場合には、図2に示すような外部磁場は不要となる。また、磁場勾配発生手段として、部材2内に小型磁石を埋め込むようにしてもよい。この場合にも、図2に示すような外部磁場は不要となる。
【0086】
なお、上記各実施の形態では、部材2がPDMSで形成されているものとしたが、本発明はこれには限られない。例えば、アクリル樹脂等の樹脂やガラスで部材2を形成するようにしてもよい。要は、磁性粒子7等を含有できることができる物質であればよい。
【0087】
また、上記各実施の形態では、光学測定部10が、細胞の2次元画像を撮像したが、本発明はこれには限られない。例えば、界面Fへの反射光の強度を検出するだけでもよい。
【0088】
また、上記各実施の形態では、SPR(表面プラズモン共鳴)現象を利用して、測定対象の細胞の特性を検出したが、本発明はこれには限られない。例えば、細胞の変化に伴って変化する金属薄膜6のインピーダンスの変化を検出するようにしてもよいし、細胞の変化に伴って変化する金属薄膜6の屈折率を、金属薄膜6への入射光と反射光との偏光状態の変化を検出するエリプソメトリを用いて測定するようにしてもよい。
【0089】
また、測定対象の細胞も、好塩基球細胞に限られない。例えば、単球、リンパ球、好中球、好酸球など、血液中の他の細胞であってもよいし、血液以外に存在する細胞であってもよい。
【0090】
また、溶液投入部3の数も、複数設けることができる。このように、微細加工技術より、1つのチップに、溶液投入部や測定部を複数設けることができるので、マルチチャンネル化が容易となり、複数検体の同時検査も可能となる。通常、人体の主たるアレルギーは10種類程度であり、10個の測定部を設ければ、10種類のアレルギーを一度に調べることが可能となり、診断時間が著しく短縮される。
【0091】
また、上記各実施の形態では、微細流路5が、毛細管力により溶液を測定部4A、4Bに送液したが、本発明はこれには限られない。溶液投入部3に外部ポンプを接続して、外部ポンプを動作させて、溶液を測定部4A、4Bに送液するようにしてもよい。
【0092】
なお、本明細書において使用される「細胞」とは、当該分野において用いられる最も広義の意味と同様に定義され、どのような種類・動物の細胞でも構わない。また、天然に存在する細胞であっても、人工的に改変された細胞(例えば、融合細胞または遺伝子改変細胞)であってもよい。「生細胞」とは、このうち生きた細胞を示す。最も好ましくは、ヒト(Homo sapience)由来の生細胞を示す。
【0093】
また、「刺激」とは、細胞表面の受容体に対するリガンドの結合、温度もしくはpH等の環境変化、機械的刺激または電気的刺激等を意味し、細胞の活性(例えば、細胞内の情報伝達系の賦活等)に対して作用する全ての刺激を包含している。
【0094】
要は、本発明は、即時型アレルギー診断だけでなく、広く細胞の解析に有用である。
【0095】
また、「磁性粒子」とは、磁場中に置く事で磁化され磁石の性質を持つ鉄や砂鉄のような物質を指す。
【0096】
本発明は、本発明の広義の精神と範囲を逸脱することなく、様々な実施の形態及び変形が可能とされるものである。また、上述した実施の形態は、本発明を説明するためのものであり、本発明の範囲を限定するものではない。すなわち、本発明の範囲は、実施の形態ではなく、特許請求の範囲によって示される。そして、特許請求の範囲内及びそれと同等の発明の意義の範囲内で施される様々な変形が、本発明の範囲内とみなされる。
【産業上の利用可能性】
【0097】
本発明は、即時型アレルギー診断に好適である。
【符号の説明】
【0098】
1 基板
2 部材
3 溶液投入部
4A、4B 測定部
5 微細流路
6 金属薄膜
7 磁性粒子
10 光学測定部
11 光源
12 偏光板
13 プリズム
14 対物レンズ
15 撮像部
100 細胞分離測定チップ
C1、C2 生細胞
【特許請求の範囲】
【請求項1】
基板に部材を貼りあわせることによって形成される細胞分離チップであって、
前記基板と前記部材との間に設けられたマイクロリッターオーダの容積を有する空隙として、
測定対象の細胞とそれ以外の磁気修飾細胞とを含む溶液の投入口が前記部材上に設けられた溶液投入部と、
前記溶液投入部から延びる微細流路と、
前記溶液投入部に投入され前記微細流路を流れる前記溶液が出力される溶液出力部と、
が設けられ、
前記磁気修飾細胞の流れを妨げる磁場勾配を前記微細流路内に発生させる磁場勾配発生手段を備える細胞分離チップ。
【請求項2】
前記溶液出力部は、
前記部材上に形成された大気開放部を有し、
前記微細流路は、毛細管力により前記溶液を前記溶液出力部側に送液するように形成されている、
ことを特徴とする請求項1に記載の細胞分離チップ。
【請求項3】
前記溶液出力部には、
前記測定対象の細胞を刺激する物質を投入する投入口が設けられている、
ことを特徴とする請求項1又は2に記載の細胞分離チップ。
【請求項4】
前記磁場勾配発生手段は、
外部磁場の磁場勾配を大きくするために前記部材内に含有された磁性粒子である、
ことを特徴とする請求項1乃至3のいずれか一項に記載の細胞分離チップ。
【請求項5】
前記磁場勾配発生手段は、
前記部材内に配線された電流回路である、
ことを特徴とする請求項1乃至3のいずれか一項に記載の細胞分離チップ。
【請求項6】
前記磁場勾配発生手段は、
前記部材内に埋め込まれた小型磁石である、
ことを特徴とする請求項1乃至3のいずれか一項に記載の細胞分離チップ。
【請求項7】
前記溶液出力部には、
前記測定対象の細胞がスポッティングされる金属薄膜が、前記基板上に設けられている、
ことを特徴とする請求項1乃至6のいずれか一項に記載の細胞分離チップ。
【請求項8】
前記金属薄膜が形成された前記基板の反対側の面から、全反射条件を満たす入射角でP偏光を前記金属薄膜に入射させる入射手段と、
前記金属薄膜に入射した前記P偏光の反射光の強度に関する情報を検出する検出手段と、
をさらに備える、
ことを特徴とする請求項7に記載の細胞分離チップ。
【請求項9】
前記検出手段は、
前記金属薄膜に入射した前記P偏光の反射光の2次元強度分布に相当する強度像を撮像する、
ことを特徴とする請求項8に記載の細胞分離チップ。
【請求項10】
付着した前記測定対象の細胞の変化に伴って変化する前記金属薄膜のインピーダンスの変化を検出する検出手段をさらに備える、
ことを特徴とする請求項7に記載の細胞分離チップ。
【請求項11】
前記金属薄膜への入射光と反射光との偏光状態の変化を検出する検出手段をさらに備える、
ことを特徴とする請求項7に記載の細胞分離チップ。
【請求項12】
前記溶液出力部が複数設けられている、
ことを特徴とする請求項1乃至11のいずれか一項に記載の細胞分離チップ。
【請求項13】
前記溶液出力部として、
第1の溶液出力部と、第2の溶液出力部とが設けられ、
前記磁場勾配発生手段は、
前記第1の溶液出力部に連通する前記微細流路内だけに前記磁気修飾細胞の流れを妨げる磁場勾配を発生させる、
ことを特徴とする請求項12に記載の細胞分離チップ。
【請求項1】
基板に部材を貼りあわせることによって形成される細胞分離チップであって、
前記基板と前記部材との間に設けられたマイクロリッターオーダの容積を有する空隙として、
測定対象の細胞とそれ以外の磁気修飾細胞とを含む溶液の投入口が前記部材上に設けられた溶液投入部と、
前記溶液投入部から延びる微細流路と、
前記溶液投入部に投入され前記微細流路を流れる前記溶液が出力される溶液出力部と、
が設けられ、
前記磁気修飾細胞の流れを妨げる磁場勾配を前記微細流路内に発生させる磁場勾配発生手段を備える細胞分離チップ。
【請求項2】
前記溶液出力部は、
前記部材上に形成された大気開放部を有し、
前記微細流路は、毛細管力により前記溶液を前記溶液出力部側に送液するように形成されている、
ことを特徴とする請求項1に記載の細胞分離チップ。
【請求項3】
前記溶液出力部には、
前記測定対象の細胞を刺激する物質を投入する投入口が設けられている、
ことを特徴とする請求項1又は2に記載の細胞分離チップ。
【請求項4】
前記磁場勾配発生手段は、
外部磁場の磁場勾配を大きくするために前記部材内に含有された磁性粒子である、
ことを特徴とする請求項1乃至3のいずれか一項に記載の細胞分離チップ。
【請求項5】
前記磁場勾配発生手段は、
前記部材内に配線された電流回路である、
ことを特徴とする請求項1乃至3のいずれか一項に記載の細胞分離チップ。
【請求項6】
前記磁場勾配発生手段は、
前記部材内に埋め込まれた小型磁石である、
ことを特徴とする請求項1乃至3のいずれか一項に記載の細胞分離チップ。
【請求項7】
前記溶液出力部には、
前記測定対象の細胞がスポッティングされる金属薄膜が、前記基板上に設けられている、
ことを特徴とする請求項1乃至6のいずれか一項に記載の細胞分離チップ。
【請求項8】
前記金属薄膜が形成された前記基板の反対側の面から、全反射条件を満たす入射角でP偏光を前記金属薄膜に入射させる入射手段と、
前記金属薄膜に入射した前記P偏光の反射光の強度に関する情報を検出する検出手段と、
をさらに備える、
ことを特徴とする請求項7に記載の細胞分離チップ。
【請求項9】
前記検出手段は、
前記金属薄膜に入射した前記P偏光の反射光の2次元強度分布に相当する強度像を撮像する、
ことを特徴とする請求項8に記載の細胞分離チップ。
【請求項10】
付着した前記測定対象の細胞の変化に伴って変化する前記金属薄膜のインピーダンスの変化を検出する検出手段をさらに備える、
ことを特徴とする請求項7に記載の細胞分離チップ。
【請求項11】
前記金属薄膜への入射光と反射光との偏光状態の変化を検出する検出手段をさらに備える、
ことを特徴とする請求項7に記載の細胞分離チップ。
【請求項12】
前記溶液出力部が複数設けられている、
ことを特徴とする請求項1乃至11のいずれか一項に記載の細胞分離チップ。
【請求項13】
前記溶液出力部として、
第1の溶液出力部と、第2の溶液出力部とが設けられ、
前記磁場勾配発生手段は、
前記第1の溶液出力部に連通する前記微細流路内だけに前記磁気修飾細胞の流れを妨げる磁場勾配を発生させる、
ことを特徴とする請求項12に記載の細胞分離チップ。
【図1】


【図2】


【図3】


【図4】


【図7】


【図8】


【図5】


【図6】




【図2】


【図3】


【図4】


【図7】


【図8】


【図5】


【図6】


【公開番号】特開2012−239408(P2012−239408A)
【公開日】平成24年12月10日(2012.12.10)
【国際特許分類】
【出願番号】特願2011−111234(P2011−111234)
【出願日】平成23年5月18日(2011.5.18)
【出願人】(504136568)国立大学法人広島大学 (924)
【Fターム(参考)】
【公開日】平成24年12月10日(2012.12.10)
【国際特許分類】
【出願日】平成23年5月18日(2011.5.18)
【出願人】(504136568)国立大学法人広島大学 (924)
【Fターム(参考)】
[ Back to top ]

